Administración intrauterina de la gonadotrofina coriónica humana (hCG) para pacientes subfértiles sometidas a reproducción asistida
Resumen
Antecedentes
La subfertilidad afecta al 15% de las parejas y representa la incapacidad para concebir naturalmente después de 12 meses de coito regular sin protección. La reproducción asistida se refiere a los procedimientos que incluyen la manipulación in vitro de ambos gametos humanos y representa una opción clave para muchas parejas subfértiles. La mayoría de las pacientes sometidas a tratamiento con reproducción asistida alcanzará el estadio de transferencia embrionaria (TE), pero la proporción de embriones que se implantan exitosamente después de la TE ha permanecido muy baja desde mediados de los años noventa. La gonadotrofina coriónica humana (hCG) es una hormona sintetizada y liberada por el sincitiotrofoblasto y tiene una función fundamental en la implantación de los embriones y los estadios iniciales del embarazo. La administración intrauterina de hCG sintética o natural mediante un catéter de TE durante un procedimiento simulado alrededor del momento de la TE es un enfoque nuevo que se ha indicado recientemente para mejorar los resultados de la reproducción asistida.
Objetivos
Investigar si la administración intrauterina de hCG alrededor del momento de la TE mejora los resultados clínicos en las pacientes subfértiles sometidas a reproducción asistida.
Métodos de búsqueda
Se realizó una búsqueda bibliográfica exhaustiva en el registro especializado del Grupo Cochrane de Ginecología y Fertilidad (Cochrane Gynaecology and Fertility Group), Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL), MEDLINE, EMBASE, CINAHL, PsycINFO, en registros de ensayos en curso y en
listas de referencias de de todos los estudios incluidos y revisiones relevantes (desde su inicio hasta el 10 noviembre 2015), en consulta con el coordinador de búsqueda de ensayos del Grupo Cochrane de Ginecología y Fertilidad.
Criterios de selección
En esta revisión se incluyeron todos los ensayos controlados aleatorios (ECA) que evaluaron la administración intrauterina de hCG alrededor del momento de la TE independientemente del idioma y el país de origen.
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, seleccionaron los estudios, evaluaron el riesgo de sesgo, extrajeron los datos de los estudios e intentaron establecer contacto con los autores cuando faltaban datos. Se realizó un análisis estadístico mediante Review Manager 5 de acuerdo con el Manual Cochrane para las Revisiones Sistemáticas de Intervenciones (Cochrane Handbook for Systematic Reviews of Interventions). La calidad de las pruebas se evaluó mediante los métodos GRADE.
Resultados principales
Doce ECA investigaron el efecto de la administración intrauterina de hCG en 4038 pacientes subfértiles sometidas a reproducción asistida. La hCG intracavitaria (hCG‐IC) se administró a dosis variables en diferentes momentos antes de la TE. La fuente de hCG fue la orina de embarazadas o cultivos celulares mediante la tecnología de ADN recombinante.
La mayoría de los estudios (9/12) tuvieron alto riesgo de sesgo en al menos uno de los siete dominios evaluados. Los problemas frecuentes fueron el informe poco claro de los métodos de estudio y la falta de cegamiento. Las principales limitaciones en la calidad general de las pruebas eran el alto riesgo de sesgo y la grave imprecisión.
Para los análisis de nacidos vivos y embarazo clínico hubo una heterogeneidad considerable (I2 mayor del 75%) y no se realizó un metanálisis. La exploración de las fuentes de heterogeneidad identificó dos variables preespecificadas clave como determinantes importantes: el estadio de la TE (estadio de división versus estadio de blastocisto) y la dosis de hCG‐IC (menos de 500 unidades internacionales [UI] versus 500 UI o más). Luego se realizó el metanálisis de estos análisis dentro de subgrupos definidos por el estadio del embrión y la dosis de hCG‐IC.
Se produjo un aumento en la tasa de nacidos vivos en el subgrupo de pacientes a las que se les realizó la TE en el estadio de división con una dosis de hCG‐IC de 500 UI o más en comparación con las pacientes a las que se les realizó la TE en el estadio de división sin hCG‐IC (cociente de riesgos [CR] 1,57; intervalo de confianza [IC] del 95%: 1,32 a 1,87; tres ECA, n = 914, I2 = 0%, pruebas de calidad moderada). Por lo tanto, en un consultorio con una tasa de nacidos vivos del 25% por ciclo, la administración de hCG‐IC de 500 UI o más se asociaría con una tasa de nacidos vivos que variaría del 33% al 46%. No se observó un efecto significativo sobre los nacidos vivos en ninguno de los otros subgrupos.
Hubo un aumento en la tasa de embarazo clínico en el subgrupo de pacientes a las que se les realizó la TE en el estadio de división con una dosis de hCG‐IC de 500 UI o más en comparación con las pacientes a las que se les realizó la TE en el estadio de división sin hCG‐IC (CR 1,41; IC del 95%: 1,25 a 1,58; siete ECA, n = 1414, I2 = 0%, pruebas de calidad moderada). No se observó un efecto significativo sobre el embarazo clínico en ninguno de los otros subgrupos.
No hubo pruebas de que la administración intrauterina de hCG tuviera influencia sobre el aborto espontáneo (CR 1,09; IC del 95%: 0,83 a 1,43; siete ECA, n = 3395, I2 = 0%, pruebas de muy baja calidad).
Otras complicaciones informadas en los estudios incluidos fueron embarazo ectópico (tres ECA, n = 915, tres eventos en general), embarazo heterotópico (un ECA, n = 495, un evento), muerte intrauterina (dos ECA, n = 978, 21 eventos) y trillizos (un ECA, n = 48, tres eventos). No hubo pruebas de una diferencia entre los grupos, pero hubo muy pocos eventos para poder establecer conclusiones y las pruebas fueron de muy baja calidad.
Conclusiones de los autores
El resultado de embarazo para la TE en el estadio de división con el uso de una dosis de hCG‐IC de 500 UI o más es alentador. Sin embargo, debido al tamaño pequeño y a la calidad variable de los ensayos, así como al hecho de que el resultado positivo se obtuvo de un análisis de subgrupos, las pruebas actuales para el tratamiento con hCG‐IC no apoyan su uso en los ciclos de reproducción asistida. Se recomienda un ensayo clínico grande definitivo con los nacidos vivos como el resultado primario. No hubo pruebas de que la administración intrauterina de hCG influyera en el aborto espontáneo, independientemente del estadio embrionario al momento de la transferencia o la dosis de hCG‐IC. Hubo muy pocos eventos para poder establecer conclusiones con respecto a otras complicaciones.
PICO
Resumen en términos sencillos
El efecto de la administración de la hormona del embarazo en la matriz de las pacientes subfértiles sometidas a reproducción asistida
Pregunta de la revisión
¿Administrar la hormona del embarazo en la matriz de las pacientes subfértiles sometidas a reproducción asistida tiene algún efecto beneficioso?
Antecedentes
La subfertilidad afecta al 15% de las parejas y representa la incapacidad para concebir (quedar embarazada) naturalmente después de 12 meses de coito regular sin protección. La reproducción asistida se refiere a los procedimientos que incluyen el tratamiento del espermatozoide y de los óvulos en el laboratorio en una placa de Petri para crear embriones que serán transferidos a la matriz (transferencia de embriones [TE]). Es una opción clave para muchas parejas subfértiles que desean tener un recién nacido. La mayoría de las pacientes sometidas a tratamiento de reproducción asistida llegará al estadio de TE, pero la proporción de embriones que sobreviven después de la TE se ha mantenido pequeña desde mediados de los años noventa. La hormona del embarazo (gonadotrofina coriónica humana) es liberada por el embrión y tiene una función importante en las primeras etapas del embarazo. La administración de la hormona del embarazo natural o sintética en la matriz de las pacientes subfértiles sometidas a reproducción asistida es un enfoque nuevo que se ha indicado para aumentar las probabilidades de tener un recién nacido.
Características de los estudios
Los autores Cochrane realizaron una búsqueda bibliográfica exhaustiva en las bases de datos médicas estándar (desde el inicio hasta el 10 de noviembre de 2015) en consulta con el Coordinador de Búsquedas de Ensayos del Grupo Cochrane de Ginecología y Fertilidad (Cochrane Gynaecology and Fertility Group) de todos los estudios aleatorios (estudios clínicos donde las personas se asignan al azar a uno de dos o más grupos de tratamiento) que investigaran el efecto de administrar la hormona del embarazo en la matriz de las pacientes subfértiles sometidas a reproducción asistida. Las búsquedas y la inclusión fueron independientes del idioma y el país de origen. Dos autores de forma independiente seleccionaron los estudios, los evaluaron, extrajeron los datos e intentaron establecer contacto con los autores cuando faltaban datos.
Se encontraron 12 estudios (4038 mujeres) que cumplían los requisitos de inclusión. La hormona del embarazo natural o sintética se administró a dosis variables en diferentes momentos antes de la TE.
Resultados clave
Hubo un aumento en la tasa de nacidos vivos en un análisis post‐hoc (después que el estudio finalizó) de un subgrupo de pacientes a las que se les realizaron tres TE con una dosis de la hormona del embarazo de 500 UI o más en comparación con las pacientes a las que se les realizaron tres TE sin la hormona del embarazo (pruebas de calidad moderada de tres estudios con 914 mujeres). Por lo tanto, en un consultorio con una tasa de nacidos vivos del 25% por ciclo, la administración de una dosis de la hormona del embarazo de 500 UI o más se asociaría con una tasa de nacidos vivos que variaría del 33% al 46%. No hubo efectos significativos sobre los nacidos vivos en ninguno de los otros subgrupos (p.ej. dosis inferiores de hormona del embarazo).
La administración de la hormona del embarazo en la matriz no influyó en el aborto espontáneo, independientemente del estadio embrionario al momento de la transferencia o la dosis de hormona del embarazo (pruebas de muy baja calidad de siete estudios con 3395 mujeres). Otras complicaciones informadas en los estudios incluidos fueron el embarazo ectópico (cuando el embrión se desarrolla fuera de la matriz), el embarazo heterotópico (cuando los embriones se desarrollan dentro y fuera de la matriz), la muerte del embrión mientras está en la matriz y los trillizos. No hubo pruebas de una diferencia entre los grupos, pero hubo muy pocos eventos para poder establecer conclusiones y las pruebas fueron de muy baja calidad.
El resultado de embarazo para el día tres de la TE con el uso de una dosis de la hormona del embarazo de 500 UI o más es alentador. Sin embargo, debido al tamaño pequeño y la calidad variable de los estudios y al hecho de que el resultado positivo se obtuvo solamente en el grupo de 500 UI o más, las pruebas actuales para el tratamiento con la hormona del embarazo no apoyan su uso en los ciclos de reproducción asistida. Se recomienda un estudio grande definitivo con los nacidos vivos como el resultado primario de interés.
Calidad de la evidencia
Las pruebas fueron de calidad muy baja a moderada.
Conclusiones de los autores
Summary of findings
| Intrauterine administration of hCG for women undergoing assisted reproduction | |||||
| Population: women undergoing assisted reproduction | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Control | Intrauterine administration of hCG | ||||
| Live birth ‐ cleavage stage: hCG < 500 IU | 495 per 1000 | 376 per 1000 | RR 0.76 | 280 | ⊕⊝⊝⊝ |
| Live birth ‐ cleavage stage: hCG ≥ 500 IU | 247 per 1000 | 388 per 1000 | RR 1.57 | 914 | ⊕⊕⊕⊝ |
| Live birth ‐ blastocyst stage: hCG ≥ 500 IU | 366 per 1000 | 337 per 1000 | RR 0.92 | 1666 | ⊕⊕⊕⊝ |
| Pregnancy ‐ cleavage stage: hCG < 500 IU | 579 per 1000 | 509 per 1000 (405 to 637) | RR 0.88 (0.70 to 1.10) | 280 | ⊕⊝⊝⊝ |
| Pregnancy ‐ cleavage stage: hCG ≥ 500 IU | 321 per 1000 | 453 per 1000 (401 to 507) | RR 1.41 (1.25 to 1.58) | 1414 (7 studies) | ⊕⊕⊕⊝ |
| Pregnancy ‐ blastocyst stage: hCG ≥ 500 IU | 430 per 1000 | 408 per 1000 (370 to 455) | RR 0.95 (0.86 to 1.06) | 1991 (3 studies) | ⊕⊕⊕⊝ |
| Miscarriage Follow‐up: mean 40 weeks | 48 per 1000 | 52 per 1000 (40 to 68) | RR 1.09 (0.83 to 1.43) | 3395 (7 studies) | ⊕⊝⊝⊝ |
| Other complications | Other complications reported in the included studies were ectopic pregnancy (3 studies, n = 915, 3 events overall), heterotopic pregnancy (1 study, n = 495, 1 event), intrauterine death (2 studies, n = 978, 21 events) and triplets (1 study, n = 48, 3 events). There were too few events to allow any conclusions to be drawn | ⊕⊝⊝⊝ | |||
| *The basis for the assumed risk is the median control group risk across studies. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Downgraded two levels due to very serious risk of bias: lack of blinding of participants and personnel, no clear description of allocation concealment and premature termination of the study following interim analysis. | |||||
Antecedentes
Descripción de la afección
La subfertilidad se define como la incapacidad de una pareja para concebir espontáneamente después de 12 meses de coito regular sin protección. Se calcula que el 15% de las parejas está afectado por la subfertilidad de diferentes causas (factor femenino, factor masculino, no explicado). La reproducción asistida se refiere a los procedimientos que incluyen la manipulación in vitro (en una placa de laboratorio) de ambos gametos humanos (espermatozoide y óvulos) con el objetivo de establecer un embarazo (Zegers‐Hochschild 2009). El paso más vulnerable de la reproducción asistida es la transferencia embrionaria (TE), ya que incluye un cambio radical en el ambiente del embrión, que lo hace propenso al fracaso (Schoolcraft 2001). La mayoría de las pacientes sometidas al tratamiento de reproducción asistida alcanzarán el estadio de TE debido a las mejorías importantes en los protocolos de estimulación ovárica y a las tecnologías de laboratorio, pero la proporción de embriones que se implantan exitosamente después de la TE se ha mantenido pequeña (menos de un tercio) desde mediados de los años noventa (Kupka 2014).
El proceso de implantación incluye una interacción recíproca entre el embrión y el endometrio que culmina en una fase pequeña en la que el endometrio está preparado para la recepción y durante la cual puede ocurrir la implantación. Esta interacción depende de la diferenciación temporal de las células del endometrio para lograr la receptividad uterina. Se considera que el fracaso de la implantación ocurre como consecuencia de la deficiencia en el potencial de desarrollo del embrión o la deficiencia en la receptividad uterina, o ambos, y a la interacción embrión‐útero (Diedrich 2007).
Se han intentado muchas intervenciones con grados variables de éxito antes de la TE (lesión endometrial(Nastri 2012), TE simulada (Mansour 1990), preparación del endometrio(Derks 2009), periimplantación (heparina (Akhtar 2013), aspirina (Siristatidis 2011)), durante la TE (orientación ecográfica(Brown 2010), eliminación del moco cervical(Craciunas 2014)), y después de la TE (selladores con fibrina, reposo en cama (Abou‐Setta 2014)) para optimizar la interacción embrión‐endometrio y mejorar los resultados.
Descripción de la intervención
La gonadotrofina coriónica humana (hCG) es una hormona sintetizada y liberada por el sincitiotrofoblasto. Estimula la producción ovárica de progesterona durante el primer trimestre del embarazo. La administración intrauterina de hCG sintética o natural alrededor del momento de la TE es un enfoque nuevo que se ha indicado para mejorar los resultados del tratamiento de reproducción asistida sobre la base de la función fundamental de la hCG en la implantación embrionaria y los estadios iniciales del embarazo (Cole 2010). La intervención incluye la administración intrauterina de hCG mediante un catéter de TE durante un procedimiento simulado (un ensayo de TE real sin utilizar un embrión, realizado para evaluar la dificultad de la TE) con el uso del volumen más bajo del medio antes de la TE convencional. La hCG se puede liberar en diferentes puntos dentro de la cavidad uterina (cerca del orificio cervical interno, en el medio de la cavidad o cerca del fondo) en minutos, horas o días antes de la TE real. Las fuentes de hCG para los tratamientos médicos incluyen la extracción de la orina de las embarazadas (natural) o de cultivos celulares mediante la tecnología de ADN recombinante (rhCG).
De qué manera podría funcionar la intervención
La hCG puede promover la tolerancia inmune peritrofoblástica, que facilita la invasión del trofoblasto al inducir un aumento de la apoptosis de los linfocitos T endometriales (Kayisli 2003). También apoya la aposición del trofoblasto (el primer estadio de la implantación, unión menos firme del trofoblasto a la decidua) y la adhesión (segundo estadio de la implantación, fijación más firme del trofoblasto a la decidua) al endometrio al regular las proteínas involucradas en la implantación (Racicot 2014). La inyección intrauterina de hCG urinaria modifica los parámetros secretores del endometrio (Licht 1998), a la vez que la proliferación y la migración celular aumentan con la presencia de la hCG(Bourdiec 2013).
Por qué es importante realizar esta revisión
La subfertilidad afecta a una proporción relativamente grande de parejas y los tratamientos de reproducción asistida todavía son costosos y estresantes. Se deben realizar todos los esfuerzos para aumentar las tasas de éxito del tratamiento de la infertilidad y los estudios de investigación primaria se deben trasladar a la práctica clínica de una manera eficaz y oportuna. La administración intrauterina de hCG alrededor del momento de la TE tiene la posibilidad de mejorar el resultado de los tratamientos de reproducción asistida y los ensayos aleatorios y no aleatorios han presentado resultados variables (Mansour 2011; Rebolloso 2013).
Un metanálisis evaluó la eficacia de la inyección intrauterina de hCG antes de la TE en ciclos de reproducción asistida, pero se les podrían hacer mejorías a los métodos de análisis (Ye 2015). Diferentes estudios han evaluado las circunstancias variables de la administración intrauterina de hCG en cuanto al estadio embrionario al momento de la transferencia (división versus blastocisto), la fuente de hCG (orina versus recombinante), la dosis de hCG, el procesamiento de los embriones (frescos versus congelados‐descongelados) y el número de embriones transferidos, lo que da lugar a incertidumbres reales acerca de la función de la intervención.
Objetivos
Investigar si la administración intrauterina de hCG alrededor del momento de la TE mejora los resultados clínicos en las pacientes subfértiles sometidas a reproducción asistida.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
En esta revisión se incluyeron todos los ensayos controlados aleatorios (ECA) que evaluaron la administración intrauterina de hCG alrededor del momento de la TE independientemente del idioma y el país de origen. Se planificó incluir en los metanálisis solamente los datos de la primera fase de los ECA cruzados.
Tipos de participantes
Mujeres subfértiles sometidas a fecundación in vitro (FIV)/inyección intracitoplasmática de espermatozoides (ICSI) seguida de TE.
Tipos de intervenciones
Fueron elegibles para inclusión los ECA que compararon la administración intrauterina de hCG alrededor del momento de la TE versus otra intervención activa, ninguna intervención o placebo.
Tipos de medida de resultado
Resultados primarios
-
Tasa de nacidos vivos (parto de un feto vivo después de las 24 semanas completas de edad gestacional) por paciente o pareja asignada al azar.
-
Tasa de aborto espontáneo (pérdida del embarazo antes de las 24 semanas completas de edad gestacional) por paciente o pareja asignada al azar.
Resultados secundarios
-
Tasa de embarazo clínico (presencia de un saco gestacional en el examen ecográfico) por paciente o pareja asignada al azar.
-
Tasa de complicación por mujer o pareja asignada al azar, que incluye embarazo ectópico, restricción del crecimiento intrauterino, defectos fetales o congénitos, infección pelviana u otros eventos adversos, informados como tasa general de complicaciones o como resultados individuales, o ambos (como se informó por los estudios individuales).
Results
Description of studies
Results of the search
We performed the systematic search on 10 November 2015 and identified 516 publications (499 from databases and 17 from other sources). Nineteen articles were potentially relevant and we assessed these in full text. We included 12 articles, excluded five articles and two articles await classification. See Figure 1 for detailed search results.
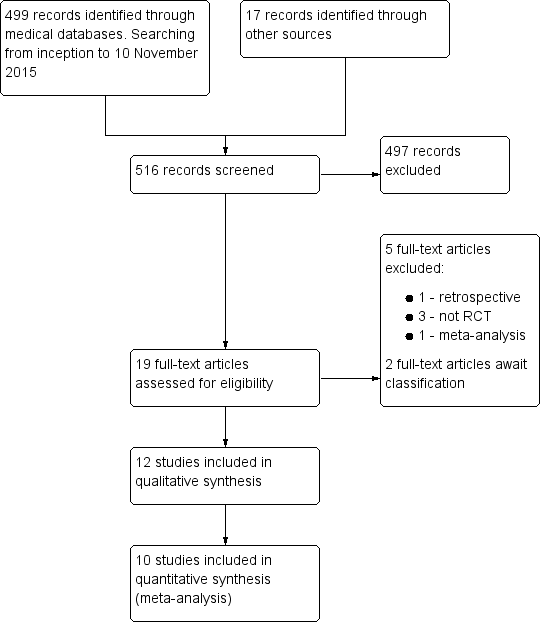
Study flow diagram.
Included studies
Types of studies
All 12 included studies were parallel‐arm RCTs. One study had two experimental arms (IC‐hCG 500 IU versus IC‐hCG 1000 IU versus control) (Janati 2013), one study had two phases with three experimental arms (phase one: IC‐hCG 100 IU versus IC‐hCG 200 IU versus control; and phase two: IC‐hCG 500 IU versus control) (Mansour 2011), and one study had two experimental arms at two different timings (IC‐hCG 500 IU versus control two days prior to ET; IC‐hCG 500 IU versus control on the day of ET) (Wirleitner 2015a). Six studies were as full text articles (Aaleyasin 2015; Hong 2014; Mansour 2011; Santibañez 2014; Wirleitner 2015a; Zarei 2014), and six studies were abstracts (Cambiaghi 2013; Janati 2013; Kokkali 2014; Leao 2013; Singh 2014; Wirleitner 2015b).
Six studies did not report funding (Aaleyasin 2015; Cambiaghi 2013; Hong 2014; Janati 2013; Leao 2013; Wirleitner 2015a), and six studies reported internal funding (Kokkali 2014; Mansour 2011; Santibañez 2014; Singh 2014; Wirleitner 2015b; Zarei 2014). None of the studies reported external funding.
Participants
Participants were couples/women recruited prior to undergoing assisted reproductive treatment for different subfertility causes. The number of participants varied between 36 (Leao 2013) and 1186 (Wirleitner 2015a). The studies were conducted in Iran, Brazil, USA, Greece, Egypt, Mexico, India and Austria.
Interventions
Most of the studies compared intrauterine administration of urine hCG 500 IU with controls. One study had two additional arms with lower doses (IC‐hCG 100 and 200 IU) (Mansour 2011), and one study had an additional arm with higher dose (IC‐hCG 1000 IU) (Janati 2013). One study used rhCG 250 μg (equivalent of 6500 IU) (Zarei 2014), and one study used intra‐cavity rhCG (IC‐rhCG) 40 μL (equivalent to 500 IU) (Singh 2014).
Nine studies administered the IC‐hCG within minutes before ET (Aaleyasin 2015; Hong 2014; Janati 2013; Kokkali 2014; Mansour 2011; Santibañez 2014; Singh 2014; Wirleitner 2015b; Zarei 2014), ranging from less than three minutes (Hong 2014) up to 12 minutes (Zarei 2014), and two studies administered the IC‐hCG six hours before ET (Cambiaghi 2013; Leao 2013). One study had four groups (two experimental and two controls) at two different timings (two days before ET and three minutes before ET) (Wirleitner 2015a).
For the control groups, six studies administered the same volume of transfer media (Hong 2014), culture media (Aaleyasin 2015; Singh 2014; Wirleitner 2015a; Wirleitner 2015b), or normal saline (Zarei 2014), without hCG and six studies did not administer anything prior to ET (Cambiaghi 2013; Janati 2013; Kokkali 2014; Leao 2013; Mansour 2011; Santibañez 2014).
Outcomes
Seven studies reported on one of our pre‐defined primary outcomes: live birth (Aaleyasin 2015; Mansour 2011; Singh 2014; Wirleitner 2015a; Wirleitner 2015b) and miscarriage (Aaleyasin 2015; Hong 2014; Janati 2013; Mansour 2011; Singh 2014; Wirleitner 2015a; Wirleitner 2015b).
Twelve studies reported on one of our pre‐defined secondary outcomes: clinical pregnancy (Aaleyasin 2015; Cambiaghi 2013; Hong 2014; Janati 2013; Kokkali 2014; Leao 2013; Mansour 2011; Santibañez 2014; Singh 2014; Wirleitner 2015a; Wirleitner 2015b; Zarei 2014), and complications (Aaleyasin 2015; Mansour 2011; Santibañez 2014; Zarei 2014).
Studies awaiting classification
Two studies await classification (Badehnoosh 2014; Bhat 2014). These studies reported interim outcomes (implantation rate and fertilisation rate) and it was unclear whether they also collected data on clinical outcomes that might be relevant to our review. We emailed the authors of these studies in February 2016, asking for more information on the methods and outcome measures of their studies.
Excluded studies
We excluded five studies due to retrospective design (Jeong 2013), non‐randomisation (Li 2013; Rebolloso 2013; Riboldi 2013), and meta‐analysis (Ye 2015).
Risk of bias in included studies
Figure 2 shows the 'Risk of bias' graph and Figure 3 shows the 'Risk of bias'. See the Characteristics of included studies table for rationales behind each judgement.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Sequence generation
All included studies were RCTs. The randomisation technique was adequate in 10 studies (Aaleyasin 2015; Cambiaghi 2013; Hong 2014; Janati 2013; Kokkali 2014; Mansour 2011; Santibañez 2014; Singh 2014; Wirleitner 2015a; Zarei 2014), which we classified at low risk of bias. Two studies lacked adequate randomisation description and we classified them at unclear risk of bias (Leao 2013; Wirleitner 2015b).
Allocation concealment
Three studies mentioned adequate allocation concealment and we classified them at low risk of bias (Aaleyasin 2015; Hong 2014; Kokkali 2014). Nine studies lacked a description of methods of allocation concealment and we classified them at unclear risk of bias (Cambiaghi 2013; Janati 2013; Leao 2013; Mansour 2011; Santibañez 2014; Singh 2014; Wirleitner 2015a; Wirleitner 2015b; Zarei 2014).
Blinding
Four studies documented blinding of participants or personnel (or both) and we classified them at low risk of bias (Aaleyasin 2015; Hong 2014; Wirleitner 2015b; Zarei 2014). We classified the remaining studies at high risk of bias (Cambiaghi 2013; Janati 2013; Kokkali 2014; Leao 2013; Mansour 2011; Santibañez 2014; Singh 2014; Wirleitner 2015a).
The outcome measurement was not likely to be influenced by lack of blinding; hence, we classified all studies at low risk of bias.
Incomplete outcome data
Five studies followed up all participants and reported the results adequately (Aaleyasin 2015; Hong 2014; Santibañez 2014; Singh 2014; Wirleitner 2015b). We classified these at low risk of bias. We classified six studies at unclear risk of bias (Cambiaghi 2013; Janati 2013; Kokkali 2014; Leao 2013; Mansour 2011; Wirleitner 2015a). One study reported large numbers of participants lost to follow‐up and we classified this at high risk of bias (Zarei 2014).
Selective reporting
Five studies reported on all relevant outcomes and we classified them at low risk of bias (Aaleyasin 2015; Mansour 2011; Singh 2014; Wirleitner 2015a; Wirleitner 2015b). All studies reported on clinical pregnancy, but, if there were no reports on live birth, we classified them at unclear risk of bias (Cambiaghi 2013; Hong 2014; Janati 2013; Kokkali 2014; Leao 2013; Santibañez 2014; Zarei 2014).
Other potential sources of bias
We classified six studies at low risk of other potential bias because groups appeared to be comparable at baseline and we could not identify any other sources of bias (Aaleyasin 2015; Santibañez 2014; Singh 2014; Wirleitner 2015a; Wirleitner 2015b; Zarei 2014). We classified four studies at unclear risk of bias because they did not report on baseline characteristics between groups (probably due to availability as abstract only) (Cambiaghi 2013; Janati 2013; Kokkali 2014), or reported a large number of participants who declined to participate after randomisation for various reasons (Hong 2014). We classified two studies at high risk of bias due to lack of reporting of participant numbers in each study group (Leao 2013), and due to performing interim analysis that changed the study protocol and ended the study prematurely (Mansour 2011)
The overall birth rate in the control groups in Mansour 2011 was 47%, whereas the control group live birth rate ranged from 25% to 39% in the other included studies. The reason for this was unclear. The mean age of women in Mansour 2011 was under 30 years, but this was also the case in Aaleyasin 2015, which reported a control group live birth rate of only 25%.
Effects of interventions
Note: One study included three experimental arms based on intrauterine hCG dose and we regarded and analysed them as three separate comparisons (Mansour 2011). We split the control group proportionally with the experimental groups in order to avoid analysing control participants in duplicate. One study investigated intrauterine hCG administration at two different timings (day three versus day five administration) and we regarded and analysed them as two separate comparisons (Wirleitner 2015a).
Two of the comparisons had considerable heterogeneity (I2 greater than 75%) and we did not perform a global meta‐analysis, as pre‐specified in the protocol (Craciunas 2015) (Analysis 1.1; Analysis 1.4).
Exploration for the sources of heterogeneity in these analyses identified two key pre‐specified variables as important determinants: stage of ET (cleavage versus blastocyst stage) and dose of IC‐hCG (less than 500 IU versus 500 IU or greater). When we subgrouped the data according to these variables, there was evidence of significant differences between the subgroups. We then performed meta‐analysis within the subgroups defined by stage of embryo and dose of hCG.
Primary outcomes
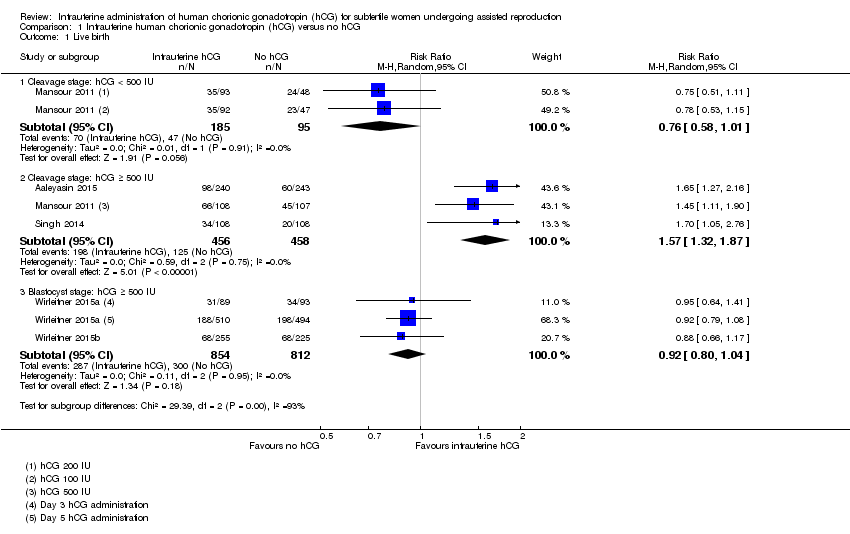
Live birth (Analysis 1.1)
Five studies with eight experimental arms reported on live birth (Aaleyasin 2015; Mansour 2011; Singh 2014; Wirleitner 2015a; Wirleitner 2015b) (Analysis 1.1).
Subgroup analysis
The forest plot displayed the studies based on the embryo stage at transfer and the hCG dose (Figure 4). The test for subgroup differences indicated a considerable difference between the subgroups (Chi2 = 29.39, degrees of freedom (df) = 2, P value ≤ 0.00001, I2 = 92.3%).
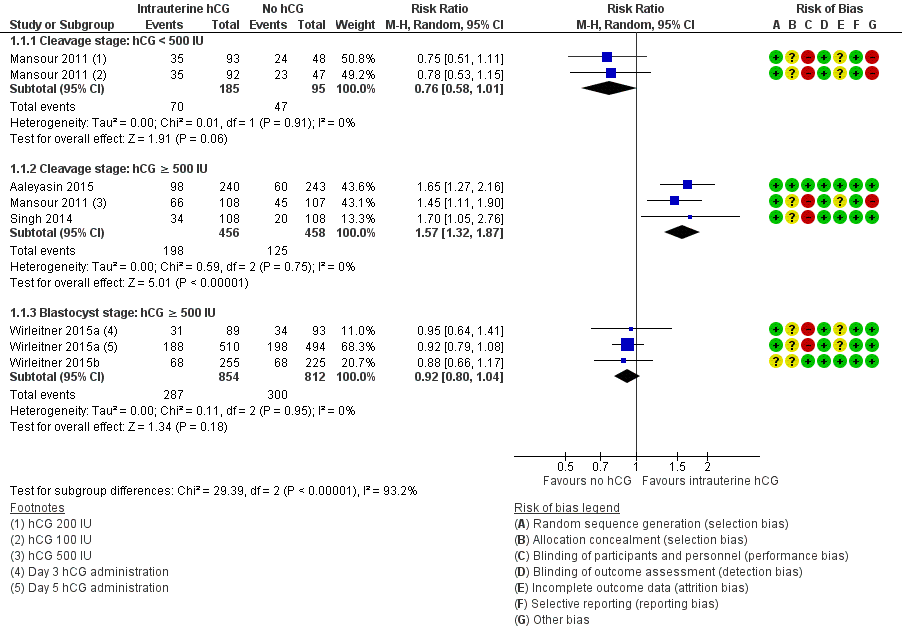
Forest plot of comparison: 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, outcome: 1.1 Live birth.
-
Cleavage stage: IC‐hCG less than 500 IU versus no IC‐hCG: one RCT with two experimental arms contributed to the calculation of the combined outcome (Mansour 2011). The heterogeneity was insignificant (Chi2 = 0.01, df = 1, P value = 0.91, I2 = 0%) and there was no evidence of a difference between the groups in live birth rates (RR 0.76, 95% CI 0.58 to 1.01, one RCT, n = 280, I2 = 0%, very low quality evidence).
-
Cleavage stage: IC‐hCG 500 IU or greater versus no IC‐hCG: three RCTs contributed to the calculation of the combined outcome (Aaleyasin 2015; Mansour 2011; Singh 2014). The heterogeneity was insignificant (Chi2 = 0.59, df = 2, P value = 0.75, I2 = 0%) and the live birth rate was higher in the hCG group (RR 1.57, 95% CI 1.32 to 1.87, three RCTs, n = 914, I2 = 0%, moderate quality evidence). This suggested that in women with a 25% chance of live birth without using IC‐hCG, the live birth rate in women using IC‐hCG 500 IU or greater will be between 33% and 46%.
-
Blastocyst stage: IC‐hCG 500 IU or greater versus no IC‐hCG: two RCTs with three experimental arms contributed to the calculation of the combined outcome (Wirleitner 2015a; Wirleitner 2015b). The heterogeneity was insignificant (Chi2 = 0.11, df = 2, P value = 0.95, I2 = 0%) and there was no evidence of a difference between the groups in live birth rates (RR 0.92, 95% CI 0.80 to 1.04, two RCTs, n = 1666, I2 = 0%, moderate quality evidence).
Data were insufficient to perform the pre‐specified subgroup analyses based on embryo processing and number of embryos transferred.
Sensitivity analyses
Removing the studies with high risk of bias in one or more domains (Mansour 2011; Singh 2014; Wirleitner 2015a) did not alter the results significantly, but it meant that there were no data for one of the comparisons
-
cleavage stage: IC‐hCG less than 500 IU versus no IC‐hCG: no data
-
cleavage stage: IC‐hCG 500 IU or greater versus no IC‐hCG: RR 1.65 (95% CI 1.27 to 2.16, one RCT, n=483)
-
blastocyst stage: IC‐hCG 500 IU or greater versus no IC‐hCG (RR 0.88, 95% CI 0.66 to 1.17, one RCT, n = 480)
Removing the studies available as abstract only (Singh 2014; Wirleitner 2015b) did not alter the results significantly:
-
cleavage stage: IC‐hCG less than 500 IU versus no IC‐hCG (RR 0.76, 95% CI 0.58 to 1.01, one RCT, n = 280, I2 = 0%, very low quality evidence);
-
cleavage stage: IC‐hCG 500 IU or greater versus no IC‐hCG (RR 1.55, 95% CI 1.28 to 1.87, two RCTs, n = 698, I2 = 0%, moderate quality evidence);
-
blastocyst stage: IC‐hCG 500 IU or greater versus no IC‐hCG (RR 0.92, 95% CI 0.80 to 1.07, one RCT, n = 1186, I2 = 0%, moderate quality evidence).
The calculated combined outcome using the fixed‐effect model was similar to random‐effects model for:
-
cleavage stage: IC‐hCG less than 500 IU versus no IC‐hCG (RR 0.76, 95% CI 0.58 to 1.01, one RCT, n = 280, I2 = 0%, very low quality evidence);
-
cleavage stage: IC‐hCG 500 IU or greater versus no IC‐hCG (RR 1.59, 95% CI 1.33 to 1.90, three RCTs, n = 914, I2 = 0%, moderate quality evidence);
-
blastocyst stage: IC‐hCG 500 IU or greater versus no IC‐hCG (RR 0.91, 95% CI 0.80 to 1.04, two RCTs, n = 1666, I2 = 0%, moderate quality evidence).
There was no significant difference between OR and RR:
-
cleavage stage: IC‐hCG less than 500 IU versus no IC‐hCG (OR 0.62, 95% CI 0.38 to 1.03, one RCT, n = 280, I2 = 0%, very low quality evidence);
-
cleavage stage: IC‐hCG 500 IU or greater versus no IC‐hCG (OR 2.10, 95% CI 1.59 to 2.79, three RCTs, n = 914, I2 = 0%, moderate quality evidence);
-
blastocyst stage: IC‐hCG 500 IU or greater versus no IC‐hCG (OR 0.87, 95% CI 0.71 to 1.06, two RCTs, n = 1666, I2 = 0%, moderate quality evidence).
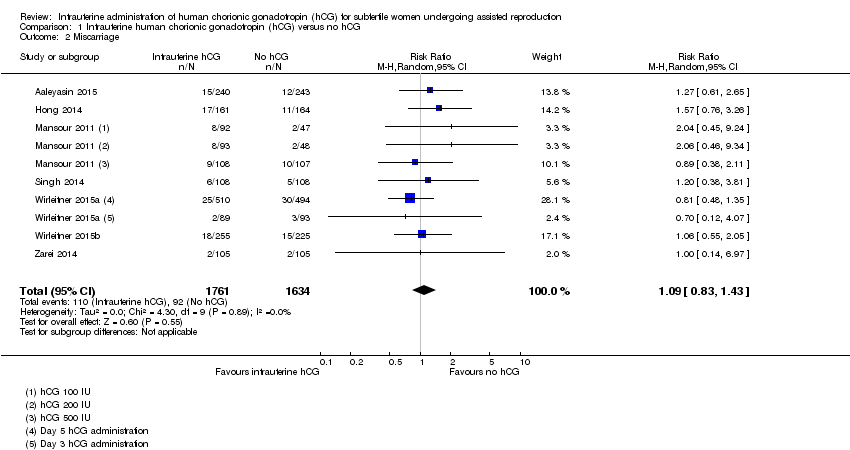
Miscarriage (Analysis 1.2, Figure 5)
Seven studies with 10 experimental arms reported on miscarriage (Aaleyasin 2015; Hong 2014; Mansour 2011; Singh 2014; Wirleitner 2015a; Wirleitner 2015b; Zarei 2014) (Analysis 1.2; Figure 5). The heterogeneity between the studies was unsubstantial (Chi2 = 4.30, df = 9, P value = 0.89, I2 = 0%) and there was no evidence of a difference between the groups in miscarriage rates (RR 1.09, 95% CI 0.83 to 1.43, seven RCTs, n = 3395, I2 = 0%, very low quality evidence).
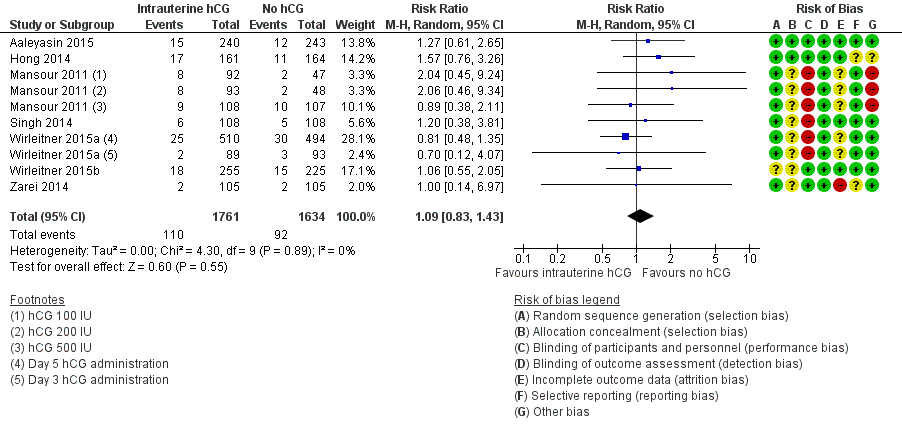
Forest plot of comparison: 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, outcome: 1.2 Miscarriage.
One study investigated IC‐hCG 500 IU and 1000 IU and reported similar miscarriage rates between experimental and control groups, without providing sufficient data to be included in a meta‐analysis (Janati 2013).
Sensitivity analyses
Removing the studies with high risk of bias in one or more domains (Mansour 2011; Singh 2014; Wirleitner 2015a) did not alter the results significantly (RR 1.25 [0.84, 1.87, four studies, n=1498, I2=0%)
Removing the two studies available as abstract only (Singh 2014; Wirleitner 2015b) did not alter the results significantly (RR 1.09, 95% CI 0.80 to 1.48, five RCTs, n = 2699, I2 = 0%, very low quality evidence).
The calculated combined outcome using the fixed‐effect model was similar to that of the random‐effects model (RR 1.10, 95% CI 0.84 to 1.44, seven RCTs, n = 3395, I2 = 0%, very low quality evidence).
There was no significant difference between OR and RR (OR 1.09, 95% CI 0.82 to 1.46, seven RCTs, n = 3395, I2 = 0%, very low quality evidence).
Secondary analysis per clinical pregnancy (Analysis 1.3)
There was no evidence of a difference between the groups in miscarriage rates calculated per clinical pregnancy (RR 1.00, 95% CI 0.77 to 1.30, seven RCTs, n = 1450, I2 = 0%, very low quality evidence) (Analysis 1.3).
Secondary outcomes
Clinical pregnancy (Analysis 1.4)
All included studies reported clinical pregnancy (Analysis 1.4).
Subgroup analysis
The forest plot displayed the studies based on the embryo stage at transfer and the hCG dose (Figure 6). The test for subgroup differences indicated a considerable difference between the subgroups (Chi2 = 28.83, df = 2, P value ≤ 0.00001, I2 = 93.1%).

Forest plot of comparison: 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, outcome: 1.4 Clinical pregnancy.
-
Cleavage stage: IC‐hCG less than 500 IU versus no IC‐hCG: one RCT with two experimental arms contributed to the calculation of the combined outcome (Mansour 2011). The heterogeneity was insignificant (Chi2 = 0.07, df = 1, P value = 0.80, I2 = 0%) and there was no evidence of a difference between the groups in clinical pregnancy rates (RR 0.88, 95% CI 0.70 to 1.10, one RCT, n = 280, I2 = 0%, very low quality evidence).
-
Cleavage stage: IC‐hCG 500 IU or greater versus no IC‐hCG: seven RCTs contributed to the calculation of the combined outcome (Aaleyasin 2015; Cambiaghi 2013; Leao 2013; Mansour 2011; Santibañez 2014; Singh 2014; Zarei 2014). The heterogeneity was insignificant (Chi2 = 3.18, df = 6, P value = 0.79, I2 = 0%) and the clinical pregnancy rate was higher in the hCG group (RR 1.41, 95% CI 1.25 to 1.58, seven RCTs, n = 1414, I2 = 0%, moderate quality evidence).
One study investigated IC‐hCG 500 IU and 1000 IU and reported similar clinical pregnancy rates between experimental and control groups (Janati 2013). One study investigated IC‐hCG 500 IU and reported no evidence of a difference between the groups in clinical pregnancy rates (Kokkali 2014). Data from these two studies were insufficient to be included in meta‐analysis.
-
Blastocyst stage: IC‐hCG 500 IU or greater versus no IC‐hCG: three RCTs with four experimental arms contributed to the calculation of the combined outcome (Hong 2014; Wirleitner 2015a; Wirleitner 2015b). The heterogeneity was insignificant (Chi2 = 2.91, df = 3, P value = 0.41, I2 = 0%) and there was no evidence of a difference between the groups in clinical pregnancy rates (RR 0.95, 95% CI 0.86 to 1.06, three RCTs, n = 1991, I2 = 0%, moderate quality evidence).
Data were insufficient to perform the pre‐defined subgroup analyses based on embryo processing and number of embryos transferred.
Complications (Analysis 1.5)
Four studies with six experimental arms reported complications (Aaleyasin 2015; Mansour 2011; Santibañez 2014; Zarei 2014) (Analysis 1.5).
None of the studies found evidence of a difference between the groups for any of the mentioned complications: ectopic pregnancy (three studies, n = 915, three events overall), heterotopic pregnancy (one study, n = 495, one event), intrauterine death (two studies, n = 978, 21 events), triplets (one study, n = 48, three events). For intrauterine death, the analysis in Figure 7 displays the Peto OR (which is the default setting for this analysis). Mantel‐Haenszel random‐effects RRs were almost identical (RR 0.82, 95% CI 0.34 to 1.94, two studies, n = 978, I2 = 0%).

Forest plot of comparison: 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, outcome: 1.5 Complications: intrauterine death.
Discusión
Resumen de los resultados principales
Esta revisión sistemática incluyó 12 ECA que investigaron el efecto de la administración intrauterina de hCG en 4038 pacientes subfértiles sometidas a reproducción asistida. La hCG‐IC se administró a dosis variables en diferentes momentos antes de la TE. La fuente de hCG fue la orina de embarazadas o cultivos celulares mediante la tecnología de ADN recombinante.
Debido a la heterogeneidad significativa (I2 mayor del 75%) en varias de las comparaciones, no se realizó un metanálisis general, como se preespecificó en el protocolo (Craciunas 2015). La exploración de las fuentes de heterogeneidad identificó dos variables preespecificadas clave como determinantes importantes: estadio de TE (estadio de división versus blastocisto) y dosis de hCG‐IC (menos de 500 UI versus 500 UI o más). Luego se realizó el metanálisis dentro de los subgrupos definidos por el estadio embrionario y la dosis de hCG‐IC.
Se produjo un aumento de la tasa de nacidos vivos en el subgrupo de pacientes a las que se les realizó la TE en el estadio de división con una dosis de hCG‐IC de 500 UI o más en comparación con las pacientes a las que se les realizó la TE en el estadio de división sin hCG‐IC. No hubo efectos significativos sobre los nacidos vivos en ninguno de los otros subgrupos.
Se produjo un aumento de la tasa de embarazo clínico en el subgrupo de pacientes a las que se les realizó la TE en el estadio de división con una dosis de hCG‐IC de 500 UI o más en comparación con las pacientes a las que se les realizó la TE en el estadio de división sin hCG‐IC. No hubo un efecto significativo sobre la tasa de embarazo clínico en ninguno de los otros subgrupos.
No hubo pruebas de que la administración de hCG‐IC influyera en las tasas de aborto espontáneo y de complicaciones, independientemente del estadio embrionario al momento de la transferencia o la dosis de hCG‐IC.
Compleción y aplicabilidad general de las pruebas
Todos los ECA informaron sobre el embarazo clínico, que es un resultado secundario importante, pero sólo unos pocos ECA continuaron el seguimiento hasta obtener los nacidos vivos, que es el resultado primario más importante.
La mayoría de los ECA informaron las tasas de aborto espontáneo. Con muy poca frecuencia los ECA informaron las complicaciones y los eventos adversos, o su ausencia.
Los datos no fueron suficientes para realizar todos los análisis de subgrupos planificados.
Los criterios de inclusión de las participantes aseguraron una variedad amplia de causas de subfertilidad y las características de las pacientes fueron similares a las esperadas en una unidad de reproducción asistida.
Calidad de la evidencia
La mayoría de los estudios (9/12) se consideró con alto riesgo de sesgo en al menos uno de los siete dominios evaluados. Los problemas frecuentes fueron el informe poco claro de los métodos de estudio y la falta de cegamiento. La presentación breve de los resultados en los estudios publicados como resúmenes representa una posible fuente de sesgo adicional. Seis estudios no informaron el financiamiento y seis estudios informaron el financiamiento interno. Ninguno de los estudios informó el financiamiento externo.
La calidad de las pruebas evaluada según GRADE fue moderada para los nacidos vivos y el embarazo clínico, lo que significa que es probable que los estudios de investigación adicionales tengan una marcada repercusión sobre la confianza en la estimación del efecto y pueda cambiarla. La calidad de las pruebas para el aborto espontáneo fue muy baja, lo que significa que no hay seguridad acerca de la estimación. Las principales limitaciones en la calidad general de las pruebas eran el alto riesgo de sesgo y la grave imprecisión.
Sesgos potenciales en el proceso de revisión
Se realizó una búsqueda sistemática en consulta con el Coordinador de Búsquedas de Ensayos del Grupo Cochrane de Ginecología y Fertilidad, pero no hay seguridad con respecto a que se hayan identificado todos los ensayos relevantes para inclusión. El protocolo se había publicado previamente y se siguió en consecuencia (Craciunas 2015). Se intentó establecer contacto con los autores cuando faltaron los datos, pero sólo un autor contestó y proporcionó aclaración y datos adicionales (Mansour 2011). Se realizaron análisis de intención de tratar. El sesgo potencial en el proceso de revisión fue poco probable.
Acuerdos y desacuerdos con otros estudios o revisiones
Un metanálisis publicado previamente concluyó que las pacientes sometidas a FIV/ICSI se pueden beneficiar de la inyección de hCG‐IC antes de la TE(Ye 2015).
El efecto informado de la administración intrauterina de hCG fue consistente dentro de los subgrupos de esta revisión, con un efecto diferente evidente basado en el estadio embrionario al momento de la transferencia y la dosis de hCG‐IC.

Study flow diagram.
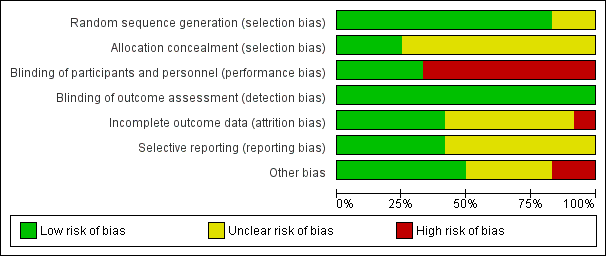
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Forest plot of comparison: 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, outcome: 1.1 Live birth.
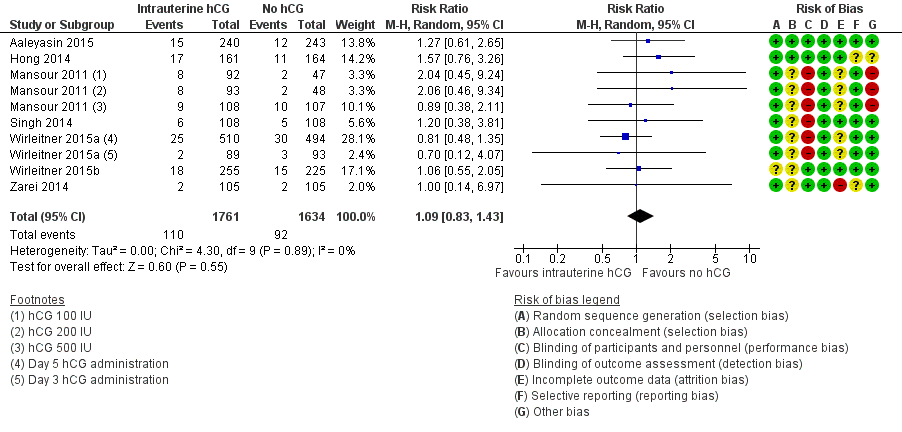
Forest plot of comparison: 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, outcome: 1.2 Miscarriage.

Forest plot of comparison: 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, outcome: 1.4 Clinical pregnancy.
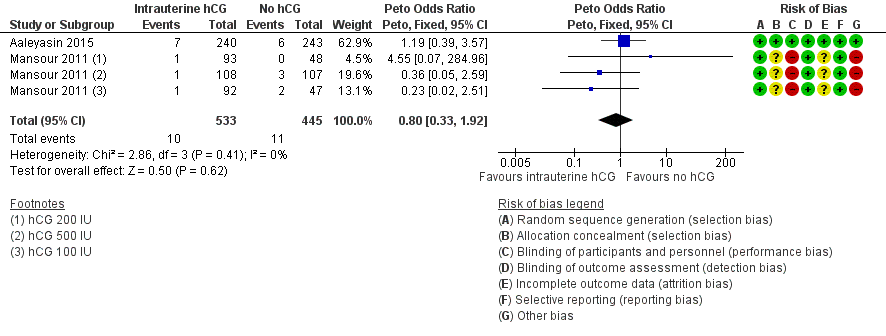
Forest plot of comparison: 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, outcome: 1.5 Complications: intrauterine death.
Comparison 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, Outcome 1 Live birth.
Comparison 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, Outcome 2 Miscarriage.
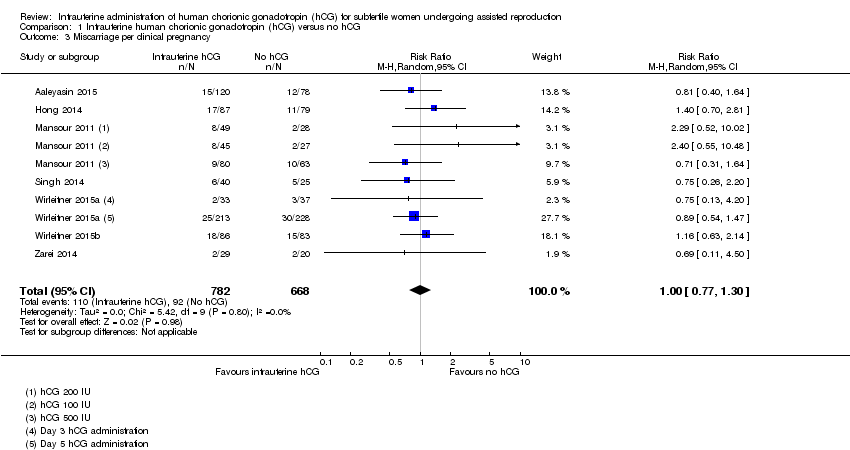
Comparison 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, Outcome 3 Miscarriage per clinical pregnancy.

Comparison 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, Outcome 4 Clinical pregnancy.

Comparison 1 Intrauterine human chorionic gonadotropin (hCG) versus no hCG, Outcome 5 Complications: intrauterine death.
| Intrauterine administration of hCG for women undergoing assisted reproduction | |||||
| Population: women undergoing assisted reproduction | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Control | Intrauterine administration of hCG | ||||
| Live birth ‐ cleavage stage: hCG < 500 IU | 495 per 1000 | 376 per 1000 | RR 0.76 | 280 | ⊕⊝⊝⊝ |
| Live birth ‐ cleavage stage: hCG ≥ 500 IU | 247 per 1000 | 388 per 1000 | RR 1.57 | 914 | ⊕⊕⊕⊝ |
| Live birth ‐ blastocyst stage: hCG ≥ 500 IU | 366 per 1000 | 337 per 1000 | RR 0.92 | 1666 | ⊕⊕⊕⊝ |
| Pregnancy ‐ cleavage stage: hCG < 500 IU | 579 per 1000 | 509 per 1000 (405 to 637) | RR 0.88 (0.70 to 1.10) | 280 | ⊕⊝⊝⊝ |
| Pregnancy ‐ cleavage stage: hCG ≥ 500 IU | 321 per 1000 | 453 per 1000 (401 to 507) | RR 1.41 (1.25 to 1.58) | 1414 (7 studies) | ⊕⊕⊕⊝ |
| Pregnancy ‐ blastocyst stage: hCG ≥ 500 IU | 430 per 1000 | 408 per 1000 (370 to 455) | RR 0.95 (0.86 to 1.06) | 1991 (3 studies) | ⊕⊕⊕⊝ |
| Miscarriage Follow‐up: mean 40 weeks | 48 per 1000 | 52 per 1000 (40 to 68) | RR 1.09 (0.83 to 1.43) | 3395 (7 studies) | ⊕⊝⊝⊝ |
| Other complications | Other complications reported in the included studies were ectopic pregnancy (3 studies, n = 915, 3 events overall), heterotopic pregnancy (1 study, n = 495, 1 event), intrauterine death (2 studies, n = 978, 21 events) and triplets (1 study, n = 48, 3 events). There were too few events to allow any conclusions to be drawn | ⊕⊝⊝⊝ | |||
| *The basis for the assumed risk is the median control group risk across studies. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Downgraded two levels due to very serious risk of bias: lack of blinding of participants and personnel, no clear description of allocation concealment and premature termination of the study following interim analysis. | |||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Live birth Show forest plot | 5 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 1.1 Cleavage stage: hCG < 500 IU | 1 | 280 | Risk Ratio (M‐H, Random, 95% CI) | 0.76 [0.58, 1.01] |
| 1.2 Cleavage stage: hCG ≥ 500 IU | 3 | 914 | Risk Ratio (M‐H, Random, 95% CI) | 1.57 [1.32, 1.87] |
| 1.3 Blastocyst stage: hCG ≥ 500 IU | 2 | 1666 | Risk Ratio (M‐H, Random, 95% CI) | 0.92 [0.80, 1.04] |
| 2 Miscarriage Show forest plot | 7 | 3395 | Risk Ratio (M‐H, Random, 95% CI) | 1.09 [0.83, 1.43] |
| 3 Miscarriage per clinical pregnancy Show forest plot | 7 | 1450 | Risk Ratio (M‐H, Random, 95% CI) | 1.00 [0.77, 1.30] |
| 4 Clinical pregnancy Show forest plot | 10 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 4.1 Cleavage stage: hCG < 500 IU | 1 | 280 | Risk Ratio (M‐H, Random, 95% CI) | 0.88 [0.70, 1.10] |
| 4.2 Cleavage stage: hCG ≥ 500 IU | 7 | 1414 | Risk Ratio (M‐H, Random, 95% CI) | 1.41 [1.25, 1.58] |
| 4.3 Blastocyst stage: hCG ≥ 500 IU | 3 | 1991 | Risk Ratio (M‐H, Random, 95% CI) | 0.95 [0.86, 1.06] |
| 5 Complications: intrauterine death Show forest plot | 2 | 978 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.80 [0.33, 1.92] |

