Administración de suplementos de vitamina D para las hepatopatías crónicas en adultos
Resumen
Antecedentes
Los pacientes con hepatopatías crónicas a menudo presentan deficiencia de vitamina D. Por lo tanto, la mejoría del estado de vitamina D podría tener un efecto beneficioso sobre los pacientes con hepatopatías crónicas.
Objetivos
Evaluar los efectos beneficiosos y perjudiciales de la administración de suplementos de vitamina D en pacientes con hepatopatías crónicas.
Métodos de búsqueda
Se hicieron búsquedas en el registro de ensayos controlados del Grupo Cochrane Hepatobiliar (Cochrane Hepato‐Biliary Group), en el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL), MEDLINE, Embase, Science Citation Index Expanded y en el Conference Proceedings Citation Index ‐ Science. También se hicieron búsquedas en bases de datos de ensayos en curso y en la World Health Organization International Clinical Trials Registry Platform. Se examinaron las bibliografías de las publicaciones relevantes y se solicitaron ensayos adicionales a expertos y compañías farmacéuticas. Todas las búsquedas fueron hasta enero de 2017.
Criterios de selección
Ensayos clínicos aleatorios que compararan la vitamina D en cualquier dosis, duración y vía de administración versus placebo o ninguna intervención en adultos con hepatopatías crónicas. La vitamina D podía haberse administrado como vitamina D suplementaria (vitamina D3 [colecalciferol] o vitamina D2 [ergocalciferol]) o como una forma activa de vitamina D (1α‐hidroxivitamina D [alfacalcidol], 25‐dihidroxivitamina D [calcitriol] o 1,25‐dihidroxivitamina D [calcitriol]).
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar previstos por La Colaboración Cochrane. Se estableció contacto con los autores de los ensayos para obtener información faltante. Se realizaron metanálisis de efectos aleatorios y fijos. Para los resultados dicotómicos, se calcularon los cocientes de riesgos (CR), y para los resultados continuos, se calcularon las diferencias de medias (DM), ambos con intervalos de confianza (IC) del 95% e IC ajustados al Análisis Secuencial de Ensayos. Se calculó el odds ratio de Peto (OR) para los eventos poco frecuentes. Se examinó el riesgo de sesgo para evaluar el riesgo de errores sistemáticos. Se realizaron análisis secuenciales de ensayos para evaluar el riesgo de errores aleatorios. Se evaluó la calidad de la evidencia mediante GRADE.
Resultados principales
Se incluyeron 15 ensayos clínicos aleatorios con 1034 participantes. Todos los ensayos presentaron un diseño de grupos paralelos. Se realizaron nueve ensayos en países de ingresos altos y seis ensayos en países de ingresos medios. Todos los ensayos presentaron un alto riesgo de sesgo. Seis ensayos incorporaron a pacientes con hepatitis C crónica; cuatro, a pacientes con cirrosis hepática; cuatro, a pacientes con hígado graso no alcohólico; y uno, a receptores de trasplante hepático. Todos los ensayos incluidos informaron el estado inicial de vitamina D de los participantes. Los participantes de seis ensayos presentaron niveles iniciales de 25‐hidroxivitamina D iguales o por encima de la adecuación de vitamina D (20 ng/mL), mientras que los participantes de los nueve ensayos restantes presentaron insuficiencia de vitamina D (menos de 20 ng/mL). Todos los ensayos administraron vitamina D por vía oral. La duración media de la administración de suplementos de vitamina D fue de 0,5 años y el seguimiento fue de 0,6 años. Once ensayos (831 participantes; 40% mujeres; media de edad 52 años) evaluarón la vitamina D3, un ensayo (18 hombres; media de edad 61 años) con tres grupos de intervención evaluó vitamina D2 y 25‐dihidroxivitamina D en grupos separados, y tres ensayos (185 participantes; 55% mujeres; media de edad 55 años) evaluaron 1,25‐dihidroxivitamina D. Siete ensayos utilizaron placebo y ocho no utilizaron ninguna intervención en el grupo de control.
No se conoce el efecto de la vitamina D sobre la mortalidad por todas las causas al final del seguimiento debido a que los resultados fueron imprecisos (OR de Peto 0,70; IC del 95%: 0,09 a 5,38; I2 = 32%; 15 ensayos; 1034 participantes; evidencia de muy baja calidad). El Análisis Secuencial de Ensayos sobre la mortalidad por todas las causas se realizó basado en una tasa de mortalidad en el grupo de control del 10%, una reducción del riesgo relativo del 28% en el grupo de intervención experimental, un error tipo I del 2,5% y un error tipo II del 10% (poder del 90%). No hubo diversidad. El tamaño necesario de información fue de 6396 participantes. La curva Z acumulativa no cruzó el límite de vigilancia secuencial del ensayo para el efecto beneficioso o perjudicial después del 15vo ensayo y el IC ajustado del Análisis Secuencial de Ensayos fue de 0,00 a 2534.
No se conoce el efecto de la vitamina D en la mortalidad relacionada con una hepatopatía (CR 1,62; IC del 95%: 0,08 a 34,66; un ensayo; 18 participantes) y en los eventos adversos graves como la hipercalcemia (CR 5,00; IC del 95%: 0,25 a 100,8; un ensayo; 76 participantes), el infarto de miocardio (CR 0,75; IC del 95%: 0,08 a 6,81; dos ensayos; 86 participantes), y la tiroiditis (CR 0,33; IC del 95%: 0,01 a 7,91; un ensayo; 68 participantes)debido a que los resultados fueron imprecisos. La evidencia en todos estos resultados es de muy mala calidad. No se conoce el efecto de la vitamina D3 en los eventos adversos no graves como la glositis (CR 3,70; IC del 95%: 0,16 a 87,6; un ensayo; 65 participantes; evidencia de muy baja calidad) debido a que el resultado fue impreciso.
Debido a los datos escasos, no se realizó el Análisis Secuencial de Ensayos sobre la mortalidad relacionada con una hepatopatía, ni sobre los eventos adversos graves y no graves.
No se encontraron datos sobre la morbilidad relacionada con una hepatopatía y la calidad de vida relacionada con la salud en los ensayos aleatorios incluidos en esta revisión.
Conclusiones de los autores
No existe seguridad sobre si la administración de suplementos de vitamina D en forma de vitamina D3, vitamina D2, 1,25‐dihidroxivitamina D, o 25‐dihidroxivitamina D tiene un efecto importante sobre la mortalidad por todas las causas, la mortalidad relacionada con una hepatopatía, o los eventos adversos graves y no graves debido a que los resultados fueron imprecisos. No existe evidencia sobre el efecto de la administración de suplementos de vitamina D sobre la morbilidad relacionada con una hepatopatía ni la calidad de vida relacionada con la salud. Las conclusiones se basan en pocos ensayos con un número insuficiente de participantes y en la falta de datos sobre los resultados clínicamente importantes. Además, los ensayos analizados presentan un alto riesgo de sesgo con heterogeneidad significativa entre los mismos. La calidad general de la evidencia es muy baja.
PICO
Resumen en términos sencillos
Administración de suplementos de vitamina D para las hepatopatías crónicas
Pregunta de la revisión
¿La administración de suplementos de vitamina D es beneficiosa o perjudicial para los pacientes con hepatopatías crónicas?
Antecedentes
La evidencia disponible sobre la vitamina D y las hepatopatías no es concluyente. Muchos estudios observacionales (un estudio de un grupo de personas en el que el investigador no tiene control de los tratamientos ni las condiciones debido a cuestiones éticas o a limitaciones logísticas) indican que las hepatopatías crónicas se asocian con niveles bajos de vitamina D en la sangre. Por lo tanto, la mejoría de los niveles de vitamina D podría tener efectos beneficiosos sobre las hepatopatías crónicas. Los resultados de los ensayos clínicos aleatorios (ensayos en los que los pacientes son asignados al azar a uno de dos o más grupos de tratamiento) que prueban el efecto de la administración de suplementos de vitamina D para las hepatopatías crónicas son contradictorios. El objetivo de esta revisión sistemática (un resumen de los resultados de los ensayos de asistencia sanitaria disponibles) fue analizar los efectos beneficiosos y perjudiciales de las diferentes formas de vitamina D en pacientes con hepatopatías crónicas.
Características de los estudios
Quince ensayos proporcionaron datos para esta revisión; 1034 participantes adultos fueron asignados al azar a la vitamina D en comparación con placebo o ningún tratamiento. Nueve ensayos se realizaron en países de ingresos altos, y seis ensayos en países de ingresos medios. Todos los ensayos presentaron un riesgo alto de sesgo (es decir, sobrestimación de los beneficios y subestimación de los efectos perjudiciales). El rango de edad de los participantes fue de 18 a 84 años y en promedio el 42% fueron mujeres. Seis ensayos incorporaron a pacientes con hepatitis C crónica; cuatro, a pacientes con cirrosis hepática; cuatro, a pacientes con hígado graso no alcohólico; y uno, a receptores de trasplante hepático. La mayoría de los ensayos incluidos informaron el estado inicial de vitamina D de los participantes. La administración de vitamina D se prolongó durante un promedio de seis meses y la mayoría de los ensayos utilizó la forma de colecalciferol (vitamina D3).
Financiación
Seis ensayos parecieron estar libres de patrocinio de la industria u otro tipo de apoyo con fines de lucro que podría sesgar los resultados de los ensayos. Ocho ensayos pueden no haber estado libres de sesgo causado por el ánimo de lucro debido a que no proporcionaron información sobre el apoyo o el patrocinio del ensayo clínico. Un ensayo fue financiado por la industria.
Resultados clave
Esta revisión indica que la vitamina D no tiene ningún efecto beneficioso ni perjudicial sobre las hepatopatías crónicas. Sin embargo, hubo muy pocos ensayos sobre el diagnóstico individual de las hepatopatías crónicas y hubo muy pocos participantes en los ensayos individuales así como en el metanálisis. Por lo tanto, no es posible excluir beneficios ni efectos perjudiciales.
Calidad de la evidencia
Todos los ensayos se consideraron en riesgo alto de sesgo (o sea, posiblemente una sobrestimación de los beneficios y una subestimación de los efectos perjudiciales).
Actualidad de la evidencia
Esta evidencia está actualizada hasta enero de 2017.
Conclusiones de los autores
Summary of findings
| Vitamin D compared to placebo or no intervention for chronic liver diseases in adults | ||||||
| Patient or population: adults with chronic liver diseases. | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with placebo or no intervention | Risk with vitamin D | |||||
| All‐cause mortality at the end of follow‐up Follow‐up: 0.1 to 1.4, mean 0.6 years | Study population | OR 0.70 | 1034 | ⊕⊝⊝⊝ | Trial Sequential Analyses‐adjusted CI was 0.00 to 2534. | |
| 4 per 1.000 | 3 per 1.000 | |||||
| Liver‐related mortality Follow‐up: mean 1 year | Study population | RR 1.62 | 18 | ⊕⊝⊝⊝ | Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision. | |
| 0 per 1.000 | 0 per 1.000 | |||||
| Serious adverse events ‐ hypercalcaemia Follow‐up: mean 1 year | Study population | RR 5.00 | 76 | ⊕⊝⊝⊝ | Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision. | |
| 0 per 1.000 | 0 per 1.000 | |||||
| Serious adverse events ‐ myocardial infarction Follow‐up: 0.2 to 1, mean 0.6 years | Study population | RR 0.75 | 86 | ⊕⊝⊝⊝ | Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision. | |
| 25 per 1.000 | 19 per 1.000 | |||||
| Serious adverse events ‐ thyroiditis Follow‐up: mean 0.2 years | Study population | RR 0.33 | 68 | ⊕⊝⊝⊝ | Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision. | |
| 29 per 1.000 | 10 per 1.000 | |||||
| Failure of sustained virological response Follow‐up: 0.3 to 1.4, mean 0.9 years | Study population | RR 0.59 | 422 | ⊕⊝⊝⊝ Very low 1,2,3,6 | The trial sequential monitoring boundary is ignored due to little information use (0.6%). | |
| 465 per 1.000 | 275 per 1.000 | |||||
| Acute cellular rejection in liver transplant recipients Follow‐up: mean 0.08 years | Study population | RR 0.33 | 75 | ⊕⊝⊝⊝ Very low 1,3,7 | The trial sequential monitoring boundary is ignored due to little information use (0.84%). | |
| 120 per 1.000 | 40 per 1.000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence
| ||||||
| 1 Downgraded one level due to risk of bias: all trials were at high risk of bias. | ||||||
Antecedentes
La vitamina D se sintetiza en la piel (vitamina D3 [colecalciferol]) o se obtiene a partir de las fuentes alimentarias (vitamina D3 o vitamina D2 [ergocalciferol]). La vitamina D3 y D2 no tienen actividad biológica. Ambas formas se metabolizan dentro del hígado a 25‐hidroxivitamina D (calcidiol) y dentro de los riñones a la forma biológicamente activa conocida como 1,25‐dihidroxivitamina D (calcitriol), que funciona como una hormona similar a un esteroide (Wesley Pike 2005). Los efectos de la 1,25‐dihidroxivitamina D son mediados por su unión a los receptores de vitamina D en las células (Wesley Pike 2005). La producción renal de 1,25‐dihidroxivitamina D es regulada por los niveles de la hormona paratiroidea, por los niveles séricos de calcio y fósforo y por el factor de crecimiento de fibroblastos 23 de la hormona fosfatúrica (Kovesdy 2013).
Descripción de la afección
El estado de la vitamina D se determina a través de la medición del nivel sérico de 25‐hidroxivitamina D, que es un indicador funcional del estado de la vitamina D (Lips 2004; Dawson‐Hughes 2005; Bischoff‐Ferrari 2009). Se utilizan varios métodos para medir el estado de vitamina D (técnica radioinmunológica, cromatografía de líquidos de alto rendimiento/presión [HPLC, por sus siglas en inglés], espectrometría de masa en tándem con cromatografía de líquidos [LC‐MS/MS, por sus siglas en inglés] y más recientemente la inmunoprueba de quimiluminiscencia [CLIA, por sus siglas en inglés] (Atef 2017). La exactitud de estos métodos varía significativamente. La HPLC y la LC‐MS/MS pueden medir la vitamina D2 y D3 de forma independiente y se han considerado el valor de referencia (gold standard) (Hollis 2008). La exposición al sol y la ingesta dietética óptimas están relacionadas con el estado óptimo de vitamina D. El Institute of Medicine de los EE.UU. recomendó niveles deseados en suero de 25‐hidroxivitamina D de 20 ng/mL (50 nmol/L) (IOM 2011). Basado en la revisión sistemática preparada por el Institute of Medicine de los EE.UU., hay datos insuficientes para determinar el límite superior seguro de los niveles de 25‐hidroxivitamina D en suero (IOM 2011). Sin embargo, las concentraciones séricas de 25‐hidroxivitamina D por encima de 50 ng/mL (125 nmol/L) se consideraron potencialmente perjudiciales (IOM 2011). La International Osteoporosis Foundation y la Endocrine Society Task Force recomiendan un nivel sérico objetivo de 25‐hidroxivitamina D de 30 ng/mL (75 nmol/L) (Dawson‐Hughes 2010; Holick 2011). Se calcula que la prevalencia global del estado subóptimo de vitamina D es alta (Lips 2010; van Schoor 2011; Hilger 2014). Las causas principales de la deficiencia de vitamina D son la exposición insuficiente a la luz del sol, una ingesta dietética reducida, la pigmentación de la piel, la obesidad y la edad avanzada (Lips 2006; Holick 2007; Tsiaras 2011; SACN 2016). Una revisión sistemática de los estudios prospectivos y de intervención que evaluó el efecto del estado de vitamina D sobre los resultados no esqueléticos indicó que un estado bajo de vitamina D en un espectro amplio de enfermedades puede ser un marcador de la enfermedad (Autier 2014).
La vitamina D es sometida a una biotransformación importante en el hígado. El hígado también desempeña una función crucial en la inactivación de la vitamina D. Debido a que la vitamina D es metabolizada por el hígado, podría esperarse que un metabolismo anormal de la vitamina D se asocie con hepatopatías crónicas. La deficiencia de vitamina D ha sido informada con frecuencia en los pacientes con hepatopatías crónicas (Arteh 2010; Malham 2011; Kitson 2012; Lim 2012; Stokes 2013; Skaaby 2014). Hay evidencia de que el estado bajo de vitamina D se asocia con una mayor mortalidad en las hepatopatías crónicas (Putz‐Bankuti 2012; Wang 2013; Stokes 2014; Finkelmeier 2015; Paternostro 2017).
Descripción de la intervención
La vitamina D podía haberse administrado como vitamina D suplementaria (vitamina D3 [colecalciferol] o vitamina D2 [ergocalciferol]) o como una forma activa de vitamina D (1α‐ hidroxivitamina D [alfacalcidol], 25‐hidroxivitamina D [calcidiol], o 1,25‐dihidroxivitamina [calcitriol D]). La administración de suplementos de vitamina D previene la osteoporosis y la osteomalacia (Lips 2006). Se especula que la administración de suplementos de vitamina D puede otorgar beneficios más allá del sistema esquelético, incluidas las hepatopatías crónicas (Davis 2007; Kitson 2012; Han 2013; Elangovan 2017).
De qué manera podría funcionar la intervención
Hay evidencia de que la administración de suplementos de vitamina D puede tener efectos beneficiosos sobre los trastornos óseos en los pacientes con hepatopatías crónicas (Guañabens 2010; Luxon 2011). Sin embargo, la administración de suplementos de vitamina D se ha sugerido como un potencial terapéutico en los pacientes con infección por hepatitis B crónica (Farnik 2013; Mahamid 2013), infección por hepatitis C crónica (Petta 2010; Gutierrez 2011; Bitetto 2012; Cacopardo 2012; Cholongitas 2012; Luong 2012), hepatitis autoinmunitaria (Luong 2013a), hígado graso no alcohólico (Geier 2011; Eliades 2013; Kwok 2013; Eliades 2015), cirrosis biliar primaria (Li 2013; Luong 2013b), cirrosis alcohólica (Trépo 2013; Konstantakis 2016), y carcinoma hepatocelular (Chiang 2011; Lange 2013). En la actualidad no se conoce cómo la vitamina D ejerce sus efectos beneficiosos postulados aparte de la posibilidad de corregir los niveles de vitamina D en suero a niveles que parecen más normales (Zittermann 2014).
Por qué es importante realizar esta revisión
Los estudios observacionales informaron una prevalencia alta de insuficiencia de vitamina D a través de un espectro de hepatopatías crónicas (Arteh 2010; Lim 2012; Han 2013; Finkelmeier 2014). Sin embargo, la evidencia disponible sobre los efectos beneficiosos y perjudiciales de la administración de suplementos de vitamina D en los pacientes con hepatopatías crónicas es insuficiente e inconsecuente. Los metanálisis de los estudios observacionales y de intervención en los pacientes con infección por virus de la hepatitis C encontraron resultados contradictorios (Villar 2013; Kitson 2014). Los resultados de las revisiones sistemáticas indican que la administración de suplementos de vitamina D3 puede prolongar la vida en los adultos (Bjelakovic 2014a), y no parece tener un efecto sobre la aparición de cáncer (Bjelakovic 2014b).
Objetivos
Evaluar los efectos beneficiosos y perjudiciales de la administración de suplementos de vitamina D en pacientes con hepatopatías crónicas.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Ensayos clínicos aleatorios, independientemente del cegamiento, el estado de la publicación o el idioma. También se consideraron para la inclusión los estudios cuasialeatorios y observacionales si se encontraban durante las búsquedas para identificar datos sobre los efectos perjudiciales. Se sabe que lo anterior se centrará más en los posibles efectos beneficiosos y menos en los posibles efectos perjudiciales
Tipos de participantes
Adultos (a partir de los 18 años de edad) diagnosticados con una hepatopatía crónica.
Tipos de intervenciones
Experimental
Vitamina D en cualquier dosis y con cualquier duración, administrada como monoterapia o en combinación con calcio. La vía de administración podía ser enteral o parenteral. La vitamina D podía haberse administrado como vitamina D suplementaria (vitamina D3 [colecalciferol] o vitamina D2 [ergocalciferol]) o como una forma activa de vitamina D (1α‐hidroxivitamina D [alfacalcidol], 25‐dihidroxivitamina D [calcitriol] o 1,25‐dihidroxivitamina D [calcitriol]).
Control
Placebo (idéntico en apariencia y aroma) o ninguna intervención.
Se permitieron las cointervenciones si se utilizaron por igual en todos los grupos de intervención.
Tipos de medida de resultado
Resultados primarios
-
Mortalidad por todas las causas.
-
Mortalidad relacionada con una hepatopatía.
-
Eventos adversos graves. Según la disponibilidad de los datos, se intentó clasificar los eventos adversos como graves o no graves. Los eventos adversos graves se definieron como cualquier episodio médico externo potencialmente mortal; que llevó a la muerte o una discapacidad persistente o significativa; o cualquier evento médico que puede haber puesto en peligro a la persona; o requiriera una intervención para prevenirlo (ICH‐GCP 1997). Se consideraron todos los otros eventos adversos como no graves (ver Medidas de resultado secundarias más abajo).
Resultados secundarios
-
Morbilidad relacionada con una hepatopatía (hemorragia gastrointestinal, encefalopatía hepática, síndrome hepatorrenal, ascitis, ictericia, cáncer de hígado).
-
Calidad de vida relacionada con la salud (cualquier escala de resultado continua válida utilizada por los investigadores).
-
Eventos adversos no graves.
Resultados exploratorios
-
Fracaso de la respuesta virológica a la semana cuatro (respuesta virológica rápida), a la semana 12 (respuesta virológica temprana) y a los seis meses después del tratamiento (respuesta virológica sostenida) (p.ej. sin depuración del ADN del virus de la hepatitis B [ADN‐VHB] o el ácido ribonucleico del virus de la hepatitis B [ARN‐VHB] del suero).
-
Rechazo celular agudo en los receptores de trasplante hepático.
-
Estado de la vitamina D.
-
Densidad mineral ósea.
-
Índices bioquímicos (aspartato‐aminotransferasa, alanina‐aminotransferasa, fosfatasa alcalina, gamma‐glutamil‐transpeptidasa, albúmina, bilirrubina, triglicéridos, colesterol y calcio).
Results
Description of studies
Results of the search
We identified 2931 references of possible interest through searching The Cochrane Hepato‐Biliary Group Controlled Trials Register (37 references), the Cochrane Central Register of Controlled Trials in the Cochrane Library (503 references), MEDLINE (299 references), Embase (1390 references), Science Citation Index Expanded (695), and reference lists (seven references). We identified an additional two ongoing trials through searching databases of ongoing trials. We will include data from the ongoing trials in updates of this review. We excluded 644 duplicates and 2256 clearly irrelevant references through reading the abstracts. Accordingly, we retrieved 30 references for further assessment. Of these, we excluded 14 references because they were not randomised trials. In total, 15 randomised trials described in 17 references fulfilled our inclusion criteria (Figure 1). Details of the trials are shown in the Characteristics of included studies table; Table 1; Table 2; and Table 3.

Study flow diagram
| Study ID | Protocol | Design | Groups | Bias | Blinding | Participants | Women | Mean |
| Yes | Parallel | 2 | High | NI | 72 | 44 | 47 | |
| No | Parallel | 2 | High | NI | 115 | 50 | 64 | |
| Yes | Parallel | 2 | High | PL | 65 | 35 | 59 | |
| No | Parallel | 2 | High | NI | 101 | 25 | 40 | |
| Yes | Parallel | 2 | High | PL | 60 | 52 | 48 | |
| Yes | Parallel | 3 | High | PL | 120 | 38 | 41 | |
| No | Parallel | 3 | High | NI | 18 | 0 | 61 | |
| No | Parallel | 2 | High | NI | 50 | 58 | 47 | |
| Yes | Parallel | 2 | High | PL | 36 | 25 | 61 | |
| No | Parallel | 2 | High | PL | 60 | 51 | 60 | |
| No | Parallel | 2 | High | NI | 76 | 66 | 61 | |
| No | Parallel | 2 | High | NI | 34 | 100 | 56 | |
| Yes | Parallel | 2 | High | NI | 68 | 13 | 42 | |
| No | Parallel | 3 | High | PL | 75 | 17 | 48 | |
| No | Parallel | 2 | High | NI | 84 | 49 | 59 |
n: number of participants; NI: no intervention; PL: placebo.
| Study ID | Participants | Outcome measures | Sponsor | Country |
| Chronic hepatitis C genotype 1 | Sustained virological response | No information | Israel | |
| Chronic hepatitis C genotype 1 | Sustained virological response | No information | Japan | |
| NAFLD | Liver steatosis, liver function | No | Italy | |
| Chronic hepatitis C genotype 4 | Sustained virological response | No information | Egypt | |
| NAFLD | Liver steatosis, liver function | No | Iran | |
| NAFLD | Liver function, body fat | No | Iran | |
| Liver cirrhosis | Bone mineral density | Yes | USA | |
| Chronic hepatitis C genotype 2 or 3 | Sustained virological response | No information | Israel | |
| Liver cirrhosis | Vitamin D status, liver function | No | Austria | |
| NAFLD | Liver function, insulin resistance index | No | Iran | |
| Liver cirrhosis | Bone mineral density | No information | Japan | |
| Primary biliary cirrhosis | Bone mineral density | No information | Japan | |
| Chronic hepatitis C genotype 1,2,3,4 | Early virological response | No | Iran | |
| Liver transplant recipients | Acute cellular rejection rate | No | China | |
| Chronic hepatitis C genotype 1 | Sustained virological response | No information | Japan |
NAFLD: non‐alcoholic fatty liver disease.
| Study ID | Vitamin | Calcium | Regimen* | Treatment | Follow‐up | Cointervention | |||
| D3 | D2 | 25(OH)D | 1,25(OH)2D | ||||||
| 2000 | ‐ | ‐ | ‐ | ‐ | Daily | 48 | 72 | PEG‐INF, RBV | |
| 2000 | ‐ | ‐ | ‐ | ‐ | Daily | 16 | 16 | PEG‐INF, RBV, SP | |
| 2000 | ‐ | ‐ | ‐ | ‐ | Daily | 24 | 24 | ‐ | |
| 2143 | ‐ | ‐ | ‐ | ‐ | Weekly | 48 | 72 | PEG‐INF, RBV | |
| 7143 | ‐ | ‐ | ‐ | ‐ | Weekly | 10 | 10 | ‐ | |
| 1000 | ‐ | ‐ | ‐ | 500 | Daily | 10 | 12 | ‐ | |
| ‐ | 17,857 | 2400 | ‐ | ‐ | Daily | 52 | 52 | ‐ | |
| 2000 | ‐ | ‐ | ‐ | ‐ | Daily | 24 | 48 | PEG‐INF, RBV | |
| 2800 | ‐ | ‐ | ‐ | ‐ | Daily | 8 | 8 | ‐ | |
| 3571 | ‐ | ‐ | ‐ | ‐ | Twice a week | 16 | 16 | ‐ | |
| ‐ | ‐ | ‐ | 1 | ‐ | Daily | 52 | 52 | ‐ | |
| ‐ | ‐ | ‐ | 1 | ‐ | Daily | 52 | 52 | ‐ | |
| 1600 | ‐ | ‐ | ‐ | ‐ | Daily | 12 | 12 | PEG‐INF, RBV | |
| ‐ | ‐ | ‐ | 0.25 | 1000 | Daily | 4 | 4 | ‐ | |
| 1000 | ‐ | ‐ | ‐ | ‐ | Daily | 16 | 24 | PEG‐INF, RBV | |
* Vitamin D was administered orally in all trials.
1,25(OH)2D: calcitriol; 25(OH)D: calcidiol; PEG‐INF: pegylated‐interferon; RBV: ribavirin; SP: simeprevir.
Included studies
All 15 included trials used a parallel‐group design with two (Shiomi 1999a; Shiomi 1999b; Abu‐Mouch 2011; Nimer 2012; Sharifi 2014; Yokoyama 2014; Esmat 2015; Atsukawa 2016; Barchetta 2016; Foroughi 2016; Pilz 2016: Vosoghinia 2016) or three intervention groups (Mobarhan 1984; Xing 2013; Lorvand Amiri 2016). The trials were published from 1984 to 2016 (Table 1).
The trials were conducted in Africa (Esmat 2015), Asia (Shiomi 1999a; Shiomi 1999b; Abu‐Mouch 2011; Nimer 2012; Xing 2013; Sharifi 2014; Yokoyama 2014; Atsukawa 2016, Foroughi 2016; Lorvand Amiri 2016; Vosoghinia 2016), Europe (Barchetta 2016; Pilz 2016), and North America (Mobarhan 1984). Nine trials were conducted in high‐income countries (Mobarhan 1984; Shiomi 1999a; Shiomi 1999b; Abu‐Mouch 2011; Nimer 2012; Yokoyama 2014; Atsukawa 2016; Barchetta 2016; Pilz 2016), and six trials in middle‐income countries (Xing 2013; Sharifi 2014; Esmat 2015; Foroughi 2016; Lorvand Amiri 2016; Vosoghinia 2016) (Table 2).
Participants
A total of 1034 participants were randomly assigned in the 15 trials. The number of participants in each trial ranged from 18 to 120 (median 68). The mean age of participants was 53 years (range 18 years to 84 years). The mean proportion of women was 42% (Table 1).
Six trials included participants with chronic hepatitis C (Abu‐Mouch 2011; Nimer 2012; Yokoyama 2014; Esmat 2015; Atsukawa 2016; Vosoghinia 2016), four trials included participants with liver cirrhosis (Mobarhan 1984; Shiomi 1999a; Shiomi 1999b; Pilz 2016), four trials included participants with non‐alcoholic fatty liver disease (Sharifi 2014; Barchetta 2016; Foroughi 2016; Lorvand Amiri 2016), and one trial included liver transplant recipients (Xing 2013) (Table 2).
All included trials reported the baseline vitamin D status of participants based on serum 25‐hydroxyvitamin D levels. Participants in six trials had baseline 25‐hydroxyvitamin D levels at or above vitamin D adequacy (20 ng/mL) (Abu‐Mouch 2011; Nimer 2012; Yokoyama 2014; Atsukawa 2016; Foroughi 2016; Vosoghinia 2016). Participants in the remaining nine trials had baseline 25‐hydroxyvitamin D levels considered vitamin D insufficient (less than 20 ng/mL) (Mobarhan 1984; Shiomi 1999a; Shiomi 1999b; Xing 2013; Sharifi 2014; Esmat 2015; Barchetta 2016; Lorvand Amiri 2016; Pilz 2016).
Experimental interventions
Vitamin D3 (cholecalciferol)
Vitamin D was administered as vitamin D3 (cholecalciferol) in 10 trials ((831 participants; 40% women; mean age 52 years) (Abu‐Mouch 2011; Nimer 2012; Sharifi 2014; Yokoyama 2014; Esmat 2015; Atsukawa 2016; Barchetta 2016; Foroughi 2016; Lorvand Amiri 2016; Pilz 2016; Vosoghinia 2016). Vitamin D3 was tested orally in all trials. Vitamin D3 was administered daily in eight trials (Abu‐Mouch 2011; Nimer 2012; Yokoyama 2014; Atsukawa 2016; Barchetta 2016; Pilz 2016; Lorvand Amiri 2016; Vosoghinia 2016), weekly in two trials (Esmat 2015; Foroughi 2016), and twice a week in one trial (Sharifi 2014). Mean daily dose of the vitamin D3 was 2478 international units (IU). The duration of supplementation in trials using vitamin D3 was 8 to 48 weeks (mean 21 weeks), and the length of the follow‐up period was from 8 to 72 weeks (mean 29 weeks) (Table 3).
Vitamin D2 (ergocalciferol)
Vitamin D was administered as vitamin D2 (ergocalciferol) in one trial (18 participants; 0% women; mean age 52 years) (Mobarhan 1984). Vitamin D2 was tested in a dose of 50,000 IU, orally, two or three times weekly for one year (Mobarhan 1984) (Table 3).
1,25‐dihydroxyvitamin D (calcitriol)
Vitamin D was administered as 1,25‐dihydroxyvitamin D in three trials (185 participants; 55% women; mean age 55 years) (Shiomi 1999a; Shiomi 1999b; Xing 2013). 1,25‐dihydroxyvitamin D was tested singly, orally, and daily in two trials (Shiomi 1999a; Shiomi 1999b). One trial administered 1,25‐dihydroxyvitamin D combined with calcium (Xing 2013). The dose of 1,25‐dihydroxyvitamin D was 1.0 μg in two trials (Shiomi 1999a; Shiomi 1999b), and 0.25 μg in one trial (Xing 2013). The duration of supplementation and follow‐up in trials using 1,25‐dihydroxyvitamin D was one month to one year (mean 0.7 years) (Table 3).
25‐hydroxyvitamin D (calcidiol)
Vitamin D was administered as 25‐hydroxyvitamin D in one trial (18 participants; 0% women; mean age 52 years) (Mobarhan 1984). 25‐hydroxyvitamin D was tested at a dose of 800 IU/day to 2000 IU/day, orally, for one year (Table 3).
Control interventions
Seven trials used placebo (Xing 2013; Sharifi 2014; Esmat 2015; Barchetta 2016; Foroughi 2016; Lorvand Amiri 2016; Pilz 2016), and eight trials used no intervention in the control group (Mobarhan 1984; Shiomi 1999a; Shiomi 1999b; Abu‐Mouch 2011; Nimer 2012; Yokoyama 2014; Atsukawa 2016; Vosoghinia 2016) (Table 1).
Cointerventions
Five trials used pegylated‐interferon and ribavirin combined with vitamin D3 in the intervention groups versus no intervention (Abu‐Mouch 2011; Nimer 2012; Yokoyama 2014; Esmat 2015; Vosoghinia 2016). One trial used pegylated‐interferon, ribavirin, and simeprevir (direct‐acting antiviral agent) combined with vitamin D3 in the intervention group versus no intervention (Atsukawa 2016). One trial with three intervention groups administered 1,25‐dihydroxyvitamin D combined with calcium gluconate in one intervention group, and calcium gluconate in another intervention group (Xing 2013). Thus, we compared the 1,25‐dihydroxyvitamin D plus calcium gluconate group versus the calcium gluconate group and placebo group combined. Another trial with three intervention groups used vitamin D3 singly in one of the intervention groups, vitamin D3 combined with calcium carbonate in another intervention group, and placebo in a third intervention group (Lorvand Amiri 2016) (Table 3). Thus, we compared the first two groups together versus the placebo group.
A detailed description of the characteristics of included studies is presented in the Characteristics of included studies table; Table 1; Table 2; and Table 3.
Excluded studies
A detailed description of the characteristics of excluded studies is presented in the Characteristics of excluded studies table.
Risk of bias in included studies
All trials were at high risk of bias (had unclear or high risk of bias control in one or more domains assessed) (Figure 2; Figure 3; Table 1). Inspection of the funnel plot did not suggest potential bias (asymmetry) (Figure 4). The adjusted‐rank correlation test (P = 0.34) and a regression asymmetry test (P = 0.48) found no significant evidence of bias.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Funnel plot of comparison: 1 Vitamin D versus placebo or no intervention, outcome: 1.1 All‐cause mortality.
Allocation
Eight trials described the generation of allocation sequence adequately (Abu‐Mouch 2011; Nimer 2012; Sharifi 2014; Atsukawa 2016; Barchetta 2016; Foroughi 2016; Lorvand Amiri 2016; Pilz 2016). The remaining seven trials were described as being randomised, but the method used for sequence generation was not described or was insufficiently described.
Nine trials described the method used to conceal allocation adequately (Shiomi 1999a; Abu‐Mouch 2011; Nimer 2012; Sharifi 2014; Esmat 2015; Barchetta 2016; Lorvand Amiri 2016; Pilz 2016; Vosoghinia 2016). The remaining six trials were described as being randomised, but the method used for allocation concealment was not described or was insufficiently described.
Blinding
Five trials performed and adequately described the blinding of participants and personnel (Sharifi 2014; Esmat 2015; Barchetta 2016; Lorvand Amiri 2016; Pilz 2016). Eight trials did not blind participants and personnel (Mobarhan 1984; Shiomi 1999a; Shiomi 1999b; Abu‐Mouch 2011; Nimer 2012; Yokoyama 2014; Atsukawa 2016; Vosoghinia 2016), while in two trials the method used for blinding of participants and personnel was not described or was insufficiently described (Xing 2013; Foroughi 2016).
Four trials performed and adequately described the blinding of outcome assessors (Sharifi 2014; Esmat 2015; Barchetta 2016; Pilz 2016). The method for blinding of outcome assessors for the remaining 11 trials was not described or was insufficiently described.
Incomplete outcome data
Twelve trials adequately addressed incomplete outcome data (Mobarhan 1984; Shiomi 1999a; Shiomi 1999b; Abu‐Mouch 2011; Nimer 2012; Xing 2013; Yokoyama 2014; Sharifi 2014; Foroughi 2016; Lorvand Amiri 2016; Pilz 2016; Vosoghinia 2016). In three trials, the information was insufficient to allow assessment of whether missing data in combination with the method used to handle missing data were likely to induce bias on the effect estimate (Esmat 2015; Atsukawa 2016; Barchetta 2016).
Selective reporting
Seven trials reported the outcomes stated in their respective protocols (Mobarhan 1984; Abu‐Mouch 2011; Barchetta 2016; Foroughi 2016; Lorvand Amiri 2016; Pilz 2016; Vosoghinia 2016). It was unclear whether the other six trials reported all predefined and clinically relevant and reasonably expected outcomes (Nimer 2012; Xing 2013; Yokoyama 2014; Sharifi 2014; Esmat 2015; Atsukawa 2016). The study authors did not report all predefined outcomes fully in two trials (Shiomi 1999a; Shiomi 1999b).
For‐profit bias
Six trials reported how they were funded and appeared to be free of industry sponsorship or other type of for‐profit support that may bias the results of the trials (Xing 2013; Sharifi 2014; Barchetta 2016; Foroughi 2016; Pilz 2016; Vosoghinia 2016). Eight trials may not have been free of for‐profit bias as they did not provide any information on clinical trial support or sponsorship (Shiomi 1999a; Shiomi 1999b; Abu‐Mouch 2011; Nimer 2012; Yokoyama 2014; Esmat 2015; Atsukawa 2016; Lorvand Amiri 2016). One trial was funded by industry (Mobarhan 1984) (Table 2).
Other potential sources of bias
We did not identify any certain signs of academic bias or other potential sources of bias in nine trials (Mobarhan 1984; Abu‐Mouch 2011; Nimer 2012; Xing 2013; Sharifi 2014; Yokoyama 2014; Esmat 2015; Atsukawa 2016; Barchetta 2016). Six trials may or may not have been free of other components that could put them at risk of bias (Shiomi 1999a; Shiomi 1999b; Foroughi 2016; Lorvand Amiri 2016; Pilz 2016; Vosoghinia 2016).
Effects of interventions
Primary outcomes
All‐cause mortality
We are uncertain as to whether vitamin D has an effect on all‐cause mortality at end of follow‐up because the results were imprecise (Peto OR 0.69, 95% CI 0.09 to 5.40; I2 = 66%; 15 trials; 1034 participants; Analysis 1.1).
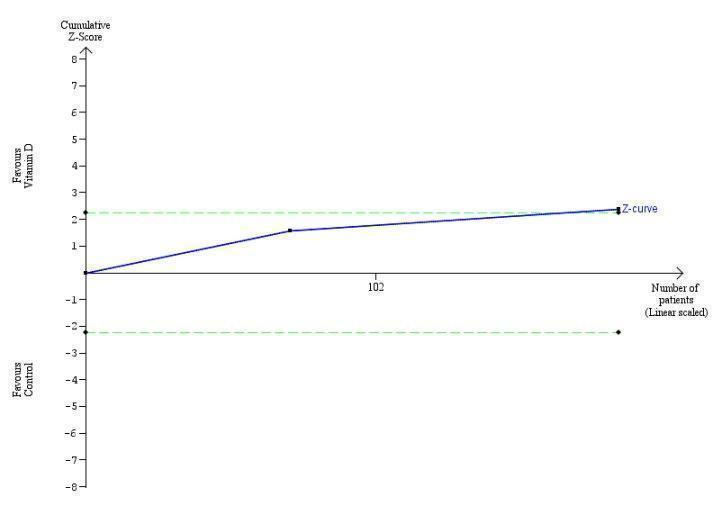
Trial Sequential Analysis on mortality in the 15 vitamin D trials was performed based on a mortality rate in the control group of 10%, a relative risk reduction (RRR) of 28% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 6396 participants. The cumulative Z‐curve did not cross the trial sequential monitoring boundary for benefit or harm, and did not enter the trial sequential monitoring area for futility (Figure 5). The Trial Sequential Analysis‐adjusted CI was 0.00 to 2534.2.

Trial Sequential Analysis on all‐cause mortality up to 1.4‐year follow‐up in 15 vitamin D trials, based on mortality rate in the control group of 10%, a relative risk reduction of 28% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 6396 participants. The cumulative Z‐curve (blue line) did not cross the trial sequential monitoring boundary for benefit or harm (red inward sloping lines) and did not enter the trial sequential monitoring area for futility (inner‐wedge with red outward sloping lines).
Sensitivity analyses taking attrition into consideration
In six trials, there were no losses to follow‐up (Shiomi 1999a; Shiomi 1999b; Abu‐Mouch 2011; Nimer 2012; Xing 2013; Foroughi 2016). In the remaining nine included trials, authors reported the exact numbers of participants with missing outcomes in the intervention and control groups. A total of 30 out of 518 (5.8%) participants had missing outcomes in the vitamin D group versus 30 of 516 (5.8%) participants in the control group.
'Best‐worst' case scenario
When we assumed that all participants lost to follow‐up in the experimental intervention group survived and all those with missing outcomes in the control intervention group died, vitamin D supplementation significantly decreased mortality (Peto OR 0.11, 95% CI 0.05 to 0.24; P < 0.00001; I2 = 0%; 1034 participants; 15 trials; Analysis 1.2).
'Worst‐best' case scenario
When we assumed that all participants lost to follow‐up in the experimental intervention group died and all those with missing outcomes in the control intervention group survived, vitamin D supplementation significantly increased mortality (Peto OR 7.80, 95% CI 3.67 to 16.57; P < 0.00001; I2 = 0%; 1034 participants; 15 trials; Analysis 1.2).
Liver‐related mortality
We are uncertain as to whether vitamin D has an important effect on liver‐related mortality because the result was imprecise (RR 1.62, 95% CI 0.08 to 34.7; 1 trial; 18 participants; Analysis 1.3). Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision.
Serious adverse events
We are uncertain as to whether the active form of vitamin D, 1,25‐dihydroxyvitamin D, has an important effect on hypercalcaemia because the result was imprecise (RR 5.00, 95% CI 0.25 to 100.8; 1 trial; 76 participants; Analysis 1.4). We are also uncertain as to whether vitamin D has an important effect on myocardial infarction (RR 0.75, 95% CI 0.08 to 6.81; 2 trials; 86 participants; Analysis 1.4) or thyroiditis (RR 0.33, 95% CI 0.01 to 7.91; 1 trial; 68 participants; Analysis 1.4) because the results were imprecise. Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision.
Secondary outcomes
Liver‐related morbidity
We found no data on liver‐related morbidity.
Health‐related quality of life
We found no data on health‐related quality of life.
Non‐serious adverse events
We are uncertain as to whether vitamin D3 has an important effect on glossitis because the results were imprecise (RR 3.70, 95% CI 0.16 to 87.58; 1 trial; 65 participants; Analysis 1.5).
There were several reported non‐serious adverse events in people with chronic hepatitis C treated with combination of vitamin D and pegylated‐interferon and ribavirin. These were similar in both groups and consistent with typical interferon‐ribavirin‐induced systemic symptoms such as nausea, headache, insomnia, chills, myalgia, pyrexia, pruritus, mild neutropenia, mild thrombocytopenia, and mild anaemia (Abu‐Mouch 2011; Nimer 2012; Yokoyama 2014; Esmat 2015; Atsukawa 2016).
Exploratory outcomes
Rapid virological response in people with chronic viral hepatitis C
We are uncertain as to whether vitamin D3 has an important effect on rapid virological response in people with chronic hepatitis C because the results were imprecise (RR 0.70, 95% CI 0.52 to 0.94, I2 = 0%; 2 trials; 187 participants; Analysis 1.6).
Trial Sequential Analysis on rapid virological response in the two vitamin D trials was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 11958 participants. The cumulative Z‐curve crossed the conventional monitoring boundary for benefit. The trial sequential monitoring boundary is ignored due to little information use (1.56%) (Figure 6).

Trial Sequential Analysis on rapid virological response in the two vitamin D trials was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 11958 participants. The cumulative Z‐curve crossed the conventional monitoring boundary for benefit. The trial sequential monitoring boundary is ignored due to little information use (1.56%).
Early virological response in people with chronic viral hepatitis C
We are uncertain as to whether the vitamin D3 has an important effect on early virological response in people with chronic hepatitis C because the results were imprecise (RR 0.10, 95% CI 0.03 to 0.33; 2 trials; 140 participants; Analysis 1.7).
Trial Sequential Analysis on early virological response in the two vitamin D trials was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 11958 participants. The cumulative Z‐curve crossed the conventional monitoring boundary for benefit. The trial sequential monitoring boundary is ignored due to little information use (1.17%) (Figure 7).

Trial Sequential Analysis on early virological response in the two vitamin D trials was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 11958 participants. The cumulative Z‐curve crossed the conventional monitoring boundary for benefit. The trial sequential monitoring boundary is ignored due to little information use (1.17%).
Sustained virological response in people with chronic viral hepatitis C
Vitamin D3 had no significant effect on sustained virological response in people with chronic hepatitis C (RR 0.59, 95% CI 0.28 to 1.21, I2 = 84%; 5 trials; 422 participants; Analysis 1.8).
Trial Sequential Analysis on sustained virological response in the five vitamin D trials was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 69798 participants. The trial sequential monitoring boundary is ignored due to little information use (0.6%) (Figure 8).

Trial Sequential Analysis on sustained virological response in the five vitamin D trials was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 69798 participants. The trial sequential monitoring boundary is ignored due to little information use (0.45%).
Acute cellular rejection in liver transplant recipients
We are uncertain as to whether the 1,25‐dihydroxyvitamin D has an important effect on acute cellular rejection in liver transplant recipients because the results were imprecise (RR 0.33, 95% CI 0.04 to 2.62; 1 trial; 75 participants; Analysis 1.9).
Trial Sequential Analysis on rapid acute cellular rejection in the one vitamin D trial was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 8979 participants. The cumulative Z‐curve did not cross the conventional monitoring boundary. The trial sequential monitoring boundary is ignored due to little information use (0.84%) (Figure 9).

Trial Sequential Analysis on acute cellular rejection in the one vitamin D trial was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 11958 participants. The cumulative Z‐curve did not cross the conventional monitoring boundary. The trial sequential monitoring boundary is ignored due to little information use (0.84%).
Vitamin D status
Vitamin D supplementation significantly increased vitamin D status of participants in the intervention group (MD 17.24 ng/mL, 95% CI 12.5 to 22.0, I2 = 94%; 6 trials; 424 participants; Analysis 1.10).
Bone mineral density
We were unable to extract relevant data from the included trials.
Biochemical indices
Vitamin D had no significant effect on activity of aspartate aminotransferase (MD ‐1.40 IU/L, 95% CI ‐2.88 to 0.08; I2 = 62%; 6 trials; 313 participants); and activity of alanine aminotransferase (MD ‐0.52 IU/L, 95% CI ‐5.10 to 4.06, I2 = 91%; 6 trials; 313 participants) (Analysis 1.11). We are uncertain as to whether vitamin D has an important effect on the following biochemical indices because the results were imprecise: serum activity of alkaline phosphatase (MD 7.39 IU/L, 95% CI ‐39.89 to 54.67; I2 = 96%; 2 trials; 96 participants); serum activity of gamma‐glutamyl transpeptidase (MD 3.64 IU/L, 95% CI 0.33 to 6.96; I2 = 0%; 2 trials; 101 participants); serum concentration of albumin (MD ‐0.10 g/L, 95% CI ‐0.40 to 0.20, I2 = 0%; 2 trials, 48 participants); serum concentration of bilirubin (MD 0.38 mg/dL, 95% CI 0.21 to 0.55, I2 = 0%; 2 trials; 48 participants); serum concentration of triglyceride (MD 23.69 mg/dL, 95% CI ‐13.90 to 61.27, I2 = 95%; 2 trials; 115 participants); serum concentration of cholesterol (MD 2.75 mg/dL, 95% CI ‐4.75 to 10.25; 1 trial; 55 participants); and serum concentration of calcium (MD 2.01 mg/dL, 95% CI ‐0.53 to 4.56, I2 = 97%; 2 trials; 72 participants (Analysis 1.11).
Summary of Findings
'summary of findings Table for the main comparison presents our findings on the outcomes: all‐cause mortality with mean follow‐up of 0.6 years; liver‐related mortality with a mean follow‐up of one year; serious adverse events such as hypercalcaemia (mean follow‐up of one year), myocardial infarction (mean follow‐up of mean 0.6 years), thyroiditis (mean follow‐up of 0.2 years), failure of sustained virological response (mean follow‐up of mean 0.9 years), glossitis (mean follow‐up of 0.5 years), acute cellular rejection in liver transplant recipients (mean follow‐up of 0.08 years). The quality of the evidence of the presented outcomes is very low.
Discusión
Resumen de los resultados principales
No existe seguridad sobre si la administración de suplementos de vitamina D en forma de vitamina D3, vitamina D2, 1,25‐dihidroxivitamina D, o 25‐dihidroxivitamina D tiene un efecto significativo sobre la mortalidad por todas las causas, la mortalidad relacionada con una hepatopatía, o los eventos adversos graves o no graves debido a que los resultados fueron imprecisos. La vitamina D no parece beneficiosa para aumentar el número de pacientes con una respuesta virológica sostenida ni para reducir el número de pacientes con rechazo celular agudo en los receptores de trasplante hepático. Los análisis de tres ensayos en pacientes con hepatitis C crónica indicaron que no existe seguridad en cuanto a si la vitamina D3 podría ser beneficiosa para aumentar el número de pacientes con una respuesta virológica rápida y temprana debido a que los resultados fueron imprecisos (Abu‐Mouch 2011; Atsukawa 2016; Vosoghinia 2016). El estado de vitamina D de los participantes con hepatopatías crónicas aumentó significativamente después de la administración de suplementos con vitamina D. No se encontró ningún cambio significativo en los índices bioquímicos después de la administración de suplementos. Hubo evidencia insuficiente sobre el efecto de la administración de suplementos de vitamina D sobre la morbilidad relacionada con una hepatopatía y la calidad de vida relacionada con la salud en los pacientes con hepatopatías crónicas.
Los resultados de la revisión sistemática deben interpretarse con gran cuidado debido a que todos los ensayos incluidos estuvieron en riesgo alto de sesgo. Debido al número pequeño de ensayos incluidos y el informe de resultado selectivo, no fue posible realizar análisis de subgrupos de acuerdo a las diferentes formas de vitamina D. El número de pacientes y de resultados fue escaso, lo que se agrega al riesgo de errores tipo I y tipo II debido a la escasez de datos (Keus 2010). El IC del Análisis Secuencial de Ensayos reveló que no hay información suficiente para establecer conclusiones válidas.
Aunque la deficiencia de vitamina D se considera común en los pacientes con diversas hepatopatías (Chen 2014; Iruzubieta 2014; Elangovan 2017), no se halló evidencia convincente de que la administración de suplementos de vitamina D tuviese un impacto terapéutico en las hepatopatías crónicas.
Compleción y aplicabilidad general de las pruebas
El protocolo publicado describió el plan de analizar el efecto de la vitamina D sobre las hepatopatías crónicas en los ensayos aleatorios en adultos (Bjelakovic 2015). Se incluyeron todos los ensayos aleatorios elegibles hasta enero de 2017. Se encontró sólo un número pequeño de ensayos aleatorios con un número pequeño de participantes. Todos los ensayos presentaron un alto riesgo de sesgo. Se encontró heterogeneidad estadística significativa en algunos de los análisis. Este hecho aumenta la precisión y el poder de los análisis (Higgins 2011; Turner 2013). Los análisis revelaron que no hubo un informe de resultado en aproximadamente un 6% de los participantes del ensayo. En consecuencia, los análisis del “mejor‐peor de los casos” y del “peor‐mejor de los casos” revelaron que los resultados fueron compatibles tanto con un efecto beneficioso grande como con un efecto perjudicial grande de la vitamina D sobre la mortalidad. Aunque estos análisis de sensibilidad extremos son análisis improbables, revelan cómo la omisión de los participantes puede cambiar significativamente los resultados de un gran beneficio a un efecto nulo o incluso quizás a un efecto perjudicial. Por lo tanto, se aconseja la aplicación crítica de los hallazgos.
Calidad de la evidencia
La revisión siguió el diseño general de un protocolo Cochrane publicado y revisado por expertos (Bjelakovic 2015). No fue posible encontrar metanálisis anteriores de los ensayos de la vitamina D en las hepatopatías crónicas en la bibliografía. Se realizó una revisión minuciosa en conformidad con la metodología Cochrane (Higgins 2011) y se implementaron los hallazgos de los estudios metodológicos (Schulz 1995; Moher 1998; Kjaergard 2001; Wood 2008; Savović 2012a; Savović 2012b; Lundh 2017).
Se efectuaron búsquedas reiteradas en varias bases de datos y se estableció contacto con los autores de los ensayos y la industria que produce suplementos de vitamina D. Por lo tanto, se cree que no se han pasado por alto ensayos clínicos aleatorios importantes. Como se indica a continuación, es posible que se hayan omitido los ensayos sólo informados a las autoridades reguladoras. Sin embargo, dichos ensayos suelen ser neutros o negativos. No se encontró evidencia significativa de sesgo de publicación (Johnson 2007). Sin embargo, se informa sólo alrededor de uno de cada dos ensayos (Gluud 2008), de manera que no es posible excluir los sesgos de informe. También se ha realizado el Análisis Secuencial de Ensayos, basado en la estimación del tamaño de información necesario ajustado por diversidad para evitar un riesgo indebido de errores aleatorios en un metanálisis acumulativo y para prevenir las afirmaciones prematuras de la superioridad de la vitamina D o de la ausencia de efecto (Brok 2008; Wetterslev 2008; Brok 2009; Thorlund 2009; Wetterslev 2009; Thorlund 2011a; Thorlund 2011b; TSA 2017; Wetterslev 2017).
Se utilizó GRADE para construir una tabla de 'Resumen de hallazgos'. Las evaluaciones de GRADE mostraron que la calidad de la evidencia fue muy baja para la mortalidad por todas las causas, la mortalidad relacionada con una hepatopatía, los eventos adversos graves (hipercalcemia, infarto de miocardio, tiroiditis), el fracaso de la respuesta virológica sostenida, la glositis, o el rechazo celular agudo en los receptores de trasplante hepático. Se aplicaron los resultados del Análisis Secuencial de Ensayos para calificar la imprecisión. Cuando hubo evidencia insuficiente para establecer una conclusión, o sea, cuando el Análisis Secuencial de Ensayos indicó que no se había alcanzado el tamaño necesario de información, se disminuyó la calidad de la evidencia. También se utilizó el riesgo de sesgo de deserción para calificar la imprecisión, la heterogeneidad significativa entre los ensayos para calificar la inconsistencia, y los errores de diseño para calificar la imposibilidad de generalizar la evidencia.
Sesgos potenciales en el proceso de revisión
Deben considerarse ciertas limitaciones de esta revisión. Como con todas las revisiones sistemáticas, los hallazgos e interpretaciones están limitados por la calidad y la cantidad de evidencia disponible sobre los efectos de la vitamina D en las hepatopatías crónicas. A pesar de las especulaciones extensas en la bibliografía y en varios estudios epidemiológicos que afirmaban posibles efectos beneficiosos de la vitamina D en los pacientes con hepatopatías crónicas, sólo pocos ensayos aleatorios evaluaron dichos efectos. La duración de la administración de suplementos y la duración del seguimiento fueron cortas en algunos de los los ensayos incluidos. Este hecho puede dificultar la detección de cualquier efecto, beneficioso o perjudicial. Los 15 ensayos incluidos presentaban un riesgo de sesgo elevado. En lugar de informar los resultados clínicos, la mayoría de los ensayos basó el análisis en los resultados alternativos. Muchos de los ensayos incluidos no tuvieron el poder estadístico suficiente. Estos factores corrompen la validez de los resultados (Schulz 1995; Moher 1998; Kjaergard 2001; Wood 2008; Savović 2012a; Savović 2012b). Los eventos adversos no se informaron suficientemente. Se ha señalado que con mucha frecuencia los eventos adversos se pasan por alto en los ensayos aleatorios (Ioannidis 2009). En varios ensayos en pacientes con hepatitis C crónica, la vitamina D fue administrada en combinación con interferón pegilado y ribavirina, lo cual dificulta juzgar los efectos beneficiosos o perjudiciales, o a qué intervención se debe asignar cualquiera de los eventos adversos observados. Se observó heterogeneidad significativa entre los ensayos en algunos de los metanálisis. Este hecho puede recalcar la inconsistencia de los resultados y además puede cuestionar los hallazgos de la revisión.
La mayoría de los ensayos incluidos utilizaron vitamina D3, tres ensayos evaluaron 1,25‐dihidroxivitamina D, un ensayo evaluó vitamina D2 y un ensayo evaluó 25‐dihidroxivitamina D. No fue posible realizar los análisis de subgrupos para comparar diferentes formas de vitamina D utilizada para la administración de suplementos.
No se buscaron los archivos de los organismos reguladores como la Food and Drug Administration y el European Medicine Agency. Este hecho puede influir en la selección de los ensayos. No se realizaron búsquedas después de los estudios observacionales sobre los efectos perjudiciales. Este hecho puede influir en los resultados hacia los beneficios de las intervenciones con menos énfasis en los efectos perjudiciales (Storebø 2015).
Diferentes clases de sesgo pueden afectar los resultados de los metanálisis, incluido el informe selectivo de algunos resultados en las publicaciones de los ensayos (Chan 2004; Williamson 2005; Furukawa 2007). El informe de los resultados de los ensayos incluidos no fue suficiente ni consistente. Hay varias explicaciones posibles para el informe selectivo de los resultados en los ensayos con asignación aleatoria. Es posible que los ensayos en los cuales no se informó el resultado no hayan evaluado medidas de resultado de interés. Los investigadores pueden no haber presentado los resultados inesperados o los resultados pueden no haber satisfecho a los patrocinadores (Lesser 2007). Las compañías farmacéuticas proporcionaron vitamina D en uno de los 15 ensayos incluidos. Este número puede ser mayor debido a que esta información no estuvo disponible en siete ensayos. Es posible que los investigadores lo hayan omitido selectivamente al informar algunas de las medidas de resultado. Se reconoce que es difícil obtener datos sobre los resultados de los ensayos clínicos que se centran en la evaluación de la seguridad y la eficacia. El sesgo de informe de resultado y la supresión de algunos hallazgos significativos o no significativos podría dar lugar en el peor de los casos al uso de intervenciones perjudiciales. Los resultados de los metanálisis pueden subestimar los efectos verdaderos de las intervenciones cuando hay un acentuado sesgo de informe de resultado. Lo conveniente sería que los resultados de los ensayos clínicos aleatorios se presenten de forma más detallada (Nordic Trial Alliance 2015). En algunos de los ensayos, en lugar del informe completo se encontró un informe parcial o cualitativo. Los grandes esfuerzos de los investigadores y el coste elevado de los ensayos clínicos aleatorios deben justificarse con un mayor rigor de los informes. A pesar de las grandes inversiones en los ensayos examinados, varias preguntas permanecen sin respuesta.
Otros tipos de sesgo, como el sesgo académico, los sesgos de ensayos con deficiencias en el diseño (Schulz 1995; Moher 1998; Kjaergard 2001), y el sesgo de los ensayos pequeños (Siersma 2007), probablemente podrían influir en los resultados. El metanálisis de los ensayos con asignación aleatoria aumenta el poder estadístico y la precisión de la estimación del efecto de la intervención, pero este efecto puede estar influenciado por errores sistemáticos o errores aleatorios y puede dar lugar al informe de resultados significativos falsos (Gluud 2006; Wetterslev 2008). Es probable que los resultados de este metanálisis estén influenciados por errores aleatorios y errores sistemáticos.
Varios errores de diseño pueden influir en los resultados. Primero, el abuso de los resultados alternativos. En la mayoría de los ensayos, los autores usaron resultados alternativos no validados como los índices bioquímicos, la esteatosis hepática o la densidad mineral ósea, suponiendo que los niveles normales son beneficiosos. El resultado primario ideal en los ensayos clínicos aleatorios es aquel que sea relevante para la calidad de vida del paciente o la evolución de la enfermedad. Cuando se evalúan nuevos tratamientos es potencialmente peligroso depender de posibles medidas de resultado alternativas no validadas (Gluud 2007; Garattini 2016). En hepatología se carece de medidas de resultado alternativas validadas. Algunos ensayos incluidos en esta revisión examinaron la respuesta virológica precoz, rápida o sostenida como un resultado alternativo para el tratamiento exitoso. Una respuesta virológica precoz, rápida o sostenida definitivamente no significa una mejoría significativa en los resultados clínicos (Gluud 2007; Jakobsen 2017). No se debe justificar el uso de nuevas intervenciones en hepatología hasta que se confirme su beneficio para los resultados clínicos (Gluud 2006; Jakobsen 2017). Estos problemas podrían resolverse con el desarrollo y la aplicación de grupos de resultados acordados, conocidos como grupos de resultados centrales (www.comet‐initiative.org). El aumento en el número de ensayos aleatorios hepato‐biliares nunca se considerará una fuente valiosa suficiente para obtener datos si no se mejoran los aspectos del diseño del ensayo, como el tamaño de la muestra, la completitud del informe de los datos, la duración del seguimiento y el riesgo de sesgo.
Acuerdos y desacuerdos con otros estudios o revisiones
Los esfuerzos al evaluar los efectos beneficiosos y perjudiciales de la administración de suplementos de vitamina D en los pacientes con hepatopatías crónicas dieron lugar a resultados neutros. Es probable que la deficiencia de vitamina D no sea un mecanismo patogénico que contribuya al daño hepático. También existe la posibilidad de que la deficiencia de vitamina D sea la consecuencia pero no la causa de las hepatopatías crónicas. Los procesos inflamatorios involucrados en la patogenia de las hepatopatías crónicas, así como otras enfermedades crónicas, reducen los niveles de vitamina D sérica, lo cual puede explicar el estado bajo de vitamina D (Autier 2014). El estilo de vida también podría estar relacionado con el estado de vitamina D (Skaaby 2016). La administración de suplementos de vitamina D tuvo un efecto neutro sobre la mortalidad que puede ser un resultado que incluyeron los ensayos clínicos aleatorios centrados en un grupo de pacientes con hepatopatías bien compensadas en riesgo bajo de mortalidad.
Cuatro ensayos en la presente revisión incluyeron a pacientes con cirrosis hepática. No se halló evidencia de que la administración de suplementos de vitamina D pueda reducir la mortalidad en los pacientes con cirrosis hepática. Este hallazgo es contrario a las afirmaciones anteriores en la bibliografía de que la deficiencia de vitamina D se asocia con una mayor mortalidad en los pacientes con cirrosis avanzada (Putz‐Bankuti 2012; Wang 2013; Stokes 2014; Finkelmeier 2015; Paternostro 2017). Parece que el estado de vitamina D en los pacientes con cirrosis hepática no sólo está relacionado con la disfunción hepática (Lim 2012). Antes se creía que los pacientes con hepatopatías colestásicas tenían una mayor probabilidad de presentar deficiencia de vitamina D. Ahora es evidente que los pacientes con cirrosis hepática, hígado graso no alcohólico y hepatitis C crónica también están en riesgo de niveles bajos de vitamina D. Es probable que la deficiencia de vitamina D en estos pacientes sea de etiología multifactorial e incluya una ingesta y absorción reducidas, una actividad alterada de la 25‐hidroxilasa hepática, y una exposición insuficiente a la luz solar (Lim 2012). Los ensayos que incluyeron a pacientes con cirrosis hepática informaron los índices bioquímicos después de la administración de suplementos de vitamina D. No hubo diferencias significativas entre el grupo de suplementos y el de control en la mayoría de los valores registrados.
La revisión no confirmó las sugerencias de que la administración de suplementos de vitamina D puede ser beneficiosa como un coadyuvante a otros fármacos como el interferón o la ribavirina (Luong 2012). El metanálisis de seis ensayos que incluyeron a participantes con hepatitis C crónica no reveló ningún efecto de la vitamina D3 sobre la respuesta virológica sostenida, y reveló un efecto beneficioso sobre la respuesta virológica rápida y temprana. Un estudio no indicó efectos de la administración de suplementos de vitamina D en los pacientes con hepatitis C crónica avanzada (Corey 2012). Oliveira y colegas no observaron ninguna asociación entre la vitamina D y el grado de fibrosis hepática en los pacientes con hepatitis C crónica (Oliveira 2017). Los resultados son contrarios al resultado de un metanálisis que encontró una relación positiva entre el estado alto de vitamina D y la respuesta virológica sostenida en los pacientes con infección por virus de la hepatitis C (Villar 2013), y de acuerdo con los resultados de otro metanálisis de Kitson y colegas que encontraron que el estado inicial de vitamina D no se asoció con una respuesta virológica sostenida en los pacientes con hepatitis C crónica (Kitson 2014). Sin embargo, debido a la escasez de datos, se advierte que los resultados pueden ser influenciados profundamente por errores sistemáticos y aleatorios. No se encontró ningún ensayo aleatorio que estudiara la administración de suplementos de vitamina D en los pacientes con hepatitis B crónica. Farnik y colegas encontraron que los niveles bajos de vitamina D se asociaron con una mayor replicación del virus de la hepatitis B en los pacientes con hepatitis B crónica (Farnik 2013), mientras que Mahamid y colegas mostraron una correlación entre los niveles normales de vitamina D y la serodepuración espontánea del antígeno de superficie de la hepatitis B (Mahamid 2013). Hoan y colegas observaron una deficiencia de vitamina D en la mayoría de los pacientes infectados por el virus de la hepatitis B (Hoan 2016). Sin embargo, aún no se conoce si la deficiencia de vitamina D es la causa o es una consecuencia de la hepatitis crónica (Bitetto 2011).
El hígado graso no alcohólico se ha convertido en la forma más común de hepatopatía crónica en los países de ingresos altos (Sayiner 2016; Younossi 2016). Hay un interés creciente en explorar la relación entre la deficiencia de vitamina D y la gravedad del hígado graso no alcohólico. Cuatro ensayos incluidos en la revisión administraron vitamina D3 a los participantes con hígado graso no alcohólico. No fue posible extraer datos sobre los resultados clínicamente importantes de estos ensayos. No se encontró ningún efecto considerable de la vitamina D3 sobre los resultados alternativos como las pruebas de la función hepática. Dos metanálisis de los estudios de casos y controles y transversales hallaron que los pacientes con hígado graso tuvieron una mayor probabilidad de presentar deficiencia de vitamina D que los pacientes de los grupos de control, lo cual sugiere que la vitamina D puede desempeñar una función en el desarrollo de hígado graso no alcohólico (Eliades 2013; Wang 2015). Sin embargo, se encontró que la administración de suplementos de vitamina D puede no ser beneficiosa en esta población.
Se carece de evidencia suficiente sobre en el efecto de la administración de suplementos de vitamina D en la morbilidad relacionada con una hepatopatía y la calidad de vida relacionada con la salud.
Aunque dos ensayos aleatorios incluidos analizaron la influencia de la administración de suplementos de vitamina D en la densidad mineral ósea en los pacientes con cirrosis hepática, no fue posible extraer datos relevantes de los informes publicados, y los autores no respondieron a la solicitud de información adicional. Una revisión sistemática y metanálisis establecieron la conclusión de que la administración de suplementos de vitamina D para la prevención de la osteoporosis en adultos que viven en la comunidad sin factores de riesgo específicos de deficiencia de vitamina D pareció ser inapropiada (Reid 2014). De la misma manera, otra revisión sistemática de evidencia actualizada para el Preventive Service Task Force de los EE.UU. no encontró ningún beneficio de la administración de suplementos de vitamina D para la prevención del cáncer y las enfermedades cardiovasculares (Fortmann 2013). Bolland y colegas encontró que la vitamina D no redujo los resultados esqueléticos, vasculares ni del cáncer (Bolland 2014).
Parece que las afirmaciones sobre la salud nuevamente son anteriores a la evidencia. El gran entusiasmo en cuanto a la vitamina D como una curación para innumerables enfermedades, reforzado por los estudios observacionales que revelan que los pacientes sanos tienen un estado mayor de vitamina D, no ha sido apoyado por la evidencia obtenida a partir de los ensayos clínicos aleatorios. Es muy probable que el estado bajo de vitamina D no sea la causa sino la consecuencia de las enfermedades crónicas (Grey 2010; Guallar 2010; Harvey 2012; Kupferschmidt 2012; Autier 2014). Ahora existe alguna evidencia de que el estado de vitamina D es un biomarcador del estado de salud (Skaaby 2016). Es probable que los pacientes menos sanos sean obesos, menos activos y más privados de la luz solar que los pacientes más sanos, y por lo tanto tengan un estado de vitamina D inferior (Lucas 2005; Bolland 2006; Grey 2010; Autier 2016; Skaaby 2016). Parece que el cuento con moraleja de los suplementos antioxidantes se repite (Garattini 2016). La evidencia actual no apoya la administración de suplementos de vitamina D para prevenir ni curar las hepatopatías crónicas. Los resultados de los ensayos aleatorios en curso nos ayudarán aún más a resolver el enigma de la vitamina D. Hasta entonces, es prudente obtener vitamina D a partir de la exposición al sol y de una dieta equilibrada.
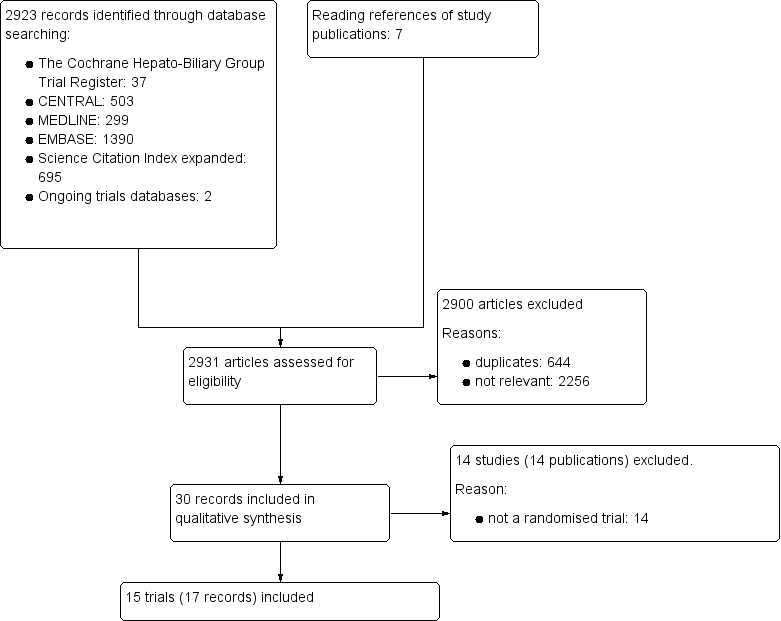
Study flow diagram
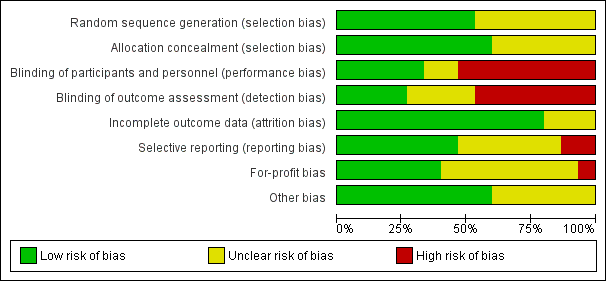
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Funnel plot of comparison: 1 Vitamin D versus placebo or no intervention, outcome: 1.1 All‐cause mortality.

Trial Sequential Analysis on all‐cause mortality up to 1.4‐year follow‐up in 15 vitamin D trials, based on mortality rate in the control group of 10%, a relative risk reduction of 28% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 6396 participants. The cumulative Z‐curve (blue line) did not cross the trial sequential monitoring boundary for benefit or harm (red inward sloping lines) and did not enter the trial sequential monitoring area for futility (inner‐wedge with red outward sloping lines).
Trial Sequential Analysis on rapid virological response in the two vitamin D trials was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 11958 participants. The cumulative Z‐curve crossed the conventional monitoring boundary for benefit. The trial sequential monitoring boundary is ignored due to little information use (1.56%).

Trial Sequential Analysis on early virological response in the two vitamin D trials was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 11958 participants. The cumulative Z‐curve crossed the conventional monitoring boundary for benefit. The trial sequential monitoring boundary is ignored due to little information use (1.17%).

Trial Sequential Analysis on sustained virological response in the five vitamin D trials was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 69798 participants. The trial sequential monitoring boundary is ignored due to little information use (0.45%).

Trial Sequential Analysis on acute cellular rejection in the one vitamin D trial was performed based on a mortality rate in the control group of 5%, a relative risk reduction (RRR) of 30% in the intervention group, a type I error of 2.5%, and type II error of 10% (90% power). There was no diversity. The required information size was 11958 participants. The cumulative Z‐curve did not cross the conventional monitoring boundary. The trial sequential monitoring boundary is ignored due to little information use (0.84%).

Comparison 1 Vitamin D versus placebo or no intervention, Outcome 1 All‐cause mortality.

Comparison 1 Vitamin D versus placebo or no intervention, Outcome 2 All‐cause mortality ('best‐worst' case and 'worst‐best' case scenarios).

Comparison 1 Vitamin D versus placebo or no intervention, Outcome 3 Liver‐related mortality.

Comparison 1 Vitamin D versus placebo or no intervention, Outcome 4 Serious adverse events.

Comparison 1 Vitamin D versus placebo or no intervention, Outcome 5 Non‐serious adverse events.

Comparison 1 Vitamin D versus placebo or no intervention, Outcome 6 Failure of rapid virological response.
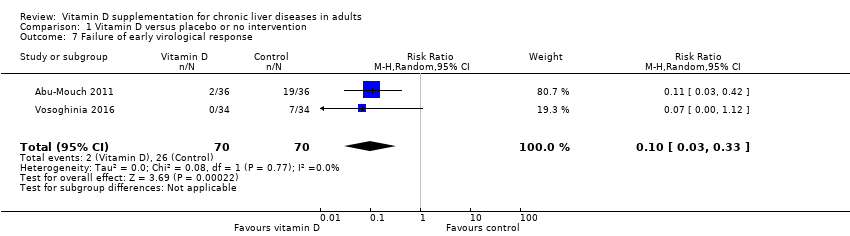
Comparison 1 Vitamin D versus placebo or no intervention, Outcome 7 Failure of early virological response.
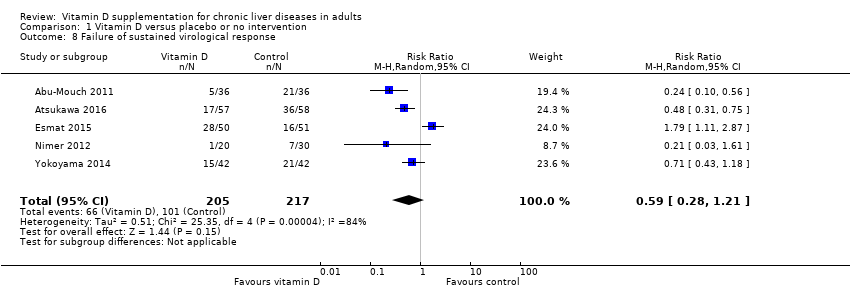
Comparison 1 Vitamin D versus placebo or no intervention, Outcome 8 Failure of sustained virological response.
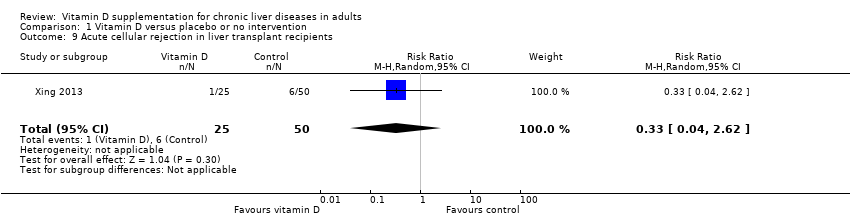
Comparison 1 Vitamin D versus placebo or no intervention, Outcome 9 Acute cellular rejection in liver transplant recipients.

Comparison 1 Vitamin D versus placebo or no intervention, Outcome 10 Vitamin D status (ng/mL).
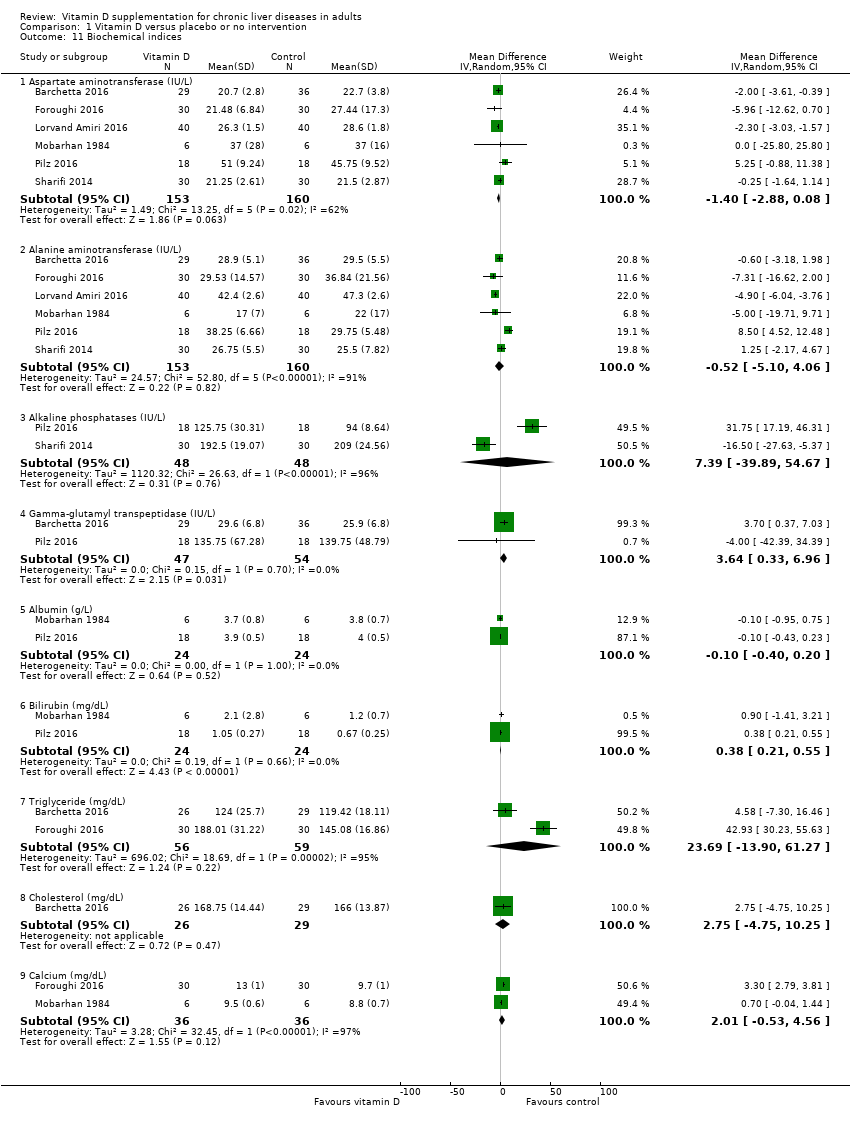
Comparison 1 Vitamin D versus placebo or no intervention, Outcome 11 Biochemical indices.
| Vitamin D compared to placebo or no intervention for chronic liver diseases in adults | ||||||
| Patient or population: adults with chronic liver diseases. | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with placebo or no intervention | Risk with vitamin D | |||||
| All‐cause mortality at the end of follow‐up Follow‐up: 0.1 to 1.4, mean 0.6 years | Study population | OR 0.70 | 1034 | ⊕⊝⊝⊝ | Trial Sequential Analyses‐adjusted CI was 0.00 to 2534. | |
| 4 per 1.000 | 3 per 1.000 | |||||
| Liver‐related mortality Follow‐up: mean 1 year | Study population | RR 1.62 | 18 | ⊕⊝⊝⊝ | Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision. | |
| 0 per 1.000 | 0 per 1.000 | |||||
| Serious adverse events ‐ hypercalcaemia Follow‐up: mean 1 year | Study population | RR 5.00 | 76 | ⊕⊝⊝⊝ | Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision. | |
| 0 per 1.000 | 0 per 1.000 | |||||
| Serious adverse events ‐ myocardial infarction Follow‐up: 0.2 to 1, mean 0.6 years | Study population | RR 0.75 | 86 | ⊕⊝⊝⊝ | Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision. | |
| 25 per 1.000 | 19 per 1.000 | |||||
| Serious adverse events ‐ thyroiditis Follow‐up: mean 0.2 years | Study population | RR 0.33 | 68 | ⊕⊝⊝⊝ | Due to few data, we did not conduct Trial Sequential Analysis which would only have revealed larger imprecision. | |
| 29 per 1.000 | 10 per 1.000 | |||||
| Failure of sustained virological response Follow‐up: 0.3 to 1.4, mean 0.9 years | Study population | RR 0.59 | 422 | ⊕⊝⊝⊝ Very low 1,2,3,6 | The trial sequential monitoring boundary is ignored due to little information use (0.6%). | |
| 465 per 1.000 | 275 per 1.000 | |||||
| Acute cellular rejection in liver transplant recipients Follow‐up: mean 0.08 years | Study population | RR 0.33 | 75 | ⊕⊝⊝⊝ Very low 1,3,7 | The trial sequential monitoring boundary is ignored due to little information use (0.84%). | |
| 120 per 1.000 | 40 per 1.000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence
| ||||||
| 1 Downgraded one level due to risk of bias: all trials were at high risk of bias. | ||||||
| Study ID | Protocol | Design | Groups | Bias | Blinding | Participants | Women | Mean |
| Yes | Parallel | 2 | High | NI | 72 | 44 | 47 | |
| No | Parallel | 2 | High | NI | 115 | 50 | 64 | |
| Yes | Parallel | 2 | High | PL | 65 | 35 | 59 | |
| No | Parallel | 2 | High | NI | 101 | 25 | 40 | |
| Yes | Parallel | 2 | High | PL | 60 | 52 | 48 | |
| Yes | Parallel | 3 | High | PL | 120 | 38 | 41 | |
| No | Parallel | 3 | High | NI | 18 | 0 | 61 | |
| No | Parallel | 2 | High | NI | 50 | 58 | 47 | |
| Yes | Parallel | 2 | High | PL | 36 | 25 | 61 | |
| No | Parallel | 2 | High | PL | 60 | 51 | 60 | |
| No | Parallel | 2 | High | NI | 76 | 66 | 61 | |
| No | Parallel | 2 | High | NI | 34 | 100 | 56 | |
| Yes | Parallel | 2 | High | NI | 68 | 13 | 42 | |
| No | Parallel | 3 | High | PL | 75 | 17 | 48 | |
| No | Parallel | 2 | High | NI | 84 | 49 | 59 | |
| n: number of participants; NI: no intervention; PL: placebo. | ||||||||
| Study ID | Participants | Outcome measures | Sponsor | Country |
| Chronic hepatitis C genotype 1 | Sustained virological response | No information | Israel | |
| Chronic hepatitis C genotype 1 | Sustained virological response | No information | Japan | |
| NAFLD | Liver steatosis, liver function | No | Italy | |
| Chronic hepatitis C genotype 4 | Sustained virological response | No information | Egypt | |
| NAFLD | Liver steatosis, liver function | No | Iran | |
| NAFLD | Liver function, body fat | No | Iran | |
| Liver cirrhosis | Bone mineral density | Yes | USA | |
| Chronic hepatitis C genotype 2 or 3 | Sustained virological response | No information | Israel | |
| Liver cirrhosis | Vitamin D status, liver function | No | Austria | |
| NAFLD | Liver function, insulin resistance index | No | Iran | |
| Liver cirrhosis | Bone mineral density | No information | Japan | |
| Primary biliary cirrhosis | Bone mineral density | No information | Japan | |
| Chronic hepatitis C genotype 1,2,3,4 | Early virological response | No | Iran | |
| Liver transplant recipients | Acute cellular rejection rate | No | China | |
| Chronic hepatitis C genotype 1 | Sustained virological response | No information | Japan | |
| NAFLD: non‐alcoholic fatty liver disease. | ||||
| Study ID | Vitamin | Calcium | Regimen* | Treatment | Follow‐up | Cointervention | |||
| D3 | D2 | 25(OH)D | 1,25(OH)2D | ||||||
| 2000 | ‐ | ‐ | ‐ | ‐ | Daily | 48 | 72 | PEG‐INF, RBV | |
| 2000 | ‐ | ‐ | ‐ | ‐ | Daily | 16 | 16 | PEG‐INF, RBV, SP | |
| 2000 | ‐ | ‐ | ‐ | ‐ | Daily | 24 | 24 | ‐ | |
| 2143 | ‐ | ‐ | ‐ | ‐ | Weekly | 48 | 72 | PEG‐INF, RBV | |
| 7143 | ‐ | ‐ | ‐ | ‐ | Weekly | 10 | 10 | ‐ | |
| 1000 | ‐ | ‐ | ‐ | 500 | Daily | 10 | 12 | ‐ | |
| ‐ | 17,857 | 2400 | ‐ | ‐ | Daily | 52 | 52 | ‐ | |
| 2000 | ‐ | ‐ | ‐ | ‐ | Daily | 24 | 48 | PEG‐INF, RBV | |
| 2800 | ‐ | ‐ | ‐ | ‐ | Daily | 8 | 8 | ‐ | |
| 3571 | ‐ | ‐ | ‐ | ‐ | Twice a week | 16 | 16 | ‐ | |
| ‐ | ‐ | ‐ | 1 | ‐ | Daily | 52 | 52 | ‐ | |
| ‐ | ‐ | ‐ | 1 | ‐ | Daily | 52 | 52 | ‐ | |
| 1600 | ‐ | ‐ | ‐ | ‐ | Daily | 12 | 12 | PEG‐INF, RBV | |
| ‐ | ‐ | ‐ | 0.25 | 1000 | Daily | 4 | 4 | ‐ | |
| 1000 | ‐ | ‐ | ‐ | ‐ | Daily | 16 | 24 | PEG‐INF, RBV | |
| * Vitamin D was administered orally in all trials. | |||||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All‐cause mortality Show forest plot | 15 | 1034 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.70 [0.09, 5.38] |
| 2 All‐cause mortality ('best‐worst' case and 'worst‐best' case scenarios) Show forest plot | 15 | Peto Odds Ratio (Peto, Fixed, 95% CI) | Subtotals only | |
| 2.1 'Best‐worst' case scenario | 15 | 1034 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.11 [0.05, 0.24] |
| 2.2 'Worst‐best' case scenario | 15 | 1034 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 7.80 [3.67, 16.57] |
| 3 Liver‐related mortality Show forest plot | 1 | 18 | Risk Ratio (M‐H, Random, 95% CI) | 1.62 [0.08, 34.66] |
| 4 Serious adverse events Show forest plot | 3 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 4.1 Hypercalcaemia | 1 | 76 | Risk Ratio (M‐H, Random, 95% CI) | 5.0 [0.25, 100.80] |
| 4.2 Myocardial infarction | 2 | 86 | Risk Ratio (M‐H, Random, 95% CI) | 0.75 [0.08, 6.81] |
| 4.3 Thyroiditis | 1 | 68 | Risk Ratio (M‐H, Random, 95% CI) | 0.33 [0.01, 7.91] |
| 5 Non‐serious adverse events Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 5.1 Glossitis | 1 | 65 | Risk Ratio (M‐H, Random, 95% CI) | 3.70 [0.16, 87.58] |
| 6 Failure of rapid virological response Show forest plot | 2 | 187 | Risk Ratio (M‐H, Random, 95% CI) | 0.70 [0.52, 0.94] |
| 7 Failure of early virological response Show forest plot | 2 | 140 | Risk Ratio (M‐H, Random, 95% CI) | 0.10 [0.03, 0.33] |
| 8 Failure of sustained virological response Show forest plot | 5 | 422 | Risk Ratio (M‐H, Random, 95% CI) | 0.59 [0.28, 1.21] |
| 9 Acute cellular rejection in liver transplant recipients Show forest plot | 1 | 75 | Risk Ratio (M‐H, Random, 95% CI) | 0.33 [0.04, 2.62] |
| 10 Vitamin D status (ng/mL) Show forest plot | 6 | 424 | Mean Difference (IV, Random, 95% CI) | 17.24 [12.46, 22.02] |
| 11 Biochemical indices Show forest plot | 6 | Mean Difference (IV, Random, 95% CI) | Subtotals only | |
| 11.1 Aspartate aminotransferase (IU/L) | 6 | 313 | Mean Difference (IV, Random, 95% CI) | ‐1.40 [‐2.88, 0.08] |
| 11.2 Alanine aminotransferase (IU/L) | 6 | 313 | Mean Difference (IV, Random, 95% CI) | ‐0.52 [‐5.10, 4.06] |
| 11.3 Alkaline phosphatases (IU/L) | 2 | 96 | Mean Difference (IV, Random, 95% CI) | 7.39 [‐39.89, 54.67] |
| 11.4 Gamma‐glutamyl transpeptidase (IU/L) | 2 | 101 | Mean Difference (IV, Random, 95% CI) | 3.64 [0.33, 6.96] |
| 11.5 Albumin (g/L) | 2 | 48 | Mean Difference (IV, Random, 95% CI) | ‐0.10 [‐0.40, 0.20] |
| 11.6 Bilirubin (mg/dL) | 2 | 48 | Mean Difference (IV, Random, 95% CI) | 0.38 [0.21, 0.55] |
| 11.7 Triglyceride (mg/dL) | 2 | 115 | Mean Difference (IV, Random, 95% CI) | 23.69 [‐13.90, 61.27] |
| 11.8 Cholesterol (mg/dL) | 1 | 55 | Mean Difference (IV, Random, 95% CI) | 2.75 [‐4.75, 10.25] |
| 11.9 Calcium (mg/dL) | 2 | 72 | Mean Difference (IV, Random, 95% CI) | 2.01 [‐0.53, 4.56] |

