Antibióticos para la tos productiva prolongada en niños
Resumen
Antecedentes
La tos es un síntoma frecuente que notan los médicos. La causa más frecuente de la tos húmeda crónica (con una duración mayor de cuatro semanas) es la bronquitis bacteriana prolongada (BBP) en algunos contextos, aunque otras causas más graves también se pueden presentar de esta manera. El tratamiento oportuno y efectivo de la tos crónica húmeda o productiva mejora resultados clínicos y de la calidad de vida. Las guías internacionales actuales indican que los ciclos de antibióticos son el primer tratamiento de elección en ausencia de signos o síntomas específicos para un diagnóstico alternativo. Esta revisión intentó aclarar la evidencia actual para apoyar esta recomendación.
Objetivos
Determinar la eficacia de los antibióticos para el tratamiento de los niños con tos húmeda prolongada (con la exclusión de los niños con bronquiectasia u otra enfermedad respiratoria subyacente conocida) y evaluar el riesgo de efectos perjudiciales debido a eventos adversos.
Métodos de búsqueda
Se realizó una búsqueda actualizada (desde 2008 en adelante) utilizando el registro especializado de ensayos del Grupo Cochrane de Vías Respiratorias (registro especializado de ensayos del Grupo Cochrane de Vías Respiratorias), Registro Cochrane de Ensayos Controlados (Cochrane Register of Controlled Trials) (CENTRAL), MEDLINE, Embase, registros de ensayos, artículos de revisión y listas de referencias de artículos relevantes. Las últimas búsquedas se realizaron en septiembre 2017.
Criterios de selección
Se incluyeron los ensayos controlados aleatorios (ECA) que compararon los antibióticos con placebo o un grupo control en niños con tos productiva crónica. Se excluyeron los ensayos grupales y los ensayos cruzados.
Obtención y análisis de los datos
Se utilizaron los métodos estándar recomendados por Cochrane. Se examinaron los resultados de las búsquedas contra los criterios de inclusión predeterminados. Dos autores de la revisión independientes seleccionaron, extrajeron y evaluaron los datos para su inclusión. Se estableció contacto con los autores de los estudios elegibles para obtener más información, según fue necesario. Los datos se analizaron por "intención de tratar".
Resultados principales
Se identificaron tres estudios como elegibles para su inclusión en la revisión. Dos estaban en la revisión anterior y se incluyó un estudio nuevo. Se consideró que los estudios más antiguos tuvieron riesgo de sesgo alto o incierto, y se consideró que el estudio recién incluido tuvo bajo riesgo de sesgo. Los estudios variaron en cuanto a la duración del tratamiento (de siete a 14 días) y el antibiótico utilizado (dos estudios usaron amoxicilina/ácido clavulánico y uno usó eritromicina).
En los metanálisis se incluyeron 190 niños (171 completaron el tratamiento), y las medias de la edad variaron de 21 meses a seis años. El análisis de los tres ensayos (190 niños) encontró que el tratamiento con antibióticos redujo la proporción de niños no curados al seguimiento (medida de resultado primaria) (odds ratio [OR] 0,15; intervalo de confianza [IC] del 95%: 0,07 a 0,31; análisis por intención de tratar), que se tradujo en un número necesario a tratar para un resultado beneficioso adicional (NNTB) de 3 (IC del 95%: 2 a 4). No se identificó heterogeneidad significativa (la estadística I² fue 0% para el modelo de efectos fijos y para el modelo de efectos aleatorios). Dos ensayos más antiguos evaluaron la progresión de la enfermedad, definida por la necesidad de antibióticos adicionales (125 niños), que fue significativamente menor en el grupo de antibióticos (OR 0,10; IC del 95%: 0,03 a 0,34; NNTB 4; IC del 95%: 3 a 5). Los tres ensayos (190 niños) informaron eventos adversos, que no aumentaron significativamente en el grupo de antibióticos comparado con el grupo control (OR 1,88; IC del 95%: 0,62 a 5,69). La calidad de la evidencia calificada mediante GRADE se evaluó como moderada para todas las medidas de resultado excepto para los eventos adversos, en los que se evaluó como de baja calidad.
Conclusiones de los autores
La evidencia indica que los antibióticos son eficaces para el tratamiento de los niños con tos húmeda crónica (duración mayor de cuatro semanas), con un NNTB de tres. Sin embargo, los antibióticos tienen efectos adversos y esta revisión solo informó incertidumbre en cuanto al riesgo de efectos adversos graves cuando se utilizaron en este contexto. La inclusión de un estudio más consistente fortaleció la revisión Cochrane anterior y sus resultados.
PICO
Resumen en términos sencillos
Antibióticos para la tos productiva prolongada en niños
Antecedentes
La tos es el síntoma más frecuente que notan los médicos. Las recomendaciones actuales indican tratar la tos húmeda prolongada con antibióticos. Se examinó si los antibióticos son útiles para el tratamiento de los niños con tos húmeda persistente en curso.
Características de los estudios
Se incluyeron los ensayos controlados aleatorios que compararon antibióticos con placebo (tratamiento simulado) o un grupo control. Los niños incluidos en los ensayos presentaban tos húmeda con una duración mayor de diez días.
La evidencia está actualizada hasta septiembre de 2017.
Se encontraron tres estudios que difirieron en algunos aspectos e incluyeron diferentes antibióticos (dos estudios utilizaron amoxicilina/ácido clavulánico y uno utilizó eritromicina), y la duración del tratamiento fue siete o 14 días.
Las medias de la edad de los niños variaron desde 21 meses a seis años.
Resultados clave
Esta revisión, que incluyó 190 niños con tos húmeda persistente, encontró que los antibióticos fueron beneficiosos para curar la tos. La tasa de curación fue un niño curado por cada tres niños tratados. Los antibióticos también impidieron el empeoramiento de la enfermedad y, por lo tanto, evitaron un ciclo adicional de antibióticos, en uno de cada cuatro niños tratados. No se encontró evidencia clara acerca de si los antibióticos se asociaron con más efectos secundarios. No se pudieron evaluar los resultados a largo plazo.
Fiabilidad de la evidencia
La fiabilidad de la evidencia fue moderada cuando se utilizaron antibióticos para curar la tos y para la progresión de la enfermedad, mientras que solo fue baja para los efectos secundarios de los fármacos.
Mensaje final
Los antibióticos son efectivos para tratar a los niños con tos húmeda crónica (durante más de cuatro semanas) y se podrían considerar cuando acuden al médico.
Conclusiones de los autores
Summary of findings
| Antibiotics compared to placebo for prolonged wet cough in children | ||||||
| Patient or population: prolonged wet cough in children | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with placebo | Risk with antibiotics | |||||
| Children not cured or substantially improved at follow‐up (using intention‐to‐treat analysis) (measured as proportion of participants) Follow‐up: range 7–14 days | 76 per 100 | 32 per 100 | OR 0.15 | 190 | ⊕⊕⊕⊝ | — |
| Children with progression of the disease resulting in additional medical therapy (complications) (measured as proportion of participants) Follow‐up: range 7–14 days | 36 per 100 | 5 per 100 | OR 0.10 | 125 | ⊕⊕⊕⊝ | — |
| Children experiencing adverse effects of antibiotics (e.g. diarrhoea, nausea, skin rash, allergic reactions (measured as proportion of participants)) | 5 per 100 | 10 per 100 | OR 1.88 | 190 | ⊕⊕⊝⊝ | — |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). CI: confidence interval; OR: odds ratio; RCT: randomised controlled trial. | ||||||
| GRADE Working Group grades of evidence | ||||||
| aOne study carrying 46% of the analysis weight was at high risk of bias due to lack of blinding. Downgraded one level for risk of bias (Darelid 1993). bOne study carrying 87% of the analysis weight was at high risk of bias due to lack of blinding. Downgraded one level for risk of bias (Darelid 1993). cOne study carrying 10% of the analysis weight was at high risk of bias due to lack of blinding and the result has been downgraded for imprecision due to wide CIs. Downgraded two levels for risk of bias and imprecision. | ||||||
Antecedentes
Descripción de la afección
A nivel internacional la tos es, de manera consistente, el síntoma más común que notan los médicos de la atención primaria(Britt 2016). En Australia, en 2015, los datos mostraron que el 9,4% de las visitas por episodios agudos a los médicos se debieron a enfermedades que se acompañan de tos(Britt 2016). La magnitud del problema se ilustra por las cifras gastadas a nivel global en fármacos sin prescripción para la tos. En los Estados Unidos se gastan varios miles de millones de dólares anualmente en fármacos para la tos y los resfriados(Irwin 2014). La carga de la tos aguda y crónica en los niños para las familias se refleja en la alta frecuencia de visitas médicas y en la administración de fármacos de venta sin receta (Anderson‐James 2015; Marchant 2008). Un estudio que examinó específicamente a niños con tos crónica encontró niveles más altos de estrés y preocupación paternos que se resolvieron cuando la tos cesó, lo que destaca la necesidad de un tratamiento apropiado y oportuno (Marchant 2008).
La tos crónica en la niñez se define como la tos que dura más de cuatro semanas, lo que se acepta internacionalmente en todas las guías para la tos en la niñez, excepto en dos guías propias del país(Chang 2016a). Además de la clasificación basada en la duración, la tos se puede clasificar como húmeda/productiva o seca. Debido a que en general los niños pequeños son incapaces de expectorar, se utiliza el término tos "húmeda" en lugar de "productiva", como se utiliza en los adultos (Chang 2003). Los médicos y los padres pueden diferenciar clínicamente la tos productiva de la seca(Chang 2005). La tos húmeda es representativa de la presencia de secreciones de las vías respiratorias inferiores (definidas en la broncoscopia), por lo que es un síntoma con una fuerte validez clínica(Chang 2005).En los niños con tos húmeda crónica, una revisión sistemática encontró que la mayor parte de los estudios describió que la mayoría de estos niños tenían una infección de las vías respiratorias inferiores por agentes patógenos respiratorios comunes (Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis) en el lavado broncoalveolar (LBA) o el esputo (Chang 2016b).
Un estudio que investigó a 108 niños que se presentaron con tos crónica encontró que la bronquitis bacteriana prolongada (BBP) fue el diagnóstico final en aproximadamente el 40% de los niños (Marchant 2006). Desde la primera descripción de la BBP (Marchant 2006), esta entidad diagnóstica se ha incorporado a las guías para la tos y está apoyada por estudios de investigación prospectivos y retrospectivos de muchas partes del mundo (Chang 2016b; Chang 2016c; Kompare 2012; Wang 2015; Wurzel 2014).
Clínicamente, la BBP se define en la actualidad como una tos húmeda crónica (con una duración mayor de cuatro semanas), sin signos ni síntomas específicos de una causa alternativa, que responde a dos semanas de tratamiento con antibióticos apropiados(Chang 2016b). Las definiciones iniciales a priori de BBP incluían un cultivo del líquido del LBA positivo, con un crecimiento de una especie bacteriana mayor de 104 unidades formadoras de colonias (UFC)/ml que mostrara crecimiento de los agentes patógenos respiratorios comunes (Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis)(Marchant 2006). Sin embargo, no era práctico hacer una broncoscopia flexible y un LBA en todos los niños que se presentaron con tos húmeda crónica, por lo que surgió la definición clínica de BBP que se utiliza actualmente(Chang 2012; Chang 2016b). A nivel internacional, numerosos estudios prospectivos y retrospectivos en niños con tos húmeda crónica han encontrado que la BBP es la causa más frecuente(Asilsoy 2008; Donnelly 2007; Kompare 2012; Usta 2014). La respuesta a los antibióticos orales es un resultado universal en estos estudios ya que es una parte clave de la definición clínica de BBP; no obstante, la duración, aunque es habitualmente de dos a cuatro semanas, y el tipo de antibiótico es diferente en todos los estudios y aún no se ha definido de manera apropiada en la bibliografía actual(Chang 2016b).
Debido a la definición de BBP y a las recomendaciones actuales de tratar con antibióticos a los niños con tos húmeda crónica sin otros indicadores específicos de tos (p.ej. dedos en palillo de tambor, deformidad de la pared torácica, etc.), una revisión que aclare la evidencia actual para la administración de antibióticos en niños con tos húmeda crónica informaría y guiaría la práctica clínica.
Descripción de la intervención
Los antibióticos son la base del tratamiento de las infecciones bacterianas para todas las edades. Hay diferentes formas de antibióticos que se pueden utilizar para las infecciones del sistema respiratorio; orales (suspensión, comprimidos, cápsulas), inhalados o intravenosos. Las razones por las que los antibióticos pueden ser útiles para los niños con tos húmeda se esbozan a continuación.
El antibiótico más ampliamente aceptado para el tratamiento de la tos húmeda es amoxicilina/ácido clavulánico oral (ya que los agentes patógenos característicos, como Haemophilus influenzae y Moraxella catarrhalis, pueden ser resistentes a la amoxicilina), aunque un macrólido, una cefalosporina oral o trimetoprima‐sulfametoxazol son alternativas en pacientes con antecedentes de hipersensibilidad a la penicilina(Chang 2016c).
De qué manera podría funcionar la intervención
Los estudios que han examinado la microbiología de las vías respiratorias inferiores en los niños con tos húmeda crónica han mostrado los agentes patógenos respiratorios comunes, y Haemophilus influenzae es el que se encuentra con mayor frecuencia en el 28% al 58% de los niños, seguido de Streptococcus pneumoniae (del 13% al 58%) y Moraxella catarrhalis (del 17% al 59%)(Chang 2006a; De Baets 2012; Douros 2011; Gedik 2015; Kompare 2012; Marchant 2006; Zgherea 2012). Marchant 2006 fue el primer estudio de BBP que describió los mismos microorganismos que se han confirmado en estudios posteriores de la microbiología de la BBP (Chang 2016c). Por lo tanto, debido a la bacteriología conocida de esta afección, es probable que los antimicrobianos activos contra estos agentes patógenos respiratorios comunes (Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis) sean efectivos para la erradicación bacteriana y la curación clínica, con resolución de la tos.
Por qué es importante realizar esta revisión
El tratamiento apropiado de los niños con tos húmeda crónica es importante por varias razones, como se describe a continuación.
Lograr la resolución inmediata de la tos crónica es importante para los padres. De modo independiente de la causa de la tos crónica, se ha descrito claramente el alto nivel de estrés y preocupación paternos, así como la carga económica en esta población (Marchant 2008). Cuando la tos se resuelve, la calidad de vida relacionada con la salud (genérica y específica para la tos) mejora (Chang 2013).
Como el conocimiento sobre la tos crónica en la niñez y la BBP ha progresado rápidamente en años recientes(Chang 2016c; Wurzel 2016), la importancia del tratamiento con antibióticos se ha incorporado a las guías internacionales para la tos(Chang 2006b; Gibson 2010; Shields 2008); por lo tanto, una revisión sistemática de su efectividad destacará lo adecuado de esta recomendación. Aunque en todas las guías actuales se indica que los niños reciban tratamiento con antibióticos, la duración varía; las guías australianas indican dos semanas como prueba de tratamiento inicial (Gibson 2010), mientras que las guías de la British Thoracic Society indican que todos los niños reciban de cuatro a seis semanas de tratamiento con antibióticos(Shields 2008). Por lo tanto, se necesita una revisión sistemática basada en la evidencia de ECA que separe el análisis en tratamiento a corto y a largo plazo, para informar las guías actuales, a la vez que destaque también las brechas en el conocimiento y, por lo tanto, guíe los estudios de investigación futuros.
Además, se ha postulado que la BBP, la enfermedad pulmonar supurativa crónica y la bronquiectasia están dentro del mismo espectro de enfermedades, con la BBP en el extremo leve del espectro y la bronquiectasia en el extremo grave de dicho espectro(Chang 2008; Goyal 2016a; Goyal 2016b). Si no se trata, la BBP puede dar lugar a la progresión de la enfermedad y a bronquiectasia radiológica. Lo anterior está apoyado por las bacterias patógenas compartidas, la inflamación neutrofílica de las vías respiratorias y el deterioro de la depuración de las vías respiratorias en las diferentes entidades diagnósticas (Chang 2008), y coincide con la hipótesis de Coles del círculo vicioso, mediante la cual se considera que la infección bacteriana persistente y los resultados de inflamación asociados dan lugar a daño de la mucosa y la pared de las vías respiratorias con el transcurso del tiempo, lo que a su vez altera la depuración de las vías respiratorias(Cole 1986). Además, en la actualidad se considera que la bronquiectasia temprana es reversible (Gaillard 2003), por lo que el tratamiento oportuno de los niños con tos húmeda crónica puede interrumpir este ciclo vicioso y preservar la salud pulmonar futura.
En la era actual de la administración de antimicrobianos, su uso apropiado es importante. Si los antibióticos no son eficaces para mejorar los resultados clínicos de los niños con tos húmeda crónica, no se deben utilizar. Si son eficaces, se debe promover su administración y equilibrar sus efectos beneficiosos con los eventos adversos descritos. Por lo tanto, esta revisión informará la práctica clínica.
Objetivos
Determinar la eficacia de los antibióticos para el tratamiento de los niños con tos húmeda prolongada (con la exclusión de los niños con bronquiectasia u otra enfermedad respiratoria subyacente conocida) y evaluar el riesgo de efectos perjudiciales debido a eventos adversos.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todos los ensayos controlados aleatorios que comparan los antibióticos con un fármaco placebo o con el grupo de control "sin tratamiento". Se excluyeron los ensayos cruzados y grupales.
Tipos de participantes
Todos los ensayos que incluyeron niños menores de 18 años con tos productiva prolongada (más de 10 días*). Se planificó a priori realizar análisis de subgrupos para los niños menores de siete años de edad y en los que la tos duró más de cuatro semanas. Criterios de exclusión: conocimiento previo de que existía evidencia radiológica de bronquiectasia o evidencia histopatológica pulmonar de bronquiectasia; conocimiento previo de que existía un diagnóstico de fibrosis quística; tos relacionada con Mycoplasma pneumoniae (que causa neumonía), Bordetella pertussis (que causa tos ferina) y Chlamydia; presencia de una afección cardiorrespiratoria subyacente (hemoptisis, neumonía recurrente, disnea crónica); sibilancia actual o recurrente (más de dos episodios); presencia de signos respiratorios de dedos en palillo de tambor o sibilancia a la auscultación (la sibilancia podría ser un signo de asma); presencia de cualquier signo de enfermedad sistémica (deterioro del desarrollo, aspiración, anomalía neurológica o del desarrollo y deficiencias inmunológicas).
*En condiciones ideales, esta revisión incluiría solo estudios que reclutaran niños con tos que persiste durante cuatro semanas o más (definición actual de tos crónica en los niños), pero como las definiciones han cambiado con el transcurso del tiempo y esta revisión se remonta a 2005, se ha mantenido este valor de corte más inclusivo. Ver Completitud general y aplicabilidad de la evidencia para discusión adicional.
Tipos de intervenciones
Todas las comparaciones controladas aleatorias de antibióticos versus placebo o grupo control en el tratamiento de la tos productiva prolongada. Los antibióticos podían ser administrados por cualquier vía. No se incluyeron los ensayos que compararon dos o más antibióticos sin un brazo placebo.
Se planificó evaluar tres regímenes de tratamiento separados:
-
tratamiento de corta duración (14 días o menos);
-
antibióticos a largo plazo (más de 14 días);
-
tratamiento con antibióticos intravenosos en el que se administraron antibióticos por al menos cinco días.
Los ensayos que abarcaban el uso de otras medicaciones o intervenciones se incluyeron si todos los participantes tenían un acceso equitativo a tales medicaciones o intervenciones, o si los tratamientos adicionales no se consideraron efectivos.
Tipos de medida de resultado
Se intentó obtener datos de al menos una de las siguientes medidas de resultado:
Resultados primarios
-
Niños no curados o que no mejoraron de manera significativa al seguimiento (medida como proporción de participantes). Se determinó la proporción de niños que no lograron mejorar durante el tratamiento y la mejoría clínica media con la siguiente jerarquía de medidas de evaluación (es decir, si dos o más medidas de evaluación se informan en un mismo estudio, la medida de resultado que se enumera en primer lugar es la utilizada).
-
-
Mediciones objetivas de los índices de la tos (frecuencia de la tos, sensibilidad del receptor de la tos, amplitud de la tos).
-
Sintomáticas (escala de Likert, escala analógica visual, nivel de interferencia de la tos, registro de tos, producción de esputo ‐ cantidad y color, bienestar general), evaluado por el niño.
-
Sintomáticas (escala de Likert, escala analógica visual, nivel de interferencia de la tos, registro de tos, producción de esputo ‐ cantidad y color, bienestar general), evaluado por los padres o cuidadores.
-
Sintomáticas (escala de Likert, escala analógica visual, nivel de interferencia de la tos, registro de tos, producción de esputo ‐ cantidad y color, bienestar general), evaluado por los médicos.
-
Indicadores de las vías respiratorias (esputo o lavado broncoalveolar) compatibles con infección o inflamación.
-
Volumen de esputo solo.
-
Pruebas de función pulmonar solas.
-
Resultados secundarios
-
Cambio en el estado clínico (diferencia de medias).
-
Diferencia en el esputo, el lavado broncoalveolar o los índices sanguíneos de inflamación o infección (mejoría media en los marcadores de la infección).
-
Mejoría en los índices de tos (diario de tos, frecuencia de la tos, puntuaciones de tos, calidad de vida) (medida como diferencia de medias).
-
Niños con progresión de la enfermedad que dio lugar a tratamiento médico adicional (complicaciones) (proporción de participantes).
-
Niños que presentaron efectos adversos de los antibióticos (p.ej. diarrea, náuseas, erupción cutánea, reacciones alérgicas [proporción de participantes]).
Para los estudios en los que no estaban disponibles los datos sobre las medidas de resultado especificadas anteriormente, pero fueron elegibles para inclusión, se planificó describir las medidas de resultado en la tabla "Características de los estudios incluidos". Sin embargo, estos estudios no se habrían incluido en los metanálisis.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
The last search for this review according to the method specified in the protocol was undertaken in 2010. For this update, we conducted a search of the following databases:
-
the Cochrane Airways Group Register of Trials (searched 22 September 2017);
-
Cochrane Central Register of Controlled Trials (CENTRAL), through the Cochrane Register of Studies Online (searched 22 September 2017);
-
MEDLINE OvidSP (1950 to September 2017);
-
Embase OvidSP (1974 to 22 September 2017).
The database search strategies are provided in Appendix 1. We also conducted a search of ClinicalTrials.gov (www.clinicaltrials.gov) and the World Health Organization (WHO) trials portal (www.who.int/ictrp/). We searched all databases from their inception to September 2017 and we imposed no restriction on language of publication. Elizabeth Stovold from the Cochrane Airways Group undertook the search.
Búsqueda de otros recursos
We checked reference lists of all primary studies and review articles for additional references. We searched relevant manufacturers' websites for trial information.
We searched for errata or retractions from included studies published in full‐text on PubMed (www.ncbi.nlm.nih.gov/pubmed) on 22 September 2017.
Obtención y análisis de los datos
We included in the subsequent meta‐analyses the results from studies that met the inclusion criteria and reported any of the outcomes of interest. We calculated odds ratios (OR) and 95% confidence interval (CI) (fixed‐effects model) using the inverse of the variance of each study result for weighting (RevMan 2014). We calculated number needed to treat (NNT) from the pooled OR and its 95% CI applied to a specified baseline risk using an online calculator (Cates 2008). This calculator converts the risk in the placebo group to the corresponding odds, applies the OR to estimate the odds in the treated group, and converts that odds to the corresponding risk and calculates the risk difference, the inverse of which is the NNT. We assumed the cough indices to be normally distributed continuous variables and so we estimated the mean difference (MD) in outcomes. If studies reported outcomes using different measurement scales, we estimated the standardised mean difference (SMD). We described any heterogeneity between the study results and tested to see if it reached statistical significance using a Chi² test. We included the 95% CI estimated using a random‐effects model whenever we had concerns about statistical heterogeneity.
We planned to test publication bias be tested by use of a funnel plot.
Selección de los estudios
The original selection of studies was reported in the previous review (Marchant 2005). Retrieval of studies for this update: from the title, abstract or descriptors, two review authors (JM, HP) independently reviewed literature searches and identified potentially relevant trials for full review. We also conducted searches of bibliographies and texts to identify additional studies. Using specific criteria, the same two review authors independently selected trials for inclusion in the review. We planned to resolve disagreement by third party adjudication (AC).
Two review authors (JM, HP) independently reviewed trials that satisfied the inclusion criteria. We recorded the following information: study setting; year of study; source of funding; participant recruitment details (including number of eligible children); inclusion and exclusion criteria; randomisation and allocation concealment method; numbers of participants randomised; blinding (masking) of participants, care providers and outcome assessors; dose and type of antibiotic therapy; duration of therapy; cointerventions; numbers of patients not followed up; reasons for withdrawals from study protocol (clinical, adverse effects, refusal and other); details on adverse effects of therapy; and whether intention‐to‐treat analyses were possible. We recorded the selection process in sufficient detail to complete the PRISMA flow diagram (Figure 1).
Extracción y manejo de los datos
We extracted study characteristics from included studies.
-
Methods: study design, total duration of study, number of study centres and location, study setting, withdrawals, date of study.
-
Participants: number, mean age, age range, gender, length of cough, inclusion criteria and exclusion criteria.
-
Interventions: antibiotic used, placebo, duration, concomitant medications and excluded medications.
-
Outcomes: primary and secondary outcomes specified and collected, and time points.
-
Notes: funding for trial, and notable conflicts of interest of trial authors.
Two review authors (JM, HP) independently extracted outcome data from included studies from searches. We noted in the Characteristics of included studies table if outcome data were not reported in a usable way. We planned to resolve disagreements by consensus or by involving a third review author (AC). One review author (JM) transferred data into Review Manager 5 (RevMan 2014). We double‐checked that data were entered correctly by comparing the data presented in the systematic review with the study reports. A second review author (HP) checked the studies' characteristics for accuracy against the trial report.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (JM, HP) independently assessed risk of bias for each study using the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). We planned to resolve any disagreements by discussion or by involving another review author (AC). We assessed the risk of bias according to the following domains.
-
Random sequence generation.
-
Allocation concealment.
-
Blinding of participants and personnel.
-
Blinding of outcome assessment.
-
Incomplete outcome data.
-
Selective outcome reporting.
-
Other bias.
We graded each potential source of bias as high, low or unclear and provided a quote from the study report together with a justification for our judgement in the 'Risk of bias' table. We then summarised the risk of bias judgements across different studies for each of the domains listed. We planned to assess blinding separately for different key outcomes where necessary (e.g. for unblinded outcome assessment, risk of bias for all‐cause mortality may be very different than for a participant‐reported pain scale). Where information on risk of bias related to unpublished data or correspondence with a trial author, we noted this in the 'Risk of bias' table. One review author (PM) independently undertook the risk of bias assessment for Marchant 2012 as several review authors also authored this trial. In addition, the Cochrane Airways editorial staff independently agreed the judgements of risk of bias for Marchant 2012.
When considering treatment effects, we took into account the risk of bias for the studies that contributed to that outcome.
Medidas del efecto del tratamiento
We analysed dichotomous data as ORs. We undertook meta‐analyses only where it was meaningful (i.e. if the treatments, participants and the underlying clinical question were similar enough for pooling to make sense).
We narratively described skewed data which was reported as medians and interquartile (IQR) ranges.
Where a trial reported multiple arms, we included only the relevant arms. Where we combined two comparisons (e.g. drug A versus placebo and drug B versus placebo) in the same meta‐analysis, we halved the control group to avoid double counting.
For continuous outcomes, we planned to record the mean relative change from baseline for each group or mean post‐treatment or postintervention values and standard deviation (SD). If standard errors or CIs had been reported, we planned to calculate the SDs and then a pooled estimate of treatment effect by the MD and 95% CI (fixed‐effect model) using Review Manager 5 (RevMan 2014)
Cuestiones relativas a la unidad de análisis
We calculated OR for the dichotomous outcome variables of each individual study, using a modified intention‐to‐treat analysis. This analysis assumed that children not available for outcome assessment had not improved (and probably represented a conservative estimate of effect). An initial qualitative comparison of all the individually analysed studies examined whether pooling of results (meta‐analysis) was reasonable. This took into account differences in study populations, inclusion/exclusion criteria, interventions, outcome assessment and estimated effect size.
Manejo de los datos faltantes
We contacted investigators or study sponsors in order to verify key study characteristics and obtain missing numerical outcome data where possible (e.g. when a study was identified as abstract only). Where this was not possible, and we thought the missing data might introduce serious bias, we explored the impact of including such studies in the overall assessment of results with a sensitivity analysis.
Evaluación de la heterogeneidad
We described any heterogeneity between study results and tested to see if it reached statistical significance using a Chi² test. We planned to report the 95% CI estimated using a random‐effects model whenever we had concerns about statistical heterogeneity. Heterogeneity was considered significant when the P value was less than 0.10 (Higgins 2011). We then used the I² statistic to measure heterogeneity among the trials in each analysis,
where heterogeneity was categorised such that a value of under 25% was considered low, 25% to 75% was considered moderate and over 75% was considered a high degree of heterogeneity (Higgins 2011).
Evaluación de los sesgos de notificación
We were not able to pool more than 10 trials, so did not create and examine a funnel plot to explore possible small‐study and publication biases.
Síntesis de los datos
We included in the subsequent meta‐analyses the results from studies that met the inclusion criteria and reported any of the outcomes of interest. We calculated the summary weighted OR and 95% CI (fixed‐effect model) using Review Manager 5 (RevMan 2014). We calculated numbers needed to treat for an additional beneficial outcome (NNTB) from the pooled OR and its 95% CI applied to a specified baseline risk using an online calculator (Cates 2008).
'Summary of findings' table
We created a 'Summary of findings' table using the following outcomes:
-
children not cured or not substantially improved at follow‐up (using intention‐to‐treat analysis);
-
children with progression of the disease resulting in additional antibiotic therapy (complications) (proportion participants);
-
children experiencing adverse effects of antibiotics (e.g. diarrhoea, nausea, skin rash, allergic reactions (proportion participants)).
We used the five GRADE considerations (study limitations, consistency of effect, imprecision, indirectness and publication bias) to assess the quality of a body of evidence as it related to the studies which contributed data to the meta‐analyses for the prespecified outcomes. We then used methods and recommendations described in Section 8.5 and Chapter 12 of the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011), using GRADEpro GDT software (GRADEpro GDT). We justified all decisions to downgrade or upgrade the quality of studies using footnotes and we made comments to aid the reader's understanding of the review where necessary.
Análisis de subgrupos e investigación de la heterogeneidad
We planned the following a priori subgroup analyses.
-
Age (children seven years or younger versus children eight years or older).
-
Control type (placebo versus no placebo/usual treatment).
-
Variation in the inclusion criteria (e.g. short duration therapy 14 days or less versus long duration therapy longer than 14 days).
-
Antibiotic types (oral antibiotics versus intravenous antibiotics; studies using same antibiotic and duration).
Análisis de sensibilidad
We planned the following sensitivity analyses to assess the impact of the potentially important factors on the primary outcome.
-
Intention to treat but only including participants not lost to follow‐up (available‐data analysis).
-
Model used: fixed effect versus random effects, risk ratio (RR) versus OR.
Results
Description of studies
See: Characteristics of included studies; Characteristics of excluded studies tables.
Results of the search
The updated Airways Group register/search, combined with original searches, identified 4291 potentially relevant titles (see Figure 1). We identified an additional 46 titles through searches of ClinicalTrials.gov and the WHO trials portal. We obtained 17 papers for consideration for inclusion in the review after the initial assessment of the abstracts. We excluded 14 papers as the study involved children with acute cough rather than chronic cough, or were non‐randomised studies or reviews. In this updated review, we included one new study (Marchant 2012).
Included studies
We included three studies in total (see Characteristics of included studies table). The three studies included 190 randomised children with 171 children completing the trial (Darelid 1993; Gottfarb 1994; Marchant 2012).
Study design
The three studies included were single‐centred studies and none received support from commercial interests. Two studies were conducted in a paediatric outpatient clinic in Sweden and both recruited children with over 10 days of cough (Darelid 1993; Gottfarb 1994). Marchant 2012 recruited children with chronic wet cough (greater than three weeks' duration) from a paediatric respiratory outpatient clinic in Australia. Although the inclusion criteria for duration of cough was short, the cough duration of the participants were longer in all the RCTs (described below under 'Participants'). A subgroup of children from one RCT had flexible bronchoscopy (FB) performed pretreatment and their BAL data were consistent with PBB (Marchant 2012).
One study was an open randomised study comparing erythromycin and a no treatment control group (Darelid 1993). Two studies compared amoxicillin/clavulanic acid and placebo in a double‐blind RCT (Gottfarb 1994; Marchant 2012). Two studies used a dosage regimen equal to current recommended treatment dosage (Darelid 1993; Marchant 2012). The dosage in Gottfarb 1994 was lower (dosage 20 mg/kg/day) than currently recommended doses (22.5 mg/kg/day to 45 mg/kg/day) (Kemp 1997). Although the studies used two different antibiotics, both would treat the respiratory pathogens found in the nasopharyngeal aspirates of these children and organisms in BAL in other studies on chronic cough in children (Chang 2006a; Gedik 2015; Zgherea 2012). The children in one study all received oxymetazoline nose drops and salbutamol mixture was allowed and recorded in both groups (Darelid 1993). Neither of these treatments should have influenced the outcome since they were available to both groups. The other two trials did not allow cointerventions (Gottfarb 1994; Marchant 2012). One trial measured compliance by the return of the medication bottles (Marchant 2012). Darelid 1993 reported 97% of participants completed the erythromycin medication; however, they failed to state how this was assessed.
Participants
All three studies reported different length of cough in their participants. Around 50% of children had cough of greater than three weeks' duration in Darelid 1993, the mean length of cough was three to four weeks in Gottfarb 1994, and median length of cough was 11 to 15 weeks in Marchant 2012. The median age of participants in Darelid 1993 was not provided but 63% of the participants were aged one to three years. Median age of children in Gottfarb 1994 was 2.6 years. Likewise, the children in Marchant 2012 were preschool age with a median of 1.75 to 2.8 years. Although two studies did not specifically mention the quality of cough, contact with the authors confirmed that at least 75% of children had wet cough (Darelid 1993; Gottfarb 1994). Also, as both studies included nasopharyngeal aspirates which grew a range of bacterial pathogens, it is highly likely that these children had wet cough.
Interventions
The antibiotics and their duration varied in the studies. Two studies compared amoxicillin/clavulanic acid and placebo (Gottfarb 1994; Marchant 2012); however, the children in Gottfarb 1994 took the antibiotics for seven days, whereas the children in Marchant 2012 took the antibiotics for 14 days. The intervention arm in Darelid 1993 took erythromycin for seven days and the control group did not take any treatment.
Outcomes
Two studies used paediatrician assessment of clinical recovery as primary outcome measure but the day of assessment was different. Outcomes were assessed at day eight (Darelid 1993) and day 12 to 14 (Gottfarb 1994), so the results described only short‐term effects. The primary outcome measure in both Swedish studies was paediatrician assessment of clinical outcome at follow‐up. Participants were classified as cured or treatment failure. Both studies also reported parental assessment and used individual symptom scores as secondary outcome measures.
The Australian study used 'cough resolution' as their primary outcome (Marchant 2012). They defined this as an improvement of more than 75% from baseline cough score, or three days of being cough free for the study duration. Their secondary outcome measures were absolute change in cough score or change in verbal category descriptive (VCD). Thirty‐seven of the 50 children underwent a bronchoscopy prior to commencing the intervention. The BAL microbiology in this subgroup identified typical respiratory pathogens including Haemophilus influenzae (14 children), Streptococcus pneumonia (nine children) and Moraxella catarrhalis (seven children). All these organisms were sensitive to amoxicillin/clavulanate acid.
Studies also documented adverse effects and progression of disease requiring further antibiotic therapy. Darelid 1993 also recorded and documented the elimination of nasopharyngeal pathogens in the intervention and control groups. Gottfarb 1994 excluded 15 children from the final analysis without indicating to which treatment group they were initially allocated. As contact with the authors was unsuccessful, we assumed that there were equal numbers of children in each group in the intention‐to‐treat analysis. Of the 15 children excluded, 12 had laboratory‐confirmed B pertussis after randomisation which is a potential weakness of the study. Ideally the diagnosis of B pertussis would have been made prior to randomisation and then these children would not have been eligible to enter the study.
Excluded studies
We recorded the reasons for excluding the 14 studies in the Characteristics of excluded studies table. The reasons for exclusion were: children did not have a chronic cough (eight studies) or were not a randomised controlled trial comparing antibiotics with placebo or no‐treatment control group (three studies) or were review articles (three studies).
Ongoing studies
We found no ongoing studies.
Risk of bias in included studies
Full details of risk of bias judgements can be found under the 'Risk of bias' section at the end of each study's details in the Characteristics of included studies table and are also summarised in Figure 2.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Two studies described generation of the randomisation sequence (Darelid 1993; Marchant 2012) and one study was unclear (Gottfarb 1994). We determined the method of allocation concealment to be adequate in one study (Marchant 2012), and unclear in two (Darelid 1993; Gottfarb 1994).
Blinding
Risk of detection bias was high in one study due to inadequate blinding of personnel, participants and outcome assessors (Darelid 1993). We judged the remaining two studies at low risk of bias due to adequate blinding (Gottfarb 1994; Marchant 2012).
Incomplete outcome data
We assessed two studies at low risk of attrition bias (Darelid 1993; Marchant 2012). The other study was at unclear risk with 15 dropouts (Gottfarb 1994).
Selective reporting
We considered reporting bias to be low in two studies with all outcome measures being reported (Darelid 1993; Marchant 2012). We judged one study as unclear as there was not enough information provided in the published article (Gottfarb 1994).
Other potential sources of bias
We did not identify any other potential sources of bias in the included studies.
Effects of interventions
All included studies used only short‐term treatment (14 days or less), that is, there were no studies of long‐term treatment (more than 14 days) or intravenous antibiotics. Thus, all the effects of intervention refer to this group. See summary of findings Table for the main comparison for the main comparisons
Primary outcome
Children not cured or not substantially improved at follow‐up (measured as proportion of participants) (using intention‐to‐treat analysis)
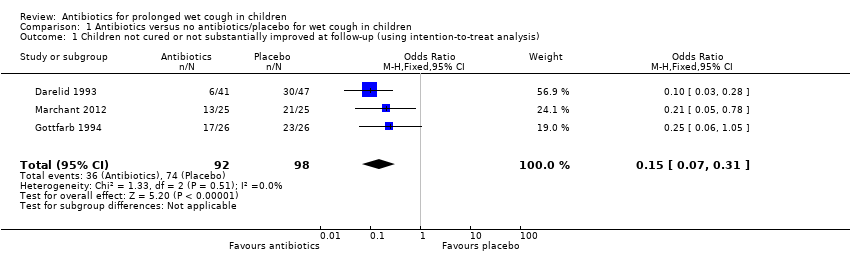
We combined data from all included studies for children not cured or not substantially improved at follow‐up. The number of children not cured at follow‐up was 110 using an intention‐to‐treat analysis. The control event rate was 64% (Darelid 1993), 88% (Gottfarb 1994), and 84% (Marchant 2012) in the three studies. Treatment with antibiotics significantly reduced the proportion of children not cured at follow‐up; the pooled OR effect estimate was 0.15 (95% CI 0.07 to 0.31; P < 0.00001; participants = 190, studies = 3; Analysis 1.1; Figure 3). These studies suggested that one child will be cured for every three children treated (NNTB 3, 95% CI 2 to 4) (Figure 4). Using GRADE, we assessed the strength of evidence to be moderate for this effect.

Forest plot of comparison: 1 Antibiotics versus no antibiotics/placebo for wet cough in children, outcome: 1.1 Children not cured or not substantially improved at follow‐up (using intention‐to‐treat analysis).

In the control group, 75/100 people had not been cured over two weeks, compared to 31/100 (95% CI 17 to 48) for the active treatment group. Number needed to treat for an additional beneficial outcome 3 (95% CI 2 to 4).
Children not cured or not substantially improved at follow‐up (measured as proportion of participants) (excluding those know to have B pertussis)
Two studies reported B pertussis data which could be combined for this outcome, hence we made the decision post‐hoc to do an analysis excluding these children (Darelid 1993; Gottfarb 1994). The number of children not cured (excluding those with known B pertussis) was 17 in the antibiotics group versus 47 in the placebo group, which was statistically significant (OR 0.13, 95% CI 0.05 to 0.30; P < 0.00001; participants = 128; studies = 2; Analysis 1.4).
The data from Marchant 2012 could not be included in the meta‐analysis as microbiological assessment for pertussis was not undertaken. However, they reported that 27/50 children had clinically important BAL microbiology (organism density of 104 or more CFU/mL BAL) with typical respiratory flora including Haemophilus influenzae (38%), Streptococcus pneumoniae (24%) and Moraxella catarrhalis (19%). They reported that all these organisms were sensitive to amoxicillin/clavulanate acid.
Secondary outcomes
Change in clinical state (mean difference)
All studies reported overall improvement in the antibiotic group but data could not be combined for this outcome.
Difference in sputum, bronchoalveolar lavage or blood indices of inflammation or infection (mean improvement in markers of infection)
Darelid 1993 examined clearance of potential pathogens from the nasopharynx using bacteriology. It found a significant higher elimination of Moraxella catarrhalis from the nasopharynx in treated (68%) versus untreated participants (20%; P < 0.001). There were similar results for Streptococcus pneumoniae (treated elimination 100%; untreated 23%; P < 0.0001). They also found a correlation with growth of Moraxella catarrhalis and persistent cough after the trial. In the untreated group, 80% of participants with untreated Moraxella catarrhalis continued to cough versus 33% of participants with no growth of this organism (P < 0.01). None of the studies provided data on the change in the analysis of sputum, BAL or blood indices of infection before and after treatment.
Improvement in cough indices (cough diary, cough frequency, cough scores, quality of life) (measured as mean difference)
All studies reported an improvement in a type of score that involved cough. These measures could not be combined due to the differing nature of the indices. Darelid 1993 used a score which combined cough frequency, morning temperature and level of daily activity, but provided no numerical value. Gottfarb 1994 looked at the number of coughing attacks in a 24‐hour period but a single numerical value could not be obtained as data were expressed as proportion of children in each category. They reported a greater reduction in the coughing attacks in the antibiotic group compared to the placebo group. Marchant 2012 used a validated cough diary and reported a significant difference between the treatment group and the placebo group and found that the median improvement in cough score was significantly higher in the antibiotic group (1.5, IQR 0 to 2.5) compared to the control group (0.5, IQR –0.4 to 1.0; P = 0.02).
Children with progression of the disease resulting in additional medical therapy (complications) (proportion of participants)
Overall 125 children contributed data on this outcome (excluding the 15 dropouts in Gottfarb 1994). Marchant 2012 did not record further antibiotic use and therefore could not be included in this analysis. The overall control event rate for complications was 36% versus a treatment event rate of 5%. Progression of illness, as defined by requirement for further antibiotics in both studies (Darelid 1993; Gottfarb 1994), was significantly lower in the treatment group (OR 0.10, 95% CI 0.03 to 0.34; P = 0.0002; Analysis 1.2; Figure 5). The NNTB to avoid progression of disease was 4 (95% CI 3 to 5). Using GRADE, we assessed the quality the of evidence to be moderate for this effect.

Forest plot of comparison: 1 Antibiotics versus no antibiotics/placebo for wet cough in children, outcome: 1.4 Illness progression: participants with progression of disease resulting in additional medical therapy required.
Children experiencing adverse effects of antibiotics (e.g. diarrhoea, nausea, skin rash, allergic reactions) (proportion of participants)
In Darelid 1993, children in the erythromycin group had a reported adverse effect rate of 2% (Darelid 1993). These were diarrhoea and vomiting. It can be argued that these results should not been pooled as Darelid 1993 did not report any adverse effects for the control group. The rate of adverse effects in the study comparing amoxicillin/clavulanic acid and placebo was 12% for both treatment and control groups (Gottfarb 1994). Marchant 2012 also used amoxicillin/clavulanic acid at a significantly higher dosage than Gottfarb 1994, and as such the reported adverse effect rate in their study was higher at 20% in the treatment group and 8% in the control group. Pooling the results, assuming that no one in the control (no treatment) group in Darelid 1993 had any adverse events gave an OR of 1.88 (95% CI 0.62 to 5.69; P = 0.26; participants = 190; studies = 3; Analysis 1.3). Given the wide CIs, this finding remains uncertain and one can neither be certain of harm, or otherwise, from adverse effects of intervention.
Subgroup analyses
Children under seven years of age
Two studies recruited children aged under seven years (Darelid 1993; Gottfarb 1994), and the mean age for the remaining study was under three years (SD 0.9) in both control and placebo group (Marchant 2012); hence, subgroup analysis was unnecessary.
Control type (placebo versus no placebo/usual treatment)
Two studies used a placebo (Gottfarb 1994; Marchant 2012). When compared to the one study that used a no‐treatment control group (Darelid 1993), both subgroups continued to favour antibiotics over control and in terms of children not cured or substantially improved. The test indicated no significant difference between subgroups (Chi² = 1.30, df = 1 (P = 0.25), I² = 23.1%; Analysis 1.5). However, the test was an underpowered due to low number of studies included.
Variation in the inclusion criteria (cough duration longer than four weeks)
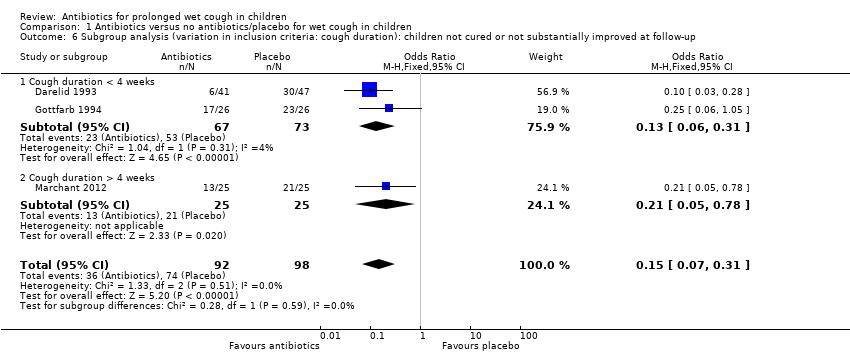
Although the two earlier studies had about 50% of children with prolonged wet cough for over four weeks, we could not extract disaggregated data for numbers of children not cured or substantially improved (Darelid 1993; Gottfarb 1994). Marchant 2012 was the sole study where children had been coughing for longer than four weeks (although inclusion criterion was over three weeks). Thus, for this subgroup analysis, we compared data from Marchant 2012, with data from the remaining two studies. Again, both subgroups favoured antibiotics over control and the test for subgroup difference was negative (Chi² = 0.28, df = 1 (P = 0.59), I² = 0%; Analysis 1.6). However, the test was underpowered due to low number of studies included.
Antibiotic types (differences in the medications used in the intervention group)
Two studies used amoxicillin/clavulanic acid (Gottfarb 1994; Marchant 2012). We compared these studies to the single study using erythromycin (Darelid 1993). Both subgroups favoured antibiotics over control in terms of the number of children not cured or substantially improved and the test for subgroup difference was negative (Chi² = 1.30, df = 1 (P = 0.25), I² = 23.1%). However, the test was underpowered due to low number of studies included.
Sensitivity analyses
Sensitivity analysis by intention to treat but only including participants not lost to follow‐up (available data analysis) for primary outcome
Combining the data from the three included studies using data that were available (as opposed to intention to treat), the proportion of children randomised to the antibiotics arm were significantly less likely to be 'not cured' compared to controls (OR 0.14, 95% CI 0.07 to 0.29; P < 0.00001; participants = 171; studies = 3; Analysis 1.8). The effect size was slightly reduced compared to the intention‐to‐treat analysis. The NNTB for benefit at the end of study was 3 (95% CI 2 to 4). Using GRADE, we assessed the strength of evidence to be moderate for this outcome.
Sensitivity analysis for primary outcome model used: fixed effect versus random effects, risk ratio versus odds ratio
There was no difference when a random‐effects model was used versus a fixed‐effect model (OR for primary outcome 0.15 (fixed) versus 0.15 (random)). Both the Chi² and I² statistical tools show low level of heterogeneity between the studies, with I² = 0% and Chi² = 1.33 for the primary outcome measure.
In the primary outcome (clinical failure), the overall estimate of effect and degree of statistical heterogeneity were sensitive to the model used for meta‐analysis although they were still significant (pooled RR 0.51, 95% CI 0.39 to 0.66 (fixed‐effect model, I² = 81%); pooled RR 0.51, 95% CI 0.28 to 0.95 (random‐effects model, I² = 81%). Both results significantly favoured use of antibiotics to prevent progression of disease.
Discusión
Resumen de los resultados principales
Esta revisión actualizada encontró tres estudios elegibles para su inclusión. En el metanálisis se incluyeron en total 190 niños con una media de edad de 21 meses a seis años (171 completaron el tratamiento). Los dos estudios anteriores se incluyeron en la revisión previa (Darelid 1993; Gottfarb 1994),y se encontró un estudio recientemente incluido (Marchant 2012). Los estudios variaron en cuanto a la duración del tratamiento (de siete a 14 días) y el antibiótico utilizado (dos estudios utilizaron amoxicilina/ácido clavulánico y uno utilizó eritromicina).
El metanálisis de los tres estudios que incluyeron 190 niños encontró que los antibióticos fueron efectivos para tratar a los niños con tos húmeda crónica (resultado primario). Tres niños (IC del 95%: 2 a 4) necesitan ser tratados para lograr una curación clínica. El metanálisis de los niños con "curación clínica" indicó que, en el grupo de tratamiento, la tasa de eventos fue del 61% en comparación con el grupo control, que tuvo una tasa de eventos del 24% (OR 0,15; IC del 95%: 0,07 a 0,31). En los análisis de subgrupos y sensibilidad del resultado primario, los datos favorecieron de manera consistente y significativa al brazo de antibióticos (en comparación con los controles).
También se encontró que los niños que recibieron antibióticos tuvieron significativamente menos probabilidades de presentar progresión de la enfermedad, definida por la necesidad de antibióticos adicionales, en comparación con los niños que no recibieron antibióticos (OR 0,10; IC del 95%: 0,03 a 0,34; 125 niños incluidos en el análisis). El NNTB fue 4 (IC del 95%: 3 a 5).
No es posible tener certeza acerca de los efectos perjudiciales ni, por otra parte, de los efectos adversos de la intervención, y este hallazgo se mantuvo con baja certidumbre, con un alto grado de imprecisión. No fue posible combinar los datos para otros resultados secundarios.
En resumen, esta revisión sistemática ha fortalecido la revisión anterior (Marchant 2005) al agregar un ECA consistente (Marchant 2012). Se hicieron algunas suposiciones acerca de los datos para los dos estudios más antiguos (calidad de la tos y abandonos iguales en los grupos intervención y control), y la falta de datos sobre la calidad de la tos en estos estudios permite la posibilidad de una heterogeneidad clínica de los participantes mayor que la que sería previsible. A pesar de las limitaciones esbozadas anteriormente, este metanálisis proporcionó evidencia clara de que los antibióticos son efectivos para el tratamiento de la tos húmeda crónica en los niños.
Compleción y aplicabilidad general de las pruebas
En los niños, la tos crónica se define como una duración mayor de cuatro semanas (Chang 2016a). En condiciones ideales, esta revisión se limitaría a los niños con una tos que dura más de cuatro semanas, o al menos incluiría un subanálisis de estos estudios. Cuando se realizó la revisión original (Marchant 2005), la única guía publicada para la tos crónica la definió como la tos con una duración mayor de tres a ocho semanas (Irwin 1998), y desde entonces se ha revisado la definición de tos crónica. Los estudios anteriores utilizaron más de diez días de tos como definición de tos prolongada (Darelid 1993; Gottfarb 1994). Seguramente ésta se clasificaría como tos subaguda en la bibliografía pediátrica disponible(Chang 2001). En un porcentaje de los niños con tos de diez días, la tos cesará espontáneamente antes de tres semanas(Hay 2002). Ninguno de los dos artículos, Darelid 1993 y Gottfarb 1994, pudo separar los pacientes con tos durante diez a 21 días de los que presentaron tos durante más de 21 días, aunque ambos estudios tuvieron un porcentaje grande de niños con tos durante más de tres semanas (duración media de la tos en Gottfarb 1994 tres a cuatro semanas [no se proporcionó la DE], y el 50% de los niños de Darelid 1993 presentaron tos durante más de 21 días). Se tomó la decisión de incluir estos estudios que incorporaron a algunos niños con una tos de menor duración porque, aunque es posible que ocurra la resolución espontánea en algunos pacientes, debería ocurrir por igual en los grupos de tratamiento y placebo. Por lo tanto, fue poco probable que esta decisión alterara el resultado de la revisión, pero puede haber limitado su fortaleza. Marchant 2012 utilizó un protocolo de reclutamiento que incluyó más de tres semanas de tos, que cuando se inició el estudio era la definición de tos húmeda(Irwin 1990; Irwin 1998). Sin embargo, la mediana de la duración de la tos en este estudio fue 15 semanas (IQR 9 a 59) en el grupo de tratamiento y 11 semanas (IQR 4 a 28) en el grupo control, por lo que es probable que la gran mayoría de este grupo presentara tos durante más de cuatro semanas, lo que coincide con las guías actuales. Además, es plausible que estos niños representen entonces el espectro más grave de la enfermedad, lo que, nuevamente, es poco probable que altere de manera favorable el resultado de la revisión, pero puede limitar su fortaleza.
Los dos estudios más antiguos utilizaron la "curación clínica" evaluada por el médico como medida de resultado, pero no se definió(Darelid 1993; Gottfarb 1994). Marchant 2012 utilizó un diario de tos previamente validado (puntuación VCD para la tos diurna; Chang 1998). Esta medida objetiva aumenta la solidez y la validez clínica de este ECA y, por lo tanto, del metanálisis actualizado.
Aunque ninguno de los estudios más antiguos evaluó específicamente las diferencias en el esputo, el LBA ni los índices sanguíneos de inflamación e infección (Darelid 1993; Gottfarb 1994), Darelid 1993 examinó los microorganismos que crecieron en el aspirado nasofaríngeo y su eliminación después del tratamiento. Mostró una eliminación significativa de Moraxella catarrhalis de la nasofaringe de los pacientes tratados. Marchant 2012 realizó broncoscopia y LBA en un subgrupo de los participantes, 19 en el grupo de tratamiento y 18 en el grupo control, y encontró inflamación neutrofílica en las vías respiratorias (mediana del porcentaje de neutrófilos 34,5% a 38,5%), así como crecimiento de microorganismos significativos en la mayoría de los niños. La microbiología identificó los microorganismos respiratorios característicos Streptococcus pneumoniae (24%), Haemophilus influenzae (38%) y Moraxella catarrhalis (19%), lo que fue consistente con numerosos estudios que han examinado la microbiología de la tos húmeda en los niños (De Baets 2012; Gedik 2015; Kompare 2012; Zgherea 2012). Estos datos del LBA indicarían que la mayoría de los niños dentro de esta cohorte tenían un diagnóstico compatible con BBP; o sea, tos húmeda crónica sin signos específicos de una causa alternativa que responde a dos semanas de tratamiento con antibióticos(Chang 2016c).
Los tres estudios eligieron diferentes antibióticos y dosis, eritromicina (dosis de 50 mg/kg/día; Darelid 1993), amoxicilina/ácido clavulánico (dosis de 20 mg/kg/día; Gottfarb 1994) y amoxicilina/ácido clavulánico (dosis de 45 mg/kg/día; Marchant 2012). Darelid 1993 probó la eritromicina, un antibiótico macrólido, que ha cubierto tradicionalmente los agentes patógenos comunes encontrados en el tracto respiratorio inferior como Streptococcus pneumoniae y Haemophilus influenzae (así como los agentes patógenos atípicos como la especie Mycoplasma) (Alvarez‐Elcoro 1999). El aumento de la aparición de resistencia a los macrólidos por los agentes patógenos comunes puede limitar la utilidad en el futuro, como indica un estudio que encontró que el 13,7% de Streptococcus pneumoniae en niños en edad escolar era resistente a la eritromicina (Gazi 2004). Por el contrario, Gottfarb 1994 y Marchant 2012 utilizó amoxicilina/ácido clavulánico, un antibiótico de amplio espectro que cubre microorganismos que se pueden encontrar en el lavado broncoalveolar en niños con tos productiva crónica, principalmente Streptococcus pneumoniae, Haemophilus influenzae , Haemophilus influenzae y Moraxella catarrhalis (Marchant 2006). En Gazi 2004, sólo el 1,2% de Haemophilus influenzae fue resistente a la amoxicilina/ácido clavulánico, y no se encontró resistencia para Moraxella catarrhalis o Streptococcus pneumoniae. Gottfarb 1994 eligió un plan de dosis muy baja (20 mg/kg/día) en comparación con la práctica estándar (45 mg/kg/día), lo que puede limitar la eficacia del fármaco, así como la tasa de curación clínica en el ensayo.
Los ensayos Darelid 1993 y Gottfarb 1994 utilizaron solamente siete días de tratamiento con antibióticos, mientras que Marchant 2012 utilizó 14 días de tratamiento con antibióticos o placebo, por lo que la duración del tratamiento fue corta. Por lo tanto, no fue posible comparar el tratamiento con antibióticos de duración corta y más larga. Además, ninguno de los estudios incluyó el seguimiento a largo plazo de los niños, por lo que se desconocen las tasas de recurrencia. Las guías actuales de la mejor práctica indican el tratamiento de 14 días en los niños con tos húmeda (Chang 2006b; Gibson 2010), la presente revisión apoyó esta recomendación. Por el contrario, las guías de la British Thoracic Society indican cuatro a seis semanas de tratamiento con antibióticos para la tos húmeda crónica en la niñez, para prevenir la recurrencia (Shields 2008). No hubo datos para comparar las tasas de resolución y recurrencia en dos versus cuatro semanas de tratamiento con antibióticos para la tos húmeda crónica. Por lo tanto, la presente revisión no pudo dar respuesta a estas recomendaciones contrapuestas de las guías. Se necesitan ECA bien diseñados que incluyan una duración más larga de los antibióticos y seguimiento a largo plazo para abordar estas preguntas clínicas importantes.
Los resultados de la presente revisión se limitan a los niños que por otra parte parecen estar bien y que no tienen otros signos de una enfermedad pulmonar subyacente. La tos húmeda crónica puede ser causada por muchas enfermedades como la bronquiectasia, los cuerpos extraños inhalados y la bronquiolitis obliterante. Por lo tanto, es necesario evaluar a los niños con tos húmeda crónica para determinar la presencia de otras causas de tos crónica, y esta revisión no se puede extrapolar a estas otras causas.
Calidad de la evidencia
La tabla "Resumen de los hallazgos" sintetiza la evidencia para los resultados. En general, la calidad de la evidencia se valoró como moderada cuando se utilizaron antibióticos para curar la tos y también para la progresión de enfermedad, mientras que la evidencia fue baja para la reacción a los fármacos. Debido a que Darelid 1993 no fue cegado, se redujo la certeza en la exactitud del estudio informado, y en particular no informaron los efectos adversos en el grupo control. Por lo tanto, la calidad de la evidencia para la reacción a los fármacos (efectos adversos) se debe considerar baja debido a la imprecisión, y la certeza es baja para este resultado. No hubo inquietudes con respecto al sesgo de falta de direccionalidad, inconsistencia o publicación en esta revisión, por lo que no se consideró necesario disminuir la calidad en otros ítems.
Sesgos potenciales en el proceso de revisión
Dos autores de la revisión (JM, HP) examinaron de forma independiente las búsquedas bibliográficas, seleccionaron los estudios, extrajeron los datos de resultado y evaluaron el riesgo de sesgo para cada estudio. Un autor de la revisión (AC) comprobó de forma independiente la extracción de los datos, la evaluación del riesgo de sesgo y las decisiones de disminuir la calidad para la tabla "Resumen de los hallazgos". Algunos autores de la revisión (JM, HP, AC) eran autores del nuevo estudio incluido; por lo tanto, para disminuir el riesgo de sesgo, este estudio lo evaluó, de forma independiente, otro autor de la revisión (PM) que no era uno de los autores de dicho estudio. Los miembros del grupo editorial del grupo Cochrane de Vías Aéreas comprobaron, de forma independiente, los hallazgos del "Riesgo de sesgo" y GRADE para disminuir el riesgo de sesgo en el proceso de revisión. El editor de las revisiones del Grupo Cochrane de Vías Aéreas (Christopher Cates) comprobó, de forma independiente, los datos y los análisis.
Acuerdos y desacuerdos con otros estudios o revisiones
Esta revisión sistemática actualizó una revisión Cochrane anterior y se ha fortalecido con la adición de un ECA pequeño, pero bien diseñado y consistente (Marchant 2012). Los hallazgos de ambas revisiones Cochrane coinciden, pero la calidad de la evidencia aumentó significativamente en la revisión actualizada. Los resultados de la presente revisión fueron consistentes con una revisión sistemática preparada bajo el auspicio del panel de guías del American College of Chest Physicians' (ACCP) para la tos (Chang 2016b). Asimismo, las recomendaciones de la presente revisión son consistentes con la guía del ACCP (Chang 2017).
Aunque estos tres ECA pequeños fueron los únicos disponibles hasta la fecha, numerosos estudios prospectivos y retrospectivos coinciden con los resultados de la utilidad de los antibióticos en la tos húmeda(Asilsoy 2008; Marchant 2006; Usta 2014). Un estudio multicéntrico de 187 niños recientemente derivados con tos encontró un odds ratio de 73,3 (IC del 95%: 10 a 544,2) para la efectividad de los antibióticos en el tratamiento de la causa de las enfermedades que se acompañan de tos. Además, encontraron que 138 niños dentro de la cohorte presentaron BBP y la tos húmeda se resolvió con dos semanas de tratamiento con antibióticos (Chang 2015). Los estudios retrospectivos han encontrado resolución de la tos en el 77% (Pritchard 2015) al 95% (Donnelly 2007) de los niños con tos húmeda y BBP.
Los resultados de la presente revisión fueron específicos para la tos crónica y fueron diferentes de otras revisiones Cochrane sobre los antibióticos en la tos aguda y el resfriado común (que no son lo mismo que la tos crónica). Los antibióticos solo tienen un efecto beneficioso mínimo (si es que tienen alguno) en el tratamiento de la bronquitis aguda (Fahey 2004), y no son eficaces para el tratamiento del resfriado común (Arroll 2005).

Study flow diagram.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Forest plot of comparison: 1 Antibiotics versus no antibiotics/placebo for wet cough in children, outcome: 1.1 Children not cured or not substantially improved at follow‐up (using intention‐to‐treat analysis).

In the control group, 75/100 people had not been cured over two weeks, compared to 31/100 (95% CI 17 to 48) for the active treatment group. Number needed to treat for an additional beneficial outcome 3 (95% CI 2 to 4).

Forest plot of comparison: 1 Antibiotics versus no antibiotics/placebo for wet cough in children, outcome: 1.4 Illness progression: participants with progression of disease resulting in additional medical therapy required.
Comparison 1 Antibiotics versus no antibiotics/placebo for wet cough in children, Outcome 1 Children not cured or not substantially improved at follow‐up (using intention‐to‐treat analysis).

Comparison 1 Antibiotics versus no antibiotics/placebo for wet cough in children, Outcome 2 Illness progression: participants with progression of disease resulting in additional antibiotic therapy required (available data only).

Comparison 1 Antibiotics versus no antibiotics/placebo for wet cough in children, Outcome 3 Children experiencing adverse effects of antibiotics (vomiting, diarrhoea, rash).

Comparison 1 Antibiotics versus no antibiotics/placebo for wet cough in children, Outcome 4 Children not cured or not substantially improved at follow‐up (excluding those known to have B pertussis).

Comparison 1 Antibiotics versus no antibiotics/placebo for wet cough in children, Outcome 5 Subgroup analysis (placebo controlled): children not cured or substantially improved at follow‐up.
Comparison 1 Antibiotics versus no antibiotics/placebo for wet cough in children, Outcome 6 Subgroup analysis (variation in inclusion criteria: cough duration): children not cured or not substantially improved at follow‐up.

Comparison 1 Antibiotics versus no antibiotics/placebo for wet cough in children, Outcome 7 Subgroup analysis (antibiotics used): children not cured or not substantially improved at follow‐up.

Comparison 1 Antibiotics versus no antibiotics/placebo for wet cough in children, Outcome 8 Sensitivity analysis: children not cured or not substantially improved at follow‐up (using available data only).
| Antibiotics compared to placebo for prolonged wet cough in children | ||||||
| Patient or population: prolonged wet cough in children | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with placebo | Risk with antibiotics | |||||
| Children not cured or substantially improved at follow‐up (using intention‐to‐treat analysis) (measured as proportion of participants) Follow‐up: range 7–14 days | 76 per 100 | 32 per 100 | OR 0.15 | 190 | ⊕⊕⊕⊝ | — |
| Children with progression of the disease resulting in additional medical therapy (complications) (measured as proportion of participants) Follow‐up: range 7–14 days | 36 per 100 | 5 per 100 | OR 0.10 | 125 | ⊕⊕⊕⊝ | — |
| Children experiencing adverse effects of antibiotics (e.g. diarrhoea, nausea, skin rash, allergic reactions (measured as proportion of participants)) | 5 per 100 | 10 per 100 | OR 1.88 | 190 | ⊕⊕⊝⊝ | — |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). CI: confidence interval; OR: odds ratio; RCT: randomised controlled trial. | ||||||
| GRADE Working Group grades of evidence | ||||||
| aOne study carrying 46% of the analysis weight was at high risk of bias due to lack of blinding. Downgraded one level for risk of bias (Darelid 1993). bOne study carrying 87% of the analysis weight was at high risk of bias due to lack of blinding. Downgraded one level for risk of bias (Darelid 1993). cOne study carrying 10% of the analysis weight was at high risk of bias due to lack of blinding and the result has been downgraded for imprecision due to wide CIs. Downgraded two levels for risk of bias and imprecision. | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Children not cured or not substantially improved at follow‐up (using intention‐to‐treat analysis) Show forest plot | 3 | 190 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.15 [0.07, 0.31] |
| 2 Illness progression: participants with progression of disease resulting in additional antibiotic therapy required (available data only) Show forest plot | 2 | 125 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.10 [0.03, 0.34] |
| 3 Children experiencing adverse effects of antibiotics (vomiting, diarrhoea, rash) Show forest plot | 3 | 190 | Odds Ratio (M‐H, Fixed, 95% CI) | 1.88 [0.62, 5.69] |
| 4 Children not cured or not substantially improved at follow‐up (excluding those known to have B pertussis) Show forest plot | 2 | 128 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.13 [0.05, 0.30] |
| 5 Subgroup analysis (placebo controlled): children not cured or substantially improved at follow‐up Show forest plot | 3 | 190 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.15 [0.07, 0.31] |
| 5.1 Placebo controlled | 2 | 102 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.22 [0.08, 0.60] |
| 5.2 No placebo used | 1 | 88 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.10 [0.03, 0.28] |
| 6 Subgroup analysis (variation in inclusion criteria: cough duration): children not cured or not substantially improved at follow‐up Show forest plot | 3 | 190 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.15 [0.07, 0.31] |
| 6.1 Cough duration < 4 weeks | 2 | 140 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.13 [0.06, 0.31] |
| 6.2 Cough duration > 4 weeks | 1 | 50 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.21 [0.05, 0.78] |
| 7 Subgroup analysis (antibiotics used): children not cured or not substantially improved at follow‐up Show forest plot | 3 | 190 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.15 [0.07, 0.31] |
| 7.1 Amoxicilin/clavulanic acid use | 2 | 102 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.22 [0.08, 0.60] |
| 7.2 Other antibiotics used | 1 | 88 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.10 [0.03, 0.28] |
| 8 Sensitivity analysis: children not cured or not substantially improved at follow‐up (using available data only) Show forest plot | 3 | 171 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.14 [0.07, 0.29] |

