Administración de suplementos de aceite marino y otros precursores de prostaglandinas durante el embarazo sin complicaciones por preeclampsia o retardo del crecimiento intrauterino
Resumen
Antecedentes
Los estudios de población han revelado que un mayor consumo de alimentos marinos durante el embarazo se asocia con embarazos más prolongados, mayor peso al nacer y una baja incidencia de preeclampsia. Se ha sugerido que los ácidos grasos de los alimentos marinos pueden ser los responsables de estas asociaciones.
Objetivos
Estimar los efectos de la administración de suplementos de aceite marino y otros precursores de prostaglandinas durante el embarazo, en relación con el riesgo de preeclampsia, parto prematuro, bajo peso al nacer y tamaño pequeño para la edad gestacional (PEG).
Métodos de búsqueda
Se realizaron búsquedas en el Registro Especializado de Ensayos Controlados del Grupo Cochrane de Embarazo y Parto (Cochrane Pregnancy and Childbirth Group) (The Cochrane Library 2005, número 2) y en MEDLINE (1966 hasta abril 2005).
Criterios de selección
Todos los ensayos aleatorios que comparaban la administración por vía oral, durante el embarazo, de suplementos de aceite marino u otros precursores de prostaglandinas, con placebo o ningún tratamiento. Se excluyeron los ensayos cuyo objetivo era tratar a mujeres con preeclampsia comprobada o presunto retardo del crecimiento intrauterino.
Obtención y análisis de los datos
Dos autores de la revisión evaluaron de forma independiente los ensayos para su inclusión, la extracción de datos y calidad de los ensayos.
Resultados principales
En esta revisión, se incluyen seis ensayos con 2 783 mujeres. Tres de estos ensayos se calificaron como de alta calidad, incluido el ensayo más amplio de 1 477 mujeres. Las mujeres a las que se asignó el suplemento de aceite marino presentaron un embarazo medio 2,6 días más prolongado que el de las mujeres asignadas al placebo o ningún tratamiento (diferencia de medias ponderada [DMP] 2,55 días, intervalo de confianza [IC] del 95%: 1,03 a 4,07 días; 3 ensayos, 1 621 mujeres). Esto no se reflejó en una diferencia neta entre ambos grupos en el riesgo relativo (RR) de nacimiento antes de las 37 semanas completas, aunque las mujeres asignadas al aceite marino presentaron un menor riesgo de dar a luz antes de las 34 semanas completas de gestación (RR 0,69; IC del 95%: 0,49 a 0,99; 2 ensayos, 860 mujeres). El peso al nacer fue ligeramente mayor en los neonatos de las mujeres del grupo de aceite marino, en comparación con el grupo de control (DMP 47 g, IC del 95%: 1 g a 93 g; 3 ensayos, 2 440 mujeres). Sin embargo, no hubo diferencias globales entre los grupos en la proporción de neonatos con bajo peso al nacer o tamaño pequeño para la edad gestacional (PEG). No se observó una diferencia clara en el riesgo relativo de preeclampsia entre ambos grupos.
Conclusiones de los autores
No hay suficientes pruebas para apoyar el uso sistemático durante el embarazo de suplementos de aceite marino, u otros precursores de prostaglandinas, para reducir el riesgo de preeclampsia, parto prematuro, bajo peso al nacer o tamaño pequeño para la edad gestacional.
PICO
Resumen en términos sencillos
No existen pruebas suficientes para afirmar si la suplementación con aceite de pescado durante el embarazo ayuda a reducir el riesgo de preeclampsia y de neonatos pequeños para la edad gestacional
La preeclampsia en la madre y en el recién nacido muy prematuro o muy pequeño son complicaciones relativamente frecuentes del embarazo que suelen afectar seriamente la salud materno infantil. Los ácidos grasos omega‐3 que se encuentran en los aceites de pescado/marinos podrían prevenir estas complicaciones. Esta revisión identificó seis ensayos que incluyeron a 2 755 mujeres. Se halló que los suplementos de aceite de pescado/marino ingeridos durante el embarazo prolongan la duración de la gestación de dos a tres días, aumentan ligeramente el peso al nacer y reducen levemente el número de niños nacidos antes de las 34 semanas de gestación. Sin embargo, estos pequeños efectos no redujeron el riesgo global de que el niño sea demasiado prematuro o pequeño, ni de que la madre desarrolle un cuadro de preeclampsia. Probablemente se necesite que un gran número de mujeres participe en los ensayos para abordar plenamente este tema, y responder a la pregunta de si la administración de suplementos es inocua. Se necesita investigación adicional.
Conclusiones de los autores
Antecedentes
La preeclampsia, el parto prematuro y el retardo del crecimiento intrauterino (RCIU) son complicaciones relativamente frecuentes del embarazo, y se hallan asociadas con una mayor morbilidad tanto materna como infantil.
La preeclampsia se caracteriza por la hipertensión arterial y la proteinuria, pero también puede afectar los riñones, el hígado y los sistemas de coagulación de la sangre. Ciertas complicaciones poco frecuentes, aunque graves y potencialmente mortales, incluyen la eclampsia, que se caracteriza por una o más convulsiones, y el síndrome de HELLP, que es la combinación de hemólisis, niveles elevados de enzimas hepáticas y disminución de las plaquetas. El desenlace clínico de la preeclampsia tanto en la mujer como en el niño suele ser favorable, pero en algunas mujeres puede ocasionar una morbilidad considerable (Pritchard 1984) y en ocasiones la muerte (DH 1998), especialmente si se desarrolla un cuadro de eclampsia.
El parto prematuro y el RCIU se asocian con una mayor morbilidad infantil y en ocasiones pueden provocar la muerte. Si bien la mayoría de los niños nacidos con un peso inferior a 2 500 g sobreviven con un desenlace clínico favorable a largo plazo, alrededor del 12% son mortinatos o mueren en el período neonatal, como en Australia Meridional por ejemplo (SA Health Commission). Se desconocen las causas de la mayoría de los partos prematuros en los países desarrollados, aunque se sabe que la preeclampsia es un antecedente en hasta un 19% de los casos (Hewitt 1988).
La reducción de la frecuencia de preeclampsia, partos prematuros y IUGR mejoraría la salud materno infantil, a la vez que conduciría a un uso más eficiente de los limitados recursos disponibles para los servicios sanitarios.
El uso de suplementos de aceite de pescado durante la segunda mitad del embarazo se propuso como una posible estrategia para prevenir la preeclampsia y el parto prematuro y aumentar el peso al nacer. Las hipótesis de que el aceite de pescado podría prevenir o mejorar estas afecciones fueron inicialmente desarrolladas a partir de comparaciones poblacionales. El elevado peso al nacer (Olsen 1985) y la prolongada duración de los embarazos (Olsen 1986) observados en la comunidad de las Islas Faroe cuya alimentación es a base de pescado, junto con un alentador informe de casos (Olsen 1987a), motivaron la sugerencia de que los ácidos grasos de los alimentos marinos podrían retrasar el parto espontáneo y, en consecuencia, aumentar el peso al nacer (Olsen 1986). El peso al nacer relativamente elevado para la edad gestacional observado en esta población motivó la sugerencia de que la grasa de los animales marinos podría también incrementar el crecimiento fetal (Andersen 1989; Olsen 1987b). Asimismo, la baja incidencia de preeclampsia observada en los esquimales de Groenlandia sentó las bases de la primera sugerencia de que el aceite de pescado podría prevenir esta enfermedad (Dyerberg 1985).
Estas hipótesis han sido comprobadas por diversos estudios epidemiológicos observacionales, varios de los cuales se analizaron en otros sitios (Olsen 1993; Olsen 1994). Cabe mencionar un ensayo de 5 644 mujeres que no se incluyó en esta revisión sistemática porque empleó asignación alternada a la intervención en lugar de asignación aleatoria. A finales de la década del 30 la League of Health de People realizó un ensayo que evaluaba la administración de suplementos multivitamínicos y minerales durante el embarazo; éste incluía una pequeña cantidad de aceite de pescado (League of Health; Olsen 1990). Se informó una disminución del 31% en la hipertensión proteinúrica (o preeclampsia) en las mujeres que recibieron suplementos en comparación con quienes no recibieron suplementos. Además, las mujeres del grupo de tratamiento presentaron un 20% menos de probabilidades de dar a luz antes de las 40 semanas de gestación, en comparación con el grupo que no recibió tratamiento (Olsen 1990).
Los aceites marinos son una fuente rica en ácidos grasos poliinsaturados de cadena larga n‐3 (AGPICL), ácido eicosapentanoico (EPA, 20:5n‐3) y ácido docosahexaenoico (DHA, 22:6n‐3). Estos ácidos grasos son los precursores de las prostaglandinas de la serie 3 y se ha demostrado que regulan los efectos inflamatorios y vasculares (Simopoulos 1991). Dado que la preeclampsia y la hipertensión gestacional se asocian con vasoconstricción y daño endotelial, es posible que los ácidos grasos del aceite marino, especialmente el ácido eicosapentanoico, puedan disminuir estas respuestas mediante la competencia directa con el ácido araquidónico, precursor del tromboxano A2. Se ha postulado que este mecanismo explicaría también las propiedades hipotensoras del tratamiento con aceite marino en las mujeres no embarazadas normotensas e hipertensas (Morris 1993). Por otra parte, los ácidos grasos del aceite marino podrían retrasar el parto de dos maneras. En primer lugar, podrían retrasar el comienzo del trabajo de parto y la dilatación cervical mediante la inhibición de la producción de prostaglandinas F2a y E2. En segundo lugar, podrían relajar el miometrio mediante el aumento de la producción de prostaciclinas (PGI2 y PGI3).
Otros agentes, como el aceite de prímula, contienen un ácido graso denominado ácido gamma‐linolénico que es un precursor de las prostaglandinas de la serie 1. Estas prostaglandinas poseen una hipótesis de mecanismo de acción similar a la de las derivadas de los ácidos grasos n‐3 (aceite marino). Por lo tanto, se incluyeron en esta revisión.
Se han realizado varios ensayos aleatorios sobre la administración de suplementos con precursores de prostaglandinas durante el embarazo para determinar si estos suplementos poseen algún beneficio clínico para la madre o el hijo. El objetivo de esta revisión es estimar los beneficios y los riesgos globales de la administración de suplementos de precursores de prostaglandinas durante el embarazo.
Objetivos
Estimar los efectos de la suplementación con aceite marino y otros precursores de prostaglandinas durante el embarazo, en relación con el riesgo de preeclampsia, parto prematuro, bajo peso al nacer y tamaño pequeño para la edad gestacional (PEG), y con otras medidas significativas de morbilidad materna y de morbilidad y mortalidad infantil.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todos los ensayos aleatorios, con adecuado ocultamiento de la asignación, de administración de suplementos dietéticos de aceite marino u otros precursores de prostaglandinas durante el embarazo. Se excluyeron los ensayos con otros métodos de asignación donde no se pudo eliminar los sesgos.
Tipos de participantes
Todas las mujeres embarazadas, independientemente del riesgo de preeclampsia, parto prematuro o RCIU.
Se definió a las mujeres con alto riesgo de preeclampsia, parto prematuro o RCIU como aquellas con antecedentes de preeclampsia grave, diabetes, hipertensión crónica, nefropatía, enfermedad autoinmune, parto prematuro anterior, RCIU previo, o fumadoras de más de 30 cigarrillos diarios. Las demás mujeres se definieron como de riesgo bajo o moderado.
Se excluyeron las mujeres con diagnóstico de preeclampsia o sospecha de IUGR al ingresar al ensayo.
Tipos de intervenciones
El aceite marino (aceite de pescado o de algas), administrado por vía oral, comparado con placebo o ningún tratamiento. Se incluyeron los ensayos que utilizaron alimentos enriquecidos con aceite marino. Se incluyeron también los tratamientos con otros aceites, como aceite de prímula o borraja, que poseen ácidos grasos que podrían generar prostaglandinas. Se excluyeron los ensayos con tratamiento de dosis única. Se excluyeron también los ensayos que investigaron el aceite marino, u otros precursores de prostaglandinas, en combinación con otros nutrientes o fármacos que pueden afectar la preeclampsia, el parto prematuro o el RCIU.
Tipos de medida de resultado
Para la mujer
Hipertensión
Preeclampsia*
Eclampsia
Otras complicaciones de la eclampsia
Ingreso en el hospital
Cesárea
Hemorragia
Duración del trabajo de parto
Morbilidad grave (como insuficiencia renal, insuficiencia hepática, eclampsia, muerte)
Duración de la gestación*
Efectos secundarios (gastrointestinales y no gastrointestinales)
Embarazo prolongado (> 42 semanas)*
Para el recién nacido
Mortinatos*
Muertes neonatales*
Parto prematuro (< 37 semanas completas)*
Morbilidad neonatal (como hemorragia intraventricular, síndrome de dificultad respiratoria)
Peso al nacer *
Bajo peso al nacer(< 2.5 kg)*
PEG (<10o percentilo)*
Ingreso en la unidad de cuidados intensivos neonatales
El seguimiento a largo plazo incluyó las medidas de resultado neurológico y del desarrollo (como la parálisis cerebral).
Para los recursos del centro de salud
Ingreso y duración de la estancia en el hospital y en las unidades de cuidados intensivos
Utilización de los centros de salud de la comunidad
Las medidas de resultado marcadas con * son las medidas de resultado primarias y las utilizadas para los análisis de subgrupos.
Métodos de búsqueda para la identificación de los estudios
Se realizaron búsquedas en el Registro Especializado de Ensayos Controlados del Grupo Cochrane de Embarazo y Parto (Cochrane Pregnancy and Childbirth Group) mediante el contacto con el Coordinador de Búsqueda de Ensayos (diciembre 2005).
El Coordinador de Búsqueda de Ensayos mantiene el Registro Especializado de Ensayos Controlados del Grupo Cochrane de Embarazo y Parto, que contiene ensayos identificados mediante:
(1) búsquedas trimestrales en el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL);
(2) búsquedas mensuales en MEDLINE;
(3) consultas manuales en 30 revistas y en los resúmenes de congresos importantes;
(4) búsqueda semanal de información actualizada en 37 revistas adicionales.
Los detalles sobre las estrategias de búsqueda en CENTRAL y MEDLINE, la lista de revistas consultadas manualmente y los resúmenes de los congresos, así como la lista de revistas revisadas por medio del servicio de información actualizada se pueden encontrar en la sección "Estrategias de búsqueda para la identificación de estudios", dentro de la información editorial sobre el Grupo Cochrane de Embarazo y Parto.
A los ensayos identificados a través de las actividades de búsqueda descritas más arriba, se les asigna un código (o códigos), dependiendo del tema. Los códigos están relacionados con los temas de la revisión. El Coordinador de Búsqueda de Ensayos busca el registro para cada revisión con el uso de estos códigos en lugar de palabras clave.
Además, se hicieron búsquedas en el Registro Cochrane Central de Ensayos Controlados (The Cochrane Library 2005, número 2) y en MEDLINE (1966 hasta abril 2005), mediante la siguiente estrategia de búsqueda:
1. PREGNANCY*:ME
2. PREGNANCY‐COMPLICATIONS*:ME
3. PREGNANCY TRIMESTERS*:ME
4. PREGNANCY‐MULTIPLE*:ME
5. PREGNAN*
6. #1 OR #2 OR #3 OR #4 OR #5
7. PREECLAMP*
8. PRE‐ECLAMP*
9. (PRE NEXT ECLAMP*)
10. ECLAMP*
11. HYPERTENS*
12. #7 OR #8 OR #9 OR #10 OR #11
13. PRIMROSE NEAR OIL
14. EVENING NEAR OIL
15. PROSTAGLANDIN* NEAR PRECURSOR*
16. FISH NEAR OIL*
17. N‐3 NEAR POLYUNSATURATED NEAR "FATTY ACID*"
18. LCPUFA
19. EICOSAPENTAENOIC NEXT ACID
20. EICOSAPENTANOIC NEXT ACID
21. 5‐8‐11‐14‐17‐EICOSAPENTAENOIC ACID*:ME
22. EPA
23. DOCOSAHEXAENOIC NEXT ACID
24. DOCOSAHEXANOIC NEXT ACID
25. DOCOSAHEXAENOIC‐ACIDS*:ME
26. DHA
27. #13 OR #14 OR #15 OR #16 OR #17 OR #18 OR #19 OR #20 OR #21 OR #22 OR #23 OR #24 or #25 or #26
28. #6 AND #12
29. #28 AND #27
No se aplicó ninguna restricción de idioma.
Obtención y análisis de los datos
La revisión se realizó según los procedimientos descritos en el Manual Cochrane (Higgins 2005). Los ensayos potencialmente elegibles se evaluaron para su inclusión y calidad metodológica, sin considerar sus resultados. Cada uno fue evaluado de forma independiente por dos de los autores. Los desacuerdos fueron resueltos mediante discusión. No se ocultó la autoría.
Se asignó a cada ensayo una puntuación de calidad según el ocultamiento de la asignación: A = adecuado, B = incierto, C = inadecuado. Se excluyeron los ensayos con asignación no aleatoria donde no se pudo eliminar los sesgos.
Además, se asignó a cada ensayo una puntuación de calidad según el cegamiento de la evaluación de resultados y el cumplimiento del seguimiento, de la siguiente manera:
Cegamiento de la evaluación de resultados:
(A) doble ciego, ni el investigador ni la participante conocían o podían descubrir el tratamiento asignado;
(B) cegamiento simple, el investigador o la participante conocían la asignación. O el ensayo se describe como doble ciego, aunque debido a los efectos secundarios de uno u otro tratamiento es probable que la asignación de una proporción significativa de las participantes (al menos el 20%) pudiera ser correctamente identificada;
(C) sin cegamiento, tanto el investigador como la participante conocían (o tenían probabilidades de descubrir) el tratamiento asignado.
(D) incierto.
Para el cumplimiento del seguimiento:
(A) menos del 3% de las participantes excluidas;
(b) 3% a 9,9% de las participantes excluidas;
(C) 10% a 19,9% de las participantes excluidas.
En caso de excluirse un 20% o más de las participantes, se excluyeron los datos de esa medida de resultado.
Dos autores de la revisión extrajeron los datos de forma independiente y los verificaron de forma cruzada. Los desacuerdos fueron resueltos mediante discusión. Cuando fue posible, se solicitaron los datos no publicados a los investigadores.
Análisis de Subgrupos
Los análisis de subgrupos preespecificados se basaron en:
(1) el tipo de suplemento: aceite marino (de pescado o de algas) u otros precursores de prostaglandinas;
(2) el embarazo al ingresar al ensayo: antes o después de las 16 semanas de gestación;
(3) el tipo de embarazo: múltiple o de feto único;
(4) el nivel de riesgo al ingresar al ensayo: riesgo alto o riesgo bajo/moderado de preeclampsia, parto prematuro o RCIU;
(5) la ingesta dietética de aceite marino al ingresar al ensayo: ingesta alta, media o baja.
Los análisis de subgrupos sólo se realizaron para las medidas de resultado principales de preeclampsia, parto prematuro, duración del embarazo, embarazo prolongado, peso al nacer, bajo peso al nacer, PEG, mortinatos y muerte neonatal. Cuando fue posible se realizaron pruebas de interacción para determinar si la suplementación con aceite marino tiene efectos diferenciales en subgrupos diferentes. Sólo fue posible realizar un análisis de interacción de los subgrupos de edad gestacional al ingresar al ensayo. Los datos de cada subgrupo no eran suficientes como para realizar un análisis según la ingesta dietética de aceite marino al ingresar al ensayo.
Resultados
Descripción de los estudios
Un total de 2 755 mujeres de seis ensayos han sido incluidas en esta revisión. Los seis ensayos tenían un diseño aleatorio y comparaban un suplemento o alimento que contiene ácidos grasos marinos con placebo o ningún tratamiento. Cuatro de los ensayos utilizaron un aceite extraído del cuerpo de los peces, en tanto que otro utilizó una mezcla de aceite de prímula y aceite (del cuerpo) de pescado (Angola 1992). El sexto ensayo, el de publicación más reciente, analizó el consumo de huevos enriquecidos con ácido docosahexaenoico (USA 2003). Este enriquecimiento se logró mediante la alimentación de gallinas ponedoras con un aceite de algas (USA 2003). La dosis asignada de principios activos en los aceites marinos (ácido eicosapentanoico y ácido docosahexaenoico) osciló entre 133 mg/día (USA 2003) y 3 g/día (Europe 2000). La dosis más utilizada fue de 2,7 g de ácido eicosapentanoico y ácido docosahexaenoico por día (Denmark 1992; England 1995; Europe 2000), y, además, estos ensayos incluyeron a la mayoría de las mujeres (2 242). La mayoría de los ensayos comenzaron la suplementación después de las 16 semanas de gestación (Denmark 1992; England 1995; Europe 2000; USA 2003). Tres de los seis ensayos incluyeron mujeres con embarazo de alto riesgo (England 1995; Europe 2000; Netherlands 1994). Las principales medidas de resultado informadas en los ensayos fueron el parto prematuro, la preeclampsia y el peso al nacer. Los datos con respecto a las medidas de resultado neonatal y de la infancia son escasos.
Además, el ensayo Europe 2000 incluyó dos subgrupos de mujeres con preeclampsia o sospecha de RCIU (Europe 2000). Estas mujeres se excluyeron de esta revisión. Otros tres estudios se excluyeron porque no se informaban datos de medidas de resultado significativas (Australia 2004), las pérdidas durante el seguimiento fueron superiores al 20% (Norway 2001; Scotland 2003) o la intervención no involucraba un precursor directo de las prostaglandinas (Netherlands 2004).
Riesgo de sesgo de los estudios incluidos
Tres ensayos (2 242 mujeres) informaron un adecuado ocultamiento de la asignación (Denmark 1992; England 1995; Europe 2000). Todos los ensayos, excepto uno (Angola 1992), utilizaron también un tratamiento de placebo o de control de aspecto idéntico al suplemento. Sin embargo, los ensayos que brindan información sobre el éxito del cegamiento indican que la mayoría de las mujeres que tomó el aceite marino pudo descubrir su grupo de asignación, en gran medida debido a los eructos y al sabor desagradable asociado con la ingesta de los suplementos de aceite de pescado (Denmark 1992; England 1995; Europe 2000). La mayoría de los ensayos informaron resultados para al menos el 83% de las mujeres reclutadas.
Efectos de las intervenciones
(1) Preeclampsia e hipertensión arterial (comparaciones 01‐01, 01‐02)
No hubo diferencias netas en el riesgo relativo (RR) de hipertensión arterial (RR 1,09; intervalo de confianza [IC] del 95%: 0,90 a 1,33; 5 ensayos, 1 831 mujeres) ni en la incidencia de preeclampsia (RR 0,86; IC del 95%: 0,59 a 1,27; 4 ensayos, 1 683 mujeres) entre el grupo tratado con aceite marino y el de control.
Análisis de subgrupos en relación con preeclampsia (comparaciones 02‐01, 03‐01, 04‐01, 05‐01)
Los grupos de tratamiento y de control no exhibieron diferencias claras en la incidencia de preeclampsia, independientemente del momento de la suplementación, ya sea que las mujeres hayan sido tratadas exclusivamente con aceite marino, o si las mujeres tenían embarazos de alto riesgo de preeclampsia, parto prematuro o RCIU. En las mujeres con embarazo de feto único a las que se asignó el aceite marino, el riesgo relativo de preeclampsia fue de 0,67 (IC del 95%: 0,43; 1,04; 4 ensayos, 1 186 mujeres) en comparación con placebo o ningún tratamiento. Sólo un estudio aportó datos de mujeres con embarazo múltiple; éste informó que en las mujeres asignadas al aceite marino el riesgo relativo de preeclampsia fue de 2,38 (IC del 95%: 0,93 a 6,10; un ensayo, 497 mujeres) en comparación con las del grupo de control.
(2) Duración de la gestación (comparaciones 01‐17, 01‐18, 01‐19, 01‐20)
Las mujeres a las que se asignó el suplemento de aceite marino presentaron un embarazo medio 2,6 días más prolongada que la de las mujeres asignadas al placebo o ningún tratamiento (diferencia de medias ponderada [DMP] 2,55 días, IC del 95%: 1,03 a 4,07 días; 3 ensayos, 1 621 mujeres). Esto no se reflejó en una diferencia neta entre ambos grupos en el riesgo relativo de nacimiento antes de las 37 semanas completas (RR 0,92; IC del 95%: 0,79 a 1,07; 5 ensayos, 1 916 mujeres). Sin embargo, las mujeres asignadas al aceite marino presentaron un menor riesgo de dar a luz antes de las 34 semanas completas de gestación, en comparación con las asignadas al placebo (RR 0,69; IC del 95%: 0,49 a 0,99; 2 ensayos, 860 mujeres). Dos ensayos informaron datos sobre el riesgo de prolongar el embarazo más allá de 42 semanas. Como había una gran heterogeneidad, este resultado se analizó mediante el modelo de efectos aleatorios (RR 1,68; IC del 95%: 0,77 a 3,66; 2 ensayos, 1 970 mujeres).
Análisis de subgrupos en relación con la duración del embarazo, el parto prematuro y el embarazo prolongado (comparaciones 02‐02, 02‐03, 02‐04, 03‐02, 03‐03, 03‐04, 04‐02, 04‐03, 04‐04, 05‐02, 05‐03, 05‐04)
Los ensayos que informaban la duración del embarazo comenzaron con la suplementación después de las 16 semanas de gestación, y el tratamiento consistió en aceite marino solo. Las mujeres con embarazos de feto único a las que se asignó aceite marino presentaron embarazos 3,0 días más prolongados que las mujeres del grupo de control (DMP 3,03 días, IC del 95%: 1,38 a 4,68 días; 3 ensayos, 1 052 mujeres). Sin embargo, en cuanto a las mujeres con embarazo múltiple no hubo una diferencia neta en la duración del embarazo entre ambos grupos. Esta prolongación del embarazo parece ser ligeramente mayor en las mujeres con embarazo de alto riesgo (para alto riesgo DMP 8,5 días, IC del 95%: 2,05 a 14,95 días; un ensayo, 255 mujeres; para riesgo bajo/moderado DMP 2,23 días, IC del 95%: 0,67 a 3,80 días; 3 ensayos, 1 393 mujeres).
En ninguno de los subgrupos investigados hubo diferencias globales en el riesgo relativo de parto prematuro entre el tratamiento con aceite marino y el de control.
Todos los ensayos que informaron datos sobre el embarazo prolongado comenzaron la suplementación después de 16 semanas de gestación, y utilizaron suplementos de aceite marino. Sólo un ensayo informó datos sobre la prolongación del embarazo más allá de 42 semanas en mujeres con embarazo de feto único y de riesgo bajo/moderado (RR 1,19; IC del 95%: 0,73 a 1,93; un ensayo, 533 mujeres). Estos datos se analizaron mediante un modelo de efectos aleatorios debido a heterogeneidad significativa en el análisis primario. No hubo datos disponibles sobre mujeres con embarazo de alto riesgo o mujeres con embarazo múltiple.
(3) Tamaño al nacer(comparaciones 01‐21, 01‐22, 01‐23, 01‐24, 01‐25)
El peso al nacer (DMP 47 g, IC del 95%: 1 a 93 g; 3 ensayos, 2 440 mujeres) y la talla al nacer (DMP 0,48 cm, IC del 95%: 0,13 a 0,83 cm; 2 ensayos, 824 mujeres) fueron ligeramente mayores en los neonatos de las mujeres del grupo de aceite marino en comparación con el de control. Sin embargo, no hubo diferencias globales entre los grupos en cuanto al riesgo relativo de bajo peso al nacer o niños pequeños para la edad gestacional. Ningún ensayo informó datos sobre neonatos de muy bajo peso al nacer.
Análisis de subgrupos en relación con el peso al nacer, el bajo peso al nacer y el tamaño pequeño para la edad gestacional (PEG) (comparaciones 02‐05, 02‐06, 02‐07, 03‐05, 03‐06, 03‐07, 04‐05, 04‐06, 04‐07, 05‐05, 05‐06, 05‐07)
Todos los ensayos que informaron sobre el peso al nacer comenzaron el tratamiento después de las 16 semanas de gestación. Las mujeres con embarazo de feto único a las que se asignó el aceite marino tuvieron niños con un peso al nacer ligeramente mayor que las asignadas al grupo de control (DMP 72 g, IC del 95%: 11 a 133 g; 3 ensayos con 1 318 mujeres), en tanto que no hubo una diferencia neta para las mujeres con embarazo múltiple (DMP 14 g, IC del 95%: ‐57 a 86 g; un ensayo con 1 122 mujeres). No hubo una diferencia neta entre los grupos de tratamiento y de control en las mujeres con embarazo de alto riesgo (DMP 12 g, IC del 95%: ‐97 a 122 g; un ensayo con 494 mujeres), mientras que las mujeres del grupo de tratamiento con embarazo de riesgo bajo/moderado tuvieron niños con un peso medio al nacer más elevado en comparación con el grupo de control (DMP 56 g, IC del 95%: 5 a 107 g; 3 ensayos con 1 946 mujeres).
El riesgo relativo de dar a luz un niño con bajo peso al nacer (menos de 2 500 g) o pequeño para la edad gestacional entre los grupos de tratamiento y de control no difirió en ningún subgrupo.
(4) Mortalidad y morbilidad del neonato(comparaciones 01‐14, 01‐15, 01‐16, 01‐26, 01‐27, 01‐28, 01‐29, 01‐30)
Aun si son considerados en conjunto, hubo muy pocas muertes de recién nacidos para establecer conclusiones fiables acerca de los efectos globales de los aceites marinos y otros precursores de prostaglandinas.
No hubo diferencias netas entre los grupos en cuanto a la duración media de la estancia hospitalaria del neonato o a los riesgos relativos de ingreso a la unidad de cuidados neonatales, malformación congénita, trastornos hemorrágicos neonatales y trastornos no hemorrágicos neonatales.
Análisis de subgrupos en relación con los mortinatos y la muerte neonatal (comparaciones 02‐08, 02‐09, 03‐08, 03‐09, 04‐08, 04‐09, 05‐08, 05‐09)
Asimismo, los datos sobre mortinatos y muerte neonatal fueron insuficientes para establecer conclusiones fiables acerca de los posibles efectos en cualquiera de los subgrupos preespecificados.
(5) Mortalidad y morbilidad materna (comparaciones 01‐03, 01‐04, 01‐05, 01‐06, 01‐10)
No hubo muertes maternas en el único ensayo que informó esta medida de resultado (1477 mujeres).
No hubo diferencias netas entre los grupos en ninguna medida de morbilidad materna, como duración de la estancia hospitalaria, cesárea y eclampsia u otra morbilidad materna grave.
(6) Efectos secundario maternos (comparaciones 01‐07, 01‐08, 01‐09, 01‐12, 01‐13)
Las mujeres a las que se asignó el aceite marino presentaron una probabilidad tres veces mayor de informar síntomas como los eructos (RR 3,55; IC del 95%: 2,78 a 4,52; 3 ensayos, 1 386 mujeres) y seis veces mayor de quejarse de un sabor desagradable (RR 6,17; IC del 95%: 4,03 a 9,44; 3 ensayos, 1 354 mujeres) que las asignadas al aceite de control. No hubo diferencias netas con respecto a náuseas, vómitos, dolor del estómago, diarrea y estreñimiento entre las mujeres de ambos grupos.
Además, no hubo diferencias entre las mujeres de ambos grupos en cuanto a complicaciones hemorrágicas, como hemorragia nasal, hemorragia vaginal previa al parto, anemia materna, hemorragia vaginal postparto y pérdida de sangre durante el parto.
(7) Desenlace clínico infantil a largo plazo(comparaciones 01‐31)
Ninguno de los ensayos incluidos aportó datos con respecto a las medidas de resultado infantiles a largo plazo.
Discusión
Los datos de esta revisión sistemática indican un pequeño aunque constante aumento en la duración media del embarazo asociado con la suplementación con aceite marino, y otros precursores de prostaglandinas, durante el embarazo. Este pequeño aumento de dos a tres días en la duración media de la gestación no se tradujo en una reducción del riesgo de nacimiento antes de las 37 semanas completas de gestación, aunque sí parece haber una reducción del riesgo relativo de nacimiento antes de las 34 semanas completas. Sin embargo, el número de mujeres correspondiente a la medida de resultado informada es relativamente pequeño, y la mayoría presentaba embarazos de alto riesgo. Por lo tanto, es posible que dicha medida se halle afectada tanto por el sesgo como por el error aleatorio.
Si bien una mayor duración del embarazo es aconsejable ya que reduce el riesgo de parto prematuro, no sería tan aconsejable si también prolonga el embarazo más allá del término. Los datos de esta revisión son insuficientes para establecer conclusiones fiables acerca de los posibles efectos sobre el embarazo prolongado.
La suplementación con aceite marino se asoció con un pequeño aumento del peso al nacer que parece ser proporcional al aumento de dos a tres días en la duración media del embarazo. Sin embargo, la importancia clínica de estos resultados es dudosa, ya que éstos no se reflejan en un impacto global sobre el riesgo relativo de un neonato con bajo peso al nacer o pequeño para la edad gestacional. Estos resultados fueron constantes en todos los análisis de subgrupos. Esto indica que posiblemente la suplementación con aceite marino durante el embarazo no favorezca el crecimiento fetal, y que el pequeño aumento del peso al nacer se deba al pequeño aumento de la duración del embarazo.
La estimación puntual del efecto de los aceites marinos u otros precursores de prostaglandinas sobre la preeclampsia fue una reducción del 14% del riesgo relativo, con intervalos de confianza del 95% para los efectos reales que iban de una reducción del 39% a un aumento del 33%, en comparación con el tratamiento de control. Si bien el análisis de subgrupos de embarazos múltiples y de feto único indica que cualquier reducción del riesgo de preeclampsia se limitaría a las mujeres con embarazo de feto único, sólo un ensayo aportó datos tanto de subgrupos de embarazo múltiple como de feto único, mientras que el resto de los ensayos sólo incluyó mujeres con embarazo de feto único. Estas diferencias entre los subgrupos, y el escaso número de mujeres con embarazo múltiple pueden dar lugar a sesgo y a error aleatorio.
Las dosis de ácido eicosapentanoico y ácido docosahexaenoico extraídos de los aceites marinos utilizados en los ensayos de esta revisión oscilaron entre 133 mg/día y 3 g/día, aunque gran parte de los ensayos que incluyeron a la mayoría de las mujeres evaluaron una dosis de 2,7 g de ácido eicosapentanoico y ácido docosahexaenoico por día. Dicha dosis sería difícil de alcanzar a partir de fuentes alimentarias. A modo de ejemplo, una mujer tendría que ingerir 300 g diarios de salmón cocido. Si bien las dosis parecen altas comparadas con los valores que se puede alcanzar mediante la dieta, las intervenciones con aceite marino parecen ser inocuas. No se produjeron aumentos del sangrado ni de las hemorragias antes o después del parto. Los únicos efectos secundarios asociados con la suplementación con aceite de pescado fueron los eructos y el sabor desagradable, y éstos son relativamente poco importantes.
Los datos bibliográficos más recientes sugieren que una mayor suplementación con ácido docosahexaenoico durante el embarazo podría mejorar tanto el estado de ánimo de la madre como el neurodesarrollo del niño. Ciertos estudios prospectivos de cohortes advierten una fuerte asociación entre la dosis dietética de ácido docosahexaenoico durante el embarazo y la prevalencia de síntomas depresivos en el período postnatal (Hibbeln 2003). Asimismo, los estudios de cohortes relacionan los niveles maternos de ácido docosahexaenoico al final del embarazo, o los niveles de ácido docosahexaenoico en la sangre del cordón umbilical, con alteraciones en los patrones de sueño neonatales (Cheruku 2002), alteración de la atención (Colombo 2004) y del desarrollo psicomotor (Bakker 2003). Sólo se hallaron dos ensayos aleatorios publicados para evaluar el efecto de la intervención con aceite de pescado durante el embarazo sobre el posterior desarrollo infantil (Norway 2001; Scotland 2003) y ambos ensayos se excluyeron de esta revisión debido a cuestiones metodológicas. No obstante, los datos relacionados con el estado de ánimo materno y el desarrollo infantil han generado un interés considerable, éstos motivaron el reciente comienzo de numerosos ensayos para evaluar el impacto de la suplementación con ácido docosahexaenoico durante el embarazo sobre el estado de ánimo materno (DOMInO) y el desarrollo infantil (DOMInO; Mexico; NICHD).
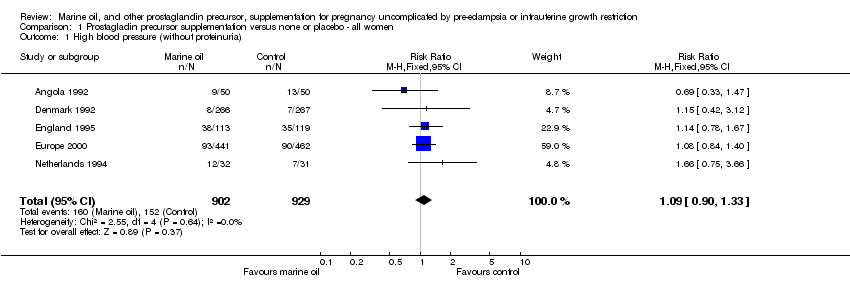
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 1 High blood pressure (without proteinuria).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 2 Pre‐eclampsia (hypertension with proteinuria).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 3 Eclampsia or other serious maternal morbidity.

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 4 Maternal death.

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 5 Maternal antepartum hospitalisation.
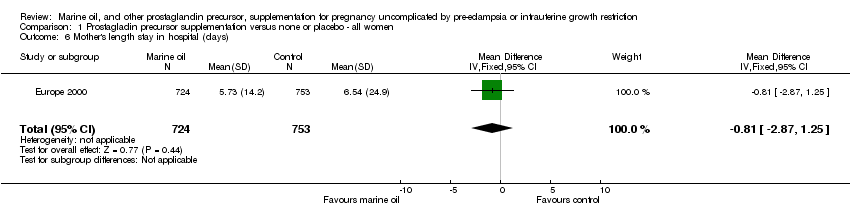
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 6 Mother's length stay in hospital (days).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 7 Antepartum vaginal bleeding.
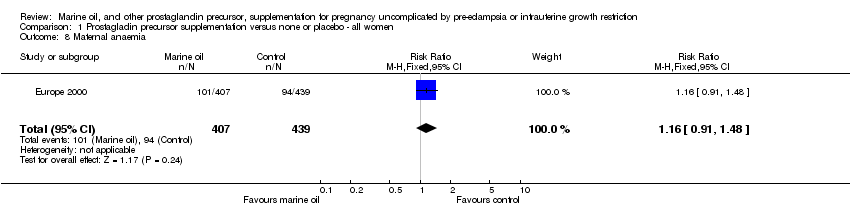
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 8 Maternal anaemia.

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 9 Maternal side‐effects.
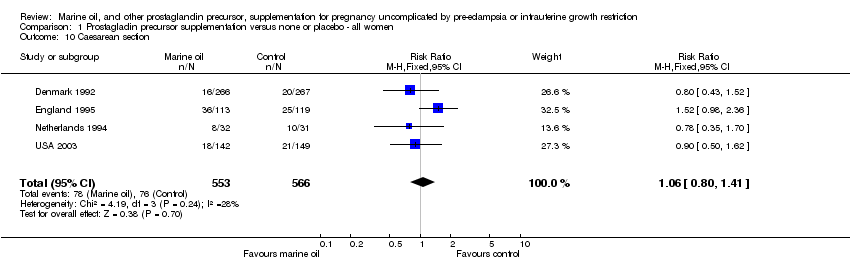
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 10 Caesarean section.
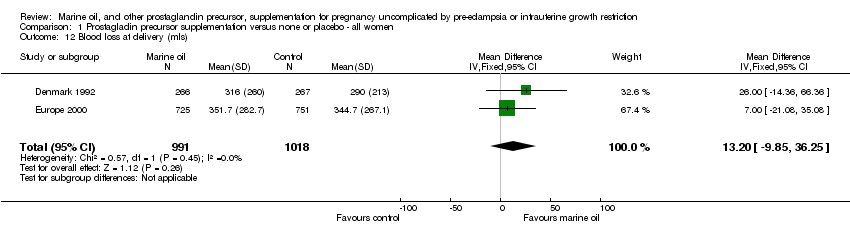
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 12 Blood loss at delivery (mls).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 13 Vaginal blood loss after delivery.
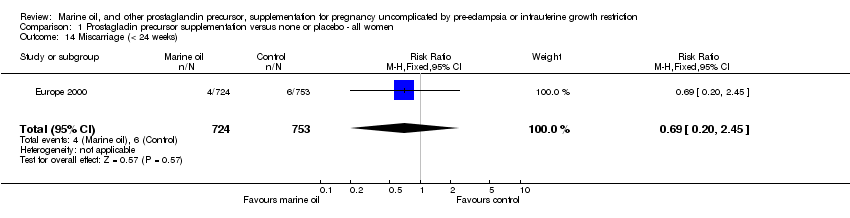
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 14 Miscarriage (< 24 weeks).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 15 Stillbirth (= or > 24 weeks).
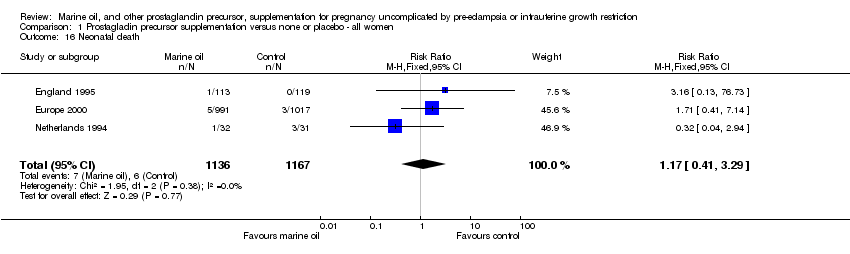
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 16 Neonatal death.

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 17 Length of gestation (days).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 18 Preterm birth (< 37 weeks).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 19 Early preterm birth (< 34 weeks).
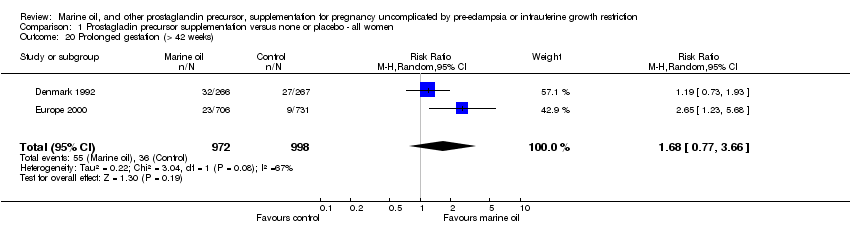
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 20 Prolonged gestation (> 42 weeks).
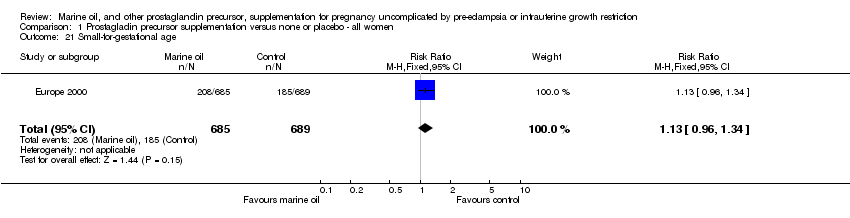
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 21 Small‐for‐gestational age.

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 22 Low birthweight (< 2500 g).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 24 Birthweight (gm).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 25 Birth length (cm).
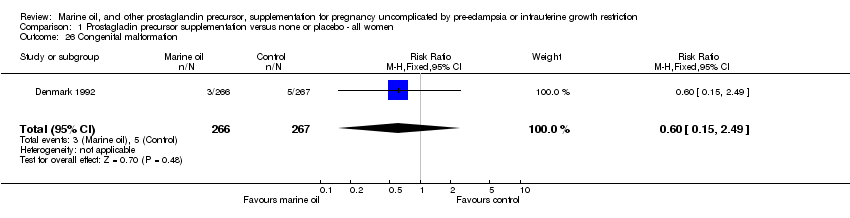
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 26 Congenital malformation.
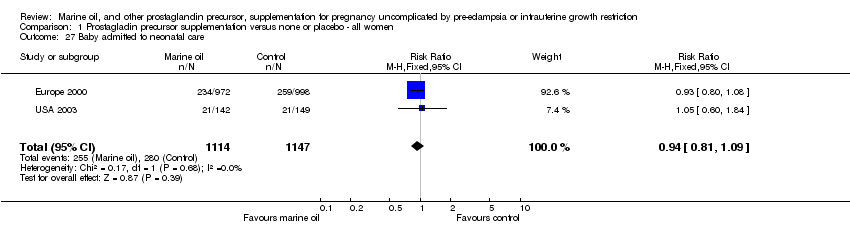
Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 27 Baby admitted to neonatal care.

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 28 Baby's length of stay in hospital (days).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 29 Neonatal morbidity ‐ bleeding disorders (eg IVH).

Comparison 1 Prostagladin precursor supplementation versus none or placebo ‐ all women, Outcome 30 Neonatal morbidity ‐ non‐bleeding disorders (eg RDS).

Comparison 2 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by gestation at trial entry, Outcome 1 Pre‐eclampsia (hypertension with proteinuria).
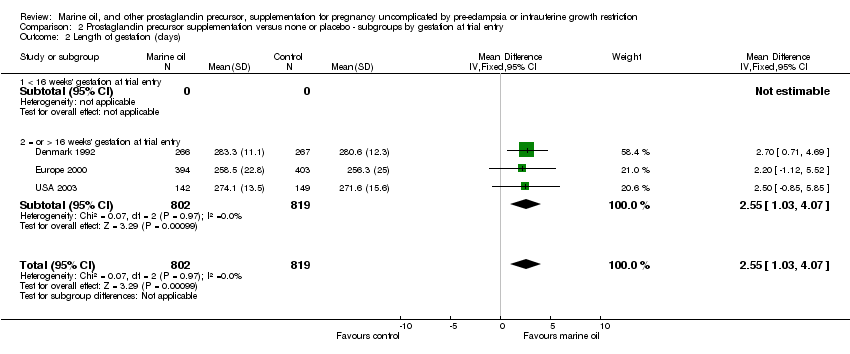
Comparison 2 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by gestation at trial entry, Outcome 2 Length of gestation (days).
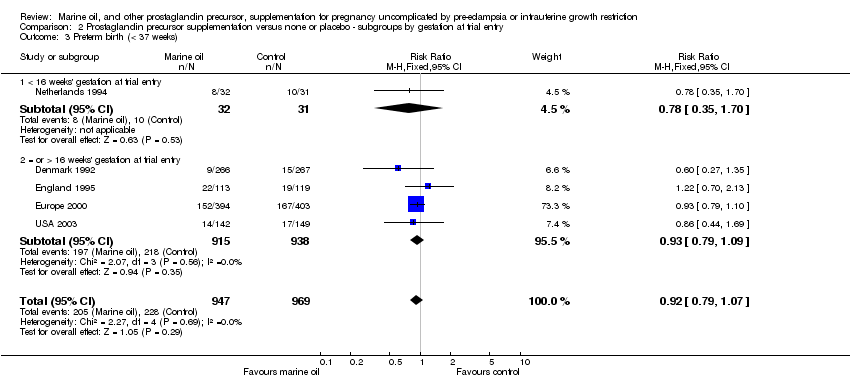
Comparison 2 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by gestation at trial entry, Outcome 3 Preterm birth (< 37 weeks).

Comparison 2 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by gestation at trial entry, Outcome 4 Prolonged gestation (> 42 weeks).

Comparison 2 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by gestation at trial entry, Outcome 5 Birthweight (gm).

Comparison 2 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by gestation at trial entry, Outcome 6 Low birthweight (< 2500 g).
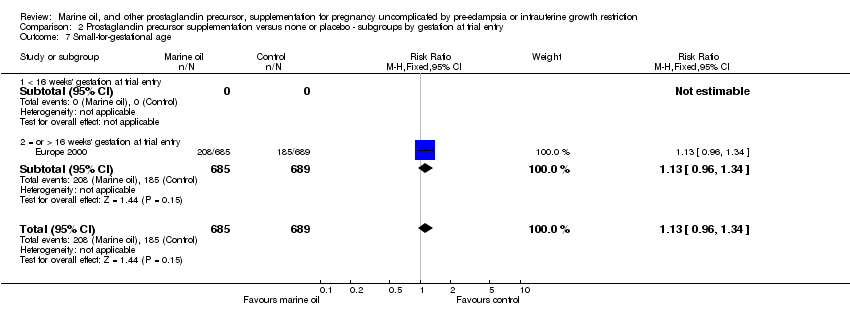
Comparison 2 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by gestation at trial entry, Outcome 7 Small‐for‐gestational age.
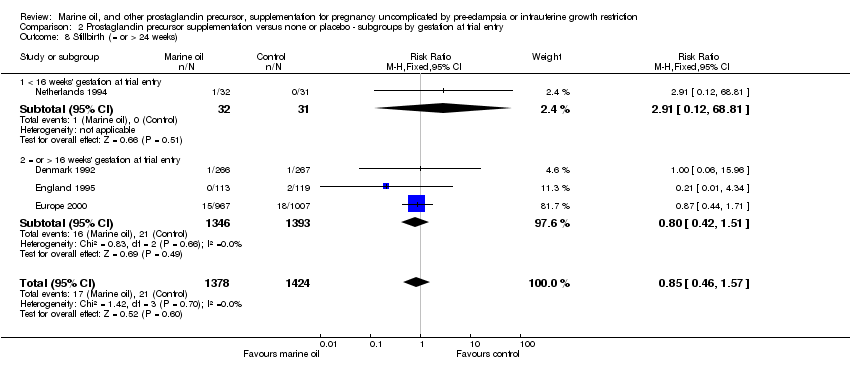
Comparison 2 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by gestation at trial entry, Outcome 8 Stillbirth (= or > 24 weeks).
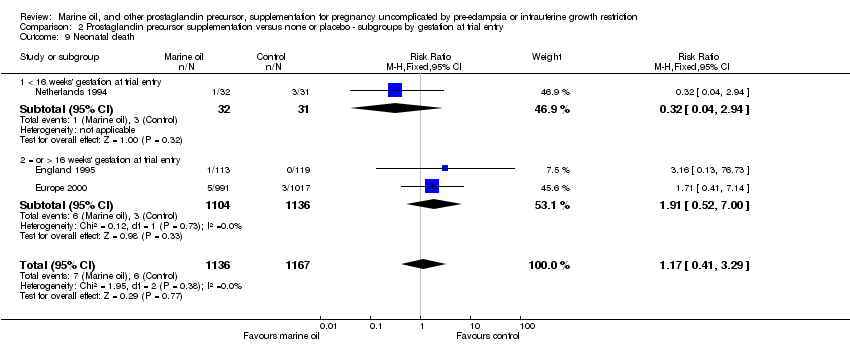
Comparison 2 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by gestation at trial entry, Outcome 9 Neonatal death.

Comparison 3 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by singleton or multiple pregnancy, Outcome 1 Pre‐eclampsia (hypertension with proteinuria).

Comparison 3 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by singleton or multiple pregnancy, Outcome 2 Length of gestation (days).

Comparison 3 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by singleton or multiple pregnancy, Outcome 3 Preterm birth (< 37 weeks).
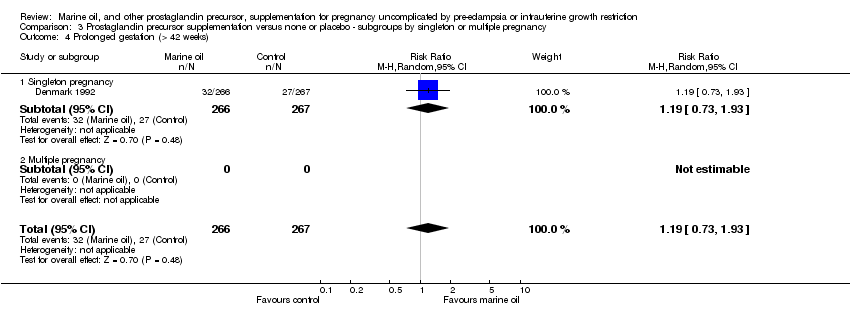
Comparison 3 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by singleton or multiple pregnancy, Outcome 4 Prolonged gestation (> 42 weeks).

Comparison 3 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by singleton or multiple pregnancy, Outcome 5 Birthweight (gm).

Comparison 3 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by singleton or multiple pregnancy, Outcome 6 Birthweight < 2500 g.
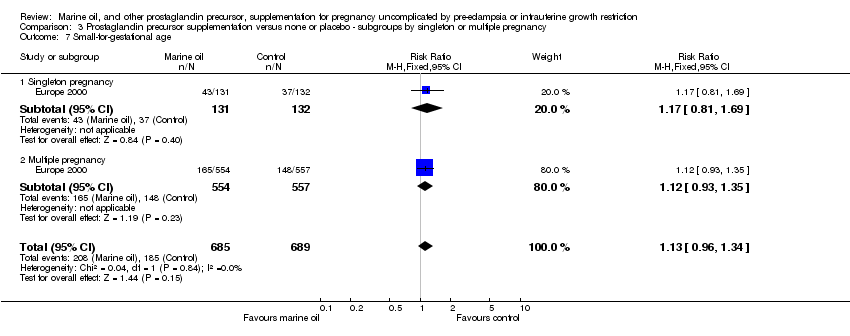
Comparison 3 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by singleton or multiple pregnancy, Outcome 7 Small‐for‐gestational age.

Comparison 3 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by singleton or multiple pregnancy, Outcome 8 Stillbirth (= or > 24 weeks).

Comparison 3 Prostaglandin precursor supplementation versus none or placebo ‐ subgroups by singleton or multiple pregnancy, Outcome 9 Neonatal death.
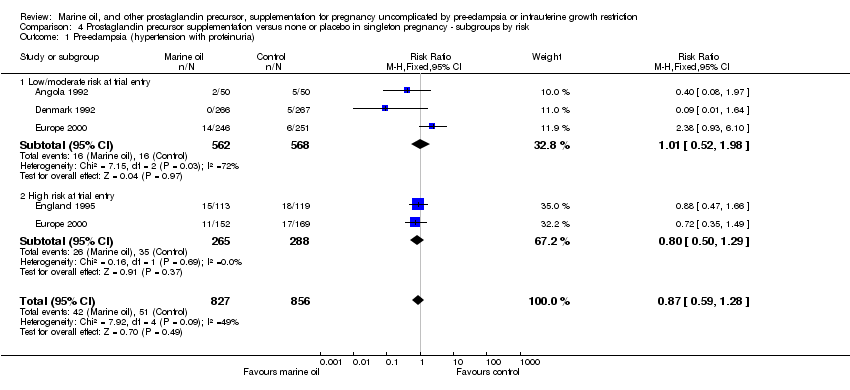
Comparison 4 Prostaglandin precursor supplementation versus none or placebo in singleton pregnancy ‐ subgroups by risk, Outcome 1 Pre‐eclampsia (hypertension with proteinuria).

Comparison 4 Prostaglandin precursor supplementation versus none or placebo in singleton pregnancy ‐ subgroups by risk, Outcome 2 Length of gestation (days).
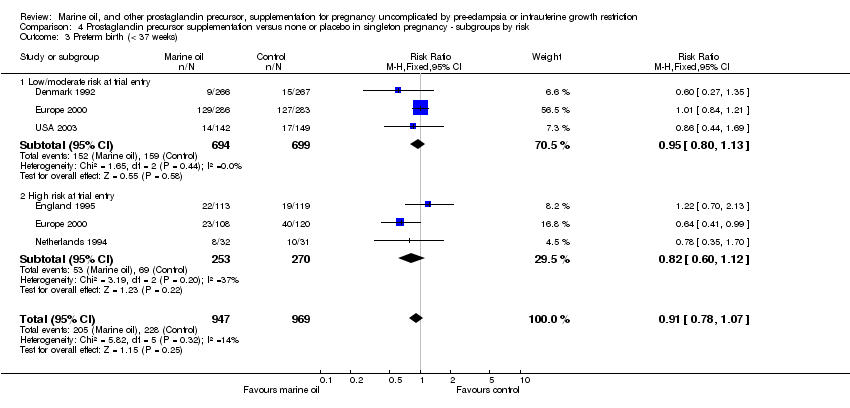
Comparison 4 Prostaglandin precursor supplementation versus none or placebo in singleton pregnancy ‐ subgroups by risk, Outcome 3 Preterm birth (< 37 weeks).

Comparison 4 Prostaglandin precursor supplementation versus none or placebo in singleton pregnancy ‐ subgroups by risk, Outcome 4 Prolonged gestation (> 42 weeks).
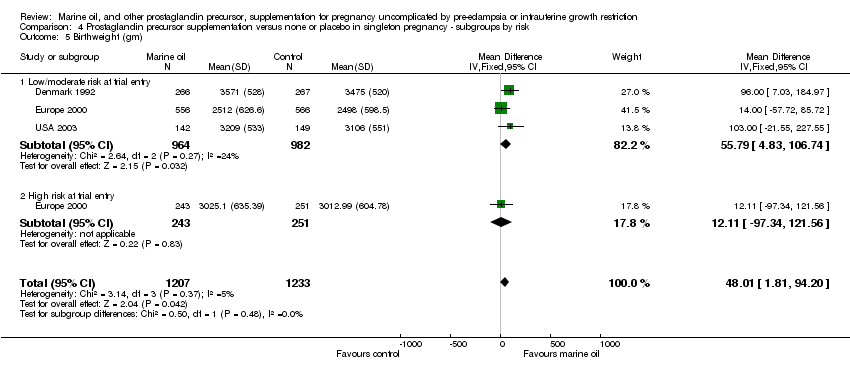
Comparison 4 Prostaglandin precursor supplementation versus none or placebo in singleton pregnancy ‐ subgroups by risk, Outcome 5 Birthweight (gm).
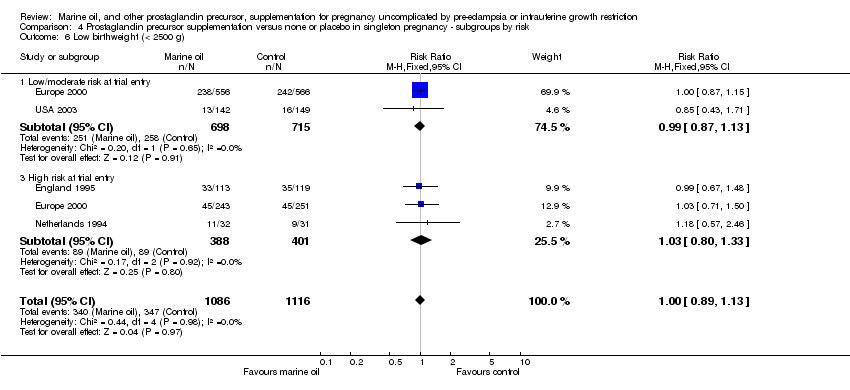
Comparison 4 Prostaglandin precursor supplementation versus none or placebo in singleton pregnancy ‐ subgroups by risk, Outcome 6 Low birthweight (< 2500 g).
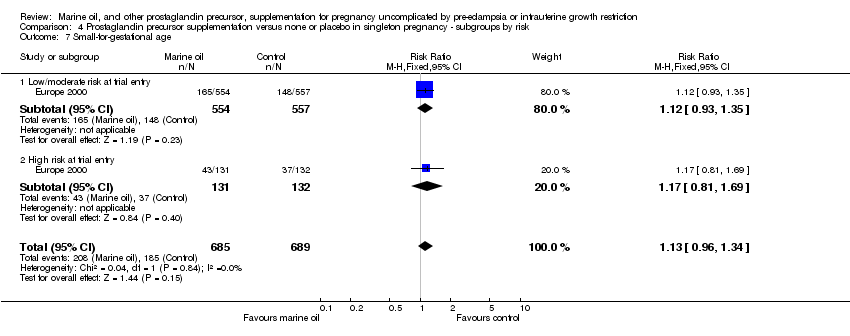
Comparison 4 Prostaglandin precursor supplementation versus none or placebo in singleton pregnancy ‐ subgroups by risk, Outcome 7 Small‐for‐gestational age.
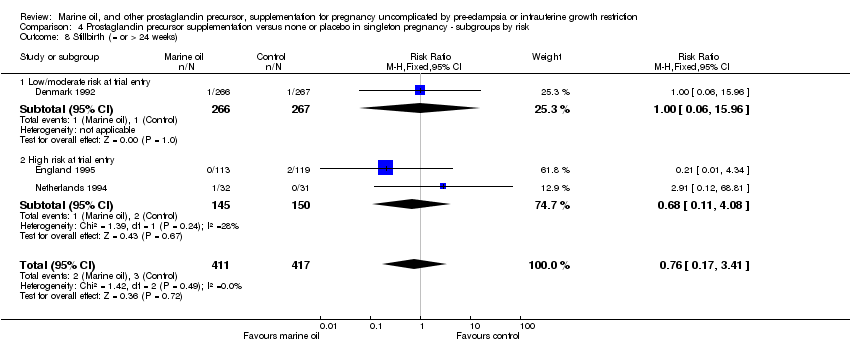
Comparison 4 Prostaglandin precursor supplementation versus none or placebo in singleton pregnancy ‐ subgroups by risk, Outcome 8 Stillbirth (= or > 24 weeks).
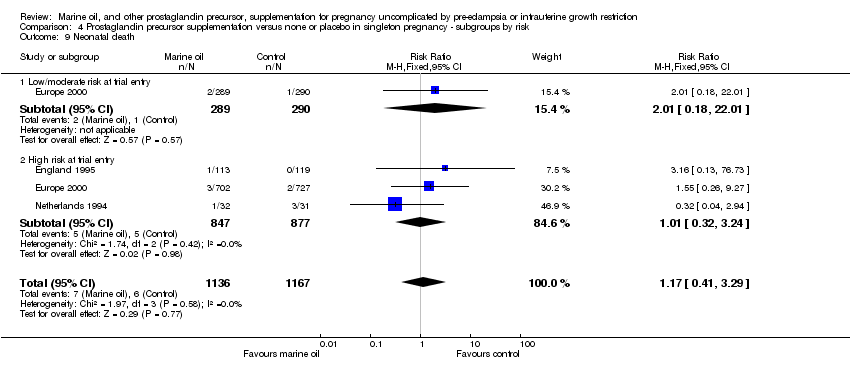
Comparison 4 Prostaglandin precursor supplementation versus none or placebo in singleton pregnancy ‐ subgroups by risk, Outcome 9 Neonatal death.

Comparison 5 Prostaglandin precursor supplementation versus placebo ‐ subgroups by type of supplement, Outcome 1 Pre‐eclampsia (hypertension with proteinuria).

Comparison 5 Prostaglandin precursor supplementation versus placebo ‐ subgroups by type of supplement, Outcome 2 Length of gestation (days).

Comparison 5 Prostaglandin precursor supplementation versus placebo ‐ subgroups by type of supplement, Outcome 3 Preterm birth (< 37 weeks).
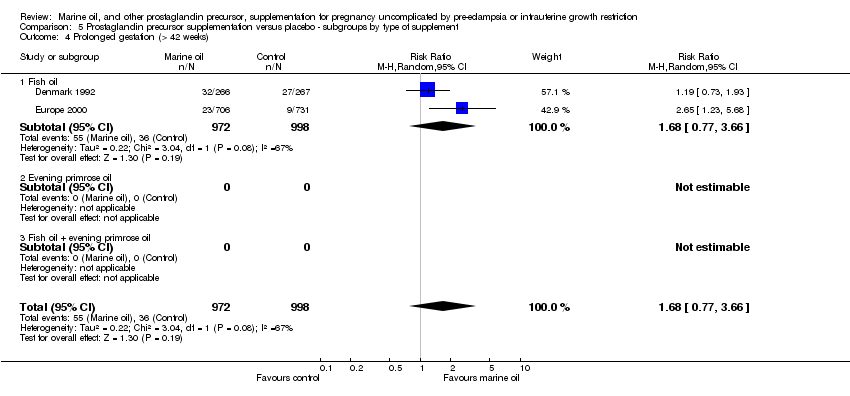
Comparison 5 Prostaglandin precursor supplementation versus placebo ‐ subgroups by type of supplement, Outcome 4 Prolonged gestation (> 42 weeks).

Comparison 5 Prostaglandin precursor supplementation versus placebo ‐ subgroups by type of supplement, Outcome 5 Birthweight (gm).

Comparison 5 Prostaglandin precursor supplementation versus placebo ‐ subgroups by type of supplement, Outcome 6 Low birthweight (< 2500 g).

Comparison 5 Prostaglandin precursor supplementation versus placebo ‐ subgroups by type of supplement, Outcome 7 Small‐for‐gestational age.
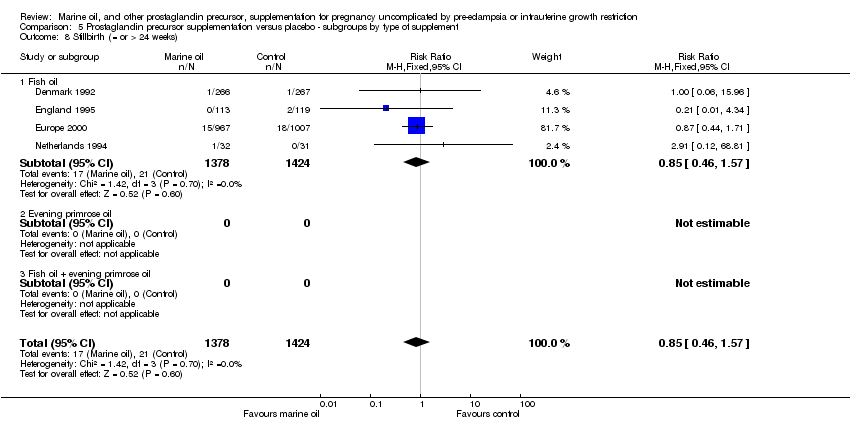
Comparison 5 Prostaglandin precursor supplementation versus placebo ‐ subgroups by type of supplement, Outcome 8 Stillbirth (= or > 24 weeks).

Comparison 5 Prostaglandin precursor supplementation versus placebo ‐ subgroups by type of supplement, Outcome 9 Neonatal death.
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 High blood pressure (without proteinuria) Show forest plot | 5 | 1831 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.09 [0.90, 1.33] |
| 2 Pre‐eclampsia (hypertension with proteinuria) Show forest plot | 4 | 1683 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.86 [0.59, 1.27] |
| 3 Eclampsia or other serious maternal morbidity Show forest plot | 1 | 100 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.14 [0.01, 2.70] |
| 4 Maternal death Show forest plot | 1 | 1477 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 5 Maternal antepartum hospitalisation Show forest plot | 1 | 63 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.23 [0.67, 2.28] |
| 6 Mother's length stay in hospital (days) Show forest plot | 1 | 1477 | Mean Difference (IV, Fixed, 95% CI) | ‐0.81 [‐2.87, 1.25] |
| 7 Antepartum vaginal bleeding Show forest plot | 2 | 1976 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.05 [0.71, 1.56] |
| 8 Maternal anaemia Show forest plot | 1 | 846 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.16 [0.91, 1.48] |
| 9 Maternal side‐effects Show forest plot | 3 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 9.1 Belching | 3 | 1386 | Risk Ratio (M‐H, Fixed, 95% CI) | 3.55 [2.78, 4.52] |
| 9.2 Unpleasant taste | 3 | 1354 | Risk Ratio (M‐H, Fixed, 95% CI) | 6.17 [4.03, 9.44] |
| 9.3 Nausea | 3 | 1352 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.09 [0.74, 1.60] |
| 9.4 Vomiting | 2 | 1263 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.95 [0.53, 1.69] |
| 9.5 Stomach pain | 2 | 477 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.55 [0.54, 4.41] |
| 9.6 Diarrhoea | 2 | 1251 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.68 [0.42, 1.12] |
| 9.7 Constipation | 1 | 1077 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.42 [0.08, 2.15] |
| 9.8 Nasal bleeding | 2 | 1506 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.94 [0.71, 1.24] |
| 10 Caesarean section Show forest plot | 4 | 1119 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.06 [0.80, 1.41] |
| 11 Length of labour (hours) | 0 | 0 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 12 Blood loss at delivery (mls) Show forest plot | 2 | 2009 | Mean Difference (IV, Fixed, 95% CI) | 13.20 [‐9.85, 36.25] |
| 13 Vaginal blood loss after delivery Show forest plot | 1 | 533 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.29 [0.49, 3.41] |
| 14 Miscarriage (< 24 weeks) Show forest plot | 1 | 1477 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.69 [0.20, 2.45] |
| 15 Stillbirth (= or > 24 weeks) Show forest plot | 4 | 2802 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.85 [0.46, 1.57] |
| 16 Neonatal death Show forest plot | 3 | 2303 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.17 [0.41, 3.29] |
| 17 Length of gestation (days) Show forest plot | 3 | 1621 | Mean Difference (IV, Fixed, 95% CI) | 2.55 [1.03, 4.07] |
| 18 Preterm birth (< 37 weeks) Show forest plot | 5 | 1916 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.79, 1.07] |
| 19 Early preterm birth (< 34 weeks) Show forest plot | 2 | 860 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.69 [0.49, 0.99] |
| 20 Prolonged gestation (> 42 weeks) Show forest plot | 2 | 1970 | Risk Ratio (M‐H, Random, 95% CI) | 1.68 [0.77, 3.66] |
| 21 Small‐for‐gestational age Show forest plot | 1 | 1374 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.13 [0.96, 1.34] |
| 22 Low birthweight (< 2500 g) Show forest plot | 5 | 2302 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.00 [0.88, 1.12] |
| 23 Very low birthweight (< 1500 g) | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 24 Birthweight (gm) Show forest plot | 3 | 2440 | Mean Difference (IV, Fixed, 95% CI) | 47.24 [1.05, 93.44] |
| 25 Birth length (cm) Show forest plot | 2 | 824 | Mean Difference (IV, Fixed, 95% CI) | 0.48 [0.13, 0.83] |
| 26 Congenital malformation Show forest plot | 1 | 533 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.60 [0.15, 2.49] |
| 27 Baby admitted to neonatal care Show forest plot | 2 | 2261 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.94 [0.81, 1.09] |
| 28 Baby's length of stay in hospital (days) Show forest plot | 1 | 1970 | Mean Difference (IV, Fixed, 95% CI) | ‐0.32 [‐1.63, 0.99] |
| 29 Neonatal morbidity ‐ bleeding disorders (eg IVH) Show forest plot | 1 | 1974 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.39 [0.62, 9.22] |
| 30 Neonatal morbidity ‐ non‐bleeding disorders (eg RDS) Show forest plot | 1 | 75 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.5 [0.11, 59.46] |
| 31 Childhood disability | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Pre‐eclampsia (hypertension with proteinuria) Show forest plot | 4 | 1683 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.86 [0.59, 1.27] |
| 1.1 < 16 weeks' gestation at trial entry | 1 | 100 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.4 [0.08, 1.97] |
| 1.2 = or > 16 weeks' gestation at trial entry | 3 | 1583 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.61, 1.37] |
| 2 Length of gestation (days) Show forest plot | 3 | 1621 | Mean Difference (IV, Fixed, 95% CI) | 2.55 [1.03, 4.07] |
| 2.1 < 16 weeks' gestation at trial entry | 0 | 0 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 2.2 = or > 16 weeks' gestation at trial entry | 3 | 1621 | Mean Difference (IV, Fixed, 95% CI) | 2.55 [1.03, 4.07] |
| 3 Preterm birth (< 37 weeks) Show forest plot | 5 | 1916 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.79, 1.07] |
| 3.1 < 16 weeks' gestation at trial entry | 1 | 63 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.78 [0.35, 1.70] |
| 3.2 = or > 16 weeks' gestation at trial entry | 4 | 1853 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.93 [0.79, 1.09] |
| 4 Prolonged gestation (> 42 weeks) Show forest plot | 2 | 1970 | Risk Ratio (M‐H, Random, 95% CI) | 1.68 [0.77, 3.66] |
| 4.1 < 16 weeks' gestation at trial entry | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 4.2 = or > 16 weeks' gestation at trial entry | 2 | 1970 | Risk Ratio (M‐H, Random, 95% CI) | 1.68 [0.77, 3.66] |
| 5 Birthweight (gm) Show forest plot | 3 | 2440 | Mean Difference (IV, Fixed, 95% CI) | 47.24 [1.05, 93.44] |
| 5.1 < 16 weeks' gestation at trial entry | 0 | 0 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 5.2 = or > 16 weeks' gestation at trial entry | 3 | 2440 | Mean Difference (IV, Fixed, 95% CI) | 47.24 [1.05, 93.44] |
| 6 Low birthweight (< 2500 g) Show forest plot | 5 | 2302 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.00 [0.89, 1.13] |
| 6.1 < 16 weeks' gestation at trial entry | 2 | 163 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.12 [0.60, 2.09] |
| 6.2 = or > 16 weeks' gestation at trial entry | 3 | 2139 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.00 [0.88, 1.13] |
| 7 Small‐for‐gestational age Show forest plot | 1 | 1374 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.13 [0.96, 1.34] |
| 7.1 < 16 weeks' gestation at trial entry | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 7.2 = or > 16 weeks' gestation at trial entry | 1 | 1374 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.13 [0.96, 1.34] |
| 8 Stillbirth (= or > 24 weeks) Show forest plot | 4 | 2802 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.85 [0.46, 1.57] |
| 8.1 < 16 weeks' gestation at trial entry | 1 | 63 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.91 [0.12, 68.81] |
| 8.2 = or > 16 weeks' gestation at trial entry | 3 | 2739 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.80 [0.42, 1.51] |
| 9 Neonatal death Show forest plot | 3 | 2303 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.17 [0.41, 3.29] |
| 9.1 < 16 weeks' gestation at trial entry | 1 | 63 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.32 [0.04, 2.94] |
| 9.2 = or > 16 weeks' gestation at trial entry | 2 | 2240 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.91 [0.52, 7.00] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Pre‐eclampsia (hypertension with proteinuria) Show forest plot | 4 | 1683 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.87 [0.59, 1.28] |
| 1.1 Singleton pregnancy | 4 | 1186 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.67 [0.43, 1.04] |
| 1.2 Multiple pregnancy | 1 | 497 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.38 [0.93, 6.10] |
| 2 Length of gestation (days) Show forest plot | 3 | 1621 | Mean Difference (IV, Fixed, 95% CI) | 2.58 [1.06, 4.10] |
| 2.1 Singleton pregnancy | 3 | 1052 | Mean Difference (IV, Fixed, 95% CI) | 3.03 [1.38, 4.68] |
| 2.2 Multiple pregnancy | 1 | 569 | Mean Difference (IV, Fixed, 95% CI) | 0.10 [‐3.77, 3.97] |
| 3 Preterm birth (< 37 weeks) Show forest plot | 5 | 1916 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.91 [0.78, 1.07] |
| 3.1 Singleton pregnancy | 5 | 1347 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.79 [0.61, 1.04] |
| 3.2 Multiple pregnancy | 1 | 569 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.01 [0.84, 1.21] |
| 4 Prolonged gestation (> 42 weeks) Show forest plot | 1 | 533 | Risk Ratio (M‐H, Random, 95% CI) | 1.19 [0.73, 1.93] |
| 4.1 Singleton pregnancy | 1 | 533 | Risk Ratio (M‐H, Random, 95% CI) | 1.19 [0.73, 1.93] |
| 4.2 Multiple pregnancy | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 5 Birthweight (gm) Show forest plot | 3 | 2440 | Mean Difference (IV, Fixed, 95% CI) | 47.99 [1.81, 94.18] |
| 5.1 Singleton pregnancy | 3 | 1318 | Mean Difference (IV, Fixed, 95% CI) | 72.11 [11.73, 132.50] |
| 5.2 Multiple pregnancy | 1 | 1122 | Mean Difference (IV, Fixed, 95% CI) | 14.0 [‐57.68, 85.68] |
| 6 Birthweight < 2500 g Show forest plot | 5 | 2302 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.99 [0.88, 1.12] |
| 6.1 Singleton pregnancy | 5 | 1180 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.98 [0.77, 1.24] |
| 6.2 Multiple pregnancy | 1 | 1122 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.00 [0.87, 1.15] |
| 7 Small‐for‐gestational age Show forest plot | 1 | 1374 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.13 [0.96, 1.34] |
| 7.1 Singleton pregnancy | 1 | 263 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.17 [0.81, 1.69] |
| 7.2 Multiple pregnancy | 1 | 1111 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.12 [0.93, 1.35] |
| 8 Stillbirth (= or > 24 weeks) Show forest plot | 3 | 828 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.76 [0.17, 3.41] |
| 8.1 Singleton pregnancy | 3 | 828 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.76 [0.17, 3.41] |
| 8.2 Multiple pregnancy | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 9 Neonatal death Show forest plot | 3 | 2303 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.17 [0.41, 3.29] |
| 9.1 Singleton pregnancy | 3 | 1724 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.01 [0.32, 3.24] |
| 9.2 Multiple pregnancy | 1 | 579 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.01 [0.18, 22.01] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Pre‐eclampsia (hypertension with proteinuria) Show forest plot | 4 | 1683 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.87 [0.59, 1.28] |
| 1.1 Low/moderate risk at trial entry | 3 | 1130 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.01 [0.52, 1.98] |
| 1.2 High risk at trial entry | 2 | 553 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.80 [0.50, 1.29] |
| 2 Length of gestation (days) Show forest plot | 3 | 1621 | Mean Difference (IV, Fixed, 95% CI) | 2.58 [1.06, 4.10] |
| 2.1 Low/moderate risk at trial entry | 3 | 1393 | Mean Difference (IV, Fixed, 95% CI) | 2.23 [0.67, 3.80] |
| 2.2 High risk at trial entry | 1 | 228 | Mean Difference (IV, Fixed, 95% CI) | 8.5 [2.05, 14.95] |
| 3 Preterm birth (< 37 weeks) Show forest plot | 5 | 1916 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.91 [0.78, 1.07] |
| 3.1 Low/moderate risk at trial entry | 3 | 1393 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.95 [0.80, 1.13] |
| 3.2 High risk at trial entry | 3 | 523 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.82 [0.60, 1.12] |
| 4 Prolonged gestation (> 42 weeks) Show forest plot | 1 | 533 | Risk Ratio (M‐H, Random, 95% CI) | 1.19 [0.73, 1.93] |
| 4.1 Low/moderate risk at trial entry | 1 | 533 | Risk Ratio (M‐H, Random, 95% CI) | 1.19 [0.73, 1.93] |
| 4.2 High risk at trial entry | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 5 Birthweight (gm) Show forest plot | 3 | 2440 | Mean Difference (IV, Fixed, 95% CI) | 48.01 [1.81, 94.20] |
| 5.1 Low/moderate risk at trial entry | 3 | 1946 | Mean Difference (IV, Fixed, 95% CI) | 55.79 [4.83, 106.74] |
| 5.2 High risk at trial entry | 1 | 494 | Mean Difference (IV, Fixed, 95% CI) | 12.11 [‐97.34, 121.56] |
| 6 Low birthweight (< 2500 g) Show forest plot | 4 | 2202 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.00 [0.89, 1.13] |
| 6.1 Low/moderate risk at trial entry | 2 | 1413 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.99 [0.87, 1.13] |
| 6.3 High risk at trial entry | 3 | 789 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.03 [0.80, 1.33] |
| 7 Small‐for‐gestational age Show forest plot | 1 | 1374 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.13 [0.96, 1.34] |
| 7.1 Low/moderate risk at trial entry | 1 | 1111 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.12 [0.93, 1.35] |
| 7.2 High risk at trial entry | 1 | 263 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.17 [0.81, 1.69] |
| 8 Stillbirth (= or > 24 weeks) Show forest plot | 3 | 828 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.76 [0.17, 3.41] |
| 8.1 Low/moderate risk at trial entry | 1 | 533 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.00 [0.06, 15.96] |
| 8.2 High risk at trial entry | 2 | 295 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.68 [0.11, 4.08] |
| 9 Neonatal death Show forest plot | 3 | 2303 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.17 [0.41, 3.29] |
| 9.1 Low/moderate risk at trial entry | 1 | 579 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.01 [0.18, 22.01] |
| 9.2 High risk at trial entry | 3 | 1724 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.01 [0.32, 3.24] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Pre‐eclampsia (hypertension with proteinuria) Show forest plot | 4 | 1683 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.86 [0.59, 1.27] |
| 1.1 Fish oil | 3 | 1583 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.61, 1.37] |
| 1.2 Evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 1.3 Fish oil + evening primrose oil | 1 | 100 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.4 [0.08, 1.97] |
| 2 Length of gestation (days) Show forest plot | 3 | 1621 | Mean Difference (IV, Fixed, 95% CI) | 2.55 [1.01, 4.09] |
| 2.1 Fish oil | 3 | 1621 | Mean Difference (IV, Fixed, 95% CI) | 2.55 [1.01, 4.09] |
| 2.2 Evening primrose oil | 0 | 0 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 2.3 Fish oil + evening primrose oil | 0 | 0 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 3 Preterm birth (< 37 weeks) Show forest plot | 5 | 1916 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.79, 1.07] |
| 3.1 Fish oil | 5 | 1916 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.79, 1.07] |
| 3.2 Evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 3.3 Fish oil + evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 4 Prolonged gestation (> 42 weeks) Show forest plot | 2 | 1970 | Risk Ratio (M‐H, Random, 95% CI) | 1.68 [0.77, 3.66] |
| 4.1 Fish oil | 2 | 1970 | Risk Ratio (M‐H, Random, 95% CI) | 1.68 [0.77, 3.66] |
| 4.2 Evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 4.3 Fish oil + evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 5 Birthweight (gm) Show forest plot | 3 | 2440 | Mean Difference (IV, Fixed, 95% CI) | 47.24 [1.05, 93.44] |
| 5.1 Fish oil | 3 | 2440 | Mean Difference (IV, Fixed, 95% CI) | 47.24 [1.05, 93.44] |
| 5.2 Evening primrose oil | 0 | 0 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 5.3 Fish oil + evening primrose oil | 0 | 0 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 6 Low birthweight (< 2500 g) Show forest plot | 5 | 1180 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.98 [0.77, 1.24] |
| 6.1 Fish oil | 4 | 1080 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.01 [0.79, 1.28] |
| 6.2 Evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 6.3 Fish oil + evening primrose oil | 1 | 100 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.4 [0.08, 1.97] |
| 7 Small‐for‐gestational age Show forest plot | 1 | 1374 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.13 [0.96, 1.34] |
| 7.1 Fish oil | 1 | 1374 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.13 [0.96, 1.34] |
| 7.2 Evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 7.3 Fish oil + evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 8 Stillbirth (= or > 24 weeks) Show forest plot | 4 | 2802 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.85 [0.46, 1.57] |
| 8.1 Fish oil | 4 | 2802 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.85 [0.46, 1.57] |
| 8.2 Evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 8.3 Fish oil + evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 9 Neonatal death Show forest plot | 3 | 2303 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.17 [0.41, 3.29] |
| 9.1 Fish oil | 3 | 2303 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.17 [0.41, 3.29] |
| 9.2 Evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 9.3 Fish oil + evening primrose oil | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |

