Tratamiento guiado por péptidos natriuréticos para la prevención de eventos cardiovasculares en pacientes sin insuficiencia cardíaca
Resumen
Antecedentes
Las enfermedades cardiovasculares (ECV) son la causa principal de morbilidad y mortalidad en todo el mundo. La intervención temprana para las personas con un riesgo cardiovascular alto es crucial para mejorar los resultados de los pacientes. Las estrategias de prevención tradicionales de las ECV se han centrado en los factores de riesgo convencionales, como el sobrepeso, la dislipidemia, la diabetes y la hipertensión, que pueden reflejar el potencial de lesiones cardiovasculares. Los péptidos natriuréticos (PN), que incluyen el péptido natriurético tipo B (o péptido natriurético cerebral, PNC) y la porción N‐terminal del pro‐péptido natriurético tipo B (NT‐proPNC), son biomarcadores bien establecidos para la detección y la evaluación diagnóstica de la insuficiencia cardíaca. Son de interés para la prevención de las ECV debido a que son secretados por el corazón como una respuesta protectora al estrés, la tensión y el daño cardiovascular. Por lo tanto, la medición de los niveles de PN en pacientes sin insuficiencia cardíaca puede ser valiosa para la estratificación del riesgo, con el fin de identificar a los que están en mayor riesgo de ECV y que obtendrían un beneficio mayor a partir de las medidas intensivas de reducción del riesgo.
Objetivos
Evaluar los efectos del tratamiento guiado por péptidos natriuréticos (PN) para los pacientes con factores de riesgo cardiovasculares y sin insuficiencia cardíaca.
Métodos de búsqueda
Se realizaron búsquedas en las siguientes bases de datos bibliográficas hasta el 9 de julio de 2019: CENTRAL, MEDLINE, Embase y Web of Science. También se realizaron búsquedas en tres registros de ensayos clínicos en julio de 2019.
Criterios de selección
Se incluyeron ensayos controlados aleatorizados en adultos con uno o más factores de riesgo cardiovasculares y sin insuficiencia cardíaca, que comparaban el cribado basado en el PN y el tratamiento guiado por PN posterior versus atención estándar en todos los ámbitos (es decir, comunidad, hospital).
Obtención y análisis de los datos
Dos autores de la revisión examinaron los títulos y los resúmenes y seleccionaron los estudios para su inclusión, extrajeron los datos y evaluaron el riesgo de sesgo de forma independiente. Se calcularon los cocientes de riesgos (CR) para los datos dicotómicos, y las diferencias de medias (DM) con intervalos de confianza (IC) del 95% para los datos continuos. Se estableció contacto con los autores de los ensayos para obtener los datos que faltaban y para verificar las características cruciales del estudio. La calidad de la evidencia fue evaluada por dos autores de revisión de forma independiente mediante los criterios Grading of Recommendations Assessment, Development and Evaluation (GRADE) y se utilizó GRADE profiler (GRADEPRO) para importar los datos de Review Manager y crear tablas de «Resumen de resultados».
Resultados principales
Se incluyeron dos ensayos controlados aleatorizados (tres informes) con 1674 participantes, con una media de edad de entre 64,1 y 67,8 años. El seguimiento varió de 2 años a una media de 4,3 años.
Para las medidas de resultado primarias, las estimaciones del efecto de un único estudio mostraron incertidumbre en cuanto al efecto del tratamiento guiado por PN en la mortalidad cardiovascular en pacientes con factores de riesgo cardiovasculares y sin insuficiencia cardíaca (CR 0,33; IC del 95%: 0,04 a 3,17; 1 estudio; 300 participantes; evidencia de calidad baja). El análisis agrupado demostró que, en comparación con la atención estándar, el tratamiento guiado por PN probablemente reduce el riesgo de hospitalización por causas cardiovasculares (CR 0,52; IC del 95%: 0,40 a 0,68; dos estudios; 1674 participantes; evidencia de calidad moderada). Estas cifras corresponden a un riesgo de 163 por 1000 en el grupo de control y de 85 (IC del 95%: 65 a 111) por 1000 en el grupo de tratamiento guiado por PN.
Cuando se evaluaron las medidas de resultado secundarias, la evidencia de un análisis agrupado mostró incertidumbre sobre el efecto del tratamiento guiado por PN en la mortalidad por todas las causas (CR 0,90; IC del 95%: 0,60 a 1,35; dos estudios; 1354 participantes; evidencia de calidad baja). El análisis agrupado indica que el tratamiento guiado por PN probablemente reduce el riesgo de hospitalización por todas las causas (CR 0,83; IC del 95%: 0,75 a 0,92; dos estudios; 1354 participantes; evidencia de calidad moderada). Estas cifras corresponden a un riesgo de 601 por 1000 en el grupo de control y 499 (IC del 95%: 457 a 553) por 1000 en el grupo de tratamiento guiado por PN. La estimación del efecto de un único estudio indica que el tratamiento guiado por PN redujo el riesgo de disfunción ventricular (CR 0,61; IC del 95%: 0,41 a 0,91; 1374 participantes; evidencia de calidad alta). El riesgo en el grupo de control de este estudio fue de 87 por 1000; en comparación con 53 (IC del 95%: 36 a 79) por 1000 con el tratamiento guiado por PN. Los resultados del mismo estudio muestran que el tratamiento guiado por PN no afecta el cambio en el nivel de PN al final del seguimiento, en relación con la atención estándar (DM ‐4,06 pg/mL; IC del 95%: ‐15,07 a 6,95; un estudio; 1374 participantes; evidencia de calidad moderada).
Conclusiones de los autores
Esta revisión muestra que es probable que el tratamiento guiado por PN reduzca la disfunción ventricular y la hospitalización cardiovascular y por todas las causas para los pacientes con factores de riesgo cardiovasculares y que no presentan insuficiencia cardíaca. Existe una menor seguridad en cuanto a los efectos sobre la mortalidad y los niveles de péptidos natriuréticos. Ninguno de los estudios incluidos tuvo poder estadístico para evaluar la mortalidad. La evidencia disponible muestra incertidumbre con respecto a los efectos del tratamiento guiado por PN sobre la mortalidad cardiovascular y la mortalidad por todas las causas; y los números de eventos muy reducidos dieron lugar a un grado alto de imprecisión en estas estimaciones del efecto. La evidencia también muestra que el tratamiento guiado por PN puede no afectar el nivel de PN al final del seguimiento.
Debido a que ambos ensayos incluidos en esta revisión eran estudios pragmáticos, la falta de cegamiento de los pacientes y las prácticas pueden haber sesgado los resultados hacia un hallazgo de equivalencia. Se necesitan estudios adicionales que incluyan tamaños de la muestra con un poder estadístico más adecuado y con una duración mayor del seguimiento para evaluar el efecto del tratamiento guiado por PN sobre la mortalidad. Debido a que hay dos ensayos en curso, uno de los cuales es un ensayo multicéntrico de gran tamaño, se espera que las iteraciones futuras de esta revisión se beneficien a partir de los tamaños de la muestra más grandes en un área geográfica más amplia.
PICO
Resumen en términos sencillos
Tratamiento guiado por péptidos natriuréticos para la prevención de la muerte y los eventos cardiovasculares en pacientes con factores de riesgo de cardiopatía
Pregunta de la revisión
Se deseaba saber si el tratamiento guiado por péptidos natriuréticos (PN) es mejor que la atención habitual para prevenir la muerte y los eventos cardiovasculares en pacientes con factores de riesgo de cardiopatía pero sin insuficiencia cardíaca.
Antecedentes
Las enfermedades cardiovasculares (ECV) son un grupo de afecciones del corazón y los vasos sanguíneos. Son las causas principales de muerte evitable en todo el mundo. Los factores de riesgo que aumentan la probabilidad de que una persona desarrolle ECV incluyen diabetes, presión arterial alta, nivel alto de colesterol y obesidad. Los péptidos natriuréticos (PN) son hormonas producidas por el corazón que se miden en la sangre. Ayudan al cuerpo a eliminar líquidos, a relajar los vasos sanguíneos y a canalizar el sodio en la orina. Cuando el corazón presenta daños, el cuerpo libera más PN para tratar de aliviar la tensión en el corazón. Al medir los niveles de PN en la sangre de una persona, es posible identificar a las que presentan un daño establecido en su corazón y que están en mayor riesgo de muerte y eventos cardiovasculares como ataque cardíaco y accidente cerebrovascular. Luego es posible utilizar esta información para reducir el riesgo cardiovascular del paciente al guiar las decisiones sobre su cuidado cardiovascular (tratamiento guiado por PN), como qué medicamentos se les deben administrar, qué investigaciones necesitan y qué ajustes deben realizar en su estilo de vida.
Características de los estudios
La evidencia de esta revisión está actualizada hasta julio 2019. Se incluyeron dos ensayos controlados aleatorizados (en los que los participantes tienen la misma probabilidad de ser asignados a cualquiera de los tratamientos) con 1674 participantes adultos que presentaban uno o más factores de riesgo de desarrollo de ECV los cuales comparaban el tratamiento guiado por PN con la atención estándar. Se excluyó a los pacientes con síntomas de insuficiencia cardíaca. La media de edad de los participantes varió entre 64,1 y 67,8 años. Los pacientes recibieron un seguimiento de entre 2 años y una media de 4,2 años.
Resultados clave
Aún no se conocen los efectos del tratamiento guiado por PN sobre la muerte debido a ECV o por cualquier otra razón, debido a que los resultados fueron imprecisos. La evidencia de calidad moderada indica que el tratamiento guiado por PN probablemente reduce el número de hospitalizaciones debido a los eventos cardiovasculares y por todas las causas en pacientes con factores de riesgo cardiovasculares. Se esperaría que de 1000 pacientes que recibieron atención estándar, 163 fueran ingresados en el hospital como resultado de un evento cardiovascular, en comparación con entre 65 a 111 pacientes que recibieron tratamiento guiado por PN. De 1000 pacientes con factores de riesgo cardiovasculares que recibieron atención estándar, 601 serían ingresados al hospital por cualquier motivo, en comparación con entre 457 y 553 pacientes que recibieron tratamiento guiado por PN.
La evidencia de calidad alta indica que el tratamiento guiado por PN reduce el riesgo de disfunción ventricular (una afección que a menudo da lugar a insuficiencia cardíaca) en comparación con la atención estándar. Los resultados sugieren que de 1000 pacientes con factores de riesgo cardiovasculares que recibieron atención estándar, 87 desarrollarían disfunción ventricular, en comparación con entre 36 y 79 pacientes que recibieron tratamiento guiado por PN. No hay evidencia que sugiera que el tratamiento guiado por PN afectó el nivel de PN al final de los estudios.
Calidad de la evidencia
La calidad de la evidencia varió de baja a alta en todos los resultados. Las razones de preocupación principales en cuanto a la calidad de la evidencia incluyeron el riesgo de sesgo, debido a que los pacientes y el personal médico que los atendía sabían si estaban en el grupo de control o de intervención, lo cual puede haber afectado la atención que recibieron; algunos resultados obtenidos fueron imprecisos, y no está claro si la intervención fue beneficiosa o perjudicial. Debido a que solo se identificaron dos estudios adecuados para su inclusión en esta revisión, la generalizabilidad de la misma es limitada.
Conclusiones de los autores
Summary of findings
| Natriuretic peptide‐guided treatment compared to standard care for the prevention of cardiovascular events in patients without heart failure | ||||||
| Patient or population: patients without heart failure | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | No. of participants | Certainty of the evidence | Comments | |
| Risk with standard care | Risk with natriuretic peptide‐guided treatment | |||||
| Cardiovascular mortality Follow‐up: 2 years | Study population | RR 0.33 | 300 | ⊕⊕⊝⊝ | Cardiovascular deaths not available, so cardiac deaths used | |
| 20 per 1000 | 7 per 1000 | |||||
| Cardiovascular hospitalisation (as defined by trialists) Follow‐up range: 2 years to mean 4.2 years | Study population | RR 0.52 | 1674 | ⊕⊕⊕⊝ | ||
| 163 per 1000 | 85 per 1000 | |||||
| All‐cause mortality | Study population | RR 0.90 | 1354 | ⊕⊕⊝⊝ | ||
| 60 per 1000 | 54 per 1000 | |||||
| All‐cause hospitalisation (all occurrences) | Study population | RR 0.83 | 1354 | ⊕⊕⊕⊝ | ||
| 601 per 1000 | 499 per 1000 | |||||
| Ventricular dysfunction (as defined by trialists) | Study population | RR 0.61 | 1374 | ⊕⊕⊕⊕ | Ventricular dysfunction was defined by trialists as left ventricular dysfunction and heart failure. Left ventricular dysfunction (LVD) included all patients with asymptomatic left ventricular systolic dysfunction (LVSD) and/or asymptomatic left ventricular diastolic dysfunction (LVDD). Heart failure included all patients with LVD (LVSD and/or LVDD) and with symptoms of heart failure requiring emergency admission to hospital | |
| 87 per 1000 | 53 per 1000 | |||||
| Change in NP level at the end of follow‐up | Mean change in NP level at the end of follow‐up was 9.52 pg/mL | MD 4.06 pg/mL higher | ‐ | 1374 | ⊕⊕⊕⊝ | These data come from Ledwidge 2013; NP level was reported as BNP. Huelsmann 2013 also reported change in NT‐proBNP after 1 year of treatment. However, these data were presented as median and interquartile range; therefore we could not calculate mean difference |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aImprecision: very wide 95% confidence interval, which includes the line of null effect and is consistent with the possibility of both important benefits and harms. The sample size is small. Downgraded by two levels. bRisk of bias: both studies did not blind patients or personnel. Downgraded by one level. cImprecision: wide 95% confidence interval, which includes the line of null effect and is consistent with the possibility of important benefits and harms. Downgraded by one level. dRisk of bias: downgraded by one level due to attrition bias as one study excluded from analysis patients who were lost to follow‐up and those who withdrew, who did not have at least one year of detailed follow‐up cost data. eRisk of bias: echocardiographer and cardiologist reviewing end of study echo were blinded and diagnosis of ventricular dysfunction was based on clearly defined echocardiographic measures, which removed subjectivity in outcome assessment. Not downgraded. fImprecision: wide CIs that cross the line of no effect (zero) and include the possibility of the intervention causing both benefit and harm. Downgraded by one level. | ||||||
Antecedentes
Descripción de la afección
La enfermedad cardiovascular (ECV) se refiere a un grupo amplio de trastornos que afectan el corazón y los vasos sanguíneos (OMS 2013); es la causa principal de mortalidad y morbilidad a nivel mundial y sigue siendo la causa principal de muerte evitable (Santulli 2013; OMS 2016). Se estima que 17 500 000 de personas murieron por ECV en 2012; lo que representa el 31% de todas las muertes a nivel global (OMS 2016). En Europa, cerca de la mitad de todas las muertes son causadas por ECV (Nichols 2014), y el coste estimado para la economía de la UE es de 169 mil millones de euros por año (HERC 2012).
La prevalencia de las ECV aumentará aún más como resultado de la epidemia de obesidad, diabetes, hipertensión y dislipidemia (alteraciones en el metabolismo de los lípidos que provocan cambios en la función o los niveles de las lipoproteínas en plasma) (Go 2014; Piepoli 2016; Santulli 2013). Una cuarta parte de los adultos de 50 años de edad tienen al menos un factor de riesgo para el desarrollo de ECV (Lloyd‐Jones 2006). Según la American Heart Association, casi el 35% de los adultos de los Estados Unidos tienen obesidad (índice de masa corporal [IMC] ≥ 30 kg/m²), casi el 40% presenta dislipidemia, el 33% presenta hipertensión, el 8,3% tiene diabetes y el 38% presenta niveles anormales de glucosa en ayunas o prediabetes (Go 2014). Entre las personas sin ECV a los 50 años de edad, más de la mitad de los hombres y casi el 40% de las mujeres desarrollarán ECV durante el resto de su vida (Lloyd‐Jones 2006). La diabetes confiere el mayor riesgo de por vida de ECV de cualquier factor de riesgo (Lloyd‐Jones 2006), y la hipertensión, la dislipidemia y la obesidad también se identifican como factores que indican un mayor riesgo (Go 2014; Lloyd‐Jones 2006; Piepoli 2016; Santulli 2013).
La ECV es una enfermedad que se presenta durante el curso de la vida y que comienza con factores de riesgo (por ejemplo, hipertensión, dislipidemia) que con el tiempo pueden contribuir al desarrollo de una enfermedad subclínica (Berenson 1998). Sin un control adecuado de los factores de riesgo, las ECV subclínicas se transforman más rápidamente en ECV manifiesta, lo que significa que la identificación temprana de los pacientes en alto riesgo es crucial para mejorar el pronóstico del paciente (Kuller 1995; OMS 2016).
Las intervenciones tradicionales sobre factores de riesgo para la prevención de las ECV y los eventos cardiovasculares han logrado reducciones en la morbilidad y mortalidad cardiovascular en las poblaciones de riesgo (Ebrahim 2011; Nadir 2012). A pesar de estos esfuerzos, sigue existiendo un riesgo residual de desarrollo de ECV que no se puede prevenir al dirigirse a los factores de riesgo tradicionales (Olsen 2007; Wang 2006). Un estudio estimó que incluso entre los pacientes con un control óptimo de los factores de riesgo, el 43% de los eventos coronarios seguirían ocurriendo (Chiuve 2006). En pacientes con diabetes, los enfoques actuales para el control del factor de riesgo cardiovascular no parecen atenuar el riesgo futuro de insuficiencia cardíaca (Rawshani 2018). Por lo tanto, existe una brecha clara entre la prevención primaria y secundaria de las ECV que no es considerada de forma adecuada con el enfoque tradicional de control de los factores de riesgo.
Descripción de la intervención
La intervención incluida en esta revisión es la aplicación de los niveles de péptido natriurético cerebral (PNC) circulante y de la porción N‐terminal del pro‐péptido natriurético tipo B (NT‐proPNC) para estratificar el riesgo de los pacientes con ECV establecida, pero sin insuficiencia cardíaca, para un tratamiento cardiovascular más intensivo.
Los biomarcadores como la troponina 1; la proteína C reactiva y los péptidos natriuréticos (PN) (PNC y NT‐proPNC) han surgido como complementos potencialmente importantes para la evaluación del riesgo cardiovascular tradicional (Zethelius 2008). El PNC y la NT‐proPNC presentan una utilidad demostrada para el diagnóstico y el pronóstico de pacientes con insuficiencia cardíaca (Clerico 2004; Eurlings 2010; Groenning 2004; Januzzi 2011; Ponikowski 2016), y una revisión Cochrane reciente encontró que el tratamiento guiado por PNC para pacientes con insuficiencia cardíaca puede reducir el número de hospitalizaciones relacionadas con la insuficiencia cardíaca (McLellan 2016). Estos PN también han demostrado una alta potencia independiente en la predicción de eventos CV y mortalidad en pacientes sin insuficiencia cardíaca y en la detección de disfunción ventricular izquierda (DVI) en pacientes asintomáticos y sintomáticos (Christenson 2010; McDonagh 1998; Tarnow 2006; Tonkin 2015; Wang 2004; Welsh 2012).
McDonagh y colegas propusieron por primera vez la medición del PN como un método de cribado para la identificación de la disfunción sistólica del ventrículo izquierdo (DSVI) en la población general (McDonagh 1998). En su estudio, demostraron que casi la mitad de los diagnosticados con DSVI mediante ecocardiografía eran asintomáticos, y que los niveles de PN eran elevados tanto en pacientes asintomáticos como sintomáticos. Se calculó que los niveles normales de PNC en esta población eran < 18 pg/mL, y otros estudios han demostrado que los niveles más altos de PN se asocian con un mayor riesgo de eventos CV, mortalidad y DSVI (Kara 2014; McDonagh 1998; Wang 2004). Numerosos estudios posteriores han reiterado la efectividad del cribado del PN para detectar la disfunción ventricular (Betti 2009; McGrady 2013; Ng 2005).
El cribado del PN proporciona una estrategia factible mediante la cual se puede detectar la insuficiencia cardíaca mucho antes en su historia natural, antes de que se desarrolle una enfermedad sintomática más avanzada (McDonagh 2002). Sin embargo, el cribado generalizado de la población requiere muchos recursos y es poco probable que sea efectivo en función de los costes. Varios estudios han demostrado la relación coste‐efectividad del cribado del PN para la ECV en subgrupos de alto riesgo, como los que presentan hipertensión, cardiopatía isquémica o diabetes (Heidenreich 2004; Ledwidge 2015; Nielsen 2003).
Ledwidge y colegas fueron los primeros en integrar el cribado del PN en la comunidad para la estratificación del riesgo de los pacientes con estrategias diagnósticas y terapéuticas intensivas (Ledwidge 2013). En este estudio, los pacientes con PNC elevado recibieron atención multidimensional colaborativa entre el médico de atención primaria y el cardiólogo. Este enfoque de atención colaborativa redujo las tasas de DVI e insuficiencia cardíaca, así como las hospitalizaciones de urgencia a causa de eventos adversos cardiovasculares graves (EACG). En un estudio posterior de pacientes con diabetes, Huelsmann y sus compañeros de trabajo utilizaron un NT‐proPNC elevado para seleccionar a los pacientes para la atención habitual, o una intervención que incluía el aumento de la dosis dirigido por el cardiólogo de los tratamientos modificadores del sistema renina‐angiotensina‐aldosterona (SRAA) y betabloqueantes en dosis máximas (Huelsmann 2013). Aunque existe heterogeneidad en las poblaciones estudiadas, las intervenciones aplicadas y los umbrales de la prueba de PN utilizados, el tratamiento guiado por PN para la prevención de la insuficiencia cardíaca se ha incorporado en las guías, incluidas las American Heart Association/American College of Cardiology Guidelines on Heart Failure (Yancy 2017) de 2017 y las Canadian Cardiovascular Society Heart Failure Management Guidelines de 2017 (Ezekowitz 2017).
Esta revisión intentó determinar si el tratamiento guiado por PN para los pacientes con factores de riesgo cardiovasculares y sin insuficiencia cardíaca mejorará la morbilidad y la mortalidad versus la atención estándar (definida como atención local basada en las guías, incluida la modificación de las intervenciones farmacológicas, educativas y del estilo de vida, sin tener en cuenta el nivel de PN).
De qué manera podría funcionar la intervención
La modulación de los factores de riesgo tradicionales (p.ej. hipertensión, dislipidemia) ha mejorado los resultados cardiovasculares en individuos en riesgo, aunque se sigue observando un riesgo residual (Ebrahim 2011; Krogsbøll 2012).
El PNC y la porción NT‐proPNC biológicamente inactiva son miembros de la familia de los PN que son liberados por los cardiomiocitos en respuesta a varios estímulos, que incluyen el estiramiento de los miocitos debido a la expansión del volumen y la sobrecarga de presión, la isquemia (reducción del suministro de sangre a las arterias coronarias del corazón), la fibrosis y la inflamación (Maeda 1998; Phelan 2012; Sabatine 2004; Yoshimura 1993). Como los PN indican una respuesta fisiológica al estrés, la tensión o el daño cardiovascular establecido, agregan un poder predictivo a los factores de riesgo convencionales, lo cual refleja en gran medida el potencial de lesiones cardiovasculares (McGrady 2013; Onodera 2012; Tarnow 2006; Wang 2004).
Los aumentos en la concentración de PNC/NT‐proPNC en plasma tienen implicaciones diagnósticas y pronósticas para poblaciones seleccionadas, como se ha demostrado inicialmente en la insuficiencia cardíaca, y posteriormente en la enfermedad en estadio temprano y asintomática (Eurlings 2010; Gardner 2003; Kearley 2011). En algunos estudios, los PN han mostrado superioridad sobre los factores de riesgo tradicionales de ECV, como la hipercolesterolemia y la hipertensión, para identificar a los pacientes en riesgo de insuficiencia cardíaca (Clerico 2007), síndrome coronario agudo (Glaser 2011; Scirica 2011) y cardiopatía coronaria (Mishra 2014). Por lo tanto, la medición de los niveles de PN para identificar a los pacientes en mayor riesgo de eventos cardiovasculares, seguida de una reducción intensiva dirigida del riesgo (que incluye farmacoterapia, estrategias de diagnóstico e investigación, e intervenciones educativas y del estilo de vida), puede reducir la ocurrencia de mortalidad y morbilidad, incluidos los EACG, en esta población. Aunque es la variable de evaluación utilizada más comúnmente para la investigación cardiovascular, no existe una definición estándar de EACG, y los resultados individuales utilizados para crear esta variable de evaluación compuesta varían según el estudio (Kip 2008).
Por qué es importante realizar esta revisión
El tratamiento guiado por PN para la optimización del tratamiento de la insuficiencia cardíaca está bien establecido (Ponikowski 2016; Yancy 2013), y el mismo es el tema de otra revisión Cochrane (McLellan 2016). Está surgiendo evidencia en cuanto al uso de los PN para identificar y administrar una intervención dirigida a una población de riesgo, aunque este enfoque a la prevención de la ECV y la insuficiencia cardíaca todavía no forma parte de la atención clínica habitual.
Las Canadian Cardiovascular Society Heart Failure Management Guidelines de 2017 sugieren que en individuos con riesgo de desarrollo de insuficiencia cardíaca (IC), "un PNC > 50 pg/mL o NT‐proPNC > 125 pg/mL debe provocar una solicitud de consulta con especialistas y pruebas de imágenes, o la iniciación o intensificación de agentes de bloqueo neurohormonal e intervenciones del estilo de vida" (Ezekowitz 2017). Las American Guidelines for the Management of Heart Failure de 2017 emitieron una recomendación "moderada" de que "para los pacientes en riesgo de desarrollo de insuficiencia cardíaca, el cribado basado en el PN seguido de la atención en equipo puede ser útil para prevenir el desarrollo de disfunción ventricular izquierda (sistólica o diastólica) o de insuficiencia cardíaca de nueva aparición" (Yancy 2017).
Debido a la escasez de evidencia científica y a la experiencia clínica limitada en esta área, es difícil que las guías proporcionen a los médicos un consenso claro o recomendaciones específicas sobre el cribado del PN. En esta revisión, se desea recopilar y, a través del metanálisis, fortalecer el grupo de evidencia existente para este enfoque a la prevención de las ECV, permitiendo así que se hagan recomendaciones más claras.
Objetivos
Evaluar los efectos del tratamiento guiado por péptidos natriuréticos (PN) para los pacientes con factores de riesgo cardiovasculares y sin insuficiencia cardíaca.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron todos los ensayos controlados aleatorizados (ECA).
Tipos de participantes
Se incluyeron adultos (≥ 18 años de edad) con factores de riesgo para el desarrollo de ECV. Se consideraron los siguientes factores de riesgo:
-
Hipertensión.
-
Dislipidemia.
-
Obesidad (IMC ≥ 30 kg/m²).
-
Síndrome metabólico.
-
Enfermedad vascular.
-
Diabetes mellitus.
-
Fibrilación auricular.
-
Cardiopatía valvular.
-
Niveles elevados de PN, definidos como PNC > 35 pg/mL, o NT‐proPNC > 125 pg/mL, o ambos (según lo considerado por la European Society of Cardiology como el límite superior de lo normal en el contexto de la insuficiencia cardíaca no aguda [Ponikowski 2016]). Se incluyó el PN medido con cualquier prueba.
No se consideraron los factores de riesgo del estilo de vida, como el estilo de vida sedentario, la dieta, el hábito de fumar y la ingesta de alcohol. Se incluyeron todos los ámbitos de atención sanitaria (es decir, hospital, comunidad). Se excluyó a los pacientes con insuficiencia cardíaca sintomática al inicio del estudio, diagnosticados mediante un estándar de referencia establecido, como ecocardiografía, imagenología de resonancia magnética cardíaca o la opinión de especialistas basado en criterios de referencia (p.ej. Framingham) (McKee 1971), o una combinación de los mismos. Al inicio, se excluyó a los pacientes que estaban siendo investigados en cuanto a un posible diagnóstico de insuficiencia cardíaca sintomática y a los pacientes con cualquier evidencia de disfunción sistólica asintomática del ventrículo izquierdo (fracción de eyección del ventrículo izquierdo < 50%) al inicio del estudio. Se estableció contacto con los autores de los estudios para obtener datos sobre los subgrupos descritos en el protocolo; sin embargo, no se recibieron datos adicionales de estos autores.
Tipos de intervenciones
Se incluyeron ECA que comparaban el cribado (screening) basado en el PN (para identificar a los pacientes en mayor riesgo de desarrollar un evento cardiovascular) y el tratamiento guiado por PN posterior versus atención estándar. El tratamiento guiado por PN incluye la modificación y optimización del tratamiento farmacológico (según lo definieron los autores de los ensayos), estrategias de diagnóstico e investigación, e intervenciones educativas y del estilo de vida basadas en los niveles de PN, es decir, complementarias a la atención proporcionada en el grupo de control. Se incluyeron estudios con cualquier elemento del tratamiento guiado por PN. Se definió la atención estándar como la atención local basada en guías, incluida la modificación de las intervenciones farmacológicas, educativas y del estilo de vida, sin tener en cuenta el nivel de PN del participante.
Tipos de medida de resultado
Resultados primarios
-
Mortalidad cardiovascular (según la definición de los autores de los ensayos)
-
Hospitalización por causas cardiovasculares (según la definición de los autores de los ensayos)
Resultados secundarios
-
Mortalidad por todas las causas
-
Hospitalización por todas las causas (todos los casos)
-
Disfunción ventricular (según la definición de los autores de los ensayos)
-
Cambio en el nivel del PN al finalizar el seguimiento
Se utilizaron las definiciones empleadas por los investigadores del estudio bajo consideración.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
The Information Specialist from the Cochrane Heart Group conducted systematic searches of the following databases for RCTs without language, publication year, or publication status restrictions (all searches conducted 9 July 2019; search strategies provided in Appendix 1).
-
Cochrane Central Register of Controlled Trials (CENTRAL; 2019, Issue 7), in the Cochrane Library.
-
Epub Ahead of Print, In‐Process & Other Non‐Indexed Citations, MEDLINE Daily, and MEDLINE (Ovid, 1946 to 8 July 2019).
-
Embase (Ovid, 1980 to 2019 week 27).
-
Conference Proceedings Citation Index ‐ Science (CPCI‐S) Web of Science (Thomson Reuters, 1990 to 9 July 2019).
The Information Specialist applied the Cochrane sensitivity‐maximising RCT filter to MEDLINE (Ovid) and adaptations of it to Embase and Web of Science (Lefebvre 2011).
We also conducted searches of ClinicalTrials.gov (www.ClinicalTrials.gov) (9 July 2019), the World Health Organization (WHO) International Clinical Trials Registry Platform (ICTRP) Search Portal (apps.who.int/trialsearch) (9 July 2019), and the EU Clinical Trials Register (www.clinicaltrialsregister.eu) (14 July 2019) for ongoing or unpublished trials.
Búsqueda de otros recursos
We checked reference lists of all primary studies and reviewed articles for additional references. We checked for retraction statements and errata among included studies but found none.
Obtención y análisis de los datos
Selección de los estudios
Two review authors (FR, CS) independently screened titles and abstracts of articles obtained in the search results and coded them as ‘retrieve' (eligible or potentially eligible/unclear) or ‘do not retrieve'. We retrieved the full‐text study reports. Two review authors (FR, CS) independently screened the full‐text articles for all potentially relevant studies, identified studies for final inclusion, and identified and recorded reasons for exclusion of ineligible studies. We resolved disagreements through discussion and, when required, we consulted a third review author (CR). When necessary, we contacted trial authors to clarify a study's eligibility. We identified and excluded duplicates and collated multiple reports of the same study so that each study rather than each report was the unit of interest in the review. We recorded the selection process in sufficient detail to complete a PRISMA flow diagram (Figure 1), along with a Characteristics of excluded studies table.
Extracción y manejo de los datos
Two review authors (CS, RBP) independently performed data extraction using a data collection form based on the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2017). The form had been piloted by one study in the review (Ledwidge 2013). One review author (CS) extracted the following study characteristics from included studies.
-
Methods: study design, total duration of study, details of any run‐in period, number of study centres and locations, study setting, and date of study.
-
Participants: number of participants randomised, number of participants completing the study period, and number of participant withdrawals; mean age, age range, gender, severity of condition (as defined by trialists), diagnostic criteria, inclusion criteria, and exclusion criteria.
-
Interventions: intervention, comparison, concomitant medications, and excluded medications.
-
Outcomes: primary and secondary outcomes specified and collected and time points reported.
-
Notes: funding for trial and notable conflicts of interest of trial authors.
Two review authors (CS, RBP) independently extracted outcome data from included studies. We resolved disagreements by reaching consensus or by involving a third review author (CR). One review author (CS) transferred data into the Review Manager 5 (RevMan 5) file (Review Manager 2014), and another review author (FR) double‐checked the data for accuracy. We double‐checked that data were entered correctly by comparing data presented in the systematic review against the study reports. A second review author (FR) spot‐checked trial characteristics for accuracy against the trial report.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (CS, RBP) independently assessed risk of bias for each study using the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions, and provided a summary judgement for each study (Higgins 2017). We resolved disagreements by discussion or by consultation with another review author (CR). We assessed risk of bias according to the following domains.
-
Random sequence generation.
-
Allocation concealment.
-
Blinding of participants and personnel.
-
Blinding of outcome assessment.
-
Incomplete outcome data.
-
Selective outcome reporting.
-
Other bias.
We judged each potential source of bias as high, low, or unclear, and provided a quote from the study report together with a justification for our judgement in the ‘Risk of bias' table. We summarised ‘Risk of bias' judgements across different studies for each of the domains listed. When we obtained information on risk of bias related to unpublished data or correspondence with a trialist, we noted this in the ‘Risk of bias' table. When considering treatment effects, we took into account the risk of bias for studies that contributed to that outcome. We had planned to undertake sensitivity analysis by excluding studies that were at high or unclear risk of bias for random sequence generation, allocation concealment, and incomplete data. However, due to the small number of included studies, this was not possible.
Assessment of bias in conducting the review
We conducted the review according to the published protocol and reported any deviations from it in the Differences between protocol and review section of the review.
Medidas del efecto del tratamiento
For dichotomous data, we used the numbers of events in intervention and control groups for each trial to calculate the Mantel‐Haenszel risk ratio (RR) with 95% confidence intervals (CIs).
For continuous outcomes, we converted data into mean differences (MDs) and presented them with 95% CIs, as per the guidelines provided in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2017).
We intended to use standardised mean differences (SMDs) to combine data when trials used different scales to measure the same variable. However, we found no such data in our included trials and we did not use SMDs.
Where applicable we described skewed data reported as medians and interquartile ranges (without variance data) narratively within the results text.
Cuestiones relativas a la unidad de análisis
The review presents no issues related to the unit of analysis, as we have included only individually randomised trials with one comparator and one control arm each, and outcomes were measured at single time points only. If in future updates of this review we encounter trials with multiple intervention arms, or trials that report outcomes at different time points, we will follow methodological guidance provided by Deeks 2017.
Manejo de los datos faltantes
When data were missing, we contacted authors/investigators to verify critical study characteristics and to request further information.
Evaluación de la heterogeneidad
We assessed statistical heterogeneity visually and by using the I² statistic. We conducted a fixed‐effect meta‐analysis when no heterogeneity was present. When we identified substantial heterogeneity (I² > 50%), we planned to employ a random‐effects model and to explore possible causes by conducting prespecified subgroup analyses (Ryan 2016; detailed in Subgroup analysis and investigation of heterogeneity). However, we did not identify substantial heterogeneity for any outcomes; therefore this was not necessary. We described clinical and methodological heterogeneity narratively.
Evaluación de los sesgos de notificación
If we had been able to pool more than 10 trials, we would have created and examined a funnel plot to explore possible small‐study bias for the primary outcomes (Sedgwick 2013). However, due to the small number of included trials, we were unable to do this.
Síntesis de los datos
We employed a fixed‐effect Mantel‐Haenszel model for calculating RRs for pooled outcomes, as substantial heterogeneity was not present for any of the outcomes (I² < 50%). Had we identified substantial heterogeneity for outcomes, we had planned to use a random‐effects model (see Assessment of heterogeneity above).
'Summary of findings' table
We created Summary of findings table 1 by using the following primary and secondary outcomes: cardiovascular mortality (as defined by trialists), cardiovascular hospitalisation (as defined by trialists), all‐cause mortality, all‐cause hospitalisation (all occurrences), ventricular dysfunction (as defined by trialists), and change in NP level at completion of follow‐up.
We used the five GRADE considerations (risk of bias, inconsistency, imprecision, indirectness, and publication bias) to assess the certainty of a body of evidence as it relates to studies that contributed data to the analyses for prespecified outcomes. We used methods and recommendations as described in Section 8.5 and Chapter 12 of the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2017), along with GRADEpro GDT software (GRADEpro GDT 2015). Two review authors (CS, RBP) independently assessed the quality of evidence. We resolved disagreements by reaching consensus or by involving a third review author (FR). We used footnotes to document our justification for decisions to downgrade the quality of evidence.
Análisis de subgrupos e investigación de la heterogeneidad
We planned to perform the following subgroup analyses for the primary outcome.
-
Age (≥ 65 years vs < 65 years).
-
Gender.
-
Diabetes mellitus.
-
Obesity (BMI ≥ 30 kg/m² vs BMI < 30 kg/m²).
-
Atrial fibrillation versus non‐atrial fibrillation.
-
Valvular heart disease versus non‐valvular heart disease.
-
Ischaemic heart failure versus non‐ischaemic heart failure.
-
NP levels at baseline for classification of subgroups (BNP < 50 pg/mL and NT‐proBNP < 125 pg/mL; BNP ≥ 50 pg/mL and NT‐proBNP ≥ 125 pg/mL). These subgroups represent the cut‐off point specified by the 2017 Canadian Cardiovascular Society Heart Failure Management guidelines for implementation of strategies to prevent heart failure (Ezekowitz 2017) (please note that this subgroup was modified post hoc to reflect updates from the 2017 guidelines; see Differences between protocol and review).
-
Renal function (estimated glomerular filtration rate (eGFR) ≥ 60 mL/min/1.73 m² or < 60 mL/min/1.73 m² as measured by the Cockcroft and Gault or Modification of Diet in Renal Disease (MDRD) formula).
Older age, female gender, and diabetes are associated with higher NP levels (Raymond 2003; Wang 2002).
Due to the paucity of data, we could not conduct most of our planned subgroup analyses. We described the characteristics of included trials according to methods, participants, interventions, and outcomes to establish clinical and methodological heterogeneity across included trials narratively. We were able to perform subgroup analysis based on NP levels at baseline (according to the post hoc modified subgroup; see Differences between protocol and review).
We included the primary outcome cardiovascular hospitalisation in the subgroup analysis. We were unable to perform subgroup analysis on the other primary outcome ‐ cardiovascular mortality ‐ as only one study reported this outcome. Post hoc, we considered performing subgroup analysis on the secondary outcomes; however we did not have sufficient data to do this. We used the formal statistical test for heterogeneity across subgroups based on the random‐effects model to test for subgroup interactions (Borenstein 2008), and we used caution in interpreting subgroup analyses, as advised in Section 9.6 of the Cochrane Handbook for Systematic Reviews of Interventions (Deeks 2017).
Análisis de sensibilidad
We planned to carry out sensitivity analyses by including only studies at low risk of bias for random sequence generation, allocation concealment, and incomplete data. However, an insufficient number of studies met the inclusion criteria of the review, so we could not do this.
Results
Description of studies
Results of the search
Through the database searches, we retrieved 14,462 records, and via a search of clinical trial registries, we retrieved 1034 records. After de‐duplication, we screened 10,193 records by title and abstract. Of these, 10,156 records did not meet the inclusion criteria, and we excluded them. We assessed the remaining 37 records in full text for eligibility and excluded 22 of them. We assessed 15 reports of four studies as eligible. Two studies (10 reports) were ongoing. We included five reports of two studies in the qualitative synthesis and three reports of two studies in the quantitative synthesis, with one additional record later sourced with data from trialists. The flow of studies is displayed in Figure 1.
Included studies
Methods
Both of the included studies (reported in three references) were RCTs (Huelsmann 2013; Ledwidge 2013). Both studies were conducted in Europe; Ledwidge 2013 was a single‐centre study conducted in Ireland, and Huelsmann 2013 was conducted in Austria with patients cared for at two sites. Both studies had one comparison arm and compared NP‐guided treatment to standard care. Study duration ranged from two years in Huelsmann 2013 to mean 4.3 years in Ledwidge 2013. One study measured BNP (Ledwidge 2013), and the other measured NT‐proBNP (Huelsmann 2013). Full reports were available for both studies, and we obtained additional information for both studies through direct contact with the study authors.
Participants
Ledwidge 2013 was a pragmatic RCT involving one specialist centre and 39 general practices in the catchment area of a large teaching hospital. The trial recruited 1374 patients (677 in control group and 697 in intervention group). Participants included adults older than 40 years of age with a history of one or more of the following: hypertension, hyperlipidaemia, obesity, vascular disease (coronary artery disease, cerebrovascular disease, and peripheral vascular disease), diabetes mellitus, arrhythmia requiring therapy, or moderate to severe valvular disease. Patients who had symptoms of heart failure or established evidence of left ventricular systolic dysfunction were excluded. The mean age of participants was 65.4 years in the control group and 64.1 years in the intervention group, and more female than male participants were included (55.7% in the control group and 53.7% in the intervention group).
In Ledwidge 2013, data for the outcomes all‐cause hospitalisation and all‐cause mortality were derived from a subanalysis, which included a subsample of participants from the primary analysis. A total of 1054 participants were included (522 in the control group and 532 in the intervention group). The median age of participants was 65.8 years, and the mean duration of follow‐up was 4.3 years. Characteristics of participants in the subsample closely mirrored the full sample, although a marginally higher proportion of patients with hypertension at baseline were included in the subsample.
Huelsmann 2013 was an RCT in which all participants (control and intervention groups) were cared for at a specialist diabetic outpatient clinic, with intervention group participants attending additional appointments at a cardiac outpatient clinic of a different hospital. A total of 300 participants with type 2 diabetes and NT‐proBNP < 125 pg/mL were randomised (150 in control group and 150 in intervention group). Patients with established evidence of left ventricular systolic dysfunction (LVSD) were excluded. The mean age of participants was 67.2 years in the control group and 67.8 years in the intervention group. Slightly fewer female than male participants were included (43.3% in the control group and 41.3% in the intervention group).
Interventions
The components of the interventions delivered in both studies differed. In one study, participants in the control group received standard care defined as routine review by their primary care physician at least annually and specialist care as required (Ledwidge 2013). In the intervention group, BNP results were made available to the participants’ primary care physician, and patients with a BNP result of ≥ 50 pg/mL were referred to a specialist cardiovascular centre. Intervention group patients with a BNP result of < 50 pg/mL received the same care as those in the control group but with disclosure of BNP values to patients and their primary care physician. Participants with a BNP level of ≥ 50 pg/mL underwent echocardiography and review by a cardiologist at the study centre, who decided on further investigation and management. The intervention in participants with BNP ≥ 50 pg/mL was multi‐dimensional and included optimisation of therapy (no predefined protocol), investigation and treatment of abnormalities detected on echocardiography, lifestyle advice, and counselling regarding medication adherence.
In the second study, control group participants received standard care at a diabetes care unit with appointments every three months over a 12‐month period (Huelsmann 2013). In addition to usual care, the intervention group attended visits at a cardiac outpatient clinic where RAAS antagonists and beta‐blockers were up‐titrated to maximum tolerated doses in a predefined manner.
Distinct differences were evident in the content of the interventions delivered in both studies. In Ledwidge 2013, intervention group patients with elevated BNP received multi‐dimensional care. By contrast, the intervention delivered to the intervention group in Huelsmann 2013 focused solely upon up‐titration of RAAS antagonists and beta‐blockers to maximum doses. Despite differences in interventional components, both interventions focused on optimisation of therapy, and both studies observed increased use of RAAS‐modifying therapy. Thus, we decided to perform meta‐analysis. However, the heterogeneity of the interventions must be kept in mind when effects of the interventions are interpreted.
Outcomes
Both studies reported the following outcomes: cardiovascular hospitalisation (secondary outcome in both studies); all‐cause hospitalisation (secondary outcome in Huelsmann 2013; not a prespecified outcome in Ledwidge 2013 but data available); all‐cause mortality (not a prespecified outcome in either study but data provided); and change in NP level at the end of follow‐up (secondary outcome in both studies). Meta‐analysis was performed for each of these outcomes, except for change in NP level at the end of follow‐up (different NPs used in each study). One study reported cardiovascular mortality (not a prespecified outcome) (Huelsmann 2013). One study included the outcome ventricular dysfunction as a primary outcome (Ledwidge 2013). In this study, trialists defined ventricular dysfunction as left ventricular dysfunction (any patient with asymptomatic LVSD and/or asymptomatic left ventricular diastolic dysfunction (LVDD)) with or without heart failure (defined as any patient with LVD (LVSD and/or LVDD) and with symptoms of heart failure requiring emergency admission to hospital). We considered this outcome definition to be appropriate to our predefined outcomes as ventricular dysfunction is an umbrella term for both asymptomatic and symptomatic ventricular dysfunction.
Clinical and methodological heterogeneity
We recognise that there is clinical and methodological heterogeneity between the included studies, and we carefully considered the appropriateness of pooling results. First, the duration of follow‐up varied from two years in Huelsmann 2013 to mean 4.3 years in Ledwidge 2013. Second, there were important differences in the inclusion criteria of the studies: Huelsmann 2013 recruited only patients with type 2 diabetes and elevated NT‐proBNP, and Ledwidge 2013 recruited a heterogeneous cohort of patients with various cardiovascular risk factors. Ledwidge 2013 did not impose a threshold on NP level for inclusion in the study; therefore the control and intervention arms were heterogeneous for high‐ and low‐risk patients as classified by NP level. The components of the interventions also differed. Ledwidge 2013 used a multi‐dimensional intervention, and Huelsmann 2013 focused solely on optimisation of drug therapy.
We acknowledge these important differences between studies, and we tried to explore the effects of these differences when possible. We assessed statistical heterogeneity visually and by using the I² statistic. We did not identify any statistical heterogeneity in any of our outcomes (I² = 0 for all). We did not have sufficient data to perform subgroup analyses for factors such as diabetes or duration of follow‐up; however, we hope that in future updates of this review, we will find sufficient data to explore these factors.
We were able to perform subgroup analysis for the primary outcome cardiovascular hospitalisation in those with (1) BNP < 50 pg/mL/NT‐proBNP < 125 pg/mL and (2) BNP ≥ 50 pg/mL/NT‐proBNP ≥ 125 pg/mL (post hoc modification; see Differences between protocol and review). The results of this analysis show that there was no significant difference in the effect estimate between subgroups. In view of these factors, we decided to pool results from both studies when possible. However, the findings of this review should be interpreted with caution due to the potential for clinical and methodological heterogeneity between studies.
Excluded studies
We have included 15 studies (19 references) in the Characteristics of excluded studies table. We excluded 10 of these studies (14 references) as the participants had heart failure or ventricular dysfunction at baseline, two because the study was not designed as an RCT, one as trial outcomes did not match our prespecified primary and secondary outcomes, and one because the intervention did not meet our inclusion criteria. One study met our eligibility criteria for inclusion in the review (NCT00604006). However, we contacted the study author on 20 August 2019 to request data and were informed that no data were available. Therefore, we excluded the study. We excluded three more studies as they were duplicate reports of the same study.
Ongoing studies
We identified two ongoing trials that met our inclusion criteria (Dimitriu 2015; Huelsmann 2016). Details are shown in Characteristics of ongoing studies. Recruitment is ongoing for both trials. No data are available yet for Huelsmann 2016, and partial outcome data are available for Dimitriu 2015.
Risk of bias in included studies
We have detailed the risk of bias assessments in the Characteristics of included studies tables, and we have summarised these in the text below and in Figure 2 and Figure 3. Assessment of risk of bias was based on both published and unpublished data.
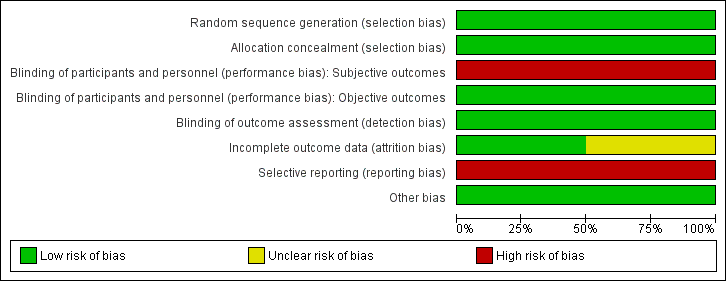
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
We judged both studies to be at low risk for selection bias, as the randomisation sequence was computer‐generated (Huelsmann 2013; Ledwidge 2013). Both studies clearly stated that the study was randomised, and one provided in the report sufficient details on the method of randomisation applied (Ledwidge 2013). For the second study, we obtained details on the method of randomisation through personal contact with the study author (Huelsmann 2013).
Allocation concealment was appropriate in both studies, and we judged risk of bias to be low (Huelsmann 2013; Ledwidge 2013). Neither study reported allocation concealment in sufficient detail in the published report. We obtained information on allocation concealment through personal contact with study authors.
Blinding
Blinding of participants and personnel (i.e. those delivering the intervention) to treatment allocation was not feasible due to the nature of the interventions. We determined that objective outcomes such as cardiovascular mortality, all‐cause mortality, ventricular dysfunction (echocardiographer and cardiologist reviewing end of study echo were blinded, and a clear definition of ventricular dysfunction was provided), and change in NP level at the end of follow‐up (laboratory measured parameter) were likely to be at low risk of performance bias in both studies, when included (Huelsmann 2013; Ledwidge 2013). Subjective outcomes (cardiovascular hospitalisation and all‐cause hospitalisation) were likely to be at high risk of performance bias in both studies (Huelsmann 2013; Ledwidge 2013).
We judged detection bias to be at low risk in both studies; outcome assessors were blinded to treatment allocation (Huelsmann 2013; Ledwidge 2013).
Incomplete outcome data
We judged one study to be at low risk of bias for incomplete outcome data (Huelsmann 2013), and we determined that the second was at unclear risk of bias (Ledwidge 2013). Both studies reported attrition by intervention arm, and one study provided detailed reasons for withdrawal (Ledwidge 2013). Huelsmann 2013 reported similar attrition between arms (13% in the control group and 9% in the intervention group). In Ledwidge 2013, overall attrition (withdrawal and loss to follow‐up) was 23.2% in the intervention group and 29.7% in the control group. Given the longer mean duration of the study (4.2 years), the attrition rate is considered reasonable.
In Ledwidge 2013, withdrawal was slightly higher in the control group than in the intervention group (19% vs 13%). However, detailed reasons for patient withdrawal were provided, and it is clear that the differential withdrawal rate was unrelated to study outcomes of interest; therefore this is unlikely to have biased the results.
Ledwidge 2013 performed an intention‐to‐treat (ITT) analysis to account for missing data for the following outcomes: cardiovascular hospitalisation (multiple imputation using chained equations), ventricular dysfunction, and change in NP level at the end of follow‐up (last observation carried forward used for both). With regard to the outcomes all‐cause hospitalisation and all‐cause mortality, participants who were lost to follow‐up or who did not provide at least one year of data were excluded from the analysis. As this study contributed most of the data for these outcomes, we judged these outcomes to be at overall high risk of attrition bias.
Huelsmann 2013 did not perform an ITT analysis. However, participants who withdrew agreed to be followed‐up for the outcomes all‐cause hospitalisation, cardiovascular hospitalisation, and death (information was obtained from mortality data and hospital files), so missing data was not an issue for these outcomes; therefore risk of attrition bias was low. For the outcome change in NP level at end of follow‐up, patients who withdrew from the study were excluded from the analysis.
Selective reporting
Both studies were preregistered at appropriate clinical trials registries, where predefined outcomes of interest were listed (Huelsmann 2013; Ledwidge 2013). Both studies were considered at high risk for reporting bias.
Huelsmann 2013 reported on all planned outcomes specified in the clinical trials registry entry; however, additional secondary outcomes listed in the paper were not prespecified in the clinical trials registry (all‐cause hospitalisation, unplanned cardiovascular hospitalisation or death, and heart failure hospitalisation).
Ledwidge 2013 has not yet reported on some of the secondary outcomes outlined in the study protocol (unpublished protocol obtained from study authors): (1) relative effects of intervention in prespecified subgroups: above and below median age, male/female, hypertension, diabetes, vascular disease, structural CVD, obesity; (2) relative effects of the intervention on Health and Lifestyle questionnaire; and (3) evaluation of clinical, demographic, biochemical, pharmacological, genomic, proteomic, and metabolomic determinants of natriuretic peptides. Through direct communication with study authors, we confirmed that these outcomes have not yet been reported.
Other potential sources of bias
We did not identify any other potential sources of bias; therefore we judged risk of bias for this domain to be low.
Effects of interventions
Cardiovascular mortality
One study with 300 participants reported cardiac mortality (Huelsmann 2013); therefore we were unable to perform meta‐analysis. As data for cardiovascular mortality were not available, we used event numbers for cardiac mortality. Event numbers were very low (one death in the intervention group and three in the control group), and there was uncertainty about effects of the intervention (risk ratio (RR) 0.33, 95% confidence interval (CI) 0.04 to 3.17; low‐quality evidence; Analysis 1.1).
Cardiovascular hospitalisation
Two studies with 1674 participants reported on cardiovascular hospitalisation (Huelsmann 2013; Ledwidge 2013). Study authors reported 135 cardiovascular hospitalisations in the control group and 72 in the intervention group (16% vs 9%). Pooled results based on a fixed‐effect model favoured the intervention group (RR 0.52, 95% CI 0.40 to 0.68; I² = 0%; moderate‐quality evidence; Analysis 1.2). Thus, moderate‐quality evidence suggests that NP‐guided treatment probably reduces the risk of cardiovascular hospitalisation.
All‐cause mortality
Two studies with 1354 participants reported on all‐cause mortality (Huelsmann 2013; Ledwidge 2013). In all, 45 deaths due to any reason were reported in the control group (7%) and 41 in the intervention group (6%). Pooled evidence, based on a fixed‐effect model, favoured NP‐guided treatment, but overall, the evidence showed uncertainty (RR 0.90, 95% CI 0.60 to 1.35; I² = 0%; low‐quality evidence; Analysis 1.4).
All‐cause hospitalisation
Two studies with 1354 participants reported on all‐cause hospitalisation (Huelsmann 2013; Ledwidge 2013). Study authors reported 404 hospitalisations for any reason in the control group (60%) and 341 in the intervention group (50%). The pooled result based on a fixed‐effect model favoured the intervention (RR 0.83, 95% CI 0.75 to 0.92; I² = 0%; moderate‐quality evidence; Analysis 1.5). Thus, moderate‐quality evidence suggests that NP‐guided treatment probably reduces the risk of all‐cause hospitalisation.
Ventricular dysfunction
One study with 1374 participants reported on ventricular dysfunction, defined as heart failure or left ventricular dysfunction (Ledwidge 2013). Fifty‐nine participants in the control group (9%) and 37 in the intervention group (5%) developed ventricular dysfunction. Results show a reduction in the risk of developing ventricular dysfunction with NP‐guided treatment compared to standard care (RR 0.61, 95% CI 0.41 to 0.91; high‐quality evidence; Analysis 1.6).
Change in NP level at the end of follow‐up
Both studies reported change in NP level (Huelsmann 2013; Ledwidge 2013). For Ledwidge 2013, we calculated change in BNP from baseline to follow‐up (mean 4.2 years). Huelsmann 2013 provided median NT‐proBNP values at baseline and after one year (follow‐up for all other outcomes was two years, but patients attended study visits for only 12 months). Given that each study used a different biomarker and that NP level was measured at different time points, it was not appropriate to perform meta‐analysis on this outcome. Furthermore, data from Huelsmann 2013 were reported as median and interquartile range (IQR), indicating that the data were skewed.
NP levels increased in both groups from baseline to time of measurement. This is consistent with previous research demonstrating that NP level increases with age (Redfield 2002; Wang 2002). In Ledwidge 2013, the mean difference in NP level from baseline to follow‐up was slightly lower in the intervention group than in the control group (mean difference (MD) from baseline to follow‐up: control arm 9.52 pg/mL, intervention arm 5.46 pg/mL). However, the evidence shows uncertainty for the effects of NP‐guided treatment on NP level at the end of follow‐up (MD between groups: 4.06 pg/mL, 95% CI ‐15.07 pg/mL to 6.95 pg/mL; 1 study; 1374 participants; moderate‐quality evidence; Analysis 1.7). Results show no significant differences between groups in change in BNP from baseline to follow‐up (P = 0.47).
For Huelsmann 2013, as the data were provided as median and IQR, we were unable to calculate the mean difference between groups. From the median values presented, we noted no significant change in NT‐proBNP concentration between groups after one year of treatment (NT‐proBNP at baseline (presented as median value): control group 266 pg/mL, IQR 181 to 402 pg/mL; intervention group 235 pg/mL, IQR 169 to 343 pg/mL; NT‐proBNP after 12 months (presented as median value): control group 264 pg/mL, IQR 167 to 394 pg/mL; intervention group 248 pg/mL, IQR 169 to 433 pg/mL).
It should be noted that currently no consensus has been reached on what should be considered a clinically significant change in NP level among patients without heart failure. Preanalytical factors and analytical and biological variability (which increases with time) contribute to the total intraindividual variability in NP level (Fraser 2006). Research conducted in heart failure patients suggests that changes in NT‐proBNP and BNP of 50% and 66%, respectively, over the course of one week are likely to signal a clinically significant change in patient status (O'Hanlon 2007), and an earlier small study suggested that in heart failure patients, a change in BNP/NT‐proBNP exceeding 30% is clinically meaningful (Bettencourt 2004).
Subgroup analysis
With the exception of NP level at baseline, it was not possible to explore subgroups within study populations as per protocol. In the review protocol, we planned to perform subgroup analysis according to those with (1) BNP 35 pg/mL to 100 pg/mL or NT‐proBNP 125 pg/mL to 300 pg/mL, and (2) BNP ≥ 100 pg/mL and NT‐proBNP ≥ 300 pg/mL. However, this was changed post hoc in light of the thresholds recommended by more recent guidelines (Ezekowitz 2017) (see Differences between protocol and review). We performed subgroup analysis for the following values: (1) BNP < 50 pg/mL and NT‐proBNP < 125 pg/mL, and (2) BNP ≥ 50 pg/mL and NT‐proBNP ≥ 125 pg/mL.
Subgroup analysis by NP level for the primary outcome cardiovascular hospitalisation shows that NP‐guided treatment reduced the risk of cardiovascular hospitalisation in both subgroups. Point estimates were similar in both subgroups and confidence intervals overlapped (BNP < 50 pg/mL and NT‐proBNP < 125 pg/mL: RR 0.55, 95% CI 0.32 to 0.95; 1 study; 876 participants; BNP ≥ 50 pg/mL and NT‐proBNP ≥ 125 pg/mL: RR 0.49, 95% CI 0.36 to 0.65; 2 studies; 798 participants; Analysis 1.3). The subgroup test for differences was non‐significant (P = 0.66).
We did not have sufficient data to perform subgroup analysis of NP level for the other pooled outcomes (all‐cause hospitalisation and all‐cause mortality).
Discusión
Resumen de los resultados principales
Se incluyeron en la revisión tres informes de dos ensayos (Huelsmann 2013; Ledwidge 2013). Se identificaron dos ensayos en curso con brazos de tratamiento que incluían las intervenciones evaluadas en esta revisión (Dimitriu 2015; Huelsmann 2016). Se realizó un análisis agrupado de los resultados de la hospitalización por causas cardiovasculares, la hospitalización por todas las causas y la mortalidad por todas las causas. Los estudios individuales incluyeron los resultados de la disfunción ventricular y la mortalidad cardiovascular; por lo tanto, no fue posible realizar análisis agrupados.
La evidencia de calidad moderada indica que el tratamiento guiado por péptidos natriuréticos (PN) probablemente reduce el riesgo de hospitalización por causas cardiovasculares (reducción del riesgo del 48%) y de hospitalización por todas las causas (reducción del riesgo del 17%) en los pacientes con factores de riesgo de enfermedad cardiovascular (ECV). La evidencia de calidad alta muestra una reducción del riesgo de desarrollo de disfunción ventricular con el tratamiento guiado por PN en comparación con la atención estándar; sin embargo, esta evidencia se derivó de un único estudio. Debido a los intervalos de confianza amplios, hubo incertidumbre acerca de la estimación de los efectos para los resultados de la mortalidad cardiovascular, la mortalidad por todas las causas y el cambio en el nivel de PN al final del seguimiento. Por lo tanto, no se pueden establecer conclusiones claras en cuanto a los efectos del tratamiento guiado por PN sobre estos resultados.
El análisis de subgrupos por nivel de PN al inicio muestra que el tratamiento guiado por PN reduce el riesgo de hospitalización por causas cardiovasculares en un grado similar en ambos subgrupos. Este análisis también indica que las diferencias en las características de los pacientes según el nivel de PN al inicio de cada estudio no introdujeron heterogeneidad en los resultados (todos los participantes en Huelsmann 2013 tenían NT‐proPNC > 125 pg/mL, y Ledwidge 2013 no impuso un umbral en el nivel de PN para su inclusión en el estudio).
Debe señalarse que se identificó heterogeneidad clínica y metodológica en los dos estudios incluidos (Huelsmann 2013; Ledwidge 2013). Aunque no se identificó heterogeneidad estadística en los resultados agrupados, no pudieron explorarse las posibles fuentes de heterogeneidad mediante el análisis de subgrupos debido a la falta de datos; por lo tanto, los resultados de esta revisión deben interpretarse con cautela.
Compleción y aplicabilidad general de las pruebas
La generalizabilidad de esta revisión estuvo limitada por el número pequeño de ensayos identificados para la inclusión. Sin embargo, aunque solo dos estudios cumplieron con los criterios para esta revisión, las conclusiones para todos los resultados excepto la mortalidad cardiovascular (datos de un estudio con 300 participantes; Huelsmann 2013) se basan en el análisis de entre 1354 y 1674 unidades analíticas, lo que contribuye a la solidez de los hallazgos.
Ambos estudios se realizaron en grandes centros urbanos de países europeos de ingresos altos, y la mayoría de los participantes eran caucásicos. Por lo tanto, los hallazgos pueden no ser generalizables a otras etnias y niveles de ingresos. En ambos estudios, la intervención fue administrada a través de una clínica ambulatoria especializada en cardiología por un equipo de personal especializado (debe observarse que en Ledwidge 2013 los pacientes del grupo de intervención con PNC < 50 pg/mL fueron atendidos por su médico de atención primaria). Es posible que los resultados observados en los dos estudios no sean reproducibles en otros ámbitos de la asistencia sanitaria que no sean los ideales, como la atención primaria sola sin el apoyo de un especialista.
A pesar del pequeño número de estudios incluidos, fue posible obtener datos sobre todos los resultados preespecificados en el protocolo de revisión, y fue posible realizar un metanálisis sobe tres de los seis resultados. Aunque fue posible obtener datos sobre las medidas de resultado de la mortalidad cardiovascular, la mortalidad por todas las causas y la hospitalización por todas las causas, las mismas no fueron resultados planificados de los estudios incluidos (la hospitalización por todas las causas fue un resultado secundario planificado en Huelsmann 2013; pero no en Ledwidge 2013). Ninguno de los estudios incluidos en esta revisión tuvo poder estadístico para detectar diferencias en la mortalidad entre los grupos de control y de intervención; este hecho, combinado con la corta duración del seguimiento, explica el pequeño número de eventos y la imprecisión observada en las estimaciones del efecto para los resultados de la mortalidad cardiovascular y la mortalidad por todas las causas. Por lo tanto, se necesitan estudios con un poder estadístico adecuado y una mayor duración del seguimiento para evaluar con precisión los efectos del tratamiento guiado por PN sobre la mortalidad.
La evidencia sobre los efectos del tratamiento guiado por PN en el resultado de la disfunción ventricular están disponibles a partir de un único estudio (Ledwidge 2013). Debido a la tasa baja de eventos, la reducción del riesgo absoluto fue pequeña y la generalizabilidad de este beneficio potencial es limitada.
El comparador en los estudios incluidos en esta revisión es la "atención estándar", que se definió como atención local basada en guías, incluida la modificación de las intervenciones farmacológicas, educativas y del estilo de vida, sin tener en cuenta el nivel de PN del participante. Es importante señalar que la atención estándar puede variar de manera considerable de un ámbito a otro, dependiendo de factores como las limitaciones de recursos, las características de los médicos y las guías locales. Para algunos médicos, la atención estándar puede abarcar simplemente la prescripción de tratamiento farmacológico, aunque otros pueden adoptar un enfoque más holístico, incorporando de manera habitual asesoramiento sobre los factores del estilo de vida y los comportamientos de adherencia a la medicación. Por lo tanto, es posible que los efectos relativos de la intervención puedan variar dependiendo del ámbito y la definición de la atención estándar adoptada por los médicos.
Se intentó realizar un análisis de subgrupos para determinar si varios factores como la edad, el sexo, la diabetes mellitus, la obesidad, la fibrilación auricular versus la fibrilación no auricular, la cardiopatía valvular versus la cardiopatía no valvular, la insuficiencia cardíaca isquémica versus la insuficiencia cardíaca no isquémica, el nivel de PN al inicio del estudio o la función renal, tuvieron alguna repercusión en el resultado primario. Sin embargo, debido a la escasez de datos, no fue posible realizar los análisis de subgrupos planificados, con la excepción del nivel de PN al inicio del estudio. Esta información sería útil para investigar si todas los pacientes con factores de riesgo cardiovasculares obtienen un beneficio similar del tratamiento guiado por PN, o si los esfuerzos deben dirigirse a subpoblaciones específicas. Para las futuras actualizaciones de esta revisión, se espera que haya datos de subgrupos más detallados, de manera que sea posible proporcionar un análisis más sólido.
Ninguno de los estudios incluidos informó explícitamente sobre la seguridad de la intervención ni proporcionó el número de eventos adversos, aunque Huelsmann 2013 señaló que no hubo hospitalizaciones por eventos adversos.
Se identificaron dos ensayos en curso (Dimitriu 2015; Huelsmann 2016). Es probable que los resultados de estos ensayos tengan un impacto importante en la confianza en las estimaciones del efecto y puedan cambiar las estimaciones en relación con la base de evidencia actual, debido al número de participantes y al número calculado de eventos.
Calidad de la evidencia
La calidad de la evidencia para los resultados incluidos en esta revisión varió de baja a alta. Las fuentes potenciales de sesgo identificadas incluyeron el informe selectivo, la falta de cegamiento de los participantes y el personal para los resultados subjetivos y el sesgo de deserción.
Se consideró que la calidad de la evidencia (GRADE; Resumen de resultados, tabla 1) fue moderada para la hospitalización cardiovascular, la hospitalización por todas las causas (ambas disminuidas en un nivel debido al riesgo alto de sesgo de realización) y el cambio en el nivel de PN al final del seguimiento (disminuido en un nivel debido a la imprecisión del tamaño del efecto; intervalo de confianza amplio consistente con la posibilidad de causar efectos beneficiosos y perjudiciales). La evidencia de calidad alta de un único estudio sugiere que el riesgo de desarrollar disfunción ventricular se reduce con el tratamiento guiado por PN. Aunque solo un estudio informó este resultado, no se disminuyó la calificación a causa de la falta de direccionalidad, en vista del gran tamaño de la muestra y la amplia población de pacientes incluidos en este estudio.
Se consideró que la calidad de la evidencia para la mortalidad cardiovascular (estudio único) fue baja debido a las preocupaciones graves sobre la imprecisión considerable y el tamaño de la muestra pequeño; por lo tanto, la confianza en el resultado agrupado es baja y es probable que la estimación se vea afectada por la investigación futura. También se consideró que la calidad de la evidencia para el resultado de la mortalidad por todas las causas (dos estudios) fue baja debido a las preocupaciones sobre la imprecisión y el sesgo de deserción.
La imprecisión se calificó con respecto a si el intervalo de confianza (IC) del 95% incluyó el valor nulo y si incluyó efectos beneficiosos y perjudiciales importantes. Cuando el intervalo de confianza del efecto general incluyó ningún efecto y un efecto beneficioso potencial, se disminuyó la calidad de la evidencia. Por lo tanto, se disminuyó la evidencia sobre la mortalidad cardiovascular, la mortalidad por todas las causas y el cambio en el nivel de PN al final del seguimiento. No se disminuyó la calidad de la evidencia para ningún resultado debido a la inconsistencia, ya que no se identificó heterogeneidad estadística, ni debido a la falta de direccionalidad.
Es importante señalar que para el resultado de la hospitalización por causas cardiovasculares, se observó una ligera heterogeneidad en las definiciones utilizadas por los autores de los estudios. Huelsmann 2013 definió la hospitalización por causas cardiovasculares como cualquier hospitalización no planificada basada en un evento cardíaco (por ejemplo, arritmia) u otro evento macrovascular (por ejemplo, accidente cerebrovascular, arteriopatía coronaria, enfermedad arterial periférica). Ledwidge 2013 definió la hospitalización por causas cardiovasculares como una hospitalización de emergencia para cualquiera de los siguientes eventos adversos cardiovasculares importantes: arritmia, ataque isquémico transitorio, accidente cerebrovascular, infarto de miocardio, trombosis/embolia periférica o pulmonar, o insuficiencia cardíaca. Aunque Huelsmann 2013 utilizó una definición un poco más amplia, se observó con satisfacción que las dos definiciones eran lo suficientemente similares como para permitir el agrupamiento de los resultados.
Se reconoce que hay varias advertencias en la interpretación de los resultados. Primero, ninguno de los estudios incluidos en esta revisión fue diseñado para evaluar los efectos del tratamiento guiado por PN sobre la mortalidad; por lo tanto, el número de eventos fue bajo y hubo una imprecisión significativa en las estimaciones del efecto. En segundo lugar, los hallazgos de los resultados fueron dominados por un único estudio (Ledwidge 2013), que contribuyó con el 82% de los datos a los análisis agrupados. En tercer lugar, se reconoce que existe heterogeneidad metodológica y clínica entre los estudios incluidos y no fue posible explorar estas fuentes de heterogeneidad mediante el análisis de subgrupos debido a la escasez de datos. Se consideró cuidadosamente la conveniencia del agrupamiento de los datos. Debido a la falta de heterogeneidad estadística identificada entre los estudios, se tomó la decisión de agrupar los estudios para su análisis. También se tuvo en cuenta el hecho de que la revisión considera una pregunta amplia en un grupo amplio de participantes; por lo tanto, la heterogeneidad en los estudios puede reflejar la situación de la "vida real". Por lo tanto, incluso en vista de la heterogeneidad, es probable que el metanálisis siga siendo útil. Sin embargo, es importante señalar que los resultados agrupados deben interpretarse con cautela debido al potencial de heterogeneidad clínica y metodológica entre los estudios.
Sesgos potenciales en el proceso de revisión
Cuatro de los revisores (ML, KMD, CW, JG) participaron en uno de los estudios incluidos. Estos autores no participaron en la selección de los artículos, ni en la evaluación del riesgo de sesgo, ni en la calificación de la calidad de los estudios incluidos para esta revisión sistemática y metanálisis.
Se reconoce el potencial de sesgo de publicación en la revisión sistemática. Aunque se realizó una búsqueda exhaustiva sin restricciones de fecha o idioma, existe inevitablemente la posibilidad de que no se hayan encontrado ensayos no publicados relevantes. Sin embargo, se recibió un apoyo excelente del Especialista en Información del Grupo Cochrane de Corazón (Cochrane Heart Information Specialist), que ayudó a realizar búsquedas exhaustivas y sistemáticas en las bases de datos para minimizar el riesgo de sesgo de publicación. Además, se minimizó el sesgo de selección de estudios mediante la asignación de dos autores de la revisión para que revisaran de forma independiente los resultados de la búsqueda y evaluaran los estudios para su inclusión según los criterios de inclusión predefinidos.
Debido a la falta de datos disponibles, no fue posible realizar la mayoría de los análisis de subgrupos planificados. No está claro si los datos adicionales habrían alterado los resultados generales de la revisión.
Acuerdos y desacuerdos con otros estudios o revisiones
Hasta donde se conoce, ésta es la primera revisión sistemática y el primer metanálisis que examinan los efectos del tratamiento guiado por PN para la prevención de eventos cardiovasculares en pacientes sin insuficiencia cardíaca. Múltiples revisiones sistemáticas y metanálisis ‐ Balion 2014; De Vecchis 2014; Li 2013; Porapakkham 2010; Savarese 2013; Troughton 2014 ‐ y una revisión Cochrane ‐ McLellan 2016 ‐ han explorado los efectos del tratamiento guiado por PN para pacientes con insuficiencia cardíaca. Sin embargo, debido a las diferentes poblaciones de pacientes incluidas, no es apropiado realizar comparaciones con estas revisiones.
Un estudio de cohortes comunitarias realizado por AbouEzzeddine y colegas refleja los hallazgos del metanálisis (AbouEzzedine 2016). Estos autores del estudio identificaron una cohorte 'similar a STOP‐HF' de 1576 participantes sin insuficiencia cardíaca ni disfunción sistólica de la población del Condado de Olmsted que presentaba uno o más factores de riesgo cardiovasculares (hipertensión, hiperlipidemia, obesidad, enfermedad vascular, diabetes, fibrilación auricular o enfermedad valvular). Los participantes fueron sometidos al cribado de múltiples biomarcadores, incluido el PNC y la porción NT‐proPNC, y recibieron una intervención preventiva 'tipo STOP‐HF' durante un período de cuatro años.
Los autores de la revisión proporcionaron un modelo teórico para evaluar si el tratamiento guiado por biomarcadores puede prevenir el desarrollo de insuficiencia cardíaca o la aparición de eventos adversos cardiovasculares graves (EACG) en una muestra de la comunidad. AbouEzzeddine y colegas aplicaron las estimaciones del efecto obtenidas a partir de la estrategia de cribado de los biomarcadores empleada en STOP‐HF para demostrar la eficacia de la aplicación de esta estrategia fuera del marco de los ensayos controlados aleatorizados (ECA) con un control riguroso (Meijers 2016). El cribado de los biomarcadores seguido de una intervención preventiva logró una reducción del 19% y el 25% al realizar el cribado de la porción N‐terminal del pro‐péptido natriurético tipo B (NT‐proPNC) y el péptido natriurético cerebral (PNC), respectivamente, en la población con pruebas positivas para los biomarcadores. Sin embargo, este análisis no asumió ningún cambio en la incidencia de EACG en la población con pruebas negativas para los biomarcadores (AbouEzzedine 2016).
En el metanálisis, la intervención se asoció con una reducción del 48% en el riesgo de hospitalización por causas cardiovasculares. La diferencia en las estimaciones del riesgo observado puede deberse a disparidades en el diseño de la intervención administrada a los pacientes. En el estudio de AbouEzzeddine y cols, la intervención consistió en un único agente o estrategia para la prevención de enfermedades cardiovasculares. En comparación, los participantes en Huelsmann 2013 y Ledwidge 2013 recibieron una intervención especializada con una evaluación y seguimiento exhaustivos. Lo anterior, junto con las condiciones ideales del entorno de los ECA, puede explicar las estimaciones del efecto más sólidas observadas en estos estudios.
Tanto Huelsmann 2013 como Ledwidge 2013 están incluidos en las Canadian Cardiovascular Society Heart Failure Management Guidelines de 2017 (Ezekowitz 2017), que recomiendan que entre los individuos con factores de riesgo para el desarrollo de insuficiencia cardíaca, los que presentan un PNC > 50 pg/mL o NT‐proPNC > 125 pg/mL deben ser sometidos a un diagnóstico por imágenes y a la consulta con un especialista, seguido de la optimización del tratamiento de bloqueo neurohormonal e intervenciones del estilo de vida.
Las guías de los EE.UU. también recomiendan el cribado del PN en pacientes con factores de riesgo de desarrollo de insuficiencia cardíaca, con la optimización posterior del tratamiento dirigido según las guías y realizado por un especialista cardiovascular, para prevenir el desarrollo de disfunción ventricular izquierda (sistólica o diastólica) o insuficiencia cardíaca de nueva aparición (Yancy 2017). Al igual que con las recomendaciones de la revisión, estas guías recomiendan que los estudios adicionales examinen los efectos del cribado del PN y la atención guiada por PN posterior sobre la mortalidad.
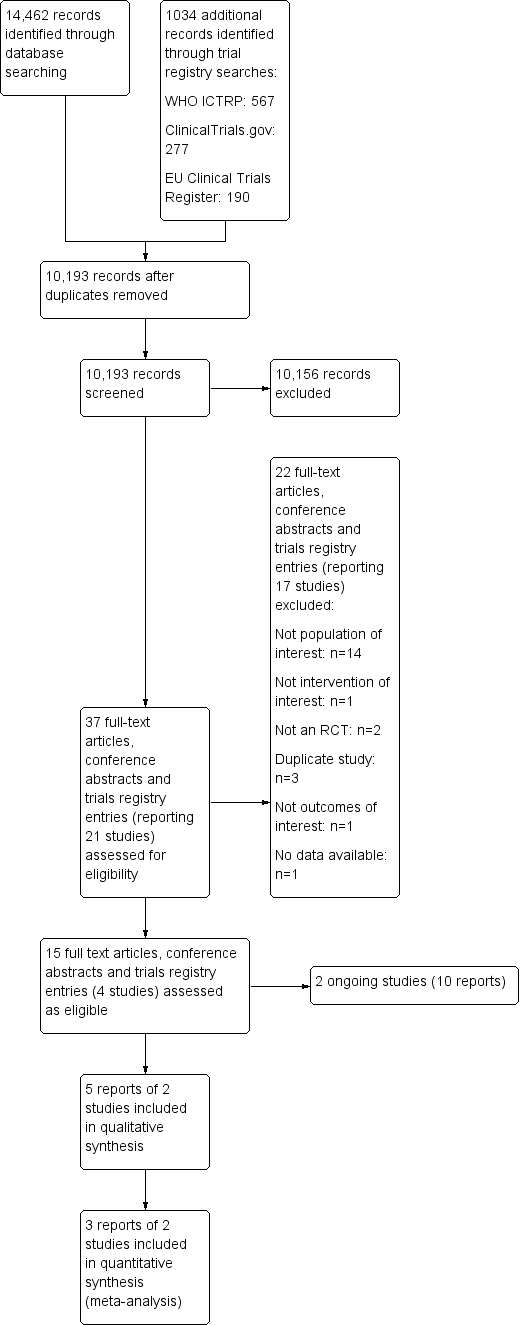
PRISMA flow diagram.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Natriuretic peptide‐guided treatment versus standard care, Outcome 1 Cardiovascular mortality (as defined by trialists).

Comparison 1 Natriuretic peptide‐guided treatment versus standard care, Outcome 2 Cardiovascular hospitalisation (as defined by trialists).

Comparison 1 Natriuretic peptide‐guided treatment versus standard care, Outcome 3 Cardiovascular hospitalisation (as defined by trialists) by natriuretic peptide level.
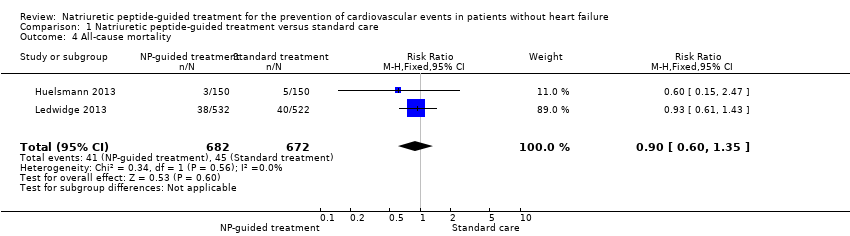
Comparison 1 Natriuretic peptide‐guided treatment versus standard care, Outcome 4 All‐cause mortality.
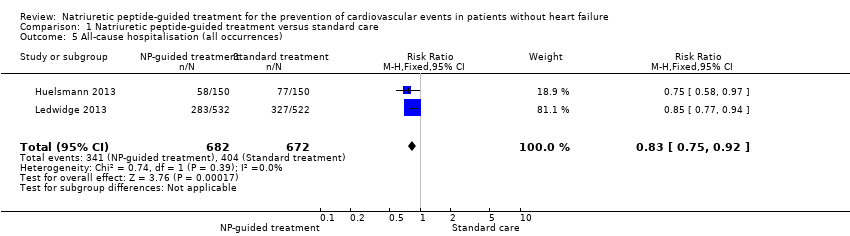
Comparison 1 Natriuretic peptide‐guided treatment versus standard care, Outcome 5 All‐cause hospitalisation (all occurrences).

Comparison 1 Natriuretic peptide‐guided treatment versus standard care, Outcome 6 Ventricular dysfunction (as defined by trialists).
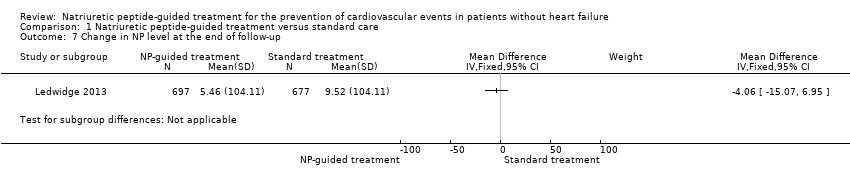
Comparison 1 Natriuretic peptide‐guided treatment versus standard care, Outcome 7 Change in NP level at the end of follow‐up.
| Natriuretic peptide‐guided treatment compared to standard care for the prevention of cardiovascular events in patients without heart failure | ||||||
| Patient or population: patients without heart failure | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | No. of participants | Certainty of the evidence | Comments | |
| Risk with standard care | Risk with natriuretic peptide‐guided treatment | |||||
| Cardiovascular mortality Follow‐up: 2 years | Study population | RR 0.33 | 300 | ⊕⊕⊝⊝ | Cardiovascular deaths not available, so cardiac deaths used | |
| 20 per 1000 | 7 per 1000 | |||||
| Cardiovascular hospitalisation (as defined by trialists) Follow‐up range: 2 years to mean 4.2 years | Study population | RR 0.52 | 1674 | ⊕⊕⊕⊝ | ||
| 163 per 1000 | 85 per 1000 | |||||
| All‐cause mortality | Study population | RR 0.90 | 1354 | ⊕⊕⊝⊝ | ||
| 60 per 1000 | 54 per 1000 | |||||
| All‐cause hospitalisation (all occurrences) | Study population | RR 0.83 | 1354 | ⊕⊕⊕⊝ | ||
| 601 per 1000 | 499 per 1000 | |||||
| Ventricular dysfunction (as defined by trialists) | Study population | RR 0.61 | 1374 | ⊕⊕⊕⊕ | Ventricular dysfunction was defined by trialists as left ventricular dysfunction and heart failure. Left ventricular dysfunction (LVD) included all patients with asymptomatic left ventricular systolic dysfunction (LVSD) and/or asymptomatic left ventricular diastolic dysfunction (LVDD). Heart failure included all patients with LVD (LVSD and/or LVDD) and with symptoms of heart failure requiring emergency admission to hospital | |
| 87 per 1000 | 53 per 1000 | |||||
| Change in NP level at the end of follow‐up | Mean change in NP level at the end of follow‐up was 9.52 pg/mL | MD 4.06 pg/mL higher | ‐ | 1374 | ⊕⊕⊕⊝ | These data come from Ledwidge 2013; NP level was reported as BNP. Huelsmann 2013 also reported change in NT‐proBNP after 1 year of treatment. However, these data were presented as median and interquartile range; therefore we could not calculate mean difference |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aImprecision: very wide 95% confidence interval, which includes the line of null effect and is consistent with the possibility of both important benefits and harms. The sample size is small. Downgraded by two levels. bRisk of bias: both studies did not blind patients or personnel. Downgraded by one level. cImprecision: wide 95% confidence interval, which includes the line of null effect and is consistent with the possibility of important benefits and harms. Downgraded by one level. dRisk of bias: downgraded by one level due to attrition bias as one study excluded from analysis patients who were lost to follow‐up and those who withdrew, who did not have at least one year of detailed follow‐up cost data. eRisk of bias: echocardiographer and cardiologist reviewing end of study echo were blinded and diagnosis of ventricular dysfunction was based on clearly defined echocardiographic measures, which removed subjectivity in outcome assessment. Not downgraded. fImprecision: wide CIs that cross the line of no effect (zero) and include the possibility of the intervention causing both benefit and harm. Downgraded by one level. | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Cardiovascular mortality (as defined by trialists) Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 2 Cardiovascular hospitalisation (as defined by trialists) Show forest plot | 2 | 1674 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.52 [0.40, 0.68] |
| 3 Cardiovascular hospitalisation (as defined by trialists) by natriuretic peptide level Show forest plot | 2 | 1674 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.50 [0.38, 0.65] |
| 3.1 BNP < 50 pg/mL and NT‐proBNP < 125 pg/mL | 1 | 876 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.55 [0.32, 0.95] |
| 3.2 BNP > 50 pg/mL and NT‐proBNP > 125 pg/mL | 2 | 798 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.48 [0.36, 0.65] |
| 4 All‐cause mortality Show forest plot | 2 | 1354 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.90 [0.60, 1.35] |
| 5 All‐cause hospitalisation (all occurrences) Show forest plot | 2 | 1354 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.83 [0.75, 0.92] |
| 6 Ventricular dysfunction (as defined by trialists) Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 7 Change in NP level at the end of follow‐up Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |

