Retiro del tratamiento biológico o inmunosupresor en pacientes con enfermedad de Crohn inactiva
Resumen
Antecedentes
La enfermedad de Crohn (EC) es una enfermedad gastrointestinal crónica, con recaídas y remisiones, que puede causar morbilidad y discapacidad significativas. Las guías actuales de tratamiento recomiendan la intervención temprana con tratamiento inmunosupresor o biológico en los pacientes de alto riesgo que se presentan con un fenotipo de enfermedad grave. La factibilidad de la reducción gradual del tratamiento una vez que se logra la remisión es una pregunta frecuente en la práctica clínica que da lugar a inquietudes por parte de los pacientes y los médicos con respecto a la seguridad, los eventos adversos, el coste y las regulaciones nacionales. El retiro de los fármacos inmunosupresores y biológicos en los pacientes con EC inactiva puede limitar los eventos adversos y reducir los costes de la asistencia sanitaria. Alternativamente, el retiro de estas farmacoterapias puede dar lugar a resultados negativos como recaída de la enfermedad, desensibilización al fármaco, daño intestinal y necesidad de cirugía.
Objetivos
Evaluar la factibilidad y la seguridad de retirar los fármacos inmunosupresores o biológicos, administrados solos o en combinación, en los pacientes con EC inactiva.
Métodos de búsqueda
Se realizaron búsquedas en CENTRAL, MEDLINE, Embase y en el registro especializado del Grupo Cochrane de Enfermedad Inflamatoria Intestinal y Trastornos Funcionales del Intestino (EII/TFI) (Cochrane Inflammatory Bowel Disease and Functional Bowel Disorders Group, IBD/FBD Group) desde su inicio hasta el 19 de diciembre de 2017. También se buscó en las listas de referencias de manuscritos potencialmente relevantes y actas de congresos para identificar estudios adicionales.
Criterios de selección
Se consideraron para inclusión los ensayos controlados aleatorios (ECA) y los estudios de cohortes prospectivos que siguieron a los pacientes durante seis meses como mínimo después de la retirada de los fármacos. La población de pacientes de interés fueron adultos (> 18 años) con EC (definida según criterios clínicos, endoscópicos o histológicos convencionales) que habían logrado la remisión mientras recibían fármacos inmunosupresores o biológicos administrados solos o en combinación. A los pacientes se les retiró el régimen farmacológico después de un período de tratamiento de mantenimiento de al menos seis meses. La comparación fue la atención habitual (es decir, continuación del régimen farmacológico).
Obtención y análisis de los datos
La medida de resultado primaria fue la proporción de pacientes con recaída después del retiro de los fármacos inmunosupresores o biológicos, administrados solos o en combinación. Los resultados secundarios incluyeron: proporción de pacientes que respondieron a la reintroducción de los fármacos inmunosupresores o biológicos, administrados como monoterapia o como tratamiento de combinación; proporción de pacientes que necesitaron cirugía después de la recaída; proporción de pacientes que necesitaron hospitalización por EC después de la recaída; proporción de pacientes que desarrollaron complicaciones nuevas relacionadas con la EC (p.ej. fístula, abscesos, estenosis) después de la recaída; proporción de pacientes con marcadores biológicos de inflamación elevados (PCR, calprotectina fecal) en los que se retiró y en los que continuaron el tratamiento; proporción de pacientes con anticuerpos contra los fármacos y niveles séricos mínimos del fármaco; tiempo hasta la recaída; y proporción de pacientes con eventos adversos, eventos adversos graves y retiros debido a eventos adversos. Para los resultados dicotómicos, se calculó el cociente de riesgos (CR) y el intervalo de confianza del 95% (IC del 95%). Los datos se analizaron por intención de tratar en que se supuso que los pacientes con resultados finales carentes habían presentado una recaída. La calidad general de la evidencia que apoya los resultados primarios y secundarios se evaluó con los criterios GRADE.
Resultados principales
Fueron elegibles para inclusión seis ECA (326 pacientes) que evaluaron el retiro terapéutico en pacientes con EC inactiva. En cuatro ECA se retiró la monoterapia con azatioprina y en dos ECA se retiró la azatioprina de un régimen de tratamiento de combinación que consistía en azatioprina con infliximab. Ningún estudio de retiro de monoterapia biológica fue elegible para inclusión. La mayoría de los estudios se consideraron con riesgo incierto o bajo de sesgo, excepto tres ECA abiertos que se consideraron con alto riesgo de sesgo en el cegamiento. Cuatro ECA (215 participantes) compararon el retiro con la continuación de la monoterapia con azatioprina, mientras que dos estudios (125 participantes) compararon el retiro de la azatioprina de un régimen de combinación con la continuación del tratamiento de combinación. Se mostró que la continuación de la monoterapia con azatioprina fue superior al retiro en el riesgo de recaída clínica. El 32% (36/111) de los participantes con retiro de azatioprina presentaron recaída, en comparación con el 14% (14/104) de los participantes que siguieron con el tratamiento con azatioprina (CR 0,42; IC del 95%: 0,24 a 0,72; evidencia de baja calidad según GRADE). Sin embargo, no está claro si hay alguna diferencia entre los grupos en las complicaciones nuevas relacionadas con la EC (CR 0,34; IC del 95%: 0,06 a 2,08; evidencia de baja calidad según GRADE), los eventos adversos (CR 0,88; IC del 95%: 0,67 a 1,17; evidencia de baja calidad según GRADE), los eventos adversos graves (CR 3,29; IC del 95%: 0,35 a 30,80; evidencia de baja calidad según GRADE) o los retiros debido a los eventos adversos (CR 2,59; IC del 95%: 0,35 a 19,04; evidencia de baja calidad según GRADE). Los eventos adversos frecuentes incluyeron infecciones, leucopenia leve, síntomas abdominales, artralgias, cefalea y enzimas hepáticas elevadas. No se observaron diferencias entre el retiro de la azatioprina del tratamiento de combinación versus la continuación del tratamiento de combinación en la recaída clínica. Entre los pacientes que continuaron el tratamiento de combinación con azatioprina e infliximab, el 48% (27/56) presentó recaída clínica en comparación con el 49% (27/55) de los pacientes a los que se les retiró la azatioprina pero permanecieron con infliximab (CR 1,02; IC del 95%: 0,68 a 1,52; P = 0,32; evidencia de baja calidad según GRADE). Los efectos sobre los eventos adversos (CR 1,11; IC del 95%: 0,44 a 2,81; evidencia de baja calidad según GRADE) o los eventos adversos graves no están claros (CR 1,00; IC del 95%: 0,21 a 4,66; evidencia de muy baja calidad según GRADE). Los eventos adversos frecuentes en los estudios de tratamiento de combinación incluyeron infecciones, elevación de las pruebas hepáticas, artralgias y reacciones a la infusión.
Conclusiones de los autores
Los efectos del retiro del tratamiento inmunosupresor en los pacientes con enfermedad de Crohn inactiva no están claros. Evidencia de muy baja calidad indica que continuar la monoterapia con azatioprina puede ser superior al retiro para evitar la recaída clínica, mientras que evidencia de muy baja calidad indica que puede no haber diferencias en las tasas clínicas de recaída entre retirar la azatioprina de un régimen de tratamiento de combinación y continuar el tratamiento de combinación. No está claro si el retiro de la azatioprina, administrada inicialmente sola o en combinación, repercute en la aparición de las complicaciones relacionadas con la EC, los eventos adversos, los eventos adversos graves o los retiros debido a eventos adversos. Se necesitan estudios de investigación adicionales de alta calidad en esta área, en particular ECA doble ciego en los que se retire un tratamiento biológico o inmunosupresor diferente de la azatioprina.
PICO
Resumen en términos sencillos
¿Es posible el retiro de la farmacoterapia en los pacientes con EC que han logrado la remisión?
Antecedentes
La enfermedad de Crohn es una enfermedad inflamatoria, crónica y grave de los intestinos delgado y grueso. Los síntomas incluyen dolor abdominal, diarrea, hemorragia y pérdida de peso. Cuando los pacientes con enfermedad de Crohn presentan síntomas la enfermedad está "activa". Cuando los síntomas desaparecen, se le llama "remisión". Cuando los pacientes en remisión presentan síntomas, se le llama "recaída". Los fármacos inmunosupresores (p.ej. azatioprina, 6‐mercaptopurina y metotrexato) y los fármacos biológicos (p.ej. infliximab, adalimumab, vedolizumab y ustekinumab) se utilizan de manera habitual, solos o en combinación, para tratar la enfermedad de Crohn. Aunque son efectivos para controlar inicialmente la enfermedad (es decir, inducir la remisión), existen preocupaciones con respecto a la seguridad y los costes del uso a largo plazo de estos fármacos para la prevención de la recaída en pacientes con enfermedad de Crohn en remisión.
Características de los estudios
Se realizó una revisión bibliográfica integral y se identificaron seis ensayos controlados aleatorios (un experimento en el que los participantes se asignan al azar a recibir dos o más intervenciones y se comparan los resultados), en los que participaron 326 pacientes. Cuatro de los seis estudios asignaron a pacientes que recibían azatioprina sola a continuar o retirar el tratamiento (215 participantes). Dos de los seis estudios asignaron a pacientes que recibían azatioprina además de infliximab a continuar el tratamiento o retirar la azatioprina (111 participantes).
Resultados clave
La recaída clínica ocurrió en el 13% (14/104) de los pacientes que continuaron la monoterapia con azatioprina, en comparación con el 32% (36/111) de los pacientes que se retiraron de la monoterapia con azatioprina. No se observaron diferencias en las complicaciones relacionadas con la enfermedad de Crohn, los efectos secundarios, los efectos secundarios graves ni los retiros debido a efectos secundarios. Los efectos secundarios frecuentes incluyeron infecciones, disminución leve en el número de leucocitos, síntomas abdominales, dolor en las articulaciones, cefalea y enzimas hepáticas elevadas. Entre los pacientes que continuaron el tratamiento de combinación con azatioprina e infliximab, el 48% (27/56) presentó recaída clínica, en comparación con el 49% (27/55) de los pacientes en los que se retiró la azatioprina pero siguieron con infliximab. No se observaron diferencias en los efectos secundarios, los efectos secundarios graves ni los retiros debido a efectos secundarios. Los efectos secundarios frecuentes informados en los estudios de tratamiento de combinación incluyeron infecciones, elevación de las pruebas hepáticas, dolor en las articulaciones y reacciones a la infusión (una reacción de hipersensibilidad a la medicación biológica).
Calidad de la evidencia
En general, la calidad de la evidencia para cada resultado fue baja debido al alto riesgo de sesgo de los estudios y al escaso número de pacientes evaluados.
Conclusiones
Los efectos del retiro del tratamiento inmunosupresor en los pacientes con enfermedad de Crohn en remisión no están claros. Evidencia de muy baja calidad indica que la monoterapia continua con azatioprina puede ser superior al retiro de la azatioprina para evitar la recaída clínica en los pacientes con enfermedad de Crohn en remisión. Evidencia de muy baja calidad indica que el retiro del inmunosupresor después del tratamiento de combinación no parece repercutir en el riesgo de recaída. No está claro si el retiro de la azatioprina, administrada inicialmente sola o en combinación, repercute en la aparición de complicaciones relacionadas con la enfermedad de Crohn, los efectos secundarios, los efectos secundarios graves o el retiro de los estudios debido a efectos secundarios. Se necesitan estudios de investigación adicionales en esta área para informar mejor la práctica clínica, en particular ensayos controlados aleatorios de alta calidad que examinen los resultados cuando se retira el tratamiento biológico.
Conclusiones de los autores
Summary of findings
| Usual care compared to immunosuppressive withdrawal after monotherapy for patients with quiescent Crohn's disease | ||||||
| Patient or population: Patients with quiescent Crohn's disease | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with immunosuppressive withdrawal after monotherapy | Risk with usual care | |||||
| Relapse at 12, 18 or 24 months | Study population | RR 0.42 | 215 | ⊕⊕⊝⊝ | Sparse data (50 events) | |
| 324 per 1,000 | 136 per 1,000 | |||||
| New CD‐related complications | Study population | RR 0.34 | 135 | ⊕⊝⊝⊝ | Very sparse data (5 events) | |
| 58 per 1,000 | 20 per 1,000 | |||||
| Adverse events | Study population | RR 0.88 | 186 | ⊕⊕⊝⊝ | Sparse data (45 events) | |
| 240 per 1,000 | 211 per 1,000 | |||||
| Serious adverse events | Study population | RR 3.29 | 134 | ⊕⊝⊝⊝ | Very sparse data (2 events) | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Withdrawal due to adverse events | Study population | RR 2.59 | 135 | ⊕⊝⊝⊝ | Very sparse data (5 events) | |
| 14 per 1,000 | 38 per 1,000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded one level due to high risk of bias for blinding in one study and unclear risk of bias in three studies in the pooled analysis 2 Downgraded one level due to sparse data 3 Downgraded one level due to unclear risk of bias in the two studies in the pooled analysis 4 Downgraded two levels due to very sparse data 5 Downgraded one level due to unclear risk of bias in the three studies in the pooled analysis | ||||||
| Usual care compared to immunosuppressive withdrawal after combination therapy for patients with quiescent Crohn's disease | ||||||
| Patient or population: Patients with quiescent Crohn's disease | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with immunosuppressive withdrawal after combination therapy | Risk with usual care | |||||
| Relapse at 12 or 24 months | Study population | RR 1.02 | 111 | ⊕⊕⊝⊝ | Sparse data (54 events) | |
| 491 per 1,000 | 501 per 1,000 | |||||
| Adverse events | Study population | RR 1.11 | 111 | ⊕⊕⊝⊝ | Sparse data (51 events) | |
| 455 per 1,000 | 505 per 1,000 | |||||
| Serious adverse events | Study population | RR 1.00 | 80 | ⊕⊝⊝⊝ | Very sparse data (6 events) | |
| 75 per 1,000 | 75 per 1,000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded one level due to high risk of bias for blinding 2 Downgraded one level due to sparse data 3 Downgraded two levels due to very sparse data | ||||||
Antecedentes
Descripción de la afección
La enfermedad de Crohn (EC) es una enfermedad gastrointestinal crónica de mediación inmune, con recaídas y remisiones, que puede dar lugar a morbilidad y discapacidad significativas debido al daño intestinal progresivo. Los síntomas característicos incluyen dolor abdominal, diarrea crónica, pérdida de peso, fatiga y deterioro de la calidad de vida. La etiología exacta de la EC aún se desconoce, aunque es probable que una interacción compleja entre los factores ambientales, la sensibilidad genética y la microbiota intestinal provoque una respuesta inmune anormal y el compromiso de la función de la barrera epitelial, que caracterizan la condición (Haag 2015).
Los adultos jóvenes son los más afectados, y la incidencia más alta de diagnóstico se informa durante la segunda o tercera décadas de la vida (Molodecky 2012). Estudios epidemiológicos muestran un aumento constante en la incidencia global de EC (Molodecky 2012). Las tasas de incidencia más altas se informan en Australia (29,3 por 100 000 años‐persona; Wilson 2010), Canadá (20 por 100 000 años‐persona; Bernstein 2006), Nueva Zelanda (16 por 100 000 años‐persona; Gearry 2006) y Europa del norte (10 por 100 000 años‐persona; Thompson 1998).
La EC afecta con mayor frecuencia el íleon y el colon terminal; sin embargo, puede estar afectado cualquier segmento del aparato gastrointestinal. Hasta la mitad de los pacientes pueden presentar manifestaciones extraintestinales (Harbord 2016). La enfermedad inflamatoria es el fenotipo más frecuente en el momento del diagnóstico, aunque aproximadamente el 50% de los pacientes con el tiempo desarrollan estenosis o enfermedad penetrante que a menudo requiere cirugía (Peyrin‐Biroulet 2012). Más del 90% de los pacientes con EC presentan recaída endoscópica de la enfermedad en los 15 años posteriores a la primera resección intestinal (Buisson 2012).
Descripción de la intervención
Las guías actuales de tratamiento recomiendan un enfoque secuencial de "aumento gradual", con la administración inicial de fármacos de primera línea como los corticosteroides orales y el paso posterior a los agentes inmunosupresores y biológicos como monoterapia o en combinación, si fuera necesario (Colombel 2010a). Por el contrario, el enfoque de "reducción gradual" incluye el tratamiento inicial de los pacientes de alto riesgo y los que presentan enfermedad grave al diagnóstico con fármacos inmunosupresores y biológicos. Durante la última década se ha acumulado evidencia en apoyo a la estrategia de reducción gradual (Colombel 2010b; D'Haens 2010). Por ejemplo, en el ensayo SONIC (The Study of Biologic and Immunomodulator Naive Patients in Crohn’s Disease), el 56,8% de los pacientes tratados con régimen de combinación lograron la remisión sin esteroides a la semana 26, en comparación con el 44,4% de los pacientes que recibieron fármacos biológicos solos, o con el 30% de los que recibieron azatioprina sola (Colombel 2010b). Los resultados de D’Haens 2008 también indican que el tratamiento de combinación temprano puede ser más efectivo que el tratamiento convencional para la inducción de la remisión en la EC. A la semana 26, el 60% de los pacientes que recibieron infliximab y azatioprina en combinación lograron la remisión clínica, en comparación con el 23% de los que recibieron corticosteroides seguidos en secuencia por azatioprina e infliximab (D'Haens 2008). Por lo tanto, en esta era de intervención temprana, hay un número cada vez mayor de pacientes que se exponen a los productos inmunosupresores y biológicos al inicio de la enfermedad y durante un período de tiempo más prolongado.
La factibilidad de reducir de forma gradual el tratamiento una vez que se logra la remisión es una pregunta frecuente en la práctica clínica, debido a las inquietudes de los pacientes y los médicos con respecto a la seguridad, los eventos adversos, el coste, la comodidad y las regulaciones nacionales. La exposición a largo plazo a las tiopurinas se ha asociado con la aparición de trastornos linfoproliferativos (Beaugerie 2009), así como a cáncer de la piel y las vías urinarias (Bourrier 2016; Peyrin‐Biroulet 2011). Los tratamientos con antagonistas del factor alfa de necrosis tumoral (TNF‐α) pueden aumentar el riesgo de infecciones (Billioud 2013), y existe evidencia contradictoria acerca de un aumento potencial del riesgo de melanoma (Andersen 2014; Long 2012). Los pacientes que reciben tratamiento de combinación pueden tener un mayor riesgo de desarrollar linfoma de linfocitos T hepatoesplénicos (Subramaniam 2014), linfoma no Hodgkin (Siegel 2009) e infecciones. Aún se desconocen las posibles consecuencias a largo plazo de la exposición a los agentes biológicos.
Los fármacos biológicos son relativamente costosos. Se calcula que los antagonistas del TNF‐α representan el 64% de los costes directos del tratamiento de la EC (van der Valk 2014), aunque es probable que los costes disminuyan con la aprobación de fármacos biosimilares. Han surgido preguntas acerca de si el retiro del tratamiento inmunosupresor y biológico en los pacientes con EC inactiva puede limitar los eventos adversos y reducir los altos costes de la asistencia sanitaria asociados con estos tratamientos, a la vez que se mantiene la remisión.
De qué manera podría funcionar la intervención
El retiro de los fármacos inmunosupresores y biológicos en los pacientes con EC inactiva puede reducir el riesgo de eventos adversos y reducir los costos de la asistencia sanitaria, sin repercutir sobre el estado de la enfermedad. Alternativamente, el retiro de estas farmacoterapias puede dar lugar a resultados negativos como recaída de la enfermedad, desensibilización al fármaco, daño intestinal y necesidad de cirugía.
Por qué es importante realizar esta revisión
Fue necesaria una evaluación sistemática de la bibliografía para destacar los posibles efectos beneficiosos y los riesgos de retirar la farmacoterapia inmunosupresora y biológica en los pacientes con EC que han logrado la remisión.
Objetivos
El objetivo primario de esta revisión fue evaluar la factibilidad y la seguridad del retiro de los fármacos inmunosupresores o biológicos, administrados solos o en combinación, en los pacientes con EC inactiva.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se consideraron para inclusión los ensayos controlados aleatorios (ECA), los ensayos clínicos controlados y los estudios de cohortes prospectivos con un grupo control. Los estudios incluidos siguieron a los pacientes durante seis meses como mínimo después del retiro del fármaco.
Tipos de participantes
Se consideraron para inclusión los adultos (> 18 años) con EC (definida según criterios clínicos, endoscópicos o histológicos convencionales) que lograron la remisión (como se definió en el estudio original) mientras recibían fármacos inmunosupresores o biológicos administrados solos o en combinación.
Tipos de intervenciones
La intervención de interés fue el retiro de los fármacos inmunosupresores o biológicos, administrados solos o en combinación, después de un período de tratamiento de mantenimiento de, al menos, seis meses. El grupo de comparación recibió atención habitual.
Tipos de medida de resultado
Resultados primarios
El resultado primario fue la proporción de pacientes con recaída (como se definió en los estudios incluidos) después del retiro de los fármacos inmunosupresores o biológicos, administrados solos o en combinación.
Resultados secundarios
Los resultados secundarios (cuando estuvieron disponibles) incluyeron: 1) proporción de pacientes que respondieron a la reintroducción de los fármacos inmunosupresores o biológicos, administrados como monoterapia o como tratamiento de combinación; 2) proporción de pacientes que necesitaron cirugía después de la recaída; 3) proporción de pacientes que necesitaron hospitalización por EC después de la recaída; 4) proporción de pacientes que desarrollaron complicaciones nuevas relacionadas con la EC (p.ej. fístula, abscesos, estenosis) después de la recaída; 5) proporción de pacientes con marcadores biológicos de inflamación elevados (PCR, calprotectina fecal) entre los que había unos que se les retiró el tratamiento y unos otros que lo continuaron; 6) proporción de pacientes con anticuerpos contra los fármacos y niveles séricos mínimos del fármaco; 7) tiempo hasta la recaída y 8) proporción de pacientes con eventos adversos, eventos adversos graves y retiros debido a eventos adversos.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
The following electronic databases were searched:
1. MEDLINE (Ovid, 1946 to 19 December 2017);
2. EMBASE (Ovid, 1984 to 19 December 2017);
3. CENTRAL; and
4. The Cochrane IBD Group Specialized Register.
The search strategies are listed in Appendix 1. The search was not limited by language, year of publication or type of publication.
Búsqueda de otros recursos
We also searched the reference lists of potentially relevant manuscripts to identify additional studies. Conference proceedings from Digestive Disease Week, the European Crohn's and Colitis Organisation annual meeting, and United European Gastroenterology Week published during the last five years were also searched to identify studies reported in abstract form only. ClinicalTrials.gov was searched to identify ongoing studies.
Obtención y análisis de los datos
Selección de los estudios
Two authors (JT and RB) independently screened titles and abstracts identified by the literature search to determine eligibility based on the inclusion criteria described above. Any disagreements between authors regarding study inclusion were resolved by discussion.
Extracción y manejo de los datos
A data extraction form was used to collect information from the relevant studies. Two authors (JT and RB) independently extracted data. Consensus regarding data extraction was reached after discussion between authors. The following data were retrieved from the included studies:
1) general information: title, journal, year, publication type;
2) study information: study type, study design, setting, inclusion/exclusion criteria, methods of randomization, concealment of allocation and blinding, study duration, and definitions of remission and relapse;
3) population characteristics: number of participants recruited, total number of patients screened and randomized, total number of participants followed, baseline characteristics (e.g. age, sex, race, disease phenotype, disease duration, concurrent medications; prior medications);
4) intervention characteristics: type and dose of medication discontinued, duration of remission prior to discontinuation, duration of therapy prior to discontinuation;
5) follow‐up (length of follow‐up, withdrawals, number of patients lost to follow‐up); and
5) outcomes: primary and secondary outcomes, as described above.
Evaluación del riesgo de sesgo de los estudios incluidos
The methodological quality of each included RCT was independently assessed by two authors (JT and RB) using the Cochrane risk of bias tool (Higgins 2011a). Consensus was reached after discussion between authors on all studies. Factors assessed included:
1) sequence generation (i.e. was the allocation sequence adequately generated?);
2) allocation sequence concealment (i.e. was allocation adequately concealed?);
3) blinding (i.e. was knowledge of the allocated intervention adequately prevented during the study?);
4) incomplete outcome data (i.e. were incomplete outcome data adequately addressed?);
5) selective outcome reporting (i.e. are reports of the study free of suggestion of selective outcome reporting?); and
6) other potential sources of bias (i.e. was the study apparently free of other problems that could put it at high risk of bias?).
Studies will be assigned a low risk of bias, high risk of bias, or unclear risk of bias for each category.
We planned to assess the quality of non‐randomized, cohort studies was assessed using the Newcastle‐Ottawa scale (NOS) (Wells 2017). Factors assessed for cohort studies were:
1) Selection:
a) representativeness of the exposed cohort;
b) selection of the non‐exposed cohort; and
c) ascertainment of exposure.
2) Comparability:
a) comparability of cohorts on the basis of the design or analysis.
3) Outcome:
a) assessment of outcome;
b) appropriate length of follow‐up for outcomes to occur; and
c) adequacy of follow‐up of cohorts.
The quality of the total body of evidence for the primary and secondary outcomes of interest was assessed using the GRADE criteria (Schünemann 2011). Randomized trials are considered high quality and were downgraded due to:
1) risk of bias;
2) indirect evidence;
3) inconsistency (unexplained heterogeneity);
4) imprecision; and
5) publication bias.
The overall quality of evidence for each outcome was classified as high quality (i.e. further research is very unlikely to change our confidence in the estimate of effect); moderate quality (i.e. further research is likely to have an important impact on our confidence in the estimate of effect and may change the estimate); low quality (i.e. further research is very likely to have an important impact on our confidence in the estimate of effect and is likely to change the estimate); or very low quality (i.e. we are very uncertain about the estimate).
Medidas del efecto del tratamiento
Review Manager (RevMan 5.3.5) was used to analyze data. All data were analyzed on an intention‐to‐treat (ITT) basis. The risk ratio (RR) and corresponding 95% confidence interval (CI) were calculated for dichotomous outcomes. We planned to calculate the mean difference (MD) and corresponding 95% CI for continuous outcomes and the hazard ratio (HR) and corresponding 95% CI using the generic inverse‐variance method for studies reporting the log hazard ratio and standard error for time‐to‐event outcomes.
Cuestiones relativas a la unidad de análisis
When studies reported multiple observations for the same outcome, the outcomes were combined for fixed intervals of follow‐up (e.g. clinical remission at eight weeks). Cross‐over trials were included if data was available from the first phase of the study (i.e. before any cross‐over). Where studies allocated participants to more than one treatment arm, these arms were to be pooled for the primary analysis. Subgroup analyses were to be performed to compare efficacy and safety among different doses of drugs. The primary analysis considered the proportion of patients who experienced at least one efficacy or safety event.
Manejo de los datos faltantes
The original study authors were contacted in the case of unclear or missing data. Data that remained missing were considered to be a treatment failure, in accordance with the ITT principle. Where appropriate, sensitivity analyses were conducted to assess the impact of including unclear data on the effect estimate.
Evaluación de la heterogeneidad
Heterogeneity was assessed using the Chi2 test (a P value of 0.10 was considered statistically significant) and the I2 statistic. An I2 value of 25% indicates low heterogeneity, 50% indicates moderate heterogeneity and 75% indicates high heterogeneity (Higgins 2003). We used sensitivity analyses to explore potential explanations for heterogeneity. If the I2 statistic showed a moderate to high degree of heterogeneity and the Chi2 test was statistically significant, forest plots were visually inspected for obvious outliers and sensitivity analysis were performed excluding the outlier to see if this explains the heterogeneity.
Evaluación de los sesgos de notificación
Potential reporting bias was evaluated by comparing outcomes listed in protocols to published manuscripts. When protocols were not available, we compared outcomes listed in the methods section of published manuscripts to those described in the results section. If a sufficient number of studies are included (i.e. > 10) in the pooled analyses, we planned to investigate potential publication bias using funnel plots (Egger 1997).
Síntesis de los datos
Data from individual trials were combined for meta‐analysis when the interventions, patient groups and outcomes were sufficiently similar (as determined by consensus). The pooled RR and 95% CI were calculated for dichotomous outcomes. For continuous outcomes, we planned to calculate the pooled MD and corresponding 95% CI. The standardized mean difference (SMD) and 95% CI were planned to be calculated when difference scales were used to measure the same outcome. Where studies reported estimates of log hazard ratios and standard errors obtained from Cox proportional hazards regression models, we planned to pool study results using the generic inverse‐variance method to obtain the pooled HR and corresponding 95% CI. Where a mixture of log‐rank and Cox model estimates are obtained from the studies, we planned to convert the log‐rank estimates into log hazard ratios and standard errors (Higgins 2011b). A fixed‐effect model was used to pool data unless heterogeneity exists between the studies. A random‐effects model was employed if heterogeneity existed (I2 50 to 75%). We did not pool data for meta‐analysis if a high degree of heterogeneity (I2 ≥ 75%) was detected.
Análisis de subgrupos e investigación de la heterogeneidad
Planned subgroup analyses included: different drug doses and routes of administration and different study designs (RCTs versus observational studies).
Análisis de sensibilidad
Sensitivity analyses were planned to examine the impact of the following variables on the pooled effect: random‐effects versus fixed‐effect modelling; low risk of bias only versus unclear or high risk of bias; and relevant loss to follow‐up (> 10% versus < 10%).
Results
Description of studies
Results of the search
A literature search conducted on 19 December 2017 identified 10,902 records. After excluding duplicate records, two authors (RB and JT) independently examined the abstracts of 6860 citations to identify eligible studies. Once the non‐applicable studies were excluded, 77 full‐text articles were assessed (Figure 1). A total of 67 of these records were excluded with reasons (see Characteristics of excluded studies). Eight reports of six studies that enrolled a total of 326 CD patients were determined to be eligible for inclusion in the review (Lémann 2005; O'Donoghue 1978; Roblin 2017; Van Assche 2008; Vilien 2004; Wenzl 2015; See Characteristics of included studies). Two ongoing studies were also identified (NCT01817426; NCT02177071). Four of the six included studies were RCTs in which immunosuppressant monotherapy (i.e. azathioprine) was discontinued (Lémann 2005; O'Donoghue 1978; Vilien 2004; Wenzl 2015). Two RCTs evaluated azathioprine withdrawal in patients who had achieved remission with azathioprine and infliximab combination therapy (Roblin 2017; Van Assche 2008). No studies of biologic monotherapy withdrawal were eligible for inclusion.

Study flow diagram.
Included studies
Roblin 2017 was an open‐label randomized trial that followed three cohorts of patients with inflammatory bowel disease (N = 81; 45 patients with CD) who had been treated with azathioprine and infliximab combination therapy for at least one year. These patients were in deep remission for at least six months. In cohort A patients continued to receive a stable dose of combination therapy; in cohort B, the initial azathioprine dose was reduced by half; and in cohort C, azathioprine therapy was completely withdrawn while the initial infliximab dose remained stable. The primary outcome was clinical relapse as defined by a Crohn's Disease Activity Index (CDAI) > 220 with an increase in CDAI of greater than 70 points from the previous assessment or need to change the original therapeutic regimen because of adverse events or drug intolerance.at 12 months. Patients with CD from cohorts A and C (n = 31) were included in this review.
Lémann 2005 was a non‐inferiority placebo‐controlled double‐blind RCT in which 83 patients with quiescent CD who had received azathioprine for at least 42 months were allocated to either continue azathioprine (n = 40) or switch to placebo (n = 43). The primary outcome was clinical relapse (as defined by a CDAI score between 150 and 250 for 3 consecutive weeks with an increase of at least 75 points above baseline value, or the need for CD‐related surgery except for limited perianal surgery) at 18 months.
O'Donoghue 1978 was a placebo‐controlled double‐blind trial in which 51 CD patients who achieved clinical remission after receiving at least 6 months of azathioprine monotherapy were randomized to continue azathioprine (n = 27) or switch to placebo (n = 24). The primary outcome was clinical relapse (defined as a significant deterioration in clinical state requiring a change in treatment as judged by two blinded physicians) at 12 months.
In Van Assche 2008, 80 patients who were in clinical remission and had received combination (azathioprine and infliximab) therapy for more than 6 months were randomized to either discontinue (n = 40) or continue (n = 40) azathioprine. The primary outcome was the proportion of patients who required a change in the infliximab dosing interval or stopped infliximab therapy. Patients were followed for 104 weeks.
Vilien 2004 was an open‐label RCT in which 29 CD patients were randomized to continue (n = 14) or stop (n = 15) azathioprine monotherapy. The patients had received azathioprine for at least two years and were in clinical remission at the time of withdrawal. The primary outcome was clinical relapse (as defined as a CDAI rise of greater or equal to 75 points and a total CDAI of at least 150, or, disease activity necessitating intervention) at month 12.
Wenzl 2015 was a placebo‐controlled double‐blind trial in which 52 CD patients in stable remission for at least 42 months and a minimum four‐year treatment history with azathioprine were randomized to continue azathioprine therapy (n = 26) or switch to placebo (n = 26). The primary outcome was clinical relapse at week 24, defined as either: a) a CDAI score greater than 150 with an increase of at least 60 points above the baseline CDAI score in the absence of infectious diarrhea; b) the development of at least one new fistula in patients who were fistula‐free prior to trial enrolment; c) an increase of four or more Perianal Disease Activity Index points compared to baseline; d) disease activity necessitating therapy with oral corticosteroids or anti‐TNF‐α drugs; e) the need for CD‐related abdominal or perianal surgery).
Excluded studies
Sixty‐seven reports were excluded during the screening process (See Characteristics of excluded studies). One study was excluded because it was a case report (Begun 2016). Helwig 2017 was excluded because it was a review article. Two letters were excluded (Benitez 2015; Chaparro 2015). Two of the reports described studies in which an immunosuppressant or biologic drug, or combination therapy, was reduced in dose rather than being completely withdrawn (Amiot 2016; Paul 2015). In three studies patients did not receive maintenance therapy for the minimum six‐month duration prior to therapy withdrawal (Feagan 2015a; Feagan 2015b; Rismo 2013). A total of nine reports exclusively enrolled pediatric patients (Crombe 2010a; Crombe 2010b; Crombe 2011; Grossi 2015b; Kang 2016; Kierkus 2015; Nuti 2010a; Nuti 2010b; Wynands 2008), and in one study CD specific data were not available (de Lima 2016). Sixteen studies were of a retrospective design and therefore did not met the inclusion criteria (Bouhnik 1996; Chauvin 2014; Domenech 2005; Fischer 2014; Gallego 2015; Hlavaty 2016b; Iborra 2016a; Iborra 2016b; Iimuro 2011; Kennedy 2016; Kim 1999; Monterubbianesi 2015; Monterubbianesi 2016a; Monterubbianesi 2016b; Waugh 2010a; Waugh 2010b). The most common reason for exclusion was the lack of a control group (i.e. a group of patients who continued to receive drug therapy), with 32 studies falling into this category (Bodini 2015; Bortlik 2015a; Bortlik 2015b; Bortlik 2016; Bots 2016a; Bots 2016b; Brooks 2017; Chen 2015a; Chen 2015b; Cortes 2016; Dai 2014; De Suray 2012a; De Suray 2012b; Duricová 2015; Echarri 2013; Farkas 2014; Grossi 2015a; Helwig 2016; Louis 2012; Molander 2014; Molander 2015; Molander 2016; Molnar 2013; Qiu 2015a; Qiu 2015b; Schnitzler 2009; Seirafi 2011a; Seirafi 2011b; Squires 2015; Thomsen 2015; Treton 2009; Zelinkova 2013).
Risk of bias in included studies
The Cochrane risk of bias analysis is summarized in Figure 2.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Four of the included RCTs were rated as low risk of bias (Lémann 2005; Roblin 2017; Vilien 2004; Wenzl 2015), and two were rated as unclear risk of bias with respect to random sequence generation (O'Donoghue 1978; Van Assche 2008). O'Donoghue 1978 reported that the treatment groups were randomly divided, but it is unclear how this was performed. Similarly, Van Assche 2008 does not clearly describe the randomization process.
Four of the included RCTs were rated as low risk of bias (Roblin 2017; Van Assche 2008; Vilien 2004; Wenzl 2015), and two were rated as unclear risk of bias (Lémann 2005; O'Donoghue 1978) with respect to allocation concealment (Lémann 2005; O'Donoghue 1978). Both Lémann 2005 and O'Donoghue 1978 fail to report sufficient detail regarding the method used to ensure that the individual performing the randomization was unaware of the next treatment assignment.
Blinding
Three of the included RCTs were rated as low risk of bias (Lémann 2005; O'Donoghue 1978; Wenzl 2015), and the remaining three studies were rated as high risk of bias with respect to blinding of participants and personnel (Roblin 2017; Van Assche 2008; Vilien 2004). Due to the open‐label design utilized in three studies no placebo was used and as such participants and personnel were aware of treatment assignment (Roblin 2017; Van Assche 2008; Vilien 2004).
With respect to blinding of outcome assessors, two of the RCTs were rated as unclear risk of bias (O'Donoghue 1978; Wenzl 2015), three were rated as high risk of bias (Roblin 2017; Van Assche 2008; Vilien 2004), and one was rated as low risk of bias (Lémann 2005). In Lémann 2005, biological tests results were reviewed by co‐investigators who were blinded to clinical information and the endoscopist was responsible for independently calculating the Crohn's Disease Endoscopic Index of Severity score. Blinded outcome assessment was not performed in three studies (Roblin 2017; Van Assche 2008; Vilien 2004).
Incomplete outcome data
All six RCTs were rated as low risk of bias for incomplete outcome data (Lémann 2005; O'Donoghue 1978; Roblin 2017; Van Assche 2008; Vilien 2004; Wenzl 2015).
Selective reporting
All six RCTs were rated as low risk of bias for selective reporting (Lémann 2005; O'Donoghue 1978; Roblin 2017; Van Assche 2008; Vilien 2004; Wenzl 2015).
Other potential sources of bias
Four of the five RCTs were rated as low risk of bias for other potential sources of bias (Lémann 2005; O'Donoghue 1978; Van Assche 2008; Vilien 2004). Wenzl 2015 and Roblin 2017 received an unclear rating for this factor since the trials were prematurely stopped due to slow enrolment.
Effects of interventions
See: Summary of findings for the main comparison Usual care compared to immunosuppressive withdrawal after monotherapy for patients with quiescent Crohn's disease; Summary of findings 2 Usual care compared to immunosuppressive withdrawal after combination therapy for patients with quiescent Crohn's disease
Withdrawal of immunosuppressant monotherapy
The proportion of patients who relapse following discontinuation
Four RCTs with a total of 215 participants provided data on the rate of clinical relapse following the discontinuation of azathioprine monotherapy (Lémann 2005; O'Donoghue 1978; Vilien 2004; Wenzl 2015). The follow‐up period was 12 months for two studies (O'Donoghue 1978, Vilien 2004), 18 months for one study (Lémann 2005) and 24 months for one study (Wenzl 2015). A total of 32.4% (36/111) participants assigned to azathioprine withdrawal experienced clinical relapse compared to 13.5% (14/104) patients assigned to therapeutic continuation. The pooled RR for the primary outcome was 0.42 (95% CI 0.24 to 0.72, P = 0.002, I² = 0%), indicating a statistically significant benefit in favour of continuing azathioprine monotherapy (Analysis 1.1). The GRADE analysis indicated that the overall quality of evidence for the primary outcome (clinical relapse) for placebo‐controlled studies was low due to high risk of bias for blinding in one study (Vilien 2004), unclear risk of bias in three studies (Lémann 2005; O'Donoghue 1978; Wenzl 2015) and sparse data (see summary of findings Table for the main comparison).
The proportion of patients with new CD‐related complications (e.g. fistula, abscesses, strictures) following discontinuation
Two RCTs with a total of 135 participants provided data on the proportion of patients with new CD‐related complications following the discontinuation of azathioprine monotherapy (Lémann 2005; Wenzl 2015). A total of 5.8% (4/69) patients in the monotherapy withdrawal group experienced a new CD‐related complication compared to 1.5% (1/66) participants in the monotherapy continuation group. The pooled RR demonstrated no statistically significant difference between the two groups (RR 0.34, 95% CI 0.06 to 2.08, P = 0.24; I² = 0%; Analysis 1.2). The GRADE analysis indicated that the overall quality of evidence for this outcome was very low due to unclear risk of bias and very sparse data (see summary of findings Table for the main comparison).
The proportion of patients with adverse events following discontinuation
Three trials with a total of 186 participants provided data on the proportion of patients who experienced an adverse event following discontinuation of azathioprine monotherapy (Lémann 2005; O'Donoghue 1978; Wenzl 2015). A total of 24.0% (23/96) of participants randomized to discontinue therapy versus 24.4% (22/90) participants randomized to continue therapy experienced an adverse event during the observation period. The pooled RR was 0.88 (95% CI 0.67 to 1.17, P = 0.39; I² = 0%) showing no statistically significant difference between the withdrawal and continuation groups (Analysis 1.3).The GRADE analysis indicated that the overall quality of evidence for this outcome was low due to sparse data and unclear risk of bias (see summary of findings Table for the main comparison). Common adverse events included infections, mild leukopenia, abdominal symptoms, arthralgias, headache and elevated liver enzymes.
The proportion of patients with serious adverse events following discontinuation
Two trials (N = 134) provided data on the proportion of patients with serious adverse events following discontinuation of azathioprine monotherapy (Lémann 2005; O'Donoghue 1978 ). A total of 0% (0/70) of participants who discontinued therapy versus 3.1% (2/64) of participants who continued therapy experienced a serious adverse event during the observation period. The pooled RR was 3.29 (95% CI 0.35 to 30.80, P = 0.30; I² = 0%) and demonstrated no statistically significant difference between treatment groups (Analysis 1.4). The GRADE analysis indicated that the quality of evidence for this outcome was very low due to unclear risk of bias and very sparse data (see summary of findings Table for the main comparison). The two serious adverse events included myelodysplastic syndrome (Lémann 2005), and pancytopenia (O'Donoghue 1978).
The proportion of patients who withdraw due to adverse events following discontinuation
Two trials with a total of 135 participants provided data on the proportion of patients who withdrew due to adverse events following discontinuation of azathioprine monotherapy (Lémann 2005; Wenzl 2015). A total of 1.4% (1/69) of participants randomized to therapeutic discontinuation versus 6.0% (4/66) of participants randomized to therapeutic continuation withdrew from the study due to an adverse event. The pooled RR of 2.59 (95% CI 0.35 to 19.04, P = 0.35; I² = 0%) failed to demonstrate a statistically significant difference between azathioprine monotherapy discontinuation compared to continuation (Analysis 1.5). The GRADE analysis indicated that the quality of evidence for this outcome was very low due to unclear risk of bias and very sparse data (see summary of findings Table for the main comparison).
Other outcomes
There were no data available to assess between‐group differences in: time to relapse; the proportion of patients who responded to the reintroduction of immunosuppressant monotherapy; the proportion of patients with elevated biomarkers of inflammation; the proportion of patients with anti‐drug antibodies and low serum trough drug levels; the proportion of patients who required surgery following relapse; or the proportion of patients who required hospitalization following relapse.
Withdrawal of anti‐TNF‐α monotherapy or other biologics
None of the included studies examined withdrawal of anti‐TNF‐α monotherapy, or withdrawal of other biologics used in Crohn's disease.
Withdrawal of immunosuppressant from combination therapy
Proportion of patients who relapse following discontinuation of immunosuppressant from combination therapy
Two studies (Roblin 2017; Van Assche 2008), reported on the proportion of patients who relapsed following discontinuation of an immunosuppressant from combination therapy (N = 111). The follow‐up period was 12 months for one study (Roblin 2017), and 24 months for one study (Van Assche 2008). When data from these studies were combined, a total of 49% (27/55) of patients who were withdrawn from azathioprine (but continued to receive infliximab) experienced clinical relapse compared to 48% (27/56) of patients who continued combination therapy with both azathioprine and infliximab. The pooled RR revealed no statistically significant difference between groups (RR 1.02, 95% CI 0.68 to 1.52, P = 0.92, I2 = 4%; (Analysis 2.1). The GRADE analysis indicated that the quality of evidence for this outcome was low due to high risk of bias for blinding and sparse data (see summary of findings Table 2).
The proportion of patients with adverse events following discontinuation of immunosuppressant from combination therapy
Two RCTs (Roblin 2017; Van Assche 2008), reported on the proportion of patients who experienced an adverse event following discontinuation of an immunosuppressant from combination therapy (N = 111). When data were pooled, 45% (25/55) of patients who were withdrawn from azathioprine (but continued to receive infliximab) experienced an adverse event compared to 46% (26/56) of patients who continued combination therapy with both azathioprine and infliximab. The pooled RR revealed no statistically significant difference between groups (RR 1.11, 95% CI 0.44 to 2.81, P = 0.83, I2 = 16%; Analysis 2.2). Likewise, the RR in each type of study neither revealed no differences between groups (RR 1.09, 95% CI 0.75 to 1.59, in the RCT (Van Assche 2008); and RR of 0.56, 95% CI 0.16 to 1.96 in the observational study (Roblin 2017)). The GRADE analysis indicated that the quality of evidence for this outcome was low due to high risk of bias for blinding and sparse data (see summary of findings Table 2). Common adverse events included infections, liver test elevations, arthralgias and infusion reactions.
The proportion of patients with serious adverse events following discontinuation of immunosuppressant from combination therapy
One study (Van Assche 2008) reported on the proportion of patients who experienced a serious adverse event following discontinuation of an immunosuppressant from combination therapy (N = 80). In both the azathioprine discontinuation and continuation groups, 0.07% (3/40) of patients experienced a serious adverse event. Thus, there was no statistically significant between‐group difference (RR 1.00, 95% CI 0.21 to 4.66; Analysis 2.3). The GRADE analysis indicated that the quality of evidence for this outcome was very low due to high risk of bias for blinding and very sparse data (see summary of findings Table 2). Serious adverse events in the azathioprine discontinuation group include appendectomy (n = 1), skin carcinoma (n = 1), and ureterolithiasis (n = 1). Serious adverse events in group that continued combination therapy include pregnancy (n = 1), pneumonia (n = 1) and partial colectomy (n =1).
Other outcomes
There were no data available to assess between‐group differences in: time to relapse; the proportion of patients who experienced a CD‐related complication; the proportion of patients who responded to the reintroduction of immunosuppressant monotherapy; the proportion of patients with elevated biomarkers of inflammation; the proportion of patients with anti‐drug antibodies and low serum trough drug levels; the proportion of patients who required surgery following relapse; the proportion of patients who required hospitalization following relapse; or the proportion of patients who withdrew from the study due to adverse events.
Withdrawal of an anti‐TNF‐αagent from combination therapy
None of the included studies examined withdrawal of an anti‐TNF‐α agent from a combination therapy regimen.
Due to the small number of included studies and limited data, pre‐specified sensitivity analyses to assess the impact of risk of bias were not performed. Sensitivity analyses to examine the impact of using random effects versus fixed effect modelling were performed; the results are presented in Table 1. The application of fixed effect modelling had no or minimal change on the point estimates for all comparisons.
| Comparison 1: Usual care versus immunosuppressive withdrawal after monotherapy | |||
| Outcome | Random Effects RR (95% CI) | Fixed Effect RR (95% CI) | Impact |
| 1.1 Relapse at 12, 18 or 24 months | 0.42 (0.24‐0.72) | 0.42 (0.24‐0.72) | No change |
| 1.2 New CD‐related complications | 0.34 (0.06‐2.08) | 0.34 (0.06‐2.08) | No change |
| 1.3 Adverse events | 0.88 (0.67‐1.17) | 0.97 (0.71‐1.32) | Minimal |
| 1.4 Serious adverse events | 3.29 (0.35‐30.80) | 3.29 (0.35‐30.80) | No change |
| 1.5 Withdrawal due to adverse events | 2.59 (0.35‐19.04) | 3.10 (0.49‐19.41) | Minimal |
| Comparison 2: Usual care versus Immunosuppressive withdrawal after combination therapy | |||
| Outcome | Random Effects RR (95% CI) | Fixed Effect RR (95% CI) | |
| 2.1 Relapse at 12 or 24 months | 1.02 (0.68‐1.52) | 0.99 (0.69‐1.43) | Minimal |
| 2.2 Adverse events | 1.11 (0.44‐2.81) | 1.04 (0.73‐1.47) | Minimal |
| 2.3 Serious adverse events | No pooling | No pooling | No pooling |
Discusión
Resumen de los resultados principales
Mediante la búsqueda bibliográfica se identificaron seis ECA que cumplieron los criterios de inclusión para esta revisión y reclutaron a 326 pacientes (Lémann 2005; O'Donoghue 1978; Roblin 2017; Van Assche 2008; Vilien 2004; Wenzl 2015).
Retiro de la monoterapia inmunosupresora
Los resultados primarios indican que los pacientes con EC inactiva que continuaron la monoterapia con azatioprina pueden tener menos probabilidades de presentar recaída clínica en comparación con los que se retiraron del tratamiento con azatioprina (CR 0,42; IC del 95%: 0,24 a 0,72; P = 0,002). Sin embargo, estos resultados se deben interpretar con cuidado porque el análisis con GRADE mostró que la calidad de la evidencia fue baja debido al alto riesgo de sesgo de cegamiento y a los datos escasos. Además, es importante señalar que ninguno de los estudios se realizó específicamente en pacientes con "remisión profunda" (remisión clínica, bioquímica y endoscópica).
No se observaron diferencias estadísticamente significativas entre los grupos con respecto a los resultados secundarios. Sin embargo, la calidad de la evidencia que apoya estos resultados varía de muy baja a baja, lo que indica que los estudios de investigación adicionales pueden repercutir sobre la certeza en la estimación del efecto, y que en último término puede cambiar dicha estimación.
Retiro del inmunosupresor del tratamiento de combinación
Dos ECA evaluaron el retiro de la azatioprina de un régimen de tratamiento de combinación en pacientes con EC inactiva (Roblin 2017; Van Assche 2008). Estos estudios informaron la proporción de pacientes que presentaron recaída y la proporción de pacientes que presentaron un evento adverso. Se realizaron análisis agrupados y por separado, que no indicaron diferencias estadísticas significativas entre los grupos de retiro y continuación. La calidad general de la evidencia fue baja, lo que indica que los estudios de investigación adicionales pueden repercutir sobre la certeza en la estimación del efecto y que, en último término, pueden cambiar dicha estimación.
Van Assche 2008 fue el único estudio que evaluó el retiro de la azatioprina de un régimen de tratamiento de combinación e informó la proporción de pacientes con eventos adversos graves. No se encontraron diferencias estadísticamente significativas entre los grupos de tratamiento. La calidad general de la evidencia que apoya este resultado se consideró muy baja. Por lo tanto, la certeza en la estimación del efecto es limitada. Se debe señalar Van Assche 2008 se diseñó como un estudio de superioridad, que supuso que el tratamiento continuo con azatioprina es superior al retiro del tratamiento con azatioprina. Este estudio no tuvo un poder estadístico adecuado para detectar la no inferioridad entre los grupos de retiro y control.
Compleción y aplicabilidad general de las pruebas
Se realizó una búsqueda bibliográfica exhaustiva para identificar los posibles estudios a incluir y se realizó una búsqueda manual para asegurar que no se pasaran por alto informes elegibles. Desafortunadamente, varios resultados secundarios de interés predeterminados no se analizaron en los estudios incluidos. No hubo datos del tiempo hasta la recaída; la proporción de pacientes que respondieron a la reintroducción del inmunosupresor; la proporción de pacientes con marcadores biológicos de inflamación elevados; la proporción de pacientes con anticuerpos contra los fármacos y niveles séricos mínimos del fármaco; la proporción de pacientes que necesitaron cirugía después de la recaída; ni la proporción de pacientes que necesitaron hospitalización debido a recaída en cualquiera de los estudios incluidos. Además, la búsqueda bibliográfica no logró identificar datos controlados con respecto al retiro del tratamiento antiTNF‐α (como parte de la monoterapia o de un régimen de tratamiento de combinación) en pacientes con EC y enfermedad inactiva.
Todos los estudios incluidos evaluaron la monoterapia con azatioprina, o un tratamiento de combinación en el que se administró azatioprina e infliximab, lo que puede limitar la aplicabilidad de los resultados de esta revisión sistemática a estos fármacos específicos. Los resultados de esta revisión sistemática se limitan a los pacientes en remisión en el momento del retiro de los fármacos. Vale la pena recalcar que hubo variaciones entre los estudios incluidos en cuanto a la definición de remisión y duración de la remisión antes del retiro de los fármacos (resumido en la Tabla 2).
Es probable que en los dos estudios que evaluaron el retiro de la azatioprina de un régimen de tratamiento de combinación (Roblin 2017; Van Assche 2008) se hayan incluido principalmente grupos de pacientes en los que había fracasado previamente la monoterapia inmunosupresora. Se podría alegar que en esta cohorte no se esperaría que el retiro posterior de este agente tuviera un efecto significativo (en comparación con, por ejemplo, una cohorte de pacientes en los que se inició el tratamiento de combinación y luego se retiró el inmunosupresor).
La búsqueda bibliográfica no identificó estudios controlados de retiro de fármacos antiTNF‐α, aunque se debe señalar que el ensayo STORI, un estudio de cohortes prospectivo no controlado, relativamente grande (N = 115), examinó el retiro de infliximab de un régimen de tratamiento de combinación en pacientes con EC inactiva (Louis 2012). Los detalles relevantes de este estudio se enumeran en Características de los estudios excluidos.
Calidad de la evidencia
Se utilizó la herramienta Cochrane de riesgo de sesgo para evaluar el riesgo de sesgo de los ECA incluidos. Tres de los ECA se consideraron con riesgo incierto de sesgo para ítems como generación de la secuencia aleatoria (O’Donoghue 1978), ocultación de la asignación (Lémann 2005; O'Donoghue 1978), cegamiento de los evaluadores de resultados (O'Donoghue 1978; Wenzl 2015), y otros sesgos (Wenzl 2015). Tres de los ECA fueron ensayos abiertos, por lo que se consideraron con alto riesgo de sesgo para el cegamiento de los participantes y el personal del estudio (Roblin 2017; Van Assche 2008; Vilien 2004), mientras que los otros tres ECA se consideraron con bajo riesgo de sesgo para este factor. Con respecto al cegamiento de los evaluadores de resultados, tres ECA se consideraron con alto riesgo de sesgo (Roblin 2017; Van Assche 2008; Vilien 2004), y un ECA se consideró con bajo riesgo de sesgo (Lémann 2005). Los seis ECA se consideraron con bajo riesgo de sesgo para los datos de resultado incompletos y el informe selectivo (ver Figura 2).
La calidad general de la evidencia que apoya cada resultado se evaluó mediante el enfoque GRADE. Como se describe en Resumen de los hallazgos Tabla 2, las evaluaciones GRADE para el retiro de la monoterapia inmunosupresora en comparación con la continuación variaron de muy baja (es decir, certeza muy baja acerca de la estimación) a baja (es decir, el efecto real puede ser significativamente diferente de la estimación del efecto).
Las evaluaciones GRADE para el retiro del tratamiento inmunosupresor de combinación en comparación con el tratamiento de combinación ininterrumpido se describen en Resumen de los hallazgos Tabla 2. Las evaluaciones de la calidad variaron de muy baja (es decir, certeza muy baja acerca de la estimación) a baja (es decir, el efecto real puede ser significativamente diferente de la estimación del efecto).
Sesgos potenciales en el proceso de revisión
Los métodos y la estructura del informe utilizados para esta revisión sistemática se basaron en las recomendaciones proporcionadas por el Manual Cochrane para Revisiones Sistemáticas de Intervenciones (Higgins 2011c). Se desarrolló y realizó una búsqueda exhaustiva de la bibliografía y el protocolo se publicó con antelación para facilitar la transparencia. Dos autores, de manera independiente, realizaron el análisis de la bibliografía y la extracción de los datos. Así como también evaluaron de manera rigurosa la calidad de los estudios incluidos y la evidencia. Sin embargo, la revisión sistemática actual tiene algunas posibles limitaciones. Primero, se obtuvieron pocos datos adicionales a partir de fuentes no publicadas. Aunque se planificó investigar la posibilidad de sesgo de publicación mediante gráficos en embudo, no fue posible debido al número insuficiente de estudios incluidos (es decir, menos de diez). Segundo, las definiciones de recaída clínica variaron en los estudios; sin embargo, se debe señalar que no se detectó heterogeneidad estadística alta. Tercero, durante la realización de la revisión ocurrieron algunas desviaciones del protocolo publicado. Estas desviaciones se informan de manera transparente y se considera que es poco probable que cambien las conclusiones (ver Diferencias entre el protocolo y la revisión).
Acuerdos y desacuerdos con otros estudios o revisiones
La evidencia disponible sobre el retiro de la farmacoterapia inmunosupresora y antiTNF‐α en los pacientes con EC inactiva se ha examinado de manera sistemática en otras seis revisiones (Doherty 2018; French 2011; Gisbert 2016; Kennedy 2016; Pariente 2014; Torres 2015).
Doherty 2018 es una revisión tópica sobre el retiro del tratamiento en la enfermedad intestinal inflamatoria. Esta revisión resume las opiniones de expertos y fue publicada por la European Crohn's and Colitis Organisation. Se señala que se realizó una revisión sistemática de la bibliografía, pero no se informaron la fecha ni la estrategia de búsqueda. No se evaluó el riesgo de sesgo ni la calidad, ni se realizó un metanálisis de los datos. Los autores concluyen que a) hay una justificación fuerte para el retiro o la reducción gradual del tratamiento inmunosupresor y antiTNF‐α, en particular cuando se utilizan juntos en un régimen de combinación; b) los pacientes con EC en los que se retira la farmacoterapia deben estar en remisión clínica, bioquímica y endoscópica y con bajo riesgo de recaída; y c) la decisión de retirar el tratamiento se debe basar en el paciente individual. También se señala que se necesita evidencia adicional de ECA sobre el retiro de la farmacoterapia.
French 2011 es una revisión sistemática y metanálisis que evaluó la repercusión del retiro de la azatioprina sobre la tasa de recaída en los pacientes con EC y enfermedad inactiva. La búsqueda bibliográfica se realizó en septiembre de 2010 y se incluyeron cinco estudios, tres ECA (Lémann 2005; O'Donoghue 1978; Vilien 2004), y dos estudios de cohortes retrospectivos (Kim 1999; Sokol 2010). Los autores concluyen que la continuación del tratamiento inmunosupresor (es decir, azatioprina y 6‐mercaptopurina) es más efectiva que el retiro para la remisión de la enfermedad de Crohn. El estudio actual difiere de French 2011 en que se identificaron e incluyeron tres ECA adicionales (Roblin 2017; Van Assche 2008; Wenzl 2015)y no se incluyeron datos retrospectivos (Kim 1999; Sokol 2010).
Torres 2015 es una revisión sistemática centrada en el retiro de los inmunosupresores o los productos biológicos en pacientes con EC o colitis ulcerosa inactivas. Se consideraron elegibles para inclusión siete ECA, 16 estudios de cohortes prospectivos y 43 estudios de cohortes retrospectivos. Dos de los ECA, 15 de los estudios de cohortes prospectivos y todos los estudios de cohortes retrospectivos no se incluyeron en la presente revisión porque la población estudiada no era de interés (es decir, pacientes con colitis ulcerosa, embarazadas y pacientes pediátricos) o no hubo un grupo control. No se realizaron metanálisis. Los autores concluyen que la actividad de la enfermedad, los factores pronósticos y la enfermedad complicada se asociaron con recaída futura, y que aproximadamente el 50% de los pacientes con enfermedad intestinal inflamatoria en los que se retira el tratamiento presentan recaída. También señalan que el retiro de la farmacoterapia es una decisión que se debe tomar según el paciente individual.
Pariente 2014 realizó una revisión bibliográfica sistemática para identificar estudios que evaluaran el retiro de los agentes inmunosupresores o antiTNF‐α en pacientes con enfermedad intestinal inflamatoria. Fueron elegibles los estudios que utilizaron un diseño retrospectivo, carecían de un grupo control y reclutaron exclusivamente pacientes con colitis ulcerosa. Se identificaron 11 estudios relevantes, incluido uno de los cinco ECA de la presente revisión sistemática (Van Assche 2008). No se realizaron evaluaciones del riesgo de sesgo ni metanálisis. Los autores concluyen que la reducción gradual del tratamiento se debe iniciar caso a caso.
Gisbert 2016 realizó una revisión bibliográfica sistemática y metanálisis de estudios que evaluaron el riesgo de recaída después del retiro del tratamiento antiTNF‐α en la EC o la colitis ulcerosa clínicamente inactivas. A diferencia de la presente revisión, los estudios que utilizaron un diseño retrospectivo o carecieron de grupo control y los que reclutaron pacientes con colitis ulcerosa fueron elegibles. Los autores concluyen que aproximadamente un tercio de los pacientes con enfermedad intestinal inflamatoria presentaron recaída después de un año del retiro del tratamiento antiTNF‐α, y esta proporción aumentó alrededor de la mitad a más largo plazo.
Kennedy 2016 realizó una revisión bibliográfica sistemática y metanálisis de estudios que evaluaron los resultados después del retiro del tratamiento antiTNF‐α en pacientes con enfermedad intestinal inflamatoria en remisión clínica. Esta revisión incluyó estudios que utilizaron un diseño retrospectivo o carecieron de un grupo control. Los autores concluyen que aproximadamente un tercio de los pacientes con EII presentan una crisis en el transcurso de un año del retiro del tratamiento antiTNF‐α.

Study flow diagram.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
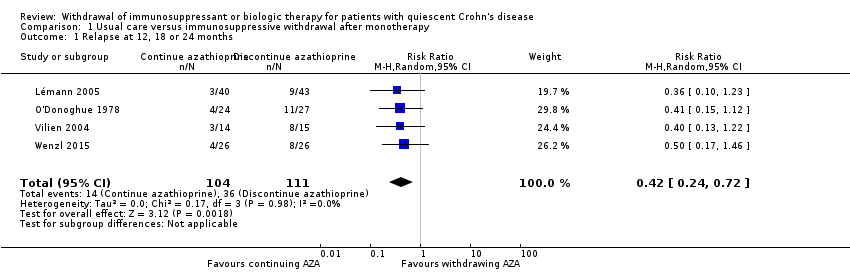
Comparison 1 Usual care versus immunosuppressive withdrawal after monotherapy, Outcome 1 Relapse at 12, 18 or 24 months.

Comparison 1 Usual care versus immunosuppressive withdrawal after monotherapy, Outcome 2 New CD‐related complications.

Comparison 1 Usual care versus immunosuppressive withdrawal after monotherapy, Outcome 3 Adverse events.

Comparison 1 Usual care versus immunosuppressive withdrawal after monotherapy, Outcome 4 Serious adverse events.
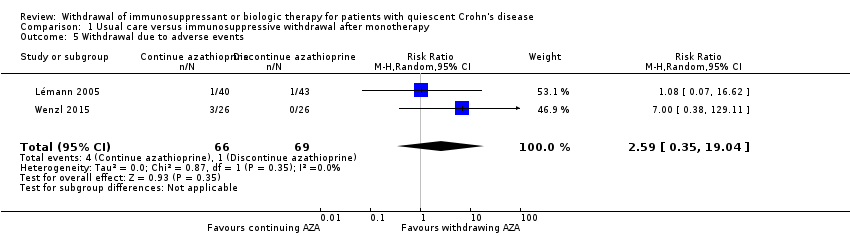
Comparison 1 Usual care versus immunosuppressive withdrawal after monotherapy, Outcome 5 Withdrawal due to adverse events.
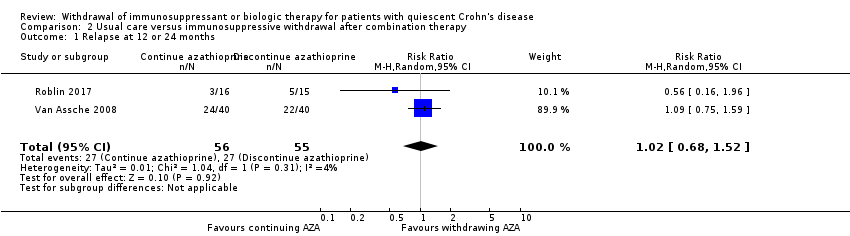
Comparison 2 Usual care versus immunosuppressive withdrawal after combination therapy, Outcome 1 Relapse at 12 or 24 months.

Comparison 2 Usual care versus immunosuppressive withdrawal after combination therapy, Outcome 2 Adverse events.
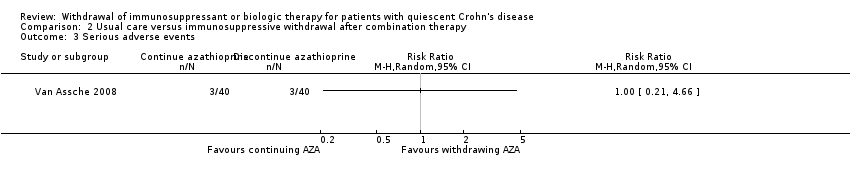
Comparison 2 Usual care versus immunosuppressive withdrawal after combination therapy, Outcome 3 Serious adverse events.
| Usual care compared to immunosuppressive withdrawal after monotherapy for patients with quiescent Crohn's disease | ||||||
| Patient or population: Patients with quiescent Crohn's disease | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with immunosuppressive withdrawal after monotherapy | Risk with usual care | |||||
| Relapse at 12, 18 or 24 months | Study population | RR 0.42 | 215 | ⊕⊕⊝⊝ | Sparse data (50 events) | |
| 324 per 1,000 | 136 per 1,000 | |||||
| New CD‐related complications | Study population | RR 0.34 | 135 | ⊕⊝⊝⊝ | Very sparse data (5 events) | |
| 58 per 1,000 | 20 per 1,000 | |||||
| Adverse events | Study population | RR 0.88 | 186 | ⊕⊕⊝⊝ | Sparse data (45 events) | |
| 240 per 1,000 | 211 per 1,000 | |||||
| Serious adverse events | Study population | RR 3.29 | 134 | ⊕⊝⊝⊝ | Very sparse data (2 events) | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Withdrawal due to adverse events | Study population | RR 2.59 | 135 | ⊕⊝⊝⊝ | Very sparse data (5 events) | |
| 14 per 1,000 | 38 per 1,000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded one level due to high risk of bias for blinding in one study and unclear risk of bias in three studies in the pooled analysis 2 Downgraded one level due to sparse data 3 Downgraded one level due to unclear risk of bias in the two studies in the pooled analysis 4 Downgraded two levels due to very sparse data 5 Downgraded one level due to unclear risk of bias in the three studies in the pooled analysis | ||||||
| Usual care compared to immunosuppressive withdrawal after combination therapy for patients with quiescent Crohn's disease | ||||||
| Patient or population: Patients with quiescent Crohn's disease | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with immunosuppressive withdrawal after combination therapy | Risk with usual care | |||||
| Relapse at 12 or 24 months | Study population | RR 1.02 | 111 | ⊕⊕⊝⊝ | Sparse data (54 events) | |
| 491 per 1,000 | 501 per 1,000 | |||||
| Adverse events | Study population | RR 1.11 | 111 | ⊕⊕⊝⊝ | Sparse data (51 events) | |
| 455 per 1,000 | 505 per 1,000 | |||||
| Serious adverse events | Study population | RR 1.00 | 80 | ⊕⊝⊝⊝ | Very sparse data (6 events) | |
| 75 per 1,000 | 75 per 1,000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded one level due to high risk of bias for blinding 2 Downgraded one level due to sparse data 3 Downgraded two levels due to very sparse data | ||||||
| Comparison 1: Usual care versus immunosuppressive withdrawal after monotherapy | |||
| Outcome | Random Effects RR (95% CI) | Fixed Effect RR (95% CI) | Impact |
| 1.1 Relapse at 12, 18 or 24 months | 0.42 (0.24‐0.72) | 0.42 (0.24‐0.72) | No change |
| 1.2 New CD‐related complications | 0.34 (0.06‐2.08) | 0.34 (0.06‐2.08) | No change |
| 1.3 Adverse events | 0.88 (0.67‐1.17) | 0.97 (0.71‐1.32) | Minimal |
| 1.4 Serious adverse events | 3.29 (0.35‐30.80) | 3.29 (0.35‐30.80) | No change |
| 1.5 Withdrawal due to adverse events | 2.59 (0.35‐19.04) | 3.10 (0.49‐19.41) | Minimal |
| Comparison 2: Usual care versus Immunosuppressive withdrawal after combination therapy | |||
| Outcome | Random Effects RR (95% CI) | Fixed Effect RR (95% CI) | |
| 2.1 Relapse at 12 or 24 months | 1.02 (0.68‐1.52) | 0.99 (0.69‐1.43) | Minimal |
| 2.2 Adverse events | 1.11 (0.44‐2.81) | 1.04 (0.73‐1.47) | Minimal |
| 2.3 Serious adverse events | No pooling | No pooling | No pooling |
| Study | Length of remission prior to drug withdrawal | Definition of remission prior to drug withdrawal |
| Minimum 6 months | CDAI ≤ 150 and fecal calprotectin levels < 250 μg/g | |
| Mean 62 months (standard deviation 26 months); Minimum 42 months | Clinical remission (CDAI ≤ 150) and no need for medical/surgical therapy in the previous 42 months | |
| Minimum 6 months | Clinical remission not otherwise specified | |
| Minimum 6 months | Clinical response to infliximab and disease control | |
| Not specified | Clinical remission: physician's global assessment | |
| Minimum 12 months | Clinical remission, no need for new medical therapy in the previous 12 months |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Relapse at 12, 18 or 24 months Show forest plot | 4 | 215 | Risk Ratio (M‐H, Random, 95% CI) | 0.42 [0.24, 0.72] |
| 2 New CD‐related complications Show forest plot | 2 | 135 | Risk Ratio (M‐H, Random, 95% CI) | 0.34 [0.06, 2.08] |
| 3 Adverse events Show forest plot | 3 | 186 | Risk Ratio (M‐H, Random, 95% CI) | 0.88 [0.67, 1.17] |
| 4 Serious adverse events Show forest plot | 2 | 134 | Risk Ratio (M‐H, Random, 95% CI) | 3.29 [0.35, 30.80] |
| 5 Withdrawal due to adverse events Show forest plot | 2 | 135 | Risk Ratio (M‐H, Random, 95% CI) | 2.59 [0.35, 19.04] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Relapse at 12 or 24 months Show forest plot | 2 | 111 | Risk Ratio (M‐H, Random, 95% CI) | 1.02 [0.68, 1.52] |
| 2 Adverse events Show forest plot | 2 | 111 | Risk Ratio (M‐H, Random, 95% CI) | 1.11 [0.44, 2.81] |
| 3 Serious adverse events Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |

