Inhibidores de la colinesterasa para el tratamiento del delirio en ámbitos fuera de la UCI
Resumen
Antecedentes
El delirio es un síndrome clínico común definido como alteraciones en la atención con un trastorno adicional en la cognición o la percepción, que se desarrolla durante un período corto y tiende a fluctuar durante el curso del episodio. El delirio habitualmente se trata en hospitales o en contextos comunitarios y a menudo se asocia con resultados adversos múltiples como aumento de los costos, morbilidad e incluso mortalidad. La intervención de primera línea involucra un enfoque no farmacológico multicomponente que incluye asegurar una comunicación efectiva y reorientación, además de proporcionar reafirmación o un ambiente apropiado de atención. En la actualidad no hay fármacos aprobados específicamente para el tratamiento del delirio. Clínicamente, sin embargo, se emplean diversos fármacos para proporcionar un alivio sintomático, como los fármacos antipsicóticos y los inhibidores de la colinesterasa, entre otros.
Objetivos
Evaluar la efectividad y la seguridad de los inhibidores de la colinesterasa para el tratamiento de los pacientes con delirio establecido en un ámbito fuera de la unidad de cuidados intensivos (UCI).
Métodos de búsqueda
Se hicieron búsquedas en ALOIS, el registro especializado del Grupo Cochrane de Demencia y Trastornos Cognitivos (Cochrane Dementia and Cognitive Improvement Group) el 26 de octubre de 2017. También se revisaron de forma cruzada las listas de referencias de los estudios incluidos para identificar cualquier ensayo potencialmente elegible.
Criterios de selección
Se incluyeron los ensayos controlados aleatorios, publicados o no publicados, informados en inglés o en chino, que compararon inhibidores de la colinesterasa con placebo u otros fármacos concebidos para tratar a los pacientes con delirio establecido en un ámbito fuera de la UCI.
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar previstos por la Colaboración Cochrane. Los resultados primarios fueron la duración del delirio, la gravedad del delirio y los eventos adversos. Los resultados secundarios fueron el uso de fármacos de rescate, el deterioro cognitivo persistente, la duración de la hospitalización, la institucionalización, la mortalidad, el costo de la intervención, el abandono temprano del estudio y la calidad de vida. Para los datos dicotómicos, se calculó el cociente de riegos (CR) con intervalos de confianza (IC) del 95%; para los resultados continuos, se calculó la diferencia de medias (DM) con IC del 95%. Se evaluó la calidad de la evidencia mediante GRADE y se creó una tabla de "Resumen de los hallazgos".
Resultados principales
Se incluyó un estudio que involucró a 15 participantes del Reino Unido. Los participantes incluidos recibieron un diagnóstico de delirio sobre la base de los criterios del Confusion Assessment Method (CAM). Se incluyeron ocho hombres y siete mujeres, con una media de edad de 82,5 años. Siete de los 15 participantes presentaban demencia concomitante al inicio. El riesgo de sesgo fue bajo en todos los dominios.
El estudio comparó rivastigmina con placebo. No se encontraron diferencias claras entre los dos grupos en cuanto a la duración del delirio (DM ‐3,6; IC del 95%: ‐15,6 a 8,4), los eventos adversos (náuseas, CR 0,30; IC del 95%: 0,01 a 6,29), el uso de fármacos de rescate (CR 0,13; IC del 95%: 0,01 a 2,1), la mortalidad (CR 0,10; IC del 95%: 0,01 a 1,56), y el abandono temprano del estudio (CR 0,88; IC del 95%: 0,07 a 11,54). No hubo evidencia disponible con respecto a la gravedad del delirio, el deterioro cognitivo persistente, la duración de la hospitalización, el costo de la intervención, u otros resultados secundarios predefinidos.
La calidad de la evidencia es baja debido al tamaño de la muestra muy pequeño.
Conclusiones de los autores
No hay evidencia suficiente para apoyar o refutar la administración de inhibidores de la colinesterasa para el tratamiento del delirio en ámbitos fuera de la UCI. No se observaron efectos beneficiosos ni perjudiciales claros asociados con los inhibidores de la colinesterasa en comparación con placebo debido a la falta de datos. Se requieren más ensayos.
PICO
Resumen en términos sencillos
Inhibidores de la colinesterasa para los pacientes con delirio, con la exclusión de los pacientes en las unidades de cuidados intensivos
Antecedentes
Durante un período de enfermedad, los pacientes pueden presentar síntomas de confusión y alteración de la conciencia, que se conoce como delirio. En comparación con los pacientes sin delirio, los pacientes con delirio pasan más tiempo en el hospital y tienen una menor probabilidad de sobrevivir su enfermedad. El tratamiento del delirio se debe centrar en la buena atención de la enfermedad subyacente y en estrategias como la reorientación del paciente. Sin embargo, todavía se utilizan con frecuencia los tratamientos basados en fármacos. Los fármacos utilizados para el tratamiento de los síntomas de la demencia (inhibidores de la colinesterasa) pueden tener una función en el tratamiento del delirio.
Pregunta de la revisión
Se deseaba determinar si el tratamiento con inhibidores de la colinesterasa reduce la gravedad o la duración del delirio. También hubo interés en los efectos secundarios de los inhibidores de la colinesterasa. El delirio a menudo se observa en las enfermedades graves que requieren niveles altos de atención médica y de enfermería, por ejemplo en la unidad de cuidados intensivos. En esta revisión el interés se centró en los estudios en pacientes que no se encontraban en un ámbito de atención de alto nivel.
Características de los estudios
Se encontró un ensayo del Reino Unido, que incluyó a 15 participantes con delirio. La edad promedio de los participantes fue 82,5 años; ocho participantes eran hombres y siete eran mujeres. Siete participantes también tenían antecedentes de demencia. Este ensayo comparó rivastigmina (un tipo de inhibidor de la colinesterasa utilizado en el tratamiento de la demencia) con un tratamiento inactivo (placebo).
Resultados clave
El ensayo no mostró diferencias en el efecto entre los participantes que recibieron rivastigmina y los que recibieron placebo. El estudio se realizó y se informó de manera apropiada, pero el escaso número de participantes limita cualquier conclusión que se podría establecer acerca de la rivastigmina como tratamiento para el delirio.
Conclusiones de los autores
Summary of findings
| Cholinesterase inhibitors (rivastigmine) compared to placebo for the treatment of delirium in non‐ICU settings | ||||||
| Patient or population: people with delirium | ||||||
| Outcomes | Illustrative comparative risks** (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Placebo | Cholinesterase inhibitors (rivastigmine) | |||||
| Duration of delirium | The mean duration was 9.9 days | The mean duration was 3.6 days lower (15.6 lower to 8.4 higher) | Not estimable | 15 | ⊕⊕⊝⊝ | The data were reported by Overshott 2010. The study was grossly underpowered, and the data were skewed. |
| Severity of delirium | See comment | See comment | See comment | See comment | See comment | No study reported this outcome. |
| Adverse events | 143 per 1000 | 43 per 1000 | RR 0.3 | 15 | ⊕⊕⊝⊝ | |
| Persistent cognitive impairment | See comment | See comment | See comment | See comment | See comment | No study reported this outcome. |
| Length of hospitalisation | See comment | See comment | See comment | See comment | See comment | No study reported this outcome. |
| Mortality | 571 per 1000 | 57 per 1000 | RR 0.1 | 15 | ⊕⊕⊝⊝ | |
| Cost of intervention | See comment | See comment | See comment | See comment | See comment | No study reported this outcome. |
| *The dose of intervention: 1.5 mg once a day increasing to 1.5 mg twice a day after 7 days. **The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Downgraded twice for imprecision due to very small sample size. | ||||||
Antecedentes
Esta revisión reemplaza una revisión Cochrane anterior, "Inhibidores de la colinesterasa para el delirio", que se publicó por primera vez en el Número 1, 2008 (Otras versiones publicadas de esta revisión).
Descripción de la afección
El delirio es un síndrome clínico común que se caracteriza por alteraciones en la atención y trastornos adicionales en la función cognitiva o la percepción, que tiene una aparición aguda y un curso fluctuante (APA 2013).
El delirio es un trastorno neuropsiquiátrico con etiologías múltiples y puede ser la consecuencia de un trastorno médico, de la intoxicación por sustancias o la abstinencia, o de la exposición a una toxina (APA 2013). Las causas del delirio son multifactoriales e incluyen factores de vulnerabilidad del paciente (como demencia o deterioro cognitivo, envejecimiento, comorbilidad médica, desnutrición, antecedentes de abuso de alcohol y prescripción de opiáceos o uso de benzodiazepinas, entre otros) y factores potencialmente modificables (como infecciones, deshidratación, anomalías de electrólitos, polifarmacia, crisis convulsivas y cirugía) (Inouye 2014; Vasilevskis 2012). Los síntomas centrales del delirio incluyen niveles alterados de atención y conciencia que habitualmente se desarrollan durante un período corto y representan un cambio en cuanto al nivel inicial de atención y conciencia del paciente. Estas alteraciones pueden fluctuar en cuanto a la gravedad a través del curso del episodio y a veces pueden empeorar en la noche y de la noche a la mañana (APA 2013; Schwartz 2016). Los pacientes con delirio presentan un aumento en la mortalidad, las complicaciones posoperatorias (Raats 2015), los nuevos ingresos al hospital (McKhann 2002), los resultados funcionales más deficientes (Inouye 1998), el riesgo de demencia (Davis 2012), la duración de la estancia hospitalaria (McCusker 2003) y mayores gastos de asistencia sanitaria (Leslie 2008).
El delirio se puede manifestar como hiperactividad, hipoactividad o una combinación (cuando están presentes características hipoactivas e hiperactivas) (NICE 2014). La quinta edición del American Psychiatric Association's Diagnostic and Statistical Manual of Mental Disorders (DSM‐V) y la décima Revision of the International Classification of Diseases (ICD‐10) proporcionan los criterios diagnósticos de referencia estándar actuales (APA 2013; WHO 1993). Con el transcurso de los años, se han creado diversos instrumentos de diagnóstico y cribado para realizar el diagnóstico del delirio según los criterios del DSM y los mismos se han utilizado o adaptado en diversas aplicaciones de investigación y clínicas (Grover 2012; Oh 2017). El Confusion Assessment Method (CAM), que proporciona un algoritmo de diagnóstico sencillo, se utiliza ampliamente para la identificación del delirio en todo el mundo (Hshieh 2018). El 4AT, un instrumento nuevo utilizado ampliamente para el cribado rápido del delirio, también es fácil de administrar y breve y tiene una alta sensibilidad y especificidad (Bellelli 2014; De 2017).
Las tasas de incidencia más altas del delirio se observan en el ámbito de la unidad de cuidados intensivos (UCI), donde alcanzan hasta el 80% (Marcantonio 2017). La incidencia del delirio posoperatorio varía según el tipo de procedimiento quirúrgico. Por ejemplo, se han informado tasas del 12% al 50% después de la cirugía no cardíaca (Brouquet 2010; Olin 2005; Shah 2012), hasta el 51% después de la cirugía cardíaca (Smulter 2013) y del 12% al 61% después de las cirugías ortopédicas (Holmes 2000). La incidencia del delirio en el ámbito de atención paliativa varía del 3% al 45% (Perrar 2013). En las salas de medicina general y geriátrica, las tasas de incidencia varían del 11% al 29% (Inouye 2014). La prevalencia del delirio en el momento del ingreso a dichas salas también es alta (18% al 35% en las salas de medicina general) (Inouye 2014). Cuando se combina con las tasas de incidencia del delirio de nueva ocurrencia después del ingreso, la aparición general del delirio en estos contextos es relativamente alta. La epidemiología del delirio en los servicios de urgencia no está muy bien establecida (Vasilevskis 2012). Además, el delirio no es exclusivo de los contextos hospitalarios. Un estudio encontró una incidencia del delirio del 20% en los residentes de hogares para convalecientes que presentan una enfermedad aguda (Flaherty 2013).
La UCI es un sistema organizado que presta atención médica y de enfermería intensiva y especializada. Los pacientes en el ámbito de la UCI parecen tener características diferentes en comparación con los pacientes de otros contextos. Por ejemplo, los pacientes de la UCI presentan enfermedades más graves que los pacientes de otros contextos. Las prioridades de tratamiento también tienden a ser diferentes. El tratamiento médico en la UCI se enfoca en modalidades múltiples de apoyo orgánico fisiológico para mantener la vida durante un período de insuficiencia aguda del sistema orgánico (Marshall 2017). Por lo tanto, se puede esperar heterogeneidad clínica potencial entre los contextos de la UCI y fuera de la UCI. Esta revisión complementa una revisión sobre el delirio en el ámbito de la UCI que realiza el Grupo Cochrane de Anestesia (Greve 2012).
Descripción de la intervención
El tratamiento del delirio procura mejorar la recuperación, maximizar el estado funcional y mejorar los resultados clínicos. Además del tratamiento sintomático general, un elemento clave del tratamiento es la investigación y el tratamiento de cualquier causa subyacente reversible (Schwartz 2016; Young 2010). Según la guía del National Institute for Health and Care Excellence (NICE), se utilizan enfoques multicomponente no farmacológicos como intervención de primera línea para el tratamiento del delirio en los pacientes adultos. Esta estrategia incluye garantizar la comunicación y la reorientación efectivas (p.ej. explicar dónde se encuentra el paciente, quiénes son los que lo asisten y su función), que proporciona confianza a los pacientes diagnosticados con delirio e incluye a la familia, los amigos y los cuidadores para ayudar en este proceso y proporcionar un ambiente apropiado de atención (NICE 2014). En la actualidad no hay fármacos específicamente aprobados por la Food and Drug Administration (FDA) de los EE.UU. ni por otros organismos de autorización de medicamentos para tratar el delirio. Sin embargo, actualmente en la práctica los médicos utilizan diversos fármacos para el alivio sintomático (Breitbart 2012; NICE 2014).
A menudo se utilizan fármacos antipsicóticos para el tratamiento del delirio. Lo anterior es especialmente válido para los fármacos antipsicóticos de segunda generación que, en comparación con los fármacos antipsicóticos de primera generación (como el haloperidol), requieren un tiempo más corto para surtir efecto y producen menos síntomas extrapiramidales (Kishi 2016). Según las guías NICE, si un paciente está angustiado o representa un riesgo significativo para sí o para otras personas, los fármacos antipsicóticos (olanzapina o haloperidol) no se recomiendan para el tratamiento del delirio a menos que las medidas no farmacológicas no hayan sido efectivas ni apropiadas (NICE 2014). Las benzodiazepinas desempeñan una función en el tratamiento del delirio causado por la abstinencia de sedantes o de alcohol. Sin embargo, no son útiles en el tratamiento del delirio por otras causas debido a que pueden causar confusión y somnolencia, en particular en los pacientes de edad más avanzada (Catic 2011). Algunos estudios de investigación han demostrado que la dexmedetomidina, un agonista de los receptores α2 adrenérgicos, es útil en el tratamiento del delirio asociado con el dolor por cáncer, la cirugía o la abstinencia de alcohol (Ayeko 2015; Nguyen 2016). Aunque los inhibidores de la colinesterasa como la rivastigmina, el donepezilo y la galantamina se han utilizado para tratar el delirio, la evidencia con respecto a su efectividad no es consistente. Un ensayo controlado aleatorio encontró que la rivastigmina, cuando se agregó al tratamiento estándar con haloperidol, aumentó potencialmente la gravedad del delirio, así como la mortalidad en los pacientes de la UCI (van Eijk 2010). Sin embargo, otros estudios prospectivos primarios (no aleatorios) indicaron que la rivastigmina fue útil para el delirio asociado con la enfermedad de Alzheimer, la demencia vascular o el accidente cerebrovascular en ámbitos fuera de la UCI (Litvineneko 2010; Oldenbeuving 2008). Otros inhibidores de la colinesterasa como el donepezilo también se han estudiado para la prevención del delirio (Liptzin 2005; Marcantonio 2011; Sampson 2007).
De qué manera podría funcionar la intervención
Los mecanismos subyacentes a la aparición del delirio son complejos y se han definido de forma deficiente, aunque se han propuesto varias teorías (Maldonado 2008). Una de las principales hipótesis es que el delirio resulta de un deterioro en la transmisión colinérgica central, considerada por algunos investigadores como "un denominador común" en este trastorno (Blass 1981). La acetilcolina es el neurotransmisor principal que actúa como mediador del aprendizaje y la atención, funciones que se encuentran profundamente perturbadas durante el delirio. El deterioro en la función colinérgica también se correlaciona con los cambios cognitivos y conductuales observados en los pacientes con delirio (Trzepacz 1996). Además, los fármacos con efectos anticolinérgicos pueden inducir el delirio, aunque los fármacos colinérgicos pueden mejorar el delirio inducido por el litio y los fármacos anticolinérgicos (Oldenbeuving 2008). Al inhibir la actividad de las enzimas que metabolizan la acetilcolina, los inhibidores de la colinesterasa causan un aumento en la actividad colinérgica en las sinapsis (Masuda 2015). También se ha demostrado que desempeñan una función en la mejoría de la función cognitiva en los pacientes con demencia (Chen 2016; Li 2015; Rolinski 2012). El delirio y la demencia comparten la deficiencia colinérgica como una hipótesis mecanicista (Hshieh 2008; Wang 2009). Los tres inhibidores de la colinesterasa, la rivastigmina, el donepezilo y la galantamina, actualmente están aprobados como fármacos de primera línea para el tratamiento de la demencia asociada con la enfermedad de Alzheimer (Li 2015; Qaseem 2008) y también son recomendados por NICE para el tratamiento de las enfermedades de cuerpos de Lewy (es decir, demencia de cuerpos de Lewy y demencia de la enfermedad de Parkinson) (NICE 2011). Por lo tanto, al tratar la presunta deficiencia colinérgica en los pacientes con delirio, los inhibidores de la acetilcolinesterasa pueden tener efectos beneficiosos.
Por qué es importante realizar esta revisión
Esta revisión reemplaza la revisión anterior "Inhibidores de la colinesterasa para el delirio", que se publicó en 2008 (Otras versiones publicadas de esta revisión). Dicha revisión incluyó sólo un ensayo, Liptzin 2005, que comparó donepezilo con placebo para la prevención y el tratamiento del delirio posoperatorio en pacientes mayores de 50 años de edad sin demencia sometidos al reemplazo articular total electivo. Desde entonces se han realizado más estudios con diversos inhibidores de la colinesterasa en diferentes contextos. En comparación con los pacientes en ámbitos fuera de la UCI, los pacientes de la UCI presentan un mayor riesgo de delirio. Además, se emplean diferentes instrumentos de evaluación y validación del delirio y estrategias de tratamiento para tratar a los pacientes de la UCI (Hayhurst 2016; Oh 2017). Debido a que el delirio en el ámbito de la UCI como objetivo único se ha examinado en revisiones anteriores (Hayhurst 2016; Trogrlić 2015), esta revisión se centró en los inhibidores de la colinesterasas para el tratamiento del delirio en ámbitos fuera de la UCI.
Objetivos
Evaluar la efectividad y la seguridad de los inhibidores de la colinesterasa para el tratamiento de los pacientes con delirio establecido en un ámbito fuera de la UCI.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se planificó incluir ensayos controlados aleatorios, publicados o no publicados, informados en inglés o chino.
Tipos de participantes
Se planificó incluir a participantes de más de 16 años de edad, de cualquier sexo, diagnosticados con delirio mediante criterios diagnósticos estandarizados (p.ej. DSM‐IV, DSM‐V, CIE‐10). Cuando los estudios señalaron que los pacientes presentaban delirio, pero no utilizaron los criterios diagnósticos estandarizados, se planificó incluir dichos estudios en el metanálisis y realizar análisis de sensibilidad para examinar si los criterios de inclusión influyeron en los resultados. También se planificó incluir a participantes que presentaban delirio por cualquier causa (como enfermedades médicas y efectos adversos de los fármacos) con la excepción de la abstinencia de alcohol/drogas. Se planificó incluir estudios realizados en ámbitos hospitalarios o comunitarios. Se excluyeron los estudios que mencionaron explícitamente que los pacientes fueron reclutados en la UCI, independientemente del tipo de UCI (como las UCI generales y otras UCI especiales incluidas las unidades de cuidados coronarios, las UCI de traumatismo, etc.). Sin embargo, cuando el estudio describió el ámbito como una unidad de alta dependencia donde los pacientes fueron atendidos más a fondo que en una sala normal, pero no hasta el punto de los cuidados intensivos, se planificó incluir el estudio.
Tipos de intervenciones
Se planificó incluir los ensayos que evaluaran el efecto de cualquiera de los inhibidores de la colinesterasa comercializados actualmente (p.ej. donepezilo, rivastigmina, galantamina), administrados en cualquier dosis y con cualquier frecuencia, en comparación con placebo. También se planificó incluir las comparaciones directas de un inhibidor de la colinesterasa con otro fármaco concebido para tratar el delirio (p.ej. fármacos antipsicóticos, agonistas de los receptores α2 adrenérgicos, benzodiazepinas y melatonina).
También se planificó incluir los ensayos que incluyeron estrategias de tratamiento no farmacológico cuando era posible extraer los datos de los grupos.
Tipos de medida de resultado
Resultados primarios
-
Respuesta al tratamiento:
-
duración del delirio;
-
gravedad del delirio medida con escalas validadas (p.ej. Memorial Delirium Assessment Scale [MDAS] [Breitbart 1997], Delirium Rating Scale [DRS] [Trzepacz 1988] o DRS‐R‐98 (Trzepacz 2001).
-
-
Eventos adversos.
Resultados secundarios
-
Uso de fármacos de rescate (p.ej., dosis únicas de antipsicóticos)
-
Deterioro cognitivo persistente (definido por los estudios originales)
-
Duración de la hospitalización
-
Institucionalización
-
Mortalidad
-
Costo de la intervención (como costo monetario directo de la intervención para los participantes o los servicios de asistencia sanitaria)
-
Abandono temprano del estudio
-
Calidad de vida
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We searched ALOIS (www.medicine.ox.ac.uk/alois), the Cochrane Dementia and Cognitive Improvement Group's Specialised Register, on 26 October 2017.
ALOIS is maintained by the review group's Information Specialist and contained dementia and cognitive improvement studies identified from:
-
quarterly search of the Cochrane Central Register of Controlled Trials (CENTRAL);
-
monthly searches of major healthcare databases: MEDLINE, Embase, CINAHL (Cumulative Index to Nursing and Allied Health Literature), PsycINFO, and LILACS (Latin American and Caribbean Health Sciences Literature);
-
monthly searches of trial registers: metaRegister of Controlled Trials (www.isrctn.com/page/mrct); UMIN Clinical Trials Registry (www.umin.ac.jp/ctr/); World Health Organization International Clinical Trials Registry Platform (apps.who.int/trialsearch) (which covers ClinicalTrials.gov, ISRCTN, Chinese Clinical Trials Register, German Clinical Trials Register, Iranian Registry of Clinical Trials, and the Netherlands National Trials Register, plus others);
-
monthly searches of a grey literature source: ISI Web of Science Core Collection.
To view a list of all sources searched for ALOIS please see About ALOIS.
We ran additional searches to ensure we had retrieved the most up‐to‐date results. The search strategies used for the retrieval of reports of trials from bibliographic databases and trial registries can be seen in Appendix 1.
Búsqueda de otros recursos
We cross‐checked the reference lists of included studies to identify any potentially eligible trials.
Obtención y análisis de los datos
Selección de los estudios
Two review authors (AY and SW) independently assessed each abstract and title for relevance. We obtained the full texts of citations that described a potentially relevant randomised controlled trial for further assessment. Two review authors independently determined eligibility of these trials for inclusion. Any disagreements at any stage of the study selection process were resolved by discussion or by the involvement of a third review author (ZZ).
Extracción y manejo de los datos
Two review authors (AY and SW) independently extracted data using prespecified data extraction forms. A pilot data extraction was performed before the formal data extraction. Any discrepancies were resolved by discussion. We collected the following information where possible.
Participant characteristics
-
Age
-
Sex
-
Education
-
Diagnostic criteria for delirium
-
Severity of delirium
-
Underlying aetiology of delirium
-
Baseline comorbid dementia
-
Setting (refers to the environment where the clinical trial was conducted, e.g. palliative care settings, general or geriatric wards, emergency departments)
-
Inclusion or exclusion criteria of the original studies
Intervention characteristics
-
Types of cholinesterase inhibitors
-
Description of the comparator
-
Dose, route, frequency, and duration of cholinesterase inhibitor and comparator
-
Duration of treatment
-
Any concomitant treatments
Outcomes
-
Outcomes as outlined in Types of outcome measures
-
Definition, instruments, and measured time points of outcomes
Methodological characteristics
-
Sample size
-
Duration of follow‐up
-
Information needed for 'Risk of bias' assessment
For continuous data, we extracted the mean, standard deviation, and number of participants for each treatment group at each time point, if available. For dichotomous data, we retrieved the number in each treatment group and numbers experiencing the outcome of interest where possible. If only treatment effects and their standard errors were reported, these would be extracted.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (AY and SW) independently assessed the risk of bias of each included study using the Cochrane 'Risk of bias' tool (Higgins 2011), which evaluates the following risk domains: random sequence generation; allocation concealment; blinding of participants, personnel, and outcome assessors; incomplete outcome data; selective outcome reporting; and other potential sources of bias (including source of financial support). We used the criteria reported in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). We applied the following judgements to each domain: low risk, high risk, or unclear risk (either lack of information or uncertainty over the potential for bias). Any disagreements were resolved by consensus or by consulting a third review author (ZZ) when necessary.
Medidas del efecto del tratamiento
If trials used the same rating scale to assess the outcome, we planned to calculate the mean difference (MD) with a 95% confidence interval (CI); if different rating scales were used to measure the same outcome, we planned to employ the standardised mean difference (SMD) for continuous data. The treatment effect for dichotomous outcomes was expressed as a risk ratio (RR) with a 95% CI.
Cuestiones relativas a la unidad de análisis
For studies with multiple eligible treatment groups, we planned to use one of the approaches described in Section 16.5.4 of the Cochrane Handbook for Systematic Reviews of Interventions to overcome the unit of analysis error (Higgins 2011). Our preferred approach was to merge all relevant experimental intervention groups of the study into a single group and to merge all relevant control intervention groups into a single control group. If this approach was not suitable, we planned to include all relevant experimental groups and split the shared control group.
Manejo de los datos faltantes
We planned to report missing outcome data and consider and discuss the potential impact of the missing data on the results for all outcomes. When attrition for a continuous outcome was between 0% and 50%, and only data from people who had completed the study to that point were reported, we planned to reproduce these.
We anticipated that some studies would have used the method of last observation carried forward (LOCF) or other imputation methods. If less than 50% of the data had been imputed, we would present and use these data and report the imputation method used. For studies with more than 50% of imputed data, we would use the data, but would conduct a sensitivity analysis by excluding these studies to test the robustness of the result.
If standard deviations were not reported, we would first attempt to obtain the missing values from the study authors. If this was not possible, we would attempt to calculate standard deviations from the available statistics in the study report according to the methods described in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011).
Evaluación de la heterogeneidad
Two review authors (AY and SW) independently assessed clinical and methodology heterogeneity, and only planned on conducting meta‐analyses when the study quality, participants, interventions, and outcomes were sufficiently similar. We planned on assessing statistical heterogeneity using the I2 statistic (I2 greater than 50% may represent substantial heterogeneity) combined with the P value from the Chi2 test (P < 0.1), if a meta‐analysis was to be performed (Higgins 2011).
Evaluación de los sesgos de notificación
If at least 10 studies were available for meta‐analysis, we planned on assessing the effect of publication bias using a funnel plot to identify small‐study effects.
Síntesis de los datos
We planned on conducting meta‐analyses using the Mantel‐Haenszel method for dichotomous outcomes, and the inverse variance method for continuous outcomes. We planned to use a random‐effects model for all analyses. For cases in which the statistical heterogeneity was significant (P value from Chi2 test < 0.1 and I2 greater than 50%), we planned to explore and address the source of heterogeneity as described in the Subgroup analysis and investigation of heterogeneity section.
Análisis de subgrupos e investigación de la heterogeneidad
Subgroup analysis
When data allowed, we planned to conduct a subgroup analysis according to:
-
participant age (older than 65 years versus 65 years or younger);
-
different causes of delirium (e.g. postoperative delirium, adverse events to medication, or delirium due to hepatic encephalopathy);
-
presence or absence of pre‐existing dementia or neurocognitive impairment.
Investigation of heterogeneity
Where there was evidence of statistical heterogeneity (P value from Chi2 < 0.1 and I2 greater than 50%) of the treatment effect between trials, if we could identify possible sources of variation, we planned to explore the source of the heterogeneity and conduct subgroup analyses. Otherwise, we would use a random‐effects model to pool the data. Where statistical heterogeneity was significant in a meta‐analysis, we would consider downgrading the quality of evidence using the GRADE approach (GRADEpro GDT 2015; Schünemann 2011a; Schünemann 2011b).
Análisis de sensibilidad
Where possible, we planned to conduct a sensitivity analysis to explore the influence of the quality of trials by excluding data from low‐quality trials. We would define low‐quality trials as those in which more than 50% of the data in one arm of the study was lost or studies with a high risk of selection bias and a high risk of detection bias due to non‐blind outcome assessment. We also planned to conduct a sensitivity analysis to investigate the difference between results from completers‐only and intention‐to‐treat analysis (for primary outcomes only). We planned on presenting results from both approaches separately and discussing the results at the full review stage.
'Summary of findings' table
For each comparison, we used the GRADE approach to assess the quality of the body of evidence for all outcomes (GRADEpro GDT 2015; Schünemann 2011a; Schünemann 2011b). We presented the following results in the 'Summary of findings' tables.
-
Duration of delirium
-
Severity of delirium
-
Adverse events
-
Persistent cognitive impairment
-
Length of hospitalisation
-
Mortality
-
Cost of intervention
Evidence was given one of four possible ratings: high, moderate, low, or very low quality. A rating of high quality indicated that we were confident in our estimate of the effect and that further research was very unlikely to change this, whereas a rating of very low quality implied that we were very uncertain about the estimate of the effect. The GRADE approach rates evidence from randomised controlled trials as high quality initially, however several factors could lead to the downgrading of the evidence, namely: study limitations (risk of bias); inconsistency; indirectness of evidence; imprecision; and publication bias (Schünemann 2011a; Schünemann 2011b).
Results
Description of studies
See Characteristics of included studies; Characteristics of excluded studies.
Results of the search
We identified a total of 194 records from databases (164 records) and other sources (30 records). The total number of records was unchanged after de‐duplication. We excluded 164 records based on the title and abstract. Of the remaining 30 records assessed in full, we excluded 27 records with reasons (see Excluded studies). One record is an ongoing study (NCT01487317). We eventually included only one study (Overshott 2010, with two records) in this review (see Figure 1 for more details).
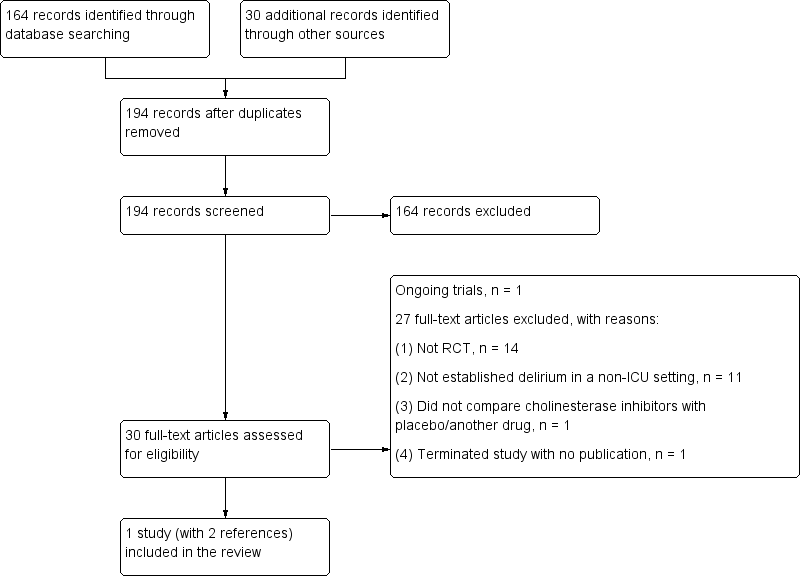
Study flow diagram.
Included studies
Only one study with 15 participants that compared rivastigmine with placebo met the inclusion criteria for this review (see Characteristics of included studies) (Overshott 2010).
The 15 participants were recruited from the UK and were diagnosed with delirium based on the Confusion Assessment Method (CAM) criteria. Seven of the 15 participants had comorbid dementia at baseline. The mean age of the participants was 82.5 years; eight participants were male and seven were female.
The study reported the following outcomes: duration of delirium as assessed by CAM criteria, adverse events, use of rescue medications (additional psychotropic medications received), mortality, and leaving the study early. Other predefined outcomes of this review (severity of delirium, persistent cognitive impairment, length of hospitalisation, institutionalisation, cost of intervention, and quality of life) were not reported.
Excluded studies
See Characteristics of excluded studies.
We excluded a total of 27 studies from this review for the following reasons.
-
Twelve studies were not randomised controlled trials (Chapin 1977; Dautzenberg 2004; Fischer 2001; Gleason 2003; Granacher 1976; Heiser 1974; Hori 2003; Kaufer 1998; Lankarani‐Fard 2006; Listed 2011; Newman 1980; Scicutella 2015; Sheldon 2010; Wengel 1999).
-
Participants of nine studies did not have a diagnosis of delirium in a non‐ICU setting (EUCTR2007‐000262‐20‐GB; Crowell 1967; Doraiswamy 2007; Liptzin 2005; Marcantonio 2011; Moretti 2004; Silver 2006; Tenovuo 2009; Van Eijk 2010; Youn 2017; Zaslavsky 2012).
-
We excluded one study due to the interventions being evaluated (Pitkala 2006). This study compared an intensified, multicomponent geriatric treatment group with a control group, and we were unable to extract data from the groups that differed only in terms of exposure to cholinesterase inhibitor versus placebo.
-
One clinical trial was terminated with no published results (NTR 537). We contacted the primary investigator, who informed us that no data had been published from this trial.
Ongoing studies
See Characteristics of ongoing studies.
We identified one ongoing study begun in France in 2011 (NCT01487317). Though recruitment was complete, no results have been reported or published. We planned to contact the primary investigator for more details but contact information was not available.
Risk of bias in included studies
The summary of risk of bias in the included study is presented in Figure 2 and Figure 3 (Overshott 2010). Please refer to the 'Risk of bias' table in Characteristics of included studies for further details.
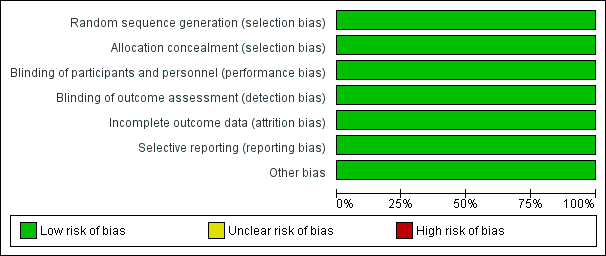
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
The included study stated that participants were randomised by numbered treatment packets developed by the special statistics department, which was independent of the research team. The random sequence was concealed before allocation. We therefore rated this study as at low risk of selection bias.
Blinding
The included study used a convincingly double‐blinded design that ensured blinding of both the participants and researchers. We rated this study as at low risk of performance and detection bias.
Incomplete outcome data
Two participants left the study early due to protocol violation. One person in the rivastigmine group withdrew their consent when CAM was negative for two consecutive days. One person in the placebo group lost the trial medication after being transferred to another ward. The number of dropouts was small and balanced between the two groups. Given that the reasons for the dropouts were not related to the intervention, we rated this study as having a low risk of attrition bias.
Selective reporting
We did not obtain the protocol for this study. The study reported all outcomes that were stated in the methods section, and the primary outcome in this review was reported as well. We rated the study as at low risk of reporting bias.
Other potential sources of bias
We found no other obvious bias in the included study and rated it as at low risk for this domain.
Effects of interventions
We included one study that involved 15 participants and compared rivastigmine with placebo (Overshott 2010). The quality of evidence for the reported outcomes was low due to the very small sample size (see summary of findings Table for the main comparison).
Primary outcomes
Response to treatment: duration of delirium
The study reported that the mean (standard deviation, range) duration of delirium for participants in the rivastigmine and placebo groups was 6.3 (5.7, 1 to 19) days and 9.9 (14.6, 1 to 42) days, respectively. The mean and range of duration of delirium were shorter for the rivastigmine group compared with the placebo group, although the authors did not find a clear difference (mean difference (MD) ‐3.6, 95% confidence interval (CI) ‐15.6 to 8.4; Analysis 1.1) due to the very small sample size (lack of statistical power).
The study used unpaired t‐test for this outcome to measure MD. However, we found that the data were skewed, and therefore a parameter test was not applicable. Hence, we just presented the results as other data in this review.
Response to treatment: severity of delirium
The study did not report this outcome.
Adverse events
Only one participant in the placebo group had nausea. The study found no clear difference in the incidence of nausea between the two groups (risk ratio (RR) 0.30, 95% CI 0.01 to 6.29; Analysis 1.2).
Secondary outcomes
Use of rescue medications
Three participants in the placebo group and no participants in the rivastigmine group received additional psychotropic medication due to behavioural disturbances. The study found no clear difference between the two groups (RR 0.13, 95% CI 0.01 to 2.1; Analysis 1.3).
Persistent cognitive impairment
The study did not report this outcome.
Length of hospitalisation
The study did not report this outcome.
Institutionalisation
The study did not report this outcome.
Mortality
Four participants in the placebo group and no participants in the rivastigmine group died. The study found no clear difference in mortality between the groups (RR 0.10, 95% CI 0.01 to 1.56; Analysis 1.4).
Cost of intervention
The study did not report this outcome.
Leaving the study early
One participant in the rivastigmine group and one participant in the placebo group left the study early. The study found no clear difference in withdrawals between the two groups (RR 0.88, 95% CI 0.07 to 11.54; Analysis 1.5).
Quality of life
The study did not report this outcome.
Subgroup analysis
We did not perform any subgroup analysis due to insufficient data.
Sensitivity analysis
We did not perform any sensitivity analysis due to insufficient data.
Assessment of reporting biases
We did not produce a funnel plot to assess reporting biases because no meta‐analysis included at least 10 studies.
Discusión
Resumen de los resultados principales
Se identificó sólo un estudio que comparó un inhibidor de la colinesterasa con placebo para el tratamiento del delirio en pacientes fuera de la UCI. Sobre la base de la diferencia absoluta, la duración del delirio fue más corta en el grupo de rivastigmina (3,6 días en promedio) en comparación con el grupo placebo y no ocurrieron muertes en el grupo de rivastigmina. Sin embargo, este estudio tuvo datos limitados (15 participantes) con evidencia de baja calidad. Es poco probable que cualquier análisis comparativo demostrara un efecto debido a que el estudio tuvo un poder estadístico extremadamente bajo. Por lo tanto, en la realidad no se encontraron diferencias claras en la duración del delirio, los eventos adversos, el uso de fármacos de rescate, la mortalidad ni el número de participantes que abandonaron temprano el estudio. No hubo evidencia disponible para evaluar la gravedad del delirio ni los resultados secundarios restantes.
Compleción y aplicabilidad general de las pruebas
La completitud y la aplicabilidad general de la evidencia en cuanto a los participantes, las intervenciones y los resultados fueron deficientes y muy limitados en este único estudio incluido. Primero, los participantes incluidos fueron diagnosticados con delirio mediante los criterios CAM en lugar de criterios diagnósticos estandarizados (p.ej. DSM‐IV, DSM‐V, CIE‐10). Las demografías de los pacientes también fueron limitadas en cuanto al país de origen (todos los participantes eran del Reino Unido) y la distribución de las edades (la edad promedio fue más de 80 años). Rivastigmina y placebo fueron las únicas intervenciones y no se evaluaron otros fármacos inhibidores de la colinesterasa (p.ej. donepezilo, galantamina). Además, no hubo comparaciones de un inhibidor de la colinesterasa con otros fármacos concebidos para tratar el delirio como los fármacos antipsicóticos, los agonistas de los receptores α2 adrenérgicos, las benzodiazepinas ni la melatonina. Se informó una cantidad muy pequeña de datos en los resultados como la duración del delirio, los eventos adversos (náuseas), el uso de fármacos de rescate, la mortalidad y el abandono temprano del estudio. La mayoría de los resultados predefinidos en esta revisión no se informaron, incluida la gravedad del delirio, el deterioro cognitivo persistente, la duración de la hospitalización, la institucionalización, el costo de la intervención y la calidad de vida. Por lo tanto, la aplicabilidad de la evidencia actual es limitada.
Calidad de la evidencia
El estudio incluido tuvo un bajo riesgo de sesgo en todos los dominios. La calidad general de la evidencia se disminuyó a baja debido al tamaño muy pequeño de la muestra.
Sesgos potenciales en el proceso de revisión
Se redujeron al mínimo los sesgos potenciales en el proceso de revisión al realizar una búsqueda minuciosa y completa de las bases de datos y otras fuentes. Dos revisores (AY y SW) seleccionaron y extrajeron los datos de forma independiente mediante formularios predeterminados de extracción de datos, un proceso que reduce la probabilidad de introducir sesgo en el proceso de revisión.
Acuerdos y desacuerdos con otros estudios o revisiones
Esta revisión reemplaza a una Revisión Cochrane previa que se publicó originalmente en 2008 (Otras versiones publicadas de esta revisión). Esta última revisión incluyó un estudio que evaluó el posible beneficio del donepezilo versus placebo en la prevención y el tratamiento del delirio posoperatorio en una población de pacientes de edad más avanzada sin demencia sometidos a la cirugía de reemplazo articular total electiva (Liptzin 2005). En esta revisión anterior se midió la incidencia del delirio posquirúrgico y no hubo diferencias claras en la duración del delirio posquirúrgico entre los dos grupos. En esta revisión actualizada, el interés se centró en el tratamiento del delirio. Se excluyó el estudio anterior, Liptzin 2005, debido a que 90 participantes incluidos no presentaban delirio en el momento de la asignación al azar y sólo 15 participantes desarrollaron delirio después del tratamiento. Esta revisión actual sólo incluyó a participantes con delirio establecido antes de la asignación al azar. Similar a la revisión anterior, no se encontraron diferencias claras en la duración del delirio entre los grupos de rivastigmina y placebo en un ámbito fuera de la UCI, ni diferencias claras entre los grupos en otros resultados como los eventos adversos, el uso de fármacos de rescate, la mortalidad y el abandono temprano del estudio. Sin embargo, ambas revisiones carecieron de evidencia suficiente para poder establecer conclusiones firmes. Aunque otros metanálisis han evaluado la prevención del delirio o la eficacia del tratamiento de determinadas intervenciones (Siddiqi 2016; Tampi 2016), los participantes no cumplieron los criterios de inclusión de la presente revisión (es decir, no tenían un diagnóstico establecido de delirio).

Study flow diagram.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
| Study | Interventions | N | MD | 95% CI | P value |
| Overshott 2010 | Cholinesterase inhibitors (rivastigmine) versus placebo | 15 | ‐3.6 | ‐15.6 to 8.4 | 0.5 |
Comparison 1 Cholinesterase inhibitors (rivastigmine) versus placebo, Outcome 1 Duration of delirium (days).

Comparison 1 Cholinesterase inhibitors (rivastigmine) versus placebo, Outcome 2 Adverse events (nausea).

Comparison 1 Cholinesterase inhibitors (rivastigmine) versus placebo, Outcome 3 Use of rescue medications.

Comparison 1 Cholinesterase inhibitors (rivastigmine) versus placebo, Outcome 4 Mortality.

Comparison 1 Cholinesterase inhibitors (rivastigmine) versus placebo, Outcome 5 Leaving the study early.
| Cholinesterase inhibitors (rivastigmine) compared to placebo for the treatment of delirium in non‐ICU settings | ||||||
| Patient or population: people with delirium | ||||||
| Outcomes | Illustrative comparative risks** (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Placebo | Cholinesterase inhibitors (rivastigmine) | |||||
| Duration of delirium | The mean duration was 9.9 days | The mean duration was 3.6 days lower (15.6 lower to 8.4 higher) | Not estimable | 15 | ⊕⊕⊝⊝ | The data were reported by Overshott 2010. The study was grossly underpowered, and the data were skewed. |
| Severity of delirium | See comment | See comment | See comment | See comment | See comment | No study reported this outcome. |
| Adverse events | 143 per 1000 | 43 per 1000 | RR 0.3 | 15 | ⊕⊕⊝⊝ | |
| Persistent cognitive impairment | See comment | See comment | See comment | See comment | See comment | No study reported this outcome. |
| Length of hospitalisation | See comment | See comment | See comment | See comment | See comment | No study reported this outcome. |
| Mortality | 571 per 1000 | 57 per 1000 | RR 0.1 | 15 | ⊕⊕⊝⊝ | |
| Cost of intervention | See comment | See comment | See comment | See comment | See comment | No study reported this outcome. |
| *The dose of intervention: 1.5 mg once a day increasing to 1.5 mg twice a day after 7 days. **The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Downgraded twice for imprecision due to very small sample size. | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Duration of delirium (days) Show forest plot | Other data | No numeric data | ||
| 2 Adverse events (nausea) Show forest plot | 1 | 15 | Risk Ratio (M‐H, Random, 95% CI) | 0.30 [0.01, 6.29] |
| 3 Use of rescue medications Show forest plot | 1 | 15 | Risk Ratio (M‐H, Random, 95% CI) | 0.13 [0.01, 2.10] |
| 4 Mortality Show forest plot | 1 | 15 | Risk Ratio (M‐H, Random, 95% CI) | 0.10 [0.01, 1.56] |
| 5 Leaving the study early Show forest plot | 1 | 15 | Risk Ratio (M‐H, Random, 95% CI) | 0.88 [0.07, 11.54] |

