Corticosteroides orales de corta duración como tratamiento adyuvante para la rinosinusitis crónica
Resumen
Antecedentes
Esta revisión es una de un conjunto de seis revisiones Cochrane que examinan las opciones primarias de tratamiento médico para los pacientes con rinosinusitis crónica.
La rinosinusitis crónica es una afección frecuente que incluye la inflamación del recubrimiento de la nariz y los senos paranasales. Se caracteriza por obstrucción nasal y secreción nasal, presión / dolor facial y pérdida del sentido del olfato. La enfermedad puede presentarse con o sin pólipos nasales. Los corticosteroides orales se utilizan para controlar la respuesta inflamatoria y mejorar los síntomas.
Objetivos
Evaluar los efectos de los corticosteroides orales de corta duración como tratamiento adyuvante (“adicional”) en pacientes con rinosinusitis crónica que ya reciben tratamientos estándar.
Métodos de búsqueda
El Especialista en Información del Grupo Cochrane de Enfermedades de Oído, Nariz y Garganta (Cochrane Ear, Nose and Throat Disorders [ENT] Group) buscó en el Registro de Ensayos del Grupo Cochrane ENT; Registro Central de Ensayos Controlados (Central Register of Controlled Trials) (CENTRAL 2015, número 7); EMBASE; EMBASE; ClinicalTrials.gov; ICTRP y fuentes adicionales de ensayos publicados y no publicados. La fecha de la búsqueda fue 11 de agosto de 2015.
Criterios de selección
Ensayos controlados aleatorios (ECA) que comparaban corticosteroides orales de corta duración (hasta 21 días) con placebo o ningún tratamiento, en los que todos los pacientes también estaban recibiendo tratamiento farmacológico para la rinosinusitis crónica.
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar previstos por Cochrane. Los resultados primarios fueron la calidad de vida relacionada con la salud (CdVRS) específica de la enfermedad, la gravedad de la enfermedad informada por el paciente y el evento adverso trastornos del estado de ánimo o conductuales. Los resultados secundarios incluyeron la CVRS general, la puntuación endoscópica de los pólipos nasales, la puntuación de la tomografía computarizada (TC) y los eventos adversos del insomnio, los trastornos gastrointestinales y la osteoporosis. Se utilizó GRADE para evaluar la calidad de las pruebas para cada resultado; esto se indica en cursiva.
Resultados principales
Dos ensayos con un total de 78 participantes cumplieron los criterios de inclusión. Tanto las poblaciones como los tratamientos “estándar” difirieron en los dos estudios.
Corticosteroides orales como tratamiento adyuvante a los corticosteroides intranasales
Un ensayo en adultos con pólipos nasales incluyó a 30 participantes. Todos los participantes usaron corticosteroides intranasales y fueron asignados al azar a los corticosteroides orales de corta duración (metilprednisolona oral, 1 mg/kg, que se redujo de forma progresiva durante un ciclo de tratamiento de 21 días) o ningún tratamiento adicional. Ninguna de las medidas de resultado primarias de interés de esta revisión fue informada por el estudio. Puede haber habido una reducción importante en el tamaño de los pólipos (medido de acuerdo a la puntuación de los pólipos nasales, una medida de resultado secundaria) en los pacientes que recibieron corticosteroides orales y corticosteroides intranasales, en comparación con los corticosteroides intranasales solos (diferencia de medias [DM] ‐0,46; intervalo de confianza [IC] del 95%: ‐0,87 a ‐0,05; 30 participantes; escala 1 a 4) al final del tratamiento (21 días). Esta cifra corresponde a un tamaño grande del efecto, aunque no existe mucha seguridad acerca de este cálculo porque se consideró que el estudio estaba en alto riesgo de sesgo. Además, los datos a más largo plazo no estaban disponibles y no se informaron los otros resultados de interés.
Corticosteroides orales como complemento de los antibióticos
Un ensayo en niños (edad promedio de ocho años) sin pólipos nasales incluyó a 48 participantes. El ensayo comparó corticosteroides orales (metilprednisolona oral, 1 mg/kg, que se redujo de forma progresiva durante un ciclo de tratamiento de 15 días) con placebo en participantes que también recibieron un ciclo de 30 días de antibióticos. Este estudio consideró una de las medidas de resultado primarias (gravedad de la enfermedad) y un resultado secundario (puntuación de la TC). Para la gravedad de la enfermedad , los cuatro síntomas clave usados para definir la rinosinusitis crónica en los niños (bloqueo nasal, secreción nasal, presión facial, tos) se combinaron en una puntuación. Hubo una mejoría mayor en la gravedad de los síntomas 30 días después del comienzo del tratamiento en los pacientes que recibieron corticosteroides orales y antibióticos en comparación con placebo y antibióticos (DM ‐7,10; IC del 95%: ‐9,59 a ‐4,61; 45 participantes; escala de 0 a 40). La diferencia de medias observada corresponde a un tamaño del efecto grande. En el mismo punto temporal hubo una diferencia en la puntuación de la TC (DM ‐2,90; IC del 95%: ‐4,91 a ‐0,89; 45 participantes; escala de 0 a 24). Se encontró que la calidad de las pruebas fue baja.
No había datos disponibles a largo plazo (tres meses).
Conclusiones de los autores
Podría haber una mejoría en la gravedad de los síntomas, el tamaño de los pólipos y la condición de los senos cuando son evaluados mediante TC en los pacientes que reciben corticosteroides orales cuando los mismos se utilizan como un tratamiento adyuvante a los antibióticos o a los corticosteroides intranasales, aunque la calidad de las pruebas que apoyan este hecho es baja o muy baja (no existe seguridad en cuanto al cálculo del efecto; el efecto verdadero puede ser considerablemente diferente de la estimación del efecto). No está claro si los beneficios de los corticosteroides orales como un tratamiento adyuvante se mantienen más allá del período de seguimiento corto informado (hasta 30 días), debido a que no hubo datos a largo plazo disponibles.
No hubo datos en esta revisión acerca de los efectos adversos asociados con los ciclos cortos de corticosteroides orales como un tratamiento adyuvante.
Se requiere más investigación en esta área, en particular investigación que evalúe los resultados a más largo plazo y los efectos adversos.
PICO
Resumen en términos sencillos
Corticosteroides orales a corto plazo además de otros tratamientos para la rinosinusitis crónica
Pregunta de la revisión
Se examinaron las pruebas sobre los efectos beneficiosos y perjudiciales del agregado de un ciclo de corta duración (habitualmente hasta 14 días) de corticosteroides administrados por vía oral a los pacientes con rinosinusitis crónica que también estaban recibiendo otro tipo de tratamiento (como corticosteroides administrados a través de la nariz).
Antecedentes
La rinosinusitis crónica es una afección frecuente que se define como inflamación de la nariz y los senos paranasales (un grupo de espacios llenos de aire detrás de la nariz, los ojos y las mejillas). Los pacientes con rinosinusitis crónica al menos presentan dos o más de los siguientes síntomas durante al menos 12 semanas: obstrucción nasal, secreción por la nariz o rinorrea, dolor o presión en la cara o disminución del sentido del olfato (hiposmia). Algunos pacientes también presentan pólipos nasales, que son tumefacciones en forma de uva del recubrimiento nasal normal dentro de la vía nasal y los senos.
Los ciclos cortos de corticosteroides orales son un tratamiento utilizado generalmente para la rinosinusitis crónica. Funcionan al controlar la inflamación y cuando hay pólipos presentes reducen rápidamente el tamaño de los pólipos para mejorar los síntomas. Los efectos adversos de los corticosteroides pueden incluir insomnio, cambios del estado de ánimo y cambios gastrointestinales (como dolor de estómago, acidez, diarrea, estreñimiento, náuseas y vómitos). Cuando se administran a más largo plazo o durante muchos ciclos cortos repetidos, también es posible desarrollar osteoporosis (huesos frágiles).
Características de los estudios
Esta revisión incluye pruebas hasta el 11 de agosto de 2015. Se incluyeron dos ensayos controlados aleatorios con un total de 78 participantes.
Un ensayo incluyó a 30 adultos con pólipos nasales. Los participantes recibieron corticosteroides intranasales y corticosteroides orales o sólo corticosteroides intranasales. El único resultado informado de interés para esta revisión fue si se redujo el tamaño de los pólipos nasales, al completar estos tratamientos (tres semanas).
Un ensayo incluyó a 48 niños (media de edad de ocho años) con rinosinusitis crónica pero sin pólipos nasales. Los participantes recibieron antibióticos y corticosteroides orales o sólo antibióticos y un placebo (pastilla de azúcar). Los corticosteroides orales y el placebo se administraron durante 15 días y los antibióticos se administraron durante 30 días. El ensayo informó los hallazgos al completar el tratamiento con antibióticos (un mes más tarde).
Resultados clave
Al final de un ciclo de tratamiento de tres semanas, los pacientes que recibieron tanto corticosteroides intranasales como corticosteroides orales pueden haber tenido pólipos nasales más pequeños que los pacientes que sólo recibieron corticosteroides intranasales. El ensayo no realizó el seguimiento de los pacientes para determinar si el tamaño de los pólipos aumentó después del final del ensayo. El ensayo no proporcionó información sobre los eventos adversos u otros resultados importantes para los pacientes, como la gravedad de los síntomas o la calidad de vida.
Los niños que recibieron tanto antibióticos como corticosteroides orales parecieron tener una reducción en la puntuación total de los síntomas y una mejoría en la puntuación de la tomografía computarizada (TC) después del tratamiento comparado con los niños que recibieron antibióticos y tratamiento de control. El informe de los efectos adversos en este ensayo no fue muy claro por lo cual es difícil establecer si algún participante presentó trastornos gastrointestinales, cambios del estado de ánimo o dificultad para dormir.
Calidad de la evidencia
Se consideró que la calidad de las pruebas sobre los corticosteroides orales más corticosteroides intranasales para adultos con pólipos nasales fue muy baja (no existe seguridad acerca del cálculo) debido a que las pruebas provienen de un ensayo que presenta un número reducido de participantes. El ensayo tuvo un alto riesgo de sesgo debido a la forma en que fue realizado. El ensayo no informó los eventos adversos y no presentó los resultados después del final del tratamiento.
Se consideró que la calidad de las pruebas sobre los corticosteroides orales más antibióticos para los niños fue baja (es muy probable que la investigación adicional tenga una marcada repercusión sobre la confianza en el cálculo del efecto y es probable que cambie el cálculo) debido a que las pruebas provienen de un ensayo pequeño. El ensayo no presentó un alto riesgo de sesgo, aunque sólo incluyó a niños sin pólipos nasales, que quizá no tengan los mismos resultados que los adultos con pólipos nasales. El ensayo no presentó los resultados después del final del tratamiento y los efectos adversos del tratamiento no se informaron de manera adecuada.
Conclusiones de los autores
Summary of findings
| Short‐course oral corticosteroids compared to no oral corticosteroid treatment (intranasal steroids in both arms) for chronic rhinosinusitis | ||||||
| Patient or population: chronic rhinosinusitis | ||||||
| Outcomes No. of participants (studies) | Relative effect (95% CI) | Anticipated absolute effects* (95% CI) | Quality | What happens | ||
| Without oral steroids | With oral steroids | Difference | ||||
| Disease‐specific health‐related quality of life | — | No RCT reported this outcome | ||||
| Disease severity ‐ patient‐reported symptom score | — | No RCT reported this outcome | ||||
| Adverse effect: mood or behavioural disturbances | — | No RCT reported this outcome | ||||
| Health‐related quality of life | — | No RCT reported this outcome | ||||
| Adverse effect: insomnia | — | No RCT reported this outcome | ||||
| Adverse effect: gastrointestinal disturbances ‐ not measured | — | No RCT reported this outcome | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| Short‐course oral corticosteroids compared to placebo (antibiotics in both groups) for chronic rhinosinusitis | |||||
| Patient or population: chronic rhinosinusitis | |||||
| Outcomes No of participants (studies) | Anticipated absolute effects* (95% CI) | Quality | What happens | ||
| Without oral steroids | With oral steroids | Difference | |||
| Disease‐specific health‐related quality of life | No RCT reported this outcome | ||||
| Disease severity ‐ patient‐reported symptom score, assessed with: 4 individual symptoms measured on 0 to 10 visual analogue scale summed to provide a range of 0 to 40 No. of participants: 45 | The mean disease severity score without oral steroids was 15.2 | The mean disease severity score with oral steroids was 3.6 | The mean disease severity score in the intervention group was 7.10 lower (9.59 lower to 4.61 lower) | ⊕⊕⊝⊝ | A lower score indicates less severe symptoms. The results relate to a standardised mean difference of 1.61 standard deviations lower (‐2.29 to 0.93 lower), corresponding to a large difference. |
| Adverse effect: mood or behavioural disturbances | No RCT reported this outcome | ||||
| Health‐related quality of life | No RCT reported this outcome | ||||
| Adverse effect: insomnia | No RCT reported this outcome | ||||
| Adverse effect: gastrointestinal disturbances | No RCT reported this outcome | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1Study completed only in children (mean age 8 years old). Study follow‐up time was less than 3 months (1 month). Scales were not validated and were completed by "parents and children". 2Symptoms included in this score were: purulent nasal discharge, nasal obstruction, cough and facial pain/headache. | |||||
Antecedentes
Descripción de la afección
La rinosinusitis crónica se define como la inflamación de la nariz y los senos paranasales caracterizada por dos o más síntomas, uno de los cuales debe ser bloqueo / obstrucción / congestión nasal o secreción nasal (goteo nasal anterior / posterior). Los otros síntomas posibles incluyen dolor / presión facial, disminución o pérdida del sentido del olfato (en los adultos) o tos (en los niños). Los síntomas deben haber continuado durante al menos 12 semanas. Además, los pacientes deben tener cambios de la mucosa dentro del complejo osteomeatal o los senos, demostrados en un examen de tomografía computarizada (TC) o mediante al menos uno de los siguientes signos endoscópicos: pólipos nasales, secreción mucopurulenta principalmente del meato medio o edema / obstrucción de la mucosa principalmente en el meato medio(EPOS 2012).
La rinosinusitis crónica representa una fuente frecuente de enfermedad; el 11% de los adultos del Reino Unido informaron síntomas de rinosinusitis crónica en un estudio llevado a cabo en la población general (Hastan 2011). Los síntomas, que incluyen obstrucción nasal, secreción nasal, dolor facial, anosmia y trastornos del sueño, tienen una repercusión importante sobre la calidad de vida, supuestamente mayor en varios dominios del SF‐36 que la angina o la enfermedad respiratoria crónica (Gliklich 1995). Son frecuentes las exacerbaciones agudas, el control insuficiente de los síntomas y la exacerbación de las enfermedades respiratorias. Las complicaciones son poco frecuentes, pero pueden incluir deficiencia visual e infección intracraneal.
Se han identificado dos fenotipos principales de rinosinusitis crónica según la presencia o ausencia de pólipos nasales al examen. Los pólipos nasales son tumefacciones hiperplásicas similares a tumores de la mucosa nasal, y la mayoría se origina habitualmente desde el interior del complejo osteomeatal(Larsen 2004). La rinosinusitis crónica con pólipos nasales (RSCcPN) se diagnostica cuando se observan pólipos (directamente o al examen endoscópico) bilateralmente en el meato medio. Las siglas RSCsPN se utilizan para la afección en la que no hay pólipos presentes.
Aunque la etiología de la rinosinusitis crónica no se comprende completamente, puede incluir anomalías en la respuesta del huésped a los irritantes, microorganismos comensales y patógenos y alérgenos, obstrucción de las vías de drenaje de los senos, anomalías de la función mucociliar normal, pérdida de la barrera de la mucosa normal o infección. Se pueden observar dos perfiles característicos en cuanto a los mediadores inflamatorios; en la rinosinusitis crónica eosinofílica, que se asocia habitualmente con pólipos nasales, es posible encontrar niveles altos de eosinófilos, inmunoglobulina E (IgE) e interleucina (IL)‐5, mientras que en la rinosinusitis crónica neutrofílica, asociada con mayor frecuencia con la rinosinusitis crónica sin pólipos, predominan los neutrófilos, con el interferón (IFN) gamma, la IL‐8 y el factor de necrosis tumoral (FNT) elevados(EPOS 2012).
Aunque las decisiones sobre el tratamiento se deben tomar según una comprensión del fenotipo de la rinosinusitis crónica del paciente y su probable etiología, en la práctica el tratamiento se puede iniciar sin el conocimiento del estado de los pólipos, en particular en la atención primaria. Esta revisión (y la mayoría de las revisiones acompañantes) consideran juntos a los pacientes con y sin pólipos para la evaluación inicial de los efectos del tratamiento. Sin embargo, los análisis de subgrupos exploran las posibles diferencias entre estos pacientes.
Las intervenciones utilizadas con mayor frecuencia para la rinosinusitis crónica se utilizan tópica (en spray nasal) o sistémicamente (por vía oral) e incluyen corticosteroides, antibióticos y solución salina.
Descripción de la intervención
Los ciclos cortos de corticosteroides orales se utilizan ampliamente en la medicina para diversas afecciones inflamatorias. En los pacientes con rinosinusitis crónica a menudo se utilizan con el objetivo de lograr una mejoría rápida en los síntomas y permitirles un mejor acceso a los agentes aplicados tópicamente. A menudo se administran durante un periodo de siete a 21 días y puede ofrecerse una dosis fija o una dosis que se reduce durante el ciclo. Se cree que esta estrategia reduce el riesgo de efectos adversos(Mygind 1996). Se ha informado un espectro amplio de eventos adversos con la administración de corticosteroides sistémicos (ver Tabla 1); sin embargo, faltan datos sobre su incidencia en asociación con la rinosinusitis crónica. Aunque es posible extrapolar los resultados de los ensayos en otras enfermedades, existe el riesgo de que la incidencia sea específica de la enfermedad; por ejemplo, se observa una elevada incidencia de necrosis avascular con la administración de dosis altas de corticosteroides en el lupus eritematoso sistémico, que se atribuye en parte al proceso y la gravedad de la enfermedad subyacente, así como a las dosis mayores prescritas en la enfermedad grave (Da Silva 2006).
Se dice que los efectos adversos asociados con la administración a corto plazo de corticosteroides orales incluyen trastornos gastrointestinales, insomnio y alteración del estado mental. Sin embargo, hay pocos o ningún dato publicado sobre la frecuencia de estos efectos cuando se prescriben ciclos a corto plazo. Los efectos adversos asociados con la administración de los corticosteroides orales a largo plazo también se enumeran en la Tabla 1.
De qué manera podría funcionar la intervención
Los ciclos cortos de corticosteroides orales se utilizan con mayor frecuencia en los pacientes con rinosinusitis crónica y pólipos nasales. La intención es disminuir la inflamación para producir una reducción rápida del tamaño de los pólipos, mejorar los síntomas y permitir una mejor penetración de los tratamientos tópicos en la cavidad nasal. Se pueden utilizar de manera similar en los pacientes con rinosinusitis crónica sin pólipos que presentan obstrucción nasal grave o anosmia total (pérdida del sentido del olfato). Se espera que el efecto inicial del tratamiento sea inmediato. Cualquier mejoría observada puede continuar, especialmente si un efecto de la intervención mejorará la biodisponibilidad de un tratamiento complementario.
Sin embargo, no existen pruebas en relación al régimen de tratamiento óptimo de los esteroides orales en lo que se refiere a indicación, dosis y duración. El uso óptimo de los esteroides es clínicamente importante porque puede reducir la necesidad de una cirugía al proporcionar un buen control sintomático.
Por qué es importante realizar esta revisión
Los ciclos cortos de corticosteroides orales se usan ampliamente como una forma de tratamiento adicional en pacientes con rinosinusitis crónica. Esta revisión y una nueva revisión estrechamente relacionada sobre “Corticosteroides orales de corta duración solos para la rinosinusitis crónica”, Head 2016a, actualizan y amplían una revisión Cochrane anterior que consideró este tratamiento en pacientes con pólipos nasales (Martinez‐Devesa 2011). Esta revisión procura establecer los beneficios adicionales (y los efectos perjudiciales) de los corticosteroides, cuando se los agrega a los tratamientos existentes para la rinosinusitis crónica. En cambio, la revisión complementaria procurará establecer la efectividad relativa (y los efectos perjudiciales) de los corticosteroides orales en comparación con ningún tratamiento u otros agentes comúnmente usados para la rinosinusitis crónica (como los corticosteroides intranasales).
Esta revisión es una de un conjunto de revisiones Cochrane que examinan las opciones habituales de tratamiento para los pacientes con rinosinusitis crónica(Chong 2016a; Chong 2016b; Chong 2016c; Head 2016a; Head 2016b), y utiliza las mismas medidas de resultado entre las revisiones. No se incluyeron estudios diseñados para evaluar las intervenciones en el período periquirúrgico inmediato, que se centran en intentar evaluar la repercusión de la intervención en el procedimiento quirúrgico o modificar los resultados posquirúrgicos.
Objetivos
Evaluar los efectos de los corticosteroides orales de corta duración como tratamiento adyuvante (“adicional”) en pacientes con rinosinusitis crónica que ya reciben tratamientos estándar.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron los estudios con las siguientes características de diseño:
-
ensayos controlados aleatorios, incluidos los ensayos aleatorios grupales y los ensayos cuasialeatorios (los ensayos cruzados solamente se incluyeron si estaban disponibles los datos de la primera fase); y
-
los pacientes tuvieron un seguimiento de al menos dos semanas.
Se excluyeron los estudios con las siguientes características de diseño:
-
pacientes asignados al azar por lado de la nariz (controlado en el mismo paciente) porque es difícil asegurar que los efectos de cualquiera de las intervenciones consideradas puedan ser localizados; o
-
los estudios perioperatorios, en los que la única finalidad del estudio fue investigar el efecto de la intervención sobre el resultado quirúrgico.
Tipos de participantes
Pacientes con rinosinusitis crónica, con pólipos o sin pólipos.
Se excluyeron los estudios que incluyeron una mayoría de pacientes con:
-
fibrosis quística;
-
sinusitis micótica alérgica / micótica eosinofílica / rinosinusitis mucinosa;
-
enfermedades respiratorias exacerbadas por la aspirina;
-
pólipos antrocoanales (pólipos benignos que se originaron de la mucosa del seno maxilar);
-
pólipos malignos;
-
discinesia ciliar primaria;
-
inmunodeficiencia grave (congénita o adquirida);
-
antecedentes de cirugía por pólipos nasales en el ciclo de seis semanas del ingreso al estudio.
Tipos de intervenciones
Se incluyeron todos los ciclos cortos (ver más adelante) de corticosteroides orales, independientemente de la dosis. Esto incluye:
-
prednisona;
-
prednisolona;
-
metilprednisolona;
-
hidrocortisona;
-
acetato de cortisona.
Los ciclos cortos de corticosteroides orales se definen como los que duran hasta, pero no exceden, 21 días.
Las comparaciones principales fueron:
-
corticosteroides orales más intranasales versus placebo o ningún tratamiento más corticosteroides intranasales.
Otros posibles pares de comparación incluyeron:
-
corticosteroide oral más cointervención X versus placebo/ningún tratamiento más cointervención X ('cointervención X' se refiere a cualquiera de las otras intervenciones posibles).
Esta revisión forma parte de una serie mayor de seis revisiones para el tratamiento de la rinosinusitis crónica:
-
Corticosteroides intranasales versus placebo o ninguna intervención para la rinosinusitis crónica (Chong 2016b).
-
Diferentes tipos de corticosteroides intranasales para la rinosinusitis crónica (Chong 2016a). Esta revisión compara diferentes clases, dosis y métodos de administración de los corticosteroides intranasales para la rinosinusitis crónica.
-
Corticosteroides orales de corta duración solos para la rinosinusitis crónica (Head 2016a). Esta revisión compara los corticosteroides orales de corta duración solos con placebo o ninguna intervención, o versus otras intervenciones farmacológicas como los antibióticos o la irrigación nasal de solución salina.
-
Corticosteroides orales de corta duración como tratamiento adyuvante para la rinosinusitis crónica (esta revisión). Esta revisión compara los corticosteroides orales cuando se utilizaron como tratamiento complementario a otros tratamientos para la rinosinusitis crónica (como corticosteroides intranasales, antibióticos o solución salina).
-
Irrigación con solución salina para la rinosinusitis crónica (Chong 2016c). Esta revisión compara la irrigación nasal con solución salina para la rinosinusitis crónica con placebo / ninguna intervención y con corticosteroides intranasales o antibióticos.
-
Antibióticos sistémicos y tópicos para la rinosinusitis crónica (Head 2016b). Esta revisión compara los antibióticos tópicos y sistémicos con placebo / ningún tratamiento, dos antibióticos diferentes entre sí y antibióticos con corticosteroides intranasales.
Tipos de medida de resultado
Se analizaron los siguientes resultados en la revisión, aunque no se utilizaron como base para incluir o excluir los estudios.
Tanto los efectos a corto plazo (al final de tratamiento) como a largo plazo son importantes, por lo tanto se evaluaron los resultados al final del tratamiento o en las tres semanas del mismo además de tres a seis meses, seis a 12 meses y más de 12 meses. Para los eventos adversos se analizaron los datos de los períodos más prolongados.
Resultados primarios
-
Calidad de vida relacionada con la salud, mediante puntuaciones de calidad de vida relacionada con la salud específica de la enfermedad como la Sino‐Nasal Outcome Test‐22 (SNOT‐22), las Rhinosinusitis Outcome Measures‐31 (RSOM‐31) y la SNOT‐20.
-
Gravedad de la enfermedad, medida según la puntuación de los síntomas informados por el paciente (como el Chronic Sinusitis Survey [CSS] y escalas analógicas visuales). A falta de datos validados de la puntuación de los síntomas, se informaron las puntuaciones de los síntomas individuales informadas por el paciente para los siguientes síntomas: obstrucción / bloqueo / congestión nasal, secreción nasal (rinorrea), presión / dolor facial, pérdida del sentido del olfato (adultos), tos (niños).
-
Efecto adverso significativo: trastornos del estado de ánimo o conductuales.
Resultados secundarios
-
Calidad de vida relacionada con la salud, mediante puntuaciones genéricas de la calidad de vida como SF‐36, EQ‐5D y otros instrumentos correctamente validados.
-
Otros efectos adversos: trastornos gastrointestinales.
-
Otros efectos adversos: insomnio.
-
Otros efectos adversos: osteoporosis (cuando el seguimiento fue de al menos seis meses).
-
Puntuación endoscópica (según la población, o la puntuación del tamaño de los pólipos nasales o la puntuación por endoscopia, p.ej. Lund‐Mackay/Lund‐Kennedy).
-
Puntuación del examen por tomografía computarizada (TC) (p.ej. Lund‐Mackay).
Los eventos adversos que se procuró recopilar de los estudios que incluían uno de los diversos comparadores enumerados más arriba fueron los mismos que los eventos adversos identificados en la sección de los métodos de las revisiones acompañantes que evaluaban los efectos de dichas intervenciones como tratamientos primarios. Por ejemplo, para los estudios en los cuales todos los participantes recibieron corticosteroides intranasales, la lista de eventos adversos también incluirá los específicamente relacionados con los corticosteroides intranasales como lo encontrado en Chong 2016a y Chong 2016b.
Results
Description of studies
Results of the search
The searches retrieved a total of 2470 references. We screened the titles and abstracts and subsequently removed 2424 studies. We assessed 46 full texts for eligibility and excluded 43 studies. We included two studies and identified one ongoing study. No studies are awaiting assessment.
A flow chart of study retrieval and selection is provided in Figure 1.
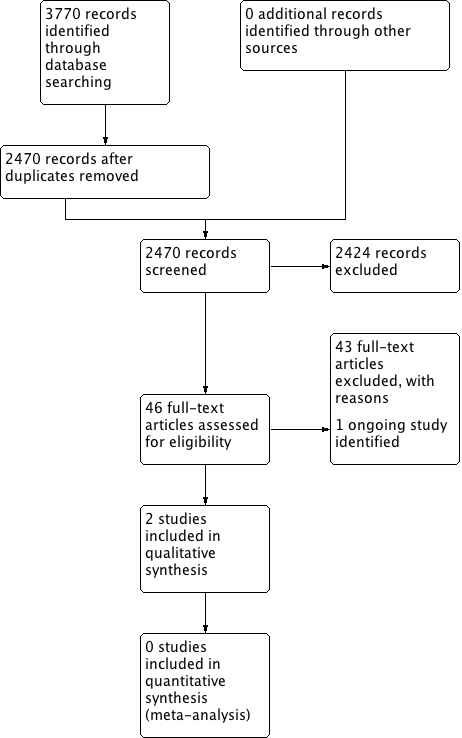
Process for sifting search results and selecting studies for inclusion.
Included studies
Two studies are included in the review (Bülbül 2013; Ozturk 2011). See Characteristics of included studies.
Design
Bülbül 2013 is an unblinded, parallel‐group, quasi‐randomised controlled trial (randomised by order of presentation). Ozturk 2011 is a double‐blind, parallel‐group, randomised, placebo‐controlled trial.
Setting
Both studies were conducted in Turkey. Bülbül 2013 was a single‐site study conducted in a university hospital outpatient ear, nose and throat department, whereas Ozturk 2011 was conducted in the paediatric ear, nose and throat outpatients clinics of two university hospitals.
Participants and sample size
In Bülbül 2013, the two study arms that met the inclusion criteria for this review consisted of 30 adults (mean age 34.73 ± 16.72) with a diagnosis of bilateral nasal polyps on endoscopic examination. Ozturk 2011 included 48 children with a mean age in the oral steroids group of 8.5 ± 2.9 years and a mean age in the placebo group of 8.0 ± 2.3 years. All patients had chronic rhinosinusitis without nasal polyps. The diagnosis of chronic rhinosinusitis was based of sinonasal symptoms and signs present for a period of more than three months in the presence of abnormalities on coronal sinus CT scans.
Interventions
Bülbül 2013 compared intranasal steroids alone (budesonide), oral steroids alone (methylprednisolone) and treatment with both intranasal steroids and oral steroids. No placebo was used. The treatment time was 21 days for all arms. For this review, the only comparison of interest was the group receiving oral steroids and intranasal steroids compared with the group receiving intranasal steroid alone (i.e. oral steroids compared with no treatment, with both groups receiving concurrent treatment with an intranasal steroid).
In Ozturk 2011, methylprednisolone was prescribed for 15 days at a dose adjusted to the weight of the child (1 mg/kg/day, maximum of 40 mg for 10 days) and reduced over the treatment time. Patients in the control arm received identical‐looking lactose tablets as placebo. In addition, children in both arms of the study received broad‐spectrum antibiotics (oral amoxicillin/clavulanate at 45/6.3 mg/kg/day, maximum of 2000/285 mg/day) for 30 days as concurrent treatment.
Outcomes
Bülbül 2013 aimed to investigate the effects of glucocorticoids on chronic rhinosinusitis with nasal polyps with detection of inflammatory response by measurement of nitric oxide levels in nasal polyp tissue. The only outcome of interest to this review was the secondary outcome of endoscopic nasal polyp score measured with Rasp criteria. No information about this scale was presented in the paper but Côté 2011 indicates that it is a four‐point scale, graded from 1 to 4 (1 = least severe, 4 = most severe). The outcomes were reported at 21 days, at the end of the treatment course. The study did not mention whether they measured any adverse events.
Ozturk 2011 presents the primary outcome of total symptom score (comprising a cumulative score for the individual symptoms of purulent nasal discharge, nasal obstruction, postnasal drainage, halitosis, cough and facial pain/headache measured using a visual analogue scale (VAS) of 0 to 10 (0 = none, 10 = most severe, non‐validated) and a CT scan score measured with the Lund‐Mackay scoring system (0 to 24; 0 = least severe, 24 = most severe). The study also specified that "tolerability was evaluated by means of medical history, physical examination, and measurement of adverse events. Hypertension, edema, weight gain, increase in appetite, gastrointestinal disturbances, nervousness, agitation, psychosis, headache, mood swings, delirium, euphoria, moon face, skin atrophy, bruising, hyperpigmentation, muscle weakness, joint pain, and allergic reactions were defined as clinically significant adverse events".
Excluded studies
We excluded 43 papers after reviewing the full paper. Further details for the reasons for exclusion can be found in the Characteristics of excluded studies table. We identified 19 of these from the excluded papers list in the previous version of the Cochrane review (Martinez‐Devesa 2011). The reasons for exclusion from the previous review were found to be still valid under the updated inclusion criteria developed for this review (Alobid 2005; Blomqvist 2001; Blomqvist 2009; Bonfils 1998; Bonfils 2003; Bonfils 2006; Chi Chan 1996; Damm 1999; Hessler 2007; Jankowski 2003a; Jankowski 2003b; Kroflic 2006; Lildholdt 1988; Lildholdt 1989; Nores 2003; Ragab 2006; Rasp 2000; Sieskiewicz 2006; Stevens 2001).
Thirteen papers were reporting RCTs comparing oral steroid treatment with placebo or no treatment, but study participants did not receive any other concurrent treatment (Alobid 2006; Alobid 2012; Alobid 2014; Benitez 2006; Ecevit 2015; Hissaria 2006; Kapucu 2012; Kirtsreesakul 2011; Kirtsreesakul 2012; Martinez‐Anton 2008; Vaidyanathan 2011; Van Zele 2008; Van Zele 2010). These studies are included in the Cochrane review of oral steroids alone for chronic rhinosinusitis (Head 2016a). We found three protocols for ongoing RCTs: none of these studies appeared to use oral steroids as an adjunct to other treatment (Chi 2011; NCT00841802; NCT02367118).
Of the remaining eight papers, one included a population of people with allergic fungal rhinosinusitis (Rupa 2010), one compared oral steroids with intranasal steroids, but participants did not receive any background treatments (Reychler 2015), and six were either non‐randomised studies or commentaries on existing RCTs (Grammer 2013; Rasp 1997; Remer 2005; Sousa 2009; Tuncer 2003; van Camp 1994).
Ongoing studies
One ongoing study is being conducted to investigate the efficacy of oral steroids (prednisone 40 mg in reducing doses for 20 days) followed by intranasal steroids (mometasone), compared with intranasal steroids alone (mometasone) in adults with chronic rhinosinusitis without nasal polyps (NCT01676415). Both groups also had a concurrent course of antibiotics lasting for three weeks. The study is due to report results during 2016. See Characteristics of ongoing studies.
Risk of bias in included studies
For details of the risk of bias in the included studies see the 'Risk of bias' tables (Characteristics of included studies). Details of the risk of bias for each study can be found in Figure 2. A 'Risk of bias' graph shows our judgements about each risk of bias item presented as percentages across all included studies (Figure 3).

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
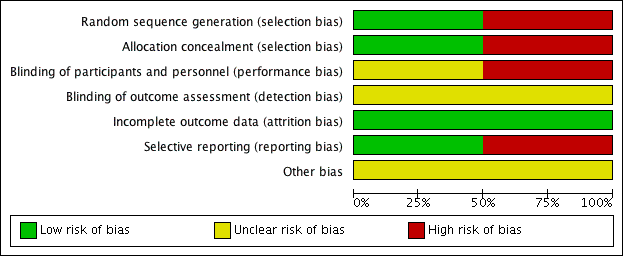
'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Allocation
Sequence generation
Both the included studies were randomised and controlled. We assessed Bülbül 2013 as high risk of bias for sequence generation as it was quasi‐randomised, with the allocation to the arm of the trial being completed based on the order of presentation. Ozturk 2011 used a random allocation chart based on a table of random numbers to generate the sequence.
Allocation concealment
We assessed Bülbül 2013 as high risk of bias for allocation concealment as the allocation to the arm of the study was completed by order of presentation, which allows the people allocating participants to treatment group to know exactly which arm participants are being allocated to. We assessed Ozturk 2011 as having a low risk of bias for allocation concealment as sealed envelopes were used to prevent the healthcare personnel from influencing allocation of participants in the study.
Blinding
As Bülbül 2013 lacked a placebo arm, we assessed that there was a high risk of bias for blinding of participants and personnel. In addition, it did not report whether outcome assessment was blinded; we therefore assessed this to be an unclear risk. We assessed Ozturk 2011 to be of unclear risk of bias for blinding of participants and personnel. Although the methods for blinding were well explained in the paper and efforts were made to keep the size and appearance of the placebo the same as the active treatment, there was no discussion on the taste of the tablets. Methylprednisolone has a distinctive, bitter taste that is different to the slightly sweet taste of lactose. This may have allowed the blinding to be compromised and it is noted that one patient did drop out of the study due to the unpalatability of the active tablet. The method for standardising reporting by outcome assessors for CT scans was mentioned in the paper but the risk was unclear for the other outcomes, since these are mostly patient/parent‐reported and the effectiveness of blinding using the placebo was unclear.
Incomplete outcome data
We assessed both studies to have a low risk of bias for incomplete outcome data. Bülbül 2013 reported that there were no patients who dropped out of the study whereas Ozturk 2011 reported a low rate of participant drop‐out (3 out of 48 (6%)).
Selective reporting
We found no protocols for either study (Bülbül 2013; Ozturk 2011).
We assessed Bülbül 2013 to have a low risk of reporting bias. The outcomes listed in the methods section were all presented in the results section although the study did not present any information about adverse events.
We assessed Ozturk 2011 to be at a high risk of bias for selective reporting. There appears to be a discrepancy between the adverse events that were planned to be reported in the methods section and the results section, which stated that "No clinically significant adverse events were reported". However, the paper follows this statement by reporting a number of patients with increase in appetite and weight gain, which were classified as "clinically significant adverse events" in the methods section of the paper. No information was provided about other types of adverse events and we cannot be certain that there were no events. In addition, the summed scores for the individual symptom scores as presented in the paper do not add up to the total symptom score as presented and no information is presented with regard to any adjustments or weighting that may have been made.
Other potential sources of bias
Use of validated outcome measures
The validation of outcomes was one area of potential bias that we identified as relevant at the start of the review. Bülbül 2013 did not provide information regarding the validation of the outcome measures. Similarly, Ozturk 2011 did not mention whether the measures they used for assessing outcomes were validated and this is particularly a concern when symptom severity was "... assessed in the patients and their parents" using visual analogue scales.
Funding and conflict of interests in trials
No funding information was presented for either trial (Bülbül 2013; Ozturk 2011). With regards to conflicts of interest, Bülbül 2013 stated that there were "None declared" and Ozturk 2011 declared that "The authors have declared that they have no conflicts of interest".
Baseline characteristics
Bülbül 2013 was a poorly reported study and did not present details of the baseline characteristics for each group. There was a non‐significant difference between the groups for the severity of nasal polyps, with the placebo group containing the more severely affected patients. The small size of the trial makes it difficult to draw conclusions.
The baseline characteristics for the two groups in Ozturk 2011 were similar with no significant differences between the groups in any of the characteristics presented including age, duration of symptoms or presence of atopy.
Effects of interventions
See: Summary of findings for the main comparison Short‐course oral corticosteroids compared to no oral corticosteroid treatment (intranasal steroids in both groups) for chronic rhinosinusitis; Summary of findings 2 Short‐course oral corticosteroids compared to placebo (antibiotics in both arms) for chronic rhinosinusitis
Two trials comprising two different comparison pairs were included in this review. Bülbül 2013 compared oral steroids with a background of intranasal corticosteroids in 30 adults with chronic rhinosinusitis and nasal polyps. Ozturk 2011 investigated oral steroids with a background of antibiotics in 48 children with chronic rhinosinusitis without nasal polyps. The results of these two comparison pairs are discussed separately.
Where the range of scales and values for minimal important differences were unclear, we used the standardised mean difference (SMD) as a guide to estimate the effect sizes. As suggested in the Cochrane Handbook for Systematic Reviews of Interventions (Handbook 2011), we used standard rules of thumb in the interpretation of effect sizes (SMD, or Cohen's effect size of < 0.41 = small, 0.40 to 0.70 = moderate, > 0.70 = large) (Cohen 1988).
Oral steroids as an adjunct to intranasal corticosteroids
See also summary of findings Table for the main comparison.
Primary outcomes
1. Disease‐specific health‐related quality of life
The study did not report this as an outcome.
2. Disease severity ‐ symptoms score
The study did not report this as an outcome. Individual symptom scores were not reported.
3. Significant adverse effect: mood or behavioural disturbances
The study did not report this as an outcome.
Secondary outcomes
1. General health‐related quality of life
The study did not report this as an outcome.
2. Other adverse event: gastrointestinal disturbances
The study did not report this as an outcome.
3. Other adverse event: insomnia
The study did not report this as an outcome.
4. Other adverse event: osteoporosis
The study did not report this as an outcome.
5. Endoscopic scores (including nasal polyps score)
Nasal polyps scores were measured after treatment (21 days) in Bülbül 2013 using the Rasp criteria, although no explanation of, or reference to, the criteria or validation thereof was made within the paper. Further investigation into this scale appears to indicate that the Rasp criteria rate the severity of nasal polyps on a four‐point scale (1 to 4, 1 = least severe) (Côté 2011). The results were available for 30 patients and showed that there might be an improvement in mean nasal polyp size for the population that received oral and intranasal steroids, compared with the group receiving intranasal steroids alone (mean difference (MD) ‐0.46, 95% confidence interval (CI) ‐0.87 to ‐0.05) (Analysis 1.1). The observed mean difference corresponds to a large effect size (SMD of 0.79). This result is not presented in the 'Summary of findings' table as we did not consider it to be a priority outcome.
6. Computerised tomography (CT) scan score
The study did not report this outcome.
Oral steroids as an adjunct to antibiotics
See also summary of findings Table 2.
Primary outcomes
1. Disease‐specific health‐related quality of life
The study did not report this as an outcome.
2. Disease severity ‐ symptoms score
Ozturk 2011 presented results for a total symptom score after treatment (30 days) as assessed by patient and parents. The symptoms measured were purulent nasal discharge, nasal obstruction, postnasal drainage, halitosis, cough and facial pain/headache using a visual analogue scale (range of 0 to 10, 0 = "none", 10 = "most severe"). We combined the four individual scores that related to elements of the EPOS 2012 diagnostic criteria (purulent nasal discharge, nasal obstruction, cough and facial pain/headache) to make a total symptom score with a range from 0 to 40 at the end of treatment. Results for 45 children were available and showed a lower score in the oral steroids group at 30 days (MD ‐7.10, 95% CI ‐9.59 to ‐4.61) (Analysis 2.1). The observed mean difference corresponds to a large effect size (SMD of 1.61).
Ozturk 2011 also presents results for individual symptom scores for each of the four domains from the EPOS 2012 definition criteria for chronic rhinosinusitis: purulent nasal discharge, nasal obstruction, cough and facial pain or headache.
Nasal obstruction/congestion/blockage
Ozturk 2011 (45 participants) at the end of the trial (30 days) showed an improvement in nasal blockage in favour of the group receiving oral steroid and antibiotics compared with the group that received antibiotics alone (MD ‐3.50, 95% CI ‐4.71 to ‐2.29) (Analysis 2.2).
Nasal discharge
Ozturk 2011 measured 'purulent nasal discharge' in 45 participants and showed no improvement in discharge between the groups at the end of the trial (MD ‐0.20, 95% CI ‐1.54 to 1.14) (Analysis 2.3).
Facial pain or headache
Ozturk 2011 (45 participants) showed an improvement in facial pain or headache in favour of the group with oral steroids in addition to antibiotics at the end of the trial (MD ‐1.30, 95% CI ‐2.55 to ‐0.05) (Analysis 2.4).
Cough
Ozturk 2011 (45 participants) showed an improvement in cough in favour of the oral steroid group at the end of the trial (MD ‐2.10, 95% CI ‐3.35 to ‐0.85) (Analysis 2.5).
None of the results for individual symptoms are presented in the GRADE 'Summary of findings' table as we did not consider them to be priority outcomes.
3. Significant adverse effect: mood or behavioural disturbances
Ozturk 2011 states that "No clinically significant adverse events were reported", but does not provide further information for any of the pre‐specified adverse events in the protocol.
Secondary outcomes
1. General health‐related quality of life
The study did not report this as an outcome.
2. Other adverse event: gastrointestinal disturbances
Ozturk 2011 listed "gastrointestinal disturbances" as a "clinical significant adverse event". Although the report states that "No clinically significant adverse events were reported", the authors noted that "increase in appetite" was reported in 16/24 patients in the oral steroids and antibiotics group and 11/24 patients in the antibiotics alone group. In addition, there was a larger "weight gain" (which was also listed as "clinically significant adverse event") reported in the children receiving oral steroids and antibiotics compared with those receiving antibiotics alone at the end of treatment (30 days) (0.42 ± 0.26 kg and 0.27 ± 0.30 kg, respectively).
3. Other adverse event: insomnia
Ozturk 2011 states that "No clinically significant adverse events were reported", but it is uncertain whether there were any events reported (see "gastrointestinal disturbances" above).
4. Other adverse event: osteoporosis
The study had not listed this as an outcome to be monitored or reported.
5. Endoscopic scores (including nasal polyps score)
The study did not report this as an outcome.
6. Computerised tomography (CT) scan score
Ozturk 2011 reported the CT scan score at 30 days, as measured using the Lund‐Mackay scoring system (range: 0 to 24, higher = more severe). The results (45 participants) showed an improvement in CT score in favour of the oral steroid group at the end of the trial (MD ‐2.90, 95% CI ‐4.91 to ‐0.89) (Analysis 2.6). This is not presented in the GRADE 'Summary of findings' table as we did not consider it to be a priority outcome.
Discusión
Resumen de los resultados principales
Los principales hallazgos de la revisión son los siguientes.
Corticosteroides orales de corta duración como un complemento del tratamiento con corticosteroides intranasales
Un estudio pequeño (30 adultos con rinosinusitis crónica y pólipos nasales) con un alto riesgo de sesgo reveló una mejoría en el tamaño de los pólipos nasales (puntuación medida con endoscopia) a los 21 días para el grupo que recibió corticosteroides orales y corticosteroides intranasales, en comparación con el grupo que recibió corticosteroides intranasales solos. No hubo datos disponibles para ningún otro resultado de eficacia o efectos adversos.
Corticosteroides orales de corta duración como un complemento del tratamiento con antibióticos
Un estudio pequeño (48 niños, con rinosinusitis crónica sin pólipos nasales) reveló una mejoría en la puntuación total de la gravedad de los síntomas (pruebas de baja calidad) y la puntuación de la tomografía computarizada (TC) con los corticosteroides orales de corta duración un mes más tarde para los participantes que recibieron corticosteroides orales y antibióticos, en comparación con los que recibieron comprimidos de placebo y antibióticos.
Compleción y aplicabilidad general de las pruebas
Las pruebas para los corticosteroides orales como un complemento de otros tratamientos están incompletas. Solamente se identificaron dos pequeños estudios (78 participantes) (Bülbül 2013; Ozturk 2011). Ninguno de ellos siguió a los pacientes más allá del final del tratamiento y, por tanto, sólo reflejan los resultados a corto plazo del tratamiento. No hay datos sobre si los beneficios a corto plazo sobre el uso de corticosteroides intranasales o antibióticos solos son sostenibles a más largo plazo.
Las poblaciones incluidas dentro de los ensayos también fueron limitadas; los criterios de inclusión para Bülbül 2013 se basaron exclusivamente en el diagnóstico de los pólipos nasales. La gravedad de los otros signos y síntomas de la rinosinusitis crónica fue poco clara. Se cree que la población incluida en Ozturk 2011 fue un grupo muy pequeño y poco habitual de la población con rinosinusitis crónica, debido a que eran niños con rinosinusitis crónica (bien definida) pero sin la presencia de pólipos nasales. La patología subyacente en los niños con rinosinusitis crónica es diferente de la de los adultos con pólipos nasales.
El plazo corto de la evaluación (menos de tres meses) en los estudios incluidos también limita severamente la completitud y la aplicabilidad de las pruebas de esta revisión.
Ninguno de los estudios incluidos en esta revisión informó de manera adecuada los efectos adversos, a pesar de que los efectos adversos fueron uno de los motivos de preocupación principales con la administración de este tipo de medicación. Esta es una tendencia repetida en otras afecciones y en la bibliografía no se han registrado correctamente los datos fiables de los eventos adversos asociados con la administración de corticosteroides a corto plazo (Burton 2008).
Calidad de la evidencia
La calidad de las pruebas sobre el tamaño de los pólipos medida de acuerdo a la puntuación endoscópica fue muy baja para los corticosteroides orales de corta duración con corticosteroides intranasales en comparación con los corticosteroides intranasales solos (Resumen de los hallazgos para la comparación principal). La calidad se evaluó como muy baja debido al riesgo grave de sesgo introducido por la metodología del ensayo (cuasialeatorio, no cegado), la muestra de estudio muy pequeña y la naturaleza a corto plazo de los resultados (21 días en lugar de tres meses).
Para la comparación de los corticosteroides orales de corta duración con antibióticos en comparación con los antibióticos solos (Resumen de los hallazgos 2), la calidad de las pruebas se evaluó como baja. Hubo inquietudes acerca de si la gravedad de la enfermedad se midió mediante un resultado validado, el tamaño de la muestra fue muy pequeño y se consideró que la posibilidad de generalizar los resultados del ensayo se redujo debido a la naturaleza a corto plazo de los resultados (un mes en lugar de tres meses).
Sesgos potenciales en el proceso de revisión
Aunque muchos médicos sugieren que la duración máxima típica para un tratamiento de corta duración con corticosteroides orales debe ser de 14 días, se decidió usar 21 días en los criterios de inclusión para esta revisión, lo cual está al extremo mayor de la duración aceptable. Las pruebas sobre los ciclos cortos hasta 21 días se consideraron relevantes y el hecho de relajar los criterios de inclusión permitió incluir más datos. Si se hubiesen limitado las pruebas a 14 días en esta revisión, se habrían excluido ambos estudios incluidos. Los estudios habían usado corticosteroides orales por 15 y 21 días respectivamente (Bülbül 2013; Ozturk 2011).
Las puntuaciones validadas de los síntomas para medir los resultados importantes para los pacientes como la calidad de vida relacionada con la salud específica de la enfermedad y la gravedad de la enfermedad a menudo no se utilizan en los ensayos de la rinosinusitis crónica lo cual se identificó en el estadio del protocolo como un sesgo potencial (Chong 2015), este hecho podría afectar la validez y la interpretación de los resultados. El problema es más grave para las puntuaciones de los síntomas usadas para medir la gravedad de la enfermedad. Diferentes ensayos miden diferentes tipos de síntomas de la rinosinusitis crónica, a menudo con más énfasis en determinados tipos de síntomas (p.ej. unas pocas preguntas relacionadas con la secreción nasal), omitiendo determinados tipos de síntomas, o ambos.
Se tuvo que tomar la decisión de si excluir todos estos datos (que representan la mayoría de los datos para la gravedad de la enfermedad a través del conjunto de revisiones) (Chong 2016a; Chong 2016b; Chong 2016c; Head 2016a; Head 2016b), o tratar de distinguir las puntuaciones que parecen válidas (basado en la validez aparente) en comparación con las que no. Lo anterior se llevó a cabo suponiendo que si una escala se considera con validez aparente, debe medir los síntomas relevantes para la mayoría de los pacientes con rinosinusitis crónica y sin síntomas que no son relevantes para la mayoría de los pacientes con rinosinusitis crónica. Cuando un estudio no usó una puntuación que se conoce como validada para medir la gravedad de la enfermedad en los pacientes con rinosinusitis crónica y el informe del estudio no proporcionó información que sugiriera que la puntuación había sido validada, se incluyó la puntuación total de los síntomas informada en el análisis cuando se habían medido al menos dos de los síntomas identificados en los criterios de diagnóstico EPOS 2012 para la rinosinusitis crónica, es decir bloqueo nasal, secreción nasal, dolor o presión facial y pérdida del sentido del olfato (para los adultos) o tos (para los niños). Sin embargo, cuando un estudio incluyó otros síntomas, se intentó excluirlos y sólo se incluyeron las puntuaciones para los síntomas principales de la rinosinusitis crónica. En Ozturk 2011, se utilizó la suma de las puntuaciones de cuatro síntomas de la rinosinusitis crónica en lugar de la puntuación total de los síntomas informada por dos razones principales: la puntuación total informada en el estudio incluyó ítems que pueden no ser relevantes para los pacientes con rinosinusitis crónica y hubo discrepancias (es decir errores) en la puntuación total al final del estudio en comparación con una sumatoria de las puntuaciones individuales. Para representar la ausencia de escalas validadas utilizadas y la falta de métodos validados para sumar las puntuaciones, se disminuyó la calidad de todos los resultados de la gravedad de la enfermedad por no usar escalas validadas cuando ocurrió este hecho.
Acuerdos y desacuerdos con otros estudios o revisiones
Ninguno de los estudios incluidos en esta revisión estuvo incluido en la revisión Cochrane anterior sobre este tema (Martinez‐Devesa 2011). El documento EPOS 2012 incluyó uno de los estudios, Ozturk 2011; para aportar pruebas sobre la administración de antibióticos y el tratamiento combinado en niños con rinosinusitis crónica, aunque no incluyó a Bülbül 2013 (que se publicó después de las guías).
Ambos estudios incluidos en esta revisión sólo presentaron datos a corto plazo y la duración más larga del seguimiento fue de 30 días. Como parte de este conjunto de revisiones Cochrane de la rinosinusitis crónica, se ha investigado la administración de corticosteroides orales de corta duración solos para la rinosinusitis crónica (Head 2016a). Esta revisión estableció la conclusión de que, en general, la calidad de vida relacionada con la salud y los síntomas informados por los pacientes mejoraron con los corticosteroides orales de corta duración en comparación con placebo o ningún tratamiento durante el período de tratamiento (14 a 21 días). Sin embargo, estas mejorías en los resultados no se mantuvieron después de que finalizó el ciclo de tratamiento con corticosteroides orales. Los hallazgos para los resultados en los grupos de control y de tratamiento no mostraron resultados concluyentes para ninguno de los resultados de eficacia a los tres a seis meses después del tratamiento. Esta revisión halló pruebas limitadas para tres de los eventos adversos predefinidos: trastornos del estado de ánimo, insomnio y trastornos gastrointestinales. En cuanto a los mismos hubo pruebas de calidad moderada de aumentos en el insomnio y los trastornos gastrointestinales en el grupo que recibió corticosteroides orales en comparación con el grupo de comparación. Las pruebas sobre los trastornos del estado de ánimo fueron menos definitivas (baja calidad) y no hubo pruebas de osteoporosis en ninguno de los estudios.
Como los estudios incluidos no informaron la incidencia de eventos adversos y el riesgo de efectos secundarios puede variar según la afección que se trate, es importante considerar los datos de afecciones similares, cuando sea posible. Una revisión reciente de corticosteroides sistémicos en la rinosinusitis aguda identificó cinco ensayos que incluyeron 1193 participantes que recibieron corticosteroides orales (prednisolona a dosis que variaron de 24 mg a 80 mg durante tres a siete días) o placebo, en los que se informaron los eventos adversos (Venekamp 2014; Venekamp 2015). No hubo diferencias entre los brazos activos y de control en cuanto al riesgo de eventos adversos, en lo que se refiere a los eventos leves o graves, o al riesgo de interrupción del tratamiento.
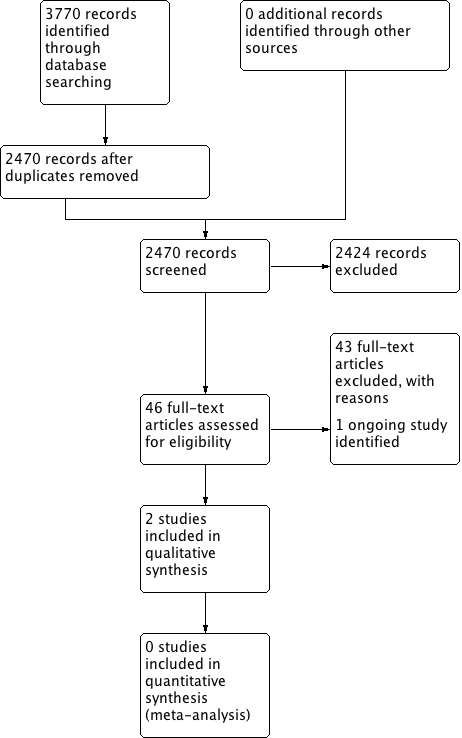
Process for sifting search results and selecting studies for inclusion.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
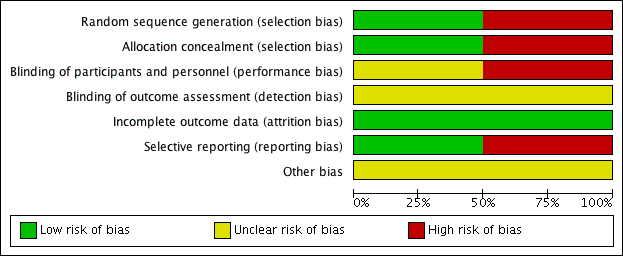
'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
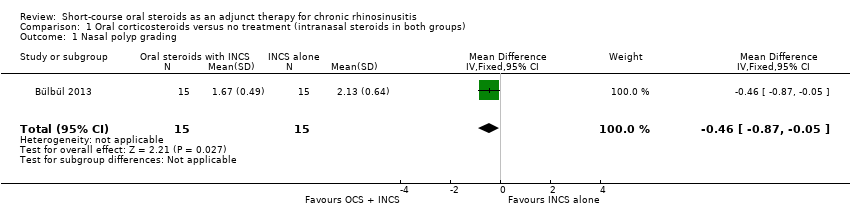
Comparison 1 Oral corticosteroids versus no treatment (intranasal steroids in both groups), Outcome 1 Nasal polyp grading.
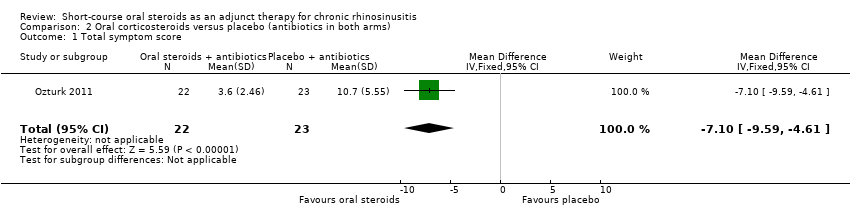
Comparison 2 Oral corticosteroids versus placebo (antibiotics in both arms), Outcome 1 Total symptom score.
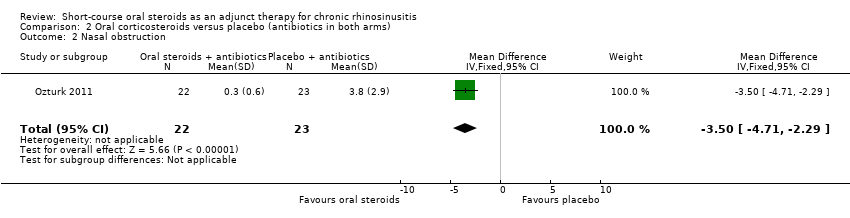
Comparison 2 Oral corticosteroids versus placebo (antibiotics in both arms), Outcome 2 Nasal obstruction.
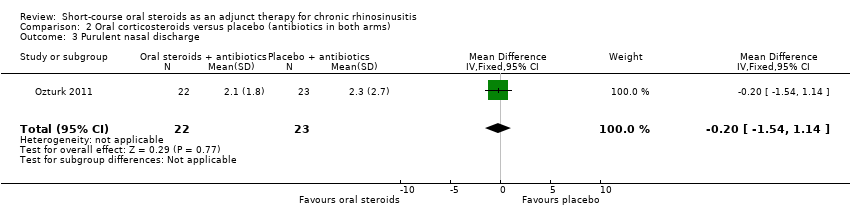
Comparison 2 Oral corticosteroids versus placebo (antibiotics in both arms), Outcome 3 Purulent nasal discharge.
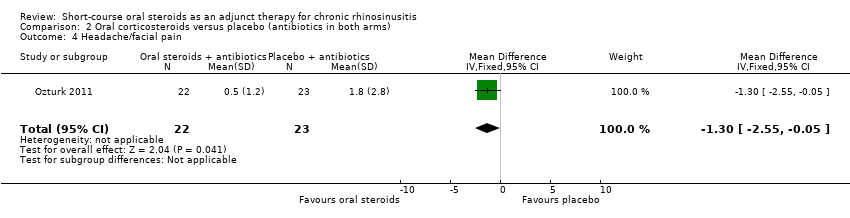
Comparison 2 Oral corticosteroids versus placebo (antibiotics in both arms), Outcome 4 Headache/facial pain.
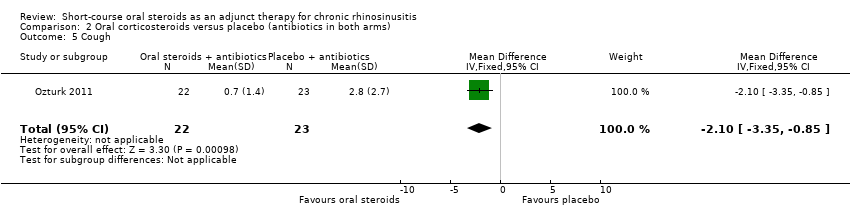
Comparison 2 Oral corticosteroids versus placebo (antibiotics in both arms), Outcome 5 Cough.
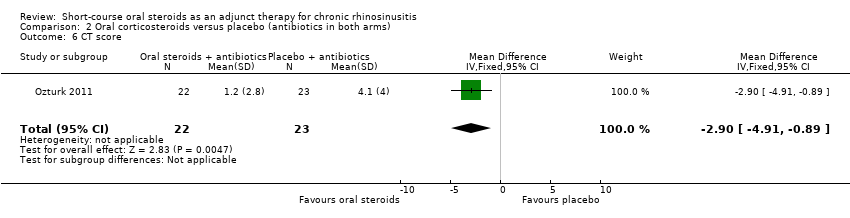
Comparison 2 Oral corticosteroids versus placebo (antibiotics in both arms), Outcome 6 CT score.
| Short‐course oral corticosteroids compared to no oral corticosteroid treatment (intranasal steroids in both arms) for chronic rhinosinusitis | ||||||
| Patient or population: chronic rhinosinusitis | ||||||
| Outcomes No. of participants (studies) | Relative effect (95% CI) | Anticipated absolute effects* (95% CI) | Quality | What happens | ||
| Without oral steroids | With oral steroids | Difference | ||||
| Disease‐specific health‐related quality of life | — | No RCT reported this outcome | ||||
| Disease severity ‐ patient‐reported symptom score | — | No RCT reported this outcome | ||||
| Adverse effect: mood or behavioural disturbances | — | No RCT reported this outcome | ||||
| Health‐related quality of life | — | No RCT reported this outcome | ||||
| Adverse effect: insomnia | — | No RCT reported this outcome | ||||
| Adverse effect: gastrointestinal disturbances ‐ not measured | — | No RCT reported this outcome | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| Short‐course oral corticosteroids compared to placebo (antibiotics in both groups) for chronic rhinosinusitis | |||||
| Patient or population: chronic rhinosinusitis | |||||
| Outcomes No of participants (studies) | Anticipated absolute effects* (95% CI) | Quality | What happens | ||
| Without oral steroids | With oral steroids | Difference | |||
| Disease‐specific health‐related quality of life | No RCT reported this outcome | ||||
| Disease severity ‐ patient‐reported symptom score, assessed with: 4 individual symptoms measured on 0 to 10 visual analogue scale summed to provide a range of 0 to 40 No. of participants: 45 | The mean disease severity score without oral steroids was 15.2 | The mean disease severity score with oral steroids was 3.6 | The mean disease severity score in the intervention group was 7.10 lower (9.59 lower to 4.61 lower) | ⊕⊕⊝⊝ | A lower score indicates less severe symptoms. The results relate to a standardised mean difference of 1.61 standard deviations lower (‐2.29 to 0.93 lower), corresponding to a large difference. |
| Adverse effect: mood or behavioural disturbances | No RCT reported this outcome | ||||
| Health‐related quality of life | No RCT reported this outcome | ||||
| Adverse effect: insomnia | No RCT reported this outcome | ||||
| Adverse effect: gastrointestinal disturbances | No RCT reported this outcome | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1Study completed only in children (mean age 8 years old). Study follow‐up time was less than 3 months (1 month). Scales were not validated and were completed by "parents and children". 2Symptoms included in this score were: purulent nasal discharge, nasal obstruction, cough and facial pain/headache. | |||||
| System | Adverse events | Notes |
| Musculoskeletal | Osteoporosis | Largely limited to long‐term use Significantly increased risk of fractures with prolonged use |
| Osteonecrosis | Rare; appears to be dose‐dependent | |
| Endocrine | Hyperglycaemia | Common; dose‐dependent, usually reversible |
| Cardiovascular | Hypertension | Common; dose‐dependent, usually reversible |
| Dermatological | Striae, bruising | Dose‐dependent, occurs after > 1 month usage |
| Ophthalmological | Cataracts | Irreversible; largely related to long‐term usage |
| Glaucoma | High risk with pre‐existing disease | |
| Gastrointestinal tract | Peptic ulceration | Increased risk largely due to concomitant NSAIDs |
| Psychological | Psychosis | Common; increased risk with dosages > 40 mg/day |
| References: Da Silva 2006; Naber 1996; Stanbury 1998 NSAIDs: non‐steroidal anti‐inflammatory drugs | ||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Nasal polyp grading Show forest plot | 1 | 30 | Mean Difference (IV, Fixed, 95% CI) | ‐0.46 [‐0.87, ‐0.05] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Total symptom score Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐7.10 [‐9.59, ‐4.61] |
| 2 Nasal obstruction Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐3.50 [‐4.71, ‐2.29] |
| 3 Purulent nasal discharge Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐0.20 [‐1.54, 1.14] |
| 4 Headache/facial pain Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐1.3 [‐2.55, ‐0.05] |
| 5 Cough Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐2.10 [‐3.35, ‐0.85] |
| 6 CT score Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐2.90 [‐4.91, ‐0.89] |

