Intervenciones para las infecciones necrosantes de partes blandas en adultos
Resumen
Antecedentes
Las infecciones necrosantes de partes blandas (INPB) son infecciones graves y que se transmiten rápidamente de las partes blandas del tejido subcutáneo, la fascia o el músculo, causadas principalmente por bacterias. Las tasas asociadas de mortalidad y morbilidad son altas; la primera se calcula en alrededor del 23%, y en el 15% de los pacientes se presenta discapacidad, secuelas y pérdida de los miembros. El tratamiento estándar incluye tratamiento antimicrobiano intravenoso empírico, desbridamiento quirúrgico inmediato de los tejidos necróticos, apoyo con cuidados intensivos y tratamientos coadyuvantes como inmunoglobulina intravenosa (IGIV).
Objetivos
Evaluar los efectos de los tratamientos médicos y quirúrgicos para las infecciones necrosantes de partes blandas (INPB) en pacientes adultos en ámbitos hospitalarios.
Métodos de búsqueda
Se hicieron búsquedas en las siguientes bases de datos hasta abril 2018: registro especializado del Grupo Cochrane de Piel (Cochrane Skin Group), CENTRAL, MEDLINE, Embase y en LILACS. También se buscó en cinco registros de ensayos, en bases de datos de resultados de ensayos de compañías farmacéuticas y en los sitios web de la US Food and Drug Administration y de la European Medicines Agency. Se revisaron las listas de referencias de los estudios incluidos y las revisiones para obtener más referencias de ensayos controlados aleatorios (ECA) relevantes.
Criterios de selección
Fueron elegibles para inclusión los ECA realizados en ámbitos hospitalarios que evaluaron cualquier tratamiento médico o quirúrgico para los pacientes adultos con INPB. Los tratamientos médicos elegibles incluyeron 1) comparaciones entre diferentes antimicrobianos o con placebo; 2) tratamientos coadyuvantes como tratamiento con inmunoglobulina intravenosa (IGIV) comparados con placebo; ningún tratamiento; u otros tratamientos coadyuvantes. Los tratamientos quirúrgicos elegibles incluyeron desbridamiento quirúrgico en comparación con amputación, intervención inmediata versus retardada, o comparaciones de varias intervenciones.
No fueron elegibles los ECA de tratamiento con oxígeno hiperbárico (OHB) para la INPB porque el OHB es el objetivo de otra revisión Cochrane.
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar previstos por Cochrane. Las medidas de resultado primarias fueron 1) mortalidad en el transcurso de 30 días y 2) proporción de participantes que presentan un evento adverso grave. Los resultados secundarios fueron 1) tiempo de supervivencia y 2) evaluación de la morbilidad a largo plazo. Se utilizó GRADE para evaluar la calidad de las pruebas para cada resultado.
Resultados principales
Se incluyeron tres ensayos que asignaron al azar a 197 participantes (el 62% hombres) con una edad promedio de 55 años. Un ensayo comparó dos tratamientos con antibióticos y dos ensayos compararon tratamientos coadyuvantes con placebo. En todos los ensayos, los participantes recibieron intervenciones estándar de forma concomitante, como tratamiento antimicrobiano intravenoso empírico, desbridamiento quirúrgico de los tejidos necróticos, apoyo con cuidados intensivos y tratamientos coadyuvantes. Todos los ensayos tuvieron riesgo de sesgo de desgaste y un ensayo no fue cegado.
Moxifloxacino versus amoxicilina‐clavulanato
Un ensayo que incluyó 54 participantes con INPB comparó una quinolona de tercera generación, moxifloxacino, a una dosis de 400 mg administrados una vez al día, versus una penicilina, amoxicilina‐clavulánico, a una dosis de 3 g administrados tres veces al día por al menos tres días, seguido de 1,5 g tres veces al día. La duración del tratamiento varió entre siete y 21 días. No hay seguridad acerca de los efectos de estos tratamientos sobre la mortalidad en el transcurso de 30 días (cociente de riesgos [CR] 3,00; intervalo de confianza [IC] del 95%: 0,39 a 23,07) ni los eventos adversos graves a los 28 días (CR 0,63; IC del 95%: 0,30 a 1,31) porque la calidad de la evidencia es muy baja.
AB103 versus placebo
Un ensayo con 43 participantes asignados al azar comparó dos dosis, 0,5 mg/kg y 0,25 mg/kg, de un fármaco coadyuvante (AB103), un antagonista del receptor de CD28, con placebo. El tratamiento se proporcionó mediante bomba de infusión por diez minutos antes, después, o durante la cirugía en el transcurso de seis horas después del diagnóstico de la INPB. No hay seguridad acerca de los efectos de AB103 sobre la tasa de mortalidad en el transcurso de 30 días (CR de 0,34; IC del 95%: 0,05 a 2,16) ni los eventos adversos graves medidos a los 28 días (CR 1,49; IC del 95%: 0,52 a 4,27) porque la calidad de la evidencia es muy baja.
Inmunoglobulina intravenosa (IGIV) versus placebo
Un ensayo con 100 participantes asignados al azar evaluó la IGIV como fármaco coadyuvante administrado a una dosis de 25 g/día, en comparación con placebo administrado durante tres días consecutivos. Puede no haber diferencias claras entre IGIV y placebo en cuanto a la mortalidad en el transcurso de 30 días (CR 1,17; IC del 95%: 0,42 a 3,23) (evidencia de certeza baja), ni los eventos adversos graves presentados en la unidad de cuidados intensivos (UCI) (CR 0,73; IC del 95%: 0,32 a 1,65) (evidencia de certeza baja).
Los eventos adversos graves solo se describieron en un ECA (ensayo IGIV versus placebo) e incluyeron lesión renal aguda, reacciones alérgicas, síndrome de meningitis aséptica, anemia hemolítica, trombos y agentes transmisibles.
Solo un ensayo reportó la evaluación de la morbilidad a largo plazo, pero el resultado no se definió de la manera que se predeterminó en el protocolo de esta revisión. El ensayo utilizó la Short Form Health Survey (SF36). Se proporcionaron a solicitud datos sobre el tiempo de supervivencia de los ensayos que compararon amoxicilina‐clavulánico versus moxifloxacino e IGIV versus placebo. Sin embargo, incluso con los datos proporcionados no fue posible realizar el análisis de supervivencia.
Conclusiones de los autores
Se encontró muy poca evidencia sobre los efectos de los tratamientos médicos y quirúrgicos para las INPB. No fue posible establecer conclusiones con respecto a los efectos relativos de cualquiera de las intervenciones sobre la mortalidad en el transcurso de 30 días ni los eventos adversos graves debido a la calidad muy baja de la evidencia.
La calidad de la evidencia está limitada por el número muy pequeño de ensayos, los tamaños de la muestra pequeños y los riesgos de sesgo en los ensayos incluidos. Es importante que los ensayos futuros definan claramente los criterios de inclusión, lo que ayudará a la aplicabilidad de los resultados de los ensayos futuros a una población real.
El tratamiento de los participantes con INPB (pacientes en estado crítico) es complejo e incluye intervenciones múltiples; por lo tanto, los estudios observacionales y los registros prospectivos podrían ser la mejor base para los estudios de investigación futuros que deben evaluar el tratamiento antimicrobiano empírico, así como el desbridamiento quirúrgico, junto con la comparación controlada con placebo del tratamiento coadyuvante. Los resultados clave a evaluar incluyen la mortalidad (en la fase aguda de la afección) y los resultados funcionales a largo plazo, p.ej. calidad de vida (en la fase crónica).
PICO
Resumen en términos sencillos
Tratamientos para las infecciones que necrosan (es decir, destruyen) partes blandas en adultos
¿Cuál era el objetivo de esta Revisión Cochrane?
Se deseaba determinar qué fármacos y tratamientos quirúrgicos son efectivos y seguros para tratar las infecciones necrosantes de partes blandas (INPB). Las INPB son infecciones graves de los tejidos por debajo de la piel causadas principalmente por bacterias.
Mensajes clave
La evidencia disponible de tres estudios no es lo bastante sólida para poder establecer conclusiones definitivas acerca de la efectividad y la seguridad de los diferentes tratamientos para las INPB evaluadas en esta revisión. Todos los estudios evaluaron el número de muertes y el riesgo de efectos secundarios graves.
Los factores que afectaron la confianza en los resultados incluyeron los siguientes:
‐ el reducido número de ensayos y participantes;
‐ las deficiencias en la metodología de los ensayos que afectaron la confianza en los resultados; y
‐ la definición deficiente de la afección de los participantes.
No se encontró evidencia que evaluara el tratamiento antimicrobiano (dirigido a una variedad amplia de bacterias y hongos que provocan enfermedades) o la eliminación quirúrgica del tejido dañado.
En los estudios futuros, el riesgo de muerte debe ser un resultado clave en la fase a corto plazo (es decir en el transcurso de 30 días) de la afección, y los resultados como la pérdida del trabajo y la calidad de vida se deben evaluar en la fase a largo plazo (después de 30 días).
¿Qué se estudió en la revisión?
Se incluyeron pacientes con INPB. Estos tipos de infecciones son poco frecuentes, pero si no se tratan se pueden volver potencialmente mortales o provocar la amputación. Las INPB necesitan tratamiento de urgencia, generalmente con antibióticos y la eliminación quirúrgica del tejido infectado.
Se buscaron los estudios que evaluaron tratamientos para las INPB diagnosticadas en pacientes adultos hospitalizados. Éstos incluyeron:
‐ tratamientos quirúrgicos: eliminación quirúrgica del tejido lesionado en comparación con amputación, tratamiento inmediato versus retardado, o comparación de varios tratamientos;
‐ fármacos antimicrobianos (que matan bacterias y hongos) en comparación con placebo (es decir, un tratamiento idéntico pero inactivo), o entre sí;
‐ fármacos administrados como tratamientos adicionales además del tratamiento primario (tratamientos coadyuvantes) en comparación con placebo, ningún tratamiento u otros tratamientos coadyuvantes.
Los resultados principales de interés fueron muerte en el transcurso de 30 días y cualquier efecto secundario grave del tratamiento.
¿Cuáles son los principales resultados de la revisión?
Se encontraron tres estudios con 197 pacientes adultos (117 hombres, edad promedio = 55). Los ensayos se realizaron en todo el mundo, financiados por compañías farmacéuticas; evaluaron tratamiento antimicrobiano o tratamientos que controlan el sistema inmunológico.
Un estudio comparó dos antibióticos: moxifloxacino y amoxicilina‐clavulanato, administrados directamente en una vena por siete a 21 días. No encontraron diferencias claras entre los grupos de tratamiento en cuanto al número de muertes en el transcurso de 30 días, pero no hay seguridad acerca de este resultado porque se basa en evidencia de certeza muy baja.
Un estudio comparó placebo con un nuevo tipo de tratamiento que controla la respuesta inmunitaria (llamado AB103) administrado a dosis única (de 0,5 mg/kg o 0,25 mg/kg) y directamente en vena. Los participantes también recibieron tratamiento estándar para la INPB basado en antibióticos y tratamiento quirúrgico, de manera que el AB103 se proporcionó como tratamiento coadyuvante. No hubo diferencias claras entre los grupos de tratamiento en cuanto al número de muertes en el transcurso de 30 días, pero no hay seguridad acerca de esta conclusión porque se basa en evidencia de certeza muy baja.
Un estudio comparó inyecciones de inmunoglobulina (un anticuerpo, parte del sistema inmunológico del cuerpo) con placebo. Ambos tratamientos se administraron por tres días consecutivos. Los participantes también recibieron tratamiento estándar para la INPB basado en antibióticos y tratamiento quirúrgico, por lo que la inmunoglobulina se proporcionó como tratamiento coadyuvante. No hubo diferencias claras entre los grupos de tratamiento en cuanto al número de muertes en el transcurso de 30 días (evidencia de certeza baja).
Ningún estudio mostró diferencias claras entre los tratamientos en cuanto a los efectos secundarios graves, pero la evidencia no es suficientemente sólida para confirmarlo. El estudio de la inmunoglobulina enumeró los efectos secundarios encontrados, que incluyeron lesión renal, reacciones alérgicas, meningitis, coágulos sanguíneos y agentes infecciosos (evidencia de certeza baja).
Solo un ensayo reportó la evaluación de la enfermedad a largo plazo, pero no se definió de la misma manera que en el protocolo de esta revisión (el ensayo utilizó otra escala: la Short‐Form Health Survey (SF36) El tiempo de supervivencia se reportó en dos ensayos (pero no hubo suficientes datos para analizar estos resultados).
¿Cuál es el grado de actualización de esta revisión?
Se buscaron estudios publicados hasta abril 2018.
Conclusiones de los autores
Summary of findings
| Moxifloxacin compared to amoxicillin‐clavulanate for NSTI | ||||||
| Patient or population: NSTI | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality/certainty of the evidence | Comments | |
| Risk with Amoxicillin‐clavulanate | Risk with Moxifloxacin | |||||
| Mortality | Study population | RR 3.00 | 54 | ⊕⊝⊝⊝ | Data from a larger trial including several types of soft tissue infections; total number of included patients N = 804 | |
| 6 per 100 | 17 per 100 | |||||
| Serious adverse events (SAE) | Study population | RR 0.63 | 54 | ⊕⊝⊝⊝ | Description of nature of serious adverse events was not available | |
| 44 per 100 | 28 per 100 | |||||
| Survival time | — | — | — | 54 | ⊕⊝⊝⊝ | The median time of death after start of antibiotic treatment was shorter in the moxifloxacin group than in the amoxicillin‐clavulanate group (10.5 days versus 42 days) (not possible to calculate hazard ratio with the data provided) |
| Assessment of long‐term morbidity | — | — | — | — | — | Not reported |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). Assumed risk for mortality was based on data of the literature (Audureau 2017; May 2009). For serious adverse effects it was based on the results of the trial. | ||||||
| GRADE Working Group grades of evidence | ||||||
| aDowngraded by five levels to very low certainty of evidence. We downgraded two levels because of high risk of bias regarding blinding (open label trial) and high risk for attrition bias because of a high rate of withdrawal (20%). We downgraded one level for serious imprecision because of small sample size (and CI of RR included 1, where reported). We downgraded a further two levels because no clear criteria for clinical diagnosis of necrotizing fasciitis were provided and because antibiotic used as comparator is not relevant (indirectness) | ||||||
| AB103 compared to Placebo for NSTI | ||||||
| Patient or population: NSTI | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality/certainty of the evidence | Comments | |
| Risk with Placebo | Risk with AB103 | |||||
| Mortality | Study population | RR 0.34 | 43 | ⊕⊝⊝⊝ | — | |
| 23 per 100* | 6 per 100 | |||||
| Serious adverse events (SAE) | Study population | RR 1.49 | 43 | ⊕⊝⊝⊝ | There were no data about the nature of serious adverse events reported | |
| 27 per 100 | 41 per 100 | |||||
| Survival time | — | — | — | — | — | Not reported |
| Assessment of long‐term morbidity | — | — | — | — | — | Not reported |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). Assumed risk for mortality was based on data of the literature (Audureau 2017; May 2009). For serious adverse effects it was based on the results of the trial. | ||||||
| GRADE Working Group grades of evidence | ||||||
| aDowngraded by three levels: one level for high risk of attrition bias, one level for no clear clinical definition of criteria for necrotizing fasciitis diagnosis at inclusion (indirectness), and one level for serious imprecision because of small sample size and CI included no difference | ||||||
| Intravenous immunoglobulin compared to placebo for NSTI | ||||||
| Patient or population: NSTI | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality/Certainty of the evidence | Comments | |
| Risk with placebo | Risk with Intravenous immunoglobulin | |||||
| Mortality | Study population | RR 1.17 | 100 | ⊕⊕⊝⊝ | — | |
| 0 per 100 | 0 per 100 | |||||
| Moderate | ||||||
| 23 per* 100 | 21 per 100 | |||||
| Serious adverse events (SAE) | Study population | RR 0.73 | 100 | ⊕⊕⊝⊝ | Serious adverse reactions included acute kidney injury, allergic reactions, aseptic meningitis syndrome, haemolytic anaemia, thrombi, and transmissible agents | |
| 22 per 100 | 16 per 100 | |||||
| Survival time | — | — | — | 100 | ⊕⊕⊝⊝ | The median time of death was shorter in the IVIG group than in the placebo group (25 days versus 49 days) (not possible to calculate hazard ratio with the data provided) |
| Assessment of long‐term morbidity | — | — | — | — | — | Not reported |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). Assumed risk for mortality was based on data of the literature (Audureau 2017; May 2009). For serious adverse effects it was based on the results of the trial. | ||||||
| GRADE Working Group grades of evidence | ||||||
| aDowngraded by two levels: one level for high risk of attrition bias (38% lost of follow‐up); other bias: imbalance at baseline for one dose 25 IVIG received before randomisation (40% in placebo group vs 16% IVIG group). One level for indirectness as a minority of patients have an infection linked to bacteria producing toxins | ||||||
Antecedentes
Por favor, vea una explicación de los términos que se han utilizado en la Tabla 1.
Descripción de la afección
Definición
Las infecciones necrosantes de partes blandas (INPB) son infecciones graves potencialmente mortales causadas en su mayoría por bacterias y que se diseminan rápidamente de los tejidos blandos del tejido subcutáneo, la fascia o el músculo (Anaya 2007; May 2009; Stevens 2014). Se han publicado múltiples descripciones de las INPB que han utilizado una variedad amplia de términos diferentes y confusos, independientemente de la ubicación anatómica, las características microbiológicas o la profundidad de la infección (Dellinger 1981). Por ejemplo, la fascitis necrosante que se presenta en el escroto se ha nombrado específicamente gangrena de Fournier (Fournier 1883). El término "fascitis" introducido en 1952 por Wilson da la impresión engañosa de que la fascia muscular está involucrada (Wilson 1952), mientras que la fascia que se afecta con mayor frecuencia es la fascia superficial, que incluye todos los tejidos entre la piel y los músculos subyacentes (es decir, el tejido subcutáneo) (Stevens 2005). Aunque se han descrito diferentes tipos de infecciones necrosantes, comparten los mismos principios para el diagnóstico y las estrategias de tratamiento y precisan cirugía de urgencia. Para abarcar todas las infecciones necrosantes (fascitis necrosante, gangrena de Fournier, gangrenas sinérgicas, gangrena gaseosa, celulitis necrosante, mionecrosis), se ha propuesto el término "infecciones necrosantes de partes blandas" (Anaya 2007; Sartelli 2014; Stevens 2014).
Incidencia
Los datos con respecto a la incidencia de las INPB son escasos (Tabla 2). La incidencia reportada de las INPB durante cinco años, calculada mediante una base de datos de seguros en los EE.UU., fue cuatro casos por 100 000 personas‐años (Ellis Simonsen 2006). Los Centers for Disease Control and Prevention (CDC) reportaron una incidencia de 500 a 1500 casos anualmente (CDC 2012). La mayoría de los datos están disponibles para las INPB causadas porStreptococcus grupo A (GAS). Por ejemplo, una encuesta poblacional de INPB‐GAS en Canadá mostró una incidencia que varió de 0,1 a 0,4 por 100 000 personas‐años. La incidencia de infecciones invasivas por GAS varió de 2,4 a 3,1 por 100 000 personas‐años, y varió según el período del año y los países estudiados (Kaul 1997; Lamagni 2008; Lepoutre 2011; O'Grady 2007).
Características clínicas
Las infecciones necrosantes de partes blandas pueden afectar cualquier parte del cuerpo, pero habitualmente las extremidades son las más involucradas (73%), seguidas del tronco (13%) y el perineo (12,6%) (Goh 2014).
La presentación de la afección varía ampliamente desde necrosis cutánea y subcutánea limitada a extensa, posiblemente asociada con sepsis potencialmente mortal. Cuando están presentes los "signos clínicos sólidos" de INPB (p.ej. crepitación, necrosis cutánea, ampollas, gas en el tejido, anestesia de la piel y síntomas de sepsis), no es difícil establecer un diagnóstico (Stevens 2014). Por el contrario, en algunos casos la distinción entre las infecciones no necrosantes y las INPB puede ser difícil debido a que solo se presentan síntomas no específicos (p.ej. dolor, edema, eritema). Un estudio de 2009 calculó que el 50% de los pacientes con INPB se diagnosticaron erróneamente en el ingreso al hospital (May 2009).
Un dolor intenso, desproporcionado para los síntomas cutáneos, debe hacer sospechar el diagnóstico de una INPB. Adicionalmente, una infección aparentemente no necrosante que no responde a la antibioticoterapia apropiada debe hacer sospechar de una INPB, especialmente en los pacientes diabéticos (Anaya 2007; Chosidow 2001).
La exploración quirúrgica se considera el valor de referencia (gold standard) para confirmar el diagnóstico de INPB. Los cirujanos identifican hallazgos macroscópicos intraoperatorios consistentes con INPB que incluyen: tejido "gris" necrótico, falta de sangrado, vasos trombosados, pus en "lavado de vajilla", falta de contracción del músculo y un resultado positivo en la "prueba del dedo", que se caracteriza por la falta de resistencia a la disección con los dedos en tejidos normalmente adherentes (Stevens 2014).
Fisiopatología y microbiología
Las infecciones necrosantes de partes blandas incluyen principalmente la fascia superficial, con deterioro extenso del tejido circundante. La mayoría de las INPB son causadas por bacterias, pero también se han informado algunos casos de INPB causados por hongos (cigomicetos, Candida), principalmente en pacientes inmunocomprometidos (Lamb 2015). Las endotoxinas y las exotoxinas producidas por bacterias inducen una respuesta inflamatoria fulminante que provoca endarteritis obliterante; trombosis; necrosis tisular; y con frecuencia, enfermedad sistémica con sepsis y síndrome de disfunción multiorgánica (Johansson 2010). Las formas polimicrobianas incluyen una combinación sinérgica de especies bacterianas aeróbicas y anaerobias y se encuentran con mayor frecuencia que las formas monomicrobianas, que ocurren en el 25% al 45% de las INPB (Elliott 2000; McHenry 1995; Sarani 2009; Wong 2003). Dos estudios retrospectivos recientes han descrito la microbiología de las infecciones polimicrobianas (Anaya 2005; Anaya 2007). Los microorganismos que se recuperan con mayor frecuencia en las infecciones polimicrobianas son los Staphylococcus aureus (16% a 22%); especies de Streptococcus (17% a 19%); bacterias gramnegativas, incluidas especies de Escherichia coli (E. coli) yKlebsiella (17% a 18%); y bacterias anaerobias (7% a 18%) (Anaya 2005; Anaya 2007; Sarani 2009). En un estudio retrospectivo con 182 pacientes con INPB, se encontró como promedio 4,4 especies por paciente (Elliott 2000). La diabetes, la vasculopatía periférica, la perforación gastrointestinal o las infecciones gástricas y urinarias son los factores de riesgo habituales de las INPB polimicrobianas (Stevens 2014). En las formas monomicrobianas, los agentes patógenos más frecuentes son los cocos grampositivos: Streptococcus pyogenes y Staphylococcus aureus (Anaya 2007; Sarani 2009). Sin embargo, se han informado con frecuencia de casos de infecciones monomicrobianas causadas por bacterias gramnegativas, p.ej. Aeromonas spp, Vibrio spp, E. coli y Pseudomonas aeruginosa . La cirrosis, el agua de mar y la exposición al agua dulce son factores de riesgo de las INPB causadas por Aeromonas spp y Vibrio spp. (Hsiao 2008; Park 2009).
Causas y factores de riesgo
En el 80% de los casos las infecciones se presentan a partir de una lesión cutánea inicial (heridas traumáticas, picaduras de insectos, sitio de inyección, heridas quirúrgicas, fuentes perianales) (Stevens 2014), pero el 20% de los pacientes no tiene una lesión cutánea visible. En las infecciones causadas por Streptococcus grupo A (GAS), alrededor del 50% de los pacientes no tienen una puerta de entrada definida y el proceso de infección comienza por lo general en el sitio de un traumatismo contuso cutáneo previo, como un esfuerzo muscular (Adams 1985; Stevens 1989; Stevens 2014). Bryant 2006 indicó que la expresión de vimentina por las células musculares aumentó después de un traumatismo contuso y que este hecho medió luego la adhesión focal del GAS y facilitó la infección. Un estudio con 257 pacientes mostró que el traumatismo contuso se asocia de forma significativa con el desarrollo de fascitis necrosante por GAS (odds ratio [OR] 5,97; intervalo de confianza [IC] del 95%: 1,04 a 34,16) (Nuwayhid 2007). Los factores de riesgo generales de INPB incluyen diabetes mellitus, vasculopatía periférica, insuficiencia renal crónica, uso de fármacos intravenosos, alcoholismo, inmunosupresión y obesidad (Elliott 1996; Hasham 2005; Phan 2010). La diabetes fue la afección preexistente más frecuente encontrada en el 44,5% de los pacientes con INPB (Goh 2014).
La repercusión de las infecciones necrosantes de partes blandas
La toxicidad sistémica, que puede progresar rápidamente al síndrome de disfunción multiorgánica y a la muerte, a menudo acompaña la necrosis tisular fulminante asociada con la INPB (Sarani 2009). La tasa de mortalidad global de la INPB fue del 23,5% en una revisión de 67 estudios desde 1980 a 2008, que incluyeron a 3302 pacientes (May 2009). Solo hubo una tendencia descendente leve en la mortalidad del 27,8% al 21,7% en los estudios publicados entre 1980 y 1999 y los estudios entre 1999 y 2008 (May 2009).
Los pacientes que sobreviven requieren hospitalización prolongada (38,5 ± 16 días) y cirugía adicional para la reconstrucción (87%) (Pham 2009). Un metanálisis de ocho estudios informó de una tasa de amputación del 16% (Goh 2014). Un estudio realizado para evaluar los resultados funcionales de los pacientes supervivientes informó de una limitación funcional leve a grave en el 30% de los pacientes, según la escala de calificación establecida por las American Medical Association Guides to the Evaluation of Permanent Impairment (Pham 2009).
Se han demostrado múltiples factores asociados con la mortalidad que incluyen la edad avanzada, las comorbilidades, el shock al ingreso, la insuficiencia renal aguda y las características microbiológicas. Sin embargo, el único factor de riesgo informado potencialmente modificable y asociado con la mortalidad es el tiempo transcurrido hasta el desbridamiento quirúrgico (Anaya 2005; Childers 2002; Elliott 2000; McHenry 1995). De hecho, varios estudios han establecido la repercusión del tratamiento quirúrgico retardado de la INPB sobre la mortalidad y la morbilidad (Bilton 1998; Boyer 2009; Elliott 2000; Kobayashi 2011; Wong 2003).
Descripción de la intervención
Las guías actuales recomiendan el desbridamiento quirúrgico inmediato con escisión de todo el tejido necrótico e infectado hasta que el tejido sano esté expuesto (Stevens 2014). Los pacientes deben volver al quirófano 24 horas después del primer desbridamiento para asegurar que la propagación de la infección se ha detenido y para evaluar si se requiere un desbridamiento adicional (May 2009). El número medio de desbridamientos quirúrgicos informados en una revisión de seis estudios retrospectivos fue de tres por paciente (Goh 2014).
El tratamiento antimicrobiano intravenoso empírico y el apoyo con cuidados intensivos comienza por lo general al mismo tiempo que la cirugía (Stevens 2014). Las guías de la French Society of Dermatology (SFD) y la French Infectious Diseases Society (SPILF) para las INPB de los miembros adquiridas en la comunidad recomiendan una combinación de penicilina (2 a 4 millones de unidades cada cuatro a seis horas) más clindamicina (600 mg cada cuatro a seis horas) más un aminoglucósido (25 mg/kg/día), y para las infecciones mixtas adquiridas en la comunidad una combinación de piperacilina‐tazobactam (4 g cada seis a ocho horas) más un aminoglucósido más clindamicina (SFD‐SPILF 2000). Para el tratamiento empírico de las infecciones mixtas adquiridas en la comunidad, las guías de la Infectious Diseases Society of America (IDSA) recomiendan administrar agentes efectivos contra los microorganismos aerobios, incluido el Staphylococcus aureus resistente a la meticilina (SARM) y los anaerobios, como una combinación de piperacilina‐tazobactam (3,37 g cada seis a ocho horas) más vancomicina (30 mg/kg/día) (Stevens 2014). Los antibióticos se administran contra los agentes patógenos habitualmente involucrados, como los recomendados en las guías ya mencionadas, hasta que no se necesite repetir los procedimientos quirúrgicos y se haya logrado una mejoría clínica durante 48 a 72 horas (Stevens 2014). La duración media del tratamiento antimicrobiano es entre 14 y 21 días. Sobre la base de estudios observacionales también se recomienda la administración de clindamicina para la INPB debido a GAS para bloquear la producción de exotoxinas y superar la inoculación bacteriana elevada (Stevens 2014).
La cirugía reconstructiva mediante injerto de piel o transferencia tisular se puede considerar solo después de la extracción de todos los tejidos necróticos y el control de la infección (Sarani 2009).
También se han propuesto los tratamientos coadyuvantes como el tratamiento con oxígeno hiperbárico (OHB) y con inmunoglobulina intravenosa (IGIV), (Linner 2014; Norrby‐Teglund 2005; Wilkinson 2004). Los datos clínicos que apoyan la función del tratamiento con HBO son de calidad muy deficiente y se basan en series de casos observacionales no controladas. Una revisión Cochrane reciente no logró localizar evidencia clínica relevante para apoyar la efectividad del tratamiento con HBO en el tratamiento de la fascitis necrosante (Levett 2015). La administración de IGIV se ha evaluado en estudios observacionales en los síndromes de shock tóxico por GAS, con resultados contradictorios (Linner 2014; Norrby‐Teglund 2005). Por lo tanto, no se recomienda su aplicación (IGIV, HBO) como tratamiento coadyuvante (Stevens 2014).
De qué manera podría funcionar la intervención
La cirugía temprana permite el desbridamiento completo de los tejidos necróticos e infectados. Los antibióticos previenen y tratan la difusión sistémica de la infección, pero la hipoxia tisular y la necrosis limitan su eficacia. De hecho, estudios anteriores han mostrado que la antibioticoterapia es solo un tratamiento complementario al tratamiento quirúrgico, que es necesario en los pacientes con NTSI (Anaya 2005; Lamb 2015; Stevens 2005). El apoyo con cuidados intensivos, incluida la reanimación con administración de líquidos, los vasopresores y el uso de la ventilación mecánica, ayuda a reponer el volumen intravascular y mantener la perfusión adecuada de los órganos. La administración de IGIV en los casos de INPB causada por estreptococos grupo A podría neutralizar las exotoxinas estreptocócicas circulantes y de esta forma reducir la necrosis tisular inducida por la toxina (Norrby‐Teglund 1998). La justificación para la administración de HBO sería aumentar la tensión de oxígeno tisular en las áreas hipóxicas infectadas y prevenir la extensión adicional de la infección (Korhonen 2000).
Por qué es importante realizar esta revisión
La infección necrosante de partes blandas es una enfermedad infecciosa poco frecuente pero potencialmente mortal que debe ser controlada por un equipo multidisciplinario (dermatólogo, cirujano plástico, intensivista, especialista en enfermedades infecciosas). Debido a la morbilidad y la mortalidad asociadas con la INPB, es importante evaluar la evidencia de las intervenciones médicas y quirúrgicas. Se espera que esta revisión haya destacado las brechas en la evidencia y cualquier necesidad de estudios de investigación futuros en esta área.
La planificación de esta revisión se publicó como el protocolo "Intervenciones para las infecciones necrosantes de partes blandas en pacientes adultos" (Hua 2015).
Objetivos
Evaluar los efectos de los tratamientos médicos y quirúrgicos para las infecciones necrosantes de partes blandas (INPB) en pacientes adultos en ámbitos hospitalarios.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron todos los ensayos controlados aleatorios con asignación aleatoria individual. Se consideró la inclusión de ensayos aleatorios por grupos. Se excluyeron los estudios cruzados.
Tipos de participantes
Se incluyeron pacientes adultos de 18 años de edad y más hospitalizados con un diagnóstico de infecciones necrosantes de partes blandas (INPB), definida como una infección de partes blandas caracterizada por una inflamación que se transmite rápidamente y necrosis posterior del músculo, la fascia o el tejido subcutáneo (Chelsom 1994). Para la selección de los estudios no se establecieron restricciones sobre la base del número de participantes.
Los estudios que utilizaron una categoría diagnóstica más amplia como "infecciones cutáneas y de partes blandas" o "infecciones complicadas cutáneas y de partes blandas", se incluyeron si estaban disponibles los resultados separados de un subgrupo específico con INPB.
Se excluyeron los participantes con neutropenia con un recuento de neutrófilos en sangre < 500/mm³, así como los participantes con infecciones necrosantes cervicofaciales, porque ambos se deben tratar con estrategias terapéuticas específicas.
Tipos de intervenciones
Esta revisión se centró en cualquier tratamiento administrado para la INPB durante la hospitalización, incluidos los siguientes.
Tratamientos médicos
-
Antibióticos en comparación con placebo o comparados entre sí (fármaco/s diferente/s, duración diferente del tratamiento).
-
Tratamientos coadyuvantes, como el tratamiento con inmunoglobulina intravenosa (IGIV), comparados con placebo, ningún tratamiento u otros tratamientos coadyuvantes.
Tratamientos quirúrgicos
-
Desbridamiento quirúrgico en comparación con amputación o intervención inmediata versus retardada o la comparación de un número de intervenciones.
No se incluyó el tratamiento con oxígeno hiperbárico (OHB) porque ya se ha publicado una revisión sobre oxigenoterapia hiperbárica coadyuvante para la fascitis necrosante (Levett 2015).
Tipos de medida de resultado
Resultados primarios
-
Mortalidad en el transcurso de 30 días.
-
Proporción de participantes que presentaron un evento adverso grave.
Los eventos adversos graves se definieron según la definición de la US Food and Drug Administration (FDA) (Guidance FDA 2012).
Resultados secundarios
-
Tiempo de supervivencia.
-
Evaluación de la morbilidad a largo plazo: alteración del 25% en la Functional Impairment Scale (resultado binario: sí o no). Se planificó evaluar una limitación física cuantitativa después de la INPB según las guías de la American Medical Association (AMA) para la Evaluación de la Deficiencia Permanente (6a edición) (Colledge 2009; Pham 2009). Las guías de la AMA proporcionan un método para cuantificar la deficiencia expresada como el porcentaje de deficiencia global de la persona. Hay cinco columnas correspondientes para las clases 0 a 4 de deficiencia, para cada parte del miembro inferior (pie o tobillo, rodilla, cadera), del miembro superior (dígito, muñeca, codo, hombro) y la pelvis. La clase 0 tiene una clasificación asociada del 0%, y todas las otras clases tienen un rango discreto de posibles valores de clasificación como sigue: clase 1 (1% al 13%), clase 2 (14% al 25%), clase 3 (26% al 49%), clase 4 (50% al 100%) (Rondinelli 2009).
Métodos de búsqueda para la identificación de los estudios
We aimed to identify all relevant RCTs regardless of language or publication status (published, unpublished, in press, or in progress), or date of publication.
Búsquedas electrónicas
The Cochrane Skin Information Specialist searched the following databases up to 19 April 2018:
-
the Cochrane Skin Group Specialised Register using the search strategy in Appendix 1;
-
the Cochrane Central Register of Controlled Trials (CENTRAL); 2018, issue 3, in the Cochrane Library using the strategy in Appendix 2;
-
MEDLINE via Ovid (from 1946) using the strategy in Appendix 3;
-
Embase via Ovid (from 1974) using the strategy in Appendix 4; and
-
LILACS (Latin American and Caribbean Health Science Information database, from 1982) using the strategy in Appendix 5.
Trials registers
We searched the following trials registers up to 19 April 2018 using the search strategies in Appendix 6:
-
the ISRCTN registry (www.isrctn.com);
-
ClinicalTrials.gov (www.clinicaltrials.gov);
-
the Australian New Zealand Clinical Trials Registry (www.anzctr.org.au);
-
the World Health Organization International Clinical Trials Registry platform (ICTRP) (www.who.int/trialsearch); and
-
the EU Clinical Trials Register (www.clinicaltrialsregister.eu/).
Búsqueda de otros recursos
Searching reference lists and other reviews
We checked bibliographies of included studies and review papers for further references to relevant trials.
Unpublished literature
We searched the trials results databases of the following pharmaceutical companies in order to identify ongoing and unpublished trials. We searched the following up to 19 April 2018 (see Appendix 6 for search terms):
We also searched relevant trials submitted to the FDA and the European Medicines Agency (EMA) for drug registration (respectively, www.accessdata.fda.gov/scripts/cder/drugsatfda/ and www.ema.europa.eu/ema/).
Adverse effects
We did not perform a separate search for adverse effects of the target intervention. However, we did examine data on adverse effects from the included studies.
Obtención y análisis de los datos
We included three 'Summary of findings' tables (Summary of findings table 1; Summary of findings table 2; Summary of findings table 3). In these, we summarised the primary outcomes and secondary outcomes for the most important comparisons. We used the five Grading of Recommendations Assessment, Development and Evaluation (GRADE) considerations (study limitations, consistency of effect, imprecision, indirectness, and publication bias) to assess the certainty of the body of evidence (Guyatt 2011; GRADEpro). We used this assessment, which two review authors (CH, LLC) conducted, to inform the main text of the discussion section. A third review author (ES) resolved any disagreements between the two other authors.
Some parts of the methods section of this review used text that was originally published in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011) and other Cochrane protocols co‐authored by LLC (predominantly Le Cleach 2014).
Selección de los estudios
Two review authors (CH and RB) independently examined each title and abstract to exclude obviously irrelevant reports. The two review authors independently examined full‐text articles to determine eligibility. We contacted authors of selected studies for clarification when necessary (Table 3). We discussed disagreements to reach consensus. We listed excluded studies and documented the primary reason for exclusion.
Extracción y manejo de los datos
Two review authors (CH and RB) independently extracted data using a piloted data extraction form designed for this review based on the Cochrane Effective Practice and Organisation of Care (EPOC) Group data collection template. A third review author (LLC) resolved any disagreements between the two other review authors. One review author (CH) checked and enter the data into the Cochrane Review Manager computer software (RevMan 2014). We contacted the authors of the trials to provide missing data when required.
We extracted data relating to the following areas.
-
Study design: randomised (cluster or non‐cluster, randomisation procedure).
-
Setting: location (hospital or centre characteristics) and relevant dates, including period of recruitment and follow‐up.
-
Physician characteristics: number of physicians, physician specialties.
-
Participant characteristics: inclusion and exclusion criteria; number of participants screened and included; average age; comorbidities; sex; necrotizing soft tissue infections (NSTI) site; and severity, including microbiology, shock upon admission.
-
Interventions during hospitalisation with descriptions of their modalities and duration: type and time course of antibiotic treatment; adjuvant treatment, such as intravenous immunoglobulin therapy; delay to surgery; number and type of surgery (amputation versus surgical debridement); the level of experience of the surgeon; time of onset to time of first treatment.
-
Relevant outcome measures: 30‐day mortality, survival time, proportion of participants with serious adverse events, assessment of long‐term morbidity with work status, and rate of impairment.
-
Risk of bias: we also extracted for each study information on potential biases, as described in the following section.
Evaluación del riesgo de sesgo de los estudios incluidos
For randomised controlled trials, we used Cochrane's 'Risk of bias' tool to assess the risk of bias (Higgins 2011). We used the following seven parameters: random sequence generation and allocation concealment, blinding of patients, caregivers and outcomes assessors, incomplete outcome data, selective outcome reporting and other bias. We graded each parameter as follows: low risk of bias, unclear risk of bias, or high risk of bias. Two review authors (CH and RB) independently assessed each included study. If necessary, referral to and consensus with a third author (LLC) resolved any discrepancies between the authors. Studies were classified as having low risk of bias if none of the domains above were rated as high risk of bias and three or less were rated as unclear risk; moderate if one was rated as high risk of bias or none were rated as high risk of bias but four or more were rated as unclear risk, and all other cases were assumed to pertain to high risk of bias.
Medidas del efecto del tratamiento
We classified and analysed studies by type of intervention and type of outcome.
For each pair‐wise comparison and each dichotomous outcome at each time point, we used risk ratios (RR) with 95% confidence intervals (CI) as a measure of treatment effect. For survival time evaluation, we planned to use hazard ratios (HR) with 95% CI.
Cuestiones relativas a la unidad de análisis
The primary unit of analysis is the participant. We planned for clustered‐randomised trials, to check for unit of analysis errors, and if necessary, to adjust their standard errors using an estimate of the intra cluster correlation coefficient (ICC) as described in Section 16.3.3 of the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). In cases of multi‐dose trials, we grouped together all the different dose groups as a single arm and compared them collectively with the control group.
Manejo de los datos faltantes
When required, we requested missing data (numbers of events and numbers of participants for important dichotomous clinical outcomes) from study authors or sponsors by e‐mail (Table 3). For the main analysis, we assumed that any participant with missing outcome data did not experience clearance, whatever the group. We planned to synthesise data as analysed in each study (complete cases).
Evaluación de la heterogeneidad
We planned to assess statistical heterogeneity by visual inspection of the forest plots and by calculating I² statistics (Section 9.5.2 of the Cochrane Handbookfor Systematic Reviews of Interventions (Higgins 2011)). We planned to use the following thresholds of I² statistic to interpret heterogeneity: 0% to 40% might not be important; 30% to 60% may represent moderate heterogeneity; 50% to 90% may represent substantial heterogeneity; 75% to 100% represents considerable heterogeneity. We planned to undertake meta‐analyses only if we judged participants, interventions, comparisons, and outcomes to be sufficiently similar (Section 9.5 of the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011)).
Where statistical heterogeneity is > 75%, we planned to not pool the data (Deeks 2011).
Evaluación de los sesgos de notificación
We planned to assess reporting bias for primary end points using funnel plots. We planned to use funnel plot asymmetry tests provided validity conditions were met (low heterogeneity, 10 or more studies including at least one with significant results, and a ratio of the maximal to minimal variance across studies greater than 4) (Ioannidis 2007). In cases of evidence of small‐trial effects, we planned to perform sensitivity analyses according to a regression‐based adjustment model.
Síntesis de los datos
We planned to pool the results of similar groups of trials (participants, interventions, and outcomes), and perform a meta‐analysis using Review Manager software (RevMan 2014, Higgins 2011). We planned to use the summary estimate based on the random‐effects model (DerSimonian–Laird method) (DerSimonian 1986). In case of a high level of heterogeneity with an I² statistic greater than 75%, we planned to not perform a meta‐analysis, and to summarise data from individual studies.
Análisis de subgrupos e investigación de la heterogeneidad
The planned subgroup analyses were:
-
location of NSTI (limb versus perineal versus trunk);
-
comorbidities (we would consider diabetes, renal failure, chronic disease, peripheral vascular disease, intravenous drug misuse, obesity, non‐steroidal anti‐inflammatory drugs (NSAID) exposure);
-
immune depression (as defined by diagnosis of human immunodeficiency virus, corticosteroid use or chronic immunosuppressive treatments, and active malignancy); and
-
microbiology of NSTI (monomicrobial versus multimicrobial forms)
Análisis de sensibilidad
To evaluate the strength of the associations and identify potential causes of statistical heterogeneity, we planned to perform sensitivity analysis by excluding high 'Risk of bias' studies.
Results
Description of studies
We reported the characteristics of studies in the 'Characteristics of included studies'; 'Characteristics of excluded studies', 'Characteristics of studies awaiting classification', and 'Characteristics of ongoing studies' tables.
Results of the search
The searches of the five electronic databases retrieved 204 records. The searches of the other resources identified 58 studies. No reports of studies were identified by searching the FDA and EMA reviews nor pharmaceuticals databases. We therefore had a total of 262 records.
After duplicates records were removed, we had 245 records. Following exclusion of 226 records on the basis of title and abstract, we screened 19 full‐text reports for eligibility. We excluded 13 reports that did not meet our inclusion criteria (See Characteristics of excluded studies). Two trials were classified as studies awaiting classification because data regarding outcomes in the subgroup of patients with a necrotizing soft tissue infection (NSTI) were lacking (Darenberg 2003; Tally 1986). We contacted the study authors but have not received a reply (See Characteristics of studies awaiting classification).
Three trials fulfilled the criteria for inclusion (Bulger 2014; Madsen 2017; Vick‐Fragoso 2009). All three studies, (Bulger 2014; Madsen 2017; Vick‐Fragoso 2009), declared pharmaceutical company funding (See Characteristics of included studies). One trial (Vick‐Fragoso 2009) provided both unpublished data (provided by authors) and published results. We used both the published and unpublished data since these were complementary. One study is ongoing (NCT02469857, see Characteristics of ongoing studies).
For a further description of our screening process, see the study flow diagram Figure 1.

Flow diagram.
Included studies
The characteristics of the three included trials (Bulger 2014; Madsen 2017; Vick‐Fragoso 2009) are described in the Characteristics of included studies and summarised below.
Trial design
All included trials were randomised at a patient level, used a parallel‐group design, and were in a hospital setting. One trial was a non‐inferiority trial (Vick‐Fragoso 2009), and the others were placebo‐controlled (Bulger 2014; Madsen 2017). One trial was monocentric, performed in Denmark (Madsen 2017), and two were multicentred: one performed worldwide in 74 centres (Vick‐Fragoso 2009), and one performed in six centres all located in the USA (Bulger 2014).
Participants
The included trials randomised in total 197 adults with a diagnosis of NSTI: 54 in Vick‐Fragoso 2009, 43 in Bulger 2014 and 100 in Madsen 2017. The overall mean age of included patients was over 50 in the three trials (52.2 years (standard deviation: 13) for the group of patients with a diagnosis of NSTI in Vick‐Fragoso 2009; 50.7 years (range 25 to 88) in Bulger 2014; and 60 years (range 50 to 71) in Madsen 2017. There was a male predominance in the three trials, with 31 males/54 participants (57.4%) in Vick‐Fragoso 2009; 26/40 (65%) in Bulger 2014; and 62/100 (62%) in Madsen 2017. The mean Sequential Organ Failure Assessment (SOFA) score at admission was 7 in Madsen 2017 and 3 in Bulger 2014. In Madsen 2017, all patients, were hospitalised in intensive care unit, and 40% were in septic shock. In Vick‐Fragoso 2009, comorbidities were described for the global population, however there was no separate data available for the subgroup of participants with NSTI. Diabetes mellitus was diagnosed in 17/40 participants (42.5%) in one trial (Bulger 2014), and in 27/100 patients (27%) in the other (Madsen 2017). In two trials (Bulger 2014; Vick‐Fragoso 2009), bacteriological results were not available for the participants with NSTI. In Madsen 2017, infections were polymicrobial in 62/100 participants and Group A streptococcus was involved in 17/100 participants. In Madsen 2017, the involved areas were the extremities and head and neck in 52/100 participants.
Concerning diagnosis criteria for inclusion, in one trial, Vick‐Fragoso 2009, criteria for inclusion were complicated skin and soft skin infection (cSSSI): diabetic foot infection, post‐surgical wound infection, complicated cellulitis, complicated erysipelas, major abscess of the skin, infection of traumatic lesion, infected ischaemic ulcer, and necrotizing fasciitis. Patients had to have only one affected site and one of the following systemic symptoms: fever, high blood white cells count, tachycardia, increased respiratory rate, elevated C‐reactive protein and two or more local signs in the affected areas: pain, tenderness, anaesthesia or hypoaesthesia, swelling, purulent, serosanguinous, or foul‐smelling discharge, gas formation under the skin, and changes in the appearance (discolouration of the skin, necrotic areas, haemorrhagic bullae, blue‐grey patches). This study, which included mixed populations, does not provide a definition for individual conditions and specifically for the subgroup of patient with necrotizing fasciitis.
In Bulger 2014, patients were included if they had a clinical diagnosis of NSTI due to bacterial infection (e.g. necrotizing fasciitis, group A Streptococcus toxic shock, Fournier gangrene, clostridial gangrene or myonecrosis, and synergistic necrotizing cellulitis) and a need to perform urgent surgical exploration and debridement. Diagnosis of NSTI was confirmed during surgery. There was no clinical definition of NSTI in the inclusion criteria.
Madsen 2017 included patients with confirmed NSTI at surgical exploration. The diagnosis of NSTI was confirmed by the surgeon doing the initial operation on the basis of macroscopic findings such as tissue necrosis, deliquescent tissue and ‘dishwater’ fluid.
Intervention
Antimicrobial therapy
Moxifloxacin versus amoxicillin‐clavulanate
One trial compared two anti‐microbial therapies head to head in NSTI (Vick‐Fragoso 2009). The trial compared penicillin (amoxicillin‐clavulanate) with a third‐generation quinolone (moxifloxacin). Surgery could be carried out either before or after the antibiotic therapy at the discretion of the investigator. The daily dose in the amoxicillin‐clavulanate group was 3 g three times daily for at least three days, followed by 1.5 g three times daily versus 400 mg once daily in the moxifloxacin group. Total duration of treatment could vary from seven to 21 days according to clinical response. In both groups, the treatment was given intravenously for at least three days, and the decision to switch from intravenous to oral therapy was made by the investigator based on clinical response.
Adjuvant therapy versus placebo
CD28 antagonist peptide
One trial assessed AB103 as an adjuvant drug in NSTI management (Bulger 2014). AB103 (mimetic octapeptide) is an antagonist that prevents the binding of superantigen exotoxins to the CD28 receptor on T‐helper1 lymphocytes. There were three groups: high‐dose treatment 0.5 mg/kg, low‐dose treatment 0.25 mg/kg, and placebo. Single intravenous dose of AB103 via infusion pump for 10 minutes or placebo before, after, or during surgery were performed within six hours after the diagnosis of NSTI. All patients were treated with standardised empiric antimicrobial therapy and underwent surgical debridement of necrotic tissue. One patient received hyperbaric oxygen (HBO) treatment and another received intravenous immunoglobulin (IVIG); however, we did not know in which group these two patients were included.
Intravenous immunoglobulin (IVIG)
One trial compared IVIG as an adjuvant drug in the NSTI management versus placebo (Madsen 2017). Patients received IVIG, 25 g/day for three consecutive days. The first dose of trial medicine was given immediately after arrival to the intensive care unit (ICU) or in the operating room before admission to ICU. All patients were treated in accordance with the protocol centre at the discretion of the treating clinicians with standardised empiric antimicrobial therapy (meropenem, clindamycin and ciprofloxacin), repeated surgical revisions, three sessions of hyperbaric oxygenation, sepsis, and supportive intensive care.
Outcomes
In the trial of Vick‐Fragoso 2009, mortality within the 30 days, proportion of serious adverse events and survival time in patients with necrotizing fasciitis were unpublished data provided by the authors. Vick‐Fragoso 2009 did not report assessment of long‐term morbidity. Bulger 2014 reported mortality within the 30 days and the proportion of serious adverse events; however, the authors did not report any of our secondary outcomes (i.e. assessment of long‐term morbidity and survival time). In the trial of Madsen 2017, mortality within the 30 days and survival time in patients with NSTI were unpublished data provided by the authors. Assessment of long‐term morbidity was reported, but not as it was defined in the protocol for this review using another scale the Short Form Health Survey (SF36).
In the trial of Bulger 2014, other outcomes included the change in the Sequential Organ Failure Assessment (SOFA) score from baseline within 28 days, hospital length of stay, ICU–free, vasopressor‐free and ventilator‐free days, number of debridements through day seven. In the trial of Vick‐Fragoso 2009, efficacy was assessed by clinical response (CR) between days 14 to 28, defined as: cure (total resolution or marked improvement of all complicated skin and skin structure infections (cSSSI) signs and symptoms; no additional or alternative antimicrobial treatment necessary). In the trial of Madsen 2017, other outcomes included time to resolution of shock, amputation, and SOFA score.
Excluded studies
We excluded 13 trials at full‐text stage and provided reasons for exclusion in Characteristics of excluded studies.
Studies awaiting classification
Two trials including NSTI among participants with serious surgical infections (Tally 1986), and streptococcal toxic shock syndrome (Darenberg 2003), were identified, but outcome data for those with a NSTI were not reported separately. We contacted authors of these trials in order to obtain the required information however we did not receive an answer (Characteristics of studies awaiting classification).
Ongoing studies
Our search identified one ongoing trial on trial registries. This trial is summarised in the Characteristics of ongoing studies. NCT02469857 is a phase III blinded, randomised, placebo‐controlled trial in patients with NSTI, which assessed the efficacy of AB103, a CD28 antagonist peptide as an adjuvant drug in NSTI management.
Risk of bias in included studies
Please see Figure 2 and Figure 3 for a visual representation of our assessment of the risk of bias

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
We considered two trials at overall high risk of bias (Madsen 2017; Vick‐Fragoso 2009), and we considered one at overall moderate risk of bias (Bulger 2014). Details of our evaluation are available in Characteristics of included studies.
Allocation
We deemed Vick‐Fragoso 2009 as being at unclear risk of selection bias as there was no statement of the method of sequence generation and concealment. We deemed Bulger 2014 to be at low risk of bias for random sequence generation and at unclear risk of bias for allocation concealment. Indeed, the randomisation sequence for the study was computer‐generated but there was no description of the method used to guarantee allocation concealment. We considered Madsen 2017 as being at low risk of bias as the randomisation sequence for the study was computer‐generated and there were sequentially numbered, opaque and sealed envelopes by a dedicated personnel who was not directly associated with the trial to ensure allocation concealment.
Blinding
The trial of Vick‐Fragoso 2009 was open‐labelled, thus participants and personnel were not blinded, we therefore considered the risk as high for performance and detection.
We considered Bulger 2014 at unclear risk of bias for performance bias. The trial was double ‐blinded, placebo‐controlled and authors reported a similar adverse effect profile. However, 2/43 (4.6%) patients randomised had received co‐treatment IVIG and HBO and there was no information on the group receiving these interventions. We considered there was a low risk of detection bias for investigator‐reported outcomes.
We judged Madsen 2017 to be at low risk of bias for performance and detection bias as the method used to guarantee blinding of participants, personnel and outcome assessor were adequate and well described.
Incomplete outcome data
We considered all studies to be at high risk of attrition bias (Bulger 2014; Madsen 2017; Vick‐Fragoso 2009).
In Vick‐Fragoso 2009, one third of participants 19/54 (35%) were lost to follow‐up in the subgroup of patients with necrotizing fasciitis. The details of withdrawal in the subgroup of patients with necrotizing fasciitis were not available. There was no information available about the method of analysis for missing data.
In Bulger 2014, the authors defined a modified intention‐to‐treat (ITT) population for efficacy analysis. They excluded three patients from the ITT population: 1/11 (9%) in the placebo group who did not meet the clinical diagnosis of NSTI and 2/15 (13.3%) in the high‐dose group.
In Madsen 2017, the primary analysis was not ITT, with missing data for 13 patients (13/100, 13%), which were not included in the analysis for the primary outcome.
Selective reporting
We judged the risk of reporting bias as unclear for the study of Vick‐Fragoso 2009, since no protocol was available on the trials register. We judged the risk of bias for the studies Bulger 2014 and Madsen 2017 as low as outcomes listed in www.clinical trials.gov were similar to those reported in the results section.
Other potential sources of bias
There were no other potential sources of bias in the trial of Bulger 2014.
There were baseline imbalances in the trial of Vick‐Fragoso 2009 and Madsen 2017. In the trial of Vick‐Fragoso 2009, the number of patients in the NSTI subgroup was two‐fold higher in the moxifloxacin treatment group (36/54) than in the amoxicillin‐clavulanate treatment group (18/54). In the trial of Madsen 2017, nearly half of patients in the placebo group (20,40%) had received one dose of IVIG (25 g) before randomisation versus eight (16%) in the IVIG group.
Effects of interventions
See: Summary of findings for the main comparison Moxifloxacin compared to amoxicillin‐clavulanate for NSTI; Summary of findings 2 AB103 compared to placebo for NSTI; Summary of findings 3 Intravenous immunoglobulin compared to placebo for NSTI
Antimicrobial therapy versus antimicrobial therapy
Moxifloxacin versus amoxicillin‐clavulanate
This comparison included (Vick‐Fragoso 2009) one trial. There were 54 participants in total (36 in the moxifloxacin group and 18 in the amoxicillin‐clavulanate group).
1 Primary outcomes
1.1 Mortality within 30 days
In the moxifloxacin group, there were 6/36 (17%) deaths within 30 days and 1/18 (6%) deaths within the 30 days in the amoxicillin‐clavulanate group. According to our calculations, there were no clear differences between the two groups due to the very wide confidence intervals (risk ratio (RR) 3.00, 95% confidence interval (CI) 0.39 to 23.0) and the certainty of evidence was rated as very low with underpowered analysis (Analysis 1.1; summary of findings Table for the main comparison).
1.2 Proportion of patients who experienced serious adverse events
In the specific subgroup of NSTI patients, at 28 days, 10/36 (28%) patients receiving moxifloxacin and 8/18 (44%) patients receiving amoxicillin‐clavulanate experienced serious adverse events. According to our calculations, there were no clear differences between the two groups (RR 0.63, 95% CI (0.30 to 1.31; Analysis 1.2) as the 95% confidence interval included 1. The certainty of evidence was rated as very low (summary of findings Table for the main comparison). There were no data about the nature of serious adverse events reported.
2 Secondary outcomes
2.1 Survival time
The median time of death after start of antibiotic treatment was shorter in the moxifloxacin group than in the amoxicillin‐clavulanate group (10.5 days versus 42 days). No statistical analysis was possible with the data provided.
2.2 Assessment of long‐term morbidity
This outcome was not reported.
Adjuvant therapy versus placebo
AB103 versus placebo
One trial (Bulger 2014), included this comparison. There were 43 participants in total (32 in the AB103 group and 11 in the placebo group).
1. Primary Outcomes
1.1 Mortality within 30 days
Four deaths occurred within 30 days, 1/17 (6%) in the high‐dose arm, 1/15 (7%) in the low‐dose arm and (2/11) (18%) in the placebo group. According to our calculations, there were no clear differences for mortality rate within 30 days between groups receiving adjuvant drug versus the placebo group (RR 0.34, 95% CI 0.05 to 2.16; Analysis 2.1), and the certainty of evidence was rated as very low with underpowered analysis (summary of findings Table 2).
1.2 Proportion of patients who experienced serious adverse events
After drug administration, 5/17 (29%) of patients in the high‐dose arm, 8/15 (53%) in the low‐dose arm and 3/11 (27%) in the placebo group, underwent one serious adverse event at 28 days. There were no data about the nature of serious adverse events reported. According to our calculations, there were no clear differences in serious adverse events rates between groups receiving adjuvant drug versus the placebo group (RR 1.49, 95% CI 0.52 to 4.27; Analysis 2.2), and the certainty of evidence was rated as very low with underpowered analysis (summary of findings Table 2).
2. Secondary Outcomes
2.1 Survival time
This outcome was not reported in the study.
2.2 Assessment of long‐term morbidity
This outcome was not assessed in the study.
Intravenous immunoglobulin versus placebo
One trial (Madsen 2017) included this comparison. There were 100 participants in total (50 in the IVIG group and 50 in the placebo group).
1 Primary outcomes
1.1 Mortality within 30 days
In the IVIG group, there were 7/50 (14%) deaths within the 30 days and 6/50 (12%) in the placebo group. According to our calculations, there were no clear differences between the two groups (RR 1.17, 95% CI 0.42 to 3.23; Analysis 3.1), and the rate certainty of evidence was low (summary of findings Table 3).
1.2 Proportion of patients who experienced serious adverse events
After drug administration, 8/50 (16%) of patients in IVIG group versus 11/50 (22%) in the placebo group underwent serious adverse event. Serious adverse reactions included acute kidney injury, allergic reactions, aseptic meningitis syndrome, haemolytic anaemia, thrombi, and transmissible agents. According to our calculations, there were no clear differences for serious adverse events rates between groups receiving IVIG versus the placebo group (RR 0.73, CI 95% 0.32 to 1.65; Analysis 3.2) and the rate certainty of evidence was low (summary of findings Table 3). The time point of assessment was unclear.
2 Secondary outcomes
2.1 Survival time
The median time of death was shorter in the IVIG group than in the placebo group (25 days versus 49 days) (no statistical analysis was possible with the data provided).
2.2 Assessment of long‐term morbidity
Assessment of long‐term morbidity was reported, but not as it was defined in the protocol for this review.They used a patient‐reported score: the physical component summary (PCS) of the 36‐item short form health survey to assess long‐term morbidity. There was no clear difference of median PCS scores between groups reported (mean adjusted difference 1, 95% CI 7 to 10, P = 0.81).
Discusión
Resumen de los resultados principales
Se identificaron tres ensayos controlados aleatorios que evaluaron intervenciones para las infecciones necrosantes de partes blandas (NSTI). Estos tres ensayos incluyeron 197 pacientes adultos con un diagnóstico de INPB en un contexto hospitalario.
No fue posible agrupar los resultados de estos tres ensayos porque las intervenciones comparadas en los ensayos fueron diferentes (Resumen de los hallazgos, tabla 1; Resumen de los hallazgos, tabla 2; Resumen de los hallazgos, tabla 3).
Un ensayo comparó amoxicilina‐clavulanato con moxifloxacino (Vick‐Fragoso 2009). Un ensayo comparó dos dosis de AB103, un fármaco coadyuvante nuevo para el tratamiento de la INPB, con placebo (Bulger 2014), y el tercer ensayo comparó inmunoglobulina intravenosa (IGIV) como un tratamiento coadyuvante en el tratamiento de la INPB (Madsen 2017).
En todos los ensayos, los participantes recibieron intervenciones estándar de forma concomitante, como tratamiento antimicrobiano intravenoso empírico, desbridamiento quirúrgico de los tejidos necróticos, cuidados intensivos y tratamientos coadyuvantes.
Con respecto a los resultados primarios predeterminados, no hubo diferencias claras en cuanto a la tasa de mortalidad a los 30 días (Análisis 1.1; Análisis 2.1; Análisis 3.1) ni en cuanto a la tasa de participantes con eventos adversos graves (Análisis 1.2; Análisis 2.2; Análisis 3.2) en cualquiera de los tres ensayos. La calidad de la evidencia fue muy baja para las comparaciones de moxifloxacino con amoxicilina‐clavulánico y de AB103 con placebo, lo que mostró que no hay certeza con respecto a estos resultados. Para la comparación de IGIV versus placebo, la calidad de la evidencia fue baja.
No hubo una descripción de los tipos de eventos adversos graves en el ensayo de moxifloxacino versus amoxicilina‐clavulánico ni en el ensayo de AB103 versus placebo, pero en el ensayo de IGIV versus placebo las reacciones adversas graves incluyeron lesión renal aguda, reacciones alérgicas, síndrome de meningitis aséptica, anemia hemolítica, trombos y agentes transmisibles.
Con respecto a los resultados secundarios de esta revisión, se obtuvo el tiempo mediano de supervivencia de dos ensayos; sin embargo, no fue posible realizar un análisis estadístico con los datos proporcionados, y ninguno de los estudios incluidos informó de una evaluación de la morbilidad a largo plazo de la manera que se definió en el protocolo de esta revisión (el ensayo utilizó la Short Form Health Survey [SF36]).
Persiste la falta de evidencia para la administración de otros tratamientos como el tratamiento antimicrobiano empírico, así como el desbridamiento quirúrgico, junto con evidencia de calidad baja del tratamiento coadyuvante en comparación con placebo. Se necesita evidencia de mejor calidad para los resultados de mortalidad y efectos adversos.
Compleción y aplicabilidad general de las pruebas
De manera general, la evidencia con respecto a la eficacia y la seguridad de las intervenciones en la INPB es muy deficiente y no fue suficiente para abordar todos los objetivos de la revisión ni para proporcionar una gran validez externa. Solo se encontraron tres ensayos con 197 participantes. Faltó evidencia sobre varios tratamientos considerados para la NSTl; el tratamiento antimicrobiano empírico y las intervenciones quirúrgicas fueron los tipos de tratamiento no evaluados por los estudios incluidos. Solo se encontraron dos ensayos que evaluaron el tratamiento coadyuvante.
El único ensayo que evaluó el tratamiento con antibióticos administró amoxicilina‐clavulánico, que es una elección inapropiada de tratamiento control en un ensayo de INPB. De hecho, las INPB son principalmente polimicrobianas y la aparición de resistencia requiere un tratamiento antimicrobiano empírico más amplio que una monoterapia con amoxicilina‐clavulánico. No se encontró otro ensayo que comparara estrategias de regímenes antibióticos. La eficacia y la seguridad del tratamiento con oxígeno hiperbárico (OHB) estaba fuera del alcance de esta revisión ya que se evaluó en otra revisión Cochrane.
Los participantes incluidos fueron principalmente hombres mayores de 50 años. La falta de una definición clara de la INPB en dos ensayos impidió determinar la aplicabilidad de los resultados de los ensayos (Bulger 2014; Vick‐Fragoso 2009), al no proporcionar una definición de la afección de INPB. Algunos pacientes incluidos en el ensayo Vick‐Fragoso 2009 con un diagnóstico de INPB (13/54 [24%]) no se sometieron a cirugía, aunque se considera la intervención de referencia (gold standard) para el diagnóstico y el tratamiento de la INPB en el contexto de una presunción clínica alta. No fue posible el análisis de subgrupos para determinar si la eficacia o la seguridad podrían ser diferentes según el sitio involucrado, el tipo de microorganismo, infección monomicrobiana o ultramicrobiana y las comorbilidades, debido a que se incluyó un número demasiado escaso de pacientes. Además, excepto en un ensayo (Madsen 2017), la información sobre las comorbilidades, el sitio involucrado y los microorganismos identificados no estuvieron disponibles.
Con respecto a los resultados, los estudios incluidos informaron las tasas de mortalidad a los 30 días y los efectos adversos graves (los resultados primarios de esta revisión), pero los resultados se basaron en evidencia de certeza baja o muy baja. La evaluación a largo plazo de la morbilidad para evaluar las secuelas solo se informó en un ensayo (Madsen 2017), pero no se definió de la manera definida según el protocolo de esta revisión. Los datos proporcionados por los autores sobre el tiempo de supervivencia no permitieron realizar el análisis de supervivencia.
Calidad de la evidencia
A nivel global, la calidad/certeza de la evidencia fue baja o muy baja para la eficacia y la seguridad de las intervenciones en la INPB; se disminuyó la evidencia de los tres ensayos incluidos.
El nivel de la evidencia para la comparación de moxifloxacino versus amoxicilina‐clavulánico se consideró muy bajo para todos los resultados porque el único ensayo que evaluó esta comparación (Vick‐Fragoso 2009) tuvo alto riesgo de sesgo debido a sesgo de desgaste, desequilibrio en la inclusión entre los grupos y sesgo de realización y de detección, ya que los participantes y los evaluadores no se cegaron. El nivel de la evidencia de este ensayo también se rebajó debido a la falta de direccionalidad ya que no hubo una definición clara de la fascitis necrosante y una proporción significativa de los pacientes (10/36 [28%] del grupo de moxifloxacino y 3/18 [17%] del grupo de amoxicilina‐clavulánico) no se sometió la cirugía, lo que hace dudar con respecto a los tipos de infecciones que presentaron estos participantes. También se rebajó por imprecisión, ya que solo incluyó 58 participantes con fascitis necrosante (Resumen de los hallazgos, tabla 1).
También se consideró que la calidad de la evidencia fue muy baja para la eficacia y la seguridad del tratamiento coadyuvante (AB103), un antagonista del receptor de CD28. El único ensayo que evaluó este tratamiento para la INPB tuvo riesgo moderado de sesgo de desgaste (Bulger 2014); también se rebajó el nivel de la evidencia por falta de direccionalidad debido a la falta de una definición clínica de INPB y debido a la imprecisión: solo se incluyeron 43 participantes, lo que no es suficiente para identificar o excluir un efecto beneficioso significativo (Resumen de los hallazgos, tabla 2).
Se consideró que el nivel de la evidencia fue bajo para la eficacia y la seguridad de la IGIV para la INPB. El único ensayo que evaluó la IGIV tuvo alto riesgo de sesgo de desequilibrio y de desgaste (Madsen 2017). Alrededor de la mitad de los pacientes (40%) del grupo placebo habían recibido una dosis de IGIV (25 g) antes de la asignación al azar versus tres dosis (75 g) en el grupo de IGIV, lo que hace dudar del diseño controlado con placebo de este ensayo (indireccionalidad) (Resumen de los hallazgos, tabla 3).
La aplicabilidad de la evidencia también estuvo limitada debido a los tamaños pequeños de la muestra y al análisis con escaso poder estadístico.
Sesgos potenciales en el proceso de revisión
La revisión consideró tanta evidencia como fue posible obtener, incluidos los estudios no publicados. La búsqueda no se limitó a la fascitis necrosante y consideró todos los ensayos relacionados con infecciones necrosantes de partes blandas. Hubo varios ensayos clínicos que incluyeron una población mixta de pacientes con una variedad amplia de infecciones cutáneas y de estructuras cutáneas, incluida la INPB, y utilizaron términos como "infecciones complicadas cutáneas y de estructuras cutáneas". Sin embargo, cuando no hubo datos disponibles para el subgrupo muy específico de INPB, estos estudios no se incluyeron. La variedad amplia de términos para designar la INPB podría haber dado lugar a que se perdieran algunos estudios que incluyeron poblaciones heterogéneas de pacientes con infecciones cutáneas y de partes blandas.
Además, la inconsistencia de las definiciones y la variabilidad en las definiciones utilizadas para la INPB entre los estudios pueden, por otro lado, dar lugar a que se incluyan por error pacientes con celulitis, úlcera del pie en pacientes con diabetes, abscesos dérmicos y gangrena isquémica. De hecho, algunos pacientes en los ensayos incluidos tenían un diagnóstico de INPB pero no se sometieron a cirugía, que es obligatoria para confirmar el diagnóstico de INPB (Vick‐Fragoso 2009), lo que indica que estos pacientes podrían haber presentado otros tipos de infecciones cutáneas y de partes blandas.
Acuerdos y desacuerdos con otros estudios o revisiones
Hasta donde se conoce no hay otra revisión sistemática sobre este tema.
Las recomendaciones con respecto a las intervenciones para la INPB se basan en el consenso de expertos (SFD‐SPILF 2000; Stevens 2014). Las guías recomiendan administrar un tratamiento antimicrobiano intravenoso empírico para abarcar los microorganismos grampositivos, gramnegativos y anaerobios (Sartelli 2014; Stevens 2014). Se han realizado muchos ensayos para evaluar la eficacia de los agentes antimicrobianos en el tratamiento de infecciones complicadas cutáneas y de tejidos cutáneos (McClaine 2010). Sin embargo, la mayoría de estos ensayos excluyeron las INPB. Hasta la fecha no hay ensayos controlados aleatorios que comparen tratamiento antimicrobiano y que incluyan solo pacientes con INPB. El efecto beneficioso de la clindamicina para la INPB debido a Streptococcus grupo A (GAS) solo se basa en estudios observacionales y no se ha evaluado mediante un ensayo (Carapetis 2014; Stevens 2014).
No hay ensayos controlados aleatorios que evalúen la cirugía en la INPB.
En cuanto al uso de la IGIV, los resultados del ensayo Madsen 2017 coinciden con un estudio observacional reciente (análisis apareado por puntuación de propensión) que incluyó 4127 pacientes con INPB y shock durante un período de cuatro años en 130 centros en los EE.UU. (Kadri 2017). Este estudio no demostró diferencias en la mortalidad hospitalaria entre los pacientes que recibieron IGIV y los que no la recibieron (odds ratio [OR] ajustado 1,00; intervalo de confianza [IC] del 95%: 0,55 a 1,83; p = 0,99), ni en el subgrupo específico de pacientes con INPB provocado por GAS o Staphylococcus aureus (SA) (Kadri 2017).

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Moxifloxacin versus amoxicillin‐clavulanate, Outcome 1 Mortality within 30 days.

Comparison 1 Moxifloxacin versus amoxicillin‐clavulanate, Outcome 2 Proportion of patients who experienced serious adverse events.
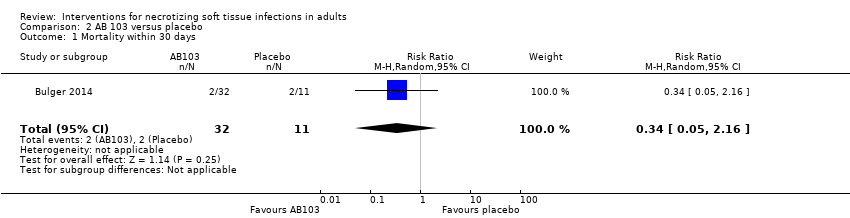
Comparison 2 AB 103 versus placebo, Outcome 1 Mortality within 30 days.
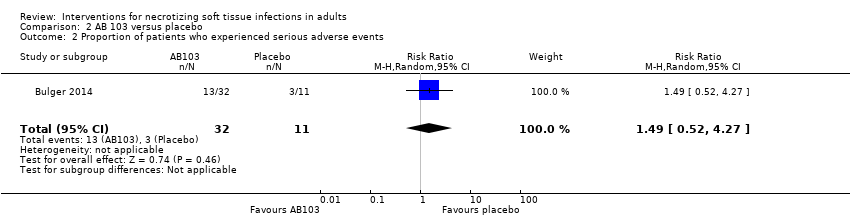
Comparison 2 AB 103 versus placebo, Outcome 2 Proportion of patients who experienced serious adverse events.

Comparison 3 IGIV versus placebo, Outcome 1 Mortality within 30 days.

Comparison 3 IGIV versus placebo, Outcome 2 Proportion of patients who experienced serious adverse events.
| Moxifloxacin compared to amoxicillin‐clavulanate for NSTI | ||||||
| Patient or population: NSTI | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality/certainty of the evidence | Comments | |
| Risk with Amoxicillin‐clavulanate | Risk with Moxifloxacin | |||||
| Mortality | Study population | RR 3.00 | 54 | ⊕⊝⊝⊝ | Data from a larger trial including several types of soft tissue infections; total number of included patients N = 804 | |
| 6 per 100 | 17 per 100 | |||||
| Serious adverse events (SAE) | Study population | RR 0.63 | 54 | ⊕⊝⊝⊝ | Description of nature of serious adverse events was not available | |
| 44 per 100 | 28 per 100 | |||||
| Survival time | — | — | — | 54 | ⊕⊝⊝⊝ | The median time of death after start of antibiotic treatment was shorter in the moxifloxacin group than in the amoxicillin‐clavulanate group (10.5 days versus 42 days) (not possible to calculate hazard ratio with the data provided) |
| Assessment of long‐term morbidity | — | — | — | — | — | Not reported |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). Assumed risk for mortality was based on data of the literature (Audureau 2017; May 2009). For serious adverse effects it was based on the results of the trial. | ||||||
| GRADE Working Group grades of evidence | ||||||
| aDowngraded by five levels to very low certainty of evidence. We downgraded two levels because of high risk of bias regarding blinding (open label trial) and high risk for attrition bias because of a high rate of withdrawal (20%). We downgraded one level for serious imprecision because of small sample size (and CI of RR included 1, where reported). We downgraded a further two levels because no clear criteria for clinical diagnosis of necrotizing fasciitis were provided and because antibiotic used as comparator is not relevant (indirectness) | ||||||
| AB103 compared to Placebo for NSTI | ||||||
| Patient or population: NSTI | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality/certainty of the evidence | Comments | |
| Risk with Placebo | Risk with AB103 | |||||
| Mortality | Study population | RR 0.34 | 43 | ⊕⊝⊝⊝ | — | |
| 23 per 100* | 6 per 100 | |||||
| Serious adverse events (SAE) | Study population | RR 1.49 | 43 | ⊕⊝⊝⊝ | There were no data about the nature of serious adverse events reported | |
| 27 per 100 | 41 per 100 | |||||
| Survival time | — | — | — | — | — | Not reported |
| Assessment of long‐term morbidity | — | — | — | — | — | Not reported |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). Assumed risk for mortality was based on data of the literature (Audureau 2017; May 2009). For serious adverse effects it was based on the results of the trial. | ||||||
| GRADE Working Group grades of evidence | ||||||
| aDowngraded by three levels: one level for high risk of attrition bias, one level for no clear clinical definition of criteria for necrotizing fasciitis diagnosis at inclusion (indirectness), and one level for serious imprecision because of small sample size and CI included no difference | ||||||
| Intravenous immunoglobulin compared to placebo for NSTI | ||||||
| Patient or population: NSTI | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality/Certainty of the evidence | Comments | |
| Risk with placebo | Risk with Intravenous immunoglobulin | |||||
| Mortality | Study population | RR 1.17 | 100 | ⊕⊕⊝⊝ | — | |
| 0 per 100 | 0 per 100 | |||||
| Moderate | ||||||
| 23 per* 100 | 21 per 100 | |||||
| Serious adverse events (SAE) | Study population | RR 0.73 | 100 | ⊕⊕⊝⊝ | Serious adverse reactions included acute kidney injury, allergic reactions, aseptic meningitis syndrome, haemolytic anaemia, thrombi, and transmissible agents | |
| 22 per 100 | 16 per 100 | |||||
| Survival time | — | — | — | 100 | ⊕⊕⊝⊝ | The median time of death was shorter in the IVIG group than in the placebo group (25 days versus 49 days) (not possible to calculate hazard ratio with the data provided) |
| Assessment of long‐term morbidity | — | — | — | — | — | Not reported |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). Assumed risk for mortality was based on data of the literature (Audureau 2017; May 2009). For serious adverse effects it was based on the results of the trial. | ||||||
| GRADE Working Group grades of evidence | ||||||
| aDowngraded by two levels: one level for high risk of attrition bias (38% lost of follow‐up); other bias: imbalance at baseline for one dose 25 IVIG received before randomisation (40% in placebo group vs 16% IVIG group). One level for indirectness as a minority of patients have an infection linked to bacteria producing toxins | ||||||
| Term used | Explanation |
| Adjuvant treatment | Treatment that is given in addition to the primary or initial therapy to improve its effectiveness |
| Empiric antimicrobial therapy | Antimicrobial therapy given before the specific bacteria causing an infection is known |
| Aseptic meningitis | Serious inflammation of the linings of the brain not caused by pyogenic bacteria |
| Empiric antibiotic therapy | Antibiotics that acts against a wide range of bacteria |
| Bullae | Blisters on the skin usually more than 5 mm in diameters |
| Cirrhosis | Advanced liver disease |
| Crepitus | Clinical signs characterised by a peculiar sound under the skin |
| Debridement | Surgery excision of necrotic tissues (medical removal of dead, damaged, or infected tissue) |
| Endotoxin | A toxin contained in bacteria that is released only when the bacteria are broken down |
| Exotoxin | A toxin that is secreted by bacteria into the surrounding medium |
| Fascia | A fibrous connective tissue that surrounds muscle and other soft tissue. Fasciae are classified according to their distinct layers and their anatomical location: superficial fascia and deep (muscle) fascia |
| Fulminant inflammatory response | Systemic inflammatory response |
| Gram‐negative bacteria | Class of bacteria gram‐negative staining |
| Haemolytic anaemia | Decrease in the total amount of red blood cells due to the abnormal breakdown of red blood cells |
| Hyperbaric oxygen therapy | Medical use of oxygen at a level higher than atmospheric pressure. This helps fight bacteria and infection |
| Hypoxia | Insufficient levels of oxygen in blood or tissue |
| Intravenous immunoglobulin (IVIG) | Administration of antibodies through the veins |
| Motricity | Strength in upper and lower extremities after disease |
| Morbidity | Disability or degree that the health condition affects the patient |
| Mortality | Death rate |
| MRSA | Methicillin‐resistant Staphylococcus aureus |
| Myonecrosis | The destruction or death of muscle tissue |
| Necrosis | Death of body tissue |
| Obliterating endarteritis | Severe proliferating endarteritis (inflammation of the inner lining of an artery) that results in an occlusion of the lumen (the space inside a tubular structure) of the smaller vessels |
| Person‐years | Unit of measurement used to estimate rate of a disease during a defined period of observation |
| Polymicrobial | Polymicrobial infection is caused by several species of micro‐organisms |
| Subcutaneous tissue | Layer of tissue below the epidermis and the dermis of the skin. It is also called the hypodermis |
| Synergistic combination | Additive effects of bacterial agents |
| Synergistic gangrenes | Necrotizing soft tissue infection caused by a mix of bacteria (usually a mix of anaerobic and aerobic micro‐organisms) |
| Systemic | Affecting the entire body |
| Third‐generation quinolones | The quinolones are a family of synthetic broad‐spectrum antibiotic drugs |
| Thrombi | A blood clot inside a blood vessel |
| Transmissible agents | Infectious pathogens that can be transmitted |
| Vasopressors | Any medication that induces vasoconstriction of blood vessels to raise reduced blood pressure |
| Vimentin | A protein, the expression of which is increased after skeletal muscle injury |
| Incidence of necrotizing fasciitis | ||||
| Authors | Period of study | Country | Pathology | Incidence |
| Kaul R et al (Kaul 1997) | 1991 | Canada | GAS NF | 0.085 per 100,000 p‐y |
| 1995 | 0.4 per 100,000 p‐y | |||
| Ellis Simonsen et al (Ellis Simonsen 2006) | January 1997 to December 2002 | United States | NF | 0.04 per 1000 p‐y |
| O'Grady et al (O'Grady 2007) | March 2002 to August 2004 | Australia | IGAS | 2.7 per 100,000 p‐y (10.9% of NF) |
| Lamagni et al (Lamagni 2008) | January 2003 to December 2004 | Europe | IGAS | 2.37 per 100,000 p‐y (8% of NF) |
| Lepoutre et al (Lepoutre 2011) | November 2006 to November 2007 | France | IGAS | 3.1 per 100,000 p‐y (18% of NF) |
| GAS NF:group A streptococcal necrotizing fasciitis; IGAS: invasive group A streptococcal disease; NF: necrotizing fasciitis; p‐y: person‐years | ||||
| Study | Contact | Requested information | Contacted | Reply (last check 23 April 2017) |
| Darenberg 2003 (awaiting classification study) | Dr Norrby‐Teglund | Outcomes in the specific subgroup of patients with NSTI: ‐Mortality at day 30, ‐Proportion of patients with serious adverse events ‐Survival time ‐Patients with alteration of 25% of Functional Impairment Scale (%) | July 28, 2015 September 07, 2015 | No response |
| Tally 1986 (awaiting classification study) | Dr Kellum | Outcomes in the specific subgroup of patients with NSTI: ‐Mortality at day 30, ‐Proportion of patients with serious adverse events ‐Survival time ‐Patients with alteration of 25% of Functional Impairment Scale (%) | July 24, 2015 September 07, 2015 | No response |
| Vick‐Fragoso 2009 (included study) | Dr Bogner, Dr Petri | Outcomes in the specific subgroup of patients with NSTI: ‐Mortality at day 30, ‐Proportion of patients with serious adverse events ‐Survival time ‐Patients with alteration of 25% of Functional Impairment Scale (%) | September 07, 2015 | Additional data to the publication provided for mortality, proportion of patients with serious adverse events and survival time. Outcome data for assessment of long term morbidity not provide |
| Bulger 2014 (included study) | Dr Bulger | Outcomes: ‐Survival time ‐Patients with alteration of 25% of Functional Impairment Scale (%) | September 07, 2015 September 09, 2015 | Outcome data not provided |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Mortality within 30 days Show forest plot | 1 | 54 | Risk Ratio (M‐H, Random, 95% CI) | 3.0 [0.39, 23.07] |
| 2 Proportion of patients who experienced serious adverse events Show forest plot | 1 | 54 | Risk Ratio (M‐H, Random, 95% CI) | 0.63 [0.30, 1.31] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Mortality within 30 days Show forest plot | 1 | 43 | Risk Ratio (M‐H, Random, 95% CI) | 0.34 [0.05, 2.16] |
| 2 Proportion of patients who experienced serious adverse events Show forest plot | 1 | 43 | Risk Ratio (M‐H, Random, 95% CI) | 1.49 [0.52, 4.27] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Mortality within 30 days Show forest plot | 1 | 100 | Risk Ratio (M‐H, Random, 95% CI) | 1.17 [0.42, 3.23] |
| 2 Proportion of patients who experienced serious adverse events Show forest plot | 1 | 100 | Risk Ratio (M‐H, Random, 95% CI) | 0.73 [0.32, 1.65] |


