Etrolizumab para la inducción de la remisión en la colitis ulcerosa
Resumen
Antecedentes
El etrolizumab (rhuMAb beta7) es un anti‐integrina que se dirige de forma selectiva a las subunidades β7 de las integrinas α4β7 and αEβ7 que participan en la patogenia de la colitis ulcerosa.
Objetivos
Los objetivos de esta revisión fueron evaluar la eficacia y la seguridad del etrolizumab para la inducción de la remisión en la colitis ulcerosa.
Métodos de búsqueda
Se hicieron búsquedas en PubMed, MEDLINE, EMBASE y en la Cochrane Library (CENTRAL), desde su inicio hasta el 12 marzo 2015. Se hicieron búsquedas en las referencias y resúmenes de congresos para identificar estudios adicionales.
Criterios de selección
Se incluyeron los ensayos controlados aleatorios (ECA) en los que etrolizumab se comparó con placebo u otro comparador activo en pacientes con colitis ulcerosa activa.
Obtención y análisis de los datos
Dos autores examinaron de forma independiente los estudios para su inclusión, evaluaron la calidad metodológica y extrajeron los datos. Se evaluó la calidad metodológica mediante la herramienta Cochrane para el riesgo de sesgo. El resultado primario fue el fracaso en la inducción de la remisión clínica (tal como lo definieron los estudios primarios). Los resultados secundarios incluyeron el fracaso en la inducción de la mejoría clínica (tal como lo definieron los estudios primarios), el fracaso en la inducción de la remisión endoscópica (tal como lo definieron los estudios primarios), los eventos adversos, los eventos adversos graves, los retiros debido a los eventos adversos y la calidad de vida relacionada con la salud (tal como lo definieron los estudios primarios). La calidad general de las pruebas se evaluó mediante los criterios GRADE. Se calculó el cociente de riesgos (CR) y el intervalo de confianza (IC) del 95% correspondiente para los resultados dicotómicos.
Resultados principales
Dos ECA con 172 pacientes con CU moderada a grave en los que fracasó el tratamiento convencional cumplieron con los criterios de inclusión. Ambos estudios fueron clasificados como de bajo riesgo de sesgo. No se agruparon los datos de eficacia de los dos estudios incluidos debido a las diferencias en la dosis y la vía de administración. El estudio pequeño de fase I no encontró diferencias estadísticamente significativas entre etrolizumab y placebo en la proporción de pacientes que no lograron entrar a la fase de remisión (CR 1,04; IC del 95%: 1,04 a 1,69; participantes = 23) ni responder a la semana diez (CR 1,67; IC del 95%: 0,26 a 10,82; participantes = 23). El estudio de fase II informó el fracaso al entrar en la fase de remisión clínica a las semanas seis y diez. En el grupo de etrolizumab el 91% (71/78) de los pacientes no logró entrar en fase de remisión en la semana seis en comparación con el 95% (39/41) de los pacientes con placebo (CR 0,96; IC del 95%: 0,87 a 1,06). El análisis de subgrupos no mostró diferencias estadísticamente significativas por dosis. A la semana diez, hubo una diferencia estadísticamente significativa en las tasas de remisión clínica a favor de etrolizumab sobre placebo. De los pacientes que recibieron etrolizumab, el 85% (66/78) no logró entrar en la fase de remisión a la semana diez en comparación con el 100% (41/41) de los pacientes del grupo placebo (CR 0,86; IC del 95%: 0,77 a 0,95). Un análisis de subgrupos por dosis encontró una diferencia estadísticamente significativa en las tasas de remisión clínica a favor de etrolizumab de 100 mg sobre placebo (CR 0,81; IC del 95%: 0,68 a 0,96), pero no de etrolizumab de 300 mg sobre placebo (CR 0,91; IC del 95%: 0,80 a 1,03). En esta comparación no se detectó heterogeneidad significativa (P = 0,28, I2 = 13,5%). Los análisis GRADE indicaron que la calidad general de las pruebas para los resultados de la remisión clínica fue moderada debido a los datos escasos. Ambos estudios incluidos informaron sobre la seguridad. El resultado eventos adversos se agrupó inicialmente; sin embargo, este análisis se eliminó debido a la heterogeneidad alta (I2 = 88%). El estudio de fase I no encontró diferencias estadísticamente significativas entre etrolizumab y placebo en la proporción de pacientes que presentaron al menos un evento adverso. El 95% (36/38) de los pacientes que recibieron etrolizumab tuvieron un evento adverso en comparación con el 100% (10/10) de los pacientes que recibieron placebo (CR 0,98; IC del 95%: 0,84 a 1,14). Los eventos adversos frecuentes informados en el estudio de fase I incluyeron exacerbación de la CU, cefalea, fatiga, dolor abdominal, mareo, nasofaringitis, náuseas, artralgia e infección urinaria. Hubo una diferencia estadísticamente significativa entre etrolizumab y placebo en la proporción de pacientes que presentaron al menos un evento adverso. El 56% (44/78) de los pacientes que recibieron etrolizumab tuvieron al menos un evento adverso en comparación con el 79% de los pacientes que recibieron placebo (CR 0,71; IC del 95%: 0,55 a 0,91). Un análisis GRADE indicó que la calidad general de las pruebas para este resultado fue moderada debido a los datos escasos. Los eventos adversos frecuentes informados en el estudio de fase II incluyeron empeoramiento de la CU, nasofaringitis, trastornos del sistema nervioso, cefalea y artralgia. Un análisis agrupado de dos estudios indica que no hubo diferencias estadísticamente significativas en la proporción de pacientes que tuvieron un evento adverso grave. El 12% (14/116) de los pacientes que recibieron etrolizumab tuvieron un evento adverso grave en comparación con el 12% de los pacientes que recibieron placebo (6/49) (CR 0,92; IC del 95%: 0,36 a 2,34). Un análisis GRADE indicó que la calidad general de las pruebas que apoyan este resultado fue baja debido a la muy reducida cantidad de datos (20 eventos). Los eventos adversos graves frecuentes incluyeron empeoramiento de la CU, deterioro de la cicatrización de la herida y peritonitis bacteriana.
Conclusiones de los autores
Pruebas de calidad moderada indican que etrolizumab puede ser un tratamiento de inducción efectivo en algunos pacientes con colitis ulcerosa moderada a grave en los que el tratamiento convencional ha fracasado. Debido al número reducido de pacientes en los subgrupos de dosis, no está clara la dosis óptima de etrolizumab. Debido a los datos escasos no existe seguridad con respecto al riesgo de eventos adversos y eventos adversos graves. Se necesitan estudios adicionales para determinar la eficacia y la seguridad del etrolizumab en esta población de pacientes. Hay cinco ensayos de fase III de etrolizumab en curso y dos estudios de extensión abiertos en curso que proporcionarán información nueva e importante sobre la eficacia, la seguridad y la dosis óptima de este fármaco para el tratamiento de la CU.
PICO
Resumen en términos sencillos
Etrolizumab para el tratamiento de la colitis ulcerosa activa
¿Qué es la colitis ulcerosa?
La colitis ulcerosa es una enfermedad intestinal inflamatoria a largo plazo (crónica). Los síntomas incluyen dolor (retortijones abdominales), necesidad frecuente de defecar (urgencia fecal) y diarrea sanguinolenta. Cuando los pacientes con colitis ulcerosa presentan síntomas se dice que la enfermedad es "activa" y a la interrupción de los síntomas de le denomina "remisión".
¿Qué es el etrolizumab?
El etrolizumab es un fármaco biológico. Se inyecta bajo la piel con una jeringuilla o se infunde en una vena (intravenosa). Los productos biológicos suprimen el sistema inmunológico y reducen la inflamación asociada con la colitis ulcerosa.
¿Qué examinaron los investigadores?
Los investigadores examinaron si el etrolizumab puede detener los síntomas de la colitis ulcerosa en los pacientes con enfermedad activa, y si esta medicación causa efectos perjudiciales (efectos secundarios). Los investigadores buscaron en la literatura médica hasta el 12 marzo de 2015.
¿Qué encontraron los investigadores?
Los investigadores identificaron dos estudios que incluyeron 172 participantes con colitis ulcerosa moderada a grave en los que fracasó el tratamiento con inmunosupresores (p.ej. esteroides) u otro fármaco biológico. Ambos estudios compararon etrolizumab con placebo (una medicina falsa). Ambos estudios eran de alta calidad. El estudio más pequeño (48 participantes) no encontró diferencias en las tasas de remisión entre etrolizumab y placebo a la semana diez. El estudio más grande (124 participantes) no encontró diferencias entre etrolizumab y placebo en la proporción de participantes que lograron la remisión a la semana seis. Sin embargo, hubo una diferencia estadísticamente significativa en las tasas de remisión a la semana diez a favor de etrolizumab sobre placebo. En el estudio más grande (124 participantes) los participantes que recibieron placebo tuvieron significativamente más probabilidades de presentar al menos un efecto secundario en comparación con los que recibieron etrolizumab. Los efectos secundarios frecuentes en este estudio incluyeron empeoramiento de la colitis ulcerosa, nasofaringitis (resfriado común), trastornos del sistema nervioso, cefalea y artralgia (dolor en las articulaciones). En el otro estudio (48 participantes) no hubo diferencias en las tasas de efectos secundarios entre los grupos placebo y etrolizumab. Los efectos secundarios frecuentes en este estudio incluyeron empeoramiento de la colitis ulcerosa, cefalea, fatiga (cansancio), dolor abdominal, mareo, nasofaringitis (resfriado común), náuseas, artralgia (dolor en las articulaciones) e infección urinaria. No hubo diferencias significativas entre etrolizumab y placebo en la proporción de pacientes que presentaron efectos secundarios graves. Los efectos secundarios graves incluyeron empeoramiento de la colitis ulcerosa e infección.
El etrolizumab puede ser mejor que placebo para producir la remisión en los pacientes con colitis ulcerosa moderada a grave en los que han fracasado otros tratamientos. Se investigaron diferentes dosis de etrolizumab, pero no está claro qué dosis es la más efectiva. Se necesitan más estudios para determinar la efectividad y la seguridad de etrolizumab en los pacientes con colitis ulcerosa moderada a grave. Actualmente hay siete estudios en curso que investigan el tratamiento con etrolizumab para la colitis ulcerosa. Estos estudios proporcionarán información nueva e importante sobre la efectividad, la seguridad y la dosis ideal de etrolizumab para el tratamiento de los pacientes con colitis ulcerosa moderada a grave.
Conclusiones de los autores
Summary of findings
| Etrolizumab versus placebo for induction of remission in ulcerative colitis | ||||||
| Patient or population: patients with induction of remission in ulcerative colitis | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Etrolizumab versus placebo | |||||
| Failure to enter clinical remission at week 10 | 1000 per 10001 | 860 per 1000 | RR 0.86 | 119 | ⊕⊕⊕⊝ | |
| Failure to enter clinical remission at week 10 ‐ 100 mg | 1000 per 10001 | 810 per 1000 | RR 0.81 | 59 | ⊕⊕⊕⊝ | |
| Failure to respond at week 10 | 707 per 10001 | 679 per 1000 | RR 0.96 | 119 | ⊕⊕⊕⊝ | |
| Failure to enter endoscopic remission at week 6 | 976 per 10001 | 956 per 1000 | RR 0.98 | 119 | ⊕⊕⊕⊝ | |
| Failure to enter endoscopic remission at week 10 | 1000 per 10001 | 920 per 1000 | RR 0.92 | 119 | ⊕⊕⊕⊝ | |
| Adverse events | 721 per 10001 | 541 per 1000 | RR 0.75 | 124 | ⊕⊕⊕⊝ | |
| Serious adverse events | 122 per 10001 | 113 per 1000 | RR 0.92 | 165 | ⊕⊕⊝⊝ | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Control group risk estimates come from control arm of meta‐analysis, based on included trials. 2 Downgraded one level due to sparse data (107 events). 3 Downgraded one level due to sparse data (51 events). 4 Downgraded one level due to sparse data (82 events). 5 Downgraded one level due to sparse data (114 events). 6 Downgraded one level due to sparse data (112 events). 7Downgraded one level due to sparse data (75 events). 8 Downgraded two levels due to very sparse data (20 events). | ||||||
Antecedentes
Descripción de la afección
La colitis ulcerosa (CU) es una enfermedad inflamatoria crónica de etiología desconocida caracterizada por diarrea sanguinolenta, dolor abdominal y urgencia fecal. Las tasas de incidencia de CU en todo el mundo oscilan entre 1,25 y 20,3 nuevos casos por 100 000 personas por año, con aproximadamente diez a 12 casos nuevos por 100 000 personas por año en Norteamérica y Europa (Danese 2011; Fedorak 2010; Molodecky 2012). En los Estados Unidos se calcula que los costos directos e indirectos asociados con la enfermedad oscilan entre USD 8 100 000 000 y USD 14 900 000 000 por año (Cohen 2010). Las pruebas indican que la CU es causada por una respuesta inmunitaria inapropiada desencadenada por una combinación de factores ambientales, genéticos e inmunológicos (Bouma 2003).
La CU se trata con fármacos antiinflamatorios de amplio espectro que incluyen corticosteroides, productos del ácido 5‐aminosalicílico (5‐ASA), tratamientos inmunosupresores (p.ej. azatioprina, 6‐mercaptopurina y metotrexato) y productos biológicos como antagonistas del factor de necrosis tumoral alfa (FNT‐α) (p.ej. infliximab [Remicade®], adalimumab [Humira®], certolizumab pegol [Cimzia®] y golimumab [Simponi®]) e inhibidores de alfa4beta7 (α4β7) (p.ej. vedolizumab) (Bickston 2014; Feagan 2012a; Feagan 2012b; Ford 2011a; Ford 2011b; Kornbluth 2010; Lawson 2006; Timmer 2012). Estos fármacos son efectivos en grados variables; sin embargo, los pacientes a menudo no responden, desarrollan dependencia de corticosteroides, el tratamiento fracasa o experimentan eventos adversos significativos relacionados con los fármacos (Faubion 2001; Gisbert 2015).
Los aminosalicilatos son efectivos para la enfermedad leve a moderada (Feagan 2012a; Feagan 2012b; Ford 2011a), mientras que a menudo se requieren corticosteroides para los que no logran responder al 5‐ASA (Ford 2011b; Turner 2007). Los corticosteroides son muy efectivos para la inducción de la remisión, aunque no son útiles para el mantenimiento de la remisión y conllevan efectos adversos significativos que incluyen osteoporosis, intolerancia a la glucosa y mayor riesgo de infección (Bjarnason 1997; Dignass 2010; Lichtenstein 2006). Los inmunosupresores, incluida la 6‐mercaptopurina y la azatioprina, tienen una función limitada en el mantenimiento de la remisión en la CU(Podolsky 2002; Timmer 2012). Además, estos fármacos pueden aumentar el riesgo de linfoma y de cáncer de piel no melanoma en los pacientes con enfermedad intestinal inflamatoria (EII) (Ariyaratnam 2014; Smith 2010). Los antagonistas del FNT‐α son útiles para la inducción y para el mantenimiento de la remisión en la CU (Reinisch 2011; Sandborn 2012; Sandborn 2014), sin embargo, su uso se ha asociado con varios eventos adversos graves que incluyen hipersensibilidad e infección oportunista (Ford 2013). Los pacientes en los que el tratamiento fracasa, desarrollan megacolon tóxico o presentan ataques graves de colitis ulcerosa que requiere colectomía, que con frecuencia da lugar a complicaciones posoperatorias que incluyen infección, pouchitis, formación de fístulas y obstrucción intestinal (Loftus 2008). Los nuevos agentes farmacológicos, en particular los específicos para el tracto intestinal, pueden ser más efectivos que los convencionales y reducen la necesidad de cirugía.
Descripción de la intervención
Las moléculas antiadhesión como el natalizumab y el vedolizumab representan una opción biológica nueva para el tratamiento de la CU. Se ha demostrado que natalizumab fue efectivo en los pacientes con enfermedad de Crohn; sin embargo, su uso se ha asociado con inmunosupresión del sistema nervioso central y desarrollo de leucoencefalopatía multifocal progresiva (LMP)(Van Assche 2005). Por el contrario, el vedolizumab ha probado ser efectivo para la inducción y el mantenimiento de la remisión en la CU y bien tolerado por los pacientes (Bickston 2014; Feagan 2013). Aunque el natalizumab regula el tráfico de leucocitos al bloquear la integrina alfa4beta1 (α4β1) y la alfa4beta7 (α4β7), el vedolizumab se dirige de forma selectiva a esta última, por lo que inhibe exclusivamente el anidamiento de los linfocitos T en los intestinos. El etrolizumab es una anti‐integrina nueva que se dirige selectivamente a las subunidades β7 de las integrinas α4β7 y αEβ7 que regulan el tráfico y la retención de los linfocitos del subgrupo de linfocitos T en la mucosa intestinal.
De qué manera podría funcionar la intervención
El etrolizumab se une con alta afinidad a la α4β7 (Holzmann 1989; Hu 1992), y αEβ7(Cepek 1993). Mediante este mecanismo, bloquea el anidamiento y la retención de las subpoblaciones de leucocitos en la mucosa intestinal, lo que ocurre a través de la unión con moléculas de adhesión de células (MAdCAM‐1) y E‐cadherina, respectivamente. Debido a que estas moléculas de adhesión celular se encuentran principalmente en la mucosa intestinal, se cree que el etrolizumab es específico del intestino. En un modelo de ratones, el etrolizumab bloquea selectivamente el anidamiento de los linfocitos en el aparato digestivo, sin efecto evidente sobre el tráfico de linfocitos al sistema nervioso central o a los tejidos no mucosos (Stefanich 2011).
Por qué es importante realizar esta revisión
Se necesitan opciones de tratamiento dirigidas a la CU capaces de lograr y mantener la remisión, reducir la dependencia de los esteroides y mantener la inmunocompetencia, a la vez que simultáneamente se evita el riesgo de eventos adversos graves. El objetivo de esta revisión sistemática es resumir las pruebas actualmente disponibles con respecto a la eficacia y la seguridad del etrolizumab para la inducción de la remisión clínica y la respuesta en pacientes con CU moderada a grave.
Objetivos
Los objetivos primarios fueron evaluar la eficacia y la seguridad del etrolizumab para la inducción de la remisión en la colitis ulcerosa.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se consideraron ensayos controlados aleatorios (ECA) para la inclusión. No hubo restricciones con respecto al estado de la publicación o al idioma de la misma.
Tipos de participantes
Pacientes adultos (18 años de edad) con CU activa definida mediante una combinación de criterios clínicos, radiológicos, endoscópicos e histológicos (en la consulta de detección).
Tipos de intervenciones
Se consideraron para inclusión los ECA que compararon etrolizumab con placebo o un comparador activo.
Tipos de medida de resultado
Resultados primarios
La medida de resultado primaria fue la proporción de pacientes que lograron una remisión clínica tal como la definieron los estudios principales y que se expresó como un porcentaje del número total de pacientes asignados al azar (análisis por intención de tratar).
Resultados secundarios
Las medidas de resultado secundarias incluyeron:
a) Mejoría clínica (tal como la definieron los estudios primarios);
b) Remisión endoscópica (tal como la definieron los estudios primarios);
c) Eventos adversos;
d) Eventos adversos graves;
e) Retiro debido a eventos adversos; y
f) Calidad de vida relacionada con la salud (tal como la definieron los estudios primarios).
Results
Description of studies
Results of the search
The literature search conducted on 12 March 2015 identified 97 records. After duplicates were removed, a total of 74 records were screened for inclusion. Of these, 10 studies were selected for full text review. Four studies were excluded (see Characteristics of excluded studies), leaving 6 reports of 2 studies (N = 172) that met the pre‐defined inclusion criteria (see Figure 1).
Included studies
Rutgeerts 2013 was a randomized phase I study (N = 48) consisting of one single ascending dose (SAD) stage and one multiple dose (MD) stage. This study evaluated the safety and pharmacology of etrolizumab in patients with moderate to severe UC. Efficacy outcomes included clinical response (a decrease in Mayo Clinical Score of 3 points plus a 30% reduction from baseline and a ≥ 1 point decrease in rectal bleeding or absolute bleeding score of 0 or 1) and clinical remission at week 10 (defined as the proportion of patients with a Mayo Clinical Score < 2 with no individual subscore > 1). In the SAD stage, patients received placebo (n = 5) or one of the following doses of intravenous (IV) etrolizumab: 0.3 mg/kg (n = 4), 1.0 mg/kg (n = 4), 3.0 mg/kg (n = 4), 10.0 mg/kg (n = 4), or 3.0 mg/kg subcutaneously (n = 4). In the MD stage patients received placebo (n = 5), or one of the following subcutaneous (SC) doses of etrolizumab: 0.5 mg/kg (n = 4), 1.5 mg/kg (n = 5), 3.0 mg/kg (n = 4) or 4.0 mg/kg intravenously (n = 5) every four weeks for three cycles at days 1, 29 and 57. See Characteristics of included studies for further details.
Vermeire 2014 was a double‐blind, placebo‐controlled, randomized, phase II study in which patients with moderate to severe UC who had not responded to conventional therapy were treated with SC etrolizumab at doses of 100 mg (n = 41), or 300 mg plus a loading dose (n = 40) or matched placebo (n = 43). Patients in the 100 mg etrolizumab group received injections at weeks 0, 2, 4 and 8. Patients assigned to the 300 mg dose received an initial injection of 420 mg etrolizumab at week 0, followed by 300 mg at weeks 2, 4 and 8. The primary outcome was achievement of clinical remission at week 10 (defined as the proportion of patients with a Mayo Clinical Score < 2 with no individual subscore > 1). Secondary outcomes included clinical remission at week 6, clinical response, and the achievement of an endoscopic subscore of 0 and a rectal bleeding subscore of 0 at weeks 6 and 10. See Characteristics of included studies for further details.
Excluded studies
Armuzzi 2014, Fiorino 2014, Kreutzkamp 2014 and Lin 2014 were excluded because they were not RCTs.
Ongoing studies
We identified seven ongoing studies (NCT02163759; NCT02171429; NCT02136069; NCT02165215; NCT02118584; NCT02100696; NCT01461317). Five of the ongoing studies are phase III, randomized, double‐blind, placebo‐controlled trials (NCT02163759; NCT02171429; NCT02136069; NCT02165215; NCT02100696). Two of these studies compare the efficacy and safety of etrolizumab to adalimumab in patients with moderate to severe UC who are naive to TNF‐α antagonists (NCT02163759; NCT02171429). One study compares the efficacy and safety of etrolizumab to infliximab in patients who moderate to severe UC who are naive to TNF‐α antagonists. One study compares the efficacy and safety of etrolizumab to placebo for maintenance of UC in patients who are naive to TNF‐α antagonists (NCT02165215). NCT02100696 compares the efficacy and safety of etrolizumab in UC patients who are refractory or intolerant to TNF‐α antagonists. The remaining two ongoing trials are open‐label extension studies for patients with UC who participated in etrolizumab phase III studies (NCT02118584; NCT01461317). See Characteristics of ongoing studies for further details.
Risk of bias in included studies
The risk of bias assessment is summarized in Figure 2. The two included studies were of high methodological quality. Both studies used an interactive voice response system to conduct sequence generation. Both included studies utilized a centralized randomization technique and were rated as low risk of bias for allocation concealment. Although both studies were double‐blind, Rutgeerts 2013 failed to explicitly note whether all patients, assessors and personnel were masked to treatment assignment. As a result, this study was rated as unclear risk of bias for performance and detection bias. The studies used adequate methods to deal with missing data and were rated as low risk of bias for incomplete outcome data. The studies reported results for all a priori outcomes are were both rated as low risk of bias for selective reporting. Both studies were rated as low risk of bias for other sources of bias.
Effects of interventions
Etrolizumab versus placebo
The Rutgeerts 2013 study reported efficacy data for the MD stage. The MD stage involved four different dose groups and both SC and IV dosing. However, Rutgeerts 2013 only reported efficacy results for all etrolizumab dose groups combined. Thus we did not pool efficacy data from the two included studies due to differences in dose and route of administration.
Failure to enter clinical remission at week 6:
Data from one randomized trial were available for this outcome (Vermeire 2014). There was no statistically significant difference in the proportion of patients who failed to enter remission at week six. Ninety‐one per cent (71/78) of patients in the etrolizumab group failed to enter clinical remission compared to 95% (39/41) of placebo patients (RR 0.96, 95% CI 0.87 to 1.06). A subgroup analysis by dose found no statistically significant difference in clinical remission rates between patients treated with 100 mg (RR=0.94, 95% CI 0.82 to 1.09) or 300 mg etrolizumab versus placebo (RR 0.97, 95% CI 0.85 to 1.11). No significant heterogeneity was detected for this comparison (P = 0.80, I2 = 0%).
Failure to enter clinical remission at week 10:
Rutgeerts 2013 reported on clinical remission rates at week 10 among patients in the MD cohort. There was no statistically significant difference in the proportion of patients who failed to enter remission at week 10, Eight‐three per cent (15/18) of etrolizumab patients failed to enter remission compared to 80% (4/5) of placebo patients (RR 1.04, 95% CI 0.64 to 1.69).
Vermeire 2014 also reported on clinical remission rates at week 10. There was a statistically significant difference in clinical remission rates favouring etrolizumab over placebo. After 10 weeks of treatment 85% (66/78) of patients treated with etrolizumab failed to achieve clinical remission compared to 100% (41/41) of patients in the placebo group (RR 0.86, 95% CI 0.77 to 0.95). A GRADE analysis indicated that the overall quality of evidence for this outcome was moderate due to sparse data (107 events, see summary of findings Table for the main comparison). A subgroup analysis by dose found a statistically significant difference in clinical remission rates favoring 100 mg etrolizumab over placebo (RR 0.81 CI 95% 0.68 to 0.96), but not 300 mg etrolizumab over placebo (RR 0.91, 95% CI 0.80 to 1.03). No significant heterogeneity was detected for this comparison (P = 0.28, I2 = 13.5%).
Failure to improve clinically at week 6:
There was no statistically significant difference in clinical response at week 6 (Vermeire 2014). Fifty‐six per cent (44/78) of patients in the etrolizumab group failed to respond at week 6 compared to 66% (27/41) of placebo patients (RR 0.86, 95% CI 0.64 to 1.15). A subgroup analysis by dose did not demonstrate a statistically significant difference in clinical response rates between patients treated with 100 mg (RR 0.79, 95% CI 0.51 to 1.23) or 300 mg etrolizumab versus placebo (RR 0.92, 95% CI 0.62 to 1.36). No significant heterogeneity was detected for this comparison (P = 0.60, I2 = 0%).
Failure to improve clinically at week 10:
Rutgeerts 2013 reported on clinical response rates at week 10 among patients in the MD cohort. There was no statistically significant difference in the proportion of patients who failed to respond at week 10. Thirty‐three per cent (6/18) of etrolizumab patients failed to have a clinical response at week 10 compared to 20% (1/5) of placebo patients (RR 1.67, 95% CI 0.26 to 10.82).
Vermeire 2014 also reported on clinical response rates at week 10. There was no statistically significant difference in clinical response at week 10. Sixty‐eight per cent (53/78) of patients in the etrolizumab group failed to respond at week 10 compared to 71% (29/41) of placebo patients (RR 0.96, 95% CI 0.75 to 1.23). A GRADE analysis indicated that the overall quality of evidence for this outcome was moderate due to sparse data (82 events, see summary of findings Table for the main comparison). A subgroup analysis by dose found no statistically significant difference in clinical response rates between patients treated with 100 mg (RR 0.95, 95% CI 0.66 to 1.37) or 300 mg etrolizumab versus placebo (RR 0.97, 95% CI 0.69 to 1.36). No significant heterogeneity was detected for this comparison (P = 0.95, I2 = 0%).
Failure to enter endoscopic remission at week 6:
There was no statistically significant difference in endoscopic remission rates at week 6 (Vermeire 2014). Ninety‐five per cent (74/78) of patients in the etrolizumab group failed to enter endoscopic remission at week 6 compared to 98% (40/41) of placebo patients (RR 0.98, 95% CI 0.90 to 1.06). A GRADE analysis indicated that the overall quality of evidence for this outcome was moderate due to sparse data (114 events, see summary of findings Table for the main comparison). A subgroup analysis by dose found no statistically significant difference in endoscopic remission rates for patients treated with 100 mg (RR 0.93, 95% CI 0.83 to 1.05) or 300 mg etrolizumab versus placebo (RR 1.02, 95% CI 0.92 to 1.14). No significant heterogeneity was detected for this comparison (P = 0.27, I2 = 18.9%).
Failure to enter endoscopic remission at week 10:
There was no statistically significant difference in endoscopic remission rates at week 10 (Vermeire 2014). Ninety‐one per cent (71/78) of patients in the etrolizumab group failed to enter endoscopic remission at week 10 compared to 100% (41/41) of placebo patients (RR 0.92, 95% CI 0.85 to 1.00). A GRADE analysis indicated that the overall quality of evidence for this outcome was moderate due to sparse data (112 events, see summary of findings Table for the main comparison). A subgroup analysis by dose found no statistically significant difference in endoscopic remission rates for patients treated with 100 mg (RR 0.91, 95% CI 0.80 to 1.03) or 300 mg etrolizumab versus placebo (RR 0.93, 95% CI 0.83 to 1.05). No significant heterogeneity was detected for this comparison (P = 0.76, I2 = 0%).
Adverse Events
Vermeire 2014 and Rutgeerts 2013 reported on the total number of patients who experienced at least one adverse event, the total number of patients who experienced at least one serious adverse event, and the number of patients that withdrew due to adverse events. Initially, we pooled the outcome adverse events, however we decided not to pool this outcome due to high heterogeneity (I2 = 82%). There was no statistically significant difference in the proportion of patients who experienced at least one adverse event in the Rutgeerts 2013 study. Ninety‐five per cent (36/38) of etrolizumab patients had at least one adverse event compared to 100% (10/10) of patients in the placebo group (RR 0.98, 95% CI 0.84 to 1.14). There was a statistically significant difference in the proportion of patients who experienced at least one adverse event in the Vermeire 2014 study. Fifty‐four per cent (44/81) of etrolizumab patients had at least one adverse event compared to 72% per cent (31/43) of patients in the placebo group (RR 0.75, 95% CI 0.57 to 0.99). A GRADE analysis indicated that the overall quality of evidence for this outcome was moderate due to sparse data (75 events, See summary of findings Table for the main comparison). Common adverse events reported in the Rutgeerts 2013 study included exacerbation of UC, headache, fatigue, abdominal pain, dizziness, nasopharyngitis, nausea, arthralgia and urinary tract infection. Common adverse events reported in the Vermeire 2014 study included worsening UC, nasopharyngitis, nervous system disorders, headache and arthralgia.
A pooled analysis of data from Vermeire 2014 and Rutgeerts 2013 (n = 165) indicates that there was no statistically significant difference in the proportion of patients who experienced a serious adverse event. Twelve per cent (14/116) of patients receiving etrolizumab had a serious adverse event compared to 12% (6/49) of patients who received placebo (RR 0.92, 95% CI 0.36 to 2.34). Serious adverse events included exacerbation of UC, impaired wound healing and bacterial peritonitis.
A pooled analysis of data from Vermeire 2014 and Rutgeerts 2013 (n = 165) also indicates that there was no statistically significant difference in the proportion of patients who withdrew due to adverse events. Five per cent (6/116) of etrolizumab patients withdrew due to an adverse event compared to 4% (2/49) of placebo patients (RR 1.09, 95% CI 0.26 to 4.62).
Health‐related quality of life
Neither of the included studies reported on health‐related quality of life as an outcome.
Discusión
Resumen de los resultados principales
El etrolizumab es un anticuerpo monoclonal humanizado que se une selectivamente a la subunidad β7 de las integrinas α4β7 y αEβ7, lo que impide que estos receptores transmembrana interactúen con las MAdCAM‐1 y los ligandos de E‐cadherina, respectivamente. Este proceso bloquea la migración y la retención de leucocitos específicamente dentro de la mucosa intestinal. Dos ensayos controlados aleatorios han estudiado el etrolizumab para la inducción de la remisión en pacientes con CU que presentan enfermedad moderada a grave y en los que el tratamiento convencional ha fracasado. Estaban disponibles para ambos estudios los datos de eficacia y seguridad (Rutgeerts 2013; Vermeire 2014). No se agruparon los datos de eficacia de los dos estudios incluidos debido a las diferencias en la dosis y la vía de administración.
Rutgeerts 2013 informó las tasas de remisión clínica en la cohorte de dosis múltiples a las diez semanas y no encontró diferencias estadísticamente significativas en la eficacia entre etrolizumab y placebo. Sin embargo, este estudio de fase I no tuvo el poder estadístico suficiente para detectar una diferencia en la eficacia, si existiera alguna. Vermeire 2014 informó las tasas de remisión clínica a la semana seis y diez. No hubo diferencias estadísticamente significativas en el fracaso para lograr la remisión clínica a la semana seis entre los grupos de etrolizumab y placebo. Vermeire 2014 encontró una diferencia estadísticamente significativa en las tasas de remisión a las diez semanas a favor de etrolizumab sobre placebo. Los análisis GRADE indicaron que la calidad general de las pruebas que apoyan este resultado fue moderada debido a los datos escasos (107 eventos). El análisis de subgrupos mostró que hubo una diferencia estadísticamente significativa en las tasas de remisión clínica a la semana diez a favor del etrolizumab de 100 mg sobre placebo; sin embargo, no hubo diferencias estadísticamente significativas entre el grupo de etrolizumab de 300 mg y placebo en este resultado. Este hecho indica que una dosis de 100 mg puede ser efectiva para la inducción de la remisión en estos pacientes. Un análisis GRADE indicó que la calidad general de las pruebas que apoyan este resultado fue moderada debido a los escasos datos (51 eventos). Se necesitan más estudios de investigación para determinar la dosis óptima de etrolizumab. Con respecto a la respuesta clínica,Vermeire 2014 informó las tasas de respuesta clínica a la semana seis y diez y Rutgeerts 2013 informó las tasas de respuesta a la semana diez. No hubo diferencias estadísticamente significativas en las tasas de respuesta entre los grupos de etrolizumab y placebo a la semana seis. Rutgeerts 2013 no encontró diferencias en las tasas de respuesta clínica a la semana diez. Asimismo, Vermeire 2014 no encontró diferencias estadísticamente significativas en la respuesta clínica a la semana diez entre los pacientes tratados con etrolizumab versus placebo. Un análisis GRADE indicó que la calidad general de las pruebas que apoyan este resultado fue moderada debido a los escasos datos (107 eventos).
Rutgeerts 2013 no encontró diferencias estadísticamente significativas entre etrolizumab y placebo en la proporción de pacientes que experimentaron al menos un evento adverso. Sin embargo, Vermeire 2014 encontró que los pacientes del grupo placebo tuvieron significativamente más probabilidades que los pacientes que recibieron etrolizumab de experimentar al menos un evento adverso. Un análisis GRADE indicó que la calidad general de las pruebas que apoyan este resultado fue moderada debido a los escasos datos (121 eventos). Los eventos adversos frecuentes informados porRutgeerts 2013 incluyeron exacerbación de la CU, cefalea, fatiga, dolor abdominal, mareos, nasofaringitis, náuseas, artralgia e infección urinaria. Los eventos adversos frecuentes informados por Vermeire 2014 incluyeron empeoramiento de la CU, nasofaringitis, trastornos del sistema nervioso, cefalea y artralgia. Aunque el etrolizumab demostró un perfil de seguridad aceptable en los dos estudios incluidos, el número de pacientes investigados no permitió la evaluación de eventos adversos poco frecuentes. Los dos estudiosRutgeerts 2013y Vermeire 2014 no encontraron diferencias estadísticamente significativas en el número de retiros debido a eventos adversos o en el número de eventos adversos graves experimentados por los pacientes en los grupos de etrolizumab y placebo. Los análisis GRADE indicaron que la calidad general de las pruebas que apoyaron estos resultados fue baja debido a los datos muy escasos (ocho y 20 eventos respectivamente). Los eventos adversos graves informados en los estudios incluyeron exacerbación de la CU, deterioro de la cicatrización de la herida y peritonitis bacteriana.
Compleción y aplicabilidad general de las pruebas
Los resultados de esta revisión son aplicables a los pacientes con CU moderada a grave en los que el tratamiento convencional ha fracasado. Pruebas de calidad moderada indican que el etrolizumab puede ser efectivo para el tratamiento de la CU moderada a grave en los pacientes en los que el tratamiento convencional ha fracasado. Sin embargo, ambos estudios incluidos fueron de tamaño relativamente pequeño, por lo que los números de eventos para los resultados fueron reducidos. Se necesitan estudios de investigación adicionales para confirmar la eficacia, la seguridad y la dosis óptima de etrolizumab en estos pacientes. El etrolizumab podría ofrecer una opción adicional para los pacientes en los que fracasan los antagonistas de FNT‐α. Actualmente hay cinco ensayos de fase III del etrolizumab que incluyen a pacientes que no responden o no toleran el tratamiento con antagonistas del FNT‐α (NCT02100696; NCT02136069; NCT02163759; NCT02165215; NCT02171429), y dos estudios de extensión abiertos que investigan la seguridad a largo plazo del etrolizumab(NCT01461317; NCT02118584). Aunque se necesitan más pruebas, el etrolizumab podría tener la posibilidad de repercutir significativamente sobre el tratamiento de la CU, en particular entre los pacientes que no responden al tratamiento con antagonistas del FNT‐α.
Calidad de la evidencia
Ambos estudios incluidos se consideraron de bajo riesgo de sesgo. Rutgeerts 2013 se consideró con riesgo incierto de sesgo para el cegamiento y el sesgo de realización. Los análisis GRADE indicaron que la calidad general de las pruebas que apoyaron los resultados primarios se consideró moderada debido a los datos escasos (es decir, < 400 eventos). Los resultados secundarios respuesta clínica y remisión endoscópica también se consideraron de calidad moderada debido a los datos escasos. Los resultados de seguridad se consideraron de baja calidad debido a los datos escasos y la heterogeneidad.
Sesgos potenciales en el proceso de revisión
Se realizó una búsqueda exhaustiva de la literatura para reducir el sesgo potencial e identificar todos los estudios elegibles. Dos autores de la revisión evaluaron de forma independiente los estudios para la inclusión y calificaron su calidad. Hay varias limitaciones a esta revisión. Los estudios que investigaron el etrolizumab fueron pequeños, por lo que solamente podían detectar efectos grandes y eventos adversos frecuentes. Además, no fue posible agrupar todos los grupos para el análisis debido a que uno de los dos ensayos incluidos fue un estudio de búsqueda de dosis, lo que disminuye el poder estadístico. Los estudios en curso sobre el etrolizumab para la CU probablemente proporcionarán más información sobre la seguridad y la eficacia de este fármaco (ver Características de los estudios en curso).
Acuerdos y desacuerdos con otros estudios o revisiones
El etrolizumab es un agente terapéutico relativamente nuevo para la colitis ulcerosa. Hasta donde se conoce, no hay otra revisión sistemática que evalúe la eficacia y la seguridad de este agente.

Study flow diagram.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Etrolizumab versus placebo, Outcome 1 Failure to enter clinical remission at week 6.
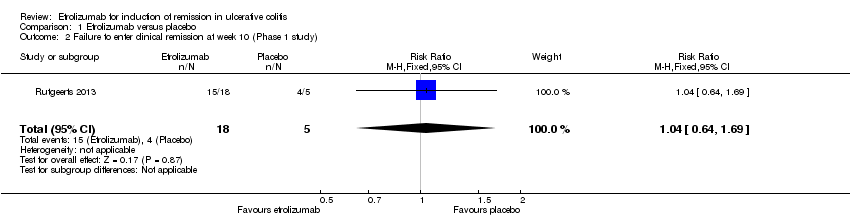
Comparison 1 Etrolizumab versus placebo, Outcome 2 Failure to enter clinical remission at week 10 (Phase 1 study).
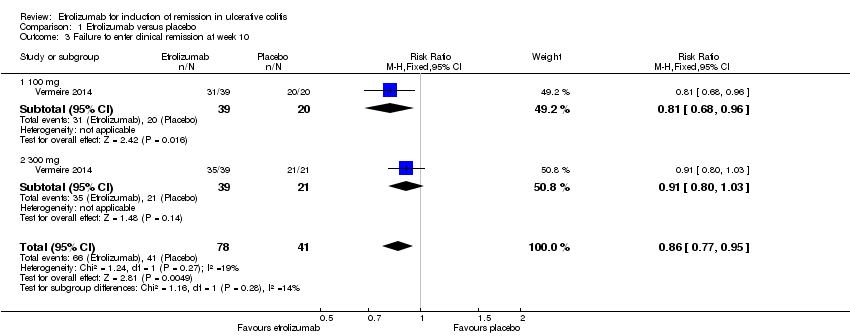
Comparison 1 Etrolizumab versus placebo, Outcome 3 Failure to enter clinical remission at week 10.
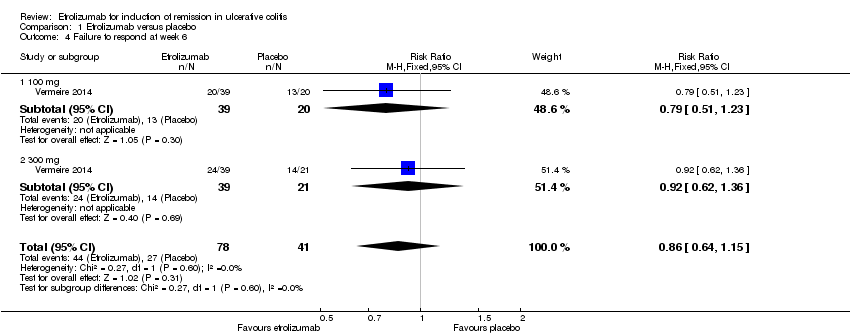
Comparison 1 Etrolizumab versus placebo, Outcome 4 Failure to respond at week 6.

Comparison 1 Etrolizumab versus placebo, Outcome 5 Failure to respond at week 10 (Phase 1 study).

Comparison 1 Etrolizumab versus placebo, Outcome 6 Failure to respond at week 10.
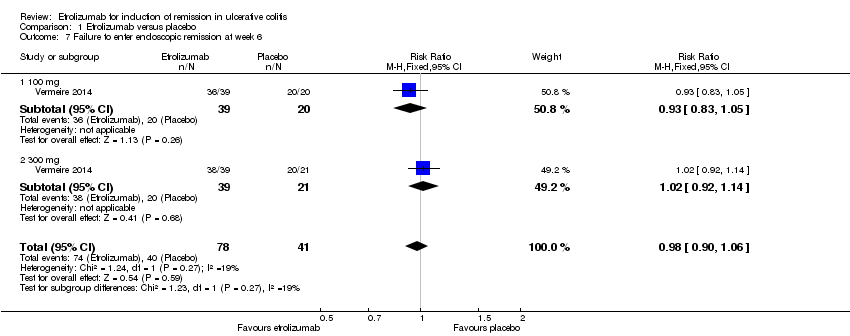
Comparison 1 Etrolizumab versus placebo, Outcome 7 Failure to enter endoscopic remission at week 6.
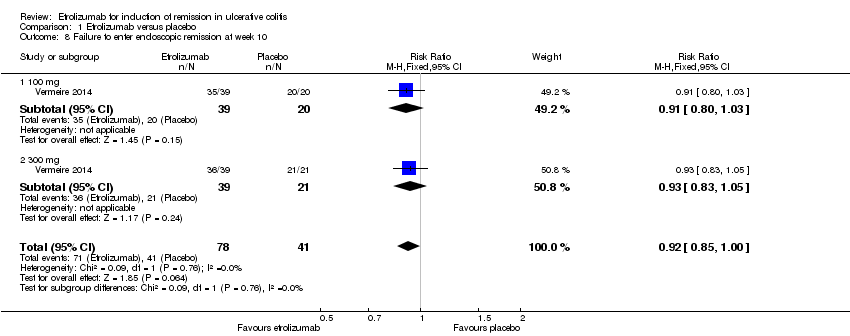
Comparison 1 Etrolizumab versus placebo, Outcome 8 Failure to enter endoscopic remission at week 10.

Comparison 1 Etrolizumab versus placebo, Outcome 9 Adverse events.
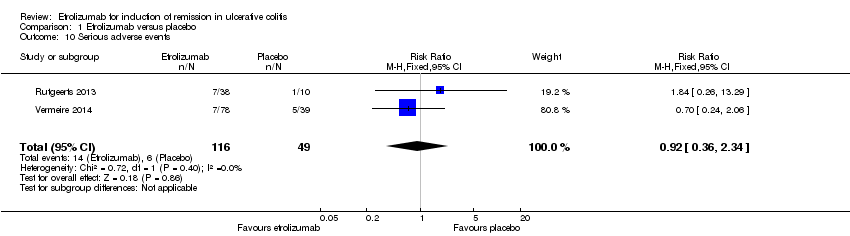
Comparison 1 Etrolizumab versus placebo, Outcome 10 Serious adverse events.

Comparison 1 Etrolizumab versus placebo, Outcome 11 Withdrawal due to adverse events.
| Etrolizumab versus placebo for induction of remission in ulcerative colitis | ||||||
| Patient or population: patients with induction of remission in ulcerative colitis | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Etrolizumab versus placebo | |||||
| Failure to enter clinical remission at week 10 | 1000 per 10001 | 860 per 1000 | RR 0.86 | 119 | ⊕⊕⊕⊝ | |
| Failure to enter clinical remission at week 10 ‐ 100 mg | 1000 per 10001 | 810 per 1000 | RR 0.81 | 59 | ⊕⊕⊕⊝ | |
| Failure to respond at week 10 | 707 per 10001 | 679 per 1000 | RR 0.96 | 119 | ⊕⊕⊕⊝ | |
| Failure to enter endoscopic remission at week 6 | 976 per 10001 | 956 per 1000 | RR 0.98 | 119 | ⊕⊕⊕⊝ | |
| Failure to enter endoscopic remission at week 10 | 1000 per 10001 | 920 per 1000 | RR 0.92 | 119 | ⊕⊕⊕⊝ | |
| Adverse events | 721 per 10001 | 541 per 1000 | RR 0.75 | 124 | ⊕⊕⊕⊝ | |
| Serious adverse events | 122 per 10001 | 113 per 1000 | RR 0.92 | 165 | ⊕⊕⊝⊝ | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Control group risk estimates come from control arm of meta‐analysis, based on included trials. 2 Downgraded one level due to sparse data (107 events). 3 Downgraded one level due to sparse data (51 events). 4 Downgraded one level due to sparse data (82 events). 5 Downgraded one level due to sparse data (114 events). 6 Downgraded one level due to sparse data (112 events). 7Downgraded one level due to sparse data (75 events). 8 Downgraded two levels due to very sparse data (20 events). | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Failure to enter clinical remission at week 6 Show forest plot | 1 | 119 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.96 [0.87, 1.06] |
| 1.1 100 mg | 1 | 59 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.94 [0.82, 1.09] |
| 1.2 300 mg | 1 | 60 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.97 [0.85, 1.11] |
| 2 Failure to enter clinical remission at week 10 (Phase 1 study) Show forest plot | 1 | 23 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.04 [0.64, 1.69] |
| 3 Failure to enter clinical remission at week 10 Show forest plot | 1 | 119 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.86 [0.77, 0.95] |
| 3.1 100 mg | 1 | 59 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.81 [0.68, 0.96] |
| 3.2 300 mg | 1 | 60 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.91 [0.80, 1.03] |
| 4 Failure to respond at week 6 Show forest plot | 1 | 119 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.86 [0.64, 1.15] |
| 4.1 100 mg | 1 | 59 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.79 [0.51, 1.23] |
| 4.2 300 mg | 1 | 60 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.62, 1.36] |
| 5 Failure to respond at week 10 (Phase 1 study) Show forest plot | 1 | 23 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.67 [0.26, 10.82] |
| 6 Failure to respond at week 10 Show forest plot | 1 | 119 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.96 [0.75, 1.23] |
| 6.1 100 mg | 1 | 59 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.95 [0.66, 1.37] |
| 6.2 300 mg | 1 | 60 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.97 [0.69, 1.36] |
| 7 Failure to enter endoscopic remission at week 6 Show forest plot | 1 | 119 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.98 [0.90, 1.06] |
| 7.1 100 mg | 1 | 59 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.93 [0.83, 1.05] |
| 7.2 300 mg | 1 | 60 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.02 [0.92, 1.14] |
| 8 Failure to enter endoscopic remission at week 10 Show forest plot | 1 | 119 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.85, 1.00] |
| 8.1 100 mg | 1 | 59 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.91 [0.80, 1.03] |
| 8.2 300 mg | 1 | 60 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.93 [0.83, 1.05] |
| 9 Adverse events Show forest plot | 2 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 10 Serious adverse events Show forest plot | 2 | 165 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.36, 2.34] |
| 11 Withdrawal due to adverse events Show forest plot | 2 | 165 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.09 [0.26, 4.62] |

