Análogos de insulina de acción rápida subcutáneos para la cetoacidosis diabética
Resumen
Antecedentes
La cetoacidosis diabética (CAD) es una complicación aguda y potencialmente mortal de la diabetes no controlada que se presenta principalmente en los individuos con diabetes tipo 1 autoinmune, pero no es poco frecuente en algunos pacientes con diabetes tipo 2. El tratamiento de la CAD se realiza tradicionalmente mediante la administración de infusión intravenosa de insulina regular que se inicia en el departamento de urgencias y se continúa en la unidad de cuidados intensivos o un ambiente de unidad de alta dependencia. No está claro si los pacientes con CAD deben ser tratados con otras formas de tratamiento como los análogos de insulina de acción rápida subcutáneos.
Objetivos
Evaluar los efectos de los análogos de insulina de acción rápida subcutáneos para el tratamiento de la cetoacidosis diabética.
Métodos de búsqueda
Se identificaron ensayos elegibles mediante búsquedas en MEDLINE, PubMed, EMBASE, LILACS, CINAHL y en la Cochrane Library. Se hicieron búsquedas en los registros de ensayos WHO ICTRP Search Portal y ClinicalTrials.gov. La fecha de la última búsqueda para todas las bases de datos fue 27 de octubre 2015. También se examinaron las listas de referencias de los ensayos controlados aleatorios (ECA) y revisiones sistemáticas incluidos y se estableció contacto con los autores de los ensayos.
Criterios de selección
Los ensayos se incluyeron si fueron ECA que compararan los análogos de insulina de acción rápida subcutáneos versus infusión intravenosa estándar en participantes con CAD de cualquier edad o sexo con diabetes tipo 1 o tipo 2 y en pacientes embarazadas.
Obtención y análisis de los datos
Dos autores de la revisión de forma independiente extrajeron los datos, evaluaron el riesgo de sesgo de los estudios y la calidad general de los mismos mediante el instrumento GRADE. La heterogeneidad estadística de los estudios incluidos se evaluó mediante la inspección visual de los diagramas de bosque y la diversidad se cuantificó mediante la estadística I². Los datos se sintetizaron mediante el metanálisis con el modelo de efectos aleatorios o el análisis descriptivo, según fuera apropiado.
Resultados principales
Cinco ensayos asignaron al azar a 201 participantes (110 participantes a análogos de insulina de acción rápida subcutáneos y 91 a insulina regular intravenosa). Los criterios para la CAD fueron consistentes con los criterios de la American Diabetes Association para la CAD leve o moderada. La causa subyacente de CAD fue principalmente el cumplimiento deficiente del tratamiento de la diabetes. La mayoría de los ensayos no informó el tipo de diabetes. Los participantes con diabetes más jóvenes y los niños estuvieron subrepresentados en los ensayos incluidos (un ensayo solamente). Cuatro ensayos evaluaron los efectos del análogo de insulina de acción rápida lispro, y uno los efectos del análogo de insulina de acción rápida aspart. El período de seguimiento medio medido según la estancia hospitalaria media varió entre dos y siete días. En general, el riesgo de sesgo de los ensayos evaluados fue incierto en muchos dominios y alto para el sesgo de realización para la medida de resultado tiempo hasta la resolución de la CAD.
No se informaron muertes en los ensayos incluidos (186 participantes; tres ensayos; pruebas de calidad moderada [insulina lispro] a baja [insulina aspart]). Hubo pruebas de calidad muy baja para evaluar los efectos de la insulina lispro subcutánea versus la insulina regular intravenosa sobre el tiempo hasta la resolución de la CAD: diferencia de medias (DM) 0,2 horas; IC del 95%: ‐1,7 a 2,1; P = 0,81; 90 participantes; dos ensayos. En un ensayo que incluyó a niños con CAD, el tiempo para alcanzar un nivel de glucosa de 250 mg/dl fue similar entre la insulina lispro y la insulina regular intravenosa. Hubo pruebas de calidad muy baja para evaluar los efectos de la insulina aspart subcutánea versus la insulina regular intravenosa sobre el tiempo hasta la resolución de la CAD: DM ‐1 hora (IC del 95%:‐3,2 a 1,2); P = 0,36; 30 participantes; un ensayo. Hubo pruebas de baja calidad para evaluar los efectos de los análogos de insulina de acción rápida subcutáneos versus la insulina regular intravenosa sobre los episodios de hipoglucemia: seis de 80 participantes tratados con insulina lispro en comparación con nueve de 76 participantes tratados con insulina regular informaron eventos hipoglucémicos; cociente de riesgos (CR) 0,59 (IC del 95%: 0,23 a 1,52); P = 0,28; 156 participantes; cuatro ensayos. Para la insulina aspart en comparación con la insulina regular, el CR para los episodios de hipoglucemia fue 1,00 (IC del 95%: 0,07 a 14,55); P = 1,0; 30 participantes; un ensayo; pruebas de baja calidad. Los efectos socioeconómicos medidos según la duración media de la estancia hospitalaria para la insulina lispro en comparación con la insulina regular mostraron una DM de ‐0,4 días (IC del 95%: ‐1 a 0,2); P = 0,22; 90 participantes; dos ensayos; pruebas de baja calidad y para la insulina aspart en comparación con la insulina regular 1,1 días (IC del 95%: ‐3,3 a 1,1); P = 0,32; pruebas de baja calidad. Los datos sobre la morbilidad fueron limitados, pero no se informaron eventos específicos para la comparación de la insulina lispro con la insulina regular. Ningún ensayo informó eventos adversos diferentes de los episodios de hipoglucemia, y ningún ensayo investigó la satisfacción del paciente.
Conclusiones de los autores
Esta revisión, que proporcionó principalmente datos sobre adultos, indica sobre la base de pruebas en general de calidad baja a muy baja que no hay ventajas ni desventajas cuando se comparan los efectos de los análogos de insulina de acción rápida subcutáneos versus la insulina regular intravenosa para tratar la CAD leve o moderada.
PICO
Resumen en términos sencillos
Análogos de insulina de acción rápida subcutáneos para la cetoacidosis diabética
Pregunta de la revisión
¿Cómo se comparan los efectos de los análogos de insulina de acción rápida subcutáneos con la infusión intravenosa estándar de insulina regular para el tratamiento de la cetoacidosis diabética?
Antecedentes
Los análogos de insulina de acción rápida (insulina artificial como insulina lispro, insulina aspart, o insulina glulisina) actúan más rápidamente que la insulina regular humana. En los pacientes con un tipo específico de coma diabético potencialmente mortal debido a la diabetes no controlada, llamado cetoacidosis diabética, la administración inmediata de insulina regular intravenosa es el tratamiento estándar. Los análogos de insulina de acción rápida, si se inyectan por vía subcutánea, actúan más rápido que la insulina regular administrada por la misma vía. De ese modo se puede evitar la necesidad de una infusión intravenosa continua, una intervención que generalmente requiere el ingreso a una unidad de cuidados intensivos. Lo anterior significa que los análogos de insulina administrados subcutáneamente para la cetoacidosis diabética se podrían aplicar en el departamento de urgencias y en una sala de medicina general.
Características de los estudios
Se encontraron cinco ensayos controlados aleatorios (estudios clínicos en los que los participantes se asignan al azar a uno de dos o más grupos de tratamiento) con un total de 201 participantes. La mayoría de los ensayos no informó el tipo de diabetes. Los participantes con diabetes más jóvenes y los niños estuvieron subrepresentados en los ensayos incluidos (un ensayo solamente). Los participantes de cuatro ensayos recibieron tratamiento con insulina lispro, y un ensayo con 45 participantes investigó la insulina aspart. El seguimiento promedio medido según la estancia hospitalaria media varió entre dos y siete días. Los autores de los estudios calificaron la cetoacidosis diabética que fue tratada con análogos de insulina o insulina regular como leve o moderada. Estas pruebas se actualizaron en octubre 2015.
Resultados clave
Los resultados de esta revisión son muy relevantes para los adultos con cetoacidosis diabética leve o moderada debido al subtratamiento de la diabetes. No se produjeron muertes. El tiempo hasta la resolución de la cetoacidosis diabética desde el principio del tratamiento no difirió de manera significativa entre los dos esquemas de tratamiento con insulina (aproximadamente 11 horas). Los episodios de hipoglucemia (azúcar sanguíneo baja) fueron equivalentes: 118 por 1000 participantes con insulina intravenosa se compararon con 70 por 1000 participantes con insulina lispro subcutánea (sin diferencias estadísticamente significativas). La duración media de la estancia hospitalaria tampoco mostró diferencias pronunciadas. Ningún ensayo informó efectos secundarios diferentes de los episodios de hipoglucemia ni investigó la satisfacción del paciente. No se observaron eventos graves asociados con la cetoacidosis diabética durante el tratamiento con insulina lispro.
Calidad de la evidencia
Los resultados fueron limitados en general por las pruebas de calidad baja a muy baja, principalmente porque el número de ensayos y de participantes incluidos fue bajo. Es muy probable que la investigación adicional tenga un impacto importante en los resultados.
Conclusiones de los autores
Summary of findings
| Subcutaneous insulin lispro versus intravenous regular insulin for diabetic ketoacidosis | ||||||
| Patient: participants with diabetic ketoacidosis | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Intravenous regular insulin | Subcutaneous insulin lispro | |||||
| All‐cause mortality (N) Mean hospital stay: 2‐7 days | See comment | See comment | Not estimable | 156 (4) | ⊕⊕⊕⊝ | No deaths reported |
| Hypoglycaemic episodes (N) Mean hospital stay: 2‐7 days | 118 per 1000 | 70 per 1000 | RR 0.59 | 156 (4) | ⊕⊕⊝⊝ | Comparable risk ratios for adults (4 trials) and children (1 trial) |
| Morbidity (N) Mean hospital stay: 2‐7 days | See comment | See comment | Not estimable | 96 (2) | See comment | No cases of cerebral oedema, venous thrombosis, adult respiratory distress syndrome, hyperchloraemic acidosis |
| Adverse events other than hypoglycaemic episodes | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Time to resolution of diabetic ketoacidosis (h) Mean hospital stay: 2‐4 days | The mean time to resolution of diabetic ketoacidosis across the intravenous regular insulin groups was 11 h | The mean time to resolution of diabetic ketoacidosis in the subcutaneous insulin lispro groups was 0.2 h higher (1.7 h lower to 2.1 h higher) | ‐ | 90 (2) | ⊕⊝⊝⊝ | Metabolic acidosis and ketosis took longer to resolve in the subcutaneous insulin lispro group in 1 trial (60 children); no exact data published |
| Patient satisfaction | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Socioeconomic effects: length of hospital stay (days) Mean hospital stay: 4‐7 days | The mean length of hospital stay in the intravenous regular insulin groups ranged between 4 and 6.6 days | The mean length of hospital stay in the subcutaneous insulin lispro groups was 0.4 days shorter (1 day shorter to 0.2 days longer) | ‐ | 90 (2) | ⊕⊕⊝⊝ | US setting: treatment of diabetic ketoacidosis in a non–intensive care setting (step‐down unit or general medicine ward) was associated with a 39% lower hospitalisation charge than was treatment with intravenous regular insulin in the intensive care unit (USD 8801 (SD USD 5549) vs USD 14,429 (SD USD 5243); the average hospitalisation charges per day were USD 3981 (SD USD 1067) for participants treated in an intensive care unit compared with USD 2682 (SD USD 636) for those treated in a non–intensive care setting |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| *Assumed risk was derived from the event rates in the comparator groups. | ||||||
| Subcutaneous insulin aspart versus intravenous regular insulin for diabetic ketoacidosis | ||||||
| Patient: participants with diabetic ketoacidosis | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Intravenous regular insulin | Subcutaneous insulin aspart | |||||
| All‐cause mortality (N) Mean hospital stay: 3‐5 days | See comment | See comment | Not estimable | 45 (1) | ⊕⊕⊝⊝ | No deaths reported |
| Hypoglycaemic episodes (N) Mean hospital stay: 3‐5 days | 67 per 1000 | 67 per 1000 | RR 1.00 | 30 (1) | ⊕⊕⊝⊝ | ‐ |
| Morbidity | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Adverse events other than hypoglycaemic episodes | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Time to resolution of diabetic ketoacidosis (h) Mean hospital stay: 3‐5 days | The mean time to resolution of diabetic ketoacidosis across the intravenous regular insulin groups was 11 h | The mean time to resolution of diabetic ketoacidosis in the subcutaneous insulin aspart group was 1 h lower (3.2 h lower to 1.2 h higher) | ‐ | 30 (1) | ⊕⊝⊝⊝ | ‐ |
| Patient satisfaction | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Socioeconomic effects: length of hospital stay (days) Mean hospital stay: 3‐5 days | The mean length of hospital stay in the intravenous regular insulin group was 4.5 days | The mean length of hospital stay in the subcutaneous insulin aspart group was 1.1 days shorter (3.3 days shorter to 1.1 days longer) | ‐ | 30 (1) | ⊕⊕⊝⊝ | ‐ |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| *Assumed risk was derived from the event rates in the comparator groups | ||||||
Antecedentes
Descripción de la afección
La diabetes mellitus es un trastorno metabólico que se origina de un defecto en la secreción de insulina, la acción de la insulina o ambas. Una consecuencia de esta enfermedad es la hiperglicemia crónica (niveles elevados de glucosa en plasma) con trastornos en el metabolismo de carbohidratos, grasas y proteínas. Entre las complicaciones a largo plazo de la diabetes mellitus, se encuentran la retinopatía, la nefropatía y la neuropatía. Aumenta el riesgo de enfermedades cardiovasculares. Los individuos con diabetes puede ser ingresados en el hospital debido a emergencias diabéticas como la cetoacidosis diabética (CAD) o el estado hiperglicémico hiperosmolar (EHH). La CAD es una complicación aguda, grave y potencialmente mortal de la diabetes que se presenta principalmente en los individuos con diabetes tipo 1 autoinmune, pero no es poco frecuente en algunos pacientes con diabetes tipo 2(Kitabchi 2009). La CAD y el EHH representan las consecuencias más extremas de la diabetes mellitus no controlada.
En los EE.UU., la tasa de incidencia para la CAD varía de 4,6 a ocho episodios por 1000 pacientes con diabetes de todas las edades, y 13,4 episodios por 1000 pacientes con diabetes que son más jóvenes de 30 años de edad (Faich 1983; Johnson 1980). La tasa de incidencia en los EE.UU. es comparable a las tasas en Europa, con cálculos de 13,6 por 1000 pacientes con diabetes tipo 1 en el Reino Unido (Dave 2004). La tasa de mortalidad por CAD actualmente varía del 0% al 19%, una tasa que ha mostrado poca disminución en años recientes(Basu 1993; Warner 1998). Las tasas de mortalidad aumentan de manera significativa con la edad y en presencia de enfermedades potencialmente mortales concomitantes como las enfermedades del riñón e infecciones coexistentes (Malone 1992). Las crisis hiperglicémicas también son económicamente costosas, ya que la CAD es responsable de más de 500 000 días hospital por año, para un cálculo anual de gastos médicos directos y costos indirectos de USD 2 400 000 000 (Kim 2007).
El mecanismo básico para el desarrollo de la CAD es una reducción de la concentración eficaz de insulina y un aumento de las hormonas antirreguladoras (catabólico o por estrés) como glucagón, catecolamina, cortisol y somatotropina. La hiperglucemia de la CAD se debe a un aumento en la producción de glucosa hepática (gluconeogénesis y glucogenólisis) y una deficiencia en la utilización de la glucosa periférica. Los cuerpos cetónicos son resultado de un aumento marcado de la liberación de ácidos grasos de los adipocitos, lo que da lugar a un cambio hacia la síntesis de cuerpos cetónicos en el hígado. Este desajuste hormonal conduce a la tríada bioquímica de la CAD: hiperglucemia, cetonemia y acidemia (Kitabchi 2001). Los pacientes con CAD tienen invariablemente el volumen agotado porque la deficiencia de insulina en la CAD provoca diuresis osmótica hiperglicémica e hipovolemia progresiva. La glucosuria también está acompañada de pérdidas urinarias grandes de potasio y fósforo. Los procesos anteriores pueden tener varias consecuencias, que incluyen hipoxia tisular, hiperviscosidad, arritmia y reducción del flujo sanguíneo a órganos diana como el cerebro.
El tratamiento exitoso de la CAD requiere de la corrección de la hiperglucemia, el ajuste cuidadoso de los líquidos y los electrólitos, la identificación de eventos desencadenantes concomitantes, y sobre todo la monitorización frecuente y estricta del paciente(Kitabchi 2009). El tratamiento de la cetoacidosis diabética se realiza tradicionalmente mediante la administración de infusión intravenosa de insulina regular, que se inicia en el departamento de urgencias y se continua en una unidad de cuidados intensivos (UCI) o un ambiente de unidad de alta dependencia, como recomienda la American Diabetes Association y la guía de las Joint British Diabetes Societies para el tratamiento de la CAD (Kitabchi 2009; Savage 2011).
Descripción de la intervención
La primera prioridad en el tratamiento de la CAD es reponer el volumen intravascular para normalizar la perfusión tisular y ayudar al suministro de insulina a los órganos diana. La administración de insulina es fundamental en el tratamiento y se inicia de inmediato, a menos que haya pruebas de hipovolemia o hipopotasemia grave. El tratamiento con insulina disminuye la concentración sérica de glucosa principalmente por la reducción de la producción de glucosa hepática en lugar de mejorar la utilización periférica (Luzi 1988), disminuye la producción cetónica (al reducir la lipólisis y la secreción de glucagón) y puede aumentar la depuración cetónica. La administración de insulina intenta restaurar la captación normal de glucosa por las células; sin embargo, se debe evitar la administración excesiva de insulina para prevenir la hipoglucemia y la hipopotasemia.
La vía de administración de la insulina en el tratamiento de la CAD se ha debatido desde principios de los años setenta. Alberti 1973 informó los resultados de la insulina intramuscular a dosis baja en el tratamiento de los pacientes con CAD. Encontraron que una dosis en bolo inicial promedio de 16 unidades seguida de 5 a 10 unidades de insulina regular intramuscular por hora fue eficaz para corregir la hiperglucemia y la acidemia. Posteriormente, en los años setenta Fisher y colegas informaron una mayor disminución en la glucemia y los niveles de cuerpos cetónicos en las primeras dos horas de tratamiento con insulina intravenosa en comparación con la insulina intramuscular o subcutánea(Fisher 1977). Además, la deshidratación y estado de shock de los pacientes con CAD da lugar a la absorción errática e impredecible de la insulina intramuscular y subcutánea (Fisher 1977). Sobre la base de este resultado, actualmente se acepta en general que la infusión intravenosa continua es la vía más eficaz de administración de la insulina(Savage 2011).
Los ensayos controlados aleatorios en pacientes con CAD han mostrado que el tratamiento con insulina es eficaz, independientemente de la vía de administración. El tratamiento con análogos de insulina de acción rápida subcutáneos administrado cada una a dos horas ha mostrado ser una alternativa eficaz a la administración de insulina regular intravenosa en el tratamiento de la CAD no complicada (Umpierrez 2004a; Umpierrez 2004b). En uno de estos ensayos, los autores encontraron que los efectos en los pacientes tratados con insulina lispro subcutánea fueron comparables a los de los pacientes tratados con insulina regular intravenosa. Los autores observaron tasas similares de muerte, duración de la estancia hospitalaria y cantidad de insulina administrada hasta la resolución de la CAD entre los grupos de tratamiento. El tratamiento de la CAD en la UCI se asoció con costos de hospitalización 39% mayores en comparación con los del tratamiento con lispro subcutáneo en un contexto de cuidados no intensivos (Umpierrez 2004b).
Efectos adversos de la intervención
La hipoglucemia es un efecto adverso inherente del tratamiento con insulina. Además, el tratamiento con insulina se asocia con reacciones en el sitio de la inyección, reacciones de hipersensibilidad generalizadas y desequilibrios electrolíticos como hipopotasemia. Se ha expresado preocupación con respecto a los posibles efectos mitogénicos de los análogos de la insulina, aunque las pruebas son contradictorias (Hemkens 2009; Kurtzhals 2000). La insulina lispro y la insulina aspart, como la insulina humana, se califican de categoría B para la administración en el embarazo, lo que significa que se carece de ensayos bien controlados en las pacientes embarazadas, mientras que la insulina glulisina es categoría C porque solamente se han realizado estudios de reproducción animal (Home 2012).
De qué manera podría funcionar la intervención
Durante la última década se ha prestado considerable atención al desarrollo de análogos de la insulina con perfiles farmacocinéticos que difieren de las preparaciones de insulina existentes. En comparación con la insulina regular humana, la prolina en la posición 28 y la lisina en la posición 29 de la región B se intercambiaron en el análogo de insulina de acción rápida lispro. En el análogo de insulina de acción rápida aspart, la prolina en la posición 28 de la región B fue reemplazada por el ácido aspártico y en el análogo de insulina de acción corta glulisina, el aminoácido asparagina fue reemplazado por la lisina en la posición tres y la lisina con el ácido glutámico en la posición 29 de la cadena B (Siebenhofer 2006). La insulina lispro, la insulina aspart y la insulina glulisina tienen perfiles farmacocinéticos muy similares. Estos análogos están presentes en forma monomérica o en una forma hexamérica muy débilmente ligada. Después de la inyección subcutánea se absorben rápidamente en menos de 30 minutos, con un tiempo máximo corto de concentración de insulina de una hora y una duración de la acción más corta de tres a cuatro horas en comparación con la insulina regular humana (Roach 2008).
Los datos sobre los análogos de insulina de acción rápida en ensayos clínicos (no en la CAD) indican variaciones inferiores en la glucosa posprandial en comparación con la insulina humana para las comidas en adultos y niños, y en la diabetes tipo 1 y tipo 2(Home 2000; Mathiesen 2007; Rayman 2007). La disminución en la incidencia de la hipoglucemia grave que requiere asistencia de terceros, en particular en la hipoglucemia nocturna grave, es la consecuencia esperada del tiempo de disponibilidad subcutánea más corto de los análogos de insulina de acción rápida. En los pacientes con diabetes tipo 1, la incidencia mediana de hipoglucemia grave para los análogos de acción rápida es 21,8 episodios por 100 persona‐años en comparación con 46,1 episodios para la insulina humana (Siebenhofer 2006). En los pacientes con diabetes tipo 2, la incidencia mediana es 0,3 episodios por 100 persona‐años para los análogos en comparación con una media de 1,4 episodios por 100 persona‐años para la insulina humana (Siebenhofer 2006).
El perfil farmacocinético de los análogos de acción rápida después de la inyección subcutánea indica que quizás sean una alternativa factible en el caso de la CAD, es decir, tienen un ascenso más rápido de la concentración en plasma, una concentración máxima mayor y un tiempo más corto de residencia subcutánea que la insulina humana no modificada (Howey 1995).
Por qué es importante realizar esta revisión
Como una opción a la infusión intravenosa de insulina regular, los pacientes con CAD leve a moderado pueden ser tratados con análogos de insulina de acción rápida subcutáneos, lo que ofrece la oportunidad de evitar ingresos costosos (Kitabchi 2009; Nyenwe 2011; Nyenwe 2011; Umpierrez 2004b). La prestación de atención médica sin la monitorización constante del enfermo (por ejemplo, fuera de los contextos de UCI) indudablemente reducirá el costo. Además, los pacientes estables podrían ser tratados en una unidad de cuidados intensivos subagudos cerca de sus familiares.
Se han publicado dos revisiones sistemáticas que compararon los análogos de insulina de acción rápida con la infusión intravenosa de insulina regular en el tratamiento de la CAD leve a moderada (Mazer 2009; Vincent 2013). Aunque ambas revisiones brindan un resumen de los estudios localizados, existen algunas limitaciones. En primer lugar, el alcance de las búsquedas sistemáticas de bibliografía fue subóptimo. La búsqueda bibliográfica en Vincent 2013 estuvo limitada exclusivamente a la base de datos PubMed. En segundo lugar, las evaluaciones del riesgo de sesgo de los estudios no se especificaron(Mazer 2009; Vincent 2013).
Debido a las limitaciones de las revisiones sistemáticas anteriores, se planificó utilizar la metodología y los criterios específicos esbozados por Cochrane con el objetivo de presentar una revisión sistemática integral para evaluar la eficacia y la seguridad de los análogos de insulina de acción rápida subcutáneos en el tratamiento de la CAD en adultos y niños.
Objetivos
Evaluar los efectos de los análogos de insulina de acción rápida subcutáneos para el tratamiento de la cetoacidosis diabética.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron ensayos controlados aleatorios (ECA).
Tipos de participantes
Se incluyeron los ensayos que evaluaron a participantes con cetoacidosis diabética (CAD) de cualquier edad o sexo con diabetes tipo 1 o tipo 2 y a pacientes embarazadas (se incluye la diabetes gestacional).
Criterios de diagnóstico para la diabetes mellitus
Para ser consistentes con los cambios en los criterios de clasificación y diagnósticos de la diabetes mellitus con el transcurso de los años, se utilizaron los criterios diagnósticos válidos en el momento del comienzo del ensayo (por ejemplo, ADA 1999; ADA 2008; WHO 1998). De ser necesario se utilizó la definición de diabetes mellitus de los autores de los estudios. Se planificó someter los criterios diagnósticos a un análisis de sensibilidad.
Criterios diagnósticos de cetoacidosis diabética
Se utilizaron los criterios de la American Diabetes Association para la CAD (ADA 2004), que se describen a continuación.
-
CAD leve: glucosa en plasma > 250 mg/dl, pH arterial 7,25 a 7,30; bicarbonato sérico 15 a 18 mEq/l, cuerpos cetónicos en orina y séricos positivos, brecha aniónica > 10, alteración sensorial u obnubilación mental: alerta.
-
CAD moderada: glucosa en plasma > 250 mg/dl, pH arterial 7,00 a 7,24; bicarbonato sérico 10 a < 15 mEq/l, cuerpos cetónicos en orina y séricos positivos, brecha aniónica > 12, alteración sensorial u obnubilación mental: alerta / somnolencia.
-
CAD grave: glucosa en plasma > 250 mg/dl, pH arterial < 7,00, bicarbonato sérico < 10 mEq/l, cuerpos cetónicos en orina y séricos positivos, brecha aniónica > 12, alteración sensorial u obnubilación mental: estupor / coma.
Tipos de intervenciones
Se planificó investigar los efectos de los análogos de insulina de acción rápida subcutáneos versus la infusión intravenosa estándar de insulina regular. Se esperaba que los regímenes de insulina (uso de bolo intravenoso, dosis y frecuencia) variaran según el estudio, por lo que se aceptaron todos los regímenes de insulina.
Intervención
-
Análogos de insulina de acción rápida subcutáneos (insulina lispro, insulina aspart o insulina glulisina).
Comparador
-
Infusión intravenosa de insulina regular.
Las intervenciones concomitantes debían ser las mismas en los grupos intervención y comparador para establecer comparaciones justas.
Tipos de medida de resultado
Resultados primarios
-
Tiempo hasta la resolución de la CAD.
-
Mortalidad por todas las causas.
-
Episodios de hipoglucemia.
Resultados secundarios
-
Morbilidad.
-
Eventos adversos diferentes de la hipoglucemia.
-
Satisfacción del paciente.
-
Hemoglobina glucosilada A1c (HbA1c).
-
Efectos socioeconómicos.
Método y momento adecuado de la medición de resultados
-
Tiempo hasta la resolución de la CAD: definido como el tiempo hasta alcanzar niveles de glucosa en sangre < 200 mg/dl y dos de los criterios siguientes: un nivel de bicarbonato sérico ≥ 15 mEq/l, un pH venoso > 7,3, y una brecha aniónica calculada ≤ 12 mEq/l(Kitabchi 2009).
-
Mortalidad por todas las causas: definida como el número total de muertes por cualquier causa y medida como mortalidad hospitalaria y mortalidad por todas las causas a los 30 días.
-
Episodios de hipoglucemia: definidos como un evento sintomático o asintomático con glucosa en plasma ≤ 70 mg/dl (3,9 mmol/l) o según la definición de los autores.
-
Morbilidad: como edema cerebral definido por criterios diagnósticos, que incluyen respuestas motrices o verbales anormales al dolor, postura decorticada y patrones respiratorios neurogénicos anormales (criterios diagnósticos principales, pero que no incluyen estado mental alterado, desaceleraciones sostenidas de la frecuencia cardíaca e incontinencia inapropiada para la edad; criterios menores que incluyen vómitos, cefalea, letargia, presión arterial diastólica > 90 mmHg y edad < 5 años (Muir 2004)).
-
Eventos adversos diferentes de hipoglucemia: como hipopotasemia definida como una concentración de potasio sérico < 3,5 mEq/l, y reacciones en el sitio de inyección.
-
Satisfacción del paciente: evaluada con un instrumento validado como el Insulin Treatment Satisfaction Questionnaire(Anderson 2004).
-
HbA1c: medida al ingreso en el hospital (valor inicial) y a los tres meses después del alta hospitalaria.
-
Efectos socioeconómicos: como duración de la estancia hospitalaria, calculada al sustraer el día del ingreso del día del alta, y los costos, medidos como datos de los costos hospitalarios.
Tabla "Resumen de los hallazgos"
Se presenta una tabla de "Resumen de los hallazgos" que informa los siguientes resultados enumerados según la prioridad.
-
Mortalidad por todas las causas.
-
Episodios de hipoglucemia.
-
Morbilidad.
-
Eventos adversos diferentes de los episodios de hipoglucemia.
-
Tiempo hasta la resolución de la CAD.
-
Satisfacción del paciente.
-
Efectos socioeconómicos.
Results
Description of studies
For a detailed description of the included trials, see Characteristics of included studies, Characteristics of excluded studies, and Characteristics of studies awaiting classification.
Results of the search
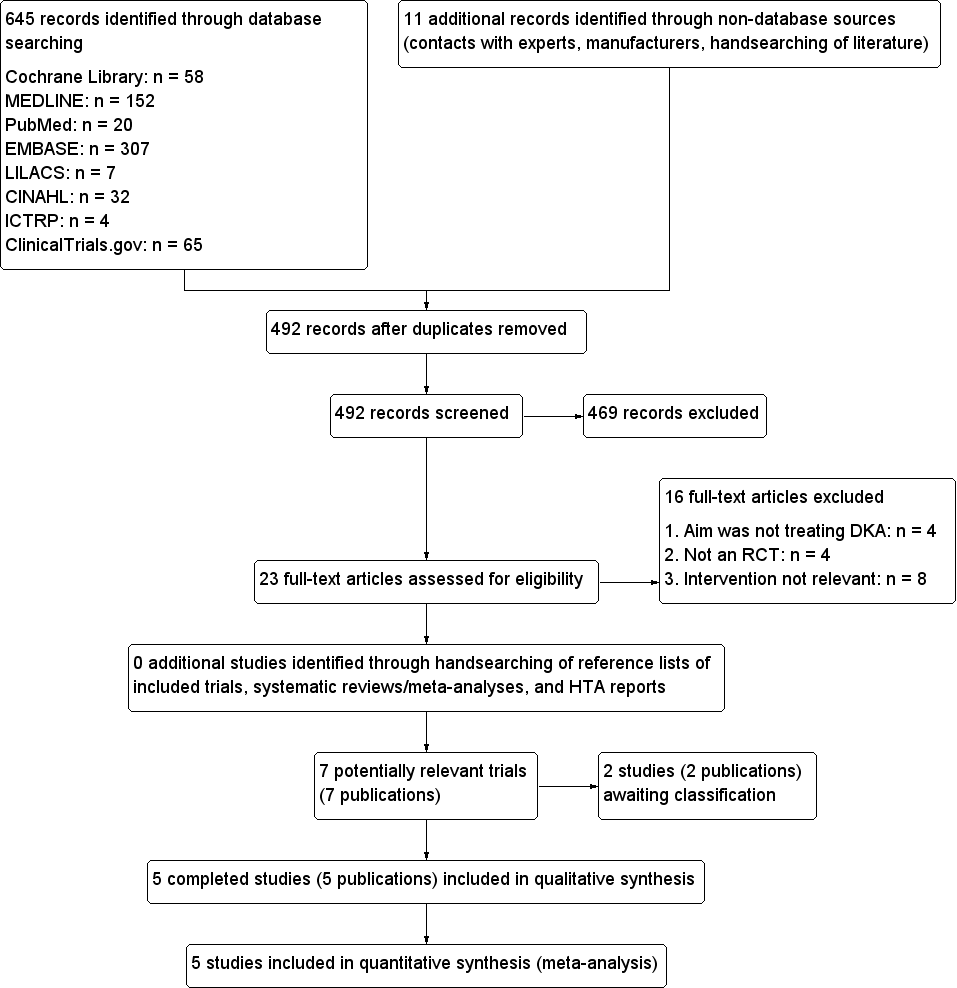
The electronic search strategies retrieved a total of 645 citations. After duplicates were excluded, two review authors (CAC, LCL) independently assessed the remaining titles and abstracts. We obtained the full text of 23 potentially relevant trials, seven of which we deemed potentially appropriate for inclusion in the analysis. Of these, two trials are awaiting classification, one trial was published as an abstract only, and another trial was registered in ClinicalTrials.gov with the status "This study has been completed", but no trial results were posted and no publication is available. We have provided information about these trials in Characteristics of studies awaiting classification.
We have provided an adapted PRISMA flowchart of study selection, see Figure 1.

Study flow diagram.
Included studies
For a detailed description of the included studies, see Characteristics of included studies. The following is a succinct overview.
Source of data
A total of five trials (five publications) met the inclusion criteria. All five included trials were published as peer‐reviewed original articles. All articles were published in English. We found no eligible trials from before the year 2004.
Comparisons
All five included trials investigated the effects of a subcutaneous rapid‐acting insulin analogues compared with intravenous regular insulin. Four trials used lispro (Della Manna 2005; Ersöz 2006; Karoli 2011; Umpierrez 2004a), and one used aspart as a rapid acting insulin analogue (Umpierrez 2004b). No trial applied glulisine.
Overview of study populations
The included trials evaluated a total of 201 participants, of which 110 received a subcutaneous rapid‐acting insulin analogue and 91 received intravenous regular insulin. All randomised participants finished their assigned treatment.
Study design
All included randomised controlled trials were of a parallel design and were performed in a single study centre. All trials compared a subcutaneous rapid‐acting insulin analogue with intravenous regular insulin in an open‐label fashion until resolution of the DKA episode. No trials specified blinding of outcome assessors. Trials were published from 2004 to 2011. Two trials were partly or entirely sponsored by the pharmaceutical industry (Umpierrez 2004a; Umpierrez 2004b).
Settings
Trials were conducted in the USA (Umpierrez 2004a; Umpierrez 2004b), Brazil (Della Manna 2005), Turkey (Ersöz 2006), and India (Karoli 2011) (see Characteristics of included studies for details). In the US and Brazilian trials, participants were treated with subcutaneous insulin managed in regular medicine wards, in Umpierrez 2004a and Umpierrez 2004b, or in the emergency department, in Karoli 2011, and the participants treated with intravenous insulin were managed in the intensive care unit (Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). Two trials stated that the participants were managed in the emergency department (Della Manna 2005; Karoli 2011), and the Turkish trial did not provide details about the setting (Ersöz 2006).
Participants
A total of 201 participants were randomised and exposed to trial insulins in the included studies. All five trials recruited people who had a DKA episode (Della Manna 2005; Ersöz 2006; Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). One trial included paediatric and adolescent participants (60 DKA episodes in 46 participants) with a median age of 11 years (range 3 to 17 years) (Della Manna 2005); the other trials included either type 1 or type 2 diabetic adults with a DKA episode (Ersöz 2006; Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). No trial specified the number of participants or percentages of participants with either type of diabetes. Three trials reported duration of diabetes (Ersöz 2006; Karoli 2011; Umpierrez 2004a); mean duration of diabetes in these trials ranged between 3.9 and 6.9 years. The mean age of participants ranged between 34 and 49 years in the trials with adults only (Ersöz 2006; Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). Sixty per cent of participants came from low‐ to middle‐income countries, and 27% to 76% were female. In one of the US trials, around 77% of participants were African American (Umpierrez 2004a). The other trials did not specify ethnic groups.
Four of the five trials reported a precipitating cause of the DKA episode (Della Manna 2005; Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). Poor compliance with insulin therapy was the most common precipitating cause (54%). Other precipitating causes reported were infections (31%) and new‐onset diabetes (15%). Two trials reported HbA1c at baseline (Ersöz 2006; Umpierrez 2004b). Mean HbA1c at baseline in these trials ranged between 11.4% and 13.9%.
All trials listed persistent hypotension as an exclusion criterion, but only the US trials clearly defined this (Umpierrez 2004a; Umpierrez 2004b). Three trials excluded people with acute myocardial ischaemia, end‐stage renal disease, anasarca, and pregnancy (Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). Two trials excluded people with dementia (Umpierrez 2004a; Umpierrez 2004b), heart failure (Karoli 2011; Umpierrez 2004a), and with American Diabetes Association (ADA) criteria for severe DKA (Ersöz 2006; Karoli 2011). Other criteria used for excluding participants were surgery, use of glucocorticoid or immunosuppressive agents (Della Manna 2005), and the presence of hepatic failure (Umpierrez 2004b).
Diagnosis
All trials specified diagnostic criteria for entry into the study. These criteria were consistent with the ADA criteria for mild or moderate DKA (ADA 2004). None of the included trials explicitly reported diagnostic criteria for diabetes mellitus.
Interventions
None of the included trials reported treatment before the DKA episode. All of the trials compared subcutaneous rapid‐acting insulin analogue injections every one to two hours with continuous intravenous infusions of regular insulin. Duration of interventions ranged from DKA diagnosis to DKA resolution.
Intravenous regular insulin regimens varied slightly across the trials. In three trials, the intravenous regular insulin bolus was 0.1 IU/kg, followed by continuous infusion given at 0.1 IU/kg/h until blood glucose decreased to < 250 mg/dL, and then continued at a lower dose (0.05 IU/kg/h until resolution of DKA) (Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). Ersöz 2006 used a slightly higher bolus dose of intravenous regular insulin of 0.15 IU/kg/h followed by “standard” intravenous regular insulin infusion. In the paediatric trial (Della Manna 2005), no bolus was used, and intravenous regular insulin infusion was given at 0.1 IU/kg/h until blood glucose decreased to < 250 mg/dL; thereafter 0.15 IU/kg regular insulin was given subcutaneously 30 minutes before stopping the intravenous line.
Subcutaneous rapid‐acting insulin analogues injections varied across studies. Four trials used lispro at given dosages: injection regimens were either 0.15 IU every two hours without bolus (Della Manna 2005), or 0.075 IU/kg every hour, preceded by a bolus injection of intravenous regular insulin (0.15 IU/kg) (Ersöz 2006), or 0.1 IU/kg every hour, preceded by an initial subcutaneous bolus of insulin lispro (0.3 IU/kg) (Umpierrez 2004a), or initial subcutaneous bolus of insulin lispro (0.3 IU/kg), followed by 0.2 IU/kg one hour later and then 0.2 IU/kg every two hours (Karoli 2011). One trial used insulin aspart; subcutaneous insulin aspart was given as an initial dose of 0.3 IU/kg, followed by either 0.1 IU/kg every hour (group 1), or 0.2 IU/kg one hour later and every two hours (group 2) (Umpierrez 2004b). In one trial, when capillary blood glucose levels neared 250 mg/dL, insulin lispro was administered every four hours for the next 24 hours (Della Manna 2005).
Concomitant interventions
Fluid replacement protocols were similar in all included trials. This was largely in agreement with guideline recommendations (ADA 2004). Isotonic (0.9%) saline was infused at a rate of 10 to 20 mL/kg/h or 500 to 1000 mL/h for the initial one to two hours. Subsequent fluid replacement was adapted depending on the participant’s overall status and blood glucose levels until resolution of DKA. Potassium replacement was also in agreement with guideline recommendations (ADA 2004).
Outcomes
Three trials did not explicitly specify a primary outcome (Della Manna 2005; Ersöz 2006; Karoli 2011). Four trials defined DKA by venous pH criteria (Della Manna 2005; Ersöz 2006; Umpierrez 2004a; Umpierrez 2004b), and one trial by arterial pH (Karoli 2011). Four trials used a serum bicarbonate criterion > 18 mmol/L as an endpoint (Ersöz 2006; Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). The paediatric trial used a serum bicarbonate criterion > 15 mmol/L (Della Manna 2005). Notably, only one trial clearly stated blood glucose levels < 200 mg/dL as an endpoint (Ersöz 2006).
All trials reported data on adverse events in the form of hypoglycaemic episodes during therapy. Four trials defined the endpoint for this outcome as a plasma glucose ≤ 60 mg/dL (Della Manna 2005; Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). In the trial by Ersöz 2006, the outcome measure of hypoglycaemia was not defined. All five trials reported on in‐hospital mortality. Three trials reported length of hospital stay (Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). The paediatric trial investigated morbidity in the form of cases of cerebral oedema (Della Manna 2005), and Karoli 2011 described venous thrombosis, adult respiratory distress syndrome, and hyperchloraemic acidosis events. One trial investigated total costs, measured as data on hospital charges (Umpierrez 2004a). No trial reported on patient satisfaction, adverse events other than hypoglycaemia, and change of HbA1c from baseline.
Excluded studies
We excluded 16 trials after evaluation of the full publication. We have provided reasons for exclusion of studies in Characteristics of excluded studies. The main reasons for exclusion were inappropriate interventions and non‐randomised study design.
Risk of bias in included studies
For details on risk of bias of included trials, see Characteristics of included studies.
For an overview of review authors' judgements about each risk of bias item for individual trials and across all trials, see Figure 2 and Figure 3.
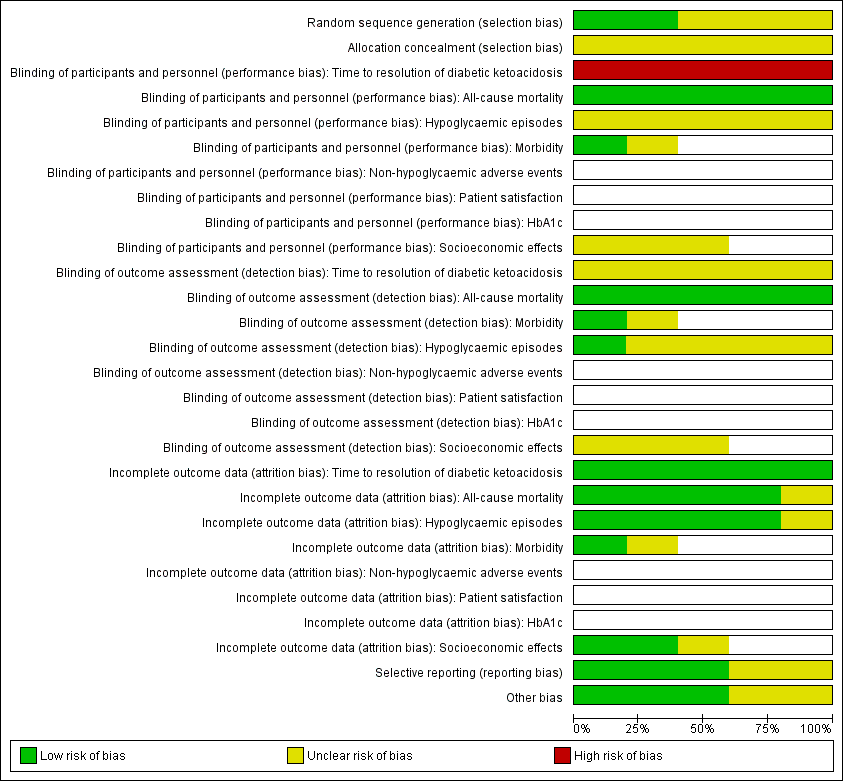
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included trials (blank cells indicate that the particular outcome was not measured in some trials).

Risk of bias summary: review authors' judgements about each risk of bias item for each included trial (blank cells indicate that the trial did not measure that particular outcome).
Allocation
Reporting on the methods of randomisation and allocation concealment was poor in most of the trials. All trials were described as randomised, however the method of randomisation was adequately described in only two trials (Karoli 2011; Umpierrez 2004b). None of the included trials described allocation concealment.
Blinding
The stated method of blinding was open in all five trials. No trial described blinding of outcome assessors. Given the nature of the interventions, participant and personnel blinding was not appropriate. However, this implied a high risk of performance bias for the outcome measure time to resolution of DKA.
Incomplete outcome data
All five trials reported having complete data for all included participants.
Selective reporting
No study protocol was available for the included trials. Reporting bias was unclear for two trials due to unclear reporting of outcome data for time to resolution of DKA (Appendix 6) (Della Manna 2005; Ersöz 2006).
Other potential sources of bias
Two publications reported commercial funding (Umpierrez 2004a; Umpierrez 2004b), a source of possible sponsor bias.
Effects of interventions
See: Summary of findings for the main comparison Subcutaneous insulin lispro versus intravenous regular insulin for diabetic ketoacidosis; Summary of findings 2 Subcutaneous insulin aspart versus intravenous regular insulin for diabetic ketoacidosis
Baseline characteristics
For details of baseline characteristics, see Appendix 3 and Appendix 4.
Subcutaneous rapid‐acting insulin analogues versus intravenous infusion of regular insulin
Umpierrez 2004b was a three‐arm trial investigating intravenous regular insulin versus subcutaneous insulin aspart, given in doses one or two hours apart. In order to avoid a unit of analysis error, we used the one‐hour group for all meta‐analyses.
Primary outcomes
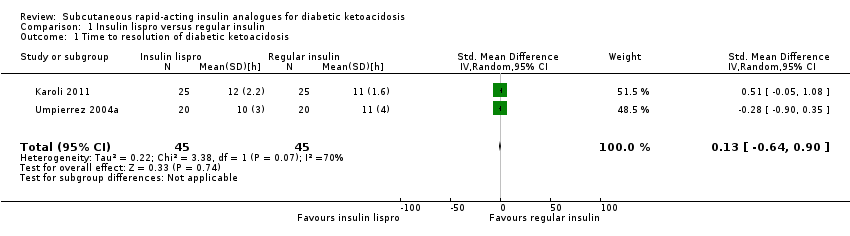
Time to resolution of DKA
Lispro versus regular insulin (adults)
Two trials compared subcutaneous insulin lispro with intravenous regular insulin in adults with DKA (Karoli 2011; Umpierrez 2004a). Meta‐analysis showed the following differences between the two groups: mean difference (MD) 0.2 h (95% confidence interval (CI) ‐1.7 to 2.1); P = 0.81; 90 participants; 2 trials; very low‐quality evidence; Analysis 1.1. There was a high risk of performance bias and an unclear risk of detection bias for both included trials (Karoli 2011; Umpierrez 2004a).
Lispro versus regular insulin (children)
One trial including 60 children compared subcutaneous insulin lispro with intravenous regular insulin (Della Manna 2005). In both groups, the time to reach a glucose level of 250 mg/dL or less was approximately six hours. However, metabolic acidosis and ketosis took longer to resolve in the subcutaneous insulin lispro group (for intravenous regular insulin the time was six hours after capillary glucose ≤ 250 mg/dL, and for subcutaneous insulin lispro this occurred "in the next 6‐h interval" (Della Manna 2005)). The trial authors concluded that glycaemic control worsened when insulin lispro was spaced to every four hours, indicating that this was time was too long to maintain the insulin analogue action. In addition, children receiving insulin lispro were more likely to receive bicarbonate therapy. There was a high risk of performance bias, an unclear risk of detection bias, and an unclear risk of reporting bias for this included trial (Della Manna 2005).
Aspart versus regular insulin
One trial compared subcutaneous insulin aspart with intravenous regular insulin in an adult population (Umpierrez 2004b). There was the following difference between the two groups: MD ‐1 h (95% CI ‐3.2 to 1.2); P = 0.36; 30 participants; 1 trial; very low‐quality evidence; Analysis 2.1. There was a high risk of performance bias and an unclear risk of detection bias for this included trial (Umpierrez 2004b).
All‐cause mortality
All five included trials reported that there were no deaths (4 trials with 156 participants evaluating insulin lispro; moderate‐quality evidence; Analysis 1.1, and 1 trial with 45 participants evaluating insulin aspart (two different insulin aspart schemes in 15 participants each); low‐quality evidence; Analysis 2.1). However, no trial was adequately powered to investigate all‐cause mortality. There was an overall low risk of bias for this outcome measure.
Hypoglycaemic episodes
Information on hypoglycaemia was available from all included trials. Hypoglycaemia was mostly defined as a blood glucose level lower than 60 mg/dL (Della Manna 2005; Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). One trial did not provide a definition of hypoglycaemia (Ersöz 2006).
Lispro versus regular insulin
Four trials reported hypoglycaemic episodes (Della Manna 2005; Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). Comparison of insulin lispro versus regular insulin showed a risk ratio (RR) 0.59 (95% CI 0.23 to 1.52); P = 0.28; 156 participants; 4 trials; low‐quality evidence; Analysis 1.3. There was a high risk of performance bias and an unclear risk of detection bias for all included trials.
Aspart versus regular insulin
One trial including 45 participants compared subcutaneous insulin aspart with intravenous regular insulin in an adult population (Umpierrez 2004b). Insulin aspart versus regular insulin did not show marked differences in the number of hypoglycaemic episodes (1/15 in the insulin aspart given every hour group; 1/15 in the insulin aspart given every two hours group; and 1/15 in the regular insulin group. RR comparing one of the two insulin aspart groups versus the regular insulin group was 1.00 (95% CI 0.07 to 14.55); P = 1.00; 30 participants; 1 trial; low‐quality evidence; Analysis 2.3. There was a high risk of performance bias and an unclear risk of detection bias for the included trial.
Secondary outcomes
Morbidity
Two trials investigating the effects of insulin lispro versus regular insulin reported some data on morbidity related to the sequelae of DKA. One paediatric trial reported morbidity in the form of cerebral oedema (Della Manna 2005). There were no cases of cerebral oedema, and no child had to be treated with mannitol. Karoli 2011 reported that none of the participants in either group developed complications such as venous thrombosis, adult respiratory distress syndrome, or hyperchloraemic acidosis.
Adverse events other than hypoglycaemia
No trials reported adverse events other than hypoglycaemia.
Patient satisfaction
No trial reported on patient satisfaction.
HbA1c
HbA1c values were available in two trials for verification of metabolic control (Ersöz 2006; Umpierrez 2004b). However, the differences in change of HbA1c from baseline to study endpoint were not reported.
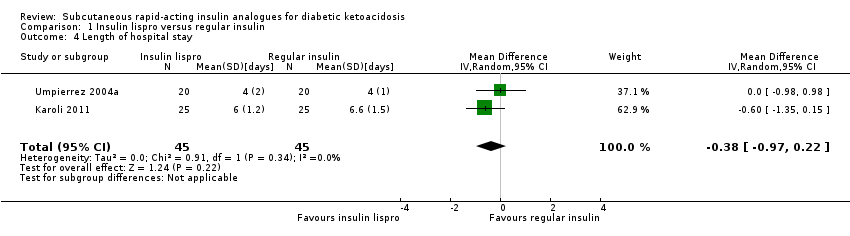
Socioeconomic effects
Three of the trials performed in adults reported length of hospital stay (Karoli 2011; Umpierrez 2004a; Umpierrez 2004b). Comparing subcutaneous insulin lispro with intravenous regular insulin resulted in a MD of ‐0.4 days (95% CI ‐1 to 0.2); P = 0.22; 90 participants; 2 trials; low‐quality evidence; (Analysis 1.4) and between subcutaneous insulin aspart and intravenous regular insulin: MD ‐1.1 day (95% CI ‐3.3 to 1.1); P = 0.32; 30 participants; 1 trial; low‐quality evidence (Analysis 2.4).
One study addressed costs (Umpierrez 2004a). The study authors calculated that DKA treatment with subcutaneous insulin lispro in the non‐intensive care unit setting was associated with 39% lower hospitalisation charges compared with regular insulin treatment in the intensive care unit (USD 8801 (SD USD 5549) versus USD 14,429 (SD USD 5243).
Subgroup analyses
We did not perform subgroup analyses because there were not enough studies to estimate effects in various subgroups.
Sensitivity analyses
We could not perform preplanned analyses excluding unpublished trials because we included only published studies in this review. We were unable to perform sensitivity analyses with regard to risk of bias because all studies were of high or unclear risk of bias in various domains.
Assessment of reporting bias
We did not draw funnel plots due to limited number of studies (n = 5).
Ongoing studies
We did not identify ongoing randomised controlled trials.
Discusión
Resumen de los resultados principales
Esta revisión sistemática analizó las pruebas de todos los ensayos controlados aleatorios publicados (ECA) de los análogos de insulina de acción rápida subcutáneos en el tratamiento de la cetoacidosis diabética (CAD). Se incluyeron cinco ensayos con un total de 201 participantes en esta revisión. Los resultados de esta revisión indican que no hay diferencias significativas en el tiempo hasta la resolución de la CAD entre los análogos de insulina de acción rápida subcutáneos lispro o aspart y la insulina regular intravenosa en los participantes adultos. En el único ensayo incluido que evaluó los efectos de la insulina lispro en niños y adolescentes con CAD, la resolución de la acidemia tardó más en comparación con la insulina regular intravenosa; los autores atribuyeron esta resolución más lenta al aumento en el intervalo de las inyecciones a cada cuatro horas después de la disminución inicial de la glucemia a menos de 250 mg/dl.
Con respecto a la hipoglucemia y la duración de la estancia hospitalaria, los resultados obtenidos con los análogos de insulina de acción rápida subcutáneos y la insulina regular fueron comparables en adultos y en niños. No se produjeron muertes. Los datos sobre la morbilidad y efectos socioeconómicos fueron limitados. Ninguno de los ensayos informó eventos adversos diferentes de la hipoglucemia, la satisfacción del paciente o la hemoglobina glucosilada A1c.
Compleción y aplicabilidad general de las pruebas
Los ensayos analizados en esta revisión se realizaron en cuatro países diferentes, tres de los cuales se podrían considerar países de ingresos bajos o medios. En particular, la mayoría de los participantes que representaron la región occidental de ingresos altos fueron del grupo étnico afroestadounidense. Los participantes con diabetes más jóvenes y los niños estuvieron subrepresentados en las cohortes de los ensayos. Según los criterios de inclusión de los ensayos analizados, los resultados son muy relevantes para los adultos con un episodio de CAD leve o moderado debido al cumplimiento deficiente del tratamiento de la diabetes. Lo anterior puede reflejar un "alfabetismo en salud" deficiente y la falta de comprensión de los planes de tratamiento, los factores asociados con la privación socioeconómica en los países de ingresos bajos o medios. Con respecto a las intervenciones, los análogos de insulina de acción rápida como la insulina lispro y la insulina aspart son de amplia disponibilidad para su uso en la práctica clínica diaria.
Calidad de la evidencia
El riesgo de sesgo a través de varios dominios fue incierto en la mayoría de los estudios incluidos. Lo anterior se debió principalmente a que no hubo información suficiente que permitiera evaluar el riesgo de sesgo de bajo o alto, a pesar de los intentos por establecer contacto con los autores del ensayo. Según el enfoque Grading of Recommendations Assessment, Development and Evaluation (GRADE), la calidad de las pruebas fue baja o muy baja para los resultados clínicamente más importantes (ver Resumen de los hallazgos para la comparación principal; Resumen de los hallazgos 2). Por lo tanto, los datos disponibles fueron demasiado pocos e inconsistentes para aportar las pruebas firmes acerca de los efectos de los análogos de insulina de acción rápida subcutáneos en los pacientes con CAD.
Sesgos potenciales en el proceso de revisión
La revisión se realizó de acuerdo con el protocolo publicado previamente. Dos autores de la revisión evaluaron de forma independiente todas las citas identificadas mediante las estrategias de búsqueda electrónica. Del mismo modo, dos autores de la revisión realizaron la evaluación del "Riesgo de sesgo" y la recopilación de datos. No hubo conflictos de interés.
Se considera que la búsqueda de ECA ha sido exhaustiva. Sin embargo, no se puede excluir la posibilidad de que los estudios con resultados negativos estén sin publicar. Además, no se buscó sistemáticamente la literatura gris.
Acuerdos y desacuerdos con otros estudios o revisiones
Esta revisión sistemática sobre los análogos de insulina de acción rápida subcutáneos para la CAD coincide con revisiones previamente publicadas, Mazer 2009 y Vincent 2013, y las guías actuales para el tratamiento de una crisis hiperglicémica en adultos con diabetes; el tratamiento con análogos de insulina de acción rápida subcutáneos (lispro y aspart) aparece como una opción al uso de la insulina regular intravenosa en el tratamiento de la CAD leve y moderada (Kitabchi 2009).
Study flow diagram.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included trials (blank cells indicate that the particular outcome was not measured in some trials).

Risk of bias summary: review authors' judgements about each risk of bias item for each included trial (blank cells indicate that the trial did not measure that particular outcome).
Comparison 1 Insulin lispro versus regular insulin, Outcome 1 Time to resolution of diabetic ketoacidosis.

Comparison 1 Insulin lispro versus regular insulin, Outcome 2 All‐cause mortality.

Comparison 1 Insulin lispro versus regular insulin, Outcome 3 Hypoglycaemic episodes.
Comparison 1 Insulin lispro versus regular insulin, Outcome 4 Length of hospital stay.

Comparison 2 Insulin aspart versus regular insulin, Outcome 1 Time to resolution of diabetic ketoacidosis.
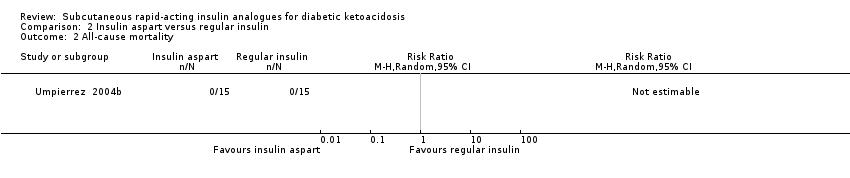
Comparison 2 Insulin aspart versus regular insulin, Outcome 2 All‐cause mortality.

Comparison 2 Insulin aspart versus regular insulin, Outcome 3 Hypoglycaemic episodes.

Comparison 2 Insulin aspart versus regular insulin, Outcome 4 Length of hospital stay.
| Subcutaneous insulin lispro versus intravenous regular insulin for diabetic ketoacidosis | ||||||
| Patient: participants with diabetic ketoacidosis | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Intravenous regular insulin | Subcutaneous insulin lispro | |||||
| All‐cause mortality (N) Mean hospital stay: 2‐7 days | See comment | See comment | Not estimable | 156 (4) | ⊕⊕⊕⊝ | No deaths reported |
| Hypoglycaemic episodes (N) Mean hospital stay: 2‐7 days | 118 per 1000 | 70 per 1000 | RR 0.59 | 156 (4) | ⊕⊕⊝⊝ | Comparable risk ratios for adults (4 trials) and children (1 trial) |
| Morbidity (N) Mean hospital stay: 2‐7 days | See comment | See comment | Not estimable | 96 (2) | See comment | No cases of cerebral oedema, venous thrombosis, adult respiratory distress syndrome, hyperchloraemic acidosis |
| Adverse events other than hypoglycaemic episodes | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Time to resolution of diabetic ketoacidosis (h) Mean hospital stay: 2‐4 days | The mean time to resolution of diabetic ketoacidosis across the intravenous regular insulin groups was 11 h | The mean time to resolution of diabetic ketoacidosis in the subcutaneous insulin lispro groups was 0.2 h higher (1.7 h lower to 2.1 h higher) | ‐ | 90 (2) | ⊕⊝⊝⊝ | Metabolic acidosis and ketosis took longer to resolve in the subcutaneous insulin lispro group in 1 trial (60 children); no exact data published |
| Patient satisfaction | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Socioeconomic effects: length of hospital stay (days) Mean hospital stay: 4‐7 days | The mean length of hospital stay in the intravenous regular insulin groups ranged between 4 and 6.6 days | The mean length of hospital stay in the subcutaneous insulin lispro groups was 0.4 days shorter (1 day shorter to 0.2 days longer) | ‐ | 90 (2) | ⊕⊕⊝⊝ | US setting: treatment of diabetic ketoacidosis in a non–intensive care setting (step‐down unit or general medicine ward) was associated with a 39% lower hospitalisation charge than was treatment with intravenous regular insulin in the intensive care unit (USD 8801 (SD USD 5549) vs USD 14,429 (SD USD 5243); the average hospitalisation charges per day were USD 3981 (SD USD 1067) for participants treated in an intensive care unit compared with USD 2682 (SD USD 636) for those treated in a non–intensive care setting |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| *Assumed risk was derived from the event rates in the comparator groups. | ||||||
| Subcutaneous insulin aspart versus intravenous regular insulin for diabetic ketoacidosis | ||||||
| Patient: participants with diabetic ketoacidosis | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Intravenous regular insulin | Subcutaneous insulin aspart | |||||
| All‐cause mortality (N) Mean hospital stay: 3‐5 days | See comment | See comment | Not estimable | 45 (1) | ⊕⊕⊝⊝ | No deaths reported |
| Hypoglycaemic episodes (N) Mean hospital stay: 3‐5 days | 67 per 1000 | 67 per 1000 | RR 1.00 | 30 (1) | ⊕⊕⊝⊝ | ‐ |
| Morbidity | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Adverse events other than hypoglycaemic episodes | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Time to resolution of diabetic ketoacidosis (h) Mean hospital stay: 3‐5 days | The mean time to resolution of diabetic ketoacidosis across the intravenous regular insulin groups was 11 h | The mean time to resolution of diabetic ketoacidosis in the subcutaneous insulin aspart group was 1 h lower (3.2 h lower to 1.2 h higher) | ‐ | 30 (1) | ⊕⊝⊝⊝ | ‐ |
| Patient satisfaction | See comment | See comment | Not estimable | See comment | See comment | Not investigated |
| Socioeconomic effects: length of hospital stay (days) Mean hospital stay: 3‐5 days | The mean length of hospital stay in the intravenous regular insulin group was 4.5 days | The mean length of hospital stay in the subcutaneous insulin aspart group was 1.1 days shorter (3.3 days shorter to 1.1 days longer) | ‐ | 30 (1) | ⊕⊕⊝⊝ | ‐ |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| *Assumed risk was derived from the event rates in the comparator groups | ||||||
| Intervention(s) and comparator(s) | Sample sizea | Screened/eligible | Randomised | Analysed | Finishing trial | Randomised finishing trial | Follow‐up timeb | |
| Umpierrez 2004a | I: s.c. insulin lispro | Arbitrary estimation of a difference between groups of ≥ 5 hours to determine ketoacidosis as being clinically important; a sample size of 20 participants was needed in each group to provide a power of 0.93, given an alpha level of 0.05, a SD of 4, and a 1:1 inclusion ratio | ‐ | 20 | 20 | 20 | 100 | Mean hospital stay: 4 days |
| C: i.v. regular insulin | 20 | 20 | 20 | 100 | ||||
| total: | 40 | 40 | 40 | 100 | ||||
| Umpierrez 2004b | I1: s.c. insulin aspart, every hour | Arbitrary estimation of a difference between groups of ≥ 4 hours to determine ketoacidosis as being clinically significant. A sample size of 15 participants was needed in each group to provide a power of 0.81, given an alpha error of 0.05 and a SD of 3 | ‐ | 15 | 15 | 15 | 100 | Mean hospital stay: 3.4 days |
| I2: s.c. insulin aspart, every 2 h | 15 | 15 | 15 | 100 | Mean hospital stay: 3.9 days | |||
| C: i.v. regular insulin | 15 | 15 | 15 | 100 | Mean hospital stay: 4.5 days | |||
| total: | 45 | 45 | 45 | 100 | ||||
| Della Manna 2005 | I: s.c. insulin lispro | ‐ | ‐ | 25 | 25 | 25 | 100 | Mean hospital stay: 2‐3 days |
| C: i.v. regular insulin | 21 | 21 | 21 | 100 | ||||
| total: | 46 | 46 | 46 | 100 | ||||
| Ersöz 2006 | I: s.c. insulin lispro | ‐ | ‐ | 10 | 10 | 10 | 100 | ‐ |
| C: i.v. regular insulin | 10 | 10 | 10 | 100 | ||||
| total: | 20 | 20 | 20 | 100 | ||||
| Karoli 2011 | I: s.c. insulin lispro | ‐ | ‐ | 25 | 25 | 25 | 100 | Mean hospital stay: 6 days |
| C: i.v. regular insulin | 25 | 25 | 25 | 100 | Mean hospital stay: 6.6 days | |||
| total: | 50 | 50 | 50 | 100 | ||||
| Grand total | All interventions | 110 | 110 | |||||
| All comparators | 91 | 91 | ||||||
| All interventions and comparators | 201 | 201 | ||||||
| aAccording to power calculation in study publication or report ‐ denotes not reported C: comparator; I: intervention; i.v.: intravenous; s.c.: subcutaneous; SD: standard deviation | ||||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Time to resolution of diabetic ketoacidosis Show forest plot | 2 | 90 | Std. Mean Difference (IV, Random, 95% CI) | 0.13 [‐0.64, 0.90] |
| 2 All‐cause mortality Show forest plot | 4 | 156 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 3 Hypoglycaemic episodes Show forest plot | 4 | 156 | Risk Ratio (M‐H, Random, 95% CI) | 0.59 [0.23, 1.52] |
| 3.1 Adults | 3 | 110 | Risk Ratio (M‐H, Random, 95% CI) | 0.67 [0.11, 3.94] |
| 3.2 Children | 1 | 46 | Risk Ratio (M‐H, Random, 95% CI) | 0.56 [0.18, 1.72] |
| 4 Length of hospital stay Show forest plot | 2 | 90 | Mean Difference (IV, Random, 95% CI) | ‐0.38 [‐0.97, 0.22] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Time to resolution of diabetic ketoacidosis Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 2 All‐cause mortality Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 3 Hypoglycaemic episodes Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 4 Length of hospital stay Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |

