Dimetilfumarato para la esclerosis múltiple
Resumen
Antecedentes
La esclerosis múltiple (EM) a menudo da lugar a discapacidad neurológica grave y a un deterioro grave en la calidad de vida. El objetivo ideal del tratamiento modificador de la enfermedad para la EM es prevenir el empeoramiento de la discapacidad y mejorar la calidad de vida. Se considera que el dimetilfumarato tiene actividad inmunorreguladora y un efecto neuroprotector. Ha sido aprobada por la Food and Drug Administration (FDA) y la European Medicines Agency como tratamiento de primera línea para los pacientes adultos con EM recurrente‐remitente (EMRR).
Objetivos
Evaluar los efectos beneficiosos y la seguridad del dimetilfumarato como monoterapia o tratamiento de combinación versus placebo u otros fármacos modificadores de la enfermedad aprobados (interferón beta, acetato de glatiramer, natalizumab, mitoxantrona, fingolimod, teriflunomida, alemtuzumab) para los pacientes con EM.
Métodos de búsqueda
El coordinador de búsquedas de ensayos buscó en el registro especializado del Grupo Cochrane de Esclerosis Múltiple y Enfermedades Raras del Sistema Nervioso Central (Cochrane Multiple Sclerosis and Rare Diseases of the Central Nervous System Group) (4 junio 2014). Se examinaron las listas de referencias de las revisiones publicadas y los artículos recuperados y se realizaron búsquedas de informes (2004 hasta junio de 2014) de las sociedades de EM en Europa y América. También se estableció contacto con investigadores que participaron en los ensayos de dimetilfumarato y el Biogen Idec Medical Information.
Criterios de selección
Se incluyeron los ensayos clínicos controlados aleatorios (ECA) de grupos paralelos con una duración del seguimiento igual o mayor de un año que evaluaron el dimetilfumarato, como monoterapia o tratamiento de combinación, versus placebo u otros fármacos modificadores de la enfermedad aprobados para los pacientes con EM sin restricciones con respecto a la dosis, la frecuencia de administración y la duración del tratamiento.
Obtención y análisis de los datos
Se utilizaron los procedimientos métodológicos estándar de la Colaboración Cochrane. Dos autores de la revisión, de forma independiente, evaluaron la calidad de los ensayos y extrajeron los datos. Los desacuerdos se discutieron y resolvieron mediante consenso entre los autores de la revisión. Se estableció contacto con los investigadores principales de los estudios incluidos para obtener datos adicionales o para confirmar datos.
Resultados principales
Se incluyeron dos ECA con 2667 pacientes adultos con EMRR para evaluar la eficacia y la seguridad de dos dosis de dimetilfumarato (240 mg por vía oral tres veces al día o dos veces al día) mediante la comparación directa con placebo durante dos años. Entre ellos, se seleccionó una submuestra de 1221 pacientes (45,8%) para participar en evaluaciones con IRM por cada sitio de estudio con capacidades propias para la IRM. No se ha encontrado un estudio de comparación directa con poder estadístico adecuado que incluya un comparador de tratamiento activo. Los metanálisis mostraron que el dimetilfumarato tres veces al día y dos veces al día redujo el número de pacientes que presentó recurrencia (cociente de riesgos [CR] 0,57; intervalo de confianza [IC] del 95%: 0,50 a 0,66; p < 0,00001 y 0,64; IC del 95%: 0,54 a 0,77; p < 0,00001; respectivamente) o empeoramiento de la discapacidad (CR 0,70; IC del 95%: 0,57 a 0,87; p = 0,0009 y 0,65; IC del 95%: 0,53 a 0,81; p = 0,0001; respectivamente) durante dos años, en comparación con placebo. Los efectos del tratamiento se redujeron en los análisis de escenario de casos probables al considerar el efecto de los abandonos. Ambas dosis también redujeron la tasa anual de recurrencia. Los datos de las lesiones activas obtenidos con los exámenes con IRM no se combinaron debido a que en ambos estudios hubo un riesgo alto de sesgo de selección de los resultados de la IRM y a la falta de precisión en los datos de la IRM, así como a la heterogeneidad obvia entre los estudios. En cuanto al perfil de seguridad, ambas dosis aumentaron el riesgo de eventos adversos y el riesgo de interrupción de los fármacos debido a eventos adversos. Los eventos adversos más frecuentes incluyeron sofocos y eventos gastrointestinales (dolor en el abdomen superior, náuseas y diarrea). Los eventos adversos poco frecuentes incluyeron linfopenia y leucopenia, aunque fue más probable que ocurrieran al administrar dimetilfumarato en comparación con placebo (dosis alta: CR 5,25; IC del 95%: 2,20 a 12,51; p = 0,0002 y 5,23; IC del 95%: 2,47 a 11,07; p < 0,0001, respectivamente; dosis baja: CR 5,69; IC del 95%: 2,40 a 13,46; p < 0,0001 y 6,53; IC del 95%: 3,13 a 13,64; p < 0,00001, respectivamente). Ambos estudios presentaron un sesgo alto de deserción debido al desequilibrio en los motivos de los abandonos entre los grupos. La calidad de las pruebas del resultado de recurrencia fue moderada, aunque para el empeoramiento de la discapacidad fue baja.
Conclusiones de los autores
Hay pruebas de calidad moderada para apoyar que el dimetilfumarato a una dosis de 240 mg por vía oral tres veces al día o dos veces al día reduce el número de pacientes con recurrencia y la tasa anual de recurrencia durante dos años de tratamiento en comparación con placebo. Sin embargo, la calidad de las pruebas para apoyar el efecto beneficioso con respecto a la reducción del número de pacientes con empeoramiento de la discapacidad es baja. No hay datos de alta calidad disponibles para evaluar el efecto beneficioso sobre los resultados de la IRM. Los efectos adversos frecuentes como los sofocos y los eventos gastrointestinales son leves a moderados en la mayoría de los pacientes. La linfopenia y la leucopenia son eventos adversos poco frecuentes, aunque se asociaron significativamente con el dimetilfumarato. Ambas dosis de dimetilfumarato tienen efectos beneficiosos y perfil de seguridad similares, lo que apoya la opción de la administración de la dosis baja. Se necesitan estudios nuevos de alta calidad y con un seguimiento a largo plazo para evaluar el efecto beneficioso del dimetilfumarato en la prevención del empeoramiento de la discapacidad y para observar los efectos adversos a largo plazo, incluida la leucoencefalopatía multifocal progresiva.
PICO
Resumen en términos sencillos
Tratamiento oral de primera línea con dimetilfumarato (BG‐12) para los pacientes con esclerosis múltiple
Antecedentes
El dimetilfumarato fue aprobado por la Food and Drug Administration (FDA) y la European Medicines Agency de los Estados Unidos para los adultos con esclerosis múltiple recurrente‐remitente (EMRR). No se requiere haber probado con otra medicación antes de prescribir dimetilfumarato. Aunque hay datos de revisiones no Cochrane disponibles, es importante evaluar sistemáticamente su eficacia y seguridad como monoterapia versus placebo.
Características de los estudios
Se efectuaron búsquedas en las bases de datos médicas para obtener estudios que hubieran asignado al azar a los participantes a dimetilfumarato o a un fármaco control (ensayos controlados aleatorios). Se consideró la eficacia de este tratamiento con respecto a la aparición de recurrencia y progresión de la enfermedad.
Resultados clave y calidad de las pruebas
Se encontraron pruebas de calidad moderada de que ambas dosis de dimetilfumarato reducen el número de pacientes con EMRR que presentan una recurrencia después de dos años de tratamiento, mientras que hay pruebas de baja calidad que muestran que la medicación reduce el número de pacientes que presentan empeoramiento de la discapacidad al final de un período de dos años.
Los efectos adversos frecuentes como sofoco y eventos gastrointestinales (diarrea, náuseas y dolor en el abdomen superior) son leves a moderados en la mayoría de los pacientes. El dimetilfumarato puede tener efecto sobre el sistema inmunológico del cuerpo al causar una disminución en el número de leucocitos que ayudan a combatir la infección. Más pacientes de los grupos tratados con dimetilfumarato experimentaron dicha reducción en comparación con los tratados con placebo. Se encontraron pruebas de calidad moderada de que fue más probable que los pacientes abandonaran el estudio temprano debido a eventos adversos cuando fueron tratados con dimetilfumarato en comparación con placebo.
Conclusiones de los autores
Summary of findings
| Dimethyl fumarate for multiple sclerosis | ||||||
| Patient or population: Patients with relapsing‐remitting multiple sclerosis | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Placebo | Dimethyl fumarate | |||||
| The proportion of patients with at least one relapse at two years | Study population | RR 0.64 | 1540 | ⊕⊕⊕⊝ | ||
| 437 per 1000 | 280 per 1000 | |||||
| The proportion of patients with disability worsening at two years | Study population | RR 0.65 | 1539 | ⊕⊕⊝⊝ | ||
| 223 per 1000 | 145 per 1000 | |||||
| The proportion of patients who discontinued study drug because of adverse events excluding relapses at two years | Study population | RR 2.18 | 1540 | ⊕⊕⊕⊝ | ||
| 58 per 1000 | 127 per 1000 | |||||
| The proportion of patients with lymphopenia at two years Follow‐up: 2 years | Study population | RR 5.69 | 1540 | ⊕⊕⊕⊝ | ||
| 8 per 1000 | 44 per 1000 | |||||
| *The basis for the assumed risk (e.g. the median placebo group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 A high rate of dropouts existed and reasons of dropouts were unbalanced between arms | ||||||
Antecedentes
Descripción de la afección
La esclerosis múltiple (EM) es una enfermedad crónica del sistema nervioso central mediada por el sistema inmunológico. Desde el punto de vista patológico se caracteriza por inflamación, desmielinización y pérdida axonal y neuronal. Clínicamente se caracteriza por recaídas recurrentes o progresión, o ambas, y habitualmente afecta a adultos durante la etapa productiva primaria de la vida y finalmente provoca discapacidad neurológica grave.
Existen cuatro fenotipos clínicos de EM. Inicialmente, más del 80% de los pacientes con EM presenta un curso de la enfermedad recurrente‐remitente (EMRR) caracterizado por exacerbaciones clínicas de los síntomas neurológicos, seguidas de una remisión completa o incompleta (Lublin 1996). Después de diez a 20 años, o una mediana de edad de 39 años, alrededor de la mitad de estos pacientes acumulan gradualmente déficits neurológicos irreversibles, con o sin recurrencias clínicas (Confavreux 2006), cuadro que se conoce como EM progresiva secundaria (EMPS). Otro 10% a 20% de los individuos con EM se diagnostica con EM progresiva primaria (EMPP), clínicamente definida como un curso de la enfermedad sin crisis clínicas ni remisión desde su aparición (Lublin 1996). Una forma significativamente menos frecuente es la EM recurrente progresiva (EMRP), que se presenta inicialmente como EMPP; sin embargo, durante el curso de la enfermedad estos individuos desarrollan verdaderas exacerbaciones neurológicas (Tullman 2004).
La EM causa una carga socioeconómica importante para el paciente y para la sociedad. El aumento de los costos y la reducción de la calidad de vida se asocian con el avance de la gravedad de la enfermedad, la progresión de la enfermedad y las recurrencias (Karampampa 2012a; Karampampa 2013b). Desde la perspectiva del paciente, una recurrencia de la EM se asocia con un aumento significativo de los costos económicos, así como una disminución en la calidad de vida relacionada con la salud (CdVRS) y la capacidad funcional (Oleen‐Burkey 2012). El tratamiento efectivo que reduce la frecuencia de las recurrencias y previene la progresión podría tener repercusión sobre los costos y la CdVRS, y podría ayudar a reducir la carga social de la EM (Karampampa 2012c).Se ha observado que el
natalizumab y el interferón (IFN) β‐1a (IFNβ‐1a) (Rebif™) son superiores a la mitoxantrona, el acetato de glatiramer, el IFNβ‐1b (Betaseron™) y el IFN IFNβ‐1a (Avonex™) para prevenir las recurrencias clínicas en la EMRR a corto plazo (24 meses) en comparación con placebo, según pruebas de alta calidad. Sin embargo, estos tratamientos se asocian con eventos adversos graves a largo plazo y su equilibrio entre riesgos y efectos beneficiosos podría ser desfavorable (Filippini 2013). Además, la administración de IFNβ no se asocia con una reducción del empeoramiento de la discapacidad entre los pacientes con EMRR (Shirani 2012). Por lo tanto, se necesitan fármacos más seguros y más efectivos con nuevos mecanismos de acción que den lugar a una acción antiinflamatoria y a la neuroprotección en la EM.
Se cree que la inflamación y el estrés oxidativo causan daño tisular en la EM. Por lo tanto, el estrés oxidativo y las vías antioxidativas son importantes en la fisiopatología de la EM (Gilgun‐Sherki 2004; Lee 2012), y las terapéuticas nuevas que mejoran la resistencia celular a los radicales libres podrían resultar útiles para el tratamiento de la EM. Datos recientes apoyan esta función importante de las vías antioxidativas para la protección tisular en la EM progresiva, en particular mediante la activación de la vía antioxidante del factor de transcripción factor 2 relacionado con el núcleo (Nrf2, por sus siglas en inglés) (derivado de eritroide 2) (Johnson 2010), al cual todavía no se dirigen otros tratamientos modificadores de la enfermedad para la EM (Linker 2011).
Descripción de la intervención
Una formulación oral de dimetilfumarato (BG‐12) ha mostrado resultados prometedores para la EMRR en los ensayos clínicos, y combina efectos antiinflamatorios y posiblemente efectos neuroprotectores clínicamente relevantes con la comodidad de la administración oral. Un estudio piloto abierto exploratorio y prospectivo mostró que los ésteres de ácido fumárico produjeron reducciones significativas desde el inicio en el número y el volumen de las lesiones resaltadas con gadolinio en los pacientes con EMRR (Schimrigk 2006). Un estudio de fase II con BG‐12 oral reveló una reducción significativa y dependiente de la dosis en la actividad de la lesión cerebral. EL BG‐12 oral a una dosis de 240 mg tres veces al día redujo significativamente el número de nuevas lesiones resaltadas con gadolinio, lesiones hiperintensas nuevas o agrandadas en T2 y lesiones hipointensas nuevas en T1 y la tasa anual de recurrencia (TAR) en los pacientes con EMRR (Kappos 2008). Un estudio aleatorio, doble ciego, controlado con placebo de fase III (DEFINE) mostró que ambas dosis orales de BG‐12 (a una dosis de 240 mg dos veces al día y 240 mg tres veces al día) redujeron significativamente la proporción de pacientes que presentó una recurrencia, la TAR, la tasa de empeoramiento de la discapacidad y el número de lesiones en los pacientes con EMRR (Gold 2012) en comparación con placebo. Otro estudio de fase III (CONFIRM) mostró que las dosis orales de BG‐12 y el acetato de glatiramer (inyecciones subcutáneas diarias de 20 mg) redujeron significativamente la TAR y los números de lesiones hiperintensas nuevas o agrandadas potenciada en T2 y de lesiones hipointensas nuevas potenciadas en T1 en los pacientes con EMRR, en comparación con placebo, aunque las reducciones del empeoramiento de la discapacidad con BG‐12 dos veces al día, BG‐12 tres veces al día y acetato de glatiramer no fueron significativas (Fox 2012). Las comparaciones post hoc de BG‐12 con acetato de glatiramer mostraron diferencias significativas en la TAR (BG‐12 tres veces al día), las lesiones hiperintensas potenciadas en T2 nuevas o agrandadas (ambas dosis de BG‐12) y las lesiones hipointensas nuevas potenciadas en T1 (BG‐12 tres veces al día). Además, BG‐12 tuvo efectos positivos sobre la calidad de vida relacionada con la salud en los pacientes con EMRR.
El dimetilfumarato (Tecfidera™) es un fármaco oral nuevo aprobado por la Food and Drug Administration (FDA) de los Estados Unidos en 2013 como un tratamiento de primera línea para los pacientes adultos con EM recurrente, y en el mismo año también se aprobó en Canadá y en Australia. En 2014 fue aprobado por la Agencia Europea de Medicamentos (EMA) como un tratamiento oral de primera línea para los pacientes adultos con EMRR. El uso adecuado indica que las cápsulas de dimetilfumarato se administran por vía oral dos veces al día, con una dosis inicial reducida durante una semana (120 mg dos veces al día) y posteriormente una dosis de mantenimiento (240 mg dos veces al día) (National MS Society 2013).
De qué manera podría funcionar la intervención
Varias líneas de investigación han demostrado efectos inmunorreguladores y también neuroprotectores de los ésteres de ácido fumárico, como se demostró in vitro y también en modelos experimentales de EM (Lukashev 2007). Los ésteres de ácido fumárico incluyen fumarato de hidrógeno metílico y dimetilfumarato. Las concentraciones inmunorreguladoras de dimetilfumarato pueden reducir el estrés oxidativo sin alterar la actividad de la red neuronal (Albrecht 2012). En la fase aguda de la encefalomielitis autoinmune experimental, el tratamiento con dimetilfumarato dio lugar a una reducción significativa de la infiltración de macrófagos / microglía en las lesiones inflamadas (Schilling 2006). En un modelo in vitro de inflamación cerebral, el dimetilfumarato inhibió la inflamación microglial y astrocítica mediante la supresión de la síntesis del óxido nítrico, la interleucina (IL)‐1β, el factor de necrosis tumoral (FNT)‐α y el IL‐6 (Wilms 2010). El dimetilfumarato y su metabolito primario, el monometil fumarato, son citoprotectores de las neuronas y los astrocitos contra la lesión y la pérdida celular inducidas por el estrés oxidativo, potencialmente por la inducción del factor de transcripción Nrf‐2 y el aumento de una respuesta antioxidante dependiente de Nrf2 (Scannevin 2012). Además, el tratamiento con dimetilfumarato para la EM mediada por linfocitos T auxiliares tipo 1 (Th1) y linfocitos T tipo 17 (Th17) induce las células Th2 que producen IL‐4 in vivo y genera células dendríticas de tipo II que producen IL‐10 en lugar de IL‐12 y IL‐23 (Ghoreschi 2011). El dimetilfumarato inhibe la maduración de las células dendríticas y posteriormente la diferenciación de las células Th1 y Th17 mediante la supresión del factor nuclear κB (NF‐κB) y de la quinasa 1 y 2 extracelular regulada por señales (ERK1/2) y la señalización de quinasa 1 activada por estrés y mitógenos (MSK1) (ERK1/2‐MSK1) (Peng 2012).
El dimetilfumarato, el componente activo del BG00012 (BG‐12), se absorbe casi exclusivamente en el intestino delgado dos horas después de la administración oral y es hidrolizado rápidamente por sus esterasas a su metabolito, el fumarato monometil, en la mucosa intestinal (Litjens 2004). El dimetilfumarato posee una vida media farmacológica de alrededor de 12 minutos y no muestra una actividad de acoplamiento a las proteínas séricas, lo que puede contribuir aún más al recambio rápido en la circulación (Lee 2008). No hay pruebas sobre un metabolismo dependiente de citocromo P450 de los ésteres de ácido fumárico en el hígado (Lee 2008).
Por qué es importante realizar esta revisión
Una revisión reciente no Cochrane basada en comparaciones indirectas ha mostrado que el dimetilfumarato ofrece una opción efectiva de tratamiento oral para los pacientes con EMRR, con un perfil de eficacia y seguridad general alentador, en comparación con IFNβ‐1a, IFNβ‐1b, acetato de glatiramer, fingolimod, natalizumab y teriflunomida (Hutchinson 2014). Otra revisión no Cochrane evaluó la eficacia y la seguridad del dimetilfumarato para la EMRR mediante la comparación directa con placebo o acetato de glatiramer, con resultados que indicaron que el dimetilfumarato (en ambas dosis) fue más efectivo en cuanto a la reducción de las recurrencias, del empeoramiento de la discapacidad y de las lesiones resaltadas con gadolinio a los dos años (Kawalec 2014). Sin embargo, los autores no consideraron completamente el impacto potencial del sesgo en la validez interna de los resultados y no realizaron un análisis integral de la calidad de las pruebas.
Objetivos
Evaluar la eficacia y la seguridad absolutas y comparativas del dimetilfumarato como monoterapia o tratamiento de combinación versus placebo u otros fármacos modificadores de la enfermedad aprobados (IFN‐β, acetato de glatiramer, natalizumab, mitoxantrona, fingolimod, teriflunomida, alemtuzumab) en pacientes con EM.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todos los ensayos clínicos aleatorios, controlados, de grupos paralelos (ECA) que evaluaran el dimetilfumarato, como monoterapia o tratamiento de combinación, versus placebo u otros fármacos modificadores de la enfermedad aprobados para los pacientes con EM. Se excluyeron los ensayos con un seguimiento inferior a un año.
Tipos de participantes
Se incluyeron pacientes de 18 a 60 años de edad con un diagnóstico definitivo de EM según lo definido según los criterios de Poser (Poser 1983) o McDonald's (McDonald 2001; Polman 2005; Polman 2011), cualquier fenotipo clínico categorizado según la clasificación de Lublin y Reingold (Lublin 1996), y una puntuación en la Expanded Disability Status Scale (EDSS)(Kurtzke 1983) de 6,0 o menos.
Tipos de intervenciones
Intervención experimental
Tratamiento con dimetilfumarato por vía oral, como monoterapia o tratamiento de combinación, sin restricciones con respecto a la dosis, la frecuencia de administración o la duración del tratamiento.
Intervención control
Placebo o un fármaco modificador de la enfermedad aprobado.
Tipos de medida de resultado
Resultados primarios
Se evaluaron los siguientes resultados primarios.
Beneficio
-
Proporción de pacientes con al menos una recurrencia al año o a los dos años. La recurrencia confirmada se definió como la aparición de nuevos síntomas o el empeoramiento de los síntomas anteriormente estables, no asociados con fiebre o infección, que ocurrían al menos 30 días después de la aparición de una recurrencia anterior, con una duración de más de 24 horas y que iban acompañados por nuevos hallazgos neurológicos objetivos según la evaluación de un neurólogo.
-
Proporción de pacientes con empeoramiento de la discapacidad según lo evaluado por la EDSS al año o a los dos años. El empeoramiento de la discapacidad se definió como un aumento en la puntuación de la EDSS de al menos 1,0 punto en los pacientes con una puntuación inicial de 1,0 o mayor o un aumento de al menos 1,5 puntos en los pacientes con una puntuación inicial de 0; con el aumento de la puntuación mantenido durante seis meses. Se utilizaron los datos cuando el empeoramiento de la discapacidad se confirmó en menos de seis meses; sin embargo, se disminuyó la calidad del estudio debido a la falta de direccionalidad de las pruebas cuando se realizó la evaluación GRADE.
Seguridad
Proporción de pacientes con al menos un evento adverso (EA), proporción de pacientes con al menos un EAG y proporción de pacientes que interrumpió el fármaco de estudio debido a EA al año y a los dos años.
Resultados secundarios
Se evaluaron los siguientes resultados secundarios:
-
la TAR al año o a los dos años, definida como el número medio de recurrencias confirmadas por paciente, ajustadas según la duración del seguimiento para anualizarla.
-
Número (tasa) de lesiones resaltadas con gadolinio potenciadas en T1 al año o a los dos años.
-
Número (tasa) de lesiones hiperintensas potenciadas en T2 nuevas o agrandadas al año o a los dos años.
-
Porcentaje de cambio en el volumen cerebral al año o a los dos años.
-
Cambio medio en la CdVRS desde el inicio hasta el año o los dos años. Se aceptaron las siguientes escalas. la Medical Outcomes Study (MOS) 36‐Item Short‐Form Health Survey (SF‐36)(Ware 1992), la Multiple Sclerosis Quality of Life‐54 (MSQOL‐54) (Vickrey 1995), la Multiple Sclerosis Quality of Life Inventory (MSQLI)(Fischer 1999) o la Functional Assessment of Multiple Sclerosis (FAMS)(Cella 1996).
Results
Description of studies
See: "Characteristics of included studies", and "Characteristics of excluded studies"
Results of the search
A total of 137 references were retrieved by the search strategy. After screening of titles and abstracts, 28 references were provisionally selected. The full papers were obtained for further assessment of eligibility. We excluded two studies (reported in four articles): one study was an uncontrolled pilot study (reported in one article) (Schimrigk 2006); the other was a RCT with a length of follow‐up shorter than one year (reported in three articles) (Kappos 2008). Two studies reported in the 24 selected articles were included in the review (Fox 2012; Gold 2012). No ongoing study was eligible according to the inclusion criteria of the review. See Figure 1.

Study flow diagram.
Included studies
Two studies (Fox 2012; Gold 2012) were included, in which 2667 patients were randomly assigned to high‐dose dimethyl fumarate (761), low‐dose dimethyl fumarate (773), placebo (773) and glatiramer acetate (360). Four (0.5%) of 773 patients in the low‐dose dimethyl fumarate group, two (0.3%) of 773 patients in the placebo group and 10 (2.8%) of 360 patients in the glatiramer acetate group did not receive treatment. A subsample of 1221 (45.8%) patients were selected from the randomised population to participate in MRI evaluations by each study site with MRI capabilities itself. Both studies aimed to evaluate the benefit and safety of dimethyl fumarate as monotherapy versus placebo for adults with relapsing‐remitting multiple sclerosis (RRMS). Subcutaneous glatiramer acetate at a dose of 20 mg per day was included as a reference comparator for a relative benefit‐risk assessment of dimethyl fumarate through comparison of the active‐treatment groups with the placebo group in Fox 2012. (Characteristics of included studies).
Characteristics of the study design
Both studies were randomised, double‐blind, placebo‐controlled clinical trial with parallel design for a two‐year follow‐up. Overall, 572 (21.4%) patients withdrew from study: 168 (22.1%) of 761 high‐dose dimethyl fumarate patients, 170 (22.0%) of 773 low‐dose dimethyl fumarate patients, 176 (22.8%) of 773 placebo controls and 58 (16.1%) of 360 glatiramer acetate patients. Not all randomly assigned patients were included in data analyses. Sixteen patients randomised but not receiving study treatment were excluded from the data analyses. For the MRI outcomes, only those with available post baseline MRI data were included in the analyses. Missing MRI data after patients switched to alternative MS medications were imputed with the use of a constant‐rate assumption. The ITT principle was not used.
Characteristics of the participants
Both studies included participants with (1) a diagnosis of RRMS according to the 2005 revision of the "McDonald Criteria" (Polman 2005); (2) an age of 18 to 55 years; (3) a score of 0 to 5 on the EDSS; (4) disease activity as evidenced by at least one clinically documented relapse in the previous 12 months or at least one gadolinium‐enhancing lesion 0 to 6 weeks before randomisation. Patients with progressive forms of MS were excluded. Baseline demographic and disease characteristics were similar among the study groups (including the MRI cohort and the HRQoL cohort).
Characteristics of the interventions
Both studies had multiple arms with two dosages of dimethyl fumarate groups (low‐dose: 240 mg orally twice daily for 96 weeks, high‐dose: 240 mg orally three times daily for 96 weeks) and a common placebo control group. Additionally, a rater‐blinded, active agent approved for RRMS (subcutaneous glatiramer acetate at a dose of 20 mg per day) was included as a reference comparator in Fox 2012.
Characteristics of the outcome measures
Both studies reported the data at two years of follow‐up only, data at one year were not available. The proportion of patients with at least one relapse was reported as the primary outcome in Gold 2012 but as one of the secondary outcomes in Fox 2012. The proportion of patients with disability worsening was reported as one of secondary outcomes in both studies. The annualised relapse rate (ARR) was reported as the primary outcome in Fox 2012. The following outcomes were reported as secondary outcomes in both studies: the proportion of patients with at least one AE, the proportion of patients with at least one SAE, the proportion of patients who discontinued study drug because of AEs, the number (rate) of gadolinium‐enhancing T1‐weighted lesions, the number (rate) of new or enlarging T2‐weighted hyperintense lesions and mean change in HRQoL. The percentage brain volume change was not an outcome measure in either study.
Excluded studies
Two studies were excluded from this review. Reasons for their exclusion are available in the Characteristics of excluded studies table.
Risk of bias in included studies
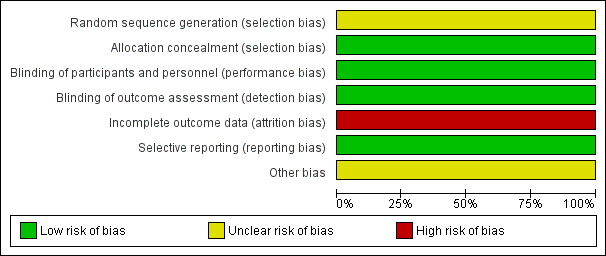
Further details of this assessment are available in the relevant section of the Characteristics of included studies table and are also presented in the 'Risk of bias' graph (Figure 2) and 'Risk of bias' summary (Figure 3).

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
Allocation
As described in the study protocols, randomisation took place across all study sites using a centralised Interactive Voice Response System (IVRS). The randomisation was stratified by site. At randomisation, the centralised IVRS assigned a unique six‐digit subject identification number to each participant (the first segment of the number represents the study site and the second segment of the number represents the participant at that study site). However, the specific method of random sequence generation was not described. The risk of selection bias was unclear. For the MRI outcomes, there was a high risk of selection bias in both studies because the participants in MRI cohort were selected by each study site with MRI capabilities itself, which led to an obvious heterogeneity between the studies.
Blinding
A double‐blinded design was used in both studies. The participants, personnel and outcome assessors were blinded to the assignment to dimethyl fumarate and placebo. Only the outcome assessors were blinded to the assignment to glatiramer acetate. The risks of performance bias and detection bias were low. However, despite that patients were instructed to take the assigned study drug at least four hours before study visits in order to keep the personnel and investigators unaware of the assignment to dimethyl fumarate, the most frequent side effect of flushing made it likely that patients could become unblinded during the course of the trial.
Incomplete outcome data
A total of 282 (22.8%) patients in Gold 2012 and 290 (20.3%) patients in Fox 2012 withdrew from study over a period of two years. The unbalanced reasons for withdrawal among groups, along with an high overall dropout rate of 21.4%, contributed to a high risk of attrition bias.
Selective reporting
All listed outcomes were reported adequately in the study. The risk of reporting bias was low.
Other potential sources of bias
The study was funded by Biogen Idec. Data were gathered by the investigators and were analysed by the sponsor (Biogen Idec). Conflict of interests may exist.
Effects of interventions
See: Summary of findings for the main comparison Dimethyl fumarate for multiple sclerosis
See: summary of findings Table for the main comparison. There were no available data at the first year of follow‐up.
Primary outcomes
Benefit
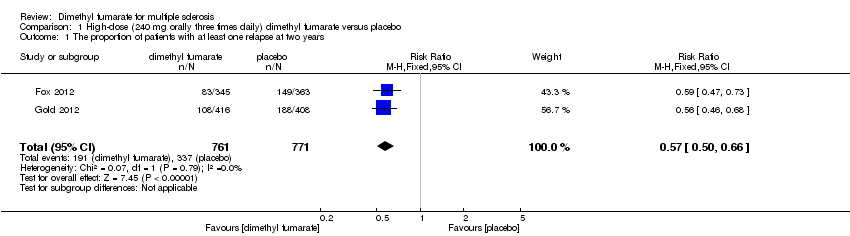
(1) The proportion of patients with at least one relapse at two years of follow‐up
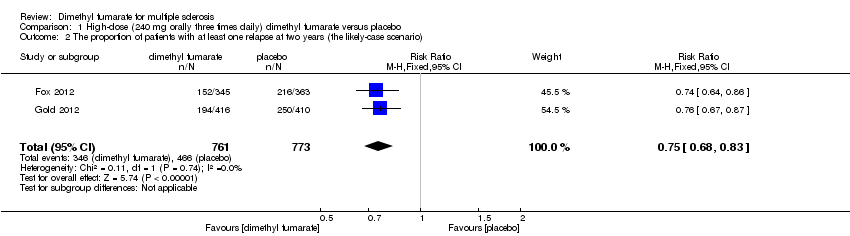
Overall, the risk of new relapse in participants receiving high‐dose and low‐dose dimethyl fumarate was 25.10% and 27.96% respectively, significantly lower than that in participants receiving placebo (43.71%), the risk difference (RD) was 18.61% and 15.75% respectively. Compared to placebo, the pooled risk ratio (RR) with high‐dose dimethyl fumarate administration was 0.57 (95% confidence interval (CI) 0.50 to 0.66, P < 0.00001; two studies 1532 participants (Analysis 1.1)), and the NNTB was 5, which means that there need to treat five patients with high‐dose dimethyl fumarate to prevent one patient against relapse during the two years of follow‐up. By contrast, the pooled RR with low‐dose dimethyl fumarate administration was 0.64 (95% CI 0.54 to 0.77, P < 0.00001; two studies 1540 participants (Analysis 2.1)), and the NNTB was 6, which means that there need to treat six patients with low‐dose dimethyl fumarate to prevent one patient against relapse during the two years of follow‐up. Assuming participants who withdrew from study both in experimental groups and control group had a relapse, the likely‐case scenario analysis showed both dosages of dimethyl fumarate reduced the number of patients with relapse at two years of follow‐up (RR = 0.75, 95% CI 0.68 to 0.83, P < 0.00001; two studies 1534 participants (Analysis 1.2) and RR = 0.81, 95% CI 0.74 to 0.89, P < 0.0001; two studies 1546 participants (Analysis 2.2), respectively).
Compared to glatiramer acetate, there was a significant difference in reducing the number of patients with relapse for high dosage of dimethyl fumarate (RR = 0.75, 95% CI 0.59 to 0.96, P = 0.02); but no difference for low dosage (RR = 0.91, 95% CI 0.72 to 1.13, P = 0.38). Taking the effect of dropouts into consideration, there was no difference in the likely‐case scenario analysis (RR = 0.91, 95% CI 0.78 to 1.07, P = 0.26 and RR = 1.01, 95% CI 0.87 to 1.17, P = 0.94, respectively).
(2) The proportion of patients with disability worsening as assessed by the EDSS at two years of follow‐up
Disability worsening was confirmed at least 12 weeks (less than six months) in both studies. Based on such data, the risk of disability worsening in participants receiving high‐dose and low‐dose dimethyl fumarate was 15.77% and 14.58% respectively, which were lower than that in participants receiving placebo (22.31%), the RD was 6.54% and 7.73% respectively. Compared to placebo, the pooled RR with high‐dose dimethyl fumarate administration was 0.70 (95% CI 0.57 to 0.87, P = 0.0009; two studies 1532 participants (Analysis 1.4)), and the NNTB was 15, which means that there need to treat 15 patients with high‐dose dimethyl fumarate to prevent one patient against disability worsening during the two years of follow‐up. By contrast, the pooled RR with low‐dose dimethyl fumarate administration was 0.65 (95% CI 0.53 to 0.81, P = 0.0001; two studies 1539 participants (Analysis 2.4)), and the NNTB was 13, which means that there need to treat 13 patients with low‐dose dimethyl fumarate to prevent one patient against disability worsening during the two years of follow‐up. Assuming all dropouts from experimental groups and control group had disability worsening, the likely‐case scenario analysis showed both dosages of dimethyl fumarate reduced the number of patients with disability worsening at two years of follow‐up (RR = 0.85, 95% CI 0.75 to 0.97, P = 0.01; two studies 1534 participants (Analysis 1.5) and RR = 0.83, 95% CI 0.73 to 0.94, P = 0.004; two studies 1546 participants (Analysis 2.5), respectively).
Compared to glatiramer acetate, there was no significant difference in reducing the number of patients with disability worsening for both dosages of dimethyl fumarate (high dosage: RR = 0.82, 95% CI 0.57 to 1.17, P = 0.27; low dosage: RR = 0.82, 95% CI 0.57 to 1.17, P = 0.27). Taking the effect of dropouts into consideration, there was no difference in the likely‐case scenario in sensitivity analysis (RR = 1.01, 95% CI 0.81 to 1.25, P = 0.95 and RR = 1.01, 95% CI 0.82 to 1.25, P = 0.91, respectively).
Safety
(1) The number of patients with at least one adverse event (AE) at two years of follow‐up
Overall, compared with placebo group, the pooled results showed that the incidence of AEs excluding relapses was significantly increased by both dosages of dimethyl fumarate administration (high dosage: RR = 1.38, 95% CI 1.27 to 1.51, P < 0.00001; two studies 1531 participants (Analysis 1.8); low dosage: RR = 1.37, 95% CI 1.25 to 1.49, P < 0.00001; two studies 1540 participants (Analysis 2.8), respectively). The most common AEs included flushing (high dosage: RR = 6.57, 95% CI 4.62 to 9.35, P < 0.00001; two studies 1531 participants (Analysis 1.11); low dosage: RR = 8.01, 95% CI 5.66 to 11.34, P < 0.00001; two studies 1540 participants (Analysis 2.11)); upper abdominal pain (RR = 1.91, 95% CI 1.35 to 2.69, P = 0.0003; two studies 1531 participants (Analysis 1.12) and RR = 1.69, 95% CI 1.19 to 2.41, P = 0.004; two studies 1540 participants (Analysis 2.12), respectively); nausea (RR= 1.59, 95% CI 1.19 to 2.12, P = 0.002); two studies 1531 participants (Analysis 1.13) and RR= 1.39, 95% CI 1.03 to 1.87, P = 0.03; two studies 1540 participants (Analysis 2.13), respectively); diarrhoea (RR = 1.55, 95% CI 1.20 to 2.01, P = 0.0008); two studies 1531 participants (Analysis 1.14) and RR = 1.31, 95% CI 0.91 to 1.87, P = 0.14; two studies 1540 participants (Analysis 2.14), respectively); and proteinuria (RR = 1.46, 95% CI 1.06 to 2.00, P = 0.02; two studies 1531 participants (Analysis 1.15) and RR = 1.14, 95% CI 0.81 to 1.59, P = 0.45; two studies 1540 participants (Analysis 2.15), respectively). Other uncommon AEs associated with dimethyl fumarate administration included lymphopenia (RR = 5.25, 95% CI 2.20 to 12.51, P = 0.0002; two studies 1531 participants (Analysis 1.16) and RR = 5.69, 95% CI 2.40 to 13.46, P < 0.0001; two studies 1540 participants (Analysis 2.16), respectively) and leukopenia (RR = 5.23, 95% CI 2.47 to 11.07, P < 0.0001; two studies 1531 participants (Analysis 1.17) and RR = 6.53, 95% CI 3.13 to 13.64, P < 0.00001; two studies 1540 participants (Analysis 2.17), respectively). There was no difference in the number of patients with an increased alanine aminotransferase level at least three times the upper limit of the normal range at two years (RR = 1.34, 95% CI 0.61 to 2.94, P = 0.46; two studies 1531 participants (Analysis 1.18) and RR = 1.33, 95% CI 0.57 to 3.07, P = 0.51; two studies 1540 participants (Analysis 2.18), respectively). Overall, the incidence of gastrointestinal events (including upper abdominal pain, nausea and diarrhoea) was increased by both dosages (RR = 1.67, 95% CI 1.31 to 2.12, P < 0.0001; two studies 1531 participants (Analysis 1.19) and RR = 1.43, 95% CI 1.11 to 1.85, P = 0.005; two studies 1540 participants (Analysis 2.19), respectively). In terms of infections, the was no difference either in the number of patients with infections (RR = 1.08, 95% CI 0.99 to 1.17, P = 0.08; two studies 1531 participants (Analysis 1.20) and RR = 1.04, 95% CI 0.92 to 1.18, P = 0.54; two studies 1540 participants (Analysis 2.20), respectively) and in the number of patients with serious infections (RR = 1.38, 95% CI 0.64 to 2.98, P = 0.41; two studies 1531 participants (Analysis 1.21) and RR = 1.55, 95% CI 0.73 to 3.28, P = 0.25; two studies 1540 participants (Analysis 2.21), respectively). No opportunistic infections were reported in any experimental group.
(2) The number of patients with at least one SAE at two years of follow‐up
The pooled risk of SAEs excluding relapses both in participants receiving high‐dose and low‐dose dimethyl fumarate was not higher than that in participants receiving placebo (RR = 1.07, 95% CI 0.75 to 1.53, P = 0.71; two studies 1531 participants (Analysis 1.9) and RR = 1.05, 95% CI 0.63 to 1.74, P = 0.87; two studies 1540 participants (Analysis 2.9), respectively).
(3) The number of patients who discontinued study drug because of AEs at two years of follow‐up
There was a significant difference in the number of patients who discontinued study drug because of AEs excluding relapses between participants receiving dimethyl fumarate and participants receiving placebo (high dosage: RR = 2.16 (95% CI 1.54 to 3.03, P < 0.00001); two studies 1531 participants (Analysis 1.10); low dosage: RR = 2.18 (95% CI 1.56 to 3.06, P < 0.00001; two studies 1540 participants (Analysis 2.10)). Overall, the incidences of study drug discontinuation due to adverse effects both in high‐dose group and low‐dose group, such as diarrhoea (1.97% and 0.91%, respectively), flushing (1.58% and 3.12%, respectively), nausea (1.58% and 0.78%, respectively) and upper abdominal pain (1.32% and 0.78%, respectively) were low.
Secondary outcomes
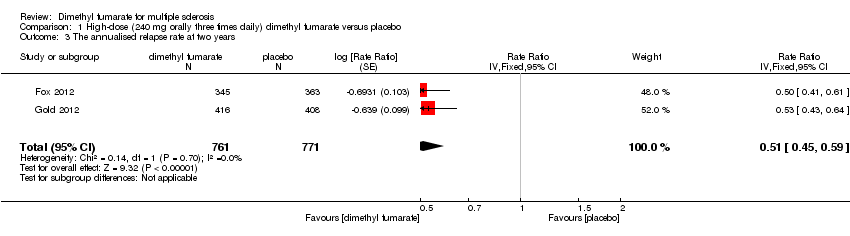
(1) The ARR at two years of follow‐up
Compared to placebo, the pooled results showed both dosages of dimethyl fumarate significantly reduced the ARR at two years of follow‐up (high dosage: rate ratio = 0.51, 95% CI 0.45 to 0.59, P < 0.00001; two studies 1532 participants (Analysis 1.3); low dosage: rate ratio = 0.51, 95% CI 0.44 to 0.59, P < 0.00001; two studies 1540 participants (Analysis 2.3)) .
Compared to glatiramer acetate, there was a significant difference in reducing the ARR for both dosages (high dosage: rate ratio = 0.69, 95% CI 0.56 to 0.86, P = 0.0007; low dosage: rate ratio = 0.76, 95% CI 0.62 to 0.94, P = 0.01).
(2) The number of gadolinium‐enhancing T1‐weighted lesions at two years of follow‐up
We did not conduct meta‐analyses for the data of active lesions on MRI scans as there was a high risk of selection bias for MRI outcomes in both studies, which led to an obvious heterogeneity between the studies. Moreover, MRI data reported in both studies showed imprecision because an improper method was used to handle the missing data. We calculated the rate ratio using the available MRI data in each study.
Compared to placebo, there was a significant difference in reducing the number of gadolinium‐enhancing T1‐weighted lesions for both dosages of dimethyl fumarate in Gold 2012 (high dosage: rate ratio = 0.28, 95% CI 0.22 to 0.36, P < 0.00001; low dosage: rate ratio = 0.06, 95% CI 0.03 to 0.09, P < 0.00001), as well as in Fox 2012 (high dosage: rate ratio = 0.25, 95% CI 0.19 to 0.32, P < 0.00001; low dosage: rate ratio = 0.25, 95% CI 0.19 to 0.32, P < 0.00001). Compared to glatiramer acetate, there was a significant difference in reducing the number of gadolinium‐enhancing T1‐weighted lesions for both dosages of dimethyl fumarate (high dosage: rate ratio = 0.57, 95% CI 0.41 to 0.78, P = 0.0005; low dosage: rate ratio = 0.71, 95% CI 0.53 to 0.95, P = 0.02).
(3) The number of new or enlarging T2‐weighted hyperintense lesions at two years of follow‐up
Compared to placebo, there was a significant difference in reducing the number of new or enlarging T2‐weighted hyperintense lesions for both dosages of dimethyl fumarate in Gold 2012 (high dosage: rate ratio = 0.26, 95% CI 0.24 to 0.28, P < 0.00001; low dosage: rate ratio = 0.15, 95% CI 0.14 to 0.17, P < 0.00001), as well as in Fox 2012 (high dosage: rate ratio = 0.27, 95% CI 0.25 to 0.29, P < 0.00001; low dosage: rate ratio = 0.29, 95% CI 0.27 to 0.32, P < 0.00001). Compared to glatiramer acetate, there was a significant difference in reducing the number of new or enlarging T2‐weighted hyperintense lesions for both dosages of dimethyl fumarate (high dosage: rate ratio = 0.59, 95% CI 0.54 to 0.65, P < 0.00001; low dosage: rate ratio = 0.64, 95% CI 0.58 to 0.70, P < 0.00001).
(4) Mean change in HRQoL measured with SF‐36 from baseline to two years
Data from two studies with a total of 1461 patients were available to analyse the mean change in HRQoL measured with SF‐36 from baseline to two years. Compared to placebo, the pooled results showed treatment with dimethyl fumarate slightly improved the physical HRQoL measured by mean change in SF‐36 Physical Component Summary (PCS) scores from baseline to two years (high dosage: mean difference (MD) = 1.51, 95% CI 0.76 to 2.26, P < 0.0001; two studies 1461 participants (Analysis 1.6); low dosage: MD = 1.54, 95% CI 0.79 to 2.30, P < 0.0001; two studies 1474 participants (Analysis 2.6)), but did not improve the mental HRQoL measured by mean change in SF‐36 Mental Component Summary (MCS) scores from baseline to two years (high dosage: MD = 1.19, 95% CI ‐ 0.70 to 3.08, P = 0.22; two studies 1461 participants (Analysis 1.7); low dosage: MD = 0.93, 95% CI ‐ 0.06 to 1.93, P = 0.07; two studies 1474 participants (Analysis 2.7)).
Discusión
Resumen de los resultados principales
Esta revisión sistemática incluyó solamente dos ensayos controlados aleatorios (ECA) con 2667 pacientes adultos con esclerosis múltiple recurrente‐remitente (EMRR). Todos los participantes tenían una puntuación de 0 a 5 en la Expanded Disability Status Scale (EDSS) y una actividad de la enfermedad con al menos una recurrencia en los 12 meses anteriores o al menos una lesión resaltada con gadolinio durante las seis semanas anteriores. Ambos estudios intentaron evaluar el efecto beneficioso del dimetilfumarato como monoterapia versus placebo con respecto a las recurrencias, el empeoramiento de la discapacidad, las lesiones cerebrales, la CdVRS y la seguridad durante un período de dos años. Un ECA fue excluido debido a la duración del seguimiento inferior a un año. Ambos estudios incluidos en esta revisión fueron informados en múltiples publicaciones. Las características, incluyendo el diseño del estudio, tipos de participantes, intervenciones y medidas de resultado fueron similares. No hubo heterogeneidad clínica ni metodológica obvia entre los estudios. Sin embargo, ambos estudios presentaron un riesgo alto de sesgo de deserción como resultado de una tasa general alta de abandonos y del desequilibrio en los motivos de los abandonos entre los grupos durante los dos años de seguimiento, lo que se combinó con el fracaso en la inclusión de todos los pacientes asignados al azar en el análisis por intención de tratar.
En comparación con placebo, la administración de dimetilfumarato a una dosis de 240 mg por vía oral tres veces al día o dos veces al día redujo significativamente el número de pacientes con recurrencias o empeoramiento de la discapacidad a los dos años. El escenario de casos probables en el análisis de sensibilidad mostró una reducción en los efectos del tratamiento, que todavía fueron significativos, sobre los dos resultados para ambas dosis. El efecto beneficioso de ambas dosis fue similar para ambos resultados. En comparación con placebo, también hubo un efecto del tratamiento similar sobre la TAR para ambas dosis. Ambos tratamientos con dimetilfumarato mejoraron ligeramente la CdVRS física en comparación con placebo, aunque no mejoraron los aspectos mentales de la CdVRS medidos con el 36‐SF. En comparación con acetato de glatiramer, al considerar el efecto de los abandonos, no hubo diferencias en cuanto a la reducción del número de pacientes con recurrencias o empeoramiento de la discapacidad para ambas dosis de dimetilfumarato; sin embargo, estos resultados, junto con el efecto estadístico de la TAR, fueron poco convincentes debido a la falta de poder estadístico. No se realizaron metanálisis para los resultados de la IRM debido a que hubo un riesgo alto de sesgo de selección para los resultados de la IRM y falta de precisión de los datos de la IRM en ambos estudios, así como una heterogeneidad obvia entre los estudios. Los resultados estadísticos sobre los hallazgos de la IRM en ambos estudios fueron poco convincentes.
En general, los pacientes del grupo placebo tendieron a presentar recurrencias con mayor frecuencia, lo que representó una gran parte de los EA en el grupo placebo. Después de excluir las recurrencias, los riesgos de otros EA en los participantes que recibieron dimetilfumarato fueron algo mayores que en los participantes que recibieron placebo, aunque los riesgos de interrupción del fármaco de estudio debido a otros EA aumentaron a causa de la administración de ambas dosis de dimetilfumarato. Los EA más frecuentes incluyeron sofocos, dolor en el abdomen superior, náuseas y diarrea. La incidencia de estos eventos fue más alta en el primer mes de tratamiento y disminuyó posteriormente. Los EA poco frecuentes, aunque asociados con la administración de dimetilfumarato, incluyeron linfopenia y leucopenia. A pesar de lo anterior, la administración de dimetilfumarato no aumentó la incidencia de infecciones ni de infecciones graves; se debe señalar que los pacientes que reciben dimetilfumarato pueden correr el riesgo de desarrollar una infección cerebral poco frecuente y grave denominada leucoencefalopatía multifocal progresiva (Ermis 2013, Sweetser 2013, van Oosten 2013). Últimamente, la Food and Drug Administration (FDA) de los Estados Unidos advirtió que un paciente con EM que recibía tratamiento con Tecfidera™ (dimetilfumarato) desarrolló leucoencefalopatía multifocal progresiva y posteriormente murió. Como resultado, la información que describe este caso de leucoencefalopatía multifocal progresiva (PML por sus siglas en inglés) se agrega a la etiqueta de Tecfidera™ (Food and Drug Administration de los EE.UU., 2014).
Compleción y aplicabilidad general de las pruebas
En esta revisión, se excluyó un ECA debido a la duración del seguimiento, inferior a un año. En general, el tratamiento modificador de la enfermedad para la EM necesita una duración de la administración y un seguimiento adecuados para determinar con exactitud los resultados de los efectos beneficiosos y la seguridad. Una duración mínima de la administración de un año, predefinida en los criterios de los tipos de intervenciones, fue una duración razonable del tratamiento que en parte evitó la inclusión de pruebas erróneas. Ningún estudio se dirigió a otros fenotipos de EM. Los datos limitados se derivaron de dos ECA específicos para los pacientes con EMRR. Los metanálisis se realizaron según las dos frecuencias diferentes de administración y se utilizaron los datos disponibles de dichos pacientes. Las pruebas de esta revisión solamente son aplicables a los adultos con EMRR que presentan una puntuación de 0 a 5 en la EDSS y una actividad de la enfermedad con al menos una recurrencia en los 12 meses anteriores o al menos una lesión resaltada con gadolinio durante las seis semanas anteriores.
Calidad de la evidencia
En esta revisión se incluyeron dos ECA con 2667 pacientes adultos con EMRR para evaluar principalmente el efecto beneficioso y la seguridad de dos dosis de dimetilfumarato (240 mg por vía oral tres veces al día o dos veces al día) mediante la comparación directa con placebo. En general no hubo heterogeneidad clínica ni metodológica obvia entre los estudios. Ambos estudios tuvieron un sesgo alto de deserción, lo que dio lugar a pruebas de calidad moderada en la mayoría de los resultados primarios. Los resultados de empeoramiento de la discapacidad estuvieron sujetos además a la falta de direccionalidad de las pruebas debido a que el empeoramiento de la discapacidad se confirmó en menos de seis meses en ambos estudios. Todos estos factores contribuyeron a una baja calidad de las pruebas para el empeoramiento de la discapacidad. La calidad de los datos de la IRM informados en los estudios primarios fue deficiente.
Sesgos potenciales en el proceso de revisión
Se realizó una búsqueda extensa y exhaustiva para limitar el sesgo en el proceso de revisión. En esta revisión dos revisores evaluaron de forma independiente la elegibilidad de los estudios para inclusión y realizaron la extracción de los datos lo que redujo la posibilidad de sesgo adicional más allá del detallado en las tablas de "Riesgo de sesgo". Los autores de esta revisión no tenían ningún conflicto de interés.
Acuerdos y desacuerdos con otros estudios o revisiones
Recientemente una revisión sistemática (Kawalec 2014) incluyó todos los ECA disponibles para evaluar la efectividad de la monoterapia con dimetilfumarato en el tratamiento de la EMRR. Los autores incluyeron tres estudios en la síntesis cualitativa. Entre ellos, dos estudios también incluidos en esta revisión sistemática fueron elegibles para los metanálisis. Los autores no consideraron completamente las influencias potenciales del sesgo sobre la validez interna de los resultados y no realizaron un análisis integral para la calidad de las pruebas. En la presente revisión se evaluó la repercusión de los cinco factores GRADE (limitaciones en el diseño o la ejecución del estudio [riesgo de sesgo], inconsistencia en los resultados, falta de precisión de los resultados, falta de direccionalidad, sesgo de publicación) sobre la calidad de las pruebas para los resultados.

Study flow diagram.
'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 1 The proportion of patients with at least one relapse at two years.
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 2 The proportion of patients with at least one relapse at two years (the likely‐case scenario).
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 3 The annualised relapse rate at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 4 The proportion of patients with disability worsening at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 5 The proportion of patients with disability worsening at two years (the likely‐case scenario).
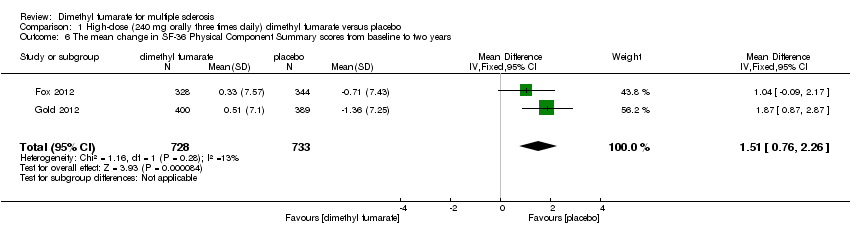
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 6 The mean change in SF‐36 Physical Component Summary scores from baseline to two years.
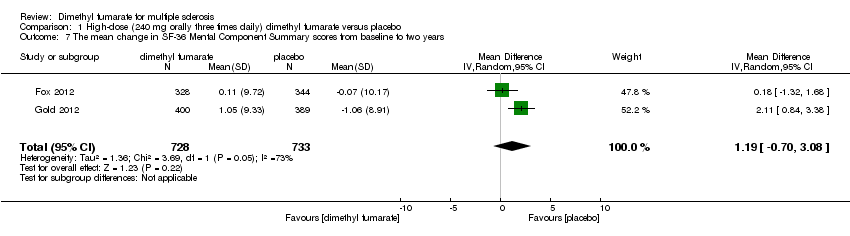
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 7 The mean change in SF‐36 Mental Component Summary scores from baseline to two years.
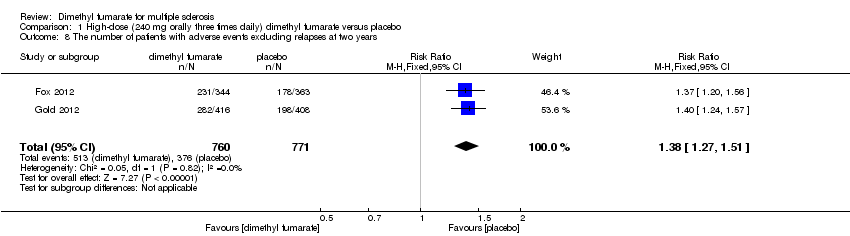
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 8 The number of patients with adverse events excluding relapses at two years.
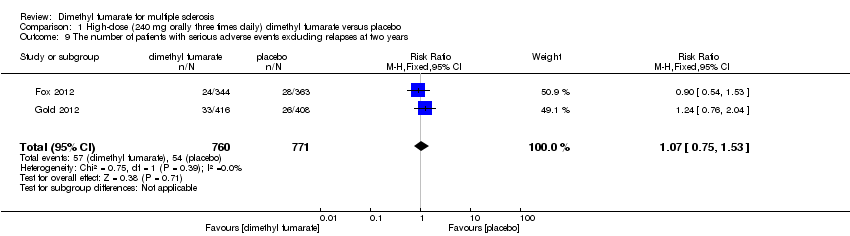
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 9 The number of patients with serious adverse events excluding relapses at two years.
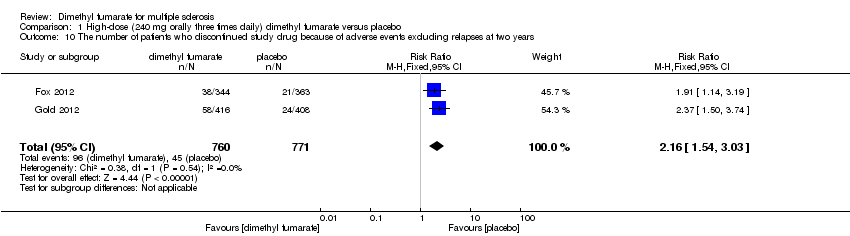
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 10 The number of patients who discontinued study drug because of adverse events excluding relapses at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 11 The number of patients with flushing at two years.
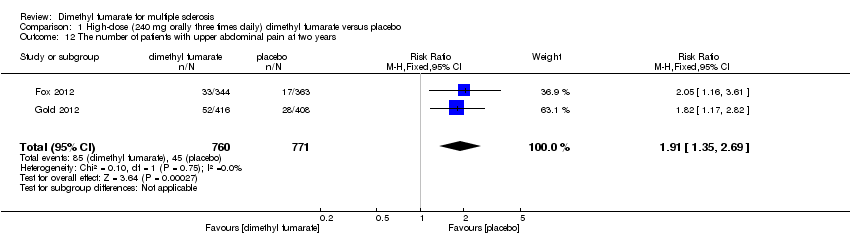
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 12 The number of patients with upper abdominal pain at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 13 The number of patients with nausea at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 14 The number of patients with diarrhoea at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 15 The number of patients with proteinuria at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 16 The number of patients with a decreased lymphocyte count of less than 0.5×109 per litre at two years.
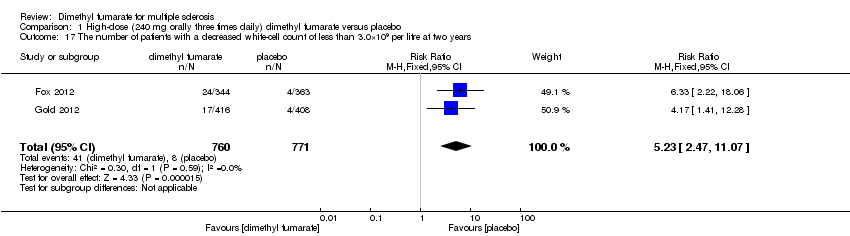
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 17 The number of patients with a decreased white‐cell count of less than 3.0×109 per litre at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 18 The number of patients with an increased alanine aminotransferase level at least three times the upper limit of the normal range at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 19 The number of patients with gastrointestinal events at two years.
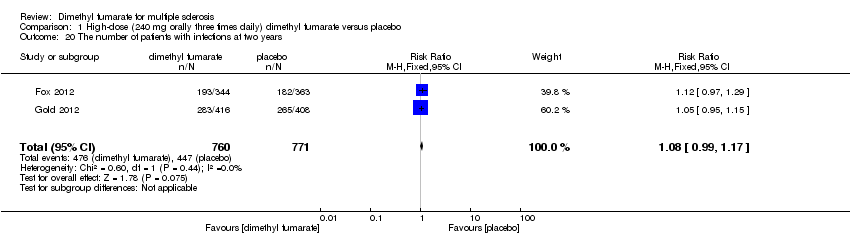
Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 20 The number of patients with infections at two years.

Comparison 1 High‐dose (240 mg orally three times daily) dimethyl fumarate versus placebo, Outcome 21 The number of patients with serious infections at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 1 The proportion of patients with at least one relapse at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 2 The proportion of patients with at least one relapse at two years (the likely‐case scenario).
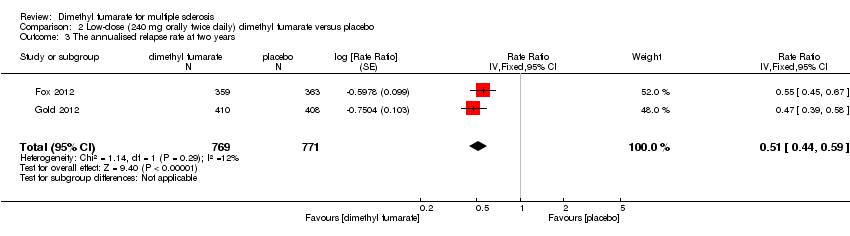
Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 3 The annualised relapse rate at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 4 The proportion of patients with disability worsening at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 5 The proportion of patients with disability worsening at two years (the likely‐case scenario).
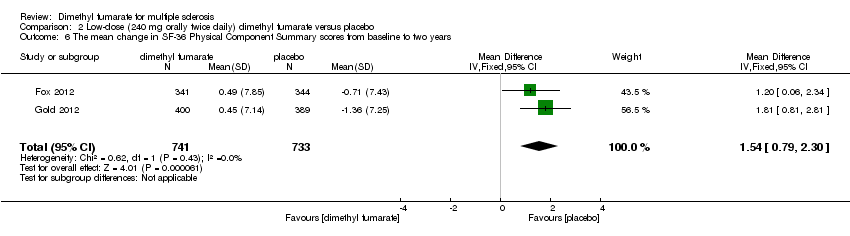
Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 6 The mean change in SF‐36 Physical Component Summary scores from baseline to two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 7 The mean change in SF‐36 Mental Component Summary scores from baseline to two years.
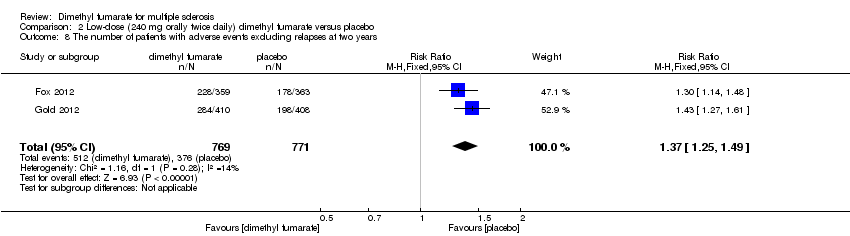
Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 8 The number of patients with adverse events excluding relapses at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 9 The number of patients with serious adverse events excluding relapses at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 10 The number of patients who discontinued study drug because of adverse events excluding relapses at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 11 The number of patients with flushing at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 12 The number of patients with upper abdominal pain at two years.
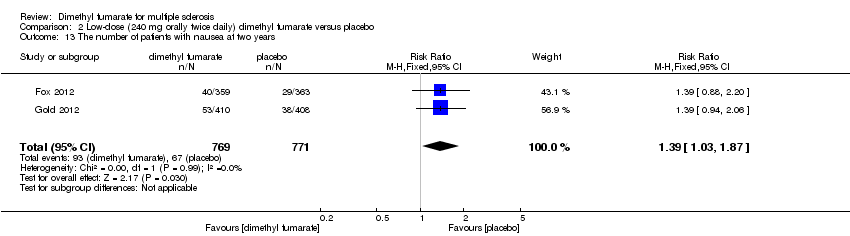
Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 13 The number of patients with nausea at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 14 The number of patients with diarrhoea at two years.
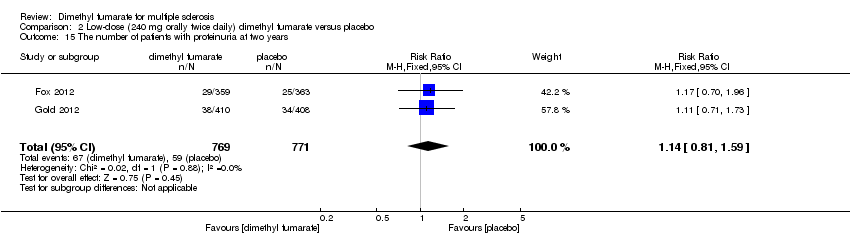
Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 15 The number of patients with proteinuria at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 16 The number of patients with a decreased lymphocyte count of less than 0.5×109 per litre at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 17 The number of patients with a decreased white‐cell count of less than 3.0×109 per litre at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 18 The number of patients with an increased alanine aminotransferase level at least three times the upper limit of the normal range at two years.
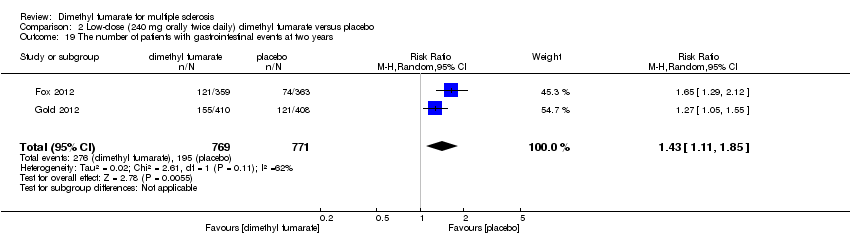
Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 19 The number of patients with gastrointestinal events at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 20 The number of patients with infections at two years.

Comparison 2 Low‐dose (240 mg orally twice daily) dimethyl fumarate versus placebo, Outcome 21 The number of patients with serious infections at two years.
| Dimethyl fumarate for multiple sclerosis | ||||||
| Patient or population: Patients with relapsing‐remitting multiple sclerosis | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Placebo | Dimethyl fumarate | |||||
| The proportion of patients with at least one relapse at two years | Study population | RR 0.64 | 1540 | ⊕⊕⊕⊝ | ||
| 437 per 1000 | 280 per 1000 | |||||
| The proportion of patients with disability worsening at two years | Study population | RR 0.65 | 1539 | ⊕⊕⊝⊝ | ||
| 223 per 1000 | 145 per 1000 | |||||
| The proportion of patients who discontinued study drug because of adverse events excluding relapses at two years | Study population | RR 2.18 | 1540 | ⊕⊕⊕⊝ | ||
| 58 per 1000 | 127 per 1000 | |||||
| The proportion of patients with lymphopenia at two years Follow‐up: 2 years | Study population | RR 5.69 | 1540 | ⊕⊕⊕⊝ | ||
| 8 per 1000 | 44 per 1000 | |||||
| *The basis for the assumed risk (e.g. the median placebo group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 A high rate of dropouts existed and reasons of dropouts were unbalanced between arms | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 The proportion of patients with at least one relapse at two years Show forest plot | 2 | 1532 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.57 [0.50, 0.66] |
| 2 The proportion of patients with at least one relapse at two years (the likely‐case scenario) Show forest plot | 2 | 1534 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.75 [0.68, 0.83] |
| 3 The annualised relapse rate at two years Show forest plot | 2 | 1532 | Rate Ratio (Fixed, 95% CI) | 0.51 [0.45, 0.59] |
| 4 The proportion of patients with disability worsening at two years Show forest plot | 2 | 1532 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.70 [0.57, 0.87] |
| 5 The proportion of patients with disability worsening at two years (the likely‐case scenario) Show forest plot | 2 | 1534 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.85 [0.75, 0.97] |
| 6 The mean change in SF‐36 Physical Component Summary scores from baseline to two years Show forest plot | 2 | 1461 | Mean Difference (IV, Fixed, 95% CI) | 1.51 [0.76, 2.26] |
| 7 The mean change in SF‐36 Mental Component Summary scores from baseline to two years Show forest plot | 2 | 1461 | Mean Difference (IV, Random, 95% CI) | 1.19 [‐0.70, 3.08] |
| 8 The number of patients with adverse events excluding relapses at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.38 [1.27, 1.51] |
| 9 The number of patients with serious adverse events excluding relapses at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.07 [0.75, 1.53] |
| 10 The number of patients who discontinued study drug because of adverse events excluding relapses at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.16 [1.54, 3.03] |
| 11 The number of patients with flushing at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 6.57 [4.62, 9.35] |
| 12 The number of patients with upper abdominal pain at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.91 [1.35, 2.69] |
| 13 The number of patients with nausea at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.59 [1.19, 2.12] |
| 14 The number of patients with diarrhoea at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.55 [1.20, 2.01] |
| 15 The number of patients with proteinuria at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.46 [1.06, 2.00] |
| 16 The number of patients with a decreased lymphocyte count of less than 0.5×109 per litre at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 5.25 [2.20, 12.51] |
| 17 The number of patients with a decreased white‐cell count of less than 3.0×109 per litre at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 5.23 [2.47, 11.07] |
| 18 The number of patients with an increased alanine aminotransferase level at least three times the upper limit of the normal range at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Random, 95% CI) | 1.34 [0.61, 2.94] |
| 19 The number of patients with gastrointestinal events at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Random, 95% CI) | 1.67 [1.31, 2.12] |
| 20 The number of patients with infections at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.08 [0.99, 1.17] |
| 21 The number of patients with serious infections at two years Show forest plot | 2 | 1531 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.38 [0.64, 2.98] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 The proportion of patients with at least one relapse at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Random, 95% CI) | 0.64 [0.54, 0.77] |
| 2 The proportion of patients with at least one relapse at two years (the likely‐case scenario) Show forest plot | 2 | 1546 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.81 [0.74, 0.89] |
| 3 The annualised relapse rate at two years Show forest plot | 2 | 1540 | Rate Ratio (Fixed, 95% CI) | 0.51 [0.44, 0.59] |
| 4 The proportion of patients with disability worsening at two years Show forest plot | 2 | 1539 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.65 [0.53, 0.81] |
| 5 The proportion of patients with disability worsening at two years (the likely‐case scenario) Show forest plot | 2 | 1546 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.83 [0.73, 0.94] |
| 6 The mean change in SF‐36 Physical Component Summary scores from baseline to two years Show forest plot | 2 | 1474 | Mean Difference (IV, Fixed, 95% CI) | 1.54 [0.79, 2.30] |
| 7 The mean change in SF‐36 Mental Component Summary scores from baseline to two years Show forest plot | 2 | 1474 | Mean Difference (IV, Fixed, 95% CI) | 0.93 [‐0.06, 1.93] |
| 8 The number of patients with adverse events excluding relapses at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.37 [1.25, 1.49] |
| 9 The number of patients with serious adverse events excluding relapses at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Random, 95% CI) | 1.05 [0.63, 1.74] |
| 10 The number of patients who discontinued study drug because of adverse events excluding relapses at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.18 [1.56, 3.06] |
| 11 The number of patients with flushing at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Fixed, 95% CI) | 8.01 [5.66, 11.34] |
| 12 The number of patients with upper abdominal pain at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.69 [1.19, 2.41] |
| 13 The number of patients with nausea at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.39 [1.03, 1.87] |
| 14 The number of patients with diarrhoea at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Random, 95% CI) | 1.31 [0.91, 1.87] |
| 15 The number of patients with proteinuria at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.14 [0.81, 1.59] |
| 16 The number of patients with a decreased lymphocyte count of less than 0.5×109 per litre at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Fixed, 95% CI) | 5.69 [2.40, 13.46] |
| 17 The number of patients with a decreased white‐cell count of less than 3.0×109 per litre at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Fixed, 95% CI) | 6.53 [3.13, 13.64] |
| 18 The number of patients with an increased alanine aminotransferase level at least three times the upper limit of the normal range at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Random, 95% CI) | 1.33 [0.57, 3.07] |
| 19 The number of patients with gastrointestinal events at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Random, 95% CI) | 1.43 [1.11, 1.85] |
| 20 The number of patients with infections at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Random, 95% CI) | 1.04 [0.92, 1.18] |
| 21 The number of patients with serious infections at two years Show forest plot | 2 | 1540 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.55 [0.73, 3.28] |

