Zuclopentixol versus placebo para la esquizofrenia
Resumen
Antecedentes
El zuclopentixol es un antipsicótico más antiguo que tiene tres formulaciones diferenciadas (diclorhidrato de zuclopentixol, acetato de zuclopentixol o Acuphase y decanoato de zuclopentixol). Aunque ha sido de uso habitual por muchos años, no se han realizado revisiones sistemáticas previas de su eficacia en comparación con placebo para la esquizofrenia.
Objetivos
Evaluar la efectividad de todas las formulaciones de zuclopentixol en comparación con un placebo para la esquizofrenia.
Métodos de búsqueda
El 6 noviembre 2013 y 20 octubre 2015, se hicieron búsquedas en el registro de ensayos del Grupo Cochrane de Esquizofrenia (Cochrane Schizophrenia Group), que se basa en búsquedas regulares en MEDLINE, EMBASE, CINAHL, BIOSIS, AMED, PubMed, PsycINFO y en registros de ensayos clínicos. También se verificaron las referencias de todos los estudios incluidos y se contactó con los autores de los estudios incluidos para obtener estudios y datos relevantes.
Criterios de selección
Se incluyeron todos los ensayos controlados aleatorios que compararon zuclopentixol en cualquier forma con placebo para el tratamiento de la esquizofrenia o las psicosis similares a la esquizofrenia.
Obtención y análisis de los datos
Los datos se extrajeron y verificaron de forma independiente. Se identificó solamente un número pequeño de estudios, por lo que todos se revisaron en forma cruzada. Se calcularon los riesgos relativos (RR) de efectos fijos y los intervalos de confianza (IC) del 95% para los datos dicotómicos. El análisis se realizó por intención de tratar. De ser posible, los resultados continuos se convirtieron a resultados dicotómicos. Cuando lo anterior no fue posible se utilizaron las diferencias de medias (DM) para las variables continuas. Se evaluó el riesgo de sesgo de los estudios y se utilizó GRADE (Grading of Recommendations Assessment, Development and Evaluation) para crear una tabla "Resumen de los hallazgos".
Resultados principales
Solamente dos estudios, con un total de 65 participantes, fueron elegibles para la inclusión en la revisión. En general la calidad de los dos estudios fue baja, con poblaciones de estudio pequeñas y fuentes significativas de sesgo, por lo que no fue posible utilizar todos los datos en las comparaciones. . Los estudios fueron tan antiguos como de 1968 y 1972 y es poco probable que aprobaran las normas modernas de revisión por pares. Solamente fue posible encontrar datos a corto plazo y exclusivamente de ensayos que asignaron al azar a diclorhidrato de zuclopentixol. También se esperaba identificar datos de comparaciones de acetato de zuclopentixol versus placebo y decanoato de zuclopentixol versus placebo. No fue posible identificar estudios que incluyeran datos sobre estos dos fármacos utilizados ampliamente.
Para el resultado primario de interés, mejoría clínicamente significativa, se encontró un estudio que proporcionó datos utilizables. El estado general medido a través de la mejoría en la escala Clinical Global Impression (CGI) mostró diferentes calificaciones cuando se evaluó por un psiquiatra o el personal de enfermería. Las puntuaciones del psiquiatra no lograron significación estadística; sin embargo, cuando se evaluó por el personal de enfermería, la diferencia a favor del zuclopentixol alcanzó la significación estadística (un ECA, n = 29; RR 2,57; IC del 95%: 1,06 a 6,20; datos de calidad muy baja). También hubo pruebas de un aumento en la sedación en los pacientes tratados con zuclopentixol en comparación con placebo (un ECA, n = 29; RR 4,67; IC del 95%: 1,23 a 17,68; datos de calidad muy baja). Los datos del "Abandono temprano del estudio" fueron ambiguos. No estaban disponibles datos utilizables de resultados como la recaída, el estado mental, la muerte, la calidad de vida, el uso de los servicios o los costos económicos.
Conclusiones de los autores
En los pacientes con esquizofrenia esta revisión indica que el diclorhidrato de zuclopentixol puede ayudar con los síntomas de la esquizofrenia. La revisión aporta algunas pruebas de los ensayos de que, si se administra diclorhidrato de zuclopentixol, los pacientes pueden experimentar algunos efectos adversos y sedación en comparación con placebo. Sin embargo, estas pruebas son de muy baja calidad y con algunas fuentes significativas de sesgo. No hay datos del decanoato de zuclopentixol o el acetato de zuclopentixol.
Para los médicos, los datos de los ensayos disponibles sobre la efectividad absoluta del diclorhidrato de zuclopentixol apoyan su uso, pero la naturaleza limitada de los datos y las fuentes significativas de sesgo hacen difícil establecer conclusiones. El zuclopentixol en las tres formas es un antipsicótico utilizado de manera habitual y es decepcionante que haya pocos datos con respecto a su uso.
PICO
Resumen en términos sencillos
Zuclopentixol versus placebo para los pacientes con esquizofrenia
Los pacientes con esquizofrenia a menudo oyen voces y ven cosas (alucinaciones) y tienen creencias extrañas (delirios). El tratamiento principal para estos síntomas de la esquizofrenia son los fármacos antipsicóticos. El zuclopentixol es un fármaco antipsicótico más antiguo, introducido por primera vez en 1962, que tiene tres formulaciones diferentes, diclorhidrato de zuclopentixol, acetato de zuclopentixol (o Acuphase) y decanoato de zuclopentixol. Aunque el zuclopentixol se ha utilizado habitualmente por muchos años, no se han realizado revisiones sistemáticas previas de su efectividad en comparación con placebo (tratamiento "simulado") para la esquizofrenia. Debido al uso generalizado de este fármaco, es importante considerar la efectividad de las tres formulaciones de este fármaco habitualmente utilizado para que los profesionales sanitarios, los elaboradores de políticas y los pacientes con esquizofrenia puedan elegir las elecciones mejor fundamentadas.
En 2013 se buscaron los ensayos controlados aleatorios que compararon zuclopentixol con placebo. Se encontraron sólo dos estudios con 65 participantes que podrían incluirse en esta revisión. En general la calidad de estos estudios fue baja, con escasos números de pacientes y sesgo significativo. Los estudios fueron tan antiguos como de 1968 y 1972, y tendrían pocas probabilidades de aprobar las normas modernas de revisión por pares. Solamente fue posible encontrar información y datos a corto plazo, y exclusivamente del diclorhidrato de zuclopentixol.
La información es muy limitada pero indica que el zuclopentixol puede dar lugar a mejoría en el estado general en comparación con placebo. Sin embargo, también hay un aumento en el riesgo de efectos secundarios como la sedación y el cansancio.
Debido a la baja calidad de la información y la antigüedad de los dos estudios se necesitan estudios de investigación adicionales, particularmente sobre el zuclopentixol en comparación con los fármacos antipsicóticos más nuevos y más recientes.
Conclusiones de los autores
Summary of findings
| ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO for schizophrenia | ||||||
| Patient or population: people with with schizophrenia | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO | |||||
| Clinically significant response on global state ‐ as defined by each of the studies, Improvement (CGI) ‐ short term ‐ as rated by nurse | Study population | RR 2.57 | 29 | ⊕⊝⊝⊝ | For this SOF table outcome CGI data as rated by a nurse and a psychiatrist were both available. The nurse data were chosen as it includes both control event and | |
| 286 per 1000 | 734 per 1000 | |||||
| Relapse as defined by the studies | No studies reported these important outcomes | |||||
| Clinically significant response on psychotic symptoms ‐ as defined by each of the studies. | ||||||
| Adverse effects: Sedation | Low | RR 4.67 | 29 | ⊕⊝⊝⊝ | No use of formal rating scales.Several other adverse events were recorded but sedation considered important. | |
| 50 per 1000 | 234 per 1000 | |||||
| Moderate | ||||||
| 150 per 1000 | 701 per 1000 | |||||
| High | ||||||
| 250 per 1000 | 1000 per 1000 | |||||
| Leaving the study early | Study population | RR 0.93 | 29 | ⊕⊝⊝⊝ | ||
| 100 per 1000 | 93 per 1000 | |||||
| Average change in quality of life/satisfaction | No studies reported these important outcomes | |||||
| Significant change in quality of life/satisfaction ‐ as defined by each of the studies | ||||||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Risk of bias: rated 'very serious' ‐ randomisation method unclear as describes "randomly assigned". Incomplete outcome data and does not accurately describe losses. Patients blinded but unclear if raters and clinicians are blinded | ||||||
| ZUCLOPENTHIXOL ACETATE versus PLACEBO for schizophrenia | |||||
| Patient or population: people with schizophrenia | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Control | ZUCLOPENTHIXOL ACETATE versus PLACEBO | ||||
| Clinically significant response on global state | No studies reported any of these important outcomes | ||||
| Relapse as defined by the studies | |||||
| Clinically significant response on psychotic symptoms ‐ as defined by each of the studies. | |||||
| Other adverse effects, general and specific | |||||
| Leaving the study early | |||||
| Average change in quality of life/satisfaction | |||||
| Significant change in quality of life/satisfaction ‐ as defined by each of the studies | |||||
| ZUCLOPENTHIXOL DECANOATE versus PLACEBO for schizophrenia | |||||
| Patient or population: people with schizophrenia | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Control | ZUCLOPENTHIXOL DECANOATE versus PLACEBO | ||||
| Clinically significant response on global state | No studies reported any of these important outcomes | ||||
| Relapse as defined by the studies | |||||
| Clinically significant response on psychotic symptoms ‐ as defined by each of the studies | |||||
| Other adverse effects, general and specific | |||||
| Leaving the study early | |||||
| Average change in quality of life/satisfaction | |||||
| Significant change in quality of life/satisfaction ‐ as defined by each of the studies | |||||
Antecedentes
Descripción de la afección
La esquizofrenia es una afección crónica de salud mental que se asocia con morbilidad y mortalidad significativas. Se caracteriza por síntomas psicóticos, alteraciones en la motivación y la abulia, desequilibrios neuroquímicos y trastornos emocionales. El diagnóstico de esta afección se basa en la entrevista clínica con el paciente y la observación del estado mental, y la comparación de estos aspectos con criterios diagnósticos, como la CIE‐10 (International Classification of Diseases) (Jablensky 2010).
La prevalencia de por vida de la esquizofrenia se calcula del 0,33% al 0,66% y la incidencia varía entre 10 y 22 por 100 000 (Jablensky 1992). Habitualmente la esquizofrenia se presenta en los adultos jóvenes o la adolescencia tardía. En los hombres tiene una edad anterior de aparición que en las mujeres y también parece tener un pronóstico peor (Picchioni 2007). La incidencia de la esquizofrenia no es uniforme entre diferentes sitios de investigación, pero está presente y es identificable en todo el mundo(McGrath 2006).
Se calcula que la esquizofrenia reduce la duración de la vida en diez a 15 años, en parte debido al acceso limitado a la asistencia sanitaria, el estigma y el aumento de los problemas de salud físicos concomitantes(Van Os 2009). La National Confidential Inquiry (NCI 2012) señala que la esquizofrenia provoca un aumento en el riesgo de suicidio en comparación con la población general y también contribuye a un aumento de la mortalidad general. La esquizofrenia causa más pérdidas de años de vida que algunos cánceres y enfermedades físicas (WHO 2004). Debido a que es una afección incapacitante que contribuye a una carga de morbilidad alta en los pacientes y los cuidadores, es de importancia vital investigar de forma adicional las causas y las opciones de tratamiento eficaces.
Descripción de la intervención
Los fármacos antipsicóticos todavía son la base del tratamiento para la esquizofrenia desde que se introdujo la clorpromazina. El zuclopentixol es uno de los antipsicóticos más antiguos (Figura 1), introducido por vez primera en 1962 y todavía se utiliza. Los médicos parecen encontrar conveniente su uso y los pacientes parecen tolerarlo razonablemente bien (Owens 2012). El zuclopentixol es conocido habitualmente por el nombre de Clopixol, aunque este uso en lenguaje médico puede provocar confusión debido a las diferentes formulaciones que existen. El zuclopentixol está disponible fundamentalmente en tres formulaciones. El diclorhidrato de zuclopentixol es la forma en comprimido y tiene una vida media de aproximadamente 20 horas (Lundbeck 2011). El acetato de zuclopentixol (Acuphase) es una opción si se prevé que el paciente estará perturbado durante un período más prolongado (NICE 2005) y también se utiliza como fármaco inicial antes de comenzar con los tratamientos antipsicóticos de depósito de acción prolongada. Acuphase alcanza la concentración media a las 36 horas. El decanoato de zuclopentixol de acción prolongada se utiliza como una preparación de depósito y es conveniente en cuanto a la frecuencia de administración, que puede variar entre semanal y mensual. El decanoato de zuclopentixol tiene una vida media de 19 días(Lundbeck 2011).
De qué manera podría funcionar la intervención
Hipotéticamente se considera que los fármacos antipsicóticos, especialmente los antipsicóticos de primera generación, funcionan al bloquear los receptores de dopamina en el cerebro, especialmente alrededor de la vía mesolímbica de la dopamina. Hay varias teorías que relacionan a la dopamina como el neurotransmisor implicado en las causas de los síntomas. Como neurotransmisor, la dopamina participa en cuatro vías principales en el cerebro. Las vías mesolímbica y mesocortical están relacionadas con la relevancia de las percepciones, la motivación y la recompensa. Estas vías están perturbadas en la esquizofrenia y son el objetivo de muchos antipsicóticos (Kapur 2005). La vía nigroestriada participa en el control del movimiento y puede estar afectada por algunos antipsicóticos, especialmente típicos, lo que provoca trastornos del movimiento como un efecto secundario habitual (Miyamoto 2005). La vía final es la vía tuberoinfundibular, que está relacionada con la secreción de prolactina. En consecuencia, muchos antipsicóticos puede interferir con la secreción de prolactina y provocan hiperprolactinemia(Owens 2012).
El zuclopentixol pertenece a una clase de compuestos químicos llamados tioxantenos. Todos tienen una estructura común de tres anillos e incluyen el zuclopentixol y el flupentixol. El zuclopentixol funciona principalmente al bloquear los receptores D2, pero también se ha mostrado que tiene propiedades de bloqueo serotoninérgico, una afinidad alta para los adrenorreceptores alfa y algunas propiedades antihistamínicas(Lundbeck 2011). Los efectos secundarios de la administración de zuclopentixol son frecuentes para muchos antipsicóticos e incluyen sedación y efectos secundarios extrapiramidales. También puede causar algunas anomalías en la función hepática.
Por qué es importante realizar esta revisión
El zuclopentixol es un fármaco ampliamente utilizado en todo el mundo. Con el transcurso de los años se han realizado numerosos estudios que lo comparan con otros fármacos y placebos. Hay tres revisiones Cochrane que han evaluado la eficacia del zuclopentixol, (Tabla 1). Estas revisiones anteriores de acetato y decanoato de zuclopentixol no encontraron datos del placebo; sin embargo, la revisión de diclorhidrato de zuclopentixol presentó algunos datos del placebo. La presente revisión permite que los datos del placebo del diclorhidrato de zuclopentixol sean transferidos de las otras comparaciones de fármacos y sustituyan a sus propios placebos para cubrir las tres formulaciones de zuclopentixol. Con el transcurso de los años ha habido un debate generalizado sobre la ética de los estudios controlados con placebo, especialmente cuando existen tratamientos bien conocidos de utilidad comprobada. Algunos investigadores también alegan que los ensayos con placebo proporcionan la forma más pura de pruebas cuando se evalúa un fármaco particular(Vallance 2006). Debido al uso generalizado de este fármaco, es fundamental conocer los efectos absolutos de sus tres formulaciones utilizadas habitualmente para que los médicos, los elaboradores de políticas y los receptores de la atención puedan elegir las alternativas mejor fundamentadas.
Objetivos
Evaluar la efectividad de todas las formulaciones de zuclopentixol en comparación con un placebo para la esquizofrenia.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todos los ensayos controlados aleatorios relevantes. Si un ensayo se describió como "doble ciego" pero dio a entender que se realizó la asignación al azar, se planificó incluir dichos ensayos en un análisis de sensibilidad (ver Análisis de sensibilidad), pero no se encontraron números suficientes de ensayos. Se habrían excluido los estudios cuasialeatorios, como los que asignan por días alternos de la semana, pero nuevamente no se encontraron ensayos cuasialeatorios. Si los pacientes recibieron tratamientos adicionales junto con el zuclopentixol (cualquier formulación), solamente se habrían incluido los datos si el tratamiento coadyuvante se distribuyó por igual entre los grupos y se asignó al azar exactamente de la misma manera que la intervención al comienzo del ensayo.
Tipos de participantes
Adultos, como quiera que lo hayan definido los autores de los estudios, con diagnóstico de esquizofrenia o trastorno esquizofreniforme, trastorno esquizoafectivo y trastorno delusorio, nuevamente, por cualquier forma de diagnóstico como la definieron los autores. Hubo interés en asegurar que la información fuera tan relevante como fuera posible para la atención actual de los pacientes con esquizofrenia, por lo que se planificó destacar claramente el estado clínico actual (agudo, posagudo temprano, remisión parcial, remisión), así como el estadio (prodrómico, primer episodio, enfermedad temprana, persistente) y si los estudios se centraron principalmente en los pacientes con problemas particulares (por ejemplo, síntomas negativos, enfermedades resistentes al tratamiento). Sin embargo, los estudios que se encontraron no proporcionaron esta información. Se excluyeron los niños y los pacientes con demencia, depresión y trastornos primarios asociados con el abuso de sustancias.
Si un estudio hubiera descrito al grupo participante como que presentaba "enfermedades mentales graves" y no proporcionaba una agrupación diagnóstica particular, se habrían incluido estos ensayos al suponer que la mayoría de los pacientes habrían presentado esquizofrenia, pero no se encontraron ensayos de este tipo.
Tipos de intervenciones
-
Diclorhidrato de zuclopentixol en cualquier forma o a cualquier dosis comparado con placebo.
-
Acetato de zuclopentixol en cualquier forma o a cualquier dosis comparado con placebo.
-
Decanoato de zuclopentixol en cualquier forma o a cualquier dosis comparado con placebo.
Tipos de medida de resultado
Los períodos de resultado se definieron según el tipo de formulación del zuclopentixol. Sin embargo, solamente se encontraron datos de ensayos del diclorhidrato de zuclopentixol y exclusivamente para del uso a corto plazo. Para el decanoato y el diclorhidrato de zuclopentixol se predefinió la duración del ensayo como a corto plazo entre cero y 12 semanas, plazo medio entre 13 a 26 semanas y largo plazo por más de 26 semanas. Para el acetato de zuclopentixol, debido a que las indicaciones para su uso son distintas y tiene una vida media diferente, se consideró que los ensayos eran a corto plazo si la duración estuvo entre cero a seis horas, plazo medio de siete a 36 horas, y largo plazo mayor de 36 horas.
Resultados primarios
1. Respuesta clínicamente significativa en el estado general, como se definió en cada estudio
Resultados secundarios
1. Muerte
1.1 Muerte ‐ no suicidio
1.2 Suicidio
2. Estado general
3.1 Puntuación promedio del estado general
3.2 Cambio promedio del estado general
3.3 Recaída, según la definición de los estudios
3. Estado mental
4.1 Respuesta clínicamente significativa en los síntomas psicóticos, como se definió en cada estudio.
4.2 Puntuación promedio de los síntomas psicóticos
4.3 Cambio promedio en los síntomas psicóticos
4.4 Respuesta clínicamente significativa en los síntomas positivos, como se definió en cada estudio.
4.5 Puntuación promedio de los síntomas positivos
4.6 Cambio promedio en los síntomas positivos
4.7 Respuesta clínicamente significativa en los síntomas negativos, como se definió en cada estudio
4.8 Puntuación promedio de los síntomas negativos
4.9 Cambio promedio en los síntomas negativos
4. Otros efectos adversos, generales y específicos.
5. Abandono temprano del estudio
6. Resultados de utilización de servicios.
6.1 Ingreso en el hospital
6.2 Ingreso obligatorio en el hospital
6.3 Reingreso, como se definió en cada estudio
7. Calidad de vida o satisfacción con la atención por parte de los pacientes o de los cuidadores
7.1. Cambio significativo en la calidad de vida/satisfacción, como se definió en cada estudio
7.2 Puntuación promedio de la calidad de vida/satisfacción
7.3 Cambio promedio en la calidad de vida/satisfacción
8. Resultados económicos
Tabla "Resumen de los hallazgos"
Se utilizó el enfoque GRADE para interpretar los hallazgos (Schünemann 2011) y se utilizó GRADE profiler (GRADEPRO) para importar los datos de RevMan 5 (Review Manager) y crear las tablas "Resumen de los hallazgos". Estas tablas proporcionan información específica de los resultados en cuanto a la calidad general de las pruebas de cada estudio incluido en la comparación, la magnitud del efecto de las intervenciones examinadas y la suma de los datos disponibles sobre todos los resultados que se consideraron importantes para la atención del paciente y la toma de decisiones. En el protocolo el objetivo fue seleccionar los resultados principales siguientes para inclusión en la tabla "Resumen de los hallazgos":
-
Respuesta clínicamente significativa en el estado general, como se definió en cada estudio.
-
Recaída, según la definición de los estudios.
-
Respuesta clínicamente significativa en los síntomas psicóticos, como se definió en cada estudio.
-
Otros efectos adversos, generales y específicos
-
Abandono temprano del estudio.
-
Cambio promedio en la calidad de vida/satisfacción.
-
Cambio significativo en la calidad de vida/satisfacción, como se definió en cada estudio.
Results
Description of studies
For full details please see, Characteristics of included studies and Characteristics of excluded studies.
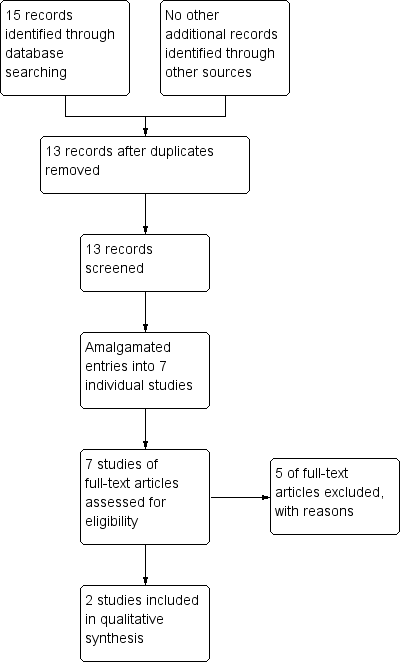
Results of the search
The search was conducted on 23 January 2013. It yielded 15 records of potential interest. Two records were duplications, so we screened 13 records. There were several reports from Serafetinides. We read these in full and all but one, Serafetinides 1971, were felt to be part of the same study, though this was confusing at times, as the excluded studies by Clark 1970 and Clark 1970a included Seraftinides as a third author. We read the remaining articles in full and judged them to be from one study, the data being used in different ways to look at different outcomes. We read all the Seraftinides group of studies in full to try and identify other pertinent data. We judged a further study, Kordas 1968 was also suitable for inclusion. For details of the decision process see Figure 2.

Processing search results
Both the included studies were old and we attempted to contact both groups of study authors. We could not identify the primary author's current contact details in Kordas 1968, so we contacted the hospital where the study was undertaken but received no response. For Serafetinides 1972, again we could not identify a current contact for the author and sent an email to the University of California's media relations as a general enquiry. They provided us with a copy of the article but were unable to provide any other data. We also contacted Lundbeck who manufacture zuclopenthixol and they stated they had no further data as, given the age of the product, all their data were in the public domain.
Included studies
We were able to include two studies, both randomising zuclopenthixol dihydrochloride compared to placebo. We identified no placebo‐controlled studies of zuclopenthixol acetate or zuclopenthixol decanoate. For full details please see Characteristics of included studies.
1. Design
In Kordas 1968 participants had a washout period and then were rated on behavioural scales. They were allocated into three arms, zuclopenthixol dihydrochloride (Clopenthixol), chlorpromazine and placebo; after four weeks of medication they were re‐rated. The allocation method is unclear. Serafetinides 1972 is a single‐centre four‐armed trial. Patients underwent a washout period and then had a baseline assessment. They were then "randomly assigned" to receive either zuclopenthixol dihydrochloride (Clopenthixol), )chlorpromazine, haloperidol or placebo. After 12 weeks participants were assessed again.
2. Sample sizes
In Kordas 1968 the total number of participants was n = 54, with n = 18 receiving zuclopenthixol dihydrochloride (Clopenthixol), n = 18 receiving chlorpromazine and n = 18 receiving placebo. Serafetinides 1972 has n = 57 patients, with n = 15 receiving zuclopenthixol dihydrochloride (Clopenthixol), n = 14 receiving chlorpromazine, n = 14 receiving haloperidol, and n = 14 receiving placebo.
3. Setting
Kordas 1968 was set in an inpatient unit in Greece. Serafetinides 1972 was set in a single inpatient hospital in the United states of America. They separated men and women into different wings.
4. Participants
All participants in Kordas 1968 had a diagnosis of schizophrenia of at least six years' duration, although no standard diagnostic criteria was identified and no exclusions described. All participants in Serafetinides 1972 had a diagnosis of chronic schizophrenia and again no standard criteria were identified. They excluded those with "organic disease".
5. Interventions
Kordas 1968 had three arms, two of interest, with zuclopenthixol dihydrochloride (Clopenthixol) (oral, dose 50 mg three times a day), and a placebo arm. They also included a chlorpromazine treatment arm. All sets of tablets were identical. In Serafetinides 1972 participants received zuclopenthixol dihydrochloride (oral average dose of 205 mg) or placebo. There were also chlorpromazine and haloperidol treatment arms.
6. Outcomes
In Kordas 1968 the only useable data are reported around side effects, as the behavioural scales are not useable (no mean or SD). They did not report losses. Serafetinides 1972 reported CGI improvement and severity data, as well as side effects and laboratory information. They did not report the SDs for the CGI data but provided the raw scores and allowed calculation of the SD, see Table 2; Table 3 They did provide BPRS, Nurse observation scale for inpatient evaluation, Oklahoma behaviour rating scale and data on the Venables‐O'connor scale but they did not report the SDs for these scales nor the raw scores, and so the data are unusable. The group did report their losses.
6.1 Outcome scales
For information we describe below the outcome scales and their uses in the studies.
6.1.1 Behavioural and inferential scale
This scale has two parts, a behavioural and inferential scale. The behavioural scale has 64 items that are considered more objective and observable, examples include, 'does not talk to patients', 'eats alone', 'attacks self'. The inferential scale contains 49 items considered less objective and includes 'poor memory', 'seems anxious' and 'grandiose feelings'. Each item is scored 0 to 4 with 0 not present and 4 maximum presence (Kordas 1968). This is a rating system that does not seem to have been especially successful. It is quite complicated and the difference between some of the 'objective' and 'subjective' behavioural markers seems crude.
6.1.2 Clinical global impression (CGI) scales
This is a global state scale used to assess both severity of illness and clinical improvement. It is observer‐rated (Guy 1976). The scale compares the condition of the person standardised against other people with the same diagnosis. It uses a seven‐point scoring system with low scores showing decreased severity and overall improvement.
6.1.3 Brief psychiatric rating scale
The BPRS (Overall 1962) is a scale about mental state that is used to assess the severity of abnormal mental state. It is observer‐rated, and different versions have different scales. The most common has 18 items and includes areas such as somatic concern, anxiety and grandiosity. Each item is scored on a seven‐point scale varying from 'not present' to 'extremely severe’ with a corresponding numerical value (1 to 7 or 0 to 6). The patient is then given an overall score.
6.1.4 Nurses' observational scale for inpatient evaluation.
The NOISE scale (Honigfeld 1965) is an observational scale designed to be a quick ward‐based observer rating of behaviour, it is rated on observation for the last three days. It has 30 items including examples such as social competence, social neatness irritability and manifest psychosis. Each item is rated 0 to 4 as never (0) sometimes, often and always (4). It is not as popular as the BPRS or CGI scales but still seems to be relatively commonly used.
6.1.5 Oklahoma behavioural rating scale
This was developed in 1961 (Clark 1961). It consists of nine items such as activity, aggression, communicativeness and toilet behaviour. Each item is rated on a 13‐point scale, from ‐6 to 6, with 0 in the middle: 0 represents typical appropriate behaviour. The plus behaviour is outgoing or overactive and the minus represents withdrawal and negative‐like behaviour.
Seven separate summary scores are then derived from this scale, each providing information different from the other. For example TB, the 'Typical Behaviour' score is the summation of item scores disregarding the direction from zero. It is the extent of deviation of behaviour reflected on the scale and can be referred to as 'gross behavioural pathology score'.Another example is 'Typical Behaviour plus' score which is the summation of item scores which fall on the plus side of zero. Over‐activity and outgoingness were thus analysed separately from their opposite.
This is then presented in tables as TB+ or E+ and comparisons are made before and after treatment. Overall this is a confusing scale that is quite difficult to use which is likely the reason for its unpopularity.
6.1.6 Venables‐O’Connor scale
This is an observational scale that rates patients on 20 items such as hostility, cleanliness or bizarre behaviour. Each item is rated 1 to 5, with 1 being normal and 5 being an extreme case. The definition of the number does change with each item. These scores are then collated to create a form of factor analysis and give scores on various factors such as paranoid and withdrawal factors (Venables 1959). This is a score system that has not remained popular over the years.
Excluded studies
For full details please see Characteristics of excluded studies. We excluded five studies, all as the interventions were not relevant to the review.
There are currently no studies awaiting classification nor any ongoing studies that we are aware of.
Risk of bias in included studies
For full details please see the risk of bias tables associated with Characteristics of included studies. Given that both studies are of a relatively old design there are some quite significant potential sources of bias. Summaries of risk of bias across the trials can also be viewed in Figure 3 and Figure 4.
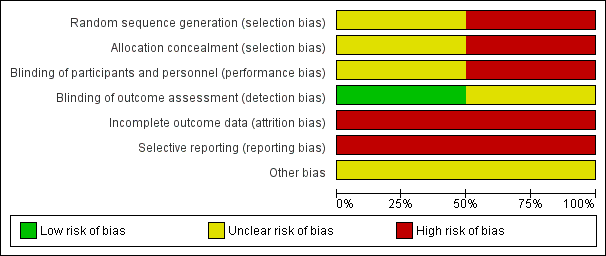
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Sequence generation: Kordas 1968 states that 'patients' were allocated to the treatment arms but does not state that this was randomised and gives no description of allocation concealment. We felt this to be a high risk of bias. Serafetinides 1972 states that patients were 'randomly assigned' but gives no information on the method or use of allocation concealment. We judged this trial to have an unclear selection bias. The numbers in the treatment groups in this study are also confusing. The numbers in 'Table 2' in Serafetinides 1972 show 13 in the placebo group. However, the text says that one individual in the placebo group failed to complete. The total number in their table comes to 56 indicating that someone has been lost. We have inferred that this person has come from the placebo group and this group started with 14 participants.
Blinding
Kordas 1968 had an unclear risk of performance and low detection bias. Study authors state that patients and raters were blinded but that medication was distributed by the attending physician: it was unclear what involvement they had. Serafetinides 1972 says that the participants were blinded but makes no comment about the staff. Clinicians could alter the dose of medication and therefore were clearly not blinded. The CGI scores were rated by both nurses and psychiatrists and it is unclear if they were blinded to the treatment. We therefore rated this trial as high risk of bias.
Incomplete outcome data
Both trials had a high risk of attrition bias. In Kordas 1968 the outcome data are incomplete: they have presented variance charts between the different comparison arms but have not provided any actual description of losses. They provide side effect data for the intervention arm but none for the placebo arm. We have assumed this means no significant side effects in the placebo group. Serafetinides 1972 have described their losses and report that four participants left early, three from the chlorpromazine arm and only one from the placebo, and none from the zuclopenthixol dihydrochloride (Clopenthixol) arm. However, when describing side effects they report that one participant taking zuclopenthixol dihydrochloride experienced persistent liver abnormalities which "resulted in withholding medication". The participant underwent a liver biopsy showing steatosis; and did not recover. They do not, however, describe how this participant's outcome was included in the data. They make no reference as to whether they were included in the results or became a loss, or if the medication was withheld for a short period of time and restarted.
Selective reporting
In both studies the risk is high as they have not described any agreed protocol prior to commencement, nor does either study state clear objectives.
Other potential sources of bias
We did not identify other potential sources of bias.
Effects of interventions
See: Summary of findings for the main comparison ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO for schizophrenia; Summary of findings 2 ZUCLOPENTHIXOL ACETATE versus PLACEBO for schizophrenia; Summary of findings 3 ZUCLOPENTHIXOL DECANOATE versus PLACEBO for schizophrenia
We identified three different zuclopenthixol preparations and so, potentially three different relevant comparisons with placebo.
1. ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO for schizophrenia
We identified two studies that compared zuclopenthixol dihydrochloride (Clopenthixol) with placebo.
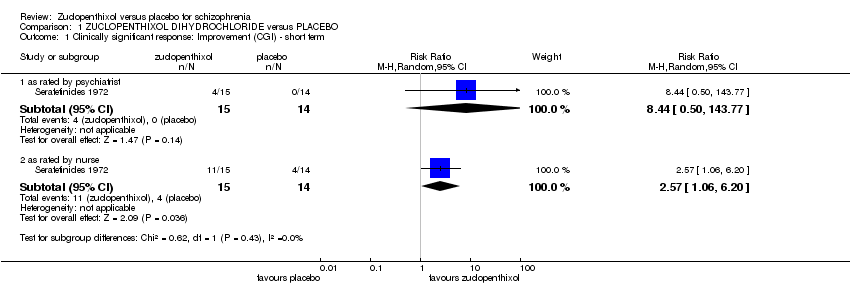
1.1 Clinically signficant response
1.1.1 Improvement (CGI) ‐ short term
Serafetinides 1972 included data on CGI improvement scores. In order to analyse these data the grouping of worse or no better was considered as a negative outcome. Better was considered an improvement and a positive event. These were rated by both a nurse and a psychiatrist with different scores for each. The psychiatrist rated data (1 RCT n = 29, RR 8.44, 95% CI 0.50 to 143.77) in favour of zuclopenthixol but not significant. The nurse rated data (1 RCT n = 29, RR 2.57 95% CI 1.06 to 6.20) also in favour of zuclopenthixol but statistically significant, Analysis 1.1.
1.1.2 Average score of severity of illness ‐ short term (CGI, high score = poor)
Serafetinides 1972 provided data on CGI severity of illness. The data presented in the paper included the initial and final means for the placebo and treatments arms. Although the SDs were not included they could be calculated from the data presented, see Table 2 and Table 3. Those in the zuclopenthixol group had lower mean scores (1 RCT n = 29, MD ‐0.62, 95% CI ‐1.17 to ‐0.07), Analysis 1.2.
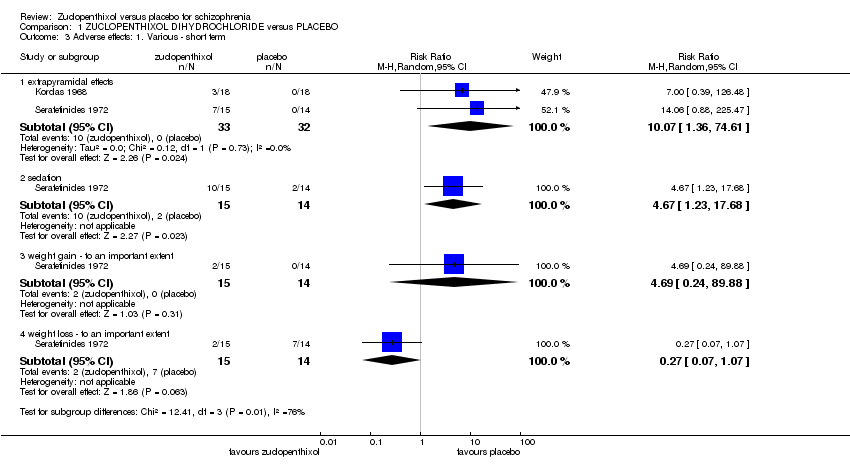
1.2. Other adverse effects, general and specific.
1.2.1 Extrapyramidal effects
Both studies included some data on extrapyramidal side effects. In Kordas 1968 they described two participants who had extrapyramidal side effects and one who had an oculogyric crisis. Although not explicit in the text we assume that these were three separate participants. The pooled effect indicates zuclopenthixol is more likely to cause side effects (2 RCTs n = 65, RR 10.07, 95% CI 1.36 to 74.61) Analysis 1.3
1.2.2 Sedation
Serafetinides 1972 included some description of sedative effects. They described sedation as 'transient and persistent' but did not define what these mean. These have been combined to give a single category of sedation and shows those taking zuclopenthixol are more likely to become sedated (1 RCT n = 29 RR, 4.67, 95% CI 1.23 to 17.68) Analysis 1.3
1.2.3 Weight change
Again Serafetinides 1972 included some data on weight change in participants. They included data on both losing and gaining weight and in both cases considered a significant change to be a loss or gain of 4.5 kg (10lb) and thus measured as a dichotomous outcome. There were no statistically significant changes for either weight gain or weight loss with zuclopenthixol. (Weight gain: 1 RCT n = 29, RR 4.69, 95%CI 0.24 to 89.88 and weight loss: 1 RCT n = 29, RR 0.27 95% CI 0.07 to 1.07). Analysis 1.3
1.2.4 Abnormal laboratory values
Serafetinides 1972 included data on a variety of abnormal laboratory values. Details of urine analysis looking at the presence of white blood cells (WBC) and sugar were presented and we have pooled these values as urine abnormalities for simplicity (1 RCT n = 29, RR 1.87 95% CI 0.19 to 18.38).
Data were presented for haematological abnormalities of raised WBC (> 12000) eosinophilia (> 5%) and WBC < 4000. These are pooled (1 RCT n = 29, RR 1.87 , 95% CI 0.40 to 8.65). They also reported blood urea nitrogen of > 20 mg per cent but no patients in the zuclopenthixol or placebo arms experienced this.
For data on liver abnormalities raised serum glutamic‐pyruvic transaminase (SGPT) of > 49 units or a total bilirubin of > 1.4 mg per cent were reported. The total pooled effects for liver abnormalities is (1 RCT n = 29, RR 8.44, 95% CI 0.50 to 143.77). The body of text describes that one participant had a persistent raised SGPT and required medication withdrawal and liver biopsy showing steatosis. They then recovered.
Cholesterol data were also presented. They reported no patients in either the placebo or zuclopenthixol arm had a cholesterol > 300 mg per cent; however, one participant taking zuclopenthixol had a cholesterol < 170 mg per cent (1 RCT n = 29, RR 2.81,95% CI 0.12 to 63.83). They also reported data for participants with triglycerides > 4.6 mEq/l (1 RCT n = 29, RR 2.80, 95% CI 0.33 to 23.86).
The final value reported is zinc. One participant in the placebo arm had a zinc level of < 70 mg per cent (1 RCT n = 29, RR 0.31, 95% CI 0.01 to 7.09). One participant in the zuclopenthixol arm had a zinc level of > 120 mg per cent (1 RCT n = 29, RR 2.81, 95% CI 0.12 to 63.83). Analysis 1.4
1.3 Leaving the study early
Kordas 1968 did not describe any losses, nor were raw data sets made available, making it impossible to determine any losses. Serafetinides 1972 described one participant lost in the placebo arm, as they became disturbed and required treatment. It is unclear about losses in the zuclopenthixol treatment arm as they stated that one participant had a persistent raised SGPT and required medication withdrawal and liver biopsy showing steatosis. The participant then recovered but it is unclear if this person resumed the trial treatment or not. They do not give any information about at what point in the study this occurred. We have assumed that this person was lost to follow up as it seems unreasonable to assume that they resumed the same medication after such a clinically significant event. No overall difference in numbers leaving the study early was found (1 RCT n = 29, RR 0.93, 95% CI 0.06 to 13.54). Analysis 1.5.
1.4 Missing outcomes
It is clear from previous trials that not reporting missing outcomes usually tends to favour the intervention arm rather than the control arm. It is disappointing that there were no data found on many of the outcomes of interest we listed in Methods . These include death, mental state, service utilisation outcomes, quality of life and economic outcomes. Given the age and widespread use of zuclopenthixol dihydrochloride it was anticipated that more data would be found. Althouh we were able to glean that some participants had left the study due to a particular reason, it was not clear whether they subsequently resumed the study or not.
We were hoping that there might be additional data to make comparisons of zuclopenthixol acetate versus placebo for schizophrenia and zuclopenthixol decanoate versus placebo for schizophrenia, however we were unable to identify any studies that included data on these two fairly widely used drugs.
Discusión
No se encontraron ensayos que investigaran los efectos absolutos del acetato (Resumen de los hallazgos 2) o el decanoato de zuclopentixol (Resumen de los hallazgos 3).
Resumen de los resultados principales
1. DICLORHIDRATO de ZUCLOPENTIXOL en comparación con PLACEBO para la esquizofrenia
Se encontraron algunos datos de diclorhidrato de zuclopentixol versus placebo (Resumen de los hallazgos para la comparación principal). En general fueron de muy baja calidad. Los datos fueron solamente de los efectos a corto plazo, pues ambos estudios tuvieron solamente 12 semanas de duración.
1.1 Respuesta clínicamente significativa en las puntuaciones de mejoría del estado general según el CGI para el seguimiento por personal de enfermería
Los datos mostraron una respuesta significativa en el estado general evaluado por el personal de enfermería, sin embargo esta respuesta no fue corroborada por la calificación de los psiquiatras de los mismos pacientes, lo que destaca algunas diferencias percibidas en las tasas de mejoría / falta de mejoría (un ECA, n = 29; RR 2,57; IC del 95%: 1,06 a 6,20; datos de calidad muy baja). Estos datos son demasiado limitados y poco fiables para poder establecer cualquier conclusión clínica. Es sorprendente que no existan datos útiles para esta comparación, para este resultado.
1.2 Otros eventos adversos
Los datos también mostraron un aumento en la sedación y los efectos secundarios extrapiramidales en los pacientes que recibieron diclorhidrato de zuclopentixol. Sin embargo todos estos datos eran de muy baja calidad y de un número muy pequeño de participantes (sedación: un ECA, n = 29; RR 4,67; IC del 95%: 1,23 a 17,68; datos de calidad muy baja; efectos extrapiramidales: dos ECA, n = 65; RR 10,07; IC del 95%: 1,36 a 74,61; datos de calidad muy baja).
1.3 Faltantes
Es decepcionante que no se encontraran datos sobre Muerte, Estado mental, Resultados de utilización de los servicios, Calidad de vida y Resultados económicos debido al uso bien establecido del diclorhidrato de zuclopentixol.
2. ACETATO de ZUCLOPENTIXOL versus PLACEBO para la esquizofrenia
No se encontraron datos sobre ninguno de los resultados de interés (Resumen de los hallazgos 2). Hay otras comparaciones de esta preparación que no son con placebo (Jayakody 2012), pero ninguna la comparara con la administración de placebo. Si se admite que es probable que dichos ensayos nunca se realicen, pudiera ser motivo para un metanálisis de redes, en el que las comparaciones se crean por una vía más indirecta.
3. DECANOATO de ZUCLOPENTIXOL versus PLACEBO para la esquizofrenia
No se encontraron datos sobre ninguno de los resultados de interés (Resumen de los hallazgos 3). En las enfermedades mentales graves se utilizan inyecciones de depósito en cerca del 25% al 33% de los pacientes y, entre los fármacos administrados, el decanoato de zuclopentixol es uno de los más habituales (Barnes 2009). A pesar de lo anterior no hay datos para apoyar su uso continuo ni para indicar que no se utilice. A falta de datos sólidos, los médicos parecen guiarse en la práctica por lo que el transcurso de los años y la experiencia personal les han enseñado.
Compleción y aplicabilidad general de las pruebas
1. Completitud
Para el clorhidrato de zuclopentixol versus placebo, ambos estudios incluidos tuvieron cantidades significativas de datos incompletos. Kordas 1968 presentó una escala conductual e inferencial autodiseñada que se describe detalladamente en los Resultados. Calculó la varianza mediante un análisis de la varianza (ANOVA) entre diferentes factores que compararon los brazos de zuclopentixol y placebo y señaló haber encontrado que algunas fuentes de esta varianza fueron significativas. Sin embargo, no presentó datos brutos, solamente gráficos de la varianza que no son utilizables. Proporcionó una suma de cuadrados, grados de libertad, cuadrados de la media y alguna estadística F. En esta revisión se investigaron métodos alternativos para calcular la DE de estos datos, pero no se consideró que fueran apropiados (Schünemann 2011). Debido a la complejidad de lo anterior, los revisores analizaron los métodos estadísticos y el consenso fue que los datos no eran utilizables.
Serafetinides 1972 presentó varias escalas conductuales diferentes que, nuevamente, son potencialmente informativas pero incluyen demasiados pocos detalles para permitir la inclusión. Presentó datos de BPRS que incluyeron la media y señaló las puntuaciones ACOVA y si la regresión fue significativa, pero no proporcionó el valor de p, sencillamente señaló "no significativo", sin definir en realidad qué valor se consideró significativo. Mostró datos de la Nurses' observational scale (NOISE) para la evaluación del paciente hospitalizado. Nuevamente lo hizo en un formato de tabla con los valores medios finales, la puntuación ACOVA y la regresión, pero sin datos brutos ni las DE. La Oklahoma behavioural rating scale y las Venables‐O'Connor rating scales se presentaron de una manera similar, con pocos datos utilizables
No se encontraron datos del acetato o el decanoato de zuclopentixol.
2. Aplicabilidad
Hay algunas dificultades para aplicar estas pruebas a la práctica psiquiátrica moderna. Los datos incluidos tienen alrededor de 40 años de antigüedad e incluyen algunos datos de EE.UU. y Grecia. La población estudiada en ambos ensayos consistió en enfermos hospitalizados con esquizofrenia crónica. Es muy probable que la población hospitalizada en los hospitales modernos sea muy diferente de la anterior debido a los cambios efectuados en la práctica de trabajo. Todo lo anterior dificulta la aplicabilidad. Los estudios incluidos solamente se realizaron durante un período corto. Esta duración dificulta aplicar estas pruebas al contexto más crónico. Los tamaños pequeños de los estudios también hacen que la aplicabilidad y la utilidad sean difíciles de interpretar. No hay datos del acetato o el decanoato de zuclopentixol, lo que hace imposible hacer observaciones sobre la aplicabilidad.
Calidad de la evidencia
En general, la calidad de las pruebas es muy baja. Solamente fue posible identificar dos estudios de diclorhidrato de zuclopentixol que tienen tamaños de la muestra pequeños. Solamente un estudio mostró datos de resultados primarios utilizables. Se han demostrado algunos resultados significativos, pero los intervalos de confianza son amplios y algunos de ellos solo están apenas por encima del umbral para la significación estadística.
Ambos estudios son muy antiguos y tienen deficiencias metodológicas significativas. Se considera que es poco probable que aprueben las normas modernas de revisión por pares. Solamente un estudio señaló que se asignó al azar pero no proporciona detalles de cómo se realizó esta asignación, el otro estudio se supuso que fue aleatorio por la descripción de los métodos. Hay preocupaciones con ambos estudios con respecto al cegamiento de los evaluadores, aunque al parecer ambos cegaron satisfactoriamente a los participantes.
Los dos estudios solamente presentan datos de resultados limitados pues proporcionaron muy escasos grupos de datos brutos de la puntuación y a menudo la presentación de los datos fue vaga y confusa. Fue necesario hacer suposiciones cuando se procesaron ciertos aspectos de los datos debido a las dificultades en los informes. En general, la calidad de las pruebas fue baja, con un riesgo significativo de sesgo. Ver Figura 3 para el gráfico "Riesgo de sesgo" y Figura 4 para el "Resumen de riesgo de sesgo". En términos prácticos la calidad de estas pruebas es tan deficiente que en realidad no se encontraron datos significativos.
Los dos estudios que se encontraron son de Clopentixol que, cuando se administra como un comprimido, se toma como diclorhidrato de zuclopentixol. No se encontraron datos utilizables sobre el acetato o el decanoato de zuclopentixol. La falta de datos es decepcionante debido al amplio uso de todas las formas de zuclopentixol.
Sesgos potenciales en el proceso de revisión
El proceso de búsqueda sólo identificó varios ensayos pequeños. Es posible que existan otros ensayos pequeños (p.ej. realizados para proyectos de investigación individuales) que no se hayan identificado.
Acuerdos y desacuerdos con otros estudios o revisiones
Kumar 2005 es una revisión del diclorhidrato de zuclopentixol e incluye una revisión versus placebo. Los hallazgos son consistentes con éstos. Incluyó algunos de los mismos estudios; sin embargo, en la presente revisión fue posible calcular y utilizar las DE de los datos del CGI de Serafetinides 1972, mientras que Kumar 2005 no lo hizo. Una versión actualizada de esta revisión está en marcha y se ha podido tener acceso a una versión inicial. De nuevo se coincide ampliamente con los datos versus placebo que sus autores encontraron. Kumar 2005 aceptó con confianza que el estudio Kordas 1968 no tuvo pérdidas durante el seguimiento. En Serafetinides 1972 hubo una diferencia en la interpretación de los números en el grupo placebo. En la presente revisión se decidió que el único paciente perdido durante el seguimiento se excluyó de los números finales, por lo que el total no es 57. Lo anterior significa que en esta revisión el brazo placebo es 14 y en Kumar 2005 es 13. En general lo anterior no cambia la importancia de los resultados y probablemente refleja la metodología y el registro deficientes del estudio, como se describió previamente.
Los datos sobre los resultados adversos son consistentes con la característica del producto y la experiencia clínica pragmática del uso del zuclopentixol.

Zuclopenthixol structure
Processing search results

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Comparison 1 ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO, Outcome 1 Clinically significant response: Improvement (CGI) ‐ short term.

Comparison 1 ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO, Outcome 2 Global state: Average score of severity of illness ‐ short term (CGI, high score=bad).
Comparison 1 ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO, Outcome 3 Adverse effects: 1. Various ‐ short term.

Comparison 1 ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO, Outcome 4 Adverse effects: 2. Laboratory values ‐ abnormal ‐ short term.

Comparison 1 ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO, Outcome 5 Leaving the study early.
| Excluded Study | Comparison | Existing review |
| Chlorpromazine versus molindone | ||
| Chlorpromazine versus placebo | ||
| Chlorpromazine versus placebo | ||
| Clopenthixol versus risperidone | ||
| D‐fenfluramine versus placebo |
| Methods | Allocation: randomised, full description of methods of randomisation and allocation concealment. |
| Participants | Diagnosis: people with schizophrenia (according to a diagnostic criteria). |
| Interventions | 1. Zuclopenthixol dihydrochloride. N = 150. 2. Placebo. N = 150. |
| Outcomes | Global state: clinically important response to treatment, average score/change of the global state. Mental state: general measurement and specific domains (depressive symptoms, positive symptoms, negative symptoms). Leaving the study early, due to any reason, due to inefficacy of treatment, and due to adverse events. Adverse events: any serious adverse event recorded. Service use: number of hospitalisations, days in hospital. |
| Methods | Allocation: randomised, fully explicit description of methods of randomisation and allocation concealment. |
| Participants | Diagnosis: people with schizophrenia (according to a diagnostic criteria). Acutely disturbed behaviour as described by the study |
| Interventions | 1. Zuclopenthixol acetate either alone or in combination with other medications. n = 150 2. Placebo. n = 150 |
| Outcomes | Global state: clinically important response to treatment, average score/change of the global state. Mental state: general measurement and specific domains (such as depressive symptoms, positive symptoms, negative symptoms) Leaving the study early, due to any reason, due to inefficacy of treatment, and due to adverse events. Adverse events: any serious adverse event recorded. Pharmacological interactions. |
| ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO for schizophrenia | ||||||
| Patient or population: people with with schizophrenia | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | ZUCLOPENTHIXOL DIHYDROCHLORIDE versus PLACEBO | |||||
| Clinically significant response on global state ‐ as defined by each of the studies, Improvement (CGI) ‐ short term ‐ as rated by nurse | Study population | RR 2.57 | 29 | ⊕⊝⊝⊝ | For this SOF table outcome CGI data as rated by a nurse and a psychiatrist were both available. The nurse data were chosen as it includes both control event and | |
| 286 per 1000 | 734 per 1000 | |||||
| Relapse as defined by the studies | No studies reported these important outcomes | |||||
| Clinically significant response on psychotic symptoms ‐ as defined by each of the studies. | ||||||
| Adverse effects: Sedation | Low | RR 4.67 | 29 | ⊕⊝⊝⊝ | No use of formal rating scales.Several other adverse events were recorded but sedation considered important. | |
| 50 per 1000 | 234 per 1000 | |||||
| Moderate | ||||||
| 150 per 1000 | 701 per 1000 | |||||
| High | ||||||
| 250 per 1000 | 1000 per 1000 | |||||
| Leaving the study early | Study population | RR 0.93 | 29 | ⊕⊝⊝⊝ | ||
| 100 per 1000 | 93 per 1000 | |||||
| Average change in quality of life/satisfaction | No studies reported these important outcomes | |||||
| Significant change in quality of life/satisfaction ‐ as defined by each of the studies | ||||||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Risk of bias: rated 'very serious' ‐ randomisation method unclear as describes "randomly assigned". Incomplete outcome data and does not accurately describe losses. Patients blinded but unclear if raters and clinicians are blinded | ||||||
| ZUCLOPENTHIXOL ACETATE versus PLACEBO for schizophrenia | |||||
| Patient or population: people with schizophrenia | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Control | ZUCLOPENTHIXOL ACETATE versus PLACEBO | ||||
| Clinically significant response on global state | No studies reported any of these important outcomes | ||||
| Relapse as defined by the studies | |||||
| Clinically significant response on psychotic symptoms ‐ as defined by each of the studies. | |||||
| Other adverse effects, general and specific | |||||
| Leaving the study early | |||||
| Average change in quality of life/satisfaction | |||||
| Significant change in quality of life/satisfaction ‐ as defined by each of the studies | |||||
| ZUCLOPENTHIXOL DECANOATE versus PLACEBO for schizophrenia | |||||
| Patient or population: people with schizophrenia | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Control | ZUCLOPENTHIXOL DECANOATE versus PLACEBO | ||||
| Clinically significant response on global state | No studies reported any of these important outcomes | ||||
| Relapse as defined by the studies | |||||
| Clinically significant response on psychotic symptoms ‐ as defined by each of the studies | |||||
| Other adverse effects, general and specific | |||||
| Leaving the study early | |||||
| Average change in quality of life/satisfaction | |||||
| Significant change in quality of life/satisfaction ‐ as defined by each of the studies | |||||
| Focus of the review | Participants | Reference |
| Zuclopenthixol acetate | acutely ill people with schizophrenia | |
| Zuclopenthixol decanoate | people with schizophrenia | |
| Zuclopenthixol dihydrochloride | people with schizophrenia |
| Individual data | Mean | Sum of mean squares | SD | |||||||||||||||
| CGI severity score clopenthixol | 3 | 4 | 4 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 6 | 6 | 6 | 6 | 6 | 5.07 | 396 | 0.88 |
| Individual data | Mean | Sum of mean squares | SD | |||||||||||||
| CGI Scores Placebo | 4 | 5 | 5 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 5.69 | 426 | 0.63 |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Clinically significant response: Improvement (CGI) ‐ short term Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 1.1 as rated by psychiatrist | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 8.44 [0.50, 143.77] |
| 1.2 as rated by nurse | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 2.57 [1.06, 6.20] |
| 2 Global state: Average score of severity of illness ‐ short term (CGI, high score=bad) Show forest plot | 1 | 29 | Mean Difference (IV, Random, 95% CI) | ‐0.62 [‐1.17, ‐0.07] |
| 3 Adverse effects: 1. Various ‐ short term Show forest plot | 2 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 3.1 extrapyramidal effects | 2 | 65 | Risk Ratio (M‐H, Random, 95% CI) | 10.07 [1.36, 74.61] |
| 3.2 sedation | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 4.67 [1.23, 17.68] |
| 3.3 weight gain ‐ to an important extent | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 4.69 [0.24, 89.88] |
| 3.4 weight loss ‐ to an important extent | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 0.27 [0.07, 1.07] |
| 4 Adverse effects: 2. Laboratory values ‐ abnormal ‐ short term Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 4.1 urine abnormalities | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 1.87 [0.19, 18.38] |
| 4.2 haematological abnormalities | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 1.87 [0.40, 8.65] |
| 4.3 liver abnormalities | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 8.44 [0.50, 143.77] |
| 4.4 cholesterol <170mg per cent | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 2.81 [0.12, 63.83] |
| 4.5 triglycerides | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 2.8 [0.33, 23.86] |
| 4.6 zinc < 70microgram | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 0.31 [0.01, 7.09] |
| 4.7 zinc > 120microgram per cent | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 2.81 [0.12, 63.83] |
| 5 Leaving the study early Show forest plot | 1 | 29 | Risk Ratio (M‐H, Random, 95% CI) | 0.93 [0.06, 13.54] |

