Leucorreducción para la prevención de las reacciones adversas de la transfusión de sangre alogénica
Resumen
Antecedentes
Una transfusión de sangre es una intervención aguda utilizada para abordar afecciones potencialmente mortales y que pueden afectar la salud a corto plazo. Sin embargo, las transfusiones de sangre provocan eventos adversos, algunos posiblemente relacionados con la modulación inmune o con una transmisión directa de agentes infecciosos (p.ej. citomegalovirus). La leucorreducción es un proceso en el cual los leucocitos se reducen de forma intencional en los concentrados de eritrocitos (CE) para reducir el riesgo de reacciones adversas. Aún no se conocen los posibles beneficios de los CE leucorreducidos en todos los tipos de pacientes que recibieron una transfusión para reducir las complicaciones infecciosas y no infecciosas.
Objetivos
Determinar la efectividad clínica de la leucorreducción de los concentrados de eritrocitos para prevenir las reacciones adversas después de la transfusión de sangre alogénica.
Métodos de búsqueda
La búsqueda más reciente se realizó el 10 de noviembre de 2015. Se hicieron búsquedas en el registro especializado del Grupo Cochrane de Lesiones (Cochrane Injuries Group), Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL, the Cochrane Library), MEDLINE (OvidSP), Embase(OvidSP), CINAHL Plus (EBSCO), LILACS (BIREME), y en registros de ensayos clínicos. Además, se verificaron las listas de referencias de todos los ensayos y las revisiones relevantes identificados en las búsquedas bibliográficas.
Criterios de selección
Ensayos clínicos aleatorios que incluyeron pacientes de todas las edades que requerían transfusión de CE alogénicos. Cualquier estudio fue elegible para inclusión, independientemente de la duración del seguimiento de los participantes o el país en el que se realizó el estudio. El resultado primario fue la lesión pulmonar aguda relacionada con la transfusión (LPART). Los resultados secundarios fueron muerte por cualquier causa, infección por cualquier causa, complicaciones no infecciosas y cualquier otro evento adverso.
Obtención y análisis de los datos
Al menos dos autores de la revisión realizaron de forma independiente la selección de los estudios, la evaluación del riesgo de sesgo y la extracción de los datos. Se calculó el riesgo relativo agrupado para los resultados dicotómicos, y la heterogeneidad estadística se midió mediante la estadística I². Se utilizó el modelo de efectos aleatorios para sintetizar los resultados. Se realizó un análisis secuencial de ensayos para evaluar el riesgo de errores aleatorios en los metanálisis acumulativos.
Resultados principales
Trece estudios, la mayoría incluyendo a pacientes adultos, cumplieron con los criterios de elegibilidad. No se encontraron pruebas claras de un efecto de los CE leucorreducidos versus los CE no leucorreducidos en pacientes asignados al azar a recibir una transfusión en los siguiente resultados:
LPART: RR 0,96; IC del 95%: 0,67 a 1,36; p = 0,80 a partir de un ensayo que informó datos de 1864 pacientes con traumatismos. La información acumulada de 1864 participantes constituyó solamente el 28,5% del tamaño de información necesario ajustado a la diversidad (TINAD) de 6548 participantes. La calidad de las pruebas fue baja.
Muerte por cualquier causa: RR 0,81; IC del 95%: 0,58 a 1,12; estadística I² = 63%, p = 0,20 de nueve ensayos que informaron datos de 6485 pacientes de cirugía cardiovascular, pacientes de cirugía gastrooncológica, pacientes con traumatismos y pacientes con infección por VIH. La información acumulada de 6485 participantes constituyó solamente el 55,3% del TINAD de 11 735 participantes. La calidad de las pruebas fue muy baja.
Infección por cualquier causa: RR 0,80; IC del 95%: 0,62 a 1,03; estadística I² = 84%, p = 0,08 de diez ensayos que informaron datos de 6709 pacientes de cirugía cardiovascular, pacientes de cirugía gastrooncológica, pacientes con traumatismos y pacientes con infección por VIH. La información acumulada de 6709 participantes constituyó solamente el 60,6% del TINAD de 11 062 participantes. La calidad de las pruebas fue muy baja.
Eventos adversos: El único evento adverso informado como un evento adverso fue la fiebre (RR 0,81; IC del 95%: 0,64 a 1,02; estadística I² = 0%, p = 0,07). La fiebre se informó en dos ensayos con 634 pacientes de cirugía cardiovascular y gastrooncológica. La información acumulada de 634 participantes constituyó solamente el 84,4% del TINAD de 751 participantes. La calidad de las pruebas fue baja.
Incidencia de otras complicaciones no infecciosas: Este resultado no se evaluó en ningún ensayo incluido.
Conclusiones de los autores
No hay pruebas claras para apoyar o rechazar el uso sistemático de leucorreducción en todos los pacientes que requieren transfusión de CE para la prevención de la LPART, la muerte, la infección, las complicaciones no infecciosas y otros eventos adversos. Como la calidad de las pruebas es muy baja a baja, se necesitan más pruebas para establecer una conclusión definitiva.
PICO
Resumen en términos sencillos
Reducción de leucocitos de las transfusiones de concentrados de eritrocitos para la prevención de reacciones adversas
Antecedentes
Una transfusión de sangre consiste en tomar sangre de una persona y administrarla a otra persona. Las transfusiones de sangre se administran para resolver en un corto plazo trastornos médicos que amenazan la salud y la vida. Sin embargo, las transfusiones de sangre provocan eventos adversos, algunos posiblemente relacionados con una respuesta del sistema inmunológico o debido a la transmisión de agentes infecciosos (p.ej. virus de la inmunodeficiencia humana). La leucorreducción es un proceso en el cual los leucocitos se eliminan de la sangre donada de forma intencional para reducir el riesgo de reacciones adversas en los pacientes que reciben la transfusión de sangre. Aún no se conocen los efectos beneficiosos de eliminar los leucocitos con la intención de reducir las complicaciones infecciosas y no infecciosas en todos los tipos de pacientes que reciben una transfusión. La eliminación de los leucocitos es costosa. Los EE.UU. y el Reino Unido gastan decenas de millones cada año en el procedimiento. En los EE.UU., el procedimiento cuesta aproximadamente USD $30 por cada unidad del producto sanguíneo. Puede no valer la pena gastar tanto dinero si no hay efectos beneficiosos claros para los pacientes.
Pregunta clínica
¿Cuáles son los efectos beneficiosos y perjudiciales de la eliminación de los leucocitos de la sangre donada en los pacientes que reciben una transfusión de sangre?
Características de los estudios
Se realizaron búsquedas en las revistas médicas para obtener informes de los ensayos clínicos que examinaron los efectos de la eliminación de los leucocitos de la sangre donada. El interés se centró en determinar si la extracción de los leucocitos de la sangre donada dio lugar a que a los pacientes que recibieron una transfusión de sangre tuvieran pocas complicaciones como lesión pulmonar aguda relacionada con la transfusión, muerte, complicaciones infecciosas y no infecciosas, o cualquier otro evento adverso. Se incluyeron pacientes de cualquier edad o sexo que recibieron una transfusión de sangre por cualquier motivo. Las pruebas se basan en los estudios recuperados hasta el 5 diciembre 2014.
Resultados principales
Se encontraron 13 estudios que incluyeron pacientes que recibieron una transfusión de sangre durante una cirugía cardíaca o por cáncer, o debido a que habían recibido lesiones, presentaban cáncer, VIH o sepsis.
No se encontraron pruebas claras que mostraran efectos beneficiosos o perjudiciales de la eliminación de los leucocitos de la sangre donada. En todos los resultados examinados (lesión pulmonar aguda relacionada con la transfusión, muerte por cualquier causa, infección por cualquier causa, complicación no infecciosa u otro evento adverso), no hubo signos de efectos beneficiosos o perjudiciales.
Calidad de la evidencia
La calidad general de las pruebas de los estudios incluidos varió de muy baja a baja. Ninguno de los estudios incluyó un número suficiente de pacientes para proporcionar una respuesta definitiva acerca de la utilidad de la eliminación de los leucocitos de la sangre donada. Se necesitan estudios nuevos de alta calidad que incluyan a miles de pacientes para permitir conocer los efectos beneficiosos y perjudiciales verdaderos de este procedimiento.
Conclusiones de los autores
Summary of findings
| Leukoreduced PRBCs versus non‐leukoreduced PRBCs for preventing adverse reaction from allogeneic blood transfusion | ||||||
| Patient or population: Patients receiving RBC transfusion | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Non‐leukoreduced packed RBCs | Leukoreduced packed RBCs | |||||
| TRALI | Study population | RR 0.96 | 1864 | ⊕⊕⊝⊝ | TSA yielded an inconclusive result. | |
| 63 per 1000 | 61 per 1000 | |||||
| Death due to any cause | Study population | RR 0.81 | 6485 | ⊕⊝⊝⊝ | TSA yielded an inconclusive | |
| 93 per 1000 | 76 per 1000 | |||||
| Infection from any cause | Study population | RR 0.80 | 6709 | ⊕⊝⊝⊝ | TSA yielded an inconclusive | |
| 204 per 1000 | 163 per 1000 | |||||
| Adverse events | Study population | RR 0.81 | 634 | ⊕⊕⊝⊝ | TSA yielded an inconclusive | |
| 387 per 1000 | 314 per 1000 | |||||
| Non‐infectious complication | Study population | Not estimable | — | — | No trial assessed this outcome. | |
| Not estimable | Not estimable | |||||
| *The basis for the assumed risk was the median control group risk across studies. The corresponding risk (and its 95% CI) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Downgraded by two due to imprecision: small sample size as compared with the calculated DARIS and the wide CI overlapping zones of no effect, as well as potential harm or benefit, or both. Few events reported. 3Downgraded due to: high risk of bias (Seven of 10 included studies were at high or unclear risk of bias, ‐1); important heterogeneity (I² statistic: 84%, ‐2); and imprecision due to the CI crossing the threshold of meaningful effect and an insufficient sample size as compared with the DARIS (‐1) 4Downgraded due to: high risk of bias (All included studies evaluated were at high risk of bias, ‐1) and imprecision due to the CI crossing the threshold of meaningful effect and an insufficient sample size as compared with the DARIS (‐1). | ||||||
Antecedentes
Descripción de la afección
Una transfusión de sangre es la infusión de formas solubles y asociadas a las células (eritrocitos, leucocitos y plaquetas) a un receptor (Vamvakas 2001). Una transfusión de sangre es una intervención aguda utilizada en un corto plazo para abordar afecciones potencialmente mortales y que pueden afectar la salud; y en general, sus efectos a largo plazo tienden a ser de importancia secundaria(Tsai 2010).
Sin embargo, la transfusión de sangre se asocia con un mayor riesgo de eventos adversos infecciosos y no infecciosos (Wagner 2004; Hendrickson 2009; Sachs 2010). La incidencia de reacciones no infecciosas a las transfusiones es mayor que la de las complicaciones infecciosas (Lavoie 2011). La mortalidad asociada con los riesgos no infecciosos también es significativamente mayor y representa el 87% al 100% de las complicaciones mortales de las transfusiones (Lavoie 2011).
Los principales eventos adversos no infecciosos para el paciente son la lesión pulmonar aguda relacionada con la transfusión (LPART), que se considera la complicación no infecciosa más grave (Renaudier 2009; Triulzi 2009; Vamvakas 2009); reacción febril no hemolítica a la transfusión (RFNHT) (King 2004; Blajchman 2006; Hoffman 2008) y reacciones alérgicas (Tenorio 2007). Menos frecuente es la enfermedad injerto versus huésped asociada con la transfusión (EIVH‐AT) (Dwyre 2008; Hoffman 2008; Rühl 2009) y la transfusión relacionada con un efecto en la inmunomodulación (TRIM) (Vamvakas 2006).
Se han considerado varios enfoques para prevenir las reacciones adversas relacionadas con la transfusión(Martí‐Carvajal 2010; Lavoie 2011; Lindholm 2011; Tobian 2011). La transfusión de concentrados de eritrocitos con reducción de los leucocitos es uno de dichos enfoques (Blajchman 2010; Blumberg 2010; Mukagatare 2010). Los leucocitos en los componentes sanguíneos pueden mediar las reacciones febriles a las transfusiones, estimular la aloinmunización de antígenos de leucocitos humanos (ALH) en los receptores de transfusiones y transmitir algunos agentes patógenos asociados con las células como el citomegalovirus (CMV). Por lo tanto, es aconsejable eliminar los leucocitos de los componentes sanguíneos transfundibles (Galel 2009).
El Apéndice 1 muestra las definiciones de reacción no infecciosa a la transfusión relacionada con los leucocitos.
Descripción de la intervención
La leucorreducción es un proceso en el cual los leucocitos son reducidos de forma intencional en casi el 99,99% en los concentrados de eritrocitos (Shapiro 2004). Hay muchos métodos para realizar este enfoque; sin embargo, este proceso actualmente se realiza mediante filtros de leucorreducción selectiva (Galel 2009). Según la Food and Drug Administration (FDA) de los Estados Unidos, los concentrados de eritrocitos reducidos en leucocitos contienen menos de 5 × 106 leucocitos/unidad y al menos el 85% de los eritrocitos originales (Galel 2009) y según el Council of Europe < 1 × 106 de leucocitos totales/unidad. Generalmente, la mayor parte de la leucofiltración de los eritrocitos se realiza en los centros de recolección de sangre en los primeros días después de la recolección (Galel 2009).
Leucorreducción en pacientes con traumatismos
Los productos de transfusión seguros son una necesidad para el tratamiento exitoso de los pacientes con traumatismos (Tien 2007; Theusinger 2009). No está claro si la leucorreducción de los concentrados de eritrocitos es el mejor método de provisión de productos sanguíneos para los pacientes con traumatismos(Nathens 2006; Phelan 2007; Watkins 2008). Los estudios retrospectivos han mostrado una disminución de las complicaciones infecciosas en los pacientes con heridas tratados con transfusión sanguínea alogénica leucorreducida; este efecto parece más pronunciado en los pacientes que reciben transfusión masiva (> 6 unidades de CE)(Friese 2008).
Leucorreducción en la cirugía
Varios estudios se han centrado en las ventajas de las células en CE leucorreducidos para la transfusión en la cirugía cardíaca (van de Watering 1998; Dzik 2002; Wallis 2002; Bilgin 2004; van Hilten 2004; Connery 2005); cirugía colorrectal (Jensen 1992; Houbiers 1994; Jensen 1996; Titlestad 2001; Dzik 2002; Skånberg 2007); cirugía gastrointestinal (Tartter 1998; Dzik 2002; van Hilten 2004); y trasplante renal (Sanfilippo 1985; Opelz 1997; Hiesse 2001). Sin embargo, algunos de los hallazgos de estos ensayos publicados se consideran controvertidos. Además, este enfoque se ha utilizado en los pacientes con SIDA; aunque no está claro si este método alternativo es beneficioso en esta población (Collier 2001).
De qué manera podría funcionar la intervención
La leucorreducción funciona a través de múltiples mecanismos para prevenir las reacciones adversas:
-
Para prevenir la LPART: evita la transferencia de leucocitos y reduce los complejos de interacción de anticuerpos celulares que lesionan el endotelio pulmonar (Triulzi 2009; Sachs 2011).
-
Para evitar las infecciones postransfusiones mediante la reducción de algunos agentes patógenos asociados con la célula, como el CMV (Bilgin 2004; Blajchman 2004; van Hilten 2004; Connery 2005; Friese 2008).
-
Para prevenir la inmunomodulación: los leucocitos del donante pueden suprimir el sistema inmunológico del receptor mediante la interacción con el mismo, lo que produce sensibilidad a muchas afecciones patológicas que incluye la recidiva del cáncer y otras neoplasias malignas (Blajchman 2002; Dellinger 2004; Flohé 2007).
Por qué es importante realizar esta revisión
Esta revisión Cochrane es importante por las siguientes razones:
En primer lugar, la leucorreducción es costosa. Se gastan alrededor de EUR 29 000 000/año para implementar la leucorreducción (AETSA 2007). Otros estudios informaron costos que variaban de CAD $26 000 000 a 46 000 000 por año (CCOHTA 1998). Un estudio calculó que el costo total de la implementación de la leucorreducción fue de alrededor de USD 600 000 000 de dólares por año en EE.UU. (Shapiro 2004). También se ha informado que la leucorreducción da lugar a un aumento de aproximadamente 30 USD/unidad de producto sanguíneo(Phelan 2007). Más recientemente, Tsantes 2014 informó un cociente gradual de la relación entre costo y eficacia de EUR 6916 para evitar un caso de reacciones febriles no hemolíticas a las transfusiones (RFNHT). En segundo lugar, la posible función de la leucorreducción para la disminución de la mortalidad y la infección es polémica(AETSA 2007; Mukagatare 2010). En tercer lugar, varios estudios y metanálisis no presentaron resultados concluyentes acerca de la leucorreducción, y mostraron inconsistencias metodológicas (Vamvakas 1996; Blumberg 1998; Jensen 1998; Fergusson 2004; Blumberg 2007; Vamvakas 2007). Por lo tanto, es importante realizar esta revisión Cochrane para determinar los posibles efectos beneficiosos del procedimiento de leucorreducción en los pacientes que requieren concentrados de eritrocitos, centrados en la prevención de las reacciones adversas.
Objetivos
Determinar la efectividad clínica de la leucorreducción de los concentrados de eritrocitos para prevenir las reacciones adversas después de la transfusión de sangre alogénica.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Ensayos controlados con asignación aleatoria (ECA).
Tipos de participantes
Pacientes que requieren transfusión de concentrados de eritrocitos (CE) alogénicos. Los pacientes podían ser de cualquier edad.
Tipos de intervenciones
Intervención
-
CE leucorreducidos.
Comparación
-
CE no leucorreducidos.
No se aplicaron limitaciones a los procedimientos de leucorreducción utilizados.
Tipos de medida de resultado
Resultados primarios
-
Incidencia de LPART.
Resultados secundarios
-
Muerte debida a cualquier causa.
-
Infección por cualquier causa (número de pacientes del total asignado al azar).
-
Complicaciones no infecciosas (Apéndice 1).
-
Cualquier otro evento adverso: "cualquier evento médico adverso que pueda presentarse durante el tratamiento con un producto farmacéutico, pero que no necesariamente tenga una relación causal con dicho tratamiento" (Nebeker 2004).
El tamaño de información para el resultado primario de esta revisión Cochrane se tomó del riesgo relativo informado en Nathens 2006. Este estudio incluyó a pacientes con traumatismos. Se definió un tamaño de la muestra total de 8781 participantes para evaluar una reducción del riesgo relativo en los eventos de LPART del 25%, a partir de una incidencia inicial en el control del 6,31% (nivel alfa del 5% y poder estadístico del 90%).
Results
Description of studies
See the Included studies section.
Results of the search
We identified 6244 references. Thirteen RCTs met our inclusion criteria (Sanfilippo 1985; Jensen 1996; Tartter 1998; van de Watering 1998; Collier 2001; Titlestad 2001; Wallis 2002; Bilgin 2004; van Hilten 2004; Boshkov 2006; Nathens 2006; Lapierre 2007; Donati 2014). See Figure 1.
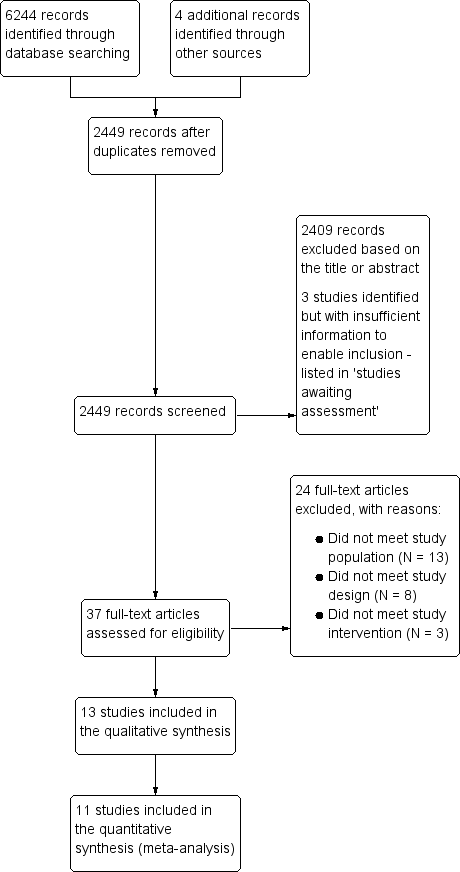
Study flow diagram.
We did not find any ongoing trials. Three studies were classified as awaiting assessment (Zhao 2004; NCT00810810; Waghmare 2012). There is insufficient information available about these studies to enable us to decide whether or not they should be included in the review. See Characteristics of studies awaiting classification.
Included studies
Methodology characteristics
Trials were published between 1985 and 2014. They were conducted in various countries: five in the USA (Sanfilippo 1985; Tartter 1998; Collier 2001; Boshkov 2006; Nathens 2006), three in the Netherlands (van de Watering 1998; Bilgin 2004; van Hilten 2004), two in Denmark (Jensen 1996; Titlestad 2001), one in France (Lapierre 2007), one in the UK (Wallis 2002) and one in Italy (Donati 2014).
All trials had a parallel study design; 11 comparing two groups and two trials comparing three groups (van de Watering 1998; Wallis 2002). The number of trial participants ranged from 20 (Donati 2014) to 1864 (Nathens 2006), with a median of 531 participants.
In three trials participants were monitored for one month or less (Jensen 1996; Nathens 2006; Donati 2014). In 10 trials participants were monitored for between two and 15 months. In 11 trials there was an a priori sample size estimation, and one trial did not report how the sample size was derived (Sanfilippo 1985). In one trial the data used were taken from the report's abstract, and there was no information about the sample size calculation (Boshkov 2006). All trials used patients as the randomisation unit and unit of analysis. All trials reported inclusion criteria. Exclusion criteria were not reported in the Boshkov 2006 study abstract.
Patient characteristics
All 13 included trials were conducted in adults, but two trials also included patients under 18 years of age: Collier 2001 (≥ 14 years) and Nathens 2006 (≥ 17 years). Twelve trials reported the gender of the participants; almost 60% of the included participants were men. Five trials involved cardiac surgery patients (van de Watering 1998; Wallis 2002; Bilgin 2004; van Hilten 2004; Boshkov 2006), four trials involved gastro‐oncology surgery patients (Jensen 1996; Titlestad 2001; van Hilten 2004; Lapierre 2007), one trial involved non‐surgical oncology patients (Lapierre 2007), one trial involved trauma patients (Nathens 2006), one trial included HIV infected patients (Collier 2001) and one trial involved patients with sepsis, severe sepsis or septic shock requiring ICU care (Donati 2014).
Interventions
Leukoreduction definition
The extent of leukoreduction differed across the studies: two studies obtained 0.1 to 0.3 × 106 per unit (Bilgin 2004; Titlestad 2001). Three trials reported 5 × 106 leukocytes per unit of blood after leukoreduction (Collier 2001; Wallis 2002; Nathens 2006). Jensen 1996 reported 1.2 × 109 per unit; van de Watering 1998 reported 1.2 ± 1.4 × 106 per unit; Tartter 1998 reported 2 × 105 per unit; and Lapierre 2007 less than 2 × 104 per unit. Four studies did not report definitions for leukoreduction (Sanfilippo 1985; van Hilten 2004; Boshkov 2006; Donati 2014).
Type of filters
Trials were conducted using different types of filters. Two trials used "Cellselect Optima" filters (Bilgin 2004; van de Watering 1998). Four trials used "BPF4" filters for blood leukoreduction (Tartter 1998; Titlestad 2001; Wallis 2002; Nathens 2006). Jensen 1996 used "RC 100" filters and two trials used "Sepacell RZ‐200B1" filters (Lapierre 2007; Donati 2014). Four trials did not report the type of filter used (Sanfilippo 1985; Collier 2001; van Hilten 2004; Boshkov 2006).
Control groups
Trials were conducted using different types of comparator groups. Five trials used "Buffy coat depleted packed cells (PCs)" as a comparison group (Jensen 1996; van de Watering 1998; Wallis 2002; Bilgin 2004; van Hilten 2004). Eight trials used "unmodified RBC transfusion" or standard RBCs as a comparison group (Sanfilippo 1985; Tartter 1998; Collier 2001; Titlestad 2001; Boshkov 2006; Nathens 2006; Lapierre 2007; Donati 2014). One trial also used "Red blood cells concentrate with plasma reduction" as a third non‐leukoreduced arm (Wallis 2002).
Cointervention
Three studies described the use of platelets as co‐intervention (Collier 2001; Bilgin 2004; Nathens 2006). Bilgin 2004 reported that platelets were all leukocyte‐depleted by filtration; Collier 2001 did not describe the platelet leukoreduction process, and Nathens 2006 reported that all patients received apheresis platelets when platelets were required. Lapierre 2007 reported that none of the patients received platelets concentrate.
Outcomes
One trial reported on TRALI (Nathens 2006).
Nine trials reported on death from any cause (Jensen 1996; van de Watering 1998; Collier 2001; Titlestad 2001; Wallis 2002; Bilgin 2004; van Hilten 2004; Nathens 2006; Lapierre 2007). Boshkov 2006 reported death only for the transfused patients group.
Ten trials reported on infection from any cause (Jensen 1996; Tartter 1998; van de Watering 1998; Collier 2001; Titlestad 2001; Wallis 2002; Bilgin 2004; van Hilten 2004; Nathens 2006; Lapierre 2007) the infections reported were: respiratory tract infections in six studies (Jensen 1996; van de Watering 1998; Titlestad 2001; Bilgin 2004; Nathens 2006; Lapierre 2007); urinary tract infections in five studies (Jensen 1996; van de Watering 1998; Bilgin 2004; Nathens 2006; Lapierre 2007); wound infections or surgical site infections in seven studies (Jensen 1996; Tartter 1998; van de Watering 1998; Titlestad 2001; Bilgin 2004; Nathens 2006; Lapierre 2007); bacteraemia or septicaemia in seven studies (Jensen 1996; van de Watering 1998; Collier 2001; Titlestad 2001; Bilgin 2004; Nathens 2006; Lapierre 2007); abdominal infection in three studies (Jensen 1996; Titlestad 2001; Nathens 2006). Collier 2001 included persons infected with HIV and CMV.
Three trials reported adverse events (Collier 2001; Wallis 2002; Lapierre 2007). One trial, Collier 2001, analysed fever episodes per transfusion, but not per study participant, thus it was not included in the meta‐analysis.
Donati 2014 and Sanfilippo 1985 reported only physiological outcomes. There were no relevant data to include in the analyses.
Excluded studies
We excluded 24 studies (see Characteristics of excluded studies) for the following reasons:
-
Use of other blood products in the intervention groups (Gilbert 1989; Jensen 1992; Houbiers 1994; Bowden 1995; Kao 1995; Gu 1996; Nielsen 1999; Hayashi 2000; Dzik 2002; Efstathiou 2003; Connery 2005; Gu 2009).
-
No transfusion in one of the study groups (Opelz 1997; de Vries 2004; Koskenkari 2005; Leal‐Noval 2005; Salamonsen 2005; So‐Osman 2010).
-
Non‐randomised clinical trial (Bracey 2002; de Vries 2003; Llewelyn 2004; Skånberg 2007), or a review article (van de Watering 2004; Vamvakas 2007).
Risk of bias in included studies
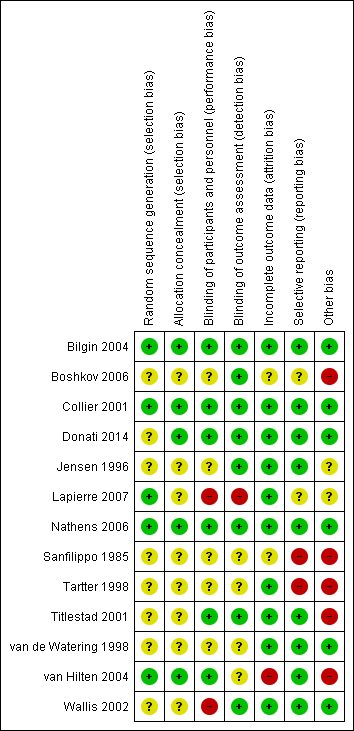
We have summarised the risk of bias in the included studies in Figure 2 and Figure 3.

'Risk of bias' graph: review authors' judgements about each 'Risk of bias' item presented as percentages across all included studies.
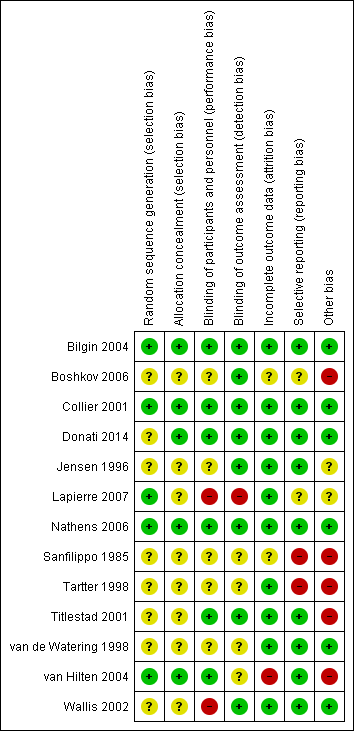
'Risk of bias' summary: review authors' judgements about each 'Risk of bias' item for each included study.
Allocation
Random sequence generation
In five trials there was low risk of bias related to the sequence generation method (Collier 2001; Bilgin 2004; van Hilten 2004; Nathens 2006; Lapierre 2007). Eight trials had unclear risk of bias (Sanfilippo 1985; Jensen 1996; Tartter 1998; van de Watering 1998; Titlestad 2001; Wallis 2002; Boshkov 2006; Donati 2014).
Allocation concealment
In five trials there was low risk of bias related to the method of allocation concealment (Collier 2001; Bilgin 2004; van Hilten 2004; Nathens 2006; Donati 2014). Eight trials had unclear risk of bias (Sanfilippo 1985; Jensen 1996; Tartter 1998; van de Watering 1998; Titlestad 2001; Wallis 2002; Boshkov 2006; Lapierre 2007).
Blinding
Blinding of participants and personnel
The risk of bias arising from the lack of blinding was rated as low in six trials (Collier 2001; Titlestad 2001; Bilgin 2004; van Hilten 2004; Nathens 2006; Donati 2014). The risk of bias from blinding was unclear in five trials (Sanfilippo 1985; Jensen 1996; Tartter 1998; van de Watering 1998; Boshkov 2006) and high in two studies (Wallis 2002; Lapierre 2007).
Blinding outcome assessment
Eight trials had a low risk of bias arising from the method of blinding outcome assessment (Jensen 1996; Collier 2001; Titlestad 2001; Wallis 2002; Bilgin 2004; Boshkov 2006; Nathens 2006; Donati 2014). Four studies were at unclear risk (Sanfilippo 1985; Tartter 1998; van de Watering 1998; van Hilten 2004) and one trial was at high risk of bias (Lapierre 2007).
Incomplete outcome data
Ten trials were judged to be at low risk of bias from incomplete outcome data (Jensen 1996; Tartter 1998; van de Watering 1998; Collier 2001; Titlestad 2001; Wallis 2002; Bilgin 2004; Nathens 2006; Lapierre 2007; Donati 2014). There was unclear risk of bias in two trials (Sanfilippo 1985; Boshkov 2006), and high risk of bias in one trial (van Hilten 2004).
Selective reporting
We judged nine trials as at low risk of reporting bias (Jensen 1996; van de Watering 1998; Collier 2001; Titlestad 2001; Wallis 2002; Bilgin 2004; van Hilten 2004; Nathens 2006; Donati 2014). Two trials were at unclear risk of bias (Boshkov 2006; Lapierre 2007), and two trials were at high risk of bias (Sanfilippo 1985; Tartter 1998).
Other potential sources of bias
Six trials appeared free of other potential sources of bias and we judged these trials to be at low risk of bias (van de Watering 1998; Collier 2001; Wallis 2002; Bilgin 2004; Nathens 2006; Donati 2014). Seven trials had design bias of different kinds: inconsistency in adequately determining inclusion criteria, premature randomisation (Sanfilippo 1985; Tartter 1998; van de Watering 1998; Titlestad 2001; van Hilten 2004; Boshkov 2006) or sample size bias (Lapierre 2007).
Effects of interventions
Leukoreduced PRBC versus non‐leukoreduced PRBC
1. Primary outcomes
TRALI (analysis based on total randomised patients)
Overall analysis
One trial including 1864 participants showed no difference between treatment groups on TRALI (6.02% versus 6.31%) (RR 0.96, 95% CI 0.67 to 1.36; P = 0.80) (Nathens 2006). See Analysis 1.1.
Quality of evidence (TSA and GRADE)
The accrued information of 1864 participants constituted only 28.5% of the diversity‐adjusted required information size (DARIS) of 6548 participants. We calculated DARIS based on a diversity of 4%; a proportion with the TRALI events of 6.3% in the control group; a relative risk reduction of 25%; an alpha of 5%; and a beta of 20% (power = 80%). With the inclusion of data from one trial, the Z‐value neither crossed the conventional statistical boundaries of 5% nor the Lan‐DeMets‐O'Brian‐Fleming boundaries. The TSA‐adjusted 95% CI overlapped with no effect (RR 1.0) and is compatible with both a potential benefit and a potential harm (RR 0.46 and RR 1.98, respectively); thus, the TSA yielded an inconclusive result. The quality of evidence was low (imprecision as reflected in the wide CI and only one trial with a small sample size as compared with the DARIS (‐2)).
In the analysis including "only transfused patients", compared to all patients results were similar (RR 0.98, 95% CI 0.74 to 1.29; P = 0.87; Analysis 2.1). We were unable to conduct other subgroup and sensitivity analyses because only one study measured this outcome. In this study, Nathens 2006, leukoreduction was performed pre‐storage.
2. Secondary outcomes
Death due to any cause
Overall analysis (total randomised patients)
The meta‐analysis of nine trials including 6485 participants showed no difference between treatment groups in the risk of death from any cause (8.54% versus 9.34%; RR 0.81, 95% CI 0.58 to 1.12, I² statistic = 63%, P = 0.20) (Jensen 1996; van de Watering 1998; Collier 2001; Titlestad 2001; Wallis 2002; Bilgin 2004; van Hilten 2004; Nathens 2006; Lapierre 2007). See Analysis 1.2.
Sensitivity analysis
We conducted three sensitivity analyses; none of which were statistically significant. The RRs using the fixed‐effect model were similar to that of the random effect model.
-
Including three studies with low risk of bias (Collier 2001; Bilgin 2004; Nathens 2006), compared to six studies at unclear or high risk of bias (RR 1.03, 95% CI 0.89 to 1.20; I² statistic = 38%, P = 0.66).
-
Including "only transfused patients", compared to all patients (RR 0.80, 95% CI 0.60 to 1.07, I² statistic: 60%, P = 0.13, Analysis 2.2).
-
Post‐storage leukoreduction, compared with pre‐storage leukoreduction (RR 0.74, 95% CI 0.53 to 1.04, I² statistic: 70%, P = 0.09).
Reporting bias
We did not explore reporting biases since the meta‐analysis included fewer than 10 studies (Higgins 2011).
Quality of evidence (TSA and GRADE)
The accrued information of 6485 participants constituted only 55.2% of the DARIS of 11,735 participants. DARIS was calculated based on a diversity of 84%; a proportion of death from any cause of 9.34% in the control group (median proportion of deaths in the control group); a relative risk reduction of 25%; an alpha of 5%; and a beta of 20% (power = 80%). The Z‐value neither crossed the conventional statistical boundaries of 5% nor the Lan‐DeMets‐O'Brian‐Fleming boundaries. The TSA did not indicate futility, as the cumulative Z‐curve did not cross the futility wedge (Figure 4). The TSA‐adjusted 95% CI overlapped with no effect (RR 1.0) and is compatible with both a potential benefit and a potential harm (RR 0.51 and RR 1.27, respectively); thus, the TSA yielded an inconclusive result. The quality of evidence was very low (high risk of bias (‐1); important heterogeneity (‐1); and imprecision as reflected in the wide CI and an insufficient accrued information size compared with the DARIS (‐1)).

TSA calculated to reliably detect a 25% relative change in the incidence of death from any cause, assuming a control group event rate of 9.34% with a power of 80% at an alpha of 5%
Infection from any cause
Overall analysis (total randomised patients)
The meta‐analysis of 10 trials involving 6709 participants showed no difference between treatment groups in the risk of infection from any cause (17.7% versus 20.4%; RR 0.80, 95% CI 0.62 to 1.03; I² statistic = 84%, P = 0.08) (Jensen 1996; Tartter 1998; van de Watering 1998; Collier 2001; Titlestad 2001; Wallis 2002; Bilgin 2004; van Hilten 2004; Nathens 2006; Lapierre 2007). See Analysis 1.3.
Sensitivity analysis
The RR was different when we used the fixed‐effect model (RR 0.85, 95% CI 0.77 to 0.93; I² statistic = 84%, P = 0.0006); however, the results of TSA indicate this statistically significant result may be a spurious finding.
We performed three other sensitivity analyses, which showed no statistically significant differences:
-
Including three studies with low risk of bias (Collier 2001; Bilgin 2004; Nathens 2006), compared with seven studies at unclear or high risk of bias (RR 0.92, 95% CI 0.63 to 1.34; I² statistic = 83%, P = 0.67).
-
Including "only transfused patients", compared with all randomised patients (RR 0.76, 95% CI 0.58 to 1.00; I² statistic = 87%, P = 0.05, Analysis 2.3), and the heterogeneity remained high.
-
Post‐storage leukoreduction, compared with pre‐storage leukoreduction (RR 0.91, 95% CI 0.76 to 1.09; I² statistic = 65%, P = 0.32).
Reporting bias
After visual assessment of the funnel plot (Figure 5) and a formal assessment of the funnel plot asymmetry, applying the Egger's test (P = 0.09), we found no sign of reporting bias.

Funnel plot of comparison: 1 Leukoreduced PRBC versus non‐leukoreduced PRBC. Main Analysis (Randomised patients), outcome: 1.3 Infection. Number of events of the total of randomised patients reported.
Quality of evidence (TSA and GRADE)
The accrued information of 6709 participants constituted only 60.6% of the DARIS of 11,062 participants. We calculated DARIS based on a diversity of 86%; a proportion of infection from any cause of 20.4% in the control group (median proportion in the control group); a relative risk reduction of 25%; an alpha of 5%; and a beta of 20% (power = 80%). The Z‐value neither crossed the conventional statistical boundaries of 5% nor the Lan‐DeMets‐O'Brian‐Fleming boundaries. TSA did not indicate futility, as the Z‐curve did not cross the futility wedge (Figure 6). The TSA‐adjusted 95% CI overlapped the zone of no effect (RR 1.0) and is compatible with both a potential benefit and a potential harm (RR 0.57 and RR 1.12, respectively); thus, the TSA yielded an inconclusive result. The quality of evidence was very low (high risk of bias (‐1); important heterogeneity (‐2); and imprecision due to the CI crossing the threshold of meaningful effect and an insufficient sample size as compared with the DARIS (‐1)).

TSA calculated to reliably detect a 25% relative change in the incidence of infection from any cause, assuming a control group event rate of 20.4% with a power of 80% at an alpha of 5%.
Adverse events (fever)
Three trials reported adverse events. However, we excluded one trial reporting fever as a temperature increase of at least 1°C per transfusion from the meta‐analysis since fever was not analysed per study participant (Collier 2001).
Overall analysis (total randomised patients)
Two trials including 634 participants showed no difference between treatment groups in adverse events (31.9% versus 38.7%; RR 0.81, 95% CI 0.64 to 1.02; I² statistic = 0%, P = 0.07) (Wallis 2002). See Analysis 1.4.
Sensitivity analysis
In the sensitivity analysis comparing "transfused patients" with randomised patients, there was a statistically significant difference (RR 0.75, 95% CI 0.60 to 0.94, I² statistic = 0%, P = 0.01, Analysis 2.4); however, the results of TSA indicate this statistically significant result may be a spurious finding.
In a sensitivity analysis of data from one study, Wallis 2002, there was no difference when comparing post‐storage with pre‐storage leukoreduction (RR 0.81, 95% CI 0.64 to 1.04).
Reporting bias
We did not explore reporting biases since the meta‐analysis included fewer than 10 studies (Higgins 2011).
Quality of evidence (TSA and GRADE)
The accrued information of 634 participants constituted only 84.4% of the DARIS of 751 participants. DARIS was calculated based on a diversity of 0%; a proportion of infection from any cause of 38.7% in the control group (median proportion in the control group); a relative risk reduction of 25%; an alpha of 5%; and a beta of 20% (power = 80%). The Z‐value neither crossed the conventional statistical boundaries of 5% nor the Lan‐DeMets‐O'Brian‐Fleming boundaries. TSA did not indicate futility, as the Z‐curve did not cross the futility wedge (Figure 7). The TSA‐adjusted 95% CI overlapped with the zone of no effect (RR 1.0) and is compatible with both a potential benefit and a potential harm (RR 0.68 and RR 1.05, respectively); thus, the TSA yielded an inconclusive result. The quality of evidence was low (high risk of bias (‐1); and imprecision due to the CI crossing the threshold of meaningful effect and an insufficient sample size as compared with the DARIS (‐1)).

TSA calculated to reliably detect a 25% relative change in the incidence of fever, assuming a control group event rate of 38.7% with a power of 80% at an alpha of 5%.
Non‐infectious complications
The included trials did not assess this pre‐defined outcome.
Discusión
Resumen de los resultados principales
En esta revisión sistemática se incluyeron 13 ensayos con pacientes de cirugía cardiovascular, pacientes de cirugía gastrooncológica, con traumatismos y con VIH que se asignaron al azar a recibir transfusión de CE leucorreducidos en comparación con CE no leucorreducidos. Después del análisis de los datos de los estudios no fue posible concluir si la leucorreducción de los CE tiene un efecto sobre la prevención de la LPART (un ensayo), la muerte (nueve ensayos), la infección (diez ensayos) y otros eventos adversos (fiebre, informada en dos ensayos). La calidad de las pruebas fue baja (LPART y eventos adversos) a muy baja (muerte e infección) debido a la heterogeneidad alta, la imprecisión y el riesgo alto de sesgo. Ninguno de los ensayos incluidos informó otras complicaciones no infecciosas. Los análisis de sensibilidad de los ensayos con riesgo bajo de sesgo no demostraron un efecto beneficioso ni perjudicial de la leucorreducción de los CE sobre los datos agrupados con respecto a la muerte, la infección y los eventos adversos.
Compleción y aplicabilidad general de las pruebas
Completitud general de las pruebas
Se analizaron 13 ensayos clínicos controlados que cumplieron los criterios de inclusión predefinidos. Dos ensayos informaron solamente resultados fisiológicos y se excluyeron de los metanálisis. Solamente un ECA evaluó el resultado primario (LPART). Sin embargo, se obtuvieron datos de 11 ensayos que contribuyeron a las estimaciones del efecto de los resultados secundarios (muerte por cualquier causa, infección por cualquier causa y eventos adversos / fiebre). No se encontraron ensayos que evaluaran complicaciones no infecciosas diferentes de la LPART (p.ej. RFNHT). Por lo tanto, los objetivos y los resultados predefinidos de la revisión Cochrane se consideraron de forma parcial y los resultados no son concluyentes. En consecuencia, los resultados de esta revisión deben interpretarse con cautela hasta que haya más datos disponibles.
Aplicabilidad de las pruebas
Esta revisión Cochrane es compleja por varias razones:
En primer lugar, con respecto a la población: los estudios identificados seleccionaron pacientes con diferentes problemas de salud que incluyeron traumatismo, cáncer, cardiopatías e infección por VIH. Algunas poblaciones de pacientes importantes no se estudiaron (p.ej. pacientes pediátricos u obstétricos) o se evaluaron de forma insuficiente (p.ej. un ECA de pacientes con traumatismos). En este contexto, la validez externa puede ser limitada debido a la falta de estudios que analizan estas poblaciones. Además, el efecto de leucorreducción en algunos tipos de pacientes sin una indicación fuerte para la administración de CE leucorreducidos no se ha evaluado de forma suficiente: pacientes con transfusión única, pacientes sin antecedentes de RFNHT, pacientes que no reciben transfusiones plaquetarias a largo plazo y los que no tienen riesgo de desarrollar enfermedad por CMV.
En segundo lugar, con respecto a la intervención, los estudios incluidos no informaron de manera suficiente varios aspectos relacionados con la transfusión de eritrocitos, lo que se debe considerar al interpretar los resultados, a saber: administración de plaquetas leucorreducidas o no leucorreducidas como una cointervención, el momento adecuado de la leucorreducción (es decir prealmacenamiento o posalmacenamiento), el tipo de filtro utilizado (p.ej. Cell select Optima, BPF4, RC 100, Sepacell RZ‐200B1), la definición de reducción de leucocitos (p.ej. 0,1 a 0,3 × 106 leucocitos/unidad, 5 × 106, 2 × 105 por unidad, etc.) y el tipo de transfusión (es decir alogénica o autóloga).
En tercer lugar, con respecto a los resultados: no todos los ensayos incluidos evaluaron resultados clínicos relevantes. Las infecciones relevantes (p.ej. CMV), las complicaciones no infecciosas (p.ej. LPART, RFNHT) y otros eventos adversos no se evaluaron ni informaron de manera suficiente (Schulz 2010). Los diversos intervalos de seguimiento (28 días a 15 meses) pueden representar otra limitación para la evaluación de los resultados.
En cuarto lugar, con respecto a los costos: la leucorreducción está ampliamente implementada en la práctica clínica en muchos países y algunos han establecido la leucorreducción universal para las transfusiones de sangre (Laupacis 2001). Sin embargo, los costos elevados relacionados con este procedimiento merecen atención especial. Aunque la reintroducción de productos no leucorreducidos probablemente no tenga una repercusión clínica, conlleva consecuencias económicas. El cambio en la estrategia de la realización de la leucorreducción universal a la selectiva daría lugar a una disminución importante en los costos (p.ej. casi EUR 30 000 000 por año en España (AETSA 2007)). Tsantes 2014 informó un cociente incremental de la relación entre costo y efectividad de 6916 EUR para prevenir un caso de RFNHT. Además, es razonable considerar otros costos asociados con el mantenimiento de los inventarios duales de CE leucorreducidos y CE no leucorreducidos.
Finalmente, debido a que se ha demostrado que la leucorreducción de los CE no tuvo efectos sobre la prevención de la LPART, la muerte, la infección y otros eventos adversos informados por los ECA, estos resultados se deben interpretar de forma adecuada dentro del contexto de la práctica clínica actual, que difiere internacionalmente y entre las poblaciones. Otras estrategias podrían ser más costo‐efectivas en comparación con la leucorreducción en cuanto a la posibilidad de evitar eventos adversos relacionados con los CE de transfusión, como la administración de factores desencadenantes de transfusión restrictivos (Carson 2012; Rohde 2014), que han mostrado efectividad independientemente de si los productos sanguíneos son leucorreducidos o no.
Calidad de la evidencia
El grupo de pruebas disponibles hasta la fecha no permite establecer una conclusión definitiva acerca de los efectos beneficiosos y perjudiciales de la leucorreducción. Los ECA incluidos presentaban importantes limitaciones metodológicas: 1. informe deficiente e incompleto de los criterios de inclusión y exclusión; 2. sesgo de deserción importante debido a la exclusión de muchos pacientes incluidos, pero no transfundidos; 3. información incompleta sobre la ocultación de la asignación; 4. informe insuficiente de otros componentes sanguíneos como cointervenciones; y 5. informe incompleto de los resultados clínicos de interés. Además, algunos de los ensayos incluidos mostraron inconsistencias importantes en las estimaciones del efecto.
Sesgos potenciales en el proceso de revisión
Se aplicó la metodología Cochrane para las revisiones sistemáticas para la búsqueda y la selección de los estudios para inclusión en la revisión. Sin embargo, a pesar del esfuerzo para incluir todos los estudios publicados que evaluaron la leucorreducción para la prevención de las reacciones adversas causadas por la transfusión de sangre alogénica, es posible que no se identificaran todos los datos relevantes. El número pequeño de ensayos identificados en la revisión plantea preocupación en cuanto al sesgo de publicación. Para identificar este posible sesgo se realizó un gráfico en embudo. Sin embargo, este método visual fue posible solamente para un resultado (infección por cualquier causa), debido a que menos de diez estudios evaluaron los otros resultados.
Se estableció contacto con los autores durante la identificación de los ensayos (ver Apéndice 3) para aclarar algunas preguntas relacionadas con los criterios de elegibilidad, pero no mientras se completó la extracción y el análisis de los datos. Se tuvieron en cuenta solamente los datos publicados durante estos procesos, y la información faltante se consideró como sesgo de informe.
En el protocolo de la revisión se definió el análisis principal basado en el enfoque de ITT (Simancas‐Racines 2012). Sin embargo, durante la extracción de los datos se identificó un número importante de pacientes incluidos pero no transfundidos. Este hecho puede afectar la precisión de las estimaciones del efecto. Para explorar este escenario se realizó un análisis por protocolo (solamente pacientes transfundidos) que no reflejó diferencias relevantes con respecto al resultado primario (LPART) y los resultados secundarios muerte e infección por cualquier causa, aunque el resultado secundario eventos adversos (fiebre) mostró diferencias.
Una limitación de la revisión fue el hecho de no considerar el efecto de la depleción de la capa leucoplaquetaria en las estimaciones a través de un análisis de sensibilidad, debido a que no se había planificado dicho análisis con antelación. Otra limitación fue el hecho de no considerar el análisis de subgrupos del posible efecto de diferentes tipos de filtros utilizados en los estudios incluidos para todos los resultados. Este análisis se planificó en el protocolo de la revisión solamente para el resultado primario.
Acuerdos y desacuerdos con otros estudios o revisiones
Anteriormente se han realizado revisiones y metanálisis sobre la infección posoperatoria y la muerte relacionadas con la leucorreducción de los productos sanguíneos. Sin embargo, hasta donde se conoce, todavía no se han publicado revisiones sistemáticas centradas en las complicaciones no infecciosas como la LPART o la RFNHT. En el análisis general de la muerte por cualquier causa, los hallazgos de otras revisiones coinciden con los presentes resultados. No obstante, una revisión sistemática mostró una reducción del 50% en la probabilidad de infección posoperatoria (Blumberg 2007) y otra revisión que analizó "solamente los pacientes que recibieron transfusión" encontró una reducción estadísticamente significativa del 40% en la infección posoperatoria, pero una reducción no significativa de la mortalidad (Fergusson 2004).
Estas dos revisiones tienen varias limitaciones. Incluyeron estudios con otros componentes sanguíneos aparte de las células de CE leucorreducidas como intervenciones, así como estudios no aleatorios. Además, no se consideró la heterogeneidad entre los estudios y el riesgo de sesgo de los estudios incluidos no se evaluó de forma apropiada. Además, no se incluyeron algunos estudios relevantes.

Study flow diagram.

'Risk of bias' graph: review authors' judgements about each 'Risk of bias' item presented as percentages across all included studies.
'Risk of bias' summary: review authors' judgements about each 'Risk of bias' item for each included study.
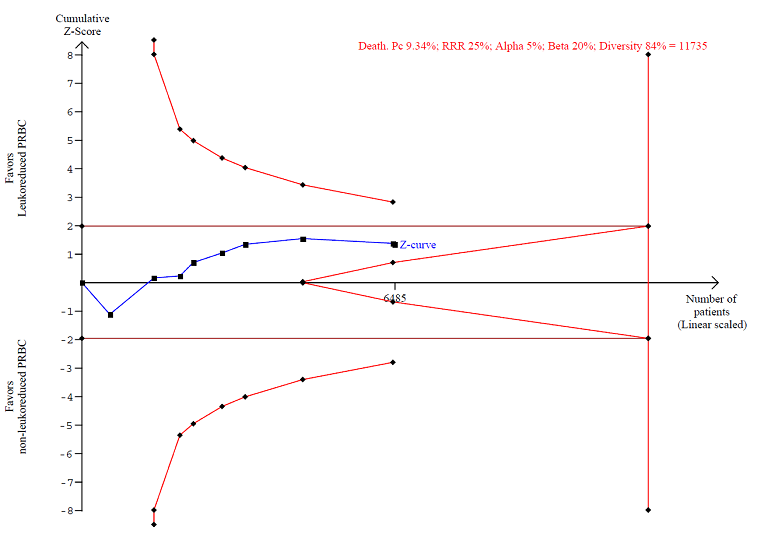
TSA calculated to reliably detect a 25% relative change in the incidence of death from any cause, assuming a control group event rate of 9.34% with a power of 80% at an alpha of 5%

Funnel plot of comparison: 1 Leukoreduced PRBC versus non‐leukoreduced PRBC. Main Analysis (Randomised patients), outcome: 1.3 Infection. Number of events of the total of randomised patients reported.

TSA calculated to reliably detect a 25% relative change in the incidence of infection from any cause, assuming a control group event rate of 20.4% with a power of 80% at an alpha of 5%.

TSA calculated to reliably detect a 25% relative change in the incidence of fever, assuming a control group event rate of 38.7% with a power of 80% at an alpha of 5%.

Comparison 1 Leukoreduced PRBC versus non‐leukoreduced PRBC. Main analysis (randomised patients), Outcome 1 TRALI. Number of events of the total of randomised patients reported.

Comparison 1 Leukoreduced PRBC versus non‐leukoreduced PRBC. Main analysis (randomised patients), Outcome 2 Death. Number of events of the total of randomised patients reported.

Comparison 1 Leukoreduced PRBC versus non‐leukoreduced PRBC. Main analysis (randomised patients), Outcome 3 Infection. Number of events of the total of randomised patients reported.
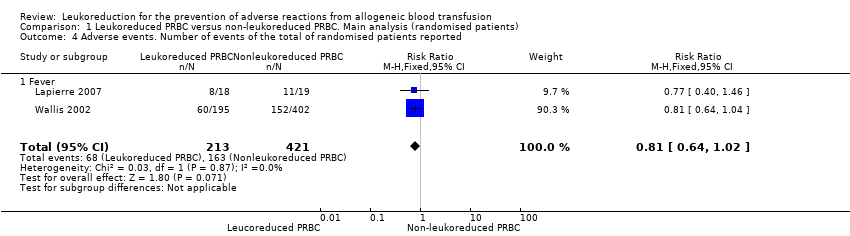
Comparison 1 Leukoreduced PRBC versus non‐leukoreduced PRBC. Main analysis (randomised patients), Outcome 4 Adverse events. Number of events of the total of randomised patients reported.
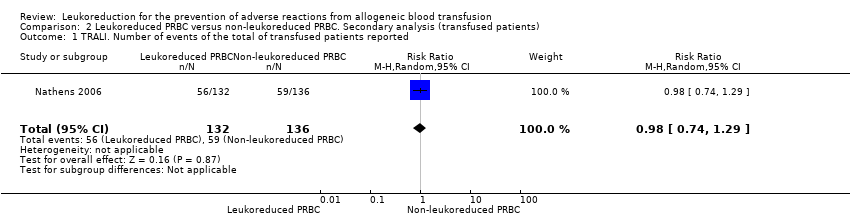
Comparison 2 Leukoreduced PRBC versus non‐leukoreduced PRBC. Secondary analysis (transfused patients), Outcome 1 TRALI. Number of events of the total of transfused patients reported.
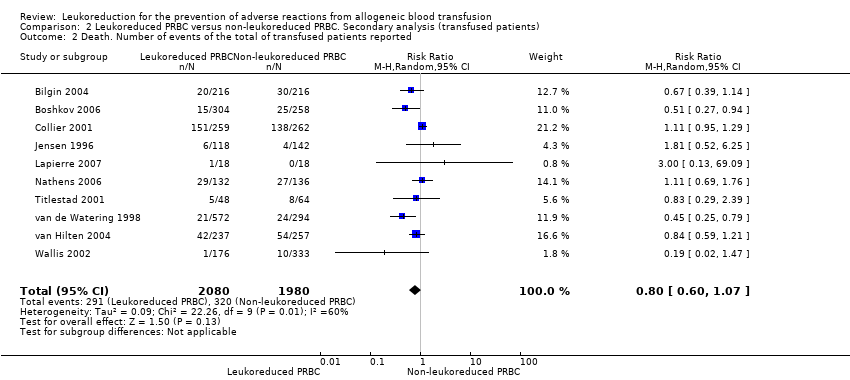
Comparison 2 Leukoreduced PRBC versus non‐leukoreduced PRBC. Secondary analysis (transfused patients), Outcome 2 Death. Number of events of the total of transfused patients reported.

Comparison 2 Leukoreduced PRBC versus non‐leukoreduced PRBC. Secondary analysis (transfused patients), Outcome 3 Infection. Number of events of the total of transfused patients reported.

Comparison 2 Leukoreduced PRBC versus non‐leukoreduced PRBC. Secondary analysis (transfused patients), Outcome 4 Adverse events. Number of events of the total of transfused patients reported.
| Leukoreduced PRBCs versus non‐leukoreduced PRBCs for preventing adverse reaction from allogeneic blood transfusion | ||||||
| Patient or population: Patients receiving RBC transfusion | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Non‐leukoreduced packed RBCs | Leukoreduced packed RBCs | |||||
| TRALI | Study population | RR 0.96 | 1864 | ⊕⊕⊝⊝ | TSA yielded an inconclusive result. | |
| 63 per 1000 | 61 per 1000 | |||||
| Death due to any cause | Study population | RR 0.81 | 6485 | ⊕⊝⊝⊝ | TSA yielded an inconclusive | |
| 93 per 1000 | 76 per 1000 | |||||
| Infection from any cause | Study population | RR 0.80 | 6709 | ⊕⊝⊝⊝ | TSA yielded an inconclusive | |
| 204 per 1000 | 163 per 1000 | |||||
| Adverse events | Study population | RR 0.81 | 634 | ⊕⊕⊝⊝ | TSA yielded an inconclusive | |
| 387 per 1000 | 314 per 1000 | |||||
| Non‐infectious complication | Study population | Not estimable | — | — | No trial assessed this outcome. | |
| Not estimable | Not estimable | |||||
| *The basis for the assumed risk was the median control group risk across studies. The corresponding risk (and its 95% CI) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Downgraded by two due to imprecision: small sample size as compared with the calculated DARIS and the wide CI overlapping zones of no effect, as well as potential harm or benefit, or both. Few events reported. 3Downgraded due to: high risk of bias (Seven of 10 included studies were at high or unclear risk of bias, ‐1); important heterogeneity (I² statistic: 84%, ‐2); and imprecision due to the CI crossing the threshold of meaningful effect and an insufficient sample size as compared with the DARIS (‐1) 4Downgraded due to: high risk of bias (All included studies evaluated were at high risk of bias, ‐1) and imprecision due to the CI crossing the threshold of meaningful effect and an insufficient sample size as compared with the DARIS (‐1). | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 TRALI. Number of events of the total of randomised patients reported Show forest plot | 1 | 1864 | Risk Ratio (M‐H, Random, 95% CI) | 0.96 [0.67, 1.36] |
| 2 Death. Number of events of the total of randomised patients reported Show forest plot | 9 | 6485 | Risk Ratio (M‐H, Random, 95% CI) | 0.81 [0.58, 1.12] |
| 3 Infection. Number of events of the total of randomised patients reported Show forest plot | 10 | 6709 | Risk Ratio (M‐H, Random, 95% CI) | 0.80 [0.62, 1.03] |
| 4 Adverse events. Number of events of the total of randomised patients reported Show forest plot | 2 | 634 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.81 [0.64, 1.02] |
| 4.1 Fever | 2 | 634 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.81 [0.64, 1.02] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 TRALI. Number of events of the total of transfused patients reported Show forest plot | 1 | 268 | Risk Ratio (M‐H, Random, 95% CI) | 0.98 [0.74, 1.29] |
| 2 Death. Number of events of the total of transfused patients reported Show forest plot | 10 | 4060 | Risk Ratio (M‐H, Random, 95% CI) | 0.80 [0.60, 1.07] |
| 3 Infection. Number of events of the total of transfused patients reported Show forest plot | 10 | 3557 | Risk Ratio (M‐H, Random, 95% CI) | 0.76 [0.58, 1.00] |
| 4 Adverse events. Number of events of the total of transfused patients reported Show forest plot | 2 | 544 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.75 [0.60, 0.94] |
| 4.1 Fever | 2 | 544 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.75 [0.60, 0.94] |

