Surfactante para el síndrome de aspiración de meconio en recién nacidos a término y prematuros tardíos
Resumen
Antecedentes
Se ha demostrado que el tratamiento de reemplazo de surfactante es beneficioso para la prevención y el tratamiento del síndrome de dificultad respiratoria (SDR) neonatal. La deficiencia de surfactante o la disfunción del surfactante puede contribuir a la insuficiencia respiratoria en un grupo más amplio de trastornos, que incluye el síndrome de aspiración de meconio (SAM).
Objetivos
Evaluar el efecto de la administración de surfactante en el tratamiento de los lactantes a término y prematuros tardíos con síndrome de aspiración de meconio.
Métodos de búsqueda
Se realizaron búsquedas en La Biblioteca Cochrane (Número 4, 2006), MEDLINE y EMBASE (1985 a diciembre de 2006), revisiones anteriores que incluyen referencias cruzadas, resúmenes, actas de congresos y simposios, informantes expertos y búsquedas manuales en revistas, sin restricciones de idioma. Se estableció contacto con los autores de los estudios para obtener datos adicionales.
En noviembre de 2014 se realizó una búsqueda actualizada y se buscaron ensayos en curso o recientemente finalizados en los siguientes sitios: www.clinicaltrials.gov; www.controlled‐trials.com y www.who.int/ictrp.
Criterios de selección
En los análisis se incluyeron ensayos controlados aleatorizados que evaluaron el efecto de la administración de surfactante en lactantes a término y prematuros tardíos con síndrome de aspiración de meconio.
Obtención y análisis de los datos
Se extrajeron datos sobre resultados clínicos, incluida la mortalidad, el tratamiento con oxigenación por membrana extracorpórea (OMEC), el neumotórax, la duración de la ventilación asistida, la duración del oxígeno suplementario, la hemorragia intraventricular (HIV de cualquier grado y grave) y la enfermedad pulmonar crónica. Se realizaron análisis de datos de acuerdo con el estándar del Grupo de Revisión Cochrane de Neonatología (Cochrane Neonatal Review Group).
Resultados principales
No se encontraron ensayos controlados aleatorizados que cumplieran con los criterios de inclusión. El metanálisis de cuatro ensayos (326 lactantes) no mostró efectos estadísticamente significativos sobre la mortalidad (riesgo relativo [RR] típico 0,98; intervalo de confianza [IC] del 95%: 0,41 a 2,39; diferencia de riesgos [DR] típica ‐0,00; IC del 95%: ‐0,05 a 0,05). No hubo heterogeneidad en este resultado (I² = 0% para el RR y la DR). El riesgo de requerir oxigenación por membrana extracorpórea se redujo significativamente en un metanálisis de dos ensayos (n = 208), (RR típico 0,64; IC del 95%: 0,46 a 0,91; DR típica ‐0,17; IC del 95%: ‐0,30 a ‐0,04; número necesario a tratar para un resultado beneficioso adicional [NNTB] 6; IC del 95%: 3 a 25). No hubo heterogeneidad para el RR (1² = 0%) pero hubo heterogeneidad moderada para la DR (I² = 50%). Un ensayo (n = 40) informó de una reducción estadísticamente significativa en la duración de la estancia hospitalaria (diferencia de medias ‐8 días; IC del 95%: ‐14 a ‐3 días; no se aplica la prueba de heterogeneidad). No hubo reducciones estadísticamente significativas en ninguna otro resultado estudiado (duración de la ventilación asistida, duración del oxígeno suplementario, neumotórax, enfisema pulmonar intersticial, fugas de aire, enfermedad pulmonar crónica, necesidad de oxígeno en el momento del alta o hemorragia intraventricular).
Conclusiones de los autores
En recién nacidos con SAM, la administración de surfactante puede reducir la gravedad de la enfermedad respiratoria y disminuir el número de niños con insuficiencia respiratoria progresiva que requieren apoyo con OMEC. La eficacia relativa del tratamiento con surfactante, comparado con, o junto con otros enfoques de tratamiento que incluyen óxido nítrico inhalado, ventilación líquida, lavado con surfactante y ventilación de alta frecuencia aún no se ha probado.
PICO
Resumen en términos sencillos
Surfactante para el síndrome de aspiración de meconio en recién nacidos a término y prematuros tardíos
Título simplificado: Tratamiento con surfactante para recién nacidos que inhalaron meconio dentro de los pulmones cerca del momento del parto o durante el mismo
Pregunta de la revisión: ¿La administración de surfactante mejora la función pulmonar y da lugar a mejores resultados clínicos en los recién nacidos a término o cerca del término que han inhalado meconio cerca del momento del parto o durante el mismo?
Antecedentes: Los pulmones de los recién nacidos pueden ser dañados por el síndrome de aspiración de meconio. El síndrome de aspiración de meconio se produce cuando un feto que presenta estrés realiza una evacuación intestinal mientras aún está en el útero y luego respira algo de este material en los pulmones. El surfactante pulmonar, la compleja combinación de químicos que recubren la superficie del pulmón, se puede alterar o inactivar en los recién nacidos que han aspirado meconio. Se cree que el tratamiento con surfactante adicional podría ayudar a superar este daño.
Características de los estudios: Cinco ensayos controlados aleatorizados con 326 recién nacidos cumplieron con los criterios de inclusión.
Resultados: Esta revisión de ensayos encontró que el surfactante puede prevenir el empeoramiento de las dificultades respiratorias y reducir la necesidad de un tratamiento de derivación cardiopulmonar en algunos recién nacidos que presentan síndrome de aspiración de meconio.
Conclusiones de los autores
Antecedentes
Descripción de la afección
La deficiencia de surfactante o la disfunción del surfactante puede contribuir a la insuficiencia respiratoria en un grupo más amplio de trastornos, que incluye el síndrome de aspiración de meconio (SAM). El meconio inhibe las propiedades de disminución de la tensión superficial del surfactante (Chen 1985, Moses 1991). La instilación de meconio dentro de las vías respiratorias de animales nacidos a término provoca obstrucción mecánica aguda y un empeoramiento de la mecánica pulmonar y del intercambio gaseoso (Chen 1985; Tran 1980; Tyler 1978). Se puede demostrar una reducción significativa en el funcionamiento pulmonar, un aumento en la resistencia pulmonar espiratoria y un aumento en la capacidad residual funcional (Tran 1980). Los investigadores plantearon que los cambios en el funcionamiento asociados con la aspiración de meconio son provocados por el desplazamiento del surfactante por parte de los ácidos grasos libres (Clark 1987). En los animales con aspiración de meconio inducida de forma experimental, el tratamiento con dosis grandes de extracto de surfactante de origen animal mejora el funcionamiento y la ventilación (Sun 1993).
Descripción de la intervención
Se ha demostrado que el tratamiento de reemplazo de surfactante es beneficioso para la prevención y el tratamiento del síndrome de dificultad respiratoria (SDR) neonatal (Soll 1992). El síndrome de dificultad respiratoria se debe a una deficiencia primaria en la producción y la liberación de surfactante pulmonar. Se ha demostrado que el tratamiento con surfactante mejora la oxigenación, disminuye la necesidad de apoyo respiratorio y mejora el resultado clínico en recién nacidos con SDR. Los recién nacidos tratados con surfactante presentan una menor mortalidad y una menor incidencia de neumotórax.
Los estudios no controlados sobre el tratamiento con surfactante en lactantes con SAM indican que el surfactante puede ser beneficioso en el SAM. En un estudio piloto de siete recién nacidos con SAM tratados con surfactante, los siete demostraron una mejoría de la insuficiencia respiratoria (Auten 1991). Khammash 1993 trató a 20 recién nacidos con SAM grave. Los recién nacidos recibieron una dosis endotraqueal de extracto de surfactante bovino (100 mg de fosfolípido/kg). Se observó una mejoría en el índice de oxigenación (IO) y en el cociente arterial/alveolar (a/A pO₂) en el 75% de los lactantes tratados en las seis horas siguientes a la instilación de surfactante. Ninguno de los lactantes tratados necesitó tratamiento experimental adicional, que incluye oxigenación por membrana extracorpórea (OMEC).
Otros enfoques para prevenir o tratar el SAM incluyen la amnioinfusión (infusión de solución salina en la cavidad amniótica), la succión oronasofaríngea de los neonatos que han aspirado meconio antes del parto y el uso de lavado con surfactante en los lactantes con diagnóstico de SAM.
En una revisión sistemática de la amnioinfusión en mujeres con líquido teñido con meconio, Hofmeyr 2010 no encontró una reducción significativa en los resultados primarios del SAM, la muerte perinatal o la morbilidad grave, ni en la muerte materna o la morbilidad grave. Sin embargo, se informó sobre algunos efectos beneficiosos en un análisis de subgrupos que incluyó estudios realizados en instituciones donde la monitorización perinatal fue limitada.
Vain 2004 evaluó la efectividad de la succión intraparto para la prevención del SAM en un ensayo controlado aleatorizado multicéntrico amplio. El resultado primaria fue la incidencia de SAM. No se observaron diferencias significativas entre los grupos de tratamiento en cuanto a la incidencia de SAM, la mortalidad o la duración de la ventilación, el tratamiento con oxígeno y la atención hospitalaria. Los autores establecieron la conclusión de que la succión orofaríngea y nasofaríngea intraparto habitual de los lactantes nacidos a término con líquido amniótico teñido con meconio no previene el SAM. Estos hallazgos dieron lugar a cambios en la práctica clínica, ya que actualmente no se recomienda la aspiración habitual de la orofaringe y la nasofaringe (AAP 2006).
Por qué es importante realizar esta revisión
Esta revisión sistemática evalúa los ensayos controlados aleatorizados que estudiaron el efecto de la administración de surfactante en bolo para el tratamiento de los lactantes a término y prematuros tardíos con SAM. Estos datos actualizan la revisión anterior Surfactante para el síndrome de aspiración de meconio en recién nacidos a término o cerca del término (El Shahed 2007).
En esta revisión no se incluyeron los estudios que utilizaron soluciones de surfactante diluido el lavado del meconio de las vías respiratorias (Hahn 2013).
Varias revisiones Cochrane evalúan el surfactante en el tratamiento de los trastornos respiratorios en recién nacidos. La mayoría de estas revisiones se centran en recién nacidos con o en riesgo de SDR. Entre las revisiones sistemáticas se incluyen revisiones del surfactante en la prevención (Soll 1998; Soll 2010) y el tratamiento (Seger 2009; Soll 1998) del SDR, revisiones que compararon productos de origen animal con productos sintéticos (Soll 2001) y revisiones que evalúan surfactantes sintéticos más recientes que contienen proteínas (Pfister 2007; Pfister 2009).
En otras revisiones se compararon los momentos adecuados del tratamiento (Bahadue 2012; Rojas‐Reyes 2012; Stevens 2007), la dosis de surfactante (Soll 2009), los métodos de instilación del surfactante (Abdel‐Latif 2011a; Abdel‐Latif 2011b: Abdel‐Latif 2012) o el uso de surfactante en afecciones distintas del SDR, incluido el surfactante para la hemorragia pulmonar en neonatos (Aziz 2012) y el surfactante para la neumonía bacteriana en lactantes prematuros tardíos y a término (Tan 2012).
Objetivos
Evaluar el efecto de la administración de surfactante en el tratamiento de los recién nacidos prematuros tardíos y a término con síndrome de aspiración de meconio (SAM).
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Ensayos controlados aleatorizados que compararon el tratamiento con surfactante con el tratamiento habitual en recién nacidos prematuros tardíos y a término con SAM.
Tipos de participantes
Recién nacidos prematuros tardíos y a término con SAM (modificado a partir de la revisión anterior que planificó incluir solo a recién nacidos a término).
Tipos de intervenciones
Administración intratraqueal de surfactante versus placebo o ningún tratamiento. No se incluyeron los estudios que utilizaron soluciones de surfactante diluido para lavar el meconio de las vías respiratorias.
Tipos de medida de resultado
Para la actualización de esta revisión se seleccionaron los siguientes resultados primarios y secundarios:
Resultados primarios
-
Mortalidad
Resultados secundarios
-
Tratamiento con oxigenación con membrana extracorpórea (OMEC);
-
Neumotórax;
-
Enfisema pulmonar intersticial;
-
Fugas de aire (neumotórax, neumomediastino, enfisema pulmonar intersticial);
-
Duración de la ventilación mecánica asistida (días);
-
Duración de la administración de oxígeno suplementario (días);
-
Necesidad de oxígeno suplementario en el momento del alta;
-
Enfermedad pulmonar crónica (definida como la necesidad de oxigenoterapia a los 28 días o 36 semanas de edad posmenstrual);
-
Hemorragia intraventricular (cualquier grado);
-
HIV grave (grado III a IV);
-
Duración de la estancia hospitalaria (días).
Resultados adicionales para la actualización en 2014:
-
Muerte o enfermedad pulmonar crónica a los 28 días;
-
Muerte o enfermedad pulmonar crónica a las 36 semanas de edad posmenstrual;
-
Seguimiento del desarrollo neurológico.
Métodos de búsqueda para la identificación de los estudios
For the previous review in 2007, we searched The Cochrane Library (Issue 4, 2006) in December 2006. We searched MEDLINE (OVID, 1966 to December 2006) using the following strategy: (exp Pulmonary Surfactants/ or surfactan:.mp. or Surface‐Active Agents/ or (surfactan: adj2 lavage:).mp.) and (Meconium Aspiration Syndrome/ or Meconium/). We searched EMBASE (OVID, 1980 to 2006 Week 06), using the following strategy: (Lung Surfactant/ or exp Surfactant/ or (surfactan: adj2 lavage:).mp. or surfactan:.mp.) and (Meconium or Aspiration/ or meconium/).
We searched previous reviews and cross‐references, and abstracts published in Pediatric Research or electronically from Pediatric Academic Societies meetings from 2000 to December 2006, without any language restrictions.
In November 2014 we updated the electronic searches. See: Appendix 1. In addition, we searched for ongoing or recently completed trials in the following clinical trials registries (www.clinicaltrials.gov; www.controlled‐trials.com; and www.who.int/ictrp).
Obtención y análisis de los datos
We used the standard methods of the Cochrane Neonatal Review Group, as documented in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011).
Selección de los estudios
Review authors independently assessed for inclusion all the potential studies identified as a result of the search strategy. We resolved any disagreement through discussion.
Extracción y manejo de los datos
For each included study, we collected information regarding the method of randomisation, blinding, drug intervention, stratification, and whether the trial was single‐ or multicentre. We noted information regarding trial participants, including gestational age criteria, birth weight criteria, cause of respiratory failure, severity of respiratory failure, and postnatal age at the time of treatment. We extracted information on clinical outcomes, including mortality, treatment with ECMO, pneumothorax, pulmonary interstitial emphysema, chronic lung disease, duration of assisted ventilation, duration of supplemental oxygen, need for supplemental oxygen at discharge, duration of hospital stay, and intraventricular haemorrhage (any grade and grades III and IV). We contacted investigators or study sponsors for clarification or provision of data not specifically noted in the original report. For the update in 2007, two review authors (AS, AO) independently evaluated all studies, abstracted the data onto extraction forms and compared and agreed the abstracted data. One review author (AS) entered the data into RevMan 4.2.9 and the other review author (AO) checked the data for accuracy. Unpublished information on the subgroup of infants with MAS obtained from Lotze at al (Lotze 1998) included in the original review were entered unchanged. Unpublished information regarding the multicentre trial conducted in Chile and previously published in abstract form was obtained from the authors (Maturana 2005) and the data from the unpublished report were entered into RevMan 5.3.
Evaluación del riesgo de sesgo de los estudios incluidos
We have used the standard review methods of the CNRG (About the CNRG) to assess the methodological quality of included studies.
For the 2014 update of the review, two review authors (AO, AS) assessed the following areas and completed a 'Risk of bias' table for each included study; see Characteristics of included studies.
Selection bias (random sequence generation and allocation concealment).
For each included study, we categorised the risk of selection bias as:
Random sequence generation:
Low risk ‐ adequate (any truly random process, e.g. random number table; computer random number generator); High risk ‐ inadequate (any non‐random process, e.g. odd or even date of birth; hospital or clinic record number); Unclear risk ‐ no or unclear information provided.
Allocation concealment:
Low risk ‐ adequate (e.g. telephone or central randomisation; consecutively numbered sealed opaque envelopes); High risk ‐ inadequate (open random allocation; unsealed or non‐opaque envelopes, alternation; date of birth); Unclear risk ‐ no or unclear information provided.
Performance bias
For each included study, we categorised the methods used to blind study personnel to knowledge of which intervention a participant received. (As our study population consisted of neonates they would all be blinded to the study intervention).
Low risk ‐ adequate for personnel (a placebo that could not be distinguished from the active drug was used in the control group); High risk ‐ inadequate ‐ personnel aware of group assignment; Unclear risk ‐ no or unclear information provided.
Detection bias
For each included study, we categorised the methods used to blind outcome assessors to knowledge of which intervention a participant received. (As our study population consisted of neonates they would all be blinded to the study intervention). Blinding was assessed separately for different outcomes or classes of outcomes. We categorised the methods used with regards to detection bias as:
Low risk ‐ adequate; follow‐up was performed with assessors blinded to group; High risk ‐ inadequate; assessors at follow‐up were aware of group assignment; Unclear risk ‐ no or unclear information provided.
Attrition bias
For each included study and for each outcome, we described the completeness of data including attrition and exclusions from the analysis. We noted whether attrition and exclusions were reported, the numbers included in the analysis at each stage (compared with the total randomised participants), reasons for attrition or exclusion where reported, and whether missing data were balanced across groups or were related to outcomes. Where sufficient information was reported or supplied by the trial authors, we re‐included missing data in the analyses. We categorised the methods with respect to the risk of attrition bias as: Low risk ‐ adequate (fewer than 10% missing data); High risk ‐ inadequate (more than 10% missing data); Unclear risk ‐ no or unclear information provided.
Reporting bias
For each included study, we described how we investigated the risk of selective outcome reporting bias and what we found. We assessed the methods as: Low risk ‐ adequate (where it is clear that all of the study's prespecified outcomes and all expected outcomes of interest to the review have been reported); High risk ‐ inadequate (where not all the study's prespecified outcomes have been reported; one or more reported primary outcomes were not prespecified; outcomes of interest are reported incompletely and so cannot be used; study fails to include results of a key outcome that would have been expected to have been reported); Unclear risk ‐ no or unclear information provided (e.g. the study protocol was not available).
Other bias
For each included study, we described any important concerns we had about other possible sources of bias (e.g. whether there was a potential source of bias related to the specific study design or whether the trial was stopped early due to some data‐dependent process). We assessed whether each study was free of other problems that could put it at risk of bias as: Low risk ‐ no concerns of other bias raised; High risk ‐ concerns raised about multiple checking of the data with the results made known to the investigators, difference in number of participants enrolled in abstract and final publications of the paper; Unclear ‐ concerns raised about potential sources of bias that could not be verified by contacting the study authors.
Where necessary, we planned to explore the impact of the level of bias through undertaking sensitivity analyses (Higgins 2011).
Medidas del efecto del tratamiento
The statistical methods included (typical) risk ratio (RR), (typical) risk difference (RD), number needed to treat for an additional beneficial outcome (NNTB) or number needed to treat for an additional harmful outcome (NNTH) for dichotomous outcomes, and mean difference (MD), all reported with 95% confidence intervals (CI). We used a fixed‐effect model for meta‐analysis.
Cuestiones relativas a la unidad de análisis
The unit of randomisation and the unit of analysis was in all cases the individual infant.
Manejo de los datos faltantes
We intended to contact the authors of all published studies if clarification was required, or to provide additional information. In the case of missing data, we intended to describe the number of participants with missing data in the Main results section. We present results only for the available participants. We intended to discuss the implications of missing data in the Discussion section of the review.
Evaluación de la heterogeneidad
We used the I² statistic to measure heterogeneity among the trials in each analysis (Higgins 2003). If we had identified substantial heterogeneity, we would have explored it by prespecified subgroup analysis and sensitivity analysis. We used the following cut‐offs for the degree of heterogeneity; < 25%, no heterogeneity; 25 to 49%, low heterogeneity; 50 to 74%, moderate heterogeneity and ≥ 75% high heterogeneity (Higgins 2011).
Evaluación de los sesgos de notificación
If available, we planned to obtain the study protocols of all included studies so that we could compare outcomes reported in the protocol to those reported in the findings for each of the included studies. We would have investigated reporting and publication bias by examining the degree of asymmetry of a funnel plot (if at least 10 trials were available for a given outcome). Where we suspected reporting bias (see selective reporting in Assessment of risk of bias in included studies), we would have attempted to contact study authors to provide missing outcome data. Where this was not possible, and the missing data were thought to introduce serious bias, we would have explored the impact of including such studies in the overall assessment of results by conducting a sensitivity analysis.
Síntesis de los datos
We analysed the data using Review Manager 5 software (RevMan 2014). We conducted a fixed‐effect Mantel‐Haenszel meta‐analysis for combining data where trials examined the same intervention and we judged the trial populations and methods to be sufficiently similar.
Análisis de subgrupos e investigación de la heterogeneidad
If sufficient data were available, we had planned to explore potential sources of clinical heterogeneity through the following a priori subgroup analyses: (i) studies done with and without availability of inhaled nitric oxide; (ii) studies done with and without availability of extracorporeal membrane oxygenation (ECMO).
Análisis de sensibilidad
If sufficient data were available, we had planned to explore methodological heterogeneity through the use of sensitivity analyses. We planned to perform these through including trials of higher quality, based on the presence of any of the following: adequate sequence generation, allocation concealment, and fewer than 10% lost to follow‐up.
Results
Description of studies
Results of the search
Seventeen potential studies were identified, of which four are included in the review.
Included studies
For details, see the table Characteristics of included studies.
We include four studies in this review:
Findlay 1996 is a single‐centre study performed in the USA:
-
Objective: To determine whether high‐dose surfactant therapy improves the pulmonary morbidity of term infants ventilated for meconium aspiration syndrome (MAS).
-
Population: Term newborn infants with MAS, diagnosed by the presence of meconium below the vocal cords at birth with or without characteristic chest radiographic findings, who needed ventilator support before six hours of age with a fractional inspired oxygen (Fi0₂) level of 0.5 or more, mean airway pressure of 7 cm of H₂O or more and arterial/alveolar (a/A) pO₂ ratio of 0.22 or less.
-
Intervention: Infants in the study group received up to four doses of 150 mg (6ml)/kg beractant (Survanta), installed every six hours by continuous infusion for 20 minutes via a side hole endotracheal tube adapter. Infants in the control group received 6 ml/kg air placebo.
-
Outcomes: Primary outcomes included decrease in Oxygen Index (OI), increase in a/A pO₂ ratio and decrease in the need for respiratory support (mean airway pressure (MAP), ventilation days). Secondary outcomes included the need for ECMO, incidence of air leaks, duration of oxygen therapy, discharge with supplemental oxygen, and mortality at less than 28 days of life.
Lotze 1998 is a multicentre study performed in the USA:
-
Objective: To determine whether surfactant (beractant) administration to term newborns in respiratory failure and at risk of requiring extracorporeal membrane oxygenation (ECMO) treatment would significantly reduce the incidence of severe complications through 28 days of age and the need for ECMO.
-
Population: Infants weighing 2000 gm or more with gestational ages of 36 weeks or greater with respiratory failure secondary to MAS, sepsis or idiopathic persistent pulmonary hypertension of newborn (requiring FiO₂ 1.00 with OI of 15 to 39).
-
Intervention: Infants were randomly assigned to receive either four doses of beractant 100 mg/kg or air placebo before ECMO treatment and four additional doses during ECMO, if ECMO was required (only infants with MAS are included in this analysis and the data were provided by the authors).
-
Outcomes: Need for ECMO and incidence of severe complications (haemorraghic, neurologic, pulmonary, renal, cardiovascular, infectious, metabolic and technical) during the first 28 days of age or at discharge.
The Chinese Collaborative Study (Chinese Study Group 2005) is a multicentre study performed in China:
-
Objective: To evaluate the safety and efficacy of exogenous surfactant replacement therapy for MAS in term and late preterm neonates.
-
Population: Term and late preterm neonates with MAS (diagnosis based on the presence of meconium in the airways with or without meconium‐stained amniotic fluid at delivery, typical chest x‐ray findings, onset of respiratory distress, and abnormal blood gas findings indicating respiratory failure and acidosis), birth weight greater than 2500 gm, postnatal age less than 36 hours, a/A pO₂ ratio less than 0.22, OI greater than 15 and need for mechanical ventilation for one to two hours without improvement.
-
Intervention: The infants in the surfactant group received an initial dose of porcine lung‐derived surfactant (Curosurf) at 200 mg/kg, with repeated doses of 200, 100 and 100 mg/kg given at 6 to 12 hourly intervals to a maximum of four doses if OI increased by more than two from baseline. The control group received the standard care without a placebo.
-
Outcomes: The primary outcomes were a reduction of OI to less than 10 and an increase of the pretreatment a/A pO₂ ratio of 100% over baseline 24 hours after surfactant treatment. The secondary outcomes were duration of mechanical ventilation, incidence of complications and survival to discharge from hospital.
Maturana 2005 is a multicentre study performed in Chile:
-
Objective: To evaluate the use of up to three doses of surfactant administered as a bolus (150 mg/kg) versus placebo to reduce the number of days on mechanical ventilation in term infants with moderate to severe MAS.
-
Population: Term newborns more than 37 weeks of gestation with moderate to severe MAS (defined as the presence of meconium‐stained amniotic fluid with or without evidence of meconium in the lower airway, abnormal x‐ray consistent with MAS and respiratory insufficiency defined as an oxygen requirement of 50% or more in an oxyhood to achieve saturation of greater than 90% or PaO₂ more than 50 mmHg if the infant was not ventilated, or an OI more than eight if the infant was on mechanical ventilation.
-
Intervention: Infants were randomly assigned to receive either 150 mg /kg/dose (6ml) of Survanta or an equivalent amount of air as placebo every six hours for total of three doses if they remained intubated.
-
Outcomes: The primary outcome was days on mechanical ventilation. Secondary outcomes included days requiring oxygen therapy with a target arterial oxygen saturation of more than 90%, air leaks (pneumothorax, pneumomediastinum, interstitial emphysema), persistent pulmonary hypertension (PPHN), OI after two hours following the first treatment dose, and mortality before discharge.
-
Notes: We obtained from the first author an unpublished manuscript of the study that included an additional four randomised infants (three infants in the surfactant group and one in the control group) compared to the published abstract. In the analyses we report on 28 infants in the surfactant group and 29 in the air‐placebo group as per the additional information we received from the authors.
Excluded studies
We excluded 14 studies from the analysis. These are detailed in the table Characteristics of excluded studies, with reasons for their exclusion.
Risk of bias in included studies
Randomised controlled trials that evaluate the effect of bolus surfactant administration in term or late preterm infants with MAS are included in the analysis. We discuss specific methodologic issues below:
Randomisation: The four included studies allocated treatments by randomisation. In Maturana 2005 the randomisation scheme was computer‐generated. The Collaborative Chinese Study (Chinese Study Group 2005) and Maturana 2005 used sealed randomisation envelopes. Findlay 1996 did not report on the method of randomisation, but stated that physicians and nurses caring for the infants were unaware of the infants' assignment groups. Lotze 1998 used a central randomisation service and stratified infants by primary diagnosis and disease severity.
Blinding of treatment: In Findlay 1996 the attending staff were unaware of treatment assignment. In Lotze 1998, the dosing investigator was prohibited from participating in any other aspects of infants' care and from revealing the treatment assignment. In the Chinese Collaborative Study (Chinese Study Group 2005), staff were not blinded to treatment groups. In Maturana 2005, the assigned treatment was administered by a person not involved in the direct infant care and was given behind a screen. The number of infants enrolled in the trial differed between the published abstract (Maturana 2005) and the information obtained from the first author (three additional infants in the surfactant group and one additional infant in the control group). Differences noted between abstracts and full reports may indicate elements of bias/poor data quality control, possibly including any of the following methodological issues: multiple examination of the data; changes in the definitions of outcomes; no prespecified sample size; closure of participant recruitment when statistical significance has been reached for the outcome under study, and other sources of bias (Walia 1999).
Blinding of outcome assessment: Outcomes were assessed by staff members unaware of treatment assignment in three of the four studies (Findlay 1996; Lotze 1998; Maturana 2005).
Exclusion after randomisation: In Chinese Study Group 2005, 66 infants were enrolled and five infants (four in the surfactant group and one in the control group) were excluded from the final analysis because of violation of the entry criteria. In Lotze 1998 all 330 randomised infants were accounted for (168 of these infants were enrolled on the basis of MAS, and the remaining infants on the basis of PPHN or sepsis). Two infants were later withdrawn from the study when parental consent was withdrawn. Their limited data were subsequently excluded from analysis. The diagnosis on which their enrolment was based and whether or not they had MAS was not reported.
Effects of interventions
SURFACTANT THERAPY versus PLACEBO OR NO TREATMENT (COMPARISON 1):
PRIMARY OUTCOME:
Mortality (Outcome 1.1):
All four studies enrolling 326 infants reported on mortality. Surfactant had no statistically significant effect on mortality [typical risk ratio (RR) 0.98, 95% confidence interval (CI) 0.41 to 2.39; typical risk difference (RD) ‐0.00, 95% CI ‐0.05 to 0.05] (Analysis 1.1). Heterogeneity of treatment effect for this outcome was low (I² = 0%) for both RR and RD.
SECONDARY OUTCOMES:
Treatment with extracorporeal membrane oxygenation (ECMO) (Outcome 1.2):
Two studies enrolling 208 infants reported on treatment with ECMO. Surfactant statistically significantly reduced treatment with ECMO [typical RR 0.64, 95% CI 0.46 to 0.91; typical RD ‐0.17, 95% CI ‐0.30 to ‐0.04; Number needed to treat for an additional beneficial outcome (NNTB) 6, 95% CI 3 to 25]. (Analysis 1.2) Heterogeneity of treatment effect for this outcome was moderate for RR (I² = 50%) and low for RD (I² = 0%).
Pneumothorax (Outcome 1.3):
Three studies enrolling 269 infants reported on the occurrence of pneumothorax. Surfactant did not statistically significantly reduce the occurrence of pneumothorax (typical RR 0.82, 95% CI 0.39 to 1.73; typical RD ‐0.02, 95% CI ‐0.08 to 0.05) (Analysis 1.3). Heterogeneity of treatment effect for this outcome was moderate for RR (I² = 50%) and high for RD (I² = 75%).
Pulmonary interstitial emphysema (Outcome 1.4):
One study enrolling 61 infants reported on the occurrence of interstitial emphysema. Surfactant had no statistically significant effect on pulmonary interstitial emphysema (RR 0.55, 95% CI 0.18 to 1.70; RD ‐0.10, 95% CI ‐0.30 to 0.09) (Analysis 1.4). Tests for heterogeneity were not applicable.
Air leaks (pneumothorax, pneumomediastinum, interstitial emphysema) (Outcome 1.5):
One study enrolling 57 infants reported on a combination of air leaks. Surfactant did not have a statistically significant effect on air leaks (RR 1.04, 95% CI 0.23 to 4.71; RD 0.00, 95% CI ‐0.16 to 0.16) (Analysis 1.5). Tests for heterogeneity were not applicable.
Duration of assisted mechanical ventilation (days) (Outcome 1.6):
Three studies enrolling 158 infants reported on duration of assisted mechanical ventilation. Mechanical ventilated was stated as the outcome in all three studies, but whether or not this included continuous positive airway pressure was not indicated. Surfactant had no statistically significant effect on the duration of assisted ventilation (MD 0.60 days, 95% CI ‐0.41 to 1.62) (Analysis 1.6). Heterogeneity of treatment effect for this outcome was moderate to high (I² = 73%).
Duration of supplemental oxygen (days) (Outcome 1.7):
Two studies enrolling 97 infants reported on duration of supplemental oxygen. Surfactant did not statistically significantly reduce the duration of supplemental oxygen (MD 0.40, 95% CI ‐2.83 to 3.64) (Analysis 1.7). Heterogeneity of treatment effect for this outcome was high (I² = 88%).
Need for supplemental oxygen at discharge (Outcome 1.8):
One study enrolling 40 infants reported on the need for oxygen at discharge. Surfactant had no statistically significant effect on need for supplemental oxygen at discharge (RR 0.75, 95% CI 0.32 to 1.77; RD ‐0.10, 95% CI ‐0.39 to 0.19) (Analysis 1.8). Tests for heterogeneity were not applicable.
Chronic lung disease (age at diagnosis not stated) (Outcome 1.9):
One study enrolling 168 infants reported on chronic lung disease. Surfactant had no statistically significant effect on chronic lung disease (RR 0.47, 95% CI 0.12 to 1.80; RD ‐0.04, 95% CI ‐0.11 to 0.03) (Analysis 1.9). Tests for heterogeneity were not applicable.
Intraventricular haemorrhage (any grade) (Outcome 1.10):
Two studies enrolling 229 infants reported on the incidence of intraventricular haemorrhage (any grade). Surfactant had no statistically significant effect on intraventricular haemorrhage (any grade) (typical RR 0.67, 95% CI 0.31 to 1.46; typical RD ‐0.04, 95% CI ‐0.12 to 0.04) (Analysis 1.10). Heterogeneity of treatment effect for this outcome was low to moderate (RR, I² = 47%) and moderate (RD, I² = 51%).
Severe intraventricular haemorrhage (grades III and IV) (Outcome 1.11):
One study enrolling 168 infants reported on the incidence of severe intraventricular haemorrhage (grades III and IV). Surfactant had no statistically significant effect on severe intraventricular haemorrhage (grades III and IV) (RR 2.79, 95% CI 0.30 to 26.31; RD 0.02, 95% CI ‐0.02 to 0.07) (Analysis 1.11).Tests for heterogeneity were not applicable.
Duration of hospital stay (days) (Outcome 1.12):
One study enrolling 40 infants reported on the duration of hospital stay. Surfactant statistically significantly reduced the duration of hospital stay (MD ‐8 days, 95% CI ‐14 to ‐3) (Analysis 1.12). Tests for heterogeneity were not applicable.
Additional outcomes for the update in 2014:
Death or chronic lung disease at 28 days: outcome not reported.
Death or chronic lung disease at 36 weeks postmenstrual age: outcome not reported.
Neurodevelopmental follow‐up: outcome not reported.
Discusión
La deficiencia o disfunción, o ambas, del surfactante pulmonar puede contribuir a la insuficiencia respiratoria en un grupo amplio de trastornos como la neumonía, el síndrome de aspiración de meconio (SAM) y el síndrome de dificultad respiratoria en adultos. Se identificaron cuatro ensayos controlados aleatorizados que estudiaron el efecto del tratamiento con surfactante en lactantes a término y prematuros tardíos con SAM. Tres de los estudios fueron controlados con placebo y utilizaron aire como placebo, y en estos tres estudios los resultados se evaluaron de forma cegada con respecto al grupo de asignación (Findlay 1996; Lotze 1998; Maturana 2005). En el cuarto estudio, no se realizó el cegamiento del personal clínico a la asignación a los grupos (Chinese Study Group 2005). Los tamaños de la muestra de los estudios fueron pequeños; 40; 57; 61 y 168 lactantes reclutados (Findlay 1996; Maturana 2005; Chinese Study Group 2005; Lotze 1998) respectivamente. El número de recién nacidos reclutados en Maturana 2005 difirió entre el resumen publicado y la información obtenida del autor. En el informe obtenido de los autores se incluyeron cuatro recién nacidos más.
El tratamiento con surfactante no tuvo un efecto estadísticamente significativo en el resultado primario de la mortalidad. En el metanálisis de los resultados de dos estudios (Findlay 1996; Lotze 1998), el tratamiento con surfactante dio lugar a una reducción estadística y clínicamente importante de la necesidad de tratamiento con oxigenación por membrana extracorpórea (OMEC), con un número necesario a tratar para un resultado beneficioso adicional (NNTB) de 6 (IC del 95%: 3 a 25). El tratamiento con OMEC no estuvo disponible en las unidades del estudio de la Chinese Collaborative (Chinese Study Group 2005) ni en el estudio de Chile (Maturana 2005). El único estudio (Findlay 1996) que informó sobre la duración de la estancia hospitalaria demostró una reducción de los días de hospitalización. No hubo otras reducciones estadísticamente significativas en los otros resultados clínicos importantes (duración de la ventilación asistida, duración del oxígeno suplementario, fugas de aire, enfermedad pulmonar crónica, duración de la ventilación asistida, necesidad de oxígeno suplementario en el momento del alta y hemorragia intraventricular). Las tendencias de todos los resultados relacionados con las vías respiratorias estuvieron a favor del uso de surfactante.
Varios investigadores han intentado llevar a cabo el tratamiento del SAM con soluciones de surfactante diluido utilizadas como lavado para eliminar el meconio residual de las vías respiratorias (Dargaville 2011; Ibara 1995; Lam 1999; Ogawa 1996). En Wiswell 2002 se reclutó a 22 lactantes (15 en el grupo de surfactante [Surfaxin] y siete en el de control). Hubo tendencias no significativas que indicaron que los recién nacidos que recibieron lavado con surfactante fueron desconectados antes de la ventilación mecánica (media de 6,3 versus 9,9 días, respectivamente), y que tuvieron una disminución más rápida en el índice de oxigenación (IO) en comparación con los recién nacidos del grupo de control. Desde la última actualización de esta revisión, Dargaville 2011 ha publicado un ensayo controlado aleatorizado del lavado con dos surfactantes bovinos diluidos en el tratamiento del SAM. Sesenta y seis recién nacidos fueron asignados al azar y un recién nacido no elegible se excluyó del análisis. En este estudio, menos recién nacidos sometidos al lavado murieron o requirieron OMEC (10% comparado con 31% en el grupo de control). Sin embargo, el lavado con surfactante no modificó la duración de la asistencia respiratoria (duración media en el grupo de lavado 5,5 días y en el grupo de control 6,0 días). Se justifican las comparaciones aleatorizadas del surfactante en bolo versus tratamiento con lavado con surfactante para el SAM.
La evidencia actual indica que la amnioinfusión previa al parto o la succión de la orofaringe/nasofaringe previa al parto de los hombros no previenen la ocurrencia del SAM. En la actualidad, las dos intervenciones más prometedoras parecen ser el tratamiento con surfactante o el lavado con surfactante. Como hasta la fecha se han estudiado pocos lactantes, se justifica la realización de más estudios de investigación, posiblemente mediante un ensayo de tres brazos con 1) administración de surfactante, 2) lavado con surfactante y 3) un grupo control que reciba aire.
La experiencia clínica indica que la hipertensión pulmonar persistente del neonato (HPPN) es una de las causas principales de muerte en los recién nacidos con SAM (Hsieh 2004). Hay evidencia de que el daño por meconio puede desencadenar directamente la liberación posnatal de vasoconstrictores como ET‐1; TXA2 y prostaglandina E2 (PGE2), que desempeñan una función en el desarrollo de hipertensión pulmonar (Soukka 1998).
Los lactantes con SAM y HPPN suelen ser tratados con oxígeno, ventilación mecánica convencional o de alta frecuencia o ambas, apoyo inotrópico, inducción de alcalosis y sedación. Cuando estas medidas fallan, se ha demostrado que la OMEC mejora el resultado (UK Collab 1996). El óxido nítrico inhalado (ONi) se utiliza con frecuencia para el tratamiento de los recién nacidos con hipertensión pulmonar grave e insuficiencia respiratoria. En consecuencia, cada vez hay más evidencia clínica y experimental que indica que el ON exógeno, administrado mediante inhalación, reduce selectivamente la vasoconstricción pulmonar y mejora la oxigenación en diversas afecciones patológicas de los pulmones de los recién nacidos, incluida la aspiración de meconio (Neonatal iNO 1997; Van Meurs 2003). De acuerdo con datos experimentales recientes, Aaltonen 2007 demostró que el ONi en el SAM está asociado con una disminución de la respuesta hipertensiva pulmonar, así como con una disminución en la oxidación del ADN y el daño neuronal en el tejido del hipocampo, lo que puede tener efectos adversos significativos a largo plazo en el estado de desarrollo de los recién nacidos afectados.
Los procedimientos de OMEC son complejos debido a que requieren una anticoagulación sistémica y la canulación de los vasos principales. Los estudios del tratamiento con ONi para la HPPN han demostrado una mejoría rápida en la oxigenación, reduciendo la necesidad de tratamiento con OMEC sin afectar la mortalidad (Christou 2000; Clark 2000). Finer 2000 mostró que el tratamiento con ONi mejora la oxigenación en aproximadamente el 50% de los neonatos a término o prematuros tardíos con insuficiencia respiratoria hipoxémica, y reduce la variable de evaluación combinada de la muerte o la necesidad de tratamiento con OMEC (riesgo relativo 0,73) en comparación con los sujetos de control. Sin embargo, la falta de una respuesta temprana al tratamiento con ONi en unas pocas horas en los recién nacidos que son derivados para recibir tratamiento con OMEC y a una edad más temprana en el momento de la presentación puede indicar la necesidad del tratamiento con OMEC en al menos el 50% de los que presentan insuficiencia respiratoria hipóxica (Fakioglu 2005).

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 1 Mortality.

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 2 Treatment with ECMO.

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 3 Pneumothorax.

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 4 Pulmonary interstitial emphysema.

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 5 Air leaks (pneumothorax, pneumomediastinum, interstitial emphysema).
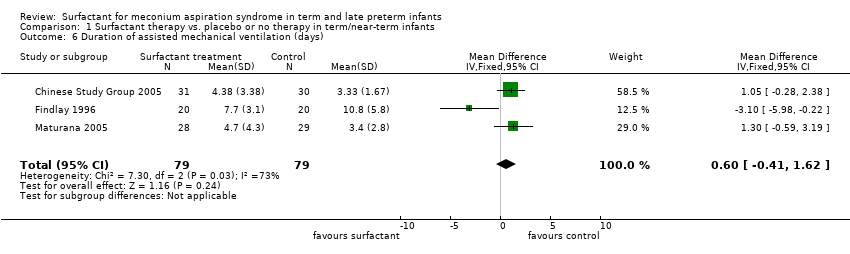
Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 6 Duration of assisted mechanical ventilation (days).

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 7 Duration of supplemental oxygen (days).

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 8 Need for supplemental oxygen at discharge.
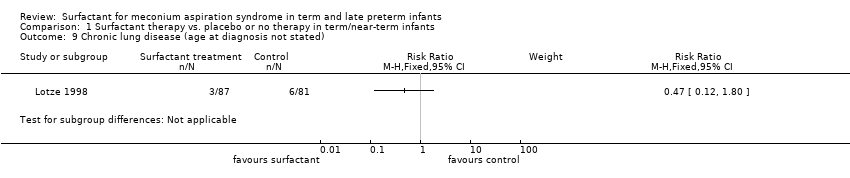
Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 9 Chronic lung disease (age at diagnosis not stated).

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 10 Intraventricular haemorrhage (any grade).

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 11 Severe intraventricular haemorrhage.

Comparison 1 Surfactant therapy vs. placebo or no therapy in term/near‐term infants, Outcome 12 Duration of hospital stay (days).
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Mortality Show forest plot | 4 | 326 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.98 [0.41, 2.39] |
| 2 Treatment with ECMO Show forest plot | 2 | 208 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.64 [0.46, 0.91] |
| 3 Pneumothorax Show forest plot | 3 | 269 | Risk Difference (M‐H, Fixed, 95% CI) | ‐0.02 [‐0.08, 0.05] |
| 4 Pulmonary interstitial emphysema Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 5 Air leaks (pneumothorax, pneumomediastinum, interstitial emphysema) Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 6 Duration of assisted mechanical ventilation (days) Show forest plot | 3 | 158 | Mean Difference (IV, Fixed, 95% CI) | 0.60 [‐0.41, 1.62] |
| 7 Duration of supplemental oxygen (days) Show forest plot | 2 | 97 | Mean Difference (IV, Fixed, 95% CI) | 0.40 [‐2.83, 3.64] |
| 8 Need for supplemental oxygen at discharge Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 9 Chronic lung disease (age at diagnosis not stated) Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 10 Intraventricular haemorrhage (any grade) Show forest plot | 2 | 229 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.67 [0.31, 1.46] |
| 11 Severe intraventricular haemorrhage Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 12 Duration of hospital stay (days) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |

