Bisfosfonatos para la osteoporosis inducida por corticosteroides
Resumen
Antecedentes
Ésta es una actualización de una revisión Cochrane publicada por primera vez en 1999. Los corticosteroides se utilizan con frecuencia en las afecciones inflamatorias como agentes inmunosupresores. La pérdida ósea es un efecto secundario grave de este tratamiento. La administración de bisfosfonatos en la prevención y el tratamiento de la osteoporosis inducida por glucocorticosteroides (OPIG) se ha examinado en varios estudios y se han informado diferentes magnitudes del efecto.
Objetivos
Evaluar los efectos beneficiosos y perjudiciales de los bisfosfonatos para la prevención y el tratamiento de la OPIG en adultos.
Métodos de búsqueda
Se hicieron búsquedas en CENTRAL, MEDLINE y Embase hasta abril 2016 y en International Pharmaceutical Abstracts (IPA) vía OVID hasta enero 2012 para obtener artículos relevantes y actas de congresos, sin restricciones de idioma. Se hicieron búsquedas en dos registros de ensayos clínicos para encontrar estudios en curso y recientemente finalizados (ClinicalTrials.gov y el portal de búsqueda de la World Health Organization (WHO) International Clinical Trials Registry Platform (ICTRP)). También se revisaron las listas de referencias de los artículos de revisión relevantes.
Criterios de selección
Se incluyeron ensayos controlados aleatorios (ECA) que cumplían los siguientes criterios: 1) prevención o tratamiento de la OPIG; 2) adultos que tomaron una dosis media de corticosteroide de 5,0 mg/día o más; 3) tratamiento activo que incluyó bisfosfonatos de cualquier tipo solo o en combinación con calcio o vitamina D; 4) tratamiento comparador que incluyó un control con calcio o vitamina D, o ambos, solo o con placebo; y 4) informó resultados relevantes. Se excluyeron los ensayos que incluyeron pacientes en los que el uso de los corticosteroides se asoció con la realización de un trasplante.
Obtención y análisis de los datos
Al menos dos autores de la revisión, de forma independiente, seleccionaron los ensayos para su inclusión, extrajeron los datos, evaluaron el "riesgo de sesgo" y valoraron la certeza de la evidencia utilizando el enfoque GRADE. Los resultados principales de interés fueron la incidencia de fracturas vertebrales y no vertebrales después de 12 a 24 meses; el cambio en la densidad mineral ósea (DMO) de la columna lumbar y el cuello femoral después de 12 meses; eventos adversos graves; retiros debidos a eventos adversos; y calidad de vida. Se utilizaron los procedimientos metodológicos Cochrane estándar.
Resultados principales
En esta revisión, se incluyó un total de 27 ECA con 3075 participantes. El análisis agrupado de la incidencia de fracturas vertebrales incluyó 12 ensayos (1343 participantes), con pruebas muy confiables y bajo riesgo de sesgo. En este análisis, 46/597 pacientes (o 77 por 1000) presentaron nuevas fracturas vertebrales en el grupo control en comparación con 31/746 (o 44 por 1000; rango: 27 a 70) en el grupo de bisfosfonato; mejoría relativa del 43% (9% al 65% mejor) con los bisfosfonatos; aumento del beneficio absoluto, el 2% de pacientes menos presentó fracturas con los bisfosfonatos (5% menos al 1% más); el número necesario a tratar para un resultado beneficioso adicional (NNTB) fue 31 (20 a 145), lo que significa que aproximadamente 31 pacientes necesitarían ser tratados con bisfosfonatos para prevenir nuevas fracturas vertebrales en un paciente.
El análisis agrupado de la incidencia de fracturas no vertebrales incluyó nueve ensayos con 1245 participantes con pruebas poco confiables (disminuidas por la imprecisión y el riesgo de sesgo importante como un resultado informado por el paciente). En este análisis, 30/546 pacientes (o 55 por 1000) presentaron nuevas fracturas no vertebrales en el grupo control en comparación con 29/699 (o 42 por 1000; rango: 25 a 69) en el grupo de bisfosfonato; mejoría relativa del 21% con los bisfosfonatos (33% peor a 53% mejor); aumento del beneficio absoluto, el 1% de pacientes menos presentó fracturas con los bisfosfonatos (4% menos al 1% más).
El análisis agrupado en el cambio de la DMO de la columna lumbar después de 12 meses incluyó 23 ensayos con 2042 pacientes. En el análisis agrupado de la DMO del cuello femoral después de 12 meses, se incluyeron 18 ensayos con 1665 participantes. Las pruebas de ambos resultados fueron de confiabilidad moderada (disminuidas por la indireccionalidad debido a un marcador alternativo para la osteoporosis), con bajo riesgo de sesgo. En general, los grupos de bisfosfonatos informaron una estabilización o un aumento de la DMO, mientras que los grupos control mostraron una reducción en la DMO durante el período de estudio. En la columna lumbar, hubo un aumento absoluto de la DMO del 3,5% con los bisfosfonatos (2,90% al 4,10% mayor), con una mejoría relativa del 1,10% con los bisfosfonatos (0,91% al 1,29%); NNTB = 3 (2 a 3). En el cuello femoral, la diferencia absoluta de la DMO fue un 2,06% mayor en el grupo de bisfosfonato en comparación con el grupo control (1,45% al 2,68% mayor), con una mejoría relativa del 1,29% (0,91% al 1,69%); NNTB = 5 (4 a 7).
El análisis agrupado de los eventos adversos graves incluyó 15 ensayos (1703 participantes), con pruebas poco confiables (disminuidas por la imprecisión y el riesgo de sesgo). En este análisis, 131/811 pacientes (o 162 por 1000) presentaron eventos adversos graves en el grupo control en comparación con 136/892 (o 147 por 1000; rango: 120 a 181) en el grupo de bisfosfonato; aumento del daño absoluto, 0% de eventos adversos más graves (2% menos al 2% más); un cambio porcentual relativo con mejoría del 9% (12% peor al 26% mejor).
El análisis agrupado de los retiros debido a eventos adversos incluyó 15 ensayos (1790 pacientes), con pruebas poco confiables (disminuidas por la imprecisión y el riesgo de sesgo). En este análisis, 63/866 pacientes (o 73 por 1000) se retiraron del grupo control en comparación con 76/924 (o 77 por 1000; rango: 56 a 107) del grupo de bisfosfonato; aumento del daño absoluto, 1% de más retiros con los bisfosfonatos (IC del 95%: 1% menos al 3% más); un cambio porcentual relativo con empeoramiento del 6% (IC del 95%: 47% peor al 23% mejor).
La calidad de vida no se evaluó en ninguno de los ensayos.
Conclusiones de los autores
Hubo pruebas muy confiables de que los bisfosfonatos son beneficiosos para reducir el riesgo de fracturas vertebrales, con datos de hasta 24 meses de uso. Hubo pruebas poco confiables de que los bisfosfonatos pueden lograr poco o ningún cambio en la prevención de las fracturas no vertebrales. Hubo pruebas de confiabilidad moderada de que los bisfosfonatos son beneficiosos para prevenir y tratar la pérdida ósea inducida por corticosteroides en la columna lumbar y el cuello femoral. Con respecto a los efectos perjudiciales, hubo pruebas poco confiables de que los bisfosfonatos pueden lograr poco o ningún cambio en la ocurrencia de eventos adversos graves o en los retiros debido a eventos adversos. Debido a la posibilidad de sesgo, se debe tener precaución al interpretar estos datos como marcadores para los efectos perjudiciales y la tolerabilidad.
En general, la presente revisión apoya la administración de bisfosfonatos para reducir el riesgo de fracturas vertebrales y para la prevención y el tratamiento de la pérdida ósea inducida por corticosteroides.
PICO
Resumen en términos sencillos
Bisfosfonatos para el tratamiento de la osteoporosis provocada por la administración de corticosteroides
Antecedentes
Los corticosteroides (glucocorticosteroides) se utilizan con frecuencia para tratar la inflamación. La pérdida ósea (osteoporosis) y las fracturas de columna son efectos secundarios graves de este tratamiento. Los bisfosfonatos se consideran un tratamiento de primera línea para la osteoporosis y se han utilizado desde los años noventa.
Métodos
Se examinaron los estudios de investigación publicados hasta abril de 2016 y se encontraron 27 ensayos elegibles que incluyeron a 3075 adultos con enfermedades inflamatorias que requirieron tratamiento con corticosteroides durante al menos un año. Los pacientes se asignaron al azar a recibir tratamiento con bisfosfonato (solo o con calcio o vitamina D, o ambos) o "ningún tratamiento" (se administró calcio o vitamina D o un placebo). El objetivo de esta revisión fue determinar los efectos beneficiosos y perjudiciales de los bisfosfonatos en los adultos con tratamiento con corticosteroides a largo plazo.
Resultados principales
Nuevas fracturas de columna (12 a 24 meses)
Hubo 12 ensayos con 1343 pacientes para este análisis. Se encontró que 77 por 1000 pacientes sin tratamiento presentaron nueva fractura de columna en comparación con 44 por 1000 pacientes (rango: 27 a 70) que recibieron bisfosfonatos; un beneficio absoluto del 2% de pacientes menos (5% menos al 1% más) presentaron fracturas de columna cuando recibieron bisfosfonatos.
Aproximadamente 31 pacientes (rango: 20 a 145) necesitarían ser tratados con bisfosfonatos para prevenir las fracturas de columna en un paciente.
Nuevas fracturas diferentes de las fracturas de columna (12 a 24 meses)
Hubo nueve ensayos con 1245 pacientes para este análisis. Se encontró que 55 por 1000 pacientes sin tratamiento presentaron nuevas fracturas vertebrales en comparación con 42 por 1000 pacientes (rango: 25 a 69) que recibieron bisfosfonatos; un beneficio absoluto del 1% de pacientes menos (4% menos al 1% más) presentaron fracturas diferentes de las fracturas de columna cuando recibieron bisfosfonatos.
Densidad mineral ósea (DMO) de la columna lumbar a los 12 meses
Hubo 23 ensayos con 2042 pacientes para este resultado. Se encontró que la DMO de la columna lumbar de los pacientes que recibieron bisfosfonatos fue 3,50% mayor (2,90% al 4,10% mayor) que la de los pacientes que no recibieron tratamiento.
Aproximadamente tres pacientes (rango: 2 a 3) necesitarían ser tratados con bisfosfonatos durante 12 meses para observar una diferencia mínimamente importante en un paciente en la DMO de la columna lumbar.
DMO del cuello femoral (parte superior del hueso del muslo) a los 12 meses
Hubo 18 ensayos con 1665 pacientes para este resultado. Se encontró que la DMO del cuello femoral fue 2,06% mayor en el grupo de bisfosfonato (1,45% al 2,68% más) que en los pacientes que no recibieron tratamiento.
Aproximadamente cinco pacientes (rango: 4 a 7) necesitarían ser tratados con bisfosfonatos durante 12 meses para observar una diferencia mínimamente importante en un paciente en la DMO del cuello femoral.
Eventos adversos graves (que necesitaron hospitalizaciones, fueron potencialmente mortales o mortales)
Hubo 15 ensayos con 1703 pacientes para este resultado. Se encontró que 162 por 1000 pacientes que no recibieron tratamiento presentaron eventos adversos graves, en comparación con 147 por 1000 (rango: 120 a 181) que recibieron bisfosfonatos; aumento del daño absoluto, 0% de eventos adversos más graves (2% menos al 2% más) con los bisfosfonatos.
Retiros debidos a eventos adversos
Hubo 15 ensayos con 1790 pacientes para este resultado. Se encontró que 73 por 1000 pacientes que no recibieron tratamiento se retiraron, en comparación con 77 por 1000 pacientes (rango: 56 a 107) que recibieron bisfosfonatos; aumento del daño absoluto, 1% más retiros debido a eventos adversos (1% menos al 3% más) con los bisfosfonatos.
Conclusiones de los autores
Según pruebas de confiabilidad moderada a muy confiables, se encontró que los bisfosfonatos son beneficiosos para prevenir nuevas fracturas de columna y prevenir y tratar la pérdida ósea inducida por corticosteroides a la columna lumbar y al cuello femoral. Para prevenir las fracturas diferentes de las fracturas de columna, se encontró que hubo poca o ninguna diferencia si los pacientes utilizaron los bisfosfonatos o no, aunque estas pruebas tuvieron poca confiabilidad porque los métodos utilizados para evaluar las fracturas diferentes de las fracturas de columna estuvieron sujetos a sesgo.
Cuando los bisfosfonatos se compararon con ningún tratamiento, se encontró que hubo poca o ninguna diferencia en el número de eventos adversos graves o los retiros debido a eventos adversos. Las pruebas de estos resultados fueron poco confiables y hay que tener precaución al establecer conclusiones firmes acerca de los efectos perjudiciales de los bisfosfonatos solamente en base a estas medidas.
En general, la presente revisión apoya la administración de los bisfosfonatos para reducir el riesgo de fracturas de columna y para la prevención y el tratamiento de la pérdida ósea inducida por corticosteroides.
Conclusiones de los autores
Summary of findings
| Bisphosphonates (alone or with calcium and/or vitamin D) compared with control (calcium and/or vitamin D and/or placebo) for adults with GIOP | ||||||
| Patient or population: adults with GIOP Settings: ambulatory Intervention: bisphosphonates (alone or with calcium and/or vitamin D) Comparison: control (calcium and/or vitamin D and/or placebo) | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control (calcium and/or vitamin D and/or placebo) | Bisphosphonates (alone or with calcium and/or vitamin D) | |||||
| Incident vertebral fractures Radiographic follow‐up: 12‐24 months | 77 per 1000 | 44 per 1000 | RR 0.57 (0.35 to 0.91) RD ‐0.02 (‐0.05 to 0.01) | 1343 | ⊕⊕⊕⊕ | Absolute increased benefit 2% fewer people with fractures using bisphosphonates (95% CI 5.00% fewer to 1.00% more) Relative per cent change 43% improvement with bisphosphonates (95% CI 9.00% to 65.00% better) NNTB = 31 (95% CI 20 to 145) |
| Incident nonvertebral fractures Radiographic follow‐up: 12‐24 months | 55 per 1000 | 42 per 1000 | RR 0.79 (0.47 to 1.33) RD ‐0.01 (‐0.04 to 0.01) | 1245 | ⊕⊕⊝⊝ due to risk of bias and imprecision | Absolute increased benefit 1% fewer people with fractures using bisphosphonates (95% CI 4.00% fewer to 1.00% more) Relative per cent change 21% improvement with bisphosphonates (95% CI 33.00% worse to 53.00% better) NNTB = n/a4 |
| Lumbar spine BMD DEXA follow‐up: 12 months | Mean per cent change in BMD across control groups was ‐3.19% (‐8.08% to 1.70%) from baseline5 | Mean per cent change in BMD from baseline in bisphosphonate groups was 3.50% higher than control groups (2.90% to 4.10% higher) | ‐ | 2042 | ⊕⊕⊕⊝ due to indirectness | Absolute increased benefit 3.50% with bisphosphonates (95% CI 2.90 to 4.10) Relative per cent change 1.10% (95% CI 0.91 to 1.29) with bisphosphonates NNTB = 3 (95% CI 2 to 3) |
| Femoral neck BMD DEXA follow‐up: 12 months | Mean per cent change in BMD across control groups was ‐1.59% (‐10.49% to 7.31%) from baseline 5 | Mean per cent change in BMD from baseline in bisphosphonate groups was 2.06% higher than control groups (1.45% to 2.68% higher) | ‐ | 1665 | ⊕⊕⊕⊝ due to indirectness | Absolute increased benefit 2.06% with bisphosphonates (95% CI 1.45 to 2.68) Relative per cent change 1.29% with bisphosphonates (95% CI 0.91 to 1.69) NNTB = 5 (95% CI 4 to 7) |
| Serious adverse events follow‐up: 12‐24 months | 162 per 1000 | 147 per 1000 | RR 0.91 (0.74 to 1.12) RD 0.00 (‐0.02, 0.02) | 1703 | ⊕⊕⊕⊝ due to risk of bias and imprecision | Absolute increased harm 0% more adverse events with bisphosphonates (95% CI 2.00% fewer to 2.00% more) Relative per cent change 9% improvement with bisphosphonates (95% CI 12.00% worse to 26.00% better) NNTH = n/a4 |
| Withdrawals due to adverse events follow‐up: 12‐24 months | 73 per 1000 | 77 per 1000 | RR 1.06 (0.77 to 1.47) RD 0.01 (‐0.01 to 0.03) | 1790 | ⊕⊕⊕⊝ due to risk of bias and imprecision | Absolute increased harm 1% more withdrawals with bisphosphonates (95% CI 1.00% fewer to 3.00% more) Relative per cent change 6% worsening with bisphosphonates (95% CI 47.00% worse to 23.00% better) NNTH = n/a4 |
| Quality of life | 0 per 1000 | 0 per 1000 | Not estimable | (0 studies) | This outcome was not assessed by any of the trials | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Vertebral fractures meet calculated OIS threshold of 1174 (calculation not shown ‐ Brant 2014) 2Downgraded for risk of bias: nonvertebral fractures were a patient‐reported, subjective outcome 3Downgraded for imprecision: total sample size is below calculated optimal information size (OIS) (calculations not shown ‐ Brant 2014) and the 95% confidence interval around the pooled estimate of effect includes both the possibility of no effect and appreciable benefit or harm 4Number needed to treat for an additional beneficial outcome (NNTB) or number needed to treat for an additional harmful outcome (NNTH) is not applicable when result is not statistically significant 5We calculated mean baseline risk for the control group in RevMan using generic inverse variance (calculations not shown) 6Most heterogeneity explained through sensitivity analyses 7Downgraded for indirectness: bone density is a surrogate marker for fracture risk 8Clinically relevant change in BMD: the natural history of participants starting steroid therapy based on control arms in our prevention trials is to see a 1%‐6% decrease in lumbar spine BMD and 1%‐4% decrease in femoral neck BMD in the first year of treatment. We have used an SMD of 0.5 as an estimate of the minimal clinically important difference for BMD change to calculate the NNTB (Schünemann 2011b) 9Downgraded for risk of bias: the protocols for the collection of harm data in a large number of trials were unclear | ||||||
Antecedentes
Descripción de la afección
Los corticosteroides se utilizan con frecuencia en las afecciones inflamatorias como agentes inmunosupresores. Las enfermedades tratadas con corticosteroides incluyen las enfermedades del tejido conectivo, las enfermedades respiratorias, las enfermedades hematológicas, la enfermedad intestinal inflamatoria y el trasplante de órganos. La pérdida ósea es un efecto secundario grave de este tratamiento a la que se le denomina habitualmente osteoporosis inducida por glucocorticoides (OPIG), y probablemente está mediada por diversos mecanismos.
Los mecanismos más aceptados en la patogenia de la OPIG son la inhibición directa de la formación ósea y el aumento de la resorción ósea. La inhibición de la formación ósea está mediada por la disminución en la diferenciación de los osteoblastos, el deterioro en la maduración y la función y la muerte apoptótica prematura de los osteoblastos, como se demuestra por la disminución de los niveles séricos de osteocalcina (Canalis 2007; Saag 2003). Los glucocorticoides mejoran la resorción ósea mediada por los osteoclastos al suprimir la osteoprotegerina, estimular el sistema RANK/RANKL y reducir la apoptosis, todo lo cual da lugar a un aumento en los niveles de osteoclastos. También hay pruebas de una disminución en la absorción de calcio, un aumento en la excreción de calcio y una disminución en la concentración sérica de las hormonas sexuales (Canalis 2007; Saag 2003). Además del efecto sobre la densidad ósea, se conoce que los corticosteroides afectan la arquitectura y la calidad óseas (Kanis 2007; Saag 2003; Van Staa 2002). Es probable que estos dos factores contribuyan a un menor umbral de DMO para la fractura en los pacientes con OPIG.
Existe controversia en la bibliografía con respecto a la dosis mínima y la duración de los corticosteroides requeridas para producir pérdida ósea y fracturas; hay informes de dosis de tan solo 2,5 a 7,5 mg/día que provocan una pérdida ósea estadísticamente significativa y un aumento de 2,5 veces de las fracturas vertebrales (Canalis 2007; Steinbuch 2004; Van Staa 2002). El riesgo de fracturas puede estar afectado por factores de confusión como los propios procesos de las enfermedades inflamatorias subyacentes, que pueden dar lugar de manera independiente a pérdida ósea y fracturas (Saag 2003).
Descripción de la intervención
Los bisfosfonatos se han utilizado para tratar la osteoporosis desde los años noventa y se consideran el tratamiento de primera línea cuando se recomienda el tratamiento farmacológico. Existen diversos tipos de bisfosfonatos, con mayor frecuencia en forma de tabletas orales, aunque también están disponibles los bisfosfonatos intravenosos, que en América del Norte se reservan tradicionalmente para los pacientes que no pueden tolerar los bisfosfonatos orales. Los regímenes orales incluyen la administración diaria o semanal, mientras que los bisfosfonatos intravenosos se administran cada pocos meses o anualmente (National Osteoporosis Foundation 2014).
De qué manera podría funcionar la intervención
Los bisfosfonatos reducen la pérdida ósea a través de diversos mecanismos de acción que no se comprenden completamente. En general, se ha mostrado que los bisfosfonatos reducen la tasa de recambio óseo mediante una afinidad fuerte por el mineral óseo, lo que se traduce en una disminución en la pérdida ósea. También tienen un efecto inhibitorio que disminuye el número y la actividad de los osteoclastos, que disuelven el hueso como parte del proceso normal de recambio óseo (Russell 2007). La eficacia de los bisfosfonatos, medida como cambio porcentual en la DMO al año, varía del ‐3% al +12% en los estudios de bisfosfonato.
Por qué es importante realizar esta revisión
Una consecuencia de la masa ósea reducida es la aparición de fracturas vertebrales y no vertebrales. La OPIG se manifiesta a menudo como una afección clínicamente silenciosa hasta que ocurre una fractura. La DMO se utiliza habitualmente como un resultado intermedio para extrapolar el riesgo de fracturas; sin embargo, se debe señalar que la correlación entre la DMO y el riesgo de fracturas que existe en la osteoporosis posmenopáusica no se ha establecido en la osteoporosis inducida por corticosteroides. Por lo tanto, es importante contar con pruebas directas del efecto beneficioso de los bisfosfonatos sobre la reducción del riesgo de fracturas en la OPIG.
El uso sistemático de tratamiento profiláctico para prevenir la pérdida ósea y las fracturas es subóptimo, a pesar de las recomendaciones de las guías prácticas del American College of Rheumatology (ACR) (Grossman 2010). Los patrones recientes de prescripción en América del Norte para la prevención de la OPIG demuestran una prevalencia de coprescripción antirreabsorción de sólo el 15% al 37% en pacientes que reciben tratamiento con corticosteroides a largo plazo (Curtis 2005; Feldstein 2005; Mckeown 2012).
Una revisión sistemática Cochrane y metanálisis es útil para determinar los efectos beneficiosos y perjudiciales de los bisfosfonatos para la prevención y el tratamiento de la OPIG y las fracturas, así como para justificar y promover su uso sistemático.
Objetivos
Evaluar los efectos beneficiosos y perjudiciales de los bisfosfonatos para la prevención y el tratamiento de la OPIG en adultos.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Ensayos controlados aleatorios (ECA).
Tipos de participantes
Los participantes fueron hombres o mujeres con más de 18 años de edad con trastornos inflamatorios subyacentes, que iniciaban el tratamiento o que ya recibían tratamiento con corticosteroides sistémicos, y que no habían recibido bisfosfonatos en los seis meses previos al comienzo del estudio. Los estudios de prevención se definieron como los que comenzaron el tratamiento en el transcurso de tres meses de iniciados los corticosteroides, mientras que los estudios de tratamiento (prevención secundaria) incluyeron los que iniciaron el tratamiento con bisfosfonatos después de tres meses de iniciado el tratamiento con corticosteroides. Estas definiciones se utilizan ampliamente en la bibliografía de la OPIG y se basan en la noción de que la pérdida ósea rápida se observa en los primeros tres a seis meses de la administración de corticosteroides (Canalis 2007; Van Staa 2002).
Debido a la controversia en la bibliografía con respecto a los corticosteroides a dosis bajas y el riesgo de osteoporosis y fractura, sólo se utilizaron los ensayos en los que la dosis media de corticosteroide fue 5 mg/día o mayor. Los participantes tenían que continuar el tratamiento con corticosteroides durante todo el estudio. Se excluyeron de la revisión los ensayos que incluyeron pacientes en los que el uso de los corticosteroides se asoció con la realización de un trasplante.
Tipos de intervenciones
Se incluyeron los ensayos que evaluaron cualquier bisfosfonato solo o en combinación con calcio o vitamina D, o ambos, como grupo de tratamiento activo. Los grupos control recibieron calcio o vitamina D, o ambos, solos o con placebo.
Tipos de medida de resultado
-
Número de participantes con incidencia de fracturas vertebrales radiográficas.
-
Número de participantes con incidencia de fracturas no vertebrales radiográficas.
-
Cambio porcentual en la DMO de la columna lumbar y el cuello femoral medida por absorciometría de rayos X de energía dual (DEXA).
-
Calidad de vida medida con cualquier herramienta de medición.
-
Cambio porcentual en la DMO de la columna lumbar con el uso de bisfosfonatos a dosis bajas versus dosis estándar.
-
Cambio porcentual en la DMO del cuello femoral con el uso de bisfosfonatos a dosis bajas versus dosis estándar.
-
Eventos adversos graves (que necesitaron hospitalización, fueron potencialmente mortales o mortales).
-
Retiros debido a eventos adversos.
-
Se extrajeron los datos de la incidencia de fractura, los eventos adversos graves y los retiros debido a eventos adversos en cualquier punto temporal cuando estuvieron disponibles.
-
Se extrajeron los datos de los resultados de la DMO a los 12 meses y a los 18 a 24 meses y se utilizaron en análisis separados.
-
Se extrajeron los datos sobre los bisfosfonatos a dosis bajas versus a dosis estándar a los 12 meses.
-
De existir datos en múltiples puntos temporales en los períodos mencionados anteriormente, sólo se extrajeron los datos del último punto temporal posible de cada período.
Beneficios
Resultados principales
Resultados menores
Efectos perjudiciales
Resultados principales
Momento de la evaluación del resultado
Results
Description of studies
Results of the search
Details of the study selection are presented in Figure 1. Our initial search of the databases, clinical trials registries and handsearching provided 3934 records after the results were merged and duplicate records removed. A primary screen of the abstracts or protocols resulted in the exclusion of 3347 records. We retrieved the full‐texts of the remaining 587 records and assessed them for eligibility. Based on the full‐text review; 534 were excluded, eight were identified as 'awaiting classification' and six were ongoing trials. The remaining 39 trials underwent data extraction. Another 12 were found to be ineligible and were thus excluded, leaving 27 trials to be included in the review (25 studies from the updated search and two studies from the existing Cochrane Review). Altogether, a total of 27 trials were included in the review, which reported on 3075 participants.
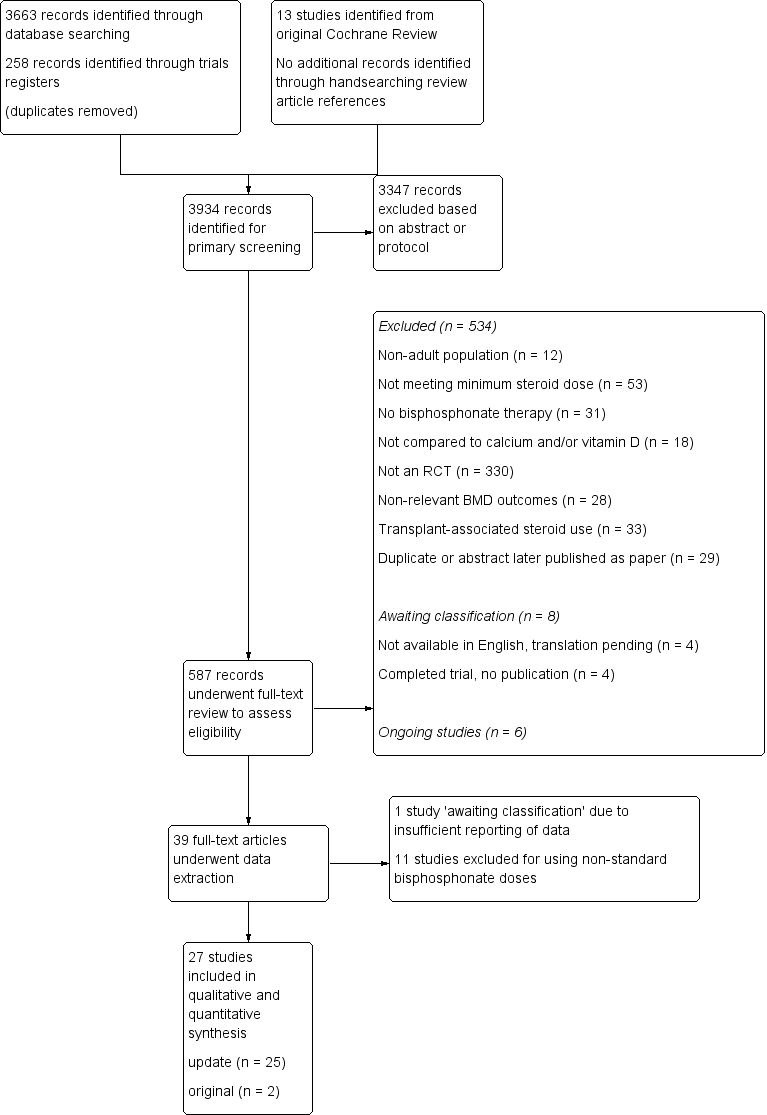
Study flow diagram.
Included studies
Key characteristics of the included trials are contained in the Characteristics of included studies tables.
Interventions
Most trials used alendronate (n = 9) or cyclic etidronate (n = 8). Other bisphosphonates used include risedronate (n = 2), pamidronate (n = 3), clodronate (n = 3), and ibandronate (n = 2).
Underlying diseases
Underlying conditions that required steroid treatment included rheumatological, respiratory, nephrological, gastrointestinal, haematological, dermatological and neurological systemic inflammatory diseases. Most trials (n = 19) included participants with a variety of diseases. Two trials included only participants with rheumatoid arthritis (Lems 2006; Van Offel 2001); two trials included only participants with systemic lupus erythematosus (Li 2010; Yeap 2008); Wolfhagen 1997 reported only on participants with primary biliary cirrhosis; Herrala 1998 included only participants with chronic obstructive pulmonary disease (COPD) and asthma; Abitbol 2007 included only participants with inflammatory bowel disease; and Tee 2012 included only participants with immunobullous skin diseases.
Mean steroid dose
Although a minimum mean steroid dose of 5 mg/day was reported in the protocols of our included trials, we found that there was much variability between trials in the actual mean steroid doses used throughout the study period. This was not surprising given the variation in underlying inflammatory diseases and considering that steroid regimes are tapered to fit individual clinical context.
Three trials reported a mean steroid dose of 5 to 7.5 mg/day (Abitbol 2007; Geusens 1998; Hakala 2012). Ten trials reported a mean steroid dose of approximately 7.5 mg/day (Cortet 1999; Frediani 2003; Herrala 1998; Jenkins 1999; Lems 2006; Pitt 1998; Saag 1998; Sambrook 2003; Skingle 1997; Van Offel 2001). Eleven trials reported a mean steroid dose of 10 to 15 mg/day (Adachi 1997; Adachi 2001; Boutsen 1997; Boutsen 2001; De Nijs 2006; Reid 2000; Roux 1998; Stoch 2009; Tee 2012; Wolfhagen 1997; Yeap 2008). Two trials reported a mean steroid dose of greater than 20 mg/day (Cohen 1999; Saadati 2008). Li 2010 was unclear in describing the mean steroid dose used throughout the study period and reported a range of steroid doses that varied between under 7.5 mg/day and 40 mg/day.
Prevalent vertebral fractures
Twelve trials had participants with vertebral fractures at baseline (Abitbol 2007; Adachi 1997; Adachi 2001; Cohen 1999; De Nijs 2006; Frediani 2003; Geusens 1998; Lems 2006; Reid 2000; Saag 1998; Sambrook 2003; Skingle 1997). Hakala 2012 included prevalent vertebral fractures but excluded participants with symptomatic or two or more radiographic vertebral fractures. Three trials reported no prevalent vertebral fractures in their participants (Li 2010; Pitt 1998; Yeap 2008), whereas Boutsen 2001; Tee 2012 and Wolfhagen 1997 excluded participants with prevalent vertebral fractures. The remaining eight trials did not explicitly state whether or not there were prevalent vertebral fractures (Boutsen 1997; Cortet 1999; Herrala 1998; Jenkins 1999; Roux 1998; Saadati 2008; Stoch 2009; Van Offel 2001).
Multiple treatment groups
Six of the included trials reported on multiple treatment groups. The standard‐dose arms and control groups were included in the major analyses (Boutsen 2001; Cohen 1999; Herrala 1998; Lems 2006; Reid 2000; Saag 1998). If a low‐dose arm was reported, we included the studies in a minor outcome analysis of standard‐dose versus low‐dose bisphosphonates (Boutsen 2001; Cohen 1999; Lems 2006; Reid 2000; Saag 1998). One of the multi‐group trials using clodronate reported on groups with dosages of 1600 mg and 2400 mg daily, which were both higher than the current standard and therefore not eligible for the standard‐dose versus low‐dose meta‐analysis (Herrala 1998).
Another trial used two distinct pair‐wise comparisons with two independent treatment groups and two independent placebo groups (Sambrook 2003). In this study, one pair‐wise comparison involved steroid use of less than six months and the other comparison involved steroid use for longer than six months. Data were entered as two separate trials, as there was no overlap in participants.
Prevention versus treatment of GIOP
Thirteen trials involved the prevention of GIOP and 14 trials involved the treatment of GIOP. For trials that had mixed prevention and treatment individuals, we categorised the trial based on whether the majority of participants were considered 'prevention' or 'treatment' as per our criteria described in Types of participants. Saadati 2008 was unclear in describing the type of study so we categorised it as a treatment trial.
Outcomes
Incident radiographic vertebral fractures
Twenty‐one trials reported this outcome, 12 trials were included and nine trials excluded from meta‐analysis.
Two trials combined fracture data from their 5 mg and 10 mg alendronate treatment arms (Lems 2006; Saag 1998) and although 5 mg daily alendronate was not considered a standard dose, we included these data in the analysis. Of the 12 included studies, seven were prevention trials (Abitbol 2007; Adachi 1997; Boutsen 1997; Boutsen 2001; Cohen 1999; De Nijs 2006; Tee 2012) and five were treatment trials (Lems 2006; Pitt 1998; Reid 2000; Saag 1998; Sambrook 2003).
Since fractures occur at a variable length of time after the onset of osteoporosis, we included trials in which the follow‐up for new fractures occurred between 12 to 24 months, to better ascertain the benefits of bisphosphonates in fracture prevention. We excluded one trial that assessed incident fractures after four years (Frediani 2003) as the timeline differed too greatly from all other trials. Four trials were excluded because they only reported radiographically confirmed symptomatic vertebral fractures and not all participants were screened for vertebral fractures (Roux 1998; Cortet 1999; Geusens 1998; Stoch 2009). We excluded Jenkins 1999 because vertebral radiographs were reported on less than half of completing participants, despite a protocol stating routine radiographic screening at baseline and 52 weeks. Saadati 2008 did not outline their assessment criteria for fractures and was therefore excluded. One trial reported the number of vertebral fractures rather than the number of participants who experienced fractures and could not be included in the analysis (Skingle 1997). Fracture data from Adachi 2001 were not included as this study was a partial cohort from Saag 1998.
Fracture Assessment Criteria
Methods for assessing incident vertebral fractures included quantitative morphometry, semiquantitative grading and a spinal deformity index. Data were analysed regardless of which of the three methods of fracture determination was used.
Saag 1998 and its extension study Adachi 2001 assessed fractures using both semiquantitative and quantitative methods. For these two trials we included the semiquantitative data as more trials reported incident fractures using this method.
Two trials (Cohen 1999; Reid 2000) used the quantitative morphometric criteria of Kiel 1995 and Melton 1993 in which incident fractures were defined as either a reduction in vertebral height of 15% or more (for intact vertebrae at baseline) or 4 mm or more (for fractured vertebrae at baseline). Two other trials (Abitbol 2007; Lems 2006) defined incident fractures by quantitative morphometry as a reduction in vertebral height of 20% or 4 mm or more, or both, based on criteria outlined by Black 1996 and Genant 1996.
Six trials used semiquantitative grading with a minimum reduction in vertebral height of 20% as criteria for incident vertebral fractures (Adachi 1997; Adachi 2001; Pitt 1998; Saag 1998; Sambrook 2003; Tee 2012) as per Genant 1993 and Van Kujik 1995 and one trial used or a reduction in height of 15% or more (De Nijs 2006) according to Kleerekoper 1984.
Two trials used the Minne 1988 spinal deformity index (Boutsen 1997; Boutsen 2001), which determines the extent of vertebral compression by comparison of the actual vertebral body height to the presumable original height.
Incident radiographic nonvertebral fractures
Thirteen trials reported this outcome, nine trials were included and four trials excluded from meta‐analysis.
Fracture sites included but were not limited to the hip, wrist, forearm, and midfoot. No atypical femur fractures were reported in any of the included trials. We reported all nonvertebral fracture data together as the majority of trials did not include complete information on specific fracture sites. Three trials reported nonvertebral fractures but provided the total number of fractures rather than the number of participants suffering from fractures and were therefore not included in the analysis (Adachi 1997; Roux 1998; Stoch 2009). Another trial reported nonvertebral fractures occurring after four years and was not included in the analysis (Frediani 2003). Protocols for assessing nonvertebral fractures were typically not stated in study procedures. We assumed all nonvertebral fractures were self‐reported symptomatic ones.
BMD data
12 months (lumbar spine)
Twenty‐six trials reported this outcome, 23 trials were included and three trials excluded from meta‐analysis.
Two trials (Saadati 2008; Sambrook 2003) reported data that were insufficient for inclusion in the lumbar spine analysis. Tee 2012 reported BMD using T scores and was therefore not included in the analysis.
12 months (femoral neck)
Twenty‐three trials reported this outcome, 18 trials were included and five trials excluded from meta‐analysis.
Reported data from Saadati 2008; Sambrook 2003 and Skingle 1997 were insufficient for inclusion in the femoral neck analysis. Van Offel 2001 reported “no change” in femoral neck BMD without providing any numerical data and was therefore not included in the femoral neck analysis. Tee 2012 reported BMD using T scores and was therefore not included in the femoral neck analysis.
18 to 24 months
Nine trials reported BMD outcomes at 18 to 24 months at both the lumbar spine and femoral neck and were included in separate analyses. One multi‐arm trial used two distinct pair‐wise comparisons with two independent treatment groups and two independent placebo groups (Sambrook 2003). In this study, one pair‐wise comparison involved steroid‐use of less than six months and the other comparison involved steroid‐use greater than six months. The data were entered as two separate trials, therefore each analysis has 10 pair‐wise comparisons.
Low‐dose versus standard‐dose bisphosphonates
Five trials included multi‐group trials with head‐to‐head comparisons of standard‐dose versus low‐dose bisphosphonates. All five trials reported on lumbar spine BMD and were included in this meta‐analysis. Four trials reported on femoral neck BMD and were all included in the analysis on femoral neck BMD.
Serious adverse events
Nineteen trials reported this outcome, 15 trials were included and four were excluded from the meta‐analysis.
Serious adverse events were most commonly defined as any event requiring hospitalisation, that was life‐threatening or fatal. One trial that we included defined serious adverse events as any event that rendered a patient incapable of performing normal activities (Reid 2000). Few included trials provided details on the types of serious adverse events that occurred (see Characteristics of included studies for further details). Five trials only reported deaths and did not specify the occurrence of other forms of serious adverse events (Adachi 1997; De Nijs 2006; Geusens 1998; Herrala 1998; Jenkins 1999) though we still included these trials in the analysis. The protocol for assessing adverse events was not clearly stated in seven of the trials included in this analysis (Adachi 1997; Geusens 1998; Jenkins 1999; Lems 2006; Pitt 1998; Saag 1998; Tee 2012).
Deaths
From the included trials, nine deaths were reported in the experimental groups (Adachi 1997; De Nijs 2006; Geusens 1998; Hakala 2012; Herrala 1998; Pitt 1998; Stoch 2009; Tee 2012) and five deaths were reported in the control groups (Boutsen 1997; De Nijs 2006; Herrala 1998; Jenkins 1999; Pitt 1998). In none of these cases did the study authors consider the deaths to be related to the study or placebo drugs. See Characteristics of included studies for further details.
Data from Adachi 2001 were not included as it was an extension trial of Saag 1998, which provided more complete data. Cortet 1999; Sambrook 2003 and Yeap 2008 each reported deaths but did not specify from which treatment group they occurred and were therefore not included in the analysis.
Withdrawals due to adverse events
Twenty‐one trials reported this outcome, 15 trials were included and six trials were excluded from meta‐analysis.
For this analysis we included withdrawals due to all adverse events regardless of their association to either the control or drug of study. We did not include death as a withdrawal due to an adverse event. See Characteristics of included studies for further details on types of adverse events leading to study withdrawal.
Four trials did not specify which treatment groups the withdrawals came from (Herrala 1998; Lems 2006; Sambrook 2003; Yeap 2008) and were therefore excluded from the analysis. Another trial did not provide numerical data on the withdrawals (Cortet 1999) and could not be included. Data from Adachi 2001 were not included as it was an extension trial of Saag 1998.
Quality of life
This outcome was not assessed by any of the trials.
Excluded studies
From our search of the databases, clinical trials registries and handsearching, we excluded 534 of the 587 articles that underwent full‐text review. The main reason for exclusion was not being an RCT (n = 330). We excluded 33 trials as they involved transplant‐associated steroid use. See Figure 1 for complete details. During data extraction from 39 studies, we excluded 11 for using only non‐standard bisphosphonate doses (Benucci 2009; Fujii 2006; Jinnouchi 2000; Kikuchi 2006; Kitazaki 2008; Nakayamada 2004; Okada 2008; Sato 2003; Takeda 2008; Takei 2010; Toukap 2005), and we categorised Ozoran 2007 as 'awaiting classification' pending data clarification from the study authors due to insufficient reporting of relevant outcome data. We have included the references of the 12 trials that we excluded during data extraction as they did meet our initial criteria for inclusion and may still be of relevance (details in Characteristics of excluded studies). In addition, eight trials were deemed to be 'awaiting classification' (details in Characteristics of studies awaiting classification). Of these, four trials identified from trials registers were completed but with no publications available and four trials were published as articles in Japanese with no English versions available (Imanishi 2006; Nakamura 2002; Okazaki 2015; Suzuki 2015). We are currently awaiting the translation of these four trials and will update the review once information is available. Finally, we identified six ongoing trials that may be of relevance to this review (details in Characteristics of ongoing studies).
The existing Cochrane Review included 13 trials and of these, only two trials were included in this review (Adachi 1997; Wolfhagen 1997). Five trials were conference abstracts that have been subsequently published and the full publications were included (Jenkins 1999; Pitt 1998; Roux 1998; Saag 1998; Skingle 1997). We excluded four trials because they were not RCTs. We excluded one trial because it measured BMD by computerised tomography (CT) instead of DEXA. Another trial from the original review reported outcome measurements at six months only. We decided that this time point was not clinically significant and not analysed in this review update, therefore we excluded this trial.
Risk of bias in included studies
Detailed results of this assessment are found in a table attached to the Characteristics of included studies table and are summarised below in Figure 2 and Figure 3.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
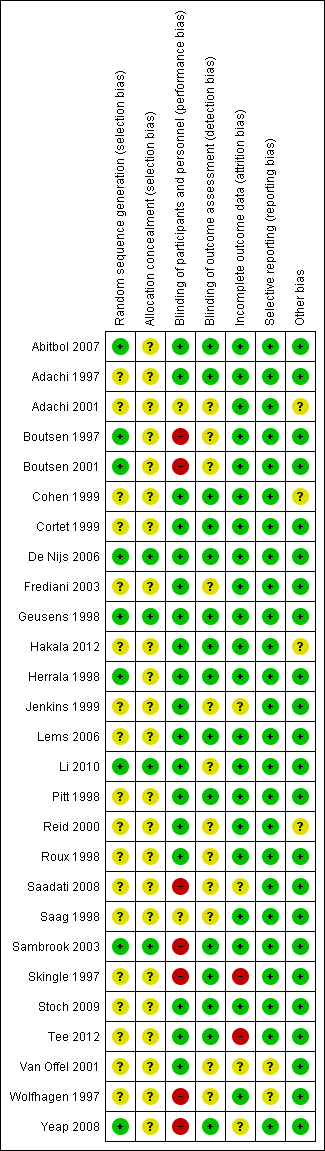
Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Four studies clearly described random sequence generation methods and allocation concealment and were at low risk for selection bias (De Nijs 2006; Geusens 1998; Li 2010; Sambrook 2003).
Eighteen studies did not provide details on random sequence generation methods or allocation concealment and so were at unclear risk for selection bias (Adachi 1997; Adachi 2001; Cohen 1999; Cortet 1999; Frediani 2003; Hakala 2012; Jenkins 1999; Lems 2006; Pitt 1998; Reid 2000; Roux 1998; Saadati 2008; Saag 1998; Skingle 1997; Stoch 2009; Tee 2012; Van Offel 2001; Wolfhagen 1997).
Five studies were at low risk of bias for randomisation as they provided clear descriptions of random sequence generation but were considered to have unclear risk of bias for allocation concealment, as no allocation details were provided (Abitbol 2007; Boutsen 1997; Boutsen 2001; Herrala 1998; Yeap 2008).
Blinding
Twelve studies provided adequate detail on blinding of participants, personnel and outcome assessment, so were at low risk for performance and detection bias (Abitbol 2007; Adachi 1997; Cohen 1999; Cortet 1999; De Nijs 2006; Geusens 1998; Hakala 2012; Herrala 1998; Lems 2006; Pitt 1998; Stoch 2009; Tee 2012)
Two studies did not provide details on blinding of participants, personnel or outcome assessors, so were at unclear risk for performance and detection bias (Adachi 2001; Saag 1998).
Six studies provided adequate detail on blinding of participants/personnel but did not mention blinding of outcome assessment so were at low risk for performance bias and unclear risk for detection bias (Frediani 2003; Jenkins 1999; Li 2010; Reid 2000; Roux 1998; Van Offel 2001).
Three studies had explicit and appropriate outcome assessment blinding, but clearly stated that participants/personnel were not blinded or were not placebo‐controlled, so were at high risk for performance bias and low risk for detection bias (Sambrook 2003; Skingle 1997; Yeap 2008).
Four studies had insufficient participant/personnel blinding and did not provide clear details on outcome assessment blinding, so were at high risk for performance bias and unclear risk for detection bias (Boutsen 1997; Boutsen 2001; Saadati 2008; Wolfhagen 1997).
Incomplete outcome data
Twenty‐one studies had sufficiently complete outcome data, adequately addressed reasons for dropout, with dropout similar between both groups, so were at low risk for attrition bias (Abitbol 2007; Adachi 1997; Adachi 2001; Boutsen 1997; Boutsen 2001; Cohen 1999; Cortet 1999; De Nijs 2006; Frediani 2003; Geusens 1998; Hakala 2012; Herrala 1998; Lems 2006; Li 2010; Pitt 1998; Reid 2000; Roux 1998; Saag 1998; Sambrook 2003; Stoch 2009; Wolfhagen 1997).
Three studies did not clearly address the reasons for participant dropout, so were at unclear risk for attrition bias (Saadati 2008; Van Offel 2001; Yeap 2008). Jenkins 1999 had low dropout and addressed reasons for dropout but only screened vertebral fractures radiographically in 13 of 28 completing participants. No explanation was provided for the low yield of vertebral radiographs so this study was at unclear risk for attrition bias.
Skingle 1997 had 31% of participants that did not complete the first year and only 23 of 38 completing participants were screened for radiographic vertebral fractures. Tee 2012 had 30% of participants that did not complete the study with the main reason being that they were unavailable for follow‐up. Both these studies were at high risk for attrition bias.
Selective reporting
Twenty‐five studies reported all outcomes that were listed in the methods section and were therefore considered to be at low risk for reporting bias (Abitbol 2007; Adachi 1997; Adachi 2001; Boutsen 1997; Boutsen 2001; Cohen 1999; Cortet 1999; De Nijs 2006; Frediani 2003; Geusens 1998; Hakala 2012; Herrala 1998; Jenkins 1999; Lems 2006; Li 2010; Pitt 1998; Reid 2000; Roux 1998; Saadati 2008; Saag 1998; Sambrook 2003; Skingle 1997; Stoch 2009; Tee 2012; Yeap 2008).
Van Offel 2001 had no mention of adverse events. Wolfhagen 1997 took spinal radiographs to validate DEXA measurements only, not as an outcome. Both these studies were at unclear risk for reporting bias.
Other potential sources of bias
Eighteen studies were judged to be at low risk as no other sources of bias were apparent (Abitbol 2007; Boutsen 1997; Boutsen 2001; Cortet 1999; Frediani 2003; Geusens 1998; Herrala 1998; Jenkins 1999; Lems 2006; Li 2010; Pitt 1998; Roux 1998; Saadati 2008; Skingle 1997; Stoch 2009; Tee 2012; Van Offel 2001; Wolfhagen 1997). Five studies were also rated as low risk and had pharmaceutical industry contribution that was limited to supplying the study drug or providing grants, with no industry authorship (Adachi 1997; De Nijs 2006; Saag 1998; Sambrook 2003; Yeap 2008).
Four studies were rated as having an unclear risk of bias due to other sources. Two studies had industry authorship (Cohen 1999; Hakala 2012); and Reid 2000 reported industry involvement in the design, implementation and analysis of the trial. We rated Adachi 2001 as unclear because it was an extension study, which has the potential risk of unblinding.
Effects of interventions
See: Summary of findings for the main comparison Bisphosphonates versus control for adults with GIOP
Benefits
Incident radiographic vertebral fractures
Twelve trials (1343 participants) reported the number of participants with new vertebral fractures. We combined symptomatic and asymptomatic fractures. In this analysis 46/597 (or 77 per 1000) people experienced new vertebral fractures in the control group compared with 31/746 (or 44 per 1000; range 27 to 70) in the bisphosphonate group. The resulting RR was statistically significant at 0.57 (95% CI 0.35 to 0.91) (Analysis 1.1) signifying a relative per cent improvement of 43% (95% CI 9% to 65% better) with bisphosphonates; an absolute increased benefit of 2% fewer people experiencing fractures (95% CI 5% fewer to 1% more); and NNTB of 31 (95% CI 20 to 145) meaning that approximately 31 people would need to be treated with bisphosphonates to prevent new vertebral fractures in one person (summary of findings Table for the main comparison). There was no statistical heterogeneity in the incident vertebral fracture analysis (I2 = 0%). Overall, there was high‐certainty evidence for a reduction in new vertebral fractures with bisphosphonates.
Incident radiographic nonvertebral fractures
In the analysis of nine trials (1245 participants), 30/546 (or 55 per 1000) people experienced new nonvertebral fractures in the control group compared with 29/699 (or 42 per 1000; range 25 to 69) in the bisphosphonate group. The resulting RR was 0.79 (95% CI 0.47 to 1.33) although this was not statistically significant (Analysis 1.2). There was a relative per cent improvement of 21% (95% CI 33% worse to 53% better) with bisphosphonates; an absolute increased benefit of 1% fewer people experiencing fractures (95% CI 4% fewer to 1% more); NNTB not applicable as results were not statistically significant (summary of findings Table for the main comparison). There was no statistical heterogeneity in the nonvertebral fracture analysis (I2 = 0%). Overall, there was low‐certainty evidence that bisphosphonates may make little or no difference in the reduction of new nonvertebral fractures (downgraded for risk of bias and imprecision).
Per cent change in lumbar spine BMD
Bisphosphonate treatment up to 12 months
In the analysis of 23 trials (2042 participants), bisphosphonate use resulted in a statistically significant MD of 3.50% (95% CI 2.90% to 4.10%) (Analysis 2.1) representing an absolute benefit with BMD 3.5% higher with bisphosphonates as compared to calcium or vitamin D alone (95% CI 2.90% to 4.10% higher); a relative per cent improvement of 1.1% (95% CI 0.91% to 1.29% better); NNTB 3 (95% CI 2 to 3) meaning that approximately three people would need to be treated with bisphosphonates over 12 months in order to see a minimally important difference in lumbar spine BMD in one person (summary of findings Table for the main comparison). There was substantial heterogeneity among these trials (I2 = 70%) that we found was adequately explained through subgroup and sensitivity analyses shown below. Overall, there was moderate‐certainty evidence of a clinically important increase in lumbar spine BMD with bisphosphonates (downgraded for indirectness).
Bisphosphonate treatment 18 to 24 months
In the analysis of nine trials (10 treatment groups) reporting on 802 participants, bisphosphonate use resulted in a statistically significant 5.49% (95% CI 3.47% to 7.51%) increase in BMD as compared to treatment with calcium or vitamin D alone (Analysis 2.5). There was substantial heterogeneity in this analysis (I2 = 91%). We removed one trial that differed from the others by using IM bisphosphonates in a female‐only population, which reduced the I2 statistic to 41% (result not shown).
Per cent change in femoral neck BMD
Bisphosphonate treatment up to 12 months
Results from 18 trials (1665 participants) showed that bisphosphonate use resulted in a statistically significant MD of 2.06% (95% CI 1.45 to 2.68) (Analysis 3.1) representing an absolute benefit with BMD 2.06% higher in the bisphosphonate group as compared to treatment with calcium or vitamin D alone (95% CI 1.45% to 2.68% higher); a relative per cent improvement of 1.29% (95% CI 0.91% to 1.69% better); NNTB 5 (95% CI 4 to 7) meaning that approximately five people would need to be treated with bisphosphonates over 12 months in order to see a minimally important difference in femoral neck BMD in one person (summary of findings Table for the main comparison). The heterogeneity among these trials was not substantial (I2 = 34%). Overall, there was moderate‐certainty evidence of a clinically important increase in femoral neck BMD with bisphosphonates (downgraded for indirectness) .
Bisphosphonate treatment 18 to 24 months
Analysis of nine trials (10 treatment groups) reporting on 802 participants showed that bisphosphonate use resulted in a statistically significant 3.28% (95% CI 1.70% to 4.87%) increase in BMD as compared to treatment with calcium or vitamin D alone (Analysis 3.5). There was substantial heterogeneity among the trials in this analysis (I2 = 83%). One trial differed by using intramuscular (IM) bisphosphonates and another trial had a lower mean participant age, however removing single trials did not appreciably alter the heterogeneity.
Quality of life
Quality of life was not assessed by any of the trials.
Per cent change in BMD at 12 months with low‐dose versus standard‐dose bisphosphonates
Lumbar spine
Head‐to‐head analysis of five trials (642 participants) resulted in a MD of 0.95% (95% CI 0.37% to 1.53%) that was statistically significant (Analysis 2.4). There was no statistical heterogeneity in this analysis (I2 = 0%)
Femoral neck
Head‐to‐head analysis of four trials (542 participants) showed a MD of 0.74% (95% CI ‐0.42% to 1.90%) that did not reach statistical significance with substantial heterogeneity among trials (I2 = 54%) (Analysis 3.4).
Harms
Serious adverse events
Fifteen trials (1703 participants) reported on serious adverse events with 131/811 (or 162 per 1000) people experiencing serious adverse events in the control group compared to 136/892 (or 147 per 1000; range 120 to 181) in the bisphosphonate group. The RR for serious adverse events in the bisphosphonate group was 0.91 (95% CI 0.74 to 1.12) (Analysis 4.1); an absolute increased harm of 0% more serious adverse events (95% CI 2.00% fewer to 2.00% more); a relative per cent change 9% improvement (95% CI 12% worse to 26% better); NNTH not applicable as there was no statistically significant difference (summary of findings Table for the main comparison). There was no statistical heterogeneity in the analysis on serious adverse events (I2 = 0%). Overall, there was low‐certainty evidence (downgraded for imprecision and risk of bias) that bisphosphonates may make little or no difference in the number of serious adverse events.
Withdrawals due to adverse events
Fifteen trials (1790 participants) reported withdrawals due to adverse events. Not all adverse events were listed, but in those trials that did have information, the most common adverse events were upper gastrointestinal symptoms and musculoskeletal pain. In this analysis, 63/866 (or 73 per 1000) people withdrew in the control group compared to 76/924 (or 77 per 1000; range 56 to 107) in the bisphosphonate group. The RR for withdrawals due to adverse events in the bisphosphonate group was not statistically significant at 1.06 (95% CI 0.77 to 1.47) (Analysis 4.2); an absolute increased harm of 1% more withdrawals with bisphosphonates (95% CI 1% fewer to 3% more); a relative per cent change 6% worse (95% CI 47% worse to 23% better); NNTH not applicable as there was no statistically significant difference between groups (summary of findings Table for the main comparison). There was no substantial heterogeneity in the withdrawals due to adverse events analysis (I2 = 2%). Overall, there was low‐certainty evidence (downgraded for imprecision and risk of bias) that bisphosphonates may make little or no difference in the number of withdrawals due to adverse events.
Subgroup analyses
Prevention and treatment studies
A pre‐specified subgroup analysis was used to analyse separately prevention and treatment effects in trials reporting on BMD at the lumbar spine and femoral neck at 12 months.
Lumbar spine
In the prevention analysis (12 trials, 930 participants) bisphosphonate use resulted in an increase in BMD of 3.92% (95% CI 2.90% to 4.94%) as compared to treatment with calcium or vitamin D alone (Analysis 2.1). In the treatment analysis (11 trials, 1112 participants), bisphosphonate use resulted in an increase in BMD of 3.19% (95% CI 2.64% to 3.73%) as compared to treatment with calcium or vitamin D alone (Analysis 2.1). Both were statistically significant. There was substantial heterogeneity among the studies in the prevention analysis (I2 = 80%) but not the treatment analysis (I2 = 16%). A sub‐subgroup analysis was done for the prevention analysis to separate trials using parenteral and oral bisphosphonates (Analysis 2.6). This appears to explain the significant heterogeneity in the prevention analysis. There were no parenteral bisphosphonates used in treatment trials.
Femoral neck
In the prevention analysis (10 trials, 751 participants), bisphosphonate use resulted in a statistically significant increase in BMD of 2.79% (95% CI 1.99% to 3.59%) as compared to treatment with calcium or vitamin D alone (Analysis 3.1). In the treatment analysis (eight trials, 914 participants), the increase in BMD was 1.53% (95% CI 0.73% to 2.33%) (Analysis 3.1). Both were statistically significant. There was no substantial heterogeneity in either the prevention or treatment analyses (I2 = 0% and 44%, respectively).
Gender and menopausal status
Fracture data were not broken down by gender and menopausal status in the individual trials included in our analysis and therefore post‐hoc subgroup analyses were not possible for fracture outcomes. Sufficient data on BMD at the lumbar spine and femoral neck at 12 months were available to analyse subgroups of gender and menopausal status (men, premenopausal women, postmenopausal women). Please see Analysis 2.7 and Analysis 3.6 for full details on results.
Mean steroid dose
In the vertebral fracture, nonvertebral fracture and 12 months BMD outcomes, Cohen 1999 was the only trial to use high‐dose steroids (greater or equal to 20 mg/day).
Prevalent fractures
No trials reported outcome data separately for those participants with and without a prevalent fracture.
Sensitivity analyses
Risk of bias
To analyse the effect of study quality, based on the exclusion of non‐blinded trials (high risk for performance or detection bias) we performed a sensitivity analysis. Sensitivity analyses excluding high‐risk trials for the outcomes of incident vertebral fractures; incident nonvertebral fractures; BMD at the lumbar spine and femoral neck after 12 months and 18 to 24 months; serious adverse events; withdrawals due to adverse events; BMD using low‐ versus standard‐dose bisphosphonates did not appreciably change the effect sizes and did not resolve heterogeneity among trials (results not shown).
Route of administration
We performed a sensitivity analysis based on route of administration. We analysed trials using oral bisphosphonates separately from those using parenteral bisphosphonates. The trials reported BMD data at the lumbar spine and femoral neck at 12 months.
Lumbar spine
At the lumbar spine, pooled analysis of 18 trials (1767 participants) using oral treatments showed a statistically significant result with MD 3.25% (95% CI 2.88% to 3.63%) (Analysis 2.2).
Analysis of five trials (275 participants) using parenteral treatments had a statistically significant MD 5.12% (95% CI 2.35% to 7.89%) at the lumbar spine (Analysis 2.3). There was no statistical heterogeneity in the oral analysis (I2 = 0%) but heterogeneity was substantial in the lumbar spine parenteral treatment analysis (I2 = 90%).
Femoral neck
At the femoral neck, analysis of 15 trials (1574 participants) using oral administration had a statistically significant MD 1.92% (95% CI 1.31% to 2.53%) (Analysis 3.2).
Analysis of three trials (91 participants) using parenteral therapy was also statistically significant with MD 4.56% (95% CI 2.07% to 7.05%) (Analysis 3.3). There was no substantial heterogeneity in either the oral or parenteral treatment analyses at the femoral neck (I2 = 34% and 0%, respectively).
Discusión
Resumen de los resultados principales
Esta revisión se realizó para evaluar los efectos beneficiosos y perjudiciales de los bisfosfonatos en la OPIG. Se examinaron los efectos beneficiosos en cuanto a los resultados fractura y cambio en la DMO; y se incluyeron análisis de subgrupos de prevención primaria versus tratamiento. La revisión proporciona nuevos datos sobre los bisfosfonatos orales y parenterales y una comparación directa de los bisfosfonatos a dosis bajas y estándar. Los datos de los efectos perjudiciales incluyen los eventos adversos graves y los retiros debido a eventos adversos.
Datos de las fracturas
El resultado clínicamente más relevante es el efecto de los bisfosfonatos sobre la prevención de las fracturas. Los resultados de los análisis indican que los bisfosfonatos reducen el número total de incidencia de fracturas vertebrales en aproximadamente el 40%, con un NNTB de 31. No hubo una reducción estadísticamente significativa de las fracturas en sitios no vertebrales, incluida la cadera.
Datos de los efectos perjudiciales
No hubo diferencias estadísticamente significativas en la incidencia de eventos adversos graves o retiros debido a eventos adversos entre los grupos de fármaco activo y control. Los eventos adversos informados con mayor frecuencia en la presente revisión fueron los musculoesqueléticos (mialgias y artralgias) y los del sistema gastrointestinal superior; no obstante, fueron de naturaleza leve y se observaron en los grupos de bisfosfonato y control. Los efectos secundarios gastrointestinales, o incluso el temor a presentarlos, se citan como un motivo importante para la reducción del cumplimiento o la interrupción del tratamiento (Pazianas 2011). Otros efectos secundarios asociados con frecuencia y que se citan en la bibliografía incluyen hipercalcemia asintomática y una respuesta transitoria de la fase aguda (dos a tres días de síntomas similares a la gripe, asociados con mayor frecuencia con el inicio del tratamiento intravenoso). Dichos efectos se observaron esporádicamente en los ensayos incluidos en la presente revisión.
Aunque las pruebas epidemiológicas muy confiables son limitadas, la osteonecrosis de la mandíbula es un evento adverso poco frecuente pero grave que se asocia con el uso de los bisfosfonatos, específicamente con su administración durante muchos años y con las dosis intravenosas frecuentes (Pazianas 2011).
Los bisfosfonatos se asocian con un mayor riesgo de fracturas atípicas del fémur (subtrocantérica o diafisaria). Las incidencias calculadas varían de 12,5 a 31 por 10 000 pacientes/año con aproximadamente diez años de exposición al alendronato (Abrahamsen 2010; Dell 2012). Los datos actuales son contradictorios, aunque la mayoría de los estudios coinciden en que el riesgo absoluto de fractura atípica del fémur es bajo con los bisfosfonatos. Un metanálisis reciente agrupó nueve ensayos observacionales y un ECA (n = 658 497) y encontró un aumento estadísticamente significativo en el riesgo de fracturas atípicas del fémur con los bisfosfonatos; OR ajustado 1,99 (IC del 95%: 1,28 a 3,10) (Lee 2015). Aunque la implicación clínica no está clara, la administración de corticosteroides a largo plazo y los procesos de las enfermedades inflamatorias sistémicas se consideran factores de riesgo asociados con las fracturas atípicas del fémur (Lee 2015).
En los ensayos incluidos en la presente revisión, no se informó osteonecrosis de la mandíbula ni fracturas atípicas del fémur.
Los expertos todavía recomiendan precaución durante la administración de los bisfosfonatos en las pacientes en edad fértil hasta que se hayan realizado estudios de investigación sistemáticos adicionales (Djokanovic 2008; Losada 2010).
Datos de la DMO
Los resultados principales de la DMO muestran aumentos estadística y clínicamente significativos de la densidad ósea en la columna lumbar y el cuello femoral después de 12 meses, con DM del 3,50% y el 2,06%, respectivamente. El NNTB para la columna lumbar después de 12 meses es 3, y el NNTB para el cuello femoral después de 12 meses es 5. Generalmente, se considera que la pérdida ósea inducida por corticosteroides no es tan prominente en el hueso cortical (Rickers 1984) y que los cambios en la DMO no son tan notables en el cuello femoral, ya que el recambio en el hueso cortical demora más. Los presentes resultados apoyan estas consideraciones y los datos de los brazos placebo de los ensayos muestran una magnitud más pequeña de la pérdida ósea en el cuello femoral que en la columna lumbar.
Los NNTB de la revisión para el cambio en la DMO en la columna lumbar y el cuello femoral se basan en una DME de 0,5 como estimación de la diferencia mínima clínicamente importante para el cambio en la DMO (Schünemann 2011b). Es difícil expresar estos resultados en términos de cambio mínimo clínicamente relevante en la DMO, ya que no se ha establecido dicho valor para la OPIG. Las fracturas en la OPIG ocurren a menudo con una DMO mayor que la que se observa en la osteoporosis primaria y, a diferencia de la osteoporosis primaria, no se ha establecido una correlación previsible entre la DMO y el riesgo de fracturas en el contexto de la OPIG. Además, la mejoría en la DMO sólo representa una parte pequeña de la reducción del riesgo de fracturas vertebrales observado con el tratamiento antirreabsorción (Cummings 2002; Kanis 2007; Saag 2003; Van Staa 2002).
Un metanálisis anterior que evalúa las mejorías en la DMO y la reducción en el riesgo de fracturas vertebrales en las mujeres posmenopáusicas y los hombres de edad avanzada indica que cada mejoría del 1% en la DMO de la columna durante el tratamiento antirreabsorción se asocia con una disminución de 0,03 en el riesgo relativo de fractura vertebral (Cummings 2002). Aunque el metanálisis no es ni específico para la OPIG ni para los bisfosfonatos, proporciona un contexto clínico crudo para considerar los presentes resultados de una diferencia del 3,5% en la DMO de la columna lumbar entre el grupo de tratamiento y el grupo control después de 12 meses de tratamiento con bisfosfonatos.
La evolución natural de los pacientes que comienzan el tratamiento con corticosteroides, según los brazos control de los ensayos de prevención, es que se observará una disminución del 1% al 6% en la DMO de la columna lumbar y una disminución del 1% al 4% en la DMO del cuello femoral en el primer año de tratamiento.
El interés se centró en el análisis de los ensayos de prevención y tratamiento por separado, porque los dos escenarios clínicos son diferentes. En general, los ensayos de prevención mostraron mayor pérdida ósea en el brazo control, con una acumulación ósea igual o pequeña en el brazo de tratamiento. Por el contrario, los ensayos de tratamiento mostraron un mayor grado de acumulación en el brazo de tratamiento, con una pérdida ósea menos notable en el brazo control. Lo anterior apoya la consideración de que la pérdida ósea es más prominente en las primeras etapas de tratamiento con corticosteroides, con una tasa más lenta de pérdida cuando el tratamiento continúa. Como tal, el tratamiento profiláctico muestra la capacidad de reducir la pérdida ósea, mientras que el tratamiento con bisfosfonatos brinda la oportunidad de reconstruir la masa ósea en los pacientes que utilizan corticosteroides de forma crónica.
Se incluyeron análisis de subgrupos post hoc según el sexo y el estado menopáusico (hombres, mujeres premenopáusicas, mujeres posmenopáusicas); sin embargo, los revisores fueron cautelosos al interpretar estos resultados porque las comparaciones de subgrupos son de naturaleza observacional (Deeks 2011). Se encontró que se mantiene una magnitud similar del efecto en los subgrupos cuando se compararon con los análisis con todos los grupos, excepto un margen mayor de variabilidad, debido quizás a que hubo menos ensayos en cada análisis. Los resultados de los grupos de mujeres en cuanto al cuello femoral no fueron estadísticamente significativos. No hubo heterogeneidad significativa en los análisis en los hombres, pero sí hubo heterogeneidad significativa en los gráficos de las mujeres. Frediani 2003 fue un valor atípico visible en los gráficos de las mujeres y fue diferente de los otros ensayos en que utilizó bisfosfonatos parenterales, lo que puede explicar esta diferencia. Los análisis de sensibilidad a priori que separaron los bisfosfonatos orales y enterales mostraron una probable heterogeneidad, debido en parte a este factor. Al extraer Frediani 2003, se redujo la estadística I2 en todos los análisis en las mujeres (I2= 0% para el análisis de la DMO de la columna lumbar en mujeres premenopáusicas; I2= 43% para el análisis de la DMO de la columna lumbar en mujeres posmenopáusicas; I2= 0% para los análisis de la DMO del cuello femoral en mujeres premenopáusicas y posmenopáusicas; no se muestran los resultados). Estos análisis post hoc incluyeron datos mixtos de ensayos de prevención y de tratamiento. No fue posible realizar análisis de subsubgrupos separados por sexo y de prevención o tratamiento porque los datos de los ensayos no se presentaron con ese nivel de detalle.
Debido a la absorción deficiente de los bisfosfonatos orales (Gertz 1995; Russell 2007) se ha observado una eficacia diferencial según la vía de administración. El presente análisis mostró que el tamaño del efecto de la DMO en la columna lumbar difirió entre los ensayos de bisfosfonato parenteral y oral (5,12% y 3,25%, respectivamente). Esta diferencia en el tamaño del efecto entre el análisis parenteral y el oral también se observó en el cuello femoral (4,56% y 1,92%, respectivamente). En el análisis de la DMO de la columna lumbar, todos los estudios de bisfosfonatos parenterales fueron estudios de prevención, que probablemente contribuyeron a la heterogeneidad significativa en el análisis de subgrupos de la prevención de la DMO en la columna lumbar. Un análisis de subsubgrupos de bisfosfonatos parenterales y orales eliminó posteriormente la heterogeneidad en el subgrupo de prevención de la DMO en la columna lumbar.
Hay pocos ensayos de comparación directa de los bisfosfonatos orales versus parenterales en la OPIG. Un ECA de 12 meses que incluyó 265 hombres, divididos en subgrupos de prevención y tratamiento, comparó una infusión única de 5 mg de ácido zoledrónico con 5 mg diarios de risedronato oral. Los autores encontraron un aumento estadísticamente significativo de la DMO de la columna lumbar del 2,7% (IC del 95%: 0,99% al 4,43%) con el ácido zoledrónico en comparación con el risedronato en el subgrupo de prevención. La diferencia de los tratamientos en el cuello femoral no fue estadísticamente significativa en el subgrupo de prevención, 1,38% (IC del 95%: ‐0,18% a 2,95%) (Sambrook 2012). Otro ECA (n = 771) encontró mejorías estadísticamente significativas en la DMO a los 12 meses con ácido zoledrónico en comparación con risedronato en la columna lumbar y en el cuello femoral en los subgrupos de prevención; 1,96% (IC del 95%: 1,04 a 2,88) y 1,33% (IC del 95%: 0,41 a 2,25%) (Reid 2009). En general, en estos ensayos, los regímenes parenterales tuvieron considerablemente mayor preferencia que los regímenes orales. La vía de administración es un factor a considerar en el tratamiento de la OPIG.
En cinco estudios, se analizaron las comparaciones directas de los grupos de tratamiento con bisfosfonato a dosis baja y estándar (Boutsen 2001; Cohen 1999; Lems 2006; Reid 2000; Saag 1998). Los grupos de bisfosfonato a dosis estándar mostraron un aumento pequeño en los efectos beneficiosos sobre la columna lumbar (0,95%; IC del 95%: 0,37% al 1,53%). Los datos indican que incluso los bisfosfonatos a dosis bajas pueden ser beneficiosos en el tratamiento de la OPIG.
Fue interesante observar que un análisis agrupado ad hoc de bisfosfonatos a dosis bajas (Boutsen 2001; Cohen 1999; Lems 2006; Reid 2000; Saag 1998)en comparación con tratamiento con calcio o vitamina D solos, dio lugar a una diferencia media del 3,15% (IC del 95%: 1,87% al 4,44%) en la columna lumbar. Este tamaño del efecto no está fuera del rango de la estimación agrupada de esta revisión para todos los estudios que utilizaron bisfosfonatos a dosis estándar, lo que apoya la indicación de que los bisfosfonatos a dosis baja pueden ser beneficiosos (no se muestran los resultados).
Existe la percepción de que los bisfosfonatos más nuevos son más efectivos que el etidronato para tratar la osteoporosis. En los análisis de las fracturas vertebrales y de la DMO para los bisfosfonatos orales, no hubo heterogeneidad entre los estudios, que incluyeron tres tipos diferentes de bisfosfonatos. No se realizó un análisis post hoc de los bisfosfonatos más nuevos.
Una crítica a los estudios de bisfosfonato es la falta de seguimiento a largo plazo. Para esta revisión actualizada, se decidió incluir el análisis de la DMO en la columna lumbar y el cuello femoral después de 18 a 24 meses. Los resultados de estos análisis muestran aumentos en la densidad ósea en la columna lumbar y el cuello femoral, con diferencias de medias del 5,49% y el 3,28%, respectivamente. Lo anterior indica la eficacia continua hasta los dos años.
Compleción y aplicabilidad general de las pruebas
Esta revisión actualizada examinó las pruebas de 27 ECA de la administración de bisfosfonatos en la prevención y el tratamiento de la OPIG. Para esta actualización, se incluyeron 25 estudios nuevos y, debido a los criterios de inclusión más rigurosos, sólo dos de los 13 estudios de la revisión existente, ya que se publicaron numerosos estudios de mayor calidad desde la revisión original. Varios resultados midieron los efectos beneficiosos y perjudiciales de los bisfosfonatos. Los efectos beneficiosos incluyeron una disminución de la pérdida ósea o de la acumulación ósea en la columna lumbar y el cuello femoral, y una reducción del riesgo de fracturas vertebrales. Aunque los datos de resultado de las fracturas pueden tener una relevancia clínica más directa que las mediciones de los resultados de la DMO, la mayoría de los estudios de OPIG informaron la DMO como resultado primario. Los datos de las fracturas vertebrales fueron suficientes para abordar los objetivos de la presente revisión; sin embargo, los datos sobre las fracturas no vertebrales a menudo carecieron de detalles y no fue posible examinar la incidencia de fracturas de cadera y muñeca por separado. Ninguno de los ensayos informó la calidad de vida, por lo que no fue posible incluirla como una medida de resultado en la revisión.
Esta revisión actualizada proporciona pruebas confirmatorias de que los bisfosfonatos, solos o en combinación con calcio o vitamina D, o ambos, son más beneficiosos que el calcio o la vitamina D, o ambos, solos o con placebo, para la prevención y el tratamiento de la OPIG de la cadera y la columna vertebral. Los ensayos analizados en esta revisión utilizaron criterios de inclusión similares; sin embargo, los grupos de participantes difirieron en los ensayos en cuanto a la administración previa de corticosteroides, las mediciones iniciales de la DMO y la prevalencia de fracturas. Esta revisión actualizada proporciona nuevos datos sobre los efectos beneficiosos de los bisfosfonatos en la reducción del riesgo de fracturas vertebrales y la prevención versus el tratamiento de la OPIG. Se proporcionaron datos nuevos sobre los diferentes tamaños del efecto observados en los ensayos clínicos de bisfosfonato oral y parenteral y el posible efecto beneficioso de los bisfosfonatos a dosis baja.
Con respecto a los efectos perjudiciales de los bisfosfonatos, no fue posible encontrar diferencias estadísticamente significativas en la aparición de eventos adversos graves o en los retiros debido a eventos adversos entre los grupos de bisfosfonato y control. En nueve de los ensayos analizados, los protocolos para la obtención de los datos de los efectos perjudiciales fueron poco claros y pueden haber dado lugar a resultados sesgados. Algunos de los estudios incluidos basaron sus cálculos del poder estadístico exclusivamente en los resultados de los efectos beneficiosos y pueden no haber tenido un poder estadístico suficiente para evaluar de forma adecuada los resultados de los efectos perjudiciales. Aunque es importante considerar los resultados sobre los eventos adversos graves y los retiros debido a eventos adversos al evaluar el tratamiento con bisfosfonatos, se fue cauteloso al interpretar estos datos como marcadores de los efectos perjudiciales y la tolerabilidad debido a la posibilidad de sesgo (Higgins 2011a).
Calidad de la evidencia
El "Resumen de los hallazgos para la comparación principal" muestra la confiabilidad y la importancia general del grupo de pruebas mediante el GRADE Working Group Approach (Schünemann 2013). La confiabilidad de las pruebas para las fracturas vertebrales se consideró alta, lo que indica que es muy poco probable que los estudios de investigación adicionales cambien la confianza en la estimación del efecto. Las pruebas del resultado de la fractura no vertebral se disminuyeron a poco confiables por la imprecisión debido a que el tamaño de la muestra total estuvo por debajo del tamaño calculado para una información óptima, y por el riesgo de sesgo al ser un resultado subjetivo informado por el paciente. La confiabilidad de los resultados restantes se consideró moderada, lo que indica que es probable que los estudios de investigación adicionales tengan una marcada repercusión sobre la confianza en la estimación del efecto y puedan cambiarla. Los resultados de la DMO se disminuyeron por la indireccionalidad como marcadores alternativos para la osteoporosis. Los eventos adversos graves y los retiros debido a eventos adversos se disminuyeron por la imprecisión debido al tamaño pequeño de la muestra total y a que los IC del 95% incluyeron la posibilidad de ningún efecto y efectos perjudiciales significativos. Todos los resultados se consideraron importantes en cuanto a la repercusión sobre las decisiones con respecto al tratamiento óptimo.
Sesgos potenciales en el proceso de revisión
Los métodos y el informe de esta revisión se basan en las recomendaciones del Manual Cochrane para las revisiones sistemáticas de intervenciones (Cochrane Handbook for Systematic Reviews of Interventions) (Higgins 2011). Se ha ideado una estrategia de búsqueda exhaustiva sin restricciones de idioma y se considera que se han identificado todos los estudios relevantes. Dos autores de la revisión, en varias combinaciones, evaluaron de forma independiente los ensayos para su inclusión en la revisión, evaluaron el riesgo de sesgo y extrajeron los datos para el análisis. Las mayores limitaciones en el proceso de revisión fueron la heterogeneidad entre los ensayos, probablemente relacionada con las características diferentes de los pacientes (diferencias en las afecciones inflamatorias subyacentes, la dosis del corticosteroide y la prevalencia de las fracturas) y que algunos ensayos informaron los resultados pero no proporcionaron los datos de una forma que se pudieran extraer para el metanálisis.
Acuerdos y desacuerdos con otros estudios o revisiones
Los resultados de esta revisión son similares a los informados en la revisión Cochrane de 1999 que evaluó la eficacia de los bisfosfonatos en la osteoporosis inducida por corticosteroides (Homik 1999). Ya que había muy pocos artículos de alta calidad incluidos en la revisión original, esta revisión actualizada incluye datos de sólo dos de los 13 estudios que se incluyeron en la versión original. Por lo tanto, han cambiado las estimaciones del efecto. Aunque la revisión original no fue capaz de establecer los efectos beneficiosos de los bisfosfonato más allá del año o contra las fracturas de columna, los metanálisis en esta revisión actualizada han proporcionado datos concluyentes sobre las medidas anteriores de beneficio.
Una revisión sistemática posterior realizada por el programa Health Technology Assessment del NHS, Kanis 2007, evaluó la efectividad clínica de numerosos tratamientos activos e inactivos para la OPIG. Las medidas de resultado incluyeron la incidencia de fracturas vertebrales, la incidencia de fracturas no vertebrales, los efectos asociados, el cumplimiento y la continuidad. Kanis 2007 incluyó 23 estudios de bisfosfonato, de los que sólo ocho se superpusieron con los 27 estudios de la presente revisión actualizada. Muchos de los estudios de Kanis 2007 no fueron elegibles para inclusión en la presente revisión por utilizar comparadores activos o por incluir participantes en los que el uso de los corticosteroides se asoció con la realización de un trasplante. Kanis 2007 analizó diferentes tipos de bisfosfonatos individualmente y encontró que, en la población que no había recibido trasplante, solamente el risedronato 5 mg/día mostró una reducción estadísticamente significativa de las fracturas vertebrales en comparación con placebo o ningún tratamiento. Ninguna intervención mostró ser beneficiosa para prevenir las fracturas no vertebrales. En los análisis de las fracturas vertebrales de la presente revisión, nueve de los diez estudios utilizaron el alendronato y mostraron una reducción estadísticamente significativa en las fracturas vertebrales.
Hay algunas otras diferencias entre la revisión actualizada y la de Kanis 2007. La presente revisión incluye 14 ensayos de bisfosfonato que no se incluyeron en Kanis 2007 porque la fractura no fue el resultado primario. Los análisis de las fracturas de la presente revisión sólo incluyeron estudios con una detección radiográfica estandarizada de las fracturas vertebrales para asegurar la obtención completa de la incidencia de fracturas, mientras que muchos de los estudios de Kanis 2007 solamente informaron las fracturas sintomáticas. Se sabe que hasta el 65% de las fracturas vertebrales pueden ser asintomáticas (Cooper 1992; Kanis 2007 ). La combinación de todos los tipos de bisfosfonato en los análisis agrupados permite una estimación más sólida del tamaño del efecto. Como muestra el informe de dicha revisión, la mayoría de los estudios sólo lograron resultados estadísticamente significativos en los análisis agrupados.
Las guías actuales de práctica clínica del American College of Rheumatology para las mujeres posmenopáusicas y los hombres de 50 años de edad o más recomiendan el tratamiento con bisfosfonatos para la OPIG según la evaluación de riesgos FRAX (Grossman 2010). El tratamiento con bisfosfonatos se recomienda en los pacientes con bajo riesgo (FRAX < 10% por fractura osteoporótica importante en diez años) en el tratamiento con corticosteroides a una dosis mayor o igual a 7,5 mg/día durante tres meses o más de duración; los pacientes con riesgo moderado (FRAX 10% al 20%) con dosis menores de 7,5 mg/día durante tres meses o más de duración; y los pacientes con alto riesgo (FRAX > 20%) con cualquier dosis y duración del corticosteroide (Grossman 2010). En comparación, las guías de la International Osteoporosis Foundation y la European Calcified Tissue Society para el tratamiento OPIG en las mujeres posmenopáusicas y los hombres de 50 años de edad o más recomiendan que se considere el tratamiento en los pacientes con tratamiento con corticosteroides a una dosis mayor o igual a 7,5 mg/día durante tres meses o más de duración con una fractura previa o en los que son mayores de 70 años de edad (Lekamwasam 2012). En los pacientes sin fracturas previas, menores de 70 años o con dosis de corticosteroides menores de 7,5 mg/día, se recomienda la evaluación FRAX con o sin evaluación de la DMO para guiar de manera adicional la toma de decisiones (Lekamwasam 2012). Este estudio apoya la administración de los bisfosfonatos en los pacientes que comienzan el tratamiento con corticosteroides o que tienen un tratamiento establecido con corticosteroides.

Study flow diagram.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Bisphosphonates vs control: benefits ‐ fractures, Outcome 1 Incident radiographic vertebral fractures 12‐24 months.

Comparison 1 Bisphosphonates vs control: benefits ‐ fractures, Outcome 2 Incident radiographic nonvertebral fractures 12‐24 months.

Comparison 2 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at lumbar spine (LS), Outcome 1 LS BMD change 12 months: all trials.

Comparison 2 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at lumbar spine (LS), Outcome 2 LS BMD change 12 months: oral treatment.
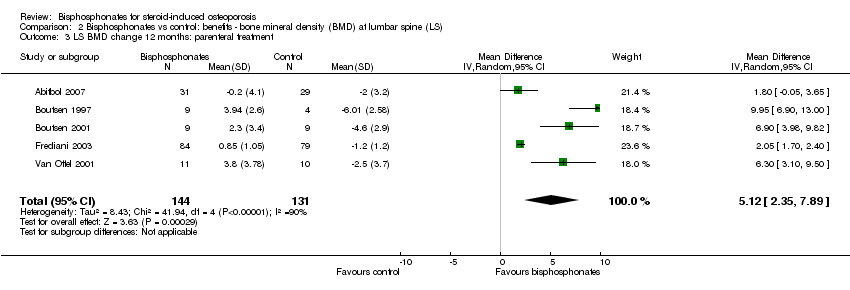
Comparison 2 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at lumbar spine (LS), Outcome 3 LS BMD change 12 months: parenteral treatment.

Comparison 2 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at lumbar spine (LS), Outcome 4 LS BMD change 12 months: low‐ vs standard‐dose.
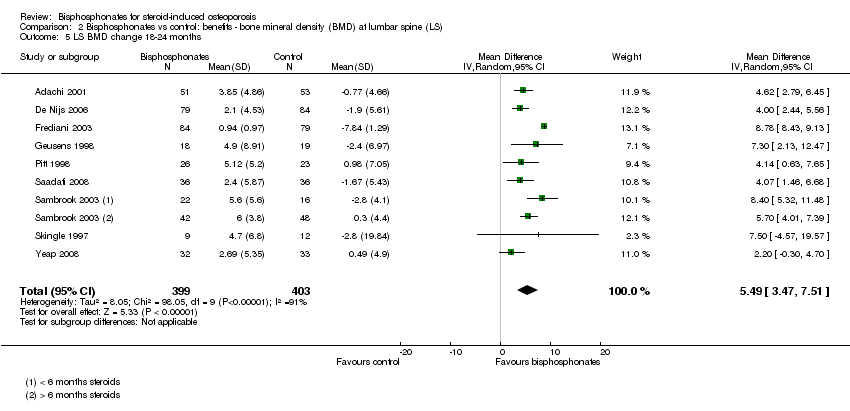
Comparison 2 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at lumbar spine (LS), Outcome 5 LS BMD change 18‐24 months.
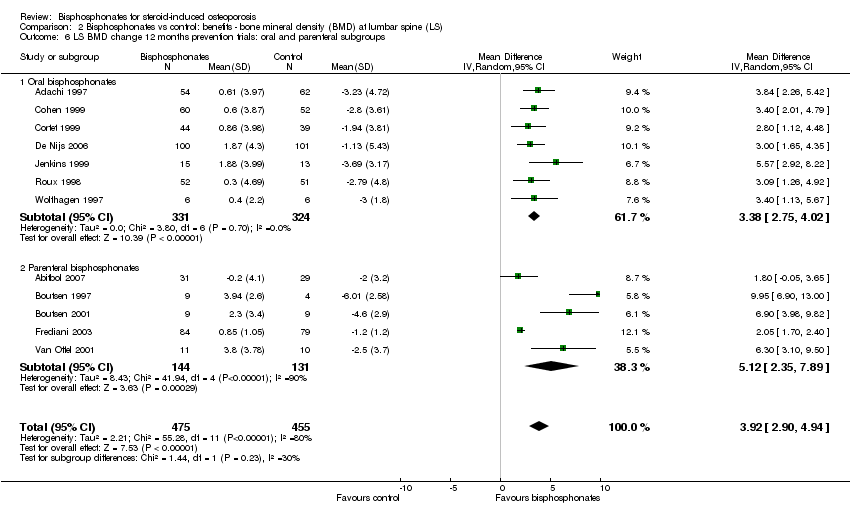
Comparison 2 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at lumbar spine (LS), Outcome 6 LS BMD change 12 months prevention trials: oral and parenteral subgroups.

Comparison 2 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at lumbar spine (LS), Outcome 7 LS BMD change 12 months: gender/menopausal status subgroups.
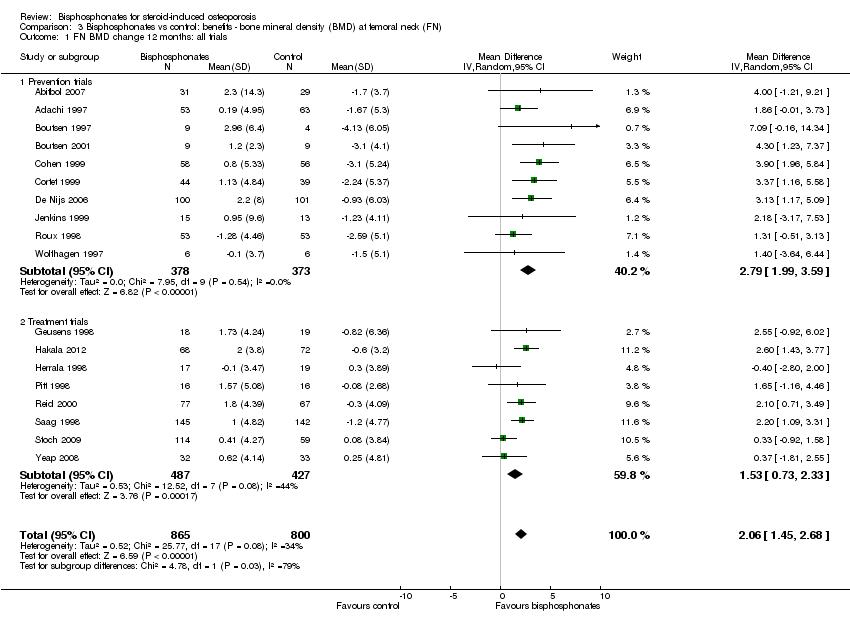
Comparison 3 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at femoral neck (FN), Outcome 1 FN BMD change 12 months: all trials.
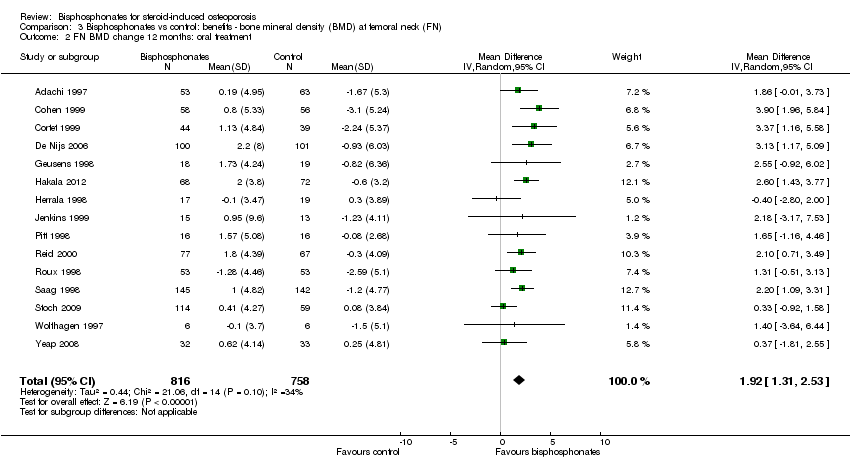
Comparison 3 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at femoral neck (FN), Outcome 2 FN BMD change 12 months: oral treatment.

Comparison 3 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at femoral neck (FN), Outcome 3 FN BMD change 12 months: parenteral treatment.
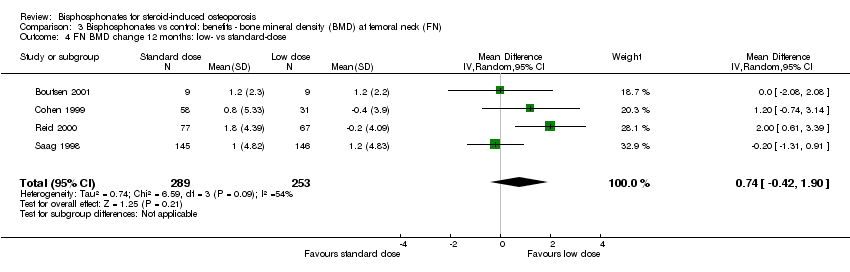
Comparison 3 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at femoral neck (FN), Outcome 4 FN BMD change 12 months: low‐ vs standard‐dose.

Comparison 3 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at femoral neck (FN), Outcome 5 FN BMD change 18‐24 months.

Comparison 3 Bisphosphonates vs control: benefits ‐ bone mineral density (BMD) at femoral neck (FN), Outcome 6 FN BMD change 12 months: gender/menopausal status subgroups.

Comparison 4 Bisphosphonates vs control: harms, Outcome 1 Serious adverse events 12‐24 months.
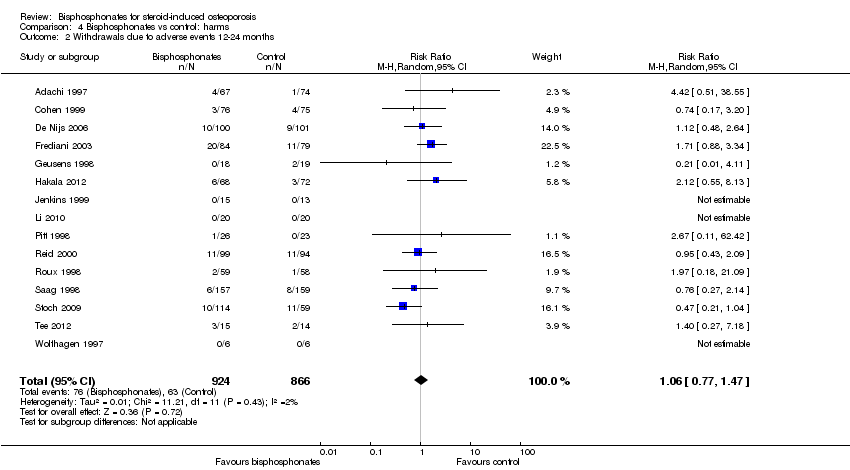
Comparison 4 Bisphosphonates vs control: harms, Outcome 2 Withdrawals due to adverse events 12‐24 months.
| Bisphosphonates (alone or with calcium and/or vitamin D) compared with control (calcium and/or vitamin D and/or placebo) for adults with GIOP | ||||||
| Patient or population: adults with GIOP Settings: ambulatory Intervention: bisphosphonates (alone or with calcium and/or vitamin D) Comparison: control (calcium and/or vitamin D and/or placebo) | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control (calcium and/or vitamin D and/or placebo) | Bisphosphonates (alone or with calcium and/or vitamin D) | |||||
| Incident vertebral fractures Radiographic follow‐up: 12‐24 months | 77 per 1000 | 44 per 1000 | RR 0.57 (0.35 to 0.91) RD ‐0.02 (‐0.05 to 0.01) | 1343 | ⊕⊕⊕⊕ | Absolute increased benefit 2% fewer people with fractures using bisphosphonates (95% CI 5.00% fewer to 1.00% more) Relative per cent change 43% improvement with bisphosphonates (95% CI 9.00% to 65.00% better) NNTB = 31 (95% CI 20 to 145) |
| Incident nonvertebral fractures Radiographic follow‐up: 12‐24 months | 55 per 1000 | 42 per 1000 | RR 0.79 (0.47 to 1.33) RD ‐0.01 (‐0.04 to 0.01) | 1245 | ⊕⊕⊝⊝ due to risk of bias and imprecision | Absolute increased benefit 1% fewer people with fractures using bisphosphonates (95% CI 4.00% fewer to 1.00% more) Relative per cent change 21% improvement with bisphosphonates (95% CI 33.00% worse to 53.00% better) NNTB = n/a4 |
| Lumbar spine BMD DEXA follow‐up: 12 months | Mean per cent change in BMD across control groups was ‐3.19% (‐8.08% to 1.70%) from baseline5 | Mean per cent change in BMD from baseline in bisphosphonate groups was 3.50% higher than control groups (2.90% to 4.10% higher) | ‐ | 2042 | ⊕⊕⊕⊝ due to indirectness | Absolute increased benefit 3.50% with bisphosphonates (95% CI 2.90 to 4.10) Relative per cent change 1.10% (95% CI 0.91 to 1.29) with bisphosphonates NNTB = 3 (95% CI 2 to 3) |
| Femoral neck BMD DEXA follow‐up: 12 months | Mean per cent change in BMD across control groups was ‐1.59% (‐10.49% to 7.31%) from baseline 5 | Mean per cent change in BMD from baseline in bisphosphonate groups was 2.06% higher than control groups (1.45% to 2.68% higher) | ‐ | 1665 | ⊕⊕⊕⊝ due to indirectness | Absolute increased benefit 2.06% with bisphosphonates (95% CI 1.45 to 2.68) Relative per cent change 1.29% with bisphosphonates (95% CI 0.91 to 1.69) NNTB = 5 (95% CI 4 to 7) |
| Serious adverse events follow‐up: 12‐24 months | 162 per 1000 | 147 per 1000 | RR 0.91 (0.74 to 1.12) RD 0.00 (‐0.02, 0.02) | 1703 | ⊕⊕⊕⊝ due to risk of bias and imprecision | Absolute increased harm 0% more adverse events with bisphosphonates (95% CI 2.00% fewer to 2.00% more) Relative per cent change 9% improvement with bisphosphonates (95% CI 12.00% worse to 26.00% better) NNTH = n/a4 |
| Withdrawals due to adverse events follow‐up: 12‐24 months | 73 per 1000 | 77 per 1000 | RR 1.06 (0.77 to 1.47) RD 0.01 (‐0.01 to 0.03) | 1790 | ⊕⊕⊕⊝ due to risk of bias and imprecision | Absolute increased harm 1% more withdrawals with bisphosphonates (95% CI 1.00% fewer to 3.00% more) Relative per cent change 6% worsening with bisphosphonates (95% CI 47.00% worse to 23.00% better) NNTH = n/a4 |
| Quality of life | 0 per 1000 | 0 per 1000 | Not estimable | (0 studies) | This outcome was not assessed by any of the trials | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Vertebral fractures meet calculated OIS threshold of 1174 (calculation not shown ‐ Brant 2014) 2Downgraded for risk of bias: nonvertebral fractures were a patient‐reported, subjective outcome 3Downgraded for imprecision: total sample size is below calculated optimal information size (OIS) (calculations not shown ‐ Brant 2014) and the 95% confidence interval around the pooled estimate of effect includes both the possibility of no effect and appreciable benefit or harm 4Number needed to treat for an additional beneficial outcome (NNTB) or number needed to treat for an additional harmful outcome (NNTH) is not applicable when result is not statistically significant 5We calculated mean baseline risk for the control group in RevMan using generic inverse variance (calculations not shown) 6Most heterogeneity explained through sensitivity analyses 7Downgraded for indirectness: bone density is a surrogate marker for fracture risk 8Clinically relevant change in BMD: the natural history of participants starting steroid therapy based on control arms in our prevention trials is to see a 1%‐6% decrease in lumbar spine BMD and 1%‐4% decrease in femoral neck BMD in the first year of treatment. We have used an SMD of 0.5 as an estimate of the minimal clinically important difference for BMD change to calculate the NNTB (Schünemann 2011b) 9Downgraded for risk of bias: the protocols for the collection of harm data in a large number of trials were unclear | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Incident radiographic vertebral fractures 12‐24 months Show forest plot | 12 | 1343 | Risk Ratio (M‐H, Random, 95% CI) | 0.57 [0.35, 0.91] |
| 2 Incident radiographic nonvertebral fractures 12‐24 months Show forest plot | 9 | 1245 | Risk Ratio (M‐H, Random, 95% CI) | 0.79 [0.47, 1.33] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 LS BMD change 12 months: all trials Show forest plot | 23 | 2042 | Mean Difference (IV, Random, 95% CI) | 3.50 [2.90, 4.10] |
| 1.1 Prevention trials | 12 | 930 | Mean Difference (IV, Random, 95% CI) | 3.92 [2.90, 4.94] |
| 1.2 Treatment trials | 11 | 1112 | Mean Difference (IV, Random, 95% CI) | 3.19 [2.64, 3.73] |
| 2 LS BMD change 12 months: oral treatment Show forest plot | 18 | 1767 | Mean Difference (IV, Random, 95% CI) | 3.25 [2.88, 3.63] |
| 3 LS BMD change 12 months: parenteral treatment Show forest plot | 5 | 275 | Mean Difference (IV, Random, 95% CI) | 5.12 [2.35, 7.89] |
| 4 LS BMD change 12 months: low‐ vs standard‐dose Show forest plot | 5 | 642 | Mean Difference (IV, Random, 95% CI) | 0.95 [0.37, 1.53] |
| 5 LS BMD change 18‐24 months Show forest plot | 9 | 802 | Mean Difference (IV, Random, 95% CI) | 5.49 [3.47, 7.51] |
| 6 LS BMD change 12 months prevention trials: oral and parenteral subgroups Show forest plot | 12 | 930 | Mean Difference (IV, Random, 95% CI) | 3.92 [2.90, 4.94] |
| 6.1 Oral bisphosphonates | 7 | 655 | Mean Difference (IV, Random, 95% CI) | 3.38 [2.75, 4.02] |
| 6.2 Parenteral bisphosphonates | 5 | 275 | Mean Difference (IV, Random, 95% CI) | 5.12 [2.35, 7.89] |
| 7 LS BMD change 12 months: gender/menopausal status subgroups Show forest plot | 5 | 840 | Mean Difference (IV, Random, 95% CI) | 3.86 [2.03, 5.68] |
| 7.1 Men | 4 | 221 | Mean Difference (IV, Random, 95% CI) | 3.58 [2.68, 4.48] |
| 7.2 Premenopausal women | 5 | 154 | Mean Difference (IV, Random, 95% CI) | 3.51 [1.50, 5.53] |
| 7.3 Postmenopausal women | 5 | 465 | Mean Difference (IV, Random, 95% CI) | 4.41 [0.65, 8.18] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 FN BMD change 12 months: all trials Show forest plot | 18 | 1665 | Mean Difference (IV, Random, 95% CI) | 2.06 [1.45, 2.68] |
| 1.1 Prevention trials | 10 | 751 | Mean Difference (IV, Random, 95% CI) | 2.79 [1.99, 3.59] |
| 1.2 Treatment trials | 8 | 914 | Mean Difference (IV, Random, 95% CI) | 1.53 [0.73, 2.33] |
| 2 FN BMD change 12 months: oral treatment Show forest plot | 15 | 1574 | Mean Difference (IV, Random, 95% CI) | 1.92 [1.31, 2.53] |
| 3 FN BMD change 12 months: parenteral treatment Show forest plot | 3 | 91 | Mean Difference (IV, Random, 95% CI) | 4.56 [2.07, 7.05] |
| 4 FN BMD change 12 months: low‐ vs standard‐dose Show forest plot | 4 | 542 | Mean Difference (IV, Random, 95% CI) | 0.74 [‐0.42, 1.90] |
| 5 FN BMD change 18‐24 months Show forest plot | 9 | 802 | Mean Difference (IV, Random, 95% CI) | 3.28 [1.70, 4.87] |
| 6 FN BMD change 12 months: gender/menopausal status subgroups Show forest plot | 4 | 537 | Mean Difference (IV, Random, 95% CI) | 3.29 [1.65, 4.94] |
| 6.1 Men | 3 | 134 | Mean Difference (IV, Random, 95% CI) | 2.91 [1.15, 4.68] |
| 6.2 Premenopausal women | 4 | 88 | Mean Difference (IV, Random, 95% CI) | 2.70 [‐0.96, 6.35] |
| 6.3 Postmenopausal women | 4 | 315 | Mean Difference (IV, Random, 95% CI) | 3.62 [‐0.37, 7.61] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Serious adverse events 12‐24 months Show forest plot | 15 | 1703 | Risk Ratio (M‐H, Random, 95% CI) | 0.91 [0.74, 1.12] |
| 2 Withdrawals due to adverse events 12‐24 months Show forest plot | 15 | 1790 | Risk Ratio (M‐H, Random, 95% CI) | 1.06 [0.77, 1.47] |

