Prebióticos para prevenir la hiperbilirrubinemia en recién nacidos
Resumen
Antecedentes
La hiperbilirrubinemia ocurre en aproximadamente dos tercios de todos los recién nacidos durante los primeros días de vida y con frecuencia se trata con fototerapia. Aunque por lo general se considera segura, existe una creciente preocupación con respecto a la fototerapia y sus efectos potencialmente dañinos sobre el ADN y el aumento de los efectos secundarios, en particular para los recién nacidos prematuros. Otros métodos, como la administración de suplementos de alimentación enteral con prebióticos, pueden tener un uso efectivo en el tratamiento de la hiperbilirrubinemia en los recién nacidos.
Objetivos
Determinar si la administración de prebióticos reduce la incidencia de hiperbilirrubinemia entre los recién nacidos a término y prematuros, en comparación con la administración de suplementos enterales de leche con agua destilada/placebo o con ningún suplemento.
Métodos de búsqueda
Se utilizó la estrategia de búsqueda estándar del Grupo Cochrane de Neonatología en el Registro Cochrane Central de Ensayos Controlados (CENTRAL 2018, número 5), MEDLINE vía PubMed (1966 hasta 14 de junio 2018), Embase (1980 hasta 14 de junio 2018) y en CINAHL (1982 hasta 14 de junio 2018). También se buscaron ensayos controlados aleatorios (ECA) y cuasialeatorios en las bases de datos de ensayos clínicos, los resúmenes de congresos y las listas de referencias de artículos recuperados.
Criterios de selección
Se consideraron todos los ECA que estudiaron recién nacidos que compararon la administración de suplementos de alimentación enteral con prebióticos versus agua destilada/placebo o ninguna administración de suplementos.
Obtención y análisis de los datos
Dos autores de revisión examinaron los trabajos y extrajeron los datos de los seleccionados. Para combinar los efectos de los estudios que eran suficientemente similares, se utilizó un método de efectos fijos. Se utilizaron los criterios GRADE para evaluar la calidad de la evidencia.
Resultados principales
En esta revisión se incluyeron tres estudios pequeños que evaluaron 154 recién nacidos. Un estudio informó de una reducción significativa del riesgo de hiperbilirrubinemia y de la tasa de tratamiento con fototerapia asociada con la administración de suplementos enterales con prebióticos (cociente de riesgos [CR] 0,75; intervalo de confianza [IC] del 95%: 0,58 a 0,97; un estudio, 50 recién nacidos; evidencia de calidad baja). Los metanálisis de dos estudios no mostraron diferencias significativas en los niveles máximos de bilirrubina no conjugada en plasma en los recién nacidos con la administración de suplementos prebióticos (diferencia de medias[DM] 0,14 mg/dl; IC del 95%: ‐0,91 a 1,20; I² = 81%; P = 0,79; dos estudios, 78 recién nacidos; evidencia de calidad baja). No hubo evidencia de una diferencia significativa en la duración de la fototerapia entre los grupos de prebióticos y control, que solo se informó en un estudio (DM 0,10 días; IC del 95%: ‐2,00 a 2,20; un estudio, 50 recién nacidos; evidencia de calidad baja). Los metanálisis de dos estudios demostraron una reducción significativa en la duración de la estancia hospitalaria (DM ‐10,57 días; IC del 95%: ‐17,81 a ‐3,33; dos estudios, 78 recién nacidos; I² = 0%; p = 0,004; evidencia de calidad baja). El metanálisis de los tres estudios mostró un aumento significativo en la frecuencia de las deposiciones en los grupos prebióticos (DM 1,18; IC del 95%: 0,90 a 1,46; I² = 90%; tres estudios, 154 recién nacidos; evidencia de calidad alta). No se informaron diferencias significativas en la mortalidad durante la estancia hospitalaria después de la administración de suplementos enterales con prebióticos (CR típico 0,94; IC del 95%: 0,14 a 6,19; I² = 6%; p = 0,95; 2 estudios; 78 recién nacidos; evidencia de calidad baja). No hubo informes de necesidad de exanguinotransfusión e incidencia de encefalopatía bilirrubínica aguda, encefalopatía bilirrubínica crónica y discapacidad importante del desarrollo neurológico en los estudios incluidos. Ninguno de los estudios incluidos informó sobre efectos secundarios.
Conclusiones de los autores
Los estudios actuales no pueden aportar evidencia fiable acerca de la efectividad de los prebióticos en la hiperbilirrubinemia. Se deben realizar ECA adicionales grandes y bien diseñados en recién nacidos que comparen los efectos de la administración de suplementos enterales con prebióticos sobre la hiperbilirrubinemia neonatal versus la administración de suplementos de leche con cualquier otro placebo (en particular agua destilada), o con ningún suplemento.
PICO
Resumen en términos sencillos
Prebióticos para prevenir la hiperbilirrubinemia en recién nacidos
Pregunta de la revisión: ¿Los prebióticos previenen la hiperbilirrubinemia (niveles elevados de bilirrubina que lleva a ictericia) en los recién nacidos?
Antecedentes: La ictericia ocurre en cerca de dos tercios de todos los recién nacidos durante los primeros días de vida. La fototerapia se utiliza comúnmente para el tratamiento de la ictericia neonatal. La fototerapia no parece causar efectos secundarios graves, pero recientemente algunos ensayos clínicos han planteado preocupaciones basadas en estudios de cultivos de animales o células con respecto a su potencial para dañar el ADN. Por lo tanto, se están considerando otros tipos de tratamiento para la ictericia neonatal. Cierta evidencia indica que la administración de suplementos alimentarios enterales con prebióticos reduce la ictericia en los recién nacidos.
Características de los estudios: Se incluyeron tres estudios pequeños (con 154 recién nacidos) que compararon los efectos de la administración de suplementos alimentarios con prebióticos sobre la ictericia neonatal versus placebo (como agua destilada). La evidencia está actualizada hasta el 14 de junio 2018.
Resultados clave: No existe evidencia adecuada para evaluar la efectividad de los prebióticos sobre la ictericia neonatal. Según los datos disponibles, la incidencia de hiperbilirrubinemia neonatal (evidencia de calidad baja) y el tratamiento con fototerapia (evidencia de calidad baja) se redujeron mediante la administración de suplementos alimentarios con prebióticos, pero solo un estudio pequeño informó sobre estos resultados.
Los metanálisis de estos estudios pequeños demostraron una reducción significativa de la duración de la estancia hospitalaria (evidencia de calidad baja) y un aumento significativo de la frecuencia de las deposiciones (evidencia de calidad alta) en los recién nacidos con la administración de suplementos prebióticos versus placebo. Además, los metanálisis no mostraron diferencias significativas en los niveles máximos de bilirrubina plasmática (evidencia de calidad baja), la duración de la fototerapia (evidencia de calidad baja) y la mortalidad neonatal (evidencia de calidad baja) entre los grupos. La revisión solo encontró tres ensayos clínicos aleatorios que compararon la administración de suplementos prebióticos con placebo. Se necesita más investigación.
Conclusiones de los autores
Summary of findings
| Feeding supplementation with prebiotics compared to no prebiotics for the prevention of hyperbilirubinaemia in neonates | ||||||
| Patient or population: Neonates, including term neonates (gestational age ≥ 37 weeks), late preterm neonates (35 to 37 weeks' gestation) and preterm neonates (< 35 weeks' gestation) | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with no prebiotics | Risk with Feeding supplementation with prebiotics | |||||
| Incidence of hyperbilirubinaemia | Study population | RR 0.75 | 50 | ⊕⊕⊝⊝ | ||
| 960 per 1,000 | 720 per 1,000 | |||||
| Maximum plasma unconjugated bilirubin levels; | The mean maximum plasma unconjugated bilirubin levels; ranged from 7.6 to 8.1 mg/dL | MD 0.14 mg/dL higher | ‐ | 78 | ⊕⊕⊝⊝ | |
| Treatment with phototherapy | Study population | RR 0.75 | 50 | ⊕⊕⊝⊝ | ||
| 960 per 1,000 | 720 per 1,000 | |||||
| Stool frequency | The mean stool frequency; ranged from 1 to 3 | MD 1.18 higher | ‐ | 154 | ⊕⊕⊕⊕ | |
| Duration of phototherapy (days) | The mean duration of phototherapy (days); ranged from 2 to 3 days | MD 0.1 days higher | ‐ | 28 | ⊕⊕⊝⊝ | |
| Length of hospital stay (days) | The mean length of hospital stay (days); ranged from 29 to 72 days | MD 10.57 days lower | ‐ | 78 | ⊕⊕⊝⊝ | |
| Neonatal mortality | Study population | RR 0.94 | 78 | ⊕⊕⊝⊝ | ||
| 26 per 1,000 | 25 per 1,000 | |||||
| Acute bilirubin encephalopathy (encephalopathy) | Study population | not estimable | (0 RCTs) | ‐ | None of the included studies showed any acute bilirubin encephalopathy. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Exchange transfusion (exchange) | Study population | not estimable | (0 RCTs) | ‐ | There were no reports of the need for exchange transfusion in included studies. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Chronic bilirubin encephalopathy or kernicterus (kernicterus) | Study population | not estimable | (0 RCTs) | ‐ | There were no reports of the incidence of chronic bilirubin encephalopathy in included studies. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Major neurodevelopmental disability | Study population | not estimable | (0 RCTs) | ‐ | Major neurodevelopmental disability was not reported in any of the included studies. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Side effects | Study population | not estimable | (0 RCTs) | ‐ | No side effects were reported in any of the included studies. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| a Downgraded one level due to high risk of performance bias b Downgraded one level due to uncertainty about precision (one study) c Downgraded one level due to uncertainty about precision (small study) d Downgraded one level due to unclear risk of attrition bias (incomplete outcome data) | ||||||
Antecedentes
Descripción de la afección
La hiperbilirrubinemia ocurre en aproximadamente dos tercios de todos los recién nacidos durante los primeros días de vida (Lauer 2011). Por lo general las elevaciones leves en los niveles de bilirrubina no tienen efectos secundarios graves, aparte de la ictericia reconocible (Maisels 2008).
La patogénesis de la ictericia en los recién nacidos prematuros es similar a la de los recién nacidos a término, pero debido a la prematuridad del hígado y del tracto gastrointestinal la hiperbilirrubinemia puede ser más peligrosa durante el período prematuro tardío (Maisels 2012). Además, debido a las complicaciones relacionadas con la prematuridad, la alimentación enteral en los recién nacidos prematuros tardíos a veces se retrasa. Este hecho puede limitar a su vez el flujo intestinal y la colonización bacteriana, lo que da lugar a una circulación enterohepática más efectiva y, por lo tanto, a una bilirrubina sérica alta (Gartner 2001). La complicación principal de la hiperbilirrubinemia (el kernícterus, o encefalopatía inducida por bilirrubina) puede ocurrir cuando existen niveles altos de bilirrubina. La hemólisis grave y ciertas enfermedades (por ejemplo, la enfermedad hemolítica isoinmune, la deficiencia de glucosa‐6‐fosfato (G6PD), la asfixia, la sepsis, la acidosis y la hipoalbuminemia) son factores de riesgo para el kernícterus (Maisels 2009). Esta devastadora disfunción neurológica puede causar discapacidades permanentes en el desarrollo neurológico (Xiong 2011). Aunque hoy en día el kernícterus se observa en muy pocas ocasiones como resultado de una fototerapia agresiva temprana, todavía ocurre (Kaplan 2011). La ictericia neonatal puede causar preocupación a los padres y puede aumentar los costos hospitalarios debido a los reingresos en el hospital (Burke 2009). Por lo tanto, el tratamiento adecuado y oportuno de la hiperbilirrubinemia tiene una importancia fundamental.
Las recomendaciones actuales para el tratamiento de la hiperbilirrubinemia neonatal se centran en determinar los niveles de bilirrubina específicos para la edad antes de iniciar la fototerapia (Maisels 2012). La fototerapia no parece causar efectos secundarios graves, pero recientemente algunos ensayos clínicos han planteado preocupaciones basadas en estudios de cultivos animales o celulares sobre su potencial para dañar el ADN (Cetinkursun 2005; Ramy 2016; Roll 2005; Rosenstein 1984; Tatli 2008; Yahia 2014). Los investigadores han observado que la hiperbilirrubinemia no influyó en el daño del ADN y la apoptosis, mientras que la fototerapia (convencional e intensiva) se asoció con daño del ADN en recién nacidos a término (Ramy 2016; Tatli 2008; Yahia 2014) y la apoptosis inducida en linfocitos de sangre periférica (Yahia 2014). Por lo tanto, se necesitan otros tipos de tratamiento para la hiperbilirrubinemia, en lugar de la fototerapia sola.
El aumento de la circulación enterohepática de la bilirrubina tiene un papel conocido en la incidencia de la ictericia neonatal (Sato 2013), y las intervenciones que reducen la circulación enterohepática de la bilirrubina pueden ser beneficiosas, ya que reducen la producción de bilirrubina.
Se observa que los prebióticos tienen efectos favorables sobre el ciclo enterohepático, que incluyen una mejor motilidad gastrointestinal y una mejor frecuencia y viscosidad de las heces (Indrio 2009; Westerbeek 2011). Por lo tanto, se ha planteado la hipótesis de que con la suplementación de la alimentación enteral con prebióticos durante la circulación enterohepática (cuando la bilirrubina circula dentro del intestino), menos bilirrubina conjugada se convierte en bilirrubina no conjugada, lo que da lugar a una mejoría en el estado de hiperbilirrubinemia y a una reducción de la ictericia entre los recién nacidos. Es de señalar que el mecanismo exacto de acción de los prebióticos sobre la hiperbilirrubinemia y el tiempo que tardan los prebióticos en retrasar la aparición de la ictericia neonatal aún están poco claros.
Descripción de la intervención
Los prebióticos son “componentes alimentarios no digeribles que benefician al huésped al estimular de manera selectiva el crecimiento o la actividad de una o un número limitado de bacterias en el colon, y mejoran así la salud del huésped“ (Gibson 1995). Los oligosacáridos son el arquetipo más común de prebióticos. La lactulosa y la inulina son otros tipos de prebióticos.
La intervención seleccionada consiste en la “administración enteral de suplementos con cualquier tipo de prebióticos“. Los prebióticos pueden tomar la forma de galacto‐oligosacáridos (GOS), fructo‐oligosacáridos (FOS), oligosacáridos ácidos (OSA), lactulosa o inulina. Los prebióticos utilizados con mayor frecuencia son los oligosacáridos (Srinivasjois 2013), que se encuentran en la leche materna humana (Armanian 2014; Srinivasjois 2013). Suelen consistir en una mezcla de carbohidratos de cadena corta (con un grado de polimerización entre 2 y 60) con carbohidratos de cadena larga (9:1) que no son digeribles por el sistema digestivo de los recién nacidos (Cummings 2002). Por lo general los oligosacáridos se administran en una dosis de 0,5 a 1,5 g/kg/d iniciada en el día dos a diez después del nacimiento, añadida a la leche enteral neonatal. El agua destilada rara vez tiene efecto sobre la ictericia neonatal. Por lo tanto, para eliminar los efectos de confusión de los diferentes tipos de placebo, el uso de agua destilada es la mejor forma de placebo.
Como hay un número limitado de artículos disponibles para el uso de agua destilada, se comparó la suplementación enteral de prebióticos agregados a la leche versus agua destilada, otras formas de placebo o ninguna suplementación. Los ensayos incluidos en esta revisión debían haber continuado durante al menos siete días. Para el tratamiento de la ictericia neonatal, todos los recién nacidos de ambos grupos recibieron tratamiento según el protocolo de fototerapia descrito en las guías de la American Academy of Pediatrics 2004.
De qué manera podría funcionar la intervención
La literatura indica efectos positivos de los prebióticos sobre los resultados neonatales como la motilidad gastrointestinal, la frecuencia y viscosidad de las heces, la tolerancia enteral y la enterocolitis necrotizante (EN) (Armanian 2014; Indrio 2009; Modi 2010; Srinivasjois 2013; Westerbeek 2011). Los prebióticos estimulan principalmente el crecimiento rápido de bacterias beneficiosas en el colon (Armanian 2016; Cummings 2002; Oozeer 2013; Sherman 2009). Los oligosacáridos representan un tipo de prebióticos en el intestino que son descompuestos por la flora microbiana en ácidos grasos de cadena corta, hidrógeno y dióxido de carbono. Los ácidos grasos de cadena corta tienen un efecto laxante leve porque reducen el nivel de pH de las heces, haciéndolas más ácidas (Rao 2009), y cambian así la consistencia de las heces y la frecuencia de la defecación. Lo anterior podría ser beneficioso para prevenir la producción de bilirrubina por la circulación enterohepática. A medida que los prebióticos entran en el sistema gastrointestinal, la circulación enterohepática de la bilirrubina rota lentamente con una mejor y más rápida evacuación gastrointestinal. Cuando la bilirrubina se elimina con mayor rapidez del sistema gastrointestinal, la oportunidad de conversión de la bilirrubina conjugada en bilirrubina no conjugada se reduce y, por lo tanto, se produce menos ictericia. Por lo tanto, la administración de suplementos con prebióticos puede reducir la producción de bilirrubina no conjugada. Por otro lado, el agua destilada rara vez tiene un efecto sobre la ictericia neonatal y puede ser el placebo de preferencia.
Por qué es importante realizar esta revisión
Las preocupaciones sobre el uso de la fototerapia se relacionan con sus efectos potencialmente dañinos sobre el ADN (Ramy 2016; Tatli 2008; Yahia 2014) y el aumento de la mortalidad entre los recién nacidos a término y en particular los prematuros (Tyson 2012), cuando se utiliza de manera intensiva. Los investigadores han evaluado otros métodos, como la administración de prebióticos, para el tratamiento de la hiperbilirrubinemia en los recién nacidos. Sin embargo, hasta donde se conoce ninguna revisión ha evaluado la repercusión de los prebióticos sobre la hiperbilirrubinemia neonatal.
Hasta la fecha solo tres estudios han examinado los efectos de los prebióticos sobre la hiperbilirrubinemia neonatal (Armanian 2015; Bisceglia 2009; Riskin 2010). En dos de estos estudios, los niveles más bajos de bilirrubina detectados por la bilirrubinometría transcutánea se asociaron con la administración de suplementos con oligosacáridos en la alimentación enteral (Armanian 2015; Bisceglia 2009). Por otro lado, se ha encontrado que las colonias de lactobacilos y bifidobacterias dentro del intestino no pueden convertir la bilirrubina en productos excretorios (Bisceglia 2009), y algunos investigadores han observado que el Clostridium (un microorganismo patógeno que se puede reducir con los prebióticos) puede convertir la bilirrubina en derivados excretorios no tóxicos (Konickova 2012; Petit 1999; Vitek 2006). Por lo tanto, la administración de suplementos con oligosacáridos en la alimentación enteral puede dar lugar a un aumento inesperado en la conversión de la bilirrubina en productos reciclables. Por consiguiente, los investigadores están interesados en discernir los efectos de los prebióticos sobre la hiperbilirrubinemia neonatal.
En resumen, la bibliografía no es consistente en cuanto a los efectos de la administración de suplementos alimentarios con prebióticos sobre la hiperbilirrubinemia neonatal. Esta revisión puede arrojar luz sobre los ensayos clínicos que investigan los efectos de los prebióticos en la hiperbilirrubinemia neonatal.
Objetivos
Determinar si la administración de prebióticos reduce la incidencia de hiperbilirrubinemia y encefalopatía bilirrubínica en los recién nacidos a término y prematuros en comparación con la administración de suplementos enterales de leche con agua destilada/placebo o con ningún suplemento.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron los ensayos controlados aleatorios (ECA) que compararon la administración de suplementos de alimentación enteral con prebióticos versus agua destilada/placebo o ninguna administración de suplementos.
La alimentación podía ser enteral o los recién nacidos podían recibir nutrición parenteral.
Tipos de participantes
Se incluyeron todos los estudios que reclutaron recién nacidos y los clasificaron en tres grupos: recién nacidos a término (edad gestacional ≥ 37 semanas); recién nacidos prematuros tardíos (35 a < 37 semanas de gestación); y recién nacidos prematuros (< 35 semanas de gestación). Se excluyeron todos los estudios que reclutaron recién nacidos con las siguientes afecciones: asfixia, anomalías congénitas graves, isoinmunización Rh, deficiencia de G6PD, errores congénitos, sepsis u otra infección comprobada, cefalohematoma y hemorragia subgaleal. También se excluyeron los recién nacidos que recibían administración de suplementos de alimentación enteral con fórmulas específicas, probióticos o zinc.
Tipos de intervenciones
La intervención en estudio es la administración de suplementos de alimentación enteral con prebióticos durante los primeros diez días de vida. Los prebióticos se pueden suministrar en forma de galacto‐oligosacáridos (GOS), fructo‐oligosacáridos (FOS), oligosacáridos ácidos (OSA), lactulosa o inulina. Se incluyeron los estudios que iniciaron la administración de suplementos con prebióticos entre el segundo y el décimo día de vida en una dosis de 0,5 a 1,5 g/kg/día, con concentraciones de 1% y 0,8 g/día para oligosacáridos, lactulosa e inulina. Para eliminar los efectos de confusión de los prebióticos en los recién nacidos que reciben leche materna y fórmula, se incluyeron los estudios que agregaron estos compuestos a la alimentación enteral neonatal. Se incluyeron estudios de tres tipos: ensayos que agregaron prebióticos a la leche materna en recién nacidos alimentados únicamente con leche materna; ensayos que agregaron prebióticos a la fórmula en recién nacidos alimentados con biberón, y ensayos que proporcionaron formas mixtas (es decir, que agregaron prebióticos a la leche materna y a la fórmula). Los investigadores compararon las intervenciones versus la suplementación enteral de leche con agua destilada/placebo o ninguna suplementación. En esta revisión solo se incluyeron los ensayos que continuaron durante al menos siete días. Para el tratamiento de la ictericia neonatal, todos los recién nacidos de ambos grupos recibieron tratamiento según las guías de la American Academy of Pediatrics 2004.
Tipos de medida de resultado
Resultados primarios
-
Hiperbilirrubinemia neonatal: incidencia de hiperbilirrubinemia en cualquier momento durante los primeros diez días de vida, considerada como la medida de resultado primaria. La hiperbilirrubinemia se define como sigue:
-
-
para los recién nacidos a término y prematuros tardíos (edad gestacional ≥ 35 semanas) como nivel de bilirrubina total (BT) elegible para fototerapia, como se describe en las guías de la American Academy of Pediatrics 2004 (Figura 1), o como nivel absoluto de BT ≥ 15 mg/dl; y
-
para los recién nacidos prematuros (< 35 semanas de gestación) como nivel de BT elegible para fototerapia, como se describe en las guías de la American Academy of Pediatrics 2004 (Figura 2), o como nivel absoluto de BT > 1% del peso corporal.
-
-
Encefalopatía bilirrubínica aguda: definida como un síndrome clínico, en presencia de hiperbilirrubinemia grave, que va desde la fase inicial de letargo, hipotonía, reducción del movimiento y la succión y succión deficiente, hasta la fase avanzada de estupor profundo, hipertonía, incapacidad para alimentarse y llanto agudo o convulsiones (Canadian Pediatric Society 2007).
Resultados secundarios
-
Niveles máximos de bilirrubina no conjugada en plasma (en cualquier momento durante el período de estudio)
-
Tratamiento con fototerapia
-
Duración de la fototerapia (días)
-
Exanguinotransfusión: recepción de cualquier exanguinotransfusión (volumen simple o doble)
-
Encefalopatía bilirrubínica crónica o kernícterus: definida por una tétrada de parálisis cerebral coreoatetoide, pérdida auditiva neurosensorial de alta frecuencia, parálisis de la mirada vertical e hipoplasia del esmalte dental evaluadas a los seis meses de edad corregida (Okumura 2009)
-
Frecuencia de las heces: número total de defecaciones registradas al día durante la intervención
-
Duración de la estancia hospitalaria (días)
-
Mortalidad neonatal
-
Grave discapacidad del neurodesarrollo
-
Principales discapacidades del neurodesarrollo consideradas
-
Parálisis cerebral
-
Retraso del desarrollo o deficiencia intelectual
-
-
Evaluación de Bayley o Griffith más de dos desviaciones estándar (DE) por debajo de la media, o una deficiencia intelectual (IQ) > 2 DE por debajo de la media
-
Desarrollo neuromotor (Bayley Scales of Infant Development ‐ Psychomotor Development Index [BSID PDI]) evaluado en los supervivientes
-
Desarrollo mental (Bayley Scales of Infant Development ‐ Psychomotor Development Index [BSID PDI]) evaluado en los supervivientes
-
Ceguera/visión (< 6/60 en ambos ojos)
-
Sordera neurosensorial que requiere amplificación
-
-
La revisión evaluó estos componentes de los resultados a largo plazo para todos los estudios que evaluaron a los niños después de los 18 meses de edad cronológica. Los autores de revisión consideraron análisis separados para niños de 18 a 24 meses de vida y de tres a cinco años de edad.
-
-
Efectos secundarios: diarrea (heces > 40 g/kg/día) y deshidratación (pérdida de peso > 10% al nacer) registrados durante la intervención
Métodos de búsqueda para la identificación de los estudios
We used the criteria and standard methods of Cochrane and Cochrane Neonatal.
Búsquedas electrónicas
We conducted a comprehensive search including: Cochrane Central Register of Controlled Trials (CENTRAL 2018, Issue 5) in the Cochrane Library; MEDLINE via PubMed (1966 to 14 June 2018); Embase (1980 to 14 June 2018); and CINAHL (1982 to 14 June 2018). We used the following search terms: (hyperbilirubinaemia [MeSH] OR jaundice[MeSH] OR (hyperbilirubinemia OR hyperbilirubinaemia OR jaundice OR icter*) AND (prebiotics[MeSH] OR prebiotic* OR oligosaccharides[Mesh] OR oligosaccharides), plus database‐specific limiters for RCTs and neonates (see Appendix 1 for the full search strategies for each database). We did not apply language restrictions.
We searched clinical trials registries for ongoing or recently completed trials (clinicaltrials.gov; the World Health Organization’s International Trials Registry and Platform www.whoint/ictrp/search/en/, and the ISRCTN Registry). We checked Proceedings of the Prenatal Society of Australia and New Zealand (PSANZ ‐ 2005 to 14 June 2018), the Society for Pediatric Research, and the European Society for Paediatric Research (2000 to 14 June 2018).
Búsqueda de otros recursos
We also searched the reference lists of any articles selected for inclusion in this review in order to identify additional relevant articles, and contacted authors of published articles to ask about possible unpublished trials.
Obtención y análisis de los datos
We employed standard methods of the Cochrane Collaboration, as described in the Cochrane Handbook for Systematic Reviews of Interventions, and of the Cochrane Neonatal Review Group (Higgins 2011).
Selección de los estudios
Two review authors (AA and NS) independently checked the titles and abstracts of all studies retrieved through the literature search to identify those that met the inclusion criteria, independently confirmed their eligibility by reviewing the full text of retrieved articles, and resolved disagreements through discussion. We consulted the Cochrane Neonatal Review Group for advice, when necessary.
Extracción y manejo de los datos
We designed a data extraction form and evaluated its validity and reliability before use. At least two review authors independently extracted data and resolved differences in data interpretation with assistance provided by the trial authors. We resolved uncertainties regarding trial information and incomplete or missing data by contacting the trial authors. We entered data into Review Manager (RevMan 5.3) and checked them for accuracy.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (AA and NS) independently assessed the risk of bias (low, high, or unclear) of all included trials using the Cochrane ‘Risk of bias’ tool (Higgins 2011) for the following domains:
-
Sequence generation (selection bias)
-
Allocation concealment (selection bias)
-
Blinding of participants and personnel (performance bias)
-
Blinding of outcome assessment (detection bias)
-
Incomplete outcome data (attrition bias)
-
Selective reporting (reporting bias)
-
Any other bias
Any disagreements were resolved by discussion or by a third assessor. See Appendix 2 for a more detailed description of risk of bias for each domain.
Medidas del efecto del tratamiento
We presented pooled estimates of dichotomous outcomes as risk ratios (RRs) or risk differences (RDs) with corresponding 95% confidence intervals (CIs). For continuous outcomes, we used mean differences (MDs) along with 95% CIs to compare intervention and control groups. When outcomes were measured by different methods or by different scales, we used standardised mean differences (SMDs). If data were missing or incomplete and the RD statistic was statistically significant, we planned to present the number needed to treat for an additional beneficial or harmful outcome (NNTB/NNTH).
Cuestiones relativas a la unidad de análisis
We considered the participating infant as the unit of analysis in clinical trials. We dealt with an approximate analysis as suggested by the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011).
Manejo de los datos faltantes
If clarification of information or missing data was needed, we contacted the relevant study authors. We attempted to contact authors to complete the information about incidence of hyperbilirubinaemia, maximum plasma unconjugated bilirubin level, treatment with phototherapy, duration of phototherapy, length of hospital stay, and neonatal mortality, but unfortunately we did not receive any replies. We excluded from the meta‐analysis studies with a high dropout rate for which we could not obtain appropriate details of missing data and performed a sensitivity analysis to evaluate the impact of exclusion on the results of analysis. Those studies which reported missing data or dropout more than 20% were considered as high level of dropout and excluded from meta‐analysis.
Evaluación de la heterogeneidad
We used the I2 statistic and the following categories to assess for heterogeneity among studies.
-
Less than 25%: no heterogeneity.
-
25% to 49%: low heterogeneity.
-
50% to 74%: moderate heterogeneity.
-
75% or greater: high heterogeneity.
We used Cochran's Chi2 Q test and the associated P value in evaluating heterogeneity. We considered P < 0.1 as an indication of the presence of heterogeneity. We performed a visual assessment to identify obvious overlaps and outliers. In cases of moderate or high heterogeneity, we explored potential sources of heterogeneity by performing sensitivity analysis and subgroup analyses. We intended to use a Galbraith plot for heterogeneity but it was deemed unnecessary.
Evaluación de los sesgos de notificación
We planned to use funnel plots to assess possible reporting or publication bias and conduct Begg and Egger linear tests in evaluating publication bias. For funnel plots to be meaningful, ten or more trials must be included, however, there were insufficient studies to do this.
you planned to do x and y; however, there were insufficient studies to do this
Síntesis de los datos
We applied standard methods of the Cochrane Neonatal Review Group and RevMan 5.3 for meta‐analyses. We used a fixed‐effect method in combining the effects of studies that were sufficiently similar. For estimates of combined risk ratio and risk difference, we used the Mantel‐Haenszel method. We used mean differences (MDs) to combine estimates of quantitative data as reported in clinical trials measuring the same outcome using the same scale. If trials reported outcomes using different scales or measurement methods, we planned to use standardised mean difference (SMDs). We reported risk ratios (RRs) and MDs along with 95% CIs, and based analysis on numbers needed to treat for additional beneficial and harmful outcomes.
Quality of evidence
We used the GRADE approach, as outlined in the GRADE Handbook (Schünemann 2013), to assess the quality of evidence for the following clinically relevant outcomes: neonatal hyperbilirubinaemia, need for phototherapy, exchange transfusion, acute bilirubin encephalopathy/kernicterus, and stool frequency.
Two authors independently assessed the quality of the evidence for each of the outcomes above. We considered evidence from randomised controlled trials as high quality but downgraded the evidence one level for serious, or two levels for very serious, limitations based upon the following: design (risk of bias), consistency across studies, directness of the evidence, precision of estimates, and presence of publication bias. We used the GRADEpro GDT Guideline Development Tool to create a ‘Summary of findings’ table to report the quality of the evidence.
The GRADE approach results in an assessment of the quality of a body of evidence in one of four grades:
-
High: We are very confident that the true effect lies close to that of the estimate of the effect.
-
Moderate: We are moderately confident in the effect estimate; the true effect is likely to be close to the estimate of the effect, but there is a possibility that it is substantially different.
-
Low: Our confidence in the effect estimate is limited; the true effect may be substantially different from the estimate of the effect.
-
Very low: We have very little confidence in the effect estimate; the true effect is likely to be substantially different from the estimate of effect
Análisis de subgrupos e investigación de la heterogeneidad
We ran a subgroup analysis based on the following.
-
Gestational age (term neonates (gestational age ≥ 37 weeks), late preterm neonates (35 to 37 weeks' gestation), preterm neonates (< 35 weeks' gestation)).
-
Birth weight (≥ 2500 grams, 1500 to 2500 grams, < 1500 grams).
-
Type of prebiotic (oligosaccharide, lactulose, inulin).
-
Type of feeding (only breast milk‐fed infants, only formula‐fed infants, infants given a mixed form of feeding).
-
Duration of supplementation (≥ 7 days, < 7 days).
Análisis de sensibilidad
We planned to perform sensitivity analyses based on both outcomes and baseline characteristics to assess the impact of bias on the results of the meta‐analysis; however, there was no need to use the sensitivity analyses because none of the included studies had a high risk of bias.
Results
Description of studies
Results of the search
Overall, 85 records were identified through our search, of which 10 articles were assessed for eligibility. Of these, only three studies met the inclusion criteria (Figure 3).

Study flow diagram.
Included studies
Ten potential studies were identified, of which three were included in the review (Figure 3). These are described in detail in the Characteristics of included studies section (Armanian 2015; Bisceglia 2009; Riskin 2010).
Armanian 2015 performed a randomised double‐blinded clinical trial that enrolled 50 preterm neonates (< 1501 grams and/or < 34 weeks). Infants who had initially been on parenteral nutrition were entered into the study after the enteral feeding with breast milk was started and met the volume of 30 mL/kg/day. Researchers randomly assigned infants to receive the intervention short‐chain galacto‐oligosaccharides (scGOSs)/ long‐chain fructo‐oligosaccharides (lcFOSs) (scGOS/lcFOS) in a ratio of 9:1 or a placebo of distilled water with the same volume as of the prebiotic mixture, 25 infants in each group. The study’s primary outcomes were change in bilirubin level after intervention as well as average and peak bilirubin levels during the intervention. Secondary outcomes were change in stool frequency, average stool frequency, and meeting full enteral feeding, defined as a milk volume of 150 mL/kg/day during the study period.
Bisceglia 2009 performed a prospective, double‐blind, clinical trial which enrolled seventy‐six infants (healthy term infants). Whenever breast milk was not available, newborns were randomly assigned to receive a formula containing 0.8 g ⁄ dL of a mixture from scGOS and lcFOS (ratio 9:1) (39 infants), or maltodextrins as placebo (37 infants). The intervention period lasted for 28 days. The primary outcome measure was bilirubin concentrations as detected by transcutaneous measurements. Secondary outcomes included stool frequency and increase in weight, length, and head circumference.
Riskin 2010 performed a double‐blinded, placebo‐controlled pilot study on twenty‐eight infants with gestational age of 23 to 34 weeks without major congenital anomaly. Researchers randomly assigned infants to receive the intervention (i.e. lactulose, 15 infants received 1% lactulose in their entire mother’s breast milk or preterm formula feeds (1 gram per 100 mL feeds)) or placebo (i.e. dextrose, 13 infants received 1% dextrose with the same volume as the lactulose). The primary outcome was the growth of bacteria in stool cultures. The most important secondary outcome measure was the absence of adverse effects, especially diarrhoea. Other secondary outcome measures were neonatal jaundice (indirect hyperbilirubinaemia) and anaemia of prematurity.
Excluded studies
See Characteristics of excluded studies table.
We rejected the following studies because they did not report our desired outcomes (i.e. hyperbilirubinaemia etc.): ISRCTN87058658, Westerbeek 2010 and Kajzer 2016. We excluded the following two studies because they enrolled non‐neonate infants (i.e. outside of our age range for inclusion): NCT01515644 and NCT02363582. We also rejected Keuth 1977 because the article was found only as an abstract.
Risk of bias in included studies
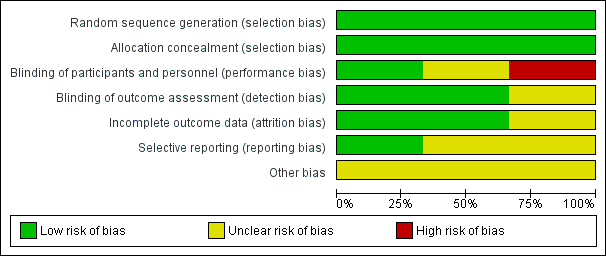
Details are provided in the Characteristics of included studies table. As well, a graphical presentation of our individual judgements per item per study and a summary graph are indicated in Figure 4 and Figure 5, respectively.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Allocation
We determined that all included studies had low risk of bias, as Armanian 2015 and Bisceglia 2009 performed random allocation by using the table of random numbers, and Riskin 2010 performed the randomisation with sealed nontransparent envelopes assigned to the lactulose or placebo groups. Allocation concealment was also adequately done in all of them.
Blinding
All studies clearly described and achieved blinding of participants, study personnel and outcome assessors except for Bisceglia 2009 and Armanian 2015 for which methods of blinding outcome assessors were not described so uncertainty about blinding were exist.
Incomplete outcome data
Two studies described reasons for attrition and exclusion of participants (Armanian 2015; Bisceglia 2009) and one study did not (Riskin 2010).
Selective reporting
For two studies, the study protocol was not available to us (Bisceglia 2009; Riskin 2010) so we cannot judge if there were any deviations from their protocols. The other study was entered into a trial registry and seemed to have no major deviations from the protocol (Armanian 2015).
Other potential sources of bias
Because we did not enough data about other potential sources of bias, we judged the risk of other bias as unclear for all included trials.
Effects of interventions
See: summary of findings Table for the main comparison for the main comparison of feeding supplementation with prebiotics versus distilled water/placebo or no supplementation.
We included three studies in the comparison, involving a total of 154 infants.
Incidence of hyperbilirubinaemia (outcome 1.1)
In the one study that clearly reported the incidence of hyperbilirubinaemia, there was a significant reduction in the prebiotic group (RR 0.75, 95% CI 0.58 to 0.97; one study, 50 infants; low‐quality evidence) (Analysis 1.1) (Armanian 2015).
The single trial that evaluated this outcome had similar data for the following subgroups: gestational age (preterm neonates defined as < 35 weeks' gestation); birth weight (< 1500 grams); type of prebiotic (oligosaccharide); type of feeding (only breast milk‐fed infants); and therefore we presented only one forest plot.
We were unable to run the planned subgroup analysis for the following subgroups because there was no study with these target variables: gestational age (term neonates defined as gestational age ≥ 37 weeks, late preterm neonates defined as 35 to 37 weeks' gestation); birth weight (≥ 2500 grams, 1500 to 2500 grams); type of prebiotic (lactulose, inulin); type of feeding (only formula‐fed infants, infants given a mixed form of feeding); duration of supplementation.
Maximum plasma unconjugated bilirubin level (outcomes 1.2, 1.3)
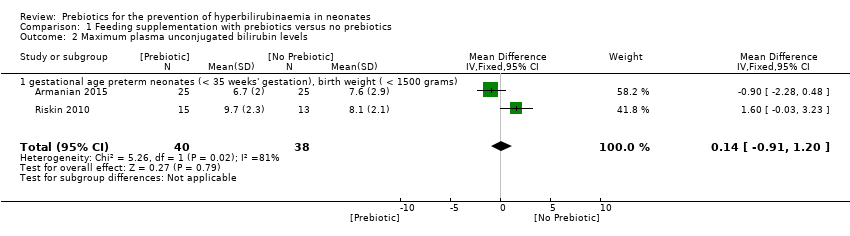
Two studies reported this outcome (Armanian 2015; Riskin 2010). Infants in these two studies were preterm and had a birth weight of < 1500 grams. Maximum plasma unconjugated bilirubin level was higher in the prebiotic group in one of these studies (Riskin 2010) while it was significantly lower in the prebiotic group in the other study (Armanian 2015). The prebiotic was lactulose in Riskin 2010 and oligosaccharide in Armanian 2015. Overall, although there was a suggestion of high heterogeneity, the meta‐analysis of these two studies demonstrated no significant difference in maximum plasma unconjugated bilirubin levels in infants with prebiotic supplementation versus placebo (MD 0.14 mg/dL, 95% CI ‐0.91 to 1.20; 2 studies, 78 infants; I² = 81%, P = 0.79; low‐quality evidence) (Analysis 1.2, Analysis 1.3).
With meta‐analysis of these two studies similar data was obtaind for the following subgroups: a. gestational age (preterm neonates defined as < 35 weeks' gestation) and birth weight (< 1500 grams); b. type of prebiotic (lactulose, oligosaccharide) and type of feeding (only breast milk‐fed infants, infants given a mixed form of feeding). Therefore we presented only two forest plots for these similar analyses.
We were unable to run the planned subgroup analysis for the following subgroups because there was no study with these target variables: gestational age (term neonates defined as gestational age ≥ 37 weeks, late preterm neonates defined as 35 to 37 weeks' gestation); birth weight (≥ 2500 grams, 1500 to 2500 grams); type of prebiotic (inulin); type of feeding (only formula‐fed infants); duration of supplementation.
Acute bilirubin encephalopathy
None of the included studies reported any acute bilirubin encephalopathy.
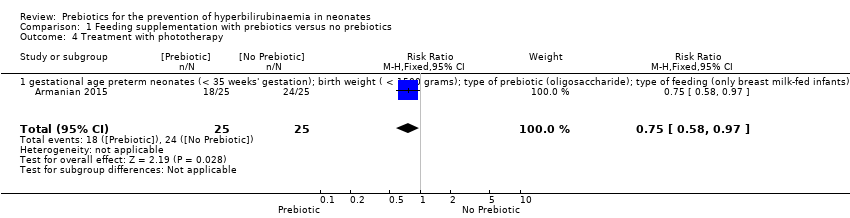
Treatment with phototherapy (outcome 1.4)
Treatment with phototherapy was only clearly reported by Armanian 2015. There was a significant reduction in the rate of treatment with phototherapy in the prebiotic group (RR 0.75, 95% CI 0.58 to 0.97; one study, 50 infants; low‐quality evidence) (Analysis 1.4).
The single trial that evaluated this outcome had similar data for the following subgroups: gestational age (preterm neonates defined as < 35 weeks' gestation); birth weight (< 1500 grams); type of prebiotic (oligosaccharide); type of feeding (only breast milk‐fed infants). Therefore we presented only one forest plot for these similar analysis.
We were unable to run the planned subgroup analysis for the following subgroups because there was no study with these target variables: gestational age (term neonates defined as gestational age ≥ 37 weeks, late preterm neonates defined as 35 to 37 weeks' gestation); birth weight (≥ 2500 grams, 1500 to 2500 grams); type of prebiotic (lactulose, inulin); type of feeding (only formula‐fed infants, infants given a mixed form of feeding); duration of supplementation.
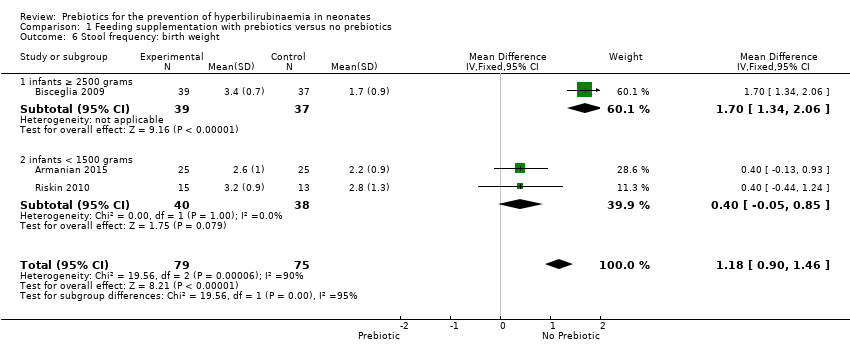
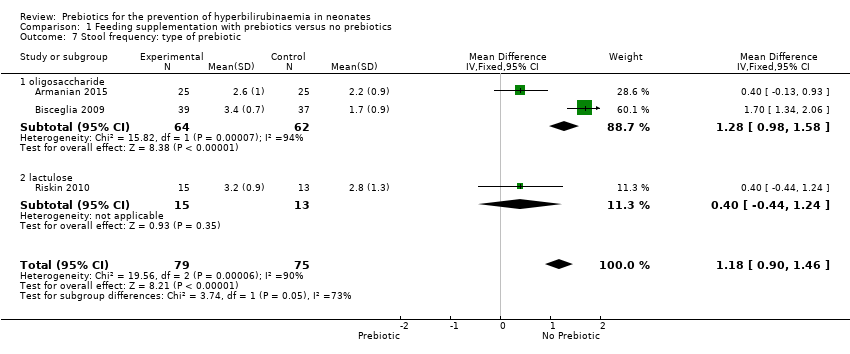
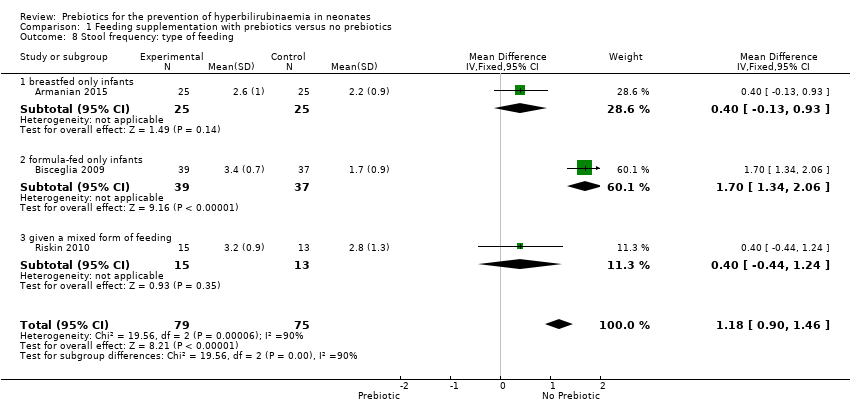
Stool frequency (outcomes 1.5 to 1.8)
All three studies reported the stool frequency, and there was a significant increase in stool frequency in the prebiotic groups. Meta‐analysis of all studies showed a significant increase in stool frequency in the prebiotic group in all subgroup analyses (MD 1.18, 95% CI 0.90 to 1.46; 3 studies, 154 infants; I² = 90%; high‐quality evidence) (Analysis 1.5, Analysis 1.6, Analysis 1.7, Analysis 1.8). While no diarrhoea was reported, this increase in stool frequency improves the movement of stool in the intestines.
We were unable to run the planned subgroup analysis for the following subgroups because there was no study with these target variables: gestational age (late preterm neonates defined as 35 to 37 weeks' gestation); birth weight (1500 to 2500 grams); type of prebiotic (inulin); duration of supplementation.
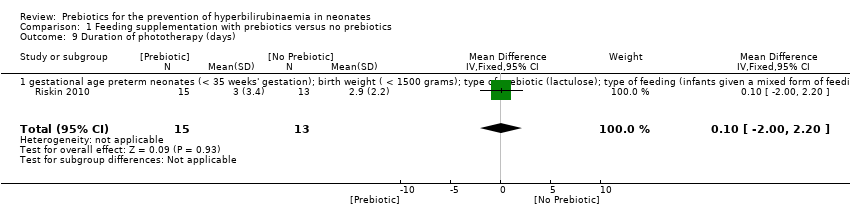
Duration of phototherapy (outcome 1.9)
Duration of phototherapy was only reported by Riskin 2010 who found no significant difference between the prebiotic and control groups (MD 0.10 days, 95% CI ‐2.00 to 2.20; one study, 28 infants; P = 0.93; low‐quality evidence) (Analysis 1.9) (Riskin 2010).
The single trial that evaluated this outcome had similar data for the following subgroups: gestational age (preterm neonates defined as < 35 weeks' gestation); birth weight (< 1500 grams); type of prebiotic (oligosaccharide); type of feeding (only breast milk‐fed infants). Therefore we presented only one forest plot for these similar analysis.
We were unable to run the planned subgroup analysis for the following subgroups because there was no study with these target variables: gestational age (term neonates defined as gestational age ≥ 37 weeks, late preterm neonates defined as 35 to 37 weeks' gestation); birth weight (≥ 2500 grams, 1500 to 2500 grams); type of prebiotic (lactulose, inulin); type of feeding (only formula‐fed infants, infants given a mixed form of feeding); duration of supplementation.
Length of hospital stay (outcomes 1.10, 1.11)
Two studies reported the length of hospital stay (Armanian 2015, Riskin 2010). In the meta‐analysis, both studies showed a significant reduction in the prebiotic group in all subgroup analyses. In the meta‐analysis, prebiotics resulted in a significant reduction in the mean length of hospital stay (MD ‐10.57 days, 95% CI ‐17.81 to ‐3.33; 2 studies, 78 infants; I² = 0%, P = 0.004; low‐quality evidence) (Analysis 1.10, Analysis 1.11).
With meta‐analysis of these two studies similar data was obtaind for the following subgroups: a. gestational age (preterm neonates defined as < 35 weeks' gestation) and birth weight (< 1500 grams); b. type of prebiotic (lactulose, oligosaccharide) and type of feeding (only breast milk‐fed infants, infants given a mixed form of feeding). Therefore we presented only two forest plots for these similar analyses.
We were unable to run the planned subgroup analysis for the following subgroups because there was no study with these target variables: gestational age (term neonates defined as gestational age ≥ 37 weeks, late preterm neonates defined as 35 to 37 weeks' gestation); birth weight (≥ 2500 grams, 1500 to 2500 grams); type of prebiotic (inulin); type of feeding (only formula‐fed infants); duration of supplementation.
Exchange transfusion
There were no reports of the need for exchange transfusion in included studies.
Chronic bilirubin encephalopathy or kernicterus
There were no reports of the incidence of chronic bilirubin encephalopathy in included studies.
Major neurodevelopmental disability
Major neurodevelopmental disability was not reported in any of the included studies.
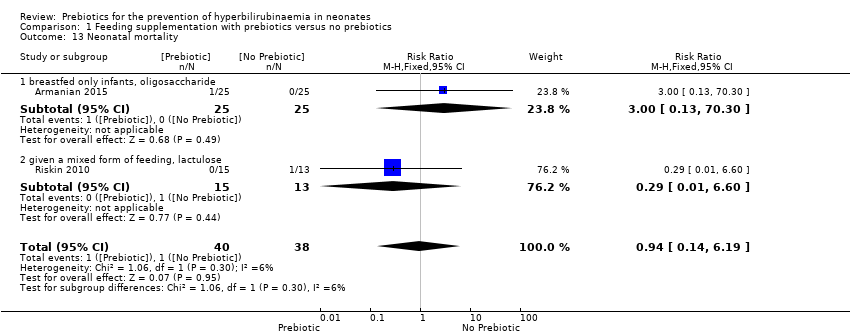
Neonatal mortality (outcomes 1.12, 1.13)
Neonatal mortality rate was reported by both Armanian 2015 and Riskin 2010. There was no significant difference between the prebiotic and placebo groups (typical RR 0.94, 95% CI 0.14 to 6.19; 2 studies; 28 infants; I² = 6%, P = 0.95; low‐quality evidence) (Analysis 1.12, Analysis 1.13).
With meta‐analysis of these two studies similar data was obtaind for the following subgroups: a. gestational age (preterm neonates defined as < 35 weeks' gestation) and birth weight (< 1500 grams); b. type of prebiotic (lactulose, oligosaccharide) and type of feeding (only breast milk‐fed infants, infants given a mixed form of feeding). Therefore we presented only two forest plots for these similar analyses.
We were unable to run the planned subgroup analysis for the following subgroups because there was no study with these target variables: gestational age (term neonates defined as gestational age ≥ 37 weeks, late preterm neonates defined as 35 to 37 weeks' gestation); birth weight (≥ 2500 grams, 1500 to 2500 grams); type of prebiotic (inulin); type of feeding (only formula‐fed infants); duration of supplementation.
Side effects
No side effects were found in any of the included studies.
Discusión
Resumen de los resultados principales
Solo hubo tres estudios que evaluaron la efectividad de los prebióticos sobre la incidencia de la ictericia neonatal, por lo que no fue posible investigar la mayoría de los resultados de esta revisión y se deben realizar más estudios al respecto. Sin embargo, los datos disponibles mostraron una disminución significativa en la incidencia de ictericia neonatal y la necesidad de fototerapia en el grupo prebiótico, aunque no hubo diferencias significativas en los niveles máximos de bilirrubina no conjugada en el plasma en los grupos prebiótico y placebo. En todos los ensayos clínicos que se han evaluado en este estudio, la frecuencia de la excreción fecal (frecuencia de las heces) en el grupo de recién nacidos que recibieron prebióticos fue significativamente mayor que la del grupo placebo, lo que puede provocar de manera indirecta una reducción de la ictericia en los recién nacidos debido a la excreción de meconio, que contiene altos niveles de bilirrubina. Es interesante señalar que el metanálisis encontró que la administración de suplementos de prebióticos a los recién nacidos redujo la duración de la hospitalización. No hubo publicaciones que informaran sobre la necesidad de exanguinotransfusión, discapacidad grave del desarrollo neurológico, encefalopatía bilirrubínica aguda/crónica o cualquier efecto secundario en los estudios incluidos.
Compleción y aplicabilidad general de las pruebas
Debido a que se realizó una búsqueda exhaustiva y se consultó con expertos en el tema, que no dieron lugar al hallazgo de otros estudios, es poco probable que el sesgo de publicación sea la explicación del número limitado de estudios.
En esta revisión solo se incluyeron tres estudios pequeños con diferentes resultados estudiados, que reclutaron entre 28 y 79 recién nacidos. La evidencia de los metanálisis de los efectos de los prebióticos solo estaban disponibles para la frecuencia de las deposiciones en los recién nacidos. Esta evidencia indica con claridad un efecto significativo de la intervención bajo estudio, aunque se basó en estudios pequeños. Para otros resultados se obtuvieron resultados no significativos o no hubo estudios o datos disponibles. Se debe señalar que, debido al pequeño tamaño de la muestra para el metanálisis, las implicaciones clínicas se deben utilizar con precaución en los recién nacidos con hiperbilirrubinemia. Ninguno de los estudios incluidos en los metanálisis mostró efectos secundarios graves. Los resultados de otro metanálisis (Deshmukh 2019) contrastan con el presente estudio, que muestra un efecto significativo de los “probióticos“ en la reducción de la duración de la fototerapia y el nivel total de bilirrubina en el suero. Las diferencias observadas en cuanto a los resultados del presente estudio y la revisión sistemática de Deshmukh se podrían atribuir a las diferentes vías a través de las cuales funcionan los probióticos y los prebióticos. Sobre la base de metanálisis realizados con datos de calidad limitada, en particular de ensayos pequeños y a corto plazo, no es posible concluir que el uso sistemático de prebióticos se pueda considerar un enfoque efectivo para prevenir o tratar la hiperbilirrubinemia neonatal. A pesar de estas revisiones sistemáticas y metanálisis, se recomienda firmemente la realización de ensayos clínicos grandes y bien diseñados.
Calidad de la evidencia
Según los datos disponibles, la certeza de la evidencia para la mayoría de los resultados fue baja, con la excepción del resultado “frecuencia de las deposiciones“, que se clasificó como de calidad relativamente alta (véase “Resumen de resultados“, tabla 1).
Los tres estudios incluidos en esta revisión sistemática y los metanálisis tuvieron buena calidad metodológica, como la asignación al azar, el ocultamiento de la asignación y el cegamiento. Todos los resultados de los ensayos incluidos se midieron de manera objetiva y los tres estudios indicaron que se había realizado el cálculo del tamaño de la muestra. Las posibles variables de confusión estuvieron equilibradas entre los grupos prebióticos y placebo. Dos debilidades importantes que limitan la calidad de los estudios incluidos son el alto nivel de sesgo de deserción o los datos incompletos y el informe selectivo. A pesar de la falta de cuestiones metodológicas importantes en los estudios incluidos, debido al pequeño tamaño de la muestra y al corto período de evaluación, no pudieron aportar evidencia fiable acerca de la efectividad de los prebióticos en la hiperbilirrubinemia.
Sesgos potenciales en el proceso de revisión
No se conoce ningún sesgo potencial en el proceso de revisión. Se desea declarar que el autor principal de esta revisión también es el primer autor de uno de los estudios incluidos (Armanian 2015). Para asegurar que no se produjera sesgo, el Dr. Armanian no participó en el proceso de cribado, la extracción de datos o las evaluaciones del riesgo de sesgo para su artículo.
Acuerdos y desacuerdos con otros estudios o revisiones
Hasta donde se conoce, no existen revisiones sobre la efectividad de los prebióticos en la hiperbilirrubinemia.

Guidelines for phototherapy in infants at ≥ 35 weeks' gestation.
(American Academy of Pediatrics Subcommittee on Hyperbilirubinaemia. Management of hyperbilirubinaemia in the newborn infant 35 or more weeks of gestation. Pediatrics 2004;114:297.)
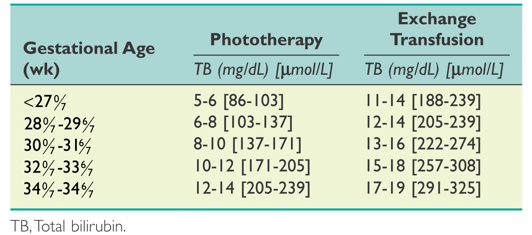
Suggested guidelines for initiating phototherapy or exchange transfusion in preterm infants (< 35 weeks' gestation).
(Maisels MJ, Watchko JF, Bhutani VK, et al. An approach to the management of hyperbilirubinaemia in the preterm infant less than 35 weeks of gestation. Journal of Perinatology 2012;32:660‐664.)
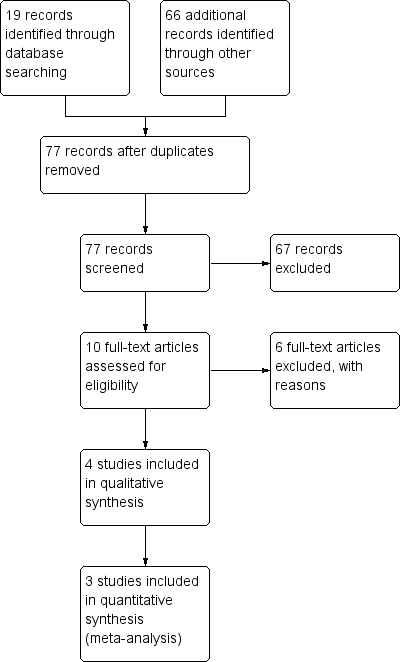
Study flow diagram.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
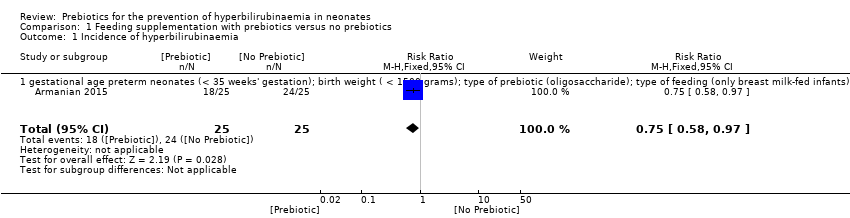
Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 1 Incidence of hyperbilirubinaemia.
Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 2 Maximum plasma unconjugated bilirubin levels.

Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 3 Maximum plasma unconjugated bilirubin levels.
Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 4 Treatment with phototherapy.

Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 5 Stool frequency: gestational age.
Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 6 Stool frequency: birth weight.
Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 7 Stool frequency: type of prebiotic.
Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 8 Stool frequency: type of feeding.
Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 9 Duration of phototherapy (days).

Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 10 Length of hospital stay (days).

Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 11 Length of hospital stay (days).

Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 12 Neonatal mortality.
Comparison 1 Feeding supplementation with prebiotics versus no prebiotics, Outcome 13 Neonatal mortality.
| Feeding supplementation with prebiotics compared to no prebiotics for the prevention of hyperbilirubinaemia in neonates | ||||||
| Patient or population: Neonates, including term neonates (gestational age ≥ 37 weeks), late preterm neonates (35 to 37 weeks' gestation) and preterm neonates (< 35 weeks' gestation) | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with no prebiotics | Risk with Feeding supplementation with prebiotics | |||||
| Incidence of hyperbilirubinaemia | Study population | RR 0.75 | 50 | ⊕⊕⊝⊝ | ||
| 960 per 1,000 | 720 per 1,000 | |||||
| Maximum plasma unconjugated bilirubin levels; | The mean maximum plasma unconjugated bilirubin levels; ranged from 7.6 to 8.1 mg/dL | MD 0.14 mg/dL higher | ‐ | 78 | ⊕⊕⊝⊝ | |
| Treatment with phototherapy | Study population | RR 0.75 | 50 | ⊕⊕⊝⊝ | ||
| 960 per 1,000 | 720 per 1,000 | |||||
| Stool frequency | The mean stool frequency; ranged from 1 to 3 | MD 1.18 higher | ‐ | 154 | ⊕⊕⊕⊕ | |
| Duration of phototherapy (days) | The mean duration of phototherapy (days); ranged from 2 to 3 days | MD 0.1 days higher | ‐ | 28 | ⊕⊕⊝⊝ | |
| Length of hospital stay (days) | The mean length of hospital stay (days); ranged from 29 to 72 days | MD 10.57 days lower | ‐ | 78 | ⊕⊕⊝⊝ | |
| Neonatal mortality | Study population | RR 0.94 | 78 | ⊕⊕⊝⊝ | ||
| 26 per 1,000 | 25 per 1,000 | |||||
| Acute bilirubin encephalopathy (encephalopathy) | Study population | not estimable | (0 RCTs) | ‐ | None of the included studies showed any acute bilirubin encephalopathy. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Exchange transfusion (exchange) | Study population | not estimable | (0 RCTs) | ‐ | There were no reports of the need for exchange transfusion in included studies. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Chronic bilirubin encephalopathy or kernicterus (kernicterus) | Study population | not estimable | (0 RCTs) | ‐ | There were no reports of the incidence of chronic bilirubin encephalopathy in included studies. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Major neurodevelopmental disability | Study population | not estimable | (0 RCTs) | ‐ | Major neurodevelopmental disability was not reported in any of the included studies. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| Side effects | Study population | not estimable | (0 RCTs) | ‐ | No side effects were reported in any of the included studies. | |
| 0 per 1,000 | 0 per 1,000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| a Downgraded one level due to high risk of performance bias b Downgraded one level due to uncertainty about precision (one study) c Downgraded one level due to uncertainty about precision (small study) d Downgraded one level due to unclear risk of attrition bias (incomplete outcome data) | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Incidence of hyperbilirubinaemia Show forest plot | 1 | 50 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.75 [0.58, 0.97] |
| 1.1 gestational age preterm neonates (< 35 weeks' gestation); birth weight ( < 1500 grams); type of prebiotic (oligosaccharide); type of feeding (only breast milk‐fed infants) | 1 | 50 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.75 [0.58, 0.97] |
| 2 Maximum plasma unconjugated bilirubin levels Show forest plot | 2 | 78 | Mean Difference (IV, Fixed, 95% CI) | 0.14 [‐0.91, 1.20] |
| 2.1 gestational age preterm neonates (< 35 weeks' gestation), birth weight ( < 1500 grams) | 2 | 78 | Mean Difference (IV, Fixed, 95% CI) | 0.14 [‐0.91, 1.20] |
| 3 Maximum plasma unconjugated bilirubin levels Show forest plot | 2 | 78 | Mean Difference (IV, Fixed, 95% CI) | 0.14 [‐0.91, 1.20] |
| 3.1 breastfed only infants, oligosaccharide | 1 | 50 | Mean Difference (IV, Fixed, 95% CI) | ‐0.90 [‐2.28, 0.48] |
| 3.2 given a mixed form of feeding, lactulose | 1 | 28 | Mean Difference (IV, Fixed, 95% CI) | 1.60 [‐0.03, 3.23] |
| 4 Treatment with phototherapy Show forest plot | 1 | 50 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.75 [0.58, 0.97] |
| 4.1 gestational age preterm neonates (< 35 weeks' gestation); birth weight ( < 1500 grams); type of prebiotic (oligosaccharide); type of feeding (only breast milk‐fed infants) | 1 | 50 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.75 [0.58, 0.97] |
| 5 Stool frequency: gestational age Show forest plot | 3 | 154 | Mean Difference (IV, Fixed, 95% CI) | 1.18 [0.90, 1.46] |
| 5.1 term neonates (gestational age ≥ 37 weeks) | 1 | 76 | Mean Difference (IV, Fixed, 95% CI) | 1.7 [1.34, 2.06] |
| 5.2 preterm neonates (< 35 weeks' gestation) | 2 | 78 | Mean Difference (IV, Fixed, 95% CI) | 0.4 [‐0.05, 0.85] |
| 6 Stool frequency: birth weight Show forest plot | 3 | 154 | Mean Difference (IV, Fixed, 95% CI) | 1.18 [0.90, 1.46] |
| 6.1 infants ≥ 2500 grams | 1 | 76 | Mean Difference (IV, Fixed, 95% CI) | 1.7 [1.34, 2.06] |
| 6.2 infants < 1500 grams | 2 | 78 | Mean Difference (IV, Fixed, 95% CI) | 0.4 [‐0.05, 0.85] |
| 7 Stool frequency: type of prebiotic Show forest plot | 3 | 154 | Mean Difference (IV, Fixed, 95% CI) | 1.18 [0.90, 1.46] |
| 7.1 oligosaccharide | 2 | 126 | Mean Difference (IV, Fixed, 95% CI) | 1.28 [0.98, 1.58] |
| 7.2 lactulose | 1 | 28 | Mean Difference (IV, Fixed, 95% CI) | 0.40 [‐0.44, 1.24] |
| 8 Stool frequency: type of feeding Show forest plot | 3 | 154 | Mean Difference (IV, Fixed, 95% CI) | 1.18 [0.90, 1.46] |
| 8.1 breastfed only infants | 1 | 50 | Mean Difference (IV, Fixed, 95% CI) | 0.40 [‐0.13, 0.93] |
| 8.2 formula‐fed only infants | 1 | 76 | Mean Difference (IV, Fixed, 95% CI) | 1.7 [1.34, 2.06] |
| 8.3 given a mixed form of feeding | 1 | 28 | Mean Difference (IV, Fixed, 95% CI) | 0.40 [‐0.44, 1.24] |
| 9 Duration of phototherapy (days) Show forest plot | 1 | 28 | Mean Difference (IV, Fixed, 95% CI) | 0.10 [0.00, 2.20] |
| 9.1 gestational age preterm neonates (< 35 weeks' gestation); birth weight ( < 1500 grams); type of prebiotic (lactulose); type of feeding (infants given a mixed form of feeding) | 1 | 28 | Mean Difference (IV, Fixed, 95% CI) | 0.10 [0.00, 2.20] |
| 10 Length of hospital stay (days) Show forest plot | 2 | 78 | Mean Difference (IV, Fixed, 95% CI) | ‐10.57 [‐17.81, ‐3.33] |
| 10.1 gestational age preterm neonates (< 35 weeks' gestation), birth weight ( < 1500 grams) | 2 | 78 | Mean Difference (IV, Fixed, 95% CI) | ‐10.57 [‐17.81, ‐3.33] |
| 11 Length of hospital stay (days) Show forest plot | 2 | 78 | Mean Difference (IV, Fixed, 95% CI) | ‐10.57 [‐17.81, ‐3.33] |
| 11.1 breastfed only infants, oligosaccharide | 1 | 50 | Mean Difference (IV, Fixed, 95% CI) | ‐10.2 [‐17.59, ‐2.81] |
| 11.2 given a mixed form of feeding, lactulose | 1 | 28 | Mean Difference (IV, Fixed, 95% CI) | ‐19.10 [‐54.58, 16.38] |
| 12 Neonatal mortality Show forest plot | 2 | 78 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.94 [0.14, 6.19] |
| 12.1 gestational age preterm neonates (< 35 weeks' gestation), birth weight ( < 1500 grams) | 2 | 78 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.94 [0.14, 6.19] |
| 13 Neonatal mortality Show forest plot | 2 | 78 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.94 [0.14, 6.19] |
| 13.1 breastfed only infants, oligosaccharide | 1 | 50 | Risk Ratio (M‐H, Fixed, 95% CI) | 3.0 [0.13, 70.30] |
| 13.2 given a mixed form of feeding, lactulose | 1 | 28 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.29 [0.01, 6.60] |

