Corticosteroides intramusculares versus orales para reducir las recaídas después del alta del servicio de urgencias para el asma aguda
Resumen
Antecedentes
El asma aguda es una causa frecuente de consulta en los centros de atención de casos agudos, como el servicio de urgencias (SU) y aunque la mayoría de los pacientes pueden ser dados de alta, las recaídas que requieren atención médica adicional son frecuentes. Los corticosteroides sistémicos son una parte principal en el tratamiento del asma agudo moderado a grave; sin embargo, no existe evidencia clara con respecto a la vía más efectiva de administración para la mejoría de los resultados en los pacientes dados de alta del servicio de atención de casos agudos.
Objetivos
Examinar la efectividad y la seguridad de una dosis única de corticosteroides intramusculares (IM) administrada antes del alta en comparación con un ciclo corto de corticosteroides orales en el tratamiento de los pacientes con asma aguda dados de alta de un SU o de un ámbito similar de atención de casos agudos.
Métodos de búsqueda
El Grupo Cochrane de Vías Respiratorias (Cochrane Airways Group) realizó búsquedas en el Registro de Ensayos del Grupo Cochrane de Vías Respiratorias, por última vez el 14 de marzo de 2018. Además, en abril de 2017 se completó una búsqueda exhaustiva en nueve bases de datos electrónicas, incluidas Medline, Embase, EBM ALL, Global Health, International Pharmaceutical Abstracts, CINAHL, SCOPUS, Proquest Disertations and Theses Global, y LILACS. Además, se buscó en la literatura gris para identificar cualquier estudio adicional.
Criterios de selección
Se incluyeron los ensayos controlados aleatorios o los ensayos clínicos controlados que compararon la efectividad de los corticosteroides intramusculares (IM) versus orales para el tratamiento de pacientes pediátricos o adultos que se presentaron con asma aguda en un SU o en un ámbito similar de atención de casos agudos. Dos autores de la revisión independientes evaluaron la elegibilidad y la calidad de los estudios. Los desacuerdos se resolvieron a través de un tercero y el riesgo de sesgo se evaluó mediante la herramienta Cochrane "riesgo de sesgo". La calidad de la evidencia se evaluó mediante GRADE.
Obtención y análisis de los datos
Para los resultados dicotómicos, las estadísticas individuales y agrupadas se calcularon como cocientes de riesgos (CR) con intervalos de confianza (IC) del 95% mediante un modelo de efectos aleatorios. Los resultados continuos se informaron como diferencia de medias (DM) o diferencia de medias estandarizada (DME) con un IC del 95% mediante un modelo de efectos aleatorios. Se informó sobre la heterogeneidad mediante las estadísticas I² y Cochran Q. Se utilizaron los procedimientos estándar recomendados por la Colaboración Cochrane.
Resultados principales
Nueve estudios que incluían a 804 participantes (IM = 402 participantes; oral = 402 participantes) cumplieron los criterios de inclusión de la revisión. Cuatro estudios reclutaron niños (n = 245 participantes), mientras que cinco estudios reclutaron adultos (n = 559 participantes). Todos los estudios reclutaron a participantes que se presentaron al SU, excepto un estudio que reclutó a participantes que asistieron a un consultorio de atención primaria. Todos los estudios pediátricos compararon dexametasona intramuscular (IM) con prednisona/prednisolona oral. En los estudios en adultos, el corticosteroide IM administrado varió de metilprednisolona, betametasona, dexametasona o triamcinolona, mientras que el régimen de corticosteroides orales administrados consistió en prednisona, metilprednisolona o dexametasona. Sólo cinco estudios fueron controlados con placebo. En esta revisión no se consideró la equivalencia de las dosis de los corticosteroides en el análisis. La cointervención administrada con mayor frecuencia a los participantes durante la visita al servicio de atención de casos agudos incluyó betaagonistas₂ de acción corta (ABAC), metilxantinas y bromuro de ipratropio. En algunos casos, los estudios informaron la administración suplementaria de corticosteroides orales o IV a algunos participantes durante la estancia en el SU. Las cointervenciones administradas a los participantes al momento del alta consistieron principalmente en ABAC, metilxantina, betaagonistas₂ de acción prolongada (ABAP) y bromuro de ipratropio. El riesgo de sesgo de los estudios incluidos varió de incierto a alto a través de diversos dominios. El resultado primario de interés fue la recaída a la atención adicional definida como una visita no programada a un personal de salud debido al empeoramiento de los síntomas del asma o la necesidad de tratamiento posterior con corticosteroides que puede haber ocurrido en cualquier momento después del alta del SU.
Se encontró que los corticosteroides intramusculares y orales tuvieron una efectividad similar para reducir el riesgo de recaída (CR 0,94; IC del 95%: 0,72 a 1,24; nueve estudios, 804 participantes; I² = 0%; evidencia de baja calidad). No se encontraron diferencias entre los subgrupos en las tasas de recaída entre los participantes pediátricos y adultos (p = 0,71), la recaída en el transcurso de diez días desde alta o después del alta (p = 0,22) ni los participantes con exacerbaciones leves/moderadas o graves (P = 0,35). Aunque no se encontraron diferencias estadísticas entre los participantes que recibieron IM versus corticosteroides orales con respecto al riesgo de eventos adversos (CR 0,83; IC del 95%: 0,64 a 1,07; cinco estudios, 404 participantes; I² = 0%; evidencia de calidad moderada), hubo 50 pacientes menos por 1000 que recibieron corticosteroides IM que informaron haber presentado eventos adversos (95% de 106 menos a 21 más). Se encontró un informe inconsistente de los eventos adversos específicos entre los estudios. No hubo diferencias en la frecuencia de eventos adversos específicos que incluyeron náuseas y vómitos, dolor, edema, rubor, insomnio o cambios de personalidad. No se buscaron datos adicionales sobre los eventos adversos.
Los participantes que recibieron corticosteroides IM y los que recibieron corticosteroides orales informaron disminuciones en el flujo espiratorio máximo (DM ‐7,78 l/min; IC del 95%: ‐38,83 l/min a 23,28 l/min; cuatro estudios, 272 participantes; I² = 33%; evidencia de calidad moderada), persistencia similar de los síntomas (CR 0,41; IC del 95%: 0,14 a 1,20; tres estudios, 80 participantes; I² = 44%; evidencia de baja calidad), y administración de betaagonistas en el plazo de 24 horas (CR 0,54; IC del 95%: 0,21 a 1,37; dos estudios, 48 participantes; I² = 0%; evidencia de baja calidad).
Conclusiones de los autores
No hay evidencia suficiente para identificar si los corticosteroides IM son más efectivos para reducir la recaída en comparación con los corticosteroides orales entre los niños o los adultos dados de alta de un SU o de un ámbito similar de atención de casos agudos para el asma aguda. Aunque no se encontraron diferencias estadísticas, los pacientes que recibieron corticosteroides IM informaron menos eventos adversos. Estudios adicionales que comparen la efectividad de los corticosteroides IM versus orales podrían aportar más transparencia en cuanto a la evidencia. Además, se necesitan estudios que comparen diferentes corticosteroides IM (p.ej. dexametasona IM versus metilprednisona IM) y diferentes corticosteroides orales (p.ej. dexametasona oral versus prednisona oral), y que consideren la dosis y las propiedades farmacocinéticas, para identificar mejor los regímenes óptimos de los corticosteroides IM u orales y mejorar los resultados de los pacientes. Otros factores, como la preferencia de los pacientes y las cuestiones potenciales con la adherencia, pueden determinar la prescripción de los médicos.
PICO
Resumen en términos sencillos
Corticosteroides intramusculares versus orales para el asma aguda
Pregunta de la revisión
Se examinó la efectividad de una inyección de corticosteroides en comparación con corticosteroides administrados por vía oral para mejorar los resultados entre los pacientes que se presentaron a un servicio de urgencias o a un ámbito similar de atención de casos agudos con asma aguda.
Antecedentes
Los ataques de asma son el resultado de la constricción de las vías de conducción de aire a los pulmones a causa de la inflamación, lo que se manifiesta con sibilancias, tos y dificultad para respirar. Los pacientes que presentan ataques de asma a menudo concurren a los servicios de urgencias. Los corticosteroides, que son agentes antiinflamatorios potentes, son la base del tratamiento de las exacerbaciones del asma y se ha observado que son efectivos para mejorar la función pulmonar y reducir las hospitalizaciones en los pacientes con asma. Al momento del alta, con frecuencia los pacientes reciben corticosteroides para disminuir las posibilidades de regresar al servicio de urgencias debido al empeoramiento de los síntomas del asma. Los corticosteroides se pueden administrar mediante una inyección única bajo la piel en el músculo ("intramuscular") o en forma de comprimidos para tomar en el domicilio y actualmente no se conoce qué régimen de corticosteroides es más efectivo para mejorar los resultados de los pacientes luego del alta del servicio de urgencias.
Fecha de la búsqueda
La búsqueda más reciente se realizó en marzo 2018.
Características de los estudios
Se incluyeron nueve estudios que compararon la efectividad de una inyección intramuscular versus comprimidos del corticosteroide en pacientes que se presentaron a un SU o a un ámbito similar de atención de casos agudos con asma aguda. Los estudios incluyeron a un total de 804 participantes pediátricos y adultos. La mayoría de los estudios investigaron los corticosteroides inyectables dexametasona o metilprednisolona en comparación con comprimidos de los corticosteroides prednisona o metilprednisolona.
Fuentes de financiación de los estudios
La mayoría de los estudios no informaron las fuentes de financiación (cinco estudios). Dos estudios recibieron financiamiento de subvenciones para investigación en salud general. Un estudio fue financiado por una compañía farmacéutica (Pfizer); sin embargo, informó que la compañía no participó en ningún aspecto del estudio ni en la preparación del texto. Un estudio informó que no fue financiado.
Resultados clave
Las inyecciones intramusculares de corticosteroides parecen presentar la misma efectividad que los comprimidos de corticosteroides para prevenir las recaídas. No se encontraron diferencias en el riesgo de recaídas entre los participantes que recibieron inyecciones intramusculares y comprimidos de corticosteroides. Aunque no todos los estudios informaron los efectos adversos en los grupos de estudio, no se encontraron diferencias entre los participantes que recibieron inyecciones intramusculares y comprimidos del corticosteroide. Al momento del seguimiento, no se encontraron diferencias en las pruebas de la función pulmonar entre los participantes que habían recibido una inyección intramuscular o comprimidos del corticosteroide. En los estudios que informaron las puntuaciones y la duración de los síntomas, no se identificaron diferencias entre los participantes que recibieron corticosteroides mediante inyección o comprimidos.
Calidad de la evidencia
La calidad de la evidencia con respecto a la efectividad de las inyecciones intramusculares de corticosteroides para mejorar los resultados de salud varió de baja a moderada. Sólo existe una confianza moderada acerca de los efectos calculados de los corticosteroides intramusculares sobre los ingresos hospitalarios, la mejoría en la función respiratoria y las recaídas debido al riesgo de sesgo entre los estudios incluidos.
Conclusiones de los autores
Summary of findings
| Intramuscular corticosteroids compared to Oral corticosteroids for acute asthma | |||||
| Patient or population: patients with acute asthma | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Oral corticosteroids | Intramuscular corticosteroids | ||||
| Relapse | 201 per 1000 | 12 fewer per 1000 | RR 0.94 | 804 | ⊕⊕⊝⊝ |
| Relapse within 10 days post‐discharge | 154 per 1000 | 40 fewer per 1000 (from 75 fewer to 11 more) | RR 0.74 | 742 | ⊕⊕⊕⊝ |
| Relapse occurring after 10 days post‐discharge | 245 per 1000 | 2 fewer per 1000 | RR 0.99 | 556 | ⊕⊕⊝⊝ |
| Adverse events | 294 per 1000 | 50 fewer per 1000 | RR 0.83 | 404 | ⊕⊕⊝⊝ |
| Pulmonary function: Peak expiratory flow | The mean pulmonary function: peak expiratory flow ranged across control groups from | The mean pulmonary function: peak expiratory flow in the intervention groups was | 272 | ⊕⊕⊕⊝ | |
| Symptom persistence | 537 per 1000 | 317 fewer per 1000 | RR 0.41 | 80 | ⊕⊕⊝⊝ |
| 24‐hour beta agonist use | 375 per 1000 | 172 fewer per 1000 | RR 0.54 | 48 | ⊕⊕⊝⊝ |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Downgraded 1 level for risk of bias. Majority of studies received an unclear risk of bias for random sequence generation and selective outcome reporting | |||||
Antecedentes
Descripción de la afección
El asma es una enfermedad inflamatoria crónica de las vías respiratorias pulmonares que afecta a niños y a adultos. Se calcula que 300 000 000 de personas en todo el mundo padecen de asma (Croisant 2014). En los Estados Unidos, la prevalencia del asma ha aumentado del 7,3% al 8,2% desde 2001 a 2009 (Croisant 2014). El asma aguda, que se caracteriza por empeoramiento de la tos, sibilancias, disnea u opresión torácica, es una causa frecuente de consulta en los servicios de urgencias (SU) hospitalarios o en ámbitos de atención de casos agudos similares. La mayoría de los pacientes con asma aguda que se presenta en un SU se pueden tratar de forma segura con intervenciones que incluyen corticosteroides sistémicos, anticolinérgicos o betaagonistas₂ y ser dados de alta (Rowe 2009). Sin embargo, aproximadamente del 10% al 18% (Emerman 1999; Emerman 2001; Rowe 2015; Topal 2014), y hasta el 31% (Ducharme 1993), de los pacientes presentarán una recaída y volverán al SU o a otros ámbitos de atención de casos agudos con exacerbaciones agudas del asma en el transcurso de las cuatro semanas posteriores. En los EE.UU., se calcula que el costo económico del asma en 2007 fue de aproximadamente USD 56 000 000 000 debido a los costos médicos y al ausentismo laboral y escolar (CDC 2011). La identificación de las opciones de tratamiento efectivas para ayudar a los pacientes a controlar los síntomas después del alta del servicio de atención de casos agudos y reducir la proporción de pacientes con recaídas son cuestiones importantes del tratamiento diseñadas para mejorar los resultados de salud para los pacientes con asma.
Descripción de la intervención
Los corticosteroides sistémicos son agentes antiinflamatorios generales potentes para el tratamiento del asma (Alangari 2014). Cuando se administran en el SU, los corticosteroides sistémicos pueden reducir las hospitalizaciones y mejorar la función pulmonar en los pacientes con asma aguda (Rowe 2001). Una revisión Cochrane informó disminuciones significativas en las puntuaciones de los síntomas cuando los pacientes recibieron corticosteroides sistémicos al momento del alta del SU o después (es decir, una inyección IM al momento del alta o corticosteroides orales para tomar en el domicilio durante los tres a ocho días posteriores). La heterogeneidad en el informe de resultado impidió el agrupamiento significativo (Rowe 2007a). El tratamiento con corticosteroides sistémicos al momento del alta también previene la recaída (Rowe 2007a). Las guías actuales recomiendan los corticosteroides sistémicos al momento del alta del SU para todas presentaciones del asma aguda, excepto las más leves, con la finalidad de reducir las recaídas futuras (GINA 2017). Aunque los corticosteroides sistémicos pueden mitigar de forma efectiva las recaídas del asma, la vía óptima de administración está menos clara.
De qué manera podría funcionar la intervención
Al momento del alta del SU o del ámbito de atención de casos agudos, los corticosteroides sistémicos se pueden administrar por vía intramuscular (IM) o por vía oral. Una dosis única de corticosteroides IM tiene propiedades farmacocinéticas de acción prolongada y menos efectos secundarios asociados con náuseas/vómitos; sin embargo, se sabe que ocurren eventos adversos asociados con la inyección IM (es decir dolor y edema alrededor del sitio de inyección) (Lahn 2004). Los corticosteroides orales tienen propiedades de acción corta y los pacientes habitualmente reciben un ciclo de corta duración de corticosteroides orales durante cinco a siete días (GINA 2017). Aunque no se necesitan inyecciones, los efectos secundarios asociados con los corticosteroides orales a menudo incluyen náuseas y vómitos, y la adherencia o el cumplimiento con los regímenes de corticosteroides orales a menudo es subóptimo (Ducharme 2011). Aunque los corticosteroides IM representan una opción alternativa de tratamiento para los pacientes con intolerancia a los agentes orales o en los pacientes en que existen inquietudes en cuanto a la adherencia/cumplimiento, no está claro si los corticosteroides IM presentan la misma efectividad que los corticosteroides orales para mitigar las recaídas.
Por qué es importante realizar esta revisión
La efectividad de los corticosteroides sistémicos es conocida (Rowe 2007a) y ampliamente aceptada por los médicos; sin embargo, no se conoce si los pacientes se benefician más o menos con los corticosteroides IM u orales. Esta revisión proporciona información suplementaria con otra revisión de diferentes regímenes orales de corticosteroides para el asma aguda (Normansell 2016). Una revisión general no informó diferencias en los eventos de recaídas en adultos después del tratamiento con corticosteroides IM u orales para el asma aguda (Krishnan 2009); sin embargo, esta revisión estuvo limitada a los estudios en idioma inglés, y desde su publicación no se ha realizado otras revisiones sistemáticas que hayan utilizado una búsqueda extensa en la bibliografía para sintetizar toda la evidencia disponible a partir de estudios que compararon corticosteroides IM versus orales.
Objetivos
Examinar la efectividad y la seguridad de una dosis única de corticosteroides intramusculares (IM) administrada antes del alta en comparación con un ciclo corto de corticosteroides orales en el tratamiento de los pacientes con asma aguda dados de alta de un SU o de un ámbito similar de atención de casos agudos.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron ensayos controlados aleatorios (ECA) en esta revisión sistemática. En los criterios de búsqueda también se incluyeron los estudios informados en forma de texto completo, los publicados en forma de resumen solamente y los datos no publicados.
Tipos de participantes
Se consideraron para inclusión en la revisión los estudios en niños o adultos que se presentaron a un SU hospitalario u otro ámbito similar de atención de casos agudos con una exacerbación del asma sin complicaciones. Para esta revisión, se definió "exacerbaciones sin complicaciones" como los pacientes cuya exacerbación aguda del asma era la razón principal de consulta al SU, sin complicaciones coexistentes (p.ej. sin evidencia de neumonía, neumotórax, etc.). El diagnóstico del asma se tenía que realizar con el uso de guías clínicas internacionales/nacionales o criterios espirométricos o ambos. Se excluyeron de esta revisión los estudios que se centraron en el tratamiento con corticosteroides en participantes hospitalizados. Solamente se incluyeron los estudios que evaluaron a pacientes con asma aguda tratados y dados de alta del SU o de otro ámbito de atención de urgencia/casos agudos. Ninguno de los estudios incluidos incluyó a participantes con enfermedad pulmonar obstructiva crónica (EPOC) y asma; sin embargo, se había determinado a priori que si había algún caso con dichas características, los estudios sólo se incluirían si proporcionaban resultados de los participantes con asma por separado de los participantes con EPOC o si la población estudiada de participantes con EPOC constituía menos del 20% de la población total.
Tipos de intervenciones
Se incluyeron los estudios que compararon una dosis única de corticosteroides IM administrados antes del alta versus un ciclo de corta duración (uno a 14 días) de corticosteroides orales. No hubo restricciones en los corticosteroides IM u orales utilizados, ni en la dosis. La dosis única de corticosteroides IM se podía haber administrado a los participantes en cualquier momento antes del alta del SU o de otro ámbito de atención de casos agudos similar. El ciclo de corticosteroides orales de corta duración podría haber comenzado en cualquier momento antes del alta o haberse administrado a los participantes durante un período de unos pocos días (uno a 14 días) después del alta. No se establecieron restricciones en el tipo de cointervenciones que podían recibir los participantes (p.ej. betaagonistas₂, corticosteroides sistémicos o inhalados [CSI], anticolinérgicos, compuestos de teofilina o antihistamínicos) durante la estancia en el SU/ámbito de atención de casos agudos; sin embargo, no se permitieron otras prescripciones de corticosteroides.
Tipos de medida de resultado
Resultados primarios
El resultado dicotómico primario fue la recaída a la atención adicional definida como una visita no programada a un profesional sanitario debido al empeoramiento de los síntomas del asma o la necesidad de tratamiento posterior con corticosteroides, que puede haber ocurrido en cualquier momento después del alta del SU. También se aceptó la aparición de la recaída en cualquier momento y también si la aparición de la recaída se informó a través del informe del paciente o de la comprobación a través de los registros de salud.
Resultados secundarios
-
La ocurrencia de eventos adversos graves (p.ej. hospitalización; ingreso en la unidad de cuidados intensivos [UCI]; muerte; recaída por visitas diferentes del empeoramiento de los síntomas del asma).
-
Eventos adversos (p.ej. dolor, celulitis/absceso, hemorragia gastrointestinal, vómitos, exacerbaciones de salud conductual/mental, dolor abdominal, insomnio, hiperfagia/aumento de peso, erupciones cutáneas, etc.).
-
Datos continuos de la prueba de la función pulmonar (incluido el flujo espiratorio máximo [FEM], cambio absoluto/porcentual en el FEM desde el inicio; volumen espiratorio forzado en un segundo [VEF₁], y cambio absoluto/porcentual en el VEF₁ desde el inicio).
-
Datos continuos a partir de las puntuaciones de los síntomas, medidos con escalas validadas.
-
Duración de los síntomas (días hasta la ausencia de los síntomas).
-
Análisis descriptivo del cumplimiento/adherencia con el tratamiento oral (corticosteroides o placebo).
-
Medidas de calidad de vida en cualquier escala validada.
-
Número de dosis de betaagonistas₂ administrados a los participantes en un período de 24 horas desde el alta.
El informe de uno o más de los resultados enumerados en la presente no fue un criterio de inclusión para la revisión.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We identified studies from the Cochrane Airways Trials Register (CATR), which is maintained by the Information Specialist for the Cochrane Airways Group. The CATR contains studies identified from several sources.
-
Monthly searches of the Cochrane Central Register of Controlled Trials (CENTRAL) in the Cochrane Library, through the Cochrane Register of Studies Online (http://crso.cochrane.org/).
-
Weekly searches of MEDLINE Ovid SP.
-
Weekly searches of Embase Ovid SP.
-
Monthly searches of PsycINFO Ovid SP.
-
Monthly searches of CINAHL EBSCO (Cumulative Index to Nursing and Allied Health Literature).
-
Monthly searches of AMED EBSCO (Allied and Complementary Medicine).
-
Handsearches of the proceedings of major respiratory conferences.
Studies contained in the CATR are identified through search strategies based on the scope of the Cochrane Airways Group. Details of these strategies, as well as a list of handsearched conference proceedings, are in Appendix 1. See Appendix 2 for search terms used to identify studies for this review. This search was completed on 14 March 2018.
In addition, an expert medical librarian (SC) conducted a supplemental search of nine electronic databases including MEDLINE (Appendix 3), Embase (Appendix 4), CINAHL (Appendix 5), Proquest Dissertation Abstracts and Theses Global (Appendix 6), SCOPUS (Appendix 7), PROSPERO (Appendix 8), the Cochrane Library (Appendix 9), and LILACS (Appendix 10) using controlled vocabulary and key words.
We also conducted an extensive search of the grey literature including ClinicalTrials.gov, the World Health Organization (WHO) International Clinical Trials Registry Platform (ICTRP), Google Scholar, bibliographies of included studies and relevant reviews, and SCOPUS forward search of a sentinel paper; and a handsearch of medical conference abstracts from 2008 to 2017 including the Canadian Journal of Emergency Medicine, Academic Emergency Medicine, and Annals of Emergency Medicine.
We conducted all searches without any restrictions on language or publication status.
Búsqueda de otros recursos
We checked the reference lists of all primary studies and review articles for additional references. We also searched relevant manufacturers' web sites for study information.
We searched for errata or retractions from included studies published in full text on PubMed and planned to report the date this was done within the review.
Obtención y análisis de los datos
Selección de los estudios
Two review authors (SWK and EC) screened the titles and abstracts of the search results independently and coded them as either potentially eligible or ineligible. We then retrieved the full‐text study reports of all potentially eligible studies and two review authors (SWK and EC) independently screened them for inclusion and recorded the reasons for exclusion of ineligible studies. We resolved any disagreement through discussion or, if required, we consulted a third review author (CVR or BHR). We identified and excluded duplicates and collated multiple reports of the same study so that each study, rather than each report, was the unit of interest in the review. We recorded the selection process in sufficient detail to complete a PRISMA flow diagram and 'Characteristics of excluded studies' table (Moher 2009).
Extracción y manejo de los datos
We used a data collection form for study characteristics and outcome data, which we piloted on at least one included study in the review. Two review authors (SWK and EC) independently extracted the following study characteristics from the included studies.
-
Methods: study design, total duration of study, details of any 'run‐in' period, number of study centres and location, study setting, withdrawals, and date of study.
-
Participants: number, mean age, age range, sex, severity of condition, diagnostic criteria, baseline lung function, smoking history, inclusion criteria, and exclusion criteria.
-
Interventions: intervention, comparison, concomitant medications, and excluded medications.
-
Outcomes: primary and secondary outcomes specified and collected, and time points reported.
-
Notes: funding for studies and notable conflicts of interest of study authors.
Two review authors (SWK and EC) independently extracted outcome data from included studies. We noted in the 'Characteristics of included studies' table if an included study did not report outcome data in a usable way. We resolved disagreements by consensus or by involving a third review author (CVR or BHR). One review author (SWK) transferred data into the Review Manager 5 (RevMan 5) file (Review Manager 2014). To ensure that the data was entered correctly, a second review author (EC) verified the extracted data for accuracy against the study report.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (SWK and EC) assessed risk of bias independently for each included study using the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). We resolved any disagreements by discussion or by involving a third review author (CVR or BHR). We assessed the risk of bias according to the following domains.
-
Random sequence generation.
-
Allocation concealment.
-
Blinding of participants and personnel.
-
Blinding of outcome assessment.
-
Incomplete outcome data.
-
Selective outcome reporting.
-
Other bias.
We judged each potential source of bias as high risk, low risk, or unclear risk and provided a quote from the study report together with a justification for our judgement in the 'Risk of bias' table. We summarised the 'Risk of bias' judgements across different studies for each of the domains listed. We considered blinding separately for different key outcomes where necessary. Where information on risk of bias relates to unpublished data or correspondence with an author, we noted this in the 'Risk of bias' table.
When considering treatment effects, we took into account the risk of bias for the studies that may have contributed to that outcome.
Assessment of bias in conducting the systematic review
We conducted the review according to the published protocol and justify any deviations from it in the 'Differences between protocol and review' section of the systematic review.
Medidas del efecto del tratamiento
Dichotomous data are reported as relative risk (RR) values and continuous data are reported as mean difference (MD) or standardised mean difference (SMD), as appropriate. If we combined data from rating scales in a meta‐analysis, we ensured we entered them with a consistent direction of effect (e.g. lower scores always indicate improvement).
We undertook meta‐analyses only when meaningful; that is, if the treatments, participants, outcomes and the underlying interventions were similar enough for pooling to make sense.
We provided a narrative description of skewed data reported as medians and interquartile ranges (IQR).
In individual studies with multiple arms, we included only the study arms assessing IM and oral corticosteroids. If we combined two comparison groups (e.g. IM corticosteroids versus different regimens of oral corticosteroids) in the same meta‐analysis, we either combined the active study arms or halved the control group to avoid double‐counting.
If a study reported outcomes at multiple time points, we used the last time point measured.
We conducted an 'as reported' and intention‐to‐treat (ITT) analysis of the primary outcome. We assessed the secondary outcomes using an 'as reported' analysis.
Cuestiones relativas a la unidad de análisis
For dichotomous outcomes, we used participants, rather than events, as the unit of analysis (i.e. number of individuals who relapsed rather than number of relapses per individual).
Manejo de los datos faltantes
We contacted investigators or study sponsors in order to verify key study characteristics and obtain missing numerical outcome data where possible (e.g. if we identified a study as an abstract only). Where this was not possible and the missing data had the potential to introduce serious bias, we took this into consideration in the GRADE rating for affected outcomes.
Evaluación de la heterogeneidad
We used the I² statistic to measure heterogeneity among the studies in each analysis. If we identified substantial heterogeneity we reported it and explored the possible causes by prespecified subgroup analysis.
Evaluación de los sesgos de notificación
We were unable to pool more than 10 studies, so we were unable to create a funnel plot to explore possible small study and publication biases.
Síntesis de los datos
We used a random‐effects model and performed a sensitivity analysis with a fixed‐effect model.
'Summary of findings' table
We created a 'Summary of findings' table using the following outcomes including: all relapse, relapse within 10 days post‐discharge, relapse after 10 days post‐discharge, adverse events, PEF/FEV₁, symptom scores, and beta₂‐agonist use in a 24‐hour period. We used the five GRADE considerations (i.e. risk of bias, consistency of effect, imprecision, indirectness, and publication bias) to assess the quality of a body of evidence as it related to the studies that contributed data for the prespecified outcomes. We used the methods and recommendations described in Section 8.5 and Chapter 12 of the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011), and used GRADEpro software (GRADEpro GDT). We justified all decisions to downgrade the quality of studies using footnotes and we made comments to aid the reader's understanding of the review where necessary.
Análisis de subgrupos e investigación de la heterogeneidad
We examined potential sources of heterogeneity in the primary outcome in the following subgroup analyses.
-
Children (zero to 18 years of age) versus adults (18 years of age and older) to examine any potential age‐specific treatment effects of IM or oral corticosteroids.
-
Relapse occurring within 10 days and over 10 days post‐discharge.
-
Low versus moderate versus high exacerbation severity based on the pulmonary function taken at the time of the participant's presentation to the ED, prior to treatment with a bronchodilator.
-
Co‐interventions received (ICS versus ICS corticosteroids/long‐acting beta₂‐agonists (LABA)).
We used the formal test for subgroup interactions in RevMan 5 (Review Manager 2014). We restricted the subgroup analysis to relapse.
Análisis de sensibilidad
We carried out the following sensitivity analyses, by removing the following types of studies from the primary outcome analyses.
-
Studies that we consider to be at high risk of bias based on the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011).
-
Studies in which the duration of oral corticosteroid treatment was less than five days.
-
The results from fixed‐effect models were compared with the random‐effects models for the main outcome.
-
Studies in which supplemental corticosteroids were provided to the patients in the ED as a co‐intervention.
Results
Description of studies
Please see Characteristics of included studies for additional information on the included studies.
Results of the search
The literature searches identified 912 studies (see Figure 1). Removing duplicates resulted in 685 potentially eligible studies overall. We selected 20 studies for full‐text review, while we excluded the remaining 665 studies, based on lack of relevance. We excluded 11 studies after full‐text review (see Excluded studies). We included the remaining nine studies in the review. We identified one of the eligible studies by grey literature search (Al‐Wahadneh 2006). A search of errata or retractions in September 2017 did not identify any retracted publications. We included insufficient studies in this review for an assessment of publication bias (i.e. by a funnel plot). We made every effort to locate all available studies through an extensive search of the literature, with no limitations set on year of publication or language of publication.

Study flow diagram.
Included studies
Publication
The first study to compare the effectiveness of IM versus oral corticosteroids in participants with acute asthma discharged from an acute care setting was published in 1988 (Hoffman 1988) while the most recent study was published in 2007 (Gordon 2007). The majority of studies were published in the United States (Gordon 2007; Gries 2000; Hoffman 1988; Klig 1997; Lahn 2004; Schuckman 1998), while the remaining studies were published in Canada (Chan 2001), Jordan (Al‐Wahadneh 2006), and Taiwan (Lee 1993). All of the studies were RCTs published in peer‐reviewed journals.
Participants/Setting
The nine studies enrolled a total of 804 participants. Overall, the studies were small clinical trials, with a range of 17 to 187 participants across the studies. Five of the studies enrolled fewer than 90 participants each (Al‐Wahadneh 2006; Gries 2000; Hoffman 1988; Klig 1997; Lee 1993). Five of the included studies enrolled adults (Chan 2001; Hoffman 1988; Lahn 2004; Lee 1993; Schuckman 1998), while the remaining four enrolled children (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997). The age of eligible children included in the studies ranged from 9 months to 14 years (Al‐Wahadneh 2006), 18 months to 7 years (Gordon 2007), 6 months to 7 years (Gries 2000), and 3 to 16 years (Klig 1997). Among the adult studies, the mean ages of participants ranged from 31 to 42 years old (Chan 2001; Hoffman 1988; Lahn 2004; Lee 1993; Schuckman 1998), while the mean age of children ranged from 3 to 6.8 years old (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997). Most of the included studies recruited more male participants, except in three studies where women comprised over 50% of participants (Chan 2001; Lahn 2004; Schuckman 1998). Only three studies reported smoking history (Chan 2001; Lahn 2004; Schuckman 1998). Chan 2001 reported that current smokers made up 31% to 33% of the participants in the IM and oral corticosteroid groups respectively. Tobacco use ranged from 35% to 38% of participants randomised to the IM and oral corticosteroid groups respectively in Lahn 2004, while Schuckman 1998 reported a range of 64% to 74% of participants randomised to receive IM or oral corticosteroids had ever smoked. All of the studies recruited participants with acute asthma presenting to an ED, except one study which recruited participants with acute asthma attending a primary care clinic (Gries 2000). We attempted to estimate and categorize exacerbation severity among the included studies based on the reported baseline pulmonary function of the included studies (Table 1). We considered studies that reported a baseline average PEF of greater than 200 L/min of the groups to be mild/moderate (Chan 2001; Lahn 2004; Lee 1993; Schuckman 1998). We considered the exacerbation severity of patients enrolled in Hoffman 1988 to be severe, as the baseline PEF of included patients was less than 150 L/min. Four studies did not report baseline pulmonary function and so exacerbation severity could not be estimated (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997).
| Studies | Pulmonary function: Eligibility criteria | Exacerbation severity |
| Severity estimated using modified scoring system based on GINA guidelines. Reported to enrolling patients with mild‐moderate exacerbations, however baseline pulmonary function of the groups was not reported. | Unable to assess | |
| Reported mean baseline PEF greater than 200 L/min: IM group: 270 L/min (SD: 103); oral group: 261 L/min (SD: 104). | Mild/moderate | |
| Reported to enrolling patients identified as moderate exacerbations, however baseline pulmonary function was not reported. | Unable to assess | |
| Applied adapted exacerbation severity score (unspecified). Reported to enrolling patients rated as mild/moderate, however baseline pulmonary function of the groups was not reported. | Unable to assess | |
| Reported baseline mean PEF of enrolled patients of less than 150 L/min: IM group: 129 L/min (SD:14); oral group: 141 L/min (SD: 14). | Severe | |
| Exacerbation severity estimated via pulmonary index score. Study reported to enrolling patients with mild/moderate exacerbations, however baseline pulmonary function was not reported. | Unable to assess | |
| Eligibility criteria required patients to have a PEFR of ≤ 70% predicted with a minimum PEFR of ≥ 40%. Reported PEF of enrolled patients was ≥ 200 L/min: IM group: 205 L/min (SD: 70); oral group: 209 L/min (SD: 72). | Mild/moderate | |
| Reported mean baseline PEF of ≥ 200 L/min: IM group: 210 L/min (SD: 30); oral group: 208 L/min (SD: 26). | Mild/moderate | |
| Reported mean baseline PEF of ≥ 200 L/min: IM group: 243.6 L/min (SD: 64); oral group: 244.7 L/min (SD: 83). | Mild/moderate |
Abbreviations:
GINA = Global Initiative for Asthma; PEF = Peak expiratory flow; PEFR = Peak expiratory flow rate; IM = intramuscular; SD = standard deviation
Intervention
All of the paediatric studies provided their participants with a single dose of IM dexamethasone (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997), while the IM corticosteroid provided in adult studies ranged from methylprednisolone (Hoffman 1988; Lahn 2004), to betamethasone (Chan 2001), dexamethasone (Lee 1993), and triamcinolone (Schuckman 1998). All of the participants randomised to receive IM corticosteroids received a single dose of IM corticosteroids prior to discharge. Only five studies were placebo controlled, in which all participants receiving IM corticosteroids were also provided with a course of oral placebo tablets (Chan 2001; Hoffman 1988; Lahn 2004; Lee 1993; Schuckman 1998). There was significant variation between the IM corticosteroid used, as well as the dosing. We provide additional information on the IM corticosteroids used in Characteristics of included studies and Table 2. We estimated corticosteroid equivalency to methylprednisolone using an equivalence converter (www.medcalc.com/steroid.html). Overall, the median dose was 78 mg with a range of 40 mg to 120 mg (Table 2).
| Studies | Location/setting | Co‐interventions | Corticosteroid doses and durations | Methyprednisolone equivalency | Relapse outcome |
| Jordan, ED | Provided in ED: not stated Provided at discharge: SABA | Dexamethasone (IM) 1.7 mg/kg Mean dose: 24 mg Single dose Prednisolone (oral) 2 mg/kg/day for 5 days Mean dose: 19.2 mg per day Total dose: 96 mg | IM Methylprednisone equivalency: 120 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 76.8 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 1/16 Day 21 Oral group 3/14 Day 21 | |
| Canada, ED | Provided in ED: SABA, methylxanthines, supplemental oral/IV corticosteroids Provided at discharge: Methylxanthines, unspecified inhaled beta₂‐agonists, and ICS | Betamethasone (IM) 12 mg Single dose. Received placebo capsules over 7 days. Prednisone (oral) 50 mg a day for 7 days. Received a single placebo injection Total dose: 350 mg | IM Methylprednisone equivalency: 72 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 280 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 12/86 Day 7 Oral group 19/82 Day 7 | |
| United States, Pediatric ED | Provided in ED: SABA, ipratropium bromide. IV corticosteroids for patients who vomited oral corticosteroids. Provided at discharge: Inhaled beta₂‐agonists and ICS | Dexamethasone (IM) 0.6 mg/kg (max 16 mg) Single dose Prednisolone (oral) 2 mg/kg (max 50 mg) daily for 5 days Total: 250 mg | IM Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12‐36 hours) Oral Methylprednisone equivalency: 200 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 8/69 Day 4 Oral group 11/73 Day 4 IM group 15/68 Day 14 Oral group 16/73 Day 14 | |
| United States, Tertiary medical center | Provided in ED: SABA Provided at discharge: SABA | Dexamethasone (IM) Patients 6 to 12 months old received 16 mg. Patients 13 to 35 months old received 24 mg. Children ≥ 36 months received 36 mg. Single dose Prednisone (oral) 2 mg/kg a day for 5 days Total dose: unclear | IM Methylprednisone equivalency: Unable to assess Oral Methylprednisone equivalency: Unable to assess | IM group 1/15 Day 28 Oral group 3/17 Day 28 | |
| United States, ED | Provided in ED: SABA, epinephrine, methylxanthines, IV corticosteroids Provided at discharge: Methylxanthine and inhaled beta₂‐agonists | Methylprednisonlone (IM) 80 mg Single dose. Received placebo capsules for 7 days Methylprednisolone (oral) Tapering dose over 7 days. Total dose: 216 mg Received placebo injection | IM Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 216 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 0/8 day Day 7 Oral group 2/10 Day 7 | |
| United States, Pediatric ED | Provided in ED: SABA Provided at discharge: SABA | Dexamethasone (IM) 0.3 mg/kg Total dose: 15 mg Single dose Prednisone (oral) 2 mg/kg a day for 3 days Total dose: 100 mg | IM Methylprednisone equivalency: 75 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 0/21 Day 5 Oral group 0/21 Day 5 | |
| United States, ED | Provided in ED: inhaled beta₂‐agonists, IV corticosteroids Provided at discharge: SABA | Methylprednisolone (IM) 160 mg Single dose. Received placebo capsules for 8 days Methylprednisolone (oral) Tapering dose over 8 days. Total dose: 160 mg (tapering dose 32 mg day 1). Received placebo injection | IM Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 13/92 Day 10 Oral group 12/88 Day 10 IM group 17/92 Day 21 Oral group 20/88 Day 21 | |
| Taiwan, ED | Provided in ED: SABA, methylxanthines Provided at discharge: Methylxanthine and inhaled beta₂‐agonists | Dexamethasone (IM) 10 mg Single dose. Received placebo capsules for 7 days Dexamethasone (oral) Tapering dose over 7 days. 11.75 mg total. Received placebo injection | IM Methylprednisone equivalency: 50 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 58.8 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 1/17 Day 7 Oral group 0/19 Day 7 | |
| United States, ED | Provided in ED: SABA, oral/IV corticosteroids Provided at discharge: SABA, antibiotics, ICS, cromolyn sodium, ipratropium bromide | Triamcinolone (IM) 40 mg Single dose. Received placebo capsules for 5 days Prednisone (oral) 40 mg a day for 5 days. Total dose: 160 mg Received placebo injection | IM Methylprednisone equivalency: 40 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 160 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 7/78 Day 7 Oral group 11/76 Day 7 |
ED = emergency department; SABA = short‐acting beta₂‐agonists; LABA = long‐acting beta₂‐agonists; IV = intravenous; IM = intramuscular; ICS = inhaled corticosteroids
Comparison
All of the paediatric studies compared IM dexamethasone to oral prednisone/prednisolone (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997). The oral corticosteroid regimen provided in the adult studies consisted of either prednisone (Chan 2001; Schuckman 1998), methylprednisolone (Hoffman 1988; Lahn 2004), or dexamethasone (Lee 1993). The paediatric studies tended to provide participants a shorter course of oral corticosteroids, lasting from three (Klig 1997) to five days (Al‐Wahadneh 2006; Gordon 2007; Gries 2000). The course of oral corticosteroids tended to last slightly longer in the adult studies, ranging from five (Schuckman 1998), seven (Hoffman 1988; Lee 1993), to eight days (Lahn 2004). Six studies provided a consistent dose of oral corticosteroids (Al‐Wahadneh 2006; Chan 2001; Gordon 2007; Gries 2000; Klig 1997; Schuckman 1998) while three studies provided a tapering dose (Hoffman 1988; Lahn 2004; Lee 1993). All participants randomised to receive oral corticosteroids were provided with their medications prior to discharge which was to be taken at home over the next 3 to 8 days. Only five studies were placebo controlled, in which all participants receiving oral corticosteroids were provided with IM placebo (Chan 2001; Hoffman 1988; Lahn 2004; Lee 1993; Schuckman 1998). We present additional information on the oral corticosteroids provided in Characteristics of included studies and Table 2. We estimated corticosteroid equivalency to methylprednisolone using an equivalence converter (www.medcalc.com/steroid.html). Overall, the median dose was 116 mg with a range of 58.8 mg to 280 mg (Table 2).
Co‐interventions
The co‐interventions provided varied among the included studies (see Characteristics of included studies and Table 2). In some cases, all participants received standardised co‐interventions (Al‐Wahadneh 2006; Gordon 2007; Hoffman 1988; Gries 2000; Klig 1997; Lee 1993; Schuckman 1998), while another study reported that participants received non‐standardized co‐interventions at the discretion of the attending physicians (Chan 2001). The most common co‐interventions provided to participants during the acute care visit included: SABA (Chan 2001; Gordon 2007; Gries 2000; Hoffman 1988; Klig 1997; Lahn 2004; Lee 1993; Schuckman 1998), methylxanthines (Chan 2001; Hoffman 1988; Lee 1993), and ipratropium bromide (Gordon 2007). In some instances, some studies reported providing participants with supplemental oral (Chan 2001; Schuckman 1998) or IV (Chan 2001; Hoffman 1988; Schuckman 1998) corticosteroids during their stay in the ED. Gordon 2007 provided participants with IV corticosteroids if they vomited the oral corticosteroids while in the ED. Co‐interventions provided to participants at discharge consisted primarily of SABA (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997; Lahn 2004; Schuckman 1998), methylxanthine (Chan 2001; Hoffman 1988; Lee 1993), LABA (Chan 2001), and unspecified inhaled beta₂‐agonists (Hoffman 1988). Supplemental corticosteroids provided at discharge were limited across the included studies. Chan 2001 and Gordon 2007 reported that the attending ED physician decided whether or not to provide participants with ICS at discharge. Participants in Lahn 2004 received ICS at discharge if they were using them previously.
Outcomes
All included studies reported relapse to additional care, with a measurement range of four to 28 days after discharge. Seven studies assessed relapse within 10 days post‐discharge (Chan 2001; Gordon 2007; Hoffman 1988; Klig 1997; Lahn 2004; Lee 1993; Schuckman 1998), while five studies measured relapse occurring more than 10 days post‐discharge (Al‐Wahadneh 2006; Chan 2001; Gordon 2007; Gries 2000; Lahn 2004). Three studies assessed relapse at two different time points after discharge (Chan 2001; Gordon 2007; Lahn 2004). In comparison to relapse, we found infrequent reporting and inconsistent measurement of our proposed secondary outcomes.
Excluded studies
We excluded 11 studies from this review, mostly due to inappropriate study design (not an RCT) (Andrews 2012; Droszcz 1981; Droszcz 1985; Ducharme 2004; Green 1995; Hofmann 2008; Kelso 2014; Ozpenpe 2011; Razi 2006; Watnick 2016; White 2010) (See Characteristics of excluded studies).
Risk of bias in included studies
Overall, the risk of bias of the included studies ranged from unclear to high and none of the studies had an overall low risk of bias (see Figure 2; Figure 3). Of the nine studies assessed, we rated four as having high risk of bias (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997), while we assessed the remaining studies as having an unclear risk of bias (Chan 2001; Hoffman 1988; Lahn 2004; Lee 1993; Schuckman 1998).

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Three studies provided adequate information on randomisation to allow for an assessment of low risk of bias for sequence generation (Lahn 2004; Lee 1993; Schuckman 1998). We considered the remaining studies to be at unclear risk of bias due to missing information on randomisation of participants (Al‐Wahadneh 2006; Chan 2001; Gordon 2007; Gries 2000; Hoffman 1988; Klig 1997). Five studies had a low risk of bias with regard to allocation concealment (Chan 2001; Gordon 2007; Klig 1997; Lahn 2004; Schuckman 1998), while the remaining studies did not provide enough information to make a clear judgement on the risk of bias on allocation concealment (Al‐Wahadneh 2006; Gries 2000; Hoffman 1988; Lee 1993).
Blinding
Given the feasibility of employing a placebo‐controlled study design, and that many outcomes of interest were collected via participant self‐report, we considered the primary and secondary outcomes of interest may have been susceptible to potential performance and detection bias. We considered three studies to have adequately blinded participants and personnel (Chan 2001; Lahn 2004; Schuckman 1998). Four studies did not blind participants or personnel, and we judged them to be at high risk of bias (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997). We considered two studies to be at unclear risk of bias due to a lack of information provided (Hoffman 1988; Lee 1993). Five studies reported adequate blinding of outcome assessors (Chan 2001; Gordon 2007; Gries 2000; Klig 1997; Schuckman 1998). We considered one study to be at high risk of bias because they did not blind outcome assessors (Al‐Wahadneh 2006), while we considered three studies to be at unclear risk of bias due to a lack of available information on the blinding of outcome assessors (Hoffman 1988; Lahn 2004; Lee 1993).
Incomplete outcome data
We assessed two studies as having an unclear risk of bias due to a lack of information on attrition (Al‐Wahadneh 2006; Lee 1993). We assessed the remaining studies as having a low risk of bias (Chan 2001; Gordon 2007; Gries 2000; Hoffman 1988; Klig 1997; Lahn 2004; Schuckman 1998).
Selective reporting
We considered only one study to be at low risk of bias for reporting bias; we received a study protocol upon request from the study authors (Chan 2001). We considered the remaining studies at be at unclear risk of reporting bias due to the lack of an available protocol (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Hoffman 1988; Klig 1997; Lahn 2004; Lee 1993; Schuckman 1998).
Other potential sources of bias
We considered four studies to be at low risk of bias for other potential sources of bias (Chan 2001; Klig 1997; Lahn 2004; Schuckman 1998). Three studies reported their source of funding in the included article (Chan 2001; Lahn 2004; Schuckman 1998), while we found additional information regarding study funding in one study (Klig 1997). Two studies received funding from general health research grants (Chan 2001; Schuckman 1998). One study received pharmaceutical company (Pfizer) sponsorship but reported that Pfizer was not involved in any aspect of the study or manuscript preparation (Lahn 2004). One study was unfunded (Klig 1997). We considered five studies to be at unclear risk of bias because the studies did not state their source of funding (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Hoffman 1988; Lee 1993). We did not consider any study to be at high risk of bias for other potential sources of bias.
Effects of interventions
See summary of findings Table for the main comparison for a summary of the main comparisons. Insufficient reporting prevented meaningful meta‐analysis of several proposed secondary outcomes, including symptom scores; relapse requiring hospitalisation; and quality of life; and specific adverse events such as pain; swelling; redness/bruising; personality changes; and insomnia.
Primary Outcome
Relapse
We detected no difference in the proportion of patients who relapsed between participants receiving IM versus oral corticosteroids (RR 0.94, 95% CI 0.72 to 1.24; 9 studies, 804 participants = 804; I² = 0%; Analysis 1.1) with low heterogeneity (I² = 0%). An ITT analysis revealed similar results (RR 0.95, 95% CI 0.72 to 1.26; 9 studies, 821 participants; I² = 0%; Analysis 1.2).
Subgroup analysis
A subgroup analysis comparing the effectiveness of IM versus oral corticosteroids to reduce relapse in paediatric (RR 0.86, 95% CI 0.48 to 1.53; 4 studies, 245 participants; I² = 0%) or adult (RR 0.97, 95% CI 0.71 to 1.33; 5 studies, 559 participants; I² = 0%) participants revealed no subgroup differences (P = 0.71; Analysis 1.3). In addition, we found no subgroup differences between studies assessing relapse within 10 days (RR 0.74, 95% CI 0.51 to 1.07; 7 studies, 742 participants; I² = 0%) or greater than 10 days post‐discharge (RR 0.99, 95% CI 0.74 to 1.33; 5 studies, 556 participants; I² = 0%) (P = 0.22; Analysis 1.4). It is important to note, however, that for the relapse greater than 10 days post‐discharge subgroup, it is unclear whether this includes relapses occurring within 10 days. We found no subgroup differences (P = 0.35; Analysis 1.5) in relapse between studies estimated to have enrolled participants with mild/moderate (RR 0.98, 95% CI 0.71 to 1.34; 4 studies, 539 participants; I² = 0%) versus severe exacerbations (RR 0.24, 95% CI 0.01 to 4.47; 1 study, 18 participants; I² = 100%). We could not complete the proposed co‐interventions subgroup comparing the effects of ICS versus ICS/LABA on relapse as planned due to a lack of studies providing information on the use of ICS and ICS/LABA agents as co‐interventions.
Sensitivity analysis
We conducted a sensitivity analysis in which we removed from the meta‐analysis the four studies considered to be at high risk of bias (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997). We identified no difference in relapse proportions between participants receiving IM or oral corticosteroids (RR 0.97, 95% CI 0.71 to 1.33; 5 studies, 559 participants; I² = 0%; Analysis 1.6). An additional sensitivity analysis, in which studies providing participants with an oral corticosteroid regimen of less than five days (Klig 1997), revealed no difference in relapse rates between participants receiving IM or oral corticosteroids (RR 0.94, 95% CI 0.72 to 1.24; 8 studies, 762 participants; I² = 0%; Analysis 1.7). Finally, fixed effects revealed similar findings to that of random effects (RR 0.91, 95% CI 0.69 to 1.19; 9 studies, 804 participants; I² = 0%; Analysis 1.8). Removing studies in which patients received additional corticosteroids as a co‐intervention during the patients' stay in the ED revealed no differences in relapse rates between participants receiving IM or oral corticosteroids (RR 0.76, 95% CI 0.45 to 1.29; 5 studies, 320 participants; I² = 0%; Analysis 1.9).
Secondary outcomes
Serious adverse effects
Insufficient reporting of serious adverse events prohibited any meaningful meta‐analysis. Only one study reported on participants relapsing and requiring hospitalisation or ICU admission by 14‐day follow‐up; however, the effect estimate is imprecise (RR 1.43, 95% CI 0.33 to 6.16; 1 study, 141 participants; Analysis 1.10) (Gordon 2007).
Adverse events
Across the included studies we found poor documentation and inconsistent measurement of adverse events associated with the use of IM and oral corticosteroids, resulting in few meaningful comparisons. Overall, a meta‐analysis did not reveal whether participants receiving IM corticosteroids are more or less likely to experience any adverse events compared to participants receiving oral corticosteroids (RR 0.83, 95% CI 0.64 to 1.07; 5 studies, 404 participants; I² = 0%; Analysis 1.11). In some cases, the occurrence of specific adverse events was reported in greater detail. We found no differences in the frequency of nausea and vomiting among participants receiving either IM or oral corticosteroids (RR 0.56, 95% CI 0.09 to 3.59; 3 studies, 320 participants; I² = 58%; Analysis 1.12). We found insufficient evidence to conclusively state whether there is a difference in the occurrence of insomnia (RR 1.74, 95% CI 0.61 to 4.97; 1 study, 171 participants; I² = 0%; Analysis 1.13) or personality changes (RR 0.82, 95% CI 0.56 to 1.19; 1 study, 30 participants; I² = 0%; Analysis 1.14) among participants receiving IM or oral corticosteroids. Some studies reported the occurrence of side effects associated with the IM corticosteroid injection. Two studies strictly reported on the occurrence of pain, swelling, and redness at the injection site among participants receiving IM corticosteroids only, as these studies did not utilize a IM placebo control group (Gordon 2007; Gries 2000). Gordon 2007 reported the proportion of paediatric participants experiencing discomfort, swelling, and redness following the IM corticosteroid injection was 1.6%, 6.5%, and 1.6% respectively. Gries 2000 reported that no paediatric participants receiving IM corticosteroids experienced any other side effects besides personality changes. Two placebo‐controlled studies compared the occurrence of pain, swelling, and redness between participants receiving IM corticosteroids compared to participants receiving oral corticosteroids who received an IM placebo injection. Overall, the imprecision of the estimate precluded identifying a difference in the occurrence of pain (RR 1.75, 95% CI 0.32 to 9.66; 2 studies, 181 participants; I² = 8%; Analysis 1.15), swelling (RR 4.76, 95% CI 0.57 to 39.84; 2 studies, 180 participants; I² = 0%; Analysis 1.16), or redness (RR 13.50, 95% CI 0.77 to 235.63; 2 studies, 175 participants; I² = 0%; Analysis 1.17) between participants receiving IM corticosteroids versus IM placebo.
Pulmonary function
None of the included studies assessing a paediatric population collected PEF or FEV₁ measures. Four studies assessed PEF among an adult population following discharge from the ED. We found no differences in PEF between participants receiving IM versus oral corticosteroids at follow‐up (MD −7.78 L/min, 95% CI −38.83 L/min to 23.28 L/min; 4 studies, 272 participants; I² = 33%; Analysis 1.18). Only one study reported on FEV₁/FVC (%), and it reported no significant differences between participants receiving IM versus oral corticosteroids (MD −1.00, 95% CI −12.44 to 10.44; 1 study, 36 participants; I² = 0%; Analysis 1.19). No studies assessed per cent change in baseline PEF following discharge from the ED.
Symptom scores
None of the included studies assessed symptom scores following discharge from the ED using validated scales. One study reported symptom scores for shortness of breath, cough, wheeze, activity limitation, and sleep disturbance at days 7 and 21 post‐discharge using an unspecified tool, in which participants were asked to give a score between 1 (indicating 'not present') to 10 (indicating 'most severe') for each symptom (Chan 2001). At day 21 post‐discharge, symptom scores between participants receiving IM versus oral corticosteroids were similar for each symptom including: shortness of breath (IM 3.8 (SD 2.4) n = 48; oral: 3.8 (SD 2.4) n = 58), cough (IM 2.8 (SD 2.2) n = 48; oral 3.4 (SD 2.4) n = 58), wheeze (IM 3.4 (SD 2.5) n = 48; oral 3.4 (SD 2.3) n = 58), activity limitation (IM 2.1 (SD 2.3) n = 48; oral 2.2 (SD 2.1) n = 58), and sleep disturbance (IM 2.9 (SD 2.7) n = 48; oral 2.8 (SD 2.7) n = 58). The study reported no significant differences in symptoms' scores between patients receiving IM or oral corticosteroids (P value not reported).
Duration of symptoms
None of the included studies reported the duration for which symptoms occurred following discharge from the ED. Three studies reported whether participants were still experiencing non‐specific symptoms at the time of follow‐up, which was assessed at day 5 (Al‐Wahadneh 2006; Gries 2000) and between 5 to 7 days post‐discharge (Hoffman 1988). We found no significant differences in the presence of symptoms at follow‐up between participants receiving IM or oral corticosteroids (RR 0.41, 95% CI 0.14 to 1.20; 3 studies, 80 participants; I² = 44%; Analysis 1.20). Three studies reported whether participants were still experiencing cough (RR 0.69, 95% CI 0.17 to 2.73; 3 studies, 178 participants; I² = 50%; Analysis 1.21) or wheezing (RR 0.59, 95% CI 0.14 to 2.52; 3 studies, 177 participants; I² = 53%; Analysis 1.22) at the time of follow‐up but no differences between participants receiving IM versus oral corticosteroids were found. As previously noted, while Chan 2001 reported symptom scores for shortness of breath, cough, wheeze, activity limitation, and sleep disturbances at days 7 and 21 post‐discharge, the study did not assess whether there was a significant difference in symptom scores between the IM and oral corticosteroid groups at days 7 and 21.
Compliance with oral medications
Three adult studies reported compliance with the oral corticosteroid treatment regimens. Although the overall compliance with the prescribed oral corticosteroid regimen varied, the reported adherence was high, with a low of 66.7% (n = 6/9; Hoffman 1988), to 94% (n = 64/68; Schuckman 1998), and 100% (n = 84/84; Chan 2001). Only two paediatric studies examined compliance with oral corticosteroids. Al‐Wahadneh 2006 reported that eight parents reported difficulties in providing their children with the oral corticosteroid tablets and four children (n = 4/14) missed between 50% and 75% of their doses. Gries 2000 reported that 41% (n = 7/17) of patients did not comply with their prescribed oral prednisone regimen, with three participants missing more than 75% of their oral prednisone doses, while another four children did not take one‐third of their medication.
Beta agonist use
Two studies reported the use of beta₂‐agonists among participants 24 hours after discharge from the ED. We found no differences in beta₂‐agonists use 24 hours after discharge from the ED among participants receiving either IM or oral corticosteroids (RR 0.54, 95% CI 0.21 to 1.37; 2 studies, 48 participants; I² = 0%; Analysis 1.23).
Discusión
Resumen de los resultados principales
Los corticosteroides sistémicos son un tratamiento efectivo para la reducción de las recaídas en los pacientes con asma agudo después del alta de un servicio de urgencias (SU) o un ámbito similar de atención de casos agudos (Krishnan 2009; Rowe 2007a). Aunque los corticosteroides sistémicos se administran habitualmente para prevenir el ingreso y reducir el riesgo de recaídas, aún no se conoce la vía de administración óptima.
Esta revisión sistemática se propuso comparar la efectividad de una dosis única de corticosteroides intramusculares (IM) con un régimen de corticosteroides orales para prevenir las recaídas entre los pacientes niños y adultos dados de alta de un SU o de un ámbito similar de atención de casos agudos para el asma aguda. Con el uso de métodos para reducir el sesgo de publicación y de selección, se identificaron nueve ensayos que incluyeron a 804 participantes y que compararon una dosis única de corticosteroides IM versus orales en participantes adultos y pediátricos con asma aguda.
En términos generales, esta revisión no pudo identificar una diferencia estadísticamente significativa en las recaídas entre los participantes que recibieron corticosteroides IM versus orales. Además, no se identificaron diferencias de subgrupos entre los niños y los adultos, las recaídas en el transcurso o después de diez días desde el alta ni los participantes que se presentaron al SU con una exacerbación leve/moderada versus grave. La efectividad de los corticosteroides IM versus orales para mitigar las recaídas siguió siendo consistente después de varios análisis de sensibilidad, incluidos los de efectos fijos versus aleatorios, las variaciones en la calidad de los estudios y las variaciones en la duración de los regímenes de corticosteroides orales. Con respecto a otros resultados clínicos importantes, el riesgo de eventos adversos entre los participantes que recibieron corticosteroides IM varió de una disminución del 36% hasta un aumento del 7%. Ningún régimen de corticosteroides demostró superioridad con respecto a las medidas de la función pulmonar, la persistencia de los síntomas o la necesidad de betaagonistas₂ después del alta.
Con un riesgo similar de recaídas, la decisión de administrar corticosteroides IM u orales a los pacientes al momento del alta probablemente incluirá otras consideraciones como la preferencia del paciente, el sabor agradable, las condiciones socioeconómicas, la capacidad para pagar las prescripciones, el perfil de efectos secundarios y la estimación de los médicos de la adherencia del paciente. Lo anterior puede variar entre los pacientes pediátricos y adultos. En los pacientes que pueden tener dificultades con el cumplimiento con un corticosteroide oral o los pacientes que previamente han presentado náuseas o vómitos al recibir corticosteroides orales, los corticosteroides IM parecen proporcionar a los médicos una opción efectiva. Desafortunadamente, la falta de informe de muchos resultados secundarios de interés limitó de forma importante el número de estudios que se pudieron incluir en cada metanálisis. Aunque todos los estudios incluidos informaron sobre los resultados de las recaídas, la mayoría de los resultados secundarios se informaron con mesura, lo que limitó la capacidad de esta revisión de establecer cualquier conclusión significativa con respecto a la efectividad general de los corticosteroides IM.
Compleción y aplicabilidad general de las pruebas
Se cree que la completitud general de la revisión es moderada. Se realizó una búsqueda extensiva de la bibliografía que identificó nueve estudios con 804 participantes. Entre los nueve estudios, cinco reclutaron adultos (n = 559) (Chan 2001; Hoffman 1988; Lahn 2004; Lee 1993; Schuckman 1998) y cuatro incluyeron niños (n = 245) (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997).
En términos generales, los estudios pediátricos tendieron a centrarse en los niños pequeños, y las medias de la edad de los grupos de corticosteroides IM y orales variaron de tres a siete años de edad. La edad de los niños elegibles incluidos en los estudios varió de nueve meses a 14 años (Al‐Wahadneh 2006), de 18 meses a siete años (Gordon 2007), de seis meses a siete años (Gries 2000) y de tres a 16 años (Klig 1997). Es importante que los estudios futuros que evalúen la efectividad de los corticosteroides en los niños con asma aguda intenten asegurar que los pacientes incluidos tengan un diagnóstico verdadero de asma: entre los estudios que incluyeron niños, solamente dos informaron la inclusión exclusiva de niños con episodios previos de enfermedades respiratorias tratados con broncodilatadores (Gordon 2007; Klig 1997).
En los estudios pediátricos hubo escasez de estudios sobre los corticosteroides sistémicos en niños de siete a 17 años de edad. Debido a la evidencia de que los niños en edad preescolar con asma aguda/sibilancias pueden no responder a los corticosteroides debido a que presentan menos eosinófilos en las vías respiratorias (Castro‐Rodriguez 2016), es posible que la efectividad de los tratamientos con corticosteroides IM u orales se pueda haber afectado por la edad de los pacientes incluidos, lo que afectaría la posibilidad de generalizar la evidencia de esta revisión. Hasta donde se sabe, se realizaron esfuerzos para evitar la inclusión de pacientes con diagnóstico de bronquiolitis en los estudios pediátricos incluidos. Sin embargo, esta contaminación tendría un efecto conservador al reducir las posibilidades de detectar una diferencia.
En los estudios en adultos, la edad de los participantes elegibles varió de más de 18 (Chan 2001), de 15 a 55 (Hoffman 1988), de 18 a 45 (Lahn 2004), de 16 a 60 (Lee 1993) y de 18 a 50 años de edad (Schuckman 1998). Mientras la mayoría de los estudios incluyó a adultos jóvenes y de edad madura, sólo un estudio incluyó a pacientes mayores de 60 (Chan 2001). Como resultado, los hallazgos de esta revisión pueden no ser aplicables a los pacientes adolescentes (hasta 14 años de edad) ni a los de edad avanzada (> 60 años) con asma aguda. Además, la efectividad de los corticosteroides en los estudios pediátricos puede estar subestimada debido a la edad de los participantes incluidos en los mismos. Todos los estudios incluidos seleccionaron a pacientes que se presentaron a consulta al SU con asma aguda, excepto Gries 2000 que incluyó a pacientes en un consultorio médico pediátrico. En términos generales, la aplicabilidad de la revisión se centra principalmente en pacientes muy jóvenes (cero a siete años de edad) y adultos jóvenes/de edad madura con asma aguda que se presentaron al SU con asma aguda en Norteamérica (Estados Unidos/Canadá). Se necesita más investigación en los centros de atención de casos agudos a través del mundo. En particular, se necesitan estudios pediátricos (que incluyan a niños en edad escolar) adicionales o en pacientes de edad muy avanzada para comprender mejor la efectividad de los corticosteroides IM versus orales en dichas poblaciones de pacientes.
El tipo de agentes IM administrados, así como las dosis empleadas, variaron considerablemente entre los estudios. Por ejemplo, los agentes IM incluyeron metilprednisolona (Hoffman 1988; Lahn 2004), betametasona (Chan 2001), dexametasona (Lee 1993) y triamcinolona (Schuckman 1998); también variaron en cuanto a la dosis. Es posible que la variación en la dosis y los agentes IM utilizados pueda haber repercutido en la efectividad de esta comparación entre corticosteroides. Además, las cointervenciones se informaron de manera deficiente; y, debido a la antigüedad de algunos de los estudios, la administración de estos agentes en la práctica clínica probablemente se haya interrumpido (p.ej. metaproterenol, aminofilina, etc.).
Algunos agentes más nuevos, que ahora son la base del tratamiento del asma crónica como los CSI y los agentes CSI/ABAP, no se prescribieron o no se informaron con detalles suficientes entre los estudios incluidos. Un estudio reciente encontró que los pacientes que recibieron CSI/ABAP al momento de la consulta al SU presentaron un riesgo más alto de recaída luego del alta (Rowe 2015) y hay evidencia de que los agentes CSI, cuando se agregan a los corticosteroides sistémicos orales (y probablemente IM) al momento del alta, pueden reducir la recaída (Rowe 1999). Entre los pacientes que se presentaron con asma aguda y que ya recibían agentes CSI, ocurrieron menos recaídas cuando los CSI/ABAP se sustituyeron por agentes CSI además de corticosteroides sistémicos orales (y probablemente IM) al momento del alta (Rowe 2007b). La falta de información sobre la administración de CSI y agentes CSI/ABAP limitó la capacidad de esta revisión de calcular la repercusión de estos agentes en la eficacia de los corticosteroides IM u orales.
Esta revisión no intentó controlar la equivalencia de los corticosteroides en los diversos regímenes de corticosteroides administrados entre los estudios. Es posible que la dosis y las propiedades farmacocinéticas de los diversos corticosteroides prescritos pudieran haber repercutido en la efectividad de los corticosteroides IM u orales. Otros estudios han comparado la efectividad de la prednisona oral versus la dexametasona oral (que tiene una vida media más larga) para mejorar los resultados en los niños con asma aguda (Paniagua 2017; Normansell 2016). Una revisión Cochrane publicada recientemente informó que no hay evidencia suficiente para identificar si las dosis inferiores o más cortas de corticosteroides orales fueron menos efectivas que las dosis más prolongadas o mayores y recomendó la realización de ensayos clínicos grandes de alta calidad adicionales (Normansell 2016). Se necesitan estudios adicionales que comparen la efectividad de diversos corticosteroides IM (p.ej. dexametasona IM versus metilprednisona IM) y la repercusión de la dosis/farmacocinética.
Calidad de la evidencia
El riesgo general de sesgo de los estudios incluidos varió de incierto a alto, y ningún estudio se consideró con riesgo bajo de sesgo. Cuatro estudios con alto riesgo de sesgo fueron ensayos no controlados con placebo (Al‐Wahadneh 2006; Gordon 2007; Gries 2000; Klig 1997). Los estudios restantes presentaron un riesgo general incierto de sesgo (Chan 2001; Hoffman 1988; Lahn 2004; Lee 1993; Schuckman 1998). La mayoría de los estudios no describió de forma adecuada el método de asignación al azar y todos, excepto Chan 2001, tuvieron un riesgo incierto de sesgo debido al informe de resultado selectivo por la falta de un protocolo disponible. Utilizando GRADE, la calidad general de los resultados varió de baja a moderada. Los resultados primarios de recaída, así como de recaída después de diez días, se redujeron a evidencia de baja calidad debido al riesgo de sesgo general incierto a alto de los estudios y a la imprecisión debido a los intervalos de confianza amplios que incluyeron efectos beneficiosos, efectos perjudiciales y ningún efecto. La calidad de los análisis de subgrupos para la recaída se consideró baja debido al número bajo de pacientes disponibles y a los intervalos de confianza amplios. La calidad del resultado de los eventos adversos se consideró baja debido al riesgo general de sesgo incierto a alto de los estudios incluidos y a la imprecisión debido a la escasez de eventos. La "persistencia de los síntomas" y "el uso de betaagonistas₂ en 24 horas" se consideraron de baja calidad debido al riesgo de sesgo general incierto a alto de los estudios incluidos, así como a la escasez de eventos. El "resultado de recaída en el transcurso de diez días" se consideró de calidad moderada debido al riesgo de sesgo general incierto a alto de los estudios. La calidad del "flujo espiratorio máximo" se redujo a moderada debido a la imprecisión de los resultados.
Sesgos potenciales en el proceso de revisión
Aunque siempre hay potencial de sesgo de evaluación y de selección de los estudios, se tomaron varias medidas para atenuar dicho riesgo. Un bibliotecario experto en ciencias de la salud realizó una búsqueda exhaustiva de la bibliografía, incluido el CATR, otra búsqueda de nueve bases de datos electrónicas y una búsqueda detallada de la literatura gris. De hecho, se identificó un estudio a partir de la literatura gris (Al‐Wahadneh 2006). No se pusieron límites con respecto al idioma, fecha de publicación o estado de publicación en ninguna de las búsquedas. Se tradujeron y seleccionaron todos los artículos en idioma extranjero identificados. Cuando la información proporcionada en el texto no permitió tomar una decisión clara con respecto a la inclusión/exclusión, se intentó establecer contacto con los autores de los estudios para aclarar la información proporcionada en el texto. Dos autores de la revisión completaron de forma independiente la selección de los estudios, que incluyó la selección de los títulos y los resúmenes y la revisión del texto completo. A pesar de los esfuerzos, se reconoce que algunos estudios podrían haberse perdido. Desafortunadamente, debido al número insuficiente de estudios incluidos, no fue posible evaluar el sesgo de publicación como se planificó (Higgins 2011). Como tal, el riesgo de sesgo de publicación se debe considerar incierto.
Acuerdos y desacuerdos con otros estudios o revisiones
Sólo se han publicado dos revisiones que comparan la efectividad de los corticosteroides IM versus orales en pacientes que se presentan a un centro de atención de casos agudos con asma aguda (Krishnan 2009; Rowe 2017). Los resultados de esta revisión son similares a una revisión general publicada previamente que comparó la efectividad de los corticosteroides IM versus orales en adultos (Krishnan 2009). La revisión identificó cinco estudios en adultos (de los cuales los cinco se incluyeron en esta revisión) y no informó diferencias significativas en las tasas de recaída en los participantes adultos que recibieron IM versus corticosteroides orales para el asma aguda después del alta del SU. A diferencia de la revisión actual, Krishnan 2009 no incluyó estudios pediátricos. Además, una revisión recientemente publicada comparó la efectividad de diversos regímenes de corticosteroides sistémicos para reducir la recaída en adultos con asma aguda (Rowe 2017). A diferencia de la revisión actual que incluyó estrictamente estudios que compararon corticosteroides IM versus orales, Rowe 2017 incluyó cualquier estudio que comparara corticosteroides IM u orales versus otros regímenes de corticosteroides orales o placebo y realizó comparaciones indirectas mediante un análisis de redes bayesiano. La revisión informó que los ciclos prolongados de corticosteroides IM y orales fueron efectivos para reducir la recaída, y la capacidad del mejor análisis del riesgo de sesgo identificó que los corticosteroides IM tuvieron el riesgo más alto de sesgo como opción de tratamiento más efectivo en comparación con los corticosteroides orales de corta duración o el ciclo prolongado de corticosteroides. A diferencia de la revisión actual, Rowe 2017 no comparó exclusivamente la efectividad de los corticosteroides IM versus orales para mitigar la recaída.
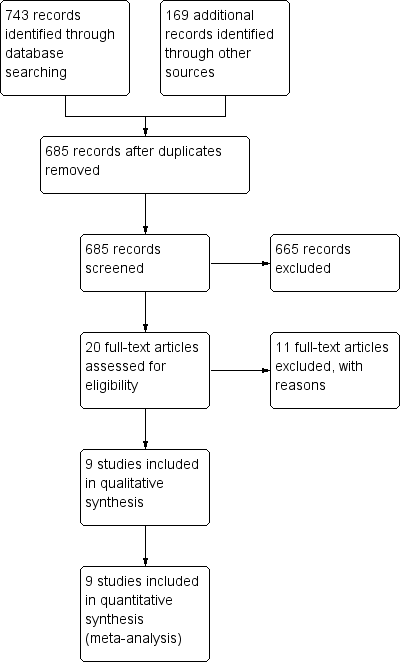
Study flow diagram.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 1 Relapse.
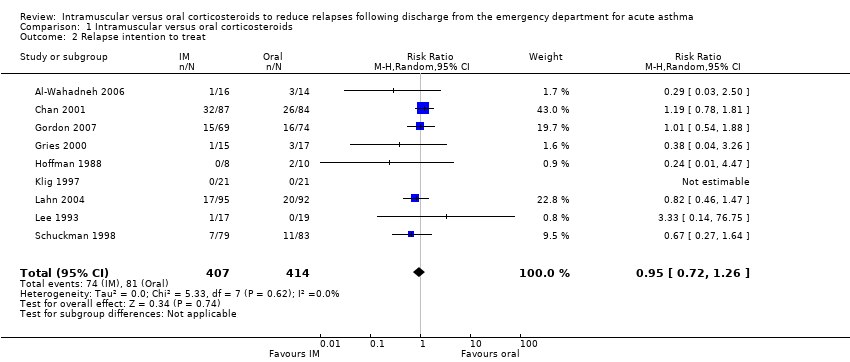
Comparison 1 Intramuscular versus oral corticosteroids, Outcome 2 Relapse intention to treat.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 3 Subgroup analysis: children versus adults.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 4 Subgroup analysis: relapse within 10 days and over 10 days post‐discharge.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 5 Subgroup analysis: mild/moderate versus severe exacerbations.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 6 Sensitivity analysis: risk of bias.
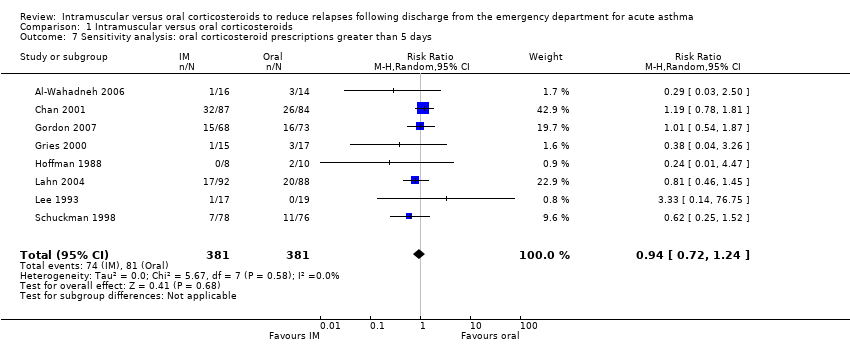
Comparison 1 Intramuscular versus oral corticosteroids, Outcome 7 Sensitivity analysis: oral corticosteroid prescriptions greater than 5 days.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 8 Sensitivity analysis: fixed effects.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 9 Sensitivity analysis: corticosteroids in ED.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 10 Serious adverse events; hospitalization following discharge.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 11 Adverse events.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 12 Adverse events: nausea/vomiting/GI distress.
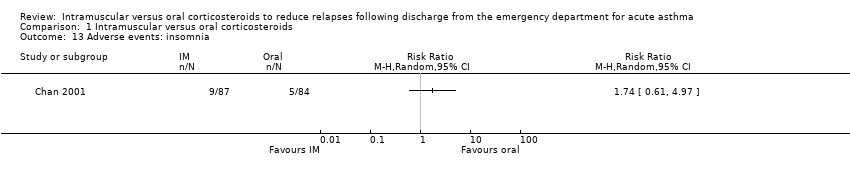
Comparison 1 Intramuscular versus oral corticosteroids, Outcome 13 Adverse events: insomnia.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 14 Adverse events: personality changes.
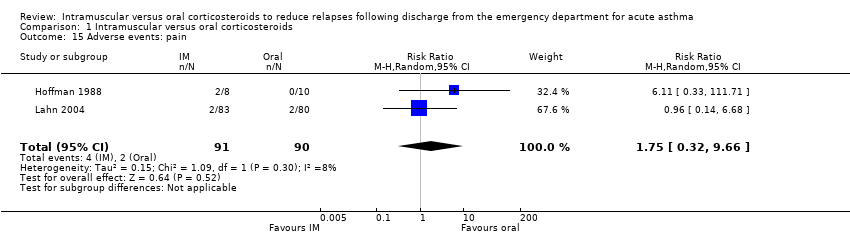
Comparison 1 Intramuscular versus oral corticosteroids, Outcome 15 Adverse events: pain.
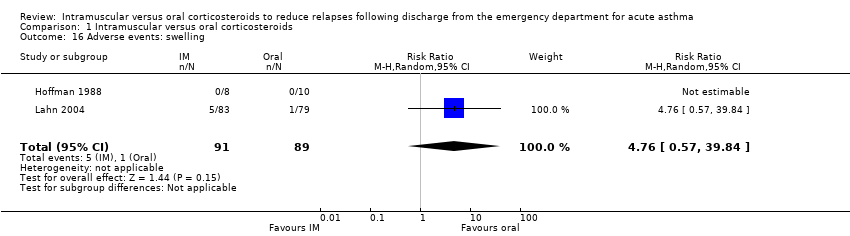
Comparison 1 Intramuscular versus oral corticosteroids, Outcome 16 Adverse events: swelling.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 17 Adverse events: redness.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 18 Pulmonary function: peak expiratory flow (L/min).

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 19 Pulmonary function: FEV₁/FVC (%).

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 20 Symptom persistence.
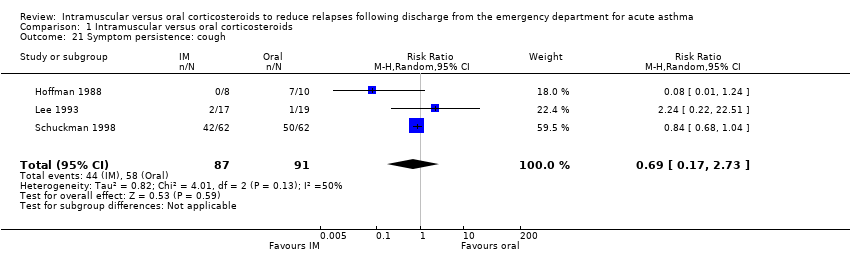
Comparison 1 Intramuscular versus oral corticosteroids, Outcome 21 Symptom persistence: cough.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 22 Symptom persistence: wheezing.

Comparison 1 Intramuscular versus oral corticosteroids, Outcome 23 24‐hour beta agonist use.
| Intramuscular corticosteroids compared to Oral corticosteroids for acute asthma | |||||
| Patient or population: patients with acute asthma | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Oral corticosteroids | Intramuscular corticosteroids | ||||
| Relapse | 201 per 1000 | 12 fewer per 1000 | RR 0.94 | 804 | ⊕⊕⊝⊝ |
| Relapse within 10 days post‐discharge | 154 per 1000 | 40 fewer per 1000 (from 75 fewer to 11 more) | RR 0.74 | 742 | ⊕⊕⊕⊝ |
| Relapse occurring after 10 days post‐discharge | 245 per 1000 | 2 fewer per 1000 | RR 0.99 | 556 | ⊕⊕⊝⊝ |
| Adverse events | 294 per 1000 | 50 fewer per 1000 | RR 0.83 | 404 | ⊕⊕⊝⊝ |
| Pulmonary function: Peak expiratory flow | The mean pulmonary function: peak expiratory flow ranged across control groups from | The mean pulmonary function: peak expiratory flow in the intervention groups was | 272 | ⊕⊕⊕⊝ | |
| Symptom persistence | 537 per 1000 | 317 fewer per 1000 | RR 0.41 | 80 | ⊕⊕⊝⊝ |
| 24‐hour beta agonist use | 375 per 1000 | 172 fewer per 1000 | RR 0.54 | 48 | ⊕⊕⊝⊝ |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Downgraded 1 level for risk of bias. Majority of studies received an unclear risk of bias for random sequence generation and selective outcome reporting | |||||
| Studies | Pulmonary function: Eligibility criteria | Exacerbation severity |
| Severity estimated using modified scoring system based on GINA guidelines. Reported to enrolling patients with mild‐moderate exacerbations, however baseline pulmonary function of the groups was not reported. | Unable to assess | |
| Reported mean baseline PEF greater than 200 L/min: IM group: 270 L/min (SD: 103); oral group: 261 L/min (SD: 104). | Mild/moderate | |
| Reported to enrolling patients identified as moderate exacerbations, however baseline pulmonary function was not reported. | Unable to assess | |
| Applied adapted exacerbation severity score (unspecified). Reported to enrolling patients rated as mild/moderate, however baseline pulmonary function of the groups was not reported. | Unable to assess | |
| Reported baseline mean PEF of enrolled patients of less than 150 L/min: IM group: 129 L/min (SD:14); oral group: 141 L/min (SD: 14). | Severe | |
| Exacerbation severity estimated via pulmonary index score. Study reported to enrolling patients with mild/moderate exacerbations, however baseline pulmonary function was not reported. | Unable to assess | |
| Eligibility criteria required patients to have a PEFR of ≤ 70% predicted with a minimum PEFR of ≥ 40%. Reported PEF of enrolled patients was ≥ 200 L/min: IM group: 205 L/min (SD: 70); oral group: 209 L/min (SD: 72). | Mild/moderate | |
| Reported mean baseline PEF of ≥ 200 L/min: IM group: 210 L/min (SD: 30); oral group: 208 L/min (SD: 26). | Mild/moderate | |
| Reported mean baseline PEF of ≥ 200 L/min: IM group: 243.6 L/min (SD: 64); oral group: 244.7 L/min (SD: 83). | Mild/moderate | |
| Abbreviations: GINA = Global Initiative for Asthma; PEF = Peak expiratory flow; PEFR = Peak expiratory flow rate; IM = intramuscular; SD = standard deviation | ||
| Studies | Location/setting | Co‐interventions | Corticosteroid doses and durations | Methyprednisolone equivalency | Relapse outcome |
| Jordan, ED | Provided in ED: not stated Provided at discharge: SABA | Dexamethasone (IM) 1.7 mg/kg Mean dose: 24 mg Single dose Prednisolone (oral) 2 mg/kg/day for 5 days Mean dose: 19.2 mg per day Total dose: 96 mg | IM Methylprednisone equivalency: 120 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 76.8 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 1/16 Day 21 Oral group 3/14 Day 21 | |
| Canada, ED | Provided in ED: SABA, methylxanthines, supplemental oral/IV corticosteroids Provided at discharge: Methylxanthines, unspecified inhaled beta₂‐agonists, and ICS | Betamethasone (IM) 12 mg Single dose. Received placebo capsules over 7 days. Prednisone (oral) 50 mg a day for 7 days. Received a single placebo injection Total dose: 350 mg | IM Methylprednisone equivalency: 72 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 280 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 12/86 Day 7 Oral group 19/82 Day 7 | |
| United States, Pediatric ED | Provided in ED: SABA, ipratropium bromide. IV corticosteroids for patients who vomited oral corticosteroids. Provided at discharge: Inhaled beta₂‐agonists and ICS | Dexamethasone (IM) 0.6 mg/kg (max 16 mg) Single dose Prednisolone (oral) 2 mg/kg (max 50 mg) daily for 5 days Total: 250 mg | IM Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12‐36 hours) Oral Methylprednisone equivalency: 200 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 8/69 Day 4 Oral group 11/73 Day 4 IM group 15/68 Day 14 Oral group 16/73 Day 14 | |
| United States, Tertiary medical center | Provided in ED: SABA Provided at discharge: SABA | Dexamethasone (IM) Patients 6 to 12 months old received 16 mg. Patients 13 to 35 months old received 24 mg. Children ≥ 36 months received 36 mg. Single dose Prednisone (oral) 2 mg/kg a day for 5 days Total dose: unclear | IM Methylprednisone equivalency: Unable to assess Oral Methylprednisone equivalency: Unable to assess | IM group 1/15 Day 28 Oral group 3/17 Day 28 | |
| United States, ED | Provided in ED: SABA, epinephrine, methylxanthines, IV corticosteroids Provided at discharge: Methylxanthine and inhaled beta₂‐agonists | Methylprednisonlone (IM) 80 mg Single dose. Received placebo capsules for 7 days Methylprednisolone (oral) Tapering dose over 7 days. Total dose: 216 mg Received placebo injection | IM Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 216 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 0/8 day Day 7 Oral group 2/10 Day 7 | |
| United States, Pediatric ED | Provided in ED: SABA Provided at discharge: SABA | Dexamethasone (IM) 0.3 mg/kg Total dose: 15 mg Single dose Prednisone (oral) 2 mg/kg a day for 3 days Total dose: 100 mg | IM Methylprednisone equivalency: 75 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 0/21 Day 5 Oral group 0/21 Day 5 | |
| United States, ED | Provided in ED: inhaled beta₂‐agonists, IV corticosteroids Provided at discharge: SABA | Methylprednisolone (IM) 160 mg Single dose. Received placebo capsules for 8 days Methylprednisolone (oral) Tapering dose over 8 days. Total dose: 160 mg (tapering dose 32 mg day 1). Received placebo injection | IM Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 80 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 13/92 Day 10 Oral group 12/88 Day 10 IM group 17/92 Day 21 Oral group 20/88 Day 21 | |
| Taiwan, ED | Provided in ED: SABA, methylxanthines Provided at discharge: Methylxanthine and inhaled beta₂‐agonists | Dexamethasone (IM) 10 mg Single dose. Received placebo capsules for 7 days Dexamethasone (oral) Tapering dose over 7 days. 11.75 mg total. Received placebo injection | IM Methylprednisone equivalency: 50 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 58.8 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 1/17 Day 7 Oral group 0/19 Day 7 | |
| United States, ED | Provided in ED: SABA, oral/IV corticosteroids Provided at discharge: SABA, antibiotics, ICS, cromolyn sodium, ipratropium bromide | Triamcinolone (IM) 40 mg Single dose. Received placebo capsules for 5 days Prednisone (oral) 40 mg a day for 5 days. Total dose: 160 mg Received placebo injection | IM Methylprednisone equivalency: 40 mg Duration: intermediate half‐life (12 to 36 hours) Oral Methylprednisone equivalency: 160 mg Duration: intermediate half‐life (12 to 36 hours) | IM group 7/78 Day 7 Oral group 11/76 Day 7 | |
| ED = emergency department; SABA = short‐acting beta₂‐agonists; LABA = long‐acting beta₂‐agonists; IV = intravenous; IM = intramuscular; ICS = inhaled corticosteroids | |||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Relapse Show forest plot | 9 | 804 | Risk Ratio (M‐H, Random, 95% CI) | 0.94 [0.72, 1.24] |
| 2 Relapse intention to treat Show forest plot | 9 | 821 | Risk Ratio (M‐H, Random, 95% CI) | 0.95 [0.72, 1.26] |
| 3 Subgroup analysis: children versus adults Show forest plot | 9 | 804 | Risk Ratio (M‐H, Random, 95% CI) | 0.94 [0.72, 1.24] |
| 3.1 Children | 4 | 245 | Risk Ratio (M‐H, Random, 95% CI) | 0.86 [0.48, 1.53] |
| 3.2 Adults | 5 | 559 | Risk Ratio (M‐H, Random, 95% CI) | 0.97 [0.71, 1.33] |
| 4 Subgroup analysis: relapse within 10 days and over 10 days post‐discharge Show forest plot | 9 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 4.1 Within 10 days post‐discharge | 7 | 742 | Risk Ratio (M‐H, Random, 95% CI) | 0.74 [0.51, 1.07] |
| 4.2 Greater than 10 days post‐discharge | 5 | 556 | Risk Ratio (M‐H, Random, 95% CI) | 0.99 [0.74, 1.33] |
| 5 Subgroup analysis: mild/moderate versus severe exacerbations Show forest plot | 5 | 557 | Risk Ratio (M‐H, Random, 95% CI) | 0.96 [0.70, 1.32] |
| 5.1 Mild/moderate exacerbations | 4 | 539 | Risk Ratio (M‐H, Random, 95% CI) | 0.98 [0.71, 1.34] |
| 5.2 Severe exacerbations | 1 | 18 | Risk Ratio (M‐H, Random, 95% CI) | 0.24 [0.01, 4.47] |
| 6 Sensitivity analysis: risk of bias Show forest plot | 5 | 559 | Risk Ratio (M‐H, Random, 95% CI) | 0.97 [0.71, 1.33] |
| 7 Sensitivity analysis: oral corticosteroid prescriptions greater than 5 days Show forest plot | 8 | 762 | Risk Ratio (M‐H, Random, 95% CI) | 0.94 [0.72, 1.24] |
| 8 Sensitivity analysis: fixed effects Show forest plot | 9 | 804 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.91 [0.69, 1.19] |
| 9 Sensitivity analysis: corticosteroids in ED Show forest plot | 5 | 320 | Risk Ratio (M‐H, Random, 95% CI) | 0.76 [0.45, 1.29] |
| 10 Serious adverse events; hospitalization following discharge Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 11 Adverse events Show forest plot | 5 | 404 | Risk Ratio (M‐H, Random, 95% CI) | 0.83 [0.64, 1.07] |
| 12 Adverse events: nausea/vomiting/GI distress Show forest plot | 3 | 320 | Risk Ratio (M‐H, Random, 95% CI) | 0.56 [0.09, 3.59] |
| 13 Adverse events: insomnia Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 14 Adverse events: personality changes Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 15 Adverse events: pain Show forest plot | 2 | 181 | Risk Ratio (M‐H, Random, 95% CI) | 1.75 [0.32, 9.66] |
| 16 Adverse events: swelling Show forest plot | 2 | 180 | Risk Ratio (M‐H, Random, 95% CI) | 4.76 [0.57, 39.84] |
| 17 Adverse events: redness Show forest plot | 2 | 175 | Risk Ratio (M‐H, Random, 95% CI) | 13.5 [0.77, 235.63] |
| 18 Pulmonary function: peak expiratory flow (L/min) Show forest plot | 4 | 272 | Mean Difference (IV, Random, 95% CI) | ‐7.78 [‐38.83, 23.28] |
| 19 Pulmonary function: FEV₁/FVC (%) Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 20 Symptom persistence Show forest plot | 3 | 80 | Risk Ratio (M‐H, Random, 95% CI) | 0.41 [0.14, 1.20] |
| 21 Symptom persistence: cough Show forest plot | 3 | 178 | Risk Ratio (M‐H, Random, 95% CI) | 0.69 [0.17, 2.73] |
| 22 Symptom persistence: wheezing Show forest plot | 3 | 177 | Risk Ratio (M‐H, Random, 95% CI) | 0.59 [0.14, 2.52] |
| 23 24‐hour beta agonist use Show forest plot | 2 | 48 | Risk Ratio (M‐H, Random, 95% CI) | 0.54 [0.21, 1.37] |

