Ensayos de comparación directa de antibióticos para la bronquiectasia
Resumen
Antecedentes
El diagnóstico de bronquiectasia se define por la dilatación anormal de las vías respiratorias, relacionada con un mecanismo patológico de destrucción progresiva de las vías respiratorias debido a un "ciclo vicioso" de infección bacteriana recurrente, liberación de mediadores inflamatorios, daño de las vías respiratorias e infección adicional posterior. Los antibióticos son la principal opción terapéutica para reducir la carga bacteriana en los pacientes con exacerbaciones de la bronquiectasia y para la erradicación a más largo plazo, pero su uso se ve afectado por los efectos adversos potenciales y las inquietudes con respecto a la resistencia a los antibióticos. Se han destacado como aspectos importantes a considerar la efectividad comparativa, la relación entre costo y efectividad y la seguridad de diferentes antibióticos, pero en la actualidad se dispone de poca evidencia que ayude a resolver la incertidumbre con respecto a los mismos.
Objetivos
Evaluar los efectos comparativos de diferentes antibióticos en el tratamiento de adultos y niños con bronquiectasia.
Métodos de búsqueda
Los ensayos controlados aleatorios (ECA) se identificaron mediante búsquedas en el registro de ensayos del Grupo Cochrane de Vías Respiratorias (Cochrane Airways Group Register of trials) y en registros de ensayos en línea, realizadas el 30 de abril de 2018. Estas búsquedas se ampliaron al revisar las listas de referencias de los estudios publicados.
Criterios de selección
Se incluyeron los ECA informados como artículos de texto completo, los publicados como resúmenes solamente y los datos no publicados. Se incluyó a adultos y niños (menores de 18 años) con un diagnóstico de bronquiectasia por broncografía o tomografía computarizada de alta resolución, que informaron signos y síntomas diarios, como tos, producción de esputo o hemoptisis y los que presentaron episodios recurrentes de infección pulmonar; se incluyeron los estudios que compararon un antibiótico versus otro cuando se administraron con el mismo método.
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, evaluaron la selección de los ensayos, la extracción de los datos y el riesgo de sesgo. La calidad general de la evidencia se evaluó mediante los criterios GRADE. Se realizaron esfuerzos para recopilar datos faltantes de los autores. Los resultados se presentaron con los intervalos de confianza del 95% (IC) como diferencias medias (DM) u odds ratios (OR).
Resultados principales
Cuatro ensayos aleatorios fueron elegibles para inclusión en esta revisión sistemática (dos estudios con 83 adultos que compararon fluoroquinolonas con β‐lactámicos y dos estudios con 55 adultos que compararon aminoglucósidos con polimixinas).
Ninguno de los estudios incluidos presentó información sobre las exacerbaciones (uno de los resultados primarios). Los estudios incluidos no informaron eventos adversos graves (otro de los resultados primarios) ni muertes. Esta evidencia se consideró de calidad baja o muy baja. Los estudios incluidos no informaron la calidad de vida. La comparación entre las fluoroquinolonas y los β‐lactámicos (amoxicilina) mostró menos fracasos del tratamiento en el grupo de fluoroquinolona que en el grupo de amoxicilina (OR 0,07; IC del 95%: 0,01 a 0,32; evidencia de calidad baja) después de siete a diez días de tratamiento. Los investigadores informaron que la infección por Pseudomonas aeruginosa se erradicó en más pacientes tratados con fluoroquinolonas (OR de Peto 20,09; IC del 95%: 2,83 a 142,59; evidencia de calidad baja), pero no aportaron evidencia de diferencias en el número de pacientes con mejoría en la purulencia del esputo (OR 2,35; IC del 95%: 0,96 a 5,72; evidencia de muy baja calidad). Los autores de los estudios no presentaron evidencia de efectos beneficiosos relacionados con el volumen espiratorio forzado en un segundo (VEF₁). Los dos estudios que compararon las polimixinas versus los aminoglucósidos no describieron diferencias evidentes entre los grupos en la proporción de participantes con erradicación de la P. aeruginosa(OR 1,40; IC del 95%: 0,36 a 5,35; evidencia de muy baja calidad) ni en la mejoría en la purulencia del esputo (OR 0,16; IC del 95%: 0,01 a 3,85; evidencia de muy baja calidad). La evidencia para los cambios del VEF₁ no fue concluyente. Dos de tres ensayos informaron eventos adversos, pero no informaron la proporción de participantes con uno o más eventos adversos, de manera que no fue posible interpretar la información.
Conclusiones de los autores
Evidencia de calidad baja limitada favorece a las fluoroquinolonas orales a corto plazo sobre los antibióticos betalactámicos en los pacientes hospitalizados con exacerbaciones. La evidencia de muy baja calidad no indica efectos beneficiosos con los aminoglucósidos inhalados versus las polimixinas. Los ECA no han presentado evidencia que compare otras vías de administración para cada una de estas comparaciones y ningún ECA ha incluido niños. En términos generales, la evidencia actual a partir de un número limitado de ensayos de comparación directa en adultos o niños con bronquiectasia no es suficiente para guiar la selección de los antibióticos para el tratamiento a corto o largo plazo. Se necesitan más estudios sobre este tema.
PICO
Resumen en términos sencillos
¿Cómo se comparan diferentes antibióticos en cuanto a la seguridad y la efectividad del tratamiento en los pacientes con bronquiectasia?
Antecedentes
La bronquiectasia se define como la dilatación anormal de las vías respiratorias de los pulmones. Generalmente es causada por infecciones pulmonares repetidas de origen bacteriano, que lesionan las vías respiratorias. Los antibióticos son la opción principal para tratar estas infecciones y se utilizan para prevenir las infecciones repetidas a más largo plazo. Sin embargo, el uso de los antibióticos se debe considerar en relación con los efectos secundarios potenciales y las inquietudes sobre la aparición de resistencia bacteriana al tratamiento antibiótico que reduce la efectividad. Solo un escaso número de estudios se ha centrado en los antibióticos para los pacientes con bronquiectasia. Es necesario lograr cuanto antes una mayor claridad con respecto a la efectividad de distintos antibióticos.
Características de los estudios
En abril de 2018, se buscaron estudios en adultos o niños con bronquiectasia que asignaran al azar a los participantes a recibir un antibiótico u otro por la misma vía de administración. Solo se encontraron cuatro estudios y eran muy pequeños. En total, incluyeron 138 participantes. Es difícil establecer conclusiones a partir de esta muestra pequeña.
Resultados clave
Cuatro ensayos aleatorios fueron elegibles para inclusión en esta revisión sistemática. Ninguno de los estudios incluidos presentó información sobre las exacerbaciones. Los estudios incluidos no informaron muertes ni eventos adversos graves. Los fracasos del tratamiento fueron menos con las fluoroquinolonas que con la amoxicilina.
Calidad de la evidencia
Los autores de la revisión consideraron que la calidad de la evidencia proporcionada por los cuatro pequeños estudios incluidos era baja o muy baja.
Mensaje clave
Las fluoroquinolonas pueden ser más exitosas que la amoxicilina en el tratamiento de las exacerbaciones, pero este resultado se basa en evidencia de calidad baja. Se necesita más evidencia de ensayos clínicos de alta calidad del tratamiento a corto y largo plazo con antibióticos si se desea establecer conclusiones firmes sobre los beneficios de un antibiótico sobre otro en los pacientes con bronquiectasia.
Conclusiones de los autores
Summary of findings
| Fluoroquinolones compared to amoxicillin for bronchiectasis: short‐term studies (< 4 weeks) | ||||||
| Patient or population: adults aged 18 years and above with diagnosis of non‐cystic fibrosis bronchiectasis | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with amoxicillin | Risk with fluoroquinolones | |||||
| Exacerbations | ‐ | ‐ | Not estimable | ‐ | ‐ | Outcome not reported in included studies |
| Serious adverse events | 0 per 1000 | 0 per 1000 | Not estimable | 83 (2 RCTs) | ⊕⊕⊝⊝ | Evidence graded on the overall quality of the study |
| Response rate ‐ treatment failure | 429 per 1000 | 50 per 1000 | OR 0.07 | 83 | ⊕⊕⊝⊝ | |
| Response rate ‐ microbiological response | 2 out of 8 participants responded. | 8 out of 8 participants responded. | Peto OR 20.09 (2.83 to 142.59) | 16 | ⊕⊕⊝⊝ | Small single study. Peto OR used owing to 100% response in intervention arm |
| Response rate ‐ improvement in sputum purulence (excellent) | 357 per 1000 | 566 per 1000 | OR 2.35 | 83 | ⊕⊝⊝⊝ | |
| Deaths | 0 per 1000 | 0 per 1000 | Not estimable | 83 (2 RCTs) | ⊕⊕⊝⊝ | No deaths reported. Evidence graded on the overall quality of the study |
| Quality of life | ‐ | ‐ | Not estimable | ‐ | ‐ | Outcome not reported in included studies |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne point deducted in relation to design and implementation of available studies suggesting likelihood of bias (unclear generation of randomisation sequence, potential selective reporting bias, and risk of other bias in Lam 1989). bOne point deducted for imprecision (small sample size and few events). cOne point deducted for imprecision (wide confidence interval). | ||||||
| Polymyxins compared to aminoglycosides for bronchiectasis: long‐term studies (≥ 4 weeks) | ||||||
| Patient or population: adults aged 18 years and above with diagnosis of bronchiectasis | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with aminoglycosides | Risk with polymyxins | |||||
| Exacerbation | ‐ | ‐ | Not estimable | ‐ | ‐ | Outcome not reported in included studies |
| Serious adverse events | 0 per 1000 | 0 per 1000 | Not estimable | 20 (1 RCT) | ⊕⊝⊝⊝ | Evidence graded on the overall quality of the study |
| Response rate ‐ improvement in sputum purulence | 800 per 1000 | 390 per 1000 (38 to 939) | OR 0.16 (0.01 to 3.85) | 20 | ⊕⊝⊝⊝ | Definition of improvement not reported |
| Response rate ‐ P aeruginosa eradication | 471 per 1000 | 554 per 1000 (242 to 826) | OR 1.40 (0.36 to 5.35) | 35 (1 RCT) | ⊕⊝⊝⊝ | Head‐to‐head comparison not reported directly |
| Deaths | 0 per 1000 | 0 per 1000 | Not estimable | 20 | ⊕⊝⊝⊝ | No deaths reported. Evidence graded on the overall quality of the study |
| Quality of life | ‐ | ‐ | Not estimable | ‐ | ‐ | Outcome not reported in included studies |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne point deducted in relation to design and implementation of available studies suggesting likelihood of bias (all study methods unclear). bOne point deducted for indirectness (no direct head‐to‐head comparisons). cOne point deducted for imprecision (small sample size and few events). dOne point deducted for imprecision (wide confidence intervals). | ||||||
Antecedentes
Descripción de la afección
La bronquiectasia se caracteriza por la dilatación anormal de las vías respiratorias, relacionada con un mecanismo patológico de destrucción progresiva de las vías respiratorias debido a un "ciclo vicioso" de infección bacteriana recurrente, liberación de mediadores inflamatorios, daño de las vías respiratorias e infección adicional posterior (Cole 1986). Las vías respiratorias muestran inflamación crónica con diversas características, incluida la pérdida del epitelio ciliado y la hipertrofia de las glándulas mucosas. La colonización bacteriana se ve facilitada por esta pérdida de estructura epitelial integral (defensa del huésped) que, a la vez, activa más respuesta inmunitaria y más proceso inflamatorio. La comprensión de este ciclo es central para el tratamiento de la bronquiectasia, y se necesitan estrategias para detener tanto los componentes inflamatorios como bacterianos y limitar la progresión de la lesión pulmonar. Habitualmente, la microbiología de los pacientes con bronquiectasia incluye Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis y Pseudomonasaeruginosa, aunque el perfil microbiológico del último microorganismo difiere entre los adultos y los niños, ya que es más frecuente en los adultos y la prevalencia en niños es solo del 0% al 6% . La colonización por P aeruginosa a menudo ocurre como parte de la evolución natural de la afección y puede implicar un peor pronóstico en cuanto a los síntomas, las exacerbaciones y la pérdida de la función pulmonar (Evans 1996). En los casos graves, el ciclo de infección pulmonar puede llevar a hospitalización repetida, insuficiencia respiratoria crónica y muerte.
La mayoría de los casos de bronquiectasia en pacientes adultos son idiopáticos o resultan de una infección pulmonar grave anterior. Sin embargo, en una minoría de casos se pueden identificar causas tratables, como deficiencia inmunológica, aspergilosis broncopulmonar alérgica, infección micobacteriana y aspiración recurrente (Goeminne 2012; Pasteur 2010; Wilson 2013). Un estudio encontró que una proporción de casos se asoció con enfermedad pulmonar obstructiva crónica (EPOC) y enfermedades del tejido conectivo (Loni 2015). Las causas subyacentes se pueden determinar hasta en el 70% de los casos en niños (Eastham 2004; Twiss 2005). El diagnóstico se basa en una combinación de síntomas clínicos y tomografía computarizada (TC) de alta resolución que muestra uno o más bronquios con dilatación anormal(Chang 2010; Pasteur 2010). Los síntomas pueden incluir: tos productiva crónica, sibilancias y disnea, junto con infecciones recurrentes de vías respiratorias inferiores. La prevalencia calculada en un estudio para la P. aeruginosa en la bronquiectasia fue del 15% (Araújo 2018). La colonización por P. aeruginosa y las exacerbaciones frecuentes se asocian con un deterioro más rápido de la función pulmonar (Evans 1996; Martínez García 2007) y, junto con el deterioro de la capacidad de ejercicio y los síntomas respiratorios, una menor calidad de vida y un mayor número de hospitalizaciones (Finch 2015; Wilson 1997).
El tratamiento de la bronquiectasia requiere una atención minuciosa de la eliminación del esputo, el tratamiento broncodilatador y la prescripción de antibióticos (Welsh 2015). A corto plazo, el objetivo principal es reducir la carga microbiana para disminuir la gravedad y la frecuencia de las exacerbaciones y así mejorar los síntomas y la calidad de vida (Pasteur 2010) y el objetivo a más largo plazo es interrumpir el ciclo de infección, enlentecer la disminución de la función pulmonar y reducir las tasas de mortalidad. Los antibióticos se han reservado tradicionalmente para el tratamiento de la infección aguda/exacerbación, aunque las estrategias de profilaxis pueden cumplir una función en algunos casos. Está en aumento el interés por el uso de macrólidos y hay ensayos que han explorado la prescripción en pacientes con bronquiectasia (Wu 2014).
Los cálculos de prevalencia a nivel global no están claros debido a la variabilidad en las estrategias de diagnóstico (Weycker 2005), junto con una mayor tasa de prevalencia en los países de ingresos bajos y medios (Habesoglu 2011). Las tasas de mortalidad en Inglaterra y Gales aumentaron en el 3% por año entre 2001 y 2007 (Roberts 2010) y las hospitalizaciones aumentaron en el 3% por año durante un período de nueve años en los EE.UU.(Seitz 2010). Las mayores tasas de prevalencia se asociaron con pacientes mayores de 60 años de edad y con mujeres, y hubo variación según el grupo étnico (Chang 2003; Seitz 2012). Datos recientes de un estudio del Reino Unido indican que la incidencia y la prevalencia pueden ser mayores que las estimadas anteriormente(Quint 2016). Durante un período de nueve años hasta 2013, las tasas de prevalencia puntuales por 100 000 aumentaron de 350,5 a 566,1 en las mujeres y de 301,2 a 485,5 en los hombres. Estos datos representan un aumento de más del 60%, con casi 263 000 adultos que vivían con bronquiectasia en 2013. De manera similar, la tasa de incidencia por 100 000 personas‐años aumentó de 21,2 a 35,2 en las mujeres y de 18,2 a 26,9 en los hombres, lo que representa un incremento aproximado de casos nuevos del 63% a más de 15 000 en 2013. La bronquiectasia también se asocia con tasas de mortalidad mayores ajustadas por edad, con cálculos 2,26 veces mayores en las mujeres y 2,14 veces mayores en los hombres en comparación con la población general (Quint 2016). La enfermedad tiene una repercusión significativa sobre las poblaciones pediátricas y la calidad de vida es peor en los niños más pequeños y en los que la tasa anual de exacerbación es más frecuente (Kapur 2012). Los cálculos de prevalencia a nivel global son variables, con una variación de cálculos moderados de 17,2 en el nordeste de Inglaterra (como se informó en Eastham 2004) a 33,5 en Nueva Zelanda (presentado en Twiss 2005) por 100 000 niños menores de 15 años de edad. Las tasas pueden ser mayores en los niños de poblaciones indígenas, con cálculos de uno por 625 (160 por 100 000) en los niños de las Islas del Pacífico (Twiss 2005), 15 por 1000 (1500 por 100 000) en los niños nativos aborígenes australianos de la zona central y 16 por 1000 (1600 por 100 000) en los niños nativos de Alaska (Chang 2002; Singleton 2000). Sin embargo, este aumento de la bronquiectasia puede representar mejores tasas de detección con la tomografía computarizada (TC) de alta calidad, en lugar de un aumento verdadero de la prevalencia (Goeminne 2016).
La carga económica de la bronquiectasia puede ser considerable, pero se dispone de escasa información. Los datos recopilados en 2001 en los EE.UU. mostraron un adicional de dos días en el hospital, seis visitas más de pacientes ambulatorios y 27,2 más días de antibioticoterapia asociada con la bronquiectasia (Weycker 2005). El cálculo de los costos anuales adicionales globales de la bronquiectasia varían entre USD 5681 y USD 7827, sobre la base de datos obtenidos entre 2001 y 2009 (Joish 2013; Seitz 2010; Weycker 2005).
Descripción de la intervención
La bronquiectasia se caracteriza por tos diaria, expectoración de esputo e infección respiratoria recurrente. Las infecciones repetidas a menudo culminan en la colonización bacteriana con dilatación e inflamación de las vías respiratorias. Aunque las anomalías pueden ser panlobulares (es decir, comprometer ambos pulmones), la bronquiectasia puede estar limitada a un solo lóbulo pulmonar o se puede presentar de manera irregular. Los antibióticos se usan para reducir la carga bacteriana y contrarrestar el ciclo de infección y daño tisular (Cole 1984; Pasteur 2010). Pueden ser administrados a corto plazo (menos de cuatro semanas) para el tratamiento de las exacerbaciones agudas o a más largo plazo (≥ cuatro semanas). El tratamiento más prolongado con antibióticos se utiliza para erradicar los agentes patógenos, suprimir la carga bacteriana o mejorar las propiedades antiinflamatorias (p.ej., macrólidos). Se dispone de diversas vías de administración, como la vía oral, inhalatoria y parenteral y la opción específica de antibiótico resulta del análisis de la bacteriología del esputo (Polverino 2017). La prescripción también surge del contexto clínico, y la bacteriología y la purulencia del esputo se consideran indicadores fiables de la necesidad de tratamiento (Hill 1988). Por tanto, los antibióticos pueden ser prescritos antes de obtener los resultados de la bacteriología del esputo. Los antibióticos son el tratamiento de primera línea para la carga bacteriana en la bronquiectasia, pero el uso se modera en relación con los efectos adversos y una mayor inquietud sobre la resistencia a los antibióticos (Pasteur 2010).
De qué manera podría funcionar la intervención
Se han aplicado varias estrategias antibióticas para reducir la carga bacteriana y las tasas de reinfección en los pacientes con bronquiectasia, incluidas las prescripciones a corto plazo para las exacerbaciones agudas y el uso profiláctico a más largo plazo para las exacerbaciones frecuentes, en las cuales la purulencia crónica del esputo es una característica frecuente (Chalmers 2012; Evans 2003). El uso a largo plazo de los antibióticos no se recomienda en la actualidad como parte del tratamiento de rutina (Valery 2012; Wu 2014), pero se puede considerar para el tratamiento de los pacientes con exacerbaciones frecuentes (tres o más por año que requieren antibioticoterapia)(Pasteur 2010). La elección de los antibióticos se basa por lo general en la microbiología del esputo y en los modelos de resistencia local a los antibióticos; sin embargo, el tratamiento con frecuencia se comienza empíricamente con un antibiótico oral o intravenoso de amplio espectro hasta que se haya aislado el agente patógeno específico (Pasteur 2010). Si más de un cultivo es positivo, se selecciona un antibiótico para cubrir ambos. Los macrólidos pueden estar indicados por sus propiedades antiinflamatorias potenciales así como por sus efectos antibacterianos.
Por qué es importante realizar esta revisión
La evidencia de la efectividad de diversas estrategias de tratamiento para la bronquiectasia se ven limitadas por el número y la calidad de los ensayos clínicos, incluidos los de antibióticos y se ha señalado como prioridad la necesidad de evidencia basada en comparaciones directas de los antibióticos (Welsh 2015). La efectividad comparativa, la relación entre costo y efectividad y la seguridad de los antibióticos intraclase (p.ej., de diferentes fabricantes) siguen sin poder precisarse, pero este tipo de evidencia se podría utilizar para informar la elección del antibiótico, en particular en los países en desarrollo, en que el uso de antibióticos más económicos puede ser más frecuente que en los países desarrollados.
Por lo tanto, esta revisión Cochrane incluirá estudios que comparan directamente la efectividad de los antibióticos y consideren aspectos relacionados con la duración del tratamiento y la vía de administración. Se harán esfuerzos para obtener la evidencia existente que muestre la efectividad para la bronquiectasia en comparación con los resultados clave identificados por Welsh 2015. En esta revisión Cochrane, se aplican los métodos establecidos en conformidad con la evaluación reciente de estos estándares versus enfoques alternativos (Page 2016). Esta revisión Cochrane se realiza en conjunto con otras cuatro revisiones estrechamente relacionadas: "Antibióticos macrólidos para la bronquiectasia" (Kelly 2018); "Antibióticos duales para la bronquiectasia"(Felix 2018); "Antibióticos orales versus inhalados para la bronquiectasia" (Spencer 2018); y "Antibióticos continuos versus intermitentes para la bronquiectasia"(Donovan 2018).
Objetivos
Evaluar los efectos comparativos de diferentes antibióticos en el tratamiento de adultos y niños con bronquiectasia.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron ensayos controlados aleatorios (ECA). Se incluyeron los estudios que se informaron como texto completo, los publicados solamente como resúmenes y los datos no publicados.
Tipos de participantes
Se incluyeron adultos y niños (menores de 18 años) con un diagnóstico de bronquiectasia por broncografía o tomografía computarizada de alta resolución, que informaron signos y síntomas diarios, como tos, producción de esputo o hemoptisis y los que presentaron episodios recurrentes de infección pulmonar. Se excluyeron los estudios en que los pacientes recibieron antibióticos de modo continuo o a dosis alta durante las cuatro semanas antes del comienzo del estudio, si habían recibido un diagnóstico de bronquiectasia de tracción debido a fibrosis pulmonar o si habían recibido un diagnóstico de fibrosis quística.
Tipos de intervenciones
Se incluyeron los estudios que compararon un antibiótico versus otro cuando se administraron por la misma vía (p.ej., nebulizado versus nebulizado) para aislar el efecto del antibiótico en lugar del dispositivo de administración. Se consideró el uso a corto plazo (menos de cuatro semanas) para tratar las exacerbaciones agudas y el uso a más largo plazo como profilaxis (≥ cuatro semanas) por separado. También se programó analizar las comparaciones generacionales (p.ej., fluoroquinolonas de tercera y cuarta generación) por separado de las comparaciones entre clases (p.ej., penicilina versus fluoroquinolonas).
Tipos de medida de resultado
Resultados primarios
Se incluyeron los siguientes resultados primarios.
-
Exacerbación (p.ej., frecuencia durante el seguimiento, tiempo transcurrido hasta la primera exacerbación).
-
Eventos adversos graves, definidos según Hansen 2015.
Resultados secundarios
Se incluyeron los siguientes resultados secundarios para el tratamiento a corto y largo plazo.
-
Frecuencia de hospitalizaciones por exacerbaciones de la bronquiectasia.
-
Tasas de respuesta según lo definido por los autores de los estudios (p.ej., tarjetas diarias de la evaluación global del médico).
-
Volumen y purulencia del esputo.
-
Medidas de la función pulmonar (p.ej., volumen espiratorio forzado en un segundo [VEF₁]).
-
Marcadores sistémicos de infección (p.ej., recuento de leucocitos, proteína C reactiva [PCR], tasa de sedimentación de eritrocitos [TSE]).
-
Eventos adversos (p.ej., arritmias cardíacas, síntomas gastrointestinales, hipoacusia).
-
Muertes, por todas las causas y respiratorias.
-
Aparición de resistencia a los antibióticos.
-
Capacidad de ejercicio (p.ej., Six‐Minute Walk Distance test [6MWD]).
-
Calidad de vida (p.ej., St George Respiratory Questionnaire [SGRQ], CdV‐B).
El informe de uno o más de los resultados enumerados no fue un criterio de inclusión de estudios para esta revisión Cochrane.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We identified studies from the Cochrane Airways Trials Register, which is maintained by the Information Specialist for the Group. The Cochrane Airways Trials Register contains studies identified from several sources.
-
Monthly searches of the Cochrane Central Register of Controlled Trials (CENTRAL), in the Cochrane Library, through the Cochrane Register of Studies Online (crso.cochrane.org).
-
Weekly searches of MEDLINE Ovid SP 1946 to date.
-
Weekly searches of Embase Ovid SP 1974 to date.
-
Monthly searches of PsycINFO Ovid SP 1967 to date.
-
Monthly searches of CINAHL EBSCO (Cumulative Index to Nursing and Allied Health Literature) 1937 to date.
-
Monthly searches of AMED EBSCO (Allied and Complementary Medicine).
-
Handsearches of the proceedings of major respiratory conferences.
Studies contained in the Trials Register are identified through search strategies based on the scope of Cochrane Airways. We have provided details of these strategies, as well as a list of handsearched conference proceedings, in Appendix 1. See Appendix 2 for search terms used to identify studies for this review.
We also conducted a search of ClinicalTrials.gov (www.ClinicalTrials.gov), as well as the World Health Organization (WHO) International Clinical Trials Registry Platform (ICTRP) portal (www.who.int/ictrp/en/). We searched all databases from their inception to 30 April 2018, and we imposed no restriction on publication language.
Búsqueda de otros recursos
We checked the reference lists of all primary studies and review articles for additional references. We also searched relevant manufacturers' websites for trial information.
We searched for errata or retractions from included studies published in full text on PubMed on 30 November 2017 (www.ncbi.nlm.nih.gov/pubmed).
Obtención y análisis de los datos
Selección de los estudios
Two review authors (ES and LF) independently screened titles and abstracts of all studies identified by the literature search and coded them as 'retrieve' (eligible or potentially eligible/unclear studies) or 'do not retrieve'. We retrieved the full‐text study reports/publications for all articles in the 'retrieve' category. The same review authors independently screened the full‐text articles, identified studies for inclusion, and identified and recorded reasons for exclusion of ineligible studies. We resolved disagreements through discussion and consulted a third review author (SJM) to clarify the inclusion of two similar reports. We planned to identify and exclude duplicates and to collate multiple reports of the same study, so that each study rather than each report was the unit of interest in the review. We recorded the selection process in detail in a PRISMA flow diagram and in the Characteristics of excluded studies tables (Moher 2009).
Extracción y manejo de los datos
We used a data collection form that was pilot‐tested on one included study to record study characteristics and outcome data. One review author (LF) extracted the following characteristics from included studies.
-
Methods: study design, total duration of study, details of any 'run‐in' period, number of study centres and locations, study settings, withdrawals, dates of study.
-
Participants: N, mean age, age range, gender, severity of condition, diagnostic criteria, baseline lung function, smoking history, inclusion criteria, exclusion criteria.
-
Interventions: intervention, comparison, concomitant medications, excluded medications.
-
Outcomes: primary and secondary outcomes specified and collected, time points reported.
-
Notes: funding for trial, notable conflicts of interest of trial authors.
Two review authors (AK and LF) independently extracted outcome data from the included studies and noted in the Characteristics of included studies table when outcome data were not reported in a usable way. We resolved disagreements by consensus or by consultation with a third review author (SS or SJM). One review author (LF) transferred data into Review Manager 5 (RevMan 5) (Review Manager 2014), and a second review author (AK) verified the data by spot‐checking study characteristics for accuracy against the trial report.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (AK and LF) independently assessed the risk of bias for each included study using the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). We resolved disagreements by discussion or by consultation with another review author (SS or SJM). We assessed risk of bias according to the following domains.
-
Random sequence generation.
-
Allocation concealment.
-
Blinding of participants and personnel.
-
Blinding of outcome assessment.
-
Incomplete outcome data.
-
Selective outcome reporting.
-
Other bias.
We graded each potential source of bias as high, low, or unclear and provided a quote from the study report together with a justification for our judgement in the 'Risk of bias' table. We summarised 'Risk of bias' judgements across different studies for each of the domains listed. We considered blinding separately for different key outcomes when necessary (e.g. for unblinded outcome assessment, risk of bias for all‐cause mortality may be very different than for a patient‐reported pain scale). When information on risk of bias was related to unpublished data or correspondence with a trial author, we noted this in the 'Risk of bias' table.
When considering treatment effects, we took into account the risk of bias for studies that contributed to the outcome.
Assessment of bias in conducting the systematic review
We conducted the review according to the published protocol (Kaehne 2017), and we reported deviations from it in the Differences between protocol and review section of the systematic review.
Medidas del efecto del tratamiento
We analysed dichotomous data as odds ratios and continuous data as mean differences or standardised mean differences. We entered data presented as a scale with a consistent direction of effect.
We planned to undertake meta‐analyses only when this was meaningful (i.e. if treatments, participants, and the underlying clinical question were similar enough for pooling to make sense).
We narratively described skewed data reported as medians and interquartile ranges.
When a single trial had multiple trial arms, we included only relevant trial arms. If two comparisons (e.g. drug A vs drug B and drug C vs drug B) were combined in the same meta‐analysis, we planned to halve the comparison group to avoid double‐counting.
Cuestiones relativas a la unidad de análisis
In all included studies, the unit of analysis was the participant. We planned to analyse exacerbation rates as rate ratios if data had been available.
Manejo de los datos faltantes
We contacted investigators or study sponsors to verify key study characteristics and to obtain missing numerical outcome data when possible (e.g. when a study was identified as abstract only). When this was not possible, and we believed that the missing data may have introduced serious bias, we planned to explore the impact of including such studies in the overall assessment of results by performing a sensitivity analysis.
Evaluación de la heterogeneidad
We planned to use the I² statistic to measure heterogeneity among the trials in each meta‐analysis. When we identified substantial heterogeneity (i.e. I² > 50%) (Deeks 2011), we reported this and explored possible causes by conducting pre‐specified subgroup analysis.
Evaluación de los sesgos de notificación
If we had pooled more than 10 studies, we planned to create and examine a funnel plot to explore possible small‐study effects and evidence of publication bias.
Síntesis de los datos
We planned to use a fixed‐effect model for meta‐analysis and to perform sensitivity analyses using a random‐effects model.
'Summary of findings' table
We created a 'Summary of findings' table using the following primary and secondary outcomes: exacerbations, serious adverse events, response rates, deaths, and quality of life. We used the five GRADE considerations (study limitations, consistency of effect, imprecision, indirectness, and publication bias) to assess the quality of evidence from studies contributing data to meta‐analyses of pre‐specified outcomes. We used methods and recommendations described in Section 8.5 ‐ in Higgins 2011 ‐ and in Chapter 12 ‐ Schünemann 2011 ‐ of the Cochrane Handbook for Systematic Reviews of Interventions using GRADEpro software (GRADEpro GDT). We provided justification for our decisions to downgrade or upgrade the quality of studies by using footnotes and made comments to aid the reader's understanding of the Cochrane Review when necessary.
Análisis de subgrupos e investigación de la heterogeneidad
We planned to carry out the following subgroup analyses.
-
Adults versus children.
-
Dose or schedule, or both.
-
Duration (prophylactic antibiotics).
-
Type of antibiotic.
We planned to use the following outcomes in subgroup analyses.
-
Exacerbation duration (short‐term therapy).
-
Exacerbation frequency (long‐term therapy).
-
Hospitalisation.
-
Adverse events.
We planned to use the formal test for subgroup interactions in RevMan 5 (Review Manager 2014).
Análisis de sensibilidad
If we had found sufficient studies, we planned to evaluate the impact of methodological study quality by removing studies at high or unclear risk of bias according to the following risk of bias domains: random sequence generation and allocation concealment. We planned to use a fixed‐effect model, as well as a random‐effects model, in performing our sensitivity analysis.
Results
Description of studies
Results of the search
A systematic search, conducted on 30 April 2018, identified 295 unique records of potentially relevant studies. Of these, we considered 262 records irrelevant following inspection of their titles and abstracts. We obtained the full texts of the remaining 33 records and scrutinised them for selection. Four studies met the Review selection criteria (Lam 1989; Chan 1996; Dimakou 2014; Kaponi 2017), and we included them in the Review (see Characteristics of included studies); we formally excluded 26 records (documented in Excluded studies). Two records were protocols for an ongoing study ‐ Chang 2013 (documented in Characteristics of ongoing studies), and for one study that is awaiting classification ‐ Lam 1986 ‐ as we could not ascertain whether it is a separate study from Lam 1989 (documented in Characteristics of studies awaiting classification). We have summarised the study selection process in the study flow diagram (Figure 1).

Study flow diagram.
Included studies
Methods
All four included studies were reported as RCTs (Chan 1996; Dimakou 2014; Kaponi 2017; Lam 1989). Two studies were two‐arm, double‐blind, placebo‐controlled trials using a double‐dummy design, each conducted at a single centre in Hong Kong (Chan 1996; Lam 1989). Dimakou 2014 was a three‐arm (tobramycin vs colistin vs saline) trial, and Kaponi 2017 was also a three‐arm trial (tobramycin vs colistin vs placebo). Both studies were available only as conference abstracts and did not report study details such as design methods, study setting, or methods of participant recruitment. We contacted trial authors for further information, but at the time of publication, we have received no reply. Both Chan 1996 and Lam 1989 worked with patients admitted to the hospital. Chan 1996 reported no withdrawals. No patients withdrew from Lam 1989, although therapy was suspended for two patients with adverse reactions to the intervention. No patients withdrew from Dimakou 2014 or Kaponi 2017.
Participants
The four studies included a total of 164 adults, aged 18 years and older. Dimakou 2014 was a three‐arm study that included a placebo group with nine control group participants. Kaponi 2017 was a three‐arm study that included a placebo group of 17 participants. Therefore 138 participants were eligible for inclusion in the Review. Two studies based a diagnosis of bronchiectasis on clinical and radiological criteria (Chan 1996; Lam 1989), but diagnostic criteria in Dimakou 2014 were unclear. Chan 1996 and Lam 1989 included participants hospitalised with infective exacerbation of bronchiectasis, confirmed by sputum purulence or volume. Dimakou 2014 and Kaponi 2017 included participants with sputum cultures with > 10⁴ colony‐forming units (CFUs) of P aeruginosa per millilitre. Of the three studies that reported gender, 64% of participants in Chan 1996 (F 27; M 42), 44% in Lam 1989 (F 18; M 23), and 63% in Kaponi 2017 (F 33; M 19) were female. The mean age of participants was 64 years in Chan 1996; 56 years in Dimakou 2014; 53 years in Lam 1989; and 59 years in Kaponi 2017, representing a total age range of 22 to 74 years.
Two studies reported that data showed no baseline imbalances between intervention groups (Chan 1996; Lam 1989). Chan 1996 reported a mean baseline FEV₁ of 69%, and Lam 1989 91%, of predicted.
Two studies reported smoking history, with non‐smokers representing 62% of participants in Chan 1996 and 48% in Lam 1989. In Chan 1996, one participant in the ciprofloxacin group was a current smoker and 15 were former smokers (six ciprofloxacin, nine amoxicillin). In Lam 1989, two participants in each of the intervention groups were current smokers, and a total of 17 were former smokers (eight ofloxacin, nine amoxicillin). Dimakou 2014 and Kaponi 2017 did not provide data on smoking history.
Interventions
Researchers compared the following two types of antibiotics: fluoroquinolone versus β‐lactam in Chan 1996 and Lam 1989, and aminoglycoside versus polymyxin in Dimakou 2014 and Kaponi 2017. The two fluoroquinolone versus β‐lactam studies delivered antibiotics orally (Chan 1996; Lam 1989), and the two aminoglycoside versus polymyxin studies by inhalation (Dimakou 2014; Kaponi 2017). Studies also differed by duration, with antibiotics administered for seven and 10 days (Chan 1996; Lam 1989), respectively, in the two short‐term studies, and for four weeks and three months (Dimakou 2014;Kaponi 2017), respectively, in the two long‐term studies.
Table 1 shows the characteristics of interventions in each study including numbers of participants, types of antibiotics, and dose, duration, and frequency of administration.
| Study | Adults/ Children (N) | Arm 1 | Arm 2 | Arm 3 | Duration | ||||||
| Antibiotic (N) | Dose/ Frequency | Mode of delivery | Antibiotic (N) | Dose/ Frequency | Mode of delivery | Comparison (N) | Dose/ Frequency | Mode of delivery | |||
| Fluoroquinolones vs β‐lactams (amoxicillin) | |||||||||||
| Adults (42) | Ciprofloxacin (plus amoxicillin placebo) (21) | 500 mg 3 times daily | Oral | Amoxicillin (plus ciprofloxacin placebo) (21) | 1000 mg 3 times daily | Oral | ‐ | ‐ | ‐ | 7 days | |
| Adults (41) | Ofloxacin (plus amoxicillin placebo) (20) | 200 mg 3 times daily | Oral | Amoxicillin (plus (21) | 1000 mg 3 times daily | Oral | ‐ | ‐ | ‐ | 10 days | |
| Aminoglycosides vs polymyxins | |||||||||||
| Adults (29) | Tobramycin (10) | 300 mg twice daily | Inhalation by nebuliser | 1 MU colistimethate sodium (10) | 300 mg twice daily | Inhalation by nebuliser | Saline solution (9) | 4 mL of 0.9% solution | Inhalation by nebuliser | 4 weeks | |
| Adults (52) | Tobramycin (17) | 300 mg twice daily | Inhalation by nebuliser | 1 MU colistimethate sodium (18) | 300 mg twice daily | Inhalation by nebuliser | Saline solution (17) | 4 mL of 0.9% solution | Inhalation by nebuliser | 3 months | |
N: number of participants.
Outcomes
Primary outcomes
Exacerbation
The included studies did not report this outcome.
Serious adverse events
None of the included studies formerly reported serious adverse events, but these are implied from the reporting of adverse events.
Secondary outcomes
Response rate ‐ treatment failure
Chan 1996 defined treatment failure as 'poor' improvement in sputum purulence (assessed at day 7).
Response rate ‐ microbiological response
Chan 1996 reported microbiological response, defined as elimination of bacterial organisms amongst those who tested positive for bacteriological culture at day 0. This was assessed on day 7. Kaponi 2017 defined microbiological response rate as the proportion of participants in each group showing eradication of P aeruginosa at the end of treatment.
Response rate ‐ improvement in sputum purulence
Three included studies reported this outcome (Chan 1996; Dimakou 2014; Lam 1989). Both Chan 1996 and Lam 1989 categorised improvement in sputum purulence as follows: excellent ‐ mucoid; fair ‐ pale yellow or pale green; and poor ‐ dark green or dark yellow. Chan 1996 assessed improvement from baseline at day 7, and Lam 1989 at day 10. In addition, Lam 1989 assessed relapse of sputum purulence at three‐month follow‐up in participants classified as excellent or fair at 10 days. Dimakou 2014 did not include classification of sputum purulence.
Sputum volume
All four studies reported sputum volume (Chan 1996; Dimakou 2014; Kaponi 2017; Lam 1989). Chan 1996 reported changes in sputum volume between baseline and follow‐up at five and 10 days. Lam 1989 reported changes between baseline and seven days. Dimakou 2014 and Kaponi 2017 measured changes in sputum volume before and after treatment but did not report further details and direct comparisons between intervention groups in the abstracts.
Measures of lung function
Lam 1989 reported improvement in FEV₁ % predicted on day 10. Chan 1996 reported FEV₁ % predicted and FEV₁/forced vital capacity (FVC) % predicted only at baseline. Dimakou 2014 and Kaponi 2017 measured changes in spirometry before and after treatment but did not include further details and comparisons between intervention groups in the abstracts.
Adverse events
Three studies reported this outcome (Chan 1996; Dimakou 2014; Lam 1989). Both Chan 1996 and Lam 1989 reported the frequency of event types by group and did not report the proportion of participants in each group who experienced at least one adverse event. Dimakou 2014 reported the number of participants with adverse events but did not include further details in the abstract. Kaponi 2017 did not report adverse events.
Deaths
The four included studies did not formally report this outcome, but it was inferred based on the number of participants who completed each study.
Frequency of hospitalisations due to exacerbations of bronchiectasis; systemic markers of infection: C‐reactive protein (CRP); emergence of resistance to antibiotics; exercise capacity; quality of life
None of the included studies reported any of the above secondary outcomes.
Notes
Only two studies provided information about the source of study funding (Chan 1996; Lam 1989). Both reported that Daiichi Seiyaku Co Ltd provided active and dummy placebo tablets for the intervention groups. No included studies provided other information such as power calculations and declarations of conflicts of interest.
Excluded studies
We recorded in Characteristics of excluded studies reasons for exclusion of 26 studies from the 287 reports. We excluded 11 studies of mixed populations because data were not available for bronchiectasis participants alone (Begg 2000; Brambilla 1992; Finegold 1981; Garcia‐Rodriguez 1984; Jia 2010; Kobayashi 1984; Nakamura 2007; Pines 1964; Pines 1967; Pines 1981; Ramer 1981). Eight studies were not head‐to‐head comparisons of antibiotics using the same mode of delivery (Alberto 1968; Allen 1988; Bevilacqua 1973; Bilton 2006; Ip 1998; Liu 2012; NCT03093974; NCT03058718). Three studies did not include bronchiectasis participants (Khan 2003; Kobayashi 1984; Kobbernagel 2016), a further three studies were not randomised controlled trials (Cherniack 1959; Lioberes 1990; Mehta 1991), and the intervention in one study was not an antibiotic (Bradley 2011).
We endeavoured to contact study authors for missing data, but at the time of publication, these data remain unavailable.
Risk of bias in included studies
Two review authors (AK and LF) assessed the risk of bias in each study using the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions. We have presented an overview of our judgements in Figure 2.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
The four included studies did not report information on sequence generation or allocation concealment. Therefore, we classified the risk of allocation bias as unclear.
Blinding
Two studies were double‐blinded using a double‐dummy design (Lam 1989; Chan 1996); therefore we considered them to be at low risk of performance bias. Chan 1996 used blinded outcome assessors, and we classified this study as having low risk of detection bias, but Lam 1989 did not report information on outcome assessors, and we judged this study as having unclear risk. Dimakou 2014 and Kaponi 2017 did not report information on blinding of the intervention or outcome assessments in the abstracts; we therefore assessed risk of performance and detection bias in these studies as unclear.
Incomplete outcome data
Two studies assessed all randomised participants at the end of treatment (Lam 1989; Chan 1996); we judged these studies to be at low risk of attrition bias. Although Dimakou 2014 and Kaponi 2017 reported assessment of all participants before and after treatment, it is not clear whether this was done at the end of the study. We therefore judged risk of attrition bias as unclear.
Selective reporting
We judged risk of selective reporting to be unclear in all four studies because pre‐specified protocols were not available and therefore it was not clear whether researchers reported all planned study outcomes (Chan 1996; Dimakou 2014; Kaponi 2017; Lam 1989).
Other potential sources of bias
Researchers in Chan 1996 withdrew amoxicillin from two participants who developed a rash but reported no further in terms of how long treatment was suspended and whether it was restarted. We therefore judged this study to be at unclear risk of other sources of bias. The authors of Lam 1989 noted that high levels of H influenzae, K pneumoniae, and P aeruginosa may be attributable to previous exposure to ampicillin and other antibiotics; we therefore judged this study to be at high risk of other bias. Dimakou 2014 and Kaponi 2017 provided insufficient study information in the abstracts to inform a clear judgement; we therefore classified this study as being at unclear risk of other bias.
Effects of interventions
See: Summary of findings for the main comparison Fluoroquinolones compared to amoxicillin for bronchiectasis; Summary of findings 2 Polymyxins compared to aminoglycosides for bronchiectasis
Fluoroquinolone versus β‐lactam (amoxicillin): short‐term studies (< 4 weeks)
Primary outcomes
Exacerbation
The included studies did not report this primary outcome.
Serious adverse events
The two included studies did not explicitly report the number of participants who had at least one serious adverse event. However, none of the adverse events reported in Chan 1996 and Lam 1989 were considered serious adverse events and no randomised participants withdrew; we therefore concluded that no serious adverse events occurred in these two studies.
According to GRADE criteria, we judged this evidence as low quality.
Secondary outcomes
Response rate ‐ treatment failure
Two studies with 83 adults reported sputum purulence using the same classification criteria of excellent, fair, and poor (Chan 1996; Lam 1989).Chan 1996 defined treatment failures as those with poor improvement after seven days of oral treatment, and we used this definition of treatment failure for the two studies. The pooled analysis showed clear differences between groups in the numbers of participants with poor improvement in sputum purulence, with significantly fewer treatment failures in the fluoroquinolone group than in the group receiving amoxicillin (odds ratio (OR) 0.07, 95% confidence interval (CI) 0.01 to 0.32; Analysis 1.1).
According to GRADE criteria, we judged this evidence as low quality.
Response rate ‐ microbiological response
One study with 42 adults reported elimination of bacterial organisms in more participants receiving seven days' oral treatment with ciprofloxacin versus seven days' oral treatment with amoxicillin (Peto OR 20.09, 95% CI 2.83 to 142.59; Analysis 1.2), although the effect estimate was based on only 16 participants who tested positive following baseline sputum culture (Chan 1996).
According to GRADE criteria, we judged this evidence as low quality.
Response rate ‐ improvement in sputum purulence
Two studies with 83 adults reported no clear differences between groups in the number of participants with excellent improvement in sputum purulence (OR 2.35, 95% CI 0.96 to 5.72; Analysis 1.3) (Chan 1996; Lam 1989). According to GRADE criteria, we judged this evidence as very low quality. The same studies reported no differences in the number of participants with fair improvement in sputum purulence (OR 2.30, 95% CI 0.88 to 6.00; I² = 53%; Analysis 1.4). We noted substantial heterogeneity between studies but no clear evidence of subgroup differences (test for subgroup differences: Chi² = 2.12, df = 1 (P = 0.15), I² = 52.9%). Separate analysis of the two studies indicated a greater proportion of participants with fair improvement after seven days' oral treatment with ciprofloxacin versus seven days' oral treatment with amoxicillin (OR 4.67, 95% CI 1.17 to 18.69; Analysis 1.4). Data show no differences between participants after 10 days' oral treatment with ofloxacin versus amoxicillin (OR 1.07, 95% CI 0.26 to 4.44; Analysis 1.4).
Relapse of sputum purulence
One study with 41 adults reported relapse of sputum purulence at three‐month follow‐up among 32 adults with excellent improvement at the end of treatment (10 days) (Lam 1989). Results showed no clear difference in relapse of sputum purulence between study groups (OR 1.04, 95% CI 0.23 to 4.77; Analysis 1.5).
Sputum volume
A single study with 42 adults reported greater reduction in sputum volume after seven days' oral treatment with ciprofloxacin versus amoxicillin (mean difference (MD) ‐13.00 mL, 95% CI ‐18.44 to ‐7.56; Analysis 1.6) (Chan 1996). Lam 1989 reported more rapid reduction in sputum volume at day 5 and at day 10 (end of treatment) in the ofloxacin group than in the amoxicillin group (P < 0.05), but these study authors did not report mean values for each group.
Measures of lung function
One study with 41 adult participants reported no clear differences between groups in the change in FEV₁ % predicted from baseline to end of treatment (10 days) (MD ‐2.70, 95% CI ‐17.01 to 11.61; Analysis 1.7) (Lam 1989).
Adverse events
Chan 1996 and Lam 1989 did not report the number of participants who experienced at least one adverse event. Chan 1996 reported the frequency of each adverse event as follows: gastrointestinal upset: 0 ciprofloxacin, 2 amoxicillin; dizziness/vertigo: 2 ciprofloxacin, 2 amoxicillin; headache: 1 ciprofloxacin, 1 amoxicillin; and rash: 0 ciprofloxacin, 2 amoxicillin. Amoxicillin was discontinued in the two participants who developed a rash, but study authors did not report further details. Lam 1989 reported the frequency of each adverse event as follows: nausea/epigastric pain: 2 ofloxacin, 5 amoxicillin; dizziness/vertigo: 1 ofloxacin, 1 amoxicillin; and peripheral eosinophilia: 0 ofloxacin, 1 amoxicillin.
Deaths
All randomised participants completed both of the included studies (Chan 1996; Lam 1989); we therefore concluded that no deaths occurred during these trials.
Based on the overall study, we graded the quality of this evidence as low.
Fluoroquinolone versus β‐lactam (amoxicillin): long‐term studies (≥ four weeks)
We did not find any studies that performed this comparison.
Polymyxins versus aminoglycosides: short‐term studies (< four weeks)
We did not find any studies that performed this comparison.
Polymyxins versus aminoglycosides: long‐term studies (≥ four weeks)
Primary outcomes
Exacerbation
The included studies did not report this primary outcome.
Serious adverse events
One study with 20 adults reported that six participants who had adverse events did not require discontinuation of treatment and no randomised participants withdrew (Dimakou 2014). We therefore concluded that no serious adverse events occurred after four weeks of treatment. Kaponi 2017 did not report this outcome.
Based on GRADE criteria, we judged the quality of this evidence to be very low.
Secondary outcomes
Response rate ‐ improvement in sputum purulence
One study with 20 adults reported no differences between groups in the number of participants with improvement in sputum purulence after four weeks of nebulised treatment (OR 0.16, 95% CI 0.01 to 3.85; Analysis 2.1), although study authors did not include criteria for improvement in the abstract (Dimakou 2014). The study reported improvement in sputum purulence in all 10 participants receiving nebulised colistin compared with eight out of 10 participants receiving nebulised tobramycin for 4 weeks.
According to GRADE criteria, we judged this evidence as very low quality.
Response rate ‐ P aeruginosa eradication
Kaponi 2017 reported no differences between groups in terms of the number of participants with P aeruginosa eradication after three months of nebulised treatment (OR 1.40. 95% CI 0.36 to 5.35; Analysis 2.2). This study reported that P aeruginosa had been eradicated in 47% of 17 participants receiving tobramycin and in 39% of 18 participants receiving colistin.
According to GRADE criteria, we judged this evidence as very low quality.
Sputum volume
Dimakou 2014 reported a significant reduction in sputum volume among participants receiving nebulised tobramycin (P = 0.005) and nebulised colistin (P = 0.009) but did not report mean values and comparisons between study groups in the abstract. Kaponi 2017 reported a reduction in sputum volume of 11.2 mL with tobramycin and 11.4 mL with colistin but included direct comparisons only for each antibiotic against placebo and did not include standard deviations in the abstract.
Sputum purulence
Kaponi 2017 reported mean reductions in sputum purulence scores with each antibiotic compared to placebo but reported no differences in mean improvement in scores between the group receiving tobramycin and the group receiving colistin (MD ‐0.20, 95% CI 0.80 to 0.40; Analysis 2.3).
Measures of lung function
Dimakou 2014 and Kaponi 2017 reported that spirometry tests were not significantly different between groups but did not provide further details in the abstracts.
Adverse events
Dimakou 2014 reported no clear differences between groups in the number of participants experiencing adverse events (OR 2.67, 95% CI 0.36 to 19.71; Analysis 2.4) after four weeks of nebulised treatment.
Deaths
All randomised participants completed the Dimakou 2014 study; we therefore concluded that no deaths occurred during this trial. Kaponi 2017 did not explicitly report deaths, and we were not able to infer this outcome because study authors did not report the number of participants who reached the end of the study.
Based on the overall study, we graded the quality of this evidence as very low.
Discusión
Resumen de los resultados principales
Cuatro ensayos aleatorios cumplieron los criterios de inclusión para esta revisión sistemática (Chan 1996; Dimakou 2014; Kaponi 2017; Lam 1989). Los cuatro estudios incorporaron adultos con diagnóstico de bronquiectasia. Dos ensayos con un total de 83 participantes se realizaron en un único centro de Hong Kong y evaluaron la efectividad de las fluoroquinolonas comparadas con la amoxicilina administradas por vía oral durante diez y siete días, respectivamente(Chan 1996; Lam 1989). Los ensayos Dimakou 2014 y Kaponi 2017 estaban disponibles solo como resúmenes de congresos y compararon polimixinas nebulizadas (colistina) versus aminoglucósidos nebulizados (tobramicina) en 55 adultos durante cuatro semanas y tres meses, respectivamente.
Ninguno de los estudios incluidos informó el resultado primario (exacerbaciones). No se informaron eventos adversos graves ni muertes en los estudios incluidos, pero se consideró que la calidad de esta evidencia fue baja o muy baja. Dos estudios compararon amoxicilina oral con fluoroquinolonas orales; Chan 1996 administró ciprofloxacina y Lam 1989 administró ofloxacina. Las tasas de fracaso del tratamiento fueron inferiores con las fluoroquinolonas que con la amoxicilina, pero este resultado se basó en evidencia de calidad baja, lo que da lugar a que no haya seguridad con respecto a los resultados. Los investigadores no encontraron evidencia de diferencias entre los grupos en la purulencia del esputo (dos estudios) ni en la recurrencia de la purulencia del esputo durante el seguimiento (un estudio), aunque de nuevo este resultado se basó en evidencia de calidad baja o muy baja. Se encontró evidencia limitada de una reducción del volumen de esputo con las fluoroquinolonas, pero en gran parte esta evidencia se basó en un estudio (Chan 1996), con datos limitados disponibles del otro estudio. La respuesta microbiológica informada en un estudio mostró una mayor eliminación de los microorganismos infecciosos con ciprofloxacina, pero nuevamente este resultado se basó en evidencia de calidad baja. La evidencia de un estudio no muestra diferencias en la función pulmonar. Los estudios incluidos no informaron el número de participantes con un evento adverso.
Dos estudios que compararon las polimixinas con los aminoglucósidos no demostraron diferencias entre los grupos en cuanto a la respuesta microbiológica, la mejoría en la purulencia o el volumen del esputo ni los eventos adversos, y los datos sobre la función pulmonar presentada en los resúmenes no fueron suficientes para establecer conclusiones firmes. Solo 55 participantes contribuyeron a las estimaciones del efecto en esta comparación y se consideró que la evidencia era de muy baja calidad.
Los intervalos de confianza amplios y la evidencia de baja o muy baja calidad explican la falta de certeza general en los resultados.
Ninguno de los estudios incluidos informó los otros resultados secundarios (marcadores sistémicos de infección, aparición de resistencia a los antibióticos, capacidad de ejercicio y calidad de vida).
Compleción y aplicabilidad general de las pruebas
Los cuatro estudios presentaron problemas metodológicos, ya que el riesgo de sesgo para casi todos los dominios fue incierto. Además, los estudios no tuvieron poder estadístico adecuado para detectar diferencias clínicamente importantes de los efectos del tratamiento entre los grupos de intervención. Las comparaciones de antibióticos en esta revisión incluyeron solo dos clases de antibióticos; la comparación entre las fluoroquinolonas y la amoxicilina incluyó a 83 adultos y la comparación entre las polimixinas y los aminoglucósidos a solo 55 adultos. Todos los estudios eran pequeños; dos se realizaron en el mismo centro y no se informó el lugar del tercero y cuarto estudios. El resultado primario (frecuencia de hospitalización debido a exacerbaciones de la bronquiectasia) no se informó en los estudios incluidos, pero este resultado puede ser menos relevante para los ensayos de una semana realizados por Chan 1996 y Lam 1989, donde todos los pacientes asignados al azar presentaban una infección pulmonar activa que se podría definir como una exacerbación. Estos estudios pueden haber limitado la relevancia clínica, ya que las exacerbaciones tratadas con antibióticos orales no requerirían por lo general el ingreso al hospital. La definición de fracaso del tratamiento utilizada en Chan 1996 es de valor limitado, ya que se basa exclusivamente en una respuesta deficiente de la purulencia del esputo, y, según observan los autores del estudio, el grado de infección inicial en Lam 1989 puede haber estado afectado por el tratamiento previo con ampicilina. No se presentó una definición de exacerbaciones en los estudios que compararon polimixinas con aminoglucósidos. Ninguno de los estudios incluidos informó los otros resultados secundarios (marcadores sistémicos de infección, aparición de resistencia a los antibióticos, capacidad de ejercicio y calidad de vida). Algunas de las diferencias de los resultados entre los grupos, como el volumen del esputo, se informaron solo como valores P, lo que limitó la oportunidad de realizar análisis de datos agrupados. La mayoría de los datos en los resúmenes de ensayos de Dimakou 2014 y Kaponi 2017 se informaron de modo narrativo o con valores P solamente.
No se identificaron estudios concluidos con niños, aunque en la búsqueda se identificaron dos protocolos (fase 1 y 2) de un estudio de comparación directa en curso (el ensayo BEST) con niños de Australia y Nueva Zelanda (Chang 2013). El contacto con el investigador principal confirmó que el estudio fue concluido y que el grupo de investigación actualmente analiza los datos.
Se excluyeron 11 ensayos de comparación directa en poblaciones mixtas de participantes (enfermedades de vías respiratorias inferiores) que no presentaron explícitamente datos de pacientes con bronquiectasia sola. Se intentó establecer contacto con cuatro de los autores de los estudios para obtener esta información, pero estos datos no estaban disponibles en el momento de la publicación. No se pudo establecer contacto con los autores de otros siete estudios.
Calidad de la evidencia
La calidad general de la evidencia varió de baja a muy baja para los resultados incluidos en la evaluación con los criterios GRADE. Los datos estaban disponibles para solo tres de los cinco resultados predefinidos que se incluirían en la tabla de resumen de los hallazgos. Para la comparación de fluoroquinolonas versus amoxicilina, se incluyeron tres resultados para la tasa de respuesta de dos estudios, pero solo un estudio aportó datos sobre la respuesta microbiológica. La calidad de la evidencia para los dos resultados fue baja. Se disminuyó la calidad en un nivel debido a las limitaciones importantes en el diseño, con falta de claridad en la generación de secuencias y la ocultación de la asignación, y otro nivel por el reducido tamaño de la muestra con pocos eventos. Fue de muy baja calidad la evidencia para la mejoría excelente en la purulencia del esputo, y se disminuyó un nivel por limitaciones significativas en el diseño, un nivel por la amplitud de los intervalos de confianza y un nivel por el reducido tamaño de la muestra con pocos eventos. De modo similar, la calidad de la evidencia de la mejoría en la purulencia del esputo para la comparación de las polimixinas con aminoglucósidos fue muy baja. El informe incierto del diseño del estudio, la falta de direccionalidad de las comparaciones (no diseñadas como ensayos de comparación directa), la imprecisión de la estimación del efecto y el reducido tamaño de la muestra resultó en una disminución de la calidad de la evidencia.
Sesgos potenciales en el proceso de revisión
Para identificar los estudios potencialmente elegibles se utilizó una búsqueda sistemática exhaustiva realizada por un especialista en información muy experimentado. Se buscaron recursos múltiples, incluidas bases de datos electrónicas, revistas, actas de congresos, listas de referencias de los estudios incluidos, citas de los estudios incluidos y registros de ensayos. No obstante, se reconoce la posibilidad de sesgo de publicación en esta revisión que podría sobrestimar o subestimar los efectos de la intervención en cuanto a los diferentes resultados incluidos en esta revisión. Es menos probable que los ensayos que no muestran ningún efecto, o muestran efectos negativos, se propongan para publicación y, de proponerse, es menos probable que se acepten, lo que da lugar a un grupo sesgado de datos disponibles para la revisión. Como se incluyó solo un reducido número de estudios con pocos participantes para cada resultado, no fue posible evaluar el sesgo de publicación con el uso de análisis formales.
Además, es posible que algunos artículos se consideraran de forma errónea como no elegibles para inclusión en la revisión. Todos los estudios fueron evaluados, de forma independiente, por dos autores de la revisión y comprobados por un tercero, y hay seguridad con respecto a que los estudios excluidos de los análisis se evaluaron sobre la base de criterios consistentes y adecuados. En algunos informes de texto completo, es posible que los datos se pudieran haber introducido de forma incorrecta en los análisis, aunque todos los datos se verificaron dos veces para evitar errores en la extracción de los datos.
Se estableció contacto con el investigador de dos de los estudios incluidos para solicitarle mayor información sobre las características de los estudios y otros datos de resultado numéricos, ya que los informes estaban disponibles solo como resúmenes de congresos, pero hasta el momento de la publicación no se había recibido una respuesta.
Debido al reducido número de estudios incluidos, no fue posible realizar análisis de sensibilidad ni de subgrupos como estaba programado.
Acuerdos y desacuerdos con otros estudios o revisiones
El Grupo de Trabajo EMBARC proporcionó recientemente una definición integral y explícita de exacerbaciones pulmonares para la bronquiectasia que incluye "tres o más de los siguientes síntomas clave durante al menos 48 horas: tos; volumen y consistencia del esputo; purulencia del esputo; disnea y tolerancia al ejercicio; fatiga y malestar general; hemoptisis" (Hill 2017). Sin embargo, la definición de exacerbación utilizada como criterio de ingreso en los cuatro estudios incluidos solo se basó en la purulencia del esputo o el volumen del esputo. La duración de la antibioticoterapia en dos de los cuatro estudios incluidos (Lam 1989 y Chan 1996) se podría considerar subóptima en comparación con el tratamiento recomendado por las guías de al menos 14 días (Pasteur 2010; Polverino 2017). Aunque es limitada la evidencia para informar la elección óptima del antibiótico, las guías actuales recomiendan la amoxicilina, 1 g tres veces al día, para los pacientes sin bacteriología anterior, o la claritromicina, 500 mg dos veces al día, para los pacientes alérgicos a la penicilina, como tratamiento primario para las exacerbaciones (Pasteur 2010). Además, los regímenes orales a dosis altas como amoxicilina 1 g tres veces al día o amoxicilina 3 g dos veces al día se recomiendan para los pacientes con bronquiectasia grave con colonización crónica de Haemophilus influenzae (Pasteur 2010).

Study flow diagram.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Fluoroquinolones versus β‐lactam (amoxicillin), Outcome 1 Response rate ‐ treatment failure.
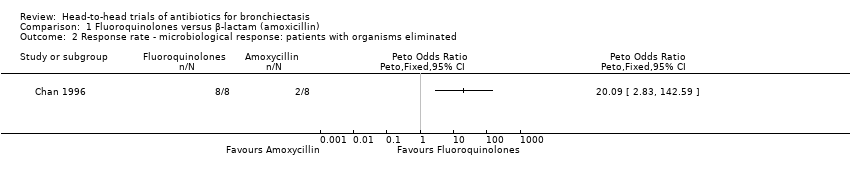
Comparison 1 Fluoroquinolones versus β‐lactam (amoxicillin), Outcome 2 Response rate ‐ microbiological response: patients with organisms eliminated.

Comparison 1 Fluoroquinolones versus β‐lactam (amoxicillin), Outcome 3 Response rate ‐ improvement in sputum purulence (excellent).
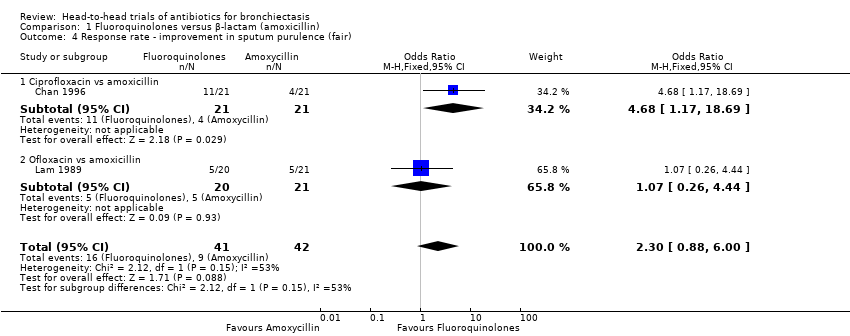
Comparison 1 Fluoroquinolones versus β‐lactam (amoxicillin), Outcome 4 Response rate ‐ improvement in sputum purulence (fair).

Comparison 1 Fluoroquinolones versus β‐lactam (amoxicillin), Outcome 5 Response rate ‐ relapse of sputum purulence at 3‐month follow‐up.
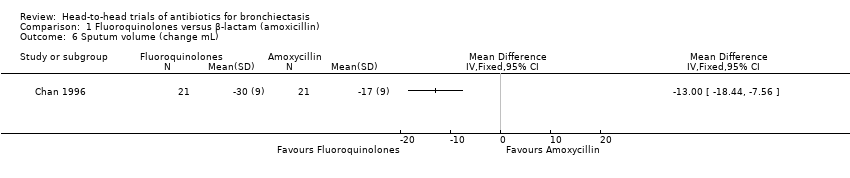
Comparison 1 Fluoroquinolones versus β‐lactam (amoxicillin), Outcome 6 Sputum volume (change mL).
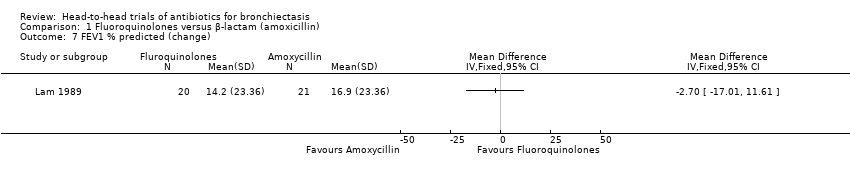
Comparison 1 Fluoroquinolones versus β‐lactam (amoxicillin), Outcome 7 FEV1 % predicted (change).
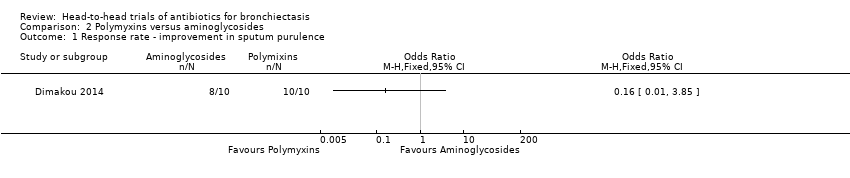
Comparison 2 Polymyxins versus aminoglycosides, Outcome 1 Response rate ‐ improvement in sputum purulence.
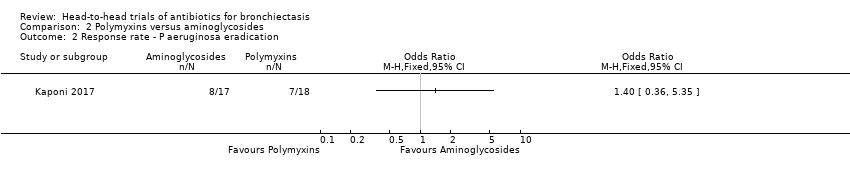
Comparison 2 Polymyxins versus aminoglycosides, Outcome 2 Response rate ‐ P aeruginosa eradication.

Comparison 2 Polymyxins versus aminoglycosides, Outcome 3 Sputum purulence ‐ improvement in score at 3 months.

Comparison 2 Polymyxins versus aminoglycosides, Outcome 4 Adverse events.
| Fluoroquinolones compared to amoxicillin for bronchiectasis: short‐term studies (< 4 weeks) | ||||||
| Patient or population: adults aged 18 years and above with diagnosis of non‐cystic fibrosis bronchiectasis | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with amoxicillin | Risk with fluoroquinolones | |||||
| Exacerbations | ‐ | ‐ | Not estimable | ‐ | ‐ | Outcome not reported in included studies |
| Serious adverse events | 0 per 1000 | 0 per 1000 | Not estimable | 83 (2 RCTs) | ⊕⊕⊝⊝ | Evidence graded on the overall quality of the study |
| Response rate ‐ treatment failure | 429 per 1000 | 50 per 1000 | OR 0.07 | 83 | ⊕⊕⊝⊝ | |
| Response rate ‐ microbiological response | 2 out of 8 participants responded. | 8 out of 8 participants responded. | Peto OR 20.09 (2.83 to 142.59) | 16 | ⊕⊕⊝⊝ | Small single study. Peto OR used owing to 100% response in intervention arm |
| Response rate ‐ improvement in sputum purulence (excellent) | 357 per 1000 | 566 per 1000 | OR 2.35 | 83 | ⊕⊝⊝⊝ | |
| Deaths | 0 per 1000 | 0 per 1000 | Not estimable | 83 (2 RCTs) | ⊕⊕⊝⊝ | No deaths reported. Evidence graded on the overall quality of the study |
| Quality of life | ‐ | ‐ | Not estimable | ‐ | ‐ | Outcome not reported in included studies |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne point deducted in relation to design and implementation of available studies suggesting likelihood of bias (unclear generation of randomisation sequence, potential selective reporting bias, and risk of other bias in Lam 1989). bOne point deducted for imprecision (small sample size and few events). cOne point deducted for imprecision (wide confidence interval). | ||||||
| Polymyxins compared to aminoglycosides for bronchiectasis: long‐term studies (≥ 4 weeks) | ||||||
| Patient or population: adults aged 18 years and above with diagnosis of bronchiectasis | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with aminoglycosides | Risk with polymyxins | |||||
| Exacerbation | ‐ | ‐ | Not estimable | ‐ | ‐ | Outcome not reported in included studies |
| Serious adverse events | 0 per 1000 | 0 per 1000 | Not estimable | 20 (1 RCT) | ⊕⊝⊝⊝ | Evidence graded on the overall quality of the study |
| Response rate ‐ improvement in sputum purulence | 800 per 1000 | 390 per 1000 (38 to 939) | OR 0.16 (0.01 to 3.85) | 20 | ⊕⊝⊝⊝ | Definition of improvement not reported |
| Response rate ‐ P aeruginosa eradication | 471 per 1000 | 554 per 1000 (242 to 826) | OR 1.40 (0.36 to 5.35) | 35 (1 RCT) | ⊕⊝⊝⊝ | Head‐to‐head comparison not reported directly |
| Deaths | 0 per 1000 | 0 per 1000 | Not estimable | 20 | ⊕⊝⊝⊝ | No deaths reported. Evidence graded on the overall quality of the study |
| Quality of life | ‐ | ‐ | Not estimable | ‐ | ‐ | Outcome not reported in included studies |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne point deducted in relation to design and implementation of available studies suggesting likelihood of bias (all study methods unclear). bOne point deducted for indirectness (no direct head‐to‐head comparisons). cOne point deducted for imprecision (small sample size and few events). dOne point deducted for imprecision (wide confidence intervals). | ||||||
| Study | Adults/ Children (N) | Arm 1 | Arm 2 | Arm 3 | Duration | ||||||
| Antibiotic (N) | Dose/ Frequency | Mode of delivery | Antibiotic (N) | Dose/ Frequency | Mode of delivery | Comparison (N) | Dose/ Frequency | Mode of delivery | |||
| Fluoroquinolones vs β‐lactams (amoxicillin) | |||||||||||
| Adults (42) | Ciprofloxacin (plus amoxicillin placebo) (21) | 500 mg 3 times daily | Oral | Amoxicillin (plus ciprofloxacin placebo) (21) | 1000 mg 3 times daily | Oral | ‐ | ‐ | ‐ | 7 days | |
| Adults (41) | Ofloxacin (plus amoxicillin placebo) (20) | 200 mg 3 times daily | Oral | Amoxicillin (plus (21) | 1000 mg 3 times daily | Oral | ‐ | ‐ | ‐ | 10 days | |
| Aminoglycosides vs polymyxins | |||||||||||
| Adults (29) | Tobramycin (10) | 300 mg twice daily | Inhalation by nebuliser | 1 MU colistimethate sodium (10) | 300 mg twice daily | Inhalation by nebuliser | Saline solution (9) | 4 mL of 0.9% solution | Inhalation by nebuliser | 4 weeks | |
| Adults (52) | Tobramycin (17) | 300 mg twice daily | Inhalation by nebuliser | 1 MU colistimethate sodium (18) | 300 mg twice daily | Inhalation by nebuliser | Saline solution (17) | 4 mL of 0.9% solution | Inhalation by nebuliser | 3 months | |
| N: number of participants. | |||||||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Response rate ‐ treatment failure Show forest plot | 2 | 83 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.07 [0.01, 0.32] |
| 1.1 Ciprofloxacin | 1 | 42 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.06 [0.01, 0.49] |
| 1.2 Ofloxacin | 1 | 41 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.09 [0.01, 0.77] |
| 2 Response rate ‐ microbiological response: patients with organisms eliminated Show forest plot | 1 | Peto Odds Ratio (Peto, Fixed, 95% CI) | Totals not selected | |
| 3 Response rate ‐ improvement in sputum purulence (excellent) Show forest plot | 2 | 83 | Odds Ratio (M‐H, Fixed, 95% CI) | 2.35 [0.96, 5.72] |
| 3.1 Ciprofloxacin vs amoxicillin | 1 | 42 | Odds Ratio (M‐H, Fixed, 95% CI) | 1.5 [0.43, 5.25] |
| 3.2 Ofloxacin vs amoxicillin | 1 | 41 | Odds Ratio (M‐H, Fixed, 95% CI) | 3.79 [1.03, 13.91] |
| 4 Response rate ‐ improvement in sputum purulence (fair) Show forest plot | 2 | 83 | Odds Ratio (M‐H, Fixed, 95% CI) | 2.30 [0.88, 6.00] |
| 4.1 Ciprofloxacin vs amoxicillin | 1 | 42 | Odds Ratio (M‐H, Fixed, 95% CI) | 4.68 [1.17, 18.69] |
| 4.2 Ofloxacin vs amoxicillin | 1 | 41 | Odds Ratio (M‐H, Fixed, 95% CI) | 1.07 [0.26, 4.44] |
| 5 Response rate ‐ relapse of sputum purulence at 3‐month follow‐up Show forest plot | 1 | Odds Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 6 Sputum volume (change mL) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 7 FEV1 % predicted (change) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Response rate ‐ improvement in sputum purulence Show forest plot | 1 | Odds Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 2 Response rate ‐ P aeruginosa eradication Show forest plot | 1 | Odds Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 3 Sputum purulence ‐ improvement in score at 3 months Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 4 Adverse events Show forest plot | 1 | Odds Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |

