Terapia de reemplazo hormonal después de la cirugía para el cáncer de ovario epitelial
Resumen
Antecedentes
Las mujeres que se han sometido a un tratamiento quirúrgico para el cáncer de ovario epitelial (COE) pueden desarrollar síntomas menopáusicos debido a la pérdida inmediata de la función ovárica después de la cirugía y la quimioterapia. Las mujeres pueden presentar síntomas vasomotores, alteraciones del sueño, dificultad para concentrarse, disfunción sexual, síntomas vaginales y osteoporosis acelerada. Aunque la terapia de reemplazo hormonal (TRH) es el tratamiento más efectivo para aliviar estos síntomas, su seguridad para las mujeres con COE se ha cuestionado.
Objetivos
Evaluar la seguridad y la eficacia de la TRH para los síntomas de la menopausia en las mujeres tratadas quirúrgicamente por COE.
Métodos de búsqueda
Se hicieron búsquedas en el Registro Cochrane Central de Ensayos Controlados (CENTRAL; 2019, Número 6), MEDLINE vía Ovid (1946 al 12 de junio 2019) y Embase vía Ovid (1980 a 2019, semana 23). También se realizaron búsquedas manuales en los informes de congresos y en los registros de ensayos. No hubo restricciones de idioma.
Criterios de selección
Se incluyeron ensayos controlados aleatorizados (ECA) con participantes de cualquier edad y estado menopáusico que se habían sometido a cirugía para un COE y que, después del diagnóstico y el tratamiento, utilizaron cualquier régimen y duración de la TRH en comparación con placebo o ninguna terapia hormonal. También se incluyeron ensayos que compararon diferentes regímenes o duraciones de la administración de la TRH.
Obtención y análisis de los datos
Dos autores de la revisión identificaron de forma independiente los ensayos que cumplieron los criterios de inclusión. Utilizaron Covidence para extraer las características del estudio y los datos de los resultados, así como para evaluar la calidad metodológica de los estudios incluidos.
Resultados principales
La estrategia de búsqueda identificó 2617 títulos, de los cuales se excluyeron 2614. Tres estudios con 350 mujeres cumplieron los criterios de inclusión. Dos de los estudios incluyeron mujeres pre y posmenopáusicas, y el tercero solo incluyó mujeres premenopáusicas. El rango de edad general de las mujeres incluidas en los estudios fue de 20 a 89,6 años, con una mediana de seguimiento que varió entre 31,4 meses y 19,1 años. La distribución geográfica de los participantes incluyó Europa, Sudáfrica y China. En dos de los estudios se incluyeron todos los estadios y subtipos histológicos, pero en el tercero se excluyó el estadio IV de la enfermedad. Los tres estudios incluidos utilizaron diversos regímenes de TRH (estrógeno conjugado con o sin medroxiprogesterona y con o sin nilestriol) y vías de administración de la TRH (oral, con parche e implante). En todos los estudios las comparaciones se hicieron versus mujeres que no habían recibido TRH.
Los estudios tuvieron un riesgo bajo o poco claro de sesgo de selección e información, y un alto riesgo de sesgo de realización, detección y desgaste. La certeza de la evidencia fue baja para la supervivencia general y la supervivencia sin progresión, y muy baja para la evaluación de la calidad de vida, la incidencia del cáncer de mama, el ataque isquémico transitorio (AIT), el accidente cerebrovascular (ACV) y el infarto de miocardio (IM).
El metanálisis de estos estudios demostró que la TRH puede mejorar la supervivencia general (cociente de riesgos instantáneos [CRI] 0,71; intervalo de confianza [IC] del 95%: 0,54 a 0,93; 350 participantes, tres estudios; evidencia de certeza baja). La evaluación de la calidad de vida mediante el cuestionario EORTC‐C30 solo se realizó en un estudio. No se conoce con certeza si la TRH mejora o reduce la calidad de vida, ya que la certeza de la evidencia se evaluó como muy baja (diferencia de medias [DM] 13,67 puntos más alta, IC del 95%: 9,26 más alta a 18,08 más alta; un estudio; 75 participantes; evidencia de certeza muy baja). Asimismo, la TRH puede hacer poca o ninguna diferencia en cuanto a la supervivencia sin progresión (CRI 0,76; IC del 95%: 0,57 a 1,01; 275 participantes, dos estudios; evidencia de certeza baja).
No se conoce con certeza si la TRH mejora o reduce la incidencia del cáncer de mama (riesgo relativo [RR] 2,00; IC del 95%: 0,19 a 21,59; 225 participantes, dos estudios; evidencia de certeza muy baja); el AIT (RR 5,00; IC del 95%: 0,24 a 102.42; 150 participantes, un estudio; evidencia de certeza muy baja); el ACV (RR 0,67; IC del 95%: 0,11 a 3,88; 150 participantes, un estudio; evidencia de certeza muy baja); y el IM (RR 0,20; IC del 95%: 0,01 a 4,10; 150 participantes, un estudio; evidencia de certeza muy baja). En los estudios incluidos no se informó sobre la incidencia de cálculos biliares.
Conclusiones de los autores
La terapia de reemplazo hormonal puede mejorar ligeramente la supervivencia general en las mujeres que han sido sometidas a tratamiento quirúrgico para un COE, pero la certeza de la evidencia es baja. La TRH puede hacer poca o ninguna diferencia en cuanto a la calidad de vida, la incidencia del cáncer de mama, el AIT, el ACV y el IM, ya que la certeza de la evidencia se evaluó como muy baja. Puede haber poco o ningún efecto de la administración de TRH sobre la supervivencia sin progresión. La evidencia de esta revisión está limitada por la imprecisión y la falta de completitud de los resultados pertinentes comunicados, por lo tanto, los resultados se deben interpretar con cautela. Se requieren ECA futuros bien diseñados, ya que ésta es un área importante para las mujeres que presentan síntomas menopáusicos después del tratamiento quirúrgico para el cáncer de ovario, en especial porque los médicos suelen ser reacios a prescribir la TRH en este escenario. La evidencia de esta revisión es demasiado limitada para apoyar o refutar que la TRH es muy perjudicial para esta población.
PICO
Resumen en términos sencillos
Terapia de reemplazo hormonal para los síntomas de la menopausia en mujeres que se han sometido a un tratamiento quirúrgico para el cáncer de ovario epitelial
El problema
El cáncer de ovario epitelial (COE) se desarrolla a partir de la capa superficial del ovario. Es el octavo cáncer más frecuente y la séptima causa de muerte por cáncer en todo el mundo en las mujeres. El tratamiento quirúrgico del COE incluye la extirpación de todos los depósitos tumorales visibles en el abdomen, y habitualmente incluye ambos ovarios, el útero (matriz), el epiplón (cortina de grasa que cuelga del estómago y el colon transverso) y el peritoneo, con o sin la extirpación de los ganglios linfáticos u otros órganos. Las mujeres que estaban premenopáusicas antes del procedimiento comienzan a presentar la menopausia como resultado de la cirugía. Este hecho puede afectar negativamente su calidad de vida debido a síntomas como sofocos, cambios de humor, cambios en la actividad sexual, sequedad vaginal y pérdida de densidad ósea. Alrededor de un cuarto de las mujeres, en especial las más jóvenes, se presentarán con una enfermedad en estadio temprano y quedarán con los efectos adversos a largo plazo de una menopausia inducida quirúrgicamente. En las mujeres con enfermedad avanzada en el momento del diagnóstico la calidad de vida es un factor importante a considerar, ya que su enfermedad limita la vida.
La terapia de reemplazo hormonal (TRH) podría ser efectiva para los síntomas posmenopáusicos, pero hay preocupaciones importantes acerca de la seguridad de este tratamiento. Estas preocupaciones no solo están relacionadas con el cáncer, sino también con el corazón, y se deben equilibrar con los efectos positivos de la TRH para la salud de las mujeres con una menopausia temprana. En los últimos años se ha cuestionado la seguridad de la TRH y es posible que los médicos sean cautelosos al recetar TRH a mujeres que presentan una menopausia inducida quirúrgicamente después del tratamiento para un COE.
Objetivo de la revisión
Evaluar la seguridad y la eficacia de la terapia de reemplazo hormonal (TRH) para los síntomas menopáusicos en pacientes tratadas quirúrgicamente por COE.
¿Cuáles fueron los principales hallazgos?
Se buscó la evidencia de los efectos beneficiosos y perjudiciales de la TRH en el COE, hasta junio 2019. Se identificaron tres estudios en los que participaron 350 mujeres. Se encontró que la TRH puede mejorar la supervivencia general y puede hacer poca o ninguna diferencia en cuanto a la supervivencia sin progresión. No existe certeza acerca de los efectos sobre la calidad de vida, la incidencia del cáncer de mama, el ataque isquémico transitorio (también conocido como "miniaccidente cerebrovascular"), el accidente cerebrovascular (derrame) y el infarto de miocardio (ataque cardíaco), ya que la evidencia fue de certeza muy baja. No hubo informes sobre la incidencia de cálculos biliares.
Calidad de la evidencia
La certeza de la evidencia fue baja a muy baja para todos los resultados, debido principalmente al pequeño número de participantes y al escaso número de eventos adversos informados. La certeza de la evidencia también disminuye debido al alto riesgo de sesgo de los estudios incluidos, lo que significa que sus resultados podrían sobrestimar o subestimar el verdadero efecto del tratamiento.
¿Cuáles fueron las conclusiones?
La terapia de reemplazo hormonal puede mejorar la supervivencia general en las mujeres que presentan una menopausia inducida quirúrgicamente después del tratamiento para un COE, pero puede hacer poca o ninguna diferencia en cuanto a la supervivencia sin un empeoramiento de la enfermedad. La certeza general de estos hallazgos es baja a muy baja, debido principalmente a la falta de información. Esta área es muy importante para los estudios de investigación futuros, y posiblemente tiene una gran repercusión en muchas mujeres.
Conclusiones de los autores
Summary of findings
| Hormone replacement therapy (HRT) compared to no HRT for epithelial ovarian cancer (EOC) | ||||||
| Patients: women of any age diagnosed with any stage of EOC who had surgical treatment, regardless of chemotherapy treatment | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with no HRT | Risk with HRT | |||||
| Overall survival | Study population | HR 0.71 | 350 | ⊕⊕⊝⊝ | The median follow‐up time in the three included studies was 31.4 months, 90 months and 19.1 years. | |
| 795 per 1,000 | 675 per 1,000 | |||||
| Quality of life, general condition | The mean quality of life (general condition) in the no HRT group was 13.84 points. | The mean quality of life (general condition) in the HRT group was 13.67 points higher | ‐ | 75 | ⊕⊝⊝⊝ | The EORTC‐C30 questionnaire was used to evaluate this outcome; higher values correspond with improvement. |
| Progression‐free survival | Study population | HR 0.76 | 275 | ⊕⊕⊝⊝ | The median follow‐up time in the two studies was 90 months and 19.1 years. | |
| 773 per 1,000 | 676 per 1,000 | |||||
| Incidence of breast cancer | Study population | RR 2.00 | 225 | ⊕⊝⊝⊝ | The median follow‐up time in the two studies was 31.41 months and 19.1 years. | |
| 8 per 1,000 | 17 per 1,000 | |||||
| Incidence of transient ischaemic attack | Study population | RR 5.00 | 150 | ⊕⊝⊝⊝ | The median follow‐up time in the study was 19.1 years. | |
| 7 per 1,000 | 33 per 1,000 | |||||
| Incidence of cerebrovascular accident | Study population | RR 0.67 | 150 | ⊕⊝⊝⊝ | The median follow‐up time in the study was 19.1 years. | |
| 40 per 1,000 | 27 per 1,000 | |||||
| Incidence of myocardial infarction | Study population | RR 0.20 | 150 | ⊕⊝⊝⊝ | The median follow‐up time in the study was 19.1 years. | |
| 27 per 1,000 | 5 per 1,000 | |||||
| Incidence of gallstones | ‐ | ‐ | ‐ | ‐ | ‐ | The incidence of gallstones was not reported in the included studies. |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded by one level due to limitations in study design | ||||||
Antecedentes
Descripción de la afección
Una de cada 70 mujeres desarrollará cáncer de ovario (Fleming 2013) y su tasa de incidencia estandarizada por edad (TEE) es de 6,6 por cada 100 000 mujeres (GLOBOCAN 2018). Esta cifra es más baja en el África occidental y más alta en Europa septentrional, y varía entre 3 y 13 por 100 000 (Fleming 2013). Una de cada 100 mujeres morirá a causa de la enfermedad (Fleming 2013) y la TEE de la mortalidad es de 3,9 por cada 100 000 (GLOBOCAN 2018). La media de edad del diagnóstico del cáncer de ovario epitelial (COE) es de 60 años (Michaelson‐Cohen 2009). Sin embargo, el 40% de las mujeres afectadas tienen entre 30 y 60 años y entre el 3% y el 17% tienen menos de 40 años (Ibeanu 2011; Michaelson‐Cohen 2009; Wen 2013). La mayoría de las mujeres con COE (60% a 75%) se presentan con una enfermedad en un estadio avanzado y la supervivencia global a los cinco años para todos los estadios es del 45% (Ibeanu 2011; Singh 2010).
La citorreducción (eliminación) de cualquier tumor visible (también conocida como cirugía citorreductora) es la cirugía estándar para el estadiamiento y el tratamiento de la enfermedad; incluye la histerectomía, la salpingo‐ooforectomía bilateral y la omentectomía con o sin linfadenectomía pélvica y paraaórtica (i.e. la eliminación de todas las lesiones visibles en el abdomen y la cavidad pélvica, incluidos los ovarios, el útero [matriz] y el epiplón [cortina de grasa que cuelga del estómago/colón transverso], con o sin los ganglios linfáticos) (Fleming 2013). En las mujeres jóvenes con enfermedades en etapas tempranas o con enfermedades presentes solo en un ovario, puede ser apropiado realizar una cirugía para preservar la fertilidad (en la que solo se extirpa el ovario afectado). Se recomienda la extirpación del ovario restante una vez que la mujer haya completado su familia. La ooforectomía bilateral (la extirpación quirúrgica de ambos ovarios), y la consiguiente pérdida de la función ovárica en las mujeres premenopáusicas, induce una menopausia quirúrgica inmediata y puede dar lugar a una serie de síntomas como los síntomas vasomotores, la depravación del sueño, la dificultad de concentración, la disfunción sexual, los síntomas vaginales y la osteoporosis acelerada (Biliatis 2012; Hopkins 2004). Los síntomas que siguen a una menopausia quirúrgica en las mujeres jóvenes pueden ser más intensos que en la menopausia natural debido a su aparición repentina (Li 2012; Singh 2010; Wen 2013).
Los estudios han demostrado que el origen de muchos COE serosos de alto grado (AG) (y del cáncer peritoneal primario), el subtipo histológico más frecuente de COE, puede ser el extremo fímbrico de la trompa de Falopio (Leeper 2002). En esta revisión se utilizan los términos "COE" y "cáncer de ovario" como términos generales para incluir los cánceres peritoneales primarios y los cánceres serosos de AG de las trompas de Falopio.
Descripción de la intervención
La terapia de reemplazo hormonal es la administración de hormonas, generalmente estrógenos con o sin progesterona, para reemplazar la producción ovárica normal de hormonas, ya sea debido a la insuficiencia ovárica (menopausia inducida por la quimioterapia) o después de la extirpación quirúrgica de ambos ovarios (menopausia inducida quirúrgicamente). La TRH se puede administrar en una variedad de formulaciones y dosis. Se puede administrar por vía oral, vaginal, intranasal, como un implante, un parche para la piel, una crema o un gel. La administración de la TRH puede ser continua (todos los días), secuencial (durante parte de cada mes) o menos frecuente (Marjoribanks 2012). La TRH puede aliviar los síntomas de la menopausia y prevenir la cardiopatía y la osteoporosis (Ibeanu 2011). Sin embargo, la TRH puede tener efecto sobre los niveles de lípidos en la sangre y causar dolores de cabeza, hinchazón y sensibilidad mamaria (Marjoribanks 2012).
En el caso de las mujeres con útero, es necesario administrar progesterona para prevenir la hiperplasia endometrial y la malignidad. A las mujeres sin útero se les puede administrar TRH con estrógeno solamente. La TRH continua combinada, que consiste en un estrógeno y un progestágeno, tomados diariamente sin descanso, puede aumentar el riesgo de eventos coronarios, tromboembolismo venoso, accidente cerebrovascular, cáncer de mama, cálculos biliares y muerte por cáncer de pulmón (Marjoribanks 2012). Sin embargo, no se ha demostrado que la TRH con estrógenos únicamente después de una histerectomía aumente la incidencia de cáncer de mama (Chlebowski 2015; Marjoribanks 2012).
De qué manera podría funcionar la intervención
La terapia de reemplazo hormonal (TRH) es un tratamiento muy efectivo para el control de los síntomas de la menopausia y la prevención de la cardiopatía y la osteoporosis (Ibeanu 2011). Sin embargo, el efecto de las hormonas también depende de la disponibilidad de los receptores de estrógeno y progesterona. El estrógeno y la progesterona se incluyen principalmente en el régimen que se administra a las mujeres que presentan síntomas de menopausia. Los estrógenos desempeñan una función importante en el desarrollo reproductivo, la homeostasis de los huesos, la remodelación cardiovascular y la función cerebral (Hua 2018). El estrógeno tiene una función en el cáncer al unirse a dos tipos de receptores de estrógeno (RE), a saber, REα (un oncogén) y REβ (un gen supresor de tumores que se puede expresar en el 40% al 60% de los tumores de ovario) (Hua 2018). Sin embargo, un metanálisis no mostró efectos pronósticos de los niveles de RE sobre la supervivencia de las mujeres con cáncer de ovario (Zhao 2013). Se ha demostrado que la progesterona y los receptores de progesterona (RP) interactúan con el estrógeno para promover una respuesta proliferativa y de supervivencia en las células mamarias. Por el contrario, la progesterona inhibe el crecimiento impulsado por el estrógeno en el útero y el ovario y protege al ovario de la transformación neoplásica (Diep 2015); también se ha demostrado que tiene una asociación significativa con la supervivencia (Luo 2017; Zhao 2013). El BRCA1 y el BRCA2 son genes oncosupresores que, cuando mutan, aumentan el riesgo de desarrollar cáncer de mama entre el 45% y el 80% y cáncer de ovario y trompas de Falopio entre el 15% y el 56%. Estas cifras se comparan con el riesgo de toda la vida de la población general de desarrollar cáncer de ovario del 2% al 3% (Marchetti 2013), aunque las pacientes con mutaciones de la línea germinal BRCA tienen una supervivencia global significativamente mejor en comparación con las portadoras de mutaciones no BRCA (Zhong 2015). Sin embargo, las mujeres con cáncer de mama que son portadoras de la mutación BRCA1 (pero no de la BRCA2) tienen una supervivencia significativamente menor (Zhong 2015).
La terapia de reemplazo hormonal se ha asociado con la angiogénesis (Hopkins 2004), que puede estimular las células residuales del cáncer de ovario de una enfermedad microscópica o visible en mujeres tratadas por COE o inducir nuevas enfermedades dependientes de las hormonas, como el cáncer de mama (Hopkins 2004; Singh 2010). Por estas razones, los médicos pueden ser cautelosos al prescribir la TRH para los síntomas de la menopausia en las mujeres después de la cirugía para un COE. Por lo tanto, los efectos beneficiosos sobre la calidad de vida de cada individuo se deben sopesar contra cualquier riesgo teórico. Sin embargo, el pronóstico del COE en etapa temprana es bueno, con una baja incidencia de recidiva y mortalidad (menos del 10% de las mujeres con enfermedad recurrente en la etapa I del COE) (Lowe 2013) y una supervivencia prolongada. Por estas razones, los riesgos de una menopausia prematura, que incluyen la osteoporosis, las enfermedades cardiovasculares, las enfermedades tromboembólicas venosas y los accidentes cerebrovasculares, pueden ser mayores que el riesgo con la administración de la TRH. El COE en estadio avanzado tiene un pronóstico desfavorable, con una mayor incidencia de recidiva y mortalidad (tasa superior al 90% para el estadio IV) (Lowe 2013) y una supervivencia global a los cinco años menor del 25% al 30% (Biglia 2015; Ibeanu 2011). Por lo tanto, los resultados de la calidad de vida son importantes para las que tienen una enfermedad en fase inicial y para las que la tienen en fase final.
La terapia de reemplazo hormonal puede aliviar los síntomas de la menopausia entre las mujeres con cáncer de ovario en etapa temprana y mejorar la calidad de vida de las que tienen la enfermedad en etapa avanzada (Ursic‐Vrscaj 2001). Tres estudios retrospectivos han demostrado que la administración de la TRH no se asoció con un aumento de la supervivencia general ni de la recidiva del tumor, ni con una tendencia a la disminución de la mortalidad (Eeles 1991; Ursic‐Vrscaj 2001; Wen 2013). En un estudio, las mujeres con cáncer de ovario tipo seroso que recibieron TRH lograron una mejor supervivencia general (Mascarenhas 2006). Además, dos ensayos controlados aleatorizados (ECA) pequeños no mostraron efectos adversos de la TRH sobre la supervivencia (Guidozzi 1999; Li 2012). Por el contrario, los estudios sobre la administración de la TRH en mujeres sin cáncer alguno han demostrado un mayor riesgo de desarrollar cáncer de ovario (Zhou 2008). Por lo tanto, la efectividad de la TRH en la supervivencia general de las mujeres con cáncer de ovario aún no está clara.
Por qué es importante realizar esta revisión
En los últimos años se ha cuestionado la seguridad de la TRH. Este hecho ha dado lugar a que menos mujeres reciban TRH, con la consecuencia de que más mujeres presentan síntomas menopáusicos y efectos a largo plazo de la menopausia. Las mujeres premenopáusicas afectadas por cáncer de ovario a las que se les extirpan ambos ovarios presentan una menopausia aguda inducida por la cirugía o la quimioterapia, lo que puede provocar síntomas menopáusicos más prominentes. La supervivencia específica de la enfermedad es mejor para las mujeres jóvenes en comparación con las mujeres de más edad (edad en el momento del diagnóstico: 30 años o menos, versus 30 a 60 años y 60 años o más) (Fleming 2013). Por lo tanto, una población de mujeres más jóvenes sobreviven a más largo plazo al COE y es más probable que presenten una menopausia precoz y posiblemente más sintomática (Li 2012; Singh 2010; Wen 2013).
La terapia de reemplazo hormonal puede ser útil para el tratamiento de los síntomas de la menopausia, pero un metanálisis de estudios de cohortes y de casos y controles mostró un aumento del riesgo de desarrollar cáncer de ovario en mujeres a las que no se les había diagnosticado previamente el cáncer de ovario, y que habían estado en tratamiento de reemplazo hormonal durante más de diez años (Zhou 2008). Se han realizado tres revisiones sistemáticas sobre la administración de la TRH en el cáncer de ovario después de la cirugía (Hopkins 2004; Li 2015; Pergialiotis 2015). La primera revisión sistemática incluyó un ECA (Guidozzi 1999) y dos estudios observacionales (Eeles 1991; Ursic‐Vrscaj 2001) e indicó que la TRH era aceptable como tratamiento de apoyo y sintomático, y no afectaba la supervivencia general ni la supervivencia sin enfermedad (Hopkins 2004). La segunda y la tercera revisiones sistemáticas (en las que la última búsqueda se realizó en marzo de 2015) incluyeron cuatro estudios de cohortes (Eeles 1991; Mascarenhas 2006; Ursic‐Vrscaj 2001; Wen 2013) y dos ECA (Guidozzi 1999; Li 2012), y mostraron una repercusión favorable de la TRH sobre la supervivencia general, sin aumentar el riesgo de recidiva (Li 2015; Pergialiotis 2015).
El objetivo de esta revisión Cochrane es investigar la seguridad de la TRH en mujeres que presentan menopausia inducida quirúrgicamente, desde la perspectiva oncológica (recidiva y supervivencia) y en términos de calidad de vida. Se espera que esta revisión facilite el asesoramiento y la toma de decisiones informadas por parte de las mujeres que buscan asesoramiento y tratamiento después de haber sido tratadas por un cáncer y de la menopausia temprana y aguda. En la actualidad no hay evidencia clara y las opiniones son contradictorias.
Objetivos
Evaluar la seguridad y la eficacia de la terapia de reemplazo hormonal (TRH) para los síntomas de la menopausia en mujeres tratadas quirúrgicamente por cáncer de ovario epitelial (COE).
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron ensayos controlados aleatorizados (ECA) (se excluyeron los ensayos aleatorizados grupales o cruzados [cross‐over]) que compararon la TRH de cualquier régimen y duración de la administración versus placebo o ninguna terapia hormonal, o los ensayos que compararon diferentes regímenes o duraciones de la administración de la TRH.
Tipos de participantes
Se incluyeron mujeres de cualquier edad con diagnóstico de cualquier estadio de COE y recibieron tratamiento quirúrgico, sin importar la quimioterapia.
Tipos de intervenciones
Se incluyeron los estudios de administración de TRH después del tratamiento para un COE. No se estudió el efecto etiológico de la TRH utilizada antes del diagnóstico. Se incluyó cualquier TRH (estrógeno solo o combinado con progestina, agonista/antagonista de estrógeno, progestina o testosterona y tibolona), de cualquier régimen o duración de administración, en comparación con placebo o ninguna terapia hormonal. Debido a las diferencias farmacocinéticas entre los diferentes regímenes y duraciones de administración, se investigaron las tres comparaciones siguientes.
-
HRT versus placebo o ninguna HRT
-
Diferentes regímenes de HRT
-
Diferentes duraciones de la administración de la TRH
Tipos de medida de resultado
Resultados primarios
-
Supervivencia general: supervivencia hasta la muerte por todas las causas; la supervivencia se evaluó desde el momento del reclutamiento en el estudio.
-
Calidad de vida: definida como la percepción de un individuo de su vida en el contexto de la cultura y los sistemas de valores (que también incluye síntomas específicos de la menopausia como sofocos, sudores nocturnos, sequedad vaginal, etc.), medida con cualquier escala o cuestionario validado para la calidad de vida.
Resultados secundarios
-
Supervivencia sin progresión: supervivencia hasta la progresión de la enfermedad. La supervivencia se evaluó desde el momento del reclutamiento en el estudio.
-
Eventos adversos
-
Incidencia de cáncer de mama
-
Eventos tromboembólicos (embolia pulmonar [EP], trombosis venosa profunda [TVP], evento coronario, infarto de miocardio [IM], accidente cerebrovascular, accidente isquémico transitorio [AIT], accidente cerebrovascular [ACV])
-
Cálculos biliares
-
Métodos de búsqueda para la identificación de los estudios
In consultation with the Cochrane Gynaecological, Neuro‐oncology and Orphan Cancers Information Specialists, we searched for papers published in any language. When necessary, papers would have been translated.
Búsquedas electrónicas
We searched the following electronic databases on 12 June 2019:
-
the Cochrane Central Register of Controlled Trials (CENTRAL; 2019, Issue 6), in the Cochrane library (Appendix 1)
-
MEDLINE via Ovid (1946 to 12 June 2019) (Appendix 2)
-
Embase via Ovid (1980 to 2019 week 23) (Appendix 3)
Búsqueda de otros recursos
All relevant articles were identified on PubMed and using the 'related articles' feature; a further search was carried out for newly published articles. We searched the following registries for ongoing trials.
-
Metaregister (www.controlled‐trials.com/rct)
-
Physicians Data Query (www.cancer.gov/publications/pdq)
-
World Health Organization International Clinical Trials Registry Platform (WHO ICTRP) (www.who.int/ictrp/en/)
-
ClinicalTrails.gov (www.clinicaltrials.gov)
-
National Cancer Institute (www.cancer.gov/about‐cancer/treatment/clinical‐trials)
If we had identified any ongoing trials that had not been published, we would have approached the principal investigators and major co‐operative groups active in this area, to ask for relevant data.
We handsearched the citation lists of included studies, key textbooks, and previous systematic reviews, and contacted experts in the field to identify further reports of trials. We also handsearched conferences abstracts from the following sources.
-
Gynecologic Oncology (Annual Meeting of the American Society of Gynecologic Oncology)
-
International Journal of Gynecological Cancer (Annual Meeting of the International Gynecologic Cancer Society)
-
British Gynaecological Cancer Society (BGCS)
-
Annual Meeting of European Society of Gynaecological Oncology (ESGO)
Obtención y análisis de los datos
Selección de los estudios
We downloaded all titles and abstracts retrieved by electronic searching to a reference management database (Endnote). After duplicates were removed, we transferred these data to Covidence for study selection. Two review authors (NS and RB) examined the remaining references independently. We excluded those studies which clearly did not meet the inclusion criteria. We obtained copies of the full text of potentially relevant references. Two review authors (NS and RB) independently assessed the eligibility of the retrieved reports/publications. We resolved any disagreement through discussion and we consulted a third person (TL) for a final decision. We identified and excluded duplicates and collated multiple reports of the same study so that each study rather than each report was the unit of interest in the review. We recorded the selection process in sufficient detail to complete a PRISMA flow diagram and 'Characteristics of excluded studies' table (Liberati 2009).
Extracción y manejo de los datos
Two review authors (NS and KP) independently extracted study characteristics and outcome data from included studies to a piloted data collection form, using Covidence. We noted in the Characteristics of included studies table if outcome data were not reported in a usable way. We resolved disagreements by consensus or by involving a third person (RB). One review author (NS) transferred data into the Review Manager 5 (RevMan 2014) file. We double‐checked that data were entered correctly by comparing the data presented in the systematic review with the study reports. A second review author (KP) spot‐checked study characteristics for accuracy against the trial report.
For included studies, we extracted the following details.
-
Author, year of publication and journal citation (including language)
-
Country
-
Setting
-
Inclusion and exclusion criteria
-
Study design, methodology
-
Study population
-
Total number enrolled
-
Participant characteristics: age, menopausal status at diagnosis, performance status
-
Treatment: type of surgery and chemotherapy
-
Tumour stage, grade and types
-
-
Intervention details
-
All types of HRT: oestrogen alone or combined with progestin, oestrogen agonist/antagonist, progestin, or testosterone, and tibolone
-
Duration of administration of HRT in years
-
Route and doses of HRT
-
-
Comparison
-
Placebo or no treatment
-
-
Risk of bias in study (see Assessment of risk of bias in included studies)
-
Duration of follow‐up
-
Outcomes: for each outcome, we extracted the outcome definition. For adjusted estimates, we recorded variables adjusted for in analyses.
-
Results: we extracted the number of participants allocated to each intervention group, the total number analyzed for each outcome and number of dropouts, including reason for leaving the study.
-
Notes: funding for trial and notable conflicts of interest of trial authors.
Outcome data were extracted as follows.
-
For time‐to‐event data (survival and disease progression), we extracted the log of the hazard ratio (log(HR)) and its standard error from trial reports. For those studies that they did not report the HR, we attempted to estimate HR, the observed minus expected events (O‐E) and the variance (V) using formula according to Tierney 2007.
-
For dichotomous outcomes (e.g. adverse events or deaths) we extracted the number of participants in each treatment arm who experienced the outcome of interest and the number of participants assessed at endpoint, in order to estimate a risk ratio.
-
For continuous outcomes (e.g. quality‐of‐life measures), we extracted the final value and standard deviation of the outcome of interest and the number of participants assessed at endpoint in each treatment arm at the end of follow‐up, in order to estimate the mean difference between treatment arms and its standard error.
Where possible, all data extracted would be those relevant to an intention‐to‐treat analysis, in which participants would be analyzed in groups to which they were assigned. We noted the time points at which outcomes were collected and reported.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (NS and KP) applied the Cochrane 'Risk of bias' tool independently and resolved differences by discussion or by appeal to a third review author (EM). We judged each item as being at high, low or unclear risk of bias, as set out in the criteria provided by Higgins 2011 (and shown below), and provided a quote from the study report and/or a statement as justification for the judgement for each item in the 'Risk of bias' table. We summarized results in both a 'Risk of bias' graph and a 'Risk of bias' summary. When interpreting treatment effects and meta‐analyses, we took into account the risk of bias for the studies that contributed to that outcome. Where information on risk of bias related to unpublished data or correspondence with a trialist, we noted this in the 'Risk of bias' table.
-
Random sequence generation
-
Low risk of bias: e.g. participants were assigned to treatments on basis of a computer‐generated random sequence or a table of random numbers
-
High risk of bias: e.g. participants were assigned to treatments on basis of date of birth, clinic ID number or surname, or there was no attempt to randomize participants
-
Unclear risk of bias: e.g. sequence generation not reported or the information was not available
-
-
Allocation concealment
-
Low risk of bias: e.g. where the allocation sequence could not be foretold
-
High risk of bias: e.g. the allocation sequence could be foretold by participants, investigators or treatment providers
-
Unclear risk of bias: e.g. allocation concealment was not reported
-
-
Blinding of participants and personnel
-
Low risk of bias if participants and personnel were adequately blinded
-
High risk of bias if participants were not blinded to the intervention that the participant received
-
Unclear risk of bias if this was not reported or unclear
-
-
Blinding of outcomes assessors
-
Low risk of bias if outcome assessors were adequately blinded
-
High risk of bias if outcome assessors were not blinded to the intervention that the participant received
-
Unclear risk of bias if this was not reported or unclear
-
-
Incomplete outcome data: we recorded the proportion of participants whose outcomes were not reported at the end of the study. We coded a satisfactory level of loss to follow‐up for each outcome as follows.
-
Low risk of bias if fewer than 20% of participants were lost to follow‐up and reasons for loss to follow‐up were similar in both treatment arms
-
High risk of bias if more than 20% of participants were lost to follow‐up or reasons for loss to follow‐up differed between treatment arms
-
Unclear risk of bias if loss to follow‐up was not reported
-
-
Selective reporting of outcomes
-
Low risk of bias: e.g. the study reported all outcomes specified in the protocol
-
High risk of bias: e.g. it was suspected that outcomes had been selectively reported
-
Unclear risk of bias: e.g. it was unclear whether outcomes had been selectively reported
-
-
Other biases
-
Low risk of bias: if we did not suspect any other source of bias and the trial appeared to be methodologically sound
-
High risk of bias: if we suspected that the trial had been prone to an additional bias
-
Unclear risk of bias: if we are uncertain whether an additional bias might had been present
-
Medidas del efecto del tratamiento
We used the following measures of the effect of treatment.
-
For time‐to‐event data, we used the hazard ratio.
-
For dichotomous outcomes, we analyzed data based on the number of events and the number of people assessed in the intervention and comparison groups. We used these to calculate the risk ratio and 95% confidence interval (CI).
-
For continuous outcomes, we analyzed data based on the mean, standard deviation and number of people assessed for both the intervention and comparison groups to calculate mean difference between treatment arms, with a 95% CI. If the mean difference was reported without individual group data, we planned to use this to report the study results. If more than one study measured the same outcome using different tools, we planned to calculate the standardized mean difference and 95% CI using the inverse variance method in RevMan 2014.
Cuestiones relativas a la unidad de análisis
If any trials with multiple treatment groups had been identified, we would have divided the ‘shared’ comparison group into the number of treatment groups and comparisons between each treatment group and treated the split comparison group as independent comparisons.
Manejo de los datos faltantes
We did not contact study authors to obtain missing data (participant, outcome or summary data). We reported on the levels of loss to follow‐up and assessed this as a source of potential bias. We explored the impact of including studies with high levels of missing data in the overall assessment of treatment effect by using sensitivity analysis. We did not impute missing outcome data for the primary outcome.
Evaluación de la heterogeneidad
We assessed the degree of heterogeneity among trials using I2 (Higgins 2003) and Chi2 statistics (Deeks 2001). We regarded heterogeneity to be substantial if I² was greater than 50% and either Tau² was greater than zero, or there was a low P value (less than 0.10) in the Chi2 test for heterogeneity. If substantial heterogeneity was found, we would have used subgroup and sensitivity analyses to explore the causes of heterogeneity.
Evaluación de los sesgos de notificación
If we identify more than ten studies in future updates of this review, we will examine funnel plots corresponding to meta‐analysis of the primary outcome to assess the potential for small‐study effects such as publication bias. We plan to assess funnel plot asymmetry visually, and if asymmetry is suggested by a visual assessment, we will perform exploratory analyses to investigate it.
Síntesis de los datos
We carried out statistical analysis using Review Manager 5 (RevMan 2014). We used a fixed‐effect model for combining data if there was no substantial heterogeneity. If substantial statistical heterogeneity was detected, we used a random‐effects meta‐analysis to produce an overall summary and the results were presented as the average treatment effect with 95% CIs (DerSimonian 1986).
-
For time‐to‐event data, we pooled hazard ratios using the generic inverse variance facility of RevMan 2014.
-
For dichotomous outcomes, we calculated the risk ratio for each study and then pooled them.
-
For continuous outcomes, we pooled the mean differences between the treatment arms at the end of follow‐up, where all trials measured the outcome on the same scale; otherwise we planned to pool standardized mean differences.
When we were unable to pool the data statistically using meta‐analysis we conducted a narrative synthesis of results. We presented the major outcomes and results, organised by intervention categories according to the major types or aims (or both) of the identified interventions. Depending on the assembled research, we may also in future explore the possibility of organising the data by population. Within the data categories we will explore the main comparisons of the review.
We presented the overall quality of the evidence for each outcome listed below, using the GRADE approach, which took into account issues not only related to internal validity (risk of bias, inconsistency, imprecision, publication bias) but also to external validity, such as directness of results (Langendam 2013). We created a 'Summary of findings' table based on the methods described Chapter 12.2 of the Cochrane Handbook for Systematic Reviews of Interventions (Schunemann 2011), using GRADEpro GDT. We used the checklist to maximize consistent GRADE decisions and the GRADE Working Group quality of evidence definitions (Meader 2014). We downgraded the evidence from 'high' quality by one level for serious limitations (or two levels for very serious limitations) for each outcome, and outlined our rationale in the footnotes.
-
High quality: further research is very unlikely to change our confidence in the estimate of effect.
-
Moderate quality: further research is likely to have an important impact on our confidence in the estimate of effect and may change the estimate.
-
Low quality: further research is very likely to have an important impact on our confidence in the estimate of effect and is likely to change the estimate.
-
Very low quality: we were very uncertain about the estimate.
We included the following outcomes included in the 'Summary of findings' table.
-
Overall survival
-
Quality of life assessment
-
Progression‐free survival
-
Adverse events
-
Incidence of breast cancer
-
Incidence of thromboembolic events (DVT/ PE, stroke, MI)
-
Incidence of gallstones
-
Análisis de subgrupos e investigación de la heterogeneidad
We did not identify any substantial heterogeneity; therefore subgroup analysis were not conducted. In future updates, if more studies are included and substantial heterogeneity is identified, it will be of clinical interest to investigate the safety (risk and benefits) for the prespecified outcomes in this protocol for the following factors.
-
Menopausal status at diagnosis: premenopausal versus postmenopausal. If menopausal status is not extractable from studies, we will instead analyze by age (under 50 years versus 50 years or older).
-
Hysterectomy versus no hysterectomy.
-
Stage of cancer: stage I to II versus stage III to IV
-
Tumour types: endometrioid versus non‐endometrioid
-
Positive or negative oestrogen receptor, progesterone receptor or BRCA mutation status.
Análisis de sensibilidad
If necessary in any future update, we will use sensitivity analyses to assess the cause of substantial heterogeneity by omitting the studies with at a high risk of bias.
Results
Description of studies
Results of the search
We searched for references up to June 2019. We found 2617 references which met our search criteria, of which 29 were duplicates. Two review authors (NS and RB) independently screened titles and abstracts; the majority of references identified were not RCTs or the objective of study was to investigate the efficacy of hormones on therapeutic outcomes of ovarian cancer and not the effect of HRT. We reviewed 11 full‐text references and excluded eight as they did not meet the inclusion criteria. We identified three studies for inclusion (Eeles 2015; Guidozzi 1999; Li 2012) (see PRISMA flow diagram; Figure 1).
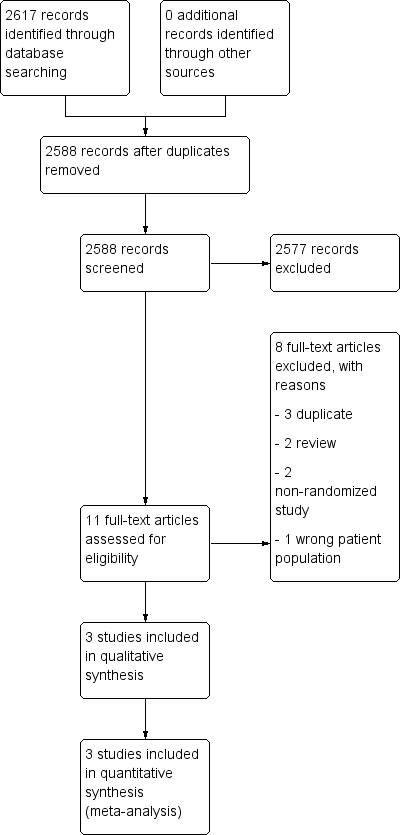
Study flow diagram.
Included studies
See Characteristics of included studies.
Study location and setting
One study (Eeles 2015) included women from multiple centres in the United Kingdom, Spain and Hungary, whereas Guidozzi 1999 and Li 2012 included single institutes in South Africa and China, respectively.
Participants
All women with a diagnosis of EOC had received cytoreductive surgery, chemotherapy, or both, and were well balanced across the two arms of the studies for demographic data. Eeles 2015 included 150 women with a median age of 58.7 years (and an age range of 29.3 to 89.6 years) and both pre and postmenopausal women were eligible for inclusion. Guidozzi 1999 included 130 women aged 59 years or younger, 44% of whom were between 56 and 59 years of age. Li 2012 included 90 women aged 45 years or younger (age range: 20 to 45 years).
The number of women that were lost to follow‐up were 0, 5 and 15 participants in Eeles 2015, Guidozzi 1999 and Li 2012, respectively. Two studies included all stages and histological types (Eeles 2015; Guidozzi 1999), whereas Li 2012 included only International Federation of Gynecology and Obstetrics (FIGO) stage I to III and serous and mucinous type. The majority of tumours were grade 3 in Eeles 2015 and grade 1 in Guidozzi 1999. There were no data on tumour grade in Li 2012. Participants were randomized to HRT versus no HRT arms using computer‐generated (Eeles 2015) or sealed‐envelope randomization (Guidozzi 1999; Li 2012).
The women that were excluded from studies were those who had conservative surgery to preserve their ovarian function, had history of hormone‐dependent malignancy with contraindications to hormone therapy (Eeles 2015), or had low malignant potential and had never taken hormone therapy (Guidozzi 1999).
None of the studies looked into the effect of BRCA status and HRT effects on survival in women with ovarian cancer. Oestrogen and progesterone receptors were investigated only in one study (Li 2012).
Interventions
The three included studies used a variety of HRT. Guidozzi 1999 used only conjugated oestrogen (0.625 mg/day). Li 2012 used combined HRT: conjugated oestrogen (0.625 mg/day) with medroxyprogesterone (4 mg/day) and nylestriol (2.5 mg/15 day) with medroxyprogesterone (4 mg/day). Eeles 2015 used oestrogen only: conjugated oestrogen, estradiol patch and estradiol implant, and combined with progesterone; conjugate oestrogen and norgestrel.
Outcomes
The median follow‐up time was 31.4 months, 90 months and 19.1 years for Li 2012, Guidozzi 1999 and Eeles 2015, respectively. There were participants who were lost to follow‐up: 3.8% in Guidozzi 1999 and 16.7% in Li 2012. These participants were excluded from the analysis and results. In Eeles 2015, where the median follow‐up was 19.1 years, 63.9% of participants discontinued hormone therapy; the most common being the presence of adverse effects or unknown reason.
There were participants who were assigned to HRT, but did not receive or discontinued HRT (65.5% in Eeles 2015 and 13.6 % in Guidozzi 1999). There were also participants who were assigned to no HRT, but who received HRT (10.7% in Eeles 2015 and 8.5% in Guidozzi 1999). However, all analyses were performed on an intention‐to‐treat basis for these studies.
Overall survival was the primary outcome in all three studies. The incidence of breast cancer was studied in two studies (Eeles 2015; Li 2012). Treatment adverse effects and quality of life (using the EORTC‐C30 questionnaire and GMU‐Gynae Index), were only studied in Li 2012. The EORTC‐C30 was used to assess five function domains (physical, emotional, social, role and cognitive), eight symptoms (fatigue, pain, nausea/vomiting, constipation, diarrhoea, insomnia, dyspnoea and loss of appetite) and global health/quality of life. The GMU‐Gynae Index assessed quality of sexual life (sexual difficulties, emotional exchange between the couple, regression of sexual life and sexual desire), symptoms of lower urinary tract infection (urethral burning and frequent urination), autonomic dysfunction (itchy skin, dry skin and formication). The incidence of gallstones was not reported in any study.
Dates of study, funding sources and declarations of interest
For Guidozzi 1999 the study period was four to seven years and included participants between January 1987 and June 1994. Eeles 2015 included participants between February 1990 and November 1995; and Li 2012 included participants between August 1999 and June 2003.
Funding was provided by their own institute in two studies(Guidozzi 1999; Li 2012); these studies did not provided details of any conflict of interest. Funding for Eeles 2015 was provided from multiple sources as this was a multicentre study; they declared conflicts of interest among the various authors.
Excluded studies
We excluded eight references from the full‐text review, of which three were duplicate reports (Guidozzi 1998; Guidozzi 1999a; Li 2008), two were non‐randomized studies (Bebar 2000; Ursic‐Vrscaj 2001), two were literature reviews (Guidozzi 2013; Lipkowitz 2015), and one was a study which included healthy postmenopausal women (Anderson 2003). See Characteristics of excluded studies.
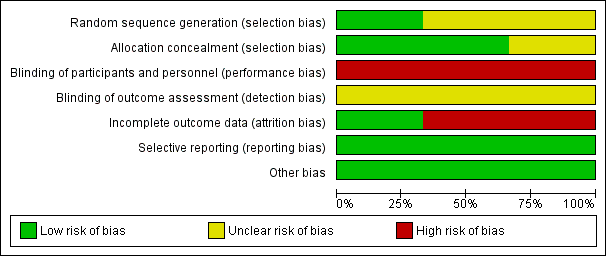
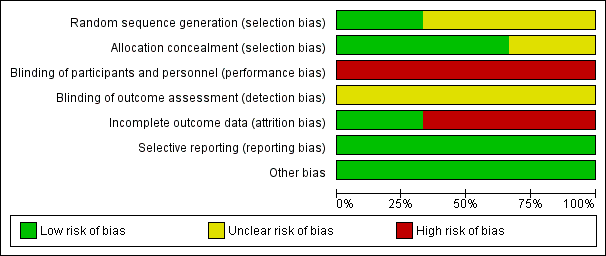
Risk of bias in included studies
The details of risk of bias for the three included studies are shown in Figure 2 and Figure 3.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Allocation
Three studies used randomization for allocation; one study clearly described using computer‐generated random permuted blocks (Eeles 2015) and the other two did not mention the method used (Guidozzi 1999; Li 2012).
Two studies showed adequate allocation concealment using central randomization (Eeles 2015) or sealed opaque envelopes (Guidozzi 1999); and one study had insufficient information to justify a judgement of low or high risk of bias (Li 2012).
Blinding
All studies had a high risk of performance bias because the participants knew the HRT they were receiving and there was no placebo used. There was no information about the assessors and whether they knew the treatment group in all three studies; therefore we classified the risk of detection bias as unclear.
Incomplete outcome data
All three studies reported data on losses to follow‐up and non‐compliance (0% and 65.3%, respectively in Eeles 2015; and 3.8% and 31.1%, respectively in Guidozzi 1999); however, they analyzed their results on an intention‐to‐treat basis. Li 2012 excluded from analysis participants who were lost to follow‐up or non‐compliance to HRT within six months (16.7%).
Selective reporting
The study protocols were not available, however, the studies reported the results as detailed in their objectives.
Other potential sources of bias
The studies appeared to be free of other sources of bias.
Effects of interventions
See summary of findings Table for the main comparison: HRT versus no HRT for women who have undergone surgical treatment for EOC.
Primary outcomes
Overall survival
All three studies reported overall survival. The pooled result showed that HRT may improve overall survival in women who have had surgery for EOC (HR 0.71, 95% CI 0.54 to 0.93; three studies, 350 participants; low‐certainty evidence; Analysis 1.1).
Quality of life
We are uncertain whether HRT improves or reduces the overall quality of life women who have had surgery for EOC (MD 13.67 points higher; 95% CI 9.26 higher to 18.08 higher; very low‐certainty evidence; one study, 75 participants; very low‐certainty evidence; Analysis 1.2).
Secondary outcome
Progression‐free survival
The effect of HRT on progression‐free survival in women who have had surgery for EOC was assessed in two studies (Eeles 2015; Guidozzi 1999); the range where the actual effect may be (the "margin of error") indicated that it may make little or no difference (HR 0.76, 95% CI 0.57 to 1.01; two studies, 275 participants; low‐certainty evidence; Analysis 1.3).
Incidence of breast cancer
It is uncertain whether HRT increased the incidence of breast cancer. There were only three participants who developed breast cancer: two participants in the HRT arm, and one participant in the no HRT arm, in one study (Eeles 2015); and none in another study (Li 2012). The effect of HRT varied and it was possible that HRT made little or no difference as we are very uncertain of the results (RR 2.00, 95% CI 0.19 to 21.59; two studies, 225 participants; very low‐certainty evidence; Analysis 1.4).
Transient ischaemic attack (TIA)
It was very uncertain whether HRT increases the incidence of TIA. There were only two participants who developed TIA in Eeles 2015, both in the HRT arm (RR 5.00, 95% CI 0.24 to 102.42; one study, 150 participants; very low‐certainty evidence; Analysis 1.5).
Cerebrovascular accident (CVA)
It was uncertain whether HRT decreases the incidence of CVA. There were five participants who developed CVA in one study (Eeles 2015): two participants in the HRT arm and three participants in the no HRT arm (RR 0.67; 95% CI 0.11 to 3.88; one study, 150 participants; very low‐certainty evidence; Analysis 1.6).
Myocardial infarction (MI)
It was uncertain whether HRT decreases the incidence of MI. There were two participants in Eeles 2015 who developed MI, both in the no HRT arm (RR 0.20, 95% CI 0.01 to 4.10; one study, 150 participants; very low‐certainty evidence; Analysis 1.7).
Incidence of gallstone
The incidence of gallstone was not reported in any of the included studies.
Subgroup and sensitivity analyses
We did not perform subgroup or sensitivity analyses for any outcomes due to there only being a small number of trials and no substantial heterogeneity identified.
Discusión
Resumen de los resultados principales
La evidencia sobre la eficacia y la seguridad de la TRH versus ninguna TRH en las mujeres que han recibido tratamiento quirúrgico para el COE es limitada; solo tres estudios pequeños cumplieron los criterios de inclusión de esta revisión y proporcionaron evidencia de certeza baja a muy baja. La calidad de vida, medida con la escala EORTC‐C30, solo se informó en un estudio (Li 2012). La TRH puede mejorar ligeramente la supervivencia general en las mujeres que han recibido tratamiento quirúrgico para el COE, pero puede hacer poca o ninguna diferencia en la calidad de vida, la supervivencia sin progresión, la incidencia de cáncer de mama, el accidente isquémico transitorio, el accidente cerebrovascular y los eventos de infarto de miocardio.
Compleción y aplicabilidad general de las pruebas
Todos los ECA publicados que se incluyeron en este metanálisis proporcionaron información sobre todos los resultados de esta revisión, excepto la incidencia de cálculos biliares. Se encontró que la TRH puede mejorar ligeramente la supervivencia general y la calidad de vida de las mujeres después del tratamiento oncológico para el COE.
Uno de los ensayos incluidos se realizó en centros europeos como el Reino Unido, España y Hungría (Eeles 2015), mientras que los otros dos fueron ensayos en un solo centro en Sudáfrica (Guidozzi 1999) y Asia (Li 2012). Los tres estudios informaron sobre la supervivencia general; dos informaron sobre la supervivencia sin progresión (Eeles 2015; Guidozzi 1999) y sobre la incidencia del cáncer de mama (Eeles 2015; Li 2012). Los efectos adversos solo se informaron en un estudio cuyos resultados tuvieron amplios intervalos de confianza debido al pequeño tamaño de la muestra (Eeles 2015).
El cuestionario EORTC‐C30 se utilizó para las evaluaciones de la calidad de vida en Li 2012, y en este cuestionario solo se seleccionó para el análisis el dominio de la condición general. El EORTC‐C30 es un cuestionario estandarizado que se utiliza de manera habitual para los pacientes con cáncer (Snyder 2013); no es una evaluación específica de la menopausia. Menopause Specific Quality of Life Questionnaire (MENQOL), World Health Organization Quality of Life (WHO QOL‐BREF), Greene Climacteric Scale, Utian Quality of Life (UQOL) Scale, Women's Health Questionnaire (WHQ), 36‐Item Short Form (SF‐36), MENCAV, Cervantes Scale, Cervantes Short‐Form Scale, y Menopause Rating Scale (MRS) son los cuestionarios que se pueden utilizar para evaluar específicamente los síntomas de la menopausia (Jenabi 2015).
La terapia de reemplazo hormonal puede aumentar el riesgo de desarrollar otras enfermedades como el cáncer de mama cuando se utiliza la terapia hormonal combinada (Benkhadra 2015; Chlebowski 2015; Manson 2013), la cardiopatía coronaria (Rossouw 2002; Rossouw 2007), el accidente cerebrovascular (Manson 2013; Rossouw 2002), la embolia pulmonar (Manson 2013; Rossouw 2002), la trombosis venosa profunda (Manson 2013), la demencia (Manson 2013) y la enfermedad de la vesícula biliar (Manson 2013). La administración prolongada de la TRH y la administración de la TRH combinada para mujeres mayores de 60 años se ha asociado con un mayor riesgo de desarrollar embolia pulmonar y un menor riesgo de cáncer colorrectal. Las mujeres que se han sometido a una histerectomía y que reciben TRH con estrógeno solamente pueden tener un riesgo mayor de sufrir un accidente cerebrovascular y cáncer colorrectal cuando tienen más de 60 y 70 años de edad, respectivamente (Manson 2013). La administración de TRH en las mujeres posmenopáusicas sanas se ha asociado con un mayor riesgo de desarrollar cáncer de ovario (Rodríguez 2001; Zhou 2008), ya sea de tipo seroso (Cancer Epidemiology 2015; Mørch 2012; Shi 2015) o de tipo endometrioide (Cancer Epidemiology 2015; Mørch 2012). La administración de la TRH durante más de cinco años se relaciona con un mayor riesgo de cáncer de ovario (Zhou 2008), y esta correlación es más fuerte para el tipo seroso (Mørch 2012).
Los receptores hormonales, los receptores de estrógenos o los receptores de progesterona y el estado de la mutación BRCA son factores pronósticos conocidos en el cáncer de ovario ( Luo 2017; Shen 2017; Zhong 2015). La presencia de receptores de estrógeno se ha asociado con una supervivencia general favorable en mujeres con COE no clasificado en Europa, América del Sur y Oceanía. Sin embargo, los receptores de estrógeno no se han asociado con una supervivencia sin progresión más larga (Shen 2017). La presencia de receptores de progesterona también se ha asociado con una supervivencia general y una supervivencia sin progresión favorables en las mujeres europeas con COE no clasificado (Luo 2017). Asimismo, la mutación BRCA se ha correlacionado con una mejor supervivencia general y sin progresión (Zhong 2015). Sin embargo, no se identificaron estudios que examinaran el efecto de la TRH en mujeres que han sido sometidas a un tratamiento quirúrgico para un COE con receptores hormonales o mutación BRCA.
No se identificó heterogeneidad entre los resultados de los diferentes estudios. No hubo estudios que compararan diferentes regímenes y duraciones de la TRH, aunque hubo variaciones en la edad y la raza de los participantes, el estadio y el tipo histológico de la enfermedad, el régimen, la dosis y la vía de administración de la TRH. Lo anterior puede indicar la generalizabilidad de la aplicación en la práctica clínica. Sin embargo, la información sobre la duración de la administración de la TRH, el estado de los receptores hormonales y la mutación BRCA fue limitada.
Calidad de la evidencia
Mediante los criterios GRADE se valoró que la certeza de la evidencia fue baja debido a las limitaciones en el diseño de los estudios incluidos y a la inconsistencia de los resultados. No todos los estudios utilizaron placebo en el grupo control; las participantes sabían qué terapia hormonal recibían y en algunos estudios hubo pérdidas durante el seguimiento superiores al 20% (Li 2012). También hubo diferencias en los resultados; un estudio mostró un efecto de la administración de TRH (Eeles 2015), mientras que los demás no mostraron el mismo efecto (o solo en parte en un estudio [Guidozzi 1999]. La calificación mediante GRADE se disminuyó aún más a evidencia de certeza muy baja debido a la imprecisión de los resultados, los pequeños tamaños de las muestras y los amplios IC del 95%.
Sesgos potenciales en el proceso de revisión
Se realizaron búsquedas exhaustivas de la evidencia disponible. Dos autores de la revisión buscaron de forma independiente los estudios y siguieron criterios claros de inclusión y exclusión, e identificaron los estudios elegibles. Dos autores de la revisión de forma independiente extrajeron los datos y evaluaron el riesgo de sesgo. Aún es posible que los estudios no se hayan informado o se hayan omitido y no se hayan incluido. No fue posible realizar un análisis del sesgo de publicación en esta revisión porque el número de estudios incluidos es inferior a diez.
Acuerdos y desacuerdos con otros estudios o revisiones
Un metanálisis reciente sobre el efecto de la TRH sobre la población general mostró que la TRH no afectó el riesgo de muerte por eventos cardíacos, accidente cerebrovascular y cáncer (de mama, pulmón, colorrectal u ovario) (Benkhadra 2015). Sin embargo, la administración de TRH combinada, pero no la TRH con estrógeno solamente, se asoció con un mayor riesgo de mortalidad por cáncer de mama (Benkhadra 2015). En este metanálisis se examinaron por separado las mujeres más jóvenes (que comenzaron la TRH con menos de 60 años o dentro de los diez años de la menopausia) y se encontró que la administración de TRH se asoció con una menor mortalidad por todas las causas. La evidencia sobre la TRH en mujeres que presentan la menopausia natural aún no está clara. Las conclusiones de una revisión sistemática y un metanálisis (en el que se incluyeron 310 329 mujeres) mostraron que las mujeres que presentaron una menopausia precoz (con menos de 45 años de edad) tuvieron en general una mayor incidencia de cardiopatía coronaria y mortalidad por cardiopatía coronaria, enfermedades cardiovasculares y mortalidad por todas las causas (Muka 2016). Un estudio epidemiológico grande, el Black Women’s Health Study, investigó la mortalidad por todas las causas en 11 212 mujeres con menopausia natural y encontró que las mujeres menores de 45 años que nunca habían utilizado TRH tuvieron una tasa de mortalidad más alta; este hallazgo no fue significativo para las que habían utilizado TRH (Li 2013). En otro estudio epidemiológico realizado en los EE.UU. con 11 287 mujeres, la mortalidad por todas las causas fue mayor en las mujeres que presentaron la menopausia antes de los 45 años de edad (Malek 2019). Durante un seguimiento de 7,1 años, las pacientes con menopausia y con menos de 45 años que habían utilizado alguna vez la terapia de reemplazo hormonal tuvieron una tasa de mortalidad por todas las causas más alta que las pacientes con menopausia y con más de 45 años que habían utilizado alguna vez la terapia de reemplazo hormonal, aunque las limitaciones incluyen la asociación del tabaquismo con una edad temprana de la menopausia. Además, se encontró que las mujeres que recibieron TRH durante más de cinco años, desde alrededor de los 50 años de edad, tuvieron un mayor riesgo de cáncer de ovario, en especial para los tipos seroso y endometrioide (Cancer Epidemiology 2015).
Se han realizado tres revisiones sistemáticas previas de la administración de TRH en el COE después del tratamiento. La primera revisión sistemática, Hopkins 2004, incluyó un ECA (Guidozzi 1999) y dos estudios observacionales. La segunda y tercera revisiones sistemáticas (Li 2015; Pergialiotis 2015) incluyeron dos ECA (Guidozzi 1999; Li 2012) y cuatro estudios de cohortes. El resultado de todas estas revisiones sistemáticas mostró que la TRH puede hacer poca o ninguna diferencia en cuanto a la supervivencia general y sin progresión. La presente revisión incluyó tres ECA (Eeles 2015; Guidozzi 1999; Li 2012) y los resultados indican que la TRH se puede asociar con una ligera mejoría en la supervivencia general y la calidad de vida (especialmente para la condición general), pero puede hacer poca o ninguna diferencia en cuanto a la supervivencia sin progresión. Ninguna de las tres revisiones sistemáticas anteriores (Hopkins 2004; Li 2015; Pergialiotis 2015) informó sobre los resultados de los efectos adversos de la TRH.

Study flow diagram.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Comparison 1 Hormone replacement therapy versus no hormone replacement therapy, Outcome 1 Overall survival.

Comparison 1 Hormone replacement therapy versus no hormone replacement therapy, Outcome 2 Quality of life, general condition.
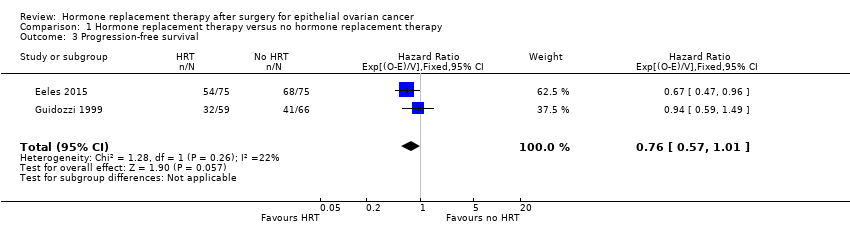
Comparison 1 Hormone replacement therapy versus no hormone replacement therapy, Outcome 3 Progression‐free survival.

Comparison 1 Hormone replacement therapy versus no hormone replacement therapy, Outcome 4 Incidence of breast cancer.
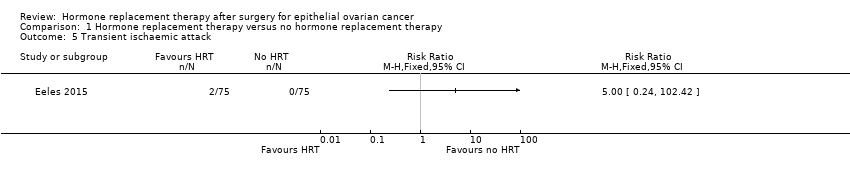
Comparison 1 Hormone replacement therapy versus no hormone replacement therapy, Outcome 5 Transient ischaemic attack.
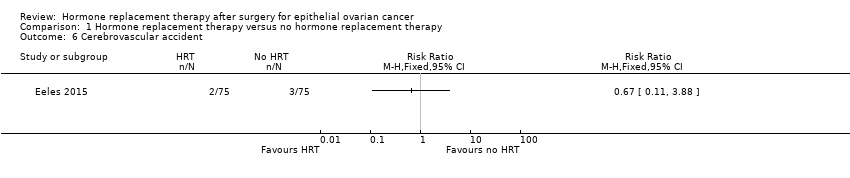
Comparison 1 Hormone replacement therapy versus no hormone replacement therapy, Outcome 6 Cerebrovascular accident.
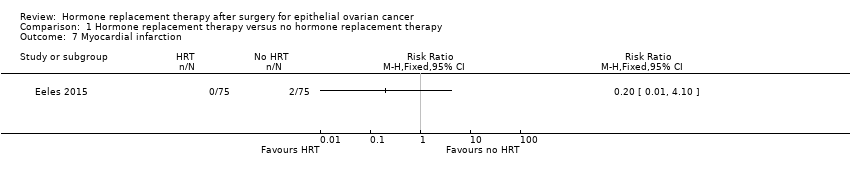
Comparison 1 Hormone replacement therapy versus no hormone replacement therapy, Outcome 7 Myocardial infarction.
| Hormone replacement therapy (HRT) compared to no HRT for epithelial ovarian cancer (EOC) | ||||||
| Patients: women of any age diagnosed with any stage of EOC who had surgical treatment, regardless of chemotherapy treatment | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with no HRT | Risk with HRT | |||||
| Overall survival | Study population | HR 0.71 | 350 | ⊕⊕⊝⊝ | The median follow‐up time in the three included studies was 31.4 months, 90 months and 19.1 years. | |
| 795 per 1,000 | 675 per 1,000 | |||||
| Quality of life, general condition | The mean quality of life (general condition) in the no HRT group was 13.84 points. | The mean quality of life (general condition) in the HRT group was 13.67 points higher | ‐ | 75 | ⊕⊝⊝⊝ | The EORTC‐C30 questionnaire was used to evaluate this outcome; higher values correspond with improvement. |
| Progression‐free survival | Study population | HR 0.76 | 275 | ⊕⊕⊝⊝ | The median follow‐up time in the two studies was 90 months and 19.1 years. | |
| 773 per 1,000 | 676 per 1,000 | |||||
| Incidence of breast cancer | Study population | RR 2.00 | 225 | ⊕⊝⊝⊝ | The median follow‐up time in the two studies was 31.41 months and 19.1 years. | |
| 8 per 1,000 | 17 per 1,000 | |||||
| Incidence of transient ischaemic attack | Study population | RR 5.00 | 150 | ⊕⊝⊝⊝ | The median follow‐up time in the study was 19.1 years. | |
| 7 per 1,000 | 33 per 1,000 | |||||
| Incidence of cerebrovascular accident | Study population | RR 0.67 | 150 | ⊕⊝⊝⊝ | The median follow‐up time in the study was 19.1 years. | |
| 40 per 1,000 | 27 per 1,000 | |||||
| Incidence of myocardial infarction | Study population | RR 0.20 | 150 | ⊕⊝⊝⊝ | The median follow‐up time in the study was 19.1 years. | |
| 27 per 1,000 | 5 per 1,000 | |||||
| Incidence of gallstones | ‐ | ‐ | ‐ | ‐ | ‐ | The incidence of gallstones was not reported in the included studies. |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded by one level due to limitations in study design | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Overall survival Show forest plot | 3 | 350 | Hazard Ratio (95% CI) | 0.71 [0.54, 0.93] |
| 2 Quality of life, general condition Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 3 Progression‐free survival Show forest plot | 2 | 275 | Hazard Ratio (95% CI) | 0.76 [0.57, 1.01] |
| 4 Incidence of breast cancer Show forest plot | 2 | 225 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.0 [0.19, 21.59] |
| 5 Transient ischaemic attack Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 6 Cerebrovascular accident Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 7 Myocardial infarction Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |

