Sobreimpresión del lecho tumoral para las pacientes que han sido sometidas a una cirugía conservadora de mama
Resumen
Antecedentes
El tratamiento conservador de la mama, que incluye la cirugía conservadora de mama seguida de irradiación completa de la mama y optativamente la sobreimpresión del lecho tumoral, es una opción terapéutica estándar para las pacientes con cáncer de mama en estadio inicial. La sobreimpresión del lecho tumoral significa que se aplica una dosis extra de radiación que abarca el sitio tumoral inicial. La justificación de la sobreimpresión del lecho tumoral es que (i) la recidiva local ocurre principalmente en el sitio del tumor primario porque es más probable que allí se encuentren células tumorales microscópicas remanentes; y (ii) la radiación puede eliminar estas células tumorales microscópicas causales. La sobreimpresión aún se utiliza en las pacientes con alto riesgo de recidiva local, pero es menos aceptada en las pacientes con menor riesgo. Las razones para cuestionar la sobreimpresión son dos. En primer lugar, la sobreimpresión ocasiona costos mayores del tratamiento. En segundo lugar, los posibles eventos adversos son significativos. En esta revisión Cochrane se investigó el efecto de la sobreimpresión del lecho tumoral sobre el control local y los efectos secundarios.
Objetivos
Evaluar los efectos de la sobreimpresión del lecho tumoral después de la cirugía conservadora de mama y la irradiación completa de la mama para el tratamiento del cáncer de mama.
Métodos de búsqueda
Se hicieron búsquedas en el registro especializado del Grupo Cochane de Cáncer de Mama (Cochrane Breast Cancer Specialised Register), Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL), MEDLINE (enero 1966 hasta 1 marzo 2017), Embase (1980 hasta 1 marzo 2017), en la World Health Organization International Clinical Trials Registry Platform y en ClinicalTrials.gov el 1 marzo 2017. También se hicieron búsquedas de resúmenes en el European Society of Radiotherapy and Oncology Annual Meeting, en las St Gallen Oncology Conferences y en el American Society for Radiation Oncology Annual Meeting.
Criterios de selección
Ensayos controlados aleatorios que compararon el agregado y la omisión de la sobreimpresión del lecho tumoral por cáncer de mama.
Obtención y análisis de los datos
Dos autores de la revisión (IK y CW) realizaron la extracción de datos y evaluaron el riesgo de sesgo utilizando la herramienta Cochrane "Riesgo de sesgo", resolviendo cualquier desacuerdo mediante discusión. Se introdujeron los datos en Review Manager 5 para su análisis y se aplicó GRADE para evaluar la calidad de la evidencia.
Resultados principales
Se incluyeron cinco ensayos controlados aleatorios que analizaron un total de 8325 mujeres.
El control local pareció ser mejor en las pacientes que recibieron la sobreimpresión del lecho tumoral en comparación con ninguna sobreimpresión del lecho tumoral (cociente de riesgos instantáneos [CRI] 0,64; intervalo de confianza [IC] del 95%: 0,55 a 0,75; cinco estudios, 8315 mujeres, evidencia de baja calidad). La supervivencia general no difirió con o sin la sobreimpresión del lecho tumoral (CRI 1,04; IC del 95%: 0,94 a 1,14; dos estudios, 6342 mujeres, evidencia de calidad moderada). La supervivencia libre de enfermedad no difirió con o sin la sobreimpresión del lecho tumoral (CRI 0,94; IC del 95%: 0,87 a 1,02; tres estudios, 6549 mujeres, evidencia de baja calidad). La toxicidad tardía calificada mediante la evaluación del porcentaje de retracción de la mama no difirió con o sin la sobreimpresión del lecho tumoral (diferencia de medias 0,38; IC del 95%: ‐0,18 a 0,93; dos estudios, 1526 mujeres, evidencia de muy baja calidad). La apariencia estética calificada por un panel fue mejor (es decir, excelente o buena en comparación con regular o deficiente) en el grupo de ninguna sobreimpresión (odds ratio [OR] 1,41; IC del 95%: 1,07 a 1,85; dos estudios, 1116 mujeres, evidencia de baja calidad). La apariencia estética calificada por un médico no difirió en los grupos con o sin la sobreimpresión del lecho tumoral (OR 1,58; IC del 95%: 0,93 a 2,69; dos estudios, 592 mujeres, evidencia de muy baja calidad).
En un análisis de sensibilidad de la recidiva local se excluyeron dos estudios (porque la dosis biológica equivalente [DBE] al lecho tumoral fue inferior, se incluyeron los tumores in situ o hubo un alto riesgo de sesgo de informe selectivo o sesgo de cegamiento de la evaluación de resultado), lo que dio lugar a una CRI de 0,62 (IC del 95%: 0,52 a 0,73; tres estudios, 6963 mujeres, evidencia de alta calidad). El análisis de subgrupos con la inclusión de las pacientes mayores de 40 años de edad produjo un CRI de 0,65 (IC del 95%: 0,53 a 0,81; dos estudios, 5058 mujeres, evidencia de alta calidad).
No se encontraron datos para los resultados de toxicidad aguda, calidad de vida ni costos.
Conclusiones de los autores
Al parecer las tasas de control local aumentan con la sobreimpresión del lecho tumoral, pero no se encontró evidencia de efectos beneficiosos en otros resultados oncológicos. El análisis de subgrupos con la inclusión de las pacientes mayores de 40 años de edad produjo resultados significativos similares. La evaluación objetiva del porcentaje de retracción de la mama parece similar entre los grupos. Al parecer la apariencia estética es peor con la sobreimpresión del lecho tumoral, pero sólo cuando la evalúa un panel, no cuando es evaluada por un médico.
PICO
Resumen en términos sencillos
Sobreimpresión del lecho tumoral para las pacientes que han sido sometidas a una cirugía conservadora de mama
¿Cuál es el problema?
El cáncer de mama es el cáncer más frecuente en las mujeres de todo el mundo. Las dos estrategias principales de tratamiento son el tratamiento conservador de la mama o la mastectomía. Para reducir el riesgo de recidiva y mejorar las tasas de supervivencia, la atención estándar incluye la radioterapia coadyuvante (tratamiento con radiación ionizante) después de la cirugía conservadora de mama. La radioterapia coadyuvante consiste principalmente en cuatro a cinco semanas de irradiación completa de la mama seguida de una dosis "de sobreimpresión" extra al lecho tumoral porque el cáncer de mama tiende a reaparecer en la misma área donde se eliminó. Además de mantener la mama y lograr el control del cáncer de mama, en el tratamiento conservador de la mama es importante una apariencia física (apariencia estética) satisfactoria.
¿Por qué es importante?
Las guías para el uso de la sobreimpresión del lecho tumoral no suelen ser específicas. Aunque sea técnicamente factible tratar a todas las pacientes con la sobreimpresión del lecho tumoral después de la irradiación completa de la mama, todavía no está claro si es necesario o si puede provocar más efectos perjudiciales que beneficiosos. Las consecuencias posibles de agregar una dosis de sobreimpresión del lecho tumoral son una apariencia estética deficiente, mayores costos del tratamiento y aumento en la duración del tratamiento.
Había interés en determinar si no administrar una dosis de sobreimpresión del lecho tumoral después de la irradiación completa de la mama y la cirugía conservadora de mama tiene tantos efectos beneficiosos como administrar la dosis de sobreimpresión. La omisión de la sobreimpresión del lecho tumoral necesitaría tener un control del cáncer equivalente cuando se compare con administrar una dosis de sobreimpresión del lecho tumoral. También sería importante que esa omisión de la sobreimpresión del lecho tumoral dé lugar a menos efectos secundarios en comparación con administrar la dosis de sobreimpresión del lecho tumoral.
Se encontraron cinco estudios con un total de 8325 mujeres. La evidencia está actualizada hasta el 1 marzo 2017. La recidiva local fue menos frecuente con la sobreimpresión del lecho tumoral (evidencia de baja calidad). No hubo evidencia de una diferencia en la supervivencia libre de enfermedad o general con o sin la administración de la sobreimpresión del lecho tumoral (baja y moderada calidad de la evidencia, respectivamente). La apariencia estética calificada por un panel pareció ser peor en el grupo de sobreimpresión del lecho tumoral (evidencia de baja calidad). No hubo diferencias en la puntuación de la apariencia estética por el médico ni en el porcentaje de retracción de la mama.
Lo anterior significa que el agregado de la sobreimpresión del lecho tumoral aumenta la tasa de control local al posible costo de una peor apariencia estética.
Conclusiones de los autores
Summary of findings
| Boost compared to no boost in breast cancer radiotherapy | ||||||
| Patient or population: breast‐conserving radiotherapy for breast cancer | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk without boost | Risk with boost | |||||
| Local control: recurrence at 5 years | Study population | HR 0.64 | 8315 | ⊕⊕⊝⊝ | Nice did not report 5‐year local control. | |
| 70 per 1000 | 45 per 1000 | |||||
| Overall survival: mortality at 5 years | Study population | HR 1.04 | 6342 | ⊕⊕⊕⊝ | ||
| 91 per 1000 | 94 per 1000 | |||||
| Disease‐free survival: disease progression/mortality at 5 years | Study population | HR 0.94 | 6549 | ⊕⊕⊝⊝ | EORTC did not report 5‐year disease‐free survival. | |
| 221 per 1000 | 209 per 1000 | |||||
| Late toxicity, pBRA | Mean pBRA 8.17, range 7.55 to 10 | Mean pBRA 8.55, | MD 0.38 higher (0.18 lower to 0.93 higher) | 1526 | ⊕⊝⊝⊝ | |
| Cosmesis, panel scored: fair or poor | Study population | OR 1.41 | 1116 | ⊕⊕⊝⊝ | ||
| 202 per 1000 | 263 per 1000 | |||||
| Cosmesis, physician‐scored: fair or poor | Study population | OR 1.58 | 592 | ⊕⊝⊝⊝ | ||
| 85 per 1000 | 128 per 1000 | |||||
| Sensitivity analysis: local control ‐ recurrence at 5 years | Study population | HR 0.62 | 6963 | ⊕⊕⊕⊕ | ||
| 74 per 1000 | 47 per 1000 | |||||
| Subgroup analysis: local control ‐ > 40 years old, recurrence at 5 years | Study population | HR 0.65 | 5058 | ⊕⊕⊕⊕ | ||
| 59 per 1000 | 39 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1High risk of selective reporting in one study. | ||||||
Antecedentes
Descripción de la afección
El cáncer de mama es el cáncer más frecuente en las mujeres en todo el mundo, con casi 1 700 000 nuevos casos diagnosticados en 2012 (Globocan). Representa cerca del 12% de todos los nuevos casos de cáncer en ambos sexos y el 25% de todos los casos de cáncer en las mujeres (Globocan). Los datos de la base de datos de mortalidad y población de la Organización Mundial de la Salud (OMS) indican que el cáncer de mama representó el número más grande de muertes debido al cáncer previstas en las mujeres en Europa; la tasa de mortalidad (mundial) calculada por cáncer de mama estandarizada por la edad fue de 14,6 por 100 000 mujeres en 2013 (Malvezzi 2013). Como cualquier cáncer, el cáncer de mama puede reaparecer localmente o en un sitio distante. Sin tratamiento (neo‐)coadyuvante, hasta el 30% de los cánceres de mama con ganglio negativo y hasta el 70% de los cánceres de mama con ganglio positivo en las pacientes, reaparecerán localmente o se diseminarán a otro órgano después de la cirugía (Darby 2011; EBCTCG 2005).
Se han informado varios factores de riesgo no favorables para la recidiva local del cáncer de mama después del tratamiento primario y se han establecido herramientas predictivas que pueden determinar el riesgo de cáncer de mama. Además del estado ganglionar, los factores de riesgo informados son: omisión de radioterapia/terapia hormonal/quimioterapia, edad temprana, presencia de invasión linfovascular y presencia de carcinoma ductal in situ (CDIS), además de tumor invasivo, grado histológico alto, diámetro tumoral grande y márgenes quirúrgicos positivos o dudosos (Darby 2011; Sanghani 2010; van Werkhoven 2011).
Descripción de la intervención
El tratamiento conservador de la mama (TCM), que incluye la cirugía conservadora de mama (CCM) seguida de irradiación completa de la mama (ICM) y optativamente la sobreimpresión del lecho tumoral, es la opción terapéutica estándar para las pacientes con cáncer de mama en estadio inicial. Los ensayos controlados aleatorios han indicado que las tasas de control local y la supervivencia en las pacientes con enfermedad en estadio inicial tratadas con TCM son equivalentes al tratamiento con mastectomía (Fisher 2002; Litière 2012). La sobreimpresión del lecho tumoral significa que se aplica una dosis extra de radiación que abarca el sitio tumoral inicial, donde hay grandes probabilidades de que el cáncer recidive. La justificación de la sobreimpresión del lecho tumoral es (i) la recidiva local ocurre principalmente en el sitio del tumor primario porque es más probable que allí se encuentren células tumorales microscópicas remanentes; y (ii) la radiación puede eliminar estas células tumorales microscópicas causales.
El objetivo principal de la radioterapia coadyuvante (es decir, ICM y sobreimpresión optativa del lecho tumoral) después de la CCM es disminuir la recidiva local y permitir la conservación de la mama con un mínimo de efectos secundarios inducidos por el tratamiento. La necesidad de la radioterapia coadyuvante ha sido demostrada por el Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). El metanálisis realizado por el EBCTCG mostró una reducción en la tasa de la primera recidiva a los diez años del 35% al 19,3%, y una ganancia en la supervivencia del cáncer de mama del 3,8% a los 15 años al agregar la radioterapia coadyuvante (Darby 2011).
El régimen estándar de radioterapia trata la mama completa con una dosis de radiación total de 40 a 50 Gy con la sobreimpresión optativa del lecho tumoral. La sobreimpresión aún se utiliza en pacientes con alto riesgo de recidiva local, pero es menos aceptada en las pacientes con menor riesgo. Las razones para cuestionar la sobreimpresión son dos. En primer lugar, la sobreimpresión ocasiona costos mayores del tratamiento. En segundo lugar, los posibles eventos adversos son significativos. Los efectos secundarios a corto plazo de la sobreimpresión del lecho tumoral incluyen fatiga, edema de la mama, eritema de la piel e hiperpigmentación, mientras los riesgos a largo plazo incluyen fibrosis, cicatrización del tejido conjuntivo, neumonía por radiación, fracturas de costilla, toxicidad cardíaca y otro cáncer inducido por la radiación. La National Comprehensive Cancer Network (NCCN) recomienda una dosis adicional en las pacientes con mayor riesgo de recidiva. Esta dosis adicional se puede lograr mediante radioterapia de haz externo con dosis de 10 a 16 Gy, o mediante braquiterapia intersticial. Las guías europeas aconsejan la sobreimpresión del lecho tumoral en las pacientes con al menos uno de los siguientes factores de riesgo: hasta 50 años de edad, tumores grado 3, CDIS extenso, invasión vascular y posiblemente en los casos de escisión tumoral no radical (Senkus 2015).
De qué manera podría funcionar la intervención
Después del tratamiento inicial, puede producirse una recidiva local cuando crecen células cancerosas microscópicas residuales en el sitio original del cáncer de mama. Los datos señalan que entre el 44% y el 90% de las recidivas locales se localizan en el lecho tumoral primario o cerca de este (Bartelink 2007; Kuerer 2004; Vaidya 2010) y estos números se correlacionan bien con los hallazgos de Holland y colegas (Holland 1985). Para eliminar las células cancerosas microscópicas residuales se recomienda la sobreimpresión adicional del lecho tumoral (Bartelink 2015; van Werkhoven 2011).
La radiación ionizante es la radiación con una alta energía cuyas trazas ionizantes depositan la energía en las células. La dosis de radiación ionizante total, D, se mide en energía por unidad de masa. La radiación daña principalmente la cromatina y causa, por ejemplo, roturas en la cadena doble del ADN (DSB, en inglés). Una dosis extrema de 1 Gy provoca muchas miles de ionizaciones en el núcleo de la célula, de las cuales una minoría pequeña induce rápidamente DSB. La mayoría de las DSB se reparan en la próxima media hora, y algunas son reparadas de forma deficiente. A una dosis típica de varios Gy, generalmente ocurre al menos una rotura reparada de forma deficiente que puede ser suficiente para matar la célula en el próximo ciclo de división celular. La irradiación también puede provocar otras clases de lesiones letales como mutaciones letales puntuales, lo que hace que el efecto sea irreparablemente letal y no propenso a reparación o reparado de forma deficiente.
El efecto de la radiación sobre los tumores se presenta en el modelo cuadrático lineal (CL), que cuantifica los efectos del daño no reparable y del daño reparable susceptible a ser reparado de forma deficiente (Kellerer 1972). El modelo se basa en el concepto de una dosis biológicamente efectiva (DBE) que representa la dosis física requerida para un determinado efecto. DBE = D [1 + d/(α/β)] ‐ γTt/α donde d es la dosis por fracción, α y β son los parámetros CL, γ = ln(2)/Tpot y Tpot es el tiempo de duplicación potencial y Tt es la duración del tratamiento (Fowler 1989).
La mejoría del control tumoral requiere una mayor dosis de radiación dentro del rango de dosis‐respuesta de cualquier carga tumoral residual. El efecto de la radiación sobre el tumor (según α/β) en el tejido mamario ya no es 10 Gy como históricamente se supuso, si no alrededor de 4,6 Gy (Hennequin 2013; START 2008). Al tener en cuenta lo anterior, los regímenes de dosis existentes para el control tumoral local se deben reconsiderar al calcular todas las DBE de los regímenes utilizados en los estudios sobre cáncer de mama.
Por qué es importante realizar esta revisión
Con la introducción de la tomografía computarizada (TC) y la planificación del tratamiento 3D en la radioterapia desde hace más de una década, los estudios de investigación se han centrado en optimizar las técnicas de tratamiento. Actualmente, el lecho tumoral en el tejido de la mama se puede irradiar mediante un conjunto completo de técnicas de tratamiento que incluyen radiación convencional, radiación conformal 3D, radiación de intensidad modulada, radiación intraoperatoria o irradiación de protones. El radioterapeuta también tiene una alternativa amplia de esquemas de fraccionamiento (es decir, aplicar la dosis total a diferentes números o tamaños de dosis por fracción): normofraccionado (el régimen estándar para la irradiación de la mama equivale a 50 Gy en 25 fracciones de 2 Gy, cinco días a la semana), hipofraccionado (la dosis total de radiación se divide en dosis más grandes por fracción), o incluso la radioterapia de fracción única y una variedad amplia de duraciones del tratamiento.
Aunque los estudios de investigación han proporcionado una variedad amplia de opciones de tratamiento, no se ha alcanzado consenso sobre la necesidad de la sobreimpresión al lecho tumoral y, por consiguiente, sus indicaciones. El tamaño absoluto del efecto beneficioso de la sobreimpresión del lecho tumoral está vinculado al riesgo inicial de recidiva local; el efecto beneficioso más alto se registra en los grupos de alto riesgo (Bartelink 2015). El efecto de la dosis de la sobreimpresión parece ser independiente de las características tumorales como el grado o el estadio, así como del tratamiento sistémico coadyuvante (Bartelink 2015). Sin embargo, puede depender de la edad y el estado del margen quirúrgico (van Werkhoven 2011).
Es importante determinar claramente qué pacientes se beneficiarán de recibir la sobreimpresión del lecho tumoral. En esta revisión se intentó ayudar a los profesionales sanitarios a sopesar el efecto beneficioso de un mejor control local y supervivencia contra un aumento de los efectos secundarios (p.ej. fibrosis, cicatrización del tejido conjuntivo), la incomodidad de una duración más prolongada del tratamiento y un mayor costo.
Objetivos
Evaluar los efectos de la sobreimpresión del lecho tumoral después de la cirugía conservadora de mama y la irradiación completa de la mama para el tratamiento del cáncer de mama.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todos los ensayos controlados aleatorios de grupos paralelos que compararon el agregado y la omisión de la sobreimpresión del lecho tumoral del cáncer de mama.
Tipos de participantes
Pacientes con un diagnóstico histológico de cáncer de mama por primera vez (sin enfermedad recidivante o metastásica) y sin antecedentes previos de enfermedad maligna (excepto el carcinoma de células basales de la piel).
Solamente se incluyeron los estudios que trataron a las pacientes con CCM. La cirugía conservadora de mama podría incluir tumorectomía, escisión local amplia, cuadrantectomía o mastectomía segmentaria con o sin disección axilar, muestreo axilar o biopsia del ganglio centinela. Las pacientes no se excluyeron sobre la base de la edad, la raza, el tamaño tumoral ni el tipo histológico.
Tipos de intervenciones
Todas las pacientes con CCM (tumorectomía, escisión local amplia, cuadrantectomía o mastectomía segmentaria) seguidas de ICM (cualquier esquema estándar). Se compararon las pacientes que habían recibido sobreimpresión adicional del lecho tumoral con las pacientes que no habían recibido sobreimpresión del lecho tumoral. La sobreimpresión se podría proporcionar mediante radiación con haz externo (electrones o fotones) o con braquiterapia intersticial.
Se excluyeron las pacientes que habían recibido radioterapia intraoperatoria.
Se permitió la administración de tratamientos sistémicos como hormonas, quimioterapia o anticuerpos monoclonales siempre que se aplicaran por igual a las pacientes de cada brazo del ensayo.
Tipos de medida de resultado
Resultados primarios
-
Control local, definido como el tiempo (desde la asignación al azar) hasta el desarrollo de cualquier recidiva local durante el seguimiento (resultado de tiempo hasta el evento). La recidiva local se definió como la presencia de recidiva en la mama ipsilateral (es decir, la mama en la que se había diagnosticado cáncer), en la piel y en el parénquima.
-
Toxicidad aguda relacionada con la radioterapia, es decir cualquier evento tóxico que ocurriera en la mama, la piel, los pulmones y el corazón en el transcurso de seis meses desde la finalización de la radioterapia. En el caso de la toxicidad aguda se la intentó clasificar según las escalas que los autores utilizaron y, de ser posible, convertirla a la puntuación de los National Cancer Institute Common Toxicity Criteria (NCI‐CTCAE v4.0).
Resultados secundarios
-
Supervivencia general, definida como el tiempo desde la asignación al azar hasta la muerte por cualquier causa durante el seguimiento.
-
Supervivencia libre de enfermedad, definida como el tiempo desde la asignación al azar hasta la recidiva (local o distante) durante el seguimiento.
-
Toxicidad tardía relacionada con la radioterapia, es decir, cualquier evento tóxico que ocurriera más de seis meses después de la radioterapia. Esta toxicidad se clasificó según las escalas que utilizaron los autores, de lo contrario, se consideraron eventos tóxicos grado 3 ó 4 según los National Cancer Institute Common Toxicity Criteria (NCI‐CTCAE v4.0). En esta revisión se extrajeron datos a los cinco, diez, 15 y 20 años.
-
Apariencia estética, calificada según la escala de Harvard en cuatro clases: excelente, buena, regular y deficiente (Harris 1979).
-
Calidad de vida, se clasificó según escalas validadas que utilizaron los autores de los ensayos o las puntuaciones actuales en la escala EORTC Quality of Life (EORTC QoL).
-
Costos del tratamiento, se clasificaron según las escalas que utilizaron los autores de los ensayos.
Results
Description of studies
See: Characteristics of included studies table.
Results of the search
We identified and screened 5276 references from the major medical databases and 7 additional references from other sources. After exclusion of duplicates and screening of references (by title or abstract), we evaluated 37 full‐text references and excluded two references (relating to the one study) because the study design was not randomised controlled trial (see Characteristics of excluded studies table). We considered one study as ongoing (ChiCTR‐IOR‐17010342). The remaining 34 references related to five studies (Budapest: 2 records; EORTC: 22 records; Lyon: 1 record; Nice: 1 record; SGW: 8 records) (see Figure 2). No studies were awaiting classification.
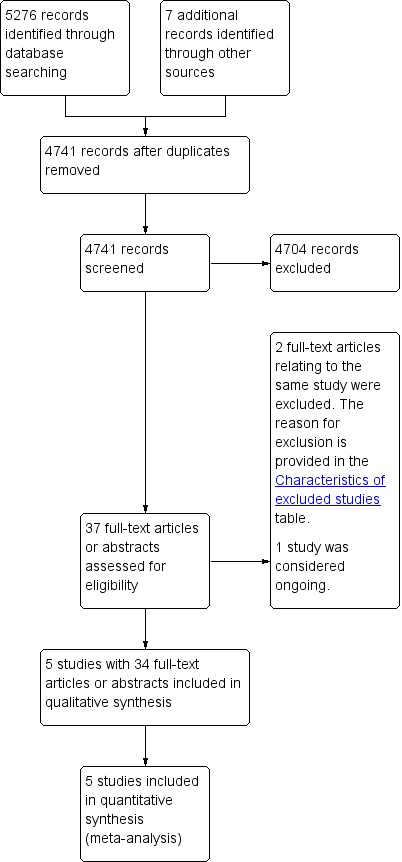
Study flow diagram.
Included studies
Design
Five studies randomised 8325 women (Budapest;EORTC;Lyon;Nice;SGW). These studies enrolled women from August 1995 to October 1998 (Budapest), May 1989 to June 1996 (EORTC), January 1986 to June 1992 (Lyon), 1987 to 1994 (Nice), and accrual was started in September 1996 without reporting an end date (SGW).
Sample size
Budapest enrolled 627 women; EORTC enrolled 5569 participants, of whom 5318 were randomised between a boost and no boost; Lyon enrolled 1028 participants, Nice enrolled 664 participants; and SGW enrolled 688 participants.
Setting
The Budapest and Nice trials were single‐centre trials. The Lyon and SGW were conducted in centres in France and Australia, respectively. The EORTC trial was a multicentre trial in nine countries.
Participants
Budapest included women with stage I‐II breast cancer excluding bilateral cases. EORTC enrolled 5569 patients with stage I or II (T1‐2, N0‐1, M0) invasive breast cancer who were younger than 70 years old. All patients in whom the tumour excision was microscopically complete according to the local pathologist (n = 5318) were randomised to either a boost and no boost to the tumour bed. Patients were excluded if they had pure carcinoma in situ. Lyon included women with invasive ductal carcinoma ≤ 3 cm and "free" pathological margins (absence of detectable cancer cells at the inked margin) and who were younger than 70 years old. SGW included women with T in situ, T1, T2 N0‐3 breast cancer. Nice included patients with invasive breast cancer treated with axillary dissection.
Interventions
Experimental arm
Whole‐breast irradiation:
plus boost irradiation:
-
high‐dose‐rate brachytherapy 12 to 14.25 (Budapest)
-
15 Gy by means of an iridium‐192 implant at a dose rate of 0.5 Gy per hour (EORTC)
-
10 Gy in 4 fractions in 1 week (Lyon)
-
10 Gy in 5 fractions in 1 week (Nice)
The BEDs for the experimental arm were 87.8 Gy in Budapest and EORTC, 86.4 Gy in Lyon, 79.9 Gy in Nice, and 78.6 Gy in SGW.
Control arm
Whole‐breast irradiation:
The BEDs for the control arm were 66.7 Gy in Budapest, EORTC, Nice, and SGW, and 72.1 Gy in Lyon.
Co‐interventions
Budapest only provided detailed population information on the first 207 patients with at least 3 years of follow‐up: 18% received hormonal therapy alone, 18% chemotherapy alone, and 6% hormonal therapy and chemotherapy. There were no significant differences between the boost and no boost group. In EORTC, participants with axillary lymph node involvement received adjuvant systemic therapy (7%): premenopausal women received chemotherapy (38%) and postmenopausal women received tamoxifen (62%). In Lyon, chemotherapy was administered in 22% of women and endocrine therapy in 30%. Premenopausal women with positive lymph nodes received adjuvant chemotherapy. For postmenopausal women, tamoxifen was always started in node‐positive women and sometimes in node‐negative women. In SGW, 20% of women received chemotherapy and 39% received endocrine therapy. Nice did not report numbers on systemic therapy.
Outcomes
Primary outcomes
-
All five studies reported local control.
-
No study reported on acute toxicity related to radiotherapy.
Secondary outcomes
-
Three studies reported disease‐free survival (Budapest; EORTC; Lyon).
-
Four studies reported on late toxicity related to radiotherapy. Budapest described grade 2 to 3 side effects of skin and subcutaneous tissues. EORTC reported the grade of fibrosis as scored by the physician (none, minimal, moderate, severe) and the pBRA. Lyon scored telangiectasias as 0, 1, 2, or 3 and reported the scores for 0 versus 1 or 2. SGW reported the BRA, pBRA, and nipple‐areolar complex hypopigmentation.
-
Cosmesis was rated by a physician in three studies (Budapest; Lyon; SGW). Participant scoring was reported in Lyon and SGW. A panel of physicians scored cosmesis in EORTC and SGW. EORTC and SGW evaluated cosmesis with the BCCT.core software.
-
SGW reported on quality of life, without analysis for boost versus no boost.
-
None of the studies reported treatment costs.
Excluded studies
We excluded two reports based on full‐text analysis (see Characteristics of excluded studies).
Risk of bias in included studies
Refer to Figure 3.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
Allocation
We judged Budapest and EORTC to be at low risk of bias for sequence generation. Lyon, Nice, and SGW did not clearly report random sequence generation or allocation concealment and so were assessed as at unclear risk of bias. We considered allocation concealment as low risk for EORTC. Allocation concealment appears to have been done in Budapest, although the description was incomplete, which contributed to the judgement of unclear risk of bias.
Blinding
Objective outcomes
We judged blinding of participants and personnel and blinding of outcome assessment for objective outcomes as at low risk of bias in Budapest, EORTC, Lyon, and SGW. No study mentioned blinding of participants, which would have been difficult to do with this intervention, but the lack of blinding was unlikely to have introduced bias. The trials also did not mention blinding of physicians. This would have been difficult to do with the intervention, but we considered failure to do so less likely to have introduced bias because the follow‐up (including mammographic screening) interval was prespecified in all four studies. No information on follow‐up was provided in Nice, so we judged assessed this domain as at high risk of bias.
Subjective outcomes
We judged blinding of participants and personnel for subjective outcomes as at low risk of bias in Budapest, EORTC, Lyon, Nice, and SGW.
Colour‐printed photographs were taken at predefined time points in EORTC, and an external review panel scored the cosmetic result. Based on the use of a grading scale and the blinding of assessors, we judged this domain as at low risk of bias. However, since the physician was not blinded to the treatment arm to score fibrosis, we judged this domain as at unclear risk of bias. The clinical oncologist assessed subjective outcomes at follow‐up in Lyon and Budapest; because there was no blinding we judged these studies as at high risk of bias. No information on the blinding of assessors was provided for SGW, therefore we judged this domain as at unclear risk of bias. No information on subjective outcomes was provided in the abstract of the Nice study, so we judged this domain as at high risk of bias.
Incomplete outcome data
In Budapest, two participants were excluded with reasons and no attrition was reported. In Lyon, two participants with bilateral breast cancer were excluded; there was no postrandomisation attrition. Because postrandomisation exclusions were detailed with reasons, we deemed these studies to be at low risk of bias. In EORTC and SGW, no exclusion or attrition was reported, so we judged this domain as at low risk of bias. No information was provided in the abstract of the Nice study, so we judged this domain as at unclear risk of bias.
Selective reporting
We did not have access to the study protocols for Budapest and Lyon, therefore we judged this domain as at unclear risk of bias. All prespecified endpoints in the protocol were reported in the results of EORTC, so we judged this domain as at low risk of bias. The results on local control in Nice were only available in an abstract, and results for SGW were briefly described in Millar 2009 and Graham 2007. Since no protocol was available and no further results on local recurrence have been reported, we judged this domain as at high risk of bias.
Other potential sources of bias
EORTC, Lyon, Nice, and SGW were at low risk of bias for other potential sources of bias. Because Budapest and Nice were interim reports, we judged them as at unclear risk of bias for this domain.
Effects of interventions
See: Summary of findings for the main comparison Boost compared to no boost in breast cancer radiotherapy
See: summary of findings Table for the main comparison.
Primary outcomes
Local control
There were 737 local recurrences in the 8315 women studied in five studies.
Local control appeared to be better with the administration of a tumour bed boost (HR 0.64, 95% CI 0.55 to 0.75; P < 0.00001; 5 studies, 8315 women, low‐quality evidence, Analysis 1.1; Figure 4). There was evidence of heterogeneity on visual inspection and statistical testing (I² = 60%). We performed a sensitivity analysis based on excluding Nice and SGW because BED to the tumour bed was lower compared to the other three studies (79.9 Gy and 78.6 Gy, respectively compared to 86.4 Gy to 87.8 Gy); there was a high risk of selective reporting bias and blinding of outcome assessment bias for Nice; and in situ tumours were included in SGW. We found that a tumour bed boost versus no tumour bed boost was associated with significantly better local control (HR 0.62, 95% CI 0.52 to 0.73; P < 0.00001; 3 studies, 6963 women, high‐quality evidence; Analysis 1.2). There was no evidence of heterogeneity on visual inspection and statistical testing (I² = 24%).

Forest plot of comparison: 1 Tumour bed boost radiotherapy versus no boost, outcome: 1.1 Local control.
We performed subgroup analysis including only women older than 40 years of age. Local control appeared to be better with the administration of a tumour bed boost in the subgroup analysis (HR 0.65, 95% CI 0.53 to 0.81; P < 0.0001; 2 studies, 5058 women, high‐quality evidence; Analysis 1.3). There was no heterogeneity on either visual inspection or statistical testing (I² = 10%).
Acute toxicity
There were no data on acute toxicity.
Secondary outcomes
Overall survival
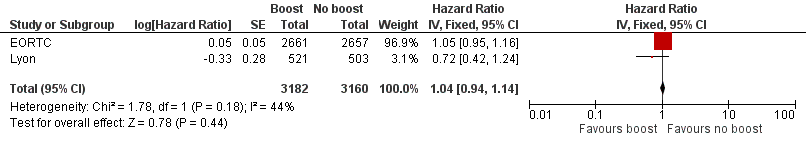
We found no difference in overall survival with or without a boost to the tumour bed with data from 1683 deaths in two studies with 6342 women (HR 1.04, 95% CI 0.94 to 1.14; P = 0.44; moderate‐quality evidence; Analysis 1.5; Figure 5). There was no heterogeneity on either visual inspection or statistical testing (I² = 44%).

Forest plot of comparison: 1 Tumour bed boost radiotherapy versus no boost, outcome: 1.5 Overall survival.
Disease‐free survival
We found no difference in disease‐free survival with or without a boost to the tumour bed with data from 2810 events in three studies with 6549 women (HR 0.94, 95% CI 0.87 to 1.02; P = 0.12; low‐quality evidence; Analysis 1.6). There was no evidence of heterogeneity on visual inspection, but there was on statistical testing (I² = 77%). For sensitivity analysis, no studies were at high risk of bias for the domains of objective outcomes and other bias.
Late toxicity
We found no difference in pBRA with or without a boost to the tumour bed with data from 1526 women in two studies (MD 0.38, 95% CI ‐0.18 to 0.93; P = 0.18; very low‐quality evidence; Analysis 1.7). There was evidence of heterogeneity on visual inspection and statistical testing (I² = 75%).
Cosmesis
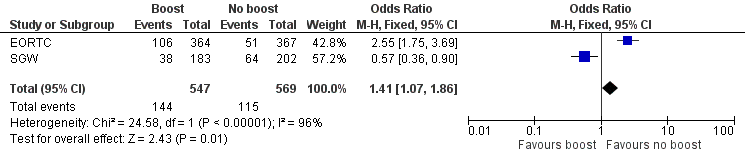
Panel‐scored cosmesis appeared to be better without the administration of a boost to the tumour bed with data from 229 women with fair or poor scoring in two studies involving 1116 women (OR 1.41, 95% CI 1.07 to 1.86; P = 0.01; low‐quality evidence; Analysis 1.8; Figure 6). There was evidence of heterogeneity on visual inspection and statistical testing (I² = 96%).

Forest plot of comparison: 1 Tumour bed boost radiotherapy versus no boost, outcome: 1.8 Cosmesis, Panel.
Treating physician‐scored cosmesis did not differ significantly between boost and no‐boost groups, however the confidence interval was very wide (OR 1.58, 95% CI 0.93 to 2.69; P = 0.09; 2 studies, 592 women; very low‐quality evidence; Analysis 1.9). There was no evidence of heterogeneity on visual inspection and statistical testing (I² = 0%).
There were no data per subgroup in the Lyon study, so a meta‐analysis was not possible.
Quality of life
There were no data on quality of life.
Treatment costs
There were no data on treatment costs.
Discusión
Resumen de los resultados principales
El control local pareció ser mejor con la sobreimpresión del lecho tumoral que sin la sobreimpresión del lecho tumoral. No se encontró evidencia de una diferencia en la supervivencia general ni en la supervivencia libre de enfermedad con o sin la sobreimpresión del lecho tumoral. La evaluación del porcentaje de retracción de la mama no pareció afectarse con la sobreimpresión del lecho tumoral. La apariencia estética calificada por un panel fue significativamente mejor (es decir, buena o excelente) si no se administró la sobreimpresión del lecho tumoral. La apariencia estética calificada por el médico no difirió significativamente entre los grupos.
No se encontraron datos de los efectos de la sobreimpresión del lecho tumoral sobre la toxicidad aguda, la calidad de vida ni los costos del tratamiento.
Sobre la base de estos resultados, la sobreimpresión del lecho tumoral parece asociarse con un mejor control local. La recidiva local se redujo en 25 por 1000 pacientes (rango: 17 a 41 por 1000) a los cinco años.
Compleción y aplicabilidad general de las pruebas
En general, la validez de los resultados fue alta debido al elevado número de mujeres analizadas y a la estrategia de búsqueda exhaustiva. Sin embargo, hubo algunas limitaciones en la completitud y la aplicabilidad de la evidencia debido a la heterogeneidad clínica entre los estudios, la duración del seguimiento y la poca o ninguna información útil disponible sobre algunas medidas de resultado.
Heterogeneidad clínica entre los ensayos
Hubo heterogeneidad clínica evidente en las participantes de los estudios y en las intervenciones, como se observa a continuación.
-
La dosis de radioterapia varió entre los ensayos. La dosis de sobreimpresión del lecho tumoral fue inferior en SGW (78,6 Gy) y Nice (79,9 Gy) en comparación con los otros tres estudios (86,4 Gy a 87,8 Gy). Se realizó un análisis de sensibilidad para el control local que excluyó estos dos estudios.
-
La técnica de sobreimpresión difirió, pero no hubo evidencia de una diferencia en el control local relacionada con la técnica de sobreimpresión (Verhoeven 2015).
-
Las técnicas utilizadas para definir el volumen objetivo difirieron. En EORTC, se recomendó la colocación de un clip en el área de la sobreimpresión y se tomó un margen de 1,5 cm a 3 cm como el volumen clínico objetivo. En Budapest, las paredes de la cavidad de escisión se marcaron con cuatro a seis clips de titanio y se utilizó un margen de 1 a 1,5 centímetros para definir el volumen clínico objetivo. No se proporcionó información sobre el delineado de los volúmenes objetivo en Lyon, Nice ni SGW. La falta de una definición para el delineado objetivo y la omisión de una garantía de calidad consistente hicieron que en algunos de los estudios la radioterapia no fuera reproducible. Por lo tanto, no hay seguridad con respecto a la dosis aplicada ni al volumen irradiado.
-
En SGW, 59 de 688 pacientes presentaban un carcinoma in situ. Los otros cuatro estudios incluyeron solamente a pacientes con un carcinoma invasivo de la mama.
-
EORTC incluyó a la población de pacientes más grande y contribuyó con más del 79% del peso en el metanálisis del control local, la supervivencia general y la supervivencia libre de enfermedad.
Duración del seguimiento
La mediana de la duración del seguimiento varió entre los cinco estudios: 60 meses en Budapest, 17,2 años en EORTC, 73 meses en Nice, 3,3 años en Lyon y seis años en SGW. Un metanálisis del Early Breast Cancer Trialists’ Collaborative Group confirmó la relación entre el control tumoral y la supervivencia general. Al agregar la radioterapia a la cirugía conservadora de mama, la tasa de la primera recidiva a los diez años disminuyó del 35,0% al 19,3% y las ganancias en la supervivencia del cáncer de mama fueron del 3,8% a los 15 años. En otras palabras, la prevención de cuatro recidivas a los diez años evita una muerte debido a cáncer de mama a los 15 años (Darby 2011). Debido a que cuatro de los cinco estudios incluidos en esta revisión informaron una mediana del seguimiento menor de siete años, el efecto sobre la supervivencia todavía podría ser evidente con un seguimiento más prolongado en el futuro.
Hubo poca o ninguna información útil disponible para algunas medidas de resultado
El estudio Budapest señala que las tasas de recidiva se compararon en las pacientes menores de 40 años de edad, pero no se proporcionó el valor de p. En el estudio EORTC, la apariencia estética se midió mediante el programa informático BCCT.core; sin embargo, no se proporcionaron puntuaciones estéticas generales, de manera que fue imposible una comparación o metanálisis con otros estudios. SGW informó datos de calidad de vida de todo el grupo de pacientes analizadas y no proporcionó un análisis de subgrupos del grupo de sobreimpresión versus el grupo ninguna sobreimpresión.
Hubo heterogeneidad en el resultado de control local. Se realizó un análisis de sensibilidad con la exclusión de Nice y SGW porque se consideraron con alto riesgo de sesgo por informe selectivo o cegamiento de la evaluación de resultado, o ambos. Esta evaluación se realizó porque la dosis al lecho tumoral fue significativamente inferior en comparación con los otros ensayos y porque los carcinomas in situ se incluyeron en el grupo de datos (SGW). En el metanálisis para pBRA y para la apariencia estética calificada por un panel hubo heterogeneidad que se atribuyó a una menor dosis de sobreimpresión al lecho tumoral en SGW; sin embargo, no hubo signos de heterogeneidad en la apariencia estética calificada por el médico. Como en los metanálisis solamente se incluyeron dos estudios, no fue posible realizar un análisis de sensibilidad.
Época del tratamiento
Los cinco estudios reclutaron a las pacientes hace dos décadas y los enfoques terapéuticos han cambiado con el transcurso del tiempo. En los estudios incluidos fue escaso el uso del tratamiento sistémico, especialmente la terapia hormonal. Además, las tasas generales de recidiva han disminuido con el transcurso del tiempo. Este efecto de la época del tratamiento no solamente se basa en el aumento del uso del tratamiento sistémico, sino también en las mejorías en la imagenología preoperatoria de la mama y el delineado posoperatorio de la cavidad de la tumorectomía, y en una mayor atención a la obtención de márgenes quirúrgicos negativos (Canavan 2014; van Laar 2013). Los números absolutos y los efectos de la sobreimpresión del lecho tumoral podrían, por lo tanto, ser inferiores en la población actual.
Calidad de la evidencia
La evidencia disponible permite establecer conclusiones con respecto al objetivo de la revisión: evaluar los efectos de la sobreimpresión del lecho tumoral después de la cirugía conservadora de mama y la irradiación completa de la mama para el tratamiento del cáncer de mama. Se encontraron cinco estudios con 8325 mujeres.
Recidiva local
La calidad de la evidencia se disminuyó por el riesgo de sesgo, ya que hubo un alto riesgo de sesgo de informe selectivo en dos estudios. Con respecto a la inconsistencia (I² = 60%) hubo heterogeneidad clínica considerable con respecto a la dosis de radioterapia y al uso de procedimientos de garantía de la calidad, por lo que se disminuyó la calidad de la evidencia. No se disminuyó por indireccionalidad ni imprecisión. Dada a la búsqueda sistemática de la bibliografía, no se disminuyó por sesgo de publicación. La calidad general de la evidencia según GRADE para este resultado fue baja.
El análisis de sensibilidad para la recidiva local excluyó dos estudios. La calidad de la evidencia no se disminuyó por riesgo de sesgo, indireccionalidad, inconsistencia, imprecisión ni sesgo de publicación. La calidad general de la evidencia según GRADE para este resultado fue alta.
La calidad de la evidencia no se disminuyó en el análisis de subgrupos de la recidiva local en las pacientes de al menos 40 años de edad sobre la base del riesgo de sesgo, la indireccionalidad, la inconsistencia, la imprecisión, ni el sesgo de publicación. La calidad general de la evidencia según GRADE para este resultado fue alta.
Supervivencia general
La calidad de la evidencia no se disminuyó por riesgo de sesgo, inconsistencia, indireccionalidad ni sesgo de publicación. Se disminuyó por imprecisión porque uno de los dos estudios incluidos tuvo un intervalo de confianza muy amplio. La calidad general de la evidencia según GRADE para este resultado fue moderada.
Supervivencia libre de enfermedad
Solamente dos de los cinco estudios informaron la supervivencia libre de enfermedad a los cinco años. La calidad de la evidencia no se disminuyó por riesgo de sesgo, indireccionalidad ni sesgo de publicación. Se disminuyó por inconsistencia debido a heterogeneidad estadística. La calidad de la evidencia se disminuyó por imprecisión debido a que ambos estudios incluidos tuvieron un intervalo de confianza muy amplio. La calidad general de la evidencia según GRADE para este resultado fue baja.
pBRA
La calidad de la evidencia se disminuyó por el riesgo de sesgo, porque hubo un alto riesgo de sesgo de informe selectivo en un estudio. Con respecto a la inconsistencia (I² = 75%) hubo heterogeneidad clínica considerable con respecto a la dosis de radioterapia y al uso de procedimientos de garantía de la calidad, por lo que se disminuyó la calidad de la evidencia. La calidad de la evidencia se disminuyó por imprecisión debido a que ambos estudios incluidos tuvieron un intervalo de confianza muy amplio. La calidad general de la evidencia según GRADE para este resultado fue muy baja.
Apariencia estética calificada por un panel
La calidad de la evidencia se disminuyó por el riesgo de sesgo, porque hubo un alto riesgo de sesgo de informe selectivo en un estudio. Con respecto a la inconsistencia (I² = 96%) hubo heterogeneidad clínica considerable con respecto a la dosis de radioterapia y al uso de procedimientos de garantía de la calidad, por lo que se disminuyó la calidad de la evidencia. La calidad de la evidencia no se disminuyó por indireccionalidad, imprecisión ni sesgo de publicación. La calidad general de la evidencia según GRADE para este resultado fue baja.
Apariencia estética calificada por el médico
La calidad de la evidencia se disminuyó dos puntos por el riesgo de sesgo porque hubo un alto riesgo de sesgo de informe selectivo en un estudio y un alto riesgo de sesgo de cegamiento de la evaluación de resultado en el otro estudio. La calidad de la evidencia se disminuyó por imprecisión debido a que ambos estudios incluidos tuvieron un intervalo de confianza muy amplio. No se disminuyó por indireccionalidad, inconsistencia ni sesgo de publicación. La calidad general de la evidencia según GRADE para este resultado fue muy baja.
Sesgos potenciales en el proceso de revisión
Se considera que se identificaron todos los ensayos controlados aleatorios finalizados relevantes. El seguimiento fue relativamente corto para el análisis de la supervivencia en todos los estudios excepto uno. Lo anterior puede mejorar en las actualizaciones futuras, cuando se proporcione más información con respecto a estos resultados.
Acuerdos y desacuerdos con otros estudios o revisiones
Se encontró una revisión sistemática con un metanálisis que analizó la función de la sobreimpresión en el tratamiento conservador del cáncer de mama estadio I‐II (Polgár 2001). Los autores informaron tasas brutas de recidiva local del 6,7% versus el 3,9% cuando se agregaba la sobreimpresión del lecho tumoral (P < 0,0001). Se analizaron cinco estudios. Además de los ensayos Budapest, EORTC, Lyon y Nice, Polgár 2001 informó datos de la presentación de un resumen realizada por Nagykálnai en el 2o Congreso Europeo de Mastología en 1994, pero hasta donde se sabe estos datos ya no están disponibles y aparentemente el número de participantes fue escaso y no se realizó un análisis estadístico. Polgár 2001 no incluyó el ensayo SGW en la revisión. Como en el metanálisis de la presente revisión, la revisión de Polgár justifica la administración de la sobreimpresión del lecho tumoral después de la irradiación completa de la mama. La revisión de Polgár también concluye que la edad temprana (< 50 años), los márgenes quirúrgicos positivos o estrechos y el componente intraductal extenso se deben ver como indicaciones absolutas para la sobreimpresión. Una revisión realizada por Bahadur informa que el efecto significativo sobre el control local se aplica a todos los grupos etarios, pero que los resultados estéticos resultaron peores con la sobreimpresión del lecho tumoral, lo que se debe tener en cuenta (Bahadur 2012). Las guías de la European Society for Medical Oncology informan una reducción del 50% en el riesgo de cualquier recidiva con sobreimpresión, y la indican en las pacientes con factores de riesgo no favorables para el control local como una edad menor de 50 años, tumores grado 3, carcinoma ductal extenso in situ, invasión vascular, o escisión tumoral no radical (focalmente, de lo contrario, se debe recomendar cirugía adicional) (Senkus 2015). Las guías de la NCCN recomiendan considerar la sobreimpresión del lecho tumoral en caso de alto riesgo de recidiva (como edad menor de 50 años, enfermedad de grado alto o márgenes focalmente positivos) (NCCN).

Illustration of the breast retraction assessment (BRA) measurements as reported by EORTC. BRA = √((a1 ‐ b1)² + (a2 ‐ b2)²); reference length = √(b1² + b2²); percentage breast retraction assessment = (BRA/reference length) x 100.
Study flow diagram.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.

Forest plot of comparison: 1 Tumour bed boost radiotherapy versus no boost, outcome: 1.1 Local control.
Forest plot of comparison: 1 Tumour bed boost radiotherapy versus no boost, outcome: 1.5 Overall survival.
Forest plot of comparison: 1 Tumour bed boost radiotherapy versus no boost, outcome: 1.8 Cosmesis, Panel.
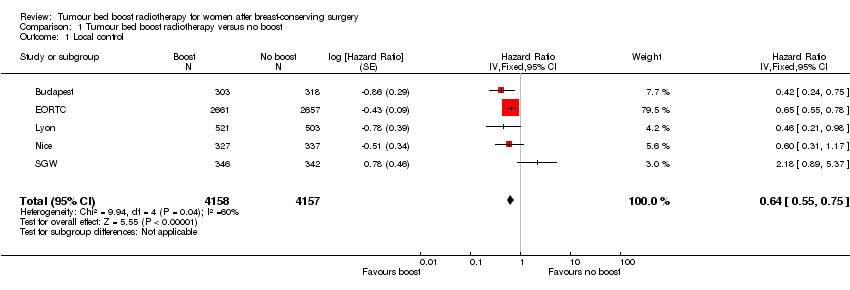
Comparison 1 Tumour bed boost radiotherapy versus no boost, Outcome 1 Local control.
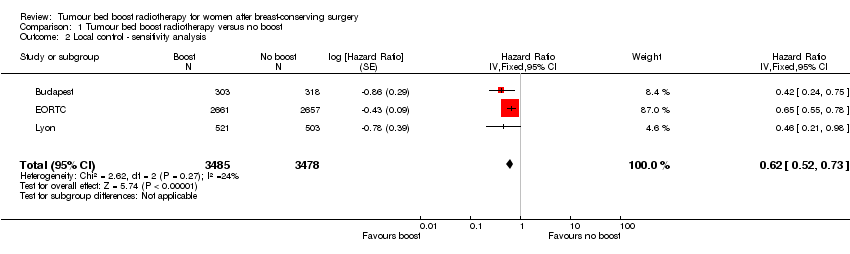
Comparison 1 Tumour bed boost radiotherapy versus no boost, Outcome 2 Local control ‐ sensitivity analysis.

Comparison 1 Tumour bed boost radiotherapy versus no boost, Outcome 3 Local control ‐ subgroup +40 years.

Comparison 1 Tumour bed boost radiotherapy versus no boost, Outcome 4 Local control ‐ subgroup low boost dose.
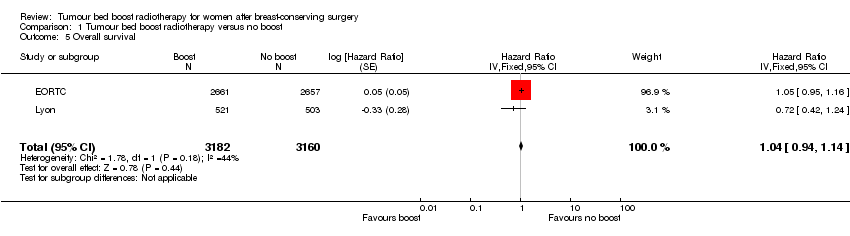
Comparison 1 Tumour bed boost radiotherapy versus no boost, Outcome 5 Overall survival.
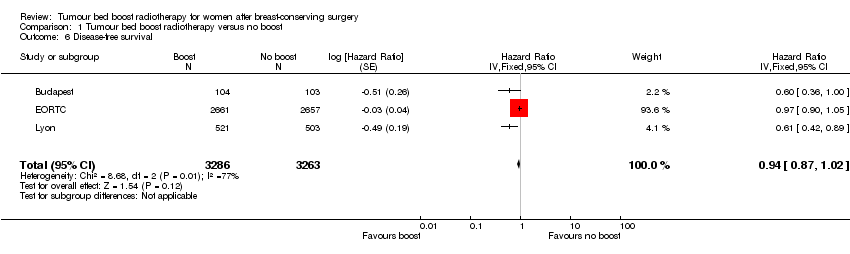
Comparison 1 Tumour bed boost radiotherapy versus no boost, Outcome 6 Disease‐free survival.

Comparison 1 Tumour bed boost radiotherapy versus no boost, Outcome 7 Late toxicity, pBRA.

Comparison 1 Tumour bed boost radiotherapy versus no boost, Outcome 8 Cosmesis, Panel.

Comparison 1 Tumour bed boost radiotherapy versus no boost, Outcome 9 Cosmesis, Physician.
| Boost compared to no boost in breast cancer radiotherapy | ||||||
| Patient or population: breast‐conserving radiotherapy for breast cancer | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk without boost | Risk with boost | |||||
| Local control: recurrence at 5 years | Study population | HR 0.64 | 8315 | ⊕⊕⊝⊝ | Nice did not report 5‐year local control. | |
| 70 per 1000 | 45 per 1000 | |||||
| Overall survival: mortality at 5 years | Study population | HR 1.04 | 6342 | ⊕⊕⊕⊝ | ||
| 91 per 1000 | 94 per 1000 | |||||
| Disease‐free survival: disease progression/mortality at 5 years | Study population | HR 0.94 | 6549 | ⊕⊕⊝⊝ | EORTC did not report 5‐year disease‐free survival. | |
| 221 per 1000 | 209 per 1000 | |||||
| Late toxicity, pBRA | Mean pBRA 8.17, range 7.55 to 10 | Mean pBRA 8.55, | MD 0.38 higher (0.18 lower to 0.93 higher) | 1526 | ⊕⊝⊝⊝ | |
| Cosmesis, panel scored: fair or poor | Study population | OR 1.41 | 1116 | ⊕⊕⊝⊝ | ||
| 202 per 1000 | 263 per 1000 | |||||
| Cosmesis, physician‐scored: fair or poor | Study population | OR 1.58 | 592 | ⊕⊝⊝⊝ | ||
| 85 per 1000 | 128 per 1000 | |||||
| Sensitivity analysis: local control ‐ recurrence at 5 years | Study population | HR 0.62 | 6963 | ⊕⊕⊕⊕ | ||
| 74 per 1000 | 47 per 1000 | |||||
| Subgroup analysis: local control ‐ > 40 years old, recurrence at 5 years | Study population | HR 0.65 | 5058 | ⊕⊕⊕⊕ | ||
| 59 per 1000 | 39 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1High risk of selective reporting in one study. | ||||||
| Organ tissue | 0 | Grade 1 | Grade 2 | Grade 3 | Grade 4 |
| Skin | None | Slight atrophy; pigmentation change; some hair loss | Patchy atrophy; moderate telangiectasia; total hair loss | Marked atrophy; gross telangiectasia | Ulceration |
| Subcutaneous tissue | None | Slight induration (fibrosis) and loss of subcutaneous fat | Moderate fibrosis but asymptomatic; slight field contracture; < 10% linear reduction | Severe induration and loss of subcutaneous tissue; field contracture > 10% linear measurement | Necrosis |
| RTOG/EORTC: Radiation Therapy Oncology Group/European Organisation for Research and Treatment of Cancer | |||||
| Cosmetic score |
| Excellent |
| Good |
| Fair |
| Poor |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Local control Show forest plot | 5 | 8315 | Hazard Ratio (Fixed, 95% CI) | 0.64 [0.55, 0.75] |
| 2 Local control ‐ sensitivity analysis Show forest plot | 3 | 6963 | Hazard Ratio (Fixed, 95% CI) | 0.62 [0.52, 0.73] |
| 3 Local control ‐ subgroup +40 years Show forest plot | 2 | 5058 | Hazard Ratio (Fixed, 95% CI) | 0.65 [0.53, 0.81] |
| 4 Local control ‐ subgroup low boost dose Show forest plot | 2 | 1352 | Hazard Ratio (Fixed, 95% CI) | 0.95 [0.55, 1.62] |
| 5 Overall survival Show forest plot | 2 | 6342 | Hazard Ratio (Fixed, 95% CI) | 1.04 [0.94, 1.14] |
| 6 Disease‐free survival Show forest plot | 3 | 6549 | Hazard Ratio (Fixed, 95% CI) | 0.94 [0.87, 1.02] |
| 7 Late toxicity, pBRA Show forest plot | 2 | 1526 | Mean Difference (IV, Fixed, 95% CI) | 0.38 [‐0.18, 0.93] |
| 8 Cosmesis, Panel Show forest plot | 2 | 1116 | Odds Ratio (M‐H, Fixed, 95% CI) | 1.41 [1.07, 1.86] |
| 9 Cosmesis, Physician Show forest plot | 2 | 592 | Odds Ratio (M‐H, Fixed, 95% CI) | 1.58 [0.93, 2.69] |

