Intervenciones quirúrgicas para la prevención o el tratamiento del linfedema después del tratamiento del cáncer de mama
Resumen
Antecedentes
El cáncer de mama es el tipo más frecuente de cáncer entre las mujeres en todo el mundo, y el linfedema de la mama y del miembro superior es una complicación angustiante del tratamiento del cáncer de mama. Hay incertidumbre con respecto a la efectividad de las intervenciones quirúrgicas en la prevención y en el tratamiento del linfedema que afecta al brazo después del tratamiento del cáncer de mama.
Objetivos
1. Evaluar y comparar la eficacia de las intervenciones quirúrgicas para la prevención del linfedema (LE) del brazo después del tratamiento del cáncer de mama.
2. Evaluar y comparar la eficacia de las intervenciones quirúrgicas para el tratamiento del LE establecido en el brazo después del tratamiento del cáncer de mama.
Métodos de búsqueda
Se hicieron búsquedas de todos los ensayos registrados prospectivamente y en curso en el registro especializado del Grupo Cochrane de Cáncer de Mama (Cochrane Breast Cancer Group’s Specialised Register), Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials), MEDLINE, Embase, en el Cumulative Index to Nursing and Allied Health Literature (CINAHL), en la WHO International Clinical Trials Registry Platform (ICTRP) y en ClinicalTrials.gov el 2 de noviembre 2017. Tres autores de la revisión también realizaron búsquedas manuales en las listas de referencias de los estudios incluidos para buscar ensayos elegibles adicionales.
Criterios de selección
Se incluyeron todos los ensayos controlados aleatorios (ECA) que compararon una intervención quirúrgica para la prevención o el tratamiento del linfedema del brazo después del tratamiento del cáncer de mama con una intervención estándar, una intervención placebo u otra intervención quirúrgica. Se consideraron los pacientes de ambos sexos y de todas las edades que habían recibido tratamiento por cáncer de mama. No se aplicaron límites en cuanto al idioma o localización de los estudios. Tres autores de la revisión determinaron de forma independiente la elegibilidad de cada estudio.
Obtención y análisis de los datos
Tres autores de manera independiente extrajeron los datos de cada estudio incluido con el uso de un proformulario prediseñado de extracción de datos y utilizaron la herramienta Cochrane de "riesgo de sesgo" para evaluar el riesgo de sesgo. Las variables dicotómicas se analizaron mediante el método de Mantel‐Haenszel para calcular los cocientes de riesgos (CR). Las diferencias en las variables continuas se expresaron como diferencias de medias (DM). Se utilizó GRADE para evaluar la certeza de la evidencia proporcionada por los estudios incluidos.
Resultados principales
Dos estudios con 95 participantes examinaron las intervenciones quirúrgicas para prevenir el linfedema relacionado con el cáncer de mama. Ambos estudios evaluaron la eficacia de la técnica de anastomosis linfático venular como parte de un protocolo de tratamiento preventivo. Se consideró que ambos estudios tuvieron en general riesgo incierto de sesgo. La variación estadística entre los estudios fue baja, lo que aumenta la fiabilidad de la evidencia. Sin embargo, los dos estudios se realizaron en el mismo centro. La anastomosis linfático venular parece dar lugar a una reducción en la incidencia de linfedema en comparación con el tratamiento no quirúrgico, con un cociente de riesgos de 0,20 (IC de 95%: 0,06 a 0,63, P = 0,006; 95 participantes; evidencia de baja certeza). Los ECA no evaluaron los resultados secundarios.
Un estudio con 36 participantes evaluó la efectividad de la transferencia de ganglios linfáticos vascularizados para el tratamiento del linfedema relacionado con el cáncer de mama. El ensayo se consideró con riesgo incierto de sesgo. En los participantes con linfedema estadio 2, la evidencia indicó reducciones en el volumen del miembro (DM ‐39,00%; IC de 95%: ‐47,37% a ‐30,63%, evidencia de muy baja certeza), las puntuaciones de dolor (DM ‐4,16; IC de 95%: ‐5,17 a ‐3,15, evidencia de muy baja certeza), la sensación de pesadez (DM ‐4,27; IC de 95%: ‐5,74 a ‐2,80, evidencia de muy baja certeza) y el número medio de infecciones/año (DM ‐1,22; IC de 95%: ‐2,00 a ‐0,44, evidencia de muy baja certeza), así como una mejoría en las puntuaciones generales de funcionalidad (DM ‐3,77; IC de 95%: ‐4,89 a ‐2,65, evidencia de muy baja certeza) en los pacientes sometidos a transferencia de ganglios linfáticos vascularizados, en comparación con los que recibieron ningún tratamiento.
Conclusiones de los autores
Hay evidencia de baja certeza de que la anastomosis linfático venular es efectiva para prevenir el desarrollo del linfedema después del tratamiento del cáncer de mama sobre la base de los resultados de dos estudios. Un estudio que aportó evidencia de muy baja certeza encontró que la transferencia de ganglios linfáticos vascularizados es una opción efectiva en el tratamiento del linfedema establecido estadio 2 relacionado con el cáncer de mama. Los resultados secundarios importantes en esta revisión se informaron en pocas ocasiones en los estudios incluidos. Se necesitan más ECA de alta calidad para dilucidar de manera adicional la efectividad de las intervenciones quirúrgicas en la prevención y el tratamiento del linfedema después del tratamiento del cáncer de mama. En el momento de esta revisión no se identificaron ensayos en curso sobre este tema.
PICO
Resumen en términos sencillos
Técnicas quirúrgicas para la prevención y el tratamiento del edema del brazo debido al linfedema después del tratamiento del cáncer de mama
¿Cuál es el problema?
Muchas mujeres en el mundo están afectadas por el cáncer de mama. La radioterapia y la cirugía utilizadas para los tratamientos del cáncer de mama tienen como objetivo la mama, el tórax y la axila del lado afectado y podrían dañar el sistema linfático local de esas regiones. Este daño provoca un drenaje deficiente del líquido del brazo afectado, que podría dar lugar a una sensación de pesadez y a edema visible. El término utilizado para describir esta afección es linfedema. El linfedema es bien reconocido por los pacientes y los profesionales sanitarios. Es incómodo y podría interferir con muchos aspectos de la vida cotidiana. Además, algunos pacientes consideran que el edema unilateral del brazo es antiestético. El edema a largo plazo también podría degradar la calidad de la piel y dar lugar a infecciones cutáneas recurrentes. Las medidas tradicionales para controlar esta molesta afección incluyen ejercicios del brazo, masaje y medias de compresión. Aunque estas medidas son efectivas para reducir el edema del brazo, requieren tiempo, paciencia y dedicación diaria y pueden tener un costo para el paciente. Estas medidas tradicionales se deben mantener de forma permanente durante toda la vida para que sean efectivas.
Pregunta de estudio
Los profesionales sanitarios han examinado maneras alternativas de controlar el linfedema después del tratamiento del cáncer de mama. Este informe examina la efectividad de las técnicas quirúrgicas que se han desarrollado para prevenir o tratar esta afección.
Resultados de los estudios
Se han propuesto varias técnicas, pero solo tres estudios publicados hasta noviembre de 2017 cumplieron los criterios de inclusión para esta revisión. Dos estudios consideraron la prevención del linfedema y un estudio consideró el tratamiento del linfedema. En total, en estos tres estudios participaron 131 pacientes.
Dos estudios se centraron en la técnica quirúrgica de la anastomosis linfático venular (un procedimiento preventivo), que deriva los vasos linfáticos a los vasos sanguíneos y utiliza el sistema circulatorio para drenar el líquido excesivo del brazo. Estos estudios indicaron que los pacientes sometidos a este procedimiento quirúrgico tuvieron una reducción del riesgo de desarrollar linfedema (desarrollo de 255 casos menos de linfedema por 1000 pacientes, donde el verdadero valor puede estar en alguna parte entre 118 casos menos y 300 casos menos de desarrollo de linfedema por 1000 pacientes), en comparación con los que no se sometieron al procedimiento. Estos dos estudios no proporcionaron datos de resultados secundarios importantes como los resultados informados por los pacientes, la capacidad de interrumpir las intervenciones adicionales para el linfedema, las complicaciones quirúrgicas o las complicaciones a largo plazo.
Un estudio evaluó una técnica de transferencia de ganglios linfáticos vascularizados que transfiere una parte de tejido que contiene ganglios linfáticos de la ingle o el abdomen a la axila del miembro afectado por el linfedema. Los autores observaron que los pacientes sometidos a este procedimiento presentaron un reducción del:
‐ volumen del miembro: como promedio, los pacientes sometidos al procedimiento tuvieron una reducción del 39% del volumen del miembro en comparación con los que recibieron atención estándar sola;
‐ dolor: como promedio, los pacientes sometidos al procedimiento tuvieron una calificación de 4,16 puntos menos en una escala de 10 puntos (es decir 1 = ningún dolor, 10 = dolor extremo) en comparación con los que recibieron atención estándar sola;
‐ sensación de pesadez: como promedio, los pacientes sometidos al procedimiento tuvieron una calificación de 4,27 puntos menos en una escala de sensación de pesadez de 10 puntos (es decir 1 = ninguna sensación de pesadez, 10 = sensación extrema de pesadez) en comparación con los que recibieron atención estándar sola; e
‐ infección: como promedio, los pacientes sometidos al procedimiento tuvieron 1,22 menos infecciones por año en comparación con los que recibieron atención estándar sola.
La técnica de transferencia de ganglios linfáticos vascularizados también proporcionó una ganancia en la mejoría funcional que significa que, como promedio, los pacientes sometidos al procedimiento tuvieron una calificación 3,77 puntos mejor en la puntuación general de funcionalidad (funcionalidad medida en una escala de 10 puntos donde 1 = funcionalidad excelente, 10 = funcionalidad muy deficiente) en comparación con los que recibieron atención estándar sola. El estudio no proporcionó datos de algunos resultados secundarios importantes como la capacidad de interrumpir las intervenciones adicionales para el linfedema o las complicaciones a largo plazo.
Certeza de la evidencia
La certeza de la evidencia que apoyó el uso de la anastomosis linfática venular en la prevención del linfedema fue baja, y consistió en solo dos estudios pequeños de un centro. De manera similar, solo un estudio de centro único evaluó el uso de la transferencia de ganglios linfáticos vascularizados y proporcionó evidencia general de muy baja certeza que apoyó el uso del procedimiento en el tratamiento del linfedema del miembro superior.
Conclusiones de los autores
Summary of findings
| Lymphaticovenular anastomosis compared to standard care for prevention of lymphoedema development | ||||||
| Patient or population: prevention of lymphoedema development | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with standard care | Risk with lymphaticovenular anastomosis | |||||
| Development of LE | Study population | RR 0.20 | 95 | ⊕⊕⊝⊝ | ||
| 319 per 1,000 | 64 per 1,000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 The surgical intervention groups were small: In Boccardo 2009 the preventive protocol was followed for 25 women of which seven underwent LVA primarily and the number undergoing LVA at a later stage was not reported. In Boccardo 2011, all 23 participants in the intervention group had LVA done at the time of axillary clearance. 2 In Boccardo 2009, the control group received physical therapy and compression garments only after lymphoedema was detected whereas the intervention group received these as a preventive measure already before any lymphoedema was detected. Therefore, the difference detected between the two groups cannot be attributed solely to the LVA done. In Boccardo 2011, neither of the groups received any compression treatments which means that the effect of the intervention was not compared with the standard treatment but no treatment at all. 3 The study group allocation was not concealed and the assessment was not blinded in either of the included studies. Therefore, we downgraded the certainty of the evidence by 1 point for risk of bias 4 Due to the small number of participants in each trial and wide confidence intervals, we downgraded the certainty of evidence by 1 point for imprecision. | ||||||
| Vascularised lymph node transfer compared to standard care for treatment of arm lymphoedema | ||||
| Patient or population: treatment of arm lymphoedema | ||||
| Outcomes | Relative effects* (95% CI) | № of participants | Certainty of the evidence | Comments |
| Vascularised lymph node transfer vs standard care | ||||
| Reduction of LE (%) | MD 39 lower | 36 | ⊕⊝⊝⊝ | |
| Number of infections per year | MD 1.22 lower | 36 | ⊕⊝⊝⊝ | |
| Pain score (1‐10; where 1 = no pain; 10 = extreme pain) | MD 4.16 lower | 36 | ⊕⊝⊝⊝ | |
| Heaviness score (1‐10; where 1 = no heaviness; 10 = extreme heaviness) | MD 4.27 lower | 36 | ⊕⊝⊝⊝ | |
| Function score (1‐10; where 1 = good function; 10 = poor function) | MD 3.77 lower | 36 | ⊕⊝⊝⊝ | |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||
| GRADE Working Group grades of evidence | ||||
| 1 The control group in Dionyssiu 2016 study received no physical or compression treatments for the 12 months prior to the final assessment and thus did not receive the current golden standard of nonoperative lymphoedema treatment. Therefore we downgraded the evidence by 1 point for indirectness | ||||
Antecedentes
Descripción de la afección
El cáncer de mama es el tipo de cáncer más frecuente en la mujer a nivel mundial (Globocan 2012). Los adelantos en el tratamiento del cáncer de mama significan que más pacientes sobreviven y viven con las consecuencias del cáncer y su tratamiento. Una secuela frecuente y angustiante del tratamiento del cáncer de mama es el linfedema (LE) (Hayes 2008). El LE describe una afección en la que se acumula un exceso de líquido en el tejido subcutáneo de los brazos, por lo general debido a la deficiencia en la salida del líquido linfático de un área afectada. La linfa o líquido linfático contiene líquido tisular circulante y leucocitos que combaten las infecciones. La etiología del desequilibrio entre la producción y el drenaje puede ser congénita o adquirida, y se denomina LE primario o secundario, respectivamente (Rockson 2008). El LE secundario es más frecuente y tiene una variedad de causas, incluida la infección, el cáncer, la radioterapia y la cirugía. En todo el mundo, la causa más común de LE es la filariasis, causada por la infección con el parásito Wuchereria bancrofti, mientras que en el mundo desarrollado la causa más común es la neoplasia maligna y su tratamiento (Doscher 2012). Como el cáncer de mama es muy frecuente, su tratamiento es una causa principal de LE secundario.
El LE puede ocurrir después del tratamiento del cáncer de mama debido al daño o la destrucción del sistema de drenaje linfático del miembro superior por la cirugía o la radioterapia, o ambas, o debido a los efectos destructivos del cáncer en sí (Brennan 1996). Las estimaciones de la incidencia del LE después del tratamiento del cáncer de mama varían mucho según el tipo de tratamiento recibido y los criterios diagnósticos del LE. A los cinco años de la cirugía, el 5% de los pacientes sometidos a biopsia del nódulo centinela, una cirugía en la que se extraen para el análisis solo algunos ganglios linfáticos, desarrolla LE cuantificable en comparación con el 16% de los pacientes que han sido sometidos a disección axilar y, por lo tanto, a extracción de todos los ganglios linfáticos del área (McLaughlin 2008). La obstrucción al drenaje linfático y la acumulación de la linfa en los tejidos provoca edema, engrosamiento de la piel y la capa grasa del tejido bajo la piel, fibrosis o cicatrización y, con el tiempo, elefantiasis con aumento crónico del volumen del miembro (Doscher 2012). El sistema de estadiaje de la International Society of Lymphology es el sistema más aceptado en todo el mundo para la evaluación del grado del LE (ISL 2009). En la enfermedad en estadio 0, el LE es subclínico, sin edema a pesar de la evidencia de deterioro del transporte linfático; en el estadio 1, el edema de la enfermedad es evidente, pero se reduce con la elevación del miembro; en el estadio 2, el edema es persistente y la fibrosis de los tejidos subcutáneos se hace evidente; y en el estadio 3, hay engrosamiento de la piel con depósitos grasos y verrugas linfostáticas, a lo que se le denomina elefantiasis (ISL 2009).
Los pacientes con LE pueden presentar morbilidad significativa relacionada con la afección que incluye pérdida de la funcionalidad del miembro, malestar y desfiguración (Brennan 1996). El LE también se puede complicar por infecciones de los tejidos blandos y los vasos linfáticos afectados (celulitis y linfangitis) (Shih 2009). Aunque no es una afección potencialmente mortal, el LE puede causar gran angustia a los sobrevivientes de cáncer de mama debido a los efectos físicos ya descritos y a sus consecuencias psicológicas (Bulley 2013). Puede actuar como un recordatorio constante de la enfermedad anterior y atraer la atención no deseada de otros (Petrek 1998). Hasta hace poco se habían subestimado los efectos que el LE puede tener en la calidad de vida del paciente. En la actualidad se aborda mediante el desarrollo de herramientas de evaluación de la calidad de vida específicas de la afección (Keeley 2010).
La medición de la circunferencia del miembro es el método utilizado con más frecuencia para evaluar el LE, ya que es sencilla y tiene una amplia disponibilidad (Yamamoto 2013). También se utilizan otras pruebas que incluyen el mapeo de los ganglios linfáticos centinelas con trazador radiactivo en la linfocentellografía o con material radiocontrastante en la linfografía, el verde de indocianina (ICG) y la evaluación del volumen mediante tomografía computarizada (TC), imagenología de resonancia magnética (IRM), la medición del desplazamiento de agua y la exploración con láser (Bulley 2013; Yamamoto 2013). Se considera muy importante diagnosticar el LE lo antes posible en la historia natural descrita anteriormente. El diagnóstico permite la intervención temprana, que incluye la provisión de información y apoyo psicológico, y puede prevenir la formación de un LE sintomático y la progresión a enfermedad grave (Yamamoto 2011). La evaluación objetiva del LE existente es importante para evaluar su grado, así como las intervenciones para reducirlo.
Descripción de la intervención
En los pacientes con cáncer de mama se utilizan diversas estrategias conservadoras para reducir el riesgo de desarrollar un LE (Stuiver 2012) y para su tratamiento, una vez que se aparece (Preston 2008). Incluyen el ejercicio, la educación del paciente, la monitorización, la terapia de compresión, el drenaje linfático manual y el vendaje linfático ("kinesiotaping"). No hay consenso en cuanto al tratamiento conservador óptimo.
Tradicionalmente la cirugía es la última opción cuando han fracasado las medidas conservadoras (Vignes 2002). Las indicaciones para la cirugía incluyen reducción insuficiente del LE con un tratamiento médico y una fisioterapia bien realizados, episodios recurrentes de linfangitis, dolor intratable, disminución de la funcionalidad del miembro, insatisfacción del paciente con los métodos conservadores y deseo del paciente de proceder a la cirugía (Campisi 2010). Sin embargo, los pacientes y los cirujanos acuden cada vez más a intervenciones quirúrgicas modernas al principio del proceso de la enfermedad con la esperanza de prevenir o revertir el edema que surge debido a los cambios que deterioran el flujo linfático (Boccardo 2011).
Estas intervenciones incluyen liposucción, transferencia de ganglios linfáticos y anastomosis linfático venular (ALV) (Becker 2006; Brorson 1997; Campisi 2004; Nagase 2005). Las técnicas intentan reducir directamente el volumen del brazo al retirar el tejido graso y fibroso (liposucción), derivar la obstrucción de la salida linfática al crear una ruta directa para que el líquido linfático vuelva a entrar a la circulación del brazo (ALV) o mejorar el drenaje linfático del brazo posiblemente mediante la creación de nuevos canales linfáticos (transferencia de ganglios linfáticos).
De qué manera podría funcionar la intervención
El LE crónico causa un aumento del edema del tejido graso subcutáneo, que da lugar a deformidad y edema del miembro. Esta es la justificación detrás de la liposucción para el LE, en la que el tejido adiposo hipertrofiado se retira en forma de circunferencia a través de cánulas insertadas en incisiones pequeñas, por lo general bajo anestesia general (Brorson 2002; Damstra 2009). Luego se necesita el uso de por vida de prendas de compresión para prevenir la recurrencia posoperatoria del linfedema (Brorson 2002; Damstra 2009).
La reconstrucción linfática microquirúrgica es otra intervención quirúrgica para el LE, con mayor frecuencia en la forma de ALV, aunque de manera ocasional se utiliza un canal linfático no afectado para derivar el área del daño linfático, un método conocido como derivación linfático‐linfática (Lee 2011). La ALV consiste en la anastomosis, o conexión, de los vasos linfáticos a una vena pequeña en el tejido subcutáneo. Este procedimiento hace que la linfa regrese a la circulación de forma periférica, lo que significa que ya no tiene que pasar por el área del daño linfático para volver al sistema circulatorio. Se utiliza colorante para encontrar el sistema linfático saludable funcional y para confirmar que la conexión entre los vasos está abierta. La linfocentellografía o la linfografía con ICG se pueden utilizar durante el seguimiento para confirmar la permeabilidad continuada de la anastomosis (Campisi 2010).
Las transferencias de ganglios linfáticos toman ganglios linfáticos sanos de un miembro no afectado y los trasladan a la axila o al codo del brazo afectado (Becker 2006). El objetivo de la técnica es que los ganglios linfáticos trasplantados se hagan cargo del drenaje linfático de los ganglios linfáticos locales que se han dañado o se han extraído mediante la cirugía (Becker 2006). En particular, el mecanismo preciso de acción del trasplante de ganglios linfáticos es complejo y no se comprende completamente.
Por qué es importante realizar esta revisión
El LE como consecuencia del tratamiento del cáncer de mama causa morbilidad física y psicosocial grave en este grupo de pacientes. No hay consenso con respecto a cuál de las opciones quirúrgicas disponibles descritas anteriormente proporciona el mejor resultado en este grupo de pacientes en cuanto a la prevención y el tratamiento de la enfermedad establecida. Se intentó aclarar las indicaciones, los efectos beneficiosos y las incertidumbres en el campo.
Objetivos
-
Evaluar y comparar la eficacia de las intervenciones quirúrgicas para la prevención del linfedema (LE) del brazo después del tratamiento del cáncer de mama.
-
Evaluar y comparar la eficacia de las intervenciones quirúrgicas para el tratamiento del LE establecido en el brazo después del tratamiento del cáncer de mama.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se consideraron todos los tipos de ensayos controlados aleatorios (ECA) que compararon una intervención quirúrgica para el tratamiento o la prevención del LE en el brazo después del tratamiento del cáncer de mama con una intervención estándar (medidas conservadoras como prendas compresivas, masaje linfático, vendas y compresión neumática intermitente), intervención placebo (cirugía realizada sin el paso quirúrgico crítico), u otra intervención quirúrgica que se incluyó en esta revisión (ver tipos de intervención).
Se consideraron aptos todos los estudios que presentaron criterios objetivos predefinidos para diagnosticar o evaluar el LE, o ambos. Estos criterios (Bulley 2013; Yamamoto 2013) incluyeron, entre otros, los siguientes:
-
mediciones del volumen y la distribución tisulares, como el desplazamiento de agua, la cinta métrica y la perometría;
-
determinación de la composición del miembro, como la tonometría, el espesor del pliegue cutáneo, la absorciometría de rayos X de energía dual y el análisis de impedancia bioeléctrica;
-
exámenes de imagenología, como la linfocentellografía, la linfangiografía, la IRM, la ecografía y el examen con TC.
Tipos de participantes
Se incluyeron participantes de ambos sexos y de todas las edades que recibieron tratamiento por cáncer de mama. Este tratamiento incluyó cualquier tipo de cirugía, radioterapia, quimioterapia o una combinación de estos.
Tipos de intervenciones
Se consideró cualquier intervención quirúrgica para el tratamiento o la prevención del LE secundario del brazo después del tratamiento del cáncer de mama. Se consideraron las técnicas de reducción y reconstructivas que incluyen, entre otras, las siguientes:
-
liposucción;
-
anastomosis linfático venular;
-
derivación linfático‐linfática;
-
transferencia de ganglios linfáticos.
Tipos de medida de resultado
Resultados primarios
Todas las medidas de resultado se evaluaron en el último punto temporal informado en el estudio.
Prevención
-
Desarrollo del LE en el último punto temporal especificado en el estudio
Tratamiento
-
Reducción de porcentaje del LE entre la asignación al azar y el final del seguimiento, medida por un sistema validado para la medición del volumen del miembro
Resultados secundarios
Las medidas de resultado secundarias fueron las siguientes:
-
Resultados informados por los pacientes con el uso de cuestionarios validados como la medida de calidad de vida para el linfedema del miembro (LYMQOL, por sus siglas en inglés) específica de la afección, que considera no solo los síntomas físicos, sino también la funcionalidad social y los efectos psicológicos (Keeley 2010). Otros cuestionarios validados similares incluyen el Upper Limb Lymphedema 27 (ULL‐27) (Launois 2002) y la Freiburg Life Quality Assessment‐Lymphedema (FLQA‐L) (Augustin 2005).
-
La capacidad para interrumpir las intervenciones adicionales para el LE; por ejemplo, puede ser la no adherencia o el número de abandonos del uso continuo de la terapia de compresión, la terapia manual o el vendaje linfático.
-
Las complicaciones quirúrgicas relacionadas con la cirugía del LE como el seroma, la linforrea, la dehiscencia de la herida, las infecciones de la herida.
-
Las complicaciones a largo plazo, como la tasa de celulitis, linfangitis, linfadenitis, úlceras de la piel y linforrea.
Métodos de búsqueda para la identificación de los estudios
We did not impose any language or publication date restrictions.
Búsquedas electrónicas
For published trials, we searched the following on 2 November 2017.
-
The Cochrane Breast Cancer Group (CBCG) Specialised Register. Details of the search strategies used by the CBCG for the identification of studies and the procedure used to code references are outlined in the Group's module (www.mrw.interscience.wiley.com/cochrane/clabout/articles/BREASTCA/frame.html). Trials with the key words 'lymphoedema', 'lymphedema', 'breast cancer', 'axillary clearance', 'axillary lymphadenectomy', 'axillary dissection', 'lymphaticovenular anastomosis', 'lymphaticovenous anastomosis', 'LYMPHA', 'lymph node transfer', 'lymph node flap', 'liposuction', 'lymphatic bypass', 'prevention', and 'treatment' were extracted and considered for inclusion in the review.
-
Cochrane Central Register of Controlled Trials (CENTRAL). See Appendix 1.
-
MEDLINE via OvidSP. See Appendix 2.
-
Embase via EMBASE.com (1947 to January 2015) and OvidSP (January 2015 to November 2017). See Appendix 3 for the search strategy.
-
The Cumulative Index to Nursing and Allied Health Literature (CINAHL) through EBSCO (1980 to May 2013). See Appendix 4 for the search strategy.
For prospectively registered and ongoing trials, we searched:
-
the World Health Organization (WHO) International Clinical Trials Registry Platform (ICTRP) search portal (http://apps.who.int/trialsearch/Default.aspx). See Appendix 5 for the search strategy;
-
ClinicalTrials.gov (http://clinicaltrials.gov/).
Búsqueda de otros recursos
Three review authors independently searched the reference lists of included studies for additional eligible studies.
Obtención y análisis de los datos
Selección de los estudios
Three review authors (PM, NL, VA) independently determined the eligibility of each study. Three authors reviewed the titles and abstracts of all citations found through the search strategy previously described. A copy of the full article for each citation reporting a potentially eligible study was obtained, and three review authors (PM, NL, VA) independently applied the eligibility criteria; any discrepancies were resolved by consensus through discussion with a fourth review author (DF). Where necessary and possible, additional information was sought from the principal investigator of the study concerned. Any exclusions from the review of a potentially eligible study were justified in the final report.
Extracción y manejo de los datos
Three review authors (PM, NL, VA) independently extracted the data for each included study using a pre‐designed data extraction pro forma. Data were extracted on the details of the study (first author, year of publication, journal, publication status, period and country of study, sources of funding, study design, sample size); participants' characteristics (age, sex, type of disease, stage of disease, type of surgery, and prior treatment status); risk of bias assessment; details of the intervention; duration of follow‐up; and the primary and secondary outcomes. A fourth review author (DF) resolved any discrepancies regarding data extraction, and consensus was reached. The most complete data set feasible was assembled. The study authors were contacted with the aim of acquiring additional information on the data presented.
Evaluación del riesgo de sesgo de los estudios incluidos
Three review authors (PM, NL, VA) independently assessed each study for risk of bias using the Cochrane Collaboration's 'risk of bias' tool (Higgins 2011). We considered selection bias, performance bias, detection bias, attrition bias, and reporting bias for each individual study. Any discrepancies were resolved by consensus through discussion with a fourth author (DF). We contacted study authors for additional information to enable the assessment of the risk of bias but did not receive any further information. We acknowledge that there is no accepted definition of high risk of bias, so we chose the threshold as those trials with greater than or equal to three of seven domains (random sequence generation, allocation concealment, blinding of participants and personnel, blinding of outcome assessment, incomplete outcome data, selective reporting, other bias) with high risk of bias when analysed with the Cochrane Collaboration's risk of bias tool to represent high risk of bias studies. In addition, if there were some risk of bias concerns on multiple domains, we classified the study to be an unclear risk of bias overall.
Medidas del efecto del tratamiento
We planned to use hazard ratios (HRs) with 95% confidence intervals (CIs) to evaluate the comparative times to development of LE after preventive LE surgery and also time to the development of complications related to surgery or to LE itself. However, this was not possible in this review version as there was insufficient detail in the reports of included studies, and the authors did not respond to requests for further information. In future updates, this analysis will be considered.
Risk ratios (RR) with 95% CI were used to quantify the risk of developing LE, surgical complications, and LE complications.
Differences in continuous variables, such as those measuring the percentage reduction of LE after treatment or the psychosocial well‐being of participants with LE, were estimated as mean differences (MDs). The amount of LE was calculated as the excess volume in the affected limb compared to the unaffected limb, expressed as a percentage of the volume of the unaffected limb. The patient‐reported measures of LE‐related well‐being assessed on a 10 point scale (where 1 was good; 10 was bad) were reported as means (at baseline and post‐intervention) and change from baseline scores.
Cuestiones relativas a la unidad de análisis
All included studies addressed people with unilateral LE after breast cancer with each participant randomly assigned. Therefore, no unit of analysis issues arose. With the surgical interventions that were done after a period of observation or nonsurgical treatment, we considered only the postoperative intervention period in the analysis.
Manejo de los datos faltantes
We based our analysis only on participants who completed the study and made no assumptions about loss to follow‐up. All analyses were done by intention‐to‐treat (Hollis 1999). If participants were allocated to one intervention (for example LVA), but after randomisation underwent a different intervention (for example lymphatico‐lymphatic bypass), they were analysed according to their randomised allocation. In Boccardo 2009, 89% of participants randomised were assessed at two years. In Boccardo 2011 and Dionyssiou 2016, no participants were lost to follow‐up after randomisation. No missing data was identified to necessitate contacting study authors for additional information.
Evaluación de la heterogeneidad
We examined heterogeneity using the Chi2 test with significance set at a P value of 0.10, and measured the quantity of heterogeneity using the I2 statistic (Higgins 2002).
Thresholds for the interpretation of the I2 statistic can be misleading. A rough guide to interpretation is:
-
0% to 40%, might not be important;
-
30% to 60%, may represent moderate heterogeneity;
-
50% to 90%, may represent substantial heterogeneity;
-
75% to 100%, considerable heterogeneity.
We took factors such as clinical and methodological heterogeneity, along with whether the heterogeneity was in the magnitude of effect or in the direction of effect, into account while interpreting the I2 statistic, particularly where there was overlap in the ranges defining levels of heterogeneity.
Evaluación de los sesgos de notificación
We compared the reported outcomes with those stated in the methods of the studies and also those listed in clinical trials registries as both primary and secondary outcomes (for example http://www.clinicaltrials.gov/). We planned to assess publication bias by creating a funnel plot using software within Review Manager 5.2 (RevMan 2012) if at least 10 studies were identified. Only three studies were included in this review so a funnel plot was not used.
Síntesis de los datos
We presented a narrative overview of the included studies. Where appropriate, we undertook meta‐analyses of outcome data using Review Manager software (RevMan 2012).
For time‐to‐event data, such as time to development of LE in a prevention study, we planned to plot (and, if appropriate, pool) estimates of the HR and 95% CI as presented in the study reports using the generic inverse variance method in the Review Manager software (RevMan 2012). However, this was not possible in this review version because there was insufficient detail on time‐to event data in the reports, and the authors did not respond to requests for further details. Comparison of the primary outcome for prevention was instead reported as a risk ratio at the final time point.
For dichotomous outcomes, such as surgical wound infection, we planned to present the summary estimate as a RR with 95% CI.
For continuous outcomes measured in the same way across studies, for example, measurements of limb volume, we planned to present a MD with 95% CI. We planned to present a standardised mean difference (SMD) for studies measuring the same outcome using different methods. The three studies identified did not enable these meta‐analyses.
To grade the certainty of the evidence, GRADE profiler software (GRADE) was used and 'Summary of findings' tables were produced for the six prespecified outcomes for the prevention and treatment of LE.
Análisis de subgrupos e investigación de la heterogeneidad
We planned to conduct subgroup analyses for participants with different types of axillary surgery and adjuvant treatments as well as those with normal or high body mass index. However, all three studies identified enrolled only participants who had axillary clearance and the study samples were too small to allow any subgroup analyses.
In future review updates, if possible, the following will be considered for possible subgroup analysis:
-
patients with sentinel lymph node biopsy and complete lymph node clearance;
-
patients treated with and without radiotherapy to the axilla;
-
patients treated with and without radiotherapy to any area (axilla, breast, chest wall);
-
patients treated with and without chemotherapy;
-
patients with a body mass index above 30 or below 30;
-
patients with different stages of lymphoedema.
Análisis de sensibilidad
We planned to perform sensitivity analysis, through excluding studies with a high risk of bias from the analysis. We acknowledged that there is no accepted categorisation of high risk of bias and therefore judged a study to be at high risk of bias if greater than or equal to three of seven domains were judged to be at high risk of bias. However, only three studies were identified and a sensitivity analysis was not conducted.
Results
Description of studies
Results of the search
A total of 792 records were retrieved (see Figure 1). Fourteen records were considered potentially relevant, and three of these met our predefined inclusion criteria (Boccardo 2009; Boccardo 2011; Dionyssiou 2016). There were no ongoing studies or studies awaiting classification identified.
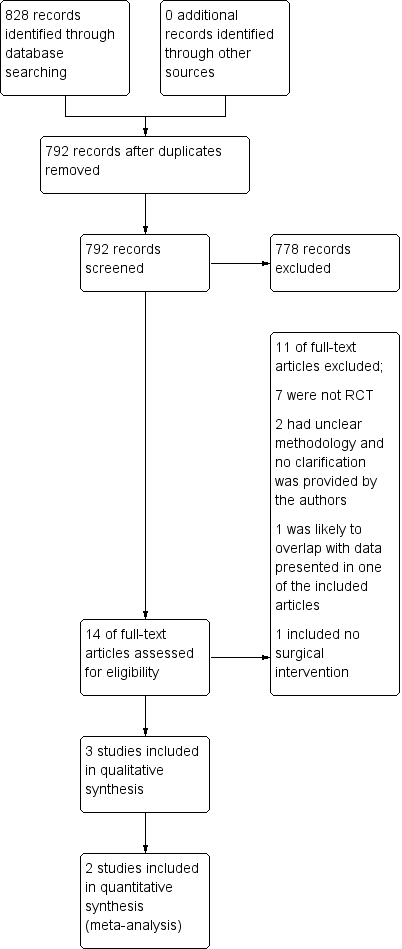
Study flow diagram.
Included studies
Three studies were included: two studies reported on the effectiveness of lymphaticovenular anastomosis as part of preventive management protocols in the prevention of breast cancer‐related lymphoedema (Boccardo 2009; Boccardo 2011) and one study (Dionyssiou 2016) reported on the effectiveness of vascularised lymph node transfer in the treatment of established breast cancer‐related lymphoedema, comparing outcomes at 18 months between two groups of participants ‐ the intervention group ‐ who had lymph node transfer and six months of combination physical and compression therapy, and the comparator group ‐ who had six months of combination physical and compression therapy only. All participants in the three studies were women. Lymphoedema was defined as an arm volume increase of 100 mL (Boccardo 2011) or 200 mL (Boccardo 2009) in comparison with the preoperative volume of that arm or as a percentage difference in volume of the affected arm in comparison with the unaffected arm (Dionyssiou 2016). Refer to the Characteristics of included studies for additional details.
Excluded studies
Of the eleven potentially relevant studies that were eventually excluded, seven studies were determined to not be randomised controlled trials after full‐text review (Brorson 1997; Brorson 1998; Brorson & Svensson 1998; Brorson 2000; Ciudad 2017; Maldonado 2011; Saaristo 2012); two studies had incomplete reporting of the study design making it impossible to determine whether they were randomised trials (Campisi 2006; Youssef 2010); one study was reported as an abstract with results that likely overlapped with another study which had already been assessed in this review (Campisi 2014); and one study was determined to not have evaluated a surgical technique (Hou 2008).
Efforts were made to contact authors to clarify their methods where there were uncertainties, but there was either no response to our efforts or no available contact details (Campisi 2006; Campisi 2014; Youssef 2010). Refer to the Characteristics of excluded studies.
Risk of bias in included studies
See Figure 2 for visual summaries of the 'risk of bias' assessment. All three studies, Boccardo 2009, Boccardo 2011 and Dionyssiou 2016, were judged to be at unclear risk of bias due to multiple domains in each study being at unclear or high risk of bias.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Both Boccardo 2009 and Boccardo 2011 were rated as unclear risk for selection bias. The studies mentioned only that they "randomly assigned" participants to different groups, without describing how the randomisation was achieved. There was also no mention as to when the allocation was revealed and whether steps were taken to ensure strict implementation of the schedule of random assignments by those enrolling participants into the different treatment arms. However, it was notable that, in both studies, no statistically significant, or potentially clinically important, differences in participants' baseline characteristics were noted between the treatment and control groups; comparisons included age, body mass index, the presence of metastatic lymph nodes, baseline lymphoedema volume, radiotherapy, infection, etc (Boccardo 2009; Boccardo 2011).
Dionyssiou 2016 employed both a satisfactory method of random sequence generation using a "random number generator" and a conscious approach to conceal allocation by revealing allocation only after participants had been initially examined, assessed and recruited. These efforts resulted in an overall rating of low risk of selection bias for this study.
Blinding
Two of the studies had a high risk of performance and detection bias as, for each of the studies, the control group did not receive a surgical intervention (Boccardo 2009; Dionyssiou 2016) and it would be practically impossible to blind the surgeons and participants to the surgical treatments provided. Moreover, outcome assessors could not practically be reliably blinded to the intervention received because of the presence of surgical scarring and also participants' knowledge. In the third study (Boccardo 2011), the experimental surgical intervention was done during the same operation as standard care. However, it was not clear whether the participants were blinded to the treatment provided.
Incomplete outcome data
For two studies, there were no concerns regarding attrition bias, and complete outcome data were reported for all participants (Boccardo 2011; Dionyssiou 2016). Boccardo 2009 reported that 6, or 11%, of their 55 participants did not complete follow‐up. Unfortunately, no reasons were specified for failure to complete the follow‐up assessments and partial data were included so it was unclear as to what impact this would have on the results.
Selective reporting
All three studies were rated as low risk for reporting bias (Boccardo 2009; Boccardo 2009; Dionyssiou 2016). Whilst no pre‐trial protocols were available, all results in these studies were reported as per the outcomes specified in the methods (Boccardo 2009; Boccardo 2009; Dionyssiou 2016). Notably, however, neither Boccardo 2009 nor Boccardo 2011 formally looked at surgical complications as an outcome to be assessed, and it was certainly unclear whether their participants suffered any complications as part of the procedure.
Other potential sources of bias
No other potential sources of bias were identified.
Effects of interventions
See: Summary of findings for the main comparison Lymphaticovenular anastomosis compared to standard care for prevention of lymphoedema development; Summary of findings 2 Vascularised lymph node transfer compared to standard care for treatment of arm lymphoedema
Prevention
The development of LE
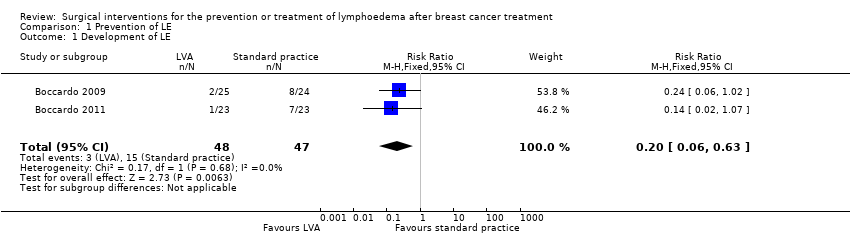
Both Boccardo 2009 and Boccardo 2011 included the development of LE as an outcome, reporting on a total of 95 participants. The statistical heterogeneity between the trials was low (I2 = 0%, P = 0.68). Analysis using a fixed‐effect model demonstrated that participants who had undergone lymphaticovenular anastomosis as a preventive measure had a reduced risk of developing lymphoedema during the 18‐month (Boccardo 2011) and 24‐month (Boccardo 2009) follow‐up compared to those who had not (RR 0.20, 95% CI 0.06 to 0.63, P = 0.006; low‐certainty evidence ; Analysis 1.1; Figure 3).

Forest plot of comparison: 1 Development of LE, outcome: 1.1 Development of LE.
Patient‐reported outcomes
The two studies did not evaluate patient‐reported outcomes.
Ability to discontinue further interventions for LE
The two studies did not report on this outcome.
Surgical complications (seroma, lymphorrhoea, wound dehiscence, wound infections)
The two studies did not report on these outcomes.
Long‐term complications (cellulitis, lymphangitis, lymphadenitis, skin ulcers, and lymphorrhoea)
The two studies did not report on these outcomes.
Treatment
The percentage reduction of LE
Dionyssiou 2016 reported a statistically significant difference (57% versus 18%) in mean limb volume reductions for participants who had undergone lymph node transfer in addition to standard care (i.e. physical and compression therapy) and those participants who had received standard care alone.This equated to a difference in volume reduction of 39.00% (95% 30.63% to 47.37%; 36 participants; very low‐certainty evidence) between the two groups, favouring lymph node transfer over no treatment (P < 0.00001; Analysis 2.1; Figure 4).
![Forest plot of comparison: 2 Reduction of LE, outcome: 2.1 Reduction of LE [%].](/cdsr/doi/10.1002/14651858.CD011433.pub2/media/CDSR/CD011433/image_n/nCD011433-AFig-FIG04.png)
Forest plot of comparison: 2 Reduction of LE, outcome: 2.1 Reduction of LE [%].
Patient‐reported outcomes
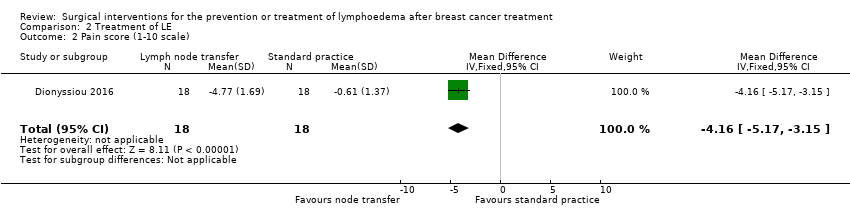
Dionyssiou 2016 studied various patient‐reported outcomes: pain, sensation of heaviness, and overall function, all of which were rated on a 10‐point scale (Dionyssiou 2016). This scale ranged from 1 (e.g. no pain or good function) to 10 (e.g. extreme pain or very poor function). Those in the lymph node transfer group (plus with standard care) experienced a reduction in pain, heaviness sensation, and also improvements function scores compared to baseline, in contrast to effects that were statistically not significant amongst participants in the standard care alone group. The mean difference in pain reduction (MD ‐4.16, 95% CI ‐5.17 to ‐3.15; very low‐certainty evidence; Analysis 2.2), sensation heaviness reduction (MD ‐4.27, 95% CI ‐5.74 to ‐2.80; very low‐certainty evidence; Analysis 2.3), and overall functional improvement (MD ‐3.77, 95% CI ‐4.89 to ‐2.65; very low‐certainty evidence; Analysis 2.4) favoured lymph node transfer over no treatment.
Ability to discontinue further interventions for LE
The study did not report on this outcome.
Surgical complications (seroma, lymphorrhoea, wound dehiscence, wound infections)
Dionyssiou 2016 reported that lymph node transfer reduced the mean number of infections per year that participants experienced in the arm affected by LE, such as erysipelas, cellulitis, or lymphangitis. The reduction in the mean number of infections was greater for the surgical group with an MD ‐1.22 (95% CI ‐2.00 to ‐ 0.44; very low‐certainty evidence; Analysis 2.5).
Long‐term complications (cellulitis, lymphangitis, lymphadenitis, skin ulcers, and lymphorrhoea)
The study did not report on these outcomes.
Discusión
Resumen de los resultados principales
La realización de la anastomosis linfático venular como parte de un protocolo de tratamiento preventivo temprano durante el tratamiento del cáncer de mama parece reducir el riesgo de desarrollo del linfedema en el brazo del lado afectado (según los resultados de dos estudios). Sin embargo, estos dos estudios de prevención no informaron sobre resultados secundarios importantes. La transferencia de ganglios linfáticos vascularizados utilizada en el tratamiento del linfedema establecido relacionado con el cáncer de mama puede reducir el volumen del miembro, las puntuaciones de dolor, la sensación de pesadez y las infecciones por año, así como mejorar la funcionalidad general (según un estudio). Los resultados secundarios importantes como las complicaciones a largo plazo y la capacidad de interrumpir las intervenciones adicionales para el tratamiento del linfedema no se obtuvieron en el estudio.
Compleción y aplicabilidad general de las pruebas
Debido a la falta de ensayos controlados aleatorios en el tema, la presente revisión sistemática ha podido responder solo una de varias preguntas que se podrían haber analizado. En particular, no hubo estudios elegibles que compararan la efectividad de una técnica quirúrgica versus otra y no hubo estudios elegibles que analizaran la eficacia de otras técnicas quirúrgicas conocidas, como la liposucción y la derivación linfático‐linfática, en el tratamiento o la prevención del linfedema relacionado con el cáncer de mama. Entre los estudios obtenidos e incluidos, también hubo falta de uniformidad en la forma en la que evaluó el linfedema, las medidas de resultado y las complicaciones informadas.
Los dos estudios que examinaron el uso de la anastomosis linfático venular en la prevención del linfedema relacionado con el cáncer de mama incluyeron pacientes sometidos o programados para una disección axilar completa como parte de su tratamiento del cáncer de mama (Boccardo 2009; Boccardo 2011). La certeza de la evidencia aportada por estos dos estudios fue baja. Los estudios incluyeron solo 95 participantes, un número insuficiente para un análisis de subgrupos efectivo que habría sido útil, por ejemplo, para identificar las características de los participantes que pueden ser más predictivas con respecto al éxito del tratamiento, e informar así las vías de tratamiento futuras. También es de señalar que estos dos estudios solo evaluaron un resultado: la presencia de linfedema. Los autores no informaron formalmente sobre las medidas de resultado informadas por los pacientes, las complicaciones posoperatorias ni la capacidad para interrumpir las intervenciones adicionales, y como el período de seguimiento máximo de los estudios fue de solo dos años, se desconocen los resultados a largo plazo. Los datos de ambos estudios provinieron de solo un equipo quirúrgico de Italia, lo que reduce potencialmente la generalizabilidad de la evidencia.
Un estudio evaluó la efectividad de la transferencia de ganglios linfáticos vascularizados, sin la necesidad de terapia física o de compresión continua, en el tratamiento del linfedema establecido relacionado con el cáncer de mama de gravedad estadio 2, lo que nuevamente reduce la posible generalizabilidad de la evidencia. (Dionyssiou 2016). La certeza de la evidencia aportada por este estudio fue muy baja. Como Boccardo 2009 y Boccardo 2011, Dionyssiou 2016 estuvo limitado por el número relativamente pequeño de participantes del estudio y por el período de seguimiento corto. Sin embargo, Dionyssiou 2016 analizó una variedad mayor de resultados e incluyó no solo la reducción del número de infecciones por año, sino también las medidas de resultado informadas por el paciente como el dolor, la sensación de pesadez y la funcionalidad. No obstante, una pregunta importante que este ensayo no pudo responder fue si los participantes sometidos a transferencia de ganglios linfáticos vascularizados presentaron resultados comparables a los resultados de los que recibieron fisioterapia descongestiva completa, el tratamiento estándar de referencia actual del linfedema. El grupo "control" en Dionyssiou 2016 no recibió tratamiento físico ni de compresión en un total de 12 meses antes de la evaluación final.
Calidad de la evidencia
El número de estudios elegibles para esta revisión fue bajo y las conclusiones se basaron en un total de solo 131 participantes. Aunque los tres estudios fueron ensayos controlados aleatorios, hubo varias deficiencias en el diseño. No hubo evidencia de generación aleatoria de la secuencia ni de encubrimiento de la asignación en dos de los ensayos, y debido a la naturaleza quirúrgica de las intervenciones, el cegamiento de los participantes, el personal y la medición de los resultados fue, en algunos casos, imposible. Los datos de resultado de Boccardo 2009 estuvieron incompletos porque seis participantes no finalizaron el seguimiento; no se informaron las razones ni los resultados parciales. Además, la calificación final de bajo riesgo de informe selectivo en los estudios de Boccardo puede ser incorrecta, ya que los autores no mencionaron formalmente los resultados informados por los pacientes, las complicaciones posoperatorias ni la capacidad para interrumpir las intervenciones adicionales, que serían de esperar en los estudios modernos que analizan intervenciones quirúrgicas. Períodos de seguimiento más prolongados también habrían hecho que los resultados de esta revisión sistemática fueran más fidedignos.
Con respecto a la evidencia del uso de la anastomosis linfático venular en la prevención del linfedema, la heterogeneidad entre Boccardo 2009 y Boccardo 2011 fue baja y los resultados del resultado principal fueron consistentes. Aunque las características demográficas de los participantes, las intervenciones y los métodos fueron ligeramente diferentes, ambos estudios indicaron una reducción del riesgo de desarrollar linfedema cuando la anastomosis linfático venular se realizó de forma temprana como parte o después del tratamiento del cáncer de mama. En general, la certeza de la evidencia que apoya el uso de la anastomosis linfático venular proporcionada en estos estudios se consideró baja.
Dionyssiou 2016 mostró diferencias claras estadísticamente significativas en cinco resultados diferentes de con la efectividad de la transferencia de ganglios linfáticos vascularizados para el tratamiento del linfedema establecido estadio 2 relacionado con el cáncer de mama. En general, la certeza de la evidencia proporcionada en este estudio fue muy baja. Sin embargo, la deficiencia principal del estudio es posiblemente si este ensayo abordó la pregunta correcta. Específicamente, comparó participantes sometidos a transferencia de ganglios linfáticos vascularizados versus participantes que no recibieron tratamiento durante 12 meses antes de la evaluación final del linfedema. De hecho, un método más apropiado habría sido comparar sus resultados quirúrgicos con los de los participantes que han sido tratados con terapia descongestiva compleja, que es el tratamiento de referencia, durante todo el seguimiento. Este método habría proporcionado una perspectiva valiosa sobre si los participantes podrían verdaderamente interrumpir por completo la prolongada terapia física y de compresión después de los tratamientos quirúrgicos para el linfedema relacionado con el cáncer de mama. Además, no se analizó la sensibilidad de la escala de 10 puntos utilizada, lo que cuestiona la significación clínica de los cambios estadísticamente significativos detectados en los diversos dominios.
Sesgos potenciales en el proceso de revisión
La posibilidad de sesgo en el proceso de revisión fue baja a moderada. La búsqueda de la bibliografía la realizó el Grupo Cochrane de Cáncer de Mama según las normas aceptadas. Por lo tanto, hay seguridad con respecto a que se han obtenido los estudios sobre este tema para esta revisión. Además, la selección de los estudios la realizaron de forma independiente tres autores de la revisión (PM, NL y VA) que siguieron de forma estricta los criterios de inclusión/exclusión acordados. Los desacuerdos los resolvió el autor de la revisión de mayor experiencia (DF).
Sin embargo, debido a que en la búsqueda se identificaron artículos que no estaban en inglés y los cuatro autores de la revisión eran angloparlantes, se podría haber perdido algún material que no estuviera en inglés. Para intentar impedir que esto sucediera, colegas médicos entrenados que dominaban el idioma en cuestión examinaron y evaluaron todo el material que estaba en un idioma diferente del inglés. En concreto, ningún artículo en un idioma que no fuera inglés cumplió los criterios de inclusión para esta revisión.
En general, es difícil excluir el sesgo de publicación secundario a los resultados que no se han publicado debido a que los resultados no fueron significativos o a que los editores de las revistas no aceptaron los ensayos para su publicación.
Acuerdos y desacuerdos con otros estudios o revisiones
Cinco revisiones sistemáticas anteriores informaron sobre la efectividad de la intervención quirúrgica para el linfedema de las extremidades y se basaron principalmente en series de casos clínicos (Carl 2017; Cormier 2012; Leung 2015; Penha 2013; Scaglioni 2017). Dos de dichas revisiones se centraron específicamente en el linfedema relacionado con el cáncer de mama (Leung 2015; Penha 2013); una se centró específicamente en la técnica de anastomosis linfovenosa (Scaglioni 2017); y las dos restantes analizaron además el linfedema que afectaba los miembros inferiores (Carl 2017; Cormier 2012). Entre la más antigua y la última de las revisiones anteriores, está claro que ha habido una explosión de estudios de investigación sobre este tema en años recientes; de hecho, aunque la búsqueda exhaustiva de Cormier 2012 solo obtuvo 20 estudios que cumplían los requisitos en 2010, una búsqueda igualmente exhaustiva realizada por Carl 2017 obtuvo 69 estudios en 2016 (Cormier 2012; Carl 2017). No obstante, las conclusiones principales que se podrían establecer de todos los estudios anteriores son las mismas y coinciden con la perspectiva alcanzada por la presente revisión Cochrane: como hay evidencia de muy baja certeza de la efectividad de la intervención quirúrgica para el tratamiento del linfedema, las conclusiones que se podrían establecer a partir de la evidencia están limitadas en general por los períodos de seguimiento relativamente cortos y el número pequeño de ensayos controlados aleatorios.
Con respecto a las recomendaciones específicas, Penha 2013 favoreció a la transferencia de ganglios linfáticos vascularizados porque, a partir de su evaluación cualitativa de la bibliografía en ese momento, fue la única técnica que aportó evidencia para permitir la interrupción de la terapia conservadora posoperatoria. Además, razonaron que teóricamente la técnica se podría combinar con la reconstrucción autóloga de la mama, lo que quizás la haga más fácil de incorporar en los programas de tratamiento del cáncer de mama ya establecidos (Penha 2013). Leung 2015 coincidió con el posible efecto beneficioso de utilizar la transferencia de ganglios linfáticos vascularizados como parte de la reconstrucción planificada de la mama, pero señaló que el riesgo y la posible morbilidad asociados con el procedimiento (por ejemplo, el linfedema del sitio donante, la cicatrización, las preocupaciones cosméticas, etc.), hacen que sea menos preferido al enfoque linfovenoso menos invasivo, para el tratamiento del linfedema menos grave (hasta el estadio IIa de la International Society of Lymphology [ISL]) (Leung 2015). A partir de su revisión sistemática y metanálisis, Carl 2017 aclaró aún más el posible algoritmo de tratamiento e indicó que la anastomosis linfovenosa es el método preferido para el linfedema parcialmente obstruido (hasta el estadio II de la ISL) definido por linfocentellografía TC‐99m, pero que la transferencia de ganglios linfáticos vascularizados, la liposucción o la escisión se prefieren para los casos más graves con obstrucción linfática total.
A falta de ensayos controlados aleatorios, la presente revisión no puede proporcionar más claridad sobre la validez del algoritmo de tratamiento propuesto por Carl 2017. Sin embargo, esta revisión aboga por extender el algoritmo propuesto para incluir el uso de la anastomosis linfovenosa para la prevención del linfedema relacionado con el cáncer de mama. También le brinda un mayor apoyo al uso de la transferencia de ganglios linfáticos vascularizados en los pacientes con linfedema más grave.
Study flow diagram.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Forest plot of comparison: 1 Development of LE, outcome: 1.1 Development of LE.
![Forest plot of comparison: 2 Reduction of LE, outcome: 2.1 Reduction of LE [%].](/es/cdsr/doi/10.1002/14651858.CD011433.pub2/media/CDSR/CD011433/image_n/nCD011433-AFig-FIG04.png)
Forest plot of comparison: 2 Reduction of LE, outcome: 2.1 Reduction of LE [%].
Comparison 1 Prevention of LE, Outcome 1 Development of LE.

Comparison 2 Treatment of LE, Outcome 1 Reduction of LE.
Comparison 2 Treatment of LE, Outcome 2 Pain score (1‐10 scale).

Comparison 2 Treatment of LE, Outcome 3 Heaviness sensation score (1‐10 scale).

Comparison 2 Treatment of LE, Outcome 4 Function score (1‐10 scale).

Comparison 2 Treatment of LE, Outcome 5 Number of infections per year.
| Lymphaticovenular anastomosis compared to standard care for prevention of lymphoedema development | ||||||
| Patient or population: prevention of lymphoedema development | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with standard care | Risk with lymphaticovenular anastomosis | |||||
| Development of LE | Study population | RR 0.20 | 95 | ⊕⊕⊝⊝ | ||
| 319 per 1,000 | 64 per 1,000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 The surgical intervention groups were small: In Boccardo 2009 the preventive protocol was followed for 25 women of which seven underwent LVA primarily and the number undergoing LVA at a later stage was not reported. In Boccardo 2011, all 23 participants in the intervention group had LVA done at the time of axillary clearance. 2 In Boccardo 2009, the control group received physical therapy and compression garments only after lymphoedema was detected whereas the intervention group received these as a preventive measure already before any lymphoedema was detected. Therefore, the difference detected between the two groups cannot be attributed solely to the LVA done. In Boccardo 2011, neither of the groups received any compression treatments which means that the effect of the intervention was not compared with the standard treatment but no treatment at all. 3 The study group allocation was not concealed and the assessment was not blinded in either of the included studies. Therefore, we downgraded the certainty of the evidence by 1 point for risk of bias 4 Due to the small number of participants in each trial and wide confidence intervals, we downgraded the certainty of evidence by 1 point for imprecision. | ||||||
| Vascularised lymph node transfer compared to standard care for treatment of arm lymphoedema | ||||
| Patient or population: treatment of arm lymphoedema | ||||
| Outcomes | Relative effects* (95% CI) | № of participants | Certainty of the evidence | Comments |
| Vascularised lymph node transfer vs standard care | ||||
| Reduction of LE (%) | MD 39 lower | 36 | ⊕⊝⊝⊝ | |
| Number of infections per year | MD 1.22 lower | 36 | ⊕⊝⊝⊝ | |
| Pain score (1‐10; where 1 = no pain; 10 = extreme pain) | MD 4.16 lower | 36 | ⊕⊝⊝⊝ | |
| Heaviness score (1‐10; where 1 = no heaviness; 10 = extreme heaviness) | MD 4.27 lower | 36 | ⊕⊝⊝⊝ | |
| Function score (1‐10; where 1 = good function; 10 = poor function) | MD 3.77 lower | 36 | ⊕⊝⊝⊝ | |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||
| GRADE Working Group grades of evidence | ||||
| 1 The control group in Dionyssiu 2016 study received no physical or compression treatments for the 12 months prior to the final assessment and thus did not receive the current golden standard of nonoperative lymphoedema treatment. Therefore we downgraded the evidence by 1 point for indirectness | ||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Development of LE Show forest plot | 2 | 95 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.20 [0.06, 0.63] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Reduction of LE Show forest plot | 1 | 36 | Mean Difference (IV, Fixed, 95% CI) | ‐39.0 [‐47.37, ‐30.63] |
| 2 Pain score (1‐10 scale) Show forest plot | 1 | 36 | Mean Difference (IV, Fixed, 95% CI) | ‐4.16 [‐5.17, ‐3.15] |
| 3 Heaviness sensation score (1‐10 scale) Show forest plot | 1 | 36 | Mean Difference (IV, Fixed, 95% CI) | ‐4.27 [‐5.74, ‐2.80] |
| 4 Function score (1‐10 scale) Show forest plot | 1 | 36 | Mean Difference (IV, Fixed, 95% CI) | ‐3.77 [‐4.89, ‐2.65] |
| 5 Number of infections per year Show forest plot | 1 | 36 | Mean Difference (IV, Fixed, 95% CI) | ‐1.22 [0.00, ‐0.44] |

