Equipos de especialistas en acceso vascular para la inserción de dispositivos y la prevención de fracasos
Resumen
Antecedentes
La mayoría de los pacientes que ingresan a los hospitales en todo el mundo requieren un dispositivo de acceso vascular (DAV). Se insertan cientos de millones de DAV anualmente en los EE.UU., y los informes indican que se utilizan más de 1 000 000 000 de catéteres intravenosos periféricos por año en todo el mundo. Numerosos informes indican que un enfoque de equipo para la evaluación, la inserción y el mantenimiento de los DAV mejora los resultados clínicos, la experiencia del paciente y los procesos de asistencia sanitaria.
Objetivos
Comparar el uso de un equipo de especialistas en acceso vascular (EEAV) para la inserción y el cuidado del DAV con un enfoque de un modelo generalista para los participantes hospitalizados o de la comunidad que requieren un DAV en cuanto al éxito de la inserción, el fracaso del dispositivo y la costo‐efectividad.
Métodos de búsqueda
Se realizaron búsquedas en el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL; 2018, número 1); Ovid MEDLINE (1950 hasta 7 febrero 2018); Ovid Embase (1980 hasta 7 febrero 2018); EBSCO CINAHL (1982 hasta 7 febrero 2018); Web of Science Conference Proceedings Citation Index ‐ Science and Social Science and Humanities (1990 hasta 7 febrero 2018); y en Google Scholar. Se hicieron búsquedas en los siguientes registros de ensayos: Australian and New Zealand Clinical Trials Register (www.anzctr.org.au); ClinicalTrials.gov (www.clinicaltrials.gov); Current Controlled Trials (www.controlled‐trials.com/mrct); HKU Clinical Trials Registry (www.hkclinicaltrials.com); Clinical Trials Registry ‐ India (ctri.nic.in/Clinicaltrials/login.php); UK Clinical Trials Gateway (www.controlled‐trials.com/ukctr/); and the World Health Organization International Clinical Trials Registry Platform (WHO ICTRP) (www.who.int/trialsearch). Se hicieron búsquedas en todas las bases de datos el 7 febrero 2018.
Criterios de selección
Se planificó incluir ensayos controlados aleatorios (ECA) que evaluaran la efectividad de los EEAV o de colocadores especialistas en cuanto a su repercusión sobre los resultados clínicos.
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar recomendados por Cochrane y se utilizó el software Covidence para ayudar con el manejo de los archivos.
Resultados principales
Se recuperaron 2398 citas: 30 estudios reunieron los requisitos para la revisión adicional del texto completo, y se encontró un ensayo clínico registrado en curso. No fue posible incluir ningún estudio en el análisis o la revisión. Un estudio se asignó como en espera de clasificación, debido a que no se ha aceptado para la publicación.
Conclusiones de los autores
Esta revisión sistemática no logró localizar ECA publicados relevantes para apoyar o refutar la aserción de que los equipos de especialistas en acceso vascular son superiores al modelo generalista. Un equipo de especialistas en acceso vascular tiene un conocimiento avanzado con respecto a las técnicas de inserción, la atención clínica, y el tratamiento de los dispositivos de acceso vascular, mientras que un modelo generalista comprende enfermeras, médicos u otros profesionales de la asistencia sanitaria designados en la instalación de asistencia sanitaria que pueden tener técnicas de inserción menos avanzadas y que administran atención para los dispositivos de acceso vascular entre otras tareas clínicas competentes. Sin embargo, esta conclusión puede cambiar una vez que se publique el estudio en espera de clasificación y el estudio en curso. Se necesitan ECA de buena calidad para evaluar la eficacia de un enfoque de equipo de especialistas en acceso vascular para la inserción y la atención de dispositivos de acceso vascular para la prevención de fracasos.
PICO
Resumen en términos sencillos
Equipos de especialistas en acceso vascular para la inserción y la prevención del fracaso de dispositivos de acceso vascular
Pregunta de la revisión
Se examinó la evidencia en cuanto a la efectividad de los equipos de especialistas en acceso vascular (EEAV) en comparación con los modelos generalistas en cuanto al éxito de la inserción de los dispositivos de acceso vascular, el fracaso del dispositivo y la costo‐efectividad.
No se encontraron estudios elegibles para la revisión.
Antecedentes
Un EEAV se describió como el grupo de personal de asistencia sanitaria que tiene conocimiento y aptitudes avanzadas en la evaluación, la inserción, los cuidados y el tratamiento de los dispositivos de acceso vascular, como los equipos de infusión/intravenosos o de tratamiento intravenoso, así como los especialistas en acceso vascular individuales (enfermeras, médicos, terapeutas, técnicos y asistentes de los médicos).
El objetivo fue evaluar si el enfoque de EEAV es superior a un enfoque de médicos generalistas.
Un modelo o enfoque generalista se definió como grupos más grandes de enfermeras, médicos, u otros profesionales de la asistencia sanitaria designados en la instalación de asistencia sanitaria que cuentan con aptitudes y conocimiento menos avanzados en cuanto a la inserción y el tratamiento de los dispositivos de acceso vascular.
Un dispositivo de acceso vascular (DAV) se definió como un catéter (tubo delgado) insertado en las venas o en los puertos que pueden implantarse bajo la piel, para permitir la administración de líquidos y medicación en las venas. Los catéteres insertados en las arterias pueden usarse para monitorizar el tratamiento. El DAV más común, el catéter intravenoso periférico (CIVP), puede permanecer implantado durante muchos días antes de la extracción. Los DAV o los catéteres implantados en las venas centrales generalmente pueden permanecer implantados durante muchas semanas, meses, y en algunos casos, en particular con los puertos, años. Los dispositivos de acceso vascular se usan para administrar líquidos (tratamiento de infusión) y medicación intravenosa (inyectada en una vena), tomar muestras de sangre y para la monitorización invasiva y suelen ser cruciales para proporcionar tratamiento y atención. El uso de DAV y de tratamiento de infusión se extiende a través de casi todas las especialidades médicas, quirúrgicas y de cuidados intensivos y ocurre en el hospital, en ámbitos de atención a largo plazo y domiciliaria.
Hay varios riesgos relacionados con la inserción de un DAV y el cuidado continuo que puede causar el fracaso del dispositivo (que ya no sea apropiado para la atención). Una complicación significativa posinserción incluye la trombosis venosa relacionada con el catéter (formación de coágulos). Los pacientes con cáncer o con enfermedades graves y que pueden requerir intervenciones médicas adicionales para tratar la trombosis están particularmente en riesgo de esta complicación. Existe un riesgo de inflamación de la vena relacionada con la infusión (flebitis o tromboflebitis) para el CIVP cuando la vena canulada comienza a presentar dolor con otros signos potenciales como eritema en el sitio de inserción. Los riesgos de infección como las infecciones del torrente sanguíneo relacionadas con el catéter se asocian con todos los DAV; la prevención de dichos acontecimientos es una prioridad de la asistencia sanitaria. Las infecciones del torrente sanguíneo relacionadas con el catéter se asocian con una estancia hospitalaria más larga, enfermedades graves, muerte y mayores costos para el servicio de salud.
Características de los estudios
Se realizaron búsquedas en un amplio rango de bases de datos médicas el 7 de febrero de 2018. Se identificaron 2398 estudios potenciales, 30 de los cuales se analizaron detalladamente. Sin embargo, se encontró un estudio apropiado y aunque el estudio está completo, el texto todavía no ha sido aceptado para la publicación, y por lo tanto no fue posible analizar los datos. Se ha asignado el estudio como en espera de clasificación; una vez que se publiquen sus resultados se evaluarán nuevamente y se decidirá si es elegible para su inclusión en la revisión. Se ha encontrado un ensayo registrado que está investigando la pregunta de la revisión, pero todavía está en curso y aún no se ha completado ni publicado.
Resultados clave
No fue posible localizar ensayos controlados aleatorios (ECA) publicados para apoyar o refutar la aserción de que los equipos de especialistas en acceso vascular son superiores al modelo generalista para la inserción de dispositivos y la prevención de fracasos. Sin embargo, esta conclusión puede cambiar una vez que se publiquen el estudio en espera de clasificación y el estudio en curso. Se necesitan ECA de buena calidad para evaluar la eficacia de un enfoque de EEAV para la inserción del DAV y la prevención de fracasos. Un ECA es un estudio (o ensayo) que procura reducir el sesgo cuando se examina un nuevo tratamiento. Los pacientes que participan en el ensayo son asignados al azar al grupo que recibe el tratamiento bajo investigación o a un grupo que recibe tratamiento estándar (o tratamiento de placebo) como el control.
Calidad de la evidencia
No se analizó la calidad de la evidencia, ya que no se encontró ningún estudio adecuado para incluir en la revisión.
Conclusiones de los autores
Antecedentes
La mayoría de los pacientes que ingresar al hospital requerirá un dispositivo de acceso vascular (DAV). Se insertan cientos de millones de DAV anualmente en los EE.UU. solamente (O’Grady 2011), y miles de millones en pacientes de todo el mundo (Rickard 2015). La mejoría en el trayecto de atención del paciente con un DAV colocado de forma apropiada se ha postulado como una prioridad para los servicios de prestación de asistencia sanitaria (Moureau 2012). Diversos profesionales actualmente proporcionan la inserción del DAV y el tratamiento continuo del dispositivo aunque hay alguna evidencia para sugerir que este hecho puede contribuir a la fragmentación de la asistencia general del paciente (Castro‐Sánchez 2014). La pregunta fundamental de esta revisión fue si es probable que un enfoque especialista en lugar de generalista produzca una mejor inserción y cuidados del DAV y, por lo tanto, una reducción de las complicaciones que contribuyen al fracaso del DAV.
Descripción de la afección
El término “dispositivo de acceso vascular” representa diversos catéteres comúnmente usados para obtener acceso al sistema circulatorio para los tratamientos de asistencia sanitaria. La mayoría de los DAV utilizados para el tratamiento intravenoso son clasificados de acuerdo a dos vías diferenciadas de inserción: a través de las venas periféricas o centrales; sin embargo, también pueden incluir vías arteriales, intraóseas y umbilicales (Green 1998; Kelly 2009; Reades 2011; Scheer 2002).
Función de un dispositivo de acceso vascular
Los dispositivos de acceso vascular permiten el tratamiento de infusión a través del aparato circulatorio, el análisis de muestreos sanguíneos y la monitorización invasiva, y suelen ser cruciales en la provisión del tratamiento y la atención (Gorski 2016). El uso de DAV y de tratamiento de infusión se extiende a través de casi todas las especialidades médicas, quirúrgicas y de los cuidados intensivos y ocurre en el hospital, los ámbitos de atención a largo plazo y los ámbitos de atención domiciliaria.
Inserción de dispositivos de acceso vascular
La inserción de dispositivos de acceso vascular es una cuestión de seguridad para el paciente (Castro‐Sánchez 2014; Moureau 2013). Pueden realizarse varios intentos para insertar un DAV con éxito, y cada intento involucra una punción en la piel con una aguja en un intento por canular el vaso deseado. Las tasas identificadas del fracaso del primer intento de inserción periférica son de un 12% a un 26% en adultos y de un 24% a un 54% en los niños (Sabri 2013). Existen diversas estrategias para mejorar los resultados de la inserción para las vías periféricas, como herramientas de evaluación y reglas de predicción clínicas (Carr 2017), debido a que el fracaso puede dar lugar a hematomas y dolor en los sitios de inserción (Webster 2008), y las punciones múltiples en la piel predisponen el ingreso de microorganismos en el torrente sanguíneo (Mermel 2017). Los DAV insertados centralmente se asocian con complicaciones procesales más críticas (p.ej. neumotórax o punción arterial) y contribuyen a la morbilidad y la mortalidad del paciente, aunque puede usarse tecnología especializada como la ecografía para reducir el riesgo de dichas complicaciones (Wu 2013).
Complicaciones asociadas con los dispositivos de acceso vascular
Hay varios riesgos relacionados con la inserción del DAV y la atención continua. Dichos riesgos pueden estar relacionados con el operador o el paciente. Las complicaciones posinserción incluida la trombosis venosa relacionada con el catéter (formación de coágulos) pueden requerir intervención médica adicional (Ge 2012). Los pacientes con cáncer o en estado crítico están particularmente en riesgo (Chopra 2013). Existe el riesgo de flebitis relacionada con la infusión (o tromboflebitis) con los catéteres intravenosos periféricos (CIVP) cuando la vena canulada comienza a presentar dolor con otros signos potenciales como eritema en el sitio de inserción (Tagalakis 2002). Los riesgos de infección como las infecciones del torrente sanguíneo relacionadas con el catéter son una carga hospitalaria significativa y se asocian con todos los DAV, aunque en particular con los catéteres venosos centrales (CVC); la prevención de dichos acontecimientos es otra prioridad de la asistencia sanitaria (O'Grady 2011). La infección del torrente sanguíneo relacionada con el catéter aumenta la estancia hospitalaria, la morbilidad, la mortalidad y los costos del servicio de salud (Ge 2012).
Equipo de especialistas en acceso vascular
Con objeto de realizar esta revisión, el término "equipo de especialistas en acceso vascular" (EEAV) representa cualquier grupo de personal específicamente asociado con la inserción y los cuidados del DAV y es sinónimo de títulos como equipos de infusión, equipos intravenosos, o equipos de tratamiento intravenoso, así como especialistas en acceso vascular individuales (enfermeras, médicos, terapeutas respiratorios, técnicos y asistentes de médicos) que tienen conocimiento y aptitudes avanzadas y que realizan la inserción y el tratamiento de los DAV con frecuencia, o ambos. Los informes favorables de un enfoque de EEAV incluyen el uso de equipos dirigidos por enfermeras y enfermeras especializadas que han insertado CVC en ambientes de cuidados intensivos (Alexandrou 2014; Gopal 2006; Yacopetti 2010). El uso de un enfoque de equipos para la inserción de los CIVP ha aumentado el éxito del primer intento de inserción (Carr 2010) e históricamente se ha asociado con una reducción en las complicaciones relacionadas con el dispositivo (Tomford 1984). La alternativa al EEAV es el modelo generalista, en el que grupos más grandes de enfermeras, médicos, u otros profesionales de la asistencia sanitaria designados en la instalación de asistencia sanitaria que presentan aptitudes menos avanzadas, llevan a cabo la inserción y la atención del DAV.
De qué manera podría funcionar la intervención
La justificación de la inserción del DAV por parte de un EEAV es que la mejor práctica en la atención es apoyada por un enfoque consistente, informado y capacitado. Los niveles más altos de conocimiento y confianza del colocador, construidos sobre la experiencia y la competencia procesal, indican que el enfoque de EEAV tiene resultados de inserción positivos para los pacientes (Alexandrou 2014; Harnage 2012; Jackson 2012). Aunque algunos modelos de EEAV se centran en la inserción del DAV solamente, otros incluyen la atención de seguimiento, que puede incluir tareas clínicas como el reemplazo de los apósitos y la evaluación diaria para la extracción potencial. Aun con un alcance limitado de “inserción solamente”, los EEAV han informado mejores resultados para el éxito del primer intento de inserción (Carr 2010). La reducción del número de fracaso de la inserción de la aguja es una estrategia importante de prevención de las infecciones (da Silva 2010), y la misma puede reducir el estrés del paciente y la duración de la estancia hospitalaria (Barton 1998).
Repercusión del equipo de especialistas en acceso vascular sobre las complicaciones relacionadas con el dispositivo
Los catéteres intravenosos periféricos insertados mediante un enfoque de EEAV se han asociado con menos flebitis, eritema, induración e infiltración (Soifer 1998). Lo anterior puede estar relacionado con un mayor éxito del primer intento de inserción con un EEAV, debido a que los intentos de inserción múltiple se han asociado con complicaciones y fracaso (Wallis 2014). Los catéteres venosos centrales insertados mediante el enfoque de EEAV tienen pocas complicaciones iatrogénicas con informes que alcanzan sólo un 1% de inserciones que desarrollan neumotórax, punción arterial e infección posterior relacionada con el catéter (Alexandrou 2012). La reducción en las tasas de infección del torrente sanguíneo relacionadas con el catéter y las tasas de bacteriemia del DAV se han atribuido a la adopción de un enfoque de EEAV (Brunelle 2003; Legemaat 2015)
Por qué es importante realizar esta revisión
El éxito de la inserción de los dispositivos de acceso vascular y la reducción del fracaso posterior son objetivos importantes que pueden repercutir positivamente en la experiencia del paciente y el resultado clínico. Es importante comprender si el enfoque de EEAV mejora el éxito de la inserción y reduce el fracaso del DAV, las complicaciones procesales iatrogénicas y la infección relacionada con el dispositivo. Sin embargo, hasta la fecha no hay evidencia clara de la efectividad del enfoque de EEAV en comparación con el generalista en cuanto a la inserción del DAV y ninguna revisión sistemática previa sobre este tema. Aunque el EEAV en sí genera costos para pagar al personal, si se consideran los resultados adversos que pueden evitarse, los EEAV puede ser el modelo más efectivo en función de los costos. La posibilidad de establecer si los resultados clínicos del EEAV son superiores a la inserción del DAV y su tratamiento mediante un enfoque generalista es de importancia inicial para los médicos, los grupos de pacientes, los responsables de las políticas y los sistemas de asistencia sanitaria.
Objetivos
Comparar el uso de un equipo de especialistas en acceso vascular para la inserción y la atención de dispositivos de acceso vascular con un modelo de enfoque generalista para los participantes hospitalizados o de la comunidad que requieren un dispositivo de acceso vascular en cuanto al éxito de la inserción, el fracaso del dispositivo y la costo‐efectividad.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se planificó incluir todos los ensayos controlados aleatorios (ECA) que evaluaban la efectividad de los EEAV o los colocadores especialistas en cuanto a su repercusión sobre los resultados clínicos. Se excluyeron los ECA con asignación al azar por grupos, en los que el grupo representó la asignación al azar a nivel de la sala o el hospital.
Se planificó incluir ensayos clínicos controlados si no se encontraba ningún ECA. Los ensayos clínicos controlados se refieren a estudios cuasialeatorios en los que, aunque el ensayo incluye la evaluación de una intervención con un control, con la matrícula concurrente y el seguimiento de los grupos tratados con la prueba y con el control, el método de asignación no se considera verdaderamente aleatorio.
Tipos de participantes
Se incluyó a participantes hospitalizados o de la comunidad que requerían un acceso vascular. La edad no fue un factor excluyente.
Tipos de intervenciones
Equipos de acceso intravenoso/vascular o colocadores especialistas (como en el EEAV) que proporcionan la inserción o el mantenimiento (o ambos) de los DAV.
Tipos de medida de resultado
Resultados primarios
-
Éxito del primer intento de inserción (en general el éxito de la inserción se informa como un porcentaje): inserción de un CIVP en donde ocurre el retorno venoso, por donde se administra un enjuague de solución salina y el CIVP es asegurado y preparado para el uso (Riker 2011), o según lo definido por los autores del estudio; en los CVC, el número de intentos de inserción informados (en general el éxito de la inserción se informa como un porcentaje) y cuando se confirma que el extremo del CVC se encuentra en el tercio inferior de la vena cava superior (Moureau 2013), o según lo definido por los autores del estudio.
-
Eventos adversos/complicaciones relacionadas con la inserción:
-
neumotórax: lesión inadvertida a la pleura pulmonar durante la canulación de una vena grande (definido por cada estudio) (Ayas 2007);
-
punción arterial: punción inadvertida de una arteria durante la canulación de una vena grande (definido por cada estudio) (Guilbert 2008);
-
daño nervioso: daño inadvertido al nervio adyacente a la vena/arteria (definido por cada estudio) (Guilbert 2008);
-
otro: según lo definido por el autor del/de los estudio/s.
-
-
Costo según lo definido por los autores del estudio (en la moneda del país en que se originó la publicación).
Resultados secundarios
-
Tasas de fracaso prematuro del dispositivo como resultado de lo siguiente:
-
flebitis/tromboflebitis: dolor, induración y eritema con una trombosis palpable de la vena canulada (Tagalakis 2002), o según lo definido por los autores del estudio;
-
infiltración/extravasación: infiltración es la fuga no intencional de la medicación o solución no vesicante en los tejidos circundantes y la extravasación es la fuga no intencional de la medicación o la solución vesicante en los tejidos circundantes (Dougherty 2008);
-
oclusión: incapacidad de infundir el líquido en el DAV o de aspirar la sangre (Camp‐Sorrell 2007);
-
trombosis: trombosis venosa central caracterizada por la tumefacción del cuello y el brazo con dolor asociado (Ge 2012);
-
infección del torrente sanguíneo relacionada con el catéter o asociada con el catéter: infección del torrente sanguíneo confirmada por laboratorio atribuida al catéter (Chopra 2013; Maki 2006);
-
desplazamiento o extracción accidental: según lo definido por los autores del estudio.
-
-
Satisfacción del paciente: según lo definido por los autores del estudio.
-
Satisfacción del personal: según lo definido por los autores del estudio.
-
Tiempo de permanencia del DAV: en horas desde la inserción hasta la extracción.
-
Duración de la estancia hospitalaria: en días desde el ingreso al hospital hasta el alta.
Métodos de búsqueda para la identificación de los estudios
We adapted an Ovid MEDLINE search strategy to search CENTRAL, Ovid Embase, and EBSCO CINAHL and ISI Web of Science. We combined the Ovid MEDLINE search with the Cochrane Highly Sensitive Search Strategy for identifying randomized trials in MEDLINE and Embase: sensitivity and precision‐maximizing version (Lefebvre 2011). We placed no date, language, or publication restrictions. We performed our search on 7 February 2018.
Búsquedas electrónicas
We identified RCTs through literature searching with systematic and sensitive search strategies as outlined in Chapter 6 of the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). We applied no restrictions to language or publication status.
We searched the following databases for relevant trials.
-
Cochrane Central Register of Controlled Trials (CENTRAL; 2018, Issue 1) (Appendix 1)
-
MEDLINE (Ovid SP, 1966 to 7 February 2018) (Appendix 2)
-
Embase (Ovid SP, 1988 to 7 February 2018) (Appendix 3)
-
CINAHL (Cumulative Index to Nursing and Allied Health Literature) (EBSCO, 1982 to 7 February 2018) (Appendix 4)
-
ISI Web of Science (1990 to 7 February 2018) (Appendix 5)
We developed a subject‐specific search strategy in MEDLINE and used that as the basis for the search strategies in the other databases listed. Where appropriate, we expanded the search strategy with search terms for identifying RCTs.
We scanned the following trials registries for ongoing and unpublished trials (7 February 2018).
-
World Health Organization International Clinical Trials Registry Platform (WHO ICTRP) (www.who.int/trialsearch)
-
ClinicalTrials.gov (www.clinicaltrials.gov)
-
Australian and New Zealand Clinical Trials Register (www.anzctr.org.au)
-
Current Controlled Trials (www.controlled‐trials.com/mrct)
-
HKU Clinical Trials Registry (www.hkclinicaltrials.com)
-
Clinical Trials Registry ‐ India (ctri.nic.in/Clinicaltrials/login.php)
-
UK Clinical Trials Gateway (www.controlled‐trials.com/ukctr/)
We developed the search strategy in consultation with the Information Specialist.
Búsqueda de otros recursos
We scanned the reference lists and citations of included trials and any relevant systematic reviews identified for further references to additional trials. We contacted trial authors for additional information when necessary.
Obtención y análisis de los datos
Selección de los estudios
We merged all the electronically retrieved studies from individual databases into Covidence. Following this we removed any duplicate references found employing the filter using icons imports; manage imports then check duplicates. Two review authors (PC, NH) independently assessed titles and abstracts of retrieved studies for relevance. We retrieved full versions of all potentially eligible studies, which the same two review authors independently checked for eligibility. Any discrepancies between review authors were resolved either through mutual discussion, or on two occasions by consulting other review authors (CR, MC) to arbitrate.
Extracción y manejo de los datos
Two review authors (PC, NH) intended to extract data from each study using our data extraction sheet (Appendix 6). The data extraction sheet was developed in conjunction with the Cochrane Anaesthesia, Critical and Emergency Care Group, and we had planned to pilot test the first two identified studies. Both PC and NH intended to independently extract data and then perform cross‐checking for accuracy and agreement. We intended to include only studies reported in one publication. If we located studies that had been published in duplicate, we intended to maximally extract data from all relevant publications but not to duplicate data in analyses. If we believed any data were missing from the papers, we planned to contact study authors to retrieve this missing information. See Appendix 6 for more information regarding the data that we intended to extract. As we did not locate any published studies, we could not perform data extraction.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (PC, NH), intended to independently assess the risk of bias for each of the studies using the 'Risk of bias' assessment tool described in Chapter 8 of the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). The tool addresses six specific domains: sequence generation, allocation and concealment, blinding, incomplete outcome data, selective outcome reporting, and other potential sources of bias (Higgins 2011). We planned to express judgements as 'low risk', 'high risk', or 'unclear risk' of bias. We intended to resolve any disagreements by discussion; if we could not reach consensus, a third review author (CR) would arbitrate. We intended to conduct sensitivity analyses to determine whether excluding studies at high risk of bias affected the results of a planned meta‐analysis. We intended to report the 'Risk of bias' table as part of the 'Characteristics of included studies' table and present a 'Risk of bias' summary figure detailing all of the judgements made for all studies included in the review. As we did not locate any published studies, we were unable to assess the risk of bias.
Medidas del efecto del tratamiento
We intended to calculate dichotomous outcomes using risk ratio (RR) with 95% confidence intervals (CI). We intended to calculate continuous outcomes using the mean difference (MD) with 95% CI. If the results were expressed as rate data (e.g. incidence rates), we planned to calculate a rate ratio. We intended to extract data from time‐to‐event (i.e. dwell time) studies, if the estimates were presented as log‐rank or Cox proportional models. We would not analyse time‐to‐event data that were incorrectly presented as continuous data. As we did not locate any published studies, we could not measure treatment effect.
Cuestiones relativas a la unidad de análisis
Ideally, a study would be designed with participant‐level randomization and analysis, and only one device per participant (adjustment for clustering not necessary in this case). However, we expected to find studies that reported on multiple devices per participant, randomized or analysed at device level, or both, and unadjusted for clustering. We expected to find the following differences.
-
Number of devices and observed per participant: one or more than one (e.g. after the removal of the initial device the consecutive device(s) was (were) also observed).
-
Randomization methods: device level, participant level, or ward (or similar) level.
-
Unit of analysis: device level, participant level, or ward (or similar) level.
-
Analysis methods: adjusted for clustering or not adjusted for clustering.
In such cases, we intended to attempt to obtain the following from the study authors: participant‐level data or results; data or results for one device per participant; or device‐level data and perform multilevel regression to calculate the adjusted effect. We intended to combine the adjusted results in the meta‐analysis with those of participant‐level trials (using the generic inverse method) and perform sensitivity analyses (Higgins 2011). If we were unsuccessful in obtaining the additional necessary data, then we planned to exclude the study from the meta‐analysis. We excluded cluster RCTs where the cluster represents randomization at the ward or hospital level. We did not locate any published studies to assess unit of analysis.
Manejo de los datos faltantes
Whenever possible, we intended to contact the original investigators to request missing data and methodological details. If we considered that data were missing at random, we intended to analyse the available information. If we considered that data were not missing at random, we intended to analyse the available information and assess the potential impact of the missing data on the findings of the review in the Discussion section. However, we did not locate any published studies.
Evaluación de la heterogeneidad
We intended to consider clinical, methodological, and statistical heterogeneity. We planned to undertake an assessment of comparability of the studies prior to meta‐analysis. We planned to assess heterogeneity of selected studies visually and by using the Chi2 test with significance level set at P value less than 0.10. This assesses whether observed differences in results are compatible with chance alone. In addition, we planned to investigate the degree of heterogeneity by calculating the I2 statistic (an equation combining the Chi2 statistic relative to its degree of freedom). This describes the percentage of the variability in effect estimates that is due to heterogeneity rather than sampling error (chance). If studies were sufficiently similar to consider pooling, we planned to use a fixed‐effect model for low‐to‐moderate levels of heterogeneity (I2 = 0% to 50%). Where appropriate, in the absence of clinical heterogeneity and in the presence of statistical heterogeneity (I2 greater than 50%), we planned to use a random‐effects model. However, studies where heterogeneity exceeded 75% were not going to be pooled (Higgins 2011). As we did not locate any published studies, we did not need to assess heterogeneity.
Evaluación de los sesgos de notificación
We intended to use visual asymmetry on funnel plots to assess reporting biases if at least 10 studies were available for a meta‐analysis (Sterne 2011). We intended to report each outcome separately. We planned to undertake an observation of small‐study effects if required.
We did not locate any published studies to assess reporting biases.
Síntesis de los datos
We intended to enter into Review Manager 5 all trials included in the systematic review and insert and analyse quantitative data (RevMan 2014). The decision to pool data in a meta‐analysis depended upon the availability of outcome data and assessment of between‐trial heterogeneity. If we identified evidence of substantial heterogeneity (i.e. greater than 50%), we planned to explore potential causes and use a random‐effects model, and a fixed‐effect model to explore any differences between these two estimates. As no studies were included in the review, and synthesis was inappropriate, we have presented a structured narrative review in the Results of the search and Discussion sections.
Análisis de subgrupos e investigación de la heterogeneidad
If sufficient data were available, we planned to perform the following subgroup analyses.
-
Adult VAST versus paediatric VAST.
-
Device type: peripheral versus central.
-
Central device type: peripherally inserted central catheter versus CVC versus tunnelled VAD versus totally implanted.
-
VAST model: insertion only versus insertion and follow‐up care services.
-
VAST team versus individual specialists.
As we did not locate any studies, we did not undertake any subgroup analysis and investigation of heterogeneity.
Análisis de sensibilidad
We planned to initially perform a sensitivity analysis by excluding studies at high risk of bias. We intended to only include studies that were assessed as having a low risk of bias for the estimates of treatment effect in all key domains, namely adequate generation of the randomization sequence, adequate allocation concealment, and blinding of outcome assessor. We also planned to perform sensitivity analysis on:
-
size of study (fewer than 100 participants);
-
missing data (worst‐case/best‐case scenario).
'Summary of findings' table and GRADE
We intended to present the main results of the review using the principles of the GRADE system to assess the quality of the body of evidence associated with specific outcomes in our review (Guyatt 2008), and construct a 'Summary of findings' table using GRADEpro GDT software (Appendix 7) (GRADEpro GDT).
We planned to present the following specific primary outcomes of interest in the 'Summary of findings' tables.
-
First‐time insertion success.
-
Insertion‐related adverse events/complications.
-
Cost.
-
Device failure with dwell time.
-
Patient satisfaction.
-
Staff satisfaction.
-
Length of hospital stay.
We intended to present key information concerning the quality of the evidence, the magnitude of the effects of the interventions examined, and the sum of the available data for the main outcomes (Schünemann 2011a). We intended that the 'Summary of findings' tables would include an overall grading of the body of evidence related to each of the main outcomes using the GRADE approach (Schünemann 2011b). The GRADE approach appraises the quality of a body of evidence based on the extent to which one can be confident that an estimate of effect or association reflects the item being assessed. The quality of a body of evidence considers within‐study risk of bias (methodological quality), directness of the evidence, heterogeneity of the data, precision of effect estimates, and risk of publication bias (Schünemann 2011b).
Results
Description of studies
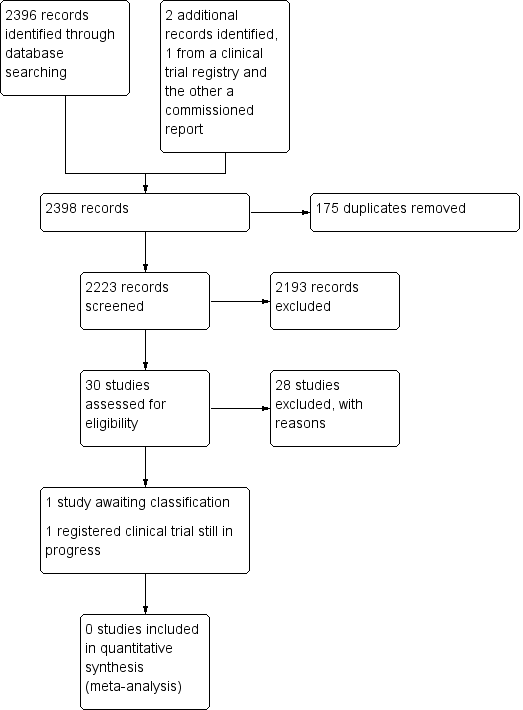
See Figure 1.
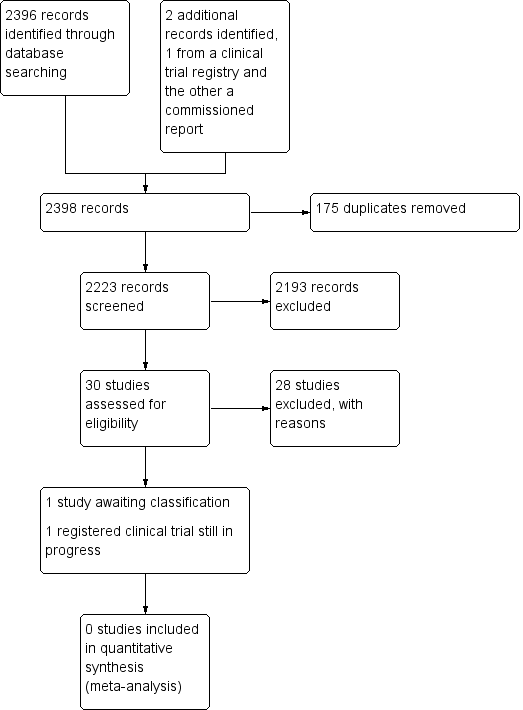
Study search flowchart.
Results of the search
We aimed to identify RCTs pertaining to VAST where the unit of randomization was the participant. We updated our search on the 7 February 2018 as per our protocol search strategy (Carr 2014).
We identified 30 studies that were potentially relevant to the interventional review question posed. We were unable to locate two papers (Tomford 1982; Ward 2000). We retrieved full‐text versions of 26 studies (Boland 2003; Casey 2003; Fong 2001; Gilbert 2016; Hammes 2015; Hockley 2007; Huraib 1994; Keohane 1983; King 2010; Larson 1984; Meier 1998; Mokrzycki 2006; Moretti 2005; Møller 2005; Nehme 1980; Neuman 1998; Puri 1982; Robinson 2005; Secola 2011; Secola 2012; Sherertz 1997; Soifer 1998; Tadokoro 2015; Taylor 2011; Tomford 1984; Treacy 2002).
We obtained one unpublished manuscript (Garate‐Echenique 2014), and we found one ongoing clinical trial (ACTRN12616001675415). Two review authors (PC, NH) independently checked the 26 full‐text papers for eligibility using the Covidence tool (Covidence), and excluded all of them. For transparency, we have provided a summary of studies assessed for full‐text review in our PRISMA flowchart as recommended (see Figure 1) (Liberati 2009).
Included studies
We included no studies in this review.
Excluded studies
We excluded 28 studies (Boland 2003; Casey 2003; Fong 2001; Gilbert 2016; Hammes 2015; Hockley 2007; Huraib 1994; Keohane 1983; King 2010; Larson 1984; Meier 1998; Mokrzycki 2006; Moretti 2005; Møller 2005; Nehme 1980; Neuman 1998; Puri 1982; Robinson 2005; Secola 2011; Secola 2012; Sherertz 1997; Soifer 1998; Tadokoro 2015; Taylor 2011; Tomford 1982; Tomford 1984; Treacy 2002; Ward 2000).
We have documented our reasons for excluding studies in the Characteristics of excluded studies table.
Studies awaiting classification
One unpublished study is awaiting classification, as the manuscript has not yet been accepted for publication, and further data analysis is pending (Garate‐Echenique 2014). See Characteristics of studies awaiting classification.
Ongoing studies
We identified one ongoing clinical trial that has not finished recruitment (ACTRN12616001675415). See Characteristics of ongoing studies.
Risk of bias in included studies
As no studies fulfilled the inclusion criteria for the review, we were unable to assess risk of bias.
Effects of interventions
As we identified no studies to include in the meta‐analysis, we were unable to generate an analysis.
Discusión
Resumen de los resultados principales
La efectividad del enfoque de EEAV para la inserción del DAV y la prevención de fracasos todavía no se ha evaluado en ensayos controlados aleatorios en los que la unidad de asignación al azar representa al participante.
Compleción y aplicabilidad general de las pruebas
Actualmente, no hay ningún ECA publicado que evalúe la eficacia del enfoque de EEAV versus generalista. Se supuso que, debido a la proliferación y la ubicuidad tanto del DAV en la asistencia sanitaria como de los diversos modelos de EEAV en uso, existirían estudios de intervención. Puede suceder que los ensayos clínicos controlados, los estudios prospectivos y las iniciativas de calidad sean suficientes para convencer a algunas instituciones de asistencia sanitaria de invertir en el concepto de EEAV. Debido a que los DAV se usan ubicuamente en la asistencia sanitaria, que el fracaso de la inserción periférica varía de un 12% a un 54% (Sabri 2013), y que las tasas de fracaso posinserción informadas alcanzan hasta un 50% (Helm 2015), no está claro por qué los investigadores del servicio de salud no han investigado este tema de forma más estricta. Dos estudios tempranos (Soifer 1998; Tomford 1984), un ECA con asignación al azar por grupos y un ensayo clínico controlado, respectivamente se centraron en los CIVP con el resultado primario de las infecciones del dispositivo, no obstante, muchos adelantos desde entonces limitan su aplicabilidad actual. Ambos estudios tuvieron lugar cuando la extracción e inserción habitual basada en el tiempo de los CIVP de reemplazo se practicaba comúnmente, no obstante, una revisión Cochrane actualmente apoya la indicación clínica de la extracción (Webster 2015). Además, la tecnología de localización de los vasos para apoyar las inserciones exitosas se informa cada vez más en la bibliografía, e incluye ecografía, transiluminadores y tecnología de infrarrojo cercano. Sin embargo, las revisiones sistemáticas y metanálisis no han demostrado un beneficio clínico abrumador en lo que se refiere al número de intentos requeridos para el éxito (Egan 2013; Heinrichs 2013; Parker 2016; Stolz 2015). El primer intento de inserción alta se ha asociado con un enfoque de EEAV (Carr 2010; Sabri 2013). Existen otros adelantos tecnológicos como los catéteres impregnados y las tecnologías de fijación que pueden ayudar a reducir las complicaciones posinserción del DAV como las infecciones (Gilbert 2016). Sin embargo, una revisión Cochrane no halló evidencia sólida para apoyar un apósito o una tecnología de fijación del dispositivo en particular para la prevención del desplazamiento del CIVP (Marsh 2015). Otros DAV, como el catéter central insertado periféricamente y el catéter venoso central agudo, carecen de evidencia proveniente de una intervención que evalúe el enfoque de EEAV, a pesar de la prevalencia cada vez mayor de un enfoque de equipo de especialistas con su uso (Chopra 2017).
Hay una ausencia de ECA publicados que evalúen la repercusión del EEAV mediante prácticas y tecnologías actuales. Esta revisión sistemática identificó un ECA presentado en un World Congress in Vascular Access en 2014; que todavía debe publicarse (Garate‐Echenique 2014). La investigación clínica desaprovechada es de interés (Glasziou 2014), pero lo que es más importante, si la evidencia que apoya un enfoque de EEAV no se publica, este hecho limita la aplicación para beneficiar a los servicios sanitarios que desean considerar la posibilidad de implementar un EEAV. Una revisión actualizada probablemente mejorará cuando se publique el trabajo de Garate‐Echenique 2014 (que evalúa un enfoque de EEAV con catéteres centrales insertados de forma periférica), y mediante las publicaciones esperadas del ECA piloto registrado por Marsh y colegas (ACTRN12616001675415).
Calidad de la evidencia
No fue posible analizar la calidad de la evidencia debido a que un estudio está en espera de clasificación (Garate‐Echenique 2014) y un ensayo en curso todavía no está completado (ACTRN12616001675415).
Sesgos potenciales en el proceso de revisión
Puede haber ocurrido sesgo de publicación si no se han publicado sólo los estudios negativos sobre este tema. Este hecho parece improbable debido a que sólo se encontró un ensayo clínico registrado, y todavía no fue publicado. Además, y en lo que se refiere a la correspondencia con Garate‐Echenique 2014, la ausencia de publicación del texto revisado puede deberse a las limitaciones de los recursos para completar las sugerencias de los autores de la revisión. Finalmente, es posible haber omitido un ensayo del EEAV representado por un sinónimo diferente. Sin embargo, este hecho es improbable debido a que dos bibliotecarios de investigación ayudaron con la estrategia de búsqueda. Un sesgo potencial es que los criterios de inclusión limitaron la revisión a los ECA en los que la unidad de asignación al azar era el participante. Sin embargo, debido a la ausencia de estudios aptos encontrados con este enfoque, existe la oportunidad de un número mayor de ECA similares sobre este tema. Se intentó realizar una búsqueda exhaustiva de los estudios, aunque el hecho de que hasta ahora no se han incorporado estudios puede ser una fuente de sesgo potencial.
Acuerdos y desacuerdos con otros estudios o revisiones
Se encontraron informes de la eficacia de un enfoque de EEAV mediante un diseño de ensayo aleatorio con asignación al azar por grupos (Tomford 1984), o estudios cuasiexperimentales (Soifer 1998). No está claro si esta y otra evidencia es suficiente para apoyar el cambio, aunque vale la pena señalar que no todos los enfoques de EEAV tienen la repercusión deseada en la reducción de las infecciones del torrente sanguíneo relacionadas con el catéter, incluso cuando se siguen rigurosamente las pautas clínicas (Secola 2012). A pesar de que un programa de evaluación de tecnologías de la salud del Reino Unido puso en marcha una investigación de los ECA que examinan la efectividad clínica y en función de los costos de la inserción de dispositivos de acceso venoso central canalizados con o sin tecnología de localización de vasos en pacientes adultos con cáncer (Boland 2003), se ha progresado poco en la evaluación de la efectividad del EEAV. Además, la encuesta más reciente sobre “especialistas en acceso vascular” informó que la práctica clínica no siempre es consistente con las recomendaciones basadas en evidencia contemporáneas (Chopra 2017). Además, la recomendación reciente para la definición de EEAV por parte de la sociedad más grande de acceso vascular (Davis 2016), quizás es una prueba más de que existe una desvinculación con este aspecto clínico de la asistencia sanitaria (Castro‐Sánchez 2014). Es concebible que los ECA fundamenten o refuten de alguna manera la evidencia sobre el EEAV.
Study search flowchart.

