Frecuencia de cambios de apósito para los dispositivos de acceso venoso central en las infecciones relacionadas con el catéter
Resumen
Antecedentes
Los pacientes ingresados en unidades de cuidados intensivos y los que presentan problemas crónicos de atención sanitaria a menudo requieren acceso vascular a largo plazo. Los dispositivos de acceso venoso central (DAVC) se utilizan para administrar fármacos intravenosos y tomar muestras de sangre. Los DAVC se cubren con un apósito y se aseguran con un adhesivo o cinta adhesiva para protegerlos de la infección y reducir el movimiento. Los apósitos se cambian cuando se ensucian con sangre o comienzan a separarse de la piel. El retiro y la aplicación repetidos de los apósitos pueden causar daño a la piel. La piel es una barrera importante que protege al cuerpo contra la infección. Los cambios de apósito menos frecuentes pueden reducir el daño cutáneo, pero no está claro si esta práctica afecta la frecuencia de infecciones relacionadas con el catéter.
Objetivos
Evaluar el efecto de la frecuencia de cambios de apósito para los DAVC sobre la incidencia de infecciones relacionadas con el catéter y otros resultados que incluyen dolor y daño cutáneo.
Métodos de búsqueda
En junio 2015, se hicieron búsquedas en: registro especializado del Grupo Cochrane de Heridas (Cochrane Wounds Group); Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL) (The Cochrane Library); Ovid MEDLINE; Ovid MEDLINE (In‐Process & Other Non‐Indexed Citations); Ovid EMBASE y EBSCO CINAHL. También se realizaron búsquedas de ensayos registrados en registros de ensayos clínicos. No hubo restricciones con respecto al idioma, la fecha de publicación ni el ámbito de estudio.
Criterios de selección
Todos los ensayos controlados aleatorios (ECA) que evaluaron el efecto de la frecuencia de cambios de apósito para los DAVC sobre la incidencia de infecciones relacionadas con el catéter en todos los pacientes en cualquier ámbito de atención sanitaria.
Obtención y análisis de los datos
Se utilizó la metodología de revisión Cochrane estándar. Dos autores de la revisión evaluaron de forma independiente los estudios para su inclusión, realizaron la evaluación del riesgo de sesgo y la extracción de datos. Cuando fue apropiado se realizó un metanálisis, de lo contrario los datos se resumieron descriptivamente cuando fueron heterogéneos.
Resultados principales
Se incluyeron cinco ECA (2277 participantes) que compararon diferentes frecuencias de cambios de apósito para los DAVC. Todos los estudios se realizaron en Europa y se publicaron entre 1995 y 2009. Los participantes se reclutaron de cuidados intensivos y de departamentos de atención del cáncer de un hospital de niños y cuatro hospitales de adultos. Los estudios utilizaron diversos apósitos transparentes y compararon un intervalo más largo entre los cambios de apósito (5 a 15 días; intervención) con un intervalo más corto entre los cambios (2 a 5 días; control). En cada estudio los participantes se siguieron hasta que el DAVC se extrajo o hasta el alta de la UCI o el hospital.
Infección hematógena relacionada con el catéter (IHRC) confirmada
Un ensayo asignó al azar a 995 pacientes que tenían insertados catéteres venosos centrales a un intervalo más largo o más corto entre los cambios de apósito y midió la IHRC. No está claro si hay una diferencia en el riesgo de IHRC entre los pacientes con intervalos largos o cortos entre los cambios de apósito (CR 1,42; intervalo de confianza [IC] del 95%: 0,40 a 4,98) (pruebas de calidad baja).
Infección hematógena relacionada con el catéter presunta
Dos ensayos asignaron al azar a 151 participantes a intervalos de apósito más largos o más cortos y midieron la IHRC presunta. No está claro si hay una diferencia en el riesgo de IHRC presunta entre los pacientes con intervalos largos o cortos entre los cambios de apósito (CR 0,70; IC del 95%: 0,23 a 2,10) (pruebas de calidad baja).
Mortalidad por todas las causas
Tres ensayos asignaron al azar a 896 participantes a intervalos de apósito más largos o más cortos y midieron la mortalidad por todas las causas. No está claro si hay una diferencia en el riesgo de muerte por cualquier causa entre los pacientes con intervalos largos o cortos entre los cambios de apósito (CR 1,06; IC del 95%: 0,90 a 1,25) (pruebas de calidad baja).
Infección en el sitio del catéter
Dos ensayos asignaron al azar a 371 participantes a intervalos de apósito más largos o más cortos y midieron la infección en el sitio del catéter. No está claro si hay una diferencia en el riesgo de infección en el sitio del catéter entre los pacientes con intervalos largos o cortos entre los cambios de apósito (CR 1,07; IC del 95%: 0,71 a 1,63) (pruebas de calidad baja).
Daño cutáneo
Un ensayo pequeño (112 niños) y tres ensayos (1475 adultos) midieron el daño cutáneo. Hubo pruebas de calidad muy baja del efecto de los intervalos largos entre los cambios de apósito en el daño cutáneo en comparación con los intervalos cortos (niños: CR de la calificación ≥ 2 en la escala de daño cutáneo 0,33; IC del 95%: 0,16 a 0,68; los datos de los adultos no se agruparon).
Dolor
Dos estudios con 193 participantes midieron el dolor. No está claro si hay una diferencia entre los cambios de apósito entre los intervalos largos y cortos en el dolor durante el retiro del apósito (CR 0,80; IC del 95%: 0,46 a 1,38) (pruebas de calidad baja).
Conclusiones de los autores
Las mejores pruebas disponibles actualmente no son concluyentes con respecto a si los intervalos más largos entre los cambios de apósito para los DAVC se asocian con más o menos infección relacionada con el catéter, mortalidad o dolor que los intervalos más cortos.
PICO
Resumen en términos sencillos
¿Con qué frecuencia se deben cambiar los apósitos en los dispositivos de acceso venoso central (DAVC) para reducir la infección relacionada con el catéter?
Antecedentes
Un dispositivo de acceso venoso central (DAVC, también conocido como un catéter venoso central) es un tubo hueco que se coloca en una vena grande con la punta situada cerca del corazón. Los DAVC permiten que los fármacos, los líquidos y los productos sanguíneos se administren directamente en la sangre y permiten tomar muestras de sangre para análisis. Una de las consecuencias negativas del DAVC puede ser una infección de la sangre que se llama infección hematógena relacionada con el catéter o IHRC, que puede ser grave e incluso potencialmente mortal. Algunos DAVC pueden permanecer insertados durante semanas, meses o años. La mayoría de los pacientes ingresados en una unidad de cuidados intensivos tendrá un DAVC insertado y a los pacientes con venas deficientes o que requieren tratamiento a largo plazo se les ofrecerá un DAVC. Los apósitos se colocan sobre el sitio de inserción del catéter donde se introduce en la vena, generalmente en el tórax, el cuello o el brazo, para proteger la piel circundante. Los apósitos ayudan a impedir las infecciones a partir de la colocación e impiden que el DAVC se mueva. Los apósitos se cambian cuando se ensucian o comienzan a caerse. Los cambios de apósito frecuente pueden causar daño a la piel circundante, por lo que los pacientes pueden presentar dolor o daño en la piel cuando el apósito se retira. El cambio del apósito con frecuencia también es costoso.
Se deseaba determinar si hubo ventajas o desventajas con los intervalos más largos o más cortos entre los cambios de apósito para los DAVC. Algunos hospitales o instalaciones de atención sanitaria recomiendan cambiar los apósitos cada pocos días, mientras otros mantienen los apósitos en el lugar por más tiempo.
Pregunta de la revisión
Se revisaron las pruebas disponibles acerca del efecto de diferentes intervalos entre los cambios de apósito para los DAVC y si tuvieron un efecto sobre el riesgo de IHRC y otras complicaciones. Se encontraron cinco estudios que proporcionan información para la revisión.
Características de los estudios
Los cinco estudios incluidos en la revisión se publicaron entre 1995 y 2009 e involucraron a un total de 2277 participantes. Estuvieron representados cuatro países (dos estudios de Francia y uno de Italia, otro de Suecia y otro de la República Checa). En un estudio participaron niños y los restantes cuatro ensayos sólo incluyeron adultos. Cuatro de los estudios incluyeron a pacientes con cáncer y uno incluyó a pacientes de una unidad de cuidados intensivos.
Los intervalos entre los cambios de apósito se clasificaron como corto (2 a 5 días) en el grupo de cambios de apósitos con mayor frecuencia y largo (5 a 15 días) en el grupo de cambios con menor frecuencia. Todos los estudios utilizaron apósitos transparentes hechos de materiales sintéticos y dos estudios utilizaron gasa (un apósito de tela que no se adhiere a la piel) asegurado con cinta cuando la piel estaba dañada. Los apósitos para los DAVC se monitorizaron diariamente en todos los ensayos y los participantes se siguieron al menos hasta que se extrajo el DAVC o hasta el alta. En un estudio el fabricante proporcionó uno de los productos, pero no tuvo influencias en el diseño ni en cómo se analizaron e informaron los resultados.
Resultados clave
Las pruebas actuales no están claras acerca de si la frecuencia de cambios de apósito para los DAVC influye en el riesgo de IHRC o muerte. De interés particular para los pacientes son los problemas que se pueden asociar con el apósito en sí, como el dolor cuando se retiran y el daño de la piel que el apósito puede causar. No se encontraron pruebas claras de que el dolor, que se evaluó diariamente, estuviera afectado por la frecuencia de cambios de apósito.
Calidad de la evidencia
La calidad de las pruebas fue muy baja o baja. La calidad de las pruebas se disminuyó debido a que los estudios fueron pequeños y pocos, los diseños de los estudios fueron deficientes y a las diferencias en los resultados entre los estudios. Todavía se necesitan estudios mejor diseñados para mostrar si el intervalo más largo o los intervalos más cortos entre los cambios de apósito son más efectivos para prevenir las infecciones relacionadas con el catéter, la mortalidad, el daño cutáneo, el dolor debido al retiro de los apósitos, la calidad de vida y el costo.
Este resumen en términos sencillos se actualizó el 10 junio 2015.
Conclusiones de los autores
Summary of findings
| Patient or population: patients with a central venous access device | ||||||
| Outcomes | Relative effect | Anticipated absolute effects* (95% CI) | Quality of the evidence | What happens | ||
| Without longer interval (5 ‐ 15 days) | With longer interval (5 ‐ 15 days) | Difference | ||||
| Catheter‐related blood stream infection (CRBSI) | RR 1.42 | Study population | ⊕⊕⊝⊝ | Longer intervals between dressing changes may have little or no effect on catheter‐related blood stream infection | ||
| 8 per 1000 | 12 per 1000 | 4 more per 1000 | ||||
| All‐cause mortality | RR 1.06 | Study population | ⊕⊕⊝⊝ | Longer intervals between dressing changes probably have little or no effect on death from any cause | ||
| 354 per 1000 | 375 per 1000 | 21 more per 1000 | ||||
| Skin damage Follow up: unclear | Not estimable | Skin damage was reported in four studies. Two provided data but their results were not combined due to inconsistency of size and direction of the effects. One study in children found less skin damage in the longer interval group (8/56) compared with the shorter interval group (24/56). Rates of skin damage in one study in adults were similar (7/39 in longer interval versus 6/42 in shorter interval).9 | ⊕⊝⊝⊝ | It is uncertain whether longer (compared with shorter) intervals between dressing changes reduce skin damage | ||
| Pain Follow up: unclear | RR 0.80 | Study population | ⊕⊕⊝⊝ | It is uncertain whether longer (compared with shorter) intervals between dressing changes affect pain on dressing removal | ||
| 347 per 1000 | 278 per 1000 | 69 fewer per 1000 | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded for risk of bias due to lack of blinding of participants and personnel and for a probable unit of analysis error (individual participants randomised but numbers of infections reported) 2 Downgraded for serious imprecision: result consistent with a reduction in CRBSI or an almost 5 fold increase 3 Downgraded for risk of bias due to lack of blinding of participants and personnel 4 Downgraded for imprecision: result consistent with a 10% reduction in mortality or a 25% increase 5 Downgraded twice for serious risk of bias: risk of performance bias due to lack of blinding of participants and personnel; different dressings were used in response to skin damage 6 Downgraded for inconsistency: experimental and control groups were different between studies and frequency of dressing changes overlapped between longer and shorter groups 7 Downgraded for imprecision 8 Downgraded for risk of bias: blinding of outcome assessment not described 9 Data from two additional RCTs could not be extracted and used within the analysis. One study presented toxicity on a 5‐point scale and reported no differences between groups. We are unable to use the data from the fourth study due to the 2 x 2 factorial design. | ||||||
Antecedentes
Ver glosario de términos en el Apéndice 1.
Descripción de la afección
Los dispositivos de acceso venoso central (DAVC), también llamados habitualmente catéteres venosos centrales, se insertan cuando un paciente requiere acceso venoso durante un período prolongado. Estos dispositivos se utilizan generalmente en los pacientes ingresados en unidades de cuidados intensivos, en los pacientes con enfermedades oncológicas y neoplasias hematológicas y otros problemas de salud crónicos. Los DAVC se utilizan para administrar fármacos inyectables que incluyen quimioterapia e inmunosupresión, líquidos, productos sanguíneos, nutrición parenteral total y para la toma de muestras de sangre.
La porción externa del DAVC puede estar parcialmente tunelizada debajo la piel o no. Los catéteres no tunelizados son los catéter en los que el sitio de inserción está directamente encima de la entrada en la vena (CNSA 2007); son para uso a corto plazo y se pueden situar en las venas yugulares, subclavias o femorales (Hayden 2005). Los catéteres centrales periféricamente insertados (CCPI) también son no tunelizados y generalmente se insertan en la circulación central de una vena periférica en la parte superior del brazo y pueden permanecer insertados durante meses (Gabriel 2005; Hayden 2005; RNAO 2005). Los DAVC tunelizados se implantan quirúrgicamente y se coloca una sección del catéter en un túnel subcutáneo entre el sitio de entrada, que es cubierto por una cicatriz, hasta la vena y el sitio de salida de la piel (CNSA 2007), y se colocan habitualmente en la vena cava superior.
Los DAVC se cubren con un apósito y se aseguran con otro dispositivo de seguridad o adhesivo cutáneo como una cinta o película adhesiva transparente, para prevenir la infección y el movimiento (Hunt 1997; Wilson 2006 y Elkabir 2001; Rippon 2007, respectivamente). Están disponibles productos más nuevos que combinan la función de apósito y de aseguramiento. La aplicación y el retiro repetidos de los adhesivos o cintas adhesivas y apósitos del mismo sitio pueden causar daño cutáneo al lacerar la piel, es decir, al separar la capa córnea superficial, lo que puede provocar el desarrollo de reacciones inflamatorias cutáneas, edema y dolor (Cutting 2008).Los sitios de entrada y salida de los DAVC se inspeccionan visualmente a diario para detectar signos de infección, lo que puede requerir el retiro del apósito. Los apósitos se reemplazan si se aflojan, ensucian o humedecen. Los cambios frecuentes de apósito pueden repercutir sobre la integridad de la piel alrededor de los sitios de entrada y salida del DAVC. Si se compromete la integridad de la piel se pueden afectar las tasas de infección relacionada con el catéter (IRC), que incluye la IHRC.
Descripción de la intervención
La intervención de interés en esta revisión es la frecuencia de cambios de apósito. Los adhesivos o las cintas adhesivas están diseñados para unirse a la piel en diversas condiciones como zonas de flexión, temperaturas cambiantes, en presencia de transpiración y de humedad externa, pero también deben ser fáciles de despegar para asegurar un malestar y traumatismo mínimos (Karwoski 2004). La elección de los apósitos y la frecuencia de los cambios depende de los protocolos de práctica clínica, y las preferencias de los pacientes y los médicos (CNSA 2007; Gillies 2003; O'Grady 2011). El consenso general es que los apósitos de gasa se cambien cada 48 horas (CNSA 2007; Hadaway 2003; O'Grady 2011; Rosenthal 2003; RNAO 2005), y los apósitos transparentes semipermeables cada siete días, o antes si la integridad de los apósitos está comprometida o hay sangre debajo del apósito (Camp‐Sorrell 2004; CNSA 2007; Loveday 2014; Hadaway 2003; INS 2011; IVNNZ 2012; O'Grady 2011; Rosenthal 2003; RNAO 2005).
De qué manera podría funcionar la intervención
Los DAVC se utilizan habitualmente en los pacientes ingresados en cuidados intensivos y en los diagnosticados con enfermedades crónicas y cáncer. Estos pacientes suelen estar inmunocomprometidos y los procesos curativos disminuyen debido a la enfermedad o al tratamiento (Cutting 2008; Lotti 1998). La piel proporciona protección como una barrera a la infección (Tortura 2000), por lo que mantener su integridad es particularmente importante en estos pacientes. Los regímenes de quimioterapia y radiación pueden provocar cambios cutáneos adversos (DeSpain 1992; Glean 2001; Hopewell 1990). Otros pacientes con riesgo particular de daño cutáneo son las personas de edad avanzada, los recién nacidos y los niños pequeños que, por la naturaleza de la edad, tienen la piel frágil (Hollingworth 2009) y los pacientes con factores relacionados con la enfermedad asociados con cambios dermatológicos (Cutting 2008). Retirar constantemente los adhesivos o cintas adhesivas para cambiar los apósitos puede agravar aún más la piel ya lesionada (Hollingworth 2009). Por lo tanto, la reducción de la frecuencia de cambios de apósito puede disminuir el daño cutáneo, el dolor, los costos, la incidencia de colonización de la piel y la posibilidad de IRC. Existe el riesgo teórico de que los apósitos transparentes aumenten la humedad superficial, lo que puede dar lugar a mayor colonización microbiana en el sitio del catéter y así aumentar el riesgo de IRC(Wille 1993). Por lo tanto, la prolongación del intervalo entre los cambios de apósito puede aumentar la infección debido a mayor colonización de la piel debajo del apósito.
Por qué es importante realizar esta revisión
Hay una falta de pruebas claras en cuanto a la frecuencia óptima de cambios de apósito para los DAVC. Las guías clínicas han influido sobre el consenso general alrededor del momento de los cambios de apósito para los DAVC, pero las guías mismas se basan en pruebas limitadas. Por ejemplo, las recomendaciones en las guías de los Centers for Disease Control and Prevention (CDC) indican solamente que los DAVC tunelizados con sitios bien cicatrizados quizás no requieran apósitos (O’Grady 2011), pero no hay recomendaciones acerca de frecuencia de cambios antes de que los sitios cicatricen. Los pacientes diagnosticados con cáncer son particularmente vulnerables al daño cutáneo debido al tratamiento que reciben (Cutting 2008; Lotti 1998). La extensión del tiempo entre los cambios de apósito puede reducir el daño y también reducir los costos asociados. Sin embargo, todavía no está claro si la prolongación del tiempo entre los cambios da lugar a otras complicaciones, como a un mayor riesgo de infección hematógena. Examinar los estudios de investigación existentes para determinar con qué frecuencia se deben cambiar los apósitos que se utilizan para proteger los DAVC. El interés principal se centró en la incidencia de IRC, pero también se considerarán resultados como el dolor y el daño cutáneo.
Objetivos
Evaluar el efecto de la frecuencia de cambios de apósito para los DAVC sobre la incidencia de IRC y de otros resultados que incluyen el dolor y el daño cutáneo.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Ensayos controlados aleatorios (ECA) que evalúan el efecto de la frecuencia de cambios de apósito para los DAVC sobre la incidencia de IRC. Se excluyeron los estudios que compararon diferentes productos de apósito y los estudios en los que la frecuencia de cambios de apósito no fue la única diferencia sistemática entre los brazos de tratamiento, ya que se requirió un enfoque explícito sobre la frecuencia de cambio del mismo tipo de apósito. Los ensayos controlados aleatorios grupales, los ensayos cuasialeatorios y los ensayos cruzados (crossover) no se incluyeron para disminuir el sesgo potencial de acuerdo con Reeves 2011.
Tipos de participantes
Participantes de cualquier edad que requerían un DAVC en cualquier ámbito de atención sanitaria o comunitario.
Tipos de intervenciones
Ensayos que compararon cualquier frecuencia de cambio del mismo tipo de apósito para el aseguramiento de un DAVC.
Tipos de medida de resultado
Resultados primarios
-
Incidencia de infección hematógena relacionada con el catéter (IHRC), definida como bacteriemia o fungemia en un paciente con un catéter intravascular, con al menos un hemocultivo positivo de una vena periférica, manifestaciones clínicas de infección (es decir, fiebre, escalofríos o hipotensión) y ninguna fuente evidente de infección hematógena excepto el catéter. Uno de los siguientes debe estar presente para un diagnóstico positivo: un cultivo semicuantitativo (> 15 unidades formadoras de colonias (UFC)/ segmento de catéter) o cuantitativo (> 10³ UFC/segmento de catéter) positivo a partir de un segmento del catéter en el que el mismo microorganismo (especie y antibiograma) es aislado del segmento del catéter y de la sangre periférica (CDC 2002).
-
Incidencia de IHRC presunta, como la describió el investigador del ensayo.
-
Mortalidad por todas las causas.
Resultados secundarios
-
Incidencia de infección en el sitio de entrada y salida del catéter, como la describió el investigador del ensayo.
-
Daño cutáneo, mediante una herramienta de evaluación (como la Eastern Cooperative Oncology Group Common Toxicity Criteria for Skin (ECOG 2007; ver Apéndice 2).
-
Dolor, mediante cualquier medida o escala validada descrita por el investigador del ensayo.
-
Calidad de vida, mediante cualquier medida o escala validada descrita por el investigador del ensayo.
-
Coste
Results
Description of studies
See Characteristics of included studies, Characteristics of excluded studies and Characteristics of studies awaiting classification.
In this review comparisons were grouped by longer duration between dressing changes versus shorter duration between dressing changes with the shorter duration treated as the control group as this is considered standard practice by the trial authors.
Results of the search
The electronic search identified 471 titles. Of these, 453 were excluded by an examination of the titles and abstracts: two were duplicates; 136 were excluded because they did not contain information about CVADs; and 315 compared different dressings or were on other topics. The remaining 18 full texts were retrieved and reviewed. Of these, 10 did not meet the inclusion criteria and were excluded (see Characteristics of excluded studies). Five published RCTs met the inclusion criteria (Benhamou 2002; Engervall 1995; Rasero 2000; Timsit 2009; Vokurka 2009), and three were supplementary references to included papers (see Criteria for considering studies for this review and Characteristics of included studies and Figure 1).
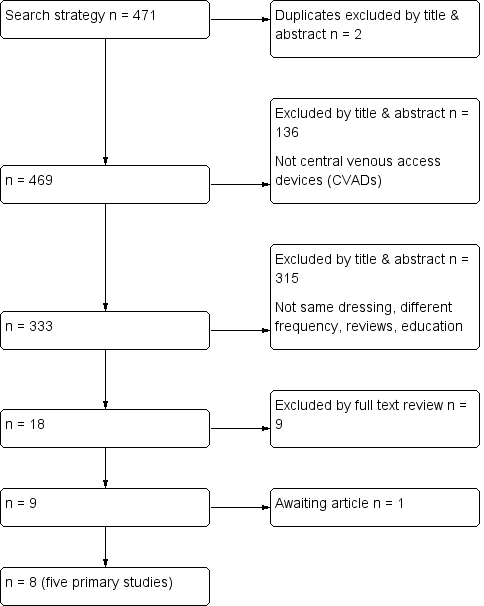
Flow diagram of included and excluded studies
A search of the clinical trials registers did not identify any additional trials. Only one study had been pre‐registered (Timsit 2009).
The reference lists of all retrieved and relevant publications were searched. One study was considered to be relevant but was not available through library resources (Fessard 1994). Attempts to contact the author and locate the journal are continuing.
Included studies
Types of patients
The five trials involved a total of 2277 participants, with the totals in individual trials ranging from 32 to 1653. One study involved children (Benhamou 2002), and the remaining four included adults only (Engervall 1995; Rasero 2000; Timsit 2009; Vokurka 2009). Two studies were set in a bone marrow transplant unit (Benhamou 2002; Rasero 2000), two studies consisted of patients undergoing treatment for a haematological malignancy (Engervall 1995; Vokurka 2009), and one study recruited patients receiving treatment in intensive care (Timsit 2009). Four countries were represented (two studies from France and one each from Italy, Sweden, and the Czech Republic). All studies were conducted in acute in‐patient settings. Patients were excluded from the studies if their skin was already damaged (Benhamou 2002; Rasero 2000; Vokurka 2009); were having treatment that would make them more susceptible to skin damage, such as the chemotherapeutic drug busulphan‐thiotepa (Benhamou 2002), or radiation to the chest (Vokurka 2009); or if they had allergies to polyurethane dressings (Rasero 2000; Timsit 2009; Vokurka 2009), chlorhexidine (Timsit 2009), or disinfectant (Vokurka 2009).
Types of interventions
Time frames for dressing changes varied between 2 and15 days. One study planned to compare 15‐day and 4‐day dressing changes for tunnelled catheters (Benhamou 2002). CVAD dressings were monitored on a daily basis in all trials and patients were followed up until the CVAD was removed or until discharge as a minimum. However, in this study there were a large number of protocol violations, that is, dressings were changed on days other than the day indicated in the protocol. In the 15‐day group, only 67 (17%) of the 365 dressing were changed on day 15 and, in the 4‐day group, 516 (76%) of the 678 dressings were changed on the correct day. This meant that dressing changes in the 15‐day group were actually changed, on average, every eight days and, in the 4‐day group, every four days. Reasons for the protocol violations included soiled and dislodged dressings and problems with the catheter that required the dressing to be removed. Two studies compared once versus twice‐weekly dressing changes for tunnelled CVADs (Engervall 1995; Timsit 2009), two studies compared once versus twice‐weekly dressing changes for non‐tunnelled CVADs (Timsit 2009; Vokurka 2009), and one study compared 5‐day versus 10‐day dressing changes for tunnelled CVADs and 2‐day versus 5‐day dressing changes for non‐tunnelled CVADs (Rasero 2000). Again however, reflecting the reality of pragmatic research in clinical settings, many of the dressings were not changed according to the group schedule. In the tunnelled CVAD 10‐day group 9.6% were not changed on the correct day, while in the tunnelled CVAD 5‐day group the proportion was 8.0%; in addition 6.8% of non‐tunnelled CVCs in the 5‐day group were not changed as scheduled and in the non‐tunnelled CVC 2‐day group the rate was 12.5%.
The dressings were applied under controlled conditions in all groups. Three studies stated that nurses were responsible for the dressing changes (Benhamou 2002; Engervall 1995; Rasero 2000). Four studies used Tegaderm (3M, St Paul, USA) dressings (Benhamou 2002; Engervall 1995; Rasero 2000; Timsit 2009), and one study used Bioclusive (Johnson and Johnson, New Jersey, USA; Vokurka 2009). One study used chlorhexidine gluconate‐impregnated sponges (Biopatch, Ethicon, New Jersey, USA) around the entry or exit site of the CVAD under the dressings (Timsit 2009).
Three studies used the same dressings throughout the period of observation. Two studies used different dressings that depended upon skin damage. One study used a Tegaderm (3M) covering a sterile gauze for grade 0 to 1 skin damage (48/56; 85% in the 15‐day group and 32/56; 57% in the 4‐day group), sterile gauze with Mefix for grade 2 to 3 skin damage (7/56; 13% in the 15‐day group and 23/56; 41% in the 4‐day group) and sterile gauze with tape for grade 4 skin damage (1/56; 2% in both the 15‐ and 4‐day groups; Benhamou 2002). The other study used a Tegaderm (3M) for undamaged skin or an exit site with mild erythema, but if the exit site had extensive erythema or other signs of local infection then the dressings were changed daily using a gauze dressing moistened with 10% ethanol with aluminium acetotartrate 10% until the erythema had disappeared, at which point the patient was returned to the allocated group (Engervall 1995). Patients in the once‐weekly group had more extra dressings due to erythema compared to the twice‐weekly group (3%; 0 to 91% once‐weekly group; 0%; 0 to 17% twice‐weekly group; P value 0.08 expressed as extra dressings days per CVAD days).
Skin decontamination varied between the groups. Two studies used the same antiseptic solution to clean the skin before the insertion of the CVAD and at dressing changes; one study used an alcohol‐based povidone‐iodine solution (Timsit 2009); and one used povidone‐iodine solution; whether the antiseptic was alcohol‐based was unclear (Vokurka 2009). One study used a 0.5% alcohol based chlorhexidine solution during insertion and at dressing changes, but changed to aqueous‐based povidone‐iodine if the skin became damaged (Benhamou 2002). One study did not describe skin decontamination that occurred prior to CVAD insertion but used 70% ethanol at dressing changes (Engervall 1995). One study did not mention which antimicrobial solution was used for skin decontamination (Rasero 2000).
Types of outcomes
Only one trial used a standard definition for confirmed CRBSI (Timsit 2009), two trials reported blood culture results (Benhamou 2002; Vokurka 2009), and one study reported blood culture and CVAD‐tip culture results separately (Engervall 1995). Blood cultures were performed on clinical suspicion of infection or determined by a temperature threshold stipulated by each study author. Three studies provided information about suspected CRBSI but these studies used different definitions (Benhamou 2002; Engervall 1995; Timsit 2009): Benhamou 2002 did not provide a definition; Engervall 1995 defined suspected CRBSI as not responding to antibiotics; and Timsit 2009 had an investigator blinded to the study group review the patient's case including the medical chart in order to perform an independent blinded review. In all five studies, catheter‐site infection was defined by skin colonisation and additionally in three studies by local signs of catheter‐site infection such as the presence of inflammation, erythema, tenderness, swelling or discharge (Benhamou 2002; Engervall 1995; Timsit 2009). Two studies measured pain: Benhamou 2002 used categories of none, moderate or severe; and Vokurka 2009 used a visual analogue score ranging from 0 to 10 (0: no pain, 5: moderate pain, 10: severe pain). No study measured quality of life. Two studies measured cost (Rasero 2000; Timsit 2009).
In the Timsit 2009 trial, a 2 x 2 factorial design was used, in which participants were randomised to a 3‐ or 7‐day dressing change and to a dressing alone or with chlorhexidine gluconate‐impregnated sponge (CHGIS). They also combined arterial and central catheters in their analysis. The authors were contacted and provided information based on central catheters only and reported separately for the CHGIS and non‐CHGIS groups. For our analysis we have included only the non‐CHGIS group, to maintain consistency with other trials.
Excluded studies
The Table of Characteristics of excluded studies specifies our reasons for excluding 10 studies. One was a systematic review (Zitella 2003); three studies compared different dressings (Davidson 1986; Hagerstrom 1994; Lucas 1996); one was a study protocol (Bystricka 2004); one was a letter to the editor commenting on a study of dressings (Dickerson 1989); in three studies the frequency of dressing change was not the only systematic difference between treatment groups (Powell 1985; Samsoondar 1985; Young 1988); and one was a cluster RCT (Ishizuka 2011).
Risk of bias in included studies
See the 'Risk of bias' tables in the Characteristics of included studies section and Figure 2; Figure 3; Table 1 and Table 2.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies

Risk of bias summary: review authors' judgements about each risk of bias item for each included study
| CRBSI | Not applicable | Not applicable | Not applicable | High risk | Not applicable |
| Suspected CRBSI | High risk | High risk | Not applicable | Not applicable | Not applicable |
| All‐cause mortality | Low risk | Low risk | Not applicable | Low risk | Not applicable |
| Catheter‐site infection | High risk | High risk | High risk | High risk | High risk |
| Skin damage | High risk | Not applicable | High risk | High risk | High risk |
| Pain | HIgh risk | Not applicable | Not applicable | Not applicable | High risk |
| Quality of life | Not applicable | Not applicable | Not applicable | Not applicable | Not applicable |
| Cost | Not applicable | Not applicable | High risk | Not applicable | Not applicable |
| CRBSI | Not applicable | Not applicable | Not applicable | Low risk | Not applicable |
| Suspected CRBSI | Unclear risk | Unclear risk | Not applicable | Not applicable | Not applicable |
| All‐cause mortality | Low risk | Low risk | Not applicable | Low risk | Not applicable |
| Catheter‐site infection | Unclear risk | Unclear risk | Unclear risk | Low risk | Unclear risk |
| Skin damage | Unclear risk | Not applicable | Unclear risk | Unclear risk | Unclear risk |
| Pain | Unclear risk | Not applicable | Not applicable | Not applicable | Unclear risk |
| Quality of life | Not applicable | Not applicable | Not applicable | Not applicable | Not applicable |
| Cost | Not applicable | Not applicable | Unclear risk | Not applicable | Not applicable |
Allocation
Random sequence generation
Three studies used computer‐generated lists to generate the allocation sequence (Benhamou 2002; Timsit 2009; Vokurka 2009). One study used manually mixed envelopes (Engervall 1995). One study did not describe how the random sequence was generated (Rasero 2000).
Allocation concealment
Vokurka 2009 used computer software to conceal the allocation of trial patients into individual groups. We contacted the trialists of Engervall 1995 who stated that they had used randomisation envelopes. The other three studies did not describe how the allocation was concealed (Benhamou 2002; Rasero 2000; Timsit 2009).
Blinding
Blinding of participants and personnel
None of the studies was able to blind participants or staff involved in direct care from identifying the allocated intervention due to the nature of the intervention.
Blinding of outcome assessment
Timsit 2009 mentioned blinding of outcome assessment, stating that staff involved in analysing catheter cultures and reviewing CRBSI were blinded to the study groups. It was unclear in the remaining four trials whether outcome assessors were blinded (Benhamou 2002; Engervall 1995; Rasero 2000; Vokurka 2009).
Incomplete outcome data
A flow chart was provided by Timsit 2009 that included the numbers of patients screened, excluded, randomised to each group and withdrawals and reasons for exclusions from the per‐protocol analysis. Four studies accounted for all randomised participants and their withdrawal from each group (Benhamou 2002; Engervall 1995; Rasero 2000; Vokurka 2009). Two studies reported sample size calculations and used an intention‐to‐treat analysis (Benhamou 2002; Timsit 2009). Two studies presented results per patient (Benhamou 2002; Vokurka 2009). Two studies presented results per catheter and per patient (Engervall 1995; Timsit 2009). One study presented results per dressing and per patient (Rasero 2000). Overall, reported attrition rates were low and well balanced. There was a proportionally higher attrition rate in one arm of the Timsit 2009 trial, but losses were marginal and unlikely to have had an impact on outcomes.
Four studies monitored the CVAD sites closely and dressings were changed if they were loose or soiled (Benhamou 2002; Rasero 2000; Timsit 2009; Vokurka 2009). This meant that approximately one‐third of the participants had additional dressing changes that constituted protocol violations. These violations were reported in the results.
Selective reporting
A study protocol was available for one study (Timsit 2009). All other authors provided results for outcomes mentioned in their published methods section (Benhamou 2002; Engervall 1995; Rasero 2000; Vokurka 2009).
Other potential sources of bias
Benhamou 2002 and Engervall 1995 varied their dressing protocol according to the grade of skin damage. The interim analysis in the Engervall 1995 study showed no statistical significance for the rates of the primary outcome between groups, so the study was stopped and the secondary outcomes analysed. Rasero 2000 did not present baseline data. In one study, the manufacturer provided one of the products but they had no influence in the design or how the results were analysed and reported (Timsit 2009).
Effects of interventions
Primary outcomes
Confirmed catheter‐related bloodstream infection (995 central venous catheters)
Only one study (Timsit 2009), that had uncertain risk of bias for allocation concealment, reported confirmed CRBSI as per our protocol. There was no clear evidence of a difference between groups for this outcome (RR 1.42; 95% CI 0.40 to 4.98; Analysis 1.1). LOW QUALITY EVIDENCE (downgraded for risk of bias and imprecision): (summary of findings Table for the main comparison).
Suspected catheter‐related bloodstream infection (151 participants)
We were able to extract data from two studies that reported suspected CRBSI (Benhamou 2002; Engervall 1995). Benhamou 2002 stated that no CVADs were removed due to suspicion of CRBSI. In the Engervall 1995 trial 6/20 (30%) of CVADs were removed in the once‐weekly group and 4/19 (21%) in the twice‐weekly group due to suspected CRBSI (RR 0.70; 95% CI 0.23 to 2.10; Analysis 1.2). Both studies were at uncertain risk of bias for allocation concealment, blinding of outcome assessment and selective reporting. There was no clear evidence of a difference between the groups for this outcome. LOW QUALITY EVIDENCE (downgraded for risk of bias and imprecision).
All‐cause mortality (896 participants)
Three studies at uncertain risk of bias, included information about all‐cause mortality (Benhamou 2002; Engervall 1995; Timsit 2009). It was possible to combine the data from all these studies; the studies were homogenous so the fixed‐effect model was used for data synthesis (I² = 0%). There was no clear difference in all‐cause mortality between longer (5‐15 days) and shorter (2‐5 days) time intervals between dressing changes (RR 1.06; 95% CI 0.90 to 1.25; Analysis 1.3). LOW QUALITY EVIDENCE (downgraded for risk of bias and imprecision): (summary of findings Table for the main comparison).
Secondary outcomes
Catheter‐site infection (371 participants)
All five studies reported catheter‐site infection but in a variety of different ways. Benhamou 2002 and Rasero 2000 reported the proportions of participants developing a catheter‐site infection. Engervall 1995 reported the rate of exit site infections per 100 CVAD days; Vokurka 2009 reported positive skin swabs and Timsit 2009 reported rates of skin colonisation, Data from the two studies (Benhamou 2002; Rasero 2000) that reported risk of catheter‐site infection in a similar way were pooled using a fixed effect model (I2 = 0%). There was no clear evidence of a difference in the risk of catheter‐site infection rate between longer (5‐15 days) and shorter (2‐5 days) time intervals between dressing changes (RR 1.07; 95% CI 0.71 to 1.63; Analysis 1.4). LOW QUALITY EVIDENCE (downgraded for risk of bias and imprecision).
Engervall 1995 reported 1.6 exit site infections per 100 CVAD days (median, range 0 to 13.3) in the longer interval (less frequent) group compared with 0 per 100 CVAD days (median, range 0 to 9.1) in the short interval (more frequent) group. Vokurka 2009 reported 13 positive skin swabs across both treatment groups but did not report by group. We contacted the trialists of Timsit 2009 but they were unable to provide per patient data. The Timsit 2009 study reported catheter‐site infection rates per catheter rather than by patient in their published paper.
Consequently it remains unclear whether longer or shorter intervals between dressing changes for CVADs influences the risk of catheter‐site infection.
Skin damage (1587 participants)
Skin damage was reported in four studies (Benhamou 2002; Rasero 2000; Timsit 2009; Vokurka 2009). Data from two trials were included in the forest plot (Benhamou 2002; Vokurka 2009). Results were highly heterogenous (I² = 78%), probably due to different scales being used to assess skin damage and dissimilar time frames for assessment, so we did not pool the data. One of these trials (Benhamou 2002) included only children and showed that fewer participants in the longer interval group (8/56) scored grade ≥ 2 on the skin damage scale compared with 24/56 in the shorter interval group (RR 0.33; 95% CI 0.16 to 0.68; P value 0.012; Analysis 1.5). There was no clear evidence of a difference in rates of skin damage between long and short intervals in adult patients (Vokurka 2009) (RR 1.26; 95% CI 0.46 to 3.41; Analysis 1.5. VERY LOW QUALITY EVIDENCE (downgraded for risk of bias, imprecision and heterogeneity).
Two trials could not be included in the skin damage forest plot. In the Rasero 2000 trial toxicity was graded on a 5‐point scale, but there were no reported differences between groups. We are unable to use the data from the Timsit 2009 trial due to the 2 x 2 factorial design.
Pain
Pain was assessed on a daily basis in two studies (Benhamou 2002; Vokurka 2009). The maximum intensity of pain reported was analysed. When data from the two studies were combined there was no clear evidence of a difference in pain however this comparison is underpowered (RR 0.80; 95% CI 0.46 to 1.38; Analysis 1.6; Benhamou 2002; Vokurka 2009). This was rated as LOW QUALITY EVIDENCE (downgraded for risk of bias and imprecision): (summary of findings Table for the main comparison). The pain classification systems used are detailed in the Characteristics of included studies. The pain data were dichotomised on the basis of a judgement that any pain experienced and reported by the patient was clinically significant.
Quality of life
None of the studies reported quality of life.
Cost
Rasero 2000 reported the costs of nursing time and dressings and stated that less frequent dressing changes would reduce costs by 400% in the tunnelled CVAD group and by 50% in the non‐tunnelled CVAD group when compared to the standard practice of changing dressings every second day. The monetary figures presented in the text and the table were different. Several attempts have been made to contact the authors for clarification but without success.
Discusión
Resumen de los resultados principales
Esta revisión sistemática incluyó cinco ECA (2277 participantes) con riesgo de sesgo incierto o alto. Se evaluaron los efectos de prolongar la frecuencia de cambios de apósito para los DAVC sobre la incidencia de IHRC confirmada, IHRC presunta, mortalidad por todas las causas, infección en el sitio de entrada y salida del DAVC, daño cutáneo, dolor, calidad de vida y costo. Todos los estudios utilizaron apósitos transparentes de poliuretano, que a menudo son favorecidos sobre los apósitos de gasa porque permiten monitorizar visualmente el sitio del catéter para detectar signos de infección sin el retiro del apósito. Los intervalos más largos de los cambios de apósito variaron de 5 a 15 días y los intervalos más cortos desde 2 a 5 días. No fue posible obtener datos que facilitaran el análisis a nivel de paciente en lugar del catéter de dos de los autores de los ensayos. Rasero 2000 presentó datos para cada cambio de apósito yTimsit 2009 informó datos por catéter. Uno de los autores con los que se estableció contacto para solicitar información adicional ya no contaba con los datos en un formulario accesible debido a los adelantos tecnológicos (Engervall 1995). La mayoría de la bibliografía publicada en este campo no fue elegible para esta revisión ya que comparó el efecto de diferentes apósitos sobre la IRC en lugar de diferentes frecuencias de cambios de apósito en el contexto de un tipo de apósito constante.
A partir de los datos disponibles no es posible establecer conclusiones acerca de la incidencia de IHRC confirmada o presunta asociado con diferentes intervalos de frecuencia de cambios de apósito. Se utilizó la definición de los CDC de IHRC confirmada (CDC 2002), que requiere la extracción del DAVC, de manera que la punta pueda ser cuantitativa o semicuantitativamente cultivada. Clínicamente esta definición no es práctica ya que requiere la extracción del DAVC. Mermel 2009 ofrece una definición más práctica de dos muestras de sangre extraídas (una del centro del catéter y otra de una vena periférica) que, cuando se cultiven, cumplan los criterios de IHRC para hemocultivos cuantitativos o el tiempo diferencial para la positividad, que permitiría que los DAVC permanezcan insertados hasta que los resultados de los hemocultivos estén disponibles.
De forma similar, no fue posible demostrar efectos beneficiosos o perjudiciales de la intervención para la mortalidad por todas las causas, la infección en el sitio de entrada y salida del DAVC, el dolor, la calidad de vida y el costo. En su mayoría las comparaciones no tienen poder estadístico y, por lo tanto, no se pueden excluir efectos clínicamente importantes.
Como se destaca en la sección "Estudios incluidos", cada estudio utilizó diversas soluciones antimicrobianas para la descontaminación de la piel. Las guías recientes recomiendan utilizar una preparación de la piel de clorhexidina > 0,5% con alcohol al 70% para la descontaminación de la piel o tintura de yodo del 1% al 2% o povidona iodada para la piel sensible (Loveday 2014; INS 2011; IVNNZ 2012; O'Grady 2011). En el momento de estos estudios esta preparación no estaba disponible. Cuando el daño cutáneo de los pacientes empeoró en Benhamou 2002, Tegaderm (3M) se dejó de utilizar y no está claro con qué frecuencia se cambiaron la cinta Mefix o la gasa estéril y el apósito de cinta. El grado de daño cutáneo ≥ 2 ocurrió con mayor frecuencia en el grupo de cuatro días, lo que puede tener un efecto sobre las tasas de infección cutánea.
No fue posible proporcionar una estimación general del efecto de cambiar los apósitos con menor frecuencia sobre el daño cutáneo. Los datos de dos estudios pequeños de calidad limitada presentaron resultados contradictorios; un ensayo favoreció los tiempos más cortos entre los cambios de apósito (dos cambios de apósito por semana; Vokurka 2009), y el otro favoreció los tiempos más largos (hasta 15 días; Benhamou 2002). Además, el estudio Benhamou 2002 tuvo poder estadístico para detectar una mejoría del 30% en la tasa de grado de daño cutáneo ≥ 2 en el grupo de 15 días, pero solamente el 17% de los apósitos en este grupo permaneció intacto durante este período de tiempo. En el estudio Benhamou 2002, como promedio, el intervalo más largo que los apósitos estuvieron en su sitio fue durante 8 días sin que ocurrieran eventos adversos en ninguno de los ensayos. Por lo tanto, lo anterior plantea la posibilidad de reemplazar los apósitos solamente cuando se está indicado clínicamente, especialmente en la población pediátrica y neonatal donde la piel es frágil. Los pacientes que reciben radioterapia, o los que presentan sensibilidad, también se pueden beneficiar de la extensión del tiempo entre los cambios de apósito.
Compleción y aplicabilidad general de las pruebas
Los resultados primarios y secundarios de interés clínico incluyeron IHRC confirmada y presunta, mortalidad por todas las causas, infección en el sitio del catéter, daño cutáneo, dolor, calidad de vida y costo, pero se informaron de manera deficiente y no fue posible extraer muchos resultados para esta revisión. Estos resultados se deben incluir en cualquier ensayo clínico futuro relacionado con la frecuencia de cambios de apósito.
Los cinco estudios incluidos en esta revisión se realizaron en ámbitos de atención de agudos en Europa. Los DAVC generalmente se colocan en los pacientes que requieren cuidados intensivos, tratamiento para las neoplasias malignas y en otros pacientes que requieren tratamiento a largo plazo. Cuatro de los estudios reclutaron a participantes con neoplasias hematológicas o que recibían un trasplante de médula ósea. Esta población está inmunocomprometida debido a la enfermedad o el tratamiento subyacente, por lo que estos resultados no se pueden aplicar fácilmente a los pacientes con problemas de salud crónicos o a los que se atienden en otros ámbitos.
Los apósitos y los productos para la descontaminación continúan en evolución, con productos nuevos que constantemente se desarrollan y comercializan. Entonces, aunque todos los estudios en esta revisión utilizaron apósitos transparentes, los estudios más antiguos pueden haber utilizado productos que ya no estén disponibles. Se han publicado otras revisiones que compararon diferentes apósitos.
La limitación final para la completitud y la generalizabilidad de los resultados es que todos los estudios compararon el cambio en la frecuencia de apósitos transparentes de poliuretano solamente. En consecuencia, los estudios que compararon la frecuencia de cambio de otros tipos de apósitos, como la gasa y la cinta, pueden proporcionar resultados diferentes. Solamente un ensayo utilizó esponjas impregnadas con clorhexidina, que actualmente se utilizan con frecuencia como parte del régimen de apósito, pero no fue posible extraer estos datos.
Calidad de la evidencia
Limitaciones en el diseño y la implementación del estudio
El riesgo de sesgo se evaluó de acuerdo a seis componentes: generación de la secuencia; ocultación de la asignación; cegamiento; informe selectivo de los resultados, seguimiento incompleto y otros sesgos potenciales. El riesgo de sesgo fue difícil de evaluar debido a la deficiente presentación de informes en la mayoría de los estudios (Figura 2; Figura 3). Sólo tres estudios proporcionaron información suficiente para evaluar cómo se generó la secuencia de asignación al azar; y dos autores de los estudios con los que se estableció contacto describieron el método utilizado para la ocultación de la asignación. No sería posible para los participantes y el personal estar cegado a la frecuencia de cambios de apósito, pero solamente un estudio cegó las evaluaciones de resultado.
Dos de los estudios comprendieron el 81% (2163/2675) de los participantes totales (Benhamou 2002; Timsit 2009). Estos dos estudios calcularon el tamaño de la muestra necesario, utilizaron una generación de números aleatorios para asignar la secuencia y utilizaron un análisis por intención de tratar. Sin embargo, ninguno se calificó con bajo riesgo de sesgo para la ocultación de la asignación.
Las desviaciones de los protocolos fueron frecuentes en los brazos de tratamiento y control. Los apósitos se cambiaron temprano cuando estaban sucios o no estaban intactos. Este tema refleja la realidad de la investigación pragmática en ámbitos clínicos y la importancia de las inspecciones visuales del apósito para mejorar la atención y el mantenimiento del DAVC.
Falta de direccionalidad de las pruebas
Esta revisión estuvo limitada por la falta de uniformidad en los grupos experimentales y control. La frecuencia de los cambios de apósito se superpuso en los límites externos de los intervalos más largos (5 a 15 días) y más cortos (2 a 5 días) entre los apósitos. Se informó IHRC confirmada en solamente un ensayo (Timsit 2009). Estas limitaciones limitan la toma de decisiones segura con respecto al efecto de la frecuencia de cambios de apósito sobre la IRC.
Heterogeneidad no explicada o inconsistencia de los resultados
La mortalidad por todas las causas y la infección en el sitio del catéter fueron los únicos resultados que se pudieron agrupar con el modelo de efectos fijos para el metanálisis. El dolor se agrupó con un modelo de efectos aleatorios para el metanálisis. No fue posible agrupar los resultados de daño cutáneo debido a la heterogeneidad. La heterogeneidad se debió en general a las diferencias en las poblaciones y las diferentes escalas y definiciones que se utilizaron para los diversos resultados.
Imprecisión de los resultados
Hubo imprecisión grave en todos los resultados, incluso cuando se realizó el metanálisis, con intervalos de confianza amplios debido a los tamaños de la muestra pequeños. En consecuencia, los resultados reflejan la falta de pruebas de una diferencia en lugar de pruebas de ninguna diferencia (entre los intervalos de cambio de apósito para los DAVC). Por lo tanto, es muy poco probable que los estudios de investigación adicionales tengan una marcada repercusión sobre la confianza de las estimaciones del efecto para todos los resultados medidos.
Sesgo de publicación
La falta de información acerca de la mayoría de los resultados clínicos importantes podría indicar el informe selectivo de los resultados, pero no fue posible confirmarlo ya que solamente un estudio se registró con un registro de ensayos.
Sesgos potenciales en el proceso de revisión
Los autores confían en que se seleccionaron todos los estudios que cumplieron los criterios de inclusión. Se realizaron búsquedas manuales en las listas de referencias y sólo se encontró un título adicional (Fessard 1994). Se solicitó el artículo completo al autor y a la revista, pero hasta la fecha las solicitudes siguen sin respuesta. Se siguieron los procedimientos claramente descritos para prevenir posibles sesgos en el proceso de revisión. Los métodos utilizados son transparentes y reproducibles. Uno de los autores (CR) ha dictado conferencias para 3M y recibió una Subvención para investigación sin restricción de Centurion. No se incluyó en esta revisión ningún producto de estas empresas.
Acuerdos y desacuerdos con otros estudios o revisiones
Zitella 2003 examinó la bibliografía relacionada con el cuidado de los DAVC en los pacientes a los que se les realiza trasplante de médula ósea: solamente los estudios Engervall 1995 y Rasero 2000 se incluyeron en esa revisión y en la presente revisión. El estudio Benhamou 2002 se publicó en el mes que la revisión Zitella 2003 se aceptó para publicación y los otros estudios en la presente revisión se publicaron después de 2003. Con respecto a la frecuencia de cambios de apósito, Zitella 2003 concluyó en primer lugar que el estudio Engervall 1995 mostró más cultivos positivos de la punta del catéter en el grupo una vez a la semana, pero el estudio estuvo limitado por un tamaño de la muestra pequeño, y en segundo lugar que el estudio Rasero 2000 no mostró diferencias significativas en la colonización de la piel entre los cuatro grupos. En general, los autores concluyeron que la colonización es una medida inadecuada para la IHRC.
Uno de los estudios excluidos asignó a los participantes a intervalos regulares (cada 72 horas) y no regulares (hasta la extracción del DAVC) entre los cambios de apósito según la sala en la que fueron ingresados (asignación al azar grupal; Ishizuka 2011). Hubo una diferencia significativa entre los grupos en la duración del tiempo de permanencia del catéter (grupo regular 9,1 ± 0,5 días y grupo no regular 11,9 ± 0,7 días). La IHRC entre los grupos (13/241 en el grupo regular y 10/266 en el grupo no regular) no fue significativa. El análisis de Kaplan‐Meier y la prueba del rango logarítmico mostraron una diferencia significativa en el período desde la inserción hasta el desarrollo de IHRC entre los grupos que favoreció al intervalo regular entre los cambios de apósito (valor de p 0,026).
El ECA Timsit 2009 se sometió a un análisis secundario en una publicación posterior, Timsit 2012, que informó datos sobre 1419 pacientes (3275 catéteres arteriales y DAVC combinados) a los que se les reemplazaron los apósitos el tercer o séptimo día asignado versus los pacientes a los que se les remplazaron los apósitos antes de cualquiera de los días programados. Este ECA encontró que el retiro (reemplazo) temprano del apósito ocurrió en el 67% de los apósitos programados y se asoció significativamente con mayor colonización de la piel, IHRC e IRC importante (IHRC o IHRC presunta). Para los DAVC subclavios solos (n = 547) se informó que el porcentaje de apósitos retirados (valor de p 0,0043) y el retiro del apósito final (valor de p 0,0004) se asociaron significativamente con mayores niveles de colonización de la piel al extraer el DAVC. Esos autores concluyeron que el retiro de los apósitos fue frecuente y que es un factor de riesgo importante de infección.
La bibliografía relacionada con las heridas y los adhesivos cutáneos reconoce que factores múltiples influyen en el grado de adherencia del mismo producto a la piel de diferentes personas (Rippon 2007). También se reconoce que el traumatismo provocado por la repetición del retiro y la aplicación de adhesivos o cintas adhesivas causa una reacción eritematosa que afecta la función de barrera de la piel(Cutting 2008; Hollingworth 2009). El compromiso en la función de barrera se torna importante cuando la hiperproliferación bacteriana se ha asociado con apósitos oclusivos (Dykes 2007), como los apósitos de poliuretano utilizados habitualmente para asegurar los DAVC. Sin embargo, todavía no está claro si los apósitos de poliuretano tienen mayores probabilidades que otros productos adhesivos de causar laceración a la piel (Cutting 2008; Dykes 2001). Tampoco está claro si hay una asociación entre la laceración de la piel y un aumento en la incidencia de infección. Sin embargo, la piel lesionada proporciona un posible punto de acceso para la infección, de manera que tiene sentido prevenir que ocurra daño cutáneo. La noción de prevención del daño cutáneo para evitar una IRC está apoyada por una guía práctica de control de la infección que recomienda no afeitar los sitios de inserción para evitar microabrasiones que puedan promover la colonización bacteriana (Wilson 2006).
El argumento opuesto a la teoría de laceración de la piel es que es probable que los microorganismos que se originan de la propia piel del paciente sean los mismos que causan muchas IRC (Casey 2010; Elliott 1998; Gillies 2003; Maki 1997; Mermel 2000); éstos pueden ser capaces de migrar de la superficie de la piel a lo largo de la porción externa del catéter para causar infección, independientemente del daño cutáneo (Wilson 2006). Si la piel alrededor del sitio del catéter se desinfecta regularmente deberían reducirse la colonización y la IHRC. Sin embargo, no es posible depender de las infecciones en el sitio del catéter para identificar o predecir las IHRC (Safdar 2002), y pueden existir independientemente de una infección sistémica (Walshe 2002). Además, los esfuerzos para mantener la integridad de la piel pueden ayudar a reducir las IHRC. Aunque lo anterior puede ser verdad, se ha encontrado que la proporción de cultivos positivos de la piel alrededor del sitio de salida es mayor en presencia de eritema en comparación con la piel sana (Engervall 1995).

Flow diagram of included and excluded studies

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies

Risk of bias summary: review authors' judgements about each risk of bias item for each included study

Comparison 1 Longer interval (5‐15 days) (intervention) versus shorter interval (2‐5 days) (control), Outcome 1 Catheter related blood stream infection.

Comparison 1 Longer interval (5‐15 days) (intervention) versus shorter interval (2‐5 days) (control), Outcome 2 Suspected catheter related blood stream infection.

Comparison 1 Longer interval (5‐15 days) (intervention) versus shorter interval (2‐5 days) (control), Outcome 3 All‐cause mortality.

Comparison 1 Longer interval (5‐15 days) (intervention) versus shorter interval (2‐5 days) (control), Outcome 4 Catheter‐site infection.

Comparison 1 Longer interval (5‐15 days) (intervention) versus shorter interval (2‐5 days) (control), Outcome 5 Skin damage.

Comparison 1 Longer interval (5‐15 days) (intervention) versus shorter interval (2‐5 days) (control), Outcome 6 Pain.
| Patient or population: patients with a central venous access device | ||||||
| Outcomes | Relative effect | Anticipated absolute effects* (95% CI) | Quality of the evidence | What happens | ||
| Without longer interval (5 ‐ 15 days) | With longer interval (5 ‐ 15 days) | Difference | ||||
| Catheter‐related blood stream infection (CRBSI) | RR 1.42 | Study population | ⊕⊕⊝⊝ | Longer intervals between dressing changes may have little or no effect on catheter‐related blood stream infection | ||
| 8 per 1000 | 12 per 1000 | 4 more per 1000 | ||||
| All‐cause mortality | RR 1.06 | Study population | ⊕⊕⊝⊝ | Longer intervals between dressing changes probably have little or no effect on death from any cause | ||
| 354 per 1000 | 375 per 1000 | 21 more per 1000 | ||||
| Skin damage Follow up: unclear | Not estimable | Skin damage was reported in four studies. Two provided data but their results were not combined due to inconsistency of size and direction of the effects. One study in children found less skin damage in the longer interval group (8/56) compared with the shorter interval group (24/56). Rates of skin damage in one study in adults were similar (7/39 in longer interval versus 6/42 in shorter interval).9 | ⊕⊝⊝⊝ | It is uncertain whether longer (compared with shorter) intervals between dressing changes reduce skin damage | ||
| Pain Follow up: unclear | RR 0.80 | Study population | ⊕⊕⊝⊝ | It is uncertain whether longer (compared with shorter) intervals between dressing changes affect pain on dressing removal | ||
| 347 per 1000 | 278 per 1000 | 69 fewer per 1000 | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded for risk of bias due to lack of blinding of participants and personnel and for a probable unit of analysis error (individual participants randomised but numbers of infections reported) 2 Downgraded for serious imprecision: result consistent with a reduction in CRBSI or an almost 5 fold increase 3 Downgraded for risk of bias due to lack of blinding of participants and personnel 4 Downgraded for imprecision: result consistent with a 10% reduction in mortality or a 25% increase 5 Downgraded twice for serious risk of bias: risk of performance bias due to lack of blinding of participants and personnel; different dressings were used in response to skin damage 6 Downgraded for inconsistency: experimental and control groups were different between studies and frequency of dressing changes overlapped between longer and shorter groups 7 Downgraded for imprecision 8 Downgraded for risk of bias: blinding of outcome assessment not described 9 Data from two additional RCTs could not be extracted and used within the analysis. One study presented toxicity on a 5‐point scale and reported no differences between groups. We are unable to use the data from the fourth study due to the 2 x 2 factorial design. | ||||||
| CRBSI | Not applicable | Not applicable | Not applicable | High risk | Not applicable |
| Suspected CRBSI | High risk | High risk | Not applicable | Not applicable | Not applicable |
| All‐cause mortality | Low risk | Low risk | Not applicable | Low risk | Not applicable |
| Catheter‐site infection | High risk | High risk | High risk | High risk | High risk |
| Skin damage | High risk | Not applicable | High risk | High risk | High risk |
| Pain | HIgh risk | Not applicable | Not applicable | Not applicable | High risk |
| Quality of life | Not applicable | Not applicable | Not applicable | Not applicable | Not applicable |
| Cost | Not applicable | Not applicable | High risk | Not applicable | Not applicable |
| CRBSI | Not applicable | Not applicable | Not applicable | Low risk | Not applicable |
| Suspected CRBSI | Unclear risk | Unclear risk | Not applicable | Not applicable | Not applicable |
| All‐cause mortality | Low risk | Low risk | Not applicable | Low risk | Not applicable |
| Catheter‐site infection | Unclear risk | Unclear risk | Unclear risk | Low risk | Unclear risk |
| Skin damage | Unclear risk | Not applicable | Unclear risk | Unclear risk | Unclear risk |
| Pain | Unclear risk | Not applicable | Not applicable | Not applicable | Unclear risk |
| Quality of life | Not applicable | Not applicable | Not applicable | Not applicable | Not applicable |
| Cost | Not applicable | Not applicable | Unclear risk | Not applicable | Not applicable |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Catheter related blood stream infection Show forest plot | 1 | 995 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.42 [0.40, 4.98] |
| 2 Suspected catheter related blood stream infection Show forest plot | 2 | 151 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.70 [0.23, 2.10] |
| 3 All‐cause mortality Show forest plot | 3 | 896 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.06 [0.90, 1.25] |
| 4 Catheter‐site infection Show forest plot | 2 | 371 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.07 [0.71, 1.63] |
| 5 Skin damage Show forest plot | 2 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 6 Pain Show forest plot | 2 | 193 | Risk Ratio (M‐H, Random, 95% CI) | 0.80 [0.46, 1.38] |

