Intervenciones para mejorar la adherencia a los fármacos para la dependencia del tabaco
Resumen
Antecedentes
Se ha demostrado que los tratamientos farmacológicos para la dependencia del tabaco, como el tratamiento de reemplazo de nicotina (TRN), son intervenciones seguras y efectivas para el abandono del hábito de fumar. Los niveles más altos de adherencia a estos fármacos aumentan la probabilidad del abandono sostenido del hábito de fumar, aunque muchos fumadores los usan en una dosis inferior y por menos tiempo que el óptimo. Es importante determinar la efectividad de las intervenciones diseñadas específicamente para mejorar la adherencia a los fármacos. Dichas intervenciones pueden considerar la motivación para usar los medicamentos, como las creencias que influyen sobre el valor de tomar los medicamentos, o la provisión de apoyo para superar los problemas con el mantenimiento de la adherencia.
Objetivos
Evaluar la efectividad de las intervenciones que tienen como objetivo aumentar la adherencia a los fármacos para el abandono del hábito de fumar sobre la adherencia a los fármacos y la abstinencia del hábito de fumar en comparación con un grupo de control que normalmente recibió atención estándar.
Métodos de búsqueda
Se realizaron búsquedas en el Registro Especializado del Grupo Cochrane de Adicción al Tabaco (Cochrane Tobacco Addiction Group Specialized Register) y en los registros de ensayos clínicos (ClinicalTrials.gov y la Plataforma Internacional de Registros de Ensayos Clínicos de la OMS) hasta el 3 de septiembre de 2018. También se realizaron búsquedas de citas hacia adelante y hacia atrás.
Criterios de selección
Estudios aleatorios, cuasialeatorios o con asignación al azar grupal en los que los adultos que recibieron tratamiento farmacológico activo para el abandono del hábito de fumar fueron asignados a un brazo de intervención en el que el interés se centró principalmente en aumentar la adherencia a los fármacos para la dependencia del tabaco, o a un brazo de control que proporcionó atención estándar. Dependiendo del entorno, la atención estándar puede haber consistido en apoyo mínimo o en diversos grados de apoyo conductual. Los estudios incluidos utilizaron una medida que permitió evaluar el grado de adherencia a los fármacos.
Obtención y análisis de los datos
Dos autores, de forma independiente, examinaron los estudios para determinar su elegibilidad, extrajeron los datos de los estudios incluidos y evaluaron el riesgo de sesgo. Para obtener las medidas de resultado continuas, se calcularon los tamaños del efecto como diferencias de medias estandarizadas (DME). Para las medidas de resultado dicotómicas, se calcularon los tamaños del efecto como cocientes de riesgos (CR). En los metanálisis para los resultados de la adherencia, se combinaron los datos dicotómicos y continuos mediante el método de la varianza inversa genérica y se informaron los tamaños del efecto agrupado como DME; para los resultados de la abstinencia, se informaron y agruparon los resultados dicotómicos. Se obtuvieron los tamaños del efecto agrupados con intervalos de confianza (IC) del 95% mediante el uso del modelo de efectos aleatorios. Se realizaron análisis de subgrupos para evaluar si el interés primario del tratamiento de adherencia (aspectos prácticos versus percepciones versus ambos), el enfoque de administración (centrado en el participante versus centrado en el médico) o el tipo de fármaco se asociaban con la efectividad.
Resultados principales
Se identificaron dos estudios nuevos, lo que proporcionó un total de diez estudios, con 3 655 participantes. Todas las intervenciones de adherencia a los fármacos estudiadas se proporcionaron además del apoyo conductual estándar y, por lo general, proporcionaron información adicional sobre la justificación y enfatizaron la importancia de la adherencia al fármaco o apoyaron el desarrollo de estrategias para superar los problemas con el mantenimiento de la adherencia (o ambos). Siete estudios se centraron en la adherencia al TRN, dos al bupropión y uno a la vareniclina. Se consideró que la mayoría de los estudios estuvo en riesgo de sesgo alto o incierto, y cuatro de estos estudios se consideraron en riesgo alto de sesgo de deserción o de detección. Se consideró que un solo estudio presentaba un riesgo de sesgo bajo.
El metanálisis de los diez estudios incluidos (12 comparaciones) proporcionó evidencia de certeza moderada de que las intervenciones de adherencia produjeron pequeñas mejorías en la adherencia (es decir, la cantidad media de medicación consumida; DME 0,10; IC del 95%: 0,03 a 0,18; I² = 6%; n = 3655), limitada por el riesgo de sesgo. Los análisis de subgrupos para la medida de resultado primaria no identificaron efectos de subgrupos significativos, y los tamaños del efecto para los subgrupos se calcularon de forma imprecisa. Sin embargo, hubo una indicación muy débil de que las intervenciones centradas en los "aspectos prácticos" de la adherencia al tratamiento (es decir, capacidades, recursos, niveles de apoyo o habilidades) pueden ser efectivas (DME 0,21; IC del 95%: 0,03 a 0,38; I² = 39%; n = 1752), mientras que las intervenciones centradas en las «percepciones» del tratamiento (es decir, creencias, cogniciones, preocupaciones y preferencias; DME 0,10; IC del 95%: ‐0,03 a 0,24; I² = 0%; n = 839) o en ambos (DME 0,04; IC del 95%: ‐0,08 a 0,16; IC del 95%: ‐0,08 a 0,16; I² = 0%; n = 1064), pueden no ser efectivas. Las intervenciones centradas en el participante pueden ser efectivas (DME 0,12; IC del 95%: 0,02 a 0,23; I² = 20%; n = 2791), mientras que las centradas en el médico pueden no serlo (DME 0,09; IC del 95%: ‐0,05 a 0,23; I² = 0%; n = 864).
Cinco estudios evaluaron la abstinencia del hábito de fumar a corto plazo (cinco comparaciones), mientras que un conjunto superpuesto de cinco estudios (siete comparaciones) evaluó la abstinencia del hábito de fumar a largo plazo a los seis meses o más. Los metanálisis dieron lugar a evidencia de baja certeza de que las intervenciones de adherencia pueden aumentar ligeramente las tasas de abandono del hábito de fumar a corto plazo (CR 1,08; IC del 95%: 0,96 a 1,21; I² = 0%; n = 1795) y las tasas de abandono del hábito de fumar a largo plazo (CR 1,16; IC del 95%: 0,96 a 1,40; I² = 48%; n = 3593). En ambos casos, la evidencia estuvo limitada por el riesgo de sesgo y la imprecisión, con IC que abarcaban un efecto perjudicial mínimo así como un beneficio moderado, y una alta probabilidad de que la evidencia adicional cambie la estimación del efecto. No hubo pruebas de que las intervenciones para aumentar la adherencia a la medicación dieran lugar a eventos adversos. Los estudios no informaron sobre los factores posiblemente asociados con el aumento de la adherencia, como la autoeficacia, la comprensión y las actitudes hacia el tratamiento, y la motivación y las intenciones de dejar de fumar.
Conclusiones de los autores
En las personas que están dejando de fumar y que reciben apoyo conductual, existe evidencia de certeza moderada de que un mayor apoyo conductual centrado en la adherencia a los fármacos para dejar de fumar puede mejorar modestamente la adherencia. Solo existe evidencia de baja certeza de que lo anterior puede mejorar ligeramente la probabilidad de cesación del hábito a corto o a largo plazo. Las intervenciones para aumentar la adherencia pueden tener como objetivo considerar los aspectos prácticos de la toma de la medicación, cambiar las percepciones acerca de la medicación, como las razones para tomarla o las preocupaciones acerca de hacerlo, o ambos. Sin embargo, en la actualidad no hay evidencia suficiente para confirmar qué enfoque es más efectivo. No existe evidencia sobre si dichas intervenciones son efectivas para las personas que están dejando de fumar sin el apoyo conductual estándar.
PICO
Resumen en términos sencillos
¿Podemos ayudar a los fumadores a aumentar el consumo de los medicamentos para dejar de fumar?
Antecedentes
Los medicamentos diseñados para hacer más fácil que las personas dejen de fumar, como el tratamiento de reemplazo de nicotina (TRN), el bupropión y la vareniclina, son seguros y ayudan a las personas a dejar de fumar de forma exitosa. Sin embargo, las personas a menudo no siguen las instrucciones que acompañan los medicamentos de forma adecuada, lo cual puede significar que los medicamentos no funcionan con la efectividad que podrían hacerlo. Lo anterior probablemente reduce las probabilidades de que una persona deje de fumar para siempre. En esta revisión, se consideró si existen maneras de ayudar a las personas a usar de manera correcta los medicamentos para dejar de fumar y si esta posibilidad aumenta la probabilidad de que las personas dejen de fumar.
Características de los estudios
Se realizaron búsquedas de estudios hasta septiembre de 2018 y se encontraron diez estudios, con 3 655 personas incluidas. Todas estas personas eran fumadores mayores de 18 años de edad. Los estudios examinaron diferentes maneras de ayudar a las personas a usar los medicamentos para dejar de fumar de manera adecuada. Por lo general, lo anterior incluyó la posibilidad de proporcionar información adicional sobre el medicamento o ayudar a las personas a superar los problemas que tenían para tomar el medicamento. Un estudio proporcionó apoyo por teléfono, y el resto proporcionó al menos algo de apoyo cara a cara. Todos los estudios incluidos midieron la cantidad de personas que usaron medicamentos y todos excepto uno midieron cuántas personas dejaron de fumar.
Resultados clave
Las personas que recibieron ayuda para mejorar el uso de medicamentos para dejar de fumar utilizaron los medicamentos un poco más que las personas que no recibieron esta ayuda. Hubo alguna evidencia de que lo anterior también dio lugar a que un número ligeramente mayor de personas dejara de fumar.
Calidad de la evidencia
La evidencia de que la posibilidad de ayudar a las personas a mejorar el uso de los medicamentos para dejar de fumar puede estimular con éxito el uso de estos medicamentos es de calidad moderada, lo que significa que se necesita más evidencia para tener más seguridad en cuanto a este efecto. Este hecho se debe a que hubo problemas con los métodos de algunos de los estudios incluidos. La evidencia que indica que los enfoques para mejorar el uso de los medicamentos para dejar de fumar pueden ayudar a más personas a dejar de fumar es de baja calidad, lo que significa que no existe seguridad en cuanto a que realmente ayuden a más personas a dejar de fumar y la evidencia adicional puede o no fortalecer la confianza en este efecto. Lo anterior se debe a que hubo problemas con algunos de los métodos de estudio y a que no está claro si la posibilidad de proporcionar apoyo adicional para alentar a las personas a usar los medicamentos da lugar a que más o menos personas dejen de fumar con éxito.
Conclusiones de los autores
Summary of findings
| Interventions to increase adherence compared to standard care for improving adherence to medications for tobacco dependence and abstinence from smoking | |||||
| Patient or population: adult smokers | |||||
| Outcomes | Relative effect (95% CI) | Illustrative comparative risks (95% CI) | No of participants | Certainty of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Standard care | Intervention to increase adherence | ||||
| Adherence to medications for tobacco dependence | SMD 0.10 (0.03 to 0.18) | Mean proportion of prescribed medication consumed over 28 days was 63.6% | Mean proportion of prescribed medication consumed over 28 days was 3.9% higher (95% CI 1.2% to 7.0% higher) | 3655 | ⊕⊕⊕⊝ |
| Short‐term abstinence from smoking (< 6 months) | RR 1.08 | 357 people per 1000 achieve abstinence) | 386 people per 1000 achieve abstinence (95% CI 343 to 432) | 1795 | ⊕⊕⊝⊝ |
| Long‐term abstinence from smoking (≥ 6 months) | RR 1.16 | 203 people per 1000 achieve abstinence | 236 per 1000 achieve abstinence (95% CI 195 to 284) | 3593 | ⊕⊕⊝⊝ |
| The basis for the illustrative comparative risks is provided in Footnotesd. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). CI: confidence interval; RCT: randomised controlled trial; RR: risk ratio; SMD: standardised mean difference. | |||||
| GRADE Working Group grades of evidence High certainty: current evidence provides a very good indication of the likely effect, and the likelihood that the actual effect will be substantially different is low. | |||||
| aMost studies were at high or unclear risk of bias which lowers confidence in estimate of effect (risk of bias). | |||||
Antecedentes
Descripción de la afección
El hábito de fumar es una de las mayores causas prevenibles de enfermedad y de muerte prematura en todo el mundo, y es un factor causal clave en las enfermedades cardíacas, los accidentes cerebrovasculares, las enfermedades pulmonares crónicas y el cáncer (GBD 2018). Se considera ampliamente que los tratamientos farmacológicos para la dependencia del tabaco, como el tratamiento de reemplazo de nicotina (TRN), son intervenciones seguras y efectivas para el abandono del hábito de fumar. Una revisión sistemática Cochrane encontró que los participantes que recibieron TRN tuvieron más de 1,5 veces más probabilidades de lograr la abstinencia que los que no lo recibieron (Hartmann‐Boyce 2018). Los participantes que reciben bupropión, nortriptilina y vareniclina también son más propensos a dejar de fumar que los que usan placebo (Cahill 2016; Hughes 2014). Sin embargo, los estudios han demostrado que muchos fumadores que usan fármacos para la dependencia del tabaco lo hacen en una dosis más baja y por menos tiempo del que la evidencia sugiere que es óptimo (Cheong 2010; Hays 2010; Shiffman 2008; Swan 2010). Por ejemplo, Burns y Levinson informaron que los usuarios del TRN, en promedio, continúan con la medicación durante menos de la mitad del tiempo para el cual fue prescrita (Burns 2008). La evidencia observacional que controla la causalidad inversa (donde las personas cuyo intento de dejar de fumar fue vacilante eligen no adherirse a la medicación) mostró que la adherencia previa a la medicación promovió la abstinencia posterior (Hollands 2013; Shiffman 2007; Shiffman 2008). Una revisión de esta relación, aunque destacó la falta de estudios de alta calidad, sugirió que el grado de adherencia predijo la abstinencia posterior (Raupach 2014). Por lo tanto, es importante saber si las intervenciones que intentan aumentar la adherencia son efectivas y si esto a su vez mejora la abstinencia; la evidencia sobre este tema se evaluó aquí.
Descripción de la intervención
Las intervenciones que tienen como objetivo específico aumentar la adherencia a los medicamentos prescritos varían ampliamente en su contenido y características (Nieuwlaat 2014). Los ejemplos pueden incluir, pero no están limitados a, una mejor o mayor provisión de información, monitoreo y comentarios con respecto al desempeño, recordatorios, y terapia psicológica o asesoramiento. En el contexto específico de los fármacos para la dependencia del tabaco, el apoyo conductual general para el abandono del hábito de fumar puede incluir componentes dirigidos a aumentar la adherencia a la medicación. También se pueden administrar intervenciones que son adicionales al apoyo conductual estándar y que dedican especial atención a mejorar la adherencia, como la posibilidad de considerar las creencias de los individuos sobre el valor de tomar medicamentos o de proporcionar apoyo adicional para superar las barreras a la adherencia.
Los tipos de intervención más específicos pueden caracterizarse por la referencia a dos factores clave informados por el Perceptions and Practicalities Approach (PAPA) (Horne 2013). Este enfoque propone que la falta de adherencia puede ser tanto intencional como no intencional, dependiendo de las motivaciones y capacidades de la persona. Los factores perceptivos ("percepciones"), es decir, las creencias, las cogniciones, las preocupaciones y las preferencias, así como los factores prácticos ("aspectos prácticos"), es decir, las capacidades, los recursos, los niveles de apoyo o las aptitudes, pueden explicar la falta de adherencia y ser considerados mediante intervenciones para aumentar la adherencia. Las guías actuales en Inglaterra sobre la adherencia a los medicamentos hacen hincapié tanto en las percepciones como en los aspectos prácticos para mejorar la adherencia a la medicación (NICE 2009). PAPA enfatiza la importancia de adaptar el contenido de la intervención mediante la obtención y la apreciación de las necesidades, las cogniciones o los comportamientos del paciente o el participante y, por lo tanto, pueden ser consideradas como "centradas en el participante". Por el contrario, las intervenciones centradas en la adherencia que están principalmente "centradas en el médico" tienden a ser de naturaleza estandarizada, directiva o didáctica. Se utilizó este enfoque para categorizar las intervenciones en esta revisión.
Por qué es importante realizar esta revisión
Hasta donde se conoce, ninguna otra revisión sistemática publicada trata este tema. Las revisiones de los estudios de las intervenciones de apoyo conductual (p.ej. Hartmann‐Boyce 2019; Lancaster 2017), que pueden incluir elementos que se centran en la adherencia a la medicación, no están diseñadas para desentrañar los efectos específicos de los componentes que se centran en aumentar la adherencia. Las revisiones anteriores de las intervenciones diseñadas para aumentar la adherencia se han centrado en grupos de pacientes o contextos de tratamiento específicos, o no han cubierto los tratamientos para dejar de fumar (Nieuwlaat 2014). Una revisión específica del tema es valiosa debido a que no es posible tener seguridad en cuanto a que los hallazgos relacionados con la adherencia a otra medicación sean generalizables a la medicación para dejar de fumar, debido a que los mismos proporcionan un contexto de tratamiento único con temas específicos para la adherencia. Por ejemplo, muchas personas consideran que dejar de fumar sin medicación es la mejor manera de dejar de fumar (Morphett 2015). Además, los inconvenientes del fracaso en la adherencia son menos significativos de lo que pueden ser en el tratamiento de las enfermedades. Por ejemplo, los individuos pueden dejar de fumar con éxito sin adherirse al tratamiento, o si fracasan en la adherencia y siguen fumando, es posible que sientan que no han perdido nada o que han experimentado algún efecto adverso. Existe evidencia que sugiere que puede ser más difícil persuadir a los individuos de los beneficios de la administración de medicación para dejar de fumar en comparación con otras afecciones. Hammond 2004 encontró que más de un tercio de los fumadores informaron que el uso de farmacoterapias (TRN o bupropión) no daría lugar a ninguna diferencia o realmente reduciría la probabilidad de dejar de fumar. Los fumadores que percibieron que los métodos de ayuda para dejar de fumar eran beneficiosos fueron más propensos a usar medicación en el futuro. Finalmente, algunos usuarios pueden percibir riesgos de efectos perjudiciales para la salud causados por la medicación que superan los beneficios potenciales.
Objetivos
Evaluar la efectividad de las intervenciones que tienen como objetivo aumentar la adherencia a los fármacos para el abandono del hábito de fumar sobre la adherencia a los fármacos y la abstinencia del hábito de fumar en comparación con un grupo de control que normalmente recibió atención estándar.
Evaluar qué enfoques de intervención son más eficaces y determinar el impacto de las intervenciones sobre los posibles precursores de la adherencia, como la comprensión del tratamiento y las percepciones de la eficacia.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Estudios aleatorios, cuasialeatorios o con asignación al azar grupal.
Tipos de participantes
Adultos (a partir de 18 años de edad) que fumaran en el momento del ingreso al estudio.
Tipos de intervenciones
A todos los participantes de los brazos de estudio de la intervención relevante y de comparación se les debía haber ofrecido un tratamiento farmacológico efectivo para el abandono del hábito de fumar. Los tratamientos farmacológicos comprendían los prescritos para aumentar las tasas de cesación (p.ej. TRN, bupropión, nortriptilina, vareniclina y regímenes combinados).
Las intervenciones para aumentar la adherencia pueden variar ampliamente en su naturaleza (Nieuwlaat 2014), por lo que la naturaleza de las intervenciones consideradas para su inclusión en esta revisión no se especificó más allá de la referencia a los criterios de exclusión. Las intervenciones elegibles incluyeron cualquier intervención que difiriera de la atención estándar administrada a los fumadores, y en las que el contenido diferenciado de la intervención se centrara claramente en aumentar la adherencia a los fármacos para la dependencia del tabaco, reflejado en el contenido descrito y en los objetivos declarados. No se incluyeron las intervenciones que alteraban sistemáticamente las características farmacológicas activas de un determinado fármaco, como la concentración de la dosis, la duración del tratamiento o los medios de administración. Las intervenciones que incluían el uso de incentivos económicos no fueron elegibles.
Los grupos de comparación aceptables fueron los que proporcionaron atención estándar o habitual. Dependiendo del entorno, lo anterior podía incluir un apoyo mínimo o varios grados de apoyo conductual.
Tipos de medida de resultado
Resultados primarios
-
Adherencia a los fármacos para la dependencia del tabaco.
Los estudios debían haber utilizado una medida cuantitativa de la adherencia. La misma podría definirse como una medida continua, como la cantidad de medicación consumida durante un período de tratamiento determinado, o como un resultado dicotómico, que indicara si el tratamiento se utilizó en un grado cuantificado específico (por ejemplo, adherencia durante x número de días, o x cantidad de medicación consumida). Lo anterior contrasta con una medida binaria (es decir, cualquier cantidad de medicación en cualquier momento versus ninguna utilización) o con una lista de verificación categórica, que no se considera una medida apropiada. La adherencia podría haberse medido de forma electrónica, conteo de tabletas por un tercero o a través del autoinforme (o combinaciones de los mismos).
Cuando los estudios informaron medidas múltiples de la adherencia, se utilizaron las más rigurosas disponibles. Cuando los estudios evaluaron los períodos de tratamiento en múltiples puntos temporales, se utilizó el punto temporal más largo. Cuando estuvo disponible, se utilizaron los datos de las medidas de resultado primarias solo para los participantes que continuaron con un intento de abandono y permanecieron comprometidos durante el periodo del programa de tratamiento en lugar de abandonar, contrariamente a la utilización de los datos de las medidas de resultado de todos los asignados al azar para recibir una intervención determinada (es decir, un análisis de intención de tratar [intention‐to‐treat analysis, ITT]) (Para obtener más detalles, véase Tratamiento de los datos faltantes).
Resultados secundarios
-
Abstinencia del hábito de fumar medida alrededor o en un punto temporal relevante para la medida de la adherencia (menos de seis meses, es decir, abstinencia a corto plazo).
Cuando hubo datos de puntos temporales múltiples, se informaron los datos medidos alrededor o en un punto temporal más cercano a la medida de la adherencia, que se espera que sea inferior a seis meses. Cuando los estudios informaron múltiples definiciones de abstinencia, se utilizaron las más rigurosas.
-
Abstinencia a los seis meses o más (es decir, abstinencia a largo plazo)
Se informó la abstinencia en el punto temporal más largo disponible de seis meses o más, con el fin de evaluar el beneficio a largo plazo de la intervención sobre las tasas de cesación. Para ambos resultados de abstinencia, se utilizaron los datos como aleatorios (ITT), suponiendo que las personas a las que no se les dio seguimiento fumaban.
Otros resultados
-
Factores posiblemente asociados con aumentos en la adherencia, tales como, pero no limitados a:
-
-
intención o motivación para dejar de fumar (según lo medido por los estudios, probablemente con la medida de un cuestionario autoinformado);
-
actitudes hacia el tratamiento, o comprensión del tratamiento (según lo medido por los estudios, probablemente con la medida de un cuestionario autoinformado);
-
autoeficacia (según lo medido por los estudios, probablemente con una medida de un cuestionario autoinformado).
-
-
Eventos adversos
Cualquier evento adverso o efecto perjudicial informado en los ensayos incluidos, como los niveles clínicos de depresión o ansiedad.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We searched the Cochrane Tobacco Addiction Group Specialized Register on the 3 September 2018, and two trial registries (ClinicalTrials.gov and the World Health Organization (WHO) International Clinical Trials Registry Platform (apps.who.int/trialsearch/)).
The most recent issues of the databases included in the Register, as searched for the current update of this review, were:
-
Cochrane Central Register of Controlled trials (CENTRAL), issue 8, 2018;
-
MEDLINE (via Ovid) to update 28 August 2018;
-
Embase (via Ovid) to week 36 2018;
-
PsycINFO (via Ovid) to update 20 August 2018.
The search strategy for the Register is given in Appendix 1. For details of the searches used to create the Specialized Register see the Cochrane Tobacco Addiction Group's website.
Búsqueda de otros recursos
We conducted forwards and backwards citation searches from included studies.
Obtención y análisis de los datos
Selección de los estudios
Two review authors independently screened all search results (titles and abstracts) for possible inclusion, and those selected by either or both review authors were subjected to full‐text assessment. Two review authors independently assessed the selected full‐text articles for inclusion. Any discrepancies were resolved by consensus, overseen by a third review author acting as arbiter as necessary. We listed excluded studies after full‐text assessment and gave reasons for exclusion in the Characteristics of excluded studies table.
Extracción y manejo de los datos
We developed a data extraction form, which was piloted and amended as necessary. We extracted the following main sets of data from each included study:
-
lead author;
-
date;
-
study participant inclusion criteria;
-
participants (participant condition(s) and demographics: race/ethnicity, gender, religion/culture, socioeconomic status, age);
-
study design and timetable; randomisation; allocation concealment;
-
interventions (content and format of interventions, including details of information provided; intervention setting and delivery provider; delivery of any cointerventions, theoretical basis of intervention if stated; intervention type coded by reference to two factors: 1. focus on perceptions, practicalities, or both; 2. participant‐centred or clinician‐centred);
-
numbers of participants in each trial arm;
-
outcome measures; time(s) at which outcomes assessed;
-
results;
-
balance of baseline characteristics;
-
analysis;
-
additional comments;
-
study funding and authors' declarations of interest
Two review authors independently extracted data. A third review author checked data extraction and resolved any errors or inconsistencies. The first review author entered the data into Review Manager 5, with another review author checking the accuracy of the data entry (Review Manager 2014).
Evaluación del riesgo de sesgo de los estudios incluidos
We assessed and reported the risk of bias of included studies by outcome, in accordance with the guidelines in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). We reported on the following individual domains:
-
random sequence generation (selection bias);
-
allocation concealment (selection bias);
-
blinding of outcome assessment (detection bias) (assessed for each main outcome or class of outcome). We did not assess risk of performance bias pertaining to blinding of participants and personnel due to the difficulty of achieving that in this context, in line with the guidance of the Cochrane Tobacco Addiction Group. It would be impractical to blind those delivering the intervention and attempts to do so could introduce additional limitations, such as reducing potency of the intervention by impairing its delivery and introducing further systematic differences between the intervention exposures by group;
-
incomplete outcome data (attrition bias) (assessed for each main outcome or class of outcome);
-
selective reporting (reporting bias);
-
other sources of bias (consistency in intervention delivery, i.e. was the information standardised/structured; was fidelity to protocol monitored).
Two review authors independently assessed risk of bias of included studies, with any disagreements resolved by discussion and consensus, and with a third review author acting as arbiter as necessary. We present our assessment in Risk of Bias tables for each included study.
A summary risk of bias judgement was derived for each study by applying an algorithm suggested in Section 8.7 (Table 8.7a) of the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). Specifically, if the judgement in at least one of these domains was 'high risk of bias' then summary risk of bias was determined to be high. If there were no judgements of 'high' risk, but the judgement in at least one domain was 'unclear risk of bias', then the summary risk of bias was determined to be unclear. Summary risk of bias was only judged 'low' if judgements in all domains were 'low risk of bias'.
Medidas del efecto del tratamiento
For continuous outcomes where the precise nature of the measures used differed but the outcomes were regarded as comparable, they were integrated and standardised to have common effect sizes, defined as the standardised mean difference (SMD). The effect measure for comparable dichotomous outcomes was risk ratio (RR). When different studies reported either dichotomous or continuous data for the same outcome, we combined these data using the generic inverse variance method and reported summary effect sizes as SMDs. This followed methods outlined in the Cochrane Handbook for Systematic Reviews of Interventions (Sections 7.7.7 and 9.4.6; Higgins 2011), whereby standard errors were computed for each study by converting CIs for log odds ratios and SMDs. Log odds ratios were converted to SMDs by multiplying each by the required constant. Where studies provided both dichotomous and continuous measures for the same outcome, a continuous outcome measure was selected. Finally, we accounted for studies that contributed multiple comparisons to the meta‐analysis by reducing their sample sizes in direct relation to how often corresponding data were used.
We obtained a pooled effect size with 95% confidence intervals (CI) using a random‐effects model.
Cuestiones relativas a la unidad de análisis
We included no cluster‐randomised trials and observed no unit of analysis errors. Should we have identified any cluster‐randomised trials, where an analysis was reported accounting for the clustered study design, we would have estimated the effect on this basis. If that had not been possible and the information was not available from authors, then an 'approximately correct' analysis would have been carried out according to current guidelines (Higgins 2011). We would have imputed estimates of the intracluster correlation (ICC) using estimates derived from similar studies or by using general recommendations from empirical research. If it was not possible to implement these procedures, we would have given the effect estimate as presented but reported the unit of analysis error.
Manejo de los datos faltantes
In the context of smoking cessation medications, it would be informative for measures of adherence to include only those participants who continue a quit attempt and not all those allocated to receive a given intervention (Hollands 2013). Including those people who abandon a quit attempt is less appropriate because first, treatment such as NRT is not indicated when a person has ceased trying to quit smoking, and second, it potentially confounds adherence with initial uptake (which may be influenced by different factors). As such, we are most interested in adherence to medication in those individuals who continue to engage with a treatment programme and do not dropout from the intervention, and hence remain in the study. Therefore, we intended to analyse data for our primary outcome in this way where available. In practice, primary outcomes for included studies were often presented as ITT, with five instances where it was clear that adherence was assessed and reported only for those who remained engaged with treatment or at least with study follow‐up (Mooney 2005; Nollen 2011; Schlam 2018; Smith 2013; Tucker 2017). For secondary smoking cessation outcomes, we assumed that people not followed up had resumed smoking following Cochrane Tobacco Addiction Group guidance. For such abstinence outcomes, ITT data were reported in all cases.
Evaluación de la heterogeneidad
We tested for heterogeneity by inspecting the overlap of CIs and quantified this using the I² statistic (which describes the percentage of the variability in effect estimates due to heterogeneity rather than sampling error). We considered a value greater than 50% to represent substantial heterogeneity (Higgins 2011).
Evaluación de los sesgos de notificación
We assessed likelihood of publication bias using funnel plots for the primary adherence outcome as there were at least ten studies within that analysis (Sterne 2011).
Síntesis de los datos
We conducted a narrative synthesis of the included studies, presenting studies' major characteristics and results. As studies were sufficiently similar in terms of setting, population, interventions and outcomes (including the time(s) at which these are assessed), we pooled the data statistically. We used a random‐effects model for meta‐analysis to obtain a pooled effect size with 95% CIs, due to observed clinical heterogeneity in study characteristics, such as differences in the treatment contexts and outcome measures used.
Certainty of the evidence
We used the GRADE framework to rate the certainty of each body of evidence relating to an outcome that was incorporated into a meta‐analysis, to indicate the confidence that may be placed in summary estimates of effect (Guyatt 2011). This is an assessment of the likelihood that the true effect will not be substantially different from what the research found. Within the GRADE approach, the certainty of a body of evidence for intervention effects is assessed based on the design of the underlying studies, with randomised controlled trials (RCTs) initially considered high certainty, and on a number of factors that can decrease or increase certainty. GRADE criteria for downgrading certainty of evidence encompass risk of bias, inconsistency, imprecision, indirectness, publication bias and other considerations. If such a criterion is identified, it is classified either as serious (leading to downgrading by one level) or very serious (downgrading by two levels). The four possible certainty ratings that can be applied are:
-
high certainty (meaning that current evidence provides a very good indication of the likely effect, and the likelihood that the actual effect will be substantially different is low);
-
moderate certainty (current evidence provides a good indication of the likely effect, and the likelihood that the actual effect of the treatment will not be substantially different is moderate);
-
low certainty (current evidence provides some indication of the likely effect, but the likelihood that the actual effect will be substantially different is high); and
-
very low certainty (current evidence does not provide a reliable indication of the likely effect, and the likelihood that the actual effect will be substantially different is very high).
'Summary of findings' tables
The 'Summary of findings' table comprises summaries of the estimated intervention effect and the number of participants and studies for each main outcome, and includes justifications underpinning GRADE assessments. In this case, we completed a 'Summary of findings' table for the primary adherence outcome and the secondary abstinence outcomes: short‐term abstinence and long‐term abstinence. Results of meta‐analyses are presented as SMDs and RRs, with 95% CIs. To facilitate interpretation of effect sizes for the primary outcome that were expressed as SMDs, we re‐expressed these in a more familiar metric (similar to the approach used in other Cochrane Reviews (e.g. Crockett 2018; Hollands 2015a). Because, to our knowledge, there is no larger more definitive survey that uses objective measurement of levels of adherence within standard care, for this translation we used outcome data from Marteau 2012. This was the largest study included within the current review that, first, reported adherence at least partly assessed by tablet counts, and second, used a general population sample in primary care (meaning that its data on adherence is likely to be relatively generalisable). Specifically, we used the standard deviation of the adherence outcome (here assessed as proportion of prescribed NRT that was consumed at 28 days) within the control group (here being the phenotype arm) as this best reflects typical adherence to medication in the absence of an intervention (i.e. within standard care). Such translations have important limitations and are only intended to be broadly illustrative to guide interpretation of the pooled result from the meta‐analysis. For example, what is considered 'standard care' inevitably differs, and in this study involved communicating to smokers that they were being prescribed a higher or lower dose based on their level of nicotine dependence. In addition, NRT may not be representative of all medications used to treat tobacco dependence. More generally, re‐expressed values relate directly to data derived from only one sample with its own context and measurement characteristics and so applying them more widely inevitably extrapolates beyond this.
Análisis de subgrupos e investigación de la heterogeneidad
We used subgroup analyses for the primary outcome to examine the specific characteristics or components of adherence interventions that may explain their effectiveness, an understanding of which could inform the design of maximally effective interventions. We coded more specific intervention types using the PAPA approach (Horne 2013). First, we coded whether interventions focused on perceptual factors ('Perceptions'; i.e. beliefs, cognitions, concerns and preferences) or practical factors ('Practicalities'; i.e. capabilities, resources, levels of support or skills), or both. Second, we coded whether the intervention content was shaped by eliciting and appreciating the needs, cognitions or behaviours of the patient or participant ('Participant‐centred') or was primarily standardised, directive or didactic in nature ('Clinician‐centred'). We also looked at these two factors in combination. Finally, we conducted a subgroup analysis looking at differential effects on adherence by the type of prescribed medication, although seven of the 10 studies focused on NRT medication.
Análisis de sensibilidad
We conducted a sensitivity analysis for the primary and secondary outcome analyses, removing the studies at high risk of bias.
Results
Description of studies
See Characteristics of included studies; Characteristics of excluded studies; Characteristics of ongoing studies; and Characteristics of studies awaiting classification tables for additional details of studies. Table 1 provides a brief overview of the nature of adherence interventions used in the included studies.
| Study | Brief description of specific intervention components intended to increase adherencea | Additional contact time relative to standard care? | Medication for which adherence was targeted | Intervention focused on perceptions, practicalities or both | Participant‐ or clinician‐centred intervention |
| Added counselling contact time to standard behavioural support, focusing specifically on medication adherence | Yes | NRT | Practicalities | Participant | |
| Added counselling contact time to standard behavioural support, focusing specifically on medication adherence | Yes | NRT | Practicalities | Participant | |
| Tailored and communicated about NRT dosage using a more potent rationale (genotype vs phenotype) | No | NRT | Perceptions | Clinician | |
| Personalised feedback of questionnaire responses regarding medication | No | NRT | Perceptions | Participant | |
| Personalised feedback of externally validated medication adherence | Yes | Bupropion | Practicalities | Participant | |
| Added counselling contact time to standard behavioural support, focusing specifically on medication adherence | Yes | Varenicline | Both | Clinician | |
| Added contact time to standard behavioural support with: 1. medication adherence counselling; 2. automated reminder calls; 3. electronic monitoring counselling | Yes | NRT | 1. Perceptions 2. Both 3. Practicalities | 1. Participant 2. Clinician 3. Participant | |
| Personalised feedback of externally validated medication adherence | Yes | Bupropion | Practicalities | Participant | |
| Added counselling contact time to standard behavioural support, focusing specifically on medication adherence | Yes | NRT | Both | Participant | |
| Added contact time to standard behavioural support with module focused on improving adherence to nicotine patch | Yes | NRT | Both | Participant |
aFor further details see Characteristics of included studies table.
NRT: nicotine replacement therapy.
Results of the search
The searches for this update retrieved 294 unique records. 10 articles were identified as potentially eligible for inclusion after title and abstract screening. Of these, six articles were excluded at the full‐text screening stage. Of the remaining four records, one was classified as an ongoing study (NCT02635919), and three contained information on two new studies eligible for inclusion in the review (Schlam 2018; Tucker 2017). The flow of studies through the systematic review process for this update is shown in Figure 1.
Study flow diagram for the current review update (eight studies were included in the previous version of the review).
Included studies
The review included 10 studies (eight previously included in Hollands 2015b), and two new at this update. These 10 studies included 3655 randomised participants (Chan 2010; Chan 2011; Marteau 2012; Mooney 2005; Mooney 2007; Nollen 2011; Schlam 2018; Schmitz 2005; Smith 2013; Tucker 2017).
Types of studies
All trials were individually randomised controlled trials. Five trials involved randomisation into two groups which were both included in our analysis (Marteau 2012; Mooney 2007; Nollen 2011; Schmitz 2005; Tucker 2017), and three trials involved randomisation into three groups, where only two of these groups were eligible for this review (Chan 2010; Chan 2011; Mooney 2005). One trial involved a 2 × 2 × 2 factorial design with eight randomised groups, but these groups were collapsed into a two‐group comparison, relevant to this review, by the study authors (Smith 2013). One trial involved a 2 × 2 × 2 × 2 × 2 factorial design with 32 randomised groups, with these groups collapsed into three two‐group comparisons relevant to this review (Schlam 2018).
Types of participants and settings
Eight studies included a general population of smokers. Two studies included only participants with a specific clinical condition, namely erectile dysfunction (Chan 2010) and HIV/AIDS (Tucker 2017). The mean ages of participants in trials ranged from 34.6 years (Mooney 2005) to 49 years (Schmitz 2005). In two trials, all participants were women (Mooney 2007; Schmitz 2005). In one trial, all participants were men (Chan 2010). In the remaining trials, percentage women ranged from 7.5% (Tucker 2017) to 62.5% (Nollen 2011). Seven trials took place in the USA (Mooney 2005; Mooney 2007; Nollen 2011; Schlam 2018; Schmitz 2005; Smith 2013; Tucker 2017), two in Hong Kong, China (Chan 2010; Chan 2011), and one in the UK (Marteau 2012). Regarding setting, all but one of the included studies featured interventions that were at least in part delivered in‐person, with the other delivering the intervention by telephone (Smith 2013). The interventions were delivered in clinic (e.g. smoking cessation or outpatient clinics) or social service settings, apart from one that was delivered by telephone (Smith 2013), one where one of the three adherence interventions was delivered by automated telephone call (Schlam 2018), and two where the setting was unclear (Chan 2010; Chan 2011). Those delivering the intervention were trained counsellors or project staff (Chan 2010; Chan 2011; Mooney 2005; Nollen 2011; Schlam 2018; Smith 2013; Tucker 2017), nurses (Marteau 2012; Schmitz 2005), or cognitive behavioural therapy (CBT) practitioners (Mooney 2007).
Types of interventions
The trials all offered pharmacological treatment and some behavioural support, comprising a form of smoking cessation counselling with no particular emphasis on adherence (e.g. providing dosing instructions and weekly checks of adverse effects; Schmitz 2005), to participants in the control arm. Support for the control arm varied from a single support session of 16 minutes (Tucker 2017) or 20 minutes (Mooney 2005) to seven weekly sessions (Marteau 2012; Mooney 2007; Schmitz 2005). In the main, the intervention consisted of an additional component to the standard behavioural support, with eight studies providing additional contact time for those in the intervention arm (Chan 2010; Chan 2011; Mooney 2007; Nollen 2011; Schlam 2018; Schmitz 2005; Smith 2013; Tucker 2017). In the other two studies, the nature of the contact changed but its duration did not significantly differ (Marteau 2012; Mooney 2005). The interventions typically provided information on the rationale for, and emphasised the importance of, adherence to medication, and aided participants in developing strategies to overcome problems and barriers to maintaining adherence. As such, they included a combination of two intervention strategies outlined within a taxonomy of interventions to increase adherence (Haynes 2008), that is included in Appendix 2, namely 1. instruction for participants on medication use or 2. counselling about smoking, and the value of medication in overcoming addiction. Two studies included interventions that involved personalised feedback of medication taking, monitored electronically (Mooney 2007; Schmitz 2005); one study elicited participants' beliefs about medication taking and then provided personalised counselling relating to those beliefs (Mooney 2005); one study tailored medication dose to either genotype or degree of tobacco dependence and explained the rationale for this to participants (Marteau 2012); and five studies added additional counselling contact time to standard behavioural support, with content focusing on medication adherence, including the use of motivational interviewing techniques and the 4/5R approach to increasing motivation (counselling addressing risks, rewards, roadblocks, and repetition, and relevance in the case of the 5Rs; Chan 2010; Chan 2011), a focus on motivation to use the medication and behavioural skills for achieving this (Nollen 2011; Tucker 2017), and targeting medication beliefs with monitoring and feedback on adherence (Smith 2013). One study examined multiple adherence interventions concerning personalised feedback of adherence behaviour, automated medication reminder calls and additional behavioural support content focused on adherence (Schlam 2018).
Seven studies prescribed NRT (Chan 2010; Chan 2011; Marteau 2012; Mooney 2005; Schlam 2018; Smith 2013; Tucker 2017), two studies prescribed bupropion (Mooney 2007; Schmitz 2005), and one study prescribed varenicline (Nollen 2011).
We categorised the content of each intervention by reference to PAPA. Of 12 comparisons included in the review, three comparisons assessed the impact of changing perceptions (Marteau 2012; Mooney 2005; Schlam 2018 (medication adherence counselling intervention)), and five comparisons assessed the impact of interventions aiming to improve the practicalities of medication‐taking (Chan 2010; Chan 2011; Mooney 2007; Schlam 2018 (electronic monitoring feedback intervention); Schmitz 2005). Four comparisons assessed Interventions of perceptions and practicalities (Nollen 2011; Schlam 2018 (automated calls intervention); Smith 2013; Tucker 2017).
We also assessed whether interventions aimed at changing perceptions or practicalities assessed participants' particular beliefs or difficulties (patient‐centred) or provided a standardised intervention (clinician‐centred). Nine comparisons were patient‐centred (Chan 2010; Chan 2011; Mooney 2005; Mooney 2007; Schlam 2018 (medication adherence counselling intervention); Schlam 2018 (electronic monitoring feedback intervention); Schmitz 2005; Smith 2013; Tucker 2017), and three comparisons were clinician‐centred (Marteau 2012; Nollen 2011; Schlam 2018 (automated calls intervention)).
Types of outcome measures
Measures of adherence varied across studies. Five studies reported at least one continuous outcome, measured as the percentage or amount of prescribed medication that was consumed (Marteau 2012; Mooney 2005; Nollen 2011), number of days on which it was used (Smith 2013), or percentage of days on which a person was adherent (Schlam 2018). Five studies used a dichotomous outcome, meaning people were classified as either achieving or not achieving a specified degree of adherence that was deemed adequate (Chan 2010; Chan 2011; Mooney 2007; Schmitz 2005; Tucker 2017). The definitions of adequate adherence naturally varied by medication type and because there may not be agreed standards for what constitutes desirable levels of adherence. Furthermore, the operationalisation of this was not always clear. In assessing adherence, seven studies at least partly used tablet counts (Marteau 2012; Mooney 2005; Nollen 2011; Tucker 2017), or electronic monitoring systems (Mooney 2007; Schlam 2018; Schmitz 2005). One study used self‐report (Smith 2013), while the means of assessing adherence was unclear in two studies (Chan 2010; Chan 2011). The period for which the primary adherence outcome was being assessed ranged from approximately two weeks (Mooney 2005; Smith 2013), to three months (Nollen 2011).
To assess abstinence seven studies used biochemically validated outcomes (Chan 2010; Chan 2011; Marteau 2012; Mooney 2005; Mooney 2007; Nollen 2011; Tucker 2017), but only six of these provided useable data in study reports (Chan 2010; Chan 2011; Marteau 2012; Mooney 2005; Nollen 2011; Tucker 2017). Two studies provided self‐reported abstinence data (Schlam 2018; Smith 2013), and one study did not report abstinence (Schmitz 2005). Time of abstinence outcome measurement ranged from two weeks (Mooney 2005), to six months (Chan 2010; Chan 2011; Marteau 2012; Schlam 2018; Smith 2013), to one year (Schlam 2018).
Excluded studies
We excluded six additional studies at this update. Two did not include an eligible adherence outcome (ISRCTN33423896; McClure 2013), and four did not include an eligible intervention (Cropsey 2017; Gong 2016; McClure 2016; Tseng 2017). Tseng 2017 was previously included in this review as an ongoing study; however, based on information in the published report it was deemed ineligible for inclusion at this update. The detailed description of the intervention made it clear that the content was equally split between standard smoking cessation support and content focused specifically on increasing medication adherence ("Each day participants in the two TM [text message] arms received one adherence‐focused message and one IMB [information‐motivation‐behavioural skills model] smoking cessation‐themed message"). As one of the inclusion criteria for this review stated that differing intervention content should have a clear principal focus on increasing adherence to medications for tobacco dependence, reflected in both described content and stated aims, we decided that this study did not meet the eligibility criteria and would not allow us to assess the effect of the adherence intervention independently.
We excluded 21 studies in the previous version of this review (Hollands 2015b). Our previous searches also identified two studies awaiting classification, which we were still unable to fully assess and include due to a lack of information (Applegate 2007; Yuhongxia 2011). See Characteristics of studies awaiting classification table.
Risk of bias in included studies
It is clear from the risk of bias summary that the included studies were often difficult to assess for bias on our criteria because there was insufficient information in published reports (Figure 2). For summary risk of bias judgements, as described in Assessment of risk of bias in included studies, we were able to judge that these conferred a low summary risk of bias for one study (Marteau 2012). Four studies were assessed at high risk of bias (Mooney 2005; Mooney 2007; Schmitz 2005; Smith 2013), with the remaining studies assessed at unclear risk of bias. Few judgements were made suggesting a high risk of bias for any domain, with the only four examples being risk of bias due to blinding of outcome assessment for Smith 2013 and due to incomplete outcome data for Mooney 2005, Mooney 2007, and Schmitz 2005.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Three studies were at low risk of selection bias with details being provided of an adequate sequence generation process and steps to ensure allocation concealment (Chan 2011; Marteau 2012; Schlam 2018). One study provided details of adequate allocation concealment but not sequence generation (Nollen 2011), while one study provided details of adequate sequence generation but not allocation concealment (Smith 2013). In the other studies, there was insufficient detail to judge the risk of selection bias (Chan 2010; Mooney 2005; Mooney 2007; Schmitz 2005; Tucker 2017).
Blinding
We did not assess performance bias, as described in the Assessment of risk of bias in included studies section. We did assess whether outcomes were assessed blind to allocation (detection bias). Six studies were judged to be at low risk of detection bias (Marteau 2012; Mooney 2005; Mooney 2007; Nollen 2011; Schmitz 2005; Tucker 2017), one was judged at high risk of detection bias, as it used self‐report to assess all components of the primary adherence outcome (Smith 2013), and three were judged at unclear risk of bias (Chan 2010; Chan 2011; Schlam 2018). Some studies clearly attempted to blind outcome assessors to the secondary abstinence outcome (Chan 2010; Marteau 2012), although only in one study to the primary adherence outcome (Chan 2011). Elsewhere, attempts to blind outcome assessors were unclear (Mooney 2005; Mooney 2007; Nollen 2011; Schlam 2018; Schmitz 2005; Smith 2013; Tucker 2017). However, the use of objective outcome measures of adherence and biochemical validation of abstinence (for all other than Schlam 2018 and Smith 2013), was evidence that these outcomes were unlikely to be affected by detection bias.
Incomplete outcome data
We deemed five studies at low risk of bias because they had low levels of attrition, or addressed substantial or differential (or both) attrition (Chan 2010; Chan 2011; Marteau 2012; Schlam 2018; Smith 2013). Two studies were judged to be at unclear risk of bias (Nollen 2011; Tucker 2017). Three studies were judged to be at high risk of bias because participant numbers were not fully reported, the overall number of participants lost was 50% or greater, the difference in percentage followed up between groups was 20% or more, or a combination of these (Mooney 2005; Mooney 2007; Schmitz 2005).
Selective reporting
Four trials were preregistered on a clinical trials register enabling us to corroborate that specified outcomes remained consistent and so we assessed risk of bias as low (Chan 2010; Chan 2011; Marteau 2012; Smith 2013). One of these also published a protocol (Marteau 2012). A further study was preregistered on a clinical trials register but the adherence outcomes were not specified (Schlam 2018) and so we assessed risk of bias as unclear. We were unable to find registrations for the other five studies so selective reporting within the final reports could not reasonably be ruled out and risk of bias was considered unclear (Mooney 2005; Mooney 2007; Nollen 2011; Schmitz 2005; Tucker 2017).
Other potential sources of bias
We regarded another potential source of bias that was relevant to this review to be consistency in intervention delivery, judging this by whether it was clear that the information given to participants was standardised or structured to some degree, and fidelity to protocol was systematically monitored. Six studies were judged to be at low risk of other bias (Chan 2011; Marteau 2012; Mooney 2005; Nollen 2011; Schlam 2018; Tucker 2017), with the remaining four assessed at unclear risk of bias (Chan 2010; Mooney 2007; Schmitz 2005; Smith 2013).
Effects of interventions
Primary outcome
Adherence to medication for tobacco dependence
Five studies reported dichotomous adherence measures (Chan 2010; Chan 2011; Mooney 2007; Schmitz 2005; Tucker 2017). Chan 2010 and Chan 2011 assessed whether or not there had been continuous use of NRT, for four weeks (Chan 2010) and eight weeks (Chan 2011). Mooney 2007 and Schmitz 2005 both assessed whether or not participants had taken two daily doses of bupropion as prescribed over the seven‐week treatment period. Tucker 2017 assessed whether participants had used six or more nicotine patches per week, for those participants who provided complete data at baseline and follow‐up. Five studies used continuous adherence measures (Marteau 2012; Mooney 2005; Nollen 2011; Schlam 2018; Smith 2013). Marteau 2012 assessed the proportion of prescribed NRT consumed over the four‐week treatment period and reported the group mean. Mooney 2005 reported the mean pieces of nicotine gum used during the first 15 days of a quit attempt in those who completed the treatment period only. Nollen 2011 assessed the proportion of prescribed varenicline doses taken over three months, for those who remained engaged. Schlam 2018 measured the percentage of days in the first six weeks of the quit attempt where participants were adherent (i.e. where participants used both a nicotine patch and four or more pieces of gum), in those participants who completed the treatment phase. Smith 2013 assessed self‐reported number of days of nicotine patch use in the first two weeks, for those remaining engaged.
Pooled analysis of these data, comprising 12 comparisons from 10 studies, showed that adherence interventions produced a small improvement in adherence, with no significant statistical heterogeneity being observed (SMD 0.10, 95% CI 0.03 to 0.18; I² = 6%; n = 3655; Figure 3). Re‐expressing this effect size produced by the primary random‐effects meta‐analysis in a more familiar metric (see Data synthesis) suggested that interventions to increase adherence could have an effect equivalent to a 3.9% increase (95% CI 1.2% to 7.0%) in the mean proportion of prescribed medications consumed over 28 days.

Forest plot of comparison: 1 Medication adherence intervention plus standard care versus standard care alone, outcome: 1.1 Adherence (combined dichotomous and continuous).
GRADE assessment indicated that the evidence for this outcome was of moderate certainty, meaning that the true effect is probably close to the estimated effect. This judgement was reached through consideration of the following criteria. The current evidence was downgraded once due to risk of bias, because the majority of studies were judged to be at high or unclear risk of bias. We did not downgrade the evidence further based on other GRADE considerations. For imprecision, the number of participants (sample size) incorporated into this meta‐analysis exceeded the optimal information size (i.e. a sufficient sample size for a single adequately powered trial), and the 95% CI ranged from a very small to a small benefit. For inconsistency, there was minimal heterogeneity and considerable overlapping of CIs. There was no clear reason to downgrade certainty of evidence for indirectness (providing it was emphasised that moderate evidence related only to those receiving an adherence intervention in addition to behavioural support for smoking cessation, compared to behavioural support alone). Finally, for other considerations, including publication bias, the certainty of the evidence was not downgraded. Although a funnel plot of the primary outcome data suggested possible asymmetry (Figure 4), only one of 12 included comparisons was statistically significant, and there was not a clearly consistent pattern of smaller studies resulting in greater intervention effect estimates than larger studies. This limited the plausibility of publication bias as an explanation for asymmetry (Sterne 2011).
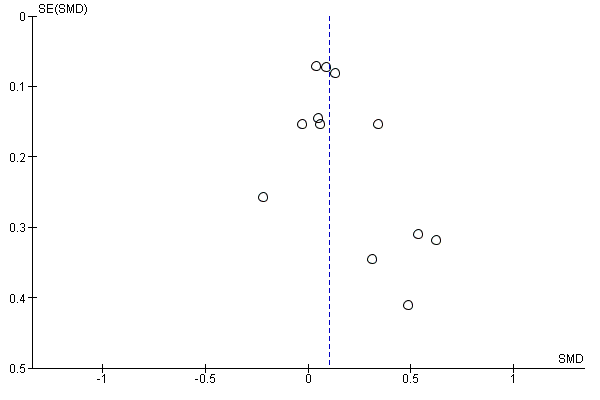
Funnel plot of comparison: 1 Medication adherence intervention plus standard care versus standard care alone, outcome: 1.1 Adherence (combined dichotomous and continuous).
Subgroup analyses
We conducted three subgroup analyses of the primary analysis in order to examine the relative impact of specific intervention types in terms of their focus on 'perceptions'; 'practicalities'; or 'both' (Analysis 1.2); and whether the intervention was participant‐centred or clinician‐centred (Analysis 1.3). The third analysis considered these two factors in combination (Analysis 1.4).
There was no strong evidence that the effect of interventions that focused on perceptions, practicalities, or on both differed in their effect on adherence (I² = 13%, P = 0.32; Analysis 1.2). That said, the effect of interventions focused on practicalities appeared slightly larger than the other two groups, with an SMD of 0.21 (95% CI 0.03 to 0.38; I² = 39%; n = 1752), compared with perceptions (SMD 0.10, 95% CI –0.03 to 0.24; I² = 0%; n = 839), or a combination of both perceptions and practicalities (SMD 0.04, 95% CI –0.08 to 0.16; I² = 0%; n = 1064).
There was no clear evidence that participant‐centred interventions differed in effectiveness from clinician‐centred interventions (I² = 0%, P = 0.71; Analysis 1.3). The SMD for participant‐centred interventions was 0.12 (95% CI 0.02 to 0.23; I² = 20%; n = 2791) and for clinician‐centred interventions was 0.09 (95% CI –0.05 to 0.23; I² = 0%; n = 864).
There was also no strong evidence that combining these two classification systems led to subgroup differences in the effect of interventions on medication adherence (I² = 0%, P = 0.65; Analysis 1.4).
We conducted a further subgroup analysis to examine whether there were differential effects of the intervention depending on which medication was prescribed (Analysis 1.5). In this analysis, there was stronger evidence of subgroup differences (I² = 68%, P = 0.04). The effect of interventions to increase adherence to bupropion (SMD 0.58, 95% CI 0.14 to 1.01; I² = 0%; n = 152) was much larger than that for NRT (SMD 0.09, 95% CI 0.02 to 0.17; I² = 0%; n = 3442) or varenicline (SMD from only one study was –0.22, 95% CI –0.73 to 0.29; n = 61).
Secondary outcomes
We reported assessments measured at the time point that most closely accorded with the assessment of adherence. If this selected abstinence measure assessed short‐term abstinence (less than six months), we additionally report abstinence at the longest available time point of six months or longer in order to assess the long‐term benefit of the intervention on cessation rates.
Short‐term abstinence (less than six months)
Five studies contributed data to the analysis of short‐term abstinence (Marteau 2012; Mooney 2005; Nollen 2011; Smith 2013; Tucker 2017). Marteau 2012 assessed biochemically validated prolonged abstinence at 28 days, Mooney 2005 assessed biochemically validated point‐prevalent abstinence at two weeks and Nollen 2011 assessed biochemically validated point‐prevalent abstinence at three months. Smith 2013 measured self‐reported 30‐day point‐prevalent abstinence at six weeks, while Tucker 2017 assessed biochemically validated continuous abstinence over 90 days.
Random‐effects meta‐analysis pooling these data produced an RR of 1.08 (95% CI 0.96 to 1.21; I² = 0%; n = 1795; Analysis 1.8). This suggested a potential small effect of adherence interventions on short‐term abstinence from smoking but with considerable uncertainty due to CIs overlapping no effect and including the possibility of a very small negative effect on abstinence.
GRADE assessment indicated that the evidence for this outcome was of low certainty, meaning that the true effect might be markedly different from the estimated effect. This judgement was reached through consideration of the following criteria. The current evidence was downgraded by one level due to risk of bias, because the majority of studies were judged to be at high or unclear risk of bias. It was also downgraded by one level due to imprecision, because while the number of participants (sample size) incorporated into this meta‐analysis exceeded the optimal information size (i.e. a sufficient sample size for a single adequately powered trial), the 95% CI overlapped no effect and ranged from a very small harm to a small benefit. We did not downgrade further due to other considerations, namely inconsistency (because there was negligible heterogeneity), indirectness or publication bias (with insufficient studies for formal assessment).
Long‐term abstinence (six months or longer)
Five studies (seven comparisons) contributed data to long‐term abstinence (Chan 2010; Chan 2011; Marteau 2012; Schlam 2018; Smith 2013). All five studies assessed abstinence at six months, which was biochemically validated in three studies (Chan 2010; Chan 2011; Marteau 2012), and based on self‐report in two studies (Schlam 2018; Smith 2013). Random‐effects meta‐analysis pooling these data produced an RR of 1.16 (95% CI 0.96 to 1.40; I² = 48%; n = 3593; Analysis 1.9). This suggested a potential small effect of adherence interventions on long‐term abstinence; however, considerable uncertainty arose due to the lower CI including the possibility of a very small negative effect on abstinence. Participants subject to interventions to improve adherence were between 4% less likely and 16% more likely to be abstinent at six months than those given standard behavioural support.
GRADE assessment indicated that the evidence for this outcome was of low certainty, meaning that the true effect might be markedly different from the estimated effect. This judgement was reached through consideration of the following criteria. The current evidence was downgraded by one level due to risk of bias because the majority of studies were at high or unclear risk of bias. It was also downgraded by one level for imprecision, because while the number of participants (sample size) incorporated into this meta‐analysis exceeded the optimal information size (i.e. a sufficient sample size for a single adequately powered trial), the 95% CI overlapped no effect and ranged from a very small harm to a small benefit. We did not downgrade further for other considerations, namely inconsistency (because heterogeneity was not classed as substantial), indirectness or publication bias (there were insufficient studies for formal assessment).
Sensitivity analyses
In sensitivity analyses, we excluded those studies at high risk of bias to determine if the primary and secondary outcome analyses were affected. Removing the two studies at high risk of bias (Mooney 2005; Smith 2013) did not affect results and interpretation for either the primary outcome (adherence to medication for tobacco dependence: SMD 0.12, 95% CI 0.02 to 0.22) or secondary outcomes (short‐term abstinence: RR 1.05, 95% CI 0.83 to 1.33; long‐term abstinence: RR 1.23, 95% CI 0.99 to 1.54).
Other outcomes
Factors plausibly associated with increases in adherence
No studies reported any relevant outcomes (i.e. factors plausibly associated with increases in adherence, such as intention or motivation, or attitudes towards treatment).
Adverse events
Four studies explicitly reported adverse events (Marteau 2012; Mooney 2005; Schlam 2018; Smith 2013). In Marteau 2012, there were no adverse events that were plausibly related to the intervention or its effect on participants' exposure to medication. There were also no differences between groups in levels of anxiety at either one‐week or six‐month assessment times. In Mooney 2005, there was no difference in adverse events between groups and in Schlam 2018 and Smith 2013 there were no serious adverse events during the study.
Discusión
Resumen de los resultados principales
Existe evidencia de certeza moderada de que las intervenciones que dedican especial atención a mejorar la adherencia a los fármacos para el abandono del hábito de fumar pueden mejorarla hasta cierto punto, cuando se agregan al apoyo conductual para el abandono del hábito de fumar. Dichas intervenciones implican la posibilidad de considerar los aspectos prácticos de la toma de medicamentos, incluida la facilitación de la resolución de problemas, o la provisión de información para considerar las percepciones sobre el valor de la toma de medicamentos o las preocupaciones sobre esta posibilidad. Existe evidencia de baja certeza de que dichas intervenciones pueden mejorar ligeramente la probabilidad de lograr la abstinencia. La evidencia para estos resultados fue limitada tanto en calidad como en cantidad ‐ caracterizada por un pequeño número de estudios, heterogeneidad clínica, calidad deficiente de los estudios y estimaciones imprecisas del efecto, que incorporan tanto efectos beneficiosos como perjudiciales potenciales.
Con respecto a la pequeña mejoría observada en la adherencia, la traducción del pequeño tamaño del efecto estadístico a una medida más familiar sugiere un efecto potencial equivalente a un aumento del 4% en la proporción media de medicación prescrita consumida (sin embargo, véase Síntesis de datos para observar las limitaciones de dichas traducciones). Una estimación es que cada miligramo adicional por día de TRN consumido podría aumentar las probabilidades de abstinencia en un 5% (Hollands 2013), por lo que esto representaría un aumento pequeño pero apreciable, equivalente al consumo de un miligramo adicional de TRN con una prescripción de 25 mg. Debido a la evidencia de que una mayor adherencia mejora los resultados de cesación de las personas que usan el TRN, y la evidencia de que las dosis más altas de vareniclina son más efectivas que las dosis más bajas (Cahill 2016), resulta lógico que este hecho se aplique también a otros fármacos, debido a que los fármacos no pueden funcionar si no se consumen. Las características del tratamiento también pueden ser moldeadas para intentar aumentar los niveles de base generales de la adherencia. Por ejemplo, se ha demostrado que las características del fármaco (Hollands 2013) y su administración (Hajek 1999) influyen en la adherencia. Incluso cuando las intervenciones de adherencia demuestran tamaños del efecto de las pequeñas magnitudes que se observan aquí, el potencial de impacto agregado es considerable, debido al grado de uso actual de los medicamentos para la dependencia del tabaco, al menos en los países de ingresos altos. El grado en que lo anterior se aplique en última instancia a nivel mundial depende del aumento de la aceptación de las farmacoterapias efectivas, en parte mediante el aumento de su disponibilidad y la reducción de su coste (van den Brand 2017).
Debido a que estas intervenciones suelen incluir agregados relativamente menores al apoyo conductual estándar, gran parte del contenido de las intervenciones incluidas pareció relativamente homogéneo. Sin embargo, una evaluación detallada del contenido específicamente relacionado con la adherencia reveló algunas vías potenciales para una investigación más profunda. Las intervenciones que se centran en considerar las barreras prácticas a la adherencia (en oposición a las percepciones del tratamiento) y responden a las necesidades de los participantes (en oposición a estar regidas por una agenda clínica establecida), y las que combinan ambos enfoques, pueden ser las más efectivas. Sin embargo, la evidencia que sugiere lo anterior es muy débil, particularmente debido a que no hubo evidencia sólida de diferencias entre subgrupos y, por lo tanto, debe tratarse con cautela. Estos hallazgos tentativos concuerdan con las guías inglesas sobre la adherencia a los fármacos (NICE 2009), que a su vez se basan en una revisión de la literatura sobre las intervenciones efectivas en la adherencia. Esta guía recalca que los factores prácticos y las barreras deben ser considerados claves para explicar la falta de adherencia, no solo las creencias y las preferencias de los participantes sobre el tratamiento. Además, reflejan evidencia que sugiere que el simple hecho de proporcionar información para dirigir las cogniciones y motivar cambios en el comportamiento a menudo es insuficiente sin considerar también factores como las acciones prácticas para superar las barreras estructurales, que impiden que se hagan realidad las buenas intenciones (Hollands 2012; Webb 2006). También es posible que un examen más detallado del contenido de la intervención proporcione una visión más clara de los mecanismos efectivos e ineficaces. El logro de una comprensión más precisa de la composición y los procesos de las intervenciones efectivas requerirá una mayor profundidad de la evidencia, incluidas las intervenciones que evalúan los mediadores, y las mejorías en la ciencia y el informe de las intervenciones conductuales (Sumner 2018).
Compleción y aplicabilidad general de las pruebas
La revisión incluyó solo diez ensayos, que fueron variables en cuanto a su contexto, los componentes de la intervención y las medidas de resultado primario, la adherencia a la medicación, lo que dificulta el resumen de los datos y reduce la certeza de las estimaciones producidas. Todos estos estudios incluyeron a participantes que estaban motivados a dejar de fumar o reducir el hábito de fumar, que habían buscado y estaban recibiendo algún grado de apoyo conductual ‐ ya sea cara a cara o por teléfono ‐ para tomar la medicación y que no estaban pagando por dicha medicación. Además, ningún estudio se centró en los participantes que eran más propensos a ser no adherentes, como los que no se habían adherido a la medicación anteriormente. En consecuencia, tal vez, la adherencia a la medicación en general fue razonablemente alta. Por ejemplo, Nollen 2011 y Marteau 2012 informaron que el porcentaje medio de dosis prescritas administradas en el brazo de intervención fue superior al 82% y el brazo de control fue superior al 63%, aunque en este último estudio, los participantes que habían abandonado su intento de dejar de fumar e interrumpieron el seguimiento se contaron como no adherentes. En los estudios que utilizaron medidas dicotómicas de la adherencia adecuada, tres estudios informaron que más del 50% de los participantes lograron niveles satisfactorios de adherencia (Chan 2011; Mooney 2007; Schmitz 2005). Tal vez en el contexto de la población general de personas que buscan apoyo para dejar de fumar, el uso de fármacos es relativamente alto ‐ contrariamente a la percepción de que la adherencia comúnmente es subóptima ‐ y las intervenciones solo tienen un potencial limitado para mejorar aún más la adherencia. Sin embargo, la mayoría de las personas que dejan de fumar con la ayuda de fármacos lo hacen sin apoyo conductual (Fidler 2011), y típicamente cualquier fármaco debe ser adquirido a un coste considerable. Es probable que la adherencia en este contexto sea mucho menor y que las intervenciones para mejorar la adherencia puedan ser particularmente útiles, pero también que la ejecución de estas intervenciones sea especialmente desafiante. En la actualidad no existe evidencia sobre lo que puede ser efectivo en estos contextos sin apoyo, aunque parece probable que la focalización de las percepciones o los aspectos prácticos, o ambos, sea relevante. Un último punto es que hay evidencia de certeza moderada de que el reembolso de los costes de los fármacos cuando no se proporcionan de forma gratuita mejora la adherencia (van den Brand 2017).
Calidad de la evidencia
La mayoría de los estudios se consideró en riesgo de sesgo poco claro debido al informe deficiente sobre la asignación al azar, aunque todos ellos se publicaron desde la primera publicación de la declaración CONSORT (Moher 2010). Solo tres estudios informaron procedimientos con suficiente claridad como para clasificarlos como en bajo riesgo de sesgo (Chan 2011; Marteau 2012; Schlam 2018). Es posible, aunque relativamente improbable, que este hecho diera lugar a sesgo. En el contexto de las clínicas para dejar de fumar, por lo general los terapeutas desconocen a los participantes del ensayo, y esto probablemente disminuye, pero no elimina, la probabilidad de que los terapeutas asignen a determinados participantes a determinados brazos y subviertan la asignación al azar. No obstante, este hecho debe considerarse en los informes de los ensayos futuros. Una fuente potencial de sesgo es que los profesionales que proporcionaron la intervención de adherencia también recolectaron datos sobre el grado de adherencia de las personas. Como tales, no estaban cegados, lo que también puede motivar a los participantes a informar sobre una mejor adherencia. Esta preocupación fue mitigada de forma considerable por el uso de los "recuentos de tabletas", comunes a la mayoría de estos ensayos. Es alentador que el uso de medidas más objetivas parezca común en este tipo de ensayos, lo que significa que no se consideró que las cuestiones de medición confirieran un riesgo particular de sesgo en la mayoría de los estudios. Estos datos contrastan con otra revisión Cochrane que se centra en la adherencia a los fármacos prescritos, donde la mayoría de los estudios utilizaron medidas de autoinforme (Nieuwlaat 2014). Además, si bien en el pasado los abordajes de vigilancia electrónica se aplicaron principalmente a la apertura y el cierre de los frascos de comprimidos, lo que los hacía adecuados solo para determinados tipos de fármacos, se ha desarrollado una tecnología que permitirá que se utilicen para otros tipos de almacenamiento de medicamentos.
La calidad general de la evidencia de cada resultado se evaluó mediante el sistema GRADE. Para la medida de resultado primaria de la adherencia, la evaluación GRADE indicó que la evidencia para esta medida de resultado era de certeza moderada, lo que significa que el efecto verdadero probablemente es cercano al efecto estimado. La evidencia actual se disminuyó solo una vez, debido al riesgo de sesgo, ya que se consideró que la mayoría de los estudios presentaba un riesgo de sesgo alto o incierto. No se disminuyó la evidencia aún más sobre la base de otras consideraciones GRADE. La evidencia fue de baja certeza para ambos resultados secundarios de la abstinencia a corto y a largo plazo, lo que significa que el efecto real podría ser notablemente diferente del efecto estimado. La evidencia actual se disminuyó dos veces para cada uno de estos resultados, lo cual en ambos casos se debió, en primer lugar, al riesgo de sesgo, debido a que se consideró que la mayoría de los estudios presentaba un riesgo de sesgo alto o incierto, y en segundo lugar, a la imprecisión, debido a que el IC del 95% no se superpuso con ningún efecto y varió desde un efecto perjudicial muy pequeño a un beneficio pequeño. Lo anterior sugiere que la investigación adicional sobre los resultados de la abstinencia será valiosa para aumentar la confiabilidad y la precisión de los cálculos del efecto y la certeza de los mismos.
Sesgos potenciales en el proceso de revisión
Las posibles limitaciones clave de la revisión son que, en primer lugar, es posible que no se hayan identificado todas las investigaciones pertinentes para su inclusión en la revisión. Se tomaron medidas para minimizar esta posibilidad, incluida la búsqueda en el registro especializado del Grupo de Adicción al Tabaco, además de las búsquedas en bases de datos electrónicas, aunque aún existe esta posibilidad. En segundo lugar, es posible que haya habido sesgo de publicación, debido a que hubo asimetría en el gráfico de embudo, aunque no se consideró que el sesgo de publicación fuera una explicación probable (ver Efectos de las intervenciones). Lamentablemente, dos estudios se clasificaron como "en espera de clasificación" debido a que la información disponible era insuficiente para confirmar la inclusión y no fue posible establecer contacto con los autores (Applegate 2007; Yuhongxia 2011).
Acuerdos y desacuerdos con otros estudios o revisiones
No se tiene conocimiento de otras revisiones que consideren este tema. Las revisiones Cochrane muestran que el apoyo conductual aumenta el abandono del hábito de fumar y, por lo general, los estudios incluidos estaban compuestos por personas que usaban medicación y recibían asesoramiento sobre la adherencia como parte del apoyo estándar para el abandono del hábito de fumar (Hartmann‐Boyce 2019; Lancaster 2017). Sin embargo, los estudios no asignaron al azar a las personas para recibir o no recibir un componente de adherencia a la medicación, por lo que no aportan evidencia específica sobre su efecto. Nieuwlaat 2014 examinó el efecto de las intervenciones para mejorar la adherencia en una gama más amplia de fármacos en un contexto general. Encontraron que los enfoques de información y asesoramiento mejoraron la adherencia y los resultados de los pacientes, aunque no pudieron identificar los componentes clave de las intervenciones. Nieuwlaat 2014 excluyó los fármacos para la dependencia del tabaco, de ahí la necesidad de esta revisión actual.
Study flow diagram for the current review update (eight studies were included in the previous version of the review).

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Forest plot of comparison: 1 Medication adherence intervention plus standard care versus standard care alone, outcome: 1.1 Adherence (combined dichotomous and continuous).

Funnel plot of comparison: 1 Medication adherence intervention plus standard care versus standard care alone, outcome: 1.1 Adherence (combined dichotomous and continuous).

Comparison 1 Medication adherence intervention plus standard care versus standard care alone, Outcome 1 Adherence (combined dichotomous and continuous).

Comparison 1 Medication adherence intervention plus standard care versus standard care alone, Outcome 2 Adherence: intervention focus subgroups.
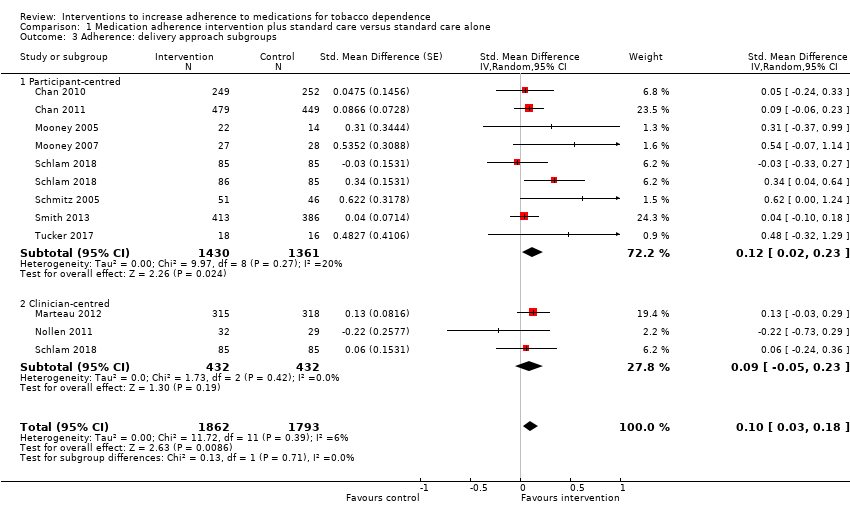
Comparison 1 Medication adherence intervention plus standard care versus standard care alone, Outcome 3 Adherence: delivery approach subgroups.

Comparison 1 Medication adherence intervention plus standard care versus standard care alone, Outcome 4 Adherence: combined focus and delivery subgroups.

Comparison 1 Medication adherence intervention plus standard care versus standard care alone, Outcome 5 Adherence: medication type subgroups.
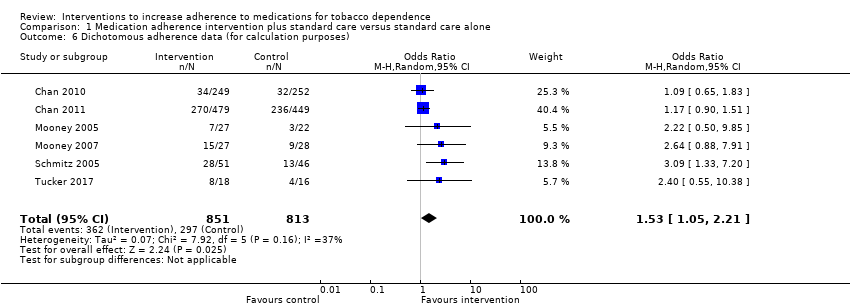
Comparison 1 Medication adherence intervention plus standard care versus standard care alone, Outcome 6 Dichotomous adherence data (for calculation purposes).
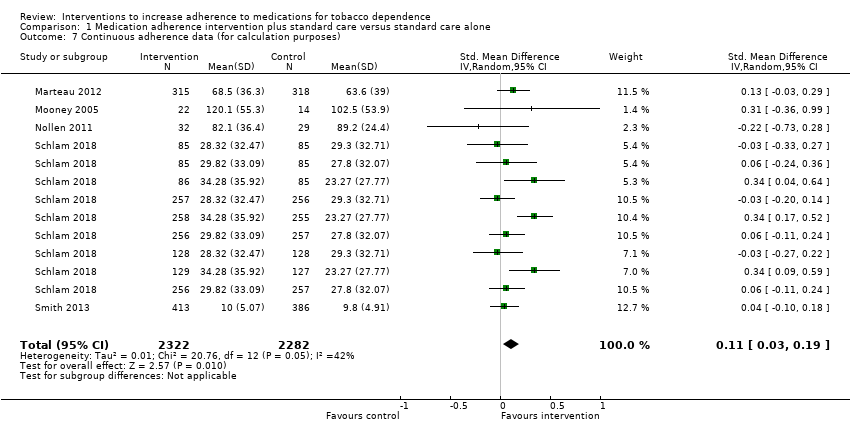
Comparison 1 Medication adherence intervention plus standard care versus standard care alone, Outcome 7 Continuous adherence data (for calculation purposes).
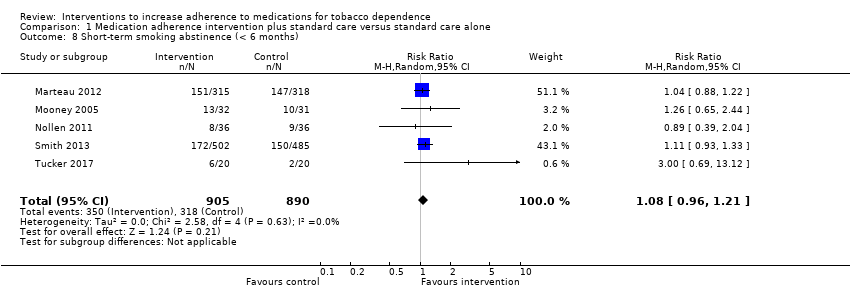
Comparison 1 Medication adherence intervention plus standard care versus standard care alone, Outcome 8 Short‐term smoking abstinence (< 6 months).
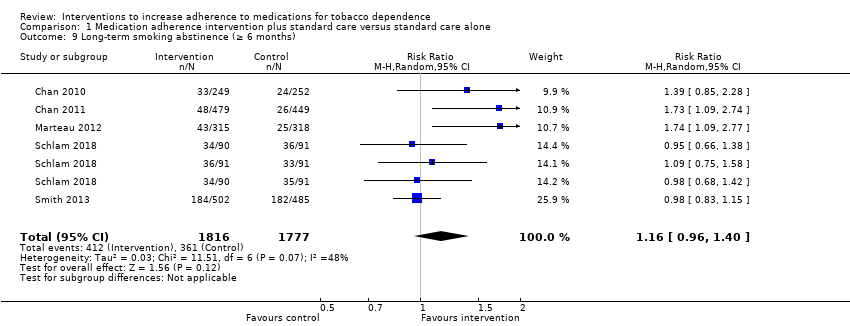
Comparison 1 Medication adherence intervention plus standard care versus standard care alone, Outcome 9 Long‐term smoking abstinence (≥ 6 months).
| Interventions to increase adherence compared to standard care for improving adherence to medications for tobacco dependence and abstinence from smoking | |||||
| Patient or population: adult smokers | |||||
| Outcomes | Relative effect (95% CI) | Illustrative comparative risks (95% CI) | No of participants | Certainty of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Standard care | Intervention to increase adherence | ||||
| Adherence to medications for tobacco dependence | SMD 0.10 (0.03 to 0.18) | Mean proportion of prescribed medication consumed over 28 days was 63.6% | Mean proportion of prescribed medication consumed over 28 days was 3.9% higher (95% CI 1.2% to 7.0% higher) | 3655 | ⊕⊕⊕⊝ |
| Short‐term abstinence from smoking (< 6 months) | RR 1.08 | 357 people per 1000 achieve abstinence) | 386 people per 1000 achieve abstinence (95% CI 343 to 432) | 1795 | ⊕⊕⊝⊝ |
| Long‐term abstinence from smoking (≥ 6 months) | RR 1.16 | 203 people per 1000 achieve abstinence | 236 per 1000 achieve abstinence (95% CI 195 to 284) | 3593 | ⊕⊕⊝⊝ |
| The basis for the illustrative comparative risks is provided in Footnotesd. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). CI: confidence interval; RCT: randomised controlled trial; RR: risk ratio; SMD: standardised mean difference. | |||||
| GRADE Working Group grades of evidence High certainty: current evidence provides a very good indication of the likely effect, and the likelihood that the actual effect will be substantially different is low. | |||||
| aMost studies were at high or unclear risk of bias which lowers confidence in estimate of effect (risk of bias). | |||||
| Study | Brief description of specific intervention components intended to increase adherencea | Additional contact time relative to standard care? | Medication for which adherence was targeted | Intervention focused on perceptions, practicalities or both | Participant‐ or clinician‐centred intervention |
| Added counselling contact time to standard behavioural support, focusing specifically on medication adherence | Yes | NRT | Practicalities | Participant | |
| Added counselling contact time to standard behavioural support, focusing specifically on medication adherence | Yes | NRT | Practicalities | Participant | |
| Tailored and communicated about NRT dosage using a more potent rationale (genotype vs phenotype) | No | NRT | Perceptions | Clinician | |
| Personalised feedback of questionnaire responses regarding medication | No | NRT | Perceptions | Participant | |
| Personalised feedback of externally validated medication adherence | Yes | Bupropion | Practicalities | Participant | |
| Added counselling contact time to standard behavioural support, focusing specifically on medication adherence | Yes | Varenicline | Both | Clinician | |
| Added contact time to standard behavioural support with: 1. medication adherence counselling; 2. automated reminder calls; 3. electronic monitoring counselling | Yes | NRT | 1. Perceptions 2. Both 3. Practicalities | 1. Participant 2. Clinician 3. Participant | |
| Personalised feedback of externally validated medication adherence | Yes | Bupropion | Practicalities | Participant | |
| Added counselling contact time to standard behavioural support, focusing specifically on medication adherence | Yes | NRT | Both | Participant | |
| Added contact time to standard behavioural support with module focused on improving adherence to nicotine patch | Yes | NRT | Both | Participant | |
| aFor further details see Characteristics of included studies table. NRT: nicotine replacement therapy. | |||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Adherence (combined dichotomous and continuous) Show forest plot | 10 | 3655 | Std. Mean Difference (Random, 95% CI) | 0.10 [0.03, 0.18] |
| 2 Adherence: intervention focus subgroups Show forest plot | 10 | 3655 | Std. Mean Difference (Random, 95% CI) | 0.10 [0.03, 0.18] |
| 2.1 Perceptions | 3 | 839 | Std. Mean Difference (Random, 95% CI) | 0.10 [‐0.03, 0.24] |
| 2.2 Practicalities | 5 | 1752 | Std. Mean Difference (Random, 95% CI) | 0.21 [0.03, 0.38] |
| 2.3 Both perceptions and practicalities | 4 | 1064 | Std. Mean Difference (Random, 95% CI) | 0.04 [‐0.08, 0.16] |
| 3 Adherence: delivery approach subgroups Show forest plot | 10 | 3655 | Std. Mean Difference (Random, 95% CI) | 0.10 [0.03, 0.18] |
| 3.1 Participant‐centred | 8 | 2791 | Std. Mean Difference (Random, 95% CI) | 0.12 [0.02, 0.23] |
| 3.2 Clinician‐centred | 3 | 864 | Std. Mean Difference (Random, 95% CI) | 0.09 [‐0.05, 0.23] |
| 4 Adherence: combined focus and delivery subgroups Show forest plot | 10 | 3655 | Std. Mean Difference (Random, 95% CI) | 0.10 [0.03, 0.18] |
| 4.1 Perceptions + participant | 2 | 206 | Std. Mean Difference (Random, 95% CI) | 0.03 [‐0.25, 0.30] |
| 4.2 Perceptions + clinician | 1 | 633 | Std. Mean Difference (Random, 95% CI) | 0.13 [‐0.03, 0.29] |
| 4.3 Practicalities + participant | 5 | 1752 | Std. Mean Difference (Random, 95% CI) | 0.21 [0.03, 0.38] |
| 4.4 Both + participant | 2 | 833 | Std. Mean Difference (Random, 95% CI) | 0.08 [‐0.16, 0.32] |
| 4.5 Both + clinician | 2 | 231 | Std. Mean Difference (Random, 95% CI) | ‐0.01 [‐0.27, 0.24] |
| 5 Adherence: medication type subgroups Show forest plot | 10 | 3655 | Std. Mean Difference (Random, 95% CI) | 0.10 [0.03, 0.18] |
| 5.1 Nicotine replacement therapy | 7 | 3442 | Std. Mean Difference (Random, 95% CI) | 0.09 [0.02, 0.17] |
| 5.2 Bupropion | 2 | 152 | Std. Mean Difference (Random, 95% CI) | 0.58 [0.14, 1.01] |
| 5.3 Varenicline | 1 | 61 | Std. Mean Difference (Random, 95% CI) | ‐0.22 [‐0.73, 0.29] |
| 6 Dichotomous adherence data (for calculation purposes) Show forest plot | 6 | 1664 | Odds Ratio (M‐H, Random, 95% CI) | 1.53 [1.05, 2.21] |
| 7 Continuous adherence data (for calculation purposes) Show forest plot | 5 | 4604 | Std. Mean Difference (IV, Random, 95% CI) | 0.11 [0.03, 0.19] |
| 8 Short‐term smoking abstinence (< 6 months) Show forest plot | 5 | 1795 | Risk Ratio (M‐H, Random, 95% CI) | 1.08 [0.96, 1.21] |
| 9 Long‐term smoking abstinence (≥ 6 months) Show forest plot | 5 | 3593 | Risk Ratio (M‐H, Random, 95% CI) | 1.16 [0.96, 1.40] |

