Fármacos de primera línea que inhiben el sistema renina angiotensina versus otras clases de antihipertensivos de primera línea para la hipertensión
Resumen
Antecedentes
Ésta es la primera actualización de una revisión Cochrane publicada por primera vez en 2015. Los inhibidores del sistema renina angiotensina (SRA) incluyen los inhibidores de la enzima convertidora de angiotensina (ECA), los bloqueadores de los receptores de angiotensina (BRA) y los inhibidores de la renina. Se prescriben ampliamente para el tratamiento de la hipertensión, sobre todo en los pacientes con diabetes debido a las supuestas ventajas para reducir la nefropatía diabética y la morbimortalidad cardiovascular. A pesar del uso generalizado para la hipertensión, no se ha podido precisar la eficacia ni la seguridad de los inhibidores del SRA en comparación con otras clases de fármacos antihipertensivos.
Objetivos
Evaluar los efectos beneficiosos y perjudiciales de los inhibidores del SRA de primera línea en comparación con otros fármacos hipotensores de primera línea en pacientes con hipertensión.
Métodos de búsqueda
El especialista en información del Grupo Cochrane de Hipertensión (Cochrane Hypertension Group) buscó ensayos controlados aleatorios en las siguientes bases de datos hasta noviembre de 2017: registro especializado del Grupo Cochrane de Hipertensión (Cochrane Hypertension Specialised Register), Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL) MEDLINE (desde 1946), Embase (desde 1974), en la World Health Organization International Clinical Trials Registry Platform y en ClinicalTrials.gov. También se estableció contacto con los autores de los artículos relevantes con respecto a otros trabajos publicados y no publicados. En las búsquedas no hubo restricciones de idioma.
Criterios de selección
Se incluyeron los estudios aleatorios, con control activo y doble ciego (ECA) con al menos seis meses de seguimiento en pacientes con presión arterial elevada (≥130/85 mmHg), que compararon inhibidores del SRA de primera línea con otras clases de fármacos hipotensores de primera línea y que informaron de la morbilidad y la mortalidad o los resultados de presión arterial. Se excluyeron los pacientes con hipertensión secundaria confirmada.
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, seleccionaron los ensayos incluidos, evaluaron los riesgos de sesgo e introdujeron los datos para el análisis.
Resultados principales
Esta actualización incluye tres nuevos ECA, para un total de 45, con 66 625 participantes, con una media de edad de 66 años. Gran parte de la evidencia para los resultados clave está dominada por un número pequeño de ECA grandes con riesgo bajo de sesgo para la mayoría de las fuentes de sesgo. Los desequilibrios en los fármacos hipotensores de segunda línea agregados en algunos de los estudios fueron lo bastante importantes como para disminuir la calidad de la evidencia.
Los resultados primarios fueron: la muerte por todas las causas, el accidente cerebrovascular mortal y no mortal, el infarto de miocardio (IM) mortal y no mortal, la insuficiencia cardíaca congestiva (ICC) mortal y no mortal que requiere hospitalización, los eventos cardiovasculares (CV) totales (accidente cerebrovascular mortal y no mortal, el IM mortal y no mortal y la ICC mortal y no mortal que requiere hospitalización) y la insuficiencia renal terminal (IRT). Los resultados secundarios fueron la presión arterial sistólica (PAS), la presión arterial diastólica (PAD) y la frecuencia cardíaca (FC).
En comparación con los bloqueadores de los canales de calcio (BCC) de primera línea, se encontró evidencia de calidad moderada de que los inhibidores del SRA de primera línea redujeron la insuficiencia cardíaca (IC) (35 143 participantes en cinco ECA, cociente de riesgos [CR] 0,83; intervalo de confianza [IC] del 95%: 0,77 a 0,90; reducción del riesgo absoluto [RRA] 1,2%) y aumentaron el accidente cerebrovascular (34 673 participantes en cuatro ECA, CR 1,19; IC del 95%: 1,08 a 1,32; aumento del riesgo absoluto [ARA] 0,7%). Evidencia de certeza moderada mostró que no hubo diferencias entre los inhibidores del SRA de primera línea y los BCC de primera línea para la mortalidad por todas las causas (35 226 participantes en cinco ECA, CR 1,03; IC del 95%: 0,98 a 1,09); los eventos CV totales (35 223 participantes en seis ECA, CR 0,98; IC del 95%: 0,93 a 1,02); ni el IM total (35 043 participantes en cinco ECA, CR 1,01; IC del 95%: 0,93 a 1,09). Evidencia de certeza baja indica que no hubo diferencias en la IRT (19 551 participantes en cuatro ECA, CR 0,88; IC del 95%: 0,74 a 1,05).
En comparación con las tiazidas de primera línea, se encontró evidencia de calidad moderada de que los inhibidores del SRA de primera línea aumentaron la IC (24 309 participantes en un ECA, CR 1,19; IC del 95%: 1,07 a 1,31; IRA 1,0%) y el accidente cerebrovascular (24 309 participantes en un ECA, CR 1,14; IC del 95%: 1,02 a 1,28; IRA 0,6%). Evidencia de certeza moderada mostró que no hubo diferencias entre los inhibidores del SRA de primera línea y las tiazidas de primera línea en la mortalidad por todas las causas (24 309 participantes en un ECA, CR 1,00; IC del 95%: 0,94 a 1,07); los eventos CV totales (24 379 participantes en dos ECA, CR 1,05; IC del 95%: 1,00 a 1,11); ni el IM total (24 379 participantes en dos ECA, CR 0,93; IC del 95%: 0,86 a 1,01). Evidencia de certeza baja indica que no hubo diferencias en la IRT (24 309 participantes en un ECA, CR 1,10; IC del 95%: 0,88 a 1,37).
En comparación con los betabloqueantes de primera línea, se encontró evidencia de baja calidad de que los inhibidores del SRA de primera línea redujeron los eventos CV totales (9239 participantes en dos ECA, CR 0,88; IC del 95%: 0,80 a 0,98; RRA 1,7%) y disminuyeron el accidente cerebrovascular (9193 participantes en un ECA, CR 0,75; IC del 95%: 0,63 a 0,88; RRA 1,7%). Evidencia de certeza baja indica que no hubo diferencias entre los inhibidores del SRA de primera línea y los betabloqueantes de primera línea en la mortalidad por todas las causas (9193 participantes en un ECA, CR 0,89; IC del 95%: 0,78 a 1,01); la IC (9193 participantes en un ECA, CR 0,95; IC del 95%: 0,76 a 1,18); ni el IM total (9239 participantes en dos ECA, CR 1,05; IC del 95%: 0,86 a 1,27).
Las comparaciones de la presión arterial entre los inhibidores del SRA de primera línea y otras clases de primera línea mostraron ninguna diferencia o diferencias pequeñas que necesariamente no se correlacionaron con diferencias en los resultados de morbilidad.
No hay información acerca de los eventos adversos graves no mortales, ya que ninguno de los ensayos informó este resultado.
Conclusiones de los autores
La muerte por todas las causas es similar con los inhibidores del SRA de primera línea y los BCC de primera línea, las tiazidas y los betabloqueantes. Sin embargo, existen diferencias en algunos resultados de morbilidad. Las tiazidas de primera línea causaron menos insuficiencia cardíaca y accidente cerebrovascular que los inhibidores del SRA de primera línea. Los BCC de primera línea aumentaron la IC, pero redujeron el accidente cerebrovascular en comparación con los inhibidores del SRA de primera línea. La magnitud del aumento en la IC excedió la reducción del accidente cerebrovascular. Evidencia de calidad baja indica que los inhibidores del SRA de primera línea redujeron los eventos de accidente cerebrovascular y los eventos CV totales en comparación con los betabloqueantes de primera línea. Las diferencias pequeñas en el efecto sobre la presión arterial entre las diferentes clases de fármacos no se correlacionaron con las diferencias en los resultados de morbilidad.
PICOs
Resumen en términos sencillos
Inhibidores del sistema renina angiotensina versus otro tipo de medicación para la hipertensión
Pregunta de la revisión
Se compararon los inhibidores del SRA (sistema renina angiotensina) como fármacos de primera línea para el tratamiento de la hipertensión con otros tipos de fármacos de primera línea (diuréticos tiazídicos, betabloqueantes, BCC, alfabloqueantes o fármacos con acción en el sistema nervioso central [SNC]) para la hipertensión.
Antecedentes
La hipertensión es un trastorno médico crónico que se asocia con morbimortalidad cardiovascular, como coronariopatía, enfermedad cerebrovascular y vasculopatía periférica, que reducirá la calidad de vida. Los inhibidores del SRA se han convertido en años recientes en el centro de las intervenciones para la hipertensión y se han prescrito ampliamente para el tratamiento de la hipertensión. Sin embargo, no está claro si los inhibidores del SRA son superiores a otros fármacos antihipertensivos en cuanto a resultados clínicamente relevantes.
Fecha de la búsqueda
Se buscó evidencia hasta noviembre de 2017.
Características de los estudios
En esta revisión se incluyeron ECA de diseño aleatorio, doble ciego, paralelo. Se incluyeron 45 ensayos con 66 625 participantes que se siguieron durante 0,5 años y 5,6 años. La edad promedio de los participantes fue 66 años.
Resultados clave
Se encontró que los inhibidores del SRA de primera línea causaron más insuficiencia cardíaca y accidentes cerebrovasculares que las tiazidas de primera línea. En comparación con los BCC de primera línea, los inhibidores del SRA de primera línea fueron superiores en la prevención de la insuficiencia cardíaca, pero inferiores en la prevención del accidente cerebrovascular, con una mayor reducción del riesgo absoluto de insuficiencia cardíaca que aumento del accidente cerebrovascular. En comparación con los betabloqueantes de primera línea, los inhibidores del SRA redujeron los eventos cardiovasculares totales y el accidente cerebrovascular. Se detectaron pequeñas diferencias en la eficacia en la reducción de la presión arterial, pero no parecieron estar relacionadas con el número de ataques cardíacos, accidentes cerebrovasculares o problemas renales.
Certeza de la evidencia
En general, la certeza de la evidencia se consideró baja a moderada según los criterios GRADE. Evidencia de certeza moderada demostró la superioridad de las tiazidas de primera línea en relación con los inhibidores del SRA de primera línea en la prevención de la insuficiencia cardíaca y el accidente cerebrovascular. La certeza de la evidencia se consideró moderada para la comparación entre los inhibidores del SRA y BCC. La certeza de la evidencia fue baja para la comparación entre los inhibidores del SRA y los betabloqueantes en los eventos cardiovasculares totales y el accidente cerebrovascular, ya que los resultados se basaron principalmente en un ensayo grande con riesgo de sesgo moderado a alto.
Conclusiones de los autores
Summary of findings
| First‐line RAS inhibitors compared to first‐line CCBs for hypertension | |||||||
| Patient or population: people with hypertension | |||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Certainty of the evidence (GRADE) | Comments | ||
| Assumed risk | Corresponding risk | ||||||
| CCBs | RAS inhibitors | ||||||
| All‐cause death | 124 per 1000 | 127 per 1000 | RR 1.03 | 35,226 | ⊕⊕⊕⊝ | ||
| Total cardiovascular events | 178 per 1000 | 174 per 1000 | RR 0.98 | 35,223 | ⊕⊕⊕⊝ | ||
| Death or hospitalization for heart failure | 72 per 1000 | 60 per 1000 | RR 0.83 | 35,143 | ⊕⊕⊕⊝ | ARR = 1.2% NNTB = 83 | |
| Total myocardial infarction | 68 per 1000 | 69 per 1000 | RR 1.01 | 35,043 | ⊕⊕⊕⊝ | ||
| Total stroke | 39 per 1000 | 46 per 1000 | RR 1.19 | 34,673 | ⊕⊕⊕⊝ | ARI = 0.7% NNTH = 143 | |
| End stage renal failure | 25 per 1000 | 22 per 1000 | RR 0.88 | 19,551 | ⊕⊕⊝⊝ | ||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||||
| GRADE Working Group grades of evidence | |||||||
| 1Downgraded because we judged some of the included trials to be at high risk of bias. | |||||||
| First‐line RAS inhibitors compared to first‐line thiazides for hypertension | ||||||
| Patient or population: people with hypertension Comparison: First‐line thiazides | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Certainty of the evidence (GRADE) | Comments | |
| Assumed risk | Corresponding risk | |||||
| Thiazides | RAS inhibitors | |||||
| All‐cause death | 144 per 1000 | 144 per 1000 (135 to 154) | RR 1.00 (0.94 to 1.07) | 24,309 (1) | ⊕⊕⊕⊝ | |
| Total cardiovascular events | 194 per 1000 | 204 per 1000 | RR 1.05 | 24,379 | ⊕⊕⊕⊝ | |
| Death or hospitalization for heart failure | 57 per 1000 | 68 per 1000 (61 to 75) | RR 1.19 (1.07 to 1.31) | 24,309 (1) | ⊕⊕⊕⊝ | ARI = 1.1% NNTH = 91 |
| Total myocardial infarction | 93 per 1000 | 86 per 1000 | RR 0.93 | 24,379 | ⊕⊕⊕⊝ | |
| Total stroke | 44 per 1000 | 50 per 1000 (45 to 56) | RR 1.14 (1.02 to 1.28) | 24,309 (1) | ⊕⊕⊕⊝ | ARI = 0.6% NNTH = 167 |
| End stage renal failure Follow‐up: mean 4.9 years | 13 per 1000 | 14 per 1000 (11 to 18) | RR 1.10 (0.88 to 1.37) | 24,309 (1) | ⊕⊕⊝⊝ | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Based on one large trial (ALLHAT 2002). | ||||||
| First‐line RAS inhibitors compared to first‐line beta‐blockers for hypertension | ||||||
| Patient or population: people with hypertension | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Certainty of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Β‐blockers | RAS inhibitors | |||||
| All‐cause death | 94 per 1000 | 84 per 1000 | RR 0.89 (0.78 to 1.01) | 9193 (1) | ⊕⊕⊝⊝ | |
| Total cardiovascular events | 143 per 1000 | 126 per 1000 | RR 0.88 | 9239 | ⊕⊕⊝⊝ | ARR = 1.7% NNTB = 59 |
| Total heart failure | 35 per 1000 | 33 per 1000 (27 to 41) | RR 0.95 (0.76 to 1.18) | 9193 (1) | ⊕⊕⊝⊝ | |
| Total myocardial infarction | 41 per 1000 | 43 per 1000 | RR 1.05 | 9239 | ⊕⊕⊝⊝ | |
| Total stroke | 67 per 1000 | 50 per 1000 (42 to 59) | RR 0.75 (0.63 to 0.88) | 9193 (1) | ⊕⊕⊝⊝ | ARR = 1.7% NNTB = 59 |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Based primarily on one moderate‐sized trial (LIFE 2002). | ||||||
Antecedentes
Descripción de la afección
La hipertensión es un problema de salud global y se ha convertido en una carga significativa para los sistemas de asistencia sanitaria. La hipertensión se asocia con mortalidad y morbilidad cardiovascular (CV) como la coronariopatía, la enfermedad cerebrovascular y la vasculopatía periférica. La presión arterial (PA) se eleva en muchas personas con diabetes tipo 2, que es un problema de salud prevalente en todo el mundo. La mayor prevalencia de la diabetes mellitus (DM) se debe sobre todo al aumento de la diabetes mellitus tipo 2 (DMT2; Inzucchi 2005). Una encuesta en adultos de los EE.UU. con diabetes mostró que en el 71,0% se había elevado la PA, definida como PA que equivale o excede 130/85 mmHg o el uso actual de la medicación prescrita para la hipertensión (Geiss 2002). La PA elevada se asocia con un conjunto de problemas de salud posteriores en los pacientes con diabetes, en particular enfermedad CV y daño renal (nefropatía). La PA elevada se ha identificado como un factor de riesgo principal en la evolución de la nefropatía diabética (Aurell 1992). El riesgo de morbilidad y mortalidad CV también se duplica en los pacientes hipertensos cuando presentan diabetes (DeStefano 1993). La revisión de la base de la evidencia sobre este tema está comprendida en las guías que tratan sobre todo la diabetes o la hipertensión (CPG 2013; JNC‐8 2014, respectivamente). Los agentes antihipertensivos utilizados como fármacos de primera línea incluyen los inhibidores de la enzima convertidora de angiotensina (ECA), los bloqueadores de los receptores de angiotensina (BRA), los bloqueadores de los canales de calcio (BCC), los betabloqueantes y los diuréticos.
Descripción de la intervención
En los últimos diez años, el antagonismo del sistema renina angiotensina (SRA) se ha convertido en el centro de las intervenciones terapéuticas para la hipertensión. Las guías que recomiendan el uso de los inhibidores de la ECA o los BRA en los pacientes hipertensos con diabetes o nefropatía basan las recomendaciones en los resultados de estudios controlados con placebo que, según se interpreta, indican que los inhibidores de la ECA y los BRA tienen efectos nefroprotectores específicos además de los que se deben a la disminución de la presión arterial (ADA 2013; JNC‐8 2014). También se han propuesto efectos beneficiosos independientes de la presión arterial de los inhibidores de la ECA y los BRA sobre los resultados CV, sobre la base de los resultados de varios estudios controlados con placebo, multicéntricos, grandes, especialmente los estudios HOPE 2000, PROGRESS 2001 y RENAAL 2001. Un metanálisis reciente ha indicado que, en los pacientes con DM, el tratamiento con inhibidores de la ECA específicos de tejido (ramipril 1,25 mg/día o 10 mg/día; perindopril 4 mg/día o 8 mg/día) en comparación con placebo reduce significativamente el riesgo de mortalidad CV en el 14,9% (p = 0,022), el infarto de miocardio (IM) en el 20,8% (p = 0,002) y la necesidad de revascularización coronaria invasiva en el 14% (P = 0,015); pero no la mortalidad por todas las causas (cociente de riesgos [CR] 0,913, intervalos de confianza [IC] del 95%: 0,825 a 1,011; Saha 2008). Una revisión Cochrane (Strippoli 2006), que incluyó 13 ensayos controlados aleatorios (ECA) con 10 070 participantes, mostró una reducción significativa en el riesgo de insuficiencia renal terminal (IRT) con los inhibidores de la ECA o los BRA en comparación con placebo o ningún tratamiento (CR 0,60; IC del 95%: 0,39 a 0,93; CR 0,78; IC del 95%: 0,67 a 0,91; respectivamente). Además, diez estudios con 2034 participantes mostraron que los inhibidores de la ECA, a la máxima dosis tolerable, reducen significativamente el riesgo de mortalidad por todas las causas en estudios controlados con placebo (CR 0,78; IC del 95%: 0,61 a 0,98; reducción del riesgo absoluto [RRA] 0,04; número necesario a tratar para un lograr resultado beneficioso adicional (NNTB) 25).
No está clara la evidencia de un efecto beneficioso en cuanto a la mortalidad y la morbilidad con los inhibidores de la ECA o los BRA versus otros agentes antihipertensivos. Algunos estudios indican que los inhibidores del SRA podrían prevenir o retrasar los eventos CV en algunos subgrupos, pero no se ha podido precisar la función en el grupo más general de pacientes con hipertensión (CAPPP 2001; LIFE 2002). Algunos estudios aportaron evidencia de un efecto beneficioso de los inhibidores del SRA en la función renal sobre otros fármacos antihipertensivos (ABCD‐HT 2000; LIFE 2002; MARVAL 2002), pero no analizaron resultados clínicamente relevantes como la insuficiencia renal o la disfunción renal combinada.
Otras revisiones sistemáticas relacionadas con esta revisión se resumen a continuación y en orden cronológico por fecha de publicación.
Una revisión sistemática y metanálisis bayesiano en red de 63 ensayos clínicos aleatorios evaluaron los efectos de diferentes clases de tratamientos antihipertensivos (monoterapia y combinaciones) sobre la supervivencia y los resultados renales principales en pacientes con diabetes (Wu 2013). Esta revisión examinó los variables de evaluación clínicas que incluyeron la mortalidad por todas las causas, la necesidad de diálisis y la duplicación de los niveles de creatinina sérica. En comparación con placebo, los BRA no mostraron una reducción en cualquiera de los tres resultados, y los inhibidores de la ECA sólo redujeron la duplicación de los niveles de creatinina sérica en comparación con placebo (odds ratio [OR] 0,58; IC del 95%: 0,32 a 0,90). Aunque los inhibidores de la ECA no mostraron otros efectos beneficiosos en comparación con otros fármacos, los investigadores apoyaron el uso de los inhibidores de la ECA como agente antihipertensivo de primera línea en los pacientes con diabetes. Sin embargo, todas las indicaciones se basaron en los resultados del metanálisis bayesiano en red, que no sólo incluyó los resultados de las comparaciones directas, sino también incorporó las comparaciones indirectas. La revisión no informó de la proporción de los pacientes hipertensos y las comparaciones indirectas podrían afectar la aplicabilidad de esta evidencia.
Una revisión y metanálisis sistemático realizado por Casas y cols. evaluaron el efecto de los inhibidores del SRA y otros fármacos antihipertensivos sobre los resultados renales (Casas 2005). En esta revisión, los efectos de los inhibidores de la ECA o los BRA en estudios controlados con placebo se compararon indirectamente con los efectos de otros fármacos antihipertensivos en pacientes con diabetes tipo 1 o tipo 2 o sin diabetes. En los pacientes con nefropatía diabética, los estudios comparativos de los inhibidores de la ECA o los BRA no indicaron un efecto beneficioso en la IRT, la tasa de filtración glomerular (TFG) o los niveles de creatinina. Los estudios controlados con placebo de los inhibidores de la ECA o BRA redujeron todos los resultados renales y también la PA.
Una revisión Cochrane de ECA comparó cualquier agente antihipertensivo con placebo u otro agente en pacientes hipertensos o normotensos con diabetes y sin enfermedad renal (Strippoli 2005). Esta revisión evaluó los resultados renales y la mortalidad CV y por todas las causas. Indicó que los inhibidores de la ECA redujeron significativamente la aparición de microalbuminuria en comparación con placebo (seis ensayos, 3840 participantes: CR 0,60; IC del 95%: 0,43 a 0,84; RRA 0,03 y NNTB 33), pero no redujeron la duplicación de la creatinina, la IRT o la mortalidad por todas las causas. En comparación con los BCC, los inhibidores de la ECA redujeron significativamente la progresión a la microalbuminuria (cuatro ensayos, 1210 participantes: CR 0,58; IC del 95%: 0,40 a 0,84; RRA 0,05 y NNTB 20).
Un metanálisis de ECA doble ciego realizado por Siebenhofer y cols. comparó los BRA con placebo o tratamiento antihipertensivo estándar en DMT2 (tres estudios, 4423 participantes) y analizó las variables de evaluación clínicas (muerte por todas las causas, morbimortalidad CV e IRT; Siebenhofer 2004). El único efecto beneficioso estadísticamente significativo de los BRA fue la reducción de la IRT en comparación con placebo (OR 0,73; IC del 95%: 0,60 a 0,89; RRA 0,05 y NNTB 20). Los BRA no lograron mostrar ser superiores al tratamiento antihipertensivo estándar (BCC, betabloqueantes) en la mortalidad total ni la morbimortalidad CV. Sin embargo, los inhibidores de la ECA no se incluyeron en este metanálisis.
Una revisión y metanálisis sistemático realizados por Pahor y cols. evaluaron los efectos beneficiosos terapéuticos de los inhibidores de la ECA y de otros fármacos antihipertensivos en los pacientes con DMT2 e hipertensión (Pahor 2000). Este metanálisis mostró un efecto beneficioso significativo de los inhibidores de la ECA en comparación con los tratamientos alternativos (BCC, betabloqueantes, diuréticos) en el IM agudo (reducción del 63%, p < 0,001; RRA 0,06 y NNTB 17), los eventos CV (reducción del 51%, p < 0,001, 8% RRA y NNTB 13) y la muerte por todas las causas (reducción del 62%, p = 0,010; RRA 0,02 y NNTB 40), pero no en el accidente cerebrovascular. Sin embargo, los BRA no se incluyeron en esta revisión. No se informó de los resultados renales (IRT, TFG creatinina sérica o albuminuria).
Un metanálisis de 100 estudios controlados y no controlados en 2494 participantes con diabetes evaluó el efecto sobre la proteinuria de diferentes clases de agentes antihipertensivos (inhibidores de la ECA, BCC, betabloqueantes y control; Kasiske 1993). Esta revisión indicó que los inhibidores de la ECA causaron reducciones mayores de la albúmina en orina y la excreción proteica en comparación con otros agentes antihipertensivos (p < 0,05 versus BCC; P < 0,05 versus control). Los inhibidores de la ECA lograron estos efectos beneficiosos sobre la función renal independientemente de los cambios en la presión arterial. Este metanálisis examinó marcadores alternativos en lugar de variables de evaluación clínicamente relevantes (como IRT, muerte por todas las causas).
De qué manera podría funcionar la intervención
El SRA es un mecanismo potencialmente fisiopatológico que causa cardiopatía diabética. Se cree que la angiotensina II (Ang II) desempeña una función importante en la patogenia de las complicaciones CV (Dzau 2001). Se ha demostrado que los inhibidores del SRA tienen efectos beneficiosos adicionales antiproteinúricos y nefroprotectores en la nefropatía diabética (Kocks 2002).
Los fármacos que inhiben el SRA incluyen: los inhibidores de la renina, los inhibidores de la ECA y los BRA, que inhiben la acción enzimática de la renina, la conversión de la angiotensina I (Ang I) a Ang II y bloquean los receptores de Ang II, respectivamente.
Los inhibidores de la ECA y los BRA bloquean el SRA en mayor grado que los inhibidores de la renina, que evitan la formación de esta sustancia. La renina es el sustrato responsable de todos los eventos "descendentes" que dan lugar a la producción de angiotensina II y la estimulación posterior de sus receptores. Se ha propuesto que los inhibidores de la renina quizás impliquen una medida más efectiva del bloqueo de los SRA que los inhibidores de la ECA o BRA (Duprez 2006).
Por qué es importante realizar esta revisión
Los inhibidores del SRA se prescriben ampliamente para el tratamiento de la hipertensión. Los inhibidores de la ECA y los BRA se recomiendan específicamente en los pacientes con diabetes sobre la base de las ventajas postuladas de reducción de la nefropatía diabética y morbimortalidad CV. A pesar del uso generalizado de los inhibidores de la ECA y los BRA en la diabetes, aún no está clara su eficacia en comparación con otros fármacos antihipertensivos. Se necesita una revisión sistemática para establecer los efectos beneficiosos y perjudiciales de los resultados clínicamente relevantes (especialmente muerte por todas las causas y morbilidad, resultados renales y CV) de los inhibidores del SRA en comparación con otros fármacos antihipertensivos en los pacientes con presión arterial elevada.
Objetivos
Evaluar los efectos beneficiosos y perjudiciales de los inhibidores del SRA de primera línea en comparación con otros fármacos hipotensores de primera línea en pacientes con hipertensión.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
El diseño del estudio debía cumplir con los siguientes criterios:
-
ECA con diseño paralelo;
-
doble ciego;
-
seguimiento mínimo de seis meses.
Tipos de participantes
Pacientes con PA elevada primaria (que equivale o excede 130/85 mmHg). Se optó por este umbral de PA, inferior que el estándar de 140/90 mmHg, para incluir a más pacientes y para ser consistente con los objetivos inferiores recomendados en los pacientes con hipertensión y diabetes. Se excluyeron los pacientes con hipertensión secundaria confirmada.
Tipos de intervenciones
Los inhibidores del SRA incluyen los inhibidores de la ECA, los BRA o los inhibidores de la renina:
-
Los inhibidores de la ECA incluyen: alacepril, altiopril, benazepril, captopril, ceronapril, cilazapril, delapril, derapril, enalapril, enalaprilat, fosinopril, idapril, imidapril, lisinopril, moexipril, moveltopril, pentopril, perindopril, quinapril, ramipril, spirapril, temocapril, trandolapril y zofenopril.
-
Los BRA incluyen: candesartán, eprosartán, irbesartán, losartán, olmesartán, tasosartán, telmisartán, valsartán y KT3‐671.
-
Los inhibidores de la renina incluyen: aliskirén, remikirén.
Comparadores
Cualquier otra clase de fármacos antihipertensivos: tiazidas, betabloqueantes, BCC, alfabloqueantes o fármacos con actividad en el sistema nervioso central (SNC).
Tipos de medida de resultado
Resultados primarios
-
Muerte por todas las causas.
-
Morbilidad grave por todas las causas (eventos adversos graves no mortales).
-
Eventos CV totales:
-
IM mortal y no mortal;
-
accidente cerebrovascular mortal y no mortal;
-
insuficiencia cardíaca congestiva (ICC) mortal y no mortal que requiere hospitalización.
-
-
Resultados renales:
-
IRT (definida como necesidad de diálisis de mantenimiento).
-
Resultados secundarios
-
Cambio en la PA sistólica y diastólica o cambio al final del estudio.
-
Cambio en la frecuencia cardíaca o cambio al final del estudio.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
The Cochrane Hypertension Group Information Specialist conducted systematic searches in the following databases for randomized controlled trials without language, publication year or publication status restrictions:
-
the Cochrane Hypertension Specialised Register via the Cochrane Register of Studies (CRS‐Web) (searched 22 November 2017);
-
the Cochrane Central Register of Controlled Trials (CENTRAL; 2017, Issue 11) via Wiley (searched 22 November 2017);
-
MEDLINE Ovid (from 1946 onwards), MEDLINE Ovid Epub Ahead of Print, and MEDLINE Ovid In‐Process & Other Non‐Indexed Citations (searched 20 November 2017);
-
Embase Ovid (searched 20 November 2017);
-
ClinicalTrials.gov (www.clinicaltrials.gov) (searched 20 November 2017);
-
World Health Organization International Clinical Trials Registry Platform (www.who.int/trialsearch) (searched 22 November 2017).
The Information Specialist modelled subject strategies for databases on the search strategy designed for MEDLINE. Where appropriate, they were combined with subject strategy adaptations of the highly sensitive search strategy designed by Cochrane for identifying randomized controlled trials (as described in the Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0, Box 6.4.b. (Handbook 2011)). Search strategies are provided in Appendix 1.
Búsqueda de otros recursos
-
The Cochrane Hypertension Group Information Specialist searched the Hypertension Specialised Register segment (which includes searches of MEDLINE, Embase and Epistemonikos for systematic reviews) to retrieve existing systematic reviews relevant to this systematic review, so that we could scan their reference lists for additional trials. The Specialised Register also includes searches of CAB Abstracts & Global Health, CINAHL, ProQuest Dissertations & Theses and Web of Knowledge.
-
We checked the bibliographies of included studies and any relevant systematic reviews identified for further references to relevant trials.
-
Where necessary, we contacted authors of key papers and abstracts to request additional information about their trials.
Obtención y análisis de los datos
We performed the initial search of all the databases to identify citations with potential relevance. In our initial screen of these abstracts we excluded articles whose titles or abstracts, or both, were clearly irrelevant. We retrieved the full text of the remaining articles (and translated into English where required) to assess whether the trials met the prespecified inclusion criteria. We searched the bibliographies of pertinent articles, reviews and texts for additional relevant citations. Two independent review authors assessed the eligibility of the trials using a study selection form. A third review author resolved discrepancies.
Selección de los estudios
We imported references and abstracts of search results into Reference Manager software. We based selection of studies on the criteria listed above.
Extracción y manejo de los datos
Two review authors independently extracted data using a standard form, and then cross‐checked them. All numeric calculations and graphic interpolations were confirmed by a second person.
Evaluación del riesgo de sesgo de los estudios incluidos
We assessed the risk of bias for each trial according to Cochrane 'Risk of bias' guidelines using the following six domains (Higgins 2011):
-
sequence generation;
-
allocation concealment;
-
blinding or objective assessment of primary outcomes;
-
incomplete outcome data;
-
selective outcome reporting;
-
other biases.
We used the overall risk of bias in the GRADE assessment in the 'Summary of findings' table. We conducted GRADE assessment according to the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011).
Medidas del efecto del tratamiento
We based quantitative analysis of outcomes on intention‐to‐treat principles as much as possible. For dichotomous outcomes, we expressed results as the risk ratio (RR) with a 95% confidence interval (CI). For combining continuous variables (systolic blood pressure (SBP), diastolic blood pressure (DBP) and heart rate (HR)), we used the mean difference (with 95% CI).
Manejo de los datos faltantes
If the included studies had missing information, we contacted investigators (using email, letter or fax or both) to obtain the missing information.
When studies did not report a within‐study variance for the effect change of continuous data, we imputed the standard deviation (SD) using the following hierarchy:
-
pooled SD calculated either from the t‐statistic corresponding to an exact P value reported or from the 95% CI of the mean difference between treatment group and comparative group;
-
SD at the end of treatment;
-
SD at baseline;
-
weighted mean SD of change calculated from at least three other trials using the same dose regimen;
-
weighted mean SD of change calculated from other trials using any dose.
Evaluación de la heterogeneidad
We used Chi² and I² statistics to test for heterogeneity of treatment effect among trials. We consider a Chi² value P < 0.1 or I² value > 50% indicative of heterogeneity.We used the fixed‐effect model when there was homogeneity and used the random‐effects model to test for statistical significance where there was heterogeneity.
Evaluación de los sesgos de notificación
We used funnel plots to investigate publication reporting bias when suspected. As a rule of thumb, tests for funnel plot asymmetry should be used only when there are at least 10 studies included in the meta‐analysis, because when there are fewer studies the power of the tests is too low to distinguish chance from real asymmetry.
Síntesis de los datos
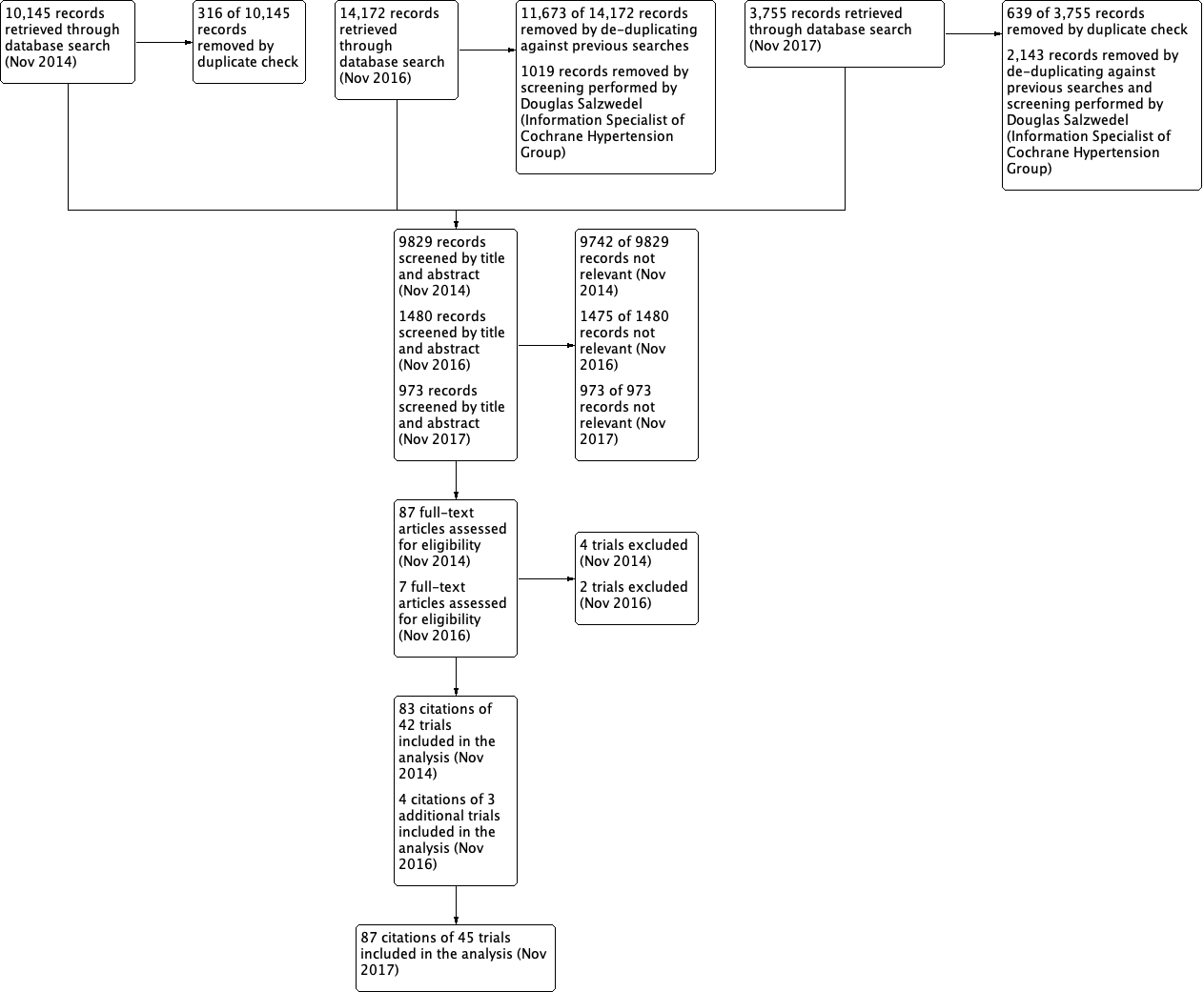
We performed data synthesis and analyses using the Cochrane Review Manager software, RevMan 5.3 (RevMan 2014). We described data results in tables and forest plots according to Cochrane guidelines. In addition we gave full details for all studies we included and excluded. We have included a standard PRISMA flow diagram (Figure 1).
Análisis de subgrupos e investigación de la heterogeneidad
Where appropriate, we performed the following subgroup analyses:
-
Heterogeneity among participants could be related to:
-
gender;
-
age;
-
presence of diabetes at initiation of antihypertensive treatment (time of trial entry);
-
baseline blood pressure;
-
previous renal disease;
-
previous CV disease.
-
-
Heterogeneity in treatments could be related to:
-
dose of drugs;
-
duration of therapy.
-
Análisis de sensibilidad
We tested the robustness of the results using several sensitivity analyses, including:
-
trials that were industry‐sponsored versus non‐industry‐sponsored;
-
trials with reported standard deviations of effect change versus imputed standard deviations;
-
trials that have a high risk of bias versus those with a low risk of bias.
Results
Description of studies
See: Characteristics of included studies; Characteristics of excluded studies.
Results of the search
Up to November 2017, the search strategy identified 15,145 citations (Figure 1). After excluding all the studies that did not meet the inclusion criteria or those we have included before, we performed full‐text assessment of five potentially eligible studies and identified three new trials (NESTOR 2015; SILVHIA 2001; Xiao 2016) (four citations) that we included in the review update. This update includes 45 RCTs with 87 citations, i.e. the three new RCTs and the 42 RCTs (83 citations) in the first publication of this review (Xue 2015).
Included studies
The 45 included studies involved 66,625 participants with a mean age of 66 years. Participants in nine studies were under 50 years old (Buus 2004; Buus 2007; Dahlöf 1993; Pedersen 1997; Schiffrin 1994; Sørensen 1998; Tarnow 1999; Xiao 2016; Zeltner 2008); in 22 studies participants were between 50 and 59 years old (Ariff 2006; Dahlöf 2002; Dalla 2004; Derosa 2004; Derosa 2005; Derosa 2014; Esnault 2008; Estacio 1998; Gottdiener 1998; Hauf‐Zachariou 1993; Hughes 2008; IDNT 2001; Malmqvist 2002; Parrinello 2009; Petersen 2001; Roman 1998; Schmieder 2009; Schneider 2004; Seedat 1998; SILVHIA 2001; Tedesco 1999; TOHMS 1993); and over 60 years old in the remaining 14 studies (ALLHAT 2002; BENEDICT 2004; Devereux 2001; Fogari 2012; Gerritsen 1998; Hajjar 2013; Hayoz 2012; Himmelmann 1996; LIFE 2002; NESTOR 2015; Ostman 1998; Schram 2005; Terpstra 2004; VALUE 2004). The mean duration of therapy was 1.9 years, ranging from 0.5 to 5.6 years. The number of participants who received RAS inhibitors was 25,421, while 5,525 received beta‐blockers, 19,040 CCBs, 16,316 thiazides, 240 alpha‐blockers, and 83 CNS active drugs. Three studies contained multiple different drug groups: Gottdiener 1998 contained six, TOHMS 1993 contained five, and ALLHAT 2002 contained three, so the numbers of studies comparing RAS inhibitors with other drug classes were 17 for beta‐blockers, 22 for CCBs ‐ within which there were two studies that used non‐dihydropyridine (BENEDICT 2004; Gottdiener 1998), and 20 studies that used dihydropyridine, 10 for thiazides, 3 for alpha‐blockers, and 1 for CNS active drugs.
Most of the included studies were industry‐sponsored (28/45). Participants with diabetes were involved in 14 studies, while one study included participants with impaired fasting glucose; participants with decreased renal function in seven studies, and seven studies contained participants with at least one risk factor for CV diseases. Three studies recruited only men (Dahlöf 1993; Gottdiener 1998; Schiffrin 1994). One study included only women, as it focused on postmenopausal women (Hayoz 2012). All 87 included citations were published in English with publication years ranging from 1993 to 2016.
Most participants (30 studies) were recruited from European countries; seven studies included participants from North America; two studies included participants from North America, Europe, and Asia (Dahlöf 2002; VALUE 2004); one study included participants from North America, South America, Europe, Asia and Australia (IDNT 2001); NESTOR 2015 included participants from North America, South America, Europe and Asia; one study included participants from North America and Europe (LIFE 2002); Devereux 2001 included participants from Europe and Asia; Seedat 1998 included participants from South Africa; and Xiao 2016 included participants from Asia. Fifteen of the 45 included studies reported ethnicity; the percentages of white, Hispanic, Asian, Black and other race participants were 71.0%, 0.3%, 1.7%, 23.7% and 3.3%, respectively.
In terms of baseline comorbidities, nine studies stated that they would not include people with a history of prior MI or stroke; 14 studies allowed participants with a history of prior MI or stroke if this had not occurred within the previous three or six months); the other 22 studies made no clear statement, but in general the proportion of participants without cardiac‐cerebral vascular comorbidities was high. Overall, this review represents treatment effects for primary prevention.
A stepwise therapeutic regimen was used in 34 studies, in which add‐on drugs were allowed to achieve BP goals. The second‐line drugs included open‐label, non‐study agents such as CCBs, thiazides, or beta‐blockers. The remaining eleven studies restricted the therapeutic regimens to monotherapy (Dahlöf 1993; Derosa 2004; Derosa 2014; Gottdiener 1998; Himmelmann 1996; Hauf‐Zachariou 1993; Sørensen 1998; Tedesco 1999; Terpstra 2004; TOHMS 1993; Xiao 2016).
With regard to the clinical classification of hypertension (see ESH/ESC 2013), we classified mean blood pressure of participants at baseline into two groups: 30 studies included Grade 1 hypertensive participants (SBP: 140 mmHg to 159 mmHg); 15 studies included Grade 2 hypertensive participants (SBP: 160 mmHg to 179 mmHg). Baseline untreated mean BP was 156/89 mmHg (SBP/DBP) for RAS inhibitors; 151/86 mmHg for CCBs; 172/98 mmHg for beta‐blockers; 146/85 mmHg for thiazides; 150/96 mmHg for alpha‐blockers; 152/99 mmHg for CNS active drugs.
For details, see Characteristics of included studies.
Excluded studies
Full‐text screening according to the prespecified inclusion criteria led to us excluding three of the seven citations during the update, in addition to the four citations excluded in the previous version of the review. In total, we excluded seven citations of six studies in the updated review. The reasons for each study's exclusion are described in Characteristics of excluded studies.
Risk of bias in included studies
The data extraction forms for each included study contained the details of study design, randomization, allocation, blinding, duration of treatment, funding, diagnosis, number of participants, age of participants, gender of participants, history of participants, inclusion and exclusion criteria, outcomes and intervention. We assessed the risk of bias for each included study (Figure 2), and all included studies (Figure 3), in detail (see Characteristics of included studies).

Risk of bias summary: review authors' judgements about each risk of bias item for each included citations
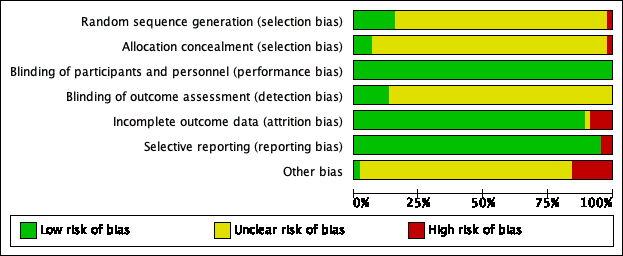
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included citations
Allocation
We assessed seven of the 45 studies as being at low risk of bias for reporting the method for generation of random sequence and one study as being at high risk (Roman 1998); in the remaining 37 studies the risk of bias for this domain was unclear. We assessed three of the 45 studies as being at low risk for allocation concealment, one study as being at high risk, and 41 studies as being at unclear risk. The three studies at low risk used either a central office allocation (ALLHAT 2002; VALUE 2004), or were strictly confidential until unblinding time (Schmieder 2009); one study reported using alternate allocation, which is a high risk method (Seedat 1998); two studies at unclear risk of selection bias reported the allocation concealment by using an envelope to maintain the random number (Derosa 2004; Derosa 2005); however, it was not clear whether the envelope was transparent or opaque.
Blinding
All the 45 included studies were at low risk of performance bias as they were all double‐blinded and met the inclusion criteria. In terms of detection bias, we judged only six studies to be at low risk due to the use of blinding for outcome assessment for BP or HR, which was critical for the control of detection bias; the risk of bias for this domain was unclear for the remaining 39 studies. We thought that unblinded assessment of outcomes like MI, stroke, HF, CV events, all‐cause death, and ESRF was not as critical as it would be for BP and HR.
Incomplete outcome data
We judged the risk of attrition bias in 40 of the 45 studies included in the review to be low because missing data were unlikely to have an impact because of low or equal numbers of dropouts between arms. In one study this risk was unclear (Petersen 2001); and in the other four studies we judged it to be high. Among these four studies with a high risk of attrition bias, Gottdiener 1998 only included participants with a left atrial dimension measurement (a small proportion of all participants) in the analysis. Pedersen 1997 and Tarnow 1999 had many participants lost to follow‐up at the end of study and Hayoz 2012 reported inconsistent numbers of participants in Figure 1 and Table 2.
Selective reporting
In this review, we judged 43 included studies to have a low risk of reporting bias; we judged that two studies had a high risk of selective reporting as they did not report HR, which was a prespecified outcome in their 'Methods' sections (Derosa 2004; Terpstra 2004).
Other potential sources of bias
Seven studies had a high risk of other potential sources of bias. Pedersen 1997 and Roman 1998 had unbalanced baseline characteristics. VALUE 2004 had an unbalanced proportion of monotherapy and highest dose between the two groups (including HCTZ and other non‐study add‐on drugs); Estacio 1998 had an unbalanced proportion of monotherapy. LIFE 2002 was evaluated as being at high risk as it was funded and conducted by the pharmaceutical company Merck. Similarly, many of the authors of IDNT 2001 had received research grants from Bristol‐Myers Squibb. Numbers of participants reported for different outcomes were not consistent in SILVHIA 2001.
Effects of interventions
See: Summary of findings for the main comparison RAS inhibitors compared to CCBs for hypertension; Summary of findings 2 RAS inhibitors compared to thiazides for hypertension; Summary of findings 3 RAS inhibitors compared to beta‐blockers for hypertension
First‐line RAS inhibitors versus first‐line CCBs
Compared with CCBs, RAS inhibitors decreased HF (5 RCTs, 35,143 participants, RR 0.83, 95% CI 0.77 to 0.90; Analysis 1.3), and increased stroke (4 RCTs, 34,673 participants, RR 1.19, 95% CI 1.08 to 1.32; Analysis 1.5), but were not significantly different for all‐cause death (5 RCTs, 35,226 participants, RR 1.03, 95% CI 0.98 to 1.09; Analysis 1.1), total CV events (6 RCTs, 35,223 participants, RR 0.98, 95% CI 0.93 to 1.02; Analysis 1.2), total MI (5 RCTs, 35,043 participants, RR 1.01, 95% CI 0.93 to 1.09; Analysis 1.4), and ESRF (4 RCTs, 19,551 participants, RR 0.88, 95% CI 0.74 to 1.05; Analysis 1.6). CCBs lowered SBP and DBP to a greater degree than RAS inhibitors (SBP: 20 RCTs, 36,437 participants, MD 1.23, 95% CI 0.90 to 1.56; Analysis 1.7; DBP: 20 RCTs, 36,437 participants, MD 0.98, 95% CI 0.79 to 1.18; Analysis 1.8). There was no difference in the effect of CCBs and RAS inhibitors on HR (5 RCTs, 540 participants, MD 0.30, 95% CI ‐1.63 to 2.22; Analysis 1.9).
First‐line RAS inhibitors versus first‐line thiazides
Compared with thiazides, RAS inhibitors increased HF (1 RCT, 24,309 participants, RR 1.19, 95% CI 1.07 to 1.31; Analysis 2.3), and increased stroke (1 RCT, 24,309 participants, RR 1.14, 95% CI 1.02 to 1.28; Analysis 2.5), but were not significantly different for all‐cause death (1 RCT, 24,309 participants, RR 1.00, 95% CI 0.94 to 1.07; Analysis 2.1), total CV events (2 RCTs, 24,379 participants, RR 1.05, 95% CI 1.00 to 1.11; Analysis 2.2), total MI (2 RCTs, 24,379 participants, RR 0.93, 95% CI 0.86 to 1.01; Analysis 2.4), and ESRF (1 RCT, 24,309 participants, RR 1.10, 95% CI 0.88 to 1.37; Analysis 2.6). Thiazides lowered SBP to a greater degree than RAS inhibitors (10 RCTs, 26,382 participants, MD 1.60, 95% CI 1.20 to 1.99; Analysis 2.7), but had a similar effect to RAS inhibitors on DBP (9 RCTs, 26,335 participants, MD ‐0.12, 95% CI ‐0.36 to 0.13; Analysis 2.8). There was also no difference in the effect on HR, but only two small trials reported this outcome (2 RCTs, 84 participants, MD 0.66, 95% CI ‐2.87 to 4.19; Analysis 2.9).
First‐line RAS inhibitors versus first‐line beta‐blockers
Compared with beta‐blockers, RAS inhibitors decreased total CV events (2 RCTs, 9,239 participants, RR 0.88, 95% CI 0.80 to 0.98; Analysis 3.2) and decreased stroke (1 RCT, 9,193 participants, RR 0.75, 95% CI 0.63 to 0.88; Analysis 3.5). Beta‐blockers and RAS inhibitors were not significantly different for all‐cause death (1 RCT, 9,193 participants, RR 0.89, 95% CI 0.78 to 1.01; Analysis 3.1), HF (1 RCT, 9,193 participants, RR 0.95, 95% CI 0.76 to 1.18; Analysis 3.3), or MI (2 RCTs, 9.239 participants, RR 1.05, 95% CI 0.86 to 1.27; Analysis 3.4). The effect on ESRF could not be assessed because there was only one small trial that examined this outcome (1 RCT, 46 participants, RR 0.33, 95% CI 0.01 to 7.78; Analysis 3.6). Beta‐blockers lowered DBP and HR more than RAS inhibitors (DBP: 16 RCTs, 10,905 participants, MD 0.48, 95% CI 0.14 to 0.83; Analysis 3.8; HR: 10 RCTs, 9,979 participants, MD 6.05, 95% CI 5.59 to 6.50; Analysis 3.9). The effect on SBP did not differ between the two classes of drug (16 RCTs, 10,905 participants, MD ‐0.55, 95% CI ‐1.22 to 0.11; Analysis 3.7).
First‐line RAS inhibitors versus first‐line alpha‐blockers
RAS inhibitors lowered SBP more than alpha‐blockers did (3 small RCTs, 380 participants, MD ‐2.38, 95% CI ‐3.98 to ‐0.78; Analysis 4.1), but did not differ in their effect on DBP and HR (DBP 3 small RCTs, 380 participants, MD ‐0.12, 95% CI ‐1.09 to 0.85; Analysis 4.2; HR: 1 small RCT, 44 participants, MD 3.10, 95% CI ‐2.41 to 8.61; Analysis 4.3).
First‐line RAS inhibitors versus first‐line CNS active drugs
When compared with CNS active drugs in one small trial, RAS inhibitors did not differ in their effect on SBP (1 RCT, 56 participants, MD 1.30, 95% CI ‐6.01 to 8.61; Analysis 5.1), DBP (1 RCT, 56 participants, MD ‐0.30, 95% CI ‐1.85 to 1.25; Analysis 5.2), or HR (1 RCT, 56 participants, MD 1.50, 95% CI ‐4.13 to 7.13; Analysis 5.3).
Subgroup analysis and investigation of heterogeneity
In this review, when the result was significant and the value of I2 was greater than 50%, we tested whether the result was still significant using the random‐effects model. However, in presenting the data we use the fixed‐effect model, as it weights the contributing trials more appropriately.
In an attempt to explore the heterogeneity of RAS inhibitors versus CCBs on HF (I2 of 68%) we analyzed the trials according to whether or not the participants had decreased renal function. In those with decreased renal function the RR was 0.55, 95% CI 0.43 to 0.70, without heterogeneity (Dalla 2004; IDNT 2001); while in those without decreased renal function the RR was 0.87, 95% CI 0.80 to 0.95, without heterogeneity (ALLHAT 2002; Estacio 1998; VALUE 2004). Subgroup analysis thus provided a possible explanation for the variation of effect sizes across the studies. The magnitude of the effect of RAS inhibitors for decreasing HF, when compared to CCBs, was greater in hypertensive participants with kidney dysfunction than in those with normal renal function.
The key results on the clinically important outcomes and grading of the evidence quality are presented in the 'Summary of findings' tables, which we created by using the software GRADEpro 3.6. (Atkins 2004) (summary of findings Table for the main comparison; summary of findings Table 2; summary of findings Table 3) These tables provide the absolute effects as well as the relative effects.
Discusión
Resumen de los resultados principales
Esta primera actualización de la revisión no muestra cambios en los resultados primarios, porque los tres nuevos ECA sólo agregaron datos de la presión arterial y la frecuencia cardíaca. En comparación con los BCC de primera línea, los inhibidores del SRA de primera línea reducen la muerte o las hospitalizaciones por IC, aumentan los accidentes cerebrovasculares mortales y no mortales y son similares para la mortalidad por todas las causas, los eventos de IRT y CV totales. En comparación con las tiazidas de primera línea, los inhibidores del SRA de primera línea aumentan la muerte o las hospitalizaciones por IC y aumentan los accidentes cerebrovasculares mortales y no mortales. Los inhibidores del SRA son similares a las tiazidas para la mortalidad por todas las causas, los eventos CV totales, el IM mortal y no mortal y los eventos de IRT. En comparación con los betabloqueantes de primera línea, los inhibidores del SRA de primera línea reducen los eventos CV totales y los accidentes cerebrovasculares mortales y no mortales y son similares para la mortalidad por todas las causas, la IC, el IM y la IRT. No hubo ECA que compararan los inhibidores del SRA de primera línea con otras clases de fármacos que informaran sobre los resultados de mortalidad y morbilidad.
Estos resultados demuestran que los inhibidores del SRA de primera línea son una opción secundaria a las tiazidas de primera línea, porque los inhibidores del SRA de primera línea aumentan la muerte y las hospitalizaciones por IC y los accidentes cerebrovasculares mortales y no mortales en comparación con las tiazidas.
Los resultados también indican que los inhibidores del SRA de primera línea son una mejor opción que los BCC de primera línea, porque la reducción absoluta del 1,2% en la muerte o las hospitalizaciones por IC encontrada con los inhibidores del SRA es mayor que el aumento del 0,7% de los accidentes cerebrovasculares mortales y no mortales. Estos resultados confirman y extienden los resultados de la revisión Cochrane de los BCC de primera línea versus otras clases de fármacos (Chen 2010).
Los resultados también indican que los inhibidores del SRA son una mejor elección de primera línea que los betabloqueantes de primera línea para la hipertensión, lo que confirma las conclusiones de otras dos revisiones Cochrane (Wiysonge 2017; Wright 2009).
Para los resultados de presión arterial y frecuencia cardíaca, la reducción leve, pero estadísticamente significativa de la PA sistólica de 1,6 mmHg con las tiazidas de primera línea en comparación con los inhibidores del SRA podría haber contribuido a los mejores resultados con las primeras, pero es poco probable que sea la única explicación. El hecho de que la PA no sea la única explicación se demuestra porque con los betabloqueantes de primera línea, que disminuyeron la FC y la PA diastólica más que los inhibidores del SRA de primera línea, se obtuvieron peores resultados de morbilidad.
Compleción y aplicabilidad general de las pruebas
El número de ensayos y participantes que contribuyen a las tres comparaciones principales de esta revisión aporta evidencia suficiente con respecto a los resultados que son importantes para los pacientes. Esta evidencia hace que las tiazidas de primera línea sean fármacos de primera línea óptimos para la hipertensión y que los inhibidores del SRA sean la segunda mejor opción de primera línea para la hipertensión. Este resultado se basa en evidencia de calidad moderada que demuestra que las tiazidas de primera línea reducen la IC y el accidente cerebrovascular en alrededor del 1,7% durante 4,9 años en comparación con los inhibidores del SRA de primera línea, lo que significa que se puede prevenir un evento por cada 59 pacientes tratados durante cinco años. Los inhibidores del SRA de primera línea son la segunda mejor opción de primera línea según la evidencia de calidad baja de que los inhibidores del SRA de primera línea reducen el accidente cerebrovascular en el 1,7% en comparación con los betabloqueantes y según la evidencia de calidad moderada de que reducen los eventos CV generales en el 0,5% en comparación con los BCC, debido a una reducción de los eventos de IC.
La evidencia de esta revisión es relevante sobre todo para la prevención primaria, pero también para los pacientes con hipertensión y comorbilidades como DMT2, hipertrofia ventricular izquierda o nefropatía diabética.
También es importante señalar que las comparaciones de mortalidad y morbilidad estudiadas en la presente revisión incluyeron sobre todo inhibidores de la ECA versus tiazidas (ALLHAT 2002) y BRA versus betabloqueantes (LIFE 2002). La comparación con los BCC incluyó inhibidores de la ECA y BRA. Las comparaciones de subgrupos basadas en los inhibidores de la ECA o los BRA en comparación con los BCC indicaron que los resultados fueron similares para la IC y el accidente cerebrovascular. Además, es importante observar que en 12 de 17 estudios de betabloqueantes, el atenolol fue el fármaco en estudio, de manera que es posible que los peores resultados observados con los betabloqueantes estén limitados al atenolol.
Análisis de sensibilidad
En esta revisión, se utilizaron varios análisis para analizar la solidez de los resultados. Los análisis de sensibilidad específicos que se realizaron se describen a continuación.
Estudios con desviaciones estándar (DE) informadas del cambio del efecto versus estudios con DE imputadas
En esta revisión, tres estudios no informaron de una varianza dentro del estudio para el cambio en la PA y las DE se imputaron con la media ponderada de la DE de otros ensayos (Esnault 2008; Fogari 2012; Roman 1998). Cuando se excluyeron estos tres ensayos del análisis, los cálculos de la PA no cambiaron significativamente.
Estudios con un riesgo de sesgo alto versus estudios con un riesgo de sesgo bajo
Se consideró que cuatro de los estudios incluidos (que aportaron datos para los análisis de los resultados primarios) presentaron un alto riesgo de "otros" sesgos (Estacio 1998; IDNT 2001; LIFE 2002; VALUE 2004). Tres de estos cuatro estudios compararon los inhibidores del SRA con los BCC; el alto riesgo de sesgo se debió a una proporción desequilibrada de la monoterapia y el uso de dosis mayores en uno de los dos grupos de tratamiento del estudio VALUE 2004, una proporción desequilibrada de la monoterapia en el estudio Estacio 1998 y por el hecho de que muchos autores recibieron subvenciones de Bristol‐Myers Squibb en el estudio IDNT 2001. Cuando se omitieron estos tres estudios del análisis, los resultados no cambiaron significativamente. Otro ensayo con alto riesgo fue financiado y realizado por Merck (LIFE 2002), pero este ECA fue el único que aportó datos de la comparación de los inhibidores del SRA y los betabloqueantes, y por lo tanto no se pudo realizar un análisis de sensibilidad.
En cuanto a los resultados secundarios (PA sistólica, PA diastólica y FC), cuando se excluyeron los estudios con un alto riesgo de otros sesgos del análisis en la comparación de los inhibidores del SRA con los BCC (Pedersen 1997; VALUE 2004), los resultados no mostraron cambios significativos. En la comparación de los inhibidores del SRA con los betabloqueantes, cuando se retiraron del análisis los estudios con un alto riesgo de otros sesgos (LIFE 2002; SILVHIA 2001), la PA sistólica se redujo más con los betabloqueantes (14 ECA, DM 1,37; IC del 95%: 0,02 a 2,71) que con los inhibidores del SRA, con escasa significación clínica. Los resultados no cambiaron significativamente en la comparación de los inhibidores del SRA con las tiazidas cuando se excluyó el estudio Roman 1998 con un alto riesgo de "otros" sesgos.
Sesgos potenciales en el proceso de revisión
Un sesgo potencial que merece atención es la medicación combinada. En los estudios más a largo plazo y a gran escala, es imposible mantener una sola farmacoterapia de primera línea, ya que con frecuencia un solo fármaco no reduce adecuadamente la PA en un nivel aceptable. En la mayoría de los casos de los estudios incluidos, a los médicos se les permitió agregar otros fármacos no estudiados para intentar alcanzar el objetivo de PA. En estos ECA y en esta revisión, se espera que los fármacos adicionales se equilibraran entre los diferentes grupos de tratamiento y, por lo tanto, que cualquier diferencia en los resultados se debiera a los fármacos de primera línea. El hecho de que en esta revisión se incluyan solamente ensayos doble ciego reduce este posible sesgo, pero no hubo forma de comprobar que fuera igual en todos los ensayos. Una limitación potencial de esta revisión es la posibilidad de que haya diferencias en el efecto de los inhibidores de la ECA y los BRA sobre la morbilidad y la mortalidad. Lo anterior se tendría que responder en ECA directos específicos que comparen las subclases de fármacos que inhiben el sistema renina angiotensina. Una revisión Cochrane que comparó los inhibidores de la ECA de primera línea con BRA de primera línea no indicó una diferencia en la mortalidad total ni en los eventos cardiovasculares totales (Li 2014), pero se necesita más evidencia.
Desafortunadamente, no hubo suficientes ensayos que aportaran datos a los resultados primarios para permitir una evaluación del sesgo de publicación. Las estimaciones de la PA y la FC no se pueden utilizar para calcular la capacidad para disminuir la PA del fármaco de primera línea, ya que se podían agregar otros fármacos. Por lo tanto, las pequeñas diferencias estadísticamente significativas de disminución de PA no se pueden atribuir por completo al fármaco de primera línea. Pueden representar diferencias reales en la capacidad de disminución de la PA, pero se necesitarán otras revisiones sistemáticas diseñadas específicamente para evaluar la PA para confirmar estos resultados.
Acuerdos y desacuerdos con otros estudios o revisiones
Los resultados de la comparación entre los inhibidores del SRA y los BCC coinciden con los de la revisión Cochrane Chen 2010 en los resultados de IM, accidente cerebrovascular, IC, eventos CV y mortalidad por todas las causas, así como en la PA sistólica y la PA diastólica. Asimismo, los resultados de esta revisión para los inhibidores del SRA de primera línea en comparación con los betabloqueantes de primera línea son similares a los informados en otra revisión (Wiysonge 2017) para los resultados de morbilidad y mortalidad.

Risk of bias summary: review authors' judgements about each risk of bias item for each included citations

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included citations

Comparison 1 RAS inhibitors vs CCBs, Outcome 1 All‐cause death.

Comparison 1 RAS inhibitors vs CCBs, Outcome 2 Total CV events.

Comparison 1 RAS inhibitors vs CCBs, Outcome 3 Total HF.

Comparison 1 RAS inhibitors vs CCBs, Outcome 4 Total MI.

Comparison 1 RAS inhibitors vs CCBs, Outcome 5 Total stroke.

Comparison 1 RAS inhibitors vs CCBs, Outcome 6 ESRF.

Comparison 1 RAS inhibitors vs CCBs, Outcome 7 SBP.

Comparison 1 RAS inhibitors vs CCBs, Outcome 8 DBP.

Comparison 1 RAS inhibitors vs CCBs, Outcome 9 HR.

Comparison 2 RAS inhibitors vs thiazides, Outcome 1 All‐cause death.

Comparison 2 RAS inhibitors vs thiazides, Outcome 2 Total CV events.

Comparison 2 RAS inhibitors vs thiazides, Outcome 3 Total HF.

Comparison 2 RAS inhibitors vs thiazides, Outcome 4 Total MI.

Comparison 2 RAS inhibitors vs thiazides, Outcome 5 Total stroke.

Comparison 2 RAS inhibitors vs thiazides, Outcome 6 ESRF.

Comparison 2 RAS inhibitors vs thiazides, Outcome 7 SBP.

Comparison 2 RAS inhibitors vs thiazides, Outcome 8 DBP.

Comparison 2 RAS inhibitors vs thiazides, Outcome 9 HR.

Comparison 3 RAS inhibitors vs beta‐blockers (β‐blockers), Outcome 1 All‐cause death.

Comparison 3 RAS inhibitors vs beta‐blockers (β‐blockers), Outcome 2 Total CV events.

Comparison 3 RAS inhibitors vs beta‐blockers (β‐blockers), Outcome 3 Total HF.

Comparison 3 RAS inhibitors vs beta‐blockers (β‐blockers), Outcome 4 Total MI.

Comparison 3 RAS inhibitors vs beta‐blockers (β‐blockers), Outcome 5 Total stroke.

Comparison 3 RAS inhibitors vs beta‐blockers (β‐blockers), Outcome 6 ESRF.

Comparison 3 RAS inhibitors vs beta‐blockers (β‐blockers), Outcome 7 SBP.

Comparison 3 RAS inhibitors vs beta‐blockers (β‐blockers), Outcome 8 DBP.

Comparison 3 RAS inhibitors vs beta‐blockers (β‐blockers), Outcome 9 HR.

Comparison 4 RAS inhibitors vs alpha‐blockers (α‐blockers), Outcome 1 SBP.

Comparison 4 RAS inhibitors vs alpha‐blockers (α‐blockers), Outcome 2 DBP.

Comparison 4 RAS inhibitors vs alpha‐blockers (α‐blockers), Outcome 3 HR.

Comparison 5 RAS inhibitors vs CNS active drug, Outcome 1 SBP.

Comparison 5 RAS inhibitors vs CNS active drug, Outcome 2 DBP.

Comparison 5 RAS inhibitors vs CNS active drug, Outcome 3 HR.
| First‐line RAS inhibitors compared to first‐line CCBs for hypertension | |||||||
| Patient or population: people with hypertension | |||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Certainty of the evidence (GRADE) | Comments | ||
| Assumed risk | Corresponding risk | ||||||
| CCBs | RAS inhibitors | ||||||
| All‐cause death | 124 per 1000 | 127 per 1000 | RR 1.03 | 35,226 | ⊕⊕⊕⊝ | ||
| Total cardiovascular events | 178 per 1000 | 174 per 1000 | RR 0.98 | 35,223 | ⊕⊕⊕⊝ | ||
| Death or hospitalization for heart failure | 72 per 1000 | 60 per 1000 | RR 0.83 | 35,143 | ⊕⊕⊕⊝ | ARR = 1.2% NNTB = 83 | |
| Total myocardial infarction | 68 per 1000 | 69 per 1000 | RR 1.01 | 35,043 | ⊕⊕⊕⊝ | ||
| Total stroke | 39 per 1000 | 46 per 1000 | RR 1.19 | 34,673 | ⊕⊕⊕⊝ | ARI = 0.7% NNTH = 143 | |
| End stage renal failure | 25 per 1000 | 22 per 1000 | RR 0.88 | 19,551 | ⊕⊕⊝⊝ | ||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||||
| GRADE Working Group grades of evidence | |||||||
| 1Downgraded because we judged some of the included trials to be at high risk of bias. | |||||||
| First‐line RAS inhibitors compared to first‐line thiazides for hypertension | ||||||
| Patient or population: people with hypertension Comparison: First‐line thiazides | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Certainty of the evidence (GRADE) | Comments | |
| Assumed risk | Corresponding risk | |||||
| Thiazides | RAS inhibitors | |||||
| All‐cause death | 144 per 1000 | 144 per 1000 (135 to 154) | RR 1.00 (0.94 to 1.07) | 24,309 (1) | ⊕⊕⊕⊝ | |
| Total cardiovascular events | 194 per 1000 | 204 per 1000 | RR 1.05 | 24,379 | ⊕⊕⊕⊝ | |
| Death or hospitalization for heart failure | 57 per 1000 | 68 per 1000 (61 to 75) | RR 1.19 (1.07 to 1.31) | 24,309 (1) | ⊕⊕⊕⊝ | ARI = 1.1% NNTH = 91 |
| Total myocardial infarction | 93 per 1000 | 86 per 1000 | RR 0.93 | 24,379 | ⊕⊕⊕⊝ | |
| Total stroke | 44 per 1000 | 50 per 1000 (45 to 56) | RR 1.14 (1.02 to 1.28) | 24,309 (1) | ⊕⊕⊕⊝ | ARI = 0.6% NNTH = 167 |
| End stage renal failure Follow‐up: mean 4.9 years | 13 per 1000 | 14 per 1000 (11 to 18) | RR 1.10 (0.88 to 1.37) | 24,309 (1) | ⊕⊕⊝⊝ | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Based on one large trial (ALLHAT 2002). | ||||||
| First‐line RAS inhibitors compared to first‐line beta‐blockers for hypertension | ||||||
| Patient or population: people with hypertension | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Certainty of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Β‐blockers | RAS inhibitors | |||||
| All‐cause death | 94 per 1000 | 84 per 1000 | RR 0.89 (0.78 to 1.01) | 9193 (1) | ⊕⊕⊝⊝ | |
| Total cardiovascular events | 143 per 1000 | 126 per 1000 | RR 0.88 | 9239 | ⊕⊕⊝⊝ | ARR = 1.7% NNTB = 59 |
| Total heart failure | 35 per 1000 | 33 per 1000 (27 to 41) | RR 0.95 (0.76 to 1.18) | 9193 (1) | ⊕⊕⊝⊝ | |
| Total myocardial infarction | 41 per 1000 | 43 per 1000 | RR 1.05 | 9239 | ⊕⊕⊝⊝ | |
| Total stroke | 67 per 1000 | 50 per 1000 (42 to 59) | RR 0.75 (0.63 to 0.88) | 9193 (1) | ⊕⊕⊝⊝ | ARR = 1.7% NNTB = 59 |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Based primarily on one moderate‐sized trial (LIFE 2002). | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All‐cause death Show forest plot | 5 | 35226 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.03 [0.98, 1.09] |
| 2 Total CV events Show forest plot | 6 | 35223 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.98 [0.93, 1.02] |
| 3 Total HF Show forest plot | 5 | 35143 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.83 [0.77, 0.90] |
| 4 Total MI Show forest plot | 5 | 35043 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.01 [0.93, 1.09] |
| 5 Total stroke Show forest plot | 4 | 34673 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.19 [1.08, 1.32] |
| 6 ESRF Show forest plot | 4 | 19551 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.88 [0.74, 1.05] |
| 7 SBP Show forest plot | 20 | 36437 | Mean Difference (IV, Fixed, 95% CI) | 1.23 [0.90, 1.56] |
| 8 DBP Show forest plot | 20 | 36437 | Mean Difference (IV, Fixed, 95% CI) | 0.98 [0.79, 1.18] |
| 9 HR Show forest plot | 5 | 540 | Mean Difference (IV, Fixed, 95% CI) | 0.30 [‐1.63, 2.22] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All‐cause death Show forest plot | 1 | 24309 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.00 [0.94, 1.07] |
| 2 Total CV events Show forest plot | 2 | 24379 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.05 [1.00, 1.11] |
| 3 Total HF Show forest plot | 1 | 24309 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.19 [1.07, 1.31] |
| 4 Total MI Show forest plot | 2 | 24379 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.93 [0.86, 1.01] |
| 5 Total stroke Show forest plot | 1 | 24309 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.14 [1.02, 1.28] |
| 6 ESRF Show forest plot | 1 | 24309 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.10 [0.88, 1.37] |
| 7 SBP Show forest plot | 10 | 26382 | Mean Difference (IV, Fixed, 95% CI) | 1.60 [1.20, 1.99] |
| 8 DBP Show forest plot | 9 | 26335 | Mean Difference (IV, Fixed, 95% CI) | ‐0.12 [‐0.36, 0.13] |
| 9 HR Show forest plot | 2 | 84 | Mean Difference (IV, Fixed, 95% CI) | 0.66 [‐2.87, 4.19] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All‐cause death Show forest plot | 1 | 9193 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.89 [0.78, 1.01] |
| 2 Total CV events Show forest plot | 2 | 9239 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.88 [0.80, 0.98] |
| 3 Total HF Show forest plot | 1 | 9193 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.95 [0.76, 1.18] |
| 4 Total MI Show forest plot | 2 | 9239 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.05 [0.86, 1.27] |
| 5 Total stroke Show forest plot | 1 | 9193 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.75 [0.63, 0.88] |
| 6 ESRF Show forest plot | 1 | 46 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.33 [0.01, 7.78] |
| 7 SBP Show forest plot | 16 | 10905 | Mean Difference (IV, Fixed, 95% CI) | ‐0.55 [‐1.22, 0.11] |
| 8 DBP Show forest plot | 16 | 10905 | Mean Difference (IV, Fixed, 95% CI) | 0.48 [0.14, 0.83] |
| 9 HR Show forest plot | 10 | 9979 | Mean Difference (IV, Fixed, 95% CI) | 6.05 [5.59, 6.50] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 SBP Show forest plot | 3 | 380 | Mean Difference (IV, Fixed, 95% CI) | ‐2.38 [‐3.98, ‐0.78] |
| 2 DBP Show forest plot | 3 | 380 | Mean Difference (IV, Fixed, 95% CI) | ‐0.12 [‐1.09, 0.85] |
| 3 HR Show forest plot | 1 | 44 | Mean Difference (IV, Fixed, 95% CI) | 3.1 [‐2.41, 8.61] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 SBP Show forest plot | 1 | 56 | Mean Difference (IV, Fixed, 95% CI) | 1.30 [‐6.01, 8.61] |
| 2 DBP Show forest plot | 1 | 56 | Mean Difference (IV, Fixed, 95% CI) | ‐0.30 [‐1.85, 1.25] |
| 3 HR Show forest plot | 1 | 56 | Mean Difference (IV, Fixed, 95% CI) | 1.5 [‐4.13, 7.13] |