Crioterapia primaria para el cáncer de próstata localizado o localmente avanzado
Resumen
Antecedentes
Tradicionalmente, la prostatectomía radical y la radioterapia con o sin tratamiento de deprivación androgénica han sido las principales opciones de tratamiento para intentar la curación en los hombres con cáncer de próstata localizado o localmente avanzado. La crioterapia es una opción alternativa para el tratamiento del cáncer de próstata que incluye la congelación total de la próstata (tratamiento total de la glándula) o solo del cáncer (tratamiento focal), pero su efectividad no está clara en comparación con otros tratamientos.
Objetivos
Evaluar los efectos de la crioterapia (tratamiento total o focal de la glándula) en comparación con otras intervenciones para el tratamiento primario del cáncer de próstata no metastásico clínicamente localizado (cT1‐T2) o localmente avanzado (cT3).
Métodos de búsqueda
Se actualizó una revisión Cochrane publicada previamente realizando una búsqueda exhaustiva en múltiples bases de datos (CENTRAL, MEDLINE, EMBASE), registros de ensayos clínicos (ClinicalTrials.gov, World Health Organization International Clinical Trials Registry Platform) y en un repositorio de literatura gris (Grey Literature Report) hasta el 6 marzo 2018. También se realizaron búsquedas en las listas de referencias de otras publicaciones relevantes y actas de congresos. No se aplicaron restricciones de idiomas.
Criterios de selección
Se incluyeron los ensayos aleatorios o cuasialeatorios que compararon la crioterapia con otras intervenciones para el tratamiento primario del cáncer de próstata.
Obtención y análisis de los datos
Dos autores de la revisión independientes examinaron la literatura, extrajeron los datos y evaluaron el riesgo de sesgo. Se realizaron análisis estadísticos utilizando un modelo de efectos aleatorios y se interpretaron de acuerdo con el Manual Cochrane para Revisiones Sistemáticas de Intervenciones (Cochrane Handbook for Systematic Reviews of Interventions). La calidad de la evidencia se calificó según el enfoque GRADE.
Resultados principales
Solamente se incluyó una comparación de crioterapia total de la glándula versus radioterapia de haz externo, informada por dos ensayos con un total de 307 participantes asignados al azar. La mediana de edad de los estudios incluidos estuvo alrededor de los 70 años. El seguimiento mediano de los estudios incluidos varió de 100 a 105 meses.
Resultados primarios: no hay seguridad acerca del efecto de la crioterapia total de la glándula en comparación con la radioterapia sobre el tiempo transcurrido hasta la muerte por cáncer de próstata; cociente de riesgos instantáneos (CRI) 1,00 (intervalo de confianza [IC] del 95%: 0,11 a 9,45; dos ensayos, 293 participantes; evidencia de calidad muy baja); lo que correspondería con cero muertes menos por cáncer de próstata por 1000 hombres (IC del 95%: 85 menos a 520 más). De igual manera, no hay seguridad acerca del efecto sobre la calidad de vida (CdV) relacionada con la función urinaria y la función intestinal a los 36 meses con el uso de la puntuación del UCLA‐Prostate Cancer Index en la que los valores mayores (rango: 0 a 100) reflejan mejor calidad de vida mediante diferencias mínimas clínicamente importantes (DMCI) de 8 y 7 puntos, respectivamente; diferencia de medias (DM) 4,4 (IC del 95%: −6,5 a 15,3) y 4,0 (IC del 95%: −73,96 a 81,96), respectivamente (un ensayo, 195 participantes; evidencia de calidad muy baja). Tampoco hay seguridad con respecto a la calidad de vida relacionada con la función sexual mediante una DMCI de 8 puntos; DM −20,7 (IC del 95%: −36,29 a −5,11; un ensayo, 195 participantes; evidencia de calidad muy baja). Finalmente, no hay seguridad acerca del riesgo de eventos adversos graves; cociente de riesgos (CR): 0,91 (IC del 95%: 0,47 a 1,78; dos ensayos, 293 participantes; evidencia de calidad muy baja); esto se corresponde con diez eventos adversos graves menos por 1000 hombres (IC del 95%: 58 menos a 86 más).
Resultados secundarios: no hay mucha seguridad acerca de los efectos de la crioterapia sobre el tiempo transcurrido hasta la muerte por cualquier causa (CRI 0,99; IC del 95%: 0,05 a 18,79; dos ensayos, 293 participantes; evidencia de calidad muy baja) ni el tiempo transcurrido hasta el fracaso bioquímico (CRI 2,15; IC del 95%: 0,07 a 62,12; dos ensayos, 293 participantes; evidencia de calidad muy baja). Las tasas de intervenciones secundarias por el fracaso del tratamiento y los eventos adversos leves no se informaron en los ensayos o no fue posible utilizar los datos en los análisis.
No se encontraron ensayos que compararan la crioterapia total de la glándula o la crioterapia focal en comparación con otras formas de tratamiento como la cirugía radical, la monitorización activa, la conducta expectante u otras formas de radioterapia.
Conclusiones de los autores
Según evidencia de calidad muy baja, la crioterapia total de la glándula tiene efectos inciertos sobre los resultados oncológicos, la CdV y los eventos adversos graves, en comparación con la radioterapia de haz externo. Las razones para la disminución de la calidad de la evidencia incluyeron limitaciones graves de los estudios, falta de direccionalidad debido al uso de radiación con dosis inferiores a las actualmente recomendadas en el grupo de comparación e imprecisión grave o muy grave.
PICO
Resumen en términos sencillos
Crioterapia primaria para el cáncer de próstata localizado o localmente avanzado
Pregunta de la revisión
¿Cómo se compara la congelación de la glándula prostática (crioterapia) con otros tratamientos en los hombres con cáncer de próstata que no han sido tratados anteriormente?
Antecedentes
Habitualmente el cáncer de próstata se trata con cirugía o radiación si todavía no se ha diseminado a otros órganos. Estos tratamientos pueden tener efectos secundarios graves. La congelación de la próstata es otra manera de tratar el cáncer de próstata. Se puede realizar mediante la congelación de toda la próstata (crioterapia total de la glándula) o solo la parte de la próstata donde está el cáncer principal (crioterapia focal). No se sabe bien cómo se compara la congelación de la próstata con otros tratamientos.
Características de los estudios
Se realizaron búsquedas de evidencia de ensayos en la literatura médica hasta el 6 de marzo de 2018. Se encontraron dos ensayos aleatorios que compararon la congelación total de la próstata con el tratamiento con radiación. Estos ensayos asignaron al azar a 307 hombres con cáncer de próstata (154 hombres a crioterapia, 153 hombres a radiación). Su edad promedio estuvo alrededor de los 70 años. Estos estudios siguieron a los hombres durante ocho a nueve años después del tratamiento. No se encontraron estudios que compararan la congelación de la próstata con la cirugía. Además, no se encontraron ensayos aleatorios que compararan la congelación de partes de la próstata (crioterapia focal) con radiación, cirugía o ningún tratamiento.
Resultados clave
No hay seguridad con respecto a los efectos de la congelación total de la próstata en comparación con el tratamiento con radiación sobre el tiempo transcurrido hasta la muerte por cáncer de próstata, la calidad de vida con respecto a la función urinaria, intestinal y sexual y las reacciones graves no deseadas del tratamiento.
Calidad de la evidencia
La calidad de la evidencia fue muy baja para todos los resultados, lo que significa que el efecto real de la crioterapia total de la glándula puede diferir mucho de los hallazgos de esta revisión. Es muy probable que los estudios de investigación adicionales modifiquen estos hallazgos.
Conclusiones de los autores
Summary of findings
| Participants: men with localised or locally advanced prostate cancer Setting: single institution in Canada Intervention: whole gland cryotherapy Comparator: external beam radiotherapy (EBRT) | |||||
| Outcomes | № of participants | Quality of the evidence | Relative effect | Anticipated absolute effects* (95% CI) | |
| Risk with EBRT | Risk difference with cryotherapy | ||||
| Time to death from prostate cancer (absolute effects: disease‐specific mortality)1 | 293 | ⊕⊝⊝⊝ | HR 1.00 | Study population | |
| 97 per 1000 | 0 fewer per 1000 | ||||
| Quality of life ‐ urinary function Follow‐up: mean 36 months | 195 | ⊕⊝⊝⊝ | ‐ | The mean quality of life ‐ urinary function was 88.6 | MD 4.4 higher |
| Quality of life ‐ bowel function Follow‐up: mean 36 months | 195 | ⊕⊝⊝⊝ | ‐ | The mean quality of life ‐ bowel function was 84.1 | MD 4 higher |
| Quality of life ‐ sexual function Follow‐up: mean 36 months | 195 | ⊕⊝⊝⊝ | ‐ | The mean quality of life ‐ sexual function was 36.7 | MD 20.7 lower |
| Major adverse events | 293 | ⊕⊝⊝⊝ | RR 0.91 | Study population | |
| 110 per 1000 | 10 fewer per 1000 | ||||
| Time to death from any cause (absolute effects: overall mortality)1 | 293 | ⊕⊝⊝⊝ | HR 0.99 | Study population | |
| 166 per 1000 | 2 fewer per 1000 | ||||
| Secondary interventions for treatment failure ‐ not reported | ‐ | ‐ | ‐ | ‐ | ‐ |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Mortality instead of survival to estimate anticipated absolute effect is reported for methodological reason. 2 Downgraded by one level for study limitations: unclear or high risk of bias in half of domains in included studies. 3 Downgraded by one level for indirectness (differences in intervention): prescribed dose of radiotherapy in the included studies was lower than 74 Gy as recommended by current guidelines (EAU 2017). Also, radiotherapy should be given in combination with long‐term androgen deprivation therapy (two to three years) in patients with high risk prostate cancer. 4 Downgraded by two levels for imprecision: wide confidence interval cross assumed threshold of clinically important differences. 5 UCLA‐Prostate Cancer Index contains six domains (urinary function (4 items), urinary bother (1 item), sexual function (5 items), sexual bother (1 item), bowel function (3 items), bowel bother (1 item)) which are scored separately (low score = worst, high score = better) (Litwin 1998). 6 Downgraded by one level for imprecision: confidence interval crosses assumed threshold of clinically important difference. | |||||
Antecedentes
Descripción de la afección
El cáncer de próstata representa uno de los problemas médicos más importantes que afectan a la población masculina. Es la neoplasia (cáncer) más frecuente en los hombres en Europa y los EE.UU., donde se diagnostican anualmente cerca de 417 000 y 209 000 nuevos casos, respectivamente, (USCS Group 2014). En todo el mundo, el cáncer de próstata representa el 14% (˜903 500) de todos los nuevos casos de cáncer y el 6% de las muertes relacionadas con el cáncer (Jemal 2011).
La determinación del estadio del cáncer de próstata incluye la revisión rectal digital, la medición de nivel de antígeno específico de la próstata (PSA) y la puntuación de Gleason (el sistema de clasificación Gleason es específico para cáncer de próstata) (D’Amico 2003) determinada por una biopsia de la próstata. El estadio tumoral clínico (estadio‐T) a menudo se clasifica como localizado (limitado al órgano, cT1/T2) o localmente avanzado (extraprostático, es decir fuera la próstata, T3/T4). Habitualmente el estadio del cáncer de próstata se expresa mediante un sistema de clasificación de grupos de riesgo (D'Amico 2003). Los hombres a menudo se clasifican de bajo riesgo (PSA < 10, Gleason < 7, y cT1‐cT2a), de riesgo intermedio (cualquiera de los siguientes: PSA 10 a 20; Gleason 7, o cT2b), o de alto riesgo (PSA > 20, Gleason > 7; cT2c localizado o cT3‐T4 localmente avanzado) (EAU 2017). Los modelos de estratificación del riesgo se utilizan para predecir la mortalidad específica por cáncer y para guiar las decisiones de tratamiento (Babaian 2008; D'Amico 2003). En los pacientes con cáncer de próstata de bajo riesgo, la monitorización activa o la conducta expectante son actualmente el enfoque terapéutico de elección. Incluso los hombres con cáncer de próstata de riesgo intermedio y de alto riesgo tienen un pronóstico relativamente favorable en comparación con otros cánceres. Según la puntuación de Gleason inicial, muchos hombres presentan un mayor peligro de morir de otras causas que por cáncer de próstata (Albertsen 1995).
La prostatectomía radical (PR), la radioterapia de haz externo (RTHE) y la braquiterapia intersticial son las intervenciones que se utilizan con más frecuencia para el tratamiento del cáncer de próstata localizado o localmente avanzado. Los factores específicos de los pacientes, así como el aumento en el conocimiento de los factores relacionados con el tratamiento, los eventos adversos y la calidad de vida relacionada con la salud (CdVRS), han dado lugar al desarrollo de enfoques terapéuticos alternativos para el cáncer de próstata (Beerlage 2003). la crioterapia es un procedimiento muy poco invasivo que se ha reconocido como una opción alternativa para el tratamiento del cáncer de próstata (AUA 2017; EAU 2017; Thompson 2007).
Descripción de la intervención
Los progresos en la crioterapia para el cáncer de próstata durante los últimos 50 años se han centrado en maximizar la destrucción del tejido de la próstata y a la vez reducir al mínimo la lesión de los tejidos adyacentes (Cooper 2001). Estudios antiguos han utilizado la crioterapia total de la glándula como un método para el tratamiento del cáncer de próstata, pero las mejorías recientes en la imagenología y los métodos diagnósticos, como la imagenología de resonancia magnética multiparamétrica y la biopsia de mapeo tridimensional, han dado lugar a un mayor énfasis en el tratamiento focal del cáncer de próstata localizado (Barqawi 2014).
El procedimiento moderno utiliza el gas presurizado argón para lograr el enfriamiento y el helio para calentar. Con guía ecográfica transrrectal, las sondas pequeñas o crioagujas se colocan en la próstata mediante una incisión perineal. Para monitorizar las temperaturas dentro de la glándula también se utilizan agujas termopares. Estos instrumentos se integran en programas informáticos para generar el mapeo geométrico y térmico durante el procedimiento. Posteriormente se utilizan catéteres de recalentamiento uretral e inyecciones salinas a la próstata para disminuir la lesión a la uretra y a la pared rectal anterior, respectivamente (Baust 2005; Cohen 2004; Donnelly 2002b; Rees 2004).
Los principios generales para la preparación incluyen dirigir el enfriamiento a la próstata o a las vesículas seminales, o ambas, mientras se protege la uretra, el recto y los paquetes neurovasculares en los pacientes, por el interés en preservar la función sexual. La ecografía en tiempo real permite la visualización de la denominada "bola de hielo" (la formación visible de un área de tejido congelado dentro de la próstata), y los sensores térmicos proporcionan mediciones de diversos puntos en la próstata y sus alrededores. Se pretende una temperatura objetivo de −40 ℃ para lograr un efecto letal máximo en el tejido de la próstata (Gage 1998). La destrucción de tejido adicional se puede mejorar al aumentar la tasa de congelación, permitir una descongelación lenta y la realización de un ciclo doble de congelación‐descongelación (Baust 2005).
La crioterapia puede tener como objetivo toda la próstata (crioterapia total de la glándula) o solamente partes de la próstata (tratamiento focal). En el último caso, los hallazgos previos por imagenología o por biopsia o ambos, buscarán determinar la "lesión índice", o sea, la que es probable que determine la evolución natural del cáncer del paciente particular. Se piensa que limitar la congelación a la lesión índice reduce la frecuencia y la gravedad de los efectos adversos relacionados con el tratamiento. Debido a su conveniencia conceptual, se ha incrementado el uso del tratamiento focal, a la vez que ha disminuido la administración del tratamiento total de la glándula (Barqawi 2014).
Los tratamientos comparativos incluyen cirugía y radioterapia. El tratamiento quirúrgico del cáncer de próstata con PR incluye la extracción física de la glándula prostática, las vesículas seminales, con o sin los ganglios linfáticos de drenaje, seguido de la reconstrucción de la continuidad de la vejiga con la uretra membranosa. La radioterapia incluye el uso de radiación ionizante para causar daño al ADN y la posterior muerte de las células (Koukourakis 2009). La radiación ionizante se puede aplicar a partir de una fuente externa, como en la RTHE, en la cual se generan fotones de alta energía que se dirigen a la próstata, o internamente mediante braquiterapia, en la que se implanta una fuente radiactiva directamente en la próstata.
Efectos adversos de la intervención
Los eventos adversos que se sabe que se asocian con la crioterapia incluyen retención urinaria, infecciones urinarias, dolor perineal y dolor o edema en el pene o el escroto. Otros efectos secundarios a más largo plazo incluyen eventos adversos persistentes, como disfunción eréctil, incontinencia urinaria, fístula recto‐uretral, estrechamiento uretral, esfacelo uretral y dolor peneano/escrotal (AUA 2017; EAU 2017; Rees 2004).
De qué manera podría funcionar la intervención
La justificación de la efectividad de la crioterapia se remonta al siglo XIX, cuando James Arnott utilizó el frío para destruir cánceres de mama y cervicouterino (Arnott 1851). El nitrógeno líquido ganó popularidad a mediados del siglo XX para el tratamiento de diversas afecciones de la piel y en 1963 estuvo disponible mediante el dispositivo Cooper para el tratamiento de tejidos más profundos. Por definición, la crioterapia es un tipo de tratamiento térmico en el cual los tejidos se enfrían a temperaturas muy bajas para provocar la destrucción pretendida (Cooper 2001). Fisiológicamente, la congelación provoca una serie de respuestas celulares que causan necrosis tisular.
El mecanismo por el cual se produce la muerte de las células incluye tres fases principales. Inicialmente, la congelación provoca la formación de hielo en el espacio extracelular; este hecho crea un gradiente hiperosmótico que causa contracción celular y daño a las proteínas intracelulares. Al mantenerla, se lesionan las células endoteliales y causa trombosis e hipoxia tisular. Finalmente, se forma y se expande el hielo en el espacio intracelular y rompe las membranas celulares y activa la apoptosis celular (Baust 2004).
Por qué es importante realizar esta revisión
Las decisiones de tratamiento para el cáncer de próstata incluyen una evaluación de las características tumorales y la clasificación del riesgo, así como la esperanza de vida y el estado de salud general de los pacientes. En los hombres que optan por recibir tratamiento para el cáncer de próstata, la elección de la intervención incluye las preferencias del paciente, otras afecciones de salud, factores relacionados con el tratamiento y las complicaciones. Aunque la PR y la radiación todavía son las elecciones estándar, han surgido opciones alternativas para los pacientes donde estas intervenciones no son adecuadas (AUA 2017; EAU 2017).
La crioterapia es una opción de tratamiento muy poco invasiva que se puede realizar en un ámbito de pacientes ambulatorios a un costo más bajo que los tratamientos comparativos (Robinson 2002). Los candidatos potenciales incluyen a los hombres que no son candidatos a prostatectomía quirúrgica (debido a comorbilidades médicas, obesidad con pelvis estrecha), o que tienen contraindicaciones para la radioterapia (radiación pelviana previa, trastornos intestinales inflamatorios, enfermedad rectal). La American Urologic Association ha reconocido a la crioterapia como una "opción" para la enfermedad limitada al órgano de cualquier grado y con evaluación metastásica negativa (AUA 2017; Babaian 2008). La European Urological Association ha reconocido a la crioterapia como una opción alternativa para el cáncer de próstata que está limitado al órgano o con extensión tumoral mínima fuera de la próstata, con clasificación del riesgo baja a intermedia (EAU 2017). La evidencia citada para apoyar estas recomendaciones se basa en estudios observacionales y en un ensayo clínico aleatorio. La finalidad de esta revisión es evaluar la evidencia que compara la crioterapia con las opciones estándar de tratamiento para el tratamiento primario del cáncer de próstata localizado o localmente avanzado. Esta revisión es una actualización de una revisión publicada en 2007 (Shelley 2007), con la inclusión de dos ensayos controlados aleatorios publicados desde entonces y la aplicación del enfoque GRADE para valorar la calidad de la evidencia (QoE).
Objetivos
Evaluar los efectos de la crioterapia (tratamiento total o focal de la glándula) en comparación con otras intervenciones para el tratamiento primario del cáncer de próstata no metastásico clínicamente localizado (cT1‐T2) o localmente avanzado (cT3).
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron los ensayos aleatorios o cuasialeatorios de grupos paralelos (p.ej. con bases de asignación alternativas a partir de la fecha de nacimiento o del número de registro de casos) que compararon la crioterapia con otras intervenciones para el tratamiento primario del cáncer de próstata.
Tipos de participantes
Hombres con cáncer de próstata no metastásico (M0) estadio clínico T1‐T3 con nódulos negativos (N0), que no han recibido tratamiento previo.
Tipos de intervenciones
Se programó investigar las siguientes comparaciones de la intervención experimental versus la intervención de comparación. Las intervenciones concomitantes debían ser las mismas en los grupos de intervención y comparador para establecer comparación justas.
Intervenciones experimentales
-
Crioterapia (toda la glándula o focal)
Se decidió incluir solamente los procedimientos de crioablación que utilizaron un catéter de calentamiento uretral e imagenología en tiempo real de la colocación de la/s sonda/s de criocirugía y los ciclos de congelación‐descongelación. Se incluyeron los estudios en los que el tratamiento de deprivación androgénica se administró antes o después de la crioterapia, o ambos, si se utilizó un régimen idéntico en el grupo comparador. Debido a que muchos protocolos de crioterapia permiten un segundo procedimiento de crioablación durante la fase de tratamiento, se incluyeron los estudios que utilizaron dichos protocolos.
Intervenciones de comparación
-
Ninguna intervención (conducta expectante o crioterapia simulada)
-
Monitorización activa
-
Braquiterapia
-
Radioterapia de haz externo (RTHE)
-
Prostatectomía radical
Tipos de medida de resultado
No se usó la medición de los resultados evaluados en esta revisión como criterio de elegibilidad.
Resultados primarios
-
Tiempo transcurrido hasta la muerte por cáncer de próstata
-
CdV
-
Eventos adversos graves
Resultados secundarios
-
Tiempo transcurrido hasta la muerte por cualquier causa
-
Intervenciones secundarias por fracaso del tratamiento
-
Tiempo transcurrido hasta el fracaso bioquímico
-
Eventos adversos leves
Método y momento adecuado de la medición de los resultados
-
Tiempo transcurrido hasta la muerte por cáncer de próstata: medido como la fecha de asignación al azar hasta la fecha de muerte debido a cáncer de próstata (Mariotto 2014).
-
CdV: cambio medio evaluado con un cuestionario validado como el UCLA‐Prostate Cancer Index (UCLA‐PCI; Litwin 1998) y el cuestionario European Organisation for Research and Treatment core QoL (EORTC QLQ C‐30; Aaronson 1993).
-
Eventos adversos graves: calificados según los Common Terminology Criteria for Adverse Events (CTCAE): Grado 3 = graves; Grado 4 = potencialmente mortales o invalidantes; Grado 5 = relacionado con la muerte; también se consideró la definición utilizada en cada ensayo clínico (National Cancer Institute). Si los autores de los estudios elegibles no utilizaron el sistema CTCAE, la gravedad de los eventos adversos se calificó según la información disponible descrita en los estudios.
-
Tiempo transcurrido hasta la muerte por cualquier causa: medido como la fecha de la asignación al azar hasta la fecha de muerte debido a cualquier causa (Mariotto 2014).
-
Intervenciones secundarias por fracaso del tratamiento: eventos que requirieron otras modalidades de tratamiento (p.ej. crioterapia de rescate o radioterapia) después de la intervención.
-
Tiempo transcurrido hasta el fracaso bioquímico: medido como la fecha de la asignación al azar hasta la fecha del fracaso bioquímico mediante la definición de la American Society for Therapeutic Radiology and Oncology (ASTRO) (Roach 2006).
-
Eventos adversos leves: calificados según los CTCAE: Grado 1 = leves; Grado 2 = moderados. Si los autores no utilizaron el sistema CTCAE, los eventos adversos se calificaron como se describió anteriormente.
La diferencia clínicamente importante en los resultados de la revisión se utilizó para evaluar la calidad de la evidencia con respecto a la imprecisión en Resumen de los hallazgos tabla 1 (Johnston 2010). No se encontró información publicada acerca de una diferencia clínicamente importante en el tiempo transcurrido hasta la muerte por cáncer de próstata, cualquier causa o fracaso bioquímico, por lo que la diferencia clínicamente importante se consideró como una reducción del riesgo relativo de al menos el 25% para estos resultados (Guyatt 2011a). Al utilizar el UCLA‐PCI, se consideraron otras diferencias mínimas clínicamente importantes (DMCI) del siguiente modo: para la función urinaria, 8 puntos; la función intestinal, 7 puntos; la función sexual, 8 puntos; las molestias urinarias, 9 puntos; las molestias intestinales, 8 puntos; y las molestias sexuales, 11 puntos (Jayadevappa 2012). De estar disponible, se consideraron las DMCI de QLQ EORTC C‐30 sobre la base de la bibliografía anterior (Bedard 2014). Aunque no se estableció un umbral para los eventos adversos graves y leves, también se consideró la diferencia clínicamente importante como una reducción del riesgo relativo de al menos el 25% (Guyatt 2011a).
Métodos de búsqueda para la identificación de los estudios
We performed a comprehensive search with no restrictions for the language of publication or publication status.
Búsquedas electrónicas
We updated the published Cochrane Review by searching the following sources between 2006 and 9 June 2015 thereby overlapping with the original search by Shelley 2007 (from 1996 to 2006). We re‐ran the searches in all relevant databases on 6 March 2018, and incorporated any identified relevant studies into the review. See Appendix 1 for the search strategy.
-
Cochrane Library (via Wiley; for the search strategy)
-
Cochrane Database of Systematic Reviews (CDSR)
-
Cochrane Central Register of Controlled Trials (CENTRAL)
-
Database of Abstracts of Reviews of Effects (DARE)
-
Health Technology Assessment Database (HTA)
-
-
MEDLINE (via Ovid)
-
EMBASE (via Ovid)
-
LILACS (Latin American and the Caribbean Health Sciences Literature; www.bireme.br/)
-
Scopus
-
Web of Science
We also searched the following trials registers on 9 June 2015 and again on 6 March 2018.
-
ClinicalTrials.gov (https://clinicaltrials.gov/)
-
World Health Organization International Clinical Trials Registry Platform search portal (http://apps.who.int/trialsearch/)
-
Grey Literature Report (http://www.greylit.org/)
When we detected additional relevant key words during any of the electronic or other searches, we modified the electronic search strategies to incorporate these terms and documented the changes.
Búsqueda de otros recursos
We tried to identify other potentially eligible trials or ancillary publications by searching the reference lists of included trials, reviews, meta‐analyses and health technology assessment reports. We also contacted study authors of included trials to identify any further studies that we might have missed. We contacted drug/device manufacturers for ongoing or unpublished trials. We searched for unpublished studies by handsearching the abstract proceedings of the annual meetings of American Urological Association, European Association of Urology, and the American Society of Clinical Oncology from 2012 to 2017.
Obtención y análisis de los datos
Selección de los estudios
We used EndNote reference management software to identify and remove potential duplicate records. Two review authors (JHJ, BR or RG) independently scanned the abstract, title, or both, of remaining records retrieved, to determine which studies should be assessed further through Covidence. Two review authors (JHJ, BR or RG) investigated all potentially relevant records as full text, mapped records to studies, and classified studies as included studies, excluded studies, studies awaiting classification, or ongoing studies in accordance with the criteria for each provided in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011a). We resolved any discrepancies through consensus or recourse to a third review author (PD). We documented reasons for exclusion of studies that may have reasonably been expected to be included in the review in a Characteristics of excluded studies table. In Figure 1, we present an adapted PRISMA flow diagram showing the process of study selection (Liberati 2009).
Extracción y manejo de los datos
We developed a dedicated data abstraction form that we pilot tested ahead of time.
For studies that fulfilled inclusion criteria, two review authors (JHJ, BR or RG) independently abstracted the following information, which we provide in the Characteristics of included studies table. For all eligible studies we abstracted the following information:
-
Study design;
-
Study dates (we reported if dates were not available);
-
Study settings and country;
-
Participant inclusion and exclusion criteria;
-
Participant details, baseline demographics;
-
Number of participants by study and by study arm;
-
Details of relevant experimental and comparator interventions;
-
Definitions of relevant outcomes, and methods and timings of outcome measurements, as well as any relevant subgroups;
-
Sources of study funding;
-
Declarations of interest by primary investigators.
We extracted outcome data relevant to this review for calculation of summary statistics and measurement of variance. For dichotomous outcomes, we obtained numbers of events and totals for population of a 2 x 2 table, as well as summary statistics with corresponding measures of variance. For continuous outcomes, we obtained means and standard deviations, or the data necessary to calculate this information. For time‐to‐event outcomes, we obtained hazard ratios (HRs) with corresponding measures of variance, or the data necessary to calculate this information.
We resolved the few, minor disagreement by discussion, or, if required, by consultation with a third review author (PD).
We provided information, including trial identifier, about potentially relevant ongoing studies in the table Characteristics of ongoing studies.
We contacted authors of included studies to obtain key missing data as needed.
Dealing with duplicate and companion publications
In the event of duplicate publications, companion documents or multiple reports of a primary study, we maximised yield of information by mapping all publications to unique studies and collating all available data, and used the most complete data‐set aggregated across all known publications. Where there was doubt, we gave priority to the publication reporting the longest follow‐up associated with our primary or secondary outcomes.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (JHJ, BR) assessed the risk of bias of each included study independently. We resolved disagreements by consensus, or by consultation with a third review author (PD).
We assessed risk of bias using the Cochrane 'Risk of bias' tool (Higgins 2011b). We assessed the following domains:
-
Random sequence generation (selection bias);
-
Allocation concealment (selection bias);
-
Blinding of participants and personnel (performance bias);
-
Blinding of outcome assessment (detection bias);
-
Incomplete outcome data (omission bias)
-
Incomplete outcome data (attrition bias);
-
Selective reporting (reporting bias);
-
Other sources of bias.
We judged risk of bias domains as being at 'low risk', 'high risk' or 'unclear risk', and evaluated individual bias items as described in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011b).
For selection bias (random sequence generation and allocation concealment), we evaluated risk of bias at a trial level.
For performance bias (blinding of participants and personnel), we considered all outcomes similarly susceptible to performance bias therefore underscoring the importance of blinding participants and personnel.
For detection bias (blinding of outcome assessment), we grouped outcomes as susceptible to detection bias (subjective outcomes) or not susceptible to detection bias (objective outcomes).
We defined the following endpoints as subjective outcomes:
-
Time to death from prostate cancer;
-
QoL;
-
Major adverse events;
-
Time to biochemical failure;
-
Minor adverse events.
We defined the following endpoints as objective outcomes:
-
Time to death from any cause;
-
Secondary interventions for treatment failure.
We also assessed attrition bias (incomplete outcome data) on an outcome‐specific basis, but sought to create groups of outcomes based on similar reporting characteristics.
For reporting bias (selective reporting), we evaluated risk of bias at a trial level.
We further summarised the risk of bias across domains for each outcome in each included study, as well as across studies and domains for each outcome, in accordance with the approach for summary assessments of the risk of bias presented in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011b).
Medidas del efecto del tratamiento
We expressed dichotomous data as risk ratios (RRs < 1: favoring intervention arm) with 95% confidence intervals (CI). We expressed continuous data as mean differences (MD > 0: favoring intervention arm) with 95% CI. We expressed time‐to‐event data as HRs (HR < 1: favoring intervention arm) with 95% CI.
Cuestiones relativas a la unidad de análisis
The unit of analysis was the individual participant. If we had identified cross‐over trials, cluster‐randomised trials, or trials with more than two intervention groups for inclusion in the review, we would have handled these in accordance with guidance provided in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011c).
Manejo de los datos faltantes
We sought to obtain missing data from the investigators and performed intention‐to‐treat analyses if data were available; otherwise, we performed available case analyses. We investigated attrition rates, e.g. dropouts, losses to follow‐up and withdrawals, and appraised instances where data were missing critically. We did not impute missing data.
Evaluación de la heterogeneidad
We identified heterogeneity (inconsistency) through visual inspection of the forest plots to assess the amount of overlap of CIs, and the I2 statistic, which quantifies inconsistency across studies and permits assessment of the impact of heterogeneity on the meta‐analysis (Higgins 2002; Higgins 2003). We interpreted I2 as follows (Deeks 2011):
-
0% to 40%: may not be important;
-
30% to 60%: may indicate moderate heterogeneity;
-
50% to 90%: may indicate substantial heterogeneity;
-
75% to 100%: indicates considerable heterogeneity.
When we identified heterogeneity, we determined possible reasons for it by examining individual study and subgroup characteristics.
Evaluación de los sesgos de notificación
We attempted to obtain study protocols to assess for selective outcome reporting. We did not perform funnel plots to assess small study effects due to paucity of included studies.
Síntesis de los datos
We summarised data using a random‐effects model and interpreted these with due consideration of the whole distribution of effects. In addition, we performed meta analyses according to the statistical guidelines contained in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011a). For dichotomous outcomes, we used the Mantel‐Haenszel method; for continuous outcomes, we used the inverse variance method; and for time‐to‐event outcomes, we used the generic inverse variance method. We used Review Manager 5 software to perform statistical analyses (Review Manager 2014).
Análisis de subgrupos e investigación de la heterogeneidad
We expected the following characteristics to introduce clinical heterogeneity, and planned to carry out a subgroup analysis with investigation of interactions limited to the primary outcomes.
-
D'Amico risk classification:
-
low versus intermediate versus high
-
We planned these subgroup analyses because a higher local tumour stage prompts a different surgical approach (D’Amico 2008; EAU 2017) and cryotherapy may have different effectiveness based on this risk classification.
Análisis de sensibilidad
We planned to perform a sensitivity analysis limited to the primary outcomes in order to explore the influence on the estimated effect size of restricting the analysis by taking risk of bias into account (when applicable).
'Summary of findings' table
We presented the overall QoE for each outcome according to the GRADE approach, which takes into account five criteria that relate to internal validity (risk of bias, inconsistency, imprecision, publication bias) and also to external validity such as directness of results (Guyatt 2008). For each comparison, two review authors (JHJ, BR) independently rated the QoE for each outcome as 'high', 'moderate', 'low', or 'very low' using GRADEproGDT; we resolved discrepancies by consensus, or, if necessary, by arbitration of a third review author (PD). For each comparison, we presented a summary of the evidence for the main outcomes in a 'Summary of findings' table, which provides key information about the best estimate of the magnitude of the effect, in relative terms and absolute differences for each relevant comparison of alternative management strategies; numbers of participants and studies addressing each important outcome; and the rating of the overall confidence in effect estimates for each outcome (Guyatt 2011b; Schünemann 2011).
We included the following outcomes in our SoF table according to priority (Summary of findings table 1).
-
Time to death from prostate cancer
-
QoL
-
Major adverse event
-
Time to death from any cause
-
Secondary interventions for treatment failure
Results
Description of studies
Results of the search
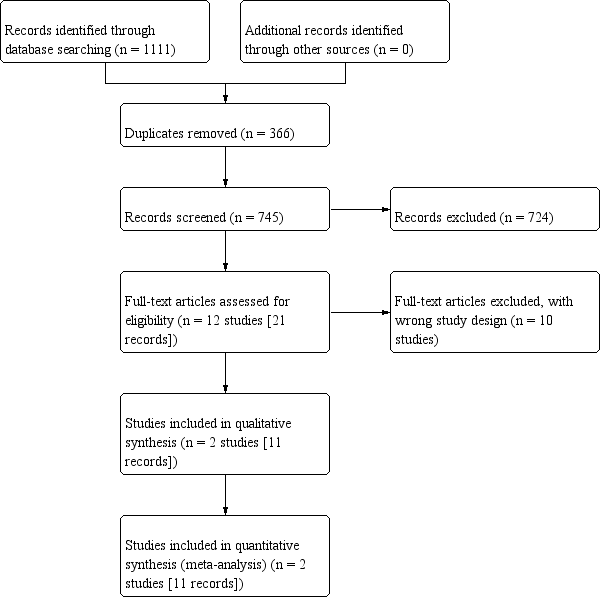
We identified 1111 records through an electronic database search. We did not find additional records through handsearching other sources. After removal of 366 duplicates, we screened the titles and abstracts of 745 records, and excluded 724 records. We screened 21 full‐text articles, and excluded 10 studies that did not meet the inclusion criteria or were not relevant to the question under trial. We included a total of two studies (11 records) in the review. We did not identify studies awaiting classification and ongoing trials. The flow of literature through the assessment process is shown in the PRISMA flowchart (Figure 1).
Included studies
Details of included studies are presented in the Characteristics of included studies, Table 1, and Table 2.
| Study name | Trial period | Setting/ country | Participants | Intervention(s) and comparator(s) | Age (median, years) | No of men with clinical tumour stage (T2a; 2b; 2c; 3a; 3b) | Biopsy Gleason score (<7; 7; >7) | PSA (median, ng/mL) | Median follow‐up (months) |
| Chin 2008 | 1999 to 2002 | Single institution in Canada | Histologically proven prostate cancer, clinically staged as T2c, T3a or T3b with no evidence of lymph node or distant metastasis and serum PSA < 25 ng/mL | Whole gland cryotherapy | 70.4 | ‐; ‐; 12; 17; 2 | 2; 24; 5 | 11.1 | 105 |
| EBRT | 70.5 | ‐; ‐; 8; 15; 8 | 1; 24; 6 | 8.6 | |||||
| Donnelly 2010 | 1997 to 2003 | Single institution in Canada | Histologically proven adenocarcinoma of the prostate, a biopsy tumour classification of T2 or T3, no evidence of lymph node or distant metastases, a pretreatment PSA level < 20 ng/mL, and a gland volume < 60 cm3 | Whole gland cryotherapy | 69.4 | 22; 28; 49; 17; 6 | 42; 69; 11 | 8.1 | 100 |
| EBRT | 68.6 | 20; 23; 57; 18; 4 | 44; 65; 13 | 9.0 |
EBRT: external beam radiotherapy; PSA: prostate specific antigen
| Study name | Intervention(s) and comparator(s) | Screened/ eligible | Randomised | Treatment completed | Treatment analysed |
| Chin 2008 | Whole gland cryotherapy | NR/140 | 32 | NR | 31 (96.8%) |
| EBRT | 31 | 31 (100.0%) | |||
| Total | 63 | NR | 62 (98.4%) | ||
| Donnelly 2010 | Whole gland cryotherapy | NR/764 | 122 | NR | 117 (95.9%) |
| EBRT | 122 | 114 (93.4%) | |||
| Total | 244 | NR | 231 (94.6%) | ||
| Grand total | 307 | NR | 293 (95.4%) | ||
EBRT: external beam radiotherapy; NR: not reported
Source of data
We identified two published full text studies through our electronic database search (Chin 2008; Donnelly 2010). Both trials were published in English. We attempted to contact both corresponding authors of included trials to obtain additional information on study methodology and results but did not obtain any meaningful additional results that were not found in the published reports (Appendix 2).
Study design and settings
Both trials were parallel randomised controlled trials that compared whole gland cryotherapy to EBRT. One study was reported as 'open label' in the protocol (Donnelly 2010), but the other included no information regarding blinding (Chin 2008). Both studies were conducted at single institutions in Canada. The studies were performed between 1997 and 2003.
Participants
We included 307 randomised participants (cryotherapy 154, EBRT 153), of whom 293 were included in the analyses of the intervention and control groups (cryotherapy 148, EBRT 145). The median age of the included studies was around 70 years. Median prostate volume was 35.6 mL in Chin 2008 while Donnelly 2010 did not specify the prostate volume. The median PSA ranged from 8 to 10 ng/mL (Chin 2008: 9.9, Donnelly 2010: 8.1 to 9.0).
The trials included men with histologically proven localised or locally advanced prostate cancer, clinically staged as T2 or T3 (using the American Joint Committee on Cancer nomenclature, with no evidence of lymph node or distant metastases, and a serum PSA less than 25 ng/ml (Chin 2008; Donnelly 2010). Chin 2008 included more men with T3 disease (42/62 (67.7%)) compared to Donnelly 2010 (45/244 (18.4%)) (Table 1).The most common biopsy Gleason score was 7. Major exclusion criteria included a history of prior pelvic radiotherapy or hormone therapy, node‐positive disease or distant metastases, or both. Chin 2008 excluded men with an enlarged prostate that exceeded 75 mL or American Society of Anesthesiology Risk Class > 3. Donnelly 2010 excluded men who had undergone transurethral resection of the prostate within three months of screening.
Intervention(s) and comparator(s)
Both included trials used third‐generation cryotherapy. Cryotherapy was performed under general or spinal anaesthesia. It was administered using transrectal ultrasound guidance, a urethral warming device, thermosensor monitoring, and two freeze‐thaw cycles. A suprapubic catheter was placed in all participants and removed around two or three weeks postoperatively. A repeat cryotherapy procedure was offered to men who had a subsequent positive biopsy (Chin 2008), or early PSA failure (Donnelly 2010), at three or six months.
EBRT was administered using a 4‐field box technique with a prescribed dose of 66 Gy (Chin 2008), or 68 Gy (Donnelly 2010), received as 2 Gy daily, five days per week (Chin 2008: 6.5 weeks, Donnelly 2010: from 6.8 to 7.4 weeks). In one study the total dose was increased to 70 Gy in 2000 and to 73.5 Gy in 2002 (Donnelly 2010). The target included the prostate gland and seminal vesicles.
All participants received androgen deprivation therapy with luteinising hormone‐releasing hormone for six months. Cryotherapy or EBRT was performed 90 to 210 days after the first injection in Chin 2008, and 180 to 210 days after the first injection in Donnelly 2010, However, only three months of hormonal therapy was administered before local treatment in the early stage of Donnelly 2010. In 2001, the investigators amended the protocol to include six months of hormonal treatment (Donnelly 2010).
The median follow‐up of the included studies was 105 months in Chin 2008, and 100 months in Donnelly 2010.
Comparisons
Both studies compared whole gland cryotherapy to EBRT; we identified none that compared whole gland cryotherapy to no intervention, active surveillance, brachytherapy, or RP. We did not find any randomised controlled trials that used focal cryotherapy.
Outcomes
Chin 2008 reported oncologic outcomes, namely time to death from prostate cancer, any cause, and biochemical failure at four years and eight years for each intervention. Donnelly 2010 reported time to death from prostate cancer and any cause at five years. Time to biochemical failure was stated at 36, 60, and 84 months post‐randomisation. Both studies only described the Kaplan Meier survival curves for the time to biochemical failure. All trials reported biochemical failure using both the ASTRO definition of three consecutive increases in serum PSA following nadir (ASTRO Consensus Panel 1997), and Phoenix criteria (second Radiation Treatment Oncology Group ‐ ASTRO Consensus Conference) of serum PSA reaching 2 ng/mL above the nadir (Roach 2006).
QoL was assessed with the UCLA‐PCI and EORTC QLQ C‐30, and was reported at three and 36 months post‐randomisation in one study (Donnelly 2010). Given that EORTC QLQ C‐30 was reported only in a figure, we used UCLA‐PCI data only for the meta‐analysis in this review. The UCLA‐PCI was developed to evaluate the QoL of men treated for early‐stage prostate cancer. It consists of 20 items related to urinary function (5 items), urinary bother (1 item), sexual function (8 items), sexual bother (1 item), bowel function (4 items), and bowel bother (1 item) which are scored by 3‐ to 6‐point Likert scales (low score is worse, high score is better) (Litwin 1998).
Both studies reported adverse events. Donnelly 2010 categorised adverse events according to the codes of the National Cancer Institute of Canada Common Toxicity Criteria (National Cancer Institute; version 2.0). However, we were not able to extract the data for minor adverse events due to a unit of analysis error.
Neither of the studies reported on secondary interventions for treatment failure.
Funding sources and conflicts of interests
Chin 2008 and Donnelly 2010 were supported by research grants from Astra‐Zeneca and the National Cancer Institute of Canada and the Alberta Cancer Board, respectively. The first author in Chin 2008 and one of the co‐authors in Donnelly 2010 disclosed relevant conflicts of interest.
Excluded studies
There were a total of 10 studies that we reviewed fully and excluded because they were the wrong study design; eight were single‐armed studies and two were non‐RCTs (Aus 2002; Bahn 2002; Cohen 1996; Coogan 1995; Donnelly 2002a; Gould 1999; Liu 2016; Long 1998; Prepelica 2005; Wong 1997). Details of the excluded studies are presented in Characteristics of excluded studies.
Risk of bias in included studies
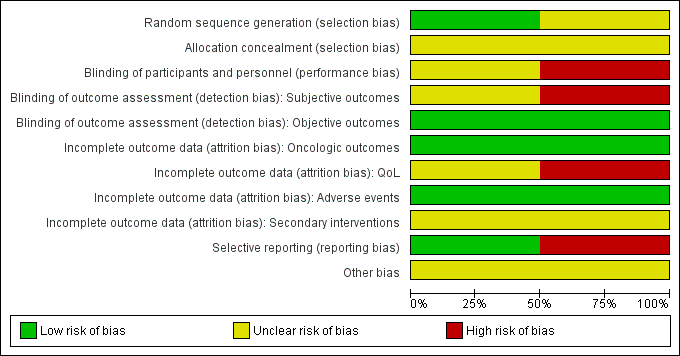
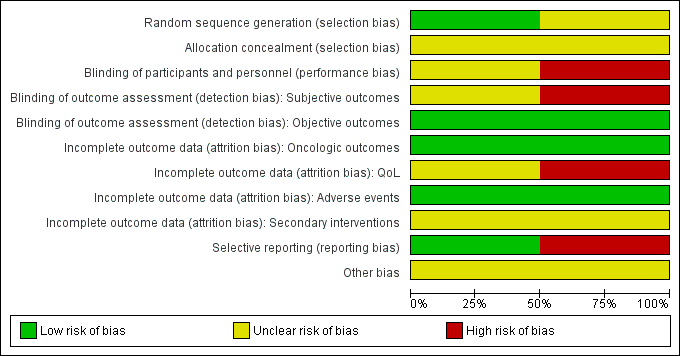
Summaries of 'Risk of bias' judgements for the included studies are presented in Figure 2 and Figure 3).
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Random sequence generation
We rated Donnelly 2010 as having low risk of bias as describing an appropriate method of sequence generation, but Chin 2008 as having unclear risk of bias due to a lack of information about random sequence generation.
Allocation concealment
We rated both studies as being at unclear risk of bias due to a lack of information about implementation of allocation.
Blinding
Blinding of participants and personnel
We rated Chin 2008 as being at unclear risk of bias due to lack of information as to whether participants and personnel were masked. We judged Donnelly 2010 as being at high risk of bias due to its open label study design.
Blinding of outcome assessment
For the subjective outcomes (i.e. time to death from prostate cancer, QoL, major adverse events, time to biochemical failure, and minor adverse events), we rated Chin 2008 as being at unclear risk of bias due to lack of information as to whether outcome assessors were masked and Donnelly 2010 as being at high risk of bias due to its open label study design.
For objective outcomes (i.e. time to death from any cause and secondary interventions for treatment failure), we rated both studies as being at a low risk of bias as these objective outcomes were unlikely to be affected by lack of blinding.
Incomplete outcome data
For time to death from prostate cancer, any cause, and biochemical failure, we rated both studies as being at low risk of bias.
For QoL, we rated Chin 2008 as having an unclear risk of bias due to attrition rates between 10% and 19% for at least one treatment arm, and Donnelly 2010 as having a high risk of bias due to attrition rates of 20% or greater for at least one trial arm.
For adverse events, we rated both studies as being at low risk of bias due to attrition rates of less than 10%.
For secondary interventions for treatment failure, we judged both studies as being at unclear risk of bias as the outcome was not measured.
Selective reporting
We judged Donnelly 2010 as having a low risk of bias given that the reported analyses and outcomes corresponded to the description in the study protocol. As Chin 2008 did not report our prespecified secondary outcome (treatment failure), we rated this trial as having a high risk of bias in this domain.
Other potential sources of bias
We rated both studies as being at unclear risk of bias due to imbalances of important baseline characteristics or violation of inclusion criteria.
Effects of interventions
A summary of our results is provided in summary of findings Table for the main comparison.
Whole gland cryotherapy versus EBRT
We included data from two studies for the outcomes of time to death from prostate cancer, major adverse events, time to death from any cause, and time to biochemical failure (293 men; cryotherapy 148, EBRT 145). For QoL, we included only one study with 194 men (cryotherapy 106, EBRT 88) at 3 months follow‐up and 195 men (cryotherapy 98, EBRT 97) at 36 months follow‐up (Donnelly 2010) .
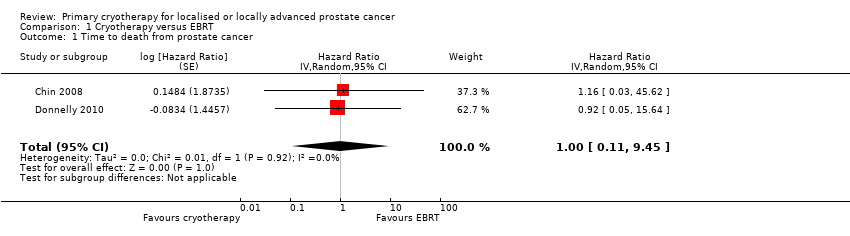
Time to death from prostate cancer
We are uncertain about the effect of whole gland cryotherapy on time to death from prostate cancer (HR 1.00, 95% CI 0.11 to 9.45; Analysis 1.1). This corresponds to zero fewer death (85 fewer to 520 more) from prostate cancer per 1000 men. We rated the QoE as very low, downgrading for study limitations, indirectness, and very serious imprecision.
QoL
At 3 months follow‐up
We are uncertain about the effects of whole gland cryotherapy on urinary (MD −21.30, 95% CI −37.35 to −5.25), bowel (MD 2.30, 95% CI −2.67 to 7.27), and sexual function (MD −25.70, 95% CI −45.06 to −6.34) (Analysis 1.2). We rated the QoE as very low, downgrading for study limitations, indirectness, and imprecision.
At 36 months follow‐up
We are uncertain about the effects of whole gland cryotherapy on urinary (MD 4.40, 95% CI −6.50 to 15.30), bowel (MD 4.00, 95% CI −73.96 to 81.96), and sexual function (MD −20.70, 95% CI −36.29 to −5.11) (Analysis 1.3). We rated the QoE as very low, downgrading for study limitations, indirectness, and imprecision.
Major adverse events
We are uncertain about the effect of whole gland cryotherapy on major adverse events (RR 0.91, 95% CI 0.47 to 1.78; Analysis 1.4). This corresponds to 10 fewer major adverse events (58 fewer to 86 more) per 1000 men. We rated the QoE as very low, downgrading for study limitations, indirectness, and imprecision.
Time to death from any cause
We are uncertain about the effect of whole gland cryotherapy on time to death from any cause (HR 0.99, 95% CI 0.05 to 18.79; Analysis 1.5). This corresponds to 2 fewer deaths from any cause (157 fewer to 801 more) per 1000 men. We rated the QoE as very low, downgrading for study limitations, indirectness, and imprecision.
Secondary interventions for treatment failure
We did not find data related to secondary interventions for treatment failure.
Time to biochemical failure
We used Phoenix criteria to define time to biochemical failure in the meta‐analyses. We are uncertain about the effect of whole gland cryotherapy on time to biochemical failure (HR 2.15, 95% CI 0.07 to 62.12; Analysis 1.6). This corresponds to 237 more biochemical failures (278 fewer to 697 more) per 1000 participants. We rated the QoE as very low, downgrading for study limitations, indirectness, and very serious imprecision.
Minor adverse events
We did not find data related to adverse events categorised as minor.
Subgroup and sensitivity analysis
We were not able to perform our predefined subgroup or sensitivity analyses due to an absence of available data, and the low number of included studies, respectively.
Discusión
Resumen de los resultados principales
Se incluyeron dos estudios, con un total de 307 hombres asignados al azar, que compararon la crioterapia total de la glándula con la RTHE. Los participantes se clasificaron clínicamente como T2 y T3, no presentaban metástasis locorregional ni distantes y tenían un PSA de hasta 25 ng/ml.
Sobre la base de la evidencia disponible, no hay seguridad con respecto a los efectos de la crioterapia total de la glándula en comparación con la RTHE en los resultados primarios (es decir, tiempo transcurrido hasta la muerte por cáncer de próstata, CdV y eventos adversos graves) y en los resultados secundarios de esta revisión. La calidad de la evidencia para todos los resultados fue muy baja. No se encontraron datos de las tasas de retratamiento ni de eventos adversos leves.
No fue posible realizar los análisis secundarios predefinidos.
No se encontraron ensayos elegibles que compararan la crioterapia total o focal de la glándula con tratamientos alternativos como la cirugía, la monitorización activa o la conducta expectante.
Compleción y aplicabilidad general de las pruebas
Aunque los dos ensayos incluidos representan los únicos dos ensayos existentes de crioterapia primaria para el cáncer de próstata localizado o localmente avanzado, este grupo de evidencia tiene limitaciones importantes con respecto a la aplicabilidad para la práctica contemporánea.
-
Ambos ensayos representan experiencias en instituciones únicas de Canadá, que pueden no ser representativas del tipo de paciente ni de la práctica clínica en otras partes del mundo. Los ensayos multiinstitucionales de otros países habrían sido informativos.
-
Los ensayos incluyeron hombres con enfermedad clínica T3 con alto riesgo de fracaso local y distante que actualmente se habrían categorizado como de alto riesgo. Además, hubo un desequilibrio en las proporciones de participantes con enfermedad T3 entre los estudios incluidos (Chin 2008: 67,7%; Donnelly 2010: 18,4%). No fue posible analizar por separado los resultados de los hombres de riesgo bajo e intermedio, lo que habría sido aconsejable.
-
Los dos ensayos informaron resultados adicionales como volumen de la próstata y progresión de la enfermedad. Ninguno de ellos se consideró tan importante para el paciente de manera directa como los que se habían planificado incluir en esta actualización, por lo que se omitieron.
-
Ambos ensayos administraron de forma sistemática terapia hormonal neoadyuvante o coadyuvante más las intervenciones (crioterapia y radioterapia) en los participantes con riesgo intermedio y alto riesgo. Aunque las guías recientes recomiendan la administración del tratamiento de deprivación androgénica con la radioterapia como la opción estándar de tratamiento para los hombres con cáncer de próstata localizado de riesgo intermedio (AUA 2017), aún es polémico si estos resultados se deben aplicar a los hombres con cáncer de próstata localizado de riesgo intermedio (EAU 2017). Entretanto, el valor de la terapia hormonal concomitante está menos claro en los hombres que reciben crioterapia (AUA 2017).
-
Aunque ambos ensayos utilizaron la crioterapia de generación más reciente (de tercera generación), se realizaron entre 1997 y 2003 cuando la de tercera generación se introdujo por primera vez. Por lo tanto, es probable que los resultados no reflejen con exactitud el estado actual de la crioablación de la próstata.
-
Aunque ha habido un reciente cambio de interés de la crioterapia total de la glándula a la crioterapia focal, no fue posible identificar ensayos elegibles.
Calidad de la evidencia
La calidad de la evidencia se disminuyó de forma sistemática a muy baja para todos los resultados. Los aspectos que redujeron la confianza en las estimaciones del efecto incluyeron las limitaciones de los estudios, específicamente el sesgo de selección (asignación poco clara), el sesgo de realización y de detección (falta de cegamiento) y otros sesgos (desequilibrio inicial, violación de los criterios de inclusión, interrupción temprana del ensayo). También se disminuyó por falta de direccionalidad e imprecisión debido a diferencias en la intervención (dosis prescritas de radioterapia y duración del tratamiento de deprivación androgénica) y los intervalos de confianza amplios, respectivamente.
Sesgos potenciales en el proceso de revisión
Aunque se efectuaron búsquedas en bases de datos múltiples y en otras fuentes con una estrategia integral de búsqueda idéntica al estándar Cochrane, solamente se encontraron dos ECA. El pequeño número de estudios incluidos en esta revisión no fue suficiente para generar gráficos en embudo; por lo tanto, puede haberse subestimado el riesgo de sesgo de publicación. Debido a que los estudios incluidos no informaron los CRI ni el número de participantes supervivientes en los resultados oncológicos, se calcularon los CRI para el tiempo transcurrido hasta la muerte por cáncer de próstata y por cualquier causa sobre la base del porcentaje de supervivencia en un punto temporal específico (Chin 2008: ocho años, Donnelly 2010: cinco años) después de la intervención con el uso del método publicado en Parmar 1998. Además, se calcularon los CRI para la supervivencia libre de enfermedad bioquímica según la curva Kaplan Meier de cada estudio (Parmar 1998). También se calcularon las desviaciones estándar a partir de las DM y los valores de p en los estudios incluidos con respecto a la CdV (Higgins 2011d). Aunque se recibió información adicional de los autores de ambos estudios, no se recibieron datos apropiados para realizar metanálisis adicionales (Apéndice 2). Lo anterior puede ser una fuente de sesgo.
Acuerdos y desacuerdos con otros estudios o revisiones
Una revisión sistemática y metanálisis recientes no revelaron diferencias significativas en las comparaciones de la crioterapia total de la glándula versus la radioterapia ni de la crioterapia total de la glándula versus PR en el tiempo transcurrido hasta la muerte por cáncer de próstata ni por cualquier causa (Gao 2016). Un metanálisis en red publicado en 2014 indicó que la crioterapia total de la glándula tampoco mejoró la supervivencia en comparación con el tratamiento de observación, la PR, la radioterapia convencional y la radioterapia conformal (Xiong 2014). Aunque Gao 2016 no reveló diferencias significativas entre la crioterapia total de la glándula y la radioterapia en las molestias urinarias y sexuales a los 12 meses o más, Xiong 2014 informó que la crioterapia total de la glándula dio lugar a menos eventos adversos gastrointestinales que la radioterapia. No hubo evidencia de que la crioterapia total de la glándula tuviera menos efectos adversos que otras formas de tratamiento.
En esta revisión la crioterapia total de la glándula se asoció con resultados oncológicos similares a los de la RTHE, lo que es consistente con los resultados de otras revisiones recientes. Aunque Gao 2016 no informó diferencias en la CdV al utilizar ensayos controlados no aleatorios, en la presente revisión se encontró que la crioterapia total de la glándula fue inferior a la RTHE en cuanto a la CdV sexual a los 36 meses de seguimiento. No se encontraron diferencias en los eventos adversos graves entre la crioterapia total de la glándula y la RTHE. Sin embargo, no hay seguridad con respecto a los efectos de la crioterapia total de la glándula sobre todos los resultados de la revisión según el enfoque GRADE.
Aunque hay un número cada vez mayor de ensayos prospectivos registrados para la crioterapia focal de la glándula, la mayoría de los estudios son de tipo cohorte y retrospectivos, con estándares variables de información (Tay 2016; Valerio 2014). Tampoco se encontraron ensayos controlados aleatorios elegibles que compararan la crioterapia focal de la glándula con otros tratamientos.
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Comparison 1 Cryotherapy versus EBRT, Outcome 1 Time to death from prostate cancer.
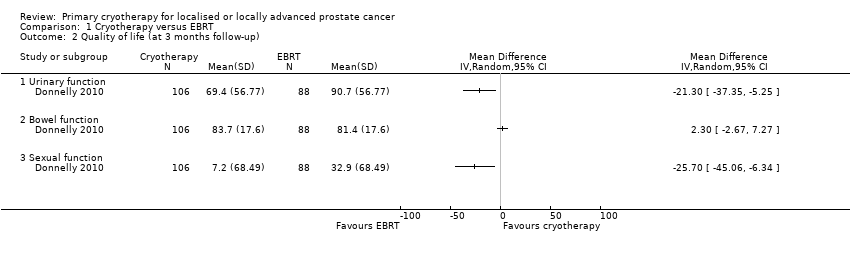
Comparison 1 Cryotherapy versus EBRT, Outcome 2 Quality of life (at 3 months follow‐up).
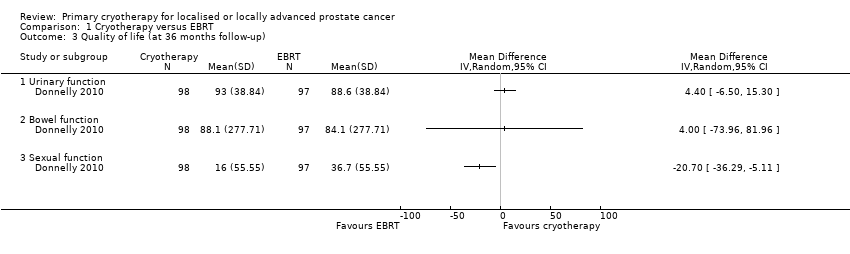
Comparison 1 Cryotherapy versus EBRT, Outcome 3 Quality of life (at 36 months follow‐up).
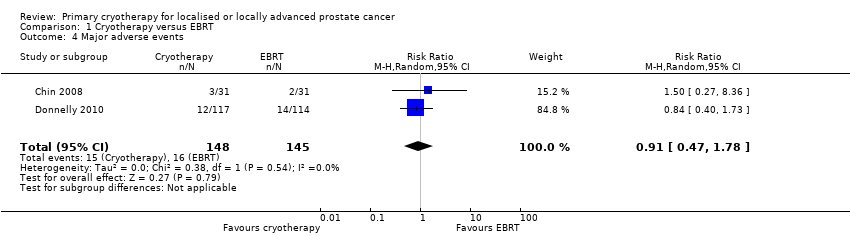
Comparison 1 Cryotherapy versus EBRT, Outcome 4 Major adverse events.
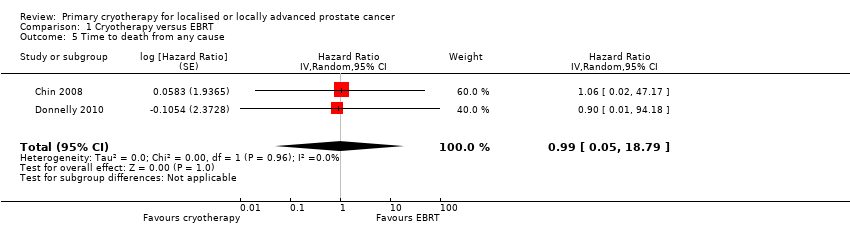
Comparison 1 Cryotherapy versus EBRT, Outcome 5 Time to death from any cause.
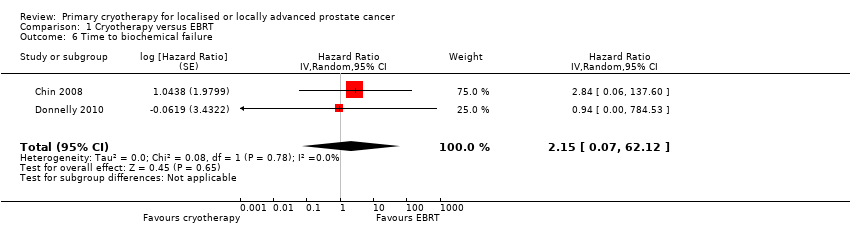
Comparison 1 Cryotherapy versus EBRT, Outcome 6 Time to biochemical failure.
| Participants: men with localised or locally advanced prostate cancer Setting: single institution in Canada Intervention: whole gland cryotherapy Comparator: external beam radiotherapy (EBRT) | |||||
| Outcomes | № of participants | Quality of the evidence | Relative effect | Anticipated absolute effects* (95% CI) | |
| Risk with EBRT | Risk difference with cryotherapy | ||||
| Time to death from prostate cancer (absolute effects: disease‐specific mortality)1 | 293 | ⊕⊝⊝⊝ | HR 1.00 | Study population | |
| 97 per 1000 | 0 fewer per 1000 | ||||
| Quality of life ‐ urinary function Follow‐up: mean 36 months | 195 | ⊕⊝⊝⊝ | ‐ | The mean quality of life ‐ urinary function was 88.6 | MD 4.4 higher |
| Quality of life ‐ bowel function Follow‐up: mean 36 months | 195 | ⊕⊝⊝⊝ | ‐ | The mean quality of life ‐ bowel function was 84.1 | MD 4 higher |
| Quality of life ‐ sexual function Follow‐up: mean 36 months | 195 | ⊕⊝⊝⊝ | ‐ | The mean quality of life ‐ sexual function was 36.7 | MD 20.7 lower |
| Major adverse events | 293 | ⊕⊝⊝⊝ | RR 0.91 | Study population | |
| 110 per 1000 | 10 fewer per 1000 | ||||
| Time to death from any cause (absolute effects: overall mortality)1 | 293 | ⊕⊝⊝⊝ | HR 0.99 | Study population | |
| 166 per 1000 | 2 fewer per 1000 | ||||
| Secondary interventions for treatment failure ‐ not reported | ‐ | ‐ | ‐ | ‐ | ‐ |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Mortality instead of survival to estimate anticipated absolute effect is reported for methodological reason. 2 Downgraded by one level for study limitations: unclear or high risk of bias in half of domains in included studies. 3 Downgraded by one level for indirectness (differences in intervention): prescribed dose of radiotherapy in the included studies was lower than 74 Gy as recommended by current guidelines (EAU 2017). Also, radiotherapy should be given in combination with long‐term androgen deprivation therapy (two to three years) in patients with high risk prostate cancer. 4 Downgraded by two levels for imprecision: wide confidence interval cross assumed threshold of clinically important differences. 5 UCLA‐Prostate Cancer Index contains six domains (urinary function (4 items), urinary bother (1 item), sexual function (5 items), sexual bother (1 item), bowel function (3 items), bowel bother (1 item)) which are scored separately (low score = worst, high score = better) (Litwin 1998). 6 Downgraded by one level for imprecision: confidence interval crosses assumed threshold of clinically important difference. | |||||
| Study name | Trial period | Setting/ country | Participants | Intervention(s) and comparator(s) | Age (median, years) | No of men with clinical tumour stage (T2a; 2b; 2c; 3a; 3b) | Biopsy Gleason score (<7; 7; >7) | PSA (median, ng/mL) | Median follow‐up (months) |
| Chin 2008 | 1999 to 2002 | Single institution in Canada | Histologically proven prostate cancer, clinically staged as T2c, T3a or T3b with no evidence of lymph node or distant metastasis and serum PSA < 25 ng/mL | Whole gland cryotherapy | 70.4 | ‐; ‐; 12; 17; 2 | 2; 24; 5 | 11.1 | 105 |
| EBRT | 70.5 | ‐; ‐; 8; 15; 8 | 1; 24; 6 | 8.6 | |||||
| Donnelly 2010 | 1997 to 2003 | Single institution in Canada | Histologically proven adenocarcinoma of the prostate, a biopsy tumour classification of T2 or T3, no evidence of lymph node or distant metastases, a pretreatment PSA level < 20 ng/mL, and a gland volume < 60 cm3 | Whole gland cryotherapy | 69.4 | 22; 28; 49; 17; 6 | 42; 69; 11 | 8.1 | 100 |
| EBRT | 68.6 | 20; 23; 57; 18; 4 | 44; 65; 13 | 9.0 | |||||
| EBRT: external beam radiotherapy; PSA: prostate specific antigen | |||||||||
| Study name | Intervention(s) and comparator(s) | Screened/ eligible | Randomised | Treatment completed | Treatment analysed |
| Chin 2008 | Whole gland cryotherapy | NR/140 | 32 | NR | 31 (96.8%) |
| EBRT | 31 | 31 (100.0%) | |||
| Total | 63 | NR | 62 (98.4%) | ||
| Donnelly 2010 | Whole gland cryotherapy | NR/764 | 122 | NR | 117 (95.9%) |
| EBRT | 122 | 114 (93.4%) | |||
| Total | 244 | NR | 231 (94.6%) | ||
| Grand total | 307 | NR | 293 (95.4%) | ||
| EBRT: external beam radiotherapy; NR: not reported | |||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Time to death from prostate cancer Show forest plot | 2 | Hazard Ratio (Random, 95% CI) | 1.00 [0.11, 9.45] | |
| 2 Quality of life (at 3 months follow‐up) Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 2.1 Urinary function | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 2.2 Bowel function | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 2.3 Sexual function | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 3 Quality of life (at 36 months follow‐up) Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 3.1 Urinary function | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 3.2 Bowel function | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 3.3 Sexual function | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 4 Major adverse events Show forest plot | 2 | 293 | Risk Ratio (M‐H, Random, 95% CI) | 0.91 [0.47, 1.78] |
| 5 Time to death from any cause Show forest plot | 2 | Hazard Ratio (Random, 95% CI) | 0.99 [0.05, 18.79] | |
| 6 Time to biochemical failure Show forest plot | 2 | Hazard Ratio (Random, 95% CI) | 2.15 [0.07, 62.12] | |