Distintos derivados de antraciclina para la reducción de la cardiotoxicidad en pacientes con cáncer
Resumen
Antecedentes
El uso de quimioterapia con antraciclinas está limitado por la aparición de cardiotoxicidad. En un intento por prevenir esta cardiotoxicidad, se han estudiado diferentes derivados de antraciclina.
Objetivos
El objetivo primario fue determinar la aparición de cardiotoxicidad con el uso de diferentes derivados de antraciclina en pacientes con cáncer.
Métodos de búsqueda
Se realizaron búsquedas en las bases de datos del Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials, CENTRAL) (The Cochrane Library, Número 1, 2005), MEDLINE (desde 1966 hasta abril de 2005) y EMBASE (desde 1980 hasta abril de 2005). Además, se realizaron búsquedas en las listas de referencias de artículos pertinentes, resúmenes de congresos y bases de datos de ensayos en curso.
Criterios de selección
Ensayos controlados aleatorios (ECA) en los que se compararon diferentes derivados de antraciclina en pacientes con cáncer (niños y adultos).
Obtención y análisis de los datos
Dos autores realizaron de forma independiente la selección de estudios, la evaluación de la calidad y la extracción de datos, con inclusión de los efectos adversos.
Resultados principales
Se identificaron cinco ECA de diferentes calidades que comparaban epirrubicina versus doxorrubicina (1 036 pacientes) en dosis iguales. El metanálisis no mostró pruebas de una diferencia significativa en la aparición de insuficiencia cardíaca clínica entre los grupos de tratamiento (RR = 0,36; IC del 95%: 0,12 a 1,11). Sin embargo, hubo algunos indicios de una tasa inferior de insuficiencia cardíaca clínica en pacientes tratados con epirrubicina.
Se identificaron dos ECA con diferentes calidades que abordaban doxorrubicina encapsulada en liposomas versus doxorrubicina convencional (521 pacientes). El metanálisis mostró una tasa significativamente baja de insuficiencia cardíaca clínica e insuficiencia cardíaca clínica y subclínica combinadas en pacientes tratados con doxorrubicina encapsulada en liposomas (RR = 0,20; IC del 95%: 0,05 a 0,75 y RR = 0,38; IC del 95%: 0,24 a 0,59, respectivamente). Se debe observar que, en uno de los estudios, los pacientes del grupo de doxorrubicina encapsulada en liposomas recibieron una dosis de antraciclina acumulativa mayor que los pacientes del grupo de doxorrubicina.
Sólo se identificó un ECA para las otras combinaciones posibles de los diferentes derivados de antraciclina.
Conclusiones de los autores
No se pudo favorecer la epirrubicina o la doxorrubicina cuando se administraron con la misma dosis. En función de las pruebas actualmente disponibles sobre la insuficiencia cardíaca, se concluye que en adultos con un tumor sólido se debe favorecer la doxorrubicina encapsulada en liposomas sobre la doxorrubicina. Para la epirrubicina versus doxorrubicina, y la doxorrubicina encapsulada en liposomas versus doxorrubicina convencional, no es posible establecer conclusiones sobre los efectos del tratamiento en niños tratados con antraciclinas, ni en pacientes con diagnóstico de leucemia. Se necesitan más estudios. Para otras combinaciones de los derivados de antraciclina, no hubo pruebas suficientes disponibles para establecer conclusiones definitivas sobre la aparición de cardiotoxicidad en pacientes tratados con antraciclinas.
PICOs
Resumen en términos sencillos
Diferentes derivados de antraciclina para reducir la cardiotoxicidad en los pacientes con cáncer.
Las antraciclinas se encuentran entre los tratamientos con quimioterapia más efectivos disponibles para los diversos tipos de cáncer. Sin embargo, existe un riesgo de daño al corazón que depende de la dosis acumulativa. En un intento de prevenir el daño al corazón, se están utilizando diferentes derivados de antraciclina (como doxorrubicina, daunorrubicina y epirrubicina).
Los autores encontraron que para el uso de muchas combinaciones diferentes de derivados de antraciclina no había pruebas disponibles de alta calidad y fue imposible establecer conclusiones.
Para el uso de la epirrubicina versus doxorrubicina, hubo algunos indicios de una tasa inferior de insuficiencia cardíaca clínica en los pacientes tratados con epirrubicina. No existen pruebas que indiquen una diferencia en la tasa de respuesta antitumoral y la supervivencia entre la epirrubicina y la doxorrubicina. No se pueden establecer conclusiones respecto de los efectos adversos. No hay datos de niños y pacientes con leucemia. Se necesita investigación adicional.
Para el uso de la doxorrubicina versus doxorrubicina encapsulada en liposomas, los autores encontraron una tasa significativamente inferior de insuficiencia cardíaca e insuficiencia cardíaca subclínica clínica (es decir, diversas anomalías cardíacas, diagnósticos realizados con diferentes métodos como la ecocardiografía en pacientes asintomáticos) en pacientes tratados con doxorrubicina encapsulada en liposomas. No existen pruebas que indiquen una diferencia en la tasa de respuesta antitumoral y la supervivencia entre la doxorrubicina y la doxorrubicina encapsulada en liposomas. Se identificó una tasa inferior de efectos adversos en los pacientes tratados con doxorrubicina encapsulada en liposomas. No hay datos de niños y pacientes con leucemia. Se necesita investigación adicional.
Conclusiones de los autores
Antecedentes
Las antraciclinas se encuentran entre los agentes quimioterápicos más efectivos, y su uso se ha generalizado para el tratamiento de numerosos tumores sólidos y neoplasias hematológicas en pacientes adultos y pediátricos. Sin embargo, este uso se ve limitado por la cardiotoxicidad dosis‐dependiente (Bonadonna 1969; Lefrak 1973)).
Según el tiempo de aparición, la lesión cardíaca después del tratamiento con antraciclina se puede dividir en cardiotoxicidad temprana y tardía: la cardiotoxicidad temprana implica la lesión que se desarrolla durante el tratamiento con antraciclina o en el primer año después de su finalización, y la cardiotoxicidad tardía se manifiesta al menos un año después de la finalización del tratamiento con antraciclina (Shan 1996). El riesgo de desarrollar una insuficiencia cardíaca continúa de por vida, especialmente para niños y adultos jóvenes que tienen una expectativa de vida larga después del éxito del tratamiento antineoplásico. Se estima que el riesgo de desarrollar insuficiencia cardíaca clínica 15 años después del tratamiento con antraciclina para el cáncer en la niñez es de aproximadamente 5% (Kremer 2001)).
La lesión cardíaca puede manifestarse en los pacientes como cardiotoxicidad subclínica o cardiotoxicidad clínica. El término cardiotoxicidad subclínica se usa para describir diversas anomalías cardíacas, diagnosticadas con diferentes métodos en pacientes asintomáticos. Por ejemplo, anomalías histológicas según la puntuación de Billingham (Billingham 1978) o anomalías en la función cardíaca medidas por ecocardiografía o ventriculografía por radionúclido. La cardiotoxicidad clínica se define en función de los síntomas de insuficiencia cardíaca clínica, confirmada por una prueba de diagnóstico anormal. En el estadio final de la insuficiencia cardíaca clínica, el trasplante de corazón es la única opción para evitar la muerte.
En la literatura, existe una amplia variación en la frecuencia informada de cardiotoxicidad clínica o subclínica; en los niños, se ha informado que la prevalencia de la disfunción cardíaca subclínica es más del 57% en una mediana de 6,4 años después del tratamiento (Kremer 2002a) y que la incidencia de insuficiencia cardíaca clínica puede alcanzar el 16%; 0,9 a 4,8 años después del tratamiento (Kremer 2002b). En los adultos, se ha informado que la prevalencia de disfunción cardíaca subclínica es de 36% durante el tratamiento con antraciclina (Nousiainen 2002) y que la incidencia de insuficiencia cardíaca clínica es de 30% en una mediana de 37 meses después del tratamiento (Meinardi 2002). Sin embargo, no se realizaron revisiones sistemáticas sobre la frecuencia de cardiotoxicidad inducida por antraciclina en adultos. Posibles factores de riesgo (Kremer 2002b; Ng 2006; Simbre 2005) son el tipo de antraciclina usada, la dosis de antraciclina acumulativa y la presencia de factores de riesgo adicionales que causan lesiones al corazón, como la radioterapia que incluye el área cardíaca, el tipo de tumor, la exposición a ciclofosfamida, ifosfamida, amsacrina, trastuzumab o taxanes o la presencia de una lesión cardíaca preexistente. Además parece haber un riesgo mayor para las mujeres, los niños y las personas ancianas.
Los médicos afrontan un dilema clínico mientras sopesan la eficacia de mayores dosis de antraciclina contra la cardiotoxicidad asociada a estas dosis mayores. Con el objetivo de prevenir o reducir esta toxicidad, se han realizado estudios exhaustivos para la identificación de derivados de antraciclina con menos efectos cardiotóxicos que la doxorrubicina, como la daunorrubicina, la epirrubicina y la idarrubicina (Muggia 1991) y las antraciclinas liposomales (Batist 2001)).
Una importante pregunta respecto de cualquier derivado de la antraciclina es si tiene un efecto cardiotóxico inferior sin reducir la eficacia antitumoral y sin efectos tóxicos diferentes al daño cardíaco, como la alopecia, las náuseas, los vómitos, la estomatitis, la diarrea, la fatiga, la anemia, la leucopenia y la trombocitopenia.
En la actualidad, no se han realizado revisiones sistemáticas sobre la cardiotoxicidad producida por los diferentes derivados de antraciclina.
Objetivos
Objetivo primario
(1) Determinar la cardiotoxicidad de cualquier tipo de derivado de antraciclina en pacientes con cáncer en comparación con otro tipo de derivado de antraciclina.
Objetivos secundarios:
(1) Determinar los efectos posibles de estos derivados de antraciclina sobre la respuesta tumoral y la supervivencia del paciente.
(2) Determinar los efectos posibles de estos derivados de antraciclina sobre efectos tóxicos diferentes al daño cardíaco, así como la calidad de vida (CdV).
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Ensayos controlados aleatorios que comparan la aparición de lesión cardíaca con el uso de algún tipo de derivado de antraciclina y otro tipo de derivado de antraciclina.
Tipos de participantes
Pacientes con cáncer (adultos y niños) que recibieron quimioterapia con antraciclinas.
Tipos de intervenciones
Diferentes tipos de derivados de antraciclina con la misma duración de infusión y dosis máxima (es decir, la dosis máxima recibida en una semana). La quimioterapia, diferente a antraciclinas, y la radioterapia que incluye el área cardíaca, debía ser la misma en los dos grupos de tratamiento. Se debería haber mencionado la dosis de antraciclina acumulativa recibida en los dos grupos de tratamiento, ya que de otro modo habría sido imposible interpretar correctamente los resultados del estudio.
Tipos de medida de resultado
Medida de resultado primaria
(1) Insuficiencia cardíaca inducida por antraciclina (es decir, insuficiencia cardíaca clínica [según la definieron los autores] y disfunción cardíaca subclínica [definida por anomalías histológicas según la puntuación de Billingham en la biopsia del miocardio o anomalías en la función cardíaca medida por ecocardiografía o ventriculografía por radionúclido]). Cuando sea posible, se evaluarán la cardiotoxicidad temprana y la tardía (la cardiotoxicidad temprana indica una lesión cardíaca que se desarrolla durante el tratamiento con antraciclina en el primer año después de su finalización y la cardiotoxicidad tardía se manifiesta al menos un año después de la finalización de tratamiento con antraciclina).
Las medidas de resultado secundarias incluirán efectos adversos potenciales de los diferentes tipos de derivados de antraciclina sobre:
(1) Tasa de respuesta (definida como el número de remisiones completas y parciales)
(2) Supervivencia del paciente libre de progresión y supervivencia general
(3) Efectos tóxicos diferentes al daño cardíaco
(4) CdV
Métodos de búsqueda para la identificación de los estudios
Ver : La estrategia de búsqueda del Grupo Colaborador de Revisión (Collaborative Review Group).
Se hicieron búsquedas en las bases de datos electrónicas de CENTRAL (Cochrane Library, número 1, 2005), MEDLINE/PubMed (desde 1966 hasta abril 2005) y en EMBASE/Ovid (desde 1980 hasta abril 2005).
Para la idarrubicina se usaron los siguientes encabezados temáticos y palabras de texto: (4‐demethoxydaunorubicin OR 4 demethoxydaunorubicin OR 4‐desmethoxydaunorubicin OR 4 desmethoxydaunorubicin OR IMI 30 OR IMI30 OR IMI‐30 OR idarubicin hydrochloride OR hydrochloride, idarubicin OR NSC 256439 OR NSC‐256439 OR NSC256439 OR idarubicin OR idarubic*).
Para la idarrubicina liposomal se usaron los siguientes encabezados temáticos y palabras de texto: (4‐demethoxydaunorubicin OR 4 demethoxydaunorubicin OR 4‐desmethoxydaunorubicin OR 4 desmethoxydaunorubicin OR IMI 30 OR IMI30 OR IMI‐30 OR idarubicin hydrochloride OR hydrochloride, idarubicin OR NSC 256439 OR NSC‐256439 OR NSC256439 OR idarubicin OR idarubic*) AND (pegylated OR pegyl* OR encapsulated OR encapsul* OR liposomal OR liposom*).
Para la epirrubicina se usaron los siguientes encabezados temáticos y palabras de texto: (4'‐epiadriamycin OR 4' epiadriamycin OR 4'‐epidoxorubicin OR 4' epidoxorubicin OR 4'‐epi‐doxorubicin OR 4' epi doxorubicin 4'‐epi‐adriamycin OR 4' epi adriamycin OR 4'‐epi‐DXR OR 4' epi DXR OR epirubicin hydrochloride OR hydrochloride, epirubicin OR farmorubicin OR IMI‐28 OR IMI 28 OR IMI28 OR NSC 256942 OR NSC‐256942 OR NSC256942 OR epirubicin OR epirubic*).
Para la epirrubicina liposomal se usaron los siguientes encabezados temáticos y palabras de texto: (4'‐epiadriamycin OR 4' epiadriamycin OR 4'‐epidoxorubicin OR 4' epidoxorubicin OR 4'‐epi‐doxorubicin OR 4' epi doxorubicin 4'‐epi‐adriamycin OR 4' epi adriamycin OR 4'‐epi‐DXR OR 4' epi DXR OR epirubicin hydrochloride OR hydrochloride, epirubicin OR farmorubicin OR IMI‐28 OR IMI 28 OR IMI28 OR NSC 256942 OR NSC‐256942 OR NSC256942 OR epirubicin OR epirubic*) AND (pegylated OR pegyl* OR encapsulated OR encapsul* OR liposomal OR liposom*).
Para la doxorrubicina se usaron los siguientes encabezados temáticos y palabras de texto: (adriablastine OR adriblastin OR adriablastin OR adriamycin OR DOX‐SL OR DOX SL OR DOXSL OR doxorubicin hydrochloride OR hydrochloride doxorubicin OR doxorubic* OR adriamyc*).
Para la doxorrubicina liposomal se usaron los siguientes encabezados temáticos y palabras de texto: ((adriablastine OR adriblastin OR adriablastin OR adriamycin OR DOX‐SL OR DOX SL OR DOXSL OR doxorubicin hydrochloride OR hydrochloride doxorubicin OR doxorubic* OR adriamyc*) AND (pegylated OR pegyl* OR encapsulated OR encapsul* OR liposomal OR liposom*)) OR (doxil OR caelyx OR liposomal doxorubicin OR doxorubicin, liposomal).
Para la daunorrubicina se usaron los siguientes encabezados temáticos y palabras de texto: (dauno‐rubidomycine OR dauno rubidomycin OR rubidomycin OR rubomycin OR daunomycin OR cerubidine OR daunoblastin OR daunoblastine OR daunorubicin hydrochloride OR hydrochloride, daunorubicin OR daunorubic* OR rubidomyc* OR NSC‐82151 OR NSC 82151 OR NSC82151).
Para la daunorrubicina liposomal se usaron los siguientes encabezados temáticos y palabras de texto: ((dauno‐rubidomycine OR dauno rubidomycin OR rubidomycin OR rubomycin OR daunomycin OR cerubidine OR daunoblastin OR daunoblastine OR daunorubicin hydrochloride OR hydrochloride, daunorubicin OR daunorubic* OR rubidomyc* OR NSC‐82151 OR NSC 82151 OR NSC82151) AND (pegylated OR pegyl* OR encapsulated OR encapsul* OR liposomal OR liposom*)) OR (daunoxome OR daunosom*).
Los encabezados temáticos y las palabras de texto de cada tipo de derivado de antraciclina se combinaron con otro tipo de derivado de antraciclina, es decir, "idarubicin versus liposomal idarubicin, idarubicin versus epirubicin, idarubicin versus liposomal epirubicin, idarubicin versus doxorubicin, idarubicin versus liposomal doxorubicin, idarubicin versus daunorubicin, idarubicin versus liposomal daunorubicin, liposomal idarubicin versus epirubicin, liposomal idarubicin versus liposomal epirubicin, liposomal idarubicin versus doxorubicin, liposomal idarubicin versus liposomal doxorubicin, liposomal idarubicin versus daunorubicin, liposomal idarubicin versus liposomal daunorubicin, epirubicin versus doxorubicin, epirubicin versus liposomal doxorubicin, epirubicin versus daunorubicin, epirubicin versus liposomal daunorubicin, epirubicin versus liposomal epirubicin, liposomal epirubicin versus doxorubicin, liposomal epirubicin versus liposomal doxorubicin, liposomal epirubicin versus daunorubicin, liposomal epirubicin versus liposomal daunorubicin, doxorubicin versus liposomal doxorubicin, doxorubicin versus daunorubicin, doxorubicin versus liposomal daunorubicin, liposomal doxorubicin versus daunorubicin, liposomal doxorubicin versus liposomal daunorubicin, and daunorubicin versus liposomal daunorubicin".
Todas las combinaciones mencionadas anteriormente se combinaron con los siguientes encabezados temáticos y las palabras de texto usadas para lesión cardíaca: heart OR heart diseases OR heart disease OR disease, heart OR diseases, heart OR cardiac diseases OR cardiac disease OR diseases, cardiac OR disease, cardiac OR cardiotoxicity OR cardiomyopathy OR heart failure, congestive OR heart failure OR cardiomyopathy, congestive OR ventricular dysfunction OR ventricular dysfunction, left OR ventricular dysfunction, right.
Finalmente, los resultados de esta búsqueda se combinaron con la estrategia de búsqueda altamente sensible según se describe en el Manual Cochrane (Higgins 2005)).
Para EMBASE y CENTRAL se utilizaron adaptaciones de esta estrategia de búsqueda. Se encontró información sobre los ensayos no registrados en CENTRAL, MEDLINE, o EMBASE, publicados o no publicados, al buscar en las listas de referencias de los artículos pertinentes y los artículos de revisión. Además, se realizaron búsquedas manuales en los resúmenes de congresos de la International Society for Paediatric Oncology (SIOP) y la American Society of Clinical Oncology (ASCO) desde 2000 a 2004. Se buscaron ensayos en curso al explorar el registro ISRCTN y el National Institute of Health Register (ambos se revisaron en marzo de 2005). Se estableció contacto con los investigadores de los posibles ensayos elegibles supuestamente en curso. No se impuso ninguna restricción de idioma.
Obtención y análisis de los datos
Identificación de los estudios
Después de emplear la estrategia de búsqueda descrita anteriormente, dos autores identificaron de forma independiente los estudios que cumplían con los criterios de inclusión. Las discrepancias entre los autores se resolvieron mediante consenso. No se necesitó la intervención de terceros como árbitros. Se obtuvo la versión completa de cualquier estudio que cumplía aparentemente con los criterios de inclusión en base al título o al resumen, o ambos, para realizar un análisis más profundo.
Evaluación de la calidad de los estudios incluidos
La calidad de los ensayos incluidos fue evaluada por dos autores de forma independiente, de acuerdo con los siguientes criterios: método de asignación al azar, ocultamiento de la asignación al tratamiento, cegamiento del profesional de la atención sanitaria, cegamiento de los pacientes, cegamiento del evaluador de resultado y cumplimiento del seguimiento. La adecuación del ocultamiento de la asignación se evaluó mediante los criterios que propusieron Schulz y colegas (Schulz 1995)). Las discrepancias se resolvieron por consenso. No se necesitó la intervención de terceros como árbitros.
Extracción de los datos
Dos autores realizaron la extracción de datos de forma independiente mediante formularios estandarizados. Se extrajeron los datos de las características de los participantes (edad, sexo, tipo de tumor), de las intervenciones (dosis máxima individual, dosis acumulativa), de las medidas de resultado y de la duración del seguimiento. Las discrepancias se resolvieron por consenso. No se necesitó la intervención de terceros como árbitros.
Análisis de los datos
Los datos se introdujeron en RevMan y se analizaron según las guías del Manual Cochrane (Higgins 2005). Las variables dicotómicas se relacionaron al riesgo con el riesgo relativo (RR). Cuando fue posible, se extrajeron los datos mediante la intervención de la asignación, independientemente del cumplimiento con la intervención asignada, para permitir un análisis del tipo intención de tratar (intention‐to‐treat analysis). Se dejó establecido cuando no fue posible hacerlo. La heterogeneidad se evaluó mediante la inspección visual de los diagramas de bosque (forest plot) y mediante una prueba estadística formal de la heterogeneidad, es decir la prueba de I2 (I2 > 50% se consideró una heterogeneidad significativa). Si había pruebas de una heterogeneidad significativa, se presentaron informes. Se utilizó un modelo de efectos aleatorios en toda la revisión. Todos los resultados se presentan con un intervalo de confianza del 95% correspondiente (IC del 95%). Cuando el agrupamiento no fue posible, se proporcionaron resultados descriptivos para estos estudios. Se utilizó la función de la varianza inversa genérica de RevMan para combinar los logs de los cocientes de riesgos instantáneos (CRI) para la supervivencia libre de progresión y la supervivencia general. Cuando fue necesario, se utilizó el método de Parmar para extraer el registro del CRI a partir de las curvas de supervivencia (Parmar 1998)). En otros casos, la supervivencia se resumió de forma cualitativa. En esta revisión sistemática solamente se incluyó una medida de resultado si la intención del estudio era realizar evaluaciones necesarias en todos los pacientes aleatorios (es decir, no solamente opcionales, ni solamente realizadas en algunos centros). Cuando menos del 50% de los pacientes de un estudio presentaba un seguimiento aceptable para una medida de resultado en particular, debido al alto riesgo de sesgo de deserción asociado, no se informaron los resultados de esta medida de resultado. En la interpretación de los resultados de la revisión se consideró la calidad de los estudios incluidos en los análisis. Se realizaron análisis de sensibilidad para los criterios de calidad usados.
Resultados
Descripción de los estudios
Después de realizar las búsquedas de las bases de datos electrónicas de CENTRAL (66 estudios), MEDLINE/PubMed (1 166 estudios) y EMBASE/Ovid (1009 estudios), se incluyó un total de siete artículos que cumplió con todos los criterios para considerar estudios de esta revisión. Se excluyeron 47 artículos después de evaluar el texto completo del artículo por los motivos descritos en la "Tabla de estudios excluidos". Los 2 187 artículos restantes se excluyeron en función del título o el resumen, ya que no constituían un ECA, eran estudios de laboratorio, estudios en animales, no incluyeron pacientes con cáncer, no describieron el tratamiento con antraciclina con diferentes derivados, fueron publicaciones duplicadas, hubo una diferencia en la dosis máxima de antraciclina o en la duración de infusión entre los grupos de tratamiento, hubo una diferencia en la quimioterapia sin antraciclinas y/o radioterapia que incluye el área cardíaca entre los grupos de tratamiento, y/o no presentó la insuficiencia cardíaca como medida de resultado.
Al analizar las listas de referencias de los artículos y revisiones pertinentes, se incluyó un artículo adicional en esta revisión. Otros nueve artículos se añadieron a la Tabla de estudios excluidos.
No se obtuvo información adicional a partir del análisis de los resúmenes de congresos de SIOP y ASCO, y de las bases de datos de ensayos en curso, aunque se excluyó un estudio adicional y, por lo tanto, se agregó a la "Tabla de estudios excluidos". No se pudo obtener a partir de otros dos ensayos toda la información necesaria para evaluar la elegibilidad de estos ensayos (ver referencias de estudios en curso y "Tabla de estudios en curso").
Por consiguiente, el número total de ECA identificados fue ocho. Cinco estudios abordaron doxorrubicina versus epirrubicina, dos estudios doxorrubicina convencional versus doxorrubicina encapsulada en liposomas (myocet), y un estudio abordó epirrubicina versus doxorrubicina encapsulada en liposomas (myocet). Para las demás combinaciones de los diferentes derivados de antraciclina no se identificaron ECA adecuados.
Descripción de los estudios que abordaron doxorrubicina versus epirrubicina
El análisis de la cardiotoxicidad por doxorrubicina en comparación con la de la epirrubicina incluyó cinco ensayos (Brambilla 1986; FESG 1988; Gasparini 1991; IMBSWE 1988; Mouridsen 1984) con un total de 1 036 pacientes. Los 515 pacientes se asignaron al azar al tratamiento con doxorrubicina, mientras que 521 pacientes se asignaron al azar al tratamiento con epirrubicina. No hubo diferencias importantes en las dosis de antraciclina acumulativa recibidas en los dos brazos de tratamiento de los diferentes ECA. Todos los estudios incluyeron pacientes adultos con un tumor sólido. En cuatro estudios, los pacientes recibieron un diagnóstico de cáncer de mama (Brambilla 1986; FESG 1988; Gasparini 1991; IMBSWE 1988), y en el otro estudio, sarcoma de partes blandas (Mouridsen 1984). En dos estudios, el seguimiento de los pacientes incluidos se realizó por más de un año (Brambilla 1986; FESG 1988) y en otro estudio, el seguimiento fue posible en al menos parte de los pacientes incluidos (IMBSWE 1988)). Por consiguiente, es posible que estos estudios hayan incluido casos de cardiotoxicidad temprana y tardía. En los otros estudios, no se mencionó la duración del seguimiento y como resultado no se sabe si los casos de cardiotoxicidad en estos estudios son tempranos o tardíos. Sin embargo, dado que todos los pacientes incluidos en estos ensayos presentaban una enfermedad avanzada o metastásica y debido al efecto asociado sobre la duración de la supervivencia, se presume que los casos de insuficiencia cardíaca en estos ensayos eran de cardiotoxicidad temprana.
Descripción de estudios que abordaron doxorrubicina convencional versus doxorrubicina encapsulada en liposomas
El análisis de la cardiotoxicidad de la doxorrubicina convencional en comparación con la de la doxorrubicina encapsulada en liposomas incluyó dos ensayos (Batist 2001; Harris 2002) con un total de 521 pacientes. Los 271 pacientes fueron asignados al azar al tratamiento con doxorrubicina, mientras que 250 pacientes fueron asignados al azar al tratamiento con doxorrubicina encapsulada en liposomas. Los dos estudios mencionaron la dosis de antraciclina acumulativa que recibieron los pacientes en los grupos de tratamiento: en el estudio de Batist 2001 los pacientes de los dos grupos de tratamiento recibieron una dosis acumulativa mediana de 360 mg/m2, mientras que en el estudio de Harris 2002 los pacientes del grupo de doxorrubicina recibieron una dosis acumulativa mediana de 570 mg/m2 y los pacientes del grupo de doxorrubicina encapsulada en liposomas recibieron una dosis acumulativa de 785 mg/m2. Ambos estudios incluyeron pacientes adultos con cáncer de mama. En un estudio, el seguimiento de pacientes incluidos se realizó por más de un año (Batist 2001) y, por consiguiente, es posible que este estudio haya incluido casos de cardiotoxicidad temprana como tardía. En el otro estudio no se mencionó la duración del seguimiento y, por lo tanto, no se sabe si los casos de cardiotoxicidad en este estudio son tempranos o tardíos. Sin embargo, debido a que todos los pacientes incluidos en este ensayo presentaron una enfermedad metastásica y a causa del efecto asociado sobre la duración de la supervivencia, se presume que los casos de insuficiencia cardíaca en este ensayo eran de cardiotoxicidad temprana.
Descripción del estudio que abordó epirrubicina versus doxorrubicina encapsulada en liposomas
El análisis de la cardiotoxicidad por epirrubicina comparado con la de doxorrubicina encapsulada en liposomas incluyó un ensayo (Chan 2004) con un total de 160 pacientes. Ochenta pacientes se asignaron al azar al tratamiento con epirrubicina, mientras que 80 pacientes se asignaron al azar al tratamiento con doxorrubicina encapsulada en liposomas. La dosis de antraciclina acumulativa que recibieron los pacientes en los dos grupos de tratamiento fue equivalente. Todos los pacientes incluidos en este estudio eran adultos con cáncer de mama. El seguimiento de al menos parte de los pacientes incluidos fue superior a un año y, por consiguiente, es posible que este estudio incluyera casos de cardiotoxicidad ya sea temprana como tardía.
Riesgo de sesgo de los estudios incluidos
Ver la lista de criterios para la evaluación de la calidad metodológica en la "Tabla adicional 01".
Calidad metodológica de los estudios que abordaron doxorrubicina versus epirrubicina
En los cinco estudios, se asignó al azar a los pacientes a los grupos de tratamiento, pero ninguno de los estudios especificó la presencia de una asignación oculta del tratamiento (Brambilla 1986; FESG 1988; Gasparini 1991; IMBSWE 1988; Mouridsen 1984)).
No pudo precisarse si en los cinco estudios se había cegado al profesional de la atención y a los pacientes al tratamiento.
Todas las medidas de resultado se evaluaron con respecto al cegamiento del evaluador, excepto la supervivencia general para la que el cegamiento de resultados no fue importante. Para todas las medidas de resultado evaluadas (es decir, insuficiencia cardíaca clínica, insuficiencia cardíaca subclínica, tasa de respuesta, supervivencia libre de progresión y efectos adversos) no se pudo precisar si se había cegado al evaluador de resultado al tratamiento en todos los estudios que evaluaban la medida de resultado.
Los pacientes perdidos durante el seguimiento también recibieron una calificación para cada medida de resultado diferente. Para la insuficiencia cardíaca clínica, se describió y fue aceptable el número de pacientes perdidos durante el seguimiento (es decir, menos del 20%) en tres estudios (FESG 1988; Gasparini 1991; IMBSWE 1988), en un estudio fue incierto (Brambilla 1986) y en otro estudio fue inadmisible (Mouridsen 1984). Para la insuficiencia cardíaca subclínica (ya sea el resultado dicotómico como el continuo), el número de pacientes perdidos durante el seguimiento fue inadmisible en el único estudio que describía esta medida de resultado (Brambilla 1986). Para la tasa de respuesta, se describió el número de pacientes perdidos durante el seguimiento en cuatro estudios y fue aceptable (Brambilla 1986; FESG 1988; Gasparini 1991; IMBSWE 1988), mientras que en otro estudio no fue aceptable (Mouridsen 1984). Para la supervivencia libre de progresión, se describió el número de pacientes perdidos durante el seguimiento y fue aceptable en tres estudios (FESG 1988; Gasparini 1991; IMBSWE 1988), mientras que en dos estudios no fue aceptable (Brambilla 1986; Mouridsen 1984). La supervivencia general se evaluó en cinco estudios, en cuatro de ellos se describió y fue aceptable el número de pacientes perdidos durante el seguimiento (Brambilla 1986; FESG 1988; Gasparini 1991; IMBSWE 1988), pero en el otro estudio no fue aceptable (Mouridsen 1984). Finalmente, para la evaluación de los efectos adversos, se describió el número de pacientes perdidos durante el seguimiento y fue aceptable en dos estudios (Gasparini 1991; IMBSWE 1988), pero en el otro estudio no fue aceptable (FESG 1988). Obsérvese que en el estudio de IMBSWE 1988 se describió el número de pacientes perdidos durante el seguimiento y fue aceptable para todos los efectos adversos, con excepción de la alopecia.
Ver puntuaciones exactas por estudio incluido en la "Tabla adicional 02".
En conclusión, la calidad de los estudios incluidos varió y el sesgo no se pudo descartar en los siguientes porcentajes de estudios incluidos: 100% de sesgo de selección (basado en el método de asignación al azar y ocultamiento de la asignación), 100% de sesgo de realización (basado en el cegamiento del profesional de la atención sanitaria y del paciente), 100% de sesgo de detección (basado en el cegamiento del evaluador de resultado) para todas las medidas de resultado evaluadas y, finalmente, 40% de sesgo de deserción (basado en el cumplimiento del seguimiento) para la insuficiencia cardíaca clínica, 100% para la insuficiencia cardíaca subclínica (ambos como un resultado dicotómico y continuo), 20% para la tasa de respuesta, 40% para la supervivencia libre de progresión, 20% para la supervivencia general y 33% para los efectos adversos.
Calidad metodológica de los estudios que aborda doxorrubicina convencional versus doxorrubicina encapsulada en liposomas
En los dos estudios, se asignó al azar la asignación de los pacientes a los grupos de tratamiento, pero fue incierto si se ocultó la asignación al tratamiento (Batist 2001; Harris 2002)). Fue incierto si el profesional de la atención y los pacientes fueron cegados al tratamiento en los dos estudios.
Todas las medidas de resultado se evaluaron con respecto al cegamiento del evaluador, excepto la supervivencia general para la que el cegamiento de resultados no fue importante. En uno de los dos estudios que evaluaban la insuficiencia cardíaca clínica no quedó claro si el evaluador de resultado estaba cegado al tratamiento (Harris 2002)). El evaluador de resultado estaba cegado al tratamiento en los dos estudios que evaluaban la insuficiencia cardíaca subclínica, la tasa de respuesta y la supervivencia libre de progresión. Fue poco claro si el evaluador de resultado estaba cegado al tratamiento en los dos estudios que evaluaban los efectos adversos.
Los pacientes perdidos durante el seguimiento también recibieron una calificación para cada medida de resultado diferente. Para la insuficiencia cardíaca clínica, la insuficiencia cardíaca subclínica, la respuesta tumoral, la supervivencia libre de progresión, la supervivencia general y los efectos adversos, se describió el número de pacientes perdidos durante el seguimiento y fue aceptable (es decir, menos del 20%) en ambos estudios.
Ver puntuaciones exactas por estudio incluido en la "Tabla adicional 02".
En conclusión, no se pudo descartar el sesgo en los siguientes porcentajes de estudios incluidos: 100% de sesgo de selección (basado en método de asignación al azar y ocultamiento de la asignación), 100% de sesgo de realización (basado en el cegamiento del profesional de la atención sanitaria y paciente), 50% de sesgo de detección (basado en el cegamiento del evaluador de resultado) para la insuficiencia cardíaca clínica, 0% para la insuficiencia cardíaca subclínica, la tasa de respuesta y la supervivencia libre de progresión, y 100% para los efectos adversos y, finalmente, 0% de sesgo de deserción (basado en el cumplimiento del seguimiento) para todas las medidas de resultado evaluadas.
Calidad metodológica del estudio que aborda epirrubicina versus doxorrubicina encapsulada en liposomas
Se asignó al azar la asignación de los pacientes a los grupos de tratamiento, pero no quedó claro si se ocultó la asignación al tratamiento (Chan 2004)). Fue incierto si el profesional de la atención sanitaria y los pacientes estaban cegados al tratamiento.
Todas las medidas de resultado se evaluaron con respecto al cegamiento del evaluador, excepto la supervivencia general para la que el cegamiento de resultados no fue importante. Para la insuficiencia cardíaca clínica, la insuficiencia cardíaca subclínica, la respuesta tumoral, la supervivencia libre de progresión y los efectos adversos no quedó claro si el evaluador de resultado estaba cegado al tratamiento.
Los pacientes perdidos durante el seguimiento también recibieron una calificación para cada medida de resultado diferente. Para todas las medidas de resultado evaluadas en este estudio (es decir, la supervivencia anteriormente mencionada y general), se describió el número de pacientes perdido durante el seguimiento y fue aceptable (es decir, menos del 20%). Ver puntuaciones exactas por estudio incluido en la "Tabla adicional 02".
En conclusión, en este estudio no se pudieron descartar el sesgo de selección, el sesgo de realización y el de detección (para todas las medidas de resultado evaluadas).
Efectos de las intervenciones
No todos los artículos permitieron la extracción de datos para todas las medidas de resultado (ver una descripción más detallada de los resultados obtenibles de cada estudio en la "Tabla de estudios incluidos").
Estudios que abordan doxorrubicina versus epirrubicina
Insuficiencia cardíaca clínica
Se pudieron recoger datos sobre la insuficiencia cardíaca clínica de cinco ensayos, en que un total de 1 036 pacientes adultos presentaban un tumor sólido (Brambilla 1986; FESG 1988; Gasparini 1991; IMBSWE 1988; Mouridsen 1984). Hubo tres casos de insuficiencia cardíaca clínica entre los 521 pacientes asignados al azar a la epirrubicina y 12 casos entre los 515 pacientes asignados al azar a la doxorrubicina. El metanálisis no mostró diferencias significativas en la aparición de la insuficiencia cardíaca clínica en los grupos de tratamiento (RR = 0,36; IC del 95%: 0,12 a 1,11; p = 0,07). Sin embargo, hubo algunos indicios de una tasa inferior de insuficiencia cardíaca clínica en pacientes tratados con epirrubicina. No se detectó heterogeneidad (I2 = 0%).
En dos estudios, el seguimiento de los pacientes incluidos fue superior a un año (Brambilla 1986; FESG 1988) y en otro estudio, fue posible que parte de los pacientes incluidos recibiera un seguimiento de más de un año (IMBSWE 1988), por consiguiente, es posible que estos estudios hayan incluido casos de cardiotoxicidad temprana y tardía. En los otros estudios, no se mencionó la duración del seguimiento (Gasparini 1991; Mouridsen 1984) y, como resultado, se desconoce si los casos de cardiotoxicidad en estos estudios son tempranos o tardíos. Sin embargo, debido a que todos los pacientes incluidos en estos ensayos presentaron una enfermedad avanzada o metastásica y el efecto asociado sobre la duración de la supervivencia, se presume que los casos de insuficiencia cardíaca en estos ensayos eran de cardiotoxicidad temprana.
Insuficiencia cardíaca clínica y subclínica combinadas
Se pudieron extraer los datos sobre la insuficiencia cardíaca clínica y subclínica combinadas de un ensayo con pacientes adultos que presentaban un tumor sólido (Brambilla 1986)). Sin embargo, debido al alto riesgo de sesgo de deserción (menos del 50% de los pacientes tuvo un seguimiento aceptable), no se informan los resultados de este estudio.
Insuficiencia cardíaca subclínica como resultado continuo
Se pudieron recoger datos sobre la insuficiencia cardíaca subclínica descrita como resultado continuo de un ensayo con pacientes adultos que presentaban un tumor sólido (Brambilla 1986)). Sin embargo, debido al alto riesgo de sesgo de deserción (menos del 50% de los pacientes tuvo un seguimiento aceptable), no se informan los resultados de este estudio.
Respuesta tumoral
Se pudieron extraer los datos sobre la tasa de respuesta de cinco ensayos con un total de 1 036 pacientes adultos con un tumor sólido (Brambilla 1986; FESG 1988; Gasparini 1991; IMBSWE 1988; Mouridsen 1984). Estos ensayos usaron criterios comparables para evaluar la respuesta tumoral (ver Tabla de estudios incluidos). Hubo 210 respuestas completas o parciales entre los 521 pacientes asignados al azar a la epirrubicina y 221 entre los 515 pacientes asignados al azar a la doxorrubicina. El metanálisis no mostró diferencias significativas en la tasa de respuesta entre los grupos de tratamiento (RR = 0,94; IC del 95%: 0,82 a 1,08; p = 0,40). No se detectó heterogeneidad (I2 = 0%). Solamente un estudio mencionó que la tasa de respuesta estaba determinada por al menos dos observadores (Mouridsen 1984)).
Nótese que es favorable una alta tasa de eventos debido a la naturaleza de esta medición (es decir, el porcentaje de pacientes en remisión). Por consiguiente, en la cifra de este análisis, "favorece la doxorrubicina" se encuentra a la izquierda y "favorece la epirrubicina" a la derecha, en contraposición con las figuras de los otros análisis.
Supervivencia
Los datos sobre la supervivencia libre de progresión se presentaron en cinco ensayos, pero solamente dos ensayos con un total de 446 adultos con un tumor sólido (FESG 1988; Mouridsen 1984) se pudieron incluir en el metanálisis. El metanálisis no mostró diferencias significativas entre los dos grupos de tratamiento (CRI = 1,05; IC del 95%: 0,76 a 1,44; p = 0,78). Sin embargo, se detectó una heterogeneidad no explicada (I2 = 59,1%).
Se excluyó el estudio de Brambilla 1986 de este análisis debido al alto riesgo de sesgo de deserción (menos del 50% de los pacientes recibieron un seguimiento aceptable). Se excluyeron los estudios de Gasparini 1991 y IMBSWE 1988 de este análisis porque no se pudieron extraer de manera fiable los datos necesarios para utilizar el método de Parmar en la evaluación de la supervivencia de este estudio. Sin embargo, para los resultados descriptivos, ver tabla adicional 03. En ningún estudio individual se identificaron diferencias significativas entre los brazos de tratamiento.
Los datos sobre la supervivencia general se presentaron en cinco ensayos, pero solamente dos ensayos con un total de 245 adultos con un tumor sólido (Gasparini 1991; Mouridsen 1984) se pudieron incluir en el metanálisis. El metanálisis no mostró diferencias significativas entre los grupos de tratamiento (CRI = 0,95; IC del 95%: 0,65 a 1,39; p = 0,79). No se detectó heterogeneidad (I2 = 0%).
Se excluyeron los estudios de Brambilla 1986, FESG 1988 y IMBSWE 1988 de este análisis porque no se pudieron extraer de manera fiable los datos necesarios para utilizar el método de Parmar en la evaluación de la supervivencia de este estudio. Sin embargo, para los resultados descriptivos, ver tabla adicional 03. En ningún estudio individual se identificaron diferencias significativas entre los brazos de tratamiento.
Efectos adversos
Debido a que todos los pacientes que recibían quimioterapia presentaban efectos secundarios, se decidió analizar solamente los efectos graves y potencialmente mortales. Se definió como toxicidad de grado 3 o 4. Todos los estudios utilizaron los criterios de la OMS (Miller 1981; WHO Handbook 1979)). Por consiguiente, se pudieron realizar metanálisis de los efectos adversos para los que se disponía de más de un ECA. Sobre los efectos adversos para los que había un ECA disponible, se proporcionan resultados descriptivos (todos los RR mencionados, los IC del 95% y los valores de p se calculan en RevMan con el modelo de efectos aleatorios).
Anaemia:
Los datos sobre la anemia se pudieron extraer de dos ensayos con un total de 546 pacientes adultos con un tumor sólido (Gasparini 1991; IMBSWE 1988). Sin embargo, en un estudio no hubo casos de anemia en los dos grupos de tratamiento y, por consiguiente, los resultados sin diferencias significativas de este estudio no se pudieron estimar para el análisis del RR (Gasparini 1991). Como resultado, no fue posible realizar el agrupamiento de los resultados. En el otro estudio (IMBSWE 1988), hubo un caso de anemia grado 3 o 4 entre los 250 pacientes asignados al azar a la epirrubicina, y nueve entre 247 pacientes asignados al azar a la doxorrubicina. Hubo una diferencia significativa a favor de la epirrubicina (RR = 0,11; IC del 95%: 0,01 a 0,86; p = 0,04).
Leucopenia:
Los datos sobre la leucopenia se pudieron extraer de dos ensayos, con un total de 546 pacientes adultos que presentaban un tumor sólido (Gasparini 1991; IMBSWE 1988). Hubo 23 casos de leucopenia grado 3 o 4 entre los 275 pacientes asignados al azar a la epirrubicina, y 46 entre los 271 pacientes asignados al azar a la doxorrubicina. El metanálisis mostró una tasa significativamente inferior de leucopenia grado 3 o cuatro en los pacientes tratados con epirrubicina en comparación con los pacientes tratados con doxorrubicina (RR = 0,50; IC del 95%: 0,31 a 0,80; p = 0,004). No se detectó heterogeneidad (I2 = 0%).
Náuseas / vómitos:
Se pudieron extraer datos sobre náuseas / vómitos de dos ensayos, con un total de 546 pacientes adultos que presentaban un tumor sólido (Gasparini 1991; IMBSWE 1988). Hubo 79 casos de náuseas / vómitos grado 3 o 4 entre los 275 pacientes asignados al azar a la epirrubicina, y 102 entre los 271 pacientes asignados al azar a la doxorrubicina. El metanálisis mostró una tasa significativamente inferior de náuseas / vómitos grado 3 o 4 en los pacientes tratados con epirrubicina en comparación con los pacientes tratados con doxorrubicina (RR = 0,77; IC del 95%: 0,61 a 0,97; p = 0,03). No se detectó heterogeneidad (I2 = 0%).
Alopecia:
No se pudieron extraer los datos sobre la alopecia de tres ensayos, con un total de 796 pacientes adultos que presentaban un tumor sólido (Gasparini 1991; FESG 1988; IMBSWE 1988). Hubo 128 casos de alopecia grado 3 o 4 entre los 402 pacientes asignados al azar a la epirrubicina, y 139 entre los 394 pacientes asignados al azar a la doxorrubicina. El metanálisis no mostró diferencias significativas en la aparición de la alopecia grado 3 o 4 entre los grupos de tratamiento (RR = 0,85; IC del 95%: 0,52 a 1,38; p = 0,51). Sin embargo, se detectó una heterogeneidad no explicada (I2 = 71,4%).
Trombocitopenia:
Dos ensayos con un total de 546 pacientes adultos con un tumor sólido evaluaron la trombocitopenia grado 3 o 4. Sin embargo, en un estudio (Gasparini 1991) no hubo no casos de trombocitopenia grado 3 o 4 en los dos grupos de tratamiento y, por consiguiente, los resultados de este estudio no se pueden estimar para el análisis del RR. Como resultado, no fue posible realizar el agrupamiento de los resultados. En el otro estudio (IMBSWE 1988) hubo cuatro casos de trombocitopenia grado 3 o 4 en los dos grupos de tratamiento (RR = 0,99; IC del 95%: 0,25 a 3,91; p = 0,99), de modo que no se detectaron diferencias significativas en los dos estudios en la aparición de la trombocitopenia grado 3 o 4 entre los grupos de tratamiento.
Infección:
Un ensayo con un total de 49 pacientes adultos con un tumor sólido evaluaron la infección grado 3 o 4 (Gasparini 1991)). Sin embargo, no hubo casos de infección grado 3 o 4 en los dos grupos de tratamiento y por consiguiente no es posible estimar los resultados de este estudio para el análisis del RR, aunque no se detectaron diferencias significativas en la aparición de la infección grado 3 o 4 entre los grupos de tratamiento.
Estomatitis/mucositis:
Dos ensayos con un total de 546 pacientes adultos con un tumor sólido evaluaron la estomatitis / mucositis grado 3 o 4. Sin embargo, en un estudio (Gasparini 1991) no hubo casos de estomatitis / mucositis grado 3 o 4 en los dos grupos de tratamiento y, por consiguiente, los resultados de este estudio no se pueden estimar para el análisis del RR. Como resultado, no fue posible realizar el agrupamiento de los resultados. En el otro estudio (IMBSWE 1988) hubo seis casos de estomatitis / mucositis grado 3 o 4 entre los 250 pacientes asignados al azar a la epirrubicina, y ocho entre los 247 pacientes asignados al azar a la doxorrubicina. Como no hubo una diferencia significativa (RR = 0,74; IC del 95%: 0,26 a 2,10; p = 0,57), en los dos estudios no se detectaron diferencias significativas en la aparición de la estomatitis / mucositis grado 3 o 4 entre los grupos de tratamiento.
Tromboflebitis:
Un ensayo con un total de 49 pacientes adultos con un tumor sólido evaluó la tromboflebitis grado 3 o 4 (Gasparini 1991)). Sin embargo, no hubo casos de tromboflebitis grado 3 o 4 en los dos grupos de tratamiento y, por consiguiente, no se pueden estimar los resultados de este estudio para el análisis del RR; pero no se detectaron diferencias significativas en la aparición de tromboflebitis grado 3 o 4 entre los grupos de tratamiento.
Otros efectos adversos:
Para la disfunción hepática relacionada a la administración de fármacos (Gasparini 1991), y la disfunción renal relacionada a la administración de fármacos (Gasparini 1991), no hubo casos en los dos grupos de tratamiento del único estudio que evaluaba el efecto adverso y, por lo tanto, no hubo diferencias significativas de la aparición del resultado evaluado.
Calidad de vida
Ninguno de los estudios evaluó la CdV.
Análisis de Subgrupos
Debido a que todos los pacientes eran adultos con un tumor sólido, no se realizaron los análisis de subgrupos para niños versus adultos y leucemias versus tumores sólidos.
Análisis de sensibilidad
Los resultados de los análisis de sensibilidad para los criterios de calidad fueron coherentes entre los ensayos y no fueron diferentes de los análisis generales.
Estudios que abordan doxorrubicina convencional versus doxorrubicina encapsulada en liposomas
Insuficiencia cardíaca clínica
Se recogieron los datos sobre la insuficiencia cardíaca clínica de dos ensayos con un total de 521 pacientes adultos con cáncer de mama (Batist 2001; Harris 2002). Hubo 14 casos de insuficiencia cardíaca clínica entre los 271 pacientes asignados al azar a la doxorrubicina convencional y dos casos entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis mostró una tasa estadísticamente inferior de la insuficiencia cardíaca clínica en los pacientes tratados con doxorrubicina encapsulada en liposomas en comparación con el tratamiento con doxorrubicina convencional (RR = 0,20; IC del 95%: 0,05 a 0,75; p = 0,02). No se detectó heterogeneidad (I2 = 0%).
En un estudio, el seguimiento de pacientes incluidos se realizó por más de un año (Batist 2001) y, por consiguiente, es posible que este estudio haya incluido casos de cardiotoxicidad temprana como tardía. En el otro estudio, no se mencionó la duración del seguimiento y, como resultado, se desconoce si los casos de cardiotoxicidad en estos estudios son tempranos o tardíos. Sin embargo, debido a que todos los pacientes incluidos en este ensayo presentaron una enfermedad metastásica y a causa del efecto asociado sobre la duración de la supervivencia, se presume que los casos de insuficiencia cardíaca en estos ensayos eran de cardiotoxicidad temprana.
Insuficiencia cardíaca clínica y subclínica combinadas
Se pudieron extraer los datos sobre insuficiencia cardíaca clínica y subclínica combinadas de dos ensayos con un total de 521 pacientes adultos con cáncer de mama (Batist 2001; Harris 2002). Hubo 67 casos de insuficiencia cardíaca clínica y subclínica combinadas entre los 271 pacientes asignados al azar a la doxorrubicina convencional, y 23 casos entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis mostró una tasa estadísticamente inferior de insuficiencia cardíaca clínica y subclínica combinadas en los pacientes tratados con doxorrubicina encapsulada en liposomas en comparación con el tratamiento con doxorrubicina convencional (RR = 0,38; IC del 95%: 0,24 a 0,59; p < 0,0001). No se detectó heterogeneidad (I2 = 0%).
En un estudio, el seguimiento de pacientes incluidos se realizó durante más de un año (Batist 2001) y, por consiguiente, es posible que este estudio haya incluido casos de cardiotoxicidad temprana como tardía. En el otro estudio no se mencionó la duración de seguimiento y, por tanto, se desconoce si los casos de cardiotoxicidad en estos estudios son tempranos o tardíos. Sin embargo, debido a que todos los pacientes incluidos en este ensayo presentaron una enfermedad metastásica y a causa del efecto asociado sobre la duración de la supervivencia, se presume que los casos de insuficiencia cardíaca en estos ensayos eran de cardiotoxicidad temprana.
Para los dos estudios se debe tener en cuenta que los pacientes con insuficiencia cardíaca clínica también se incluyeron en el metanálisis de insuficiencia cardíaca clínica como se mencionó anteriormente.
Respuesta tumoral
Se pudieron extraer los datos sobre la tasa de respuesta de dos ensayos con un total de 521 pacientes adultos con cáncer de mama (Batist 2001; Harris 2002). Estos ensayos usaron criterios comparables para evaluar la respuesta tumoral (ver "Tabla de estudios incluidos"). Hubo 96 respuestas completas o parciales entre los 271 pacientes asignados al azar a la doxorrubicina convencional y 89 entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis no mostró diferencias significativas en la tasa de respuesta entre los grupos de tratamiento (RR = 1,01; IC del 95%: 0,80 a 1,26; p = 0,95). No se detectó heterogeneidad (I2 = 0%). Ninguno de los estudios mencionó que al menos dos observadores determinaron la tasa de respuesta.
Nótese que es favorable una alta tasa de eventos debido a la naturaleza de esta medición (es decir, el porcentaje de pacientes en remisión). Por consiguiente, en la figura de este análisis, "favorece la doxorrubicina" se encuentra a la izquierda y "favorece la doxorrubicina encapsulada en liposomas" a la derecha, en contraposición con las figuras de los otros análisis.
Supervivencia
Se pudieron extraer los datos sobre la supervivencia de dos ensayos con un total de 521 pacientes adultos con cáncer de mama (Batist 2001; Harris 2002). Los dos estudios presentaron CRI con IC del 95%, lo que permitió el uso del método de Parmar para la evaluación de la supervivencia (Parmar 1998)).
Para la supervivencia libre de progresión, el metanálisis no mostró diferencias significativas entre los pacientes tratados con doxorrubicina encapsulada en liposomas y los pacientes tratados con doxorrubicina convencional (CRI = 1,01; IC del 95%: 0,83 a 1,24; p = 0,89). No se detectó heterogeneidad (I² = 0%).
Para la supervivencia general, el metanálisis tampoco mostró diferencias significativas entre los pacientes tratados con doxorrubicina encapsulada en liposomas y los pacientes tratados con doxorrubicina convencional (CRI = 1,12; IC del 95%: 0,83 a 1,53; p = 0,46). No se detectó heterogeneidad (I² = 49,9%).
Efectos adversos
Se pudieron extraer los datos sobre los efectos adversos de dos ensayos con un total de 521 pacientes adultos con cáncer de mama (Batist 2001; Harris 2002)). Debido a que todos los pacientes que recibían quimioterapia presentaban efectos secundarios, se decidió analizar solamente los efectos graves y potencialmente mortales. Se definió como toxicidad de grado 3 o 4. Los dos estudios usaron los CTC (criterios comunes de toxicidad) del National Cancer Institute. Por lo tanto, no se pudieron realizar los metanálisis.
Anaemia:
Hubo 73 casos de anemia grado > = 3 entre los 271 pacientes asignados al azar a la doxorrubicina convencional y 56 entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis no mostró diferencias significativas en la aparición de la anemia grado > = 3 entre los grupos de tratamiento (RR = 0,83; IC del 95%: 0,61 a 1,13; p = 0,23). No se detectó heterogeneidad (I2 = 0%).
Trombocitopenia:
Hubo 20 casos de trombocitopenia grado > = 3 entre los 271 pacientes asignados al azar a la doxorrubicina convencional y también 20 entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis no mostró diferencias significativas en la aparición de trombocitopenia grado > = 3 entre los grupos de tratamiento (RR = 1,09; IC del 95%: 0,60 a 1,97; p = 0,78). No se detectó heterogeneidad (I2 = 0%). Obsérvese que la trombocitopenia grado > = 3 en este metanálisis se definió como plaquetas < 20*109/l, mientras que según los criterios CTC el grado 3 comienza con plaquetas < 50*109. El estudio de Batist 2001 también informó pacientes con plaquetas < 50*109 y nuevamente no se identificaron diferencias significativas entre los grupos de tratamiento (p = 0,78 como informaron los autores).
Neutropenia:
Hubo 184 casos de neutropenia grado 4 entre los 271 pacientes asignados al azar a la doxorrubicina convencional, y 140 entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis mostró una tasa significativamente inferior de neutropenia grado 4 en los pacientes tratados con doxorrubicina encapsulada en liposomas en comparación con los pacientes tratados con doxorrubicina convencional (RR = 0,82; IC del 95%: 0,72 a 0,94; p = 0,005). No se detectó heterogeneidad (I2 = 0%). El estudio de Batist 2001 también informó pacientes con neutropenia prolongada grado 4 (definida por durar siete días o más), y nuevamente no se identificaron diferencias significativas entre los grupos de tratamiento (p = 0,18 como informaron los autores).
Fiebre neutropénica:
Hubo 31 casos de fiebre neutropénica (es decir, fiebre > = 38ºC, neutropenia grado 4 y antibióticos IV y hospitalización) entre los 271 pacientes asignados al azar a la doxorrubicina convencional, y 25 entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis no mostró diferencias significativas en la aparición de fiebre neutropénica entre los grupos de tratamiento (RR = 0,88; IC del 95%: 0,53 a 1,45; p = 0,61). No se detectó heterogeneidad (I2 = 0%).
Náuseas / vómitos:
Hubo 53 casos de náuseas / vómitos grado > = 3 entre los 271 pacientes asignados al azar a la doxorrubicina convencional, y 32 entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis mostró una tasa significativamente inferior de náuseas / vómitos grado > = 3 en los pacientes tratados con doxorrubicina encapsulada en liposomas en comparación con los pacientes tratados con doxorrubicina convencional (RR = 0,65; IC del 95%: 0,44 a 0,98; p = 0,04). No se detectó heterogeneidad (I2 = 0%).
Estomatitis/mucositis:
Hubo 28 casos de estomatitis / mucositis grado > = 3 entre los 271 pacientes asignados al azar a la doxorrubicina convencional, y 15 entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis no mostró diferencias significativas en la aparición de la estomatitis / mucositis grado > = 3 entre los grupos de tratamiento (RR = 0,58; IC del 95%: 0,32 a 1,05; p = 0,07). No se detectó heterogeneidad (I2 = 0%).
Diarrea:
Hubo 17 casos de diarrea grado > = 3 entre los 271 pacientes asignados al azar a la doxorrubicina convencional, y cinco entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis mostró una tasa significativamente inferior de diarrea grado > = 3 en los pacientes tratados con doxorrubicina encapsulada en liposomas en comparación con los pacientes tratados con doxorrubicina convencional (RR = 0,33; IC del 95%: 0,12 a 0,87; p = 0,03). No se detectó heterogeneidad (I2 = 0%).
Astenia / fatiga:
Hubo 30 casos de astenia / fatiga grado 3 entre los 271 pacientes asignados al azar a la doxorrubicina convencional, y 24 entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis no mostró diferencias significativas en la aparición de astenia / fatiga grado 3 entre los grupos de tratamiento (RR = 0,85; IC del 95%: 0,52 a 1,41; p = 0,54). No se detectó heterogeneidad (I2 = 0%).
Toxicidad cutánea:
Hubo dos casos de toxicidad cutánea grado 3 entre los 271 pacientes asignados al azar a la doxorrubicina convencional, y uno entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis no mostró diferencias significativas en la aparición de la toxicidad cutánea grado 3 entre los grupos de tratamiento (RR = 0,68; IC del 95%: 0,08 a 5,45; p = 0,71). No se detectó heterogeneidad (I2 = 0%).
Infección:
Hubo 26 casos de infección grado > = 3 entre los 271 pacientes asignados al azar a la doxorrubicina convencional, y 21 entre los 250 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El metanálisis no mostró diferencias significativas en la aparición de infección grado > = 3 entre los grupos de tratamiento (RR = 0,78; IC del 95%: 0,21 a 2,89; p = 0,71). Sin embargo, se detectó una heterogeneidad no explicada (I2 = 78,4%).
Calidad de vida
Ninguno de los estudios evaluó la CdV.
Análisis de Subgrupos
Debido a que todos los pacientes eran adultos con un tumor sólido, no se realizaron los análisis de subgrupos para niños versus adultos y leucemias versus tumores sólidos.
Estudio que abordó epirrubicina versus doxorrubicina encapsulada en liposomas
Debido a la falta de más de un ECA, no fue posible el agrupamiento de los resultados para la epirrubicina versus doxorrubicina encapsulada en liposomas. Por consiguiente, se proporcionan resultados descriptivos de este estudio. Todos los RR, IC del 95% y valores de p mencionados se calculan en RevMan con el modelo de efectos aleatorios.
Insuficiencia cardíaca clínica
En el estudio de Chan 2004 no hubo casos de insuficiencia cardíaca clínica en los dos grupos de tratamiento y, por consiguiente, no es posible estimar los resultados de este estudio para el análisis del RR. Sin embargo, no se identificaron diferencias significativas en la aparición de insuficiencia cardíaca clínica entre los grupos de tratamiento. Todos los pacientes incluidos en este estudio eran adultos con cáncer de mama.
Insuficiencia cardíaca clínica y subclínica combinadas
En el estudio de Chan 2004 hubo ocho casos de insuficiencia cardíaca clínica y subclínica combinadas entre los 80 pacientes asignados al azar a la epirrubicina, y nueve casos entre los 80 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El análisis no mostró diferencias significativas en la aparición de insuficiencia cardíaca clínica y subclínica entre los grupos de tratamiento (RR = 1,13; IC del 95%: 0,46 a 2,77; p = 0,80). Todos los pacientes incluidos en este estudio eran adultos con cáncer de mama. El seguimiento de al menos parte de los pacientes incluidos fue superior a un año y, por consiguiente, es posible que este estudio incluyera casos de cardiotoxicidad ya sea temprana como tardía.
Respuesta tumoral
En el estudio de Chan 2004 hubo 31 respuestas completas o parciales entre los 80 pacientes asignados al azar a la epirrubicina, y 37 entre los 80 pacientes asignados al azar a la doxorrubicina encapsulada en liposomas. El análisis no mostró diferencias significativas en la tasa de respuesta entre los grupos de tratamiento (RR = 1,19; IC del 95%: 0,83 a 1,72; p = 0,34). No se mencionó que al menos dos observadores determinaron la tasa de respuesta. Todos los pacientes incluidos en este estudio eran adultos con cáncer de mama. Nótese que es favorable una alta tasa de eventos debido a la naturaleza de esta medición (es decir, el porcentaje de pacientes en remisión).
Supervivencia
En el estudio de Chan 2004 se identificó una diferencia significativa en la supervivencia libre de progresión a favor de la doxorrubicina encapsulada en liposomas. Los pacientes asignados al azar a la epirrubicina presentaron una supervivencia libre de progresión mediana de 5,6 meses y en los pacientes asignados al azar a la doxorrubicina encapsulada en liposomas fue de 7,7 meses (CRI = 1,52; IC del 95%: 1,06 a 2,20 como informaron los autores). Sin embargo, no se encontraron diferencias significativas de supervivencia general entre los brazos del tratamiento. Los pacientes asignados al azar a la epirrubicina presentaron una supervivencia general mediana de 16 meses y en los pacientes asignados al azar a la doxorrubicina encapsulada en liposomas fue 18,3 meses (CRI = 1,15; IC del 95%: 0,77 a 1,72 como informaron los autores).
Efectos adversos
Debido a que todos los pacientes que recibían quimioterapia presentaban efectos secundarios, se decidió analizar solamente los efectos graves y potencialmente mortales. Se definió como toxicidad de grado 3 o 4. Chan 2004 utilizó los criterios comunes de toxicidad (CTC) del National Cancer Institute. Los resultados se muestran en la Tabla adicional 04. La neutropenia grado 4 ocurrió significativamente con más frecuencia en los pacientes asignados al azar al tratamiento con doxorrubicina encapsulada en liposomas. No se identificaron diferencias significativas entre los grupos de tratamiento para todos los demás efectos adversos evaluados.
Calidad de vida
La CdV no se evaluó en este estudio.
Análisis de Subgrupos
Debido a que todos los pacientes eran adultos con un tumor sólido, no se realizaron los análisis de subgrupos para niños versus adultos y leucemias versus tumores sólidos.
Discusión
La lesión cardíaca debida a quimioterapia con antraciclinas es una complicación importante y grave. Reduce la CdV y además puede causar la muerte prematura. Además, cuando se desarrolla una lesión cardíaca durante el tratamiento, se necesita limitar la máxima dosis acumulativa de antraciclinas y, como resultado, se reducirá la eficacia de la quimioterapia. Ésta es la primera revisión sistemática que evalúa las pruebas existentes en diferentes derivados de antraciclina para reducir la cardiotoxicidad. Se pudieron identificar ensayos controlados aleatorios para tres combinaciones de derivados diferentes de antraciclina, es decir, epirrubicina versus doxorrubicina, doxorrubicina encapsulada en liposomas (myocet) versus doxorrubicina y doxorrubicina encapsulada en liposomas (myocet) versus epirrubicina. Para las otras 25 combinaciones de diferentes derivados de antraciclina (ver estrategia de búsqueda) no se pudieron identificar ECA adecuados.
Para la epirrubicina versus doxorrubicina se identificaron cinco ensayos.
El metanálisis de cinco ensayos no mostró pruebas de una diferencia significativa en la aparición de insuficiencia cardíaca clínica entre los grupos de tratamiento (RR = 0,36; IC del 95%: 0,12 a 1,11; p = 0,07). Sin embargo, en base al bajo RR y al amplio IC del 95%, hubo algunos indicios de una tasa inferior de insuficiencia cardíaca clínica en los pacientes tratados con epirrubicina en comparación con los pacientes tratados con doxorrubicina. La razón por la que esta diferencia no es estadísticamente significativa podría ser consecuencia del bajo poder estadístico de los estudios incluidos. No se dispone de resultados sobre la aparición de insuficiencia cardíaca clínica y subclínica combinadas en los pacientes tratados con epirrubicina o doxorrubicina, debido a que ninguno de los estudios incluidos evaluó adecuadamente la insuficiencia cardíaca subclínica.
El metanálisis de la respuesta tumoral no mostró diferencias significativas en la tasa de respuesta entre los grupos de tratamiento (RR = 0,94; IC del 95%: 0,82 a 1,08; p = 0,40). Lo mismo ocurrió en los metanálisis de la supervivencia libre de progresión y general (CRI = 1,05; IC del 95%: 0,76 a 1,44; p = 0,78 y CRI = 0,95; IC del 95%: 0,65 a 1,39; p = 0,79, respectivamente). Sin embargo, obsérvese que en el metanálisis de la supervivencia libre de progresión se detectó una heterogeneidad significativa. Los estudios individuales no incluidos en el metanálisis tampoco mostraron diferencias significativas en la supervivencia entre los grupos de tratamiento.
Fue posible realizar un metanálisis para tres efectos adversos evaluados. Se identificó una tasa significativamente inferior de leucopenia y náuseas / vómitos en los pacientes tratados con epirrubicina en comparación con los pacientes tratados con doxorrubicina. No se identificaron diferencias significativas en la aparición de alopecia entre los grupos de tratamiento; para esta medida de resultado hubo una heterogeneidad significativa. Para los otros efectos adversos evaluados no se pudo realizar el agrupamiento de los resultados. En consecuencia, esta revisión no permite establecer conclusiones definitivas con respecto a esos efectos adversos en pacientes tratados con epirrubicina o doxorrubicina. Sin embargo, para la trombocitopenia, infección, estomatitis / mucositis, tromboflebitis y disfunción hepática o renal relacionada a la administración de fármacos, los resultados fueron coherentes entre los estudios individuales que evaluaban el resultado (ya sea uno o dos estudios). Ninguno de los estudios identificó una diferencia significativa en la aparición de los efectos adversos evaluados entre los grupos de tratamiento. Para la anemia, los resultados no fueron coherentes entre los estudios individuales que evaluaban la medida de resultado. La razón por la que algunos estudios no identificaron una diferencia significativa entre los grupos de tratamiento podría deberse a que el número de pacientes incluidos en estos estudios era demasiado pequeño para detectar una diferencia entre los grupos de tratamiento (es decir, un poder estadístico bajo).
La dosis de antraciclina acumulativa recibida en ambos grupos de tratamiento fue comparable. Por consiguiente, los resultados de las diferentes medidas de resultado son comparaciones directas de las dosis equimolares de la epirrubicina y la doxorrubicina. No es posible establecer conclusiones sobre el tratamiento con epirrubicina y doxorrubicina en las diferentes dosis acumulativas. La calidad de los estudios incluidos fue variable. Sin embargo, actualmente, estas pruebas son la mejor evidencia disponible de los ECA que evalúan la epirrubicina y la doxorrubicina.
Se identificaron dos ensayos de doxorrubicina encapsulada en liposomas versus doxorrubicina convencional.
El metanálisis de los dos ensayos mostró una tasa significativamente inferior de insuficiencia cardíaca clínica e insuficiencia cardíaca clínica y subclínica combinadas en los pacientes tratados con doxorrubicina encapsulada en liposomas, en comparación con los pacientes tratados con doxorrubicina (RR = 0,20; IC del 95%: 0,05 a 0,75; p = 0,02 y RR = 0,38; IC del 95%: 0,24 a 0,59; p < 0,0001, respectivamente).
Sin embargo, una pregunta importante respecto de cualquier intervención cardioprotectora durante el tratamiento de antraciclina es si la intervención podría reducir selectivamente el daño al corazón sin reducir la eficacia antitumoral y la supervivencia del paciente, y sin presentar efectos tóxicos diferentes al daño cardíaco. El metanálisis de dos ensayos para la tasa de respuesta no mostró diferencias significativas entre los grupos de tratamiento (RR = 1,01; IC del 95%: 0,80 a 1,26; p = 0,95). Lo mismo ocurrió en los metanálisis de una supervivencia libre de progresión y general (CRI = 1,01; IC del 95%: 0,83 a 1,24; p = 0,89 y CRI = 1,12; IC del 95%: 0,83 a 1,53; p = 0,46, respectivamente). Sin embargo, se debe notar que en el estudio de Harris 2002 hubo una tendencia no significativa hacia una supervivencia general más corta en pacientes tratados con doxorrubicina encapsulada en liposomas (p = 0,09). Los autores establecen que aunque no se puede ignorar este resultado, parece improbable, dados los otros parámetros de eficacia, que sea consecuencia de una eficacia reducida de la doxorrubicina encapsulada en liposomas en comparación con la doxorrubicina convencional. Es posible que el exceso de positividad del receptor de progesterona en el brazo de doxorrubicina convencional pueda denotar un grupo con mejores factores pronósticos. Es posible que otros factores pronósticos no medidos (p.ej. la expresión HER‐2) también hayan tenido una influencia en la evolución natural de la enfermedad. En el estudio de Batist 2001no hubo diferencias significativas en la positividad del receptor de progesterona entre los grupos de tratamiento.
Fue imposible realizar un metanálisis para todos los efectos adversos. Para la neutropenia, las náuseas / vómitos y la diarrea se observó una tasa significativamente inferior del efecto adverso en los pacientes tratados con doxorrubicina encapsulada en liposomas en comparación con los pacientes tratados con doxorrubicina. Para la anemia, la trombocitopenia, la fiebre neutropénica, la estomatitis / mucositis, la astenia / fatiga, la toxicidad cutánea y la infección no se identificaron diferencias significativas entre los grupos de tratamiento. Se debe observar que hubo heterogeneidad en el análisis de la infección.
Se debe enfatizar que la dosis de antraciclina acumulativa recibida en los dos grupos de tratamiento fue la misma en el estudio de Batist 2001, mientras que en el estudio de Harris 2002 los pacientes del grupo de doxorrubicina encapsulada en liposomas recibieron una dosis de antraciclina acumulativa mayor que los pacientes del grupo de doxorrubicina. A pesar de la alta dosis de antraciclina acumulativa administrada al grupo de doxorrubicina encapsulada en liposomas, la tasa de insuficiencia cardíaca y efectos adversos seguía siendo menor en el grupo de doxorrubicina encapsulada en liposomas en comparación con el grupo de doxorrubicina. Sin embargo, no se identificaron diferencias significativas en la respuesta tumoral y en la supervivencia entre los dos grupos de tratamiento, aunque podría esperarse que esos resultados mejoraran con una mayor dosis de antraciclina acumulativa. Como resultado, no se pueden proporcionar conclusiones definitivas sobre la respuesta tumoral y la supervivencia.
La calidad de los estudios incluidos fue variable. Sin embargo, en la actualidad, estas pruebas son las mejores a disposición de los ECA que evalúan la doxorrubicina y la doxorrubicina encapsulada en liposomas.
Se identificó un ensayo para la doxorrubicina encapsulada en liposomas versus epirrubicina. Como no fue posible el agrupamiento de resultados, esta revisión no permite establecer conclusiones definitivas sobre los efectos del tratamiento con doxorrubicina o epirrubicina encapsulada en liposomas. No se identificaron diferencias significativas en la aparición de insuficiencia cardíaca clínica o insuficiencia cardíaca clínica y subclínica combinadas. Lo mismo ocurrió para la tasa de respuesta y la supervivencia general, aunque la supervivencia libre de progresión fue significativamente mejor en los pacientes tratados con doxorrubicina encapsulada en liposomas en comparación con los pacientes tratados con doxorrubicina. No se puede explicar esta diferencia.
Esta revisión no permite establecer conclusiones definitivas sobre los efectos adversos en los pacientes tratados con epirrubicina o doxorrubicina encapsulada en liposomas. Sin embargo, sólo se identificó una diferencia significativa en la neutropenia que favorece la epirrubicina. Para todos los demás efectos adversos evaluados no se encontraron diferencias significativas entre los grupos de tratamiento.
No se identificaron diferencias significativas entre los grupos de tratamiento de este estudio, para la mayoría de los resultados evaluados, porque posiblemente el número de pacientes incluidos fue demasiado pequeño para detectar una diferencia entre los grupos de tratamiento (es decir, un poder estadístico bajo).
La dosis de antraciclina acumulativa recibida en ambos grupos de tratamiento fue comparable. Por consiguiente, los resultados de las diferentes medidas de resultado son comparaciones directas de las dosis equimolares de la epirrubicina y la doxorrubicina. No se pueden establecer conclusiones sobre el tratamiento con epirrubicina y doxorrubicina encapsulada en liposomas con diferentes dosis acumulativas.
La calidad del ensayo incluido fue incierta; solamente se descartó la presencia del sesgo de deserción. Sin embargo, en la actualidad, estas pruebas son las mejores a disposición de los ECA que evalúan la epirrubicina y la doxorrubicina encapsulada en liposomas.
Respecto de la cardiotoxicidad temprana y tardía, se deben establecer las siguientes conclusiones para las tres comparaciones. En algunos estudios, el seguimiento de (al menos parte de) los pacientes incluidos duró más de un año, por consiguiente, es posible que estos estudios incluyeran casos de cardiotoxicidad temprana y tardía. En los otros estudios, no se mencionó la duración del seguimiento; por lo tanto, se desconoce si los casos de cardiotoxicidad en estos estudios son tempranos o tardíos. Sin embargo, en función de que todos los pacientes incluidos en estos ensayos presentaban una enfermedad metastásica o avanzada y el efecto asociado sobre la duración de la supervivencia, se presume que los casos de insuficiencia cardíaca en estos ensayos eran de cardiotoxicidad temprana.
Para las tres comparaciones de los diferentes derivados de antraciclina se debe enfatizar que todos los pacientes incluidos eran adultos con un tumor sólido, principalmente cáncer de mama. Como resultado, no se pueden establecer conclusiones sobre los efectos del tratamiento con epirrubicina y doxorrubicina en niños tratados con antraciclinas, ni en pacientes con diagnóstico de leucemia.

Comparison 1 Doxorubicin versus epirubicin, Outcome 1 Clinical heart failure.
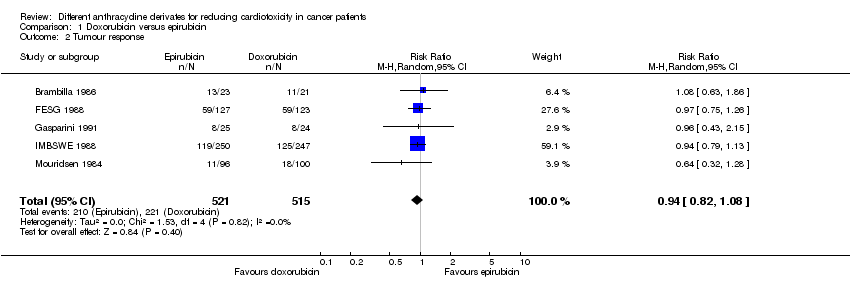
Comparison 1 Doxorubicin versus epirubicin, Outcome 2 Tumour response.
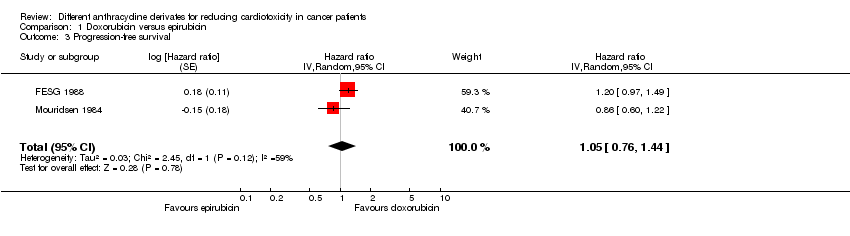
Comparison 1 Doxorubicin versus epirubicin, Outcome 3 Progression‐free survival.
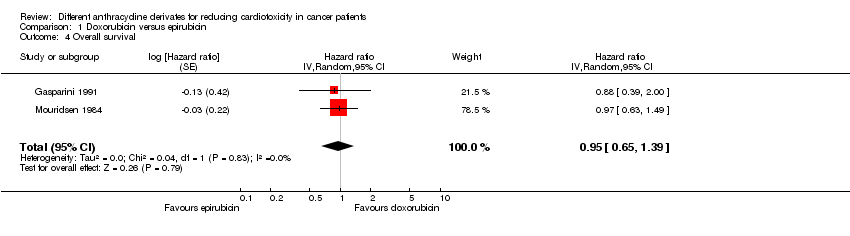
Comparison 1 Doxorubicin versus epirubicin, Outcome 4 Overall survival.
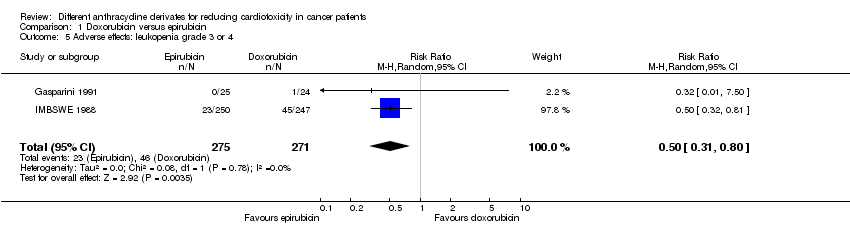
Comparison 1 Doxorubicin versus epirubicin, Outcome 5 Adverse effects: leukopenia grade 3 or 4.
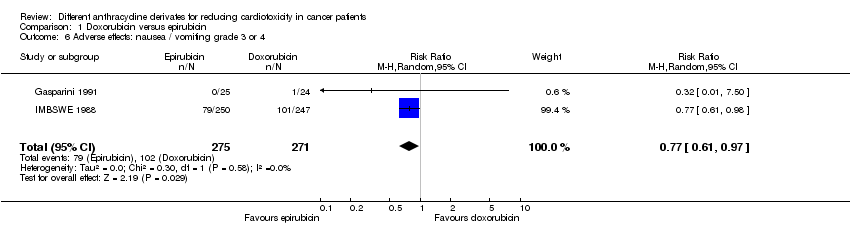
Comparison 1 Doxorubicin versus epirubicin, Outcome 6 Adverse effects: nausea / vomiting grade 3 or 4.

Comparison 1 Doxorubicin versus epirubicin, Outcome 7 Adverse effects: alopecia grade 3 or 4.

Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 1 Clinical heart failure.

Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 2 Heart failure combined.
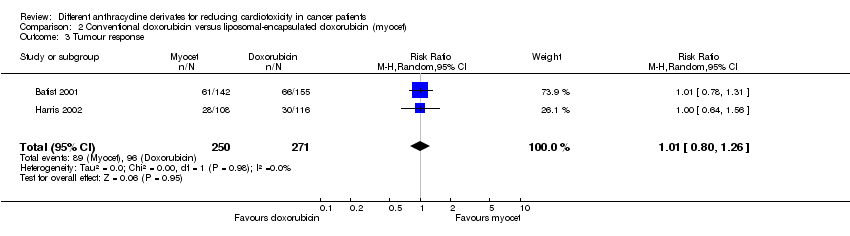
Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 3 Tumour response.

Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 4 Progression‐free survival.
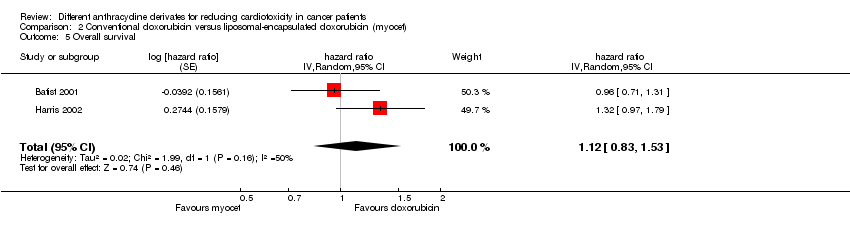
Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 5 Overall survival.
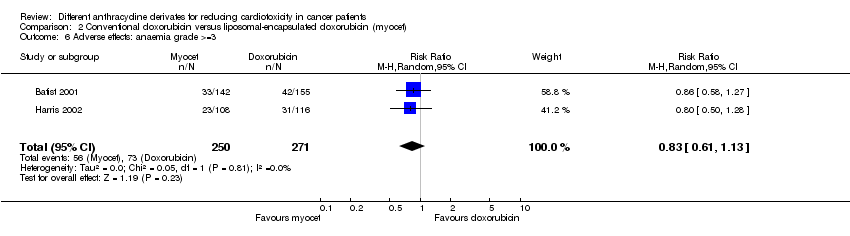
Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 6 Adverse effects: anaemia grade >=3.
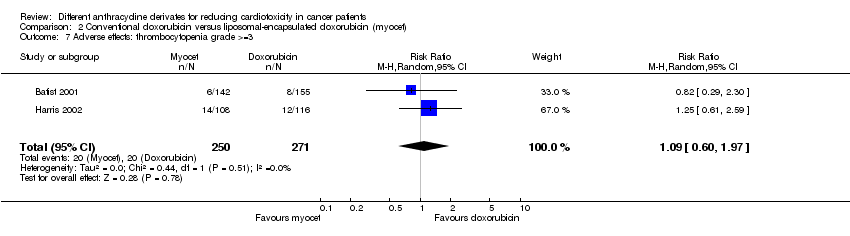
Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 7 Adverse effects: thrombocytopenia grade >=3.

Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 8 Adverse effects: neutropenia grade 4.

Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 9 Adverse effects: neutropenic fever (fever >=38, neutropenia grade 4, IV antibiotics and/or hospitalisation).
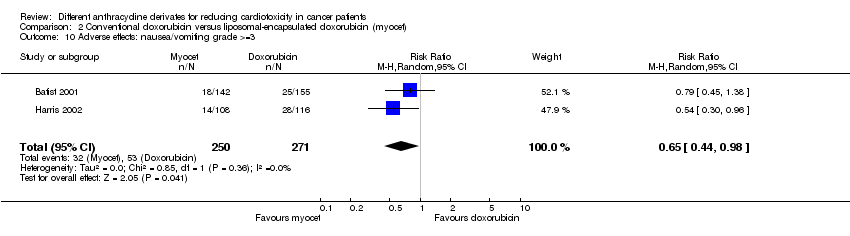
Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 10 Adverse effects: nausea/vomiting grade >=3.
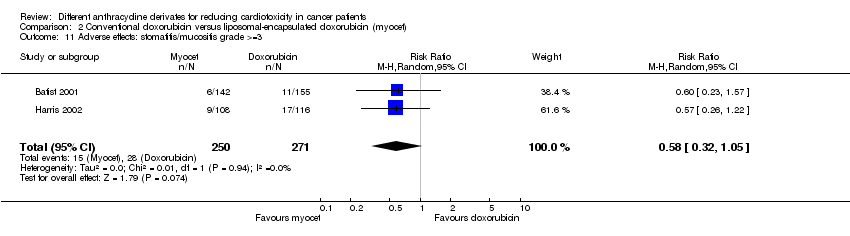
Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 11 Adverse effects: stomatitis/mucositis grade >=3.
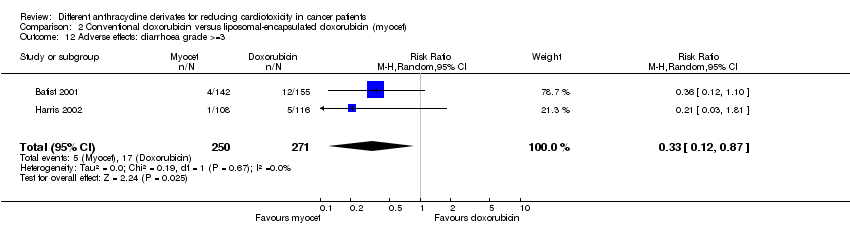
Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 12 Adverse effects: diarrhoea grade >=3.
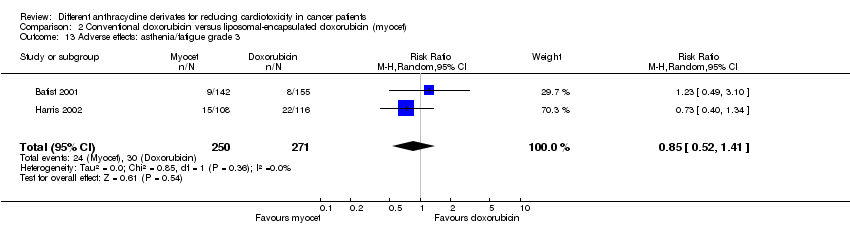
Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 13 Adverse effects: asthenia/fatigue grade 3.

Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 14 Adverse effects: cutaneous grade 3.
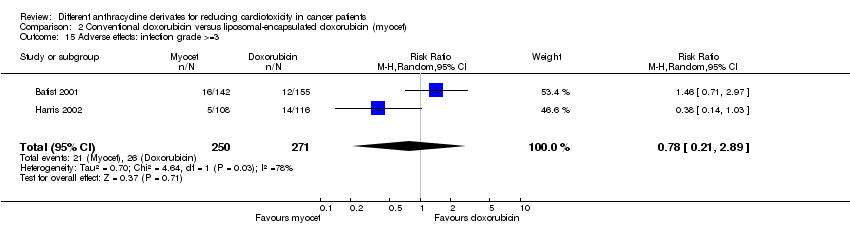
Comparison 2 Conventional doxorubicin versus liposomal‐encapsulated doxorubicin (myocet), Outcome 15 Adverse effects: infection grade >=3.
| Item ID | Description | Implementation |
| Patient selection | Note: all criteria were scored yes (+), no (‐) or unclear (?) | |
| a | Was the allocation of participants to treatment groups randomised? | A random (unpredictable) assignment sequence must have been applied. |
| b | Was the treatment allocation concealed? | Allocation must have been performed by a person not responsible for determining eligibility of patients for inclusion. |
| Interventions | ||
| c | Was the care provider blinded to the intervention? | Adequate information about blinding must have been provided. |
| d | Was the patient blinded to the intervention? | Adequate information about blinding must have been provided. |
| Outcome assessments (for each outcome separately) | ||
| e | Was the outcome assessor blinded to the intervention? | Adequate information about blinding must have been provided. |
| f | Were patients lost to follow‐up described and acceptable? | For each outcome measure the number of evaluated patients must be mentioned. If the percentage of non‐evaluable patients does not exceed 20% a "yes" (+) is scored. |
| Study | a | b | c | d | e | f | Intervention |
| Batist 2001 | + | ? | ? | ? | Clinical heart failure, subclinical heart failure, tumour response, PFS: +; adverse effects: ? | Clinical heart failure, subclinical heart failure, tumour response, PFS, OS, adverse effects: + | Doxorubicin versus liposomal‐encapsulated doxorubicin (myocet). |
| Brambilla 1986 | + | ? | ? | ? | Clinical heart failure, subclinical heart failure, tumour response, PFS: ? | Clinical heart failure: ?; subclinical heart failure, PFS: ‐; tumour response, OS: + | Doxorubicin versus epirubicin. |
| Chan 2004 | + | ? | ? | ? | Clinical heart failure, subclinical heart failure, tumour response, PFS, adverse effects: ? | Clinical heart failure, subclinical heart failure, tumour response, PFS, OS, adverse effects: + | Epirubicin versus liposomal‐encapsulated doxorubicin (myocet). |
| FESG 1998 | + | ? | ? | ? | Clinical heart failure, tumour response, PFS, adverse effects: ? | Clinical heart failure, tumour response, PFS, OS: +; adverse effects: ‐ | Doxorubicin versus epirubicin. |
| Gasparini 1991 | + | ? | ? | ? | Clinical heart failure, tumour response, PFS, adverse effects: ? | Clinical heart failure, tumour response, PFS, OS, adverse effects: + | Doxorubicin versus epirubicin. |
| Harris 2002 | + | ? | ? | ? | Clinical heart failure, adverse effects: ?; subclinical heart failure, tumour response, PFS: + | Clinical heart failure, subclinical heart failure, tumour response, PFS, OS, adverse effects: + | Doxorubicin versus liposomal‐encapsulated doxorubicin (myocet). |
| IMBSWE 1988 | + | ? | ? | ? | Clinical heart failure, tumour response, adverse effects: ? | Clinical heart failure, tumour response, PFS, OS, adverse effects (with the exeption of alopecia: ‐): + | Doxorubicin versus epirubicin. |
| Mouridsen 1984 | + | ? | ? | ? | Clinical heart failure, tumour response, PFS: ? | Clinical heart failure, tumour response, PFS, OS: ‐ | Doxorubicin versus epirubicin. |
| Study | Progr‐free survival | Overall survival |
| Brambilla 1986 | Not evaluated in review. | Median: in epirubicin group > 16 months (7‐25+), in doxorubicin group > 18 months (6‐28+) (no significant difference) |
| FESG 1988 | Median: in epirubicin group 220 days (30‐1230), in doxorubicin group 270 days (30‐1380) (no significant difference) | Median: in epirubicin group 450 days (20‐1582), in doxorubicin group 530 days (36‐1681) (no significant difference) |
| Gasparini 1991 | In epirubicin group range 2 to 11 months, in doxorubicin group 3 to 14 months (P=0.91) | Median: in epirubicin group 12 months, in doxorubicin group 11 months (no significant difference) |
| IMBSWE 1988 | Median: in epirubicin group 273 days, in doxorubicin group 314 days (P=0.59) | Median: in epirubicin group 591 days, in doxorubicin group 613 days (P=0.75) |
| Mouridsen 1987 | No significant differences between both treatment groups (P=0.41) | No significant differences between both treatment groups (P=0.90) |
| Adverse effect | n/N myocet pts | n/N epirubicin pts | RR (95% CI) | P‐value |
| Anaemia grade >=3 | 19/80 | 11/80 | 1.73 (0.88 ‐ 3.39) | 0.11 |
| Thrombocytopenia grade >=3 | 3/80 | 2/80 | 1.50 (0.26 ‐ 8.74) | 0.65 |
| Neutropenia grade 4 | 66/80 | 52/80 | 1.17 (1.05 ‐ 1.53) | 0.01 |
| Prolonged neutropenia grade 4 (>=7 days) | 20/80 | 24/80 | 0.83 (0.50 ‐ 1.38) | 0.48 |
| Febrile neutropenia (fever >=38 C, neutropenia grade 4, IV antibiotics and/or hospitalisation) | 4/80 | 1/80 | 4.00 (0.46 to 35.01) | 0.21 |
| Infection grade >=3 | 5/80 | 1/80 | 5.00 (0.60 ‐ 41.85) | 0.14 |
| Nausea / vomiting grade >=3 | 16/80 | 15/80 | 1.07 (0.57 ‐ 2.01) | 0.84 |
| Stomatitis / mucositis grade 3 | 5/80 | 0/80 | 11.00 (0.62 ‐ 195.69) | 0.10 |
| Diarrhoea grade 3 | 1/80 | 1/80 | 1.00 (0.06 ‐ 15.71) | 1.00 |
| Asthenia / fatigue grade 3 | 0/80 | 1/80 | 0.33 (0.01 ‐ 8.06) | 0.50 |
| Cutaneous grade 3 | 0/80 | 1/80 | 0.33 (0.01 ‐ 8.06) | 0.50 |
| Injection site toxicity grade 3 | 0/80 | 1/80 | 0.33 (0.01 ‐ 8.06) | 0.50 |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Clinical heart failure Show forest plot | 5 | 1036 | Risk Ratio (M‐H, Random, 95% CI) | 0.36 [0.12, 1.11] |
| 2 Tumour response Show forest plot | 5 | 1036 | Risk Ratio (M‐H, Random, 95% CI) | 0.94 [0.82, 1.08] |
| 3 Progression‐free survival Show forest plot | 2 | Hazard ratio (Random, 95% CI) | 1.05 [0.76, 1.44] | |
| 4 Overall survival Show forest plot | 2 | Hazard ratio (Random, 95% CI) | 0.95 [0.65, 1.39] | |
| 5 Adverse effects: leukopenia grade 3 or 4 Show forest plot | 2 | 546 | Risk Ratio (M‐H, Random, 95% CI) | 0.50 [0.31, 0.80] |
| 6 Adverse effects: nausea / vomiting grade 3 or 4 Show forest plot | 2 | 546 | Risk Ratio (M‐H, Random, 95% CI) | 0.77 [0.61, 0.97] |
| 7 Adverse effects: alopecia grade 3 or 4 Show forest plot | 3 | 796 | Risk Ratio (M‐H, Random, 95% CI) | 0.85 [0.52, 1.38] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Clinical heart failure Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.20 [0.05, 0.75] |
| 2 Heart failure combined Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.38 [0.24, 0.59] |
| 3 Tumour response Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 1.01 [0.80, 1.26] |
| 4 Progression‐free survival Show forest plot | 2 | hazard ratio (Random, 95% CI) | 1.01 [0.83, 1.24] | |
| 5 Overall survival Show forest plot | 2 | hazard ratio (Random, 95% CI) | 1.12 [0.83, 1.53] | |
| 6 Adverse effects: anaemia grade >=3 Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.83 [0.61, 1.13] |
| 7 Adverse effects: thrombocytopenia grade >=3 Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 1.09 [0.60, 1.97] |
| 8 Adverse effects: neutropenia grade 4 Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.82 [0.72, 0.94] |
| 9 Adverse effects: neutropenic fever (fever >=38, neutropenia grade 4, IV antibiotics and/or hospitalisation) Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.88 [0.53, 1.45] |
| 10 Adverse effects: nausea/vomiting grade >=3 Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.65 [0.44, 0.98] |
| 11 Adverse effects: stomatitis/mucositis grade >=3 Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.58 [0.32, 1.05] |
| 12 Adverse effects: diarrhoea grade >=3 Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.33 [0.12, 0.87] |
| 13 Adverse effects: asthenia/fatigue grade 3 Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.85 [0.52, 1.41] |
| 14 Adverse effects: cutaneous grade 3 Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.68 [0.08, 5.45] |
| 15 Adverse effects: infection grade >=3 Show forest plot | 2 | 521 | Risk Ratio (M‐H, Random, 95% CI) | 0.78 [0.21, 2.89] |

