Drenaje linfático manual para el linfedema posterior al tratamiento del cáncer de mama
Resumen
Antecedentes
Más de una de cada cinco pacientes que reciben tratamiento para el cáncer de mama desarrollará linfedema relacionado con el cáncer de mama (LRCM). El LRCM puede ocurrir como resultado de la cirugía por cáncer de mama o la radioterapia. El LRCM puede repercutir negativamente en el bienestar, la función y la calidad de vida (CdV). El drenaje linfático manual (DLM), un tipo de tratamiento que se realiza con las manos, se utiliza con frecuencia para el LRCM y a menudo como parte del tratamiento descongestivo complejo (TDC). El TDC es un tratamiento conservador cuádruple que incluye el DLM, el tratamiento de compresión (que consiste en el uso de vendajes de compresión, mangas de compresión u otros tipos de ropas compresivas), el cuidado de la piel y los ejercicios que reducen la linfa (ERL). La fase 1 del TDC busca reducir el edema; La fase 2 busca mantener la reducción del edema.
Objetivos
Evaluar la eficacia y la seguridad del DLM en el tratamiento del LRCM.
Métodos de búsqueda
Se hicieron búsquedas en Medline, EMBASE, CENTRAL, WHO ICTRP (World Health Organization's International Clinical Trial Registry Platform) y en el registro especializado del Grupo Cochrane de Cáncer de Mama (Cochrane Breast Cancer Group) desde su inicio hasta el 24 mayo 2013. No se aplicaron restricciones de idioma.
Criterios de selección
Se incluyeron los ensayos controlados aleatorios (ECA) o cuasialeatorios en pacientes con LRCM. La intervención fue el DLM. Los resultados primarios fueron (1) cambios volumétricos, (2) eventos adversos. Los resultados secundarios fueron (1) función, (2) sensaciones subjetivas, (3) CdV, (4) costo de la atención.
Obtención y análisis de los datos
Se obtuvieron datos sobre tres resultados volumétricos. (1) El volumen del LE (linfedema) se definió como la cantidad excesiva de líquido que queda en el brazo después del tratamiento, calculado como el volumen en ml del brazo afectado después del tratamiento menos el volumen del brazo no afectado después del tratamiento. (2) La reducción del volumen se definió como la cantidad de reducción de líquido en ml desde antes hasta después del tratamiento calculada como el volumen del LE pretratamiento del brazo afectado menos el volumen del LE después del tratamiento del brazo afectado. (3) La reducción porcentual se definió como la proporción de reducción de líquido con respecto al exceso de volumen inicial, calculada como la reducción del volumen dividida por el volumen del LE inicial multiplicado por 100. Los datos de los ensayos se introdujeron en Review Manger 5.2 (RevMan); los datos agrupados se analizaron mediante un modelo de efectos fijos y los datos continuos se analizaron como diferencias de medias (DM) con intervalos de confianza (IC) del 95%. También se exploraron los subgrupos para determinar si el LRCM leve en comparación con el LRCM moderado o grave, y el LRCM de menos de un año en comparación con más de un año se asociaron con una mejor respuesta al DLM.
Resultados principales
Se incluyeron seis ensayos. Los ensayos se agruparon en tres categorías según sus diseños similares.
(1) DLM + fisioterapia estándar versus fisioterapia estándar (un ensayo) mostró mejorías significativas en ambos grupos al inicio, pero no hubo diferencias significativas entre los grupos en la reducción porcentual.
(2) DLM + vendaje de compresión versus vendaje de compresión (dos ensayos) mostró reducciones porcentuales significativas del 30% al 38,6% para el vendaje de compresión solo y una reducción adicional del 7,11% para el DLM (DM 7,11%; IC del 95%: 1,75% a 12,47%; dos ECA; 83 participantes). La reducción del volumen tuvo una significación marginal (p = 0,06). El volumen del LE no fue significativo. Los análisis de subgrupos mostraron de forma significativa que las participantes con LRCM leve a moderado respondieron mejor al DLM que las participantes con LRCM moderado a grave.
(3) DLM + tratamiento de compresión versus tratamiento sin DLM + tratamiento de compresión (tres ensayos) fueron demasiado variados para agruparlos. Uno de los ensayos comparó manga de compresión más DLM con manga de compresión más bomba neumática. La reducción del volumen fue estadísticamente significativa y favoreció al DLM (DM 47,00 ml; IC del 95%: 15,25 ml a 78,75 ml; un ECA; 24 participantes), la reducción porcentual tuvo una significación marginal (p = 0,07), y el volumen del LE no fue significativo. Un segundo ensayo comparó manga de compresión más DLM con manga de compresión más drenaje linfático simple (DLS) autoadministrado y fue significativo para el DLM para el volumen del LE (DM ‐230,00 ml; IC del 95%: ‐450,84 ml a ‐9,16 ml; un ECA; 31 participantes) pero no para la reducción del volumen o la reducción porcentual. Un tercer ensayo de DLM + vendaje de compresión versus DLS + vendaje de compresión no fue significativo (p = 0,10) para la reducción porcentual, el único resultado medido (DM 11,80%; IC del 95%: ‐2,47% a 26,07%, 28 participantes).
El DLM fue bien tolerado y seguro en todos los ensayos.
Dos ensayos midieron la función como amplitud de movimiento, con resultados contradictorios. Un ensayo informó ganancias significativas dentro de los grupos en ambos grupos, pero sin diferencias entre los grupos. El otro ensayo informó que no hubo ganancias significativas dentro de los grupos y no informó resultados entre los grupos. Un ensayo midió la fuerza y no informó cambios significativos en cualquiera de los grupos.
Dos ensayos midieron la CdV, pero los resultados no fueron utilizables porque un ensayo no presentó resultados y el otro ensayo no presentó los resultados entre los grupos.
Cuatro ensayos midieron sensaciones como el dolor y la pesadez. En general las sensaciones se redujeron significativamente en ambos grupos a partir del valor inicial, pero sin diferencias entre los grupos. Ningún ensayo informó el coste de la atención.
Los ensayos eran pequeños y variaron entre 24 y 45 participantes. En su mayoría los ensayos parecieron asignar al azar a las participantes de forma adecuada. Sin embargo, en cuatro ensayos la persona que midió el edema sabía qué tratamiento recibían las participantes, lo que pudo haber sesgado los resultados.
Conclusiones de los autores
El DLM es seguro y puede ofrecer efectos beneficiosos adicionales con respecto al vendaje de compresión para la reducción del edema. En comparación con las pacientes con LRCM moderado a grave, las pacientes con LRCM leve a moderado pueden ser las que se beneficien de agregar DLM al tratamiento intensivo con vendaje de compresión. Este hallazgo, sin embargo, debe ser confirmado mediante datos aleatorios.
En los ensayos que compararon DLM y manga con un tratamiento sin DLM y manga, los resultados volumétricos no fueron consistentes dentro del mismo ensayo. Se necesitan estudios de investigación para identificar la medición volumétrica clínicamente más significativa, para incorporar tecnologías más nuevas en la evaluación del LE y para evaluar otros resultados clínicamente relevantes como la formación de tejido fibrótico.
Los resultados fueron contradictorios para la función (amplitud de movimiento) y no concluyentes para la calidad de vida.
Para los síntomas como el dolor y la pesadez, el 60% al 80% de las participantes informaron sentirse mejor independientemente del tratamiento que recibieron.
El seguimiento al año indica que una vez que el edema se redujo, fue probable que las participantes mantuvieran la reducción del edema con el uso de una manga hecha a la medida.
PICO
Resumen en términos sencillos
Drenaje linfático manual para el linfedema posterior al tratamiento del cáncer de mama
Antecedentes
Más de una de cada cinco pacientes con cáncer de mama desarrollará linfedema relacionado con el cáncer de mama (LRCM). El LRCM es un edema que puede ocurrir en el brazo, la mama o la pared torácica como resultado de la cirugía por cáncer de mama o la radioterapia. El LRCM puede repercutir negativamente en el bienestar, la función y la calidad de vida
El drenaje linfático manual (DLM) es un tratamiento que se realiza con las manos y se utiliza con frecuencia para el LRCM, a menudo como parte del tratamiento descongestivo complejo (TDC). El TDC consiste en DLM, vendaje de compresión, ejercicios que reducen la linfa (ERL) y cuidado de la piel.
Preguntas de revisión
¿El DLM es seguro y eficaz para tratar el LRCM?
Características de los estudios
Se encontraron seis ensayos publicados hasta mayo de 2013, con un total de 208 participantes.
Resultados clave
Cuando las pacientes se trataron con un ciclo intensivo de vendaje de compresión, el edema se redujo del 30% al 37%. Cuando el DLM se agregó al ciclo intensivo de vendaje de compresión, el edema se redujo otro 7,11%. Por lo tanto, el DLM puede ofrecer efectos beneficiosos cuando se agrega al vendaje de compresión.
El examen más minucioso de este resultado mostró que este efecto beneficioso significativo de reducción se observó en las pacientes con linfedema leve a moderado en comparación con las participantes con linfedema moderado a grave. Por lo tanto, los resultados indican que las pacientes con LRCM leve a moderado son las que se pueden beneficiar de agregar el DLM al tratamiento intensivo con vendaje de compresión. Este hallazgo, sin embargo, debe ser confirmado mediante investigaciones adicionales.
Cuando a las pacientes se les proporcionó una manga estándar elástica de compresión más DLM y se compararon con las pacientes que recibieron una manga estándar de compresión más un tratamiento sin DLM, los resultados fueron mixtos (a veces favorecieron al DLM y a veces no favorecieron a tratamiento alguno).
El seguimiento al año indica que una vez que el edema se redujo, fue probable que las participantes mantuvieran la reducción del edema con el uso de una manga hecha a la medida.
El DLM es seguro y bien tolerado.
Los resultados fueron contradictorios para la función (amplitud de movimiento); un ensayo que muestra efectos beneficiosos y el otro no. Dos ensayos midieron la calidad de vida, pero ningún ensayo presentó resultados que compararan el grupo de tratamiento con control, de manera que los resultados no son concluyentes.
Ningún ensayo midió el coste de la atención.
Calidad de la evidencia
Los ensayos fueron pequeños y variaron entre 24 y 45 participantes. En su mayoría los ensayos parecieron asignar al azar a las participantes de forma adecuada. Sin embargo, en cuatro ensayos la persona que midió el edema sabía qué tratamiento recibían las participantes, lo que pudo haber sesgado los resultados.
Conclusiones de los autores
Antecedentes
Descripción de la afección
Más de una de cada cinco pacientes con cáncer de mama desarrollará linfedema relacionado con el cáncer de mama (LRCM) (DiSipio 2013; Paskett 2012). El LRCM es una acumulación anormal de linfa en los tejidos del lado del cuerpo afectado después del tratamiento del cáncer de mama como resultado de los procedimientos quirúrgicos o la radioterapia. La cirugía por cáncer de mama puede causar linfedema mediante varios mecanismos: la extracción quirúrgica de las estructuras linfáticas como los ganglios y los vasos puede deteriorar la capacidad de transporte linfático. La cicatrización quirúrgica puede disminuir el transporte linfático por la oclusión de los vasos linfáticos o la pérdida de elasticidad en los vasos linfáticos. La extracción o daño quirúrgico del tejido muscular puede disminuir la fuerza compresiva del músculo sobre los vasos linfáticos y deteriorar la "bomba muscular" (Ridner 2013). La radioterapia también puede provocar LRCM mediante varios mecanismos que incluyen el daño tisular directo, el daño a los ganglios o la cicatrización y la fibrosis, ya que todos reducen la capacidad de carga linfática (Ahmed 2011; Kwan 2010).
Aunque cambios recientes en el diagnóstico y el tratamiento del cáncer de mama (como la biopsia del ganglio centinela, los cambios en la radioterapia y técnicas quirúrgicas menos invasivas debido a un diagnóstico precoz) han reducido el riesgo de LRCM, el LRCM todavía es un problema importante en las pacientes con cáncer de mama. Las tasas de prevalencia a los seis meses, para seis meses cualquiera dentro de una ventana de tres años, se han calculado del 23% al 29% (Paskett 2007). Las tasas de incidencia prospectivas de LRCM varían del 20% al 40% en los tres primeros años después de la cirugía por cáncer de mama (Armer 2009; Clark 2005; Geller 2003). Las tasas de incidencia varían según el tipo de tratamiento para el cáncer de mama recibido, y las pacientes que reciben radiación axilar y resección de los ganglios linfáticos axilares muestra la incidencia más alta (Shah 2012).
Los factores de riesgo del LRCM incluyen mayor estadio del cáncer de mama, mayor número de ganglios linfáticos extraídos, obesidad, estado funcional más deficiente, haber recibido quimioterapia o radioterapia adyuvantes (Helyer 2010; Miaskowski 2013) y ciertos genes (Miaskowski 2013). Ejercicios como el entrenamiento de fuerza se han asociado con un riesgo menor de LRCM(Park 2008; Swenson 2009).
El LRCM puede afectar al brazo, la mano, los dedos, la muñeca, al codo, al hombro, al cuello, a la mama, al tórax o cualquier combinación de estas áreas. El LRCM del brazo es el más ampliamente estudiado y se clasifica según el exceso de volumen del brazo afectado en comparación con el brazo no afectado. Una clasificación frecuente del brazo es leve (exceso de volumen < 20%), moderado (exceso de volumen del 20% al 40%) y grave (exceso de volumen > 40%) (Partsch 2010). A menudo el LRCM del brazo no se diagnostica hasta que la misma paciente nota signos sutiles de edema como imposibilidad de utilizar anillos o relojes, o presenta síntomas como malestar, pesadez u opresión en el miembro o la región. En algunos casos la piel puede parecer brillosa, las venas pueden ser menos visibles y el tejido se puede sentir más firme de lo normal.
El LRCM del tronco (tórax, axila, hombro, mama o espalda superior) no se ha documentado tan bien como el LRCM del brazo (Brennan 1996) pero también se asocia con secuelas físicas y psicológicas. El LRCM del tronco se puede evaluar con calibradores del pliegue cutáneo, la constante dieléctrica tisular, la medición ultrasónica del espesor de la piel o la bioimpedancia. Sin embargo, la observación visual es aún la evaluación más práctica del linfedema del tronco: por ejemplo, la asimetría, las huellas de los tirantes del sujetador y de las costuras, el fenómeno de la piel de naranja, los cambios en el color de la piel, la palpación de la textura tisular y los pliegues cutáneos entre el lado afectado y no afectado. El LRCM del tronco se puede presentar con o sin LRCM del brazo y viceversa (Ridner 2010b).
Además de la acumulación excesiva de líquido, el LRCM puede provocar discapacidad considerable, dolor (Brennan 1996), limitación del movimiento, pesadez, adormecimiento, morbilidad psicosocial (Mirolo 1995; Passik 1998), y disminución de la calidad de vida (Brennan 1992; Tobin 1993). De no tratarse, el LRCM puede progresar y la piel sobre la zona afectada puede perder la elasticidad y la paciente ser propensa a infecciones repetidas y fibrosis (Petrek 1998). Sin embargo, la detección y el tratamiento tempranos del LRCM pueden reducir el edema linfático y mantener esa reducción con el transcurso del tiempo (Hayes 2012). Por lo tanto, es importante alterar la progresión de esta afección potencialmente incapacitante mediante la intervención eficaz temprana.
Descripción de la intervención
El drenaje linfático manual (DLM) es un tratamiento ligero pero muy específico que se realiza con las manos, diseñado para reducir el edema linfático al mejorar el drenaje linfático. Los terapeutas que realizan el DLM se adiestran en la anatomía y la fisiología del sistema linfático para facilitar el drenaje linfático de los vasos. A veces el DLM se administra solo, pero a menudo se administra como parte de un tratamiento conservador cuádruple conocido como tratamiento descongestivo complejo (TDC). Los cuatro componentes del TDC son DLM, tratamiento de compresión, ejercicios que reducen la linfa y cuidado de la piel.
El TDC es el tratamiento más frecuente para muchos tipos de linfedema e incluye dos fases. En la Fase 1, que dura dos a cuatro semanas, el objetivo es reducir el edema a través del DLM y el vendaje de compresión. El terapeuta también instruye a la paciente en buenas prácticas de cuidado de la piel para asegurar que la piel permanezca saludable y libre de infección y prescribe ejercicios especializados para reducir la linfa. Las modificaciones del TDC pueden incluir el reemplazo del vendaje de compresión con una manga de compresión (Cohen 1998).
En la Fase 2, después que se reduce suficientemente el volumen del miembro, a la paciente se le ajusta una ropa compresiva(Foldi 1998). En la Fase 2, el objetivo es mantener las reducciones del volumen logradas en la Fase 1 mediante el tratamiento compresivo autoadministrado, los ejercicios que reducen la linfa y el autodrenaje linfático. En general el DLM no se prescribe en la Fase 2 a menos que se necesite; sin embargo, hay pruebas que indican que muchas participantes continúan el DLM de mantenimiento además del automasaje (Ridner 2010a; Ridner 2012). Además, la paciente continúa el cuidado de la piel.
Para esta revisión, el "tratamiento de compresión" se utiliza para describir la parte de compresión del tratamiento del linfedema, ya sea mediante vendaje, manga o ropa a la medida. Muchos estudios han mostrado que la parte del tratamiento de compresión del TDC, que generalmente comienza con el vendaje de compresión y más tarde continúa con una manga de compresión, puede reducir eficazmente el edema. El TDC se utiliza indistintamente en la bibliografía médica con fisioterapia descongestiva completa o tratamiento linfático descongestivo.
De qué manera podría funcionar la intervención
En condiciones normales, la circulación del cuerpo da lugar al intercambio de líquido en el lado arterial de los capilares hacia el espacio intersticial. La mayoría de este líquido intersticial se devuelve a la circulación por los terminales venosos de los capilares. El líquido intersticial restante, junto con las moléculas proteicas, las bacterias, los virus y los productos de desecho son recogidos por los vasos linfáticos pequeños y se convierten en líquido linfático (Ridner 2013). La investigación de Levick 2010 indica que el equilibrio del líquido tisular depende en gran medida de la función linfática en la mayoría de los tejidos.
El líquido linfático pasa a los vasos linfáticos más grandes y con el tiempo regresa a la circulación venosa (Lawenda 2009). El líquido linfático no es "bombeado" a través del cuerpo mediante una bomba central como el corazón; en su lugar, se mueve mediante las contracciones rítmicas de las paredes musculares de los linfangiones, que son porciones segmentadas de los vasos linfáticos separadas por una válvula a ambos lados. Las contracciones secuenciales de segmento a segmento de los linfangiones están bajo el control del sistema nervioso autonómico, pero pueden aumentar por estímulos externos sobre el sistema linfático como la compresión de los músculos circundantes y las estructuras filamentosas de apoyo o la pulsación arterial local. Cuando el sistema linfático se daña, se puede comprometer el drenaje del líquido intersticial. La estasis linfática resultante causa la acumulación de líquido intersticial, afección conocida como "linfedema".
El DLM es un tipo de tratamiento especializado realizado con las manos basado en la anatomía del sistema linfático. Se considera que funciona al mejorar el movimiento de la linfa, disminuir el líquido intersticial y disminuir la fibrosis (Moseley 2007). Se ha propuesto que el DLM puede "ayudar a la naturaleza" al estimular las contracciones peristálticas naturales de los linfangiones(Mislin 1961). Por lo tanto, el DLM reduce el edema al estimular el bombeo de los linfangiones, reducir la resistencia hidrostática al flujo linfático y redireccionar completamente la linfa lejos de las áreas de estasis y hacia los vasos linfáticos viables (Leduc 1998). La capacidad del DLM para reducir el edema linfático ha sido bien demostrada (Williams 2010; Williams 2002).
Como el DLM se utiliza con frecuencia como parte del TDC, los otros tres componentes del TDC se describen brevemente a continuación.
El tratamiento de compresión ayuda a reducir el líquido intersticial al disminuir su formación y evitar que la linfa regrese al espacio intersticial (Moseley 2007). La compresión también ayuda a la acción de bombeo de los músculos al crear una resistencia contra la cual los músculos pueden trabajar. A lo anterior se le llama efecto de la "bomba muscular". El tratamiento de compresión en Fase 1 se realiza generalmente mediante vendaje de compresión multicapas, que consiste en gasa para envolver los dedos y la mano, una manga envolvente que protege la piel, envoltura de algodón o espuma de alta densidad suaves y dos a tres capas de vendaje de poca elasticidad. Las vendas de elasticidad limitada se utilizan para que según se mueva el miembro, los músculos se contraigan contra la resistencia de las vendas no elásticas. Las diferentes variaciones en las presiones del vendaje inferior pueden mejorar la función linfática y venosa. El tratamiento de compresión en la Fase 2 del TDC está diseñado para mantener las reducciones de volumen de la primera fase y se puede lograr con el uso de una manga de compresión o una ropa a la medida, con o sin un guante o con un guante de puño alto que se utiliza durante el día. En algunos casos durante la noche se utilizan vendas de compresión.
El objetivo de los ejercicios que reducen la linfa es específicamente promover el flujo linfático y reducir el edema. Estos ejercicios incluyen "movimientos activos, repetitivos, sin resistencia de la parte corporal interesada" y "son similares a algunos movimientos de baja repercusión de Tai Chi y Qigong" y siempre se realizan "con compresión de la extremidad afectada" (NLN 2011). La compresión permite que los músculos se contraigan contra la resistencia, lo que crea una "bomba muscular" más eficaz que mejora el retorno linfático y venoso. Los ejemplos de ejercicios que reducen la linfa están disponibles en la web (Zuther 2011a).
Cuidado de la piel. Las pacientes con LRCM tienen mayor riesgo de infección de la piel porque el edema del LRCM estira la piel lo que da lugar a un aumento en el riesgo de lesión. Además, el alto contenido de proteínas del líquido linfático sirve de medio en el cual las bacterias pueden prosperar y causar una infección de la piel conocida como celulitis. La celulitis se puede diseminar a los tejidos más profundos o sistémicamente a través del cuerpo. Por lo tanto, con la educación del cuidado de la piel las participantes aprenden cómo mantener la piel flexible y protegida de lesiones y desgarros, y cómo y por qué utilizar cremas o lociones con pH neutral y jabones con pH bajo para evitar la colonización bacteriana.
Por qué es importante realizar esta revisión
las pacientes con LRCM tienen costos médicos de $14 887 a $23 167 mayores que las pacientes con cáncer de mama sin LRCM. Los costos indirectos (p.ej. días de trabajo perdidos) también son mayores para el LRCM (Shih 2009). La detección y el tratamiento tempranos pueden reducir los costos generales al mantener los miembros afectados en volúmenes mínimos (Stout 2012b) y tratar otras comorbilidades antes de que se vuelvan crónicas (Hayes 2012). Por lo tanto, las intervenciones tempranas y eficaces en función de los costos son importantes.
El DLM generalmente se considera dentro del contexto del TDC y es necesario evaluar su contribución relativa al TDC. El TDC se reconoce como el tratamiento de elección por "la International Society of Lymphology (ISL), la National Lymphedema Network (NLN), la Lymphology Association of North America (LANA), el American Lymphedema Framework Project (ALFP), y la North American Lymphedema Education Association (NALEA)" (Zuther 2011a). Las guías de práctica (Harris 2012), revisiones (Brennan 1996; Kligman 2004; Megans 1998; Rockson 1998), y una declaración de consenso (Bernas 2001) también recomiendan el TDC como el tratamiento de elección para el LRCM.
Sin embargo, una encuesta realizada a médicos (Kärki 2009) muestra que, aunque el DLM teóricamente se proporciona como parte del TDC en realidad el DLM se administra sin tratamiento de compresión. Por lo tanto, es necesario evaluar el DLM dentro del contexto del TDC y como una forma de tratamiento independiente.
Las revisiones sistemáticas que examinan el DLM para el LRCM presentan resultados contradictorios que varían desde ningún efecto beneficioso (Huang 2013), un efecto beneficioso pequeño (McNeely 2011), un efecto beneficioso significativo (Moseley 2007) hasta un efecto beneficioso no concluyente (Devoogdt 2010). Esta revisión es la primera en utilizar principalmente datos de pacientes individuales para calcular los resultados primarios faltantes o sin informar y, por lo tanto, explorar los resultados contradictorios actuales de las revisiones presentes.
También es importante evaluar si hay ciertos grupos de participantes que pueden responder al DLM. McNeely 2004, por ejemplo, observó que las participantes con LRCM leve ( exceso de volumen del 15% al inicio) o temprano (< 12 meses de duración del LRCM) parecieron beneficiarse más del DLM que las pacientes con LRCM moderado / grave o con una duración de 12 meses o más. Este hallazgo requiere más investigación. Esta revisión es la primera en utilizar los datos disponibles de pacientes individuales para explorar de forma adicional los posibles subgrupos que responden al tratamiento.
Objetivos
Evaluar la eficacia y la seguridad del drenaje linfático manual (DLM) para tratar el linfedema relacionado con el cáncer de mama (LRCM).
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron ensayos controlados aleatorios o cuasialeatorios (p.ej., asignación alterna, por fecha de nacimiento, etc.) en cualquier idioma.
Tipos de participantes
Se incluyeron participantes diagnosticadas con LRCM en cualquier área corporal (es decir, brazo, mano, tronco).
El diagnóstico del LRCM del brazo se ha definido como cualquiera de los siguientes. En comparación con el brazo no afectado, el brazo afectado presentaba (1) un aumento de 2 cm o más en cualquier punto en una medida de la circunferencia del brazo, o (2) un aumento de 200 ml o más en una medida de desplazamiento de agua, o (3) un exceso de volumen del 10% o más. Si se utilizó como resultado la bioimpedancia o la constante dieléctrica tisular, se aceptaron los criterios para el LRCM definidos por los autores. Las definiciones del LRCM del tronco son menos claras en la bibliografía médica y, por lo tanto, se aceptaron las definiciones especificadas por los autores de los ensayos.
Tipos de intervenciones
Se incluyeron los ensayos que administraron DLM a un grupo y no al otro y, por lo tanto, pudieron evaluarse.
Tipos de medida de resultado
Resultados primarios
Se seleccionaron los resultados volumétricos primarios porque todos consideran el volumen del miembro no afectado en las fórmulas.
(1) Cambios volumétricos en el brazo, la mano, la mama o el tronco
Para el brazo, el volumen se podía medir de cualquiera de las siguientes maneras y todas incluyeron una comparación con el lado no afectado.
-
‐ definido como la cantidad excesiva de líquido que queda en el brazo después del tratamiento, calculado como el volumen en ml del brazo afectado después del tratamiento menos el volumen del brazo no afectado después del tratamiento.
-
Reducción del v ‐ definido como la cantidad de reducción de líquido en ml desde antes hasta después del tratamiento, calculada como el volumen del LE pretratamiento del brazo afectado menos el volumen del LE después del tratamiento del brazo afectado.
-
‐ la proporción de reducción de líquido con respecto al exceso de volumen inicial, calculada como la reducción del volumen dividida por el volumen del linfedema inicial multiplicado por 100.
Para obtener explicaciones adicionales de estos términos ver Tabla 1.
El cambio también se podía medir mediante el espesor de la piel, la bioimpedancia o la constante dieléctrica tisular.
(2) Eventos adversos
Resultados secundarios
(1) Medidas funcionales
-
Amplitud de movimiento
-
Fuerza
(2) Sensaciones subjetivas
(3) Calidad de vida y otros resultados psicosociales
(4) Coste de la atención
(5) Otros resultados informados por el ensayo
Results
Description of studies
Results of the search
One thousand, one‐hundred and ten records were retrieved through the search strategies and other handsearched sources. After removing duplicates, we had 834 records. Although we did fairly extensive searching of gray literature, we did not find any trial that did not also appear in at least one electronic database. Of the 834 records remaining after duplicate removal, we excluded 805 based on the information in the title and/or abstract, primarily because they did not represent original research but rather pertained to the management of lymphedema in general, instructions for manual lymphatic drainage (MLD), or benefits of MLD in general terms. Of those abstracts that did present original research, our major reasons for excluding them were either that the study participants were not exclusively breast cancer‐related lymphedema participants; there was no control group; or interventions were given other than MLD. Refer to the Characteristics of excluded studies section.
We retrieved the full papers for the remaining 29 citations. After full‐text review, we excluded 23 papers and these are listed with the reasons in the Characteristics of excluded studies. Six trials met the inclusion criteria (Andersen 2000; Johansson 1998; Johansson 1999; McNeely 2004; Sitzia 2002; Williams 2002). Refer to Figure 1.

Study flow diagram for review.
Included studies
There were six included studies: Andersen 2000; Johansson 1998; Johansson 1999; McNeely 2004; Sitzia 2002; Williams 2002. The Characteristics of included studies table shows the most important characteristics of these included trials. All trials were in English although country of trial varied: Canada (McNeely 2004), Denmark (Andersen 2000), Sweden (Johansson 1998; Johansson 1999 ), and United Kingdom (Sitzia 2002; Williams 2002).
Interventions used in the trials
All trials combined MLD with some form of compression therapy. MLD was not given as a stand‐alone treatment in any of the trials, and complex decongestive therapy (CDT) was not given as the baseline intervention in any of the trials.
Trials fell into three categories.
(1) MLD + standard physiotherapy versus standard physiotherapy
One trial assessed standard physiotherapy (compression therapy, lymph‐reducing exercises (LREs), skin care), with or without MLD (Andersen 2000). Compression therapy was a two‐stage process: For the first couple of weeks, participants used decreasing sizes of Jobst compression garments to reduce the edema, then they were fitted for a custom‐made sleeve‐and‐glove garment.
(2) MLD + compression bandaging versus compression bandaging
Two trials assessed the effectiveness of MLD as an adjunct to compression bandaging (Johansson 1999; McNeely 2004). Thus, baseline compression bandaging was given to both groups, and MLD was given to one group and not the other.
(3) MLD + compression therapy versus nonMLD treatment + compression therapy
Three trials (Johansson 1998; Sitzia 2002; Williams 2002) assessed MLD compared with another active treatment. Thus, baseline compression therapy was given to both groups. MLD was given to one group and a different nonMLD treatment added to the control group. The nonMLD treatment for the control group was intermittent sequential pneumatic pump in one trial (Johansson 1998) and simple lymphatic drainage in the other two trials (Sitzia 2002; Williams 2002). Simple lymphatic drainage can be administered by a therapist or by the patient, herself, because it is designed to facilitate lymphatic movement in the areas of the body by focusing on areas that the patient can reach. Therefore, the back is not treated in simple lymphatic drainage, but the chest and axilla are. In one trial (Williams 2002), the patient performed the simple lymphatic drainage, and in the other simple lymphatic drainage trial (Sitzia 2002), the therapist performed simple lymphatic drainage.
Timing of addition of MLD
In four trials, compression therapy was given concurrently with MLD (Andersen 2000; McNeely 2004; Sitzia 2002; Williams 2002) while in two trials (Johansson 1998; Johansson 1999), compression therapy was administered two weeks prior to MLD, and then in the third week, MLD was added to compression therapy.
Types of baseline interventions
CDT was not given in any trial. Five trials gave compression therapy (Johansson 1998; Johansson 1999; McNeely 2004; Sitzia 2002; Williams 2002); one trial gave standard therapy: compression sleeve, lymphedema exercises and skin care to both groups, with or without MLD (Andersen 2000). No trial assessed MLD as a stand‐alone intervention.
Types of baseline compression therapy
Type of baseline compression therapy given to both treatment and control groups varied among trials. Three trials used compression bandaging (Johansson 1999; McNeely 2004; Sitzia 2002); three trials used compression sleeves (Andersen 2000; Johansson 1998; Williams 2002).
Outcomes reported
All trials assessed arm volume reduction as the primary outcome (either as a per cent reduction, lymphedema volume, or volume reduction). Only one trial also assessed truncal lymphedema (Williams 2002).
Trial designs
All trials were parallel‐group designs with the exception of one cross‐over trial (Williams 2002) for which we used only first‐cycle data. Andersen 2000 permitted those in the control group to optionally cross‐over at three months, so that if they desired, they could get MLD during the maintenance phase.
Follow‐up and sample size
Follow‐up times were presented immediately post‐treatment for all trials except one (Andersen 2000), and that trial followed up for one year. All trials assessed Phase 1 (decongestion phase), and only one (Andersen 2000) also assessed Phase 2 (maintenance phase).
Trials were small with a median of 35 total participants per trial (range 24 to 45) and a total of 208 participants. We were able to obtain individual patient data from four trials for subgroup analyses (Johansson 1998; Johansson 1999; McNeely 2004; Williams 2002). Only one trial (Andersen 2000) had more than one publication.
Excluded studies
Studies were excluded if they used a non‐manual form (i.e., electronic) of lymphatic drainage in place of MLD, if they used a different type of massage instead of MLD, if they used MLD in both groups (thereby making it impossible to distinguish the relative effect of MLD), if they altered more than the MLD component of CDT (thereby making it impossible to distinguish the relative effect of MLD), or if they addressed prevention rather than treatment of BCRL. The Characteristics of excluded studies table lists the studies we excluded as well as the reason for exclusion.
Risk of bias in included studies
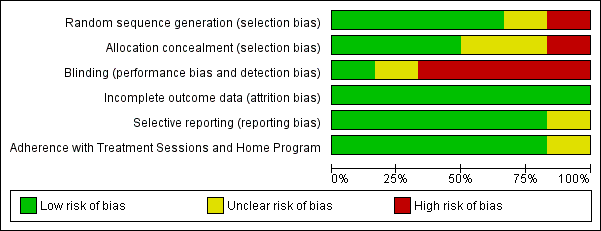
Methodological quality varied among studies (Figure 2).

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Allocation
Random sequence generation
We included one quasi‐randomized trial, Johansson 1999 (random sequence generation via alternate assignment, medical record number) that was judged as high risk of bias on this domain. Four trials received a low risk of bias score on randomization: Johansson 1998 (shuffled cards), McNeely 2004, Sitzia 2002 (used a computerized randomization program), and Williams 2002 (used a random number table), while one trial (Andersen 2000) received an 'unclear' risk of bias judgement because although randomization was stated, details were lacking. Because we included one quasi‐randomized trials, we paid special attention to the reported baseline demographic and medical characteristics of participants in the two groups. In all trials, the baseline information appeared comparable between the two groups.
Allocation concealment
Three trials received low risk of bias ratings for allocation concealment: Johansson 1998 used sequentially numbered opaque envelopes; McNeely 2004 clearly stated "allocation sequence was concealed from research personnel involved in screening, scheduling and enrolling participants"; and Williams 2002 called a centralized office for the next group assignment. One trial (Johansson 1999), received a high‐risk‐of‐bias score for using alternate assignment, and two trials (Andersen 2000; Sitzia 2002) received an 'unclear' rating because although randomization was stated, details of allocation concealment were lacking.
Blinding
Blinding of participants
MLD and CDT are highly physical, intensive interventions. It is impossible to blind participants to the treatment group assignment. Patient blinding would have only been possible had there been a sham MLD treatment compared with a real treatment, and no trial used that design. Therefore, none of the trials (Andersen 2000; Johansson 1998; Johansson 1999; McNeely 2004; Sitzia 2002; Williams 2002) reported patient blinding. However, inability to blind participants and the potential for performance bias, is most important in trials in which the primary outcome is a subjective self‐report (Manheimer 2011; Wood 2008). The primary outcome in these trials was volume change, which is an objective outcome measured by an outcomes assessor and is not a subjective self‐report. Measures of function, such as range of motion and strength are also objective measures assessed by an outcomes assessor. Thus, for these outcomes, we do not consider performance bias to be a major concern.
However, the lack of patient blinding could present a concern in subjective self‐reported outcomes (i.e., sensations of pain, heaviness, tension), quality of life, or other self‐reported psychosocial outcomes such as body image. Trials where there is a therapist‐administered intervention in one group, but not in the other may be especially prone to biasing subjective outcomes because the therapist's touch, time, and attention can provide powerful nonspecific effects.
Blinding of outcomes assessor
Both limb volume and functional outcomes of range of motion and strength are objective outcomes assessed by a person other than the patient. Therefore, it is important that the assessor be blinded to the treatment group assignment. Four trials (Johansson 1998; Johansson 1999; Sitzia 2002; Williams 2002) did not blind the outcomes assessor and were therefore judged as having a high‐risk of bias; one trial (McNeely 2004) clearly blinded the outcomes assessor, and one trial (Andersen 2000) was unclear from the publication, and the author could not be contacted.
Incomplete outcome data
The number of dropouts and withdrawals was low. Generally, reasons were described for dropouts that were unrelated to the treatment. When it was treatment‐related, it was due to the irritation of compression therapy. No attrition was mentioned related to MLD. Therefore, attrition bias (either from large dropout rates or differential dropouts) is not believed to be a major concern and all included studies (Andersen 2000; Johansson 1998; Johansson 1999; McNeely 2004; Sitzia 2002; Williams 2002 ) were judged as having a low risk of bias for this domain.
Selective reporting
Selective outcomes reporting also was not likely to be a problem in this set of studies as most studies reported outcomes regardless of whether they were statistically significant or not, and all trials presented data on the main outcome of volumetric change. However, one trial (Andersen 2000) was assessed as unclear risk of bias because one outcome measure (the European Organisation for Research and Treatment of Cancer (EORTC)) was mentioned as having been measured, but results were not reported. The discrepancy between assessment and reporting, therefore, was the reason for this score.
Other potential sources of bias
We also considered adherence and treatment adequacy as potential sources of bias.
Adherence
Adherence with therapist‐administered treatments was high in five trials based on publication and/or confirmation from the authors (Johansson 1998; Johansson 1999; McNeely 2004; Sitzia 2002; Williams 2002) and unclear in one trial (Andersen 2000) based on insufficient reporting.
Home‐care regimens were part of two trials (Andersen 2000; Williams 2002). Home‐care regimens were self‐massage (Williams 2002) or lymph‐reducing exercises (Andersen 2000). These trials mentioned that participants kept diaries, and Williams 2002 provided adherence data that showed adherence to be high, and thus was rated a low risk of bias. Andersen 2000 reported that exercise adherence diaries were kept, but did not report diary results, and thus, was rated 'unclear.'
Only Andersen 2000 provided long‐term follow‐up results (i.e., Phase 2/maintenance phase) and noted that in this phase, adherence with compression sleeve was high and thus was rated low risk of bias.
MLD treatment adequacy
The lymphedema reviewers rated all MLD treatments as adequate; however, one reviewer mentioned concern that standard elastic compression sleeves in Phase 1 might not provide adequate volume reductions (Johansson 1998; Williams 2002). Another reviewer raised a concern about the pressure of the lymphatic pump in a control group (Johansson 1998).
Effects of interventions
MLD + standard physiotherapy versus standard physiotherapy
One trial, Andersen 2000, reported on this comparison. "Standard physiotherapy" in this trial had all four of the components of CDT; however, because compression bandages (considered an integral part of CDT) were not used, but rather other compression garments used instead, the intervention was not termed 'CDT'.
Primary outcomes
(1) Volumetric changes in arm, hand, breast or trunk
(a) lymphedema (LE) volume
No trials reported on this outcome.
(b) volume reduction
No trials reported on this outcome.
(c) per cent reduction
Andersen 2000 reported there were no significant between‐groups differences at the end of phase I (P = 0.66), so the authors combined the data from both groups and reported an overall statistically significant 43% reduction from baseline (P ≤ 0.001).
Phase II (maintenance phase): This was the only trial to present maintenance phase follow‐up results: At three‐month follow‐up, there was no statistically significant between‐groups difference: 60% (95% confidence interval (CI): 43% to 78%) reduction in standard physiotherapy group; 48% (95% CI: 32% to 65%) in standard physiotherapy plus MLD. At 12‐month follow‐up, data were combined for both groups and showed an overall 66% reduction from baseline (P ≤ 0.001).The authors note, "The results of treatment depend on compliance of the participants, assessed by their use of the compression garment."
(2) Adverse events
There were two dropouts, and neither dropped out due to an adverse event from MLD. One had a recurrence and one was less than four months post‐treatment. No infections were reported for either group.
Secondary outcomes
(1) Functional measures
Range of motion was assessed by Andersen 2000 as flexion/extension and abduction/adduction and the authors reported there were no between‐groups differences, but significant within‐groups improvements in both groups. Data in numeric form were not presented in the paper.
(2) Subjective sensations
Andersen 2000 found no between‐groups differences, but significant within‐groups improvements for both groups for subjective sensations of pain and heaviness. Data in numeric form were not presented in the paper.
(3) Quality of life and other psychosocial outcomes
Andersen 2000 reported measuring quality of life using the EORTC (European Organization for Research and Treatment of Cancer) but did not report the results.
(4) Cost of care
Cost of care was not reported.
(5) Any other outcome reported by the trial
Subjective outcomes: Andersen 2000 found no between‐groups differences, but significant within‐groups improvements for both groups for other subjective outcomes of aching and discomfort.
MLD + compression bandaging versus compression bandaging
Two trials reported on this comparison: Johansson 1999 and McNeely 2004.
Primary outcomes
(1) Volumetric changes in arm, hand, breast or trunk
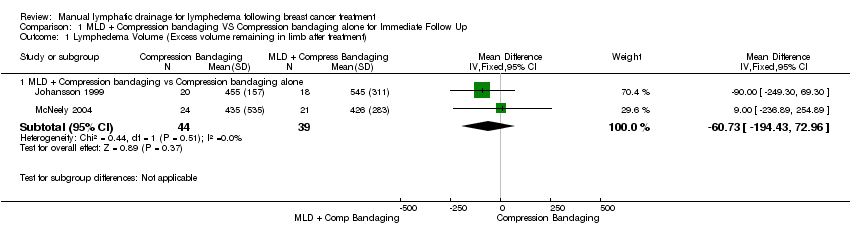
(a) lymphedema (LE) volume
At immediate post‐treatment follow‐up, there were no significant between‐groups differences in lymphedema volume in mL either for individual or two pooled trials (mean difference (MD) ‐60.73 mL, 95% CI ‐194.43 mL to 72.96 mL; P = 0.37; 2 trials; 83 participants). See Figure 3 (Analysis 1.1).

Forest plot of comparison: 1 MLD + Compression bandaging VS Compression bandaging alone for Immediate Follow Up, outcome: 1.1 Lymphedema Volume (Excess volume remaining in limb after treatment).
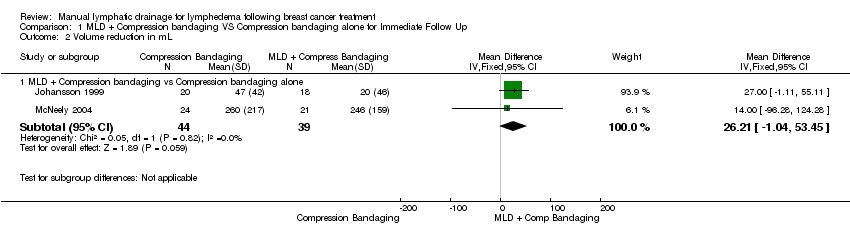
(b) volume reduction
At immediate post‐treatment follow‐up, two pooled trials showed borderline significance favoring MLD (MD 26.21 mL, 95% CI ‐1.04 mL to 53.45 mL; P = 0.06; 2 trials; 83 participants). See Figure 4 (Analysis 1.2).
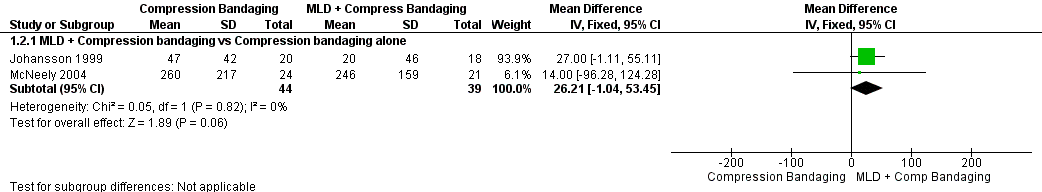
Forest plot of comparison: 1 MLD + Compression bandaging VS Compression bandaging alone for Immediate Follow Up, outcome: 1.2 Volume reduction in mL.
(c) per cent reduction
At immediate post‐treatment follow‐up, two pooled trials showed a 7.11% additional per cent reduction for the MLD group than the compression bandaging group (MD 7.11%, 95% CI 1.75% to 12.47%; P = 0.009; 2 trials; 83 participants). See Figure 5 (Analysis 1.3).
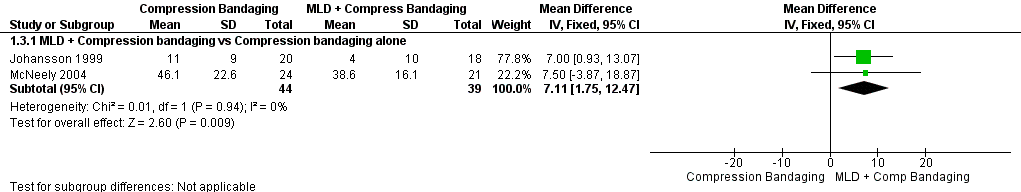
Forest plot of comparison: 1 MLD + Compression bandaging VS Compression bandaging alone for Immediate Follow Up, outcome: 1.3 Per cent change.
(2) Adverse events
Adverse events were reported in only one trial (McNeely 2004). Adverse events for two participants were their reason for dropping out. One patient had a skin reaction to bandaging, and another patient had elbow discomfort from bandaging. No adverse events were reported from MLD. No infections were reported. Contact with the trial authors (Johansson 1999; McNeely 2004) stated that infections were not a problem in the trial in either group.
Secondary outcomes
(1) Functional measures
Neither trial assessed range of motion or strength.
(2) Subjective sensations
Only one trial, Johansson 1999, assessed the following subjective symptoms and reported the following results in the paper.
-
Pain: significant within‐groups reductions were noted for both groups, but no between‐groups differences were found (Johansson 1999).
-
Heaviness: significant within‐groups reductions were noted for both groups, but no between‐groups differences were found (Johansson 1999).
-
Tension: significant within‐groups reductions were noted for both groups, but no between‐groups differences were found (Johansson 1999).
(3) Quality of life and other psychosocial outcomes
Neither trial reported on this outcome.
(4) Cost of care
Neither trial examined cost of care.
(5) Any other outcome reported by the trial
No other outcomes were reported.
MLD + compression therapy versus non MLD treatment + compression therapy
Three trials fit this comparison category (Johansson 1998; Sitzia 2002; Williams 2002). One trial (Johansson 1998) measured volumetric change using water displacement, and two trials (Sitzia 2002; Williams 2002) used circumferential measurement. In all three trials, follow‐up times were immediate post‐treatment only. These trials used different active control groups; thus, the means and confidence intervals are provided in forest plots for individual trials separately according to comparison groups, and results were not pooled (Figure 6; Figure 7; Figure 8).

Forest plot of comparison: 2 MLD + Compression therapy vs Other treatment + Compression therapy, outcome: 2.1 Lymphedema volume (excess volume remaining in limb after treatment).
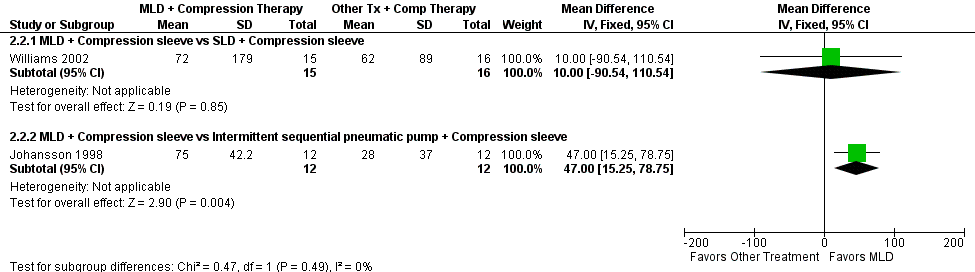
Forest plot of comparison: 2 MLD + Compression therapy vs Other treatment + Compression therapy, outcome: 2.2 Volume reduction in mL.

Forest plot of comparison: 2 MLD + Compression therapy vs Other treatment + Compression therapy, outcome: 2.3 Per cent change.
Primary outcomes
(1) Volumetric changes in arm, hand, breast or trunk
(a) lymphedema (LE) volume
Two trials measured LE volume (Johansson 1998; Williams 2002). In Williams 2002, MLD plus compression sleeve significantly reduced LE volume compared to simple lymphatic drainage plus compression sleeve (MD ‐230.00 mL, 95% CI ‐450.84 mL to ‐9.16 mL; P = 0.04; one trial; 31 participants). In Johansson 1998, there was no difference when comparing MLD plus compression sleeve versus intermittent pneumatic pump plus compression sleeve (MD 122.00 mL, 95% CI ‐57.59 mL to 301.59 mL; P = 0.18; one trial; 24 participants). One trial measured trunk LE (Williams 2002), but between‐groups differences were not reported. It was only reported that the MLD group had statistically significantly greater within‐groups reduction in trunk LE than did the control group of simple lymphatic drainage done by the patient. See Figure 6 (Analysis 2.1).
(b) volume reduction
Of the two trials with data that could be analyzed for this outcome (Johansson 1998; Williams 2002), MLD plus compression sleeve versus intermittent pneumatic pump plus compression sleeve Johansson 1998 showed a statistically significant benefit favoring the MLD intervention (MD 47.00 mL, 95% CI 15.25 mL to 78.75 mL; one trial; 24 participants) (Johansson 1998). The results for Williams 2002 were not significant (MD 10.00 mL, 95% CI ‐90.54 mL to 110.54 mL; P = 0.85; one trial; 31 participants). See Figure 7 (Analysis 2.2).
(c) per cent reduction
Of the three trials that reported on this outcome (Johansson 1998; Sitzia 2002; Williams 2002), there were no significant between‐groups differences for per cent reduction for any trial. Although in one trial, Johansson 1998, MLD compared with intermittent sequential pneumatic pump approached significance at P = 0.07 favoring MLD. The designs and results were as follows: Johansson 1998: MLD plus compression sleeve versus intermittent pneumatic pump plus compression sleeve (MD 8.00%, 95% CI ‐0.75% to 16.75%; P = 0.08; one trial; 24 participants); Sitzia 2002: MLD plus compression bandaging versus simple lymphatic drainage by therapist plus compression bandaging (MD 11.80%, 95% CI ‐2.47% to 26.07%; P = 0.10; one trial; 28 participants); Williams 2002: MLD plus compression sleeve versus simple lymphatic drainage by patient plus compression sleeve (MD ‐2.40%, 95% CI ‐14.11% to 9.31%; P = 0.69; one trial; 31 participants). See Figure 8 (Analysis 2.3).
(2) Adverse events
No trial reported adverse events. Infections were not reported in any trial, and contact with authors (Johansson 1998; Sitzia 2002; Williams 2002) stated infections were not a problem in either group, and there were no adverse events from MLD.
Secondary outcomes
(1) Functional measures
-
Range of motion: range of motion was measured in one trial (Johansson 1998) giving baseline compression sleeve to both groups and then adding MLD versus sequential pneumatic compression (SPC) pump. Five mobility measurements were taken: elbow flexion, shoulder flexion, shoulder abduction, shoulder inward and outward rotation. All five measures of the affected arm compared to the unaffected arm were statistically significantly diminished at baseline, but authors note, "Treatment with MLD or SPC did not change arm mobility." Numeric data were not provided in the paper.
-
Strength: strength was measured as four assessments: isometric muscle strength for shoulder flexion, abduction, adduction, and hand gripping force (Johansson 1998) and showed no between‐groups differences. Numeric data were not provided in the paper.
(2) Subjective sensations
-
Pain: there were no between‐groups differences on pain; however, Johansson 1998 noted that only a few people reported having pain. Williams 2002, reporting only within‐groups findings, stated that the MLD group was more likely than the self‐administered simple lymphatic drainage group to improve pain scores. Numeric data were not provided in the paper.
-
Heaviness: during the initial two weeks of therapy when both groups were given a baseline compression sleeve, Johansson 1998 reported a statistically significant improvement in heaviness compared to baseline. During the third week, when MLD was given to one group and SPC to the other, the authors state, "only the MLD group showed a further decrease of heaviness P = 0.008." However, there were no significant differences between the two groups. Williams 2002, reporting only within groups, stated that the MLD group was more likely than the self‐administered SLD group to improve heaviness scores. Numeric data were not provided in the papers.
-
Tension: during the initial two weeks of therapy when both groups were given a baseline compression sleeve, Johansson 1998 reported there was a statistically significant improvement in tension compared to baseline. During the third week, when MLD was given to one group and SPC to the other, the authors stated within groups results: "only the MLD group showed a further decrease of tension P=0.01." However, there were no between‐groups differences. Numeric data were not provided in the paper.
-
Discomfort and Fullness: within‐groups differences but not between‐groups differences were reported in Williams 2002. They reported that the MLD group was significantly more likely than the control group of self‐administered SLD to improve scores on discomfort and fullness.
(3) Quality of life and other psychosocial outcomes
One trial (Williams 2002) assessed quality of life using the EORTC QLQ‐C30 quality of life questionnaire and presented data only as within groups stating that the MLD group had improvement in emotional function on scales of worry, irritability, tension and depression. MLD also showed within‐groups improvement on dyspnea and reduced sleep disturbance. They further noted there were not corresponding within‐groups improvements for these measures in the simple lymphatic drainage group.
(4) Cost of care
No trial examined cost of care.
(5) Any other outcome reported by the trial
Dermal thickness: dermal thickness was measured using ultrasound in one trial (Williams 2002). The MLD group had significantly greater within‐groups reduction in dermal thickness than did the control group. Between‐groups differences were not reported.
Subgroup analyses
We obtained individual patient data for the two trials with designs MLD + compression bandaging versus compression bandaging alone (trial design: MLD + x versus x alone) (Johansson 1999; McNeely 2004).
When we applied McNeely's severity classifications (mild BCRL was defined as 15% or less excess volume), there was a statistically significant response favoring the addition of MLD to bandaging (P = 0.005) versus bandaging alone (MD 27.37%, 95 CI 8.23% to 48.51; 20 participants). Statistical significance was not noted in the moderate/severe group.
When we applied the more conservative estimate of mild BCRL (less than 20% excess volume at baseline), we similarly found an effect favoring MLD over compression bandaging alone (P = 0.02), (MD 16.40%, 95% CI 2.17% to 30.62%; 28 participants) that was not noted in the compared to moderate/severe LE.
When we explored a cut point of percentage excess volume at baseline for a group who may benefit from MLD, we found a statistically significant benefit favoring MLD for those with mild‐to‐moderate BCRL (less than 23% excess volume) (MD 12.09% 95% CI 0.15% to 24.04%; 36 participants) (P = 0.05), but not for moderate‐to‐severe BCRL. Higher cut points were not significant.
When we analyzed BCRL of shorter duration (less than 12 months) compared to longer duration (12 or more months), we did not find statistical significance favoring MLD (P = 0.10) in the shorter duration group, nor were the results significant at six or 18 months. At 24 months and through 110 months' duration, results favored MLD at each time point compared to compression bandaging alone.
We also obtained the data for two trials with designs MLD + compression sleeve versus nonMLD treatment + compression sleeve (trial design: MLD + x versus nonMLD + x) (Johansson 1998; Williams 2002). Using the same methods as above, we found no significant trends for either severity or duration.
Discusión
Resumen de los resultados principales
Se revisaron los resultados de seis ensayos clínicos que evaluaron la contribución relativa del drenaje linfático manual (DLM) en el tratamiento del linfedema relacionado con el cáncer de mama (LRCM). Se han examinado varios resultados que incluyen los resultados objetivos del linfedema (LE) cambios volumétricos y amplitud de movimiento, así como resultados subjetivos de dolor, tensión, pesadez y calidad de vida. Todos los ensayos agregaron algún tipo de tratamiento de compresión al DLM; ningún ensayo evaluó el DLM como un tratamiento independiente.
Cambios volumétricos en el linfedema del brazo, la mano, la mama o el tronco
Un ensayo (Andersen 2000) examinó la reducción porcentual al utilizar la fisioterapia estándar con / sin DLM y no encontró diferencias entre los grupos, así como una reducción general del 43% a partir del valor inicial en los dos grupos combinados. Dos ensayos examinaron la reducción porcentual del linfedema con el uso de DLM y vendaje de compresión (Johansson 1999; McNeely 2004). El agregado de DLM al vendaje proporcionó una reducción porcentual adicional del 7,11% en comparación con el grupo control. La similitud en la reducción de volumen adicional entre los dos ensayos es sorprendente, ya que sus diseños fueron diferentes: McNeely 2004 proporcionó DLM en la primera semana y antes de cada sesión de vendaje de compresión, mientras que Johansson 1999 indicó dos semanas de vendaje de compresión solo a ambos grupos antes de proporcionar DLM más vendaje de compresión al grupo de tratamiento en la tercera semana. Se podría suponer que, debido a que las reducciones del volumen son mayores en la primera semana (Leduc 1998), el ensayo que proporcionó DLM en la tercera semana mostraría una contribución más pequeña del DLM. De hecho, el ensayo que proporcionó DLM en la tercera semana (Johansson 1999) mostró reducciones absolutas más pequeñas que el ensayo que proporcionó DLM durante todo el período de intervención de cuatro semanas (McNeely 2004), pero las reducciones relativas fueron iguales.
Hay tres explicaciones posibles para la similitud de las reducciones relativas: El azar, el sesgo o un resultado verdadero. Si los resultados se deben al azar entonces es muy probable que los intentos futuros de repetir estos resultados muestren un resultado diferente. Si los resultados se deben al sesgo puede ser que, como Oremus 2012 ha indicado, diseños de calidad inferior en el LE tienden a producir efectos más grandes. Por lo tanto, el diseño cuasialeatorio que administró DLM en la tercera semana(Johansson 1999) puede haber sobrestimado los efectos. Si los resultados se deben a un resultado verdadero entonces la reducción del 7,11% en ambos ensayos puede representar que una porción del líquido linfático, aunque pequeña, es más propicia a movilizarse con el DLM que mediante el vendaje de compresión. También puede ser que el miembro puede ser más propicio a un mejor drenaje linfático una vez que se ha logrado la reducción inicial del miembro con tratamiento de compresión. El I2 = 0 que muestra que no hay heterogeneidad estadística entre los dos ensayos da credibilidad a la idea de que, aunque los ensayos utilizaron diseños diferentes, en realidad son muy similares. Con cualquiera de los diseños el vendaje de compresión logró mayores reducciones del volumen que el DLM, lo que apoya la idea habitualmente aceptada de que el DLM se debe considerar dentro del contexto del tratamiento de compresión (Lasinski 2013; Leduc 1998).
Los otros dos resultados volumétricos mostraron resultados mixtos: no hubo cambios significativos en el volumen del LE entre los grupos de tratamiento mientras que la reducción del volumen se acercó a la significación y favoreció al DLM. La falta de una diferencia significativa en el volumen del LE se puede deber a que las participantes que tuvieron mayores reducciones relativas (reducciones porcentuales) tuvieron un exceso de volumen inferior al comienzo (es decir, LRCM leve) y las medias grupales podrían haber estado influenciadas por unos pocos casos graves que ocultaron cualquier detección de un efecto beneficioso medio. También puede ser que las cantidades absolutas de reducción de líquido del DLM sean cantidades pequeñas y no se reflejen en el volumen del LE, que es una estimación de reducción absoluta en lugar de relativa.
Tres ensayos examinaron DLM más tratamiento de compresión versus tratamiento sin DLM y tratamiento de compresión (Johansson 1998; Sitzia 2002; Williams 2002) y fueron demasiado diferentes entre ellos para agruparse y los resultados variaron según el resultado volumétrico utilizado. También se han informado resultados inconsistentes dentro del mismo ensayo según el resultado volumétrico utilizado en un ensayo aleatorio reciente (Dayes 2013) lo que indica que es necesario realizar más estudios de investigación para determinar la medición volumétrica clínicamente más significativa. El trabajo de Ancukiewicz 2012 indica que los valores relativos son más confiables que los absolutos. También es necesario explorar otras tecnologías como la bioimpedancia y la constante dieléctrica tisular como resultados potencialmente significativos desde el punto de vista clínico.
Los ensayos que utilizaron mangas estándar como tratamiento de compresión inicial (Johansson 1998; Williams 2002) mostraron reducciones porcentuales más pequeñas que los que utilizaron vendaje de compresión o una ropa a la medida con manga y guante aplicados después que las mangas estándar sucesivas redujeron primero el volumen.
Análisis de subgrupos
Una pregunta surgida en esta revisión es si hay un subgrupo de participantes en las que el DLM podría ser más beneficioso. En particular, hay limitaciones para los análisis de subgrupos porque los números son pequeños y las pruebas múltiples pueden dar lugar a errores Tipo I (falso positivo). Por lo tanto, los análisis de subgrupos que encontraron que el LRCM leve a moderado (exceso de volumen inicial menor del 23%) se asoció con una respuesta significativa al DLM no deben tomarse como pruebas confirmatorias, sino que se deben probar en un ensayo controlado aleatorio. Dicho ensayo podría incluir solamente participantes con un exceso de volumen de hasta el 23% y estar diseñado para dilucidar la efectividad del componente DLM del tratamiento descongestivo complejo (TDC). Los resultados de los subgrupos son consistentes con estudios previos que muestran que el LRCM leve responde mejor al TDC en general que los casos moderados o graves (Didem 2005; Ramos 1999; Wozniewski 2001). McNeely 2004 observó previamente que las participantes con LRCM leve parecieron mostrar una mayor respuesta relativa al DLM e indicó un mecanismo de acción. En el LRCM leve, el sistema linfático estaría relativamente intacto y, por lo tanto, las pacientes mejoran más fácilmente. Por lo tanto, el DLM sería más capaz de estimular el flujo linfático y redireccionar completamente el flujo linfático por vías colaterales. Por el contrario, los miembros con edema más grave que aparentemente no responden al DLM, pueden presentar más daño secundario del sistema linfático y, por lo tanto, solamente responder al vendaje de compresión mediante la influencia en la presión microvascular. Los cambios tisulares en el edema más grave se caracterizan por más tejido graso y fibrosis, lo que probablemente provoca una respuesta más deficiente al tratamiento con DLM.
El hallazgo de un subgrupo evidente de pacientes que responden al tratamiento hace que surjan preguntas importantes acerca de cómo interpretar los resultados variados de los seis ensayos de esta revisión. Por ejemplo, Sitzia 2002, que utilizó vendaje de compresión inicial, no encontró efectos beneficiosos adicionales del DLM. Aunque este resultado se puede deber a una verdadera equivalencia de los dos tratamientos, también se puede deber a criterios de inclusión que excluyeron el LRCM leve. Una pregunta similar podría hacerse para Andersen 2000, que no encontró diferencias entre los grupos para la reducción porcentual cuando utilizó un diseño de atención estándar con / sin DLM e incluyó el LRCM con una gravedad de hasta el 30% de exceso de volumen inicial.
Los análisis de subgrupos de los dos ensayos (Johansson 1998; Williams 2002) que proporcionaron tratamiento activo al grupo control y utilizaron mangas de compresión en lugar de vendaje de compresión no mostraron una asociación entre el LRCM leve y la respuesta al DLM. La falta de un resultado significativo en los ensayos de manga puede indicar equivalencia de los tratamientos activos, poco poder estadístico o la posibilidad de que las mangas estándar quizás no pudieran descongestionar suficientemente las áreas con linfedema o retener las reducciones del volumen logradas por los tratamientos manuales en la Fase 1.
Otros resultados
El resultado funcional de amplitud de movimiento mostró resultados contradictorios debido a que de los dos ensayos que midieron la amplitud de movimiento; uno informó mejorías en ambos grupos (Andersen 2000), y el otro informó que no hubo mejorías en los grupos (Johansson 1998). El resultado funcional de la fuerza solamente se midió en un ensayo (Johansson 1998), sin mejorías en los grupos.
Las sensaciones subjetivas de dolor, pesadez u opresión estuvieron muy influenciadas por el tratamiento en los cuatro ensayos que midieron estos resultados y todos los grupos mostraron mejorías significativas a partir del valor inicial pero sin diferencias entre los grupos. Es necesario realizar más estudios de investigación para determinar si una intervención es mejor que otra para mejorar los síntomas subjetivos de malestar y por cuánto tiempo se pueden mantener estas mejorías.
Los resultados de calidad de vida (CdV) no fueron concluyentes porque, de los dos ensayos que los midieron, uno no presentó resultados y el otro informó resultados dentro de los grupos solamente. No obstante, la CdV se afecta con el LRCM(Ahmed 2008; Chachaj 2010; Lee 2012; Maunsell 1993; Pusic 2013; Ridner 2011; Sagen 2009). Además, en el momento en que se realizaron los ensayos, las escalas de CdV específicas del linfedema como ULL‐27 (Augustin 2005); FLQA‐L (Launois 2000); Lymph‐IFC (Devoogdt 2011) y LYMQOL (Keeley 2010) no existían o recién comenzaban a utilizarse. Los estudios de investigación futuros deben utilizar medidas de calidad de vida específicas del linfedema porque la CdV en el LRCM es complicada y a menudo se relaciona con síntomas específicos del linfedema que no se detectan bien en las escalas de CdV más generales. Además, las reducciones del volumen solas pueden no ser suficientes para mejorar las clasificaciones de deterioro psicosocial de las pacientes (Tobin 1993), debido a que las puntuaciones de CdV suelen estar relacionadas con otras comorbilidades como el dolor y la disfunción (Hormes 2010) La posibilidad de que el ejercicio pueda tratar otras comorbilidades y, por lo tanto, mejorar la calidad de vida (Schmitz 2012) proporciona una razón para investigar el tratamiento de combinación del ejercicio con TDC.
Los eventos adversos fueron mínimos y el DLM se toleró bien. Cuando los ensayos informaron los eventos adversos estuvieron limitados a uno o dos participantes, generalmente por irritación del vendaje y ninguno debido al DLM. El contacto adicional con los autores confirmó que el cumplimiento con el DLM fue alto (solamente uno a tres abandonos en un ensayo). Por lo tanto, con un cumplimiento alto del DLM y el hecho de que ninguna participante presentara un evento adverso debido al DLM, el DLM parece seguro y bien tolerado en esta población.
Compleción y aplicabilidad general de las pruebas
Todos los ensayos presentaron datos sobre el resultado principal cambio volumétrico. Hubo tres medidas de cambio volumétrico (reducción porcentual, volumen del LE [ml excesivos que quedan en el brazo al final del ensayo] y reducción del volumen [cálculo de la reducción en ml desde antes del tratamiento hasta después del tratamiento]). Algunos ensayos informaron los tres y otros solamente uno; sin embargo, fue posible calcular los otros para los cuatro ensayos de los que se recibieron los datos brutos, de manera que se considera que los datos que muestran los cambios volumétricos son muy completos. Por lo tanto, las pruebas volumétricas están suficientemente completas para que el médico, el terapeuta o la paciente puedan percibir la contribución relativa del DLM.
No hubo completitud en otros resultados importantes. Las medidas funcionales (amplitud de movimiento, fuerza), la calidad de vida y las sensaciones subjetivas se evaluaron en menos de la mitad de los ensayos y son difíciles de interpretar. Kligman 2004 indica incluir estas medidas porque ayudan a llevar la investigación a la práctica.
Calidad de la evidencia
Las pruebas de esta revisión apoyan la práctica habitual de combinar el DLM con vendaje de compresión para el tratamiento del LRCM y muestran que el DLM se tolera bien. Sin embargo, los datos de esta revisión no fueron suficientes para abordar los objetivos de evaluar la calidad de vida o la mejoría funcional. Además, en algunos contextos de práctica el DLM se administra sin tratamiento de compresión y ningún ensayo en esta revisión evaluó el DLM solo.
La calidad metodológica de las pruebas varió entre los ensayos, por lo que algunos ensayos se calificaron de "bajo riesgo de sesgo" en casi todas las medidas y otros ensayos recibieron calificaciones de "incierto" o "alto riesgo de sesgo" en algunos ítems. No hubo un número suficiente de ensayos en cualquier subgrupo para evaluar si los efectos del DLM variaron con cualquiera de los dominios del "Riesgo de sesgo" en los ensayos. Sin embargo, se observó que el número mayor de calificaciones metodológicas deficientes aparecen para el cegamiento, pues cuatro de los seis ensayos no utilizaron un evaluador de resultado cegado para medir los resultados volumétricos.
Sesgos potenciales en el proceso de revisión
Es poco probable que se introdujera un sesgo importante en la búsqueda de los ensayos. Se buscó de forma exhaustiva entre las bases de datos, se buscó en la literatura gris, se mantuvo correspondencia con los autores de los ensayos y no se hicieron exclusiones por el idioma. Se utilizaron los métodos más actuales para evaluar los ensayos y realizar el análisis de los datos. De haber algún sesgo que influyera en la revisión, sería el hecho de que se incluyó un ensayo cuasialeatorio que puede estar sesgado hacia resultados positivos. Sin embargo, McNeely 2011, una revisión sistemática que utilizó solamente ensayos aleatorios, estableció conclusiones similares a las de esta revisión.
Acuerdos y desacuerdos con otros estudios o revisiones
Se observó que los resultados que detectan las múltiples comorbilidades del LRCM y los aspectos psicosociales / calidad de vida del LRCM se midieron en menos de la mitad de los ensayos y estas observaciones son consistentes con Kärki 2009, que observó una falta de resultados centrados en la paciente en los ensayos de LRCM.
Se señaló que en los ensayos que combinan el vendaje de compresión con DLM, el vendaje de compresión da lugar a una mayor reducción del volumen que el DLM. En los grupos control que recibieron solamente vendaje de compresión las reducciones en los miembros fueron 30% (Johansson 1999) y 38,6% (McNeely 2004). Estas reducciones con vendaje de compresión solo son comparables con el 36% en un grupo control de vendaje de compresión con ejercicios correctivos no locales para el LRCM (Didem 2005) y las estimaciones de una revisión sistemática reciente (McNeely 2011).
También se ha señalado que el DLM proporciona resultados mixtos: cuando se agrega al vendaje de compresión produce un beneficio relativo pequeño, pero cuando se compara con otro tratamiento activo con mangas de compresión iniciales para ambos grupos, los resultados a veces muestran una diferencia significativa que favorece al DLM y otras veces no muestra diferencias significativas entre el DLM y otro tratamiento activo. Dayes 2013, un ensayo aleatorio de TDC versus compresión sola, señaló inconsistencias similares en los resultados volumétricos, lo que indica que es necesario realizar más estudios de investigación para identificar la medida de volumen clínicamente más significativa.
Lo que es más importante, los resultados concilian los resultados contradictorios evidentes de otras revisiones sobre la función del DLM para tratar el LRCM. Dos revisiones, McNeely 2011 que utilizó solamente datos aleatorios y Moseley 2007 que utilizó datos aleatorios y no controlados, determinaron que el DLM tiene efectos beneficiosos. Su resultado seleccionado fue una combinación de resultados volumétricos que incluyó la reducción porcentual. Si en la presente revisión se hubieran agrupado ensayos con grupos control variados, los datos sobre la reducción porcentual coincidirían con estas revisiones. En esta revisión no se presentó una estimación puntual global agrupada debido a las diferencias entre los grupos de tratamiento y control. En cambio, Huang 2013 no informó efectos del DLM. Su resultado seleccionado fue el volumen del LE. Si en la presente revisión se hubieran agrupado ensayos con grupos control variados, los datos sobre el volumen del LE coincidirían con Huang 2013 sin un resultado significativo del DLM.
Por lo tanto, los hallazgos contradictorios evidentes de diferentes revisiones de DLM son explicables por el resultado seleccionado. ¿Qué explica los diferentes hallazgos basados en diferentes resultados? Quizás se deban a que las participantes que tuvieron reducciones porcentuales mayores tenían un exceso de volumen inferior al comienzo. Estas pacientes serían las que presentaban LRCM leve o LRCM ligeramente moderado, el grupo identificado en el análisis de subgrupos que podría tener mayores probabilidades de responder al DLM. Las pacientes con volúmenes iniciales más grandes pueden haber mostrado reducciones absolutas más grandes, pero estas pueden haber sido pequeñas en puntos porcentuales.
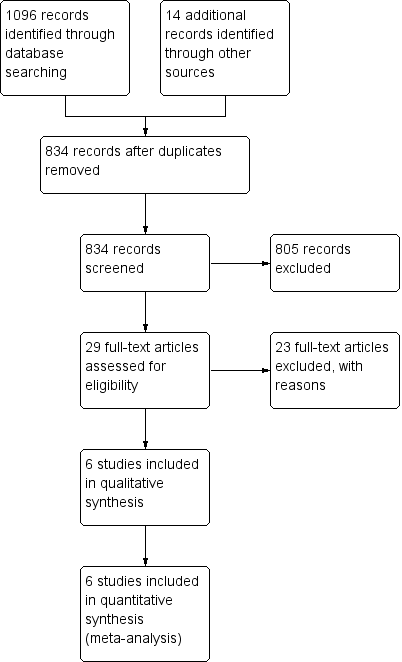
Study flow diagram for review.
'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Forest plot of comparison: 1 MLD + Compression bandaging VS Compression bandaging alone for Immediate Follow Up, outcome: 1.1 Lymphedema Volume (Excess volume remaining in limb after treatment).

Forest plot of comparison: 1 MLD + Compression bandaging VS Compression bandaging alone for Immediate Follow Up, outcome: 1.2 Volume reduction in mL.

Forest plot of comparison: 1 MLD + Compression bandaging VS Compression bandaging alone for Immediate Follow Up, outcome: 1.3 Per cent change.

Forest plot of comparison: 2 MLD + Compression therapy vs Other treatment + Compression therapy, outcome: 2.1 Lymphedema volume (excess volume remaining in limb after treatment).

Forest plot of comparison: 2 MLD + Compression therapy vs Other treatment + Compression therapy, outcome: 2.2 Volume reduction in mL.

Forest plot of comparison: 2 MLD + Compression therapy vs Other treatment + Compression therapy, outcome: 2.3 Per cent change.
Comparison 1 MLD + Compression bandaging VS Compression bandaging alone for Immediate Follow Up, Outcome 1 Lymphedema Volume (Excess volume remaining in limb after treatment).
Comparison 1 MLD + Compression bandaging VS Compression bandaging alone for Immediate Follow Up, Outcome 2 Volume reduction in mL.

Comparison 1 MLD + Compression bandaging VS Compression bandaging alone for Immediate Follow Up, Outcome 3 Per cent change.

Comparison 2 MLD + Compression therapy vs Other treatment + Compression therapy, Outcome 1 Lymphedema volume (excess volume remaining in limb after treatment).

Comparison 2 MLD + Compression therapy vs Other treatment + Compression therapy, Outcome 2 Volume reduction in mL.

Comparison 2 MLD + Compression therapy vs Other treatment + Compression therapy, Outcome 3 Per cent change.
| Volumetric Outcome | Definition / Explanation | Formula | Other terms for this outcome in the included studies |
| Lymphedema Volume | The excess volume in the limb. The volume is measured in milliliters (mL). It is called ‘lymphedema volume’ because it is the amount of the limb volume that is attributed to lymphedema. Lymphedema volume is NOT the total volume of the limb. To calculate the lymphedema volume, you have to compare the affected limb to the unaffected limb by subtracting. In this review, we are interested in the lymphedema volume (or excess volume) that remains in the limb after treatment. | Post‐treatment total volume of the affected arm minus post‐treatment total volume of the unaffected arm. | Lymphedema volume has also been called absolute lymphedema volume, post‐intervention volume (McNeely 2004), and excess limb volume (Williams 2002) |
| Volume Reduction | An estimate of how much the limb has been reduced (in ml) presumably from the treatment. | Lymphedema volume at baseline minus the lymphedema volume after treatment. OR Excess volume before treatment minus the excess volume after treatment. | Volume reduction has also been called the mean lymphedema volume reduction (Johansson 1998; Johansson 1999) and mean change lymphedema volume (McNeely 2004) |
| Per cent Reduction | The decrease in excess volume relative to the amount of excess volume at baseline. Both the lymphedema volume and the volume reduction are considered absolute values not relative values. However, when absolute values are used, a person with a large excess limb volume might get a 2% reduction, but the amount can look large because the beginning volume was large. By contrast, a person with a small beginning volume, can get a 30% reduction, and it can look small in absolute terms. Thus, it is valuable to have a third way to think about lymphedema outcomes, and that is to look at the per cent change because that is a relative value. | Difference Test A – Difference Test B ____________________________________ x 100 Difference Test A Where difference is the affected arm volume minus the unaffected arm volume (McNeely 2004) Another way to think of per cent reduction is this formula: Excess volume at baseline – Excess volume post‐treatment ______________________________________________x100 Excess volume at baseline | Per cent Reduction has also been called the percentage lymphedema reduction (Johansson 1998; Johansson 1999), per cent change, per cent reduction in lymphedema volume (McNeely 2004), percentage change in excess limb volume (Sitzia 2002) |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Lymphedema Volume (Excess volume remaining in limb after treatment) Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 1.1 MLD + Compression bandaging vs Compression bandaging alone | 2 | 83 | Mean Difference (IV, Fixed, 95% CI) | ‐60.73 [‐194.43, 72.96] |
| 2 Volume reduction in mL Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 2.1 MLD + Compression bandaging vs Compression bandaging alone | 2 | 83 | Mean Difference (IV, Fixed, 95% CI) | 26.21 [‐1.04, 53.45] |
| 3 Per cent change Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 3.1 MLD + Compression bandaging vs Compression bandaging alone | 2 | 83 | Mean Difference (IV, Fixed, 95% CI) | 7.11 [1.75, 12.47] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Lymphedema volume (excess volume remaining in limb after treatment) Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 1.1 MLD + Compression sleeve vs SLD + Compression sleeve | 1 | 31 | Mean Difference (IV, Fixed, 95% CI) | ‐230.0 [‐450.84, ‐9.16] |
| 1.2 MLD + Compression sleeve vs Intermittent Sequential Pneumatic Pump + Compression sleeve | 1 | 24 | Mean Difference (IV, Fixed, 95% CI) | 122.0 [‐57.59, 301.59] |
| 2 Volume reduction in mL Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 2.1 MLD + Compression sleeve vs SLD + Compression sleeve | 1 | 31 | Mean Difference (IV, Fixed, 95% CI) | 10.0 [‐90.54, 110.54] |
| 2.2 MLD + Compression sleeve vs Intermittent sequential pneumatic pump + Compression sleeve | 1 | 24 | Mean Difference (IV, Fixed, 95% CI) | 47.0 [15.25, 78.75] |
| 3 Per cent change Show forest plot | 3 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 3.1 MLD + Compression bandaging vs SLD + Compression bandaging | 1 | 28 | Mean Difference (IV, Fixed, 95% CI) | 11.80 [‐2.47, 26.07] |
| 3.2 MLD + Compression sleeve vs SLD + Compression sleeve | 1 | 31 | Mean Difference (IV, Fixed, 95% CI) | ‐2.40 [‐14.11, 9.31] |
| 3.3 MLD + Compression sleeve vs. Intermittent Sequential Pneumatic Pump + Compression sleeve | 1 | 24 | Mean Difference (IV, Fixed, 95% CI) | 8.0 [‐0.75, 16.75] |

