Entrenamiento en tareas repetitivas para la mejoría de la capacidad funcional después del accidente cerebrovascular
Resumen
Antecedentes
El entrenamiento en tareas repetitivas (ETR) incluye la práctica activa de actividades motoras con tareas específicas y es un componente de los enfoques terapéuticos actuales en la rehabilitación del accidente cerebrovascular.
Objetivos
Objetivo primario: Determinar si el ETR mejora la función/alcance del miembro superior y la función/estabilidad del miembro inferior en los adultos después de un accidente cerebrovascular.
Objetivos secundarios: 1) Determinar el efecto del ETR sobre medidas de resultado secundarias que incluyen las actividades cotidianas, la función motora general, la calidad de vida/estado de salud y los eventos adversos. 2) Determinar los factores que podrían influir en las medidas de resultado primarias y secundarias, incluido el efecto de "dosis" de la práctica de las tareas; el tipo de tarea (terapia completa, tarea única o mixta); el momento de la intervención y el tipo de intervención.
Métodos de búsqueda
Se hicieron búsquedas en el registro de ensayos del Grupo Cochrane de Accidentes Cerebrales Vasculares (Cochrane Stroke Group Trials Register) (4 marzo 2016); Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials, CENTRAL) (The Cochrane Library 2016, número 5: 1 octubre 2006 hasta 24 junio 2016); MEDLINE (1 octubre 2006 hasta 8 marzo 2016); Embase (1 octubre 2006 hasta 8 marzo 2016); CINAHL (2006 hasta 23 junio 2016); AMED (2006 hasta 21 junio 2016) y en SPORTSDiscus (2006 hasta 21 junio 2016).
Criterios de selección
Ensayos aleatorios/cuasialeatorios en adultos después de un accidente cerebrovascular, donde la intervención fue una secuencia motora activa realizada repetitivamente como parte de una sesión única de entrenamiento, dirigida a un objetivo funcional claro.
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, examinaron los resúmenes, extrajeron los datos y evaluaron los ensayos. La calidad de las pruebas de cada estudio y grupo de resultados se determinó mediante la herramienta Cochrane "Riesgo de sesgo" y los criterios GRADE (Grades of Recommendation, Assessment, Development and Evaluation). Los datos de los resultados del seguimiento no se evaluaron mediante GRADE. Se estableció contacto con los autores de los ensayos para obtener información adicional.
Resultados principales
Se incluyeron 33 ensayos con 36 pares de intervención‐control y 1853 participantes. El riesgo de sesgo presente en muchos estudios fue incierto debido al informe deficiente; por lo tanto, la calidad de las pruebas se consideró "moderada" o "baja" cuando se utilizó el sistema GRADE.
Hay pruebas de calidad baja de que el ETR mejora la función del brazo (diferencia de medias estandarizada [DME] 0,25; intervalo de confianza [IC] del 95%: 0,01 a 0,49; 11 estudios, número de participantes analizados = 749), la función de la mano (DME 0,25; IC del 95%: 0,00 a 0,51; ocho estudios, número de participantes analizados = 619), y las medidas funcionales del miembro inferior (DME 0,29; IC del 95%: 0,10 a 0,48; cinco ensayos, número de participantes analizados = 419).
Hay pruebas de calidad moderada de que el ETR mejora la distancia de caminata (diferencia de medias [DM] 34,80; IC del 95%: 18,19 a 51,41; nueve estudios, número de participantes analizados = 610) y la deambulación funcional (DME 0,35; IC del 95%: 0,04 a 0,66; ocho estudios, número de participantes analizados = 525). Se encontraron diferencias significativas entre los grupos en los resultados del miembro superior (DME 0,92; IC del 95%: 0,58 a 1,26; tres estudios, número de participantes analizados = 153) y del miembro inferior (DME 0,34; IC del 95%: 0,16 a 0,52; ocho estudios, número de participantes analizados = 471) hasta seis meses después del tratamiento, pero no después de seis meses. Los efectos sobre el miembro superior o inferior no se modificaron por el tipo de intervención, la dosis de la práctica de tareas o el tiempo desde el accidente cerebrovascular. No hubo pruebas de confiabilidad suficiente acerca del riesgo de eventos adversos.
Conclusiones de los autores
Hay pruebas de calidad baja a moderada de que el ETR mejora la función del miembro superior e inferior; las mejorías se mantuvieron hasta seis meses después del tratamiento. Los estudios de investigación adicionales se deben centrar en el tipo y la cantidad de entrenamiento, que incluye las formas de medir el número de repeticiones realizadas en realidad por los participantes. Será necesario volver a revisar la definición del ETR antes de realizar actualizaciones adicionales de esta revisión para asegurar que todavía es clínicamente significativo y distinguible de otras intervenciones.
PICOs
Resumen en términos sencillos
Entrenamiento en tareas repetitivas para la mejoría de la capacidad funcional después del accidente cerebrovascular
Pregunta de la revisión: ¿Cuáles son los efectos de la práctica repetida de tareas funcionales sobre la recuperación después del accidente cerebrovascular en comparación con la atención habitual o los tratamientos placebo?
Antecedentes: El accidente cerebrovascular puede provocar problemas con el movimiento, a menudo en un lado del cuerpo. Aunque es frecuente alguna recuperación con el transcurso del tiempo, en alrededor de un tercio de los pacientes los problemas persisten. La práctica repetida de tareas funcionales (p.ej. levantar una taza) es un enfoque terapéutico utilizado para ayudar a la recuperación del movimiento después del accidente cerebrovascular. Este enfoque se basa en la idea sencilla de que para mejorar la capacidad de realizar tareas es necesario practicar realizando numerosas veces la tarea particular, como cuando se aprende a escribir por primera vez. Los tipos de práctica que los pacientes realizan, y el tiempo que dedican a la práctica, pueden afectar cuán bien funcionan estos tratamientos. Para explorar lo anterior de forma adicional también se deben considerar diferentes aspectos de la práctica repetitiva que pueden influir en cuán bien funciona.
Características de los estudios: Se identificaron 33 estudios con 1853 participantes. Los estudios incluyeron una variedad amplia de tareas a practicar que incluyeron levantar una pelota, caminar, pararse a partir de la posición de sentado y el entrenamiento en circuitos con una tarea diferente en cada estación. Las pruebas están actualizadas hasta junio 2016.
Resultados clave: En comparación con los grupos de atención habitual (fisioterapia estándar) o placebo, los pacientes que practicaron las tareas funcionales mostraron mejorías pequeñas en la función del brazo, la función de la mano, la distancia de caminata y las medidas de capacidad de caminar. Las mejorías en la función del brazo y la pierna se mantuvieron hasta seis meses después. No hubo pruebas de confiabilidad suficiente acerca del riesgo de eventos adversos, por ejemplo caídas. Se necesitan estudios de investigación adicionales para determinar el mejor tipo de práctica de tareas, y si una práctica más mantenida podría mostrar mejores resultados.
Calidad de la evidencia: La calidad de las pruebas se consideró baja para la función del brazo, la función de la mano y las medidas funcionales del miembro inferior y moderada para la distancia de caminata y la deambulación funcional. La calidad de las pruebas de cada resultado fue limitada debido al informe deficiente de los detalles de los estudios (en particular en los estudios antiguos), los resultados inconsistentes entre los estudios y los números pequeños de participantes en los estudios en algunas comparaciones.
Conclusiones de los autores
Summary of findings
| Repetitive task training compared with usual care or attention control for patients with stroke | ||||||
| Patient or population: people with stroke Settings: hospital, clinic or home Intervention: repetitive task training (RTT) Comparison: usual care, attention control or no treatment | ||||||
| Outcomes | Illustrative comparative risks (95% CI) | Relative effect | No of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Estimated score / value with control | Absolute reduction in score / value with RTTa | |||||
| Arm function | Arm function score in the repetitive task training groups was on average 0.25 standard deviations (0.01 to 0.49) higher than in the control groups. SD units, measured using different instruments; higher scores mean better arm function. | SMD 0.25, 95% CI 0.01 to 0.49 | 11 studies 749 participants | ⊕⊕⊝⊝ | Downgraded by one level for inconsistency (12 58%). Downgraded by one level for study design (random sequence generation unclear in 4/11 trials and high risk in 1/11 trials in the meta‐analysis; allocation concealment unclear in 7/11 trials and high risk in 1/11 trials). | |
| Hand function | Hand function score in the repetitive task training groups was on average 0.25 standard deviations (0.00 to 0.51) higher than in the control groups. SD units, measured using different instruments; higher scores mean better hand function. | SMD 0.25, 95% CI 0.00 to 0.51 | 8 studies 619 participants | ⊕⊕⊝⊝ | Downgraded by one level for inconsistency (12 54%). Downgraded by one level for study design (random sequence generation unclear in 2/8 trials and high risk in 1/8 trials in the meta‐analysis; allocation concealment unclear in 4/8 trials and high risk in 1/8 trials). | |
| Walking distance: change from baseline | The mean change in walking distance (metres walked in six minutes; a higher score means greater walking distance) in the control groups ranged from ‐1.0 to 118.5. | The mean change in walking distance (metres walked in six minutes; a higher score means greater walking distance) in the repetitive training group ranged from 19 to 221. | MD 34.80, 95% CI 18.19 to 51.41 | 9 studies 610 participants | ⊕⊕⊕⊝ | Downgraded by one level for study design (random sequence generation unclear in 6/9 trials in the meta‐analysis; allocation concealment unclear in 6/9 trials and high risk in 3/9 trials). |
| Walking speed | The mean walking speed in the control groups ranged from | The mean walking speed in the intervention groups ranged from 0.39 to 2.03 metres per second. A higher score means faster walking speed. | SMD 0.39, 95% CI ‐0.02 to 0.79 | 12 studies 685 participants | ⊕⊕⊝⊝ | Downgraded by one level for inconsistency (12 80%). Downgraded by one level for study design (random sequence generation unclear in 7/12 trials in the meta‐analysis; allocation concealment unclear in 9/12 trials and high risk in 3/12 trials). |
| Functional ambulation | Functional ambulation score in the repetitive task training groups was on average 0.35 standard deviations (0.04 to 0.66) higher than in the control groups. SD units, measured using different instruments; higher scores mean better function. | SMD 0.35, 95% CI 0.04 to 0.66 | 8 studies 525 participants | ⊕⊕⊕⊝ | Downgraded by one level for study design (random sequence generation unclear in 4/8 trials in the meta‐analysis; allocation concealment unclear in 7/8 trials and high risk in 1/8 trials). | |
| Lower limb functional measures | Lower limb functional measures in the repetitive task training groups were on average 0.29 standard deviations (0.10 to 0.48) higher than in the control groups. SD units, measured using different instruments; higher scores mean better function. | SMD 0.29, 95% CI 0.10 to 0.48 | 5 studies 419 participants | ⊕⊕⊝⊝ | Downgraded by one level for study design (random sequence generation unclear in 3/5 trials in the meta‐analysis; allocation concealment unclear in 3/5 trials and high risk in 1/5 trials). Downgraded by one level for publication bias; 4 out of 5 are small studies (less than 50 participants). | |
| Global motor function scales | Global motor function in the repetitive task training groups was on average 0.38 standard deviations (0.11 to 0.65) higher than in the control groups. SD units, measured using different instruments; higher scores mean better function. | SMD 0.38, 95% CI 0.11 to 0.65 | 5 studies 222 participants | ⊕⊕⊕⊝ | Downgraded by one level for study design (random sequence generation unclear in 4/5 trials in the meta‐analysis; allocation concealment unclear in 4/5 trials and high risk in 1/5 trials). | |
| Adverse events | Barreca 2004: 3/25 (12%) falls in the intervention group versus 4/23 (17.4%) in the control group, OR 0.65, 95% CI 0.13 to 3.27. Holmgren 2010: 11 participants in total fell during study (32%), five in the intervention group and six in the attention control group. van de Port 2012: 29 falls reported in the circuit training group and 26 in the usual physiotherapy group (P = 0.93). Two serious adverse events were reported in the circuit training group: one participant fell and consulted a GP and one patient experienced arrhythmias during one session. Winstein 2016: 168 serious adverse events involving 109 participants. The most common were hospitalisation (n = 143, 25% of randomised participants) and recurrent stroke (n = 42, 9% of randomised participants). Adverse events were not presented by trial arm. Salbach 2004: intervention‐related reasons for withdrawal that could be interpreted as adverse events included one participant out of 47 in a mobility training group who experienced the onset of groin pain. Four participants also fell during the mobility intervention but did not suffer injury and continued to participate in the group. Two falls also occurred during evaluation. Two trials narratively reported no adverse effects (de Sèze 2001; McClellan 2004). | |||||
| a As a rule of thumb, 0.2 SD represents a small difference, 0.5 a moderate, and 0.8 a large difference. CI: confidence interval; MD: mean difference; SMD: standardised mean difference; OR: odds ratio; SD: standard deviation | ||||||
| GRADE Working Group grades of evidence | ||||||
Antecedentes
Descripción de la afección
Aunque la incidencia del accidente cerebrovascular relacionado con la edad puede estar en descenso, el número absoluto de personas que presentan un accidente cerebrovascular cada año y la carga global general del accidente cerebrovascular en cuanto a años de vida ajustados por discapacidad está en aumento (Feigin 2014). El accidente cerebrovascular todavía es la causa principal de discapacidad neurológica a largo plazo en los adultos (Wolfe 2000). Las tasas de prevalencia de discapacidad y deficiencia varían según las muestras de cohortes, pero en la etapa aguda del accidente cerebrovascular aproximadamente la mitad de todos los supervivientes del accidente cerebrovascular quedan con problemas funcionales graves (Lawrence 2001). Las estimaciones de la recuperación de la deambulación independiente en los estudios que reclutan cohortes poco después del accidente cerebrovascular varían del 41% al 85% (Dallas 2008; Feigin 1996; Kwah 2013; Verbeek 2011; Wade 1987; Wandel 2000); las relacionadas con la recuperación de la función del miembro superior independiente varían del 32% al 34% (Au‐Yeung 2009; Heller 1987; Nijland 2010). Sólo del 5% al 20% de los pacientes con deficiencia inicial del miembro superior después del accidente cerebrovascular recupera completamente la función del brazo y del 30% al 66% no ha recuperado el uso funcional a los seis meses (Heller 1987; Nakayama 1994; Sunderland 1989; Wade 1983). A las tres semanas y a los seis meses después del accidente cerebrovascular, el 40% y el 15% de los pacientes no pueden caminar de forma independiente en interiores (Wade 1987), y sólo el 18% recupera la capacidad de caminar sin restricción (Lord 2004).
Descripción de la intervención
Las revisiones sistemáticas de intervenciones de tratamientos para el miembro superior parético indican que los participantes se benefician de los programas de ejercicios en los que se entrenan directamente en tareas funcionales (Van Peppen 2004). Un metanálisis ha indicado que el tratamiento más intensivo puede al menos mejorar la tasa de recuperación de las actividades cotidianas (AC) (Kwakkel 2004), en particular si se adopta un enfoque funcional directo (Kwakkel 1999; Van der Lee 2001). Más recientemente, una revisión de las pruebas de la fisioterapia posterior al accidente cerebrovascular concluyó que existen pruebas sólidas para la práctica de alta intensidad (tiempo adicional de tratamiento de 17 horas a las diez semanas) con un número alto de repeticiones dentro de una sesión única de tratamiento y un objetivo funcional (Verbeek 2014). La práctica de tareas repetitivas combina elementos de intensidad de la práctica y relevancia funcional.
De qué manera podría funcionar la intervención
Muchos aspectos de la rehabilitación incluyen la repetición de movimientos. Se ha formulado la hipótesis de que la práctica motora repetida reduce la debilidad y la espasticidad muscular (Nuyens 2002), a la vez que forma la base fisiológica del aprendizaje motor (Butefisch 1995), aunque el acoplamiento sensitivomotor contribuye a la adaptación y la recuperación de las vías neuronales (Dobkin 2004). También se conjetura que la participación cognitiva activa, la relevancia funcional y el conocimiento del rendimiento mejoran el aprendizaje (Carr 1987; Schmidt 2014). Sin embargo, la mayoría de las intervenciones evaluadas en los ensayos controlados aleatorios (ECA) no se dirigen explícitamente a procesos fisiopatológicos específicos (Langhorne 2009).
Por qué es importante realizar esta revisión
El entrenamiento en tareas repetitivas (ETR) tiene la posibilidad de ser un componente eficiente en cuanto a los recursos de la rehabilitación del accidente cerebrovascular, que incluye la administración en un contexto grupal o la práctica autoiniciada en el ambiente domiciliario. La repetición del movimiento es el mecanismo básico de acción asociado con muchas intervenciones que parecen ser promisorias para mejorar la función motora (Langhorne 2009) (p.ej. la terapia de movimiento inducido limitado [Corbetta 2015], el entrenamiento en estera [Mehrholz 2014] y el entrenamiento con dispositivos electromecánicos, por ejemplo los robots (Mehrholz 2015b)). La presente revisión es importante porque considera si el ETR solo da lugar a ganancias funcionales a falta de otros mecanismos de acción.
Objetivos
Objetivo primario: Determinar si el entrenamiento en tareas repetitivas (ETR) mejora la función/alcance del miembro superior y la función/estabilidad del miembro inferior en los adultos después de un accidente cerebrovascular.
Objetivos secundarios: 1) Determinar el efecto del ETR sobre medidas de resultado secundarias que incluyen las actividades cotidianas (AC), la función motora general, la calidad de vida/estado de salud, y los eventos adversos. 2) Determinar los factores que podrían influir en las medidas de resultado primarias y secundarias, incluido el efecto de "dosis" de la práctica de las tareas; el tipo de tarea (terapia completa, tarea única o mixta); momento de la intervención; y el tipo de intervención.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron ECA y ensayos cuasialeatorios (definidos como métodos de asignación de los pacientes al ensayo que no son aleatorios, pero que se pretende que produzcan grupos similares cuando se utilizan para asignar a los participantes, como los que asignan por fecha o alternancia (Higgins 2011)). Un brazo del ensayo tenía que incluir ETR en comparación con la práctica habitual (que incluye "ningún tratamiento"), o un grupo de atención control. Se excluyeron los estudios en los que el ETR fue un componente de los tratamientos experimentales y control. Ejemplos de tratamientos de atención control son recibir terapia en un miembro diferente durante un tiempo comparable o participar en una actividad sin posibles efectos beneficiosos. Se aceptaron los grupos de comparación de práctica habitual cuando la intervención recibida por el grupo control se consideró un componente normal o habitual de las prácticas de rehabilitación del accidente cerebrovascular, incluidos los enfoques neurofisiológicos u ortopédicos. Se supuso que, poco después del accidente cerebrovascular, la práctica habitual significaría que los pacientes recibirían alguna terapia.
Tipos de participantes
Adultos (18 años y más) que han presentado un accidente cerebrovascular. La Organización Mundial de la Salud (OMS) define el accidente cerebrovascular como "un síndrome de síntomas y signos que se desarrollan rápidamente de pérdida focal, y a veces general, de la función cerebral que persiste por más de 24 horas o que da lugar a la muerte, sin una causa evidente que no sea de origen vascular" (WHO 1989). Se incluyeron los ensayos que comenzaron en cualquier momento después de un accidente cerebrovascular agudo y en cualquier contexto. Se excluyeron los estudios en participantes con etiología mixta (por ejemplo, participantes con lesión cerebral adquirida), a menos que hubiera datos disponibles de los participantes con accidente cerebrovascular solamente.
Tipos de intervenciones
Un brazo del ensayo tenía que incluir una intervención en la que se realizó una secuencia motora activa de manera repetitiva dentro de una sesión única de entrenamiento, y en la que la práctica se dirigió a un objetivo funcional claro. Los objetivos funcionales podrían incluir tareas complejas completas (p.ej. recoger una taza), o movimientos previos a la tarea para el miembro completo o para un segmento del miembro como el agarre, el control o el movimiento en una trayectoria para facilitar una actividad tipo AC (p.ej. cambiar de la posición de sentado a la posición de pie). Para estar incluidos, los ensayos de actividades repetitivas debían incluir movimientos complejos de varias articulaciones con medición funcional del resultado, en lugar del ejercicio de una articulación única o de un grupo muscular dirigido a resultados de rendimiento motor.
Se incluyó cualquier intensidad y duración del esquema de entrenamiento en tareas, pero los ensayos sólo se incluyeron si fue posible identificar el tiempo de duración o el número de repeticiones dentro de una sesión de práctica y el número de sesiones administradas. Se incluyeron los ensayos que utilizaron claramente el reaprendizaje motor en su enfoque terapéutico como un todo si fue posible identificar la cantidad de entrenamiento con tareas específicas recibido.
Se incluyeron los ensayos que combinaron el ETR con la ayuda para el movimiento proporcionada por una persona, por medios mecánicos o con robot si la finalidad de la asistencia fue facilitar una repetición relacionada con la tarea. Los estudios se excluyeron si el movimiento con ayuda fue predominante, o si no fue posible relacionarlo fácilmente con un objetivo funcional.
Los ensayos se excluyeron si combinaron el ETR con otra intervención en la que no fue posible aislar la influencia de la repetición de las tareas, por ejemplo, la estimulación eléctrica, los ambientes virtuales, el uso forzado, el movimiento bilateral o la repetición mental. Los ensayos también se excluyeron si la intervención utilizó medios mecánicos sencillamente para aumentar la fuerza o la resistencia.
Se estableció contacto con los autores de los ensayos para aclarar la naturaleza de la intervención cuando no estuvo claro si el ensayo cumplió la definición de la revisión.
Tipos de medida de resultado
Resultados primarios
Los resultados primarios que se seleccionaron fueron medidas funcionales generales y específicas del miembro. Debido a la amplia variedad de medidas utilizadas entre los ensayos, los revisores seleccionaron las medidas de resultado para facilitar el agrupamiento cuantitativo. Si hubo más de una medida disponible en una categoría de resultado, se priorizaron las medidas de capacidad motora funcional utilizadas en los ensayos primarios, como se señala en las siguientes categorías diferentes.
-
Función/alcance del miembro superior
-
Función del brazo: Motor Assessment Scale ‐ componente miembro superior, Action Research Arm Test, Frenchay Arm Test, Wolf Motor Function Test, Functional Test of the Hemiparetic Upper Extremity, Box and Block Test, Southern Motor Group Assessment
-
Función de la mano: Motor Assessment Scale ‐ mano, Jebsen Test of Hand Function*, Peg Test*, Stroke Impact Scale ‐ dominio mano
-
Estabilidad/alcance en posición de sentado: Reaching Performance Scale, alcance funcional
-
-
Función/estabilidad en posición de pie del miembro inferior
-
Función del miembro inferior: distancia de caminata, velocidad de caminata, deambulación funcional, Timed Up and Go Test/sit‐to‐stand*; medidas de función del miembro inferior, como la Rivermead Motor Assessment, la Sødring Motor Evaluation Scale, el Walking Ability Questionnaire, la Stroke Impact Scale ‐ dominio movilidad.
-
Estabilidad/alcance en posición de pie: Berg Balance Scale, Standing Equilibrium Index, Functional Reach, Activities Based Confidence Scale, Timed Balance Test
-
Resultados secundarios
-
Actividades cotidianas (AC)
-
Barthel Index, Functional Independence Measure, Modified Rankin Scale, Global Dependency Scale, Canadian Occupational Performance Measure
-
-
Función motora general (incluido el brazo, la pierna y el tronco y la función motora simple [p.ej. capacidad para moverse de decúbito a sentado en el borde de la cama])
-
Motor Assessment Scale, Rivermead Motor Assessment Scale, Sødring Motor Evaluation Scale
-
-
Medidas de calidad de vida, estado de salud, satisfacción del usuario, carga para el cuidador, motivación o mejoría percibida
-
Por ejemplo, Nottingham Health Profile*, SF36, Dartmouth Cooperative Chart*
-
-
Eventos adversos.
-
Por ejemplo, dolor, lesión, caídas
-
*Los ítems marcados con un asterisco son las medidas en las que una puntuación baja equivale a un resultado positivo. Los datos se presentaron como valores negativos en estos estudios. En todas las otras medidas, una puntuación alta indica un buen resultado, y los datos se presentaron como valores positivos.
Momento de la evaluación del resultado
El momento de evaluación del resultado primario fue al final del período de tratamiento. Si el final del período de tratamiento no se definió claramente, las medidas de resultado a los tres meses después del tratamiento se seleccionaron como primarias porque se consideró que era el período promedio para la contribución de la rehabilitación. Los datos de resultado se presentan para el seguimiento menor de seis meses después del tratamiento y entre seis meses y un año después del tratamiento. En ambos puntos de seguimiento se introdujeron los datos del resultado primario si se especificó un resultado primario y los datos estaban disponibles; de no ser así, se incluyeron los datos de los resultados disponibles y se seleccionaron los resultados similares entre los estudios en los que se proporcionaron datos de más de un resultado.
Results
Description of studies
Results of the search
We identified 66,028 records from the database searches. After deduplication we screened 55,011 records and excluded 54,100 as not relevant. In total 911 records progressed to filtering in full text (Figure 1). Out of the 911 full papers retrieved, we excluded a further 878. We subsequently excluded studies where there was uncertainty whether or not they met the inclusion criteria ‐ details are presented in the Characteristics of excluded studies table, In total, we identified 19 new studies and added them to the 14 studies previously included in the 2007 review. A total of 33 studies are now included in the review. We categorised 11 studies as on‐going (Characteristics of ongoing studies) and 14 studies as awaiting assessment (Characteristics of studies awaiting classification).

Study flow diagram (2007 review and update 2016 figures)
Included studies
We identified 33 trials, comprising 36 intervention‐control pairs, which met the inclusion criteria. One paper (Kwakkel 1999) refers to a trial with two intervention‐control pairs which have been referenced separately in the review: Kwakkel 1999a refers to a lower limb training group versus splint control, Kwakkel 1999b refers to an upper limb training group versus splint control. Blennerhassett 2004 includes two intervention‐control pairs: Blennerhassett 2004a refers to an upper limb training group versus lower limb attention control, and Blennerhassett 2004b refers to a lower limb training group versus upper limb training attention control. Salbach 2004 has two intervention‐control pairs: Salbach 2004a refers to a lower limb training group versus upper limb training attention control, and Salbach 2004b refers to the upper limb training group versus lower limb training attention control. In five trials (Baer 2007; Olawale 2011; Peurala 2009; Winstein 2004; Winstein 2016) there were three arms. We only included the data for the intervention‐control pair of repetitive task training (RTT) versus control in the review.
Design
Of the 33 included trials, 32 were RCTs (Arya 2012; Baer 2007; Barreca 2004; Blennerhassett 2004; Dean 1997; Dean 2000; Dean 2007; de Sèze 2001; Frimpong 2014; Gordon 2013; Holmgren 2010; Howe 2005; Kim 2012; Kim 2014; Kim 2016; Kwakkel 1999; Langhammer 2000; Lennon 2009; McClellan 2004; Mudge 2009; Olawale 2011; Park 2011; Peurala 2009; Ross 2009; Salbach 2004; Song 2015; Tung 2010; van de Port 2012; Van Vliet 2005; Winstein 2004; Winstein 2016; Yen 2005), and one is a quasi‐randomised trial (Turton 1990). Four of the trials were pilot randomised controlled trials (Dean 2000; de Sèze 2001; Howe 2005; Winstein 2004). Four of the trials were multicentre (Arya 2012; Kwakkel 1999; van de Port 2012; Winstein 2016). Nine of the trials were stratified before randomisation using: baseline level of walking deficit (Lennon 2009; Peurala 2009; Salbach 2004), cognition and falls risk (Holmgren 2010), gender and side of stroke (Langhammer 2000); rehabilitation centre (van de Port 2012), stroke severity (Baer 2007; Winstein 2004), and motor severity and time from stroke onset (Winstein 2016).
Sample size
Eleven trials had 25 participants or less (Dean 1997; Dean 2000; Dean 2007; de Sèze 2001; Frimpong 2014; Kim 2012; Kim 2014; Kim 2016; Park 2011; Song 2015; Turton 1990). Ten trials had between 26 and 49 participants (Barreca 2004; Blennerhassett 2004; Holmgren 2010; Howe 2005; McClellan 2004; Peurala 2009; Ross 2009; Tung 2010; Winstein 2004; Yen 2005). Twelve trials had 50 participants or more (Arya 2012; Baer 2007; Gordon 2013; Kwakkel 1999; Langhammer 2000; Lennon 2009; Mudge 2009; Olawale 2011; Salbach 2004; van de Port 2012; Van Vliet 2005; Winstein 2016).
Country
Of the 33 trials, three were carried out in Canada (Barreca 2004; Dean 2000; Salbach 2004), five in Australia (Blennerhassett 2004; Dean 1997; Dean 2007; McClellan 2004; Ross 2009), four in the UK (Baer 2007; Howe 2005; Turton 1990; Van Vliet 2005), two in Taiwan (Tung 2010; Yen 2005), five in Korea (Kim 2012; Kim 2014; Kim 2016; Park 2011; Song 2015), two in the Netherlands (Kwakkel 1999; van de Port 2012), two in the USA (Winstein 2004; Winstein 2016), one in Norway (Langhammer 2000), two in Africa (Frimpong 2014; Olawale 2011), one in India (Arya 2012), one in Jamaica (Gordon 2013), one in Sweden (Holmgren 2010), one in Finland (Peurala 2009), one in Ireland (Lennon 2009), one in New Zealand (Mudge 2009), and one in France (de Sèze 2001).
Participants
The 33 trials included 2014 participants, of which 1853 were included in the 36 intervention‐control pairs relevant to this review. All of the trials included both genders, with 10 trials having more than 60% male participants (Arya 2012; Barreca 2004; Dean 1997; Dean 2007; Frimpong 2014; Holmgren 2010; Kim 2016; Salbach 2004; Tung 2010; van de Port 2012). In 10 trials, the participants had a mean age of less than 60 (Arya 2012; Blennerhassett 2004; Frimpong 2014; Kim 2012; Kim 2014; Olawale 2011; Park 2011; Tung 2010; Turton 1990; van de Port 2012), and in seven trials the mean age was over 70 (Baer 2007; Holmgren 2010; Howe 2005; Langhammer 2000; Lennon 2009; Salbach 2004; Van Vliet 2005). Fourteen trials included only participants after a first stroke (Arya 2012; Dean 2000; Dean 2007; de Sèze 2001; Frimpong 2014; Kim 2014; Kim 2016; Kwakkel 1999; Langhammer 2000; Park 2011; Peurala 2009; Tung 2010; Winstein 2004; Yen 2005). Six trials included participants with either first or recurrent stroke (Blennerhassett 2004; Holmgren 2010; Howe 2005; Lennon 2009; Mudge 2009; Salbach 2004). In the remaining trials, it was unclear whether inclusion was limited to first stroke only.
Mean time since stroke
Mean time since stroke was one month or less in 10 trials (Barreca 2004; Dean 2007; Howe 2005; Kim 2016; Kwakkel 1999; Langhammer 2000; Lennon 2009; Peurala 2009; Van Vliet 2005; Winstein 2004), between one and three months in five trials (Arya 2012; Blennerhassett 2004; de Sèze 2001; Frimpong 2014; Winstein 2016), between three and six months in four trials (Holmgren 2010; McClellan 2004; Turton 1990; van de Port 2012), and between six and 12 months in five trials (Gordon 2013; Kim 2014; Olawale 2011; Salbach 2004; Yen 2005). Participants were in the chronic phase of stroke in nine trials (Baer 2007; Dean 1997; Dean 2000; Kim 2012; Mudge 2009; Park 2011; Ross 2009; Song 2015; Tung 2010).
Interventions
Upper limb RTT interventions were tested in six trials (Arya 2012; Ross 2009; Turton 1990; Winstein 2004; Winstein 2016; Yen 2005). Lower limb repetitive task‐oriented training interventions were tested in 17 trials (Barreca 2004; Dean 2000; Frimpong 2014; Gordon 2013; Holmgren 2010; Kim 2012; Kim 2014; Kim 2016; Lennon 2009; McClellan 2004; Mudge 2009; Olawale 2011; Park 2011; Peurala 2009; Song 2015; Tung 2010; van de Port 2012). Of these trials, two of the interventions focused specifically on sit‐to‐stand practice (Barreca 2004; Tung 2010) and six of the interventions focused on walking practice (Gordon 2013; Kim 2014; Lennon 2009; Olawale 2011; Park 2011; Peurala 2009). Three trials investigated RTT interventions for both the upper and lower limb (Blennerhassett 2004; Kwakkel 1999; Salbach 2004). Four trials investigated RTT interventions that focused specifically on: sitting balance (Dean 1997; Dean 2007), trunk control (de Sèze 2001), and balance (Howe 2005), and two trials investigated whole therapy approaches (Langhammer 2000; Van Vliet 2005).
Setting
The intervention was delivered solely in an inpatient setting in 11 trials (Barreca 2004; Blennerhassett 2004; Dean 2007; Frimpong 2014; de Sèze 2001; Howe 2005; Kim 2014; Kwakkel 1999; Lennon 2009; Peurala 2009; Winstein 2016). In three trials the intervention was delivered during both inpatient and outpatient rehabilitation (Ross 2009; Van Vliet 2005; Winstein 2004), with one trial continuing to deliver the intervention in community settings and the patients' own homes (Langhammer 2000). Nine trials delivered the intervention as outpatient rehabilitation (Arya 2012; Dean 2000; Mudge 2009; Olawale 2011; Park 2011; Salbach 2004; Tung 2010; van de Port 2012; Yen 2005). Two trials delivered the intervention in community settings (Gordon 2013; Holmgren 2010), and four trials delivered the intervention solely in the patients' home environments (Baer 2007; Dean 1997; McClellan 2004; Turton 1990). In three trials it was not clear in which setting the intervention was delivered (Kim 2012; Kim 2016; Song 2015).
Amount of task practice
The number of hours of task practice varied considerably across the interventions. Six trials were estimated to have provided less than 10 hours training in total (Dean 1997; Dean 2007; Howe 2005; Lennon 2009; Tung 2010; Van Vliet 2005). A further 16 trials provided between 10 and 21 hours training (Arya 2012; Barreca 2004; Blennerhassett 2004; Dean 2000; Frimpong 2014; Gordon 2013; Kim 2012; Kim 2014; Langhammer 2000; Mudge 2009; Olawale 2011; Park 2011; Peurala 2009; Salbach 2004; Song 2015; Winstein 2004). Four trials provided between 30 and 40 hours training (Kim 2016; Ross 2009; van de Port 2012; Winstein 2016), and four trials prescribed more than 40 hours therapy (Kwakkel 1999; McClellan 2004; Turton 1990; Yen 2005). In one trial, the number of hours was not reported (Baer 2007). As only four of the included trials reported the duration of the RTT component of the task training sessions (Arya 2012; Mudge 2009; Peurala 2009; Ross 2009), we have used figures for the total duration of the task training sessions as these were more frequently reported in the included studies.
Duration of training
The length of time that training was spread over varied from two to four weeks in 19 trials (Arya 2012; Baer 2007; Blennerhassett 2004; Dean 1997; Dean 2000; Dean 2007; de Sèze 2001; Howe 2005; Kim 2012; Kim 2014; Kim 2016; Lennon 2009; Mudge 2009; Park 2011; Peurala 2009; Song 2015; Tung 2010; Winstein 2004; Yen 2005). The intervention was between four and 12 weeks in eight trials (Barreca 2004; Frimpong 2014; Holmgren 2010; McClellan 2004; Ross 2009; Salbach 2004; Turton 1990; Winstein 2016) and between 12 and 20 weeks in four trials (Gordon 2013; Kwakkel 1999; Olawale 2011; van de Port 2012). For two trials, the duration of training was over the inpatient rehabilitation period, with therapy for some participants in an outpatient setting if required (Langhammer 2000; Van Vliet 2005).
Intervention delivery
The RTT interventions were delivered by trained therapists in all but four of the included trials. In three trials trained staff input was restricted to prescription and review of self‐administered homework exercise programmes (Baer 2007; McClellan 2004; Turton 1990). Trained therapy assistants provided balance training in one trial (Howe 2005), and registered practical nurses delivered sit‐to‐stand training in one trial (Barreca 2004). A group or circuit training approach was used in eight studies (Barreca 2004; Blennerhassett 2004; Dean 2000; Frimpong 2014; Kim 2016; Mudge 2009; Song 2015;van de Port 2012 ). In one trial it was unclear who delivered the intervention (Kim 2014).
Comparison interventions
Eleven trials compared the intervention against an attention control: two trials used a recreation or cognitive therapy control group (Barreca 2004; Dean 1997), two used educational sessions (Holmgren 2010; Mudge 2009), one used a splint control (Kwakkel 1999), one used light massage (Gordon 2013), one used a sham sitting protocol (Dean 2007) and four used a comparison training programme for the upper or lower limb (Blennerhassett 2004; Dean 2000; McClellan 2004; Salbach 2004). Eighteen trials compared the intervention against usual care. Equivalent hours of therapy were provided in eight trials (Arya 2012; de Sèze 2001; Langhammer 2000; Lennon 2009; Olawale 2011; van de Port 2012; Van Vliet 2005; Winstein 2016).The RTT group received additional practice in 14 trials (Baer 2007; Frimpong 2014; Holmgren 2010; Howe 2005; Kim 2012; Kim 2014; Kim 2016; Park 2011; Peurala 2009; Ross 2009; Song 2015;Tung 2010; Turton 1990; Winstein 2004). It is unclear whether the duration of therapy for the intervention‐control pair was equivalent for Yen 2005.
Outcomes
The 33 included trials used a wide range of different outcome measures, measurement statistics, and time intervals for follow‐up. Measures selected by the review team for each outcome category are detailed below, and in Table 2 for ease of reference per outcome category. In some studies, more than one measure was available for a category, and in this case, we prioritised measures as detailed in the Methods section.
| Author and year | Global function | Lower limb function | Balance/sit‐to‐stand | Upper limb function | Hand function | ADL function | QOL, health status | Adverse events |
| Action Research Arm Test ‐ gross arm movement | ||||||||
| Number of participants able to stand | Dartmouth COOP | Falls | ||||||
| Blennerhassett 2004; Blennerhassett 2004a; Blennerhassett 2004b | 6 Minute Walk Test; Step Test | Timed Up & Go Test | Motor Assessment Scale ‐ arm | Motor Assessment Scale ‐ hand | ||||
| 10 Metre Walk Speed | Reaching distance | |||||||
| 6 Minute Walk Test; 10 Metre Walk Speed; Step Test | Timed Up & Go Test | |||||||
| 10 Metre Walk Test | Reaching distance | |||||||
| Functional Ambulation Classification | Sitting and Standing Equilibrium Index | Functional Independence Measure | ||||||
| 10 Metre Walk Test Functional Ambulatory Category | ||||||||
| 6 Minute Walk Test | Barthel Index | SF‐36 physical health component | ||||||
| Berg Balance Scale | Barthel Index | |||||||
| Lateral reach ‐ time, sit‐to‐stand ‐ time | ||||||||
| 10 Metre Walk Speed | Berg Balance Scale; Timed Up & Go Test | |||||||
| Stroke Impact Scale ‐ social participation subscale | 10 Metre Walk Test 6 Minute Walk Test | |||||||
| 6 Minute Walk Test | Berg Balance Scale | Korean version of Modified Barthel Index | ||||||
| Functional Ambulation Classification; Walking speed | Action Research Arm Test | Barthel Index | Nottingham Health Profile | |||||
| Motor Assessment Scale | Motor Assessment Scale ‐ walking; Sødring Motor Evaluation Scale ‐ trunk, balance and gait | Motor Assessment Scale ‐ balanced sitting, Motor Assessment Scale ‐ sit‐to‐stand | Motor Assessment Scale ‐ arm | Motor Assessment Scale ‐ hand | Barthel Index | Nottingham Health Profile | ||
| 5 Metre Walk Speed | ||||||||
| Motor Assessment Scale ‐ walking | Functional Reach Test | |||||||
| 6 Minute Walk Test | ||||||||
| 10 Metre Walk Speed | ||||||||
| 10 Metre Walk Speed; 6 Minute Walk Test; Walking ability questionnaire | Activities‐Specific Balance Confidence Scale | |||||||
| Rivermead Mobility Index | ||||||||
| Wolf Motor Function Test (functional score) | Canadian Occupational Performace Measure | |||||||
| 6 Minute Walk Test; 5 Metre Walk Speed | Timed Up and Go Test; Berg Balance Scale | Box & Block Test | 9 Hole Peg Test | Barthel Index | ||||
| Berg Balance Scale | ||||||||
| Southern Motor Group's Motor Assessment ‐ upper extremity | 10 Hole Peg Test | |||||||
| 6 Minute Walk Test; 5 Metre Walk Speed; Stroke Impact Scale ‐ mobility domain | Timed Balance Test | |||||||
| Rivermead Motor Assessment ‐ gross function | Rivermead Motor Assessment ‐ leg and trunk; 6 Minute Walk Test; Motor Assessment Scale ‐ walking, Motor Assessment Scale ‐ leg and truck | Motor Assessment Scale ‐ balanced sitting, Motor Assessment Scale ‐ sit‐to‐stand | Motor Assessment Scale ‐ arm | Motor Assessment Scale ‐ hand | Barthel Index | |||
| Functional Test of the Hemiparetic Upper Extremity | ||||||||
| Log Wolf Motor Function Test | Stroke Impact Scale ‐ hand function | |||||||
| Wolf Motor Function Test |
Primary outcomes
Upper limb functional outcome measures
-
Arm function: Action Research Arm Test (Arya 2012; Kwakkel 1999b; Ross 2009), Wolf Motor Function Test (Winstein 2016; Yen 2005), Motor Assessment Scale ‐ arm (Blennerhassett 2004a; Langhammer 2000; Van Vliet 2005), Box and Block Test (Salbach 2004b), Functional Test of the Hemiparetic Upper Extremity (Winstein 2004), Southern Motor Group Assessment ‐ upper limb activity (Turton 1990), Frenchay Arm Test (Baer 2007).
-
Hand function: 9 Hole Peg Test (Salbach 2004b), 10 Hole Peg Test (Turton 1990), Motor Assessment Scale ‐ hand (Blennerhassett 2004a; Langhammer 2000; Van Vliet 2005), Wolf Motor Funtion Test (functional ability) (Ross 2009), Stroke Impact Scale ‐ hand domain (Winstein 2016).
-
Sitting balance and reach: Reaching distance (Dean 1997; Dean 2007), Sitting Equilibrium Index (de Sèze 2001), Motor Assessment Scale ‐ balanced sitting (Langhammer 2000; Van Vliet 2005), lateral reach ‐ time to return to quiet sitting (Howe 2005).
Lower limb functional outcome measures
-
Walking distance: 6 Minute Walk Test (Blennerhassett 2004b; Dean 2000; Gordon 2013; Kim 2014; Kim 2016Mudge 2009; Park 2011; Salbach 2004a; van de Port 2012).
-
Walking speed: 10 Metre Walk speed (Dean 1997; Dean 2000; Dean 2007; Frimpong 2014; Kim 2012; Kim 2014; Kwakkel 1999a; Olawale 2011; Park 2011), 5 Metre Walk Speed (Lennon 2009; Salbach 2004a; van de Port 2012), 6 Metre Walk Speed (Van Vliet 2005).
-
Functional ambulation: Functional Ambulation Classification (de Sèze 2001; Frimpong 2014; Kwakkel 1999a), Motor Assessment Scale ‐ walking (Langhammer 2000; McClellan 2004; Van Vliet 2005); Walking Ability Questionnaire (Park 2011), Stroke Impact Scale ‐ mobility domain (van de Port 2012).
-
Sit‐to‐stand: Timed Up and Go (Baer 2007; Blennerhassett 2004b; Dean 2000; Kim 2012; Salbach 2004a), Motor Assessment Scale ‐ sit‐to‐stand (Langhammer 2000; Van Vliet 2005), sit‐to‐stand time in seconds (Howe 2005), and number of people able to stand safely and independently on two occasions (Barreca 2004).
-
Lower limb function: Sødring Motor Evaluation Scale ‐ trunk, balance and gait subscale (Langhammer 2000), Step Test (Baer 2007; Blennerhassett 2004b; Dean 2000), Motor Assessment Scale ‐ leg and trunk (Van Vliet 2005).
-
Standing balance and reach: Upright Equilibrium Index (de Sèze 2001), Functional Reach (McClellan 2004), Berg Balance Scale (Holmgren 2010; Kim 2012; Kim 2016; Salbach 2004a; Tung 2010), Activities Based Confidence Scale (Park 2011), Timed Balance Test (van de Port 2012).
Secondary outcomes
ADL measures
The Barthel Index (Baer 2007; Gordon 2013; Holmgren 2010;Kim 2016; Kwakkel 1999; Langhammer 2000; Salbach 2004; Van Vliet 2005), the Canadian Occupational Performance Measure (Ross 2009), Functional Independence Measure (de Sèze 2001), Frenchay Activity Index (Baer 2007). Three trials used the Barthel Index scoring out of 20 (Baer 2007; de Sèze 2001; Van Vliet 2005), while the other trials used the scoring out of 100.
Global motor function
Motor Assessment Scale (Baer 2007; Langhammer 2000), Balance Master System (Tung 2010), Rivermead Gross Function subscale (Van Vliet 2005), Rivermead Mobility Index (Peurala 2009), Stroke Impact Scale ‐ social participation subscale (van de Port 2012).
Quality of life/health status measures
Dartmouth Primary Care Cooperative Chart (COOP) (Barreca 2004), Nottingham Health Profile (NHP) (Kwakkel 1999; Langhammer 2000), the Short Form‐36 (health component) (Gordon 2013), Stroke Impact Scale (Baer 2007).
Adverse events
Number of falls (Barreca 2004; Holmgren 2010; van de Port 2012) and other serious and non‐serious adverse events (e.g. arrhythmias) (van de Port 2012; Winstein 2016) were measured.
Outcomes used at follow‐up
Upper limb outcome measures
We used the following outcomes for Comparisons 2.1.1 and 2.1.2:
Action Research Arm Test (Arya 2012),Time to complete Jebson Taylor Hand Test (Blennerhassett 2004), Sitting Equilibrium Index (de Sèze 2001), Lateral Reach Test ‐ time to return to quiet sitting (Howe 2005), Maximum reach distance (Dean 2007), Motor Assessment Scale ‐ upper arm (Langhammer 2000;Van Vliet 2005), Functional test of the hemiparetic upper extremity (Winstein 2004), Wolf Motor Function Test (Winstein 2016).
Lower limb outcome measures
We used the following outcomes for Comparisons 5.1.1 and 5.1.2:
Upright Equilibrium Index (de Sèze 2001), Walking speed with assistive device (Dean 2000), 10 Metre Walk Test (Dean 2007), Berg Balance Scale (Holmgren 2010 ‐ Comparison 5.1.1), Barthel Index (Holmgren 2010 ‐ Comparison 5.1.2), Sit‐to‐stand‐to‐sit (Howe 2005), Walking speed (Lennon 2009), Functional Reach Test (McClellan 2004), 6 Minute Walk Test (Blennerhassett 2004; Mudge 2009), Comfortable Walk Test (van de Port 2012) and Motor Assessment Scale ‐ walking (Langhammer 2000;Van Vliet 2005).
Excluded studies
There is a large number of excluded studies described in Characteristics of excluded studies. Because of the difficulties in determining whether trial interventions included task‐specific functional repetition, we have attempted to be as transparent as possible about the basis on which we excluded trials. The reasons for exclusion were:
-
not repetition, or unable to determine amount of practice: five studies;
-
comparison group also includes repetitive task practice: nine studies;
-
alternative mechanism of action: 10 studies.
We were unable to obtain subgroup data relating to stroke patients in one study (Sherrington 2008).
Ongoing studies
There are 11 ongoing studies, where the information available is sufficient to say that the interventions are RTT. Five trials involved training for standing, balance or sit‐to‐stand (Hariohm 2013; Korner‐Bitensky 2013; Kumaran 2010; Stuart 2009; Tanne 2008) . Six trials involved upper limb task‐specific training (NCT02765152; Bosomworth 2013; NCT02235974; CTRI/2015/06/005877; Schultz 2012; Turton 2011) (Characteristics of ongoing studies).
Studies awaiting classification
Fourteen studies are awaiting classification (Baglary 2013; Bhaskar 2009; Brkic 2016; NCT02429180; Eng 2009; Ferrari 2015; Gandhi 2015; Indurkar 2013; Knox 2014; Kumar 2012; Pandian 2014; ChiCTR‐ICR‐15005992; Zhu 2013; Xu 2012) (Characteristics of studies awaiting classification).
Risk of bias in included studies

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
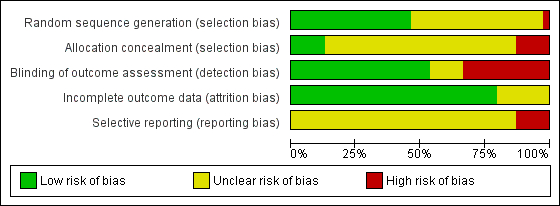
'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Allocation
Random sequence generation was adequate in 14 trials (Arya 2012; Baer 2007; Barreca 2004; Dean 2007; de Sèze 2001; Holmgren 2010; Howe 2005; Kwakkel 1999; Mudge 2009; Ross 2009; Salbach 2004; van de Port 2012; Van Vliet 2005; Winstein 2016). Allocation concealment was adequate in five trials (Arya 2012; Holmgren 2010; Howe 2005; Ross 2009; Winstein 2016).
Blinding
20 trials reported blinding of the outcome assessor (Arya 2012; Barreca 2004; Blennerhassett 2004; Dean 1997; Dean 2007; de Sèze 2001; Gordon 2013; Holmgren 2010; Howe 2005; Kim 2014;Kim 2016; Langhammer 2000; McClellan 2004; Park 2011; Ross 2009; Tung 2010; van de Port 2012; Van Vliet 2005; Winstein 2016; Yen 2005), however unblinding occurred in two trials (Baer 2007; Winstein 2016).
Incomplete outcome data
We deemed 25 trials to be at low risk of bias in relation to incomplete outcome data (Arya 2012; Baer 2007; Barreca 2004; Blennerhassett 2004; Dean 1997; Dean 2000; Dean 2007; de Sèze 2001; Holmgren 2010; Howe 2005; Kim 2012; Kim 2016; Kwakkel 1999; Langhammer 2000; Lennon 2009; McClellan 2004; Mudge 2009; Peurala 2009; Ross 2009; Salbach 2004; Turton 1990; van de Port 2012; Winstein 2004; Winstein 2016; Yen 2005).
Selective reporting
There were no study protocols available for any of the included trials to allow us to make a judgement of low risk of bias in relation to selective reporting with the exception of one recent trial (Winstein 2016) . All primary measures were not reported in five studies (Lennon 2009; Peurala 2009; van de Port 2012; Van Vliet 2005; Winstein 2016).
Other potential sources of bias
To detect systematic differences in care provided to participants in comparison groups other than the intervention under investigation, we assessed trials to determine whether groups were treated equally. In 15 studies participants in the intervention group received additional hours of therapy (Baer 2007; Frimpong 2014; Holmgren 2010; Howe 2005; Kim 2012; Kim 2014; Kim 2016; Park 2011; Peurala 2009; Ross 2009; Song 2015; Tung 2010; Turton 1990; van de Port 2012; Winstein 2004).
There is some evidence of baseline imbalance in 10 trials (de Sèze 2001; Dean 2000; Dean 2007; Kim 2012; Langhammer 2000; Lennon 2009; Tung 2010; Turton 1990; van de Port 2012; Van Vliet 2005); in van de Port 2012 analyses were adjusted for covariates at baseline.
Effects of interventions
See: Summary of findings for the main comparison
Primary outcomes
Results are presented for 1) upper limb, and 2) lower limb outcomes. All results are post therapy, except for Langhammer 2000, which is three months post stroke, and Van Vliet 2005, which is three months post baseline. We were not able to obtain data suitable for pooling from Baer 2007 and Song 2015.
Upper limb function: post treatment
Results are presented for 1) arm function, 2) hand function, and 3) sitting balance and reach.
Comparison 1.1: Arm function
Eleven trials recruiting 844 participants measured arm function (Arya 2012; Blennerhassett 2004a; Kwakkel 1999b; Langhammer 2000; Ross 2009; Salbach 2004b; Turton 1990; Van Vliet 2005; Winstein 2004; Winstein 2016; Yen 2005). Data were available for 88.7% (N = 749) of participants. The impact of functional training on upper limb function post therapy overall indicated a statistically significant effect favouring the treatment group: standardised mean difference (SMD) 0.25, 95% confidence interval (CI) 0.01 to 0.49 (Analysis 1.1, GRADE: low quality).
Comparison 1.2: Hand function
Eight trials recruiting 701 participants measured hand function (Arya 2012; Blennerhassett 2004a; Langhammer 2000; Ross 2009; Salbach 2004b; Turton 1990; Van Vliet 2005; Winstein 2016). Data were available for 88.3% (N = 619) of participants. The impact of functional training on hand function was statistically significant favouring the treatment group: SMD 0.25, 95% CI 0.00 to 0.51 (Analysis 1.2, GRADE: low quality).
Comparison 1.3: Sitting balance/reach
Six trials, recruiting 268 participants, measured sitting balance or functional reach (de Sèze 2001; Dean 1997; Dean 2007; Howe 2005; Langhammer 2000; Van Vliet 2005). Data were available for 82.8% (N = 222) of participants. There was some heterogeneity of treatment effects (I2 = 48%), although not sufficient to merit the use of a random‐effects approach. The impact of functional training on sitting balance and reach was statistically significant: SMD 0.28, 95% CI 0.01 to 0.55 (Analysis 1.3, GRADE: low quality).
Upper limb function: follow‐up
Comparison 2.1: All outcomes
Less than six months post treatment
Three trials recruiting 158 participants measured some aspect of upper limb function for retention effects of repetitive task training (RTT) interventions under six months post treatment (Arya 2012; de Sèze 2001; Howe 2005). Data were available for 96.8% (N = 153) of participants. There was a large effect size, which was statistically significant: SMD 0.92, 95% CI 0.58 to 1.26 (Analysis 2.1).
Between six and 12 months post treatment
Six trials recruiting 505 participants measured arm function for retention effects of RTT interventions between six and 12 months post treatment (Blennerhassett 2004a; Dean 2007; Langhammer 2000; Van Vliet 2005; Winstein 2004; Winstein 2016 ). Data were available for 81.6% (N = 412) of participants. Results showed no effect of treatment: SMD 0.10, 95% CI ‐0.09 to 0.30 (Analysis 2.1).
Upper limb function: subgroup analyses
Comparison 3.1: Dosage of task practice
Trials were classified according to whether they provided zero to 20 hours of therapy (nine trials), or more than 20 hours of therapy (six trials). The difference between groups did not reach statistical significance (Chi2 = 0.39, df = 1, P = 0.53) (Analysis 3.1).
Comparison 3.2: Time since stroke
Trials were classified according to whether they recruited within 15 days post stroke (four trials), 16 days to six months post stroke (seven trials), or more than six months post stroke (four trials). The difference between the groups did not reach statistical significance (Chi2 = 1.16, df = 2, P = 0.56) (Analysis 3.2).
Comparison 3.3: Type of intervention
Trials were classified according to whether they were whole therapy approaches (three trials), mixed task training (eight trials), or single task training (four trials). The difference between the groups did not reach statistical significance (Chi2 = 4.01, df = 2, P = 0.13) (Analysis 3.3).
Lower limb function: post treatment
Results are presented for 1) walking distance, 2) walking speed, 3) functional ambulation, 4) sit‐to‐stand, 5) lower limb function, and 6) standing balance/reach. All results are post therapy, except for Langhammer 2000, which is three months post stroke, and Van Vliet 2005, which is three months post baseline.
Comparison 4.1: Walking distance: change from baseline
Nine trials recruiting 638 participants measured walking distance (Blennerhassett 2004b; Dean 2000; Gordon 2013; Kim 2014; Kim 2016; Mudge 2009; Park 2011; Salbach 2004a; van de Port 2012). Data were available for 95.6% (N = 610) of participants. Change from baseline scores are presented. Using a random‐effects model because of significant heterogeneity in treatment effects, results were statistically significant: mean difference (MD) 34.80, 95% CI 18.19 to 51.41 (Analysis 4.1, GRADE: moderate quality). In effect, participants in the experimental groups could walk on average 35 metres further in six minutes than those in the control groups.
Comparison 4.2: Walking speed
Twelve trials recruiting 748 participants measured walking speed, with data available for 91.6% (N = 685) of participants (Dean 1997; Dean 2000; Dean 2007; Frimpong 2014; Kim 2014; Kwakkel 1999a; Lennon 2009; Olawale 2011; Park 2011; Salbach 2004a; van de Port 2012; Van Vliet 2005). Results were not statistically significant: SMD 0.39, 95% CI ‐0.02 to 0.79 (Analysis 4.2, GRADE: low quality).
Comparison 4.3: Functional ambulation
Eight trials recruiting 592 participants measured functional ambulation, with data available for 88.7% (N = 525) of participants (de Sèze 2001; Frimpong 2014; Kwakkel 1999a; Langhammer 2000; McClellan 2004; Park 2011; van de Port 2012; Van Vliet 2005). Results indicated a statistically significant effect: SMD 0.35, 95% CI 0.04 to 0.66 (Analysis 4.3, GRADE: moderate quality).
Comparison 4.4: Sit‐to‐stand: post treatment/change from baseline
Seven trials recruiting a total of 397 participants included a measure of sit‐to‐stand, with data available for 87% (N = 346) (Barreca 2004; Blennerhassett 2004b; Dean 2000; Howe 2005; Langhammer 2000; Salbach 2004a; Van Vliet 2005). Results were significant overall: SMD 0.35, 95% CI 0.13 to 0.56 (Analysis 4.4).
Comparison 4.5: Lower limb functional measures
Five trials recruiting 473 participants included a measure of lower limb function, with data available for 88.6% (N = 419) of participants (Blennerhassett 2004b; Dean 2000; Langhammer 2000; van de Port 2012; Van Vliet 2005). Results overall showed a small but statistically significant effect size: SMD 0.29, 95% CI 0.10 to 0.48 (Analysis 4.5, GRADE: low quality).
Comparison 4.6: Standing balance/reach
Nine trials recruiting 520 participants measured standing balance or functional reach, with data available for 96.9% (N = 504) (de Sèze 2001; Holmgren 2010; Kim 2012; Kim 2016; McClellan 2004; Park 2011; Salbach 2004a; Tung 2010; van de Port 2012). Results showed a small but statistically significant effect size: SMD 0.24, 95% CI 0.07 to 0.42 (Analysis 4.6).
Lower limb function: follow‐up
Comparison 5.1: all outcomes
Less than six months post treatment
Eight trials recruiting 496 participants measured some aspect of lower limb function for retention effects of RTT interventions under six months post treatment (de Sèze 2001; Dean 2000; Holmgren 2010; Howe 2005; Lennon 2009; McClellan 2004; Mudge 2009; van de Port 2012). Data were available for 95.0% (N = 471) of participants. Effects across trials were homogeneous (I2 = 6%). Results showed a moderate effect size which was statistically significant: SMD 0.34, 95% CI 0.16 to 0.52 (Analysis 5.1).
Between six to 12 months post treatment
Six trials recruiting 318 participants measured some aspect of lower limb function for retention effects of RTT interventions between six to 12 months post treatment (Blennerhassett 2004b; Dean 2007; Holmgren 2010; Langhammer 2000; Lennon 2009; Van Vliet 2005). Data were available for 84.3% (N = 268) of participants. Results showed no treatment effect: SMD 0.06, 95% CI ‐0.18 to 0.31 (Analysis 5.1).
Lower limb function: subgroup analyses
Comparison 6.1: Dosage of task practice
Eight trials providing more than 20 hours of task practice showed a moderate, statistically significant effect size: SMD 0.33, 95% CI 0.16 to 0.50. There was a small, statistically significant effect from 16 trials providing 20 hours training or less: SMD 0.39, 95% CI 0.07 to 0.71. However, the difference in effects between these subgroups was not statistically significant (Chi2 = 0.08, df = 1, P = 0.77) (Analysis 6.1).
Comparison 6.2: Time since stroke
The analysis suggests that size of the effect on lower limb function is the same whether recruitment to training is within 15 days post stroke (five trials): SMD 0.16, 95% CI ‐0.15 to 0.46, from 15 days to six months of stroke (nine trials): SMD 0.52, 95% CI ‐0.03 to 1.07, or more than six months post stroke (10 trials): SMD 0.41, 95% CI 0.21 to 0.60. There was no statistically significant difference between subgroups (Chi2 = 2.29, df = 2, P = 0.32) (Analysis 6.2).
Comparison 6.3: Type of intervention
Results for single task (five trials): SMD 0.07, 95% CI ‐0.42 to 0.55, and whole therapy approaches (two trials): SMD 0.10, 95% CI ‐0.24 to 0.43 were not statistically significant . Mixed training (17 trials) had a moderate and statistically significant effect: SMD 0.42, 95% CI 0.17 to 0.67. There was no statistically significant difference between subgroups (Chi2 = 3.16, df = 2, P = 0.21) (Analysis 6.3).
Secondary outcomes
Results are presented for 1) ADL function, 2) global motor function, 3) quality of life/health status, and 4) adverse events.
Comparison 7.1: Activities of daily living (ADL) function
Eleven intervention‐control pairs, recruiting a total of 616 participants, used a measure of ADL with data available for 85.5% (N = 527) (de Sèze 2001; Gordon 2013; Holmgren 2010; Kim 2016; Kwakkel 1999a; Kwakkel 1999b; Langhammer 2000; Ross 2009; Salbach 2004a; Salbach 2004b; Van Vliet 2005). Kwakkel 1999 comprises the combined results for the upper and lower limb training groups compared against a splint control group, based on the assumption that effect sizes are similar for the two intervention‐control pairs. The data presented for Salbach 2004 are the results for the lower limb training group compared against the upper limb training attention control group (Salbach 2004a). Overall results indicated a small effect size that was statistically significant: SMD 0.28, 95% CI 0.10 to 0.45 (Analysis 7.1).
Comparison 7.2: Global motor function
Five trials, recruiting a total of 269 participants measured global motor function (Kim 2014; Langhammer 2000; Peurala 2009; Tung 2010; Van Vliet 2005). Results were available for 82.5% (N = 222) of participants and indicated a small to moderate effect size; this was statistically significant: SMD 0.38, 95% CI 0.11 to 0.65 (Analysis 7.2, GRADE: moderate quality). There were too few trials to undertake planned subgroup analyses for global functional outcomes.
Comparison 7.3: Quality of life/health status
Four intervention‐control pairs recruiting 305 participants used a measure of quality of life or health status, with data available for 86.6% (N = 264) (Barreca 2004; Gordon 2013; Kwakkel 1999; Langhammer 2000). All results are post therapy except Kwakkel 1999, which was measured at 26 weeks. There was a small effect size, which was statistically significant: SMD 0.28, 95% CI 0.04 to 0.53 (Analysis 7.3).
Adverse events
One trial of sit‐to‐stand training presented data for the number of falls: intervention group 3/25 (12%) versus control group 4/23 (17.4%), OR 0.65, 95% CI 0.13 to 3.27 (Barreca 2004). In one trial of an intensive lower limb exercise programme, 11 participants in total fell during the study (32%), five in the intervention group and six in the attention control group (Holmgren 2010). Fall frequency was reported as 1.35 falls per person per year. Three participants in each group (18%) fell more than once; the most falls for any single subject was six. In the FIT‐Stroke trial, 29 falls were reported in the circuit training group and 26 in the usual physiotherapy group (P = 0.93) (van de Port 2012). Two serious adverse events were reported in the circuit training group: one participant fell and consulted a GP and one patient experienced arrhythmias during one session.
In one trial of an upper limb intervention there were 168 serious adverse events involving 109 participants (Winstein 2016). The most common were hospitalisation (N = 143, 25% of randomised participants) and recurrent stroke (N = 42, 9% of randomised participants). Adverse events were not presented by trial arm.
Two trials narratively reported no adverse effects (de Sèze 2001; McClellan 2004). In Salbach 2004, intervention‐related reasons for withdrawal that could be interpreted as adverse events included one participant out of 47 in a mobility training group who experienced the onset of groin pain. Four participants also fell during the mobility intervention but did not suffer injury and continued to participate in the group. Two falls also occurred during evaluation. No other trials reported intervention‐related reasons for withdrawal, however one study reported a withdrawal due to "disinterest" in the intervention group and one withdrawal who did not like the group sessions in the comparison group (Mudge 2009).
Sensitivity analyses
We carried out planned sensitivity analysis to investigate the following.
Studies with adequate allocation concealment (i.e. removing studies with high or unclear risk of bias for allocation concealment)
The significance of post treatment results was affected for Comparison 1.1 Arm function (removing eight studies: Blennerhassett 2004a; Kwakkel 1999b; Langhammer 2000; Salbach 2004b;Turton 1990; Van Vliet 2005; Winstein 2004; Yen 2005) (SMD 0.38, 95% CI ‐0.40 to 1.15), and Comparison 1.2 Hand function (removing five studies: Blennerhassett 2004a; Langhammer 2000; Salbach 2004b; Turton 1990; Van Vliet 2005) (SMD 0.38, 95% CI ‐0.22 to 0.98).
Sensitivity analysis was not possible for the following primary outcomes as one or no studies had adequate allocation concealment: sitting balance/reach, walking distance, walking speed, functional ambulation, sit‐to‐stand, lower limb functional measures and standing balance/reach.
Studies with an attention control comparison (i.e. removing studies with a usual care comparison)
The significance of post‐treatment results was affected for Comparison 1.1 Arm function (removing eight studies: Arya 2012; Langhammer 2000; Ross 2009; Turton 1990; Van Vliet 2005; Winstein 2004; Winstein 2016; Yen 2005) (SMD 0.17, 95% CI ‐0.16 to 0.49), Comparison 1.2 Hand function (removing six studies: Arya 2012; Langhammer 2000; Ross 2009; Turton 1990; Van Vliet 2005; Winstein 2016) (SMD 0.19, 95% CI ‐0.17 to 0.55), Comparison 4.3 Functional ambulation (removing six studies> de Sèze 2001; Frimpong 2014; Langhammer 2000; Park 2011; van de Port 2012; Van Vliet 2005) (SMD 0.19, 95% CI ‐0.72 to 1.10), Comparison 4.5 Lower limb functional measures (removing three studies: Langhammer 2000; van de Port 2012; Van Vliet 2005) (SMD 0.60, 95% CI ‐0.05 to 1.25), and Comparison 4.6 Standing balance/reach (removing six studies: de Sèze 2001; Kim 2012; Kim 2016; Park 2011; Tung 2010; van de Port 2012) (SMD 0.21, 95% CI ‐0.12 to 0.54).
Results were not affected for Comparison 1.3 Sitting balance/reach, Comparison 4.1 Walking distance, Comparison 4.2 Walking speed and Comparison 4.4 Sit‐to‐stand.
Studies with no additional therapy time (i.e. removing studies with additional therapy time)
The significance of post‐treatment results was affected for Comparison 1.3 Sitting balance/reach (removing one study, Howe 2005) (SMD 0.28, 95% CI ‐0.01 to 0.57), Comparison 4.3 Functional ambulation (removing three studies, Frimpong 2014; Park 2011; van de Port 2012) (SMD 0.25, 95% CI ‐0.03 to 0.54), Comparison 4.5 Lower limb functional measures (removing one study, van de Port 2012) (SMD 0.20, 95% CI ‐0.10 to 0.50) and Comparison 4.6 Standing balance/reach (removing six studies, Holmgren 2010; Kim 2012; Kim 2016; Park 2011; Tung 2010; van de Port 2012) (SMD 0.29, 95% CI ‐0.06 to 0.63).
Results were not affected for Comparison 1.1 Arm function, Comparison 1.2 Hand function, Comparison 4.1 Walking distance, Comparison 4.2 Walking speed and Comparison 4.4 Sit‐to‐stand
Studies where the intervention was delivered at an individual level (i.e. removing studies delivered at a group level)
The significance of post‐treatment results was affected for Comparison 4.3 Functional ambulation (removing two studies: Frimpong 2014; van de Port 2012) (SMD 0.24, 95% CI ‐0.01 to 0.48) and Comparison 4.5 Lower limb functional measures (removing three studies: Blennerhassett 2004b; Dean 2000; van de Port 2012) (SMD 0.09, 95% CI ‐0.24 to 0.43).
Results were not affected for Comparison 4.1 Walking distance, Comparison 4.2 Walking speed and Comparison 4.6 Sit‐to‐stand.
Discusión
Resumen de los resultados principales
Función/estabilidad en posición de sentado del miembro superior
Hubo pruebas de la efectividad del entrenamiento en tareas repetitivas (ETR) en la función del brazo (DME 0,25; IC del 95%: 0,01 a 0,49; GRADE: baja calidad), la función de la mano (DME 0,25; IC del 95%: 0,00 a 0,51; GRADE: baja calidad), y estabilidad/alcance funcional en posición de sentado (DME 0,28; IC del 95%: 0,01 a 0,55; GRADE: baja calidad). Hay pruebas de que el efecto se mantuvo hasta seis meses después del tratamiento (DME 0,92; IC del 95%: 0,58 a 1,26), pero no entre seis meses y un año después del tratamiento (DME 0,10; IC del 95%: ‐0,09 a 0,30). Los efectos del tratamiento no se modificaron por la dosis de la práctica de tareas, el tipo de intervención o el tiempo desde el accidente cerebrovascular.
Los resultados de la función del brazo y la mano dejaron de ser significativos cuando se retiraron del análisis los estudios con ocultación incierta o deficiente de la asignación; el retiro de los estudios con una comparación atención habitual también cambia la dirección de la significación. Los resultados de la estabilidad/alcance en posición de sentado dejaron de ser significativos cuando se retiró un estudio con tiempo adicional de tratamiento.
Un estudio parece ser un valor atípico, con un efecto del tratamiento mucho mayor sobre la función del brazo que otros estudios en la comparación (Arya 2012). Lo anterior se puede explicar por la inclusión de participantes con accidente cerebrovascular menos grave (puntuación de la National Institute of Health Stroke Scale < 14) y participantes capaces de participar en "ejercicios intensivos". El estudio también informó la intensidad de la intervención recibida (alrededor de 55 minutos por sesión en el grupo de intervención); esta información se proporcionó raras veces, por lo que no está claro si se logró el nivel específico de la intervención en la mayoría de los estudios.
Función/estabilidad en posición de pie del miembro inferior
Hubo pruebas de una repercusión estadísticamente significativa pequeña a moderada del ETR sobre la distancia de caminata (DM 34,80; IC del 95%: 18,19 a 51,41; GRADE: calidad moderada), el cambio de posición de sentado a posición de pie (DME 0,35; IC del 95%: 0,13 a 0,56) y la deambulación funcional (DME 0,35; IC del 95%: 0,04 a 0,66; GRADE: calidad moderada). También hubo pruebas de efecto sobre las medidas funcionales del miembro inferior (DME 0,29; IC del 95%: 0,10 a 0,48; GRADE: baja calidad), y la estabilidad/alcance en posición de pie (DME 0,24; IC del 95%: 0,07 a 0,42). Los resultados al seguimiento fueron estadísticamente significativos hasta los seis meses después del tratamiento (DME 0,34; IC del 95%: 0,16 a 0,52), pero no hasta un año después del tratamiento (DME 0,06; IC del 95%: ‐0,18 a 0,31). No hay pruebas que indiquen que el entrenamiento en tareas es más efectivo si se administra en el transcurso de 15 días, entre 16 días y seis meses, o más de seis meses después del accidente cerebrovascular. Los efectos de cantidades mayores versus menores de entrenamiento tampoco alcanzaron la significación estadística (P = 0,77); el tipo de entrenamiento (terapia completa, entrenamiento mixto o entrenamiento en tareas únicas) tampoco alcanzó significación estadística (p = 0,21); sin embargo, el tamaño de la muestra para el entrenamiento en tareas únicas (112) y la terapia completa (138) fue relativamente pequeño.
Los resultados para la deambulación funcional, las medidas funcionales del miembro inferior y estabilidad/alcance en posición de pie dejaron de ser significativos cuando se retiraron los estudios con una comparación atención habitual. El retiro de los estudios con tiempo adicional de tratamiento cambió los resultados a no significativos para la deambulación funcional, las medidas funcionales del miembro inferior y estabilidad/alcance en posición de pie. Los resultados para la deambulación funcional y las medidas funcionales del miembro inferior también se tornaron no significativos cuando se retiraron los estudios que administraron la intervención en un contexto grupal.
Un estudio reciente parece ser un valor atípico, con un efecto mayor sobre la velocidad de caminata y la deambulación funcional que otros estudios en estas comparaciones (Frimpong 2014). Las posibles explicaciones podrían ser el tamaño pequeño de la muestra (20 participantes en total) y la calidad deficiente del estudio: no se proporcionaron detalles suficientes para todos los elementos del riesgo de sesgo. El retiro de este estudio del análisis no cambia la dirección de la significación estadística en las comparaciones.
Medidas de resultado secundarias
En los cinco ensayos que utilizaron medidas de función motora general hubo un efecto pequeño sobre la función motora general (DME 0,38; IC del 95%: 0,11 a 0,65) (Kim 2014; Langhammer 2000; Peurala 2009; Tung 2010; Van Vliet 2005). Hubo un efecto pequeño estadísticamente significativo sobre las actividades cotidianas (AC) (DME 0,28; IC del 95%: 0,10 a 0,45) y las percepciones de la calidad de vida/estado de salud (DME 0,28; IC del 95%: 0,04 a 0,53). No hubo pruebas de confiabilidad suficiente con respecto al riesgo de eventos adversos.
Compleción y aplicabilidad general de las pruebas
Los ensayos incluidos fueron clínicamente diversos en cuanto al foco y existen brechas en la base de pruebas, en particular para los pacientes con más de seis meses después del accidente cerebrovascular. Sólo cuatro ensayos evaluaron la repercusión del ETR en la función del miembro superior en pacientes con más de seis meses después del accidente cerebrovascular: tres ensayos de 20 horas o menos (Dean 1997; Mudge 2009; Salbach 2004b), y dos de más de 20 horas (Ross 2009; Yen 2005). Sólo cinco ensayos evaluaron la repercusión de más de 20 horas de ETR sobre la función del miembro superior en pacientes con cero a seis meses después del accidente cerebrovascular (Arya 2012; Kwakkel 1999b; Turton 1990; Winstein 2016). Más ensayos se han centrado en la repercusión del ETR sobre la función del miembro inferior, pero también existen brechas en las pruebas; sólo seis ensayos evaluaron más de 20 horas de entrenamiento del miembro inferior en pacientes con cero a seis meses después del accidente cerebrovascular (Holmgren 2010; Kim 2016; Kwakkel 1999a; McClellan 2004; Peurala 2009; van de Port 2012 ).
Aunque no fue posible clasificar a los participantes en subgrupos con más o menos discapacidad, la tabla "Características de los estudios incluidos" ilustra la amplia variedad de niveles de discapacidad de los participantes en los ensayos incluidos. Sin embargo, muchos de los ensayos tuvieron criterios de inclusión que especificaron niveles mínimos, o niveles mínimos y máximos de capacidad, la motivación para participar y la capacidad de comprender las instrucciones. Por lo tanto, las pruebas aportadas por la revisión parecen ser ampliamente aplicables, quizás con la excepción de los pacientes con discapacidad muy grave con poco control postural o movimiento voluntario, los que presentan déficits muy leves y los que tienen dificultades graves de comunicación. Siete de los 33 estudios incluidos (Howe 2005; Holmgren 2010; Kwakkel 1999; Lennon 2009; Ross 2009; van de Port 2012; Van Vliet 2005) informaron el subtipo de accidente cerebrovascular mediante la herramienta de clasificación Oxfordshire Community Stroke Project (Bamford 1991).
No están claras la aceptabilidad y la seguridad del ETR en todos los tipos de participantes. Aunque en general se informaron pocos efectos adversos, la falta de un informe formal significa que este resultado no es concluyente. De la información proporcionada acerca de las razones para los abandonos en los ensayos, la causa más frecuente fue la enfermedad física, y sólo una proporción muy pequeña de los participantes abandonó por razones físicas que podrían haber estado relacionadas con la intervención. También hubo un número pequeño de participantes que se perdieron durante el seguimiento por razones relacionadas con el cumplimiento o la preferencia del tratamiento.
A menudo no se proporcionó información acerca del reclutamiento pero, de los que proporcionaron información, un ensayo grande que reclutó pacientes hospitalizados poco después del accidente cerebrovascular tuvo un número relativamente bajo de negativas a participar (por ejemplo, en Kwakkel 1999 cuatro de 101 participantes no dieron el consentimiento), mientras que un ensayo que reclutó en la comunidad después de la rehabilitación tuvo números altos de negativas a la intervención (Salbach 2004a tuvo 73% de negativas). Puede ser que algunas formas de intervención sean menos aceptables, o que las intervenciones sólo apelen a un subgrupo de supervivientes de accidente cerebrovascular, en particular si es necesario viajar.
No fue posible establecer una conclusión acerca de la repercusión del número de repeticiones como una medida de la intensidad de la práctica, ya que pocas veces se proporcionó esta información. Por lo tanto, la cantidad de práctica de las tareas es una medida de la duración de las sesiones de la intervención, en lugar de la cantidad de tiempo pasado en prácticas en tareas repetitivas o el número de repeticiones.
Tampoco fue posible hacer observaciones sobre las implicaciones de recursos de diferentes sitios de tratamiento, intervenciones administradas por terapeutas versus autoadministradas o de la administración grupal versus individual, ya que hubo muy pocos ensayos para la comparación. Sin embargo, la presencia de tres ensayos que incluyeron la autoadministración en el ambiente domiciliario (Holmgren 2010 (última semana de la intervención solamente); McClellan 2004; Turton 1990), y seis ensayos que incluyeron la administración grupal del entrenamiento con tareas específicas (Barreca 2004; Blennerhassett 2004; Dean 2000; Kim 2012; Mudge 2009; van de Port 2012), indican que estas formas de administración son factibles. En general los dos estudios que recopilaron información mostraron niveles altos de satisfacción con el programa (Barreca 2004; Dean 2000). Los niveles de asistencia a los programas comunitarios también fueron muy buenos, lo que indica que estos programas de entrenamiento fueron bien recibidos por los que decidieron participar.
La presente revisión se dirigió a evaluar si el ETR solo da lugar a ganancias funcionales a falta de otros mecanismos de acción. Sin embargo, se podría alegar que el ETR como intervención incluye necesariamente algunos mecanismos adicionales, por ejemplo muchos de los ensayos se refirieron a principios de aprendizaje motor como la base de la intervención. Este enfoque incluye un conjunto mucho más complejo de principios que la sola repetición de tareas específicas, que incluyen dirigirse a las necesidades individuales, la variación de las tareas y las formas particulares de retroalimentación. La inclusión de estos ensayos en la revisión indica una reducción del aprendizaje motor o las terapias de las ciencias del movimiento a su denominador común más bajo, pero incluso los ensayos que no señalaron una base en dichos enfoques a menudo incluyeron también aspectos de aprendizaje activo, formación de tareas, retroalimentación o individualización del tratamiento.
La definición de ETR de esta revisión y las decisiones posteriores acerca de la inclusión de los estudios tienen consecuencias para la aplicabilidad de las pruebas. Se excluyeron los ensayos en los que la repetición descrita pareció ser principalmente para el entrenamiento de fuerza o de resistencia, por ejemplo ciclismo o entrenamiento de la marcha, y en los que el tipo de entrenamiento pareció estar divorciado del objetivo funcional, por ejemplo entrenamiento en caminar hacia atrás, con tragamonedas o juegos en computadora. Al excluir los ensayos que se podrían definir como tipos de movimiento "prefuncional", en efecto se habría excluido un grupo de pacientes que, sin embargo, no pueden participar en el movimiento funcional. La misma consecuencia se aplica a la exclusión de los ensayos con un elemento grande de movimiento con ayuda pasiva y activa.
Desde la publicación de la revisión original, el ETR se ha convertido en una intervención establecida evaluada en los ensayos de rehabilitación. La calidad del informe de las intervenciones de ETR también ha mejorado enormemente. Por lo tanto, es probable que los estudios nuevos incluidos en esta actualización se asemejen más a los criterios de inclusión y la definición de ETR que los incluidos en la revisión original.
Calidad de la evidencia
El informe deficiente, en particular en los estudios más antiguos, hizo que el riesgo general de sesgo fuera incierto en muchos estudios: solamente ocho de los 33 ensayos tuvieron una ocultación adecuada de la asignación, aunque 22 estudios cegaron la evaluación de los resultados. Muchos de los ensayos fueron pequeños, con 21 ensayos con menos de 50 participantes. La inclusión de ensayos piloto y de factibilidad (cinco estudios) indica que muchos no tuvieron un poder estadístico suficiente para detectar una diferencia entre los grupos de intervención. Once estudios no descritos como ensayos piloto o de factibilidad informaron un cálculo del poder estadístico; 13 estudios adicionales no lo informaron.
Sesgos potenciales en el proceso de revisión
Cuando se diseñó la revisión se tomó la decisión inmediata de considerar el efecto del ETR sobre los resultados de función del miembro superior e inferior por separado, ya que se consideró que podría haber una repercusión diferencial. Los resultados de la revisión apoyan esta decisión, aunque hay dos desventajas. En primer lugar, no fue posible brindar una estimación general del efecto del ETR, aunque la consideración de las diferentes intervenciones y objetivos del entrenamiento del miembro superior e inferior puede no haber sido un elemento clínicamente significativo. En segundo lugar, los análisis de subgrupos son más pequeños, por lo que tienen un poder estadístico menor que el que habrían tenido si se hubieran combinado todos los ensayos. Como el número de estudios informados en los análisis de subgrupos es pequeño, los resultados se deben analizar con precaución.
El objetivo principal en esta revisión fue la repercusión sobre la función de las tareas específicas. En la práctica se excluyó un gran número de estudios sobre la base de que no consideraron los resultados como funcionales, o que la intervención fuera con tareas específicas. También se incluyeron los estudios en los que la interpretación de la intervención fue que la repetición del movimiento funcional fue el mecanismo de acción principal (por ejemplo, de Sèze 2001). También es un tema de interpretación si el entrenamiento de la estabilidad es verdaderamente "funcional".
Aunque las intervenciones a menudo se describieron bien, en ocasiones fue difícil calcular la intensidad relativa del tratamiento, especialmente en las intervenciones mixtas. La información sobre el número de repeticiones estuvo disponible en pocas ocasiones. Lo anterior significa posiblemente que la revisión investiga la repercusión de la especificidad de las tareas funcionales en lugar del elemento de repetición. La decisión fue incluir los ensayos si fue posible identificar claramente la cantidad de práctica.
Los ensayos incluidos utilizaron una amplia variedad de medidas de resultado, metodologías e intervalos de seguimiento, lo que dificultó las estadísticas resumen. Se realizaron grandes esfuerzos para obtener los datos apropiados para agrupar cada resultado, pero en ocasiones no estaban disponibles, y el método de agrupamiento fue menos que óptimo, al igual que el uso de la diferencia de medias estandarizada para la velocidad de caminata. Habría sido mejor utilizar los cambios en el resultado en comparación con el valor inicial, especialmente en los análisis con números más pequeños de participantes, pero tampoco estuvieron disponibles en los ensayos. También se utilizaron en general los análisis de efectos fijos, que se podrían criticar debido a la presencia de alguna heterogeneidad clínica en los tratamientos y los ensayos combinados.
El análisis de subgrupos del diseño de los ensayos (o sea, atención control versus control atención habitual) alcanzó significación estadística (P = 0,88). Sin embargo, mantener los ensayos de miembros superiores e inferiores separados significó que no fue posible la subdivisión adicional en tipos de grupos de comparación.
Acuerdos y desacuerdos con otros estudios o revisiones
A diferencia de la revisión original, que no encontró pruebas de un efecto beneficioso significativo del ETR del miembro superior, esta actualización indica un efecto beneficioso significativo en la función del brazo y la mano, con efectos beneficiosos mantenidos en el seguimiento a corto plazo (hasta seis meses después de la intervención). Sin embargo, los estudios fueron heterogéneos (I2 58% y 54% para la función del brazo y la mano, respectivamente). El entrenamiento en tareas repetitivas del miembro inferior encontró efectos beneficiosos significativos en todas las medidas de resultado primarias y secundarias, con la excepción de la velocidad de caminata. Lo anterior coincide con revisiones recientes sobre fisioterapia (Verbeek 2014) e intervenciones dirigidas a la recuperación motora después del accidente cerebrovascular (Langhorne 2009).
Los efectos del tratamiento de cantidades de entrenamiento mayores versus menores no alcanzaron significación estadística para el miembro superior, lo que indica que los resultados no están mediados por la cantidad de práctica. Los hallazgos en el miembro superior no apoyan una revisión y metanálisis recientes de la fisioterapia después del accidente cerebrovascular (Verbeek 2014), lo que indica que se necesita una práctica de alta intensidad (específicamente un tiempo de tratamiento adicional de 17 horas durante diez semanas) para un efecto beneficioso funcional. Los resultados tampoco apoyan la relación dosis‐respuesta identificada entre la cantidad de tratamiento y un mejor resultado del entrenamiento del miembro superior encontrado en Kwakkel 2004.
En el miembro inferior, el efecto de más de 20 horas de entrenamiento en tareas fue mayor que el entrenamiento de cero a 20 horas, pero la diferencia entre los subgrupos no fue significativa (p = 0,77), contrario a los hallazgos de Van der Lee 2001, en el que se encontró que más de 20 horas de entrenamiento fue preferible a hasta 20 horas de entrenamiento. Una revisión reciente de enfoques de fisioterapia concluyó de manera similar que, con respecto a la dosis de la intervención, el análisis de subgrupos mostró que una dosis de 30 a 60 minutos por día administrada de cinco a siete días por semana fue efectiva en cuanto a la independencia en las AC (Pollock 2014b). Los resultados del análisis de subgrupos indican que los estudios de investigación adicionales sobre la relación dosis‐respuesta en las intervenciones en los miembros inferiores deben ser una prioridad.
Hubo efectos positivos pequeños sobre la función motora general, las AC y la deambulación funcional. Aunque la magnitud del cambio sea pequeña, es probable que el efecto beneficioso clínico del cambio en las actividades cotidianas sea significativo con respecto a la calidad de vida (Van Exel 2004).
En los estudios que mostraron un efecto beneficioso y proporcionaron evaluaciones más tardías, las mejorías al final del entrenamiento fueron evidentes en la función del miembro superior y el inferior hasta seis meses después del tratamiento, pero no más allá. A partir de esta revisión no está claro si lo anterior se relaciona con las características de los participantes, la intensidad del entrenamiento o el grado de mejoría requerido antes de que se observara el cambio detectable.
Las pruebas de esta revisión no apoyan la indicación de que la provisión más temprana de tratamiento dé lugar a una mayor mejoría funcional. La mejoría en la función fue posible incluso en las etapas más tardías de la recuperación (Page 2004).
En una revisión de los tratamientos con fisioterapia después del accidente cerebrovascular (Pollock 2014b) se indica que se deben realizar estudios de investigación para determinar la eficacia de las técnicas individuales claramente descritas y los tratamientos con tareas específicas. La definición clara de las técnicas individuales aún es un reto, pero esta revisión indica que es posible centrarse en tratamientos específicos; actualmente existen clasificaciones taxonómicas para la agrupación de dichas intervenciones (p.ej. Pollock 2014a). Los lectores pueden no coincidir con la clasificación de los estudios de la presente revisión, pero los revisores compararon detalladamente todas las intervenciones para tomar estas decisiones difíciles.
Los mecanismos de acción responsables de cualquier ganancia funcional del miembro inferior aún no están claros. Muchas de las intervenciones fueron mixtas y, aunque todas contenían prácticas de repetición y funcionales, también podrían incluir elementos de entrenamiento de resistencia o de fuerza. Sin embargo, la revisión del entrenamiento en estera encontró que los pacientes que reciben entrenamiento de rutina con o sin apoyo de peso corporal después de un accidente cerebrovascular no tienen más probabilidades de mejorar su capacidad para caminar de forma independiente en comparación con los pacientes que no reciben entrenamiento habitual después de un accidente cerebrovascular, pero puede haber mejoría en la velocidad de caminata y la resistencia en la caminata (Mehrholz 2014). Los resultados de una revisión reciente de tratamiento ayudado por robots en la función del brazo encontraron pruebas de calidad moderada de que la robótica puede ser efectiva para mejorar la deficiencia de los miembros superiores y los resultados de las AC (Mehrholz 2015b). Sin embargo, es posible que la robótica no sea más beneficiosa que el tratamiento convencional a la misma dosis. Debido a que la repetición es el mecanismo de acción principal en la estera y la robótica, indicaría que el reflejo de la complejidad de las tareas del mundo real en el entrenamiento es un factor significativo. Sin embargo, otros posibles mecanismos de acción también están implícitos en algunas de las intervenciones de los ensayos como la autoeficacia, la novedad de la tarea y la motivación para participar en las intervenciones administradas en contextos grupales.

Study flow diagram (2007 review and update 2016 figures)

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Comparison 1 Upper limb function: post treatment, Outcome 1 Arm function.

Comparison 1 Upper limb function: post treatment, Outcome 2 Hand function.

Comparison 1 Upper limb function: post treatment, Outcome 3 Sitting balance/reach.

Comparison 2 Upper limb function: follow‐up, Outcome 1 All outcomes.

Comparison 3 Upper limb function: subgroup analyses, Outcome 1 Dosage of task practice.

Comparison 3 Upper limb function: subgroup analyses, Outcome 2 Time since stroke.

Comparison 3 Upper limb function: subgroup analyses, Outcome 3 Type of intervention.

Comparison 4 Lower limb function: post treatment, Outcome 1 Walking distance: change from baseline.

Comparison 4 Lower limb function: post treatment, Outcome 2 Walking speed.

Comparison 4 Lower limb function: post treatment, Outcome 3 Functional ambulation.

Comparison 4 Lower limb function: post treatment, Outcome 4 Sit‐to‐stand: post treatment/change from baseline.

Comparison 4 Lower limb function: post treatment, Outcome 5 Lower limb functional measures.

Comparison 4 Lower limb function: post treatment, Outcome 6 Standing balance/reach.

Comparison 5 Lower limb function: follow‐up, Outcome 1 All outcomes.

Comparison 6 Lower limb function: subgroup analyses, Outcome 1 Dosage of task practice.

Comparison 6 Lower limb function: subgroup analyses, Outcome 2 Time since stroke.

Comparison 6 Lower limb function: subgroup analyses, Outcome 3 Type of intervention.

Comparison 7 Secondary outcomes, Outcome 1 Activities of daily living function.

Comparison 7 Secondary outcomes, Outcome 2 Global motor function scales.

Comparison 7 Secondary outcomes, Outcome 3 Quality of life/health status.
| Repetitive task training compared with usual care or attention control for patients with stroke | ||||||
| Patient or population: people with stroke Settings: hospital, clinic or home Intervention: repetitive task training (RTT) Comparison: usual care, attention control or no treatment | ||||||
| Outcomes | Illustrative comparative risks (95% CI) | Relative effect | No of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Estimated score / value with control | Absolute reduction in score / value with RTTa | |||||
| Arm function | Arm function score in the repetitive task training groups was on average 0.25 standard deviations (0.01 to 0.49) higher than in the control groups. SD units, measured using different instruments; higher scores mean better arm function. | SMD 0.25, 95% CI 0.01 to 0.49 | 11 studies 749 participants | ⊕⊕⊝⊝ | Downgraded by one level for inconsistency (12 58%). Downgraded by one level for study design (random sequence generation unclear in 4/11 trials and high risk in 1/11 trials in the meta‐analysis; allocation concealment unclear in 7/11 trials and high risk in 1/11 trials). | |
| Hand function | Hand function score in the repetitive task training groups was on average 0.25 standard deviations (0.00 to 0.51) higher than in the control groups. SD units, measured using different instruments; higher scores mean better hand function. | SMD 0.25, 95% CI 0.00 to 0.51 | 8 studies 619 participants | ⊕⊕⊝⊝ | Downgraded by one level for inconsistency (12 54%). Downgraded by one level for study design (random sequence generation unclear in 2/8 trials and high risk in 1/8 trials in the meta‐analysis; allocation concealment unclear in 4/8 trials and high risk in 1/8 trials). | |
| Walking distance: change from baseline | The mean change in walking distance (metres walked in six minutes; a higher score means greater walking distance) in the control groups ranged from ‐1.0 to 118.5. | The mean change in walking distance (metres walked in six minutes; a higher score means greater walking distance) in the repetitive training group ranged from 19 to 221. | MD 34.80, 95% CI 18.19 to 51.41 | 9 studies 610 participants | ⊕⊕⊕⊝ | Downgraded by one level for study design (random sequence generation unclear in 6/9 trials in the meta‐analysis; allocation concealment unclear in 6/9 trials and high risk in 3/9 trials). |
| Walking speed | The mean walking speed in the control groups ranged from | The mean walking speed in the intervention groups ranged from 0.39 to 2.03 metres per second. A higher score means faster walking speed. | SMD 0.39, 95% CI ‐0.02 to 0.79 | 12 studies 685 participants | ⊕⊕⊝⊝ | Downgraded by one level for inconsistency (12 80%). Downgraded by one level for study design (random sequence generation unclear in 7/12 trials in the meta‐analysis; allocation concealment unclear in 9/12 trials and high risk in 3/12 trials). |
| Functional ambulation | Functional ambulation score in the repetitive task training groups was on average 0.35 standard deviations (0.04 to 0.66) higher than in the control groups. SD units, measured using different instruments; higher scores mean better function. | SMD 0.35, 95% CI 0.04 to 0.66 | 8 studies 525 participants | ⊕⊕⊕⊝ | Downgraded by one level for study design (random sequence generation unclear in 4/8 trials in the meta‐analysis; allocation concealment unclear in 7/8 trials and high risk in 1/8 trials). | |
| Lower limb functional measures | Lower limb functional measures in the repetitive task training groups were on average 0.29 standard deviations (0.10 to 0.48) higher than in the control groups. SD units, measured using different instruments; higher scores mean better function. | SMD 0.29, 95% CI 0.10 to 0.48 | 5 studies 419 participants | ⊕⊕⊝⊝ | Downgraded by one level for study design (random sequence generation unclear in 3/5 trials in the meta‐analysis; allocation concealment unclear in 3/5 trials and high risk in 1/5 trials). Downgraded by one level for publication bias; 4 out of 5 are small studies (less than 50 participants). | |
| Global motor function scales | Global motor function in the repetitive task training groups was on average 0.38 standard deviations (0.11 to 0.65) higher than in the control groups. SD units, measured using different instruments; higher scores mean better function. | SMD 0.38, 95% CI 0.11 to 0.65 | 5 studies 222 participants | ⊕⊕⊕⊝ | Downgraded by one level for study design (random sequence generation unclear in 4/5 trials in the meta‐analysis; allocation concealment unclear in 4/5 trials and high risk in 1/5 trials). | |
| Adverse events | Barreca 2004: 3/25 (12%) falls in the intervention group versus 4/23 (17.4%) in the control group, OR 0.65, 95% CI 0.13 to 3.27. Holmgren 2010: 11 participants in total fell during study (32%), five in the intervention group and six in the attention control group. van de Port 2012: 29 falls reported in the circuit training group and 26 in the usual physiotherapy group (P = 0.93). Two serious adverse events were reported in the circuit training group: one participant fell and consulted a GP and one patient experienced arrhythmias during one session. Winstein 2016: 168 serious adverse events involving 109 participants. The most common were hospitalisation (n = 143, 25% of randomised participants) and recurrent stroke (n = 42, 9% of randomised participants). Adverse events were not presented by trial arm. Salbach 2004: intervention‐related reasons for withdrawal that could be interpreted as adverse events included one participant out of 47 in a mobility training group who experienced the onset of groin pain. Four participants also fell during the mobility intervention but did not suffer injury and continued to participate in the group. Two falls also occurred during evaluation. Two trials narratively reported no adverse effects (de Sèze 2001; McClellan 2004). | |||||
| a As a rule of thumb, 0.2 SD represents a small difference, 0.5 a moderate, and 0.8 a large difference. CI: confidence interval; MD: mean difference; SMD: standardised mean difference; OR: odds ratio; SD: standard deviation | ||||||
| GRADE Working Group grades of evidence | ||||||
| STUDY | Task practice dose | Time since stroke | Type of intervention | Practice intensity | Allocation conceal | Comparison group | Therapy equivalence | Small trials |
| 1 = 20 hours or less 2 = more than 20 hours | 1 = 1 to 14 days 2 = 15 days to 6 months 3 = more than 6 months | 1 = whole therapy 2 = mixed task 3 = single task | 1 = 1 to 4 weeks or less 2 = more than 4 weeks | A = adequate B = inadequate/unclear | AC = attention control UC = usual care | EQ = equivalent therapy time ADD = additional therapy time | 1 = less than 25 participants 2 = 25 or more participants | |
| Not reported | 2 | 1 | 1 | A | UC | EQ | 2 | |
| Not reported | 3 | 2 | 1 | B | UC | ADD | 2 | |
| 1 | 2 | 1 | 2 | B | AC | ADD | 2 | |
| 1 | 2 | 2 | 1 | B | AC | EQ | 2 | |
| 1 | 3 | 3 | 1 | B | AC | EQ | 1 | |
| 1 | 3 | 2 | 1 | B | AC | EQ | 1 | |
| 1 | 2 | 3 | 1 | B | AC | EQ | 1 | |
| 1 | 2 | 3 | 1 | B | UC | EQ | 2 | |
| 1 | 2 | 2 | 2 | B | UC | ADD | 1 | |
| 1 | 3 | 2 | 2 | B | AC | EQ | 2 | |
| 2 | 2 | 2 | 2 | A | UC | ADD | 2 | |
| 1 | 2 | 3 | 1 | A | UC | ADD | 2 | |
| 1 | 3 | 2 | 1 | B | UC | ADD | 1 | |
| 1 | 3 | 2 | 1 | B | UC | ADD | 2 | |
| 2 | 2 | 2 | 1 | B | UC | ADD | 1 | |
| 2 | 1 | 2 | 2 | B | AC | EQ | 2 | |
| 1 | 1 | 1 | 1 | B | UC | EQ | 2 | |
| 1 | 1 | 2 | 1 | B | UC | EQ | 2 | |
| 2 | 3 | 2 | 2 | B | AC | EQ | 2 | |
| 1 | 3 | 2 | 1 | B | AC | EQ | 2 | |
| 2 | 3 | 2 | 2 | B | UC | EQ | 2 | |
| 1 | 3 | 2 | 1 | B | UC | ADD | 2 | |
| 2 | 1 | 2 | 1 | B | UC | ADD | 2 | |
| 2 | 3 | 2 | 2 | A | UC | ADD | 2 | |
| 1 | 3 | 2 | 2 | B | AC | EQ | 2 | |
| 1 | 3 | 2 | 1 | B | UC | ADD | 1 | |
| 1 | 3 | 1 | 1 | B | UC | ADD | 2 | |
| 2 | 2 | 2 | 2 | B | UC | ADD | 1 | |
| 2 | 2 | 2 | 2 | B | UC | ADD | 2 | |
| 1 | 1 | 1 | 1 | B | UC | EQ | 2 | |
| 1 | 1 | 2 | 1 | B | UC | ADD | 2 | |
| 2 | 2 | 2 | 2 | A | UC | EQ | 2 | |
| 2 | 3 | 2 | 1 | B | UC | EQ | 2 |
| Author and year | Global function | Lower limb function | Balance/sit‐to‐stand | Upper limb function | Hand function | ADL function | QOL, health status | Adverse events |
| Action Research Arm Test ‐ gross arm movement | ||||||||
| Number of participants able to stand | Dartmouth COOP | Falls | ||||||
| Blennerhassett 2004; Blennerhassett 2004a; Blennerhassett 2004b | 6 Minute Walk Test; Step Test | Timed Up & Go Test | Motor Assessment Scale ‐ arm | Motor Assessment Scale ‐ hand | ||||
| 10 Metre Walk Speed | Reaching distance | |||||||
| 6 Minute Walk Test; 10 Metre Walk Speed; Step Test | Timed Up & Go Test | |||||||
| 10 Metre Walk Test | Reaching distance | |||||||
| Functional Ambulation Classification | Sitting and Standing Equilibrium Index | Functional Independence Measure | ||||||
| 10 Metre Walk Test Functional Ambulatory Category | ||||||||
| 6 Minute Walk Test | Barthel Index | SF‐36 physical health component | ||||||
| Berg Balance Scale | Barthel Index | |||||||
| Lateral reach ‐ time, sit‐to‐stand ‐ time | ||||||||
| 10 Metre Walk Speed | Berg Balance Scale; Timed Up & Go Test | |||||||
| Stroke Impact Scale ‐ social participation subscale | 10 Metre Walk Test 6 Minute Walk Test | |||||||
| 6 Minute Walk Test | Berg Balance Scale | Korean version of Modified Barthel Index | ||||||
| Functional Ambulation Classification; Walking speed | Action Research Arm Test | Barthel Index | Nottingham Health Profile | |||||
| Motor Assessment Scale | Motor Assessment Scale ‐ walking; Sødring Motor Evaluation Scale ‐ trunk, balance and gait | Motor Assessment Scale ‐ balanced sitting, Motor Assessment Scale ‐ sit‐to‐stand | Motor Assessment Scale ‐ arm | Motor Assessment Scale ‐ hand | Barthel Index | Nottingham Health Profile | ||
| 5 Metre Walk Speed | ||||||||
| Motor Assessment Scale ‐ walking | Functional Reach Test | |||||||
| 6 Minute Walk Test | ||||||||
| 10 Metre Walk Speed | ||||||||
| 10 Metre Walk Speed; 6 Minute Walk Test; Walking ability questionnaire | Activities‐Specific Balance Confidence Scale | |||||||
| Rivermead Mobility Index | ||||||||
| Wolf Motor Function Test (functional score) | Canadian Occupational Performace Measure | |||||||
| 6 Minute Walk Test; 5 Metre Walk Speed | Timed Up and Go Test; Berg Balance Scale | Box & Block Test | 9 Hole Peg Test | Barthel Index | ||||
| Berg Balance Scale | ||||||||
| Southern Motor Group's Motor Assessment ‐ upper extremity | 10 Hole Peg Test | |||||||
| 6 Minute Walk Test; 5 Metre Walk Speed; Stroke Impact Scale ‐ mobility domain | Timed Balance Test | |||||||
| Rivermead Motor Assessment ‐ gross function | Rivermead Motor Assessment ‐ leg and trunk; 6 Minute Walk Test; Motor Assessment Scale ‐ walking, Motor Assessment Scale ‐ leg and truck | Motor Assessment Scale ‐ balanced sitting, Motor Assessment Scale ‐ sit‐to‐stand | Motor Assessment Scale ‐ arm | Motor Assessment Scale ‐ hand | Barthel Index | |||
| Functional Test of the Hemiparetic Upper Extremity | ||||||||
| Log Wolf Motor Function Test | Stroke Impact Scale ‐ hand function | |||||||
| Wolf Motor Function Test |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Arm function Show forest plot | 11 | 749 | Std. Mean Difference (IV, Random, 95% CI) | 0.25 [0.01, 0.49] |
| 2 Hand function Show forest plot | 8 | 619 | Std. Mean Difference (IV, Random, 95% CI) | 0.25 [0.00, 0.51] |
| 3 Sitting balance/reach Show forest plot | 6 | 222 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.28 [0.01, 0.55] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All outcomes Show forest plot | 9 | Std. Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 1.1 Under 6 months post treatment | 3 | 153 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.92 [0.58, 1.26] |
| 1.2 6 to 12 months post treatment | 6 | 412 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.10 [‐0.09, 0.30] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Dosage of task practice Show forest plot | 15 | 833 | Std. Mean Difference (IV, Random, 95% CI) | 0.33 [0.11, 0.56] |
| 1.1 0 to 20 hours | 9 | 383 | Std. Mean Difference (IV, Random, 95% CI) | 0.23 [0.00, 0.46] |
| 1.2 More than 20 hours | 6 | 450 | Std. Mean Difference (IV, Random, 95% CI) | 0.38 [‐0.03, 0.80] |
| 2 Time since stroke Show forest plot | 15 | 833 | Std. Mean Difference (IV, Random, 95% CI) | 0.33 [0.11, 0.56] |
| 2.1 0 to 15 days | 4 | 239 | Std. Mean Difference (IV, Random, 95% CI) | 0.21 [‐0.04, 0.47] |
| 2.2 16 days to 6 months | 7 | 421 | Std. Mean Difference (IV, Random, 95% CI) | 0.48 [0.06, 0.91] |
| 2.3 More than 6 months | 4 | 173 | Std. Mean Difference (IV, Random, 95% CI) | 0.24 [‐0.23, 0.72] |
| 3 Type of intervention Show forest plot | 15 | 833 | Std. Mean Difference (IV, Random, 95% CI) | 0.33 [0.11, 0.56] |
| 3.1 Whole therapy | 3 | 240 | Std. Mean Difference (IV, Random, 95% CI) | 0.51 [‐0.18, 1.20] |
| 3.2 Mixed training | 8 | 509 | Std. Mean Difference (IV, Random, 95% CI) | 0.14 [‐0.03, 0.32] |
| 3.3 Single task training | 4 | 84 | Std. Mean Difference (IV, Random, 95% CI) | 0.71 [0.11, 1.30] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Walking distance: change from baseline Show forest plot | 9 | 610 | Mean Difference (IV, Random, 95% CI) | 34.80 [18.19, 51.41] |
| 2 Walking speed Show forest plot | 12 | 685 | Std. Mean Difference (IV, Random, 95% CI) | 0.39 [‐0.02, 0.79] |
| 3 Functional ambulation Show forest plot | 8 | 525 | Std. Mean Difference (IV, Random, 95% CI) | 0.35 [0.04, 0.66] |
| 4 Sit‐to‐stand: post treatment/change from baseline Show forest plot | 7 | 346 | Std. Mean Difference (Fixed, 95% CI) | 0.35 [0.13, 0.56] |
| 5 Lower limb functional measures Show forest plot | 5 | 419 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.29 [0.10, 0.48] |
| 6 Standing balance/reach Show forest plot | 9 | 504 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.24 [0.07, 0.42] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All outcomes Show forest plot | 12 | Std. Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 1.1 Under 6 months post treatment | 8 | 471 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.34 [0.16, 0.52] |
| 1.2 6 to 12 months post treatment | 6 | 268 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.06 [‐0.18, 0.31] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Dosage of task practice Show forest plot | 24 | 1144 | Std. Mean Difference (IV, Random, 95% CI) | 0.32 [0.12, 0.53] |
| 1.1 0 to 20 hours | 16 | 583 | Std. Mean Difference (IV, Random, 95% CI) | 0.39 [0.07, 0.71] |
| 1.2 More than 20 hours | 8 | 561 | Std. Mean Difference (IV, Random, 95% CI) | 0.33 [0.16, 0.50] |
| 2 Time since stroke Show forest plot | 24 | 1144 | Std. Mean Difference (IV, Random, 95% CI) | 0.32 [0.12, 0.53] |
| 2.1 0 to 15 days | 5 | 288 | Std. Mean Difference (IV, Random, 95% CI) | 0.16 [‐0.15, 0.46] |
| 2.2 16 days to 6 months | 9 | 428 | Std. Mean Difference (IV, Random, 95% CI) | 0.52 [‐0.03, 1.07] |
| 2.3 More than 6 months | 10 | 428 | Std. Mean Difference (IV, Random, 95% CI) | 0.41 [0.21, 0.60] |
| 3 Type of intervention Show forest plot | 24 | 1144 | Std. Mean Difference (IV, Random, 95% CI) | 0.32 [0.12, 0.53] |
| 3.1 Whole therapy | 2 | 138 | Std. Mean Difference (IV, Random, 95% CI) | 0.10 [‐0.24, 0.43] |
| 3.2 Mixed training | 17 | 894 | Std. Mean Difference (IV, Random, 95% CI) | 0.42 [0.17, 0.67] |
| 3.3 Single task training | 5 | 112 | Std. Mean Difference (IV, Random, 95% CI) | 0.07 [‐0.42, 0.55] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Activities of daily living function Show forest plot | 9 | 527 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.28 [0.10, 0.45] |
| 2 Global motor function scales Show forest plot | 5 | 222 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.38 [0.11, 0.65] |
| 3 Quality of life/health status Show forest plot | 4 | 264 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.28 [0.04, 0.53] |

