Cannabis para el tratamiento de la colitis ulcerosa
Resumen
Antecedentes
El cannabis y los canabinoides se promueven con frecuencia como tratamiento para muchas enfermedades y son de uso amplio en pacientes con colitis ulcerosa (CU). En pocos estudios se ha evaluado el uso de estos agentes en la CU. Además, el cannabis puede causar eventos adversos y no se conocen las consecuencias a largo plazo del uso de cannabis y de canabinoides en la CU.
Objetivos
Evaluar la eficacia y la seguridad del cannabis y los canabinoides para el tratamiento de los pacientes con CU.
Métodos de búsqueda
Se realizaron búsquedas en MEDLINE, Embase, la ICTRP de la OMS, AMED, PsychINFO, el registro especializado de ensayos del Grupo Cochrane de Enfermedad Inflamatoria Intestinal y Trastornos Funcionales del Intestino (Cochrane IBD Group), CENTRAL, clinicalTrials.Gov y el registro de ensayos clínicos europeo desde su inicio hasta el 2 de enero de 2018. Se hicieron búsquedas en las referencias y resúmenes de congresos para identificar estudios adicionales.
Criterios de selección
Se incluyeron los ensayos controlados aleatorios (ECA) que compararon cualquier forma o dosis de cannabis o derivados de canabinoide (natural o sintético) con un placebo o un tratamiento activo en pacientes adultos (> 18 años) con CU.
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, examinaron los resultados de la búsqueda, extrajeron los datos y evaluaron el sesgo mediante la herramienta Cochrane riesgo de sesgo. Los resultados primarios fueron: la remisión clínica y la recurrencia (tal como las definieron los estudios primarios). Los resultados secundarios fueron: la respuesta clínica, la remisión endoscópica, la mejoría endoscópica, la mejoría histológica, la calidad de vida, la proteína C reactiva (PCR) y las mediciones de calprotectina fecal, la mejoría de los síntomas, los eventos adversos, los eventos adversos graves, los retiros debido a eventos adversos, los eventos adversos psicotrópicos y la dependencia del cannabis y los efectos de la abstinencia. Se calculó el cociente de riesgos (CR) y el intervalo de confianza (IC) del 95% correspondiente para los resultados dicotómicos. Para los datos continuos, se calculó la diferencia de medias (DM) y el IC del 95% correspondiente. Los datos se agruparon para análisis cuando las intervenciones, los grupos de pacientes y los resultados fueron suficientemente similares (decidido por consenso). Los datos se analizaron por intención de tratar (intention‐to‐treat analysis). Se utilizaron los criterios GRADE para evaluar la certeza general de la evidencia.
Resultados principales
Dos ECA (92 participantes) cumplieron los criterios de inclusión. Un estudio (N = 60) comparó diez semanas de cápsulas de cannabidiol con hasta el 4,7% de D9‐tetrahidrocannabinol (THC) con cápsulas placebo en pacientes con CU leve a moderada. La dosis inicial de cannabidiol fue de 50 mg dos veces al día y se aumentó a 250 mg dos veces al día si se toleraba. El otro estudio (N = 32) comparó ocho semanas de tratamiento con dos cigarrillos de cannabis por día que contenían 0,5 g de cannabis, correspondientes a 23 mg de THC/día versus cigarrillos placebo en pacientes con CU que no respondieron al tratamiento médico convencional. No se identificaron estudios que evaluaran el tratamiento con cannabis en la CU inactiva. El primer estudio se consideró con bajo riesgo de sesgo y el segundo (publicado en forma de resumen) se consideró con alto riesgo de sesgo en el cegamiento de los participantes y el personal. Los estudios no se agruparon debido a las diferencias en el fármaco de intervención.
No está claro el efecto de las cápsulas de cannabidiol (100 mg a 500 mg diarios) en comparación con el placebo en la respuesta y la remisión clínica. La remisión clínica a la diez semanas se logró en el 24% (7/29) del grupo de cannabidiol en comparación con el 26% (8/31) del grupo de placebo (CR 0,94; IC del 95%: 0,39 a 2,25; evidencia de certeza baja). La respuesta clínica a las diez semanas se logró en el 31% (9/29) de los participantes que recibieron cannabidiol en comparación con el 22% (7/31) de los pacientes que recibieron placebo (CR 1,37; IC del 95%: 0,59 a 3,21; evidencia de certeza baja). Los niveles de PCR sérica fueron similares en ambos grupos después de diez semanas de tratamiento. La media de la PCR en el grupo de cannabidiol fue 9,428 mg/l en comparación con 7,638 mg/l en el grupo de placebo (DM 1,79; IC del 95%: ‐5,67 a 9,25; evidencia de certeza moderada). Puede haber una mejoría clínicamente significativa en la calidad de vida a las diez semanas, medida con la escala IBDQ (DM 17,4; IC del 95%: ‐3,45 a 38,25; evidencia de certeza moderada). Los eventos adversos fueron más frecuentes en los participantes que recibieron cannabidiol en comparación con los que recibieron placebo. El 100% (29/29) de los participantes que recibieron cannabidiol presentaron un evento adverso, en comparación con el 77% (24/31) de los participantes que recibieron placebo (CR 1,28; IC del 95%: 1,05 a 1,56; evidencia de certeza moderada). Sin embargo, la gravedad de estos eventos adversos se consideró leve o moderada. Los eventos adversos frecuentes fueron: mareos, trastorno de la atención, cefalea, náuseas y fatiga. Ninguno (0/29) de los participantes que recibieron cannabidiol presentaron eventos adversos graves en comparación con el 10% (3/31) de los participantes que recibieron placebo (CR 0,15; IC del 95%: 0,01 a 2,83; evidencia de certeza baja). Los eventos adversos graves en el grupo de placebo fueron: empeoramiento de la CU y un embarazo complicado. Se consideró que estos eventos adversos graves no estaban relacionados con el fármaco de estudio. Más participantes del grupo de cannabidiol se retiraron debido a un evento adverso en comparación con los participantes que recibieron placebo. El 34% (10/29) de los participantes que recibieron cannabidiol se retiraron debido a un evento adverso en comparación con el 16% (5/31) de los participantes que recibieron placebo (CR 2,14; IC del 95%: 0,83 a 5,51; evidencia de certeza baja). Los retiros del grupo cannabidiol se debieron principalmente a los mareos. Los retiros del grupo de placebo se debieron al empeoramiento de la CU.
No está claro el efecto de los cigarrillos de cannabis (23 mg/día THC) en comparación con placebo en la media de la actividad de la enfermedad, los niveles de PCR y la media de los niveles de calprotectina fecal. Después de ocho semanas, la media de la puntuación del índice de actividad de la enfermedad en los participantes que recibieron cannabis fue 4 en comparación con 8 en los participantes que recibieron placebo (DM ‐4,00; IC del 95%: ‐5,98 a ‐2,02). Después de ocho semanas, la media del cambio en los niveles de PCR fue similar en ambos grupos (DM ‐0,30; IC del 95%: ‐1,35 a 0,75; evidencia de certeza baja). La media del nivel de calprotectina fecal en los participantes que recibieron cannabis fue 115 mg/dl en comparación con 229 mg/dl en los participantes que recibieron placebo (DM ‐114,00; IC del 95%: ‐246,01 a 18,01). No se observaron eventos adversos graves. Este estudio no informó sobre la remisión clínica, la respuesta clínica, la calidad de vida, los eventos adversos ni los retiros debido a eventos adversos.
Conclusiones de los autores
Los efectos del cannabis y del cannabidiol sobre la CU no están claros, por lo que no se pueden establecer conclusiones firmes con respecto a la eficacia ni la seguridad del cannabis o cannabidiol en los adultos con CU activa. No hay evidencia del uso del cannabis o canabinoide para el mantenimiento de la remisión en la CU. Se necesitan estudios adicionales con un número mayor de pacientes para evaluar los efectos del cannabis en los pacientes de CU con enfermedad activa e inactiva. Se deben investigar diferentes dosis de cannabis y vías de administración. Por último, se necesita un seguimiento para evaluar los resultados de seguridad a largo plazo del consumo frecuente de cannabis.
PICO
Resumen en términos sencillos
Cannabis y aceite de cannabis para el tratamiento de la colitis ulcerosa
¿Qué es la colitis ulcerosa?
La colitis ulcerosa es una enfermedad crónica, a largo plazo, que causa inflamación del colon y el recto. Los síntomas pueden incluir diarrea, hemorragia rectal, eliminación de moco y dolor abdominal. Se caracteriza por períodos de exacerbación aguda, en que los pacientes presentan síntomas, así como períodos de remisión, sin síntomas.
¿Qué son el cannabis y los canabinoides?
El cannabis es un fármaco de amplio uso recreativo, que tiene efectos múltiples sobre el organismo a través del sistema endocannabinoide. El cannabis contiene múltiples principios activos, llamados canabinoides. El cannabis y el aceite de cannabis que contiene canabinoides específicos pueden causar cambios cognitivos, como sensación de euforia y percepción sensorial alterada. Sin embargo, algunos canabinoides, como el cannabidiol, no tienen efectos psicoactivos. Se ha demostrado que el cannabis y algunos canabinoides disminuyen la inflamación en modelos animales y de laboratorio, lo que sugiere que puede ser de utilidad en pacientes con colitis ulcerosa. Por ejemplo, el cannabidiol es un canabinoide que ha demostrado actividad antiinflamatoria en ratones.
¿Qué examinaron los investigadores?
Los investigadores evaluaron si el cannabis o el aceite de cannabis (cannabidiol) fueron mejores que un placebo (p.ej., fármaco inactivo) para el tratamiento de pacientes adultos con colitis ulcerosa activa o colitis ulcerosa en remisión. Los investigadores buscaron extensamente en la literatura médica hasta el 2 de enero de 2018.
¿Qué encontraron los investigadores?
Se incluyeron dos estudios que incluyeron 92 participantes adultos con colitis ulcerosa. Ambos estudios evaluaron el tratamiento con cannabis en pacientes con colitis ulcerosa activa. No se identificaron estudios que evaluaran el tratamiento con cannabis en pacientes con colitis ulcerosa en remisión. Un estudio (60 participantes) comparó diez semanas de tratamiento con cápsulas que contenían aceite de cannabis con hasta el 4,7% de D9‐tetrahidrocannabinol (THC) versus placebo en pacientes con colitis ulcerosa leve a moderadamente activa. La dosis inicial de cannabidiol fue 50 mg dos veces al día que se aumentó, de ser tolerado, a un objetivo de 250 mg dos veces al día. El otro estudio (32 participantes) comparó ocho semanas de tratamiento con dos cigarrillos de cannabis por día que contenían 0,5 g de cannabis, correspondientes a 11,5 mg de THC versus cigarrillos placebo en pacientes con colitis ulcerosa que no respondían al tratamiento médico convencional.
El estudio que comparó las cápsulas de aceite de cannabis con placebo no encontró diferencias en las tasas de remisión a las diez semanas. El 24% (7/29) de los participantes que recibieron cannabidiol lograron la remisión clínica en comparación con el 26% (8/31) de los participantes que recibieron placebo. El estudio también mostró mayores puntuaciones de calidad de vida informadas por los participantes en el grupo de cannabis en comparación con el grupo de placebo. Se observaron más efectos secundarios en los participantes que recibieron aceite de cannabis en comparación con los participantes que recibieron placebo. La gravedad de estos efectos secundarios se consideró leve a moderada. Los efectos secundarios informados con más frecuencia fueron: mareos, trastornos de la atención, cefalea, náuseas y fatiga. Ningún paciente del grupo de aceite de cannabis presentó efectos secundarios graves. El 10% (3/31) del grupo de placebo presentó un efecto secundario grave. Los efectos secundarios graves en el grupo de placebo incluyeron empeoramiento de la colitis ulcerosa y un embarazo complicado.
El segundo estudio que comparó dos cigarrillos de cannabis (23 mg THC/día) con cigarrillos placebo mostró puntuaciones del índice de actividad de la enfermedad más bajas en el grupo de cannabis en comparación con el grupo de placebo. Los niveles de proteína C reactiva y de calprotectina fecal (medidas de inflamación) fueron similares en ambos grupos. No se observaron efectos secundarios graves. Este estudio no informó las tasas de remisión.
Conclusions
Los efectos del cannabis y el aceite de cannabis sobre la colitis ulcerosa no están claros, por lo tanto no se puede establecer una conclusión firme con respecto a su efectividad y seguridad en pacientes adultos con colitis ulcerosa activa. No existe evidencia para el uso de cannabis o aceite de cannabis para el mantenimiento de la remisión en la colitis ulcerosa. Se necesitan estudios adicionales con un número mayor de participantes para evaluar los efectos del cannabis en los pacientes con colitis ulcerosa activa e inactiva. Se deben investigar diferentes dosis de cannabis y vías de administración. Por último, se necesita un seguimiento para evaluar los resultados de seguridad a largo plazo del consumo frecuente de cannabis.
Conclusiones de los autores
Summary of findings
| Cannabidiol compared to placebo for the treatment of ulcerative colitis | ||||||
| Patient or population: participants with active ulcerative colitis | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with placebo | Risk with Cannabidiol with up to 4.7% THC | |||||
| Clinical remission at 10 weeks | 258 per 1,000 | 243 per 1,000 | RR 0.94 | 60 | ⊕⊕⊝⊝ | Remisison was defined as a Mayo score of < 2 (with no sub‐score > 1) |
| Clinical response at 10 weeks | 226 per 1,000 | 309 per 1,000 | RR 1.37 | 60 | ⊕⊕⊝⊝ | Response defined as decrease in Mayo score of ≥3 points compared to baseline, with a reduction of at least 1 point in endoscopy findings sub‐score |
| CRP at 10 weeks | The mean CRP at 10 weeks was 9.4 mg/L | MD 1.79 mg/L higher | ‐ | 59 | ⊕⊕⊕⊝ | |
| Quality of life Inflammatory Bowel Disease Questionnaire (IBDQ) at 10 weeks | The mean IBDQ score at 10 weeks was 146.8 | MD 17.4 higher | ‐ | 53 | ⊕⊕⊕⊝ | IBDQ scores range from 32 to 224 with a higher score indicating better quality of life |
| Adverse events | 774 per 1,000 | 991 per 1,000 | RR 1.28 | 60 | ⊕⊕⊕⊝ | Common adverse events included dizziness, disturbance in attention, headache, nausea and fatigue |
| Serious adverse events | 97 per 1,000 | 15 per 1,000 | RR 0.15 | 60 | ⊕⊕⊝⊝ | There were no serious adverse events in the cannabidiol group Serious adverse events in the placebo group included worsening of ulcerative colitis and one complicated pregnancy |
| Withdrawal due to adverse event | 161 per 1,000 | 345 per 1,000 | RR 2.14 | 60 | ⊕⊕⊝⊝ | Withdrawls in the cannabidiol group were mostly due to dizziness Withdrawals in the placebo group were due to worsening ulcerative colitis |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded two levels due to very sparse data (15 events). 2 Downgraded two levels due to very sparse data (16 events). 3 Downgraded one level due to sparse data (59 participants). 4 Downgraded one level due to sparse data (53 participants). 5 Downgraded one level due to sparse data (53 events). 6 Downgraded two levels due to very sparse data (4 events). | ||||||
| Cannabis cigarettes (23 mg THC/day) compared to placebo for the treatment of ulcerative colitis | ||||||
| Patient or population: participants with active ulcerative colitis | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with placebo | Risk with cannabis cigarettes (11.5 mg THC) | |||||
| Clinical remission | Not reported | This outcome was not reported | ||||
| Clinical response | Not reported | This outcome was not reported | ||||
| CRP at 8 weeks | The mean CRP at 8 weeks was 1.0 mg/L | MD 0.3 mg/L lower | ‐ | 28 | ⊕⊕⊝⊝ | |
| Quality of life Inflammatory Bowel Disease Questionnaire (IBDQ) | Not reported | This outcome was not reported | ||||
| Adverse events | Not reported | This outcome was not reported | ||||
| Serious adverse events | 0 per 1,000 | 0 per 1,000 | not estimable | No serious adverse events were observed | ||
| Withdrawal due to adverse events | Not reported | This outcome was not reported | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded two levels due to very sparse data (28 participants). | ||||||
Antecedentes
El cannabis o marihuana se promueve con frecuencia como tratamiento para diversas enfermedades, como el cáncer y los trastornos autoinmunitarios (Hill 2015). Es un fármaco recreativo común que altera la percepción sensorial y produce sensación de euforia (Tibirica 2010). Se sabe que el cannabis afecta el dolor y el malestar mediante los efectos psicotrópicos de su principio activo D9‐tetrahidrocannabinol (THC) (Tibirica 2010). Sin embargo, el cannabis también modula el sistema endocannabinoide que actúa en la función del sistema nervioso y de las células inmunitarias (Klein 2006). Se formula la hipótesis de que el cannabis y sus derivados pueden tener una función mediante esta vía para ejercer un efecto terapéutico sobre la colitis ulcerosa (CU) (Schicho 2014; Tibirica 2010). El cannabidiol es un derivado del cannabis que carece de un efecto psicotrópico, pero ha demostrado efectos antiinflamatorios en modelos de animales de laboratorio (Schicho 2014).
La prevalencia del consumo de cannabis es mayor en los pacientes con enfermedad inflamatoria intestinal en comparación con la población general (Weiss 2015). El cannabis puede aliviar los síntomas de la CU, como el dolor abdominal, la pérdida de apetito y la diarrea (Lal 2011; Weiss 2015). Sin embargo, no se sabe si estos beneficios potenciales están relacionados con los efectos psicotrópicos de acción central o con las propiedades antiinflamatorias, como se indica en estudios en animales (Hasenoehrl 2016; Klein 2006; Singh 2012). En estudios que consideran la CU en modelos de animales y de laboratorio se ha encontrado un efecto beneficioso en la reducción de la inflamación (Borrelli 2009; Leinwand 2017). Sin embargo, en los seres humanos, hay evidencia de que el cannabis se puede asociar con efectos perjudiciales y adversos como mareos y diarrea (Whiting 2015).
En 2015 se publicaron los resultados preliminares del primer estudio aleatorio, doble ciego, controlado con placebo en seres humanos que consideró la administración de un canabinoide en la CU (Irving 2015). Este estudio planteó preguntas importantes con respecto a si el cannabis y sus derivados pueden mejorar los síntomas de la CU. Por ejemplo, ¿el cannabis puede reducir de forma objetiva la inflamación en la CU? De ser así, ¿este efecto beneficioso es clínicamente significativo en ausencia de efectos psicotrópicos? Además, ¿cuál es la seguridad y el perfil de efectos secundarios asociados con estos agentes?
Descripción de la afección
La CU es un trastorno crónico mediado por el sistema inmunitario, que causa inflamación de la mucosa del colon y del recto, y se asocia con una morbilidad significativa y una menor calidad de vida (Lahat 2012). En Norteamérica, la prevalencia de la CU se calcula en 37 a 246 casos por 100 000 personas‐años (Friedman 2012). En Europa, la prevalencia de la CU varía de 21,4 a 243 casos por 100 000 personas‐años (Friedman 2012). Fuera de estas áreas, la CU es menos frecuente, con la excepción de Israel, Australia y Sudáfrica (Friedman 2012). Sin embargo, la incidencia de CU aumenta rápidamente en países como Hong Kong, Japón, Corea del Sur, Singapur, la India (norte) y en América Latina (Friedman 2012). La mortalidad en la CU es más alta durante los años iniciales de actividad de la enfermedad (Friedman 2012). Sin embargo, a largo plazo, la mortalidad de la CU se debe a un mayor riesgo de cáncer de colon (Friedman 2012).
Los pacientes con CU pueden tener una predisposición genética a esta enfermedad, y la fisiopatología es multifactorial (Friedman 2012). Ésta incluye una desregulación de la respuesta inmunitaria hacia la microbiota comensal y los contenidos alimentarios en el tracto gastrointestinal (Friedman 2012). Esta respuesta inmunitaria lleva a una cascada inflamatoria de linfocitos T activados que secretan citoquinas proinflamatorias en exceso, como interleucina 1 (IL‐1), interleucina 6 (IL‐6) y anticuerpos contra el factor de necrosis tumoral alfa (FNT α), que dan lugar a inflamación y daño en tejidos previamente sanos (Friedman 2012). La CU es un trastorno con recurrencia y remisión, con síntomas que pueden incluir diarrea, hemorragia rectal, tenesmo, eliminación de moco y dolor abdominal (Friedman 2012). Las opciones terapéuticas incluyen agentes antiinflamatorios e inmunodepresores (Friedman 2012). Los agentes comunes de primera línea son: los 5‐aminosalicilatos, los corticosteroides, las tiopurinas (p.ej., azatioprina o 6‐mercaptopurina) y las terapias biológicas como los antagonistas del FNT α y vedolizumab (Friedman 2012).
Descripción de la intervención
El cannabis se obtiene de las hojas y partes superiores en floración de la planta y se prepara en diversas formas como cigarrillos, aceite de hachís y formulaciones comestibles (Mello 2012). El cannabis contiene más de 400 compuestos y numerosos derivados llamados canabinoides (Mello 2012). Aunque el THC es el principal derivado psicotrópico del cannabis, existen otros derivados como el cannabidiol, con efectos antiinflamatorios en modelos animales sin efectos psicotrópicos (Klein 2006). El cannabis se absorbe rápidamente en el organismo (debido a su naturaleza lipofílica), luego se retiene en los tejidos y se elimina muy lentamente a través de las heces (Mello 2012). Aunque hay datos que indican un aumento de los efectos adversos a corto plazo asociados de los canabinoides como mareos y diarrea, faltan estudios y datos con respecto a los efectos beneficiosos y perjudiciales a largo plazo de los canabinoides (Whiting 2015).
De qué manera podría funcionar la intervención
Se cree que el cannabis afecta la actividad de la enfermedad en la CU a través del sistema endocannabinoide (Hasenoehrl 2016). El sistema endocannabinoide afecta al sistema nervioso, los tejidos periféricos y el sistema inmunitario (Tibirica 2010). Está compuesto de receptores de canabinoides (CB) 1 y 2, endocannabinoides endógenos y enzimas asociadas (Hasenoehrl 2016; Klein 2006). Se propone que la modulación de este sistema puede reducir terapéuticamente la inflamación intestinal (Hasenoehrl 2016).
Los receptores CB1 se encuentran en el sistema nervioso central, los tejidos periféricos y el sistema digestivo (Hasenoehrl 2016; Klein 2006). La activación de estos receptores puede ayudar a reducir el tiempo de tránsito intestinal y la propulsión del colon, y mejorar el cierre de las heridas epiteliales en el colon (Pinto 2002; Wright 2005). Hay evidencia de que estos receptores desempeñan una función fisiológica en la protección del colon durante la inflamación excesiva (Massa 2004). En el sistema nervioso central, los receptores CB1 se asocian con efectos como la reducción del dolor y náuseas (Klein 2006; Tibirica 2010).
Los receptores CB2 se encuentran en el plexo mientérico, las células inmunitarias y en las células epiteliales en la colitis ulcerosa (Hasenoehrl 2016; Klein 2006; Marquez 2009). Se piensa que el cannabis influye en las células inmunitarias por diversas vías. Por ejemplo, la activación de receptores CB2 puede llevar a la apoptosis de los linfocitos T, la disminución de la proliferación de los linfocitos T en la colitis, un menor reclutamiento de los leucocitos al colon inflamado y también puede ayudar a reducir la liberación de citoquinas ( Klein 2006; Lahat 2012; Singh 2012).
El sistema endocannabinoide también presenta otras vías que pueden ser activadas por el cannabis y los canabinoides. Por ejemplo, los canabinoides no psicotrópicos, como el cannabidiol, pueden reducir la inflamación en los receptores activados por proliferadores de peroxisomas y las vías de los receptores subfamilia V de canales catiónicos de receptores de potencial transitorio (Hasenoehrl 2016).
Por qué es importante realizar esta revisión
Esta revisión se realizó para evaluar la evidencia que apoya el uso del cannabis y los canabinoides para el tratamiento de la CU. El uso de cannabis y canabinoide es cada vez más común, y los médicos se enfrentan con mayores exigencias de los pacientes para agregar el cannabis al tratamiento. Sin embargo, hay muy poca evidencia con respecto a los efectos beneficiosos y perjudiciales del cannabis y los canabinoides, por lo que es necesario examinar el conocimiento actual de su uso. Se evaluaron la eficacia y la seguridad del cannabis y sus derivados para el tratamiento de la CU. Esta revisión sistemática ayudó a distinguir los marcadores objetivos de mejoría de las puntuaciones subjetivas y también ayudó a identificar los eventos adversos asociados con el cannabis y los canabinoides.
Objetivos
El objetivo fue evaluar la eficacia y la seguridad del cannabis y los canabinoides en el tratamiento de los pacientes con CU.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se consideraron para la inclusión ensayos controlados aleatorios. Se incluyeron los estudios publicados sólo como resúmenes cuando se pudo contactar con los autores para obtener información adicional que permitiera evaluar la calidad y los resultados principales. Se incluyeron estudios de cualquier duración.
Tipos de participantes
Se consideró la inclusión de pacientes adultos (> 18 años de edad) con CU (diagnosticada por métodos convencionales). Se consideraron para inclusión los pacientes con CU clínicamente activa o inactiva. La remisión clínica o la enfermedad inactiva a menudo se definieron con la Mayo Score o el Disease Activity Index (DAI) para la CU. Se incluyeron pacientes con enfermedad activa (p.ej., DAI > 2) o inactiva (definida con síntomas leves o ausentes antes de ingresar al estudio o con una puntuación DAI total < 2 sin subpuntuación > 1). Se incluyeron pacientes con todos los tratamientos para la CU, incluidos los que tenían antecedentes de terapia biológica.
Tipos de intervenciones
Se incluyeron los estudios que compararon cualquier forma de cannabis o derivados de canabinoides con un placebo o un tratamiento activo para la CU. Se incluyeron los estudios que utilizaron cualquier dosis y vía de administración
Tipos de medida de resultado
Resultados primarios
El resultado primario de los estudios de inducción de remisión fue la remisión clínica al final del estudio (tal como la definieron los estudios primarios). El resultado primario de los estudios de mantenimiento de la remisión fue la recurrencia al final del estudio (tal como la definieron los estudios primarios). Se incluyó cualquier sistema de puntuación validado. Se incluyeron todos los puntos temporales de resultados a corto y largo plazo.
Resultados secundarios
Las medidas de resultado secundarias incluyeron:
1. Respuesta clínica (tal como la definieron los estudios incluidos);
2. Remisión endoscópica (tal como la definieron los estudios incluidos);
3. Respuesta endoscópica (tal como la definieron los estudios incluidos);
4. Respuesta histológica (tal como la definieron los estudios incluidos);
5. Calidad de vida (definida con un instrumento validado o estudio primario, p.ej., el Inflammatory Bowel Disease Questionnaire o IBDQ);
6. Proteína C reactiva (PCR) y mediciones de calprotectina en heces;
7. Mejoría de los síntomas (p.ej., mejoría del dolor, las náuseas o la anorexia);
8. Eventos adversos (es decir, efectos psicológicos, deterioro cognitivo, accidentes de seguridad personal y molestia gastrointestinal);
9. Eventos adversos graves;
10. Retiro debido a eventos adversos;
11. Eventos adversos psicotrópicos (incluidos los efectos sobre la salud mental, como psicosis y esquizofrenia); y
12. Dependencia del cannabis y efectos de la abstinencia (definidos y medidos por los estudios primarios).
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We searched the following databases from inception to 2 January 2018:
1. MEDLINE (Ovid);
2. Embase (Ovid);
3. WHO ICTRP;
4. AMED (Allied & Alternative Medicine);
5. Psych INFO;
4. The Cochrane IBD Group Specialized Register;
5. CENTRAL;
6. ClinicalTrials.Gov; and
7. European Clinical Trials Register.
Conference proceedings were also searched to identify additional studies. We also contacted authors in this field for more information and upcoming abstracts or studies. See Appendix 1 for search strategy.
Búsqueda de otros recursos
We searched conference proceedings to identify studies only published in abstract form. We searched ClinicalTrials.gov and EU Clinical Trials Register to identify ongoing studies. We also searched the references sections of applicable studies and systematic reviews to identify additional studies that may meet the inclusion criteria.
Obtención y análisis de los datos
Selección de los estudios
We reviewed studies and abstracts identified by the literature search. Two authors (TK and NC) independently screened the search results to identify potentially relevant studies for full text evaluation. The studies selected for full text review were independently assessed by two authors (TK and NC) and consensus for study inclusion and exclusion was reached through discussion. Any conflicts regarding inclusion or exclusion were resolved by consultation with a third author (JKM) as necessary. Studies published in abstract form were only included if the authors could be reached for further information.
Extracción y manejo de los datos
Two authors (TK and NC) independently extracted the outcome data of interest from each study. Any conflicts were resolved by discussion and consensus or by consultation with a third author (JKM) as necessary. If data were missing or unclear, the study authors were contacted for clarification.
Other information extracted from the studies included:
a. Study characteristics and design;
b. Characteristics of patients;
c. Inclusion and exclusion criteria;
d. Interventions (if available, we extracted specific information per the Herbal CONSORT statement) (Gagnier 2006); and
e. Outcomes scoring methods.
Evaluación del riesgo de sesgo de los estudios incluidos
Two authors (TK and NC) independently assessed bias using the Cochrane risk of bias tool (Higgins 2011). Any conflicts were resolved by discussion and consensus or by consultation with a third author (JKM) as required. Items assessed included:
1. Random sequence generation;
2. Allocation sequence concealment;
3. Blinding of participants, personnel and outcome assessors;
4. Incomplete outcome data;
5. Selective outcome reporting; and
6. Other potential sources of bias.
Each category was evaluated as low, high or unclear risk of bias and justification for judgement was provided in the characteristics of included studies section of the review.
GRADE Analysis
The overall certainty of the evidence supporting the primary outcome and selected secondary outcomes was evaluated using the GRADE criteria (Guyatt 2008; Schünemann 2011). Using this approach outcome data were rated as high, moderate, low or very low certainty. Outcome data from randomized controlled trials began as high certainty, but could be downgraded based on several criteria. These criteria included:
1. Risk of bias from the studies;
2. Indirect evidence (by comparison, population, setting);
3. Inconsistency (i.e. unexplained heterogeneity);
4. Imprecision (i.e. few events and wide confidence intervals); and
5. Likelihood of publication bias.
Medidas del efecto del tratamiento
For dichotomous outcomes, we calculated the risk ratio (RR) and corresponding 95% confidence interval (CI). For continuous outcomes, we calculated the mean difference (MD) and corresponding 95% CI.
Cuestiones relativas a la unidad de análisis
For multi‐arm trials (e.g. with two or more dose groups) with a single placebo group, we planned to split the placebo group across the treatment groups to avoid a unit of analysis error (Higgins 2011b). In order to avoid potential carry‐over effects, we would only include the first part of the study (i.e. before the cross‐over) for any cross‐over studies (Higgins 2011b). For studies where events may re‐occur we would only include the first event. When there were repeated observations on participants, we used the primary endpoint defined by the study. It was unlikely that we would find study designs applicable to cannabis in UC where multiple treatment attempts were used. We did not anticipate encountering any available cluster‐randomized studies.
Manejo de los datos faltantes
Data were analysed on an intention‐to‐treat (ITT) basis, whereby missing data with no explanations were assumed to be treatment failures. We counted treatment failures as a relapse for maintenance studies and as a failure to enter remission for induction studies. We conducted a sensitivity analysis to assess the impact of this assumption on the effect estimate. If needed, we imputed missing standard deviations. We conducted an available case analysis for missing continuous outcomes.
Evaluación de la heterogeneidad
We planned to use the Chi2 test and the I2 statistic to assess heterogeneity. For the Chi2 test, we considered a P value of 0.10 to be statistically significant. We planned to use the I2 statistic to quantify the proportion of variation that is due to heterogeneity rather than to chance. An I2 value of 25% indicates low heterogeneity, >50% indicates moderate heterogeneity and >75% indicates high heterogeneity. We planned to visually inspected the forest plots to identify any outliers. If outliers are identified, a sensitivity analysis would be conducted to explore potential explanations for the heterogeneity.
Evaluación de los sesgos de notificación
Reporting bias was assessed by comparing the outcomes pre‐specified in study protocols to the outcomes reported in the study manuscripts. However, if the protocols were not available, we assessed reporting bias by comparing the outcomes specified in the methods section of the manuscript to those reported in the results section. If a sufficient number of studies were included in the pooled analysis (i.e. > 10), we would have constructed a funnel plot to assess the potential for publication bias (Egger 1997).
Síntesis de los datos
We planned to pool data from individual studies for meta‐analysis when the outcomes, patient groups and interventions were similar enough to justify pooling (determined by consensus). When pooling studies was not possible, we narratively summarized the results of individual trials. For dichotomous outcomes, we planned to calculate the pooled RR and 95% CI using a fixed‐effect model. For continuous outcomes, we planned to calculate the pooled MD and corresponding 95% CI. However, if the continuous outcomes utilize different scales to measure the same underlying construct (e.g. for quality of life), we planned to calculate the standardized mean difference (SMD) and corresponding 95% CI. If significant heterogeneity was identified, a random‐effects model would be used to pool data. We would not pool data for meta‐analysis if a high degree of heterogeneity was detected (e.g. I2 > 75%).
Análisis de subgrupos e investigación de la heterogeneidad
Subgroup analysis based on dose of cannabis or cannabinoid would have been performed if the data allowed for such comparisons. Other subgroup analyses of interest included the form of cannabis consumed, UC disease location, cigarette smoking status, history of prior biologic therapy and failure of biologic therapy.
Análisis de sensibilidad
We planned to perform a sensitivity analysis of study quality by excluding studies with a high risk of bias to see if there is an impact on the effect estimate.
Results
Description of studies
Results of the search
A literature search conducted on 2 January 2018 identified 116 studies. Two studies were identified through other sources. After duplicates were removed, a total of 66 studies were identified. Fifty‐seven studies were not applicable and were excluded. Nine studies remained for full text review. Two studies were excluded with reasons. Seven reports of two studies met the inclusion criteria and were included in the review (See Figure 1). Both of the included studies assessed cannabis therapy in participants with active UC. No studies were identified that assessed cannabis therapy in participants with quiescent UC.
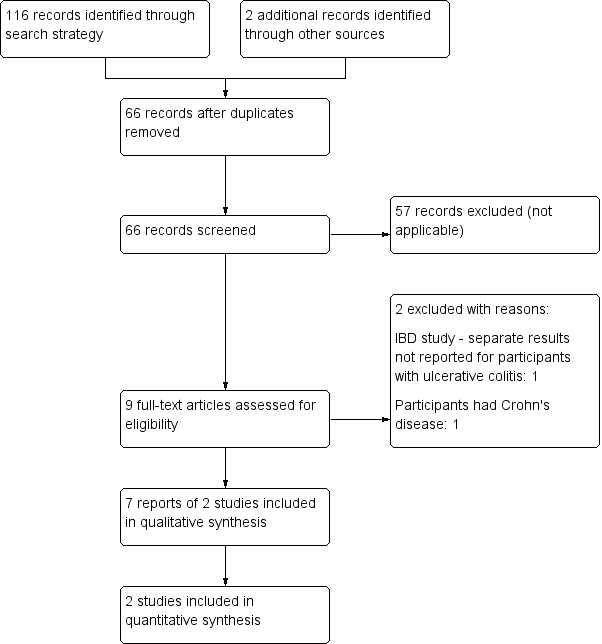
Flow diagram.
Included studies
Irving 2018 was a randomized, multi‐centre, double‐blind, placebo‐controlled study that compared cannabidiol capsules with up to 4.7% THC (n = 29) to placebo (n = 31) over a ten week period. The starting dose of cannabidiol was 50 mg twice daily which was increased, if tolerated, to target of 250 mg twice daily. Patients who were previously diagnosed with mild to moderate UC and were on stable doses of 5‐aminosalicylates for at least two weeks prior to screening for study entry were eligible for inclusion. Patients with severe UC or proctitis were excluded. The goal of the study was to determine whether cannabidiol had a positive benefit for treating UC symptoms and other markers such as CRP. The primary outcome was clinical remission (Mayo score of ≤2 with no subscore of >1) after 10 weeks treatment. The secondary outcomes included inflammatory marker levels (CRP, plasma interleukin and fecal calprotectin), inflammatory bowel disease questionnaire (IBDQ) score, physician global assessment of illness severity (PGAS) score, stool frequency and rectal bleeding. The original study protocol only planned an ITT analysis, but one year after completion of the study they added a per protocol (PP) analysis set.
Naftali 2018 is an abstract publication reporting a randomized placebo controlled trial. The study enrolled patients with UC who did not respond to conventional medical treatment (N = 32). Patients were given either two cannabis cigarettes (n = 17; 0.5 g of cannabis, corresponding to 11.5 mg of THC for a total of 23 mg THC/day) or placebo cigarettes (n = 15; cannabis leaves from which THC was extracted) daily for eight weeks. Outcomes reported in the abstract included disease activity index (DAI), Mayo endoscopic score, endoscopic findings and laboratory tests (CRP, fecal calprotectin).
Excluded studies
Two records were excluded. One study assessed the use of cannabis for the treatment of Crohn's disease (NCT01037322). Naftali 2013a assessed the use of cannabis for the treatment of inflammatory bowel disease. This study was excluded because separate data for patients with UC could not be obtained.
Risk of bias in included studies
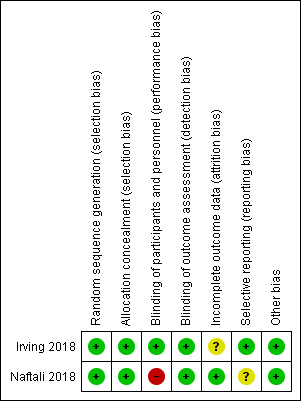
See Figure 2 for a summary of the risk of bias results.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Random sequence generation was rated as low risk for Irving 2018. An independent statistician produced a central randomization schedule. Allocation concealment was rated as low risk of bias, as centralized randomization was used. Random sequence generation was rated as low risk for Naftali 2018, where block randomization was used to assign participants to receive either medical cannabis or placebo. Allocation concealment was rated as low risk of bias as sequentially numbered drug containers of identical appearance were used to conceal treatment allocation.
Blinding
Irving 2018 was double blinded and had quadruple masking "participant, care provider, investigator, outcomes assessor". Identical gelatin capsules were formulated to maintain blinding throughout the study. The maximum number of dose units was identical in treatment and placebo groups. This study was rated as low risk of bias for blinding of participants and personnel and for blinding of outcome assessment. The Naftali 2018 study was rated as high risk of bias for blinding of participants and personnel. Although placebo cigarettes were used, blinding was likely to be broken due to the psychotropic effects of cannabis that contained high doses of THC. Naftali 2018 was rated as low risk of bias because outcome assessors were blind to treatment assignment.
Incomplete outcome data
Irving 2018 was rated as unclear risk of bias for incomplete outcome data. There was a higher rate of withdrawal in the treatment group (13/29) compared to the placebo group (8/31). There were no withdrawals in the Naftali 2018 study. We rated this study as low risk of bias for incomplete outcome data.
Selective reporting
Irving 2018 was rated as low risk of bias for selective reporting. The Naftali 2018 study was rated as unclear risk of bias for selective reporting. The primary outcome reported in the study protocol was for Crohn's disease and was a reduction in the Crohn's Disease Activity Index of 70 points. The study enrolled participants with Crohn's disease and ulcerative colitis and the results for participants with Crohn's disease are reported elsewhere (Naftali 2013b). The secondary outcomes reported in the study protocol included adverse events due to cannabis smoking, change in quality of life, change in IL‐10, IL‐2, and TGF beta, None of these outcomes were reported in the abstract publication but could potentially be reported in a full manuscript.
Other potential sources of bias
The Irving 2018 and Naftali 2018 studies were rated as low risk of bias for other potential sources of bias.
Effects of interventions
See: Summary of findings for the main comparison Cannabidiol compared to placebo for the treatment of ulcerative colitis; Summary of findings 2 Cannabis cigarettes compared to placebo for the treatment of ulcerative colitis
Data from the two included studies were not pooled as the routes and formulas were different. Naftali 2018 studied cannabis cigarettes with 11.5 mg THC and Irving 2018 studied cannabidiol capsules with a dose range of 50 to 250 mg twice daily. There was up to 4.7% THC in each capsule.
Cannabidiol capsules (100 mg to 500 mg/day with up to 4.7% THC) versus placebo capsules at 10 weeks:
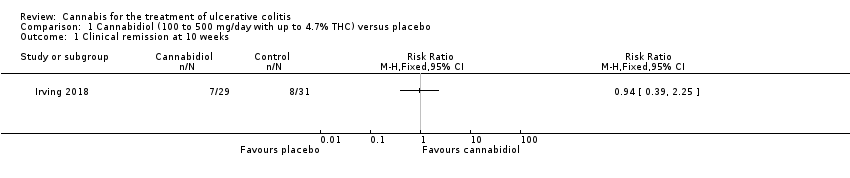
There was no difference between the cannabidiol group and the placebo group in clinical remission rates at 10 weeks (Irving 2018). Clinical remission was reported in 24% (7/29) of patients in the treatment group compared to 26% (8/31) of patients in the placebo group (RR 0.94, 95% CI 0.39 to 2.25). The GRADE analysis indicated that the overall certainty of evidence for this outcome was low due to very sparse data (See summary of findings Table for the main comparison). There was no difference in clinical response rates at 10 weeks. Clinical response defined by a decrease in Mayo total score of ≥3 points, compared to baseline, with a reduction of at least 1 point in endoscopy findings sub‐score was reported in 31% (9/29) of patients in the cannabidiol group compared to 22% (7/31) of patients in the placebo group (RR 1.37, 95% CI 0.59 to 3.21). The GRADE analysis indicated that the overall certainty of evidence for this outcome was low due to very sparse data (See summary of findings Table for the main comparison).
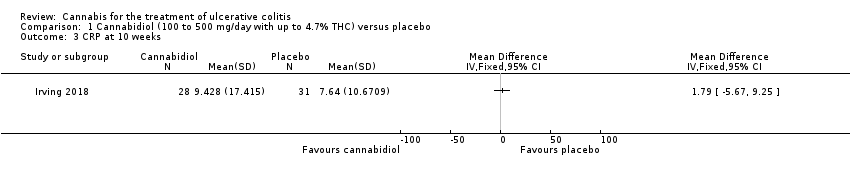
There was no difference in mean CRP levels at 10 weeks. The mean CRP in the cannabidiol group at 10 weeks was 9.428 mg/L + 17.4 compared to 7.638 mg/L + 10.7 in the placebo group (MD 1.79, 95% CI ‐5.67 to 9.25). The GRADE analysis indicated that the overall certainty of evidence for this outcome was moderate due to sparse data (See summary of findings Table for the main comparison). There was no difference in mean IBDQ scores at 10 weeks. The mean IBDQ score at 10 weeks was 164.2 + 29.1 in the cannabidiol group compared to 146.8 + 47.5 in the placebo group (MD 17.40, 95% CI ‐3.45 to 38.25). The GRADE analysis indicated that the overall certainty of evidence for this outcome was moderate due to sparse data (See summary of findings Table for the main comparison). There were no differences in pain (MD 0.32, 95% CI ‐0.51 to 1.15), stool frequency (MD 0.00, 95% CI ‐0.35 to 0.35), or rectal bleeding (MD ‐0.09, 95% CI ‐0.47 to 0.29) at 10 weeks. Adverse events were more frequent in the cannabidiol group compared to the placebo group. All the patients in the cannabis group (29/29) experienced an adverse event compared to 77% (24/31) of patients in the placebo group (RR 1.28, 95% CI 1.05 to 1.56). The GRADE analysis indicated that the overall certainty of evidence for this outcome was moderate due to sparse data (See summary of findings Table for the main comparison). However, these adverse events were considered to be mild or moderate in severity. Common adverse events reported in the cannabidiol group included dizziness, somnolence, disturbance in attention, headache, memory impairment, nausea, dry mouth, vomiting, lower respiratory tract infection, disorientation and fatigue. Common adverse events reported in the placebo group include dizziness, headache, nausea, abdominal pain, worsening ulcerative colitis, abdominal distention, constipation, fatigue, back pain and rash. There was no difference in the proportion of participants who developed serious adverse events. None of the patients (0/29) in the cannabidiol group had a serious adverse event compared to 10% (3/31) of patients in the placebo group (RR 0.15, 95% CI 0.01 to 2.83). The GRADE analysis indicated that the overall certainty of evidence for this outcome was low due to very sparse data (See summary of findings Table for the main comparison). Serious adverse events in the placebo group were related to worsening of disease and one complicated pregnancy. None of the serious adverse events were thought to be treatment‐related. Withdrawal due to adverse events was more frequent in the cannabidiol group. Thirty‐four per cent (10/29) of cannabidiol participants withdrew due to an adverse event (mostly dizziness) compared to 16% (5/31) of placebo participants (RR 2.14, 95% CI 0.83 to 5.51). The GRADE analysis indicated that the overall certainty of evidence for this outcome was low due to very sparse data (See summary of findings Table for the main comparison). Withdrawls in the cannabidiol group were mostly due to dizziness. Withdrawls in the placebo group were due to worsening ulcerative colitis. The outcomes relapse, endoscopic remission, endoscopic response, histological response and cannabis withdrawal effects were not reported in this study.
Cannabis cigarettes (23 mg THC/day) versus placebo cigarettes at 8 weeks:
A small study (N = 32) compared cannabis cigarettes to placebo (Naftali 2018). Greater improvements were reported in DAI scores and the Mayo endoscopic score in the cannabis group compared to placebo. After eight weeks of therapy, the DAI in the cannabis group was 4 + 3.2 compared to 8 + 2 in the placebo group (MD ‐4.00, 95% CI ‐5.98 to ‐2.02; 28 participants). After eight weeks of treatment, the Mayo endoscopic score decreased from a median of 2 (IQR 2 to 2.5) to 1 (IQR 0 to 2) in the cannabis group and from 2 (IQR 2 to 2) to 2 (IQR 1.25 to 2) in placebo group. Mean serum CRP concentrations were similar at eight weeks. The mean CRP in the cannabis group was 0.7 mg/L + 1.2 compared to 1 mg/L + 1.6 in the placebo group (MD ‐0.30, 95% CI ‐1.35 to 0.75). The GRADE analysis indicated that the overall certainty of evidence for this outcome was low due to very sparse data (28 participants) (See summary of findings Table 2). After eight weeks of treatment fecal calprotectin levels were lower in the cannabis group than the placebo group. The mean fecal calprotectin concentration was 115 μg/g ±103 in cannabis group compared to 229 μg/g ± 230 in the placebo group (MD ‐114.00, 95% CI ‐246.01 to 18.01). The authors reported that no serious adverse effects were observed. The outcomes relapse, clinical response, endoscopic remission, endoscopic response, histological response, quality of life, symptom improvement, adverse events, withdrawal due to adverse events and cannabis withdrawal effects were not reported in this study.
Discusión
Resumen de los resultados principales
Esta revisión sistemática incluyó dos ensayos controlados aleatorios (92 participantes) que evaluaron la eficacia y la seguridad de cannabidiol o cannabis en la colitis ulcerosa activa. El estudio Naftali 2018 se publicó como resumen solamente. Sin embargo, se pudo obtener información adicional del investigador principal para informar la evaluación del riesgo de sesgo. En general, los estudios incluyeron un número reducido de participantes y cada estudio utilizó diferentes dosis y fórmulas del cannabis o los canabinoides y diferentes vías de administración. Irving 2018 utilizó cannabidiol con hasta el 4,7% de THC. Naftali 2018 utilizó cigarrillos de cannabis que contenían 11,5 mg de THC (dosis total 23 mg/día de THC). Los estudios no se agruparon por las diferencias en las vías, las fórmulas, las dosis de las intervenciones y los pacientes. El estudio Irving 2018 reclutó a participantes con CU leve a moderada diagnosticada previamente. El estudio Naftali 2018 reclutó a participantes que no respondieron al tratamiento médico convencional.
En el estudio Irving 2018, el análisis de intención de tratar mostró que el cannabidiol (dosis diaria 100 mg a 500 mg con hasta 4,7% de THC) no pareció proporcionar un beneficio sobre el placebo en cuanto a la inducción de la remisión o la respuesta clínica. La tasa de respuesta y remisión clínica en el grupo de cannabidiol fue del 24% y del 31%, respectivamente, en comparación con del 26% y del 22% en el grupo de placebo. Los análisis GRADE indicaron que la certeza general de la evidencia que apoya estos resultados fue baja debido la imprecisión muy grave. Fue más probable que los participantes que recibieron cannabidiol informaran de un evento adverso en comparación con los pacientes que recibieron placebo. Todos los pacientes (29/29) del grupo de cannabidiol presentaron un evento adverso en comparación con el 77% (24/31) de los participantes que recibieron placebo. Un análisis GRADE indicó que la certeza general de la evidencia para este resultado fue moderada debido a la imprecisión. La gravedad de estos eventos adversos se consideró leve o moderada. Los eventos adversos comunes informados en el grupo de cannabidiol fueron: mareos, somnolencia, trastorno en la atención, cefalea, deterioro de la memoria, náuseas, sensación de sequedad en la boca, vómitos, infección de las vías respiratorias inferiores, desorientación y fatiga. Los eventos adversos comunes informados en el grupo de placebo fueron: mareos, cefalea, náuseas, dolor abdominal, empeoramiento de la colitis ulcerosa, distensión abdominal, estreñimiento, fatiga, dolor lumbar y erupción cutánea. Más participantes que recibieron cannabidiol se retiraron del estudio debido a los eventos adversos en comparación con placebo. Un análisis GRADE indicó que la certeza general de la evidencia que apoya este resultado fue baja debido la imprecisión muy grave. Los retiros del grupo cannabidiol se debieron principalmente a los mareos. Los retiros en el grupo de placebo se debieron al empeoramiento de la colitis ulcerosa. No hubo eventos adversos graves en el grupo de cannabidiol (0/29) en comparación con una tasa de eventos adversos graves del 13% (4/31) en el grupo de placebo. Un análisis GRADE indicó que la certeza general de la evidencia que apoya este resultado fue baja debido la imprecisión muy grave. Los eventos adversos graves en el grupo de placebo se debieron al empeoramiento de la colitis ulcerosa y un embarazo complicado, con retraso del crecimiento fetal y mortinatalidad posterior.
La calidad de vida a las ocho semanas medida con la IBDQ fue mayor en los participantes que recibieron cannabidiol (media 164,2) que en los pacientes que recibieron placebo (media 146,8). La diferencia de medias entre los grupos de cannabidiol y de placebo fue de 17,4 puntos en la IBDQ. Un aumento de la puntuación IBDQ de 16 a 32 puntos constituye los límites superiores e inferiores de una mejoría clínicamente significativa en la calidad de vida relacionada con la salud en los pacientes con colitis ulcerosa o enfermedad de Crohn (Irvine 1994; Irvine 2008). Sin embargo, el intervalo de confianza del 95% para este resultado tampoco implicó beneficios. Un análisis con los criterios GRADE indicó que la certeza general de la evidencia que apoya este resultado fue moderada debido a los datos escasos. Se necesitan estudios de investigación adicionales para confirmar el beneficio posible del cannabidiol en la calidad de vida relacionada con la salud en los pacientes con colitis ulcerosa. No hubo diferencias en los niveles de PCR sérica a las ocho semanas. Después de ocho semanas de tratamiento, no hubo diferencias en el dolor, la frecuencia de heces ni las escalas de calificación numérica de la hemorragia rectal.
Se debe observar que el grupo de intervención fue muy heterogéneo con respecto a la dosis de cannabidiol. Los pacientes recibieron una dosis de cannabidiol entre 50 mg y 250 mg dos veces al día con hasta el 4,7% de THC. Este intervalo se basó en la dosis máxima tolerada y puede haber afectado a los resultados. Los autores describieron un estudio en ratas que encontró que la dosis de 10 mg/kg fue óptima, pero no describieron cómo seleccionaron el propio régimen de dosis (Jamontt 2010).
El estudio Naftali 2018 incluyó a participantes con CU que no respondían al tratamiento convencional. El resultado primario no se especificó en la publicación del resumen. Los participantes del grupo de cigarrillo de cannabis (23 mg de THC/día) tuvieron puntuaciones de DAI menores (4 + 3,2) después de ocho semanas de tratamiento en comparación con los participantes del grupo de cigarrillo placebo (8 + 2). El tratamiento con cigarrillos de cannabis también pareció repercutir sobre la puntuación endoscópica de Mayo, que fue significativamente inferior en los participantes que recibieron tratamiento activo. La media de los niveles de PCR sérica y calprotectina fecal fue baja en los participantes que recibieron el cigarrillo de cannabis en comparación con los participantes que recibieron el cigarrillo placebo. Los análisis GRADE indicaron que la certeza general de la evidencia que apoya el resultado de la PCR fue baja debido la imprecisión muy grave. Los autores informaron que no se observaron efectos adversos graves. En este estudio no se informaron los siguientes resultados: recurrencia, respuesta clínica, remisión endoscópica, respuesta endoscópica, respuesta histológica, calidad de vida, mejoría de los síntomas, eventos adversos, retiros debido a eventos adversos y efectos de la abstinencia del cannabis.
Compleción y aplicabilidad general de las pruebas
Preocupa la completitud general de la evidencia ya que esta revisión sólo encontró dos estudios pequeños con un total de 92 participantes. Se necesitan estudios más grandes con mayor calidad metodológica para poder establecer conclusiones más definitivas acerca de la eficacia y la seguridad del cannabis y los canabinoides en la CU. Aunque esta revisión puede ser aplicable a los pacientes con CU, hay inquietudes por los criterios de exclusión de los estudios incluidos. Irving 2018 excluyó a los pacientes con antecedentes de consumo de cannabis el mes anterior al ingreso al estudio y los pacientes con antecedentes de trastornos psiquiátricos diferentes de la depresión reactiva. Esta inquietud surge por el hecho de que las enfermedades mentales y el consumo de cannabis es prevalente en los pacientes norteamericanos con EII (Hauser 2014; Weiss 2015). Naftali 2018 incluyó a pacientes con CU resistentes a los tratamientos. Otros criterios de inclusión y exclusión no se describieron en esta publicación resumida.
Calidad de la evidencia
El riesgo general de sesgo del estudio Irving 2018 es bajo. Aunque el estudio Naftali 2018 utilizó cigarrillos de cannabis placebo, este estudio se consideró con alto riesgo de sesgo en el cegamiento de los participantes y el personal ya que probablemente no se ocultara la asignación de los tratamientos debido a la naturaleza psicotrópica del cannabis. Los análisis con los criterios GRADE indican que la certeza general de la evidencia que apoya los resultados de esta revisión varía entre baja y moderada. Para el cannabidiol, se consideró baja la calidad general de la evidencia que apoya los resultados de remisión clínica, respuesta clínica, eventos adversos y retiros debido a eventos adversos. La certeza general de la evidencia que apoya los resultados calidad de vida, PCR y eventos adversos se consideró moderada. Se necesitan más estudios de investigación antes de poder establecer conclusiones firmes con respecto a la eficacia y la seguridad del cannabidiol en la CU. Para los cigarrillos de cannabis, se consideró baja la certeza general de la evidencia sobre el resultado de la PCR. En general, no hay seguridad acerca de los efectos beneficiosos ni perjudiciales de los cigarrillos de cannabis en los pacientes con CU activa. Se necesitan más estudios de investigación antes de poder establecer conclusiones firmes acerca del consumo de cigarrillos de cannabis en la CU.
Sesgos potenciales en el proceso de revisión
Se realizó una búsqueda bibliográfica exhaustiva para disminuir el sesgo relacionado con la selección de los estudios. También se realizaron búsquedas en bases de datos no tradicionales y de humanidades para encontrar estudios relevantes. Dos autores de la revisión (TK and NC), de forma independiente, examinaron los estudios, extrajeron los datos y evaluaron el riesgo de sesgo. Las limitaciones de esta revisión sistemática incluyen el número pequeño de estudios incluidos y los escasos datos. Ambos estudios incluidos fueron de tamaño pequeño y pueden haber tenido escaso poder estadístico para detectar (si existiera) un beneficio del cannabis en la CU.
Acuerdos y desacuerdos con otros estudios o revisiones
No fue posible identificar revisiones sistemáticas que evaluaran la eficacia y la seguridad del tratamiento con cannabis en la CU.
Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 1 Clinical remission at 10 weeks.

Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 2 Clinical response at 10 weeks.
Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 3 CRP at 10 weeks.
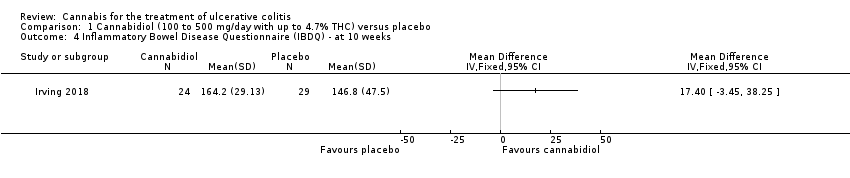
Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 4 Inflammatory Bowel Disease Questionnaire (IBDQ) ‐ at 10 weeks.

Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 5 Symptom measure ‐ pain.
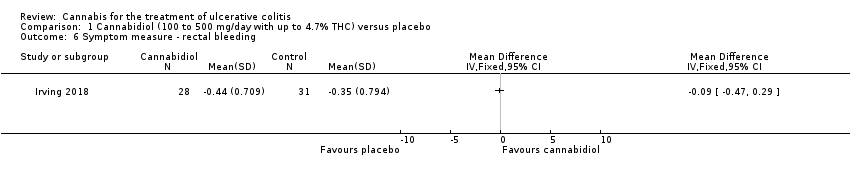
Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 6 Symptom measure ‐ rectal bleeding.
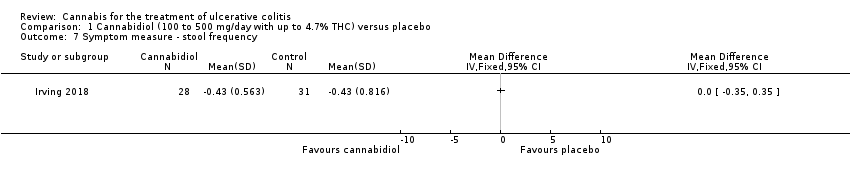
Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 7 Symptom measure ‐ stool frequency.

Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 8 Adverse events.
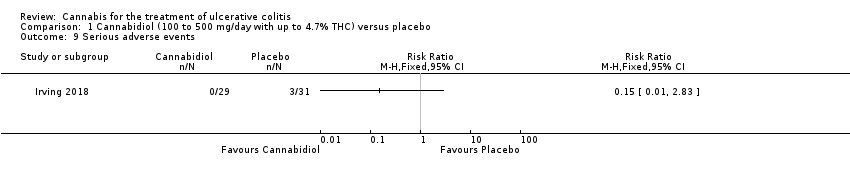
Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 9 Serious adverse events.

Comparison 1 Cannabidiol (100 to 500 mg/day with up to 4.7% THC) versus placebo, Outcome 10 Withdrawal due to adverse event.

Comparison 2 Cannabis cigarettes (11.5 mg THC/day) versus placebo, Outcome 1 DAI.
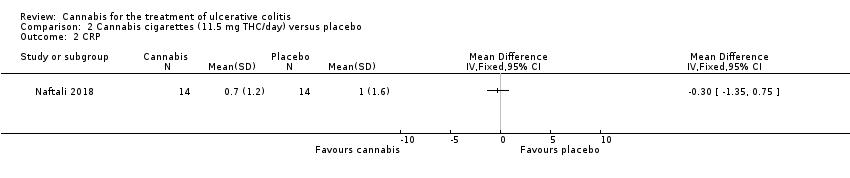
Comparison 2 Cannabis cigarettes (11.5 mg THC/day) versus placebo, Outcome 2 CRP.
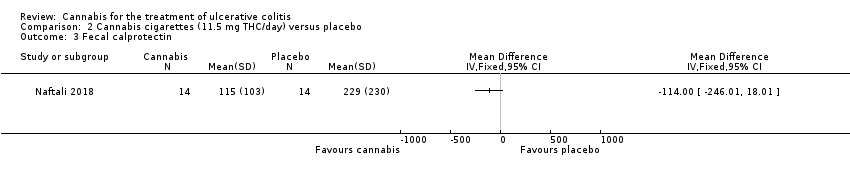
Comparison 2 Cannabis cigarettes (11.5 mg THC/day) versus placebo, Outcome 3 Fecal calprotectin.
Comparison 2 Cannabis cigarettes (11.5 mg THC/day) versus placebo, Outcome 4 Serious adverse events.
| Cannabidiol compared to placebo for the treatment of ulcerative colitis | ||||||
| Patient or population: participants with active ulcerative colitis | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with placebo | Risk with Cannabidiol with up to 4.7% THC | |||||
| Clinical remission at 10 weeks | 258 per 1,000 | 243 per 1,000 | RR 0.94 | 60 | ⊕⊕⊝⊝ | Remisison was defined as a Mayo score of < 2 (with no sub‐score > 1) |
| Clinical response at 10 weeks | 226 per 1,000 | 309 per 1,000 | RR 1.37 | 60 | ⊕⊕⊝⊝ | Response defined as decrease in Mayo score of ≥3 points compared to baseline, with a reduction of at least 1 point in endoscopy findings sub‐score |
| CRP at 10 weeks | The mean CRP at 10 weeks was 9.4 mg/L | MD 1.79 mg/L higher | ‐ | 59 | ⊕⊕⊕⊝ | |
| Quality of life Inflammatory Bowel Disease Questionnaire (IBDQ) at 10 weeks | The mean IBDQ score at 10 weeks was 146.8 | MD 17.4 higher | ‐ | 53 | ⊕⊕⊕⊝ | IBDQ scores range from 32 to 224 with a higher score indicating better quality of life |
| Adverse events | 774 per 1,000 | 991 per 1,000 | RR 1.28 | 60 | ⊕⊕⊕⊝ | Common adverse events included dizziness, disturbance in attention, headache, nausea and fatigue |
| Serious adverse events | 97 per 1,000 | 15 per 1,000 | RR 0.15 | 60 | ⊕⊕⊝⊝ | There were no serious adverse events in the cannabidiol group Serious adverse events in the placebo group included worsening of ulcerative colitis and one complicated pregnancy |
| Withdrawal due to adverse event | 161 per 1,000 | 345 per 1,000 | RR 2.14 | 60 | ⊕⊕⊝⊝ | Withdrawls in the cannabidiol group were mostly due to dizziness Withdrawals in the placebo group were due to worsening ulcerative colitis |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded two levels due to very sparse data (15 events). 2 Downgraded two levels due to very sparse data (16 events). 3 Downgraded one level due to sparse data (59 participants). 4 Downgraded one level due to sparse data (53 participants). 5 Downgraded one level due to sparse data (53 events). 6 Downgraded two levels due to very sparse data (4 events). | ||||||
| Cannabis cigarettes (23 mg THC/day) compared to placebo for the treatment of ulcerative colitis | ||||||
| Patient or population: participants with active ulcerative colitis | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with placebo | Risk with cannabis cigarettes (11.5 mg THC) | |||||
| Clinical remission | Not reported | This outcome was not reported | ||||
| Clinical response | Not reported | This outcome was not reported | ||||
| CRP at 8 weeks | The mean CRP at 8 weeks was 1.0 mg/L | MD 0.3 mg/L lower | ‐ | 28 | ⊕⊕⊝⊝ | |
| Quality of life Inflammatory Bowel Disease Questionnaire (IBDQ) | Not reported | This outcome was not reported | ||||
| Adverse events | Not reported | This outcome was not reported | ||||
| Serious adverse events | 0 per 1,000 | 0 per 1,000 | not estimable | No serious adverse events were observed | ||
| Withdrawal due to adverse events | Not reported | This outcome was not reported | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded two levels due to very sparse data (28 participants). | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Clinical remission at 10 weeks Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 2 Clinical response at 10 weeks Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 3 CRP at 10 weeks Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 4 Inflammatory Bowel Disease Questionnaire (IBDQ) ‐ at 10 weeks Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 5 Symptom measure ‐ pain Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 6 Symptom measure ‐ rectal bleeding Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 7 Symptom measure ‐ stool frequency Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 8 Adverse events Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 9 Serious adverse events Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 10 Withdrawal due to adverse event Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 DAI Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 2 CRP Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 3 Fecal calprotectin Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 4 Serious adverse events Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |


