Ecografía, TC, RM o TEP‐TC para el estadiaje y reestadiaje de adultos con melanoma cutáneo
Resumen
Antecedentes
El melanoma es una de las formas más agresivas de cáncer de piel, con el potencial de metástasis a otras partes del cuerpo a través del sistema linfático y el torrente sanguíneo. Representa un porcentaje pequeño de los casos de cáncer de piel, pero es responsable de la mayoría de las muertes causadas por la enfermedad. Se pueden utilizar varios estudios de diagnóstico por imagen con el objetivo de detectar la diseminación metastásica de la enfermedad después de un diagnóstico primario de melanoma (estadiaje primario) o ante la sospecha clínica de recidiva de la enfermedad (reestadiaje). El estadiaje preciso es fundamental para asegurar que los pacientes reciban el tratamiento más apropiado y efectivo en diferentes puntos de la vía clínica. Establecer la precisión comparativa de la ecografía, la tomografía computadorizada (TC), la resonancia magnética (RM) y la tomografía por emisión de positrones (TEP)‐TC para la detección de metástasis ganglionares o a distancia, o ambas, es fundamental para entender si, cómo y dónde en la vía se pueden usar estos estudios.
Objetivos
Objetivos primarios
Se calculó la exactitud por separado de acuerdo con el punto de la vía clínica en que se utilizaron los estudios de diagnóstico por imagen. Los objetivos de la revisión fueron:
• determinar la precisión diagnóstica de la ecografía o de la TEP‐TC para la detección de metástasis ganglionares antes de la biopsia del ganglio linfático centinela en adultos con melanoma invasivo cutáneo confirmado; y
• determinar la precisión diagnóstica de la ecografía, la TC, la RM o la TEP‐TC para la obtención de imágenes de cuerpo entero en adultos con melanoma invasivo cutáneo:
○ para la detección de cualquier metástasis en adultos con un diagnóstico primario de melanoma (es decir, estadiaje primario en la presentación); y
○ para la detección de cualquier metástasis en adultos que se someten al estadiaje de la recidiva del melanoma (es decir, el reestadiaje impulsado por los hallazgos sobre el seguimiento de rutina).
Se realizaron análisis separados en función de si los datos de precisión se informaron por paciente o por lesión.
Objetivos secundarios
Se intentó determinar la exactitud diagnóstica de la ecografía, la TC, la RM o la TEP‐TC para la obtención de imágenes de cuerpo entero (detección de cualquier metástasis) en poblaciones mixtas o no claramente descritas de adultos con melanoma cutáneo invasivo.
Para los participantes del estudio sometidos a estadiaje primario o reestadiaje (para una posible recidiva), y para las poblaciones mixtas o poco claras, los objetivos fueron:
• determinar la exactitud diagnóstica de la ecografía, la TC, la RM o la TEP‐TC para la detección de metástasis ganglionares:
• determinar la exactitud diagnóstica de la ecografía, la TC, la RM o la TEP‐TC para la detección de metástasis a distancia; y
• determinar la exactitud diagnóstica de la ecografía, la TC, la RM o la TEP‐TC para la detección de metástasis a distancia según el sitio metastásico.
Métodos de búsqueda
Se realizó una búsqueda exhaustiva en las siguientes bases de datos desde su inicio hasta agosto de 2016: Registro Cochrane Central de Ensayos Controlados; MEDLINE; Embase; CINAHL; CPCI; Zetoc; Science Citation Index; National Institutes of Health Ongoing Trials Register de EE.UU.; NIHR Clinical Research Network Portfolio Database; y la International Clinical Trials Registry Platform de la OMS. Se estudiaron las listas de referencias y los artículos de revisiones sistemáticas publicados.
Criterios de selección
Se incluyeron estudios de cualquier diseño que evaluaran la ecografía (con o sin el uso de citología por aspiración con aguja fina [CAAF]), TC, RM o TEP‐TC para el estadiaje del melanoma cutáneo en adultos, en comparación con un estándar de referencia de confirmación histológica o imágenes con seguimiento clínico de al menos tres meses de duración. Se excluyeron los estudios que informaron de múltiples aplicaciones de la misma prueba en más del 10% de los participantes del estudio.
Obtención y análisis de los datos
Dos autores de la revisión extrajeron, de forma independiente, todos los datos mediante un formulario estandarizado de extracción de datos y de evaluación de la calidad (basado en Quality Assessment of Diagnostic Accuracy Studies 2 [QUADAS‐2]). Se calculó la exactitud con el modelo de dos variables jerárquico para obtener la especificidad y la sensibilidad resumidas con una confianza del 95% y regiones de predicción. Se realizó el análisis de los estudios, que permitió la comparación directa e indirecta entre las pruebas. Se examinó la heterogeneidad entre los estudios mediante la inspección visual de los diagramas de bosque de sensibilidad y especificidad y los diagramas de características operativas resumidas del receptor (ROC, sigla en inglés). El número de estudios identificados fue insuficiente para permitir la investigación formal de las fuentes potenciales de heterogeneidad.
Resultados principales
Se incluyó un total de 39 publicaciones que informaron sobre 5204 participantes en el estudio; 34 estudios que informaron de datos por paciente incluyeron 4980 participantes en el estudio, con 1265 casos de enfermedad metastásica, y siete estudios que informaron de datos por lesión incluyeron 417 participantes en el estudio, con 1846 lesiones potencialmente metastásicas, de las cuales se confirmaron metástasis en 1061 casos. El riesgo de sesgo fue bajo o poco claro para todos los dominios además del flujo de participantes. Las preocupaciones con respecto a la aplicabilidad de la evidencia fueron altas o poco claras para casi todos los dominios. La selección de participantes de poblaciones mixtas o no claramente definidas y la aplicación e interpretación de los exámenes índice mal descritas fueron particularmente problemáticas.
La exactitud de las imágenes para la detección de metástasis ganglionares regionales antes de la biopsia del ganglio linfático centinela (BGLC) se evaluó en 18 estudios. En 11 estudios (2614 participantes; 542 casos), la sensibilidad resumida de la ecografía sola fue de 35,4% (intervalo de confianza [IC] del 95%: 17% a 59,4%) y la especificidad fue de 93,9% (IC del 95%: 86,1% a 97,5%). La combinación de la ecografía pre‐BGLC con la CAAF indicó una sensibilidad resumida del 18% (IC del 95%: 3,58% a 56,5%) y una especificidad del 99,8% (IC del 95%: 99,1% a 99,9%) (1164 participantes; 259 casos). Cuatro estudios demostraron una menor sensibilidad (10,2%; IC del 95%: 4,31% a 22,3%) y especificidad (96,5%; IC del 95%: 87,1% a 99,1%) para la TEP‐TC antes de la BGLC (170 participantes, 49 casos). Cuando estos datos se traducen a una cohorte hipotética de 1000 pacientes candidatos a la BGLC, 237 de los cuales presentan metástasis ganglionares (prevalencia mediana), la combinación de ecografía con CAAF puede permitir que 43 pacientes con metástasis ganglionares sean derivados directamente al tratamiento adyuvante en lugar de someterse primero a la BGLC, a un coste de dos pacientes con resultados positivos falsos (que son tratados incorrectamente). Los pacientes con ecografía negativa falsa serán identificados en la BGLC subsiguiente.
Se dispuso de datos limitados sobre la precisión de los estudios de diagnóstico por imagen de cuerpo entero mediante TEP‐TC para el estadiaje primario o el reestadiaje para la recidiva de la enfermedad, y ninguno evaluó la RM. Veinticuatro estudios evaluaron las imágenes de cuerpo entero. Seis de estos estudios exploraron el estadiaje primario después de un diagnóstico confirmado de melanoma (492 participantes), tres evaluaron el reestadiaje de la enfermedad después de alguna indicación clínica de recidiva (589 participantes), y 15 incluyeron grupos de población mixtos o no claramente descritos con participantes en varios puntos de la vía clínica y en diversos estadios de la enfermedad (1265 participantes). Los resultados de las imágenes de cuerpo entero no pudieron traducirse a una cohorte hipotética de pacientes debido a la escasez de datos.
La mayoría de los estudios (6/9) de enfermedad primaria o reestadiaje de la enfermedad consideraron la TEP‐TC, dos en comparación con la TC sola, y tres examinaron el uso de la ecografía. No se identificaron evaluaciones elegibles de RM en estos grupos. Todos los estudios utilizaron estándares de referencia histológicos combinados con el seguimiento, y dos incluyeron CAAF para algunos participantes. La precisión observada para la detección de cualquier metástasis para la TEP‐TC fue mayor para el reestadiaje de la enfermedad (sensibilidad resumida de dos estudios: 92,6%; IC del 95%: 85,3% a 96,4%; especificidad: 89,7%, IC del 95%: 78,8% a 95,3%; 153 participantes; 95 casos) en comparación con el estadiaje primario (la sensibilidad de los estudios individuales varió del 30% al 47% y la especificidad del 73% al 88%), y fue más sensible que la TC sola en ambos grupos de población, pero el número de participantes fue muy pequeño.
No se pueden establecer conclusiones con respecto al estudio de diagnóstico por imagen de rutina del cerebro con RM o TC.
Conclusiones de los autores
Los autores de revisión encontraron una falta de evidencia decepcionante sobre la exactitud de los estudios de diagnóstico por imagen en pacientes con diagnóstico de melanoma en diferentes puntos de la vía clínica. Los estudios fueron pequeños y a menudo informaron de datos según el número de lesiones en lugar del número de participantes del estudio. Las imágenes ecográficas combinadas con CAAF antes de la BGLC pueden identificar cerca de una quinta parte de los pacientes con enfermedad ganglionar, pero los intervalos de confianza son amplios y se necesita más investigación para establecer la coste‐efectividad. Gran parte de la evidencia de las imágenes de cuerpo entero para el estadiaje primario o reestadiaje de la enfermedad se centra en la TEP‐TC, y faltan datos comparativos con la TC o la RM. Los estudios futuros deben ir más allá de la exactitud diagnóstica y considerar los efectos de diferentes estudios de diagnóstico por imagen sobre el tratamiento de la enfermedad. La creciente disponibilidad de tratamientos adyuvantes para los pacientes con melanoma de alto riesgo de propagación de la enfermedad en el momento de la presentación tendrá un impacto considerable en los servicios de estudios de diagnóstico por imagen; sin embargo, la evidencia de la precisión diagnóstica relativa de los exámenes disponibles es limitada.
Resumen en términos sencillos
¿Cuál es la efectividad de la ecografía, la TC, la RM y la TEP‐TC para identificar la diseminación de la enfermedad en pacientes con melanoma?
¿Cuál es el objetivo de la revisión?
Se buscó averiguar qué estudios de diagnóstico por imagen son mejores para identificar la diseminación de la enfermedad en los pacientes con un primer diagnóstico de melanoma (estadiaje primario) y en los pacientes con posible recidiva de melanoma (reestadiaje). Se examinó la evidencia de la ecografía, TC, RM y TEP‐TC y se incluyeron 39 estudios para responder a estas preguntas.
¿Por qué son importantes los estudios de diagnóstico por imagen para el melanoma?
El melanoma es una de las formas más agresivas de cáncer de piel, con la posibilidad de que las metástasis (células cancerosas) se propaguen a los ganglios linfáticos y otros órganos del cuerpo. Para asegurarse de que los pacientes con melanoma reciban el tratamiento más apropiado y efectivo, es importante identificar si la enfermedad se ha propagado y a qué zonas. Esto se llama "estadiaje de la enfermedad". El estadiaje se realiza para determinar si un melanoma se ha diseminado a los ganglios linfáticos regionales o a los ganglios linfáticos cercanos al melanoma original, y si se ha diseminado a los ganglios linfáticos de otras partes del cuerpo o a órganos como el hígado o el cerebro (metástasis a distancia). Los estudios de diagnóstico por imagen son herramientas que se pueden utilizar para ayudar a determinar el grado de diseminación de la enfermedad. Actualmente existen varios tratamientos nuevos para reducir el riesgo de diseminación del melanoma y para tratarlo cuando se ha diseminado.
¿Qué se estudió en la revisión?
La revisión incluye cuatro estudios de diagnóstico por imagen que crean imágenes del cuerpo de diferentes maneras. La ecografía utiliza ondas sonoras de alta frecuencia para crear imágenes; las tomografías computadorizadas (TC) utilizan radiación ionizante en forma de rayos X (una dosis muy baja de radiación); y la resonancia magnética (RM) utiliza grandes imanes y radiación no ionizante en forma de ondas de radio (que no son dañinas) para generar imágenes del cuerpo. La TEP‐TC requiere la inyección de una sustancia débilmente radioactiva (FDG). La parte TEP de la exploración identifica las áreas del cuerpo que absorben mucha FDG (lo que indica la presencia de células cancerosas), y la parte TC ayuda a mejorar la calidad de la imagen y a localizar con mayor precisión las áreas que utilizan más FDG. La ecografía también se puede realizar junto con un procedimiento bastante simple llamado "citología por aspiración con aguja fina" (CAAF), en que se utiliza una aguja muy fina para tomar una pequeña muestra de células de un ganglio linfático que parece sospechoso en la ecografía. Luego se utiliza un microscopio para identificar si las células son malignas o no.
Las imágenes se pueden utilizar en diferentes momentos después del diagnóstico de melanoma. Los profesionales sanitarios pueden usar imágenes para observar los ganglios linfáticos regionales más cercanos al melanoma antes de que se realice un tipo de cirugía llamada biopsia del ganglio linfático centinela. La biopsia del ganglio linfático centinela extrae los ganglios linfáticos que tienen mayor probabilidad de presentar metástasis, de manera que puedan ser analizados en un laboratorio. Las imágenes también se pueden usar después de una biopsia del ganglio linfático centinela o en pacientes con melanoma de alto riesgo para buscar cualquier diseminación de la enfermedad. Las imágenes se pueden utilizar en pacientes que recibieron tratamiento para el melanoma anteriormente y que podrían presentar una recidiva de la enfermedad.
¿Cuáles son los principales resultados de la revisión?
Ecografía de los ganglios linfáticos regionales antes de la biopsia del ganglio linfático centinela
Se encontraron 11 estudios relevantes con 2614 pacientes. Tres de estos estudios compararon la ecografía por sí sola con la ecografía combinada con CAAF. Los resultados sugieren que el procedimiento combinado identifica correctamente cerca de una quinta parte de los pacientes con metástasis en los ganglios linfáticos, con muy pocos resultados positivos falsos (pacientes con diagnóstico incorrecto de metástasis). Estos resultados se pueden ilustrar si se imagina un grupo de 1000 pacientes con melanoma que van a ser sometidos a biopsia del ganglio linfático centinela, de los cuales 237 (24%) presentan metástasis en los ganglios linfáticos. La combinación de la ecografía con la CAAF puede identificar a 43 pacientes con metástasis ganglionares y evitar una biopsia del ganglio linfático centinela, a un coste de dos pacientes con resultados positivos falsos que podrían seguir con el tratamiento equivocado. Los pacientes con metástasis en los ganglios linfáticos que no se detectan en la ecografía (negativos falsos) serán identificados en la BGLC subsiguiente.
Imágenes de cuerpo completo (detección de metástasis)
Se encontraron 24 estudios, pero solo en nueve fue claro el punto en el curso temporal de la enfermedad en que se realizaron las imágenes. Seis estudios con 492 pacientes analizaron las imágenes para el estadiaje primario después de un diagnóstico confirmado de melanoma, y tres estudios con 589 individuos evaluaron el reestadiaje de la enfermedad en pacientes con posible recidiva de la enfermedad.
La mayoría de los estudios (6/9) consideraron la TEP‐TC, dos en comparación con la TC sola, y tres examinaron el uso de la ecografía. No se encontraron estudios adecuados de RM en estos grupos.
Los resultados generales sugieren que la TEP‐TC es mejor para identificar correctamente a los pacientes con diseminación metastásica de la enfermedad que podrían presentar una recidiva (reestadiaje) que a los pacientes con un nuevo diagnóstico de melanoma (estadiaje primario). La TEP‐TC también parece ser mejor que la TC para identificar la propagación de la enfermedad en ambos grupos de pacientes, pero los estudios fueron muy pequeños y los resultados podrían no ser confiables.
¿Cuán confiables son los resultados de los estudios incluidos en esta revisión?
En la mayoría de nuestros estudios, se realizó un diagnóstico fiable de propagación de la enfermedad (o estándar de referencia) mediante la realización de biopsias y el seguimiento de los pacientes a lo largo del tiempo con evaluación clínica e imágenes. A menudo se carecía de detalles sobre cómo se realizaba el seguimiento de los pacientes y qué pruebas se utilizaban. Muchos estudios no incluyeron a pacientes en momentos claramente definidos del proceso de la enfermedad, lo que dificulta la evaluación de la relevancia de sus resultados. Los informes sobre la aplicación e interpretación de los pruebas fueron deficientes.
¿Para quiénes son relevantes los resultados de esta revisión?
Se realizaron 33 estudios en Europa (85%) y el resto en Norteamérica (n = 4), Asia (n = 1) u Oceanía (n = 1). La edad promedio de los pacientes en los estudios fue de 50 a 67 años, y cerca de la mitad eran hombres. Los estudios incluyeron en su mayoría a pacientes con melanoma en cualquier parte del cuerpo, pero dos incluyeron solo pacientes con melanoma en la cabeza o el cuello. Los estudios a menudo incluyeron a pacientes en diferentes estadios de la enfermedad, y no se pudo observar la exactitud de las pruebas para los pacientes en cualquier estadio de la enfermedad en particular. Los estudios fueron pequeños, y los resultados podrían no coincidir con lo que sucede en la vida real.
¿Cuáles son las implicaciones de esta revisión?
Los autores de revisión encontraron cierta evidencia para apoyar el uso de la ecografía combinada con CAAF antes de la biopsia del ganglio linfático centinela, pero se necesitan más estudios para establecer la coste‐efectividad. Se dispone de evidencia limitada sobre la obtención de imágenes de cuerpo entero para el estadiaje primario o el reestadiaje de la enfermedad. La evidencia disponible se centra en la TEP‐TC; hay pocas comparaciones con la TC y ninguna con la RM. La investigación futura necesita considerar más que la exactitud de los exámenes y analizar los efectos de los distintos estudios de diagnóstico por imagen sobre las decisiones de tratamiento para los pacientes.
¿Cuál es el grado de actualización de esta revisión?
Los autores de la revisión buscaron e incluyeron estudios publicados hasta agosto de 2016.*
*En estos estudios, el seguimiento con estudios de diagnóstico por imagen y la biopsia fueron los estándares de referencia (métodos para establecer los diagnósticos finales).
Conclusiones de los autores
Summary of findings
| Question | How accurate is ultrasound, CT, MRI, or PET‐CT for staging or re‐staging of cutaneous invasive melanoma in adults? | ||||||
| Population: | Adults with a confirmed diagnosis of melanoma undergoing imaging for staging purposes:
| ||||||
| Index test(s): | Ultrasound with or without fine needle aspiration cytology (FNAC) Computed tomography (CT) Magnetic resonance imaging (MRI) Positron emission tomography–computed tomography (PET‐CT) | ||||||
| Comparator test: | All of the index tests may be used in comparison to each other | ||||||
| Target condition: | For pre‐SLNB imaging: detection of nodal metastases For all other imaging: detection of any metastases | ||||||
| Reference standard: | Histology plus clinical or imaging follow‐up | ||||||
| Action: | If accurate, positive results of imaging before SLNB in some circumstances could allow patients with nodal metastases to proceed directly to commence adjuvant therapy and avoid an additional invasive procedure (SLNB). Accurate whole body imaging will allow appropriate locoregional and systemic therapies to be initiated in a timely manner | ||||||
| Quantity of evidence (n = 39 studies) | Number of studies | Number of participants | Number of cases | ||||
| Per patient data: | 34 | 4980 | 1265 | ||||
| Per lesion data: | 7 | 417 (1846 lesions) | 1061 metastases | ||||
| Limitations | |||||||
| Risk of bias: | Some concerns due to poor reporting across almost all domains. Unclear risk for participant selection method (11/39) or exclusions not clearly described (3/39). High risk from exclusions on the basis of index test results (4/39). Low risk for the index test for pre‐SLNB ultrasound (6/11), other ultrasound evaluation (3/5), CT (7/10), and MRI (4/4). For PET‐CT, unclear risk from lack of description of blinded case note review to ascertain imaging results for retrospective studies (13/23) and high risk from data driven selection of test threshold (1/23). Unclear risk for reference standard from lack of detail on participant follow‐up schedules (12/39). Lack of blinding of the histological diagnosis (2/39) or data collection on follow‐up (3/39) to the index result. High risk from differential verification (20/39) and participant exclusions (13/39). Low risk for comparisons between tests (6/9) | ||||||
| Applicability of evidence to question: | High or unclear concern for applicability for almost all domains. High concern for participant selection from mixed populations (11/39) or data presented per lesion (5/39). Unclear concern from lack of clarity regarding study population. High concern for index tests from poor description of test thresholds (pre‐SLNB ultrasound (1/11), other ultrasound (1/5), CT (5/10), MRI (3/4), PET‐CT (4/23)) or consensus test interpretation (CT (6/10), MRI (2/4), PET‐CT (11/23)). Unclear concern for application and interpretation of the index test (pre‐SLNB US (10/11), CT (3/10), MRI (2/4), PET‐CT (6/23)) or unclear observer expertise (pre‐SLNB ultrasound (6/11), CT (3), MRI (2/4), PET‐CT (6/23)). Unclear concern for applicability of the reference standard from lack of description of the target condition or no breakdown of cases according to nodal or distant metastases. Expertise of the histopathologist poorly described (6/39) | ||||||
| Findings | |||||||
| Thirty‐nine studies reporting accuracy data for pre‐SLNB imaging (n = 18) or for whole body imaging (n = 24) were included. The 24 studies of whole body imaging were of primary staging (n = 6) or staging for potential recurrence of disease (n = 3), or were conducted in mixed or not clearly described populations (n = 15). As we are unable to make clear statements regarding the expected accuracy of imaging at any particular point on the clinical pathway for the mixed population group, the findings presented are based on results for pre‐SLNB imaging, and for primary staging and re‐staging of melanoma only. | |||||||
| Test: pre‐SLNB imaging | |||||||
| Test | Studies: patients (cases) | Sensitivity (95% CI) | Specificity (95% CI) | Numbers in a cohort of 1000 lesions at a median prevalence of 23.7%a | |||
| TP (95% CI) | FN (95% CI) | FP (95% CI) | TN (95% CI) | ||||
| US | 11: 2614 (542) | 35.4 (17.0 to 59.4) | 93.9 (86.1 to 97.5) | 84 (40 to 141) | 153 (197 to 96) | 47 (106 to 19) | 716 (657 to 744) |
| US + FNAC | 3: 1164 (259) | 18.0 (3.58 to 56.5) | 99.8 (99.1 to 99.9) | 43 (8 to 134) | 194 (229 to 103) | 2 (7 to 1) | 761 (756 to 762) |
| PET‐CT | 4: 170 (49) | 10.2 (4.31 to 22.3) | 96.5 (87.1 to 99.1) | 24 (10 to 53) | 213 (227 to 184) | 27 (98 to 7) | 736 (665 to 756) |
| Whole bodyimaging for primary staging of melanoma | |||||||
| Quantity of evidence (n = 6 studies) | Number of studies | Number of participants | Number of cases | ||||
| Any metastases | 3 | 81 | 51 | ||||
| Nodal metastases | 3 | 373 | 68 | ||||
| Distant metastases | 2 | 112 | 17 | ||||
| Findings | |||||||
| Four of the six studies evaluated PET‐CT, one in comparison to CT.
No data for MRI were identified. Results for ultrasound for the detection of nodal metastases (2 studies) were highly variable and likely subject to bias. | |||||||
| Whole bodyimaging for re‐staging of melanoma | |||||||
| Quantity of evidence (n = 3 studies) | Number of studies | Number of participants (lesions) | Number of cases (metastases) | ||||
| Any metastases: | 2 (1) | 153 (139) | 95 (87) | ||||
| Nodal metastases: | 1 | 460 | 37 | ||||
| Distant metastases: | 0 | N/A | N/A | ||||
| Findings: | |||||||
|
No data for MRI were identified. | |||||||
| aMedian prevalence observed across 11 studies of pre‐SLNB ultrasound (interquartile range: 25th percentile 20.5%, 75th percentile 25.4%). CT: computed tomography; FN: false negative; FNAC: fine needle aspiration cytology; FP: false positive; MRI: magnetic resonance imaging; PET: positron emission tomography; SLNB: sentinel lymph node biopsy; TN: true negative; TP: true positive. | |||||||
Antecedentes
Esta revisión forma parte de una serie de revisiones de la Cochrane Diagnostic Test Accuracy (DTA) sobre el diagnóstico y el estadiaje de los cánceres de piel de melanoma y queratinocitos realizadas para el Programa Cochrane de Revisiones Sistemáticas del National Institute for Health Research (NIHR). El Apéndice 1 muestra el contenido y la estructura del programa. En el Apéndice 2 figura un glosario de los términos utilizados, y en el Apéndice 3 se presenta un cuadro con las siglas utilizadas.
Enfermedad de interés diagnosticada
El melanoma es una de las formas más agresivas de cáncer de piel, con el potencial de metástasis a otras partes del cuerpo a través del sistema linfático y el torrente sanguíneo. Representa un porcentaje pequeño de los casos de cáncer de piel, pero es responsable de hasta un 75% de las muertes causadas por la enfermedad (Boring 1994; Cancer Research UK 2017). El melanoma surge de la proliferación incontrolada de melanocitos, las células epidérmicas que producen pigmento o melanina. Se presenta con mayor frecuencia en la piel, pero puede ocurrir en cualquier órgano que contenga melanocitos, incluidas las superficies mucosas, la parte posterior del ojo y el revestimiento alrededor de la médula espinal y el cerebro. El «melanoma cutáneo» se refiere a una lesión cutánea con melanocitos malignos presentes en la dermis, e incluye la diseminación superficial y variantes de melanoma nodular, lentiginoso acral y lentigo maligno (Figura 1).
La incidencia de melanoma aumentó a más de 200 000 nuevos casos diagnosticados en todo el mundo en 2012 (Erdmann 2013; Ferlay 2015), con una estimación de 55 000 muertes (Ferlay 2015). La mayor incidencia se observa en Australia, con 11 405 nuevos casos de melanoma de piel (ACIM 2014), y en Nueva Zelanda, con 2341 casos registrados en 2010 (Cancer Society of New Zealand 2013). En los EE.UU. para 2014, la incidencia prevista era de 73 870 por año, y el número previsto de muertes de 9940 (Siegel 2015). Las tasas más altas de Europa se observan en el noroeste y en los países escandinavos, con una incidencia más alta en Suiza, de 25,8 por 100 000 en 2012. Las tasas en el Reino Unido se triplicaron, de 4,6 y 6,0 por cada 100 000 hombres y mujeres, respectivamente, en Inglaterra en 1990, a 18,6 y 19,6 por cada 100 000 en 2012 (EUCAN 2012). En el Reino Unido, el melanoma tiene una de las tasas de incidencia de cáncer que más rápido ha aumentado, y muestra el mayor aumento proyectado de incidencia entre 2007 y 2030 (Mistry 2011). En la década anterior a 2013, la incidencia estandarizada por edad aumentó en un 46%, con 14 500 nuevos casos en 2013 y 2459 muertes en 2014 (Cancer Research UK 2017a). Aunque las tasas generales de incidencia son más altas en las mujeres que en los hombres, la tasa de incidencia en hombres está aumentando más rápidamente que en las mujeres (Arnold 2014).
Se cree que el aumento de la incidencia de melanoma está relacionado sobre todo con el aumento de la exposición recreativa al sol y el uso de camas de bronceado, sumado a una población cada vez más envejecida con una mayor exposición vital recreativa a los rayos ultravioleta (UV) (Boniol 2012; Gandini 2005), junto con una posible detección más temprana (Belbasis 2016; Linos 2009). Los factores de riesgo supuestos se revisan en detalle en otra parte (Belbasis 2016), pero pueden dividirse ampliamente en factores del huésped y ambientales. Los factores del huésped incluyen: piel clara y cabello o color de ojos claro; edad avanzada (Geller 2002); sexo masculino (Geller 2002); antecedentes de cáncer de piel (Tucker 1985); lesiones cutáneas predisponentes (p.ej. recuentos elevados de nevus melanocíticos) (Gandini 2005), nevus clínicamente atípicos (Gandini 2005) y nevus congénitos de gran tamaño (Swerdlow 1995); trastornos de la piel heredados genéticamente (por ejemplo, xerodermia pigmentaria) (Lehmann 2011); y antecedentes familiares de melanoma (Gandini 2005). Los factores ambientales incluyen: la exposición recreativa y ocupacional a la luz solar (tanto acumulativa como episódica) (Armstrong 1977; Gandini 2005), el bronceado artificial (Boniol 2012) y la inmunosupresión (p.ej. en receptores de trasplantes de órganos o en individuos con el virus de la inmunodeficiencia humana [VIH]) (DePry 2011). La clase socioeconómica más baja puede estar asociada con una presentación tardía y, por lo tanto, con una enfermedad más avanzada en el momento del diagnóstico (Reyes‐Ortiz 2006).
Los principales indicadores pronósticos tras el diagnóstico de melanoma cutáneo se pueden dividir en factores histológicos y clínicos. Histológicamente, el espesor de Breslow es el factor predictivo más importante de supervivencia, ya que es una medida cuantitativa de la invasión o volumen tumoral y, por tanto, de la propensión a la metástasis (Balch 2001). Otros factores asociados con un peor pronóstico histológicamente incluyen la ulceración microscópica, la tasa mitótica, los satélites microscópicos, la regresión, la invasión linfovascular y los subtipos nodulares (de rápido crecimiento) o amelanóticos (sin pigmento de melanina) (Moreau 2013; Shaikh 2012). Independientemente del espesor del tumor, el pronóstico es peor en personas mayores, hombres y aquellos con lesiones localmente recurrentes, compromiso de los ganglios linfáticos regionales o ubicación de la lesión primaria en el cuero cabelludo o el cuello (Zemelman 2014).
Después de la confirmación histológica del diagnóstico, la lesión se estadifica según el sistema de estadiaje del American Joint Committee on Cancer (AJCC) para informar la estrategia de tratamiento (la octava versión del sistema de estadiaje ‐ AJCC 8 ‐ se describe en Gershenwald 2017). El estadio 0 se refiere al melanoma in situ; los estadios I a II, al melanoma localizado; el estadio III a la metástasis regional (diseminada a los ganglios linfáticos, generalmente pero no siempre a los más cercanos al tumor primario); y el estadio IV a la metástasis a distancia. Se asigna una etapa preliminar basada en la evaluación histológica (espesor de la lesión primaria y presencia de ulceración) y clínica (y a veces radiológica) de los ganglios linfáticos regionales. Luego se confirma un estadio patológico basado en la histología de la lesión primaria y de los ganglios linfáticos regionales (si el paciente se somete a una biopsia del ganglio linfático centinela [BGLC] o a una linfadenectomía completa [LNDC] en el caso de los pacientes con ganglios linfáticos clínicamente palpables) y en la obtención de imágenes para confirmar la presencia o ausencia de la enfermedad diseminada, cuando esté indicado.
Una base de datos norteamericana de más de 40 000 pacientes a partir de 1998, que ayudó al desarrollo del AJCC 8, indicó una supervivencia a cinco años del 99% para el melanoma en estadio muy temprano, que luego descendió a entre el 32% y el 93% en la enfermedad en estadio III, según el espesor del tumor, la presencia de úlceras y el número de ganglios comprometidos (Gershenwald 2017). Antes de la llegada del tratamiento dirigido y las inmunoterapias, el melanoma diseminado (a sitios a distancia/órganos viscerales) se asociaba con una mediana de supervivencia de seis a nueve meses, una supervivencia a un año del 25% y una supervivencia a tres años del 15% (Balch 2009; Korn 2008).
Entre 1975 y 2010, la supervivencia relativa a cinco años para el melanoma (es decir, sin incluir la muerte por otras causas) en los Estados Unidos aumentó del 80% al 94%, con una supervivencia para la enfermedad localizada, regional y a distancia estimada en 99%, 70% y 18%, respectivamente, en 2010 (Cho 2014). Sin embargo, las tasas de mortalidad mostraron pocos cambios, de 2,1 por cada 100 000 muertes en 1975, y de 2,7 por cada 100 000 en 2010 (Cho 2014). El aumento de la incidencia de la enfermedad localizada durante el mismo período (de 5,7 a 21 por 100 000) sugiere que gran parte de la mejoría observada en la supervivencia puede deberse a una detección más temprana y a una mayor vigilancia (Cho 2014). Las nuevas terapias dirigidas para el melanoma avanzado (estadio IV) (p.ej. los inhibidores de la BRAF) han mejorado la supervivencia, y las inmunoterapias están evolucionando de tal manera que se está documentando la supervivencia a largo plazo (Rozeman 2018). No se analizaron nuevos datos sobre las perspectivas de supervivencia de los pacientes con enfermedad en estadio IV para las guías de estadiaje del AJCC 8 debido a la falta de datos contemporáneos (Gershenwald 2017).
Tratamiento del melanoma
El tratamiento del melanoma varía, hasta cierto punto, según el estadio de la enfermedad en el momento del diagnóstico. Para el melanoma primario, la base del tratamiento es la escisión completa de la lesión, con un margen de seguridad a cierta distancia de los bordes del tumor primario para extirpar tanto el tumor como cualquier célula maligna que pueda haberse extendido a la piel circundante (Garbe 2016; Marsden 2010; NICE 2015a; SIGN 2017; Sladden 2009). Los márgenes quirúrgicos recomendados varían según el espesor del tumor (Garbe 2016) y el estadio de la enfermedad en el momento de la presentación (NICE 2015a). La evidencia de intervenciones locales o regionales adicionales, como márgenes quirúrgicos más amplios, es limitada (Sladden 2009; Wheatley 2016), aunque se programan ensayos adicionales en esta área.
La biopsia del ganglio linfático centinela se ha ofrecido a los pacientes que no presentan ganglios linfáticos clínicamente palpables como una forma de proporcionar información pronóstica durante varios años, con la opción de LNDC en caso de un resultado positivo (metástasis identificadas en la BGLC). Datos recientes (ensayos MLST II ‐ Kyrgidis 2015 y Morton 2014 ‐ y DeCOG ‐ Leiter 2016 y Leiter 2018) muestran que no hay beneficio para la supervivencia con la LNDC para este grupo de pacientes, y el procedimiento dejó de ser un estándar de atención para la mayoría de los pacientes. Los avances recientes que demuestran una supervivencia libre de recidiva más prolongada para los pacientes con melanoma en estadio III, que reciben terapia dirigida por el BRAF o inmunoterapias, han resultado en el uso de la BGLC como prueba para identificar a los pacientes a los que se les debe ofrecer tratamiento adyuvante (Eggermont 2016; Eggermont 2018; Long 2017; Weber 2017). Hasta el momento de la revisión, las guías disponibles no representaban este cambio reciente de la práctica (Garbe 2016; NICE 2015a). En el Reino Unido, el National Institute for Health and Care Excellence (NICE) aprobó el dabrafenib y el trametinib para el tratamiento adyuvante del melanoma resecado con la mutación BRAF V600 (NICE 2018a), con evaluaciones adicionales del pembrolizumab para el tratamiento adyuvante del melanoma con alto riesgo de recidiva (NICE 2018b), así como evaluaciones en curso del nivolumab para el tratamiento adyuvante del melanoma resecado en estadio III y IV (NICE 2019a).
Para el melanoma en estadio IV, la dacarbazina fue el único fármaco aprobado en todo el mundo durante muchos años, con el uso de fotemustina en algunos países europeos (Avril 2004) y de interleucina (IL)‐2 en los Estados Unidos (Atkins 1999). También se ha utilizado la temozolomida, sobre todo en pacientes con metástasis cerebrales, ya que tiene una alta capacidad para atravesar la barrera hematoencefálica (Lukas 2014; Zhu 2014). Se han producido cambios significativos en esta situación por la introducción de dos enfoques terapéuticos distintos que indican un beneficio para la supervivencia en el melanoma metastásico: (1) dirigido a mutaciones en células tumorales, y (2) inmunomodulación (Chapman 2011; Chapman 2012; Dummer 2014; Hamid 2013; Hodi 2010; Larkin 2014; Robert 2015; Villanueva 2010). Varios tratamientos diferentes han demostrado una tasa de respuesta alta y, lo más importante, han demostrado por primera vez en el tratamiento del melanoma el potencial de una respuesta clínica duradera (Chapman 2011; Hamid 2013; Hodi 2010; Hodi 2016; Larkin 2015; Maio 2015; Sznol 2013). Actualmente, se recomiendan varios tratamientos solos o en combinación para subgrupos particulares de pacientes con melanoma metastásico, tanto en el Reino Unido (NICE 2018a) como en otros países (Garbe 2016), y han sido el tema de una revisión Cochrane (Pasquali 2018). Se está llevando a cabo una evaluación del encorafenib con binimetinib para el melanoma con mutación avanzada BRAF V600 (NICE 2019b), y en la actualidad se suspenden otros tratamientos a la espera de las solicitudes de autorización de comercialización de las empresas afectadas (NICE 2018c).
También se dispone de intervenciones psicosociales para mejorar la calidad de vida y la angustia psicológica general después del diagnóstico en pacientes con cáncer. Sin embargo, una revisión Cochrane encontró variaciones considerables en la evidencia para apoyar estas intervenciones (Galway 2012).
Prueba/s índice
El estadiaje preciso del melanoma es más importante que nunca, en parte para evitar el tratamiento innecesario y la morbilidad asociada en los pacientes con enfermedad en estadio temprano, y también para asegurar que se inicien de manera oportuna los tratamientos potencialmente efectivos en los pacientes con enfermedad metastásica ganglionar o a distancia.
Los estudios de diagnóstico por imagen como la ecografía, la tomografía computadorizada (TC) o la resonancia magnética (RM) pueden realizarse en varios puntos a lo largo de la vía clínica, como la presentación inicial de la enfermedad (estadiaje primario), la recidiva (reestadiaje) y el seguimiento después del tratamiento previo en los pacientes son asintomáticos para la recidiva. El uso de imágenes durante el seguimiento sin indicación clínica específica para su obtención (es decir, como prueba de monitorización para la vigilancia de enfermedades) no es el objetivo de estas revisiones. Históricamente, la mayor parte del estadiaje en términos de imágenes se ha realizado en pacientes con la enfermedad en estadio clínico III y IV (ver Vía clínica). Sin embargo, este panorama está cambiando a medida que se dispone de más tratamientos sistémicos adyuvantes para el melanoma.
Los estudios de diagnóstico por imagen son típicamente realizados e interpretados por radiólogos, con decisiones sobre el tratamiento del paciente después del estudio de diagnóstico por imagen o la BGLC en reuniones de un equipo multidisciplinario que incluye oncólogos, dermatólogos y cirujanos (Vía clínica).
Ecografía
La ecografía utiliza ondas sonoras de alta frecuencia para crear imágenes del cuerpo. Se puede utilizar para ayudar en la detección de ganglios linfáticos afectados por un melanoma clínicamente negativo en los ganglios; en el tratamiento de pacientes con imágenes positivas, que lleva a la citología por aspiración con aguja fina (CAAF) o a la biopsia de núcleo; y en el tratamiento de pacientes que son negativos en la ecografía sola o en la ecografía combinada con la CAAF, que lleva a la BGLC. Una revisión sistemática de 2011 identificó 21 estudios de ecografía para el estadiaje o vigilancia de los ganglios linfáticos primarios; en el estadiaje primario, la sensibilidad fue del 60% para la detección de ganglios linfáticos afectados, con una especificidad del 97% (el número de estudios que consideraron el estadiaje versus la vigilancia no está claro) (Xing 2011).
Tomografía computadorizada (TC) (sin contraste o con contraste)
Las tomografías computadorizadas utilizan radiación ionizante en forma de rayos X para tomar imágenes transversales del cuerpo (Bluemm 1983; van Waes 1983). Este procedimiento implica cantidades variables de radiación de acuerdo con el área del cuerpo que se va a escanear (Mahesh 2017), y se puede realizar con un agente de contraste intravenoso (TC con contraste) para aumentar la sensibilidad de la detección de metástasis en órganos sólidos.
Mohr 2009 describe la TC con contraste como el mejor método para identificar metástasis intratorácicas y como superior a los rayos X para la detección de adenopatías mediastinales e hiliares asociadas con la diseminación linfática y para la evaluación de lesiones óseas. La tomografía computadorizada también se puede usar para evaluar la diseminación metastásica al cerebro, aunque la resonancia magnética (RM) se considera más sensible (Goulart 2011). La especificidad general es alta para la detección de la enfermedad ganglionar regional y a distancia, pero la sensibilidad varía entre el 23% y el 85% para la detección de metástasis ganglionares, y entre el 25% y el 74% para la evaluación de la diseminación a distancia (Xing 2011).
Resonancia magnética (RM) (sin contraste o con contraste)
Las exploraciones por resonancia magnética utilizan grandes imanes y radiación no ionizante en forma de ondas de radio para generar imágenes del cuerpo (Ai 2012). Estas exploraciones son más costosas y llevan más tiempo en comparación con las exploraciones por TAC (Whaley 2016b).
No se identificaron revisiones sistemáticas de la RM para el estadiaje del melanoma mediante las búsquedas preliminares; sin embargo, varios estudios han considerado la RM de cuerpo entero (Jouvet 2014; Mosavi 2013), así como la RM para la detección de metástasis cerebrales o hepáticas (Aukema 2010a; Sofue 2012). Dado que el melanoma es uno de los tres tipos de cáncer que causan metástasis cerebrales (Cagney 2017), debe considerarse el conjunto de la evidencia para aumentar la exactitud de la RM en comparación con otros estudios de diagnóstico por imagen.
TEP‐TC (tomografía de emisión de positrones ‐ tomografía computadorizada)
Tomografía de emisión de positrones‐tomografía computadorizada es una técnica de estudios de diagnóstico por imagen híbrida que proporciona información tanto funcional como anatómica. Implica la inyección de un radiofármaco que emite positrones débilmente radioactivo, que generalmente es la 2‐desoxi‐2‐[18F]fluoro‐D‐glucosa (FDG), con el propósito de obtener imágenes oncológicas. La distribución de la FDG por todo el cuerpo se representa en imágenes, y el tejido maligno generalmente muestra mayores niveles de captación de FDG que el tejido normal (Lammertsma 2017). El componente de dosis baja de TC del estudio genera factores de atenuación que mejoran la calidad de las imágenes TEP y permite una localización anatómica precisa de las áreas de captación de FDG (IAEA 2016). Aunque inicialmente los escáneres TEP eran dispositivos autónomos, desde 2004, todos los escáneres modernos han sido integrados con escáneres TEP‐TC (Jones 2017). Una revisión sistemática del valor agregado de la TEP‐TC integrada comparada con la TEP sola en una variedad de cánceres sugirió un aumento del 10% en la sensibilidad de la TEP‐TC comparada con la TEP sola a partir de un metanálisis de diez estudios comparativos (Gao 2013). Por estas razones, la TEP sola no se ha considerado como una prueba índice para esta revisión.
En comparación con la TC sola, la TEP‐TC se considera generalmente como un estudio más sensible (Xing 2011); sin embargo, los aumentos en la sensibilidad deben estar vinculados a cualquier beneficio para el paciente en términos de cambios en el tratamiento y, en última instancia, en los resultados del paciente (Schroer‐Gunther 2012; Subesinghe 2013). Puede ser que la TEP‐TC tenga el valor agregado significativo para metástasis en sitios que son difíciles de alcanzar con la TC u otros estudios de diagnóstico por imagen (Tan 2012) o para metástasis indeterminadas en sitios como el pulmón. Aún no se ha establecido si estos supuestos están respaldados por la evidencia actual. El informe para la guía NICE en 2015 no encontró evidencia "que sugiera que el tratamiento temprano de la enfermedad metastásica mejore la supervivencia y, por lo tanto, el aumento de la sensibilidad no se considera actualmente un tema importante" (NICE 2015d). Con el tratamiento adyuvante como una opción cada vez mayor para el melanoma, es probable que esta conclusión se revise en una futura actualización de las guías.
Vía clínica
El estadiaje del melanoma confirmado se lleva a cabo solo en ámbitos de atención secundaria y terciaria (NICE 2015a). Las recomendaciones sobre el tratamiento del melanoma después del diagnóstico, publicadas en la Guía NICE 2015 (NICE 2015a), así como en otras guías del Reino Unido (Burkill 2014; Marsden 2010; Melanoma Taskforce 2011), se resumen en la Figura 2 y se presentan a continuación; sin embargo, la práctica varía en el Reino Unido. Es importante señalar que la práctica clínica está cambiando a medida que se autorizan más tratamientos adyuvantes para el melanoma, lo que no se representa adecuadamente en las guías actuales. Sin embargo, se ha publicado una declaración de consenso que representa los cambios en los umbrales de decisión del uso de BGLC para el estadiaje del melanoma (Melanoma Focus 2018). Cualquier variación clave en la práctica recomendada en las guías europeas o estadounidenses (ESMO 2019; Swetter 2019) o bajo consideración en una actualización actual de las guías australianas (Cancer Council Australia 2019; Gyorki 2018; Millward 2018; Morton 2018; Saw 2018), también se representa a continuación.
Todos los pacientes deben ser sometidos a una estadiaje preliminar después de la escisión completa de la lesión primaria. Esto implica una historia clínica detallada para determinar si hay síntomas tales como pérdida de peso que sugiera propagación metastásica de la enfermedad, seguida de un examen clínico completo, con examen de la piel de todo el cuerpo, palpación de los ganglios linfáticos y examen abdominal y torácico completo (Figura 2). Se asigna una etapa preliminar sobre la base de los resultados de la histopatología para la(s) lesión(es) primaria(s). A los pacientes con ganglios linfáticos palpables se les asigna automáticamente el estadio clínico III o IV, y a los que no tienen ganglios linfáticos palpables se les asigna un estadio entre 0 y IIC, según el espesor del tumor (Breslow) y la presencia de ulceración (Gershenwald 2017).
Los resultados de todas las investigaciones llevadas a cabo durante el proceso de diagnóstico se discuten en una reunión del equipo multidisciplinario (Melanoma Taskforce 2011), en que se toman decisiones con respecto a los procedimientos de estadiaje adicionales. Podría tratarse de un equipo local multidisciplinario de la piel o, para los pacientes con enfermedad en estadio IIB y superior, un equipo multidisciplinario especializado en la piel (Marsden 2010). Los equipos deben incluir dermatólogos, cirujanos (incluidos cirujanos plásticos), oncólogos médicos y clínicos, radiólogos, histopatólogos, especialistas en enfermería especializada en cáncer de piel, fisioterapeutas, psicólogos, profesionales de servicios de linfedema, terapeutas ocupacionales y asesores de camuflaje estético (Melanoma Taskforce 2011).
Según la guía actual del Reino Unido (basada en la versión 7 de AJCC [Balch 2009]), no se recomiendan más investigaciones de estadiaje aparte de un examen clínico completo para los pacientes con melanomas delgados (≤ 1 mm) sin ulceración ni mitosis, y la BGLC está reservada para los pacientes con la enfermedad en estadio IB o estadio II (NICE 2015a). La práctica actual se basa ahora en el estadiaje según la versión 8 de la AJCC, por ejemplo, con melanomas "delgados" definidos como < 0,8 mm de espesor sin evidencia de ulceración (Gershenwald 2017). Además, con el advenimiento de nuevos tratamientos adyuvantes, la BGLC se considera esencial para determinar la elegibilidad para el tratamiento adyuvante sistémico (Gyorki 2018; Melanoma Focus 2018; Swetter 2019), y los estudios de diagnóstico por imagen se usan en pacientes con ganglios centinela positivos para confirmar la ausencia de propagación adicional de la enfermedad (ESMO 2019; Swetter 2019). La BGLC se recomienda para los pacientes con melanoma primario mayor que 1,0 mm y debe considerarse para algunos pacientes con melanomas más delgados (es decir, melanomas < 0,8 mm con ulceración y melanomas de 0,8 a 1,0 mm con o sin ulceración), especialmente en presencia de invasión linfovascular o una tasa mitótica de al menos 2 por mm² (Melanoma Focus 2018). Los pacientes con ganglios linfáticos clínicamente palpables o con enfermedad ganglionar significativa detectada en las imágenes son candidatos a ser sometidos a la LNDC, con la opción de tratamiento adyuvante para los que no presentan evidencia de metástasis a distancia.
Las recomendaciones disponibles sobre la elección óptima de los estudios de diagnóstico por imagen varían hasta cierto punto, incluso dentro del Reino Unido (Burkill 2014; Melanoma Focus 2014; NICE 2015a). La tomografía computadorizada generalmente es el estudio de diagnóstico por imagen de elección; sin embargo, algunos centros ofrecen además ecografías de alta resolución, resonancias magnéticas o tomografías por emisión de positrones (TEP‐TC). El National Institute for Health and Care Excellence recomienda el estadiaje de la TC para identificar a pacientes que pueden beneficiarse con la terapia sistémica en los que presentan enfermedad en estadio CII, estadio III o sospecha de enfermedad en estadio IV (NICE 2015a), así como la obtención de imágenes del cerebro (con TC para adultos y RM para niños y adultos jóvenes) solo si se sospecha de enfermedad metastásica fuera del sistema nervioso central (NICE 2015a). Sin embargo, el documento de posición de Melanoma Focus recomienda que todos los pacientes de “alto riesgo" se sometan a una tomografía computadorizada de tórax, abdomen y pelvis (o TEP‐TC de cuerpo entero), más una resonancia magnética de cráneo, como tratamiento estándar (Melanoma Focus 2014). En la práctica clínica actual, es probable que la elegibilidad para los estudios de diagnóstico por imagen difiera de estos dos grupos objetivo; sin embargo, es poco probable que el surgimiento de nuevas opciones de tratamiento afecte la elección de los estudios de diagnóstico por imagen realizados ni los sitios del cuerpo a los que se les tomaron imágenes.
Las guías europeas recomiendan la ecografía pre‐BGLC basal de ganglios linfáticos (GL) para la enfermedad en estadio IB a IIA, y la TC o la TEP para el estadio IIB y en adelante (ESMO 2019). Las guías australianas en Morton 2018 y las estadounidenses en Swetter 2019 recomiendan no tomar imágenes de referencia para todos los pacientes asintomáticos y con ganglios negativos. En los Estados Unidos, la TC o la TEP‐TC pueden considerarse para la enfermedad del ganglio linfático centinela (GLC), pero por lo demás deben reservarse para la investigación de signos o síntomas específicos o metástasis ganglionares o a distancia (Swetter 2019). En Australia, se recomienda la ecografía y la CAAF para identificar el grado de participación regional de GL en el melanoma con ganglios clínicos positivos (Saw 2018), así como la TEP‐TC de cuerpo entero con TC o RM del cerebro para la enfermedad en estadio clínico III o IV (Saw 2018; Millward 2018).
La guía del Royal College of Radiologists recomienda que las imágenes se ajusten según el sitio de la lesión primaria y el lecho ganglionar regional más probable. En general, la tomografía computadorizada de la cabeza, el tórax, el abdomen y la pelvis debe emplearse para las lesiones de las extremidades inferiores y de la pared inferior del cuerpo, y la tomografía computadorizada del cuello para los tumores primarios de las extremidades superiores, el cuero cabelludo, el cuello y la parte superior del torso (Burkill 2014). La resonancia magnética puede ser más apropiada para obtener imágenes del sistema nervioso central (Burkill 2014). Aunque se ha sugerido que la TEP‐TC tiene una función en la obtención de imágenes de las extremidades inferiores, se requiere evidencia adicional (Burkill 2014).
También se ofrece ahora genotipado para identificar las mutaciones del BRAF y así permitir una mayor planificación del tratamiento sistémico (Melanoma Taskforce 2011; NICE 2018a; NICE 2019b).
Prueba/s previa/s
La consideración de los estudios de diagnóstico por imagen anteriores a los que se han sometido los participantes del estudio es clave para la interpretación de los índices de precisión de los exámenes resultantes, que se sabe que varían según el espectro o la combinación de casos de los participantes incluidos (Lachs 1992; Leeflang 2013; Moons 1997; Usher‐Smith 2016). Los estudios anteriores se pueden considerar de dos maneras. En primer lugar, los resultados de cualquier estudio realizado alrededor del momento de la aplicación de la prueba índice pueden contribuir a la decisión de realizar el prueba índice en cualquier participante del estudio en particular. Por ejemplo, la TEP‐TC puede realizarse debido a la presencia de características primarias de melanoma de alto riesgo o debido a hallazgos anormales en la ecografía abdominal o en la radiografía de tórax; la probabilidad de hallazgos anormales en la TEP‐TC y, por lo tanto, la sensibilidad o especificidad, pueden estar influidas por los resultados de cualquier prueba realizado previamente.
En segundo lugar, los exámenes anteriores pueden considerarse en términos del lugar en la vía clínica o del tiempo de evolución de la enfermedad que han alcanzado los pacientes. Es menos probable que los pacientes sometidos a estudios de diagnóstico por imagen para el estadiaje después del diagnóstico primario de melanoma presenten diseminación metastásica de la enfermedad en comparación con los pacientes en quienes los estudios de diagnóstico por imagen son indicados por la presencia de signos de recidiva. Es probable que la naturaleza de cualquier diseminación de la enfermedad varíe entre la población con estadiaje primario y los pacientes sometidos a seguimiento, que pueden haber sido sometidos a un tratamiento previo, como la linfadenectomía completa. Reinhardt 2006 evaluó la precisión de la TC, la TEP y la TEP‐TC en 250 participantes con melanoma "en diferentes momentos del curso de la enfermedad", incluido el estadiaje primario después de la biopsia del ganglio centinela (n = 75); el control del tratamiento después de la quimioterapia para la enfermedad metastásica (n = 42); el estadiaje de la enfermedad recurrente clínicamente sospechada (n = 65); y la evaluación durante el seguimiento dentro de los cinco años del tratamiento primario (n = 68). Tanto para el estadiaje ganglionar como para el estadiaje a distancia, la sensibilidad y la especificidad general de cada estudio ocultaron las posibles variaciones en la precisión entre subgrupos. Por ejemplo, la sensibilidad y la especificidad general de la TC para la detección de metástasis ganglionares fueron de 85% y 87%, pero cuando se estimó para cada subgrupo de participantes, la sensibilidad de la TC varió de 67% para los que se sometieron a seguimiento a 93% para los que se sometieron a imágenes para la evaluación del tratamiento, y la especificidad varió de 73% para los que se sometieron al grupo de evaluación del tratamiento a 93% para los que se sometieron a estadiaje primario (Reinhardt 2006). El análisis agrupado general sugirió diferencias estadísticamente significativas en la sensibilidad (TC 73% versus TEP‐TC 99%; P < 0,0001) y en la especificidad (TC 88% versus TEP‐TC 98%; P < 0,0001) para la detección de metástasis a distancia, pero para el subgrupo de estadiaje primario, no se observó ninguna diferencia en la sensibilidad (93,8% para ambos exámenes) y la diferencia en la especificidad no fue significativa (TC 94,9% versus TEP‐TC 98,3%) (Reinhardt 2006). Para el subgrupo de reestadiaje, se observaron diferencias tanto en la sensibilidad (TC 85% versus TEP‐TCP 100%) como en la especificidad (TC 79% versus TEP‐TC 96%) entre los exámenes (Reinhardt 2006). Aunque el número de subgrupos fue relativamente pequeño, estos hallazgos apoyan la hipótesis de que la vía clínica afecta la precisión del estudio en este contexto, aunque, como en otros exámenes y enfermedades, los mecanismos de acción pueden ser complejos y difíciles de identificar (Leeflang 2013).
Función de la/s prueba/s índice
La ecografía con CAAF como prueba de triaje antes de la BGLC fue promovida originalmente para el paso al tratamiento rápido de los pacientes con resultados positivos en citología (micrometástasis identificadas) a LNDC, mientras que los pacientes con citología negativa pueden derivarse para la BGLC, según sea necesario (Voit 2014). Con el cambio en la vía clínica y la falta de evidencia para el beneficio de supervivencia de la LNDC (Leiter 2018; Morton 2014), se considera que el único papel potencial para la ecografía y la CAAF en el Reino Unido se observa en los centros en que la BGLC no está disponible de inmediato (con un resultado positivo de la citología que indica que debe iniciarse el tratamiento adyuvante); sin embargo, se sigue recomendando el uso de este enfoque después del diagnóstico primario de melanoma en Europa (ESMO 2019), así como para el melanoma con ganglios positivos clínicamente en Australia (Saw 2018).
No se ha recomendado ninguna función para los estudios de diagnóstico por imagen en las etapas iniciales de la enfermedad. La necesidad de descartar metástasis a distancia en los pacientes que de otra manera son elegibles para el tratamiento adyuvante sugiere que los estudios de diagnóstico por imagen podrían ser utilizados en un grupo de pacientes mucho más ampliamente definido que antes. Hasta el momento de redactar esta revisión, la TC se recomienda como el estudio de diagnóstico por imagen de elección para la detección de la diseminación a distancia y ganglionar de los pacientes con estadio III o IV (y para los que presentan estadio IIC si no han sido sometidos a BGLC) (NICE 2015a). Aunque la tomografía por emisión de positrones ‐ tomografía computadorizada se utiliza cada vez más, la práctica varía en todo el país, sobre todo según la disponibilidad. Aún se desconocen las ventajas del tratamiento de la enfermedad derivadas de la TEP‐TC. Sigue siendo incierta la función más apropiada para la RM en el estadiaje del melanoma en adultos, aparte de la enfermedad del sistema nervioso central.
Prueba/s alternativa/s
Se pueden utilizar varios otros exámenes para informar el tratamiento de la enfermedad después de un diagnóstico de melanoma.
La biopsia del ganglio linfático centinela, que permite detectar la diseminación metastásica a los lechos de ganglios linfáticos regionales, es el tema de otra revisión en esta serie de revisiones (Ferrante di Ruffano 2019).
La biopsia con aguja gruesa de los ganglios linfáticos, como en Whaley 2016a, o CAAF, como en Hall 2013, para confirmar la presencia de macrometástasis puede ser guiada por simple palpación o, para lesiones más profundas, por medio de una guía basada en imágenes para identificar las micrometástasis (que requiere el uso de un microscopio para su visualización) (Bohelay 2015). Aunque la precisión de la biopsia con aguja gruesa comparada con la aspiración con aguja fina se ha identificado como una cuestión clínica clave para la investigación, este tema está fuera del alcance de estas revisiones, que se centran principalmente en la detección de la enfermedad metastásica no palpable.
Las pruebas genéticas de muestras primarias de melanoma, por ejemplo para mutaciones BRAF, se utilizan cada vez más (NICE 2015a), particularmente con la aparición de tratamientos sistémicos para el melanoma positivo a la mutación BRAF V600 (Chapman 2011; Chapman 2012; Larkin 2014; Larkin 2015). Sin embargo, el propósito es informar las decisiones de tratamiento sistémico más que servir como parte integral del procedimiento de estadiaje en sí mismo. Los biomarcadores, como el S100, se utilizan en países como Alemania como marcador de pronóstico (Gray 2014), o de recidiva temprana de la enfermedad (Peric 2011), en lugar de para fines de estadiaje per se (Egberts 2010; Pirpiris 2010), y la lactatodeshidrogenasa (LDH) forma parte del estadiaje de la AJCC para la etapa IV (Pirpiris 2010); sin embargo, estos enfoques están fuera del alcance de nuestras revisiones.
Fundamento
El estadiaje apropiado del melanoma es fundamental para asegurar que a los pacientes se los someta al tratamiento más adecuado y efectivo. Se dispone de varios exámenes para ayudar en el estadiaje del melanoma; sin embargo, es incierta la precisión comparativa para la detección de metástasis ganglionares o a distancia, o ambas, de acuerdo con el estadio histológico de la presentación.
Las recomendaciones de la guía NICE para el estadiaje (ver Vía clínica) se basaron en revisiones sistemáticas disponibles tanto de la BGLC como de los estudios de diagnóstico por imagen (Hall 2013; Jiménez‐Requena 2010; Krug 2008; Rodríguez 2014; Valsecchi 2011; Xing 2011), con algunos datos suplementarios derivados de estudios primarios (NICE 2015d). La mayoría de las revisiones están limitadas en cuanto a vigencia (de Rosa 2011; Jiménez‐Requena 2010; Krug 2008; Valsecchi 2011; Warycha 2009; Xing 2011), y en la mayoría de los casos las búsquedas bibliográficas se extienden hasta 2009 (Jiménez‐Requena 2010; Krug 2008; Valsecchi 2011; Xing 2011). Además, la única revisión que comparó la precisión entre los estudios de diagnóstico por imagen no consideró el estadio histológico (Xing 2011). Dos revisiones presentan una evaluación más reciente de TEP y TEP‐TC (fechas de búsqueda hasta 2012 y 2011, respectivamente) (Rodríguez 2014; Schroer‐Gunther 2012); sin embargo, la revisión de Schroer‐Gunther 2012 también se basó en revisiones publicadas con anterioridad (Jiménez‐Requena 2010; Krug 2008), con búsqueda complementaria de estudios publicados más recientemente, y la revisión de Rodríguez 2014 incluyó solo melanoma en estadio III. La revisión de Schroer‐Gunther 2012 se basó en la evaluación de calidad que se realizó para las revisiones sistemáticas originales, y solo se incluyó un pequeño número de estudios; los propios autores de la revisión recomiendan que las revisiones futuras incluyan un grupo más amplio de diseños de estudio (Schroer‐Gunther 2012).
Por lo tanto, aún queda por determinar la exactitud comparativa de los estudios de diagnóstico por imagen según el estadio de la enfermedad. Además, falta identificar cualquier evidencia a favor o en contra del uso sistemático de los estudios de diagnóstico por imagen cerebrales para el melanoma en estadio III con TC o RM. La tomografía por emisión de positrones‐tomografía computadorizada se utiliza cada vez más, pero cualquier función adicional de esta prueba comparado con la TC o la RM necesita ser examinada según grupos particulares de pacientes.
Esta revisión sigue un protocolo Cochrane DTA genérico para el estadiaje del melanoma (Dinnes 2017). Por lo tanto, los apartados de «Antecedentes» y «Métodos» de esta revisión incluyen algún texto que se publicó originalmente en el protocolo (Dinnes 2017), junto con un texto que se superpone a algunas de las otras revisiones para el diagnóstico o el estadiaje del melanoma (p.ej. Dinnes 2018; Ferrante di Ruffano 2019).
Objetivos
Objetivos primarios
Se calculó la exactitud por separado de acuerdo con el punto de la vía clínica en que se utilizaron los estudios de diagnóstico por imagen. Los objetivos de la revisión fueron:
-
determinar la precisión diagnóstica de la ecografía o de la TEP‐TC para la detección de metástasis ganglionares antes de la biopsia del ganglio linfático centinela en adultos con melanoma invasivo cutáneo confirmado; y
-
determinar la exactitud diagnóstica de la ecografía, la TC, la RM o la TEP‐TC para las imágenes de cuerpo entero en pacientes adultos con melanoma cutáneo invasivo:
-
para la detección de cualquier metástasis en adultos con un diagnóstico primario de melanoma (es decir, estadiaje primario en la presentación); y
-
para la detección de cualquier metástasis en adultos sometidos al estadiaje de la recidiva del melanoma (es decir, el reestadiaje impulsado por los hallazgos sobre el seguimiento de rutina).
-
Se realizaron análisis separados en función de si los datos de precisión se informaron por paciente o por lesión.
Objetivos secundarios
Se intentó determinar la exactitud diagnóstica de la ecografía, la TC, la RM o la TEP‐TC para la obtención de imágenes de cuerpo entero (detección de cualquier metástasis) en poblaciones mixtas o no claramente descritas de adultos con melanoma cutáneo invasivo.
Para los participantes del estudio sometidos a estadiaje primario o reestadiaje (para una posible recidiva), y para las poblaciones mixtas o poco claras, los objetivos fueron:
-
determinar la exactitud diagnóstica de la ecografía, la TC, la RM o la TEP‐TCE para la detección de metástasis ganglionares;
-
determinar la exactitud diagnóstica de la ecografía, la TC, la RM o la TEP‐TCE para la detección de metástasis ganglionares;
-
determinar la exactitud diagnóstica de la ecografía, la TC, la RM o la TEP‐TC para la detección de metástasis a distancia según el sitio metastásico.
Investigación de fuentes de heterogeneidad
Se intentó considerar una variedad de fuentes potenciales de heterogeneidad para la investigación, como se describe en el protocolo genérico y se describe en el Apéndice 4, pero no se identificaron datos suficientes para permitir que se realizaran investigaciones de heterogeneidad.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron estudios de exactitud de los exámenes que permiten una comparación de los resultados con prueba índice versus un estándar de referencia, como:
-
estudios prospectivos y retrospectivos;
-
estudios en que todos los participantes reciben una única prueba índice y un estándar de referencia;
-
estudios en que todos los participantes son sometidos a una única prueba índice y un estándar de referencia;
-
estudios en que los participantes son asignados (por cualquier método) para ser sometidos a diferentes exámenes índice o combinaciones de exámenes índice y todos son sometidos a un estándar de referencia (estudios comparativos entre individuos);
-
estudios que incorporan una serie de participantes no seleccionados por su verdadero estado de enfermedad; y
-
estudios de diagnóstico de casos y controles que incorporan por separado a grupos enfermos y no enfermos (Rutjes 2005).
Se excluyeron los estudios de seguimiento y vigilancia que utilizaron estudios de diagnóstico por imagen repetidos para detectar la recidiva de la enfermedad, ya que definir el programa de seguimiento más apropiado para los pacientes con melanoma no es el objetivo primario de estas revisiones.
Se excluyeron los estudios si no era posible derivar el número de positivos verdaderos, positivos falsos, negativos falsos y negativos verdaderos a partir de los datos del documento, y se excluyeron los estudios pequeños con menos de cinco participantes con enfermedad positiva o menos de cinco participantes con enfermedad negativa o lesiones identificadas en las imágenes. Aunque el umbral de tamaño de cinco es arbitrario, es probable que estos estudios pequeños produzcan cálculos poco fiables de sensibilidad o especificidad, y es poco probable que añadan precisión a los cálculos de precisión.
Se incluyeron estudios que informaron sobre análisis basados en lesiones o en participantes; sin embargo, se concedió más importancia a los que informaron datos por participante, ya que la detección de múltiples sitios metastásicos en un paciente individual puede tener un efecto desproporcionado sobre los cálculos de la exactitud de la prueba basados en los datos por lesión. Además, el tratamiento posterior al estadiaje generalmente está dirigido al paciente más que a la lesión metastásica individual, lo que hace que el paciente sea la unidad de análisis más adecuada.
Se excluyeron los estudios disponibles solo como resúmenes de congresos.
Participantes
Se incluyeron estudios en adultos con melanoma cutáneo en cualquier sitio primario sometidos a estadiaje, ya sea después de la presentación primaria o de la recidiva de la enfermedad. Se incluyeron estudios de completitud con poblaciones mixtas de pacientes, o en que no se pudo determinar la vía clínica, pero no se realizó un agrupamiento estadístico. Se incluyeron estudios si hasta un 10% de los participantes presentaban otras formas de melanoma como el melanoma ocular o mucoso. Se incluyeron estudios con una proporción mayor de participantes con melanoma no cutáneo y estudios con participantes con otras formas de cáncer solo si se podían diferenciar los resultados de los exámenes para los participantes con melanoma cutáneo.
Pruebas índice
Los estudios que informaron de datos de precisión para una sola aplicación de una o más de los siguientes estudios fueron elegibles para su inclusión.
-
Ecografía (con o sin CAAF posterior o biopsia central).
-
RM (sin contraste o con contraste).
-
TEP‐TC (solo en ¹⁸FDG).
-
RM (sin contraste o con contraste).
Se incluyó cualquier umbral para decidir la positividad de la prueba, ya sea cualitativa o cuantitativa.
Se excluyeron los estudios que informaron sobre aplicaciones múltiples de la misma prueba en más del 10% de los participantes del estudio debido a los efectos previstos sobre la precisión del estudio (las pruebas múltiples aumentan la probabilidad de detección de metástasis, lo que aumenta la sensibilidad de la prueba y reduce la especificidad). El umbral del 10% es arbitrario, pero permite la inclusión de estudios centrados principalmente en la evaluación de la precisión de un solo estudio para el estadiaje de la enfermedad. Se excluyeron los estudios de diagnóstico por imagen de vigilancia después del tratamiento definitivo inicial.
Enfermedades de interés
Las condiciones objetivo primarias se definieron como detección de:
-
metástasis ganglionares en participantes programados para la BGLC (para identificar a los que deben ser sometidos directamente a la LNDC); y
-
cualquier metástasis para todos los otros estadios.
Dos definiciones adicionales de la condición objetivo fueron consideradas en los análisis secundarios, es decir la detección de:
-
metástasis ganglionares; y
-
cualquier metástasis a distancia (combinada o por sitio metastásico).
Estándares de referencia
Los estándares de referencia aceptables incluyen:
-
histología de los ganglios linfáticos o muestras a distancia, con muestras obtenidas por biopsia de núcleo, BGLC o disección de ganglios linfáticos;
-
citología de muestras de ganglios linfáticos, con muestras obtenidas mediante biopsia de núcleo o aspiración con aguja fina;
-
seguimiento clínico o radiológico para identificar una recidiva ganglionar o a distancia de al menos tres meses; y
-
cualquier combinación de las anteriores.
Se excluyeron los estudios que utilizaron estándares de referencia transversales basados en imágenes (es decir, comparación directa de la prueba índice versus un estudio de diagnóstico por imagen estándar de referencia alternativo).
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
The Information Specialist (SB) carried out a comprehensive search for published and unpublished studies. A single large literature search was conducted to cover all topics in the programme grant (see Appendix 1 for a summary of reviews included in the programme grant). This allowed screening of search results for potentially relevant papers for all reviews at the same time. A search combining disease‐related terms with terms related to test names, using both text words and subject headings, was formulated. The search strategy was designed to capture studies evaluating tests for the diagnosis or staging of skin cancer. As a majority of records were related to searches for tests for staging of disease, a filter using terms related to cancer staging and to accuracy indices was applied to the staging test search to try to eliminate irrelevant studies, for example, those using imaging tests to assess treatment effectiveness. A sample of 300 records that would be missed by applying this filter was screened and the filter adjusted to include potentially relevant studies. When piloted on MEDLINE, inclusion of the filter for staging tests reduced the overall numbers by around 6000. The final search strategy, incorporating the filter, was subsequently applied to all bibliographic databases as listed below (Appendix 5). The final search result was cross‐checked against the list of studies included in five systematic reviews; our search identified all but one of these studies, and this study was not indexed on MEDLINE. The Information Specialist devised the search strategy, with input from the Information Specialist from Cochrane Skin. No additional limits were used.
We searched the following bibliographic databases to 29 August 2016 for relevant published studies.
-
MEDLINE via OVID (from 1946).
-
MEDLINE In‐Process & Other Non‐Indexed Citations via OVID.
-
Embase via OVID (from 1980).
We searched the following bibliographic databases to 30 August 2016 for relevant published studies.
-
Cochrane Central Register of Controlled Trials (CENTRAL; 2016, Issue 7), in the Cochrane Library.
-
Cochrane Database of Systematic Reviews (CDSR; 2016, Issue 8), in the Cochrane Library.
-
Cochrane Database of Abstracts of Reviews of Effects (DARE; 2015, Issue 2).
-
CRD HTA (Health Technology Assessment) database (2016, Issue 3).
-
Cumulative Index to Nursing and Allied Health Literature (CINAHL) via EBSCO from 1960.
We searched the following databases for relevant unpublished studies using a strategy based on the MEDLINE search.
-
Conference Proceedings Citation Index (CPCI), via Web of Science™ (from 1990; searched 28 August 2016).
-
Science Citation Index (SCI) Expanded™ via Web of Science™ (from 1900, using the 'Proceedings and Meetings Abstracts' Limit function; searched 29 August 2016).
We searched the following trials registers using the search terms 'melanoma', 'squamous cell', 'basal cell', and 'skin cancer' combined with 'diagnosis'.
-
Zetoc (from 1993; searched 28 August 2016).
-
US National Institutes of Health Ongoing Trials Register (www.clinicaltrials.gov; searched 29 August 2016).
-
NIHR Clinical Research Network Portfolio Database (www.nihr.ac.uk/research‐and‐impact/nihr‐clinical‐research‐network‐portfolio/; searched 29 August 2016).
-
World Health Organization International Clinical Trials Registry Platform (apps.who.int/trialsearch/; searched 29 August 2016).
We aimed to identify all relevant studies regardless of language or publication status (published, unpublished, in press, or in progress), but because of time constraints, we were unable to follow up on potentially relevant studies identified from conference abstracts. We applied no date limits.
Búsqueda de otros recursos
We screened relevant systematic reviews identified by the searches for their included primary studies, and we included any missed by our searches. We checked the reference lists of all included papers, and subject experts within the author team reviewed the final list of included studies. We conducted no electronic citation searching.
Obtención y análisis de los datos
Selección de los estudios
At least one review author (JDi or NC) screened titles and abstracts and discussed and resolved any queries by consensus. A pilot screen of 539 MEDLINE references showed good agreement (89% with a kappa of 0.77) between screeners. Primary test accuracy studies and test accuracy reviews (for scanning of reference lists) of any test used to investigate suspected melanoma, basal cell carcinoma (BCC), or cutaneous squamous cell carcinoma (cSCC) were included at initial screening. Inclusion criteria were applied independently by both a clinical review author (from one of a team of 12 clinician reviewers) and a methodologist review author (JDi, NC, or LFR) to all full‐text articles, and disagreements were resolved by consensus or by a third party (JDe, CD, HW, RM) (Appendix 6). No study authors were contacted in regard to study eligibility because of the volume of data retrieved. Authors of eligible studies were contacted when insufficient data were presented to allow for construction of 2×2 contingency tables.
The study selection process is described in a PRISMA‐DTA flowchart (McInnes 2018).
Extracción y manejo de los datos
One clinical (SAC, AD, AG, LP) and at least one methodologist review author (LFR, JDi) extracted data concerning details of study design, participants, index test(s) or test combinations, criteria for index test positivity, reference standards, and data required to populate a 2×2 diagnostic contingency table for each index test using a piloted data extraction form. Disagreements were resolved through discussion or by a third party (JDe, CD, HW, RM).
Dealing with multiple publications and companion papers
In the event of multiple reports of a primary study, the most complete and up‐to‐date data source available was used to contribute 2×2 contingency table data to eliminate double‐counting of datasets. When possible, yield of information regarding study methods and participants was maximised by extracting relevant data from multiple publications.
Evaluación de la calidad metodológica
We assessed risk of bias and applicability of included studies using the Quality Assessment of Diagnostic Accuracy Studies 2 (QUADAS‐2) checklist (Whiting 2011), which had been tailored to the review topic (Appendix 7). We piloted the modified QUADAS‐2 tool on a small number of included full‐text articles. One clinical (as detailed above) and at least one methodologist review author (LFR, JDi, BH, or SB) independently assessed quality for the remaining studies; any disagreement was resolved by consensus or by a third party when necessary (JDe, CD, HW, RM).
Análisis estadístico y síntesis de los datos
We conducted separate analyses first according to whether study participants were recruited on primary presentation of melanoma or with a disease recurrence, and second according to our primary and secondary objectives (i.e. detection of any metastasis (which must include both nodal and distant recurrence) and detection of nodal metastasis alone or detection of any distant metastasis, as defined under Target condition being diagnosed).
Studies may report test accuracy per lesion or per patient. Our unit of analysis for primary analyses was the patient, as study participants may have multiple metastatic sites at any one time, such that a per lesion analysis may overestimate test accuracy.
We initially explored the data by plotting estimates of sensitivity and specificity on coupled forest plots and in receiver operating characteristic (ROC) space for each index test. We performed meta‐analyses using the bivariate method to produce summary operating points (summary sensitivities and specificities) with 95% confidence and prediction regions (Chu 2006; Macaskill 2010; Reitsma 2005). When few studies were available for a meta‐analysis, we simplified the bivariate model to univariate fixed‐effect or random‐effects logistical regression models depending on whether or not heterogeneity was observed on forest plots and in ROC space (Takwoingi 2015). If there were only two or three studies and we observed heterogeneity on the plots, we did not pool the data, as a fixed‐effect approach would be inappropriate and the number of studies too small to reliably estimate random effects.
To compare the accuracy of the index tests, we performed both direct and indirect test comparisons, as comparative studies are scarce (Takwoingi 2013). To formally compare index tests, we added a co‐variate for test type to a bivariate model (i.e. bivariate meta‐regression). We used likelihood ratio tests to assess the statistical significance of differences in sensitivity and specificity by comparing models without the co‐variate terms versus models containing the co‐variate terms. Using parameter estimates from bivariate meta‐regression models, we calculated absolute differences in sensitivity and specificity. We obtained 95% confidence intervals and P values for these differences using the delta method and the Wald test, respectively. When the number of studies in a direct comparison was insufficient for meta‐regression, we examined individual study results and computed absolute differences in sensitivity and specificity for each comparative study. We calculated 95% confidence intervals (CIs) for these differences using the Newcombe‐Wilson method without continuity correction (Newcombe 1998).
We conducted analyses using Review Manager 5 (Review Manager 2014), along with the meqrlogit command in the statistical software STATA version 15 (STATA 2017).
Investigación de la heterogeneidad
We initially examined heterogeneity between studies by visually inspecting forest plots of sensitivity and specificity and summary ROC plots. We identified insufficient numbers of studies to allow meta‐regression to formally investigate potential sources of heterogeneity.
Análisis de sensibilidad
We performed no sensitivity analyses because limited data were available.
Evaluación del sesgo de notificación
Because of uncertainty about the determinants of publication bias for diagnostic accuracy studies and the inadequacy of tests for detecting funnel plot asymmetry (Deeks 2005), we did not assess publication bias.
Results
Results of the search
We identified and screened for inclusion a total of 34,507 unique references. Of these, we reviewed 1035 full‐text papers for eligibility for any one of the reviews of tests for staging of melanoma or cSCC. Of the 1035 full‐text papers assessed, we excluded 829 from all reviews in our series (see Figure 3 PRISMA flow diagram of search and eligibility results).

PRISMA flow diagram.
Of the 390 studies tagged as potentially eligible for this review of imaging tests for staging of melanoma, we included 39 publications. Exclusions were due to publication as a conference abstract (n = 202), not a primary study (n = 103), not a test accuracy study (no index test and or reference standard reported) (n = 11), wrong index test (n = 125; including 17 studies with more than one scan reported per participant), inadequate reference standard (n = 90), wrong study population (n = 47), inadequate sample size (n = 55), wrong target condition (n = 125), missing data to complete 2×2 contingency table (n = 46), and duplicate or related publication (n = 86). We have provided a list of the 351 publications excluded from this review with reasons for exclusion in Characteristics of excluded studies. We contacted the authors of four included studies for further details of study methods (Chai 2012; Reinhardt 2006; Stoffels 2012; Voit 2014). We received a response in regard to one study (Reinhardt 2006), but study authors did not provide the additional data requested.
The 39 included study publications provide 195 contingency table datasets for a total of 5204 study participants. Thirty‐four studies reported data on a per patient basis, including two that also reported data per lesion identified on imaging (Cachin 2014; Iagaru 2007), and five reported data only on a per lesion basis (Dellestable 2011; Hausmann 2011; Jouvet 2014; Pfannenberg 2007; Pfluger 2011). The 34 studies that reported data per patient included 4980 study participants, 1265 of whom had confirmed metastatic disease. The seven studies that reported data per lesion included 417 study participants with 1846 potentially metastatic lesions identified on imaging, 1061 of which were confirmed metastases.
Table 1 cross‐tabulates the index tests evaluated and the population groups and target conditions considered in the 39 included studies. Eighteen studies considered the use of imaging for nodal metastases before SLNB; 11 of these studies considered the use of ultrasound, and eight evaluated PET‐CT. Twenty‐four studies evaluated the use of imaging as a staging tool in study participants undergoing primary staging on diagnosis of melanoma (n = 6) or re‐staging for recurrence of disease (n = 3), or inclusion of mixed (n = 11) or not clearly described populations (n = 4). The imaging tests evaluated included ultrasound (n = 5), CT (n = 10), MRI (n = 4), and PET‐CT (n = 15) for detection of any metastases (n = 14), nodal metastases (n = 14), or distant metastases (n = 9). Five studies also reported data separately by metastatic site.
| Study | US | US‐ FNAC | CT | MRI | PET‐CT | Population group | Population detail | Reference standard | Any metastases | Distant metastases | Nodal metastases | Other sites |
| PRIMARY STAGING | ||||||||||||
| ‐ | ‐ | ‐ | ‐ | X | Primary (any); primary (pre‐SLNB) | BT > 4 mm | SLNB/CLND/FU | Per patient | Per patient | Per patient/ Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB/CLND ± FU | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | (X) | Primary (pre‐SLNB); primary | Standard SLNB | SLNB/CLND | ‐ | ‐ | Per patient/ | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | High risk (BT ≥ 2.0 mm or other RF) | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | X | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB/CLND | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (any) | All staging (incl N+) | Histology/FU | per patient | ‐ | ‐ | ‐ | |
| X | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |||||
| ‐ | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (any); primary (pre‐SLNB) | BT > 4 mm | SLNB/CLND ± FU | Per patient | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (any) | All staging (incl N+) | CLND/FU | ‐ | ‐ | Per patient | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB; any (incl N+) | SLNB ± FU | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | HN MM | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB | Pre‐SLNB | ||||
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | Standard SLNB/BT > 4 mm | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | X | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB/CLND | ‐ | ‐ | pre‐SLNB | ‐ | |
| ‐ | ‐ | X | ‐ | X | Primary (any) | All staging (incl N+) | Histology/FU | ‐ | Per patient | Per patient | ‐ | |
| X | X | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB/CLND | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | High risk (BT ≥ 4 mm or > 1 mm and ulcerated) | SLNB/CLND | ‐ | ‐ | Pre‐SLNB | ‐ | |
| RE‐STAGING | ||||||||||||
| ‐ | ‐ | X | ‐ | X | Re‐staging | Any re‐staging | Histology/FU | Per patient /Per lesion | ‐ | ‐ | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Re‐staging | Any FU and suspicious on B‐mode US | FNAC/Histology/FU | ‐ | ‐ | Per patient | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Re‐staging | High risk (BT > 4 mm, etc.), elevated S100 | Histology/Cytology/FU | Per patient | ‐ | ‐ | ‐ | |
| MIXED OR UNCLEARLY REPORTED | ||||||||||||
| ‐ | ‐ | ‐ | ‐ | X | Mixed | Stage III | Histology/FU | Per patient | ‐ | ‐ | ‐ | |
| ‐ | ‐ | ‐ | (X ‐ Brain) | X | Mixed | S100 positive | FNAC/Histology/Imaging FU | Per patient | ‐ | ‐ | ‐ | |
| ‐ | ‐ | ‐ | (X ‐ Brain) | X | Unclear | Node positive | FNAC/Histology/FU | Per patient | ‐ | ‐ | ‐ | |
| ‐ | ‐ | X | ‐ | (X) | Mixed | All node positive | Histology/FU | ‐ | Per patient | ‐ | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Mixed | Stage III | Histology/Imaging/FU | Per patient/Per lesion | Per lesion | Per lesion | Per lesion | |
| ‐ | ‐ | X | X | X | Mixed | All staging | Histology/FU | Per lesion | Per lesion | Per lesion | Per lesion | |
| ‐ | ‐ | X | X | ‐ | Unclear | Stage III/IV | Histology/FU | Per lesion | Per lesion | Per lesion | Per lesion | |
| X | ‐ | X | X | X | Unclear | Stage IV | FNAC/FU | Per lesion | Per lesion | Per lesion | Per lesion | |
| X | ‐ | ‐ | ‐ | ‐ | Mixed | Clark IV/V in FU | Histology/FU | ‐ | ‐ | per patient | ‐ | |
| ‐ | ‐ | X | X | X | Mixed | Stage III/IV | Histology/Imaging/FU | Per lesion | Per patient | Per lesion | Per lesion | |
| ‐ | ‐ | X | ‐ | X | Mixed | All stage III | Histology/FU | Per patient | ‐ | ‐ | ‐ | |
| ‐ | ‐ | X | ‐ | X | Mixed | All staging (incl N+) | Histology/FU | Per patient | Per patient | Per patient | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Unclear | High risk (BT > 4 mm, etc.) | Histology/Cytology/FU | Per patient | ‐ | ‐ | ‐ | |
| X | ‐ | ‐ | Mixed | HN MM and N+ | Histology | ‐ | ‐ | Per patient | ‐ | |||
| ‐ | ‐ | ‐ | ‐ | X | Mixed | Stage IIIB/IIIC palpable groin mets | Histology (combined groin dissection) | ‐ | ‐ | Per patient | ‐ | |
BT: Breslow thickness; CLND: complete lymph node dissection; CT: computed tomography; FNAC: fine needle aspiration cytology; FU: follow‐up; HN: head and neck; MM: malignant melanoma; MRI: magnetic resonance imaging; mm: millimetre; N+: node positive; PET: positron emission tomography; RF: risk factor; SLNB: sentinel lymph node biopsy; US: ultrasound.
Methodological quality of included studies
The overall methodological quality of all included study cohorts is summarised in Figure 4 and Figure 5. Studies were generally at low or unclear risk of bias and of high or unclear concern regarding applicability of the evidence.
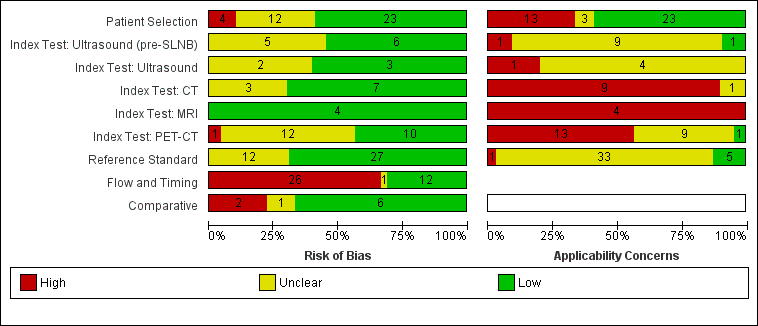
Risk of bias and applicability concerns graph: review authors' judgements about each domain presented as percentages across included studies.

Risk of bias and applicability concerns summary: review authors' judgements about each domain for each included study.
Over half of studies (23; 59%) were at low risk of bias for participant selection. High risk of bias was observed in four studies (10%) because of inappropriate participant exclusions; all excluded study participants on the basis of findings on the index test (ultrasound in all cases) (Hinz 2011; Hinz 2013; Radzhabova 2009; Rubaltelli 2011). Those at unclear risk of bias (n = 12) did not clearly describe participant recruitment as random or consecutive (n = 11) (all except Iagaru 2007) (Abbott 2011; Aukema 2010b; Cachin 2014; Hocevar 2004; Iagaru 2007; Jouvet 2014; Kang 2011; Klebl 2003; Pfluger 2011; Prayer 1990; Sanki 2009; Singh 2008), or did not clearly report participant exclusions (n = 3) (Iagaru 2007; Kang 2011; Pfluger 2011).
Over half of evaluations were considered at low risk of bias for the index test (55% (6/11) for pre‐SLNB ultrasound; 60% (3/5) for other uses of ultrasound; 70% (7/10) for CT; 100% (4/4) for MRI; and 43% (10/23) for PET‐CT). Across the 11 evaluations of pre‐SLNB ultrasound, five (45%) studies were retrospective or unclear in the nature of their design and did not describe blinded case note review to ascertain imaging test results (Hinz 2013; Hocevar 2004; Radzhabova 2009; Sanki 2009; van Rijk 2006). The same rationale for unclear risk of bias was made for two of the five (40%) other evaluations of ultrasound (Prayer 1990; Rubaltelli 2011), three evaluations of CT (30%) (Iagaru 2007; Pfluger 2011; van den Brekel 1998), and 13 (57%) evaluations of PET‐CT (Abbott 2011; Arrangoiz 2012; Aukema 2010a; Hinz 2013; Iagaru 2007; Kang 2011; Klode 2010; Pfluger 2011; Revel 2010; Singh 2008; Strobel 2007a; van Wissen 2016; Wagner 2012). One evaluation of pre‐SLNB ultrasound ‐ Radzhabova 2009 ‐ and one of PET‐CT ‐ Iagaru 2007 ‐ did not clearly prespecify the index test threshold. One study of PET‐CT ‐ Kang 2011 ‐ retrospectively selected the maximum standardised uptake value (SUVmax) threshold for PET‐CT using ROC analysis and therefore scored high risk of bias for this domain.
Most studies (27/39) were judged at low risk of bias for the reference standard; the 12 studies at unclear risk of bias provided no information on the follow‐up schedule used to determine final disease status (Arrangoiz 2012; Aukema 2010a; Aukema 2010b; Bastiaannet 2009; Cachin 2014; Dellestable 2011; Iagaru 2007; Jouvet 2014; Pfluger 2011; Rubaltelli 2011; Strobel 2007b; Veit‐Haibach 2009). Although blinding of the reference standard diagnosis did not contribute to overall risk of bias, two studies clearly reported blinding of the histological diagnosis (Pfannenberg 2007; Sibon 2007), and three reported blinding of data collection on follow‐up (Hausmann 2011; Pfannenberg 2007; Reinhardt 2006). Two studies reported no blinding of histological diagnosis (Cachin 2014; Singh 2008), and three reported no blinding to the original imaging result during follow‐up (Abbott 2011; Cachin 2014; Jouvet 2014).
Two‐thirds of studies were at high risk of bias for participant flow and timing (26/39), and one was judged as having unclear risk. High risk of bias was considered in one study because of performance of the imaging test (PET‐CT) up to four months after the reference standard (SLNB) (Maubec 2007); in 19 studies (49%) because of differential verification (Abbott 2011; Arrangoiz 2012; Aukema 2010a; Aukema 2010b; Bastiaannet 2009; Cachin 2014; Dellestable 2011; Hausmann 2011; Iagaru 2007; Jouvet 2014; Kang 2011; Klebl 2003; Pfannenberg 2007; Pfluger 2011; Prayer 1990; Reinhardt 2006; Strobel 2007a; Strobel 2007b; Veit‐Haibach 2009); and in 13 studies (33%) because of exclusion of participants from the analysis (Bastiaannet 2009; Cachin 2014; Chai 2012; Dellestable 2011; Hafner 2004; Hausmann 2011; Klebl 2003; Pfannenberg 2007; Pfluger 2011; Radzhabova 2009; Rubaltelli 2011; van Wissen 2016; Wagner 2012).
Among the nine studies providing direct comparisons of index tests, six were judged at low risk of bias for the comparative domain. Pfluger 2011 was considered at high risk of bias, as PET‐CT and CT images were interpreted side by side, and in Hinz 2013, only a subgroup of those with US also underwent PET‐CT. In two studies, blinding between tests was not clearly described (Hinz 2013; Iagaru 2007).
In terms of applicability of evidence to the review question, 40% (n = 16) of studies were of high or unclear concern due to participant selection (Figure 4). High concern was primarily due to inclusion of participants from mixed population groups (including primary staging, re‐staging, or patient follow‐up) (Abbott 2011; Aukema 2010a; Bastiaannet 2009; Cachin 2014; Dellestable 2011; Klebl 2003; Pfannenberg 2007; Pfluger 2011; Reinhardt 2006; van den Brekel 1998; van Wissen 2016), or it was due to the presentation of only per lesion rather than per patient data (Dellestable 2011; Hausmann 2011; Jouvet 2014; Pfannenberg 2007; Pfluger 2011). Three studies were of unclear concern due to lack of clear description of the indication for imaging (Aukema 2010b; Iagaru 2007; Strobel 2007b).
Almost all test evaluations were considered at high or unclear concern around applicability of the index test. For pre‐SLNB ultrasound, there was high concern from lack of detail regarding the threshold used (n = 1) (Hafner 2004), and unclear concern resulted from lack of information on application and interpretation of the index test (n = 9) (Chai 2012; Hafner 2004; Hinz 2011; Hocevar 2004; Kunte 2009; Radzhabova 2009; Sibon 2007; van Rijk 2006; Voit 2014), or regarding the expertise of the observer performing the ultrasound examination (n = 6) (Chai 2012; Hinz 2011; Kunte 2009; Radzhabova 2009; Sanki 2009; van Rijk 2006).
For CT, six evaluations were of high concern due to use of consensus test interpretation (Iagaru 2007; Jouvet 2014; Pfannenberg 2007; Pfluger 2011; Reinhardt 2006; Veit‐Haibach 2009), two for MRI (Jouvet 2014; Pfannenberg 2007), and 11 for PET‐CT (Aukema 2010a; Aukema 2010b; Iagaru 2007; Jouvet 2014; Kang 2011; Pfannenberg 2007; Pfluger 2011; Reinhardt 2006; Revel 2010; Strobel 2007a; Strobel 2007b). Only five CT evaluations described the provision of usual clinical information to test interpreters (Jouvet 2014; Pfannenberg 2007; Pfluger 2011; Reinhardt 2006; Veit‐Haibach 2009), one evaluation of MRI (Pfannenberg 2007), and four for PET‐CT (Pfannenberg 2007; Pfluger 2011; Reinhardt 2006; Revel 2010). Three CT evaluations were unclear on the information provided to assist test interpretation (Bastiaannet 2009; Dellestable 2011; van den Brekel 1998), two for MRI (Dellestable 2011; Hausmann 2011), and six for PET‐CT (Dellestable 2011; Kell 2007; Klode 2010; Maubec 2007; Singh 2008; Veit‐Haibach 2009).
Inadequate details of test threshold were provided in five evaluations of CT (Bastiaannet 2009; Dellestable 2011; Iagaru 2007; Jouvet 2014; Reinhardt 2006), three for MRI (Dellestable 2011; Hausmann 2011; Jouvet 2014), and four for PET‐CT (Abbott 2011; Hinz 2013; Jouvet 2014; Reinhardt 2006). Threshold details were unclear for one study for both CT and MRI (Pfannenberg 2007), as were six for PET‐CT (Aukema 2010a; Aukema 2010b; Dellestable 2011; Klode 2010; Maubec 2007; Wagner 2012). Two CT evaluations were unclear with regard to observer expertise (Dellestable 2011; van den Brekel 1998), one for MRI (Dellestable 2011), and seven for PET‐CT (Arrangoiz 2012; Dellestable 2011; Hinz 2013; Kell 2007; Klode 2010; Maubec 2007; Revel 2010).
For applicability of the reference standard, five studies were considered of low concern (Hafner 2004; Hinz 2011; Hinz 2013; Kang 2011; van Wissen 2016), and one was rated of high concern because it did not present data for the primary target condition of any metastasis (nodal plus distant metastases) (Veit‐Haibach 2009). The remaining 33 studies were considered at unclear concern for applicability because they did not clearly define the target condition or provide a breakdown according to nodal or distant metastases. Only five studies described the expertise of the histopathologist (Hafner 2004; Hinz 2011; Hinz 2013; Kang 2011; van Wissen 2016); the remaining studies were rated of unclear concern.
Findings
1. Imaging for detection of nodal metastases before SLNB
Imaging before SLNB can be used to identify patients with nodal metastatic disease that is not detectable clinically such that they can bypass the SLNB procedure and undergo complete lymph node dissection. Eighteen studies were included, 10 of which considered the use of pre‐SLNB ultrasound (Chai 2012; Hafner 2004; Hinz 2011; Hocevar 2004; Kunte 2009; Radzhabova 2009; Sanki 2009; Sibon 2007; van Rijk 2006; Voit 2014); seven evaluated PET‐CT (Arrangoiz 2012; Kell 2007; Klode 2010; Maubec 2007; Revel 2010; Singh 2008; Wagner 2012), and one evaluated both tests (Hinz 2013). Three studies of ultrasound also presented accuracy data for ultrasound combined with FNAC (i.e. complete lymph node dissection recommended only if both ultrasound and FNAC were positive for metastases) (Hocevar 2004; van Rijk 2006; Voit 2014).
Forest plots of study data are provided in Figure 6. Summary estimates for indirect and direct comparisons of tests are presented in Table 2 and Figure 7. Summary details of all studies in this section are presented alphabetically in Appendix 8.

Forest plot of all data for pre‐SLNB ultrasound, ultrasound plus FNAC, or PET‐CT for the detection of nodal metastasis.
(HN MM ‐ head and neck only malignant melanoma.)
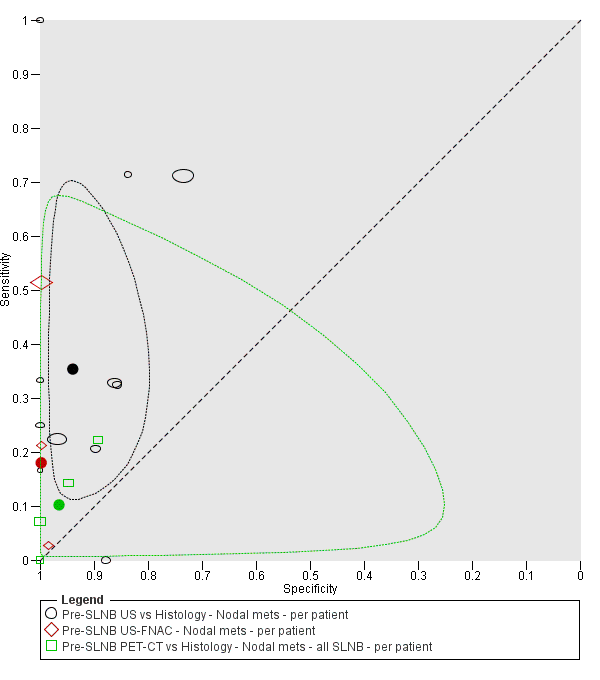
Summary ROC plot comparing pre‐SLNB ultrasound vs ultrasound plus FNAC vs PET‐CT.
| Test | Studies | Participants (cases) | Sensitivity (95% CI), % | Specificity (95% CI), % |
| Comparison of imaging tests before SLNB | ||||
| Indirect comparison of imaging tests for detection of nodal metastasis (per patient data) | ||||
| US | 11 | 2614 (542) | 35.4 (17.0 to 59.4) | 93.9 (86.1 to 97.5) |
| US‐FNAC | 3 | 1164 (259) | 18.0 (3.58 to 56.5) | 99.8 (99.1 to 99.9) |
| PET‐CT | 4 | 170 (49) | 10.2 (4.31 to 22.3) | 96.5 (87.1 to 99.1) |
| Difference | P = 0.07 | P < 0.001 | ||
| Direct comparison of imaging tests for detection of nodal metastasis (per patient data) | ||||
| US | 3 | 1164 (259) | 58.7 (36.5 to 77.9) | 79.4 (70.0 to 86.4) |
| US‐FNAC | 3 | 1164 (259) | 18.0 (3.58 to 56.5) | 99.8 (99.1 to 99.9) |
| Difference | ‐40.7 (‐75.0 to ‐6.50), P = 0.02 | +20.4 (+12.2 to +28.6), P < 0.001 | ||
| Whole body imaging | ||||
| Imaging for re‐staging for the detection of any metastasis (per patient data) | ||||
| PET‐CT | 2a | 153 (95) | 92.6 (85.3 to 96.4) | 89.7 (78.8 to 95.3) |
CI: confidence interval; CT: computed tomography; FNAC: fine needle aspiration cytology; PET: positron emission tomography; SLNB: sentinel lymph node biopsy; US: ultrasound.
aWhere there were only two studies, estimates of summary sensitivity and summary specificity were obtained by using univariate fixed‐effect logistic regression models to pool sensitivities and specificities separately.
Description of studies
Study design and setting. Four of the 18 studies (22%) were prospective case series (Hafner 2004; Hinz 2011; Kunte 2009; Maubec 2007), nine (50%) were retrospective (Arrangoiz 2012; Chai 2012; Hinz 2013; Kell 2007; Klode 2010; Revel 2010; Sibon 2007; van Rijk 2006; Wagner 2012), and five (28%) did not clearly report the design (Hocevar 2004; Radzhabova 2009; Sanki 2009; Singh 2008; Voit 2014). Studies were conducted in Europe (n = 14), Australia (n = 1; Sanki 2009), and the USA (n = 3; Arrangoiz 2012; Chai 2012; Kell 2007).
Participants. Thirteen of the 18 studies (72%) were considered to have been conducted in ‘standard’ SLNB populations, either reporting the inclusion of participants with primary melanomas with Breslow thickness of at least 0.76 mm or 1 mm unless other adverse prognostic factors were present such as Clark level of at least IV, ulceration, or regression (Chai 2012; Hafner 2004; Hinz 2011; Kell 2007; Klode 2010; Kunte 2009; Sanki 2009; Sibon 2007; Singh 2008; van Rijk 2006; Voit 2014), or reporting including ‘candidates for SLNB’ with no further detail (Hocevar 2004; Radzhabova 2009). One study restricted inclusion to participants with head and neck melanoma only (Revel 2010), and the remaining four studies included only higher‐risk participants, with Breslow thickness of at least 2 mm (Hinz 2013), or 4 mm (Arrangoiz 2012; Maubec 2007; Wagner 2012).
A total of 2894 participants were included, with 640 nodal metastases identified (prevalence 22%, ranging from 10% in Hinz 2011 to 60% in Hinz 2013). Sample sizes ranged from 20 participants in Hinz 2013 and Maubec 2007 to 1000 in Voit 2014. When reported (n = 11), the ages of included participants ranged from one year in Hocevar 2004 to 94 years in Voit 2014. The mean age of included participants was reported in 11 studies (the median of reported means was 57.5 years, range 50 to 67 years), and the median age was reported in five studies (the median of reported means was 58 years, range 55 to 62 years); five studies reported neither the mean nor median age of included study participants (Hinz 2013; Hocevar 2004; Radzhabova 2009; Sanki 2009; Wagner 2012). When reported (n = 15), 48% of included participants were male. Of 11 studies reporting the site of the primary melanoma lesion (excluding Revel 2010, which included head and neck melanomas only), the percentage of participants with head and neck melanoma ranged from 0% in Hinz 2013 to 36% in Maubec 2007 (median 14%), and melanoma of the extremities, including the hands or feet where documented, from 32% in Maubec 2007 to 56% in Kunte 2009 (median 50%).
Ultrasound. The 11 studies of pre‐SLNB ultrasound were all conducted in standard SLNB populations, although Hinz 2013 restricted inclusion to participants with melanomas at least 2 mm thick or with risk factors such as ulceration or regression. The two studies by Hinz and colleagues excluded participants with classic sonographic signs of lymphatic metastasis (Hinz 2011; Hinz 2013), whereas Radzhabova 2009 included only those who were positive on US or in whom metastases could not be excluded.
Studies employed mainly B‐mode ultrasound, with two studies also employing Doppler ultrasound in all participants (Hinz 2011; Voit 2014). B‐mode ultrasound frequencies were variable, mainly ranging from 5 or 6 MHz to 10 or 12 MHz in each study, apart from Voit 2014, which used three transducers ranging from 1 to 18 MHz in frequency. Ultrasound was performed before lymphoscintigraphy in five studies (Chai 2012; Hafner 2004; Hinz 2011; Hinz 2013; Sibon 2007), after lymphoscintigraphy in two studies (Sanki 2009; Voit 2014), and both before and after lymphoscintigraphy in four studies (Hocevar 2004; Kunte 2009; Radzhabova 2009; van Rijk 2006). Lymph node basins were imaged according to the site of the primary melanoma (Chai 2012; Hafner 2004; Hinz 2011; Hinz 2013; Sibon 2007; Voit 2014), according to the site marked following lymphoscintigraphy (Sanki 2009; Voit 2014), or this information was not reported (Hocevar 2004; Kunte 2009; Radzhabova 2009; van Rijk 2006). Criteria for detection of nodal metastases were clearly described in all studies apart from Hafner 2004 (Appendix 8). Ultrasound was reported to be performed by dermatologists (Kunte 2009), sonographers (Voit 2014), radiologists (Hafner 2004; Hocevar 2004; Sibon 2007), or nuclear medicine physicians (Sanki 2009), or this was not reported.
PET‐CT. Of the eight studies of PET‐CT before SLNB, four were conducted in any participant eligible for SLNB (Hinz 2013; Kell 2007; Klode 2010; Singh 2008); one in those with head and neck melanoma (Revel 2010); and three in higher‐risk melanoma populations (Arrangoiz 2012; Maubec 2007; Wagner 2012). Singh 2008 also reported data for the subgroup of participants with higher‐risk melanoma (Breslow thickness > 4 mm). When reported (n = 3), studies employed two‐dimensional (2D) PET (Wagner 2012), three‐dimensional (3D) PET (Maubec 2007), or either 2D or 3D PET (Arrangoiz 2012). PET was combined with unenhanced ‐ in Arrangoiz 2012,Kell 2007, and Maubec 2007 ‐ or contrast‐enhanced ‐ in Hinz 2013,Klode 2010, and Singh 2008 ‐ CT scans (use of contrast not reported in Revel 2010 and Wagner 2012). When reported, CT was used for attenuation correction (Arrangoiz 2012; Hinz 2013; Revel 2010; Singh 2008; Wagner 2012), as well as for anatomical localisation (Revel 2010; Wagner 2012).
Criteria for the detection of nodal metastases were not reported in Hinz 2013, were based on a qualitative assessment of increased 18FDG uptake in six studies (Kell 2007; Klode 2010; Maubec 2007; Revel 2010; Singh 2008; Wagner 2012), and were based on a quantitative assessment of focal uptake in Arrangoiz 2012 (SUV ≥ 2.5) (see Appendix 8). Performance and interpretation of PET‐CT were not clearly described. For example, Wagner 2012 reported interpretation by a nuclear medicine specialist, while two others mentioned an in‐house medical physicist ‐ Singh 2008 ‐ and a team of radiologists and nuclear physicians ‐ Arrangoiz 2012. Only Revel 2010 and Wagner 2012 reported the provision of clinical or other radiological findings to assist PET‐CT interpretation.
Reference standard. Ten studies (56%) evaluated the accuracy of imaging in comparison to histology from SLNB alone (Hinz 2011; Hinz 2013; Kell 2007; Klode 2010; Kunte 2009; Radzhabova 2009; Revel 2010; Sanki 2009; Sibon 2007; Singh 2008), seven studies (39%) included histology results from participants proceeding directly to CLND as well as SLNB results as a reference standard (Chai 2012; Hafner 2004; Hocevar 2004; Maubec 2007; van Rijk 2006; Voit 2014; Wagner 2012), and one study reported only data for histology based on CLND or SLNB combined with follow‐up to determine any false negative results on PET‐CT as the reference standard (Arrangoiz 2012).
Participant exclusions. Five studies reported the exclusion of between two and eight participants primarily due to technical failure of SLNB (sentinel node not identified or SLNB not performed) (Chai 2012; Hafner 2004; Maubec 2007; Revel 2010; Wagner 2012), and in one study (Radzhabova 2009), 100 participants did not undergo SLNB on the basis of a negative ultrasound finding.
Results: ultrasound for detection of nodal metastases
Across the 11 ultrasound evaluations, sensitivity for detection of nodal metastasis in comparison to a histological reference standard (SLNB or LCND) ranged from 0% in Hafner 2004 to 33% in Chai 2012 and Kunte 2009 in eight studies, and from 71% in Hocevar 2004 and Voit 2014 to 100% in Radzhabova 2009 in three. Specificity ranged from 73% in Voit 2014 to 100% in Kunte 2009,Hinz 2011,Hinz 2013, and Radzhabova 2009) (Figure 6). Radzhabova 2009 included a highly selected group of study participants, which likely explains the perfect sensitivity and specificity observed. The particularly low sensitivity in Hafner 2004 (0%) may be related to the use of only a 5‐MHz ultrasound transducer, but this study was poorly reported and other explanations may be possible. The relatively high sensitivities (both 71%) in Hocevar 2004 and Voit 2014 are also difficult to explain based on the information reported. In terms of specificity, Kunte 2009, Hinz 2011, and Hinz 2013 all applied ultrasound before and after the use of lymphoscintigraphy, which is likely to have contributed to the 100% specificity observed.
The summary sensitivity of ultrasound across the 11 studies was 35.4% (95% CI 17.0% to 59.4%) and summary specificity was 93.9% (86.1% to 97.5%) for 2614 participants and 542 confirmed cases of nodal metastasis (Table 2; Figure 7).
The three studies that reported the accuracy of ultrasound combined with FNAC reported decreased sensitivity but increased specificity in comparison to ultrasound alone. Sensitivities ranged from 3% (95% CI 0% to 14%) in van Rijk 2006 to 51% (95% CI 44% to 58%) in Voit 2014, and specificities ranged from 99% (95% CI 92% to 100%) in van Rijk 2006 to 100% (95% CI 99% to 100%) in Voit 2014 (Figure 6). The summary sensitivity was 18.0% (95% CI 3.58% to 56.5%), and summary specificity was 99.8% (95% CI 99.1% to 99.9%), based on 1164 participants and 259 cases (Table 2; Figure 7).
Results: PET‐CT for detection of nodal metastases
The four studies comparing PET‐CT to histology based on SLNB in standard SLNB populations reported sensitivities ranging from 0% (95% CI 0% to 26%) in Hinz 2013 to 22% (95% CI 3% to 60%) in Kell 2007, and specificities from 89% (95% CI 72% to 98%) in Kell 2007 to 100% (95% CI 63% to 100%) in Hinz 2013 and 100% (95% CI 92% to 100%) in Klode 2010 (Figure 6). The summary sensitivity was 10.2% (95% CI 4.31% to 22.3%) and summary specificity was 96.5% (95% CI 87.1% to 99.1%) for 170 participants and 49 confirmed cases of nodal metastasis (Table 2; Figure 7).
Data from the three studies in higher‐risk melanoma populations (75 participants with 28 cases) that compared PET‐CT to histology based on SLNB alone could not be pooled because of substantial heterogeneity likely resulting from small sample sizes (Maubec 2007; Singh 2008; Wagner 2012). Sensitivities ranged from 0% (95% CI 0% to 41%) in Maubec 2007 to 43% (95% CI 18% to 71%) in Wagner 2012, and specificities from 92% (95% CI 64% to 100%) in Maubec 2007 to 100% (95% CI 48% to 100%) in Singh 2008 and 100% (95% CI 88% to 100%) in Wagner 2012 (Figure 6).
One of these studies ‐ Maubec 2007 ‐ and Arrangoiz 2012 reported data for PET‐CT compared to histology based on SLNB plus follow‐up to identify false negatives. Maubec 2007 identified one additional false negative result on follow‐up, but sensitivity (0%) and specificity (92%) remained the same with marginal changes to CIs (95% CI 0% to 37% for sensitivity and 62% to 100% for specificity). Arrangoiz 2012 reported sensitivity of PET‐CT as 41% (95% CI 24% to 61%) and specificity as 89% (95% CI 71% to 98%) (Figure 6).
Revel 2010 reported the sensitivity of PET‐CT as 20% (95% CI 3% to 56%) and 100% (95% CI 69% to 100%) for 20 participants with head and neck melanoma when compared to SLNB alone as a reference standard. Adding data for a follow‐up reference standard identified two additional nodal metastases missed on PET‐CT for sensitivity of 17% (95% CI 2% to 48%) and specificity of 100% (95% CI 69% to 100%) (Figure 6).
Results: comparison between tests
Upon comparison of ultrasound alone, ultrasound plus FNAC, and PET‐CT, summary sensitivities were not statistically significantly different (P = 0.07), and summary specificities were significantly higher for ultrasound plus FNAC compared to the other two modalities (P < 0.001) (Table 2; Figure 7).
The direct comparison of ultrasound alone versus ultrasound plus FNAC suggested higher sensitivity (58.7%, 95% CI 36.5% to 77.9%) but lower specificity (79.4%, 95% CI 70.0% to 86.4%) (3 studies; 1164 participants; 259 cases of nodal metastases) for ultrasound alone compared to the overall pooled result. Requiring both ultrasound and FNAC to be positive for nodal metastases (as an indicator for CLND instead of SLNB) reduced sensitivity by 40.7% (95% CI 6.50% to 75.0%; P = 0.02) but increased specificity by 20.4% (95% CI 12.2% to 28.6%; P < 0.001) (Table 2).
2. Whole body imaging for detection of any metastases, nodal metastases, and distant metastases
Twenty‐four studies evaluated whole body imaging. Summary characteristics of all studies are tabulated alphabetically in Appendix 9, and a narrative description is provided in Appendix 10. Results are presented below according to the population group studied, the target condition and imaging test, and the presentation of data per patient and per lesion.
Primary staging
Six studies recruited participants undergoing primary staging following a confirmed diagnosis of melanoma (Arrangoiz 2012; Hafner 2004; Kang 2011; Maubec 2007; Prayer 1990; Veit‐Haibach 2009). Two studies included any participant following diagnosis of melanoma (Kang 2011; Veit‐Haibach 2009); two excluded those with distant metastases on diagnosis (Hafner 2004; Maubec 2007). Maubec 2007 restricted data to those with melanomas at least 4 mm in thickness; one study included clinically node positive participants but did not report exclusion of those with distant metastases (Prayer 1990), and one included only clinically node negative participants with melanomas of at least 4 mm Breslow thickness (Arrangoiz 2012). Three studies also reported data for pre‐SLNB imaging (Arrangoiz 2012; Hafner 2004; Maubec 2007), two of which reported subgroup data for clinically node negative participants who underwent SLNB (Hafner 2004; Maubec 2007). All six studies reported accuracy data on a per patient basis; no per lesion data were identified.
Forest plots of all available study data are presented in Figure 8. Summary details of all studies in this section are presented alphabetically in Appendix 9. Sensitivities and specificities from studies evaluating more than one target condition (any metastasis, nodal metastasis, or distant metastasis) are tabulated in Appendix 11.

Forest plot of imaging for primary staging, for the detection of any metastases, nodal metastases, and distant metastases (per patient and per lesion data).
Results: detection of any metastases
Three studies presented data for detection of any metastasis in 118 study participants with 51 cases of metastatic disease (Figure 8) (Arrangoiz 2012; Kang 2011; Maubec 2007); the prevalence of metastases ranged from 24% in Kang 2011 to 57% in Arrangoiz 2012.
CT. No data on CT were identified for participants undergoing primary staging of melanoma.
MRI. No data on MRI were identified for participants undergoing primary staging of melanoma.
PET‐CT. Three studies presented per patient data for PET‐CT for detection of any metastasis; no per lesion data were identified.
Two studies evaluated PET‐CT in participants with melanomas ≥ 4 mm in thickness: one reported sensitivity and specificity for detection of any metastases of 47% (95% CI 29% to 65%) and 88% (95% CI 68% to 97%) (56 participants; 32 cases of metastatic disease) (Arrangoiz 2012); and in the other (Maubec 2007), sensitivity was 30% (95% CI 7% to 65%) and specificity 73% (95% CI 45% to 92%) (25 participants; 10 cases of metastatic disease) (Figure 8). Arrangoiz 2012 identified four patients with distant metastases whose disease would have been missed without PET‐CT imaging (prevalence of distant metastases 4/56; 7%). In the other study (Maubec 2007), no distant metastases were identified, but all three false positive results suggested possible distant metastases.
The third study evaluated PET‐CT for the prediction of subsequent recurrence in any participant following diagnosis of melanoma (Kang 2011). Stage of disease on presentation was reported as stage 0 (n = 7), stage I or II (n = 23), stage III (n = 6), and stage IV (n = 1); all patients underwent curative surgery for primary and metastatic lesions. The sensitivity of PET‐CT for the prediction of later recurrence at an SUVmax ≥ 2.2 at baseline was 89% (95% CI 52% to 100%) and specificity 61% (95% CI 41% to 78%) (37 participants; nine cases of metastatic disease) (Figure 8). The accuracy of PET‐CT for initial staging was not reported. Three of the nine patients who developed recurrence during follow‐up were stage III or greater at presentation.
Results: detection of nodal metastases
Three studies presented data for the detection of nodal metastases in 373 participants with 68 cases of nodal metastases (Hafner 2004; Prayer 1990; Veit‐Haibach 2009) (Figure 8); the prevalence of nodal metastases ranged from 13% in Prayer 1990 to 26% in Hafner 2004.
Ultrasound. Two studies evaluated the use of ultrasound in any participant following the diagnosis of melanoma, including those who were clinically node positive (Hafner 2004; Prayer 1990). Hafner 2004 restricted inclusion to those with melanomas ≥ 1 mm in thickness, and all underwent SLNB including three with clinically detectable nodal metastases (data for clinically node negative are reported in the pre‐SLNB imaging section above). The sensitivity of ultrasound was 8% (95% CI 1% to 25%) and specificity 88% (95% CI 78% to 94%) (100 participants, 26 with nodal metastases) (Figure 8); the only true positive results were both detected on physical examination. In Prayer 1990, the sensitivity of ultrasound was 100% (95% CI 88% to 100%) and specificity 97% (95% CI 93% to 99%) (217 participants, 29 with nodal metastases) (Figure 8). These results are likely to be influenced by incorporation bias and inadequate follow‐up to identify false negatives on ultrasound. Of 217 included participants, 15% (35/217) had suspicious findings on palpation; however, among these, only those who were also found to have suspicious nodes on ultrasound had histological verification (n = 15). This left 17 who were positive on palpation but negative on ultrasound, along with 165 who were negative on both palpation and ultrasound, with a six‐month follow‐up reference standard.
Other imaging tests. One study presented data comparing CT with PET‐CT for the detection of nodal metastases in all participants referred for PET‐CT after primary melanoma resection (Veit‐Haibach 2009). No false positive results were obtained with either test (specificity 100%, 95% CI 92% to 100%), but sensitivity was higher for PET‐CT (38%, 95% CI 14% to 68%) compared to CT (23%, 95% CI 5% to 54%) (56 participants, 13 with nodal metastases) (Figure 8). Initial staging procedures including histology of the primary lesion, SLNB, and all imaging procedures apart from PET‐CT identified four of the 13 participants with nodal metastases, two of whom were identified only on SLNB and were missed by all imaging tests (Veit‐Haibach 2009). Both CT and PET‐CT correctly identified additional participants with nodal metastases (one and three, respectively) that were not picked up by other staging procedures at the time of melanoma diagnosis.
No data on MRI to detect nodal disease were identified for participants undergoing primary staging of melanoma.
Results: detection of distant metastases
Two studies presented data for the detection of distant metastases in 112 participants with 17 cases of distant metastases (Arrangoiz 2012; Veit‐Haibach 2009) (Figure 8); the prevalence of distant metastases was 9% in Arrangoiz 2012 and 21% in Veit‐Haibach 2009.
CT. One study presented data for CT: sensitivity for the detection of 12 distant metastases was 25% (95% CI 5% to 57%) and specificity 93% (95% CI 81% to 99%) (56 participants) (Veit‐Haibach 2009).
MRI. No per patient data on MRI were identified for participants undergoing primary staging of melanoma.
PET‐CT.Veit‐Haibach 2009 provided a direct comparison of CT with PET‐CT; two additional cases of distant metastases were detected in comparison to CT (sensitivity 42%, 95% CI 15% to 72%), with no difference in specificity (93%, 95% CI 81% to 99%) (Figure 8).
Arrangoiz 2012 evaluated the use of PET‐CT in clinically node negative participants with primary melanoma greater than 4 mm in thickness and no indications for distant metastases; all five distant metastases were detected by PET‐CT (sensitivity 100%, 95% CI 48% to 100%), with three false positive results (specificity 94%, 95% CI 84% to 99%) (56 participants).
Results: detection of distant metastases by metastatic site
No data were identified for the detection of metastatic disease according to metastatic site in participants undergoing imaging for primary staging of melanoma.
In three of six studies, scan coverage was reported to include the skull (Arrangoiz 2012; Kang 2011; Maubec 2007), but the detection of brain metastases was not separately documented.
Re‐staging
Three studies recruited participants undergoing imaging for re‐staging of disease following a clinical indication of recurrence (Iagaru 2007; Rubaltelli 2011; Strobel 2007a). One study included any participant having imaging for re‐staging purposes (Iagaru 2007), and two included clinically node negative participants either undergoing ultrasound of the regional lymph nodes as part of a follow‐up program (Rubaltelli 2011), or with raised serum S100 (> 0.2 μg/L) during follow‐up (Strobel 2007a).
Forest plots of all available study data are presented in Figure 9. Summary estimates of sensitivity and specificity are presented in Table 2. Summary details of all studies in this section are presented alphabetically in Appendix 9.

Forest plot of imaging for re‐staging of melanoma, for the detection of any metastases or nodal metastases (per patient and per lesion data).
Results: detection of any metastases
Two studies provided per patient data for the detection of any metastasis in 153 participants with 95 cases of metastatic disease (Figure 9); the prevalence of any metastasis was 53% in Iagaru 2007 and 83% in Strobel 2007a.
CT. In one study, the sensitivity of CT for detection of any metastasis on a per patient basis was 68% (95% CI 54% to 80%) and specificity 94% (95% CI 83% to 99%) (106 participants; 56 cases of metastatic disease) (Iagaru 2007).
MRI. No data on MRI were identified for participants undergoing re‐staging of melanoma.
PET‐CT. Two studies evaluated PET‐CT on a per‐patient basis in 153 participants, 95 of whom had confirmed metastases (Iagaru 2007; Strobel 2007a); summary sensitivity was 92.6% (95% CI 85.3% to 96.4%) and specificity 89.7% (95% CI 78.8% to 95.3%) (Table 2).
Comparison of PET‐CT with CT in Iagaru 2007 demonstrated PET‐CT to be more sensitive (89%, 95% CI 78% to 96%) than CT alone (increase of 21%), with similar specificity (88%, 95% CI 76% to 95%). Similar results were observed on a per lesion basis (Figure 9). Although numbers were small, PET‐CT was more sensitive in the subgroup with stage IIIc to IV disease who underwent PET‐CT for re‐staging after therapy (100%, 95% CI 81% to 100%) (n = 32; 18 with metastatic disease) than in those with less advanced disease (84%, 95% CI 69% to 94%).
Results: detection of nodal metastases
One study presented per patient data for the detection of nodal recurrence after primary treatment in 460 participants with 37 cases of nodal metastases (prevalence 8%) (Rubaltelli 2011) (Figure 9).
Ultrasound. Considering participants with 'common signs of malignancy' or with focal hypoechoic cortical thickening as positive for metastases detected all participants with nodal metastases (sensitivity 100%, 95% CI 91% to 100%) with a specificity of 93% (95% CI 90% to 95%) (460 participants, 37 with nodal metastases) (Rubaltelli 2011). The combination of contrast‐enhanced ultrasound with B‐mode ultrasound for participants with focal cortical thickening (presence of perfusion defects corresponding to the cortical focal thickening required for a positive test result) increased specificity to 100% (95% CI 98% to 100%).
Other imaging tests. No data on CT, MRI, or PET‐CT for the detection of nodal metastases were identified for participants undergoing re‐staging for recurrence of melanoma.
Results: detection of distant metastases
No data were identified for the detection of distant metastases in participants undergoing re‐staging for disease recurrence.
Results: detection of distant metastases by metastatic site
Two of three studies conducted in participants undergoing imaging for re‐staging of melanoma included imaging of the brain and documented some results for the detection of brain metastases.
In Iagaru 2007, one of the nine lesions classified as a false negative on PET‐CT was a brain lesion that was identified by MRI during follow‐up; the total number of brain metastases identified in the study was not reported.
In Strobel 2007a, two brain metastases were identified on PET‐CT, both of which were confirmed to be malignant on the reference standard.
3. Staging in mixed or not clearly described populations
Studies in mixed and not clearly described populations have been considered together on the basis that we would be unable to make clear statements regarding the expected accuracy of imaging at any particular point on the clinical pathway for either subset of studies. Table 3 describes variability in the clinical pathway and indications for imaging, inclusion criteria, and stage of disease of participants included in these studies.
| Study Population group | Participant inclusion criteria and reported indications for imaging | Stage of disease on presentation | Imaging tests | Patients/cases (prevalence) [lesions/metastases (prevalence)] | Average no. metastases per patient |
| PER PATIENT DATA | |||||
| Mixed – primary or follow‐up | Undergoing FU after prior SLNB/CLND for micro‐metastases or presenting with clinically detectable nodal disease at or subsequent to initial diagnosis | Stage: IIIA 18, 53% | PET‐CT (NR) | 34/7 (21%) | N/A |
| Mixed – primary or re‐staging | Asymptomatic S100 positive. Previously treated for locoregional recurrence (n = 15) or distant metastases (n = 5); or with unfavourable primary tumour (n = 6), primary melanoma with simultaneous nodal metastases (n = 20) | Any (stage NR) | PET‐CT (U) | 46/23 (50%) | N/A |
| Unclear | Palpable and pathology proven lymph node metastases and no signs of distant metastases. Imaging to identify further ‘undetected’ disease | Stage III: 100% | PET‐CT (U) | 70/30 (43%) | N/A |
| Mixed – primary or re‐staging | Node positive (clinical or histology/cytology proven) candidates for CLND; imaging to identify further disease. Includes those with LN mets diagnosed at time of primary diagnosis 39, 15.5%; LN metastases identified ≤ 3 years since primary diagnosis 145, 57.8%; recurrence > 3 years since primary diagnosis 67, 26.7% | Stage III (100%) | CT (CE) | 251/78 (31%) distant metastases | N/A |
| Mixed ‐ staging or re‐staging | Any primary MM, visceral metastases, or cutaneous metastases from unknown primary | Any; 51% with metastases | PET‐CT (NR) | 67/39 (58%) [176/85 (48%)] | N/A |
| Mixed | Clark level IV or V undergoing FU after primary surgery. Reports primary (n = 8) and imaging during follow‐up (n = 75) | Any (NR) | US | 79/17 (22%) nodal | N/A |
| Mixed – primary, re‐staging, FU, disease response | All with PET‐CT for primary staging after sentinel node biopsy (n = 75); therapy control after chemotherapy of metastatic disease (n = 42); staging of clinically suspected recurrent disease (n = 65); during follow‐up within 5 years of primary treatment (n = 68) | Stage I 22, 9% Stage II 88, 35% Stage III 108, 43% Stage IV 32, 13% | CT (CE) PET‐CT (CE) | 250/116 (46%) | N/A |
| Unclear | High risk melanoma (BT > 4 mm, or Clark level III or IV, or known resected metastases) with PET‐CT for depiction or exclusion of metastases | Any (NR) | PET‐CT (CE) | 124/53 (43%) | N/A |
| Mixed ‐ primary and recurrence | Head and neck MM with CT before neck dissection, including therapeutic and elective (negative on palpation). "Interval between the treatment of the primary and the neck dissection ranged from 0 to 8.8 years (mean: 21 months)" | Stage I to II 8, 31% Stage III 18, 69% | CT (CE) | 26/21 (81%) nodal | N/A |
| Mixed ‐ primary and recurrence | Stage IIIB or IIIC MM with palpable groin metastases; selected for therapeutic combined groin dissection. Discussion states: "large proportion of our patients were initially treated for their primary tumour at other hospitals, and sometimes years prior to the current groin dissection" | All stage IIIB and C | PET‐CT (U) | 69/59 (superficial nodes 86%) 67/24 (deep nodes 36%) | N/A |
| PER LESION DATA | |||||
| Mixed ‐ staging or re‐staging | Any primary MM, visceral metastases, or cutaneous metastases from unknown primary. Lesions with equivocal focal uptake considered test positive Only 1 eligible index test | Any: 51% with metastases | CT (NR) | 67/39 (58%) [176/85 (48%)] | 1 (85/67) |
| Mixed ‐ primary or follow‐up | All with PET‐CT regardless of AJCC stage or indication for examination Number of lesions included varies per test | Stage I to II: 27.5% Stage III to IV: 72.5% | CT (CE) MRI (DW) PET‐CT | 40 [108/66 (61%)] [117/70 (60%)] [119/72 (61%)] | 2 (72/40) |
| Unclear | AJCC stage III or IV with positive SLNB or suspicious lesions on ultrasound or X‐ray studies Number of lesions included same per test | Stage III 38% Stage IV 62% | CT (CE) MRI (NR) | 33 All tests [824/455 (55%)] | 14 (455/33) |
| Unclear | AJCC stage IV. Number of lesions included varies per test | Stage IV: 100% | CT (CE) MRI (DW) MRI (DW + ultrafast GE) PET‐CT | 37 (218 lesions) [209/115 (55%)] [218/125 (57%)] [191/104 excl brain (54%)] | 3 (125/37) |
| Mixed – incl primary, FU, and NR | Stage III or IV imaged before surgery due to abnormal radiological, clinical, and laboratory findings, or routine surveillance in high risk Number of lesions included same per test | Stage III: 39% Stage IV: 61% | CT (CE) MRI (DW + ultrafast GE) PET‐CT | 64 All tests [420/297 (71%)] | 5 (297/64) |
| Mixed ‐ primary or follow‐up | Melanoma with regional lymph node metastases; excluded any lesions newly arising during follow‐up Number of lesions included same per test | Stage III: 100% | CT (CE); CT (U) PET‐CT (CE); (U) | 50 All tests [232/151 (65%)] | 3 (151/50) |
AJCC: American Joint Cancer Committee; BT: Breslow thickness; CE: contrast enhanced; CLND: complete lymph node dissection; CT: computed tomography; DW: diffusion weighted; FNAC: fine needle aspiration cytology; FU: follow‐up; GE: gradient echo; HN: head and neck; LN: lymph node; MM: malignant melanoma; MRI: magnetic resonance imaging; mm: millimetre; N+: node positive; N/A: not applicable; NR: not reported; PET: positron emission tomography; SLNB: sentinel lymph node biopsy; U: unenhanced; US: ultrasound; VIBE: MRI sequence.
Fifteen studies were conducted in mixed population groups (n = 11), including participants undergoing primary staging, re‐staging, and follow‐up imaging (i.e. at more than one point in the clinical pathway) (Abbott 2011; Aukema 2010a; Bastiaannet 2009; Cachin 2014; Dellestable 2011; Klebl 2003; Pfannenberg 2007; Pfluger 2011; Reinhardt 2006; van den Brekel 1998; van Wissen 2016), or did not clearly describe the clinical pathway in included participants (n = 4) (Aukema 2010b; Hausmann 2011; Jouvet 2014; Strobel 2007b).
Stage of disease on recruitment was not reported in four studies (Aukema 2010a; Cachin 2014; Klebl 2003; Strobel 2007b), two studies included any stage of disease (with 56% (Reinhardt 2006) and 73% (Dellestable 2011) at stage III or stage IV), six included only stage III melanoma (Abbott 2011; Aukema 2010b; Bastiaannet 2009; Pfluger 2011; van den Brekel 1998; van Wissen 2016), one included stage IV only (Jouvet 2014), and two included either stage III or IV melanoma (both with just under 40% with stage III disease) (Hausmann 2011; Pfannenberg 2007).
Nine of the fifteen studies reported accuracy data only on a per patient basis (Abbott 2011; Aukema 2010a; Aukema 2010b; Bastiaannet 2009; Klebl 2003; Reinhardt 2006; Strobel 2007b; van den Brekel 1998; van Wissen 2016), five reported data per lesion (Dellestable 2011; Hausmann 2011; Jouvet 2014; Pfannenberg 2007; Pfluger 2011), and one reported both per patient and per lesion data (Cachin 2014). Of those reporting per lesion data, two studies reported accuracy data only for those imaging abnormalities identified by each test (Dellestable 2011; Jouvet 2014), such that comparative studies reported different numbers of lesions and confirmed metastases per index test evaluated (Dellestable 2011; Jouvet 2014). Three studies included all lesions detected by any index test so that the number of lesions included in each 2×2 contingency table was the same for every test (Hausmann 2011; Pfannenberg 2007; Pfluger 2011); two included all lesions considered suspicious by any one index test (Hausmann 2011; Pfannenberg 2007); and one reported including only lesions considered positive for melanoma on at least one index test (Pfluger 2011). Variation in lesion inclusion has the potential to reduce sensitivity in studies that included all lesions detected by any index test, as any metastases missed by any one test would count as false negative results in the contingency table; any missed benign lesions would be considered true negative results, but a large number of lesions would need to be missed to have any detectable effect on specificity.
The considerable clinical heterogeneity between studies in terms of population groups, stages of disease, lesion selection, differences between tests, and definitions of target conditions (either including or excluding imaging of the brain) means that no conclusions can be drawn from studies in mixed and not clearly described populations (Table 3; Appendix 9). Study results are therefore described narratively in Appendix 12.
Discusión
Resumen de los resultados principales
Existe una cantidad significativa de bibliografía que evalúa la exactitud de los estudios de diagnóstico por imagen para el estadiaje del melanoma, aunque además del uso específico de las imágenes para identificar las metástasis ganglionares antes de la biopsia del ganglio linfático centinela (BGLC), solo un número reducido de estudios identificados fueron elegibles para la revisión y se realizaron en poblaciones bien definidas de participantes sometidos a estadiaje primario o reestadiaje de la recidiva de la enfermedad. En cuanto a la calidad metodológica, los estudios en general presentaron un riesgo de sesgo bajo o poco claro, y los métodos de selección de participantes y de revisión de las notas de casos cegadas se informaron de manera particularmente deficiente. Los estudios fueron de alta o incierta preocupación con respecto a la aplicabilidad de la evidencia debido a la selección de participantes de poblaciones mixtas o no claramente definidas, a la aplicación e interpretación mal descritas de la prueba índice o a la experiencia de los observadores, y a la falta de definición de la condición objetivo (p.ej. con o sin detección de metástasis cerebrales, sin desglose de los casos de acuerdo con las metástasis ganglionares o a distancia). Debido a que pocos estudios compararon exámenes elegibles y a que los datos disponibles para la resonancia magnética (RM) eran limitados y no se disponía de información sobre el estadio de la enfermedad en el momento del diagnóstico, no fue posible responder completamente a la pregunta de la revisión.
Se pueden extraer cuatro conclusiones principales de esta revisión.
1. La ecografía pre‐BGLC combinada con la citología por aspiración con aguja fina (CAAF) permite identificar cerca de una quinta parte de los pacientes con metástasis ganglionares con pocos resultados positivos falsos.
La mitad de los estudios incluidos (18/39) consideraron el uso de imágenes antes de la BGLC para identificar a los pacientes con metástasis ganglionares, en particular el uso de ecografía con o sin CAAF (n = 11). Las poblaciones de estudio estaban bien definidas e incluían a pacientes que probablemente se consideraban candidatos para la BGLC en la práctica habitual. Los estudios utilizaron principalmente la ecografía del modo B, aunque dos también utilizaron la ecografía Doppler en todos los participantes, y hubo variación en el uso de la ecografía antes o después de la linfocentellografía para identificar los ganglios centinela.
La tabla 1 de «Resumen de resultados» presenta los resultados clave y traduce los cálculos resumidos a una cohorte hipotética de 1000 lesiones. Dado que la linfadenectomía completa (LNDC) dejó de ser un estándar de atención para los pacientes que son candidatos para la BGLC, el beneficio previamente postulado de la ecografía y la CAAF para el triaje de pacientes con metástasis ganglionares en la citología directamente a la LNDC no es relevante. Por lo tanto, se ha considerado el beneficio potencial de la ecografía y la CAAF en términos de acceso al tratamiento adyuvante, aunque habría beneficio solo si se pudiera obtener un resultado del estudio de diagnóstico por imagen y la citología significativamente más rápido que un resultado de la BGLC, o si la BGLC no estuviera disponible o contraindicada.
Todos los estudios de diagnóstico por imagen tuvieron una sensibilidad deficiente, y en el mejor de los casos se detectó un tercio de los pacientes con metástasis ganglionares que no eran clínicamente detectables (sensibilidad del 35,4% para la ecografía sola); sin embargo, todas las especificidades resumidas fueron superiores al 90%.
Con el uso de la mediana de prevalencia de metástasis ganglionares observada en los 11 estudios de ecografía, una sensibilidad de la prueba de 35,4% identificaría correctamente a 84 de 237 pacientes con metástasis ganglionares pero con 47 resultados positivos falsos, o pacientes que serían consideradas incorrectamente para el tratamiento adyuvante. La combinación de ecografía con la CAAF (de modo que solo se consideraría que tienen enfermedad ganglionar los pacientes con resultados positivos tanto en la ecografía como en el CAAF subsiguiente [es decir, un umbral definido más estrechamente para la positividad en la prueba]) reduce en 41 el número de pacientes con metástasis ganglionares identificadas correctamente (de 84 a 43), pero también reduce a dos el número de personas con resultados positivos falsos. En otras palabras, por cada 1000 pacientes candidatos para la BGLC, la ecografía con CAAF puede permitir que cerca de una quinta parte de los pacientes con metástasis ganglionares sean considerados para el tratamiento adyuvante sin la necesidad de un procedimiento más invasivo (BGLC), a un coste de dos personas que reciben un tratamiento inapropiado (negativos falsos).
Sin embargo, se observaron diferencias considerables entre los estudios, de manera que el número de pacientes con resultados positivos falsos podría oscilar entre uno y siete, y el de pacientes con resultados negativos falsos entre 8 y 134. Los resultados también fueron dominados por un solo estudio grande de 1000 participantes de un grupo de expertos (Voit 2014), y es difícil determinar si estos resultados pueden ser replicados.
2. Se dispuso de datos limitados sobre la exactitud de la prueba para las imágenes de cuerpo entero con tomografía por emisión de positrones‐tomografía computadorizada (TEP‐TC) en el estadiaje primario o el reestadiaje para la recidiva de la enfermedad y no se evaluó la RM.
De 24 estudios que cumplieron con los criterios de inclusión para esta revisión, solo seis incorporaron de modo claro a participantes sometidos a estadiaje primario después de un diagnóstico confirmado de melanoma y tres incorporaron a participantes sometidos a estudios de diagnóstico por imagen para el reestadiaje de la enfermedad después de alguna indicación clínica de recidiva. La mayoría de los estudios (6/9) consideraron la TEP‐TC, dos en comparación con la TC sola, y tres examinaron el uso de la ecografía. Ninguno de los estudios incluidos en estos grupos evaluó la RM. La sensibilidad y especificidad observadas para la detección de cualquier metástasis en la TEP‐TC parecieron ser mayores para los pacientes sometidos a reestadiaje de la enfermedad (la sensibilidad resumida de dos estudios fue del 92,6% y la especificidad del 89,7%) en comparación con el estadiaje primario (la sensibilidad osciló entre el 30% y el 47% y la especificidad entre el 73% y el 88%) y fueron más sensibles que la TC sola en ambos grupos de población, aunque el número de participantes fue muy pequeño.
3. No se pueden establecer conclusiones con respecto al estudio de diagnóstico por imagen de rutina del cerebro con RM o TC.
Se excluyeron de esta revisión varios estudios que informaron de datos para los "estudios de diagnóstico por imagen convencionales", incluida la TC o la RM, porque no tenían protocolos de estudios de diagnóstico por imagen claramente definidos en que todos los participantes incluidos se sometieran a ambos exámenes (Finkelstein 2004; Fuster 2004; Gulec 2003; Oehr 1999; Paquet 2000; Rinne 1998). Además, no se identificaron estudios elegibles que informaran de datos para la RM en poblaciones primarias o de reestadiaje.
De los estudios realizados en poblaciones mixtas, la cobertura de las exploraciones incluyó de manera variable el cerebro, de modo que la definición de la condición objetivo de cualquier metástasis podía incluir o excluir específicamente la detección de metástasis cerebrales. En términos generales, los estudios fueron demasiado pequeños para incluir un número significativo de lesiones cerebrales. Solo dos estudios en grupos de población mixtos identificaron un número suficiente de metástasis cerebrales para permitir el cálculo de la sensibilidad. Jouvet 2014 mostró que la TC con contraste intravenoso (i.v.) y la RM con secuencias de eco de gradiente ultrarrápido tuvieron sensibilidades del 95% (TC) o más (100% para la RM) en comparación con el 65% de sensibilidad para la RM sin secuencias de eco de gradiente ultrarrápido. En Cachin 2014, la TEP‐TC detectó una de las siete metástasis confirmadas del cerebro (sensibilidad 14%; IC del 95%: 0% a 58%).
4. Existen gran preocupación con respecto a la aplicabilidad de la evidencia, aunque el riesgo de sesgo es generalmente bajo.
La calidad de los estudios fue moderada en cuanto al riesgo de sesgo, y existen preocupaciones reales con respecto a la aplicabilidad de la evidencia a la pregunta de la revisión. Gran parte de esta preocupación se debe a la inclusión de grupos de participantes mixtos y no definidos claramente. Hubo una tendencia a incluir participantes sobre la base de la disponibilidad de resultados para una prueba en particular, pero se necesita una consideración más cuidadosa de la indicación para los estudios de diagnóstico por imagen antes de que se pueda establecer la exactitud comparativa de estos en diferentes puntos de la vía clínica. Aunque existe una tentación comprensible de traducir los resultados de las poblaciones mixtas a un escenario primario de estadiaje o reestadiaje, existe al menos alguna evidencia de que la precisión varía según la vía y de diferentes maneras para diferentes exámenes (Reinhardt 2006), y esto se apoya en el trabajo en otros campos (Leeflang 2013).
Otras preocupaciones sobre la aplicabilidad se relacionan con la información de los datos por lesión y no por paciente, lo que no solo afecta potencialmente a los cálculos de sensibilidad y especificidad de la prueba, sino que dificulta la consideración de las implicaciones de este para el tratamiento de los pacientes, a menos que se facilite más información en los documentos. Aunque se puede esperar que la sensibilidad se sobredimensione con los datos de cada lesión, los efectos sobre la precisión no siempre son claros. Cachin 2014 fue uno de los pocos estudios que informó de datos por paciente y por lesión; tanto la sensibilidad como la especificidad de la TEP‐TC fueron mayores para los datos informados por paciente (87% y 71%) en comparación con los informados por lesión (80% y 54%). La detección de lesiones metastásicas adicionales por cualquier prueba es de beneficio limitado si no hay un cambio resultante en el estadiaje de la enfermedad o en las opciones de tratamiento del paciente. Por ejemplo, en Pfluger 2011, las cinco lesiones que resultaron ser negativas falsas en la TEP‐TC sin contraste se identificaron en pacientes con metástasis múltiples, de manera que no habría habido impacto en el estadio de TNM; por otro lado, las seis lesiones positivas falsas se identificaron en pacientes que de otro modo estarían libres de metástasis y que fueron cambiadas de estadio M0 a M1 erróneamente.
También se observaron variaciones en la cobertura de la gammagrafía entre los estudios, lo que afectará la definición de la condición objetivo, y se proporcionó información limitada sobre los umbrales utilizados para identificar la presencia de metástasis.
Fortalezas y limitaciones de la revisión
Las fortalezas de esta revisión incluyen una búsqueda exhaustiva en la literatura electrónica, métodos de revisión sistemática que comprenden la doble extracción de los trabajos por parte de médicos y metodólogos, y los intentos de contactar a los autores de los estudios para aclarar los datos. Se realizó un análisis detallado y reproducible de la calidad metodológica y se adoptó una estructura de análisis clara.
En comparación con otras revisiones sistemáticas disponibles de estudios de diagnóstico por imagen (p.ej. Catalano 2011; Danielsen 2014; El‐Maraghi 2008; Rodriguez 2014; Sadigh 2014; Schroer‐Gunther 2012; Xing 2011), esta revisión cubre un período de búsqueda más reciente y una pregunta de revisión más amplia, que incluye tanto el estadiaje primario como el reestadiaje del melanoma, a diferencia de una u otra (Danielsen 2014; Schroer‐Gunther 2012), y considera la precisión comparativa de diferentes exámenes a diferencia de la de la de la revisión de un solo estudio (como en el caso de todas las otras revisiones, aparte de la de la revisión de Xing 2011). También se consideraron por separado los datos de acuerdo con el informe de los datos del estudio por paciente y no por lesión (un enfoque que no fue adoptado por ninguna de las otras revisiones sistemáticas identificadas).
La aplicación rigurosa de los criterios de inclusión de la revisión significa que se excluyó una proporción considerable de estudios incluidos en revisiones anteriores. Por ejemplo, en una selección de cuatro revisiones que consideraron el TEP, se incluyeron solo tres de 12 (El‐Maraghi 2008), siete de 12 (Xing 2011), tres de nueve (Rodríguez 2014) y uno de siete estudios incluidos en esas revisiones (Danielsen 2014). Se excluyeron los estudios sobre la base de haber evaluado la TEP sola en lugar de la TEP‐TC (Acland 2000; Acland 2001; Belhocine 2002; Fink 2004; Havenga 2003; Koskivuo 2007; Longo 2003; Nguyen 1999; Steinert 1998; Tyler 2000; Vereecken 2005; Wagner 1999; Wagner 2005), una combinación de TEP y TEP‐TC que no pudo diferenciarse entre sí (Horn 2006; Wagner 2011), el uso de la TEP para la respuesta al tratamiento (Beasley 2012; Raymond 2011), el uso de un estándar de referencia inadecuado (p.ej. no se informó el período de seguimiento mínimo) (Peric 2011), tamaño de la muestra inadecuado (Libberecht 2005) o imposibilidad de calcular los datos 2x2 (Mottaghy 2007). Se incluyeron los cinco estudios TEP‐TC incluidos por Schroer‐Gunther y colegas para el estadiaje primario del melanoma (Schroer‐Gunther 2012), pero se consideró que dos de los cinco se realizaron en poblaciones de estadiaje mixto en lugar de primario (Aukema 2010b; Strobel 2007b).
Una situación similar se observó para los otros exámenes. Se incluyeron solo siete de 22 estudios de ecografía y cuatro de 13 estudios de TC solos que fueron incluidos por Xing 2011, seis de 24 estudios de ecografía de Catalano 2011, y dos de ocho estudios de TC en Sadigh 2014. La razón más frecuente para la exclusión de los estudios de ecografía de esta revisión fue el informe de más de una ecografía por paciente (p.ej. Binder 1997; Brountzos 2003; Schmid‐Wendtner 2003; Tregnaghi 1997; Voit 2001). Para la TC, fue el informe de los datos de precisión para la TC combinada con otros estudios de diagnóstico por imagen como la RM en Finkelstein 2004 y Fuster 2004 o el informe de más de una TC por paciente en Sawyer 2009 y Swetter 2002, estándares de referencia inadecuados (Buzaid 1993; Buzaid 1995; Chomyn 1992; Holder 1998) o la inclusión de más del 10% de los participantes con melanoma no cutáneo (Brady 2006; Sofue 2012).
Las principales preocupaciones de esta revisión se derivan de la información deficiente de los estudios primarios, en particular, la limitación de la evaluación de los estudios según la vía clínica, por estadio de la enfermedad en el momento del diagnóstico y por las diferentes definiciones de la condición objetivo. Esta revisión también se ve algo limitada por la fecha de la última búsqueda (2016); sin embargo, los estudios de diagnóstico por imagen del melanoma no han sido un campo de movimiento particularmente rápido (con solo siete de los 39 estudios incluidos publicados en los cinco años anteriores a la búsqueda); además, no se conoce la publicación de ningún estudio de referencia en el período intermedio.
Aplicabilidad de los hallazgos a la pregunta de la revisión
Las distintas definiciones de las poblaciones de estudio elegibles y la falta de claridad con respecto a la vía del paciente y cualquier prueba previa restringen la medida en que los hallazgos pueden aplicarse en el ámbito clínico.

Sample photographs of superficial spreading melanoma (left) and nodular melanoma (right). Copyright © 2010 Dr. Rubeta Matin: reproduced with permission.

Summary of 2015 NICE guideline recommendations for the management of cutaneous melanoma following primary diagnosis (NICE 2015a); not necessarily reflective of current practice.
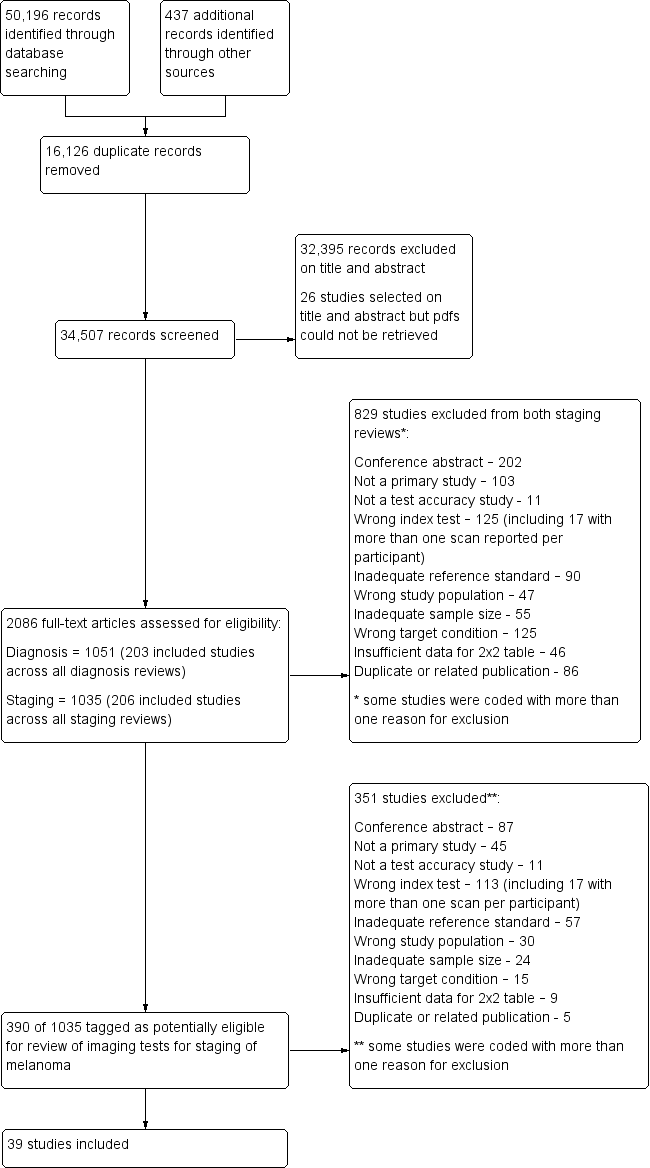
PRISMA flow diagram.

Risk of bias and applicability concerns graph: review authors' judgements about each domain presented as percentages across included studies.
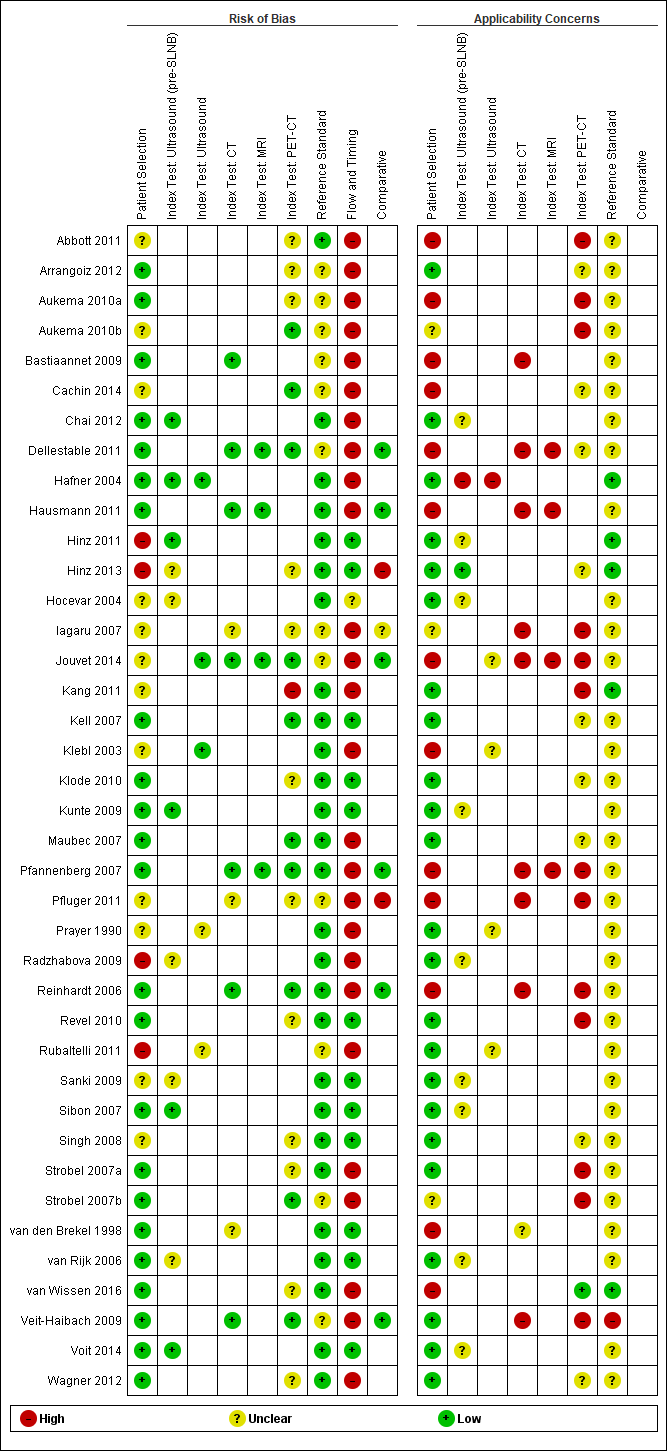
Risk of bias and applicability concerns summary: review authors' judgements about each domain for each included study.

Forest plot of all data for pre‐SLNB ultrasound, ultrasound plus FNAC, or PET‐CT for the detection of nodal metastasis.
(HN MM ‐ head and neck only malignant melanoma.)

Summary ROC plot comparing pre‐SLNB ultrasound vs ultrasound plus FNAC vs PET‐CT.

Forest plot of imaging for primary staging, for the detection of any metastases, nodal metastases, and distant metastases (per patient and per lesion data).

Forest plot of imaging for re‐staging of melanoma, for the detection of any metastases or nodal metastases (per patient and per lesion data).

Forest plot of tests for the detection of any metastases (mixed populations ‐ per patient data).

Forest plot of tests for the detection of any metastases (mixed populations ‐ per lesion data).

ROC plot of direct comparisons between CT and MRI for the detection of any metastases in mixed population group studies (per lesion data).

ROC plot of direct comparisons between CT and PET‐CT for the detection of any metastases in mixed population group studies (per lesion data).
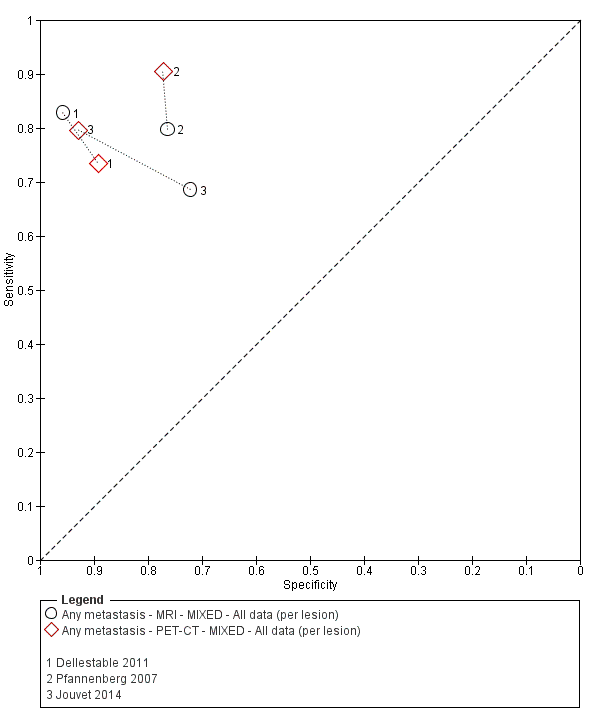
ROC plot of direct comparisons between MRI and PET‐CT for the detection of any metastases in mixed population group studies (per lesion data).

Forest plot of tests for the detection of nodal metastases (mixed populations ‐ per patient data).

Forest plot of tests for the detection of nodal metastases (mixed populations ‐ per lesion data).

ROC plot of direct comparisons between CT and MRI for the detection of nodal metastases in mixed population group studies (per lesion data).

ROC plot of direct comparisons between CT and PET‐CT for the detection of nodal metastases in mixed population group studies (per lesion data).

ROC plot of direct comparisons between MRI and PET‐CT for the detection of nodal metastases in mixed population group studies (per lesion data).

Forest plot of tests for the detection of distant metastases (mixed populations ‐ per patient data only).
Forest plot of tests for the detection of distant metastases (per lesion data).

ROC plot of direct comparisons between CT and MRI for the detection of distant metastases in mixed population group studies (per lesion data).

ROC plot of direct comparisons between CT and PET‐CT for the detection of distant metastases in mixed population group studies (per lesion data).
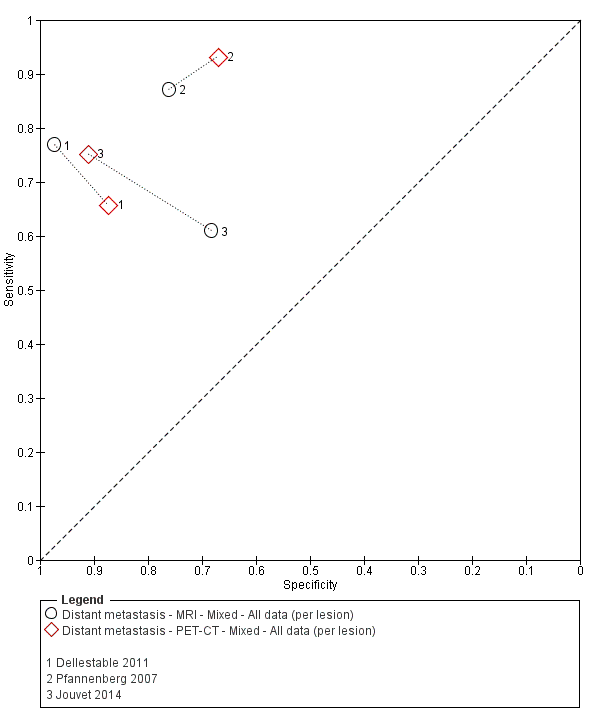
ROC plot of direct comparisons between MRI and PET‐CT for the detection of distant metastases in mixed population group studies (per lesion data).
Forest plot of tests for the detection of bone metastasis in mixed population groups (per lesion data).
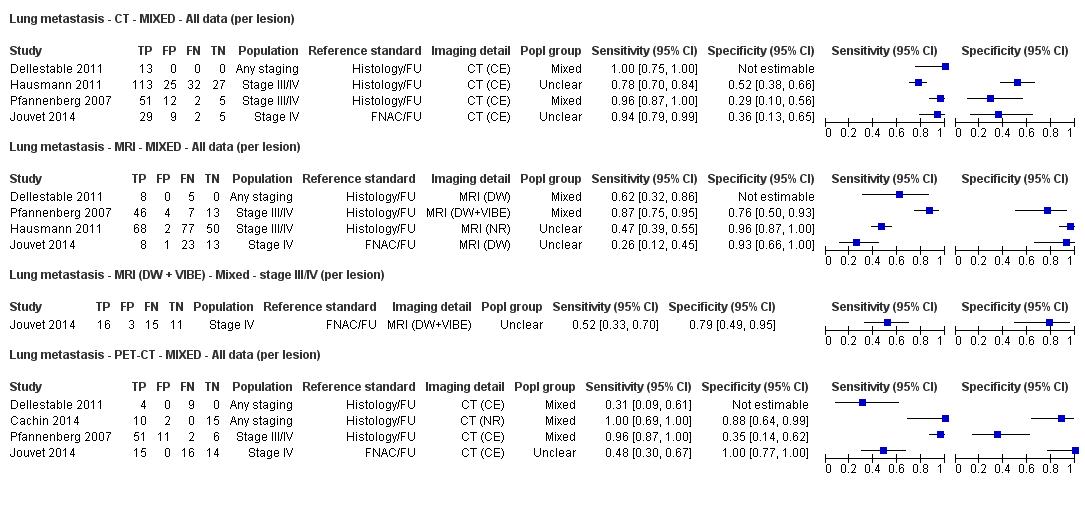
Forest plot of tests for the detection of lung metastasis in mixed population groups (per lesion data).
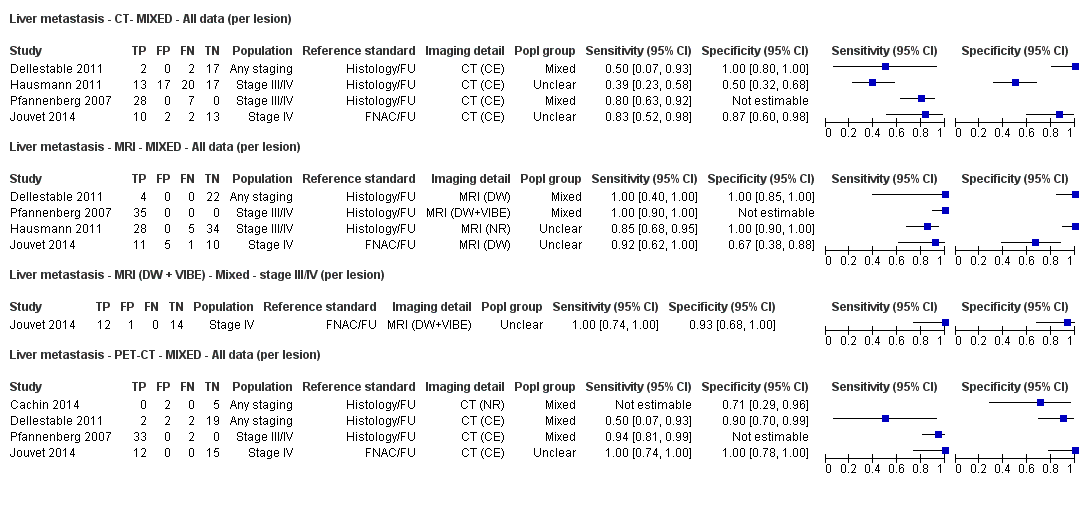
Forest plot of tests for the detection of liver metastasis in mixed population groups (per lesion data).

Forest plot of tests: 75 soft tissue metastasis ‐ PET‐CT ‐ MIXED (per lesion), 76 local/subcutaneous metastasis ‐ CT ‐ MIXED (per lesion), 77 local/subcutaneous metastasis ‐ MRI ‐ MIXED (per lesion), 78 local/subcutaneous metastasis ‐ MRI (DW + VIBE) ‐ MIXED (per lesion), 79 local/subcutaneous metastasis ‐ PET‐CT ‐ MIXED (per lesion).
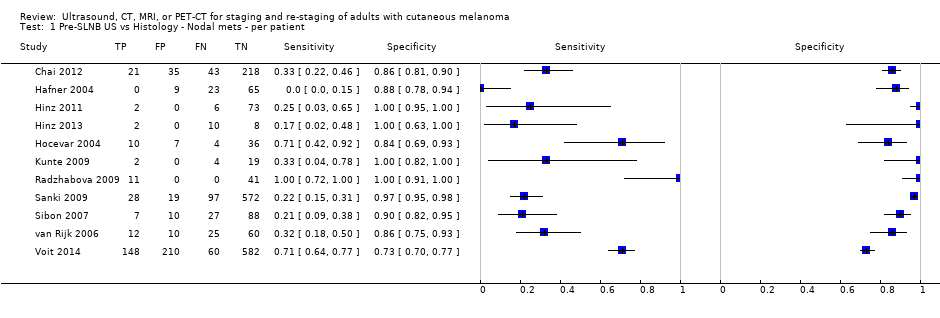
Pre‐SLNB US vs Histology ‐ Nodal mets ‐ per patient.
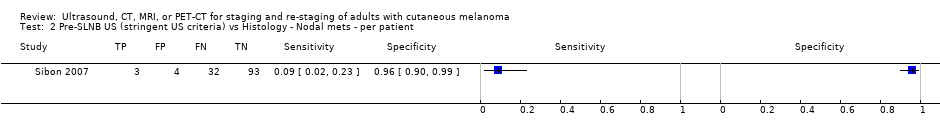
Pre‐SLNB US (stringent US criteria) vs Histology ‐ Nodal mets ‐ per patient.

Pre‐SLNB US‐FNAC ‐ Nodal mets ‐ per patient.

Pre‐SLNB PET‐CT vs Histology ‐ Nodal mets ‐ all SLNB ‐ per patient.
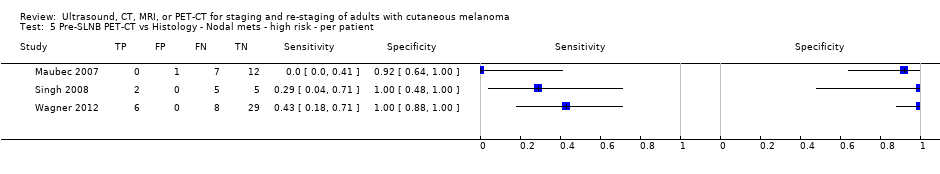
Pre‐SLNB PET‐CT vs Histology ‐ Nodal mets ‐ high risk ‐ per patient.

Pre‐SLNB PET‐CT vs Histology ‐ Nodal mets ‐ head and neck only ‐ per patient.

Pre‐SLNB PET‐CT vs Histology/FU ‐ Nodal mets ‐ high risk ‐ per patient.
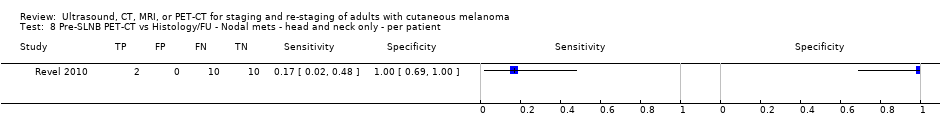
Pre‐SLNB PET‐CT vs Histology/FU ‐ Nodal mets ‐ head and neck only ‐ per patient.

Any metastasis ‐ PET‐CT ‐ PRIMARY ‐ Any stage (per pt).
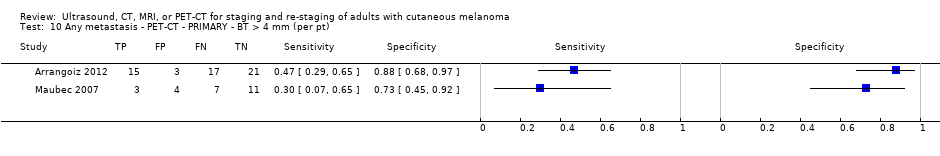
Any metastasis ‐ PET‐CT ‐ PRIMARY ‐ BT > 4 mm (per pt).

Any metastasis ‐ CT ‐ RE‐STAGING ‐ Any stage (per pt).

Any metastasis ‐ PET‐CT ‐ RE‐STAGING ‐ Any stage (per pt).

Any metastasis ‐ PET‐CT ‐ RE‐STAGING ‐ Stage IIIb or less (per pt).

Any metastasis ‐ PET‐CT ‐ RE‐STAGING ‐ Stage IIIc to IV (per pt).

Any metastasis ‐ CT‐ MIXED ‐ All data (per pt).

Any metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per pt).

Any metastasis ‐ PET‐CT (plus CT) ‐ Mixed ‐ Any stage (per pt).

Any metastasis ‐ PET‐CT ‐ RE‐STAGING ‐ Any stage (per lesion).

Any metastasis ‐ CT‐ MIXED ‐ All data (per lesion).

Any metastasis (incl brain) ‐ CT (U) ‐ MIXED (per lesion).

Any metastasis (incl brain) ‐ CT (CE) ‐ MIXED (per lesion).

Any metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion).

Any metastasis (excl brain) ‐ MRI (DW + VIBE) ‐ MIXED (per lesion).

Any metastasis (incl brain) ‐ MRI (DW) ‐ MIXED (per lesion).

Any metastasis (incl brain) ‐ MRI (DW + VIBE) ‐ MIXED (per lesion).

Any metastasis (incl brain) ‐ MRI plus CT ‐ MIXED (per lesion).

Any metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion).

Any metastasis (incl brain) ‐ PET‐CT (U) ‐ MIXED (per lesion).

Any metastasis (direct test comparisons) ‐ CT ‐ Mixed ‐ Stage III/IV (per lesion).

Any metastasis (direct test comparisons) ‐ MRI ‐ Mixed ‐ Stage III/IV (per lesion).
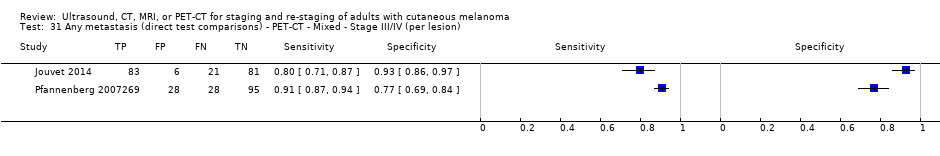
Any metastasis (direct test comparisons) ‐ PET‐CT ‐ Mixed ‐ Stage III/IV (per lesion).
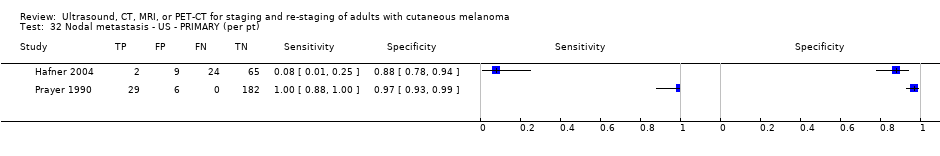
Nodal metastasis ‐ US ‐ PRIMARY (per pt).

Nodal metastasis ‐ CT ‐ PRIMARY (per pt).
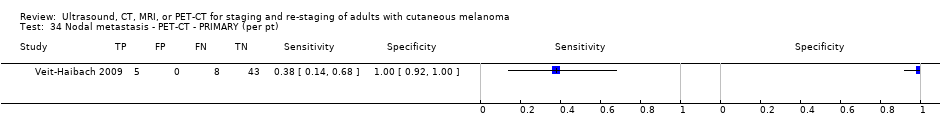
Nodal metastasis ‐ PET‐CT ‐ PRIMARY (per pt).

Nodal metastasis ‐ US ‐ RE‐STAGING (per pt).

Nodal metastasis ‐ US plus US (CE) ‐ RE‐STAGING (per pt).

Nodal metastasis ‐ US ‐ MIXED (per pt).

Nodal metastasis ‐ CT ‐ MIXED (per pt).

Nodal metastasis (superficial groin) ‐ PET‐CT (indeterminate test positive) ‐ MIXED (per pt).

Nodal metastasis (superficial groin) ‐ PET‐CT (indeterminate test negative) ‐ MIXED (per pt).

Nodal metastasis (deep groin) ‐ PET‐CT (indeterminate test positive) ‐ MIXED (per pt).

Nodal metastasis (deep groin) ‐ PET‐CT (indeterminate test negative) ‐ MIXED (per pt).

Nodal metastasis ‐ PET‐CT ‐ MIXED (per pt).

Nodal metastasis ‐ CT ‐ MIXED ‐ All data (per lesion).

Nodal metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion).

Nodal metastasis ‐ MRI (DW + VIBE) ‐ MIXED (per lesion).

Nodal metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion).

Superficial nodal metastasis ‐ US ‐ Mixed ‐ stage IV (per LNB).

Superficial nodal metastasis ‐ CT ‐ Mixed ‐ stage IV (per LNB).
Superficial nodal metastasis ‐ MRI ‐ Mixed ‐ stage IV (per LNB).

Superficial nodal metastasis ‐ MRI (DW + VIBE) ‐ Mixed ‐ Stage IV (per lesion).
Superficial nodal metastasis ‐ PET‐CT ‐ Mixed ‐ stage IV (per LNB).

Distant metastasis ‐ CT ‐ PRIMARY (per pt).

Distant metastasis ‐ PET‐CT ‐ PRIMARY (per pt).

Distant metastasis ‐ CT ‐ MIXED ‐ All data (per pt).

Distant metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per pt).

Distant metastasis ‐ CT ‐ Mixed ‐ All data (per lesion).

Distant metastasis ‐ MRI ‐ Mixed ‐ All data (per lesion).

Distant metastasis ‐ PET‐CT ‐ Mixed ‐ All data (per lesion).

Distant metastasis (excl brain) ‐ MRI (DW + VIBE) ‐ Mixed ‐ stage III/IV (per lesion).

Distant metastasis (incl brain) ‐ MRI (DW) ‐ Mixed ‐ stage III/IV (per lesion).

Distant metastasis (incl brain) ‐ MRI (DW + VIBE) ‐ Mixed ‐ stage III/IV (per lesion).

Bone metastasis ‐ CT‐ MIXED ‐ All data (per lesion).

Bone metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion).

Bone metastasis ‐ MRI (DW + VIBE) ‐ MIXED ‐ All data (per lesion).

Bone metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion).

Liver metastasis ‐ CT‐ MIXED ‐ All data (per lesion).

Liver metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion).

Liver metastasis ‐ MRI (DW + VIBE) ‐ Mixed ‐ stage III/IV (per lesion).

Liver metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion).

Lung metastasis ‐ CT ‐ MIXED ‐ All data (per lesion).

Lung metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion).

Lung metastasis ‐ MRI (DW + VIBE) ‐ Mixed ‐ stage III/IV (per lesion).
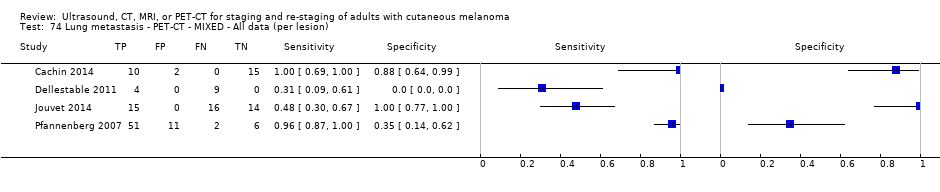
Lung metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion).

Soft tissue metastasis ‐ PET‐CT ‐ MIXED (per lesion).

Local/subcutaneous metastasis ‐ CT ‐ MIXED (per lesion).

Local/subcutaneous metastasis ‐ MRI ‐ MIXED (per lesion).

Local/subcutaneous metastasis ‐ MRI (DW + VIBE) ‐ MIXED (per lesion).

Local/subcutaneous metastasis ‐ PET‐CT ‐ MIXED (per lesion).
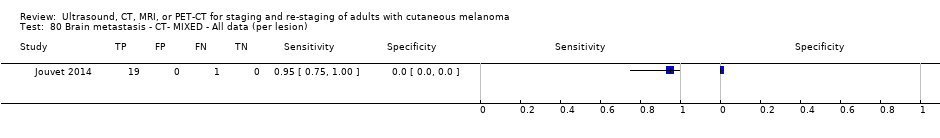
Brain metastasis ‐ CT‐ MIXED ‐ All data (per lesion).

Brain metastasis ‐ MRI (DW) ‐ MIXED ‐ All data (per lesion).
Brain metastasis ‐ MRI (DW + VIBE) ‐ MIXED ‐ All data (per lesion).

Brain metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion).

'Other' metastasis ‐ CT ‐ Mixed ‐ Any stage (per lesion).

'Other' metastasis ‐ MRI ‐ Mixed ‐ Any stage (per lesion).

'Other' metastasis ‐ PET‐CT ‐ Mixed ‐ Any stage (per lesion).

'Other' metastasis ‐ CT ‐ Mixed ‐ stage III/IV (per lesion).

'Other' metastasis ‐ MRI ‐ Mixed ‐ stage III/IV (per lesion).

'Other' metastasis ‐ PET‐CT ‐ Mixed ‐ stage III/IV (per lesion).
| Question | How accurate is ultrasound, CT, MRI, or PET‐CT for staging or re‐staging of cutaneous invasive melanoma in adults? | ||||||
| Population: | Adults with a confirmed diagnosis of melanoma undergoing imaging for staging purposes:
| ||||||
| Index test(s): | Ultrasound with or without fine needle aspiration cytology (FNAC) Computed tomography (CT) Magnetic resonance imaging (MRI) Positron emission tomography–computed tomography (PET‐CT) | ||||||
| Comparator test: | All of the index tests may be used in comparison to each other | ||||||
| Target condition: | For pre‐SLNB imaging: detection of nodal metastases For all other imaging: detection of any metastases | ||||||
| Reference standard: | Histology plus clinical or imaging follow‐up | ||||||
| Action: | If accurate, positive results of imaging before SLNB in some circumstances could allow patients with nodal metastases to proceed directly to commence adjuvant therapy and avoid an additional invasive procedure (SLNB). Accurate whole body imaging will allow appropriate locoregional and systemic therapies to be initiated in a timely manner | ||||||
| Quantity of evidence (n = 39 studies) | Number of studies | Number of participants | Number of cases | ||||
| Per patient data: | 34 | 4980 | 1265 | ||||
| Per lesion data: | 7 | 417 (1846 lesions) | 1061 metastases | ||||
| Limitations | |||||||
| Risk of bias: | Some concerns due to poor reporting across almost all domains. Unclear risk for participant selection method (11/39) or exclusions not clearly described (3/39). High risk from exclusions on the basis of index test results (4/39). Low risk for the index test for pre‐SLNB ultrasound (6/11), other ultrasound evaluation (3/5), CT (7/10), and MRI (4/4). For PET‐CT, unclear risk from lack of description of blinded case note review to ascertain imaging results for retrospective studies (13/23) and high risk from data driven selection of test threshold (1/23). Unclear risk for reference standard from lack of detail on participant follow‐up schedules (12/39). Lack of blinding of the histological diagnosis (2/39) or data collection on follow‐up (3/39) to the index result. High risk from differential verification (20/39) and participant exclusions (13/39). Low risk for comparisons between tests (6/9) | ||||||
| Applicability of evidence to question: | High or unclear concern for applicability for almost all domains. High concern for participant selection from mixed populations (11/39) or data presented per lesion (5/39). Unclear concern from lack of clarity regarding study population. High concern for index tests from poor description of test thresholds (pre‐SLNB ultrasound (1/11), other ultrasound (1/5), CT (5/10), MRI (3/4), PET‐CT (4/23)) or consensus test interpretation (CT (6/10), MRI (2/4), PET‐CT (11/23)). Unclear concern for application and interpretation of the index test (pre‐SLNB US (10/11), CT (3/10), MRI (2/4), PET‐CT (6/23)) or unclear observer expertise (pre‐SLNB ultrasound (6/11), CT (3), MRI (2/4), PET‐CT (6/23)). Unclear concern for applicability of the reference standard from lack of description of the target condition or no breakdown of cases according to nodal or distant metastases. Expertise of the histopathologist poorly described (6/39) | ||||||
| Findings | |||||||
| Thirty‐nine studies reporting accuracy data for pre‐SLNB imaging (n = 18) or for whole body imaging (n = 24) were included. The 24 studies of whole body imaging were of primary staging (n = 6) or staging for potential recurrence of disease (n = 3), or were conducted in mixed or not clearly described populations (n = 15). As we are unable to make clear statements regarding the expected accuracy of imaging at any particular point on the clinical pathway for the mixed population group, the findings presented are based on results for pre‐SLNB imaging, and for primary staging and re‐staging of melanoma only. | |||||||
| Test: pre‐SLNB imaging | |||||||
| Test | Studies: patients (cases) | Sensitivity (95% CI) | Specificity (95% CI) | Numbers in a cohort of 1000 lesions at a median prevalence of 23.7%a | |||
| TP (95% CI) | FN (95% CI) | FP (95% CI) | TN (95% CI) | ||||
| US | 11: 2614 (542) | 35.4 (17.0 to 59.4) | 93.9 (86.1 to 97.5) | 84 (40 to 141) | 153 (197 to 96) | 47 (106 to 19) | 716 (657 to 744) |
| US + FNAC | 3: 1164 (259) | 18.0 (3.58 to 56.5) | 99.8 (99.1 to 99.9) | 43 (8 to 134) | 194 (229 to 103) | 2 (7 to 1) | 761 (756 to 762) |
| PET‐CT | 4: 170 (49) | 10.2 (4.31 to 22.3) | 96.5 (87.1 to 99.1) | 24 (10 to 53) | 213 (227 to 184) | 27 (98 to 7) | 736 (665 to 756) |
| Whole bodyimaging for primary staging of melanoma | |||||||
| Quantity of evidence (n = 6 studies) | Number of studies | Number of participants | Number of cases | ||||
| Any metastases | 3 | 81 | 51 | ||||
| Nodal metastases | 3 | 373 | 68 | ||||
| Distant metastases | 2 | 112 | 17 | ||||
| Findings | |||||||
| Four of the six studies evaluated PET‐CT, one in comparison to CT.
No data for MRI were identified. Results for ultrasound for the detection of nodal metastases (2 studies) were highly variable and likely subject to bias. | |||||||
| Whole bodyimaging for re‐staging of melanoma | |||||||
| Quantity of evidence (n = 3 studies) | Number of studies | Number of participants (lesions) | Number of cases (metastases) | ||||
| Any metastases: | 2 (1) | 153 (139) | 95 (87) | ||||
| Nodal metastases: | 1 | 460 | 37 | ||||
| Distant metastases: | 0 | N/A | N/A | ||||
| Findings: | |||||||
|
No data for MRI were identified. | |||||||
| aMedian prevalence observed across 11 studies of pre‐SLNB ultrasound (interquartile range: 25th percentile 20.5%, 75th percentile 25.4%). CT: computed tomography; FN: false negative; FNAC: fine needle aspiration cytology; FP: false positive; MRI: magnetic resonance imaging; PET: positron emission tomography; SLNB: sentinel lymph node biopsy; TN: true negative; TP: true positive. | |||||||
| Study | US | US‐ FNAC | CT | MRI | PET‐CT | Population group | Population detail | Reference standard | Any metastases | Distant metastases | Nodal metastases | Other sites |
| PRIMARY STAGING | ||||||||||||
| ‐ | ‐ | ‐ | ‐ | X | Primary (any); primary (pre‐SLNB) | BT > 4 mm | SLNB/CLND/FU | Per patient | Per patient | Per patient/ Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB/CLND ± FU | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | (X) | Primary (pre‐SLNB); primary | Standard SLNB | SLNB/CLND | ‐ | ‐ | Per patient/ | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | High risk (BT ≥ 2.0 mm or other RF) | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | X | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB/CLND | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (any) | All staging (incl N+) | Histology/FU | per patient | ‐ | ‐ | ‐ | |
| X | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |||||
| ‐ | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (any); primary (pre‐SLNB) | BT > 4 mm | SLNB/CLND ± FU | Per patient | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (any) | All staging (incl N+) | CLND/FU | ‐ | ‐ | Per patient | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB; any (incl N+) | SLNB ± FU | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | HN MM | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB | Pre‐SLNB | ||||
| X | ‐ | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | Standard SLNB/BT > 4 mm | SLNB | ‐ | ‐ | Pre‐SLNB | ‐ | |
| X | X | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB/CLND | ‐ | ‐ | pre‐SLNB | ‐ | |
| ‐ | ‐ | X | ‐ | X | Primary (any) | All staging (incl N+) | Histology/FU | ‐ | Per patient | Per patient | ‐ | |
| X | X | ‐ | ‐ | ‐ | Primary (pre‐SLNB) | Standard SLNB | SLNB/CLND | ‐ | ‐ | Pre‐SLNB | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Primary (pre‐SLNB) | High risk (BT ≥ 4 mm or > 1 mm and ulcerated) | SLNB/CLND | ‐ | ‐ | Pre‐SLNB | ‐ | |
| RE‐STAGING | ||||||||||||
| ‐ | ‐ | X | ‐ | X | Re‐staging | Any re‐staging | Histology/FU | Per patient /Per lesion | ‐ | ‐ | ‐ | |
| X | ‐ | ‐ | ‐ | ‐ | Re‐staging | Any FU and suspicious on B‐mode US | FNAC/Histology/FU | ‐ | ‐ | Per patient | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Re‐staging | High risk (BT > 4 mm, etc.), elevated S100 | Histology/Cytology/FU | Per patient | ‐ | ‐ | ‐ | |
| MIXED OR UNCLEARLY REPORTED | ||||||||||||
| ‐ | ‐ | ‐ | ‐ | X | Mixed | Stage III | Histology/FU | Per patient | ‐ | ‐ | ‐ | |
| ‐ | ‐ | ‐ | (X ‐ Brain) | X | Mixed | S100 positive | FNAC/Histology/Imaging FU | Per patient | ‐ | ‐ | ‐ | |
| ‐ | ‐ | ‐ | (X ‐ Brain) | X | Unclear | Node positive | FNAC/Histology/FU | Per patient | ‐ | ‐ | ‐ | |
| ‐ | ‐ | X | ‐ | (X) | Mixed | All node positive | Histology/FU | ‐ | Per patient | ‐ | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Mixed | Stage III | Histology/Imaging/FU | Per patient/Per lesion | Per lesion | Per lesion | Per lesion | |
| ‐ | ‐ | X | X | X | Mixed | All staging | Histology/FU | Per lesion | Per lesion | Per lesion | Per lesion | |
| ‐ | ‐ | X | X | ‐ | Unclear | Stage III/IV | Histology/FU | Per lesion | Per lesion | Per lesion | Per lesion | |
| X | ‐ | X | X | X | Unclear | Stage IV | FNAC/FU | Per lesion | Per lesion | Per lesion | Per lesion | |
| X | ‐ | ‐ | ‐ | ‐ | Mixed | Clark IV/V in FU | Histology/FU | ‐ | ‐ | per patient | ‐ | |
| ‐ | ‐ | X | X | X | Mixed | Stage III/IV | Histology/Imaging/FU | Per lesion | Per patient | Per lesion | Per lesion | |
| ‐ | ‐ | X | ‐ | X | Mixed | All stage III | Histology/FU | Per patient | ‐ | ‐ | ‐ | |
| ‐ | ‐ | X | ‐ | X | Mixed | All staging (incl N+) | Histology/FU | Per patient | Per patient | Per patient | ‐ | |
| ‐ | ‐ | ‐ | ‐ | X | Unclear | High risk (BT > 4 mm, etc.) | Histology/Cytology/FU | Per patient | ‐ | ‐ | ‐ | |
| X | ‐ | ‐ | Mixed | HN MM and N+ | Histology | ‐ | ‐ | Per patient | ‐ | |||
| ‐ | ‐ | ‐ | ‐ | X | Mixed | Stage IIIB/IIIC palpable groin mets | Histology (combined groin dissection) | ‐ | ‐ | Per patient | ‐ | |
| BT: Breslow thickness; CLND: complete lymph node dissection; CT: computed tomography; FNAC: fine needle aspiration cytology; FU: follow‐up; HN: head and neck; MM: malignant melanoma; MRI: magnetic resonance imaging; mm: millimetre; N+: node positive; PET: positron emission tomography; RF: risk factor; SLNB: sentinel lymph node biopsy; US: ultrasound. | ||||||||||||
| Test | Studies | Participants (cases) | Sensitivity (95% CI), % | Specificity (95% CI), % |
| Comparison of imaging tests before SLNB | ||||
| Indirect comparison of imaging tests for detection of nodal metastasis (per patient data) | ||||
| US | 11 | 2614 (542) | 35.4 (17.0 to 59.4) | 93.9 (86.1 to 97.5) |
| US‐FNAC | 3 | 1164 (259) | 18.0 (3.58 to 56.5) | 99.8 (99.1 to 99.9) |
| PET‐CT | 4 | 170 (49) | 10.2 (4.31 to 22.3) | 96.5 (87.1 to 99.1) |
| Difference | P = 0.07 | P < 0.001 | ||
| Direct comparison of imaging tests for detection of nodal metastasis (per patient data) | ||||
| US | 3 | 1164 (259) | 58.7 (36.5 to 77.9) | 79.4 (70.0 to 86.4) |
| US‐FNAC | 3 | 1164 (259) | 18.0 (3.58 to 56.5) | 99.8 (99.1 to 99.9) |
| Difference | ‐40.7 (‐75.0 to ‐6.50), P = 0.02 | +20.4 (+12.2 to +28.6), P < 0.001 | ||
| Whole body imaging | ||||
| Imaging for re‐staging for the detection of any metastasis (per patient data) | ||||
| PET‐CT | 2a | 153 (95) | 92.6 (85.3 to 96.4) | 89.7 (78.8 to 95.3) |
| CI: confidence interval; CT: computed tomography; FNAC: fine needle aspiration cytology; PET: positron emission tomography; SLNB: sentinel lymph node biopsy; US: ultrasound. aWhere there were only two studies, estimates of summary sensitivity and summary specificity were obtained by using univariate fixed‐effect logistic regression models to pool sensitivities and specificities separately. | ||||
| Study Population group | Participant inclusion criteria and reported indications for imaging | Stage of disease on presentation | Imaging tests | Patients/cases (prevalence) [lesions/metastases (prevalence)] | Average no. metastases per patient |
| PER PATIENT DATA | |||||
| Mixed – primary or follow‐up | Undergoing FU after prior SLNB/CLND for micro‐metastases or presenting with clinically detectable nodal disease at or subsequent to initial diagnosis | Stage: IIIA 18, 53% | PET‐CT (NR) | 34/7 (21%) | N/A |
| Mixed – primary or re‐staging | Asymptomatic S100 positive. Previously treated for locoregional recurrence (n = 15) or distant metastases (n = 5); or with unfavourable primary tumour (n = 6), primary melanoma with simultaneous nodal metastases (n = 20) | Any (stage NR) | PET‐CT (U) | 46/23 (50%) | N/A |
| Unclear | Palpable and pathology proven lymph node metastases and no signs of distant metastases. Imaging to identify further ‘undetected’ disease | Stage III: 100% | PET‐CT (U) | 70/30 (43%) | N/A |
| Mixed – primary or re‐staging | Node positive (clinical or histology/cytology proven) candidates for CLND; imaging to identify further disease. Includes those with LN mets diagnosed at time of primary diagnosis 39, 15.5%; LN metastases identified ≤ 3 years since primary diagnosis 145, 57.8%; recurrence > 3 years since primary diagnosis 67, 26.7% | Stage III (100%) | CT (CE) | 251/78 (31%) distant metastases | N/A |
| Mixed ‐ staging or re‐staging | Any primary MM, visceral metastases, or cutaneous metastases from unknown primary | Any; 51% with metastases | PET‐CT (NR) | 67/39 (58%) [176/85 (48%)] | N/A |
| Mixed | Clark level IV or V undergoing FU after primary surgery. Reports primary (n = 8) and imaging during follow‐up (n = 75) | Any (NR) | US | 79/17 (22%) nodal | N/A |
| Mixed – primary, re‐staging, FU, disease response | All with PET‐CT for primary staging after sentinel node biopsy (n = 75); therapy control after chemotherapy of metastatic disease (n = 42); staging of clinically suspected recurrent disease (n = 65); during follow‐up within 5 years of primary treatment (n = 68) | Stage I 22, 9% Stage II 88, 35% Stage III 108, 43% Stage IV 32, 13% | CT (CE) PET‐CT (CE) | 250/116 (46%) | N/A |
| Unclear | High risk melanoma (BT > 4 mm, or Clark level III or IV, or known resected metastases) with PET‐CT for depiction or exclusion of metastases | Any (NR) | PET‐CT (CE) | 124/53 (43%) | N/A |
| Mixed ‐ primary and recurrence | Head and neck MM with CT before neck dissection, including therapeutic and elective (negative on palpation). "Interval between the treatment of the primary and the neck dissection ranged from 0 to 8.8 years (mean: 21 months)" | Stage I to II 8, 31% Stage III 18, 69% | CT (CE) | 26/21 (81%) nodal | N/A |
| Mixed ‐ primary and recurrence | Stage IIIB or IIIC MM with palpable groin metastases; selected for therapeutic combined groin dissection. Discussion states: "large proportion of our patients were initially treated for their primary tumour at other hospitals, and sometimes years prior to the current groin dissection" | All stage IIIB and C | PET‐CT (U) | 69/59 (superficial nodes 86%) 67/24 (deep nodes 36%) | N/A |
| PER LESION DATA | |||||
| Mixed ‐ staging or re‐staging | Any primary MM, visceral metastases, or cutaneous metastases from unknown primary. Lesions with equivocal focal uptake considered test positive Only 1 eligible index test | Any: 51% with metastases | CT (NR) | 67/39 (58%) [176/85 (48%)] | 1 (85/67) |
| Mixed ‐ primary or follow‐up | All with PET‐CT regardless of AJCC stage or indication for examination Number of lesions included varies per test | Stage I to II: 27.5% Stage III to IV: 72.5% | CT (CE) MRI (DW) PET‐CT | 40 [108/66 (61%)] [117/70 (60%)] [119/72 (61%)] | 2 (72/40) |
| Unclear | AJCC stage III or IV with positive SLNB or suspicious lesions on ultrasound or X‐ray studies Number of lesions included same per test | Stage III 38% Stage IV 62% | CT (CE) MRI (NR) | 33 All tests [824/455 (55%)] | 14 (455/33) |
| Unclear | AJCC stage IV. Number of lesions included varies per test | Stage IV: 100% | CT (CE) MRI (DW) MRI (DW + ultrafast GE) PET‐CT | 37 (218 lesions) [209/115 (55%)] [218/125 (57%)] [191/104 excl brain (54%)] | 3 (125/37) |
| Mixed – incl primary, FU, and NR | Stage III or IV imaged before surgery due to abnormal radiological, clinical, and laboratory findings, or routine surveillance in high risk Number of lesions included same per test | Stage III: 39% Stage IV: 61% | CT (CE) MRI (DW + ultrafast GE) PET‐CT | 64 All tests [420/297 (71%)] | 5 (297/64) |
| Mixed ‐ primary or follow‐up | Melanoma with regional lymph node metastases; excluded any lesions newly arising during follow‐up Number of lesions included same per test | Stage III: 100% | CT (CE); CT (U) PET‐CT (CE); (U) | 50 All tests [232/151 (65%)] | 3 (151/50) |
| AJCC: American Joint Cancer Committee; BT: Breslow thickness; CE: contrast enhanced; CLND: complete lymph node dissection; CT: computed tomography; DW: diffusion weighted; FNAC: fine needle aspiration cytology; FU: follow‐up; GE: gradient echo; HN: head and neck; LN: lymph node; MM: malignant melanoma; MRI: magnetic resonance imaging; mm: millimetre; N+: node positive; N/A: not applicable; NR: not reported; PET: positron emission tomography; SLNB: sentinel lymph node biopsy; U: unenhanced; US: ultrasound; VIBE: MRI sequence. | |||||
| Test | No. of studies | No. of participants |
| 1 Pre‐SLNB US vs Histology ‐ Nodal mets ‐ per patient Show forest plot | 11 | 2604 |
| 2 Pre‐SLNB US (stringent US criteria) vs Histology ‐ Nodal mets ‐ per patient Show forest plot | 1 | 132 |
| 3 Pre‐SLNB US‐FNAC ‐ Nodal mets ‐ per patient Show forest plot | 3 | 1164 |
| 4 Pre‐SLNB PET‐CT vs Histology ‐ Nodal mets ‐ all SLNB ‐ per patient Show forest plot | 4 | 170 |
| 5 Pre‐SLNB PET‐CT vs Histology ‐ Nodal mets ‐ high risk ‐ per patient Show forest plot | 3 | 75 |
| 6 Pre‐SLNB PET‐CT vs Histology ‐ Nodal mets ‐ head and neck only ‐ per patient Show forest plot | 1 | 20 |
| 7 Pre‐SLNB PET‐CT vs Histology/FU ‐ Nodal mets ‐ high risk ‐ per patient Show forest plot | 2 | 76 |
| 8 Pre‐SLNB PET‐CT vs Histology/FU ‐ Nodal mets ‐ head and neck only ‐ per patient Show forest plot | 1 | 22 |
| 9 Any metastasis ‐ PET‐CT ‐ PRIMARY ‐ Any stage (per pt) Show forest plot | 1 | 37 |
| 10 Any metastasis ‐ PET‐CT ‐ PRIMARY ‐ BT > 4 mm (per pt) Show forest plot | 2 | 81 |
| 11 Any metastasis ‐ CT ‐ RE‐STAGING ‐ Any stage (per pt) Show forest plot | 1 | 106 |
| 12 Any metastasis ‐ PET‐CT ‐ RE‐STAGING ‐ Any stage (per pt) Show forest plot | 2 | 153 |
| 13 Any metastasis ‐ PET‐CT ‐ RE‐STAGING ‐ Stage IIIb or less (per pt) Show forest plot | 1 | 76 |
| 14 Any metastasis ‐ PET‐CT ‐ RE‐STAGING ‐ Stage IIIc to IV (per pt) Show forest plot | 1 | 30 |
| 15 Any metastasis ‐ CT‐ MIXED ‐ All data (per pt) Show forest plot | 1 | 250 |
| 16 Any metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per pt) Show forest plot | 6 | 591 |
| 17 Any metastasis ‐ PET‐CT (plus CT) ‐ Mixed ‐ Any stage (per pt) Show forest plot | 1 | 124 |
| 18 Any metastasis ‐ PET‐CT ‐ RE‐STAGING ‐ Any stage (per lesion) Show forest plot | 1 | 139 |
| 19 Any metastasis ‐ CT‐ MIXED ‐ All data (per lesion) Show forest plot | 5 | 1770 |
| 20 Any metastasis (incl brain) ‐ CT (U) ‐ MIXED (per lesion) Show forest plot | 1 | 232 |
| 21 Any metastasis (incl brain) ‐ CT (CE) ‐ MIXED (per lesion) Show forest plot | 1 | 209 |
| 22 Any metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 1556 |
| 23 Any metastasis (excl brain) ‐ MRI (DW + VIBE) ‐ MIXED (per lesion) Show forest plot | 1 | 195 |
| 24 Any metastasis (incl brain) ‐ MRI (DW) ‐ MIXED (per lesion) Show forest plot | 1 | 218 |
| 25 Any metastasis (incl brain) ‐ MRI (DW + VIBE) ‐ MIXED (per lesion) Show forest plot | 1 | 218 |
| 26 Any metastasis (incl brain) ‐ MRI plus CT ‐ MIXED (per lesion) Show forest plot | 1 | 116 |
| 27 Any metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion) Show forest plot | 5 | 1138 |
| 28 Any metastasis (incl brain) ‐ PET‐CT (U) ‐ MIXED (per lesion) Show forest plot | 1 | 232 |
| 29 Any metastasis (direct test comparisons) ‐ CT ‐ Mixed ‐ Stage III/IV (per lesion) Show forest plot | 3 | 1430 |
| 30 Any metastasis (direct test comparisons) ‐ MRI ‐ Mixed ‐ Stage III/IV (per lesion) Show forest plot | 3 | 1439 |
| 31 Any metastasis (direct test comparisons) ‐ PET‐CT ‐ Mixed ‐ Stage III/IV (per lesion) Show forest plot | 2 | 611 |
| 32 Nodal metastasis ‐ US ‐ PRIMARY (per pt) Show forest plot | 2 | 317 |
| 33 Nodal metastasis ‐ CT ‐ PRIMARY (per pt) Show forest plot | 1 | 56 |
| 34 Nodal metastasis ‐ PET‐CT ‐ PRIMARY (per pt) Show forest plot | 1 | 56 |
| 35 Nodal metastasis ‐ US ‐ RE‐STAGING (per pt) Show forest plot | 1 | 460 |
| 36 Nodal metastasis ‐ US plus US (CE) ‐ RE‐STAGING (per pt) Show forest plot | 1 | 460 |
| 37 Nodal metastasis ‐ US ‐ MIXED (per pt) Show forest plot | 1 | 79 |
| 38 Nodal metastasis ‐ CT ‐ MIXED (per pt) Show forest plot | 2 | 276 |
| 39 Nodal metastasis (superficial groin) ‐ PET‐CT (indeterminate test positive) ‐ MIXED (per pt) Show forest plot | 1 | 69 |
| 40 Nodal metastasis (superficial groin) ‐ PET‐CT (indeterminate test negative) ‐ MIXED (per pt) Show forest plot | 1 | 69 |
| 41 Nodal metastasis (deep groin) ‐ PET‐CT (indeterminate test positive) ‐ MIXED (per pt) Show forest plot | 1 | 67 |
| 42 Nodal metastasis (deep groin) ‐ PET‐CT (indeterminate test negative) ‐ MIXED (per pt) Show forest plot | 1 | 67 |
| 43 Nodal metastasis ‐ PET‐CT ‐ MIXED (per pt) Show forest plot | 1 | 250 |
| 44 Nodal metastasis ‐ CT ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 629 |
| 45 Nodal metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 630 |
| 46 Nodal metastasis ‐ MRI (DW + VIBE) ‐ MIXED (per lesion) Show forest plot | 1 | 53 |
| 47 Nodal metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 288 |
| 48 Superficial nodal metastasis ‐ US ‐ Mixed ‐ stage IV (per LNB) Show forest plot | 1 | 33 |
| 49 Superficial nodal metastasis ‐ CT ‐ Mixed ‐ stage IV (per LNB) Show forest plot | 1 | 33 |
| 50 Superficial nodal metastasis ‐ MRI ‐ Mixed ‐ stage IV (per LNB) Show forest plot | 1 | 33 |
| 51 Superficial nodal metastasis ‐ MRI (DW + VIBE) ‐ Mixed ‐ Stage IV (per lesion) Show forest plot | 1 | 33 |
| 52 Superficial nodal metastasis ‐ PET‐CT ‐ Mixed ‐ stage IV (per LNB) Show forest plot | 1 | 33 |
| 53 Distant metastasis ‐ CT ‐ PRIMARY (per pt) Show forest plot | 1 | 56 |
| 54 Distant metastasis ‐ PET‐CT ‐ PRIMARY (per pt) Show forest plot | 2 | 112 |
| 55 Distant metastasis ‐ CT ‐ MIXED ‐ All data (per pt) Show forest plot | 2 | 501 |
| 56 Distant metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per pt) Show forest plot | 1 | 250 |
| 57 Distant metastasis ‐ CT ‐ Mixed ‐ All data (per lesion) Show forest plot | 4 | 920 |
| 58 Distant metastasis ‐ MRI ‐ Mixed ‐ All data (per lesion) Show forest plot | 4 | 926 |
| 59 Distant metastasis ‐ PET‐CT ‐ Mixed ‐ All data (per lesion) Show forest plot | 4 | 618 |
| 60 Distant metastasis (excl brain) ‐ MRI (DW + VIBE) ‐ Mixed ‐ stage III/IV (per lesion) Show forest plot | 1 | 142 |
| 61 Distant metastasis (incl brain) ‐ MRI (DW) ‐ Mixed ‐ stage III/IV (per lesion) Show forest plot | 1 | 165 |
| 62 Distant metastasis (incl brain) ‐ MRI (DW + VIBE) ‐ Mixed ‐ stage III/IV (per lesion) Show forest plot | 1 | 165 |
| 63 Bone metastasis ‐ CT‐ MIXED ‐ All data (per lesion) Show forest plot | 3 | 97 |
| 64 Bone metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion) Show forest plot | 3 | 99 |
| 65 Bone metastasis ‐ MRI (DW + VIBE) ‐ MIXED ‐ All data (per lesion) Show forest plot | 1 | 35 |
| 66 Bone metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 133 |
| 67 Liver metastasis ‐ CT‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 150 |
| 68 Liver metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 155 |
| 69 Liver metastasis ‐ MRI (DW + VIBE) ‐ Mixed ‐ stage III/IV (per lesion) Show forest plot | 1 | 27 |
| 70 Liver metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 94 |
| 71 Lung metastasis ‐ CT ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 325 |
| 72 Lung metastasis ‐ MRI ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 325 |
| 73 Lung metastasis ‐ MRI (DW + VIBE) ‐ Mixed ‐ stage III/IV (per lesion) Show forest plot | 1 | 45 |
| 74 Lung metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion) Show forest plot | 4 | 155 |
| 75 Soft tissue metastasis ‐ PET‐CT ‐ MIXED (per lesion) Show forest plot | 1 | 25 |
| 76 Local/subcutaneous metastasis ‐ CT ‐ MIXED (per lesion) Show forest plot | 3 | 139 |
| 77 Local/subcutaneous metastasis ‐ MRI ‐ MIXED (per lesion) Show forest plot | 3 | 148 |
| 78 Local/subcutaneous metastasis ‐ MRI (DW + VIBE) ‐ MIXED (per lesion) Show forest plot | 1 | 22 |
| 79 Local/subcutaneous metastasis ‐ PET‐CT ‐ MIXED (per lesion) Show forest plot | 3 | 102 |
| 80 Brain metastasis ‐ CT‐ MIXED ‐ All data (per lesion) Show forest plot | 1 | 20 |
| 81 Brain metastasis ‐ MRI (DW) ‐ MIXED ‐ All data (per lesion) Show forest plot | 1 | 20 |
| 82 Brain metastasis ‐ MRI (DW + VIBE) ‐ MIXED ‐ All data (per lesion) Show forest plot | 1 | 20 |
| 83 Brain metastasis ‐ PET‐CT ‐ MIXED ‐ All data (per lesion) Show forest plot | 1 | 9 |
| 93 'Other' metastasis ‐ CT ‐ Mixed ‐ Any stage (per lesion) Show forest plot | 1 | 26 |
| 94 'Other' metastasis ‐ MRI ‐ Mixed ‐ Any stage (per lesion) Show forest plot | 1 | 21 |
| 95 'Other' metastasis ‐ PET‐CT ‐ Mixed ‐ Any stage (per lesion) Show forest plot | 1 | 26 |
| 96 'Other' metastasis ‐ CT ‐ Mixed ‐ stage III/IV (per lesion) Show forest plot | 2 | 160 |
| 97 'Other' metastasis ‐ MRI ‐ Mixed ‐ stage III/IV (per lesion) Show forest plot | 2 | 160 |
| 98 'Other' metastasis ‐ PET‐CT ‐ Mixed ‐ stage III/IV (per lesion) Show forest plot | 1 | 25 |

