Antibióticos continuos versus antibióticos intermitentes para la bronquiectasia
Resumen
Antecedentes
La bronquiectasia es una enfermedad crónica de las vías respiratorias que se caracteriza por un ciclo destructivo de infección, inflamación y daño tisular recurrentes en las vías respiratorias. Los antibióticos son un tratamiento principal para la bronquiectasia. El objetivo del tratamiento continuo con antibióticos profilácticos es suprimir la carga bacteriana, aunque las bacterias se pueden volver resistentes a los antibióticos, y dar lugar a una pérdida de efectividad. Por otro lado, los antibióticos profilácticos intermitentes, administrados durante un período e intervalo predefinidos, pueden reducir la presión de la selección de los antibióticos y reducir o prevenir el desarrollo de resistencia. Esta revisión sistemática procuró evaluar la evidencia actual de los estudios que comparan la administración continua versus intermitente del tratamiento con antibióticos en la bronquiectasia con respecto a la eficacia clínica, la aparición de resistencia y los eventos adversos graves.
Objetivos
Evaluar la efectividad de los antibióticos administrados de forma continua versus intermitente en el tratamiento de los adultos y los niños con bronquiectasia, mediante el uso de los resultados primarios de las exacerbaciones, la resistencia a los antibióticos y los eventos adversos graves.
Métodos de búsqueda
El 1 de agosto de 2017 y el 4 de mayo de 2018 se hicieron búsquedas en el registro especializado del Grupo de Revisión Cochrane de Vías Respiratorias (Cochrane Airways Review Group Specialised Register) (CAGR), CENTRAL, MEDLINE, Embase, PsycINFO, CINAHL y en AMED. El 25 de septiembre de 2017 y el 4 de mayo de 2018 también se hicieron búsquedas en www.clinicaltrials.gov, en el portal de ensayos de la World Health Organization (WHO), en actas de congresos y en las listas de referencias de las revisiones sistemáticas existentes.
Criterios de selección
Se planificó incluir los ensayos controlados aleatorios (ECA) en adultos o niños con bronquiectasia que compararan la administración continua versus intermitente de antibióticos profilácticos a largo plazo, con una duración de al menos tres meses. Se incluyeron los estudios elegibles que se informaron como texto completo, los publicados solamente como resúmenes y los datos no publicados.
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, seleccionaron los resultados de la búsqueda y los informes de texto completo.
Resultados principales
Se identificaron 268 registros únicos. De éstos, se recuperaron y examinaron 126 informes de texto completo, que representan 114 estudios, pero ninguno de estos estudios cumplió con los criterios de inclusión.
Conclusiones de los autores
Ningún ensayo controlado aleatorio ha comparado la efectividad ni los riesgos del tratamiento continuo versus el tratamiento intermitente con antibióticos para la bronquiectasia. Se necesitan ensayos clínicos de alta calidad para establecer cuál de estas intervenciones es más efectiva para reducir la frecuencia y la duración de las exacerbaciones, la resistencia a los antibióticos y la aparición de eventos adversos graves.
PICO
Resumen en términos sencillos
¿Los antibióticos son más efectivos cuando se administran de forma continua o intermitente a los pacientes con bronquiectasia?
Antecedentes
La bronquiectasia es una enfermedad pulmonar incurable que se caracteriza por infecciones repetidas en las vías respiratorias. Los antibióticos son una forma importante de tratamiento y se pueden administrar a largo plazo para prevenir el desarrollo de infecciones en las vías respiratorias. Dicha administración podría ser continua o intermitente durante un período determinado. Sin embargo, actualmente no se conoce qué enfoque es el más efectivo para reducir la frecuencia y la duración de las exacerbaciones, manejar la resistencia a los antibióticos y minimizar los efectos secundarios.
Características de los estudios
El 1 de agosto de 2017, se buscó en una amplia variedad de fuentes para encontrar ensayos clínicos para la revisión. Se encontraron 268 resultados potencialmente relevantes pero, al examinarlos más de cerca, ninguno de los estudios cumplió con los criterios de la revisión y no se pudo incluir ninguno.
Conclusiones de los autores
No existe evidencia de alta calidad acerca de si la administración continua o la administración intermitente de antibióticos es más segura y más útil para los pacientes con bronquiectasia. Se necesitan más estudios de investigación para evaluar cuál de estos métodos es mejor para reducir las infecciones respiratorias, limitar la resistencia a la antibioticoterapia y reducir los efectos secundarios graves.
Conclusiones de los autores
Antecedentes
Descripción de la afección
La bronquiectasia es una enfermedad crónica de las vías respiratorias que se caracteriza por una destrucción y dilatación anormales de las vías respiratorias grandes, los bronquios y los bronquiolos (Pasteur 2010). Se caracteriza radiológicamente por la dilatación permanente de los bronquios, y desde el punto de vista clínico por un síndrome de tos, producción de esputo e infecciones respiratorias recurrentes (Chalmers 2014). La patogenia de la bronquiectasia se puede deber a la teoría del ciclo vicioso, mediante el cual un insulto inicial a las vías respiratorias da lugar a inflamación y daño de la pared bronquial y a un trastorno en la limpieza mucociliar, lo que predispone al paciente a una infección crónica o recurrente que resulta en un daño adicional a las vías respiratorias (Cole 1986; Chalmers 2013). La comprensión de este ciclo de colonización bacteriana persistente, inflamación crónica de la mucosa bronquial y destrucción tisular progresiva es fundamental para el tratamiento de la bronquiectasia debido a que se necesitan estrategias para detener los componentes inflamatorios y bacterianos, además de limitar la progresión de la lesión pulmonar (Cole 1997; Pasteur 2010). Las bacterias aisladas con más frecuencia de las vías respiratorias de los pacientes con bronquiectasia incluyen Haemophilus influenzae no tipificable, Pseudomonas aeruginosa, Streptococcus pneumoniae, Staphylococcus aureus y Moraxella catarrhalis (Foweraker 2011). Los agentes patógenos colonizantes como P aeruginosa, H influenzae y M catarrhalis , habitualmente también muestran resistencia a los antimicrobianos debido a los mecanismos de resistencia intrínsecos o de la exposición frecuente a los agentes antimicrobianos.
Aproximadamente la mitad de los casos que se presentan se clasifican como idiopáticos. La etiología asignada más comúnmente es la bronquiectasia posinfecciosa, un grupo heterogéneo que incluye a los pacientes con infecciones respiratorias de la niñez como tos ferina, neumonía bacteriana o tuberculosis (Pasteur 2010). El diagnóstico se basa en la identificación de uno o más bronquios dilatados anormalmente mediante la tomografía computarizada de alta resolución (HRCT) (Chang 2010; Pasteur 2010). Los objetivos principales del tratamiento terapéutico son la reducción de síntomas como la tos, la disnea y la expectoración, la reducción del número y la duración de las exacerbaciones y la mejoría en la calidad de vida (Pasteur 2010; Chalmers 2015).
La bronquiectasia era considerada una enfermedad relativamente poco frecuente, aunque estudios recientes han indicado un aumento de la prevalencia, en particular en las mujeres y las personas mayores de 60 años de edad (Weycker 2005; Roberts 2010; Seitz 2010) y tasas de prevalencia mayores en los países de ingresos bajos y medios (Habesoglu 2011). La prevalencia en Alemania en 2013 se calculó en 67 casos por 100 000 habitantes en general (Ringshausen 2015). En el Reino Unido, las tasas de prevalencia puntuales por 100 000 se elevaron de 350,5 a 566,1 en las mujeres y de 301,2 a 485,5 en los hombres durante un período de nueve años, lo que refleja un aumento de más del 60% y cerca de 263 000 adultos con bronquiectasia en 2013 (Quint 2016). De igual manera, las tasas de incidencia por 100 000 personas‐años durante el mismo período se elevaron de 21,2 a 35,2 en las mujeres y de 18,2 a 26,9 en los hombres, un aumento del 63%, con más de 15 000 casos nuevos en 2013. Las tasas de mortalidad promedio europeas por 100 000 habitantes en general se calculan en 0,3 en 27 de los 28 países de la UE y a 0,2 en nueve países que no pertenecen a la UE, sobre la base de datos de 2005 a 2009 (European Lung White Book 2013). Las tasas de mortalidad recientes del Reino Unido ajustadas por edad son 2,26 veces mayores en las mujeres y 2,14 veces mayores en los hombres en comparación con la población general (Quint 2016).
La enfermedad tiene una repercusión significativa en los niños y se observa una calidad de vida peor en los niños más pequeños y en los que presentan exacerbaciones más frecuentes (Kapur 2012). La bronquiectasia también es más común en algunos grupos indígenas en los que la prevalencia puede alcanzar una cifra de 16 por 1000 entre los niños del sudoeste de Alaska, de 15 por 1000 en los niños aborígenes australianos y en los isleños del Estrecho de Torres (Chang 2002). Además, un estudio informó una incidencia de 3,7 por 100 000 por año en los niños menores de 15 años de edad de Nueva Zelanda. Estas cifras se equiparan a una prevalencia general de uno por 3000 niños y uno por 625 niños del Pacífico (Twiss 2005). Lo anterior también demuestra que la tasa de incidencia entre los niños de Nueva Zelanda es casi siete veces mayor que en los de Finlandia (Twiss 2005).
Se ha citado la mejoría en el diagnóstico como resultado de un acceso más fácil a los escáneres de TC de alta calidad, y el mayor conocimiento de los síntomas habituales de la bronquiectasia y de otras enfermedades pulmonares, como factores que contribuyen a una mayor prevalencia (Goeminne 2016).
La bronquiectasia impone una carga mayor en los sistemas de asistencia sanitaria internacionalmente (Chalmers 2015; Redondo 2016), y los pacientes tienen una tasa alta de exacerbaciones, ingresos hospitalarios y mortalidad atribuible (Chalmers 2015). Los datos del registro europeo de bronquiectasia indican que cerca de la mitad de los pacientes con bronquiectasia tienen dos o más exacerbaciones por año y un tercio es hospitalizado al menos una vez al año (Polverino 2017). Los pacientes con colonización por P aeruginosa y los que presentan una tasa anual de exacerbación más frecuente tienen una disminución acelerada en la función pulmonar, una reducción en la calidad de vida relacionada con la salud (medida con el St George's Respiratory Questionnaire, SGRQ), un mayor riesgo de hospitalización y un mayor riesgo de mortalidad (Evans 1996; Wilson 1997; Martínez‐García 2007, Polverino 2017). Los antecedentes de exacerbaciones y en particular de exacerbaciones graves, un índice de masa corporal bajo, la infección bacteriana crónica, un porcentaje teórico bajo en el volumen espiratorio forzado en un segundo (VEF₁), una proporción mayor de lóbulos afectados y la mayor disnea también se asocian con un mayor riesgo de hospitalización y mortalidad (Seitz 2010; Chalmers 2014; Rogers 2014).
Este caso se observa en particular con la infección por P aeruginosa. Una revisión sistemática de estudios observacionales identificó que la infección por P aeruginosa se asocia con un aumento del triple en el riesgo de mortalidad, un aumento de siete veces en el riesgo de ingreso hospitalario y un promedio de una exacerbación adicional por paciente por año.
La atención de la bronquiectasia se asocia con un uso significativo de recursos. Un estudio español reciente informó un costo médico anual directo medio para los pacientes adultos con bronquiectasia de EUR 4671; que aumenta con la gravedad de la enfermedad (de la Rosa 2016). Además, factores como el porcentaje teórico del VEF₁, la edad, la colonización por Pseudomonas y la hospitalización pueden influir, de forma independiente, en los costos de asistencia sanitaria. Un estudio realizado en los EE.UU. informó un aumento anual de USD 2319 en los costos globales y de USD 1607 en los costos relacionados con las enfermedades respiratorias en los pacientes con bronquiectasia en comparación con casos y controles pareados, que se atribuye principalmente a un aumento de dos visitas a la atención ambulatoria y 1,6 visitas relacionadas con enfermedades respiratorias por paciente por año (Joish 2013).
Descripción de la intervención
Los antibióticos que intentan tratar las infecciones bacterianas de las vías respiratorias o controlar la colonización bacteriana, o ambos, representan un componente fundamental del tratamiento de la bronquiectasia, debido a que reducen la carga bacteriana, la inflamación, y la destrucción tisular consiguiente en las vías respiratorias (Chalmers 2012). Los antibióticos profilácticos a largo plazo, administrados durante más de tres meses, han demostrado ser efectivos en los pacientes con exacerbaciones frecuentes de la bronquiectasia o en los que presentan menos exacerbaciones que causan morbilidad significativa, debido a que parecen disminuir la frecuencia y la gravedad de las exacerbaciones, a expensas de un aumento significativo del riesgo de farmacorresistencia emergente (Hnin 2015). Los pacientes que reciben antibióticos continuos presentan un riesgo más de tres veces mayor de resistencia bacteriana en comparación con los que no los reciben (Hnin 2015). Los agentes patógenos aislados en los cultivos de esputo de dichos pacientes durante una exacerbación o en la enfermedad estable, como P aeruginosa, H influenzae o M catarrhalis, habitualmente muestran resistencia a los antimicrobianos debido a los mecanismos de resistencia intrínsecos o a la exposición frecuente a los agentes antimicrobianos. También existe un riesgo de efectos adversos relacionados con los antibióticos, como la deficiencia en la audición y la cardiotoxicidad (Serisier 2013).
Los ensayos controlados aleatorios (ECA) han evaluado diferentes formas de administración, a saber oral, intravenosa e inhalada y diferentes clases de antibióticos que incluyen, pero no se limitan a los macrólidos, las quinolonas o las polimixinas. Se han descrito dos estrategias para la administración de los antibióticos a largo plazo: administración (I) continua y (ii) intermitente. A diferencia de la administración continua, la intermitente se refiere a la administración profiláctica repetida de ciclos de antibióticos con una duración e intervalos predefinidos. Los ejemplos incluyen un ciclo corto de antibióticos todos los meses; un mes sí y un mes no; o durante los meses de invierno. Esta revisión procuró incluir la antibioticoterapia intermitente en la que la administración se realiza a intervalos regulares predefinidos durante un período de al menos tres semanas, y en la que los pacientes no reciben antibióticos profilácticos concomitantes. Se intentó comparar la administración continua versus intermitente de antibióticos profilácticos a largo plazo durante al menos tres meses.
De qué manera podría funcionar la intervención
Hay una relación fuerte entre la infección bacteriana de las vías respiratorias y la morbilidad por enfermedades en la bronquiectasia; por ejemplo, los pacientes con infección crónica por P aeruginosa tienen un aumento del triple en la mortalidad, un aumento de 6,5 veces en la tasa de ingreso hospitalario y un promedio de una exacerbación adicional por paciente por año, en comparación con los pacientes sin infección crónica por P aeruginosa (Finch 2015). Otras bacterias habitualmente aisladas como la H influenzae y la M catarrhalis también dan lugar a un aumento de la inflamación neutrofílica (Chalmers 2012); y se asocian con un mayor riesgo de exacerbaciones graves (Chalmers 2014). El objetivo del tratamiento con antibióticos es suprimir la inflamación neutrofílica, reducir la carga bacteriana y así mejorar los resultados clínicos (Brodt 2014). La administración continua del tratamiento con antibióticos se basa en la presuposición de que la infección crónica no se puede erradicar y, por lo tanto, se debe suprimir continuamente para prevenir el retorno de la carga bacteriana, el aumento de la inflamación y la recurrencia de los síntomas (Haworth 2014).
El argumento en contra de la exposición continua a los antibióticos es que da lugar a una mayor resistencia bacteriana y, en consecuencia, el tratamiento puede perder efectividad (Chalmers 2015). Por el contrario, la administración intermitente de los antibióticos podría eliminar o limitar la presión de la selección de los antibióticos y, de esta manera, prevenir la aparición de resistencia, aunque los antibióticos intermitentes también podrían ser menos efectivos. Aunque hay una falta de datos sobre la repercusión de la administración intermitente versus continua de los antibióticos en el desarrollo de resistencia a los antibióticos entre los pacientes con bronquiectasia, hay alguna evidencia indirecta. Por ejemplo, en un análisis retrospectivo grande de pacientes sometidos a ventilación mecánica con infecciones nosocomiales (40% con enfermedad pulmonar crónica), un intervalo de al menos 20 días entre las series de antibióticos se asoció con una reducción del 24% en la aparición de resistencia (Hui 2013).
Una ventaja adicional de la administración de antibióticos intermitentes es la reducción en la carga de tratamiento de los pacientes, debido a que la administración continua puede dar lugar a más efectos secundarios como resultado de la exposición acumulativa mayor del paciente a los antibióticos.
Por qué es importante realizar esta revisión
Aunque los tratamientos con antibióticos a largo plazo, administrados por vía oral y mediante inhalación, forman parte de la atención estándar de los pacientes con bronquiectasia (Chalmers 2015), no hay acuerdo sobre el método óptimo de administración de las antibioticoterapias. La práctica habitual incluye la administración de antibióticos orales e inhalados de forma diaria (Altenburg 2013; Haworth 2014), en días alternos (Wong 2012), un mes sí y un mes no (Barker 2014) o durante los meses de invierno cuando los pacientes pueden presentar más exacerbaciones. Las guías internacionales no pueden formular observaciones sobre qué método de administración de antibióticos es más efectivo o se asocia con las tasas más bajas de eventos adversos o de resistencia a los antibióticos. Un grupo de estudio de la European Respiratory Society/European Bronchiectasis Network (EMBARC) produjo 22 recomendaciones de consenso para los estudios de investigación futuros sobre la bronquiectasia, que incluyeron que "Los estudios deben evaluar si la administración cíclica o continua de antibióticos a largo plazo es superior en cuanto a la eficacia clínica y a la aparición de resistencia" (Aliberti 2016). Debido a que lo anterior se consideró una pregunta clínica importante por los pacientes y los médicos, esta revisión sistemática procuró evaluar la evidencia actual sobre la administración continua versus intermitente del tratamiento con antibióticos en la bronquiectasia.
Objetivos
Evaluar la efectividad de los antibióticos administrados de forma continua versus intermitente en el tratamiento de los adultos y los niños con bronquiectasia, mediante el uso de los resultados primarios de las exacerbaciones, la resistencia a los antibióticos y los eventos adversos graves.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se planificó incluir ensayos controlados aleatorios (ECA) y ensayos con asignación al azar grupal. También se planificó incluir estudios cruzados, pero sólo utilizar los datos de la primera fase previa al cruzamiento para eliminar los efectos de arrastre potencialmente irreversibles (p.ej., resistencia a los antibióticos). También se planificó incluir los estudios informados en texto completo, los publicados como resumen solamente y los datos no publicados.
Tipos de participantes
Se planificó incluir pacientes adultos y niños (< 18 años de edad) diagnosticados con bronquiectasia mediante broncografía o tomografía computarizada que informaran signos o síntomas diarios, como tos, producción de esputo o que presentaran episodios recurrentes de infecciones respiratorias. Los estudios se habrían excluido si los participantes habían recibido un diagnóstico de fibrosis quística (FQ) o aspergilosis broncopulmonar alérgica activa. Se planificó analizar los datos de niños y adultos por separado.
Tipos de intervenciones
El objetivo fue comparar la administración continua versus intermitente de antibióticos profilácticos a largo plazo durante un período de al menos tres meses. El método de administración debía ser el mismo en todos los grupos de estudio, p.ej., nebulizado versus nebulizado, para considerar el efecto del antibiótico en lugar del efecto del dispositivo de administración.
Se consideró administración intermitente de antibióticos, siempre que hubiera intervalos regulares predefinidos de administración de antibióticos seguidos de una duración de al menos tres semanas donde los participantes no recibían antibióticos profilácticos (p.ej., un ciclo corto de antibióticos por mes; un mes sí y un mes no; o durante los meses de invierno). Los antibióticos administrados sin intervalos de ningún antibiótico durante el período del estudio se consideraron continuos.
Tipos de medida de resultado
Resultados primarios
-
Exacerbaciones (frecuencia, proporción con una o más, duración, tiempo transcurrido hasta la próxima exacerbación), definidas según los criterios de los autores de los estudios.
-
Resistencia a los antibióticos, definida como la presencia de resistencia a los antibióticos después de la administración de antibióticos durante al menos tres meses o el desarrollo de resistencia a los antibióticos en el plazo de al menos tres meses desde la administración de antibióticos. Se planificó evaluar solamente la resistencia al/a los antibiótico/s investigado/s.
-
Eventos adversos graves.
Resultados secundarios
-
Calidad de vida relacionada con la salud mediante medidas validadas en un ámbito clínico (p.ej., SGRQ, Leicester Cough Questionnaire [LCQ], cuestionario Quality of Life‐Bronchiectasis [QoL‐B]).
-
Ingresos hospitalarios debido a las exacerbaciones (frecuencia, duración), definidos según los criterios de los autores de los estudios.
-
Mortalidad (se planificó extraer e informar si la mortalidad se definió como por todas las causas o relacionada con la bronquiectasia en los estudios individuales).
-
Volumen y color del esputo.
-
Síntomas (tos, disnea, sibilancias).
-
Función pulmonar medida como volumen espiratorio forzado en un segundo (VEF₁) (litros o porcentaje teórico).
-
Capacidad de ejercicio (p.ej., Six‐Minute Walk Test o Incremental Shuttle Walk Test).
-
Eventos adversos/efectos secundarios.
Se planeó usar las definiciones de Edwards 2000 y Hansen 2015 para eventos adversos graves y eventos adversos de la siguiente manera.
-
Los eventos adversos graves son los que dan lugar a la muerte o a eventos potencialmente mortales; necesidad de hospitalización o prolongación de la estancia hospitalaria; discapacidad persistente o significativa; o malformaciones congénitas; o son eventos considerados médicamente importantes.
-
Los eventos adversos son cualquier hecho desfavorable que se presenta mientras un paciente recibe un fármaco, pero que no necesariamente tiene una relación causal con el tratamiento. No son detectables por el paciente; generalmente se identifican mediante pruebas de laboratorio (p.ej., pruebas bioquímicas, hematológicas, inmunológicas, radiológicas y patológicas); o mediante investigaciones clínicas (p.ej., endoscopia gastrointestinal, cateterismo cardíaco).
El informe en el estudio de uno o más de los resultados enumerados en la presente revisión no fue un criterio de inclusión para la revisión.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We identified studies from the Cochrane Airways Group Register of Trials, which is maintained by the Information Specialist for the Group. The Cochrane Airways Trials Register contains studies identified from several sources, as follows.
-
Monthly searches of the Cochrane Central Register of Controlled Trials (CENTRAL, in the Cochrane Library), through the Cochrane Register of Studies Online (crso.cochrane.org);
-
Weekly searches of MEDLINE Ovid SP 1946 to date;
-
Weekly searches of Embase Ovid SP 1974 to date;
-
Monthly searches of PsycINFO Ovid SP;
-
Monthly searches of CINAHL EBSCO (Cumulative Index to Nursing and Allied Health Literature);
-
Monthly searches of AMED EBSCO (Allied and Complementary Medicine); and
-
Handsearches of the proceedings of major respiratory conferences.
We identified studies contained in the Trials Register through search strategies based on the scope of the Cochrane Airways Group. Details of these strategies, as well as a list of handsearched conference proceedings, are in Appendix 1. See Appendix 2 for search terms used to identify studies for this review.
We searched the following trials registries.
-
US National Institutes of Health Ongoing Trials Register ClinicalTrials.gov (www.ClinicalTrials.gov);
-
World Health Organization International Clinical Trials Registry Platform (apps.who.int/trialsearch).
We searched the Cochrane Airways Trials Register and additional sources from inception to 1 August 2017 and registries on 25 September 2017, with no restriction on language of publication.
Búsqueda de otros recursos
We checked the reference lists of all primary studies and review articles for additional references. We searched relevant manufacturers' websites for study information.
We planned to search for errata or retractions from included studies published in full text on PubMed and to report the date this was done within the review.
Obtención y análisis de los datos
Selección de los estudios
Two review authors (SM and TD) independently screened the titles and abstracts of the search results and coded them as 'retrieve' (eligible or potentially eligible/unclear) or 'do not retrieve'. We retrieved the full‐text study reports of all potentially eligible studies and two review authors (SM and TD) independently screened them for inclusion, recording the reasons for exclusion of ineligible studies. We resolved disagreement through discussion or, if it had been necessary, we planned to consult a third review author (JC). We identified and excluded duplicates and collated multiple reports of the same study so that each study, rather than each report, was the unit of interest in the review. We recorded the selection process in sufficient detail to complete a PRISMA flow diagram and 'Characteristics of excluded studies' table (Moher 2009).
Extracción y manejo de los datos
We planned to use a data collection form for study characteristics and outcome data, that had been piloted on at least one study in the review. One review author (TD) would have extracted the following study characteristics from included studies.
-
Methods: study design, total duration of study, details of any 'run‐in' period, number of study centres and location, study setting, withdrawals and date of study.
-
Participants: N, mean age, age range, gender, severity of condition, diagnostic criteria, baseline lung function, smoking history, inclusion criteria and exclusion criteria.
-
Interventions: intervention, comparison, concomitant medications and excluded medications.
-
Outcomes: primary and secondary outcomes specified and collected, and time points reported.
-
Notes: funding for studies and notable conflicts of interest of trial authors.
We planned for two review authors (TD and LF) to independently extract outcome data from included studies. We planned to note in the 'Characteristics of included studies' table where outcome data were not reported in a usable way. We planned to resolve disagreements by consensus or by involving a third review author (JC). We also planned for one review author (TD) to transfer data into the Review Manager 5 file (Review Manager 2014); and to double‐check that data were entered correctly by comparing the systematic review with the study reports. We planned for a second review author (LF) to spot‐check study characteristics for accuracy against the study report.
Evaluación del riesgo de sesgo de los estudios incluidos
We planned for two review authors (LF and TD) to independently assess risk of bias for each study using the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011); and to resolve disagreements by discussion or by involving another author (SM). We planned to assess the risk of bias according to the following domains.
-
Random sequence generation.
-
Allocation concealment.
-
Blinding of participants and personnel.
-
Blinding of outcome assessment.
-
Incomplete outcome data.
-
Selective outcome reporting.
-
Other bias.
We planned to judge each potential source of bias as high, low or unclear and provide a quote from the study report together with a justification for our judgement in the 'Risk of bias' table. We also planned to summarise the risk of bias judgements across different studies for each of the domains listed. We planned to consider blinding separately for different key outcomes where necessary (e.g. for unblinded outcome assessment, risk of bias for all‐cause mortality may be very different than for a patient‐reported pain scale). Where information on risk of bias related to unpublished data or correspondence with a trialist, we planned to note this in the 'Risk of bias' table.
When considering treatment effects, we planned to take into account the risk of bias for the studies that contributed to that outcome.
Assessment of bias in conducting the systematic review
We conducted the review according to the published protocol and planned to justify any deviations from it in the 'Differences between protocol and review' section of the systematic review.
Medidas del efecto del tratamiento
We planned to analyse dichotomous data as odds ratios, and continuous data as mean differences or standardised mean differences. We planned to enter data presented as a scale with a consistent direction of effect.
We planned to undertake meta‐analyses only when it was meaningful (i.e. when treatments, participants and the underlying clinical question were similar enough for pooling to make sense).
We planned to narratively describe skewed data reported as medians and interquartile ranges.
If multiple trial arms had been reported in a single trial, we planned to include only the relevant arms. If two comparisons (e.g. drug A versus placebo and drug B versus placebo) had been combined in the same meta‐analysis, we planned to halve the control group to avoid double‐counting.
Cuestiones relativas a la unidad de análisis
If we had included any studies, the unit of analysis would have been the participant. In terms of exacerbation rates and hospitalisation rates, we planned to focus on the number of events experienced by the participant during the trial and to analyse the results using rate ratios if possible. We planned to use adjusted data where it was available (e.g. rate ratios from Poisson regression models, or mean differences from ANOVA or results from cluster randomised studies adjusted for cluster effect) as a first choice, followed by change scores and final scores as last choice.
Manejo de los datos faltantes
We planned to contact investigators or study sponsors in order to verify key study characteristics and to obtain missing numerical outcome data where possible (e.g. when a study was only identified as an abstract). Where this was not possible, and missing data were thought to introduce serious bias, we planned to take this into consideration in the GRADE rating for affected outcomes.
Evaluación de la heterogeneidad
We planned to use the I² statistic to measure heterogeneity among the studies in each analysis; and if we had identified substantial heterogeneity, to report it and explore possible causes using the prespecified subgroup analyses.
Evaluación de los sesgos de notificación
If we had been able to pool more than 10 studies, we would have created and examined a funnel plot to explore possible small‐study and publication biases.
Síntesis de los datos
We planned to conduct meta‐analyses when the population, interventions, outcomes and study designs were similar. In the presence of substantial heterogeneity (> 50%), we planned to report outcomes in the text, giving direction and size of the effect along with the strength of the evidence (risk of bias). We envisaged that antibiotic studies would vary by population, design, and outcomes, and therefore meta‐analysis using a random‐effects model would be most appropriate. However, where there are few studies or the effects of interventions across studies are not randomly distributed (e.g. with publication bias), the estimates from a random‐effects model may be unreliable or biased. It was likely that this review would only include a small number of low‐powered studies, and we had therefore planned to use a fixed‐effect model, reported with 95% confidence intervals (CI), and to evaluate the impact of model choice using a sensitivity analysis. We planned to synthesise and report dichotomous and continuous data separately for each outcome (e.g. exacerbation/no exacerbation or exacerbation duration). Where end‐of‐study point estimates and change from baseline scores were reported, we planned to analyse these separately. Furthermore, we planned to use standardised mean differences (SMD) when outcomes were measured using different scales (e.g. health‐related quality of life measures) and to use the baseline standard deviation (SD) for SMD analyses.
'Summary of findings' table
We planned to create a 'Summary of findings' table using the following outcomes: exacerbations; antibiotic resistance; serious adverse events; hospitalisations; mortality; symptoms; and quality of life. We planned to use the five GRADE considerations (risk of bias, consistency of effect, imprecision, indirectness and publication bias) to assess the overall quality of the evidence in terms of the studies that contributed data to the prespecified outcomes. We planned to use the methods and recommendations described in Section 8.5 and Chapter 12 of the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011), using GRADEpro software (GRADEpro GDT); and to justify all decisions to downgrade the quality of studies using footnotes. We planned to include comments to aid the reader's understanding of the review where necessary.
Análisis de subgrupos e investigación de la heterogeneidad
We planned to carry out the following subgroup analyses.
-
Mode of delivery (e.g. oral, nebulised).
-
Antibiotic class (e.g. macrolide).
-
Duration participants colonised with P aeruginosa.
-
Specifically for the outcome antibiotic resistance, we planned subgroup analyses according to the definition of antibiotic resistance (presence of antibiotic resistance versus development of antibiotic resistance, following at least three months' administration of antibiotics).
We planned to use the following outcomes in subgroup analyses.
-
Exacerbations.
-
Antibiotic resistance.
-
Serious adverse events.
We planned to use the formal test for subgroup interactions in Review Manager 5 (Review Manager 2014).
Análisis de sensibilidad
We planned to evaluate the impact of methodological quality using the following domains to remove studies at high or unclear risk of bias.
-
Random sequence generation.
-
Allocation concealment.
We planned to compare the results from a fixed‐effect model with the random‐effects model.
Results
Description of studies
Results of the search
We identified 268 study reports in our database searches on 1 August and 25 September 2017, and 4 May 2018. We also searched the USA National Institutes of Health Ongoing Trials Register (www.ClinicalTrials.gov), the World Health Organization International Clinical Trials Registry Platform (apps.who.int/trialsearch), conference proceedings and the reference lists of existing systematic reviews. We identified 13 additional records through other sources (WHO trials portal) but they were not relevant to our inclusion criteria Figure 1
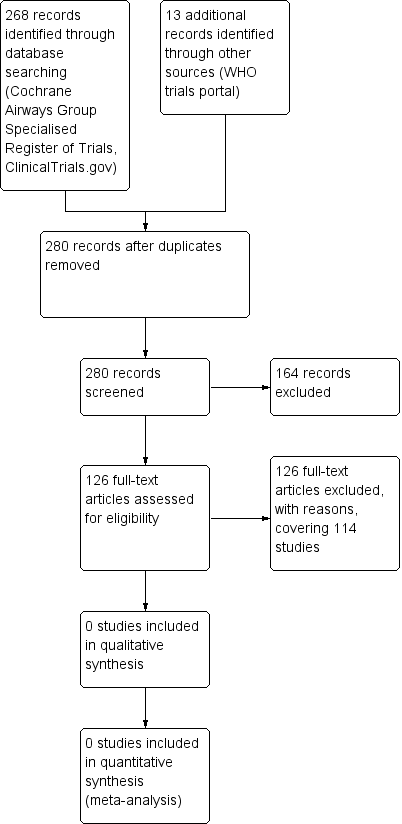
Study flow diagram.
Included studies
We did not identify any studies relevant to our inclusion criteria.
Excluded studies
One hundred and twenty‐six study reports (covering 114 studies) were excluded, with reasons, from original database searches following inspection of the study report (Characteristics of excluded studies). Sixty‐seven (59%) were not randomised studies (and were also otherwise not relevant to our inclusion criteria), 23 (20%) compared an antibiotic versus placebo, 12 (10%) compared different antibiotics, five (4%) made a comparison between doses of the same antibiotic, two (2%) were excluded on the basis of the study having no relevance to the condition. The following were also excluded: Juqin mixture (Chinese medicine) aerosol inhalation plus standard care versus standard care alone, one (1%); comparison between Pidotimod versus no treatment, one (1%); comparison between herbal decoction with standard decoction, one (1%); comparison between colistimethate sodium versus saline solution, one (1%); and the one remaining record (1%) was a letter.
Risk of bias in included studies
No studies met the review inclusion criteria (Criteria for considering studies for this review). We were therefore unable to conduct the planned assessment risk of bias.
Effects of interventions
We were unable to evaluate the effectiveness of continuous versus intermittent antibiotics for bronchiectasis given the absence of studies meeting our inclusion criteria.
Discusión
Resumen de los resultados principales
Se planificó evaluar la efectividad de la administración continua versus intermitente de los antibióticos para la bronquiectasia con respecto a los resultados predefinidos. A pesar de una búsqueda exhaustiva, no se identificaron ensayos aleatorios que cumplieran los criterios de inclusión predeterminados (Criterios para considerar los estudios para esta revisión), lo que revela una escasez de evidencia en esta área.
Compleción y aplicabilidad general de las pruebas
No fue posible evaluar la completitud ni la aplicabilidad de la evidencia debido a que ningún estudio cumplió los criterios de inclusión.
Calidad de la evidencia
No fue posible considerar la calidad de la evidencia debido a que no se incluyeron estudios en esta revisión.
Sesgos potenciales en el proceso de revisión
Se realizó una búsqueda extensiva e integral de los estudios relevantes, con el apoyo de los expertos del Grupo Cochrane de Vías Respiratorias (Cochrane Airways Group). Se realizaron búsquedas en nueve bases de datos y se obtuvo la traducción de todas las publicaciones no inglesas potencialmente relevantes identificadas en las búsquedas.
Acuerdos y desacuerdos con otros estudios o revisiones
Aunque no se identificaron otras revisiones sistemáticas relevantes ni ensayos clínicos en las búsquedas, en la práctica clínica la administración continua e intermitente de los antibióticos se utiliza con justificaciones contrapuestas (Chalmers 2015). El tratamiento con antibióticos intermitentes puede ayudar a limitar la resistencia ya que, aunque los antibióticos se seleccionan según las bacterias resistentes, la resistencia a menudo conlleva un "costo de la adaptación" para las bacterias, lo que significa que una vez que se interrumpen los antibióticos, entonces se multiplican los microorganismos resistentes (Melnyk 2015). Esta es la razón por la que los antibióticos inhalados se suelen administrar en ciclos de 28 días con 28 días de descanso entre los ciclos. Se han realizado dos ensayos de aztreonam lisina con un régimen intermitente en la bronquiectasia (Barker 2014), aunque muchos antibióticos que incluyen la tobramicina y el aztreonam en la fibrosis quística se administran de forma intermitente (Elborn 2016). En un metanálisis de redes la administración continua de colistina inhalada se comparó de forma indirecta con la administración intermitente de tobramicina y aztreonam inhalados para los pacientes con fibrosis quística e infección por Pseudomonas. Se encontraron eficacias equivalentes entre estos brazos; sin embargo, sus resultados son limitados por la pequeña población general estudiada y la heterogeneidad (Littlewood 2012). Existe una falta de evidencia de que este enfoque limita la resistencia en la bronquiectasia. Un beneficio agregado de la administración intermitente de los antibióticos inhalados es que la administración de la antibioticoterapia inhalada puede tomar mucho tiempo, por lo que la administración menos frecuente puede mejorar el cumplimiento (McCullough 2014). Algunas preparaciones también son costosas y la administración intermitente puede limitar los costos. En la administración oral de antibióticos, algunos estudios indican que las exacerbaciones de la bronquiectasia son estacionales; por ejemplo, Bibby y colegas indicaron que los ingresos debido a la bronquiectasia fueron más frecuentes en el invierno y la primavera (Bibby 2015). Por lo tanto, la práctica común en algunos países es administrar antibióticos profilácticos sólo durante el invierno.
Por el contrario, el argumento a favor de la administración continua de los antibióticos es que la carga bacteriana en las vías respiratorias, que es suprimida por los antibióticos, vuelve a los niveles iniciales después de alrededor de 14 días desde la interrupción de los antibióticos y provoca una mayor inflamación de las vías respiratorias (Chalmers 2012; Wilson 2013). Los estudios de azitromicina y gentamicina nebulizada han mostrado que el efecto beneficioso del tratamiento se pierde una vez que se interrumpe el fármaco, aunque el seguimiento en ambos estudios fue solo de tres meses.(Murray 2011; Altenburg 2013).

Study flow diagram.

