Tratamiento adyuvante con antidepresivos para la enfermedad intestinal inflamatoria
Resumen
Antecedentes
Los síntomas de ansiedad y depresión son frecuentes en la enfermedad intestinal inflamatoria (EII). Cerca de un 30% de pacientes con EII toma antidepresivos. Sin embargo, no hay guías actuales para el tratamiento con antidepresivos de la ansiedad y la depresión concomitante en pacientes con EII y tampoco existen datos claros sobre la función de los antidepresivos en el control de los síntomas físicos de la EII.
Objetivos
Los objetivos fueron evaluar la eficacia y la seguridad de los antidepresivos para el tratamiento de la ansiedad y la depresión en la EII y para evaluar los efectos de los antidepresivos sobre la calidad de vida (CdV) y el control de la actividad de la EII.
Métodos de búsqueda
Se hicieron búsquedas en MEDLINE; Embase, CINAHL, PsycINFO, CENTRAL y en el registro especializado del Grupo Cochrane de Enfermedad Inflamatoria Intestinal y Trastornos Funcionales del Intestino (EII/TFI) (Cochrane IBD/FBD Group Specialized Register) desde su inicio hasta el 23 agosto 2018. También se realizaron búsquedas en las listas de referencias, registros de ensayos, actas de congresos y literatura gris.
Criterios de selección
Se incluyeron ensayos controlados aleatorios (ECA) y estudios observacionales que compararan cualquier tipo de antidepresivo con un placebo, ningún tratamiento o un tratamiento activo para la EII.
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, examinaron los resultados de la búsqueda, extrajeron los datos y evaluaron el sesgo mediante la herramienta Cochrane riesgo de sesgo. Se utilizó la Newcastle‐Ottawa Scale para evaluar la calidad de los estudios observacionales. Se utilizaron los criterios GRADE para evaluar la certeza de la evidencia que apoyaba los resultados. Los resultados primarios incluyeron ansiedad y depresión. Se evaluó la ansiedad con la Hospital Anxiety and Depression Scale (HADS) o la Hamilton Anxiety Rating Scale (HARS). La depresión se evaluó con la HADS o el Beck Depression Inventory. Los resultados secundarios fueron: los eventos adversos (EA), los EA graves, los retiros debidos a los EA, la calidad de vida (CdV), la remisión clínica, la recaída, el dolor, los ingresos hospitalarios, la cirugía y la necesidad de tratamiento con corticosteroides. La CdV se evaluó con el WHO‐QOL‐BREF questionnaire. Para los resultados dicotómicos, se calculó el cociente de riesgos (CR) y los intervalos de confianza (IC) del 95% correspondientes. Para los resultados continuos, se calculó la diferencia de medias (DM) con IC del 95%. En el análisis se utilizó un modelo de efectos fijos.
Resultados principales
Se incluyeron cuatro estudios (188 participantes). Dos estudios eran ECA doble ciego; uno era un ensayo controlado no aleatorio; y otro era un estudio observacional retrospectivo pareado por casos. La edad de los participantes varió de 27 a 37,8 años. En tres estudios los participantes presentaban EII inactiva, y en otro, EII activa o inactiva. Los participantes de un estudio presentaban ansiedad o depresión concomitante. Un estudio usó duloxetina (60 mg diarios); otro usó fluoxetina (20 mg diarios); otro, tianeptina (36 mg diarios); y otro, varios antidepresivos en intervalos clínicos. Tres estudios tuvieron controles de placebo, y otro tuvo un grupo de control sin tratamiento. Un ECA se evaluó como de riesgo de sesgo bajo, y el otro, alto (datos de resultado incompletos). El ensayo controlado no aleatorio se calificó de alto riesgo de sesgo (generación de la secuencia aleatoria, ocultación de la asignación, cegamiento). El estudio observacional se calificó como de calidad metodológica alta, pero aún se considera en riesgo de sesgo alto por el diseño observacional.
Es incierto el efecto de los antidepresivos sobre la ansiedad y la depresión. A las 12 semanas, la media de la puntuación de ansiedad en los participantes con antidepresivos fue de 6,11 + 3 en comparación con 8,5 + 3,45 en los participantes que recibieron el placebo (DM ‐2,39; IC del 95%: ‐4,30 a ‐0,48; 44 participantes, evidencia de certeza baja). A los 12 meses, la media de la puntuación de ansiedad en los participantes con antidepresivos fue de 3,8 + 2,5 en comparación con 4,2 + 4,9 en los participantes que recibieron el placebo (DM ‐0,40; IC del 95%: ‐3,47 a 2,67; 26 participantes; evidencia de certeza baja). A los 12 meses, la media de la puntuación de depresión en los participantes que recibieron antidepresivos fue de 7,47 + 2,42 en comparación con 10,5 + 3,57 en los que recibieron el placebo (DM ‐3,03; IC del 95%: ‐4,83 a ‐1,23; 44 participantes; evidencia de certeza baja). A los 12 meses, la media de la puntuación de depresión en los participantes con antidepresivos fue de 2,9 + 2,8 en comparación con 3,1 + 3,4 en los participantes que recibieron el placebo (DM ‐0,20; IC del 95%: ‐2,62 a 2,22; 26 participantes; evidencia de certeza baja).
Es incierto el efecto de los antidepresivos sobre los EA. Un 57% (8/14) de los participantes del grupo de antidepresivos informaron de EA en comparación con un 25% (3/12) de los participantes que recibieron el placebo (CR 2,29; IC del 95%: 0,78 a 6,73; evidencia de certeza baja). Los EA informados con más frecuencia fueron: náuseas, cefalea, mareos, somnolencia, trastornos sexuales, insomnio, fatiga, estado de ánimo bajo/ansiedad, sensación de sequedad en la boca, espasmos musculares y sofocos. Ninguno de los estudios incluidos informó de EA graves. Ninguno de los estudios incluidos informó sobre el dolor.
Un estudio (44 participantes) informó sobre la CdV a las 12 semanas, y otro (26 participantes) a los 12 meses. La CdV física, psicológica, social y ambiental mejoró a las 12 semanas en comparación con el placebo (evidencia de certeza baja). No hubo diferencias grupales en la CdV a los 12 meses (evidencia de certeza baja). No se sabe el efecto de los antidepresivos sobre el mantenimiento de la remisión clínica y la recaída endoscópica. A los 12 meses, un 64% (9/14) de los participantes del grupo de antidepresivos mantuvo la remisión clínica en comparación con un 67% (8/12) de los participantes que recibieron el placebo (CR 0,96; IC del 95%: 0,55 a 1,69; evidencia de certeza baja). A los 12 meses, ninguno (0/30) de los participantes del grupo de antidepresivos presentó recaída endoscópica en comparación con un 10% (3/30) de los participantes que recibieron el placebo (CR 0,14; IC del 95%: 0,01 a 2,65; evidencia de certeza muy baja).
Conclusiones de los autores
Los hallazgos de los resultados evaluados en esta revisión son inciertos, por lo que no se pueden establecer conclusiones definitivas con respecto a la eficacia y la seguridad de los antidepresivos en la EII. Los estudios futuros deben emplear diseños de ECA, con un seguimiento más prolongado y proponer soluciones para el abandono. Se recomienda firmemente la inclusión de marcadores objetivos de actividad de la enfermedad al igual que el análisis de antidepresivos de diferentes clases, ya que en la actualidad no se sabe si algún antidepresivo (o clase) tiene eficacia diferencial.
PICO
Resumen en términos sencillos
Antidepresivos para la enfermedad intestinal inflamatoria
¿Qué es la enfermedad intestinal inflamatoria?
La enfermedad intestinal inflamatoria (EII) es una enfermedad inflamatoria crónica que afecta el aparato digestivo (colon o intestino delgado o ambos). La EII comprende fundamentalmente la enfermedad de Crohn y la colitis ulcerosa. Los síntomas de EII incluyen: diarrea, urgencia para defecar (incluida la incontinencia fecal), dolor abdominal, hemorragia rectal, fatiga y pérdida de peso. Cuando los pacientes presentan síntomas de EII, se considera que tienen la enfermedad activa. Cuando cesan los síntomas, la enfermedad está en remisión. La EII se asocia con una carga psicosocial, y la tasa de depresión en pacientes con EII es dos veces más altas que en la población general. La ansiedad y la depresión que acompañan la EII pueden asociarse con una menor calidad de vida, empeoramiento de la actividad de la EII, tasas más altas de hospitalización y menor adherencia al tratamiento. Hasta un 30% de pacientes con EII toman antidepresivos, prescritos para la salud mental o los síntomas intestinales, o ambos.
¿Qué son los antidepresivos?
Los antidepresivos son fármacos usados para tratar la depresión y otros trastornos mentales como la ansiedad. En la actualidad, ningún antidepresivo está aprobado por los organismos reguladores para el tratamiento específico de la ansiedad y la depresión, para el control de los síntomas físicos o para la reducción de la inflamación intestinal en pacientes con EII. Sin embargo, algunos antidepresivos tienen indicaciones para el tratamiento del dolor en las afecciones crónicas y se han usado comúnmente para controlar los síntomas intestinales funcionales en enfermedades como el síndrome de colon irritable.
¿Qué examinaron los investigadores?
Se examinaron los estudios realizados previamente sobre tratamiento antidepresivo en la EII. Los datos de algunos de estos estudios se combinaron utilizando un método llamado metanálisis. Durante el análisis, los pacientes que tomaron los antidepresivos se compararon con los que no los tomaron con respecto a las tasas de ansiedad y depresión y también otras medidas, como la calidad de vida, los efectos secundarios y la actividad de la EII.
¿Qué encontraron los investigadores?
Los investigadores buscaron en la literatura médica hasta el 23 de agosto de 2018. Cuatro estudios publicados, con un total de 188 individuos, examinaron el tratamiento antidepresivo en pacientes con EII. La edad de los participantes varió de 27 a 37,8 años. En tres estudios, los participantes presentaban EII en remisión, y en uno, los participantes presentaban EII activa o en remisión. Los participantes de un estudio presentaban ansiedad o depresión concomitante. Un estudio usó duloxetina (60 mg diarios); otro usó fluoxetina (20 mg diarios); otro, tianeptina (36 mg diarios); y otro, varios antidepresivos. Tres estudios tuvieron un grupo de placebo (p.ej. pastilla de azúcar) y un estudio tuvo un grupo control de ningún tratamiento.
El análisis demostró que los síntomas de ansiedad y depresión mejoraron en los pacientes que tomaron los antidepresivos en comparación con el placebo. Los participantes que recibieron antidepresivos presentaron más efectos secundarios que los que recibieron el placebo. Los efectos secundarios informados por los pacientes que tomaron los antidepresivos fueron: náuseas, cefalea, mareos, somnolencia, trastornos sexuales, insomnio, fatiga, estado de ánimo bajo/ansiedad, sensación de sequedad en la boca, sueño deficiente, piernas inquietas y sofocos. Algunos aspectos de la calidad de vida mejoraron igual que la actividad de la EII en el grupo antidepresivo. La calidad general de los estudios incluidos en esta revisión fue deficiente porque incluyeron un número reducido de participantes e incorporaron poblaciones con EII que diferían entre sí en cuanto a características clave. Además, como se evaluaron diferentes tipos de antidepresivos, la evidencia para cualquier fármaco de esta clase fue incierta. Por lo tanto, se necesitan futuros estudios para confirmar estas observaciones.
Conclusión
Los hallazgos de los resultados evaluados en esta revisión son inciertos, por lo que no se pueden establecer conclusiones definitivas con respecto a los efectos beneficiosos y perjudiciales de los antidepresivos en la EII. Se necesitan más estudios para permitir conclusiones firmes con respecto a los efectos beneficiosos y perjudiciales de la administración de antidepresivos en pacientes con EII.
Conclusiones de los autores
Summary of findings
| Antidepressants compared to placebo for inflammatory bowel disease | ||||||
| Patient or population: participants with active and inactive inflammatory bowel disease | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with Placebo | Risk with Antidepressants | |||||
| Anxiety at 12 weeks | The mean anxiety was 8.5 (SD = 3.45) | The mean anxiety was 6.11 (SD = 3) MD 2.39 lower | ‐ | 44 | ⊕⊕⊝⊝ | Anxiety was assessed using the HADS |
| Anxiety at 12 months | The mean anxiety was 4.2 (SD = 4.9) | The mean anxiety was 3.8 (SD = 2.5) MD ‐0.40 lower | ‐ | 26 | ⊕⊕⊝⊝ | Anxiety was assessed using the HADS A second non‐randomised study using the HARS reported a mean score of 12.65 + 3.76 in the antidepressant group (n = 30) compared to 17.85 + 3.33 in the placebo group (n = 30) (MD ‐5.20, 95% CI ‐7 to ‐3.40; very low certainty evidence) |
| Depression at 12 weeks | The mean depression was 10.5 (SD = 3.57) | The mean depression was 7.47 (SD = 2.42) MD ‐3.03 lower | ‐ | 44 | ⊕⊕⊝⊝ | Depression was assessed using the HADS |
| Depression at 12 months | The mean depression was 3.1 (SD = 3.4) | The mean depression was 2.9 (SD = 2.8) MD ‐0.20 lower | ‐ | 26 | ⊕⊕⊝⊝ | Depression was assessed using the HADS A second non‐randomised study using the Beck Depression Inventory reported a mean score of 9.6 + 2.76 in the antidepressant group (n = 30) compared to 16.35 + 5.41 in the placebo group (n = 30) (MD ‐6.75, 95% CI ‐8.92 to ‐4.58; very low certainty evidence) |
| Adverse events at 12 months | 250 per 1,000 | 573 per 1,000 | RR 2.29 | 26 | ⊕⊕⊝⊝ | Commonly reported adverse events include nausea, headache, dizziness, drowsiness, sexual problems, insomnia, fatigue, low mood/anxiety, dry mouth muscle spasms and hot flushes None of the included studies reported any serious adverse events |
| Quality of life | ‐ | ‐ | See comment | 70 | ⊕⊕⊝⊝ | Quality of life was assessed using the WHO‐QOL‐BREF We were unable to pool data as the outcome was reported at 12 weeks in 1 trial (44 participants) and 12 months in 1 trial (26 participants). Physical, Psychological, Social and Environmental QoL were improved only at 12 weeks with no group difference at 12 months |
| Pain | Not reported | No studies reported this outcome | ||||
| Maintenance of remission at 12 months | 667 per 1,000 | 640 per 1,000 | RR 0.96 | 26 | ⊕⊕⊝⊝ | Maintenance of remission was measured by the CDAI (< 150) and fecal calprotectin levels |
| Endoscopic relapse at 12 months | 0 per 1,000 | 0 per 1,000 | RR 0.14 | 60 | ⊕⊝⊝⊝ | Non‐randomised study. We were unable to calculate absolute effects. Endoscopic relapse occurred in 0% (0/30) of participants in the antidepressants group compared to 10% (3/30) in the placebo group |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded one level due to serious imprecision (44 participants) 2 Downgraded one level due to high risk of bias (incomplete outcome data) 3 Downgraded two levels due very serious imprecision (26 participants) 4 Downgraded two levels due very serious imprecision (11 events) 5 Downgraded two levels due very serious imprecision (17 events). 6 Downgraded one level due to very serious imprecision (3 events) and a large CI around the point estimate | ||||||
Antecedentes
Descripción de la afección
La enfermedad intestinal inflamatoria (EII) es una enfermedad inflamatoria crónica que afecta el aparato digestivo. Se piensa que la etiología comprende una respuesta inmunitaria inapropiada a la microbiota intestinal, desencadenada por factores ambientales, en los pacientes genéticamente susceptibles. Los síntomas característicos de la EII incluyen diarrea, urgencia para defecar, cólicos y dolor abdominal, fatiga y pérdida de peso. La EII afecta a 2,2 millones de personas de Europa (Loftus 2004), 1,4 millones de personas de los EE.UU. (CCFA 2012), 233 000 personas de Canadá (Rocchi 2012), y más de 75 000 personas de Australia (CCA 2015).
La enfermedad se asocia con una carga psicosocial. Los pacientes con EII tienen una prevalencia de depresión durante la vida mayor en comparación con la comunidad general, y la tasa calculada alcanza un 27% en pacientes con EII en comparación con un 12% en la población general (Walker 2008). Durante la remisión de la EII, más de un 20% de los pacientes informan de síntomas de ansiedad o depresión, aunque esta cifra aumenta a un 60% cuando la EII está activa (Mikocka‐Walus 2016a). Se halló que el estrés psicológico predice el curso de la enfermedad sintomática (Bernstein 2011), y también está vinculado a una mayor inflamación (Maunder 2008). También se han sugerido asociaciones entre los síntomas de depresión y la recurrencia clínica con el transcurso del tiempo (Mikocka‐Walus 2016d), tasas más altas de hospitalización (Van Langenberg 2010), y baja adherencia al tratamiento (Nigro 2001), .
A pesar de la alta prevalencia de comorbilidades mentales con la EII y el efecto sobre el curso de la enfermedad, los trastornos mentales no son tratados de modo sistemático en esta población. En realidad, menos de un 40% los pacientes que informan de síntomas mentales reciben psicoterapia (Bennebroek Evertsz 2012). El acceso limitado a los psicólogos puede explicar este resultado. En el Reino Unido, por ejemplo, solo una parte de los servicios de EII (12%) tiene acceso a la psicología clínica (RCP 2014). Sin embargo, la psicoterapia no es un tratamiento universal para los síntomas mentales y físicos asociados con la EII (Timmer 2011). Aunque en el metanálisis más reciente se demostró que las terapias psicológicas, y la terapia cognitivo‐conductual en particular, quizá tengan pequeños efectos beneficiosos a corto plazo sobre las puntuaciones de depresión y calidad de vida (CdV) en la EII (Gracie 2017), no existe evidencia de que las psicoterapias sean efectivas para la actividad de la EII. Las limitaciones de los estudios actuales sobre psicoterapia en la EII se tratan en otro trabajo (Knowles 2013).
Según la población, de un 10% a un 30% de pacientes con EII reciben antidepresivos (Fuller‐Thomson 2006; Haapamaki 2013; Mikocka‐Walus 2012). Sin embargo, los estudios han mostrado que los pacientes con EII que toman antidepresivos no necesariamente padecen de depresión pero a menudo reciben tratamiento para el dolor, el insomnio o los síntomas intestinales funcionales que se superponen con la EII (Mikocka‐Walus 2007; Mikocka‐Walus 2012). Lo anterior se asemeja al tratamiento para los trastornos intestinales funcionales, como el síndrome de colon irritable, en que hay evidencia convincente de la eficacia de los antidepresivos para los síntomas físicos (Ford 2009; Ford 2014). Sin embargo, aunque los antidepresivos se usan en la EII, hasta la fecha no se ha establecido la eficacia de esta intervención en esta población.
Descripción de la intervención
Los antidepresivos son fármacos usados para tratar la depresión y otros trastornos mentales como la ansiedad. Aunque el litio se conoció en el siglo XIX , no se introdujo en la práctica común de psiquiatría hasta los años cincuenta (Shorter 2009). Otros antidepresivos (inhibidores de la monoaminooxidasa y tricíclicos) también se introdujeron en los años cincuenta, y los tetracíclicos en los años setenta. Actualmente, los antidepresivos usados con más frecuencia son los inhibidores selectivos de la recaptación de serotonina (ISRS) que se introdujeron en la década de 1980. Los inhibidores de la recaptación de serotonina y noradrenalina (IRSN) estuvieron disponibles en la década de 1990. Otros grupos menos conocidos de antidepresivos incluyen: heterocíclicos, inhibidores de la recaptación de noradrenalina (IRNA), inhibidores de la recaptación de noradrenalina y dopamina (IRND), antidepresivos noradrenérgicos y serotoninérgicos específicos (ANASE), e inhibidores de la recaptación y antagonistas de serotonina (IRAS).
Los regímenes de dosificación difieren entre las distintas clases y antidepresivos y dependen de la gravedad de los síntomas. Por lo general, los antidepresivos se toman diariamente (a la mañana o noche), y el tratamiento dura desde varios meses a varios años o incluso de por vida. La eficacia de los antidepresivos más antiguos (p.ej. tricíclicos) y los antidepresivos más nuevos de segunda generación (p.ej. ISRS) es similar (Williams 2000). Sin embargo, el uso de los antidepresivos de primera generación se asocia con eventos adversos más graves y un mayor poder letal con la sobredosis (Gartlehner 2007; Gartlehner 2011), por lo que estos agentes dejaron de ser el tratamiento de primera línea para la depresión o la ansiedad. Entre los antidepresivos de nueva generación, el escitalopram y la sertralina se consideran superiores a otros usados comúnmente en cuanto a la eficacia y la aceptabilidad (Cipriani 2009).
En la actualidad, ningún antidepresivo está aprobado por los organismos reguladores para el tratamiento específico de la ansiedad y la depresión concomitante con la EII, para controlar los síntomas físicos de la EII o reducir la inflamación intestinal. Sin embargo, algunos antidepresivos tienen indicaciones para el tratamiento del dolor de enfermedades crónicas. Por ejemplo, la duloxetina está indicada para la neuropatía diabética periférica (AMH 2012).
De qué manera podría funcionar la intervención
Se piensa que la función de los antidepresivos se encuentra en la compensación de los déficits de los transmisores cerebrales, que se consideran la causa subyacente de la depresión (Ritter 2015). Los antidepresivos pueden inhibir la recaptación de los neurotransmisores a partir de la hendidura sináptica o inhibir el metabolismo de los neurotransmisores. Por lo tanto, los tricíclicos, por ejemplo, inhiben la captación de noradrenalina o serotonina, o ambas. Los ISRS inhiben la captación de serotonina, mientras que los IRSN inhiben la captación de noradrenalina y de serotonina, y los inhibidores de la monoaminooxidasa inhiben el metabolismo de los neurotransmisores de monoaminas como la serotonina. Sin embargo, también se formula la hipótesis de que los antidepresivos pueden ayudar en el tratamiento de la depresión debido a los efectos inmunorreguladores (Maes 2001). Se ha observado una disminución significativa en la concentración sérica de la proteína C reactiva (independientemente de la resolución de los síntomas depresivos) después de cuatro semanas de tratamiento con ISRS en pacientes con un trastorno depresivo mayor (O'Brien 2006). Aun en voluntarios sanos, se ha demostrado que los antidepresivos mejoran la actividad inmunorreguladora (Szuster‐Ciesielska 2003); y en los pacientes con afecciones inflamatorias crónicas como el asma, se informa que reducen la necesidad de corticosteroides (Brown 2005), y mejoran la función inmunitaria general (Krommydas 2005).
Dado el efecto inmunorregulador de los antidepresivos, es posible que, cuando se usan en pacientes con enfermedades inflamatorias como la EII, puedan ejercer un efecto sobre la inflamación extracerebral y, por lo tanto, mejorar no solo el estado de ánimo sino también los síntomas intestinales, al prolongar o inducir la remisión. Los estudios en animales que examinan modelos de colitis pueden servir de prueba de concepto (Mikocka‐Walus 2009). Por ejemplo, en ratones a quienes se les administró desipramina (un antidepresivo tricíclico) se redujo significativamente el daño microscópico (p < 0,05) y la atenuación de la actividad de la mieloperoxidasa colónica (p < 0,05) en comparación con el placebo (Varghese 2006). Además, la concentración sérica de Il‐1β fue significativamente inferior en las ratas que recibieron 10 mg de fluoxetina (un ISRS), 20 mg de fluoxetina, 20 mg de desipramina o 10 mg de desipramina en comparación con los controles (P < 0,001) (Guemei 2008). De manera similar, se observó una reducción del factor de necrosis tumoral alfa en las ratas que recibieron desipramina o fluoxetina (10 o 20 mg) en comparación con los controles (P < 0,001). En consecuencia, los antidepresivos pueden inducir una respuesta antiinflamatoria que no está relacionada con los efectos antidepresivos.
Además, se sabe que los tratamientos que mejoran la inflamación en la EII, como los productos biológicos, también mejoran la CdV (Feagan 2007). Por lo tanto, se formula la hipótesis de que los antidepresivos pueden reducir los síntomas de ansiedad y depresión y mejorar la CdV en la EII. Además se formula la hipótesis de que, de manera similar a lo que se presenta en modelos animales (en que se ha demostrado que tienen propiedades antiinflamatorias), los antidepresivos pueden inducir la remisión de la EII y reducir el número de exacerbaciones en humanos.
Por qué es importante realizar esta revisión
Existe un interés creciente en la salud mental y el uso de antidepresivos en enfermedades crónicas para controlar la depresión concomitante así como los síntomas físicos, y se han realizado recientemente revisiones sistemáticas Cochrane sobre diabetes (Baumeister 2014), arteriopatía coronaria (Baumeister 2011), y trastornos intestinales funcionales (Ruepert 2011). Estas revisiones han demostrado un mejor control glucémico después del uso de ISRS versus placebo en pacientes con diabetes (Baumeister 2014); mejorías de la depresión, reducción de las hospitalizaciones y las visitas a la sala de urgencias (aunque sin efectos beneficiosos sobre la mortalidad, los eventos cardíacos o la CdV) después del uso de ISRS en comparación con el placebo en la arteriopatía coronaria (Baumeister 2011); y mejorías del dolor abdominal y los síntomas (después de los tricíclicos en comparación con un placebo) y en la evaluación global (después de los ISRS en comparación con un placebo) en el síndrome de colon irritable (Ruepert 2011). Sin embargo, no existe una revisión sistemática Cochrane que explore la función de los antidepresivos en la EII.
La primera revisión sistemática sobre el uso de los antidepresivos en la EII se realizó en 2005 e identificó 12 estudios no controlados (Mikocka‐Walus 2006). Aunque la revisión observó un efecto beneficioso de los antidepresivos sobre el estado mental y físico de los pacientes con EII, la investigación disponible fue de calidad baja, lo que imposibilita establecer conclusiones definitivas sobre la eficacia de los antidepresivos para mejorar los resultados en pacientes con EII. Una revisión sistemática más reciente (Macer 2017), incluyó 15 estudios con un ensayo controlado aleatorio, dos estudios de cohortes, un estudio de casos y controles, una encuesta transversal, un estudio cualitativo, dos auditorías, una serie de casos clínicos y seis informes de casos. Doce estudios indicaron que los antidepresivos tienen un efecto positivo sobre el curso de la EII. Nueve estudios informaron de la ansiedad y la depresión como resultados. Ocho de estos estudios informaron de los efectos beneficiosos de los antidepresivos. Se consideró que la mayoría de los estudios presentaban un riesgo de sesgo bajo, además de los informes de casos, en que el riesgo de sesgo fue alto. Aunque esta revisión confirmó el efecto beneficioso de los antidepresivos sobre el curso de la EII, se concluyó que no fue posible confirmar la eficacia de los antidepresivos debido a la ausencia de ensayos controlados aleatorios (ECA). Desde la publicación de la última revisión, se publicó otro ensayo sobre el uso de antidepresivos en la EII (Mikocka‐Walus 2017). Se necesita ahora revisar la evidencia actual sobre la efectividad y la seguridad de los antidepresivos para el estado de ánimo y la actividad de la enfermedad en los pacientes con EII. También es fundamental realizar el primer metanálisis de los efectos de los antidepresivos en el tratamiento de la EII.
Dado el uso generalizado de los antidepresivos en la EII (Fuller‐Thomson 2006; Haapamaki 2013; Mikocka‐Walus 2012), y la posibilidad de abordar no solo la salud mental deficiente sino también la actividad inmunorreguladora (Krommydas 2005), es importante evaluar la eficacia y la seguridad de los antidepresivos en la EII. Esta revisión explora la función adyuvante de los antidepresivos en la EII.
Objetivos
Objetivos primarios
-
Evaluar la eficacia y la seguridad de los antidepresivos para el tratamiento de la ansiedad y la depresión en la EII.
Objetivos secundarios
-
Evaluar la eficacia y la seguridad de los antidepresivos para mejorar la CdV en la EII.
-
Evaluar la eficacia y la seguridad de los antidepresivos para el control de la actividad de la enfermedad de la EII.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todos los estudios cuantitativos publicados y no publicados, incluidos: ECA y estudios controlados no aleatorios, estudios prospectivos y retrospectivos incluidos los estudios de cohortes, control de casos, transversales y de auditoría. Se excluyeron los estudios sin un grupo de comparación.
Tipos de participantes
Se consideraron para la inclusión los pacientes con diagnóstico clínico de EII de cualquier tipo (es decir, enfermedad de Crohn, colitis ulcerosa o colitis indeterminada), según la práctica generalizada (es decir, una combinación de criterios clínicos, radiológicos, endoscópicos e histológicos).
Tipos de intervenciones
Se incluyeron todos los tipos de antidepresivos (en cualquier dosis):
-
ISRS (citalopram, escitalopram, fluoxetina, fluvoxamina, paroxetina, sertralina);
-
tricíclicos (amitriptilina, clomipramina, desipramina, dotiepina, doxepina, imipramina, lofepramina, nortriptilina, protriptilina, trimipramina);
-
heterocíclicos (mianserina);
-
inhibidores de la MAO (isocarboxazida, fenelzina, tranilcipromina, brofaromina, moclobemida, tirima);
-
IRNA (reboxetina);
-
IRND (amineptina, buproprión);
-
IRSN (duloxetina, milnaciprán, venlafaxina);
-
ANASE (mirtazapina);
-
IRAS (trazodona); y
-
otros antidepresivos no clasificados (agomelatina, vilazodona).
Para la inclusión se consideraron comparadores que incluyeran cualquiera de los siguientes:
-
Ninguna intervención;
-
Placebo;
-
Atención estándar / tratamiento habitual;
-
Cirugía;
-
Intervenciones alternativas para tratar la depresión y la ansiedad, p.ej. ansiolíticos, psicoterapia;
-
Otro antidepresivo; y
-
Otros comparadores activos.
Tipos de medida de resultado
Resultados primarios
Eficacia
-
Ansiedad y depresión, medidas por cualquier escala de depresión o ansiedad reconocida
Resultados secundarios
Seguridad
-
Eventos adversos;
-
Eventos adversos graves;
-
Retiro del estudio por eventos adversos.
Eficacia
-
CdV medida con cualquier escala de CdV bien establecida;
-
Remisión clínica o recaída de la EII;
-
Intensidad del dolor según cualquier escala de dolor bien establecida; e
-
Ingresos hospitalarios, cirugía, necesidad de tratamiento con corticosteroides.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
The following sources were searched from inception to 23rd August 2018 and without language restrictions:
-
MEDLINE via PubMed (Appendix 1);
-
Embase (Appendix 2);
-
CINAHL (Appendix 3);
-
PsycINFO (Appendix 4);
-
CENTRAL; and
-
The Cochrane IBD Group Specialized Register.
Trial registries were searched to identify any unpublished or ongoing studies. These registries included:
-
The WHO Trials portal (ICTRP);
-
ClinicalTrials.gov; and
-
The EU clinical trials register.
Conference proceedings were searched to identify studies published in abstract form. These conferences included:
-
Digestive Disease Week;
-
United European Gastroenterology Week;
-
European Crohn’s and Colitis Organisation; and
-
Advances in IBD.
The grey literature database Open Grey was searched to identify studies not indexed in the major databases.
Búsqueda de otros recursos
We searched the reference lists of included studies and applicable systematic reviews to identify studies missed by the database searches.
Obtención y análisis de los datos
Selección de los estudios
Two authors (AMW, JP) independently screened titles and abstracts identified by the search and excluded those studies not meeting the selection criteria. Full text reports were obtained for all the studies deemed eligible and were read independently by two review authors (AMW, JP). For the studies co‐authored by AMW, eligibility was assessed by other researchers (JP, SLP). If information pertaining to eligibility was missing, we contacted the authors of the studies for further information. In cases where the two authors could not reach consensus on study eligibility, a third investigator (SLP or SK) was consulted.
Extracción y manejo de los datos
Data were independently extracted by two authors (AMW, JP or JP and SLP in the case of the trial co‐authored by AMW). Any disagreements were resolved by consensus and, if this could not be reached, a third author (SLP or SK) was asked to arbitrate.
The following information was extracted:
-
General study information: authors, year, country;
-
Method: design (including details such as: randomisation, allocation concealment, duration, follow‐up), setting, recruitment, intervention (type of antidepressant, dose, frequency, type of controls, adherence), clinical measures (e.g. disease activity measure, measures of anxiety/depression), sample size calculation;
-
Participants: number of participants, age, sex, IBD type, per cent in remission; and
-
Outcomes: descriptives (mean/SD or median/inter‐quartile range (or range), frequency (%) plus accompanying statistics, e.g. OR, P value) for primary and secondary outcome measures at time points, adverse events, and loss to follow‐up.
We contacted the authors of one study about missing or unclear information and the study authors provided the requested data (Chojnacki 2011).
Evaluación del riesgo de sesgo de los estudios incluidos
Two authors independently assessed the risk of bias. The variety of study designs included in this review necessitated the use of several different quality assessment tools. For RCTs, the Cochrane risk of bias tool was used (Higgins 2011). The following types of bias were examined: selection bias (sequence generation and allocation sequence concealment, two items), performance bias (blinding of participants and personnel, two items), detection bias (blinding of outcome assessment, one item), attrition bias (incomplete outcome data at short‐term (two to six weeks) and at long‐term (greater than six weeks, two items), reporting bias (selective outcome reporting, one item). Each item was rated as either ‘Low risk’, ‘High risk’ or 'Unclear risk'. For observational studies (case‐control), we used the Newcastle‐Ottawa Scale (Wells 2000), for which a study could score a possible of nine points, with a higher score consistent with better methodological quality.
In addition, the GRADE approach was used to evaluate the overall quality of the evidence supporting the primary outcomes and selected secondary outcomes (Guyatt 2008). Following the GRADE, evidence from randomised trials starts as high quality but may be downgraded due to within‐study risk of bias (methodological quality), indirect evidence, unexplained heterogeneity, imprecision of effect estimates and risk of publication bias. Evidence from non‐randomised studies starts as low quality. Each outcome was assigned one of the following scores: high quality (future research unlikely to change confidence in the estimate); moderate quality (future research likely to impact confidence in the estimate); low quality (future research very likely to impact confidence in the estimate); very low quality (the estimate is uncertain).
Summary of findings tables were prepared for the following outcomes post‐treatment:
-
Anxiety symptoms;
-
Depression symptoms;
-
Adverse events;
-
Quality of life;
-
Pain;
-
Clinical remission; and
-
Relapse.
Medidas del efecto del tratamiento
We used the RevMan software for data analysis. For dichotomous outcomes, we calculated the risk ratio (RR) and corresponding 95% confidence interval (CI). The number needed to treat (NNT) and risk difference (RD) were calculated where appropriate. For continuous outcomes, the mean difference (MD) or standardised mean difference (SMD) and corresponding 95% CI were calculated.
Cuestiones relativas a la unidad de análisis
Where the efficacy of multiple antidepressants (on IBD activity) was meant to be compared, it was planned to split the shared comparison group (e.g. standard care or psychotherapy) equally between the antidepressants arms as comparison groups. However, such a study was not identified. Cross‐over trials were to be included only when antidepressant and comparator data were extracted from the first treatment period or when the sufficient wash‐out period occurred between treatment periods (e.g. two weeks for all antidepressants except for fluoxetine where four weeks are required in light of the long plasma half‐life). However, no cross‐over trial was identified. SE was converted into SD using the following formula: SD = SE / √1/NE+1/NC.
Manejo de los datos faltantes
Where possible, the intention‐to‐treat principle was adhered to. In the case of dichotomous data when treatment response was compared, the total number of participants in each pre‐treatment comparison group (as the denominator) was included. In the analyses of treatment response, only the data from studies reporting a group size prior to drop‐outs were included. For continuous outcome measures, we included summary statistics derived from (in order of preference) mixed‐effects models, observed cases summary statistics, and last observation carried forward where possible. This was dictated by the notion that mixed‐effects models are considered less biased than the analyses of the last observation carried forward (Verbeke 2000).
Evaluación de la heterogeneidad
We planned to assess clinical homogeneity using the forest plot of the risk ratio. We also planned to review the results of the Chi2 test. A P value of less than 0.10 was to be considered evidence of statistically significant heterogeneity (assuming the low power of the Chi2 statistic when few trials are available) (Deeks 2011). This proved impractical due to the very small number of studies identified.
The I2 statistic was used to assess heterogeneity across trials (Higgins 2003). An I2 statistic greater than 30% was considered moderate heterogeneity and greater than 50% was considered severe heterogeneity.
Subgroup differences in continuous measures of antidepressant efficacy were to be investigated using Deeks' stratified test of heterogeneity (Deeks 2001). Herein the sum of the Chi2 statistics for each of the subgroups included in the study is subtracted from the Chi2 statistic for all the studies, to provide a measure (Qb) of heterogeneity between groups. As different antidepressants may exert different effects, we planned to stratify all of the outcome comparisons by the individual antidepressant used (excluding subgroup and sensitivity analyses). This however proved impossible due to each study using a different type of antidepressant.
Evaluación de los sesgos de notificación
Small‐sample effects were to be investigated by visual inspection of a funnel plot of treatment response (Sterne 2011). This was however deemed inappropriate as we identified fewer than 10 studies and the method is not robust in such cases (Egger 1997).
Síntesis de los datos
The pooled RR and corresponding 95% CI was calculated for dichotomous outcomes. For continuous outcomes, the pooled MD or SMD with 95% CI was calculated as appropriate. It was planned to combine dichotomous and continuous variables using the standard Cochrane procedure (InOR = SMD X π / √ 3) (Deeks 2011), but this proved unnecessary. We obtained categorical and continuous treatment effects using a fixed‐effect model. The outcomes were expressed as an average effect size for each subgroup and 95% CIs. In some models, heterogeneity was present and in such cases random‐effects models are usually preferred. However, the Cochrane Handbook does warn that if the effect size is associated with sample size, then using a random‐effects model will award relatively more weight to the smaller studies, and will exacerbate bias (Deeks 2011). This is further confirmed by a recent evidence synthesis (Bender 2018). As this review includes a small number of studies, a fixed‐effect model was applied for the analyses.
Análisis de subgrupos e investigación de la heterogeneidad
Subgroup analysis was to be conducted for the following subgroups:
IBD subtype: Crohn's disease versus ulcerative colitis or indeterminate colitis;
Sex: Male versus female; and
Types of antidepressants: SSRI versus tricyclics.
This was not deemed practical due to the small number of studies.
Análisis de sensibilidad
Sensitivity analysis was to be performed to check the robustness of our conclusions for the meta‐analysis of the primary outcome. We planned to follow the same procedure as was applied in our previous protocol on a similar topic (Gordon 2013):
We planned to assess whether treatment response varies as a function of the use of treatment response versus non‐response as outcomes. Treatment response may produce less consistent outcome statistics than non‐response in cases when the control group event rate is greater than 50% (Deeks 2002). This analysis was only to be conducted if the majority of studies reported a control group event rate greater than 50%. This was not the case for the analysis.
Conducting a 'worst case/best case' analysis was considered to examine the impact of the exclusion of those lost to follow‐up on treatment efficacy effect estimates (Deeks 2011). Herein, for the worst case scenario, all the missing data for the treatment group were to be recorded as non‐responders. For the best case scenario, all missing data in the control group were to be considered non‐responders. Where the effect estimates of treatment efficacy would not differ between these two comparisons, it would be concluded that missing data in the studies did not have a marked impact on outcomes. This analysis was to be done in case we had access to full data sets for the included studies. This was the case for one study only (Mikocka‐Walus 2016c).
Results
Description of studies
Results of the search
The search was conducted on 23 August 2018 and identified 3920 records. After duplicates were removed, 3144 records were screened for inclusion. Of the studies that were screened, 16 were selected for full text review. Overall, 4 studies met the inclusion criteria (Figure 1). No additional studies were identified through other sources.

Study flow diagram.
Included studies
Country
Included studies came from four countries: one each conducted in Australia (Mikocka‐Walus 2016c), Iran (Daghaghzadeh 2015), Poland (Chojnacki 2011) and the United Kingdom (Goodhand 2012).
Study design
The search identified two double blind RCTs (Daghaghzadeh 2015; Mikocka‐Walus 2016c), one non‐randomised controlled trial (Chojnacki 2011), and one observational retrospective case‐matched study (Goodhand 2012).
Participant characteristics
The studies included a total of 188 patients with IBD (96 assigned to intervention and 93 assigned to controls). The age of participants ranged from 27 (Goodhand 2012) to 37.8 years (Daghaghzadeh 2015). The proportion of female participants ranged from 46% (Daghaghzadeh 2015; Mikocka‐Walus 2016c) to 65% (Chojnacki 2011). In three studies participants were in IBD remission (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c) and in one study participants had mixed IBD activity (Goodhand 2012). In one study participants had to have co‐morbid symptoms of anxiety and/or depression (Chojnacki 2011) while in the remaining studies this was not part of the inclusion criteria. Two studies included both participants with Crohn's disease and ulcerative colitis (Daghaghzadeh 2015; Goodhand 2012), one study included only participants with Crohn's disease (Mikocka‐Walus 2016c) and another only those with ulcerative colitis (Chojnacki 2011).
Treatment
In the experimental groups, one study used duloxetine 60 mg daily (an SNRI antidepressant) (Daghaghzadeh 2015), one study used fluoxetine 20 mg daily (an SSRI antidepressant) (Mikocka‐Walus 2016c), one study used tianeptine 12 mg three times a day (an atypical antidepressant) (Chojnacki 2011), and one study used various antidepressants in clinical ranges (Goodhand 2012). Three studies used a placebo control (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c), and one study used a no treatment control group matched for various clinical and demographic characteristics (Goodhand 2012).
Follow‐up
The follow‐up periods ranged from 12 weeks to 12 months, with one study (Goodhand 2012) observing participants 12 months before and 12 months after being prescribed an antidepressant. In two studies no attrition was recorded (Chojnacki 2011; Goodhand 2012), while in one study 79% of participants remained in the study at 12‐weeks of follow‐up (Daghaghzadeh 2015), and in another study 69% of participants remained in the study at 12‐months of follow‐up (Mikocka‐Walus 2016c).
Outcome measures
In terms of the primary outcome measures, three studies measured symptoms of anxiety and depression (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c). Symptoms of anxiety and depression were measured using the Hospital Anxiety and Depression Scale (HADS) in two studies (Daghaghzadeh 2015; Mikocka‐Walus 2016c), and the Hamilton Anxiety Rating Scale (HARS) and the Beck Depression Inventory (BDI) in one study (Chojnacki 2011).
Regarding the secondary outcome measures, three studies measured adverse events (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c), two studies measured study withdrawal due to adverse events and QoL (Mikocka‐Walus 2016c; Daghaghzadeh 2015). All studies measured IBD activity. Three studies used an IBD activity index (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c), two studies used blood tests ( Chojnacki 2011; Mikocka‐Walus 2016c), one study used faecal calprotectin (Mikocka‐Walus 2016c), and one study used endoscopy (Chojnacki 2011).
QoL was measured using the World Health Organization Quality of Life (WHOQOL‐BREF) questionnaire (Daghaghzadeh 2015; Mikocka‐Walus 2016c). The WHOQOL‐BREF is a short version of the World Health Organization Quality of Life (WHOQOL‐100) questionnaire and is a tool which can be used cross‐culturally to evaluate quality of life (WHOQOL‐BREF). WHOQOL‐BREF measures four major domains of QoL: physical (corresponding with physical health, e.g. fatigue, pain, sleep), psychological (corresponding with psychological well‐being, e.g. self‐esteem, body image, positive or negative feelings), social relationships (corresponding with personal relationships, social support and sexual functioning) and environment (corresponding with people's relationship to their environment, e.g. safety, financial resources, transport, physical environment).
Disease activity indices included the Crohn's Disease Activity Index (CDAI) (Mikocka‐Walus 2016c), the Lichtiger Colitis Activity Index (Daghaghzadeh 2015), and the Mayo Clinic Disease Activity Index (Chojnacki 2011). The blood tests included C‐reactive protein (CRP) (Chojnacki 2011), and cytokines/chemokines (Mikocka‐Walus 2016c).
One study measured hospital admissions and need for steroid treatment (Goodhand 2012). None of the studies measured pain or surgery.
For details of studies see Characteristics of included studies.
Excluded studies
Studies were excluded for not meeting the inclusion criteria of study design (Drossmann 2014; Eirund 1998), presenting data overlapping with another paper (Iskandar 2012; Iskandar 2011), lack of information regarding the efficacy of antidepressants (Loftus 2011; Virta 2014), including combination therapy without separate data on antidepressant efficacy (Xie 2014; NCT02162862), no validated measure of outcomes (Mikocka‐Walus 2016b), no control group (Yanartas 2016), a control group not comprised of IBD patients (Iskandar 2014), and a trial registration without published results (NCT00126373). See Characteristics of excluded studies.
Risk of bias in included studies
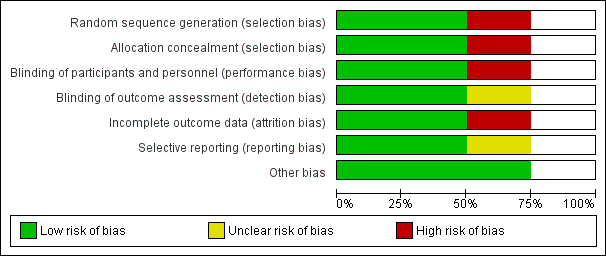
The results of the risk of bias analysis for the three controlled trials are summarized in Figure 2 and Figure 3 (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c). Table 1 reports the Newcastle‐Ottawa Scale results for the observational study (Goodhand 2012). Mikocka‐Walus 2016c was rated as low risk of bias. Daghaghzadeh 2015 was rated as high risk of bias for incomplete outcome data. The non‐randomised controlled trial was associated with low risk of bias on two items, unclear risk on two items (blinding of outcome assessment and selective reporting) and high risk on three items (random sequence generation, allocation concealment, blinding of participants and personnel) (Chojnacki 2011).

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
| Case Control Study | Is the case definition adequate? (/1) | Representativeness of the cases (/1) | Selection of controls (/1) | Definition of controls (/1) | Comparability of cases and controls on the basis of the design or analysis (/2) | Assessment of exposure (/1) | Same method of ascertainment for cases and controls (/1) | Non‐Response Rate (/1) | |
| Goodhand (2012) | 1 | ‐ | 1 | ‐ | 2 | 1 | 1 | 1 | 7 |
The observational study (Goodhand 2012), was considered to be of reasonable methodological quality and was given a score of seven stars. However, there were concerns with two items: representativeness of the cases and definition of controls. Cases were not completely representative as some of them were excluded based on the lack of data (e.g. when the date of commencement of the antidepressant was missing). The definition of controls was considered incomplete as it did not mention the history of outcome in this group. Importantly, this study was non‐randomised and as such is likely to be associated with a higher risk of bias than RCTs.
Allocation
Random sequence generation was rated as low risk of bias in two studies (Daghaghzadeh 2015; Mikocka‐Walus 2016c), and as high risk in the non‐randomised controlled trial (Chojnacki 2011). Allocation concealment was rated as high risk of bias in one study (Chojnacki 2011), as low risk in two studies (Daghaghzadeh 2015; Mikocka‐Walus 2016c).
Blinding
Blinding of participants and personnel was judged to be adequate in two studies (Daghaghzadeh 2015; Mikocka‐Walus 2016c), and high risk of bias in one study (Chojnacki 2011). Blinding of outcome assessment was judged to be adequate in two studies (Daghaghzadeh 2015; Mikocka‐Walus 2016c), and unclear risk of bias in one study (Chojnacki 2011).
Incomplete outcome data
One study was judged to be at high risk of bias for Incomplete outcome data (Daghaghzadeh 2015), while two studies were judged to be at low risk of bias for this item (Chojnacki 2011; Mikocka‐Walus 2016c).
Selective reporting
Selective reporting was considered at low risk of bias in two studies (Daghaghzadeh 2015; Mikocka‐Walus 2016c), and unclear risk of bias in one study (Chojnacki 2011).
Other potential sources of bias
The three trials were considered at low risk of bias for other types of bias (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c) .
Effects of interventions
Comparison 1: Antidepressants versus placebo
Overall, four studies have contributed to this comparison (Chojnacki 2011; Daghaghzadeh 2015; Goodhand 2012; Mikocka‐Walus 2016c).
Primary outcome measures
Anxiety
Three studies examined the effect of antidepressants on symptoms of anxiety (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c).
At 12 weeks, using the HADS, Daghaghzadeh 2015 reported a mean score of 6.11 + 3 in the antidepressant group (n = 22) compared to 8.5 + 3.45 in the placebo group (n = 22) (MD ‐2.39, 95% ‐4.30 to ‐0.48; low certainty evidence, see Analysis 1.1 and summary of findings Table for the main comparison).
At 12 months, two trials reported that symptoms of anxiety were improved in participants receiving antidepressants compared to placebo (Chojnacki 2011; Mikocka‐Walus 2016c). We initially attempted to pool these studies using the SMD but a very high degree of heterogeneity was detected (I2= 87%). Thus we report the results for each trial separately. Using the HARS, Chojnacki 2011 reported a mean score of 12.65 + 3.76 in the antidepressant group (n = 30) compared to 17.85 + 3.33 in the placebo group (n = 30) (MD ‐5.20, 95% CI ‐7 to ‐3.40; very low certainty evidence). Using the HADS, Mikocka‐Walus 2016c reported a mean score of 3.8 + 2.5 in the antidepressant group (n = 14) compared to 4.2 + 4.9 in the placebo group (n = 12) (MD ‐0.40, 95% ‐3.47 to 2.67, low certainty evidence; See Analysis 1.2 and summary of findings Table for the main comparison).
Depression
Three studies examined the effect of antidepressants on symptoms of depression (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c).
At 12 weeks, using the HADS, Daghaghzadeh 2015 reported a mean score of 7.47 + 2.42 in the antidepressant group (n = 22) compared to 10.5 + 3.57 in the placebo group (n = 22) (MD ‐3.03, 95% CI ‐4.83 to ‐1.23, low certainty evidence; see Analysis 1.3 and summary of findings Table for the main comparison).
At 12 months, two trials reported that symptoms of depression were improved in participants receiving antidepressants compared to placebo (Chojnacki 2011; Mikocka‐Walus 2016c). We initially attempted to pool these studies using the SMD but a very high degree of heterogeneity was detected (I2= 89%). Thus we report the results for each trial separately. Using the BDI, Chojnacki 2011 reported a mean score of 9.6 + 2.76 in the antidepressant group (n = 30) compared to 16.35 + 5.41 in the placebo group (n = 30) (MD ‐6.75, 95% CI ‐8.92 to ‐4.58; very low certainty evidence). Using the HADS, Mikocka‐Walus 2016c reported a mean score of 2.9 + 2.8 in the antidepressant group (n = 14) compared to 3.1 + 3.4 in the placebo group (n = 12) (MD ‐0.20, 95% ‐2.62 to 2.22, low certainty evidence; See Analysis 1.4 and summary of findings Table for the main comparison).
Secondary outcome measures
Adverse events
Adverse events were reported in three studies, with nausea being an adverse event common to all three studies (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c).
At 12 weeks, higher rates of nausea were reported in the antidepressant group compared to placebo (Daghaghzadeh 2015). Thirty‐two per cent (7/22) of participants in the antidepressant group reported nausea compared to nine per cent (2/22) of placebo participants (RR 3.50, 95% CI 0.82 to 15.01; very low certainty evidence). The very low GRADE rating was due to a small sample size and incomplete outcome data.
At 12 months, two trials showed no group difference in nausea between those taking antidepressants and placebo (Chojnacki 2011; Mikocka‐Walus 2016c). Thirteen per cent (6/44) of those taking antidepressants reported nausea compared to two per cent (1/42) of placebo participants (RR 4.02, 95% CI 0.74 to 22.03).
Adverse events in the group who received antidepressants included nausea, headache, dizziness, drowsiness, sexual problems, insomnia, fatigue, low mood/anxiety, dry mouth, poor sleep, restless legs and hot flushes. Adverse events in the control group included dizziness, insomnia and muscle spasms (Daghaghzadeh 2015; Mikocka‐Walus 2016c).
Mikocka‐Walus 2016c reported on the number of participants who had an adverse event. Fifty‐seven per cent (8/14) of those in the antidepressant group reported adverse events compared to 25% (3/12) of the placebo group (RR 2.29, 95% CI 0.78 to 6.73, low certainty evidence; See Analysis 1.5 and summary of findings Table for the main comparison).
Serious adverse events
Serious adverse events were not reported by the included studies.
Study withdrawal due to adverse events
One RCT examined the effect of antidepressants on study withdrawal due to adverse events at 12 weeks (Daghaghzadeh 2015), and one RCT examined the effect of antidepressants on study withdrawal due to adverse events at 12 months (Mikocka‐Walus 2016c).
At 12 weeks, no group difference in study withdrawal due to adverse events was observed, with 4% (1/22) of participants taking antidepressants withdrawing from the study due to adverse events (adverse event type not reported) compared to 0% (0/22) of placebo group participants (RR 3, 95% CI 0.13 to 69.9; see Analysis 1.8).
At 12 months, no group difference in study withdrawal due to adverse events was observed, with 7% (1/14) of participant taking antidepressants withdrawing from the study due to adverse events (including poor sleep, anxiety, restless legs) compared to 0% (0/12) of placebo group participants (RR 2.6, 95% CI 0.12 to 58.5; see Analysis 1.9).
Quality of life
One RCT examined the effect of antidepressants on QoL at 12 weeks (Daghaghzadeh 2015) and one RCT examined the effect of antidepressants on QoL at 12 months (Mikocka‐Walus 2016c). Both studies used the WHOQOL‐BREF questionnaire.
Physical QoL
At 12 weeks, Daghaghzadeh 2015 reported a mean score of 60.24 + 12.94 in the antidepressant group (n = 22) compared to 49.52 + 10.12 in the placebo group (n = 22) (MD 10.72, 95% CI 3.86 to 17.58, low certainty evidence; See Analysis 1.10 and summary of findings Table for the main comparison).
At 12 months, Mikocka‐Walus 2016c reported a mean score of 68.83 + 13.34 in the antidepressant group (n = 14) compared to 66.66 + 21.72 in the placebo group (n = 12) (MD 2.17, 95% CI ‐11.97 to 16.31, low certainty evidence; See Analysis 1.11 and summary of findings Table for the main comparison).
Psychological QoL
At 12 weeks, Daghaghzadeh 2015 reported a mean score of 51.81 + 13.6 in the antidepressant group (n = 22) compared to 43.5 + 11.94 in the placebo group (n = 22) (MD 8.31, 95% CI 0.75 to 15.87, low certainty evidence; See Analysis 1.12 and summary of findings Table for the main comparison).
At 12 months, Mikocka‐Walus 2016c reported a mean score of 75.37 + 14.84 in the antidepressant group (n = 14) compared to 72.22 + 16.79 in the placebo group (n = 12) (MD 3.15, 95% CI ‐9.12 to 15.42, low certainty evidence; See Analysis 1.13 and summary of findings Table for the main comparison).
Social QoL
At 12 weeks, Daghaghzadeh 2015 reported a mean score of 51.2 + 15.1 in the antidepressant group (n = 22) compared to 38.88 + 12.12 in the placebo group (n = 22) (MD 12.32, 95% CI 4.23 to 20.41, low certainty evidence; See Analysis 1.14 and summary of findings Table for the main comparison).
At 12 months, Mikocka‐Walus 2016c reported a mean score of 73.48 + 18.56 in the antidepressant group (n = 14) compared to 75 + 23.19 in the placebo group (n = 12) (MD ‐1.52, 95% CI ‐17.85 to 14.81, low certainty evidence; See Analysis 1.15 and summary of findings Table for the main comparison).
Environmental QoL
At 12 weeks, Daghaghzadeh 2015 reported a mean score of 51.79 + 10.24 in the antidepressant group (n = 22) compared to 44.13 + 12.27 in the placebo group (n = 22) (MD 7.66, 95% CI 0.98 to 14.34, low certainty evidence; See Analysis 1.16 and summary of findings Table for the main comparison).
At 12 months, Mikocka‐Walus 2016c reported a mean score of 73.86 + 14.41 in the antidepressant group (n = 14) compared to 75.69 + 9.85 in the placebo group (n = 12) (MD ‐1.83, 95% CI ‐11.21 to 7.55; low certainty evidence; See Analysis 1.17 and summary of findings Table for the main comparison).
The low GRADE rating at both 12 weeks and 12 months was due to very serious imprecision (26 participants) in one study (Mikocka‐Walus 2016c), and incomplete outcome data and imprecision (44 participants) in the other study (Daghaghzadeh 2015).
Clinical remission
One trial reported on remission rates at 12 months post treatment (Mikocka‐Walus 2016c). In the group receiving an antidepressant, 64% (9/14) of participants remained in remission (based on CDAI and faecal calprotectin) compared to 66% (8/12) in the placebo group (RR 0.96, 95% CI 0.55 to 1.69, low certainty evidence; see Analysis 1.18 and summary of findings Table for the main comparison).
Three studies used a disease activity index to measure disease activity (Chojnacki 2011; Daghaghzadeh 2015; Mikocka‐Walus 2016c). This post hoc outcome was not pre‐specified in our protocol.
At 12 weeks, using the Lichtiger Colitis Activity Index, Daghaghzadeh 2015 reported a mean score of 4.52 + 11.63 in the antidepressant group (n = 22) compared to 6.83 + 2.09 in the placebo group (n = 22) (MD ‐2.31, 95% CI ‐3.42 to ‐1.20; See Analysis 1.19).
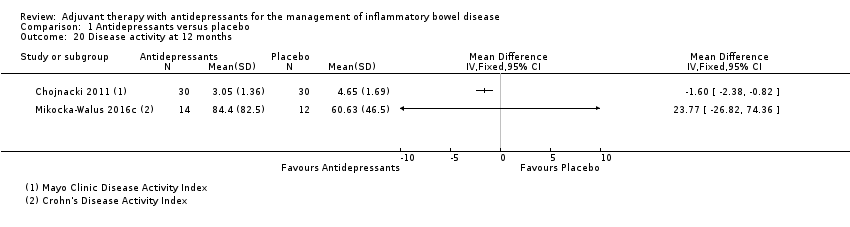
At 12 months, two trials reported that disease activity was improved in the group taking antidepressants as compared to placebo (Chojnacki 2011; Mikocka‐Walus 2016c). We initially attempted to pool these studies using the SMD but a very high degree of heterogeneity was detected (I2= 87%). Thus we report the results for each trial separately. Using the Mayo Clinic Disease Activity Index, Chojnacki 2011 reported a mean score of 3.05 + 1.36 in the antidepressant group (n = 30) compared to 4.65 + 1.69 in the placebo group (n = 30) (MD ‐1.60, 95% CI ‐2.38 to ‐0.82; See Analysis 1.20). Using the CDAI, Mikocka‐Walus 2016c reported a mean score of 84.4 + 82.5 in the antidepressant group compared (n = 14) to 60.63 + 46.5 in the placebo group (n = 12) (MD 23.77, 95% CI ‐26.82 to 74.36; See Analysis 1.20).
No study collected data on clinical remission at longitudinal follow‐up beyond trial completion.
Relapse
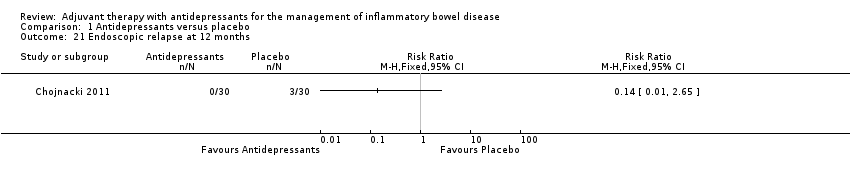
One non‐randomised trial reported on endoscopic relapse up to 12 months post treatment (Chojnacki 2011). At 12 months, 0% (0/30) of participants in the antidepressant group had endoscopic relapse compared to 10% (3/30) of placebo group participants (RR 0.14, 95% CI 0.01 to 2.65, very low certainty evidence; see Analysis 1.21 and summary of findings Table for the main comparison).
The following relevant post hoc outcomes were not pre‐specified in our review protocol: relapse using clinician's assessment, faecal calprotectin and blood tests (CRP, cytokines/chemokines).
Goodhand 2012 reported on the number of relapses (clinician assessed based on symptoms/blood tests) in the year preceding treatment with antidepressants and in the year after the treatment commenced. In the year after starting an antidepressant, patients treated with an antidepressant had fewer relapses than controls (median[range] = 0 [0–4) versus 1 [0–3]).
In one trial (Mikocka‐Walus 2016c) there was no group difference in the relapse rate as measured using faecal calprotectin at 12 months (post treatment), with 7% (1/14) of the participants in the antidepressant group relapsing (faecal calprotectin > 200) compared to 0% (0/12) of the placebo group (MD 2.60, 85% CI 0.12 to 58.48; See Analysis 1.22).
Regarding blood tests, one trial reported data on CRP (Chojnacki 2011), while another trial reported data for cytokines and chemokines (Mikocka‐Walus 2016c). Chojnacki 2011 reported a mean CRP of 6.99 + 5.65 in the antidepressant group (n = 30) compared to 9.40 + 6.78 in the placebo group (n = 30) (MD ‐2.41, 95% CI ‐5.57 to 0.75; See Analysis 1.23).
Mikocka‐Walus 2016c reported a mean proportion of TH Effector Memory RA cells of 45.8 + 4.5 in the antidepressant group (n = 14) compared to 39.7 + 3.1 in the placebo group (n = 12) (MD 6.10, 95% CI 3.16 to 9.04; See Analysis 1.24).
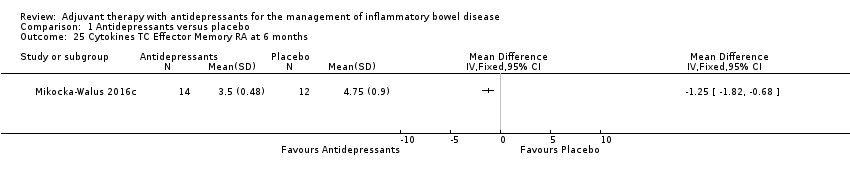
Mikocka‐Walus 2016c reported a mean proportion of TC Effector Memory RA cells of 3.5 + 0.48 in the antidepressant group (n = 14) compared to 4.75 + 0.9 in the placebo group (n = 12) (MD ‐1.25, 95% CI ‐1.82 to ‐0.68; See Analysis 1.25).
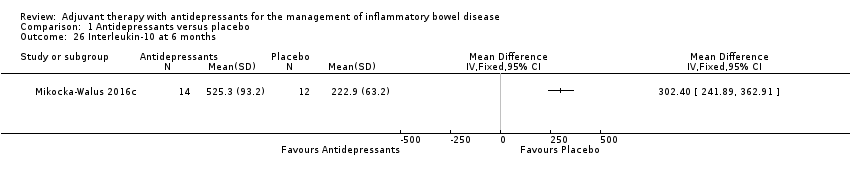
Regarding interleukin‐10 (IL‐10) secretion, Mikocka‐Walus 2016c reported a mean of CD3/CD28 stimulated cytokine concentrations in peripheral blood mononuclear cells supernatants of 525.3 + 93.2 in the antidepressant group (n = 14) compared to 222.9 + 63.2 in the placebo group (n = 12) (MD 302.4, 95% CI 241.89 to 362.91; See Analysis 1.26).
No study collected data on relapse at longitudinal follow‐up beyond trial completion.
Pain severity
None of the included studies examined the impact of antidepressants on pain.
Hospital admissions
Hospital admissions were included as an outcome in only one study (Goodhand 2012), and thus a meta‐analysis was not conducted. At 12‐month follow‐up, no participants in either group had hospital admissions due to IBD.
Surgery
The included studies did not examine the impact of antidepressants on the need for surgery.
Need for steroid treatment
The need for steroid treatment was included as an outcome in only one study (Goodhand 2012). At 1‐year follow‐up, no participants in the antidepressant group (0/29) required steroids compared to 3% (1/29) of those in the control group (MD 0.33, 95% CI 0.01 to 7.86; See Analysis 1.27).
Discusión
Hasta un 30% de los pacientes con EII toman antidepresivos (Fuller‐Thomson 2006; Haapamaki 2013; Mikocka‐Walus 2012). A pesar de la relevancia clínica de este tema, solo hubo cuatro estudios (con 188 pacientes) de calidad suficiente para incluir en esta revisión sistemática.
La revisión indica con cautela que los antidepresivos mejoraron los síntomas de ansiedad y depresión. No hubo diferencias entre los grupos en cuanto a las náuseas o el retiro del estudio debido a los eventos adversos. Los antidepresivos se asociaron con algunos beneficios para la CdV y la actividad de la enfermedad. Sin embargo, el análisis con criterios GRADE indicó que la certeza general de la evidencia fue muy baja, debido al pequeño tamaño de la muestra, los datos de resultado incompletos y la heterogeneidad en la población y el tipo de tratamiento antidepresivo, por lo que se necesitan más estudios bien diseñados. Por tanto, se necesitan ensayos que examinen la función de los antidepresivos en la EII para aclarar si los resultados actuales son consistentes.
Resumen de los resultados principales
Hasta un 30% de los pacientes con EII toman antidepresivos (Fuller‐Thomson 2006; Haapamaki 2013; Mikocka‐Walus 2012). A pesar de la relevancia clínica de este tema, solo hubo cuatro estudios (188 participantes) que cumplieron los criterios de inclusión (Chojnacki 2011; Daghaghzadeh 2015; Goodhand 2012; Mikocka‐Walus 2016c). Dos estudios eran ECA doble ciego (Daghaghzadeh 2015; Mikocka‐Walus 2016c). Un estudio era un ensayo controlado no aleatorio (Chojnacki 2011), y el estudio final fue un estudio observacional retrospectivo de casos pareados (Goodhand 2012).
Los síntomas de ansiedad y depresión mejoraron a las 12 semanas y a los 12 meses en los participantes que recibían antidepresivos en comparación con el placebo. No hubo diferencias entre los grupos en cuanto a los eventos adversos a los 12 meses o el retiro del estudio debido a los eventos adversos a las 12 semanas o 12 meses. La CdV física, psicológica, social y ambiental mejoró a las 12 semanas en comparación con diferencias de ningún grupo a los 12 meses. La actividad de la enfermedad según los índices específicos también mejoró en el grupo que recibió antidepresivos. Sin embargo, no hubo diferencias grupales en la remisión clínica a los 12 meses (según el CDAI y la calprotectina fecal) ni la tasa de recaída a los 12 meses (según la endoscopia o la calprotectina fecal). No hubo diferencias entre los grupos en cuanto a los ingresos hospitalarios ni la necesidad del tratamiento con corticosteroides. No se informó la gravedad del dolor ni la cirugía en los estudios incluidos.
Compleción y aplicabilidad general de las pruebas
Los resultados de esta revisión son aplicables a adultos con enfermedad de Crohn y colitis ulcerosa, aunque a esta altura no está claro si los pacientes con cualquiera de los subtipos de EII pueden obtener más beneficio con el tratamiento antidepresivo. Los estudios incluidos en esta revisión evaluaron a diferentes poblaciones con EII. Por ejemplo, un estudio limitó la intervención a los participantes que informaron sobre síntomas de ansiedad y depresión (Chojnacki 2011), mientras los otros estudios no lo hicieron. Un estudio incluyó a participantes con actividad de la enfermedad diversa (Goodhand 2012), mientras los otros incorporaron a participantes que estaban en remisión. Dos estudios incluyeron a participantes con enfermedad de Crohn y colitis ulcerosa (Daghaghzadeh 2015; Goodhand 2012), mientras los otros examinaron solo un subtipo de EII. La base general de la evidencia no está completa. El tamaño de la muestra en los estudios incluidos fue pequeño, y no fue posible recopilar los datos para algunos de los resultados predefinidos (p.ej. gravedad de dolor y cirugía). Varios resultados solo fueron informados por un estudio (p.ej. PCR, citocinas, calprotectina fecal, recaída endoscópica, ingresos hospitalarios, necesidad de corticosteroides). Los cuatro estudios evaluaron diferentes clases de antidepresivos, por lo que es escasa la evidencia que apoya el uso de un tipo particular de antidepresivo. La certeza de esta evidencia fue muy baja y se necesitan estudios adicionales antes de que puedan establecerse conclusiones firmes.
Calidad de la evidencia
Un ECA se consideró de riesgo bajo de sesgo (Mikocka‐Walus 2016c). El otro ECA se calificó como de riesgo de sesgo alto por los datos de resultados incompletos. El ensayo controlado no aleatorio se calificó como de riesgo de sesgo alto para la generación de la secuencia aleatoria, la ocultación de la asignación y el cegamiento de los participantes y el personal. Aunque el estudio observacional obtuvo una buena puntuación en la Newcastle‐Ottawa scale, todavía se considera en riesgo de sesgo alto en comparación con ECA dado el diseño observacional (Goodhand 2012).
El análisis con criterios GRADE indicó que la certeza general de la evidencia que apoya los resultados de ansiedad, depresión, CdV, eventos adversos y actividad de la enfermedad fue baja o muy baja debido a la imprecisión grave y el riesgo de sesgo alto (datos de resultados incompletos) en un estudio.
Sesgos potenciales en el proceso de revisión
Se tomaron medidas para asegurar que los autores de la revisión que redactaron uno de los ensayos incluidos no extrajeran datos o evaluaran la calidad de los estudios (Mikocka‐Walus 2016c). Los autores que no participaron en el ensayo anterior (SLP, SK, JP) realizaron esta tarea. Todos los estudios fueron evaluados para su inclusión por dos autores independientes y cualquier desacuerdo se resolvió mediante un tercer autor. Dos autores de la revisión extrajeron todos los datos de forma independiente. Además, para reducir cualquier sesgo de idioma, no se impusieron restricciones de idioma en la revisión actual y se tradujo el estudio polaco incluido (Chojnacki 2011), así como los dos estudios excluidos no ingleses (Eirund 1998; Xie 2014).
Las limitaciones de la presente revisión incluyen la desviación de un diseño de ECA generalmente utilizado en las revisiones de efectividad. Se decidió expandir los criterios de inclusión para comprender estudios no aleatorios y aumentar la cantidad de estudios incluidos en la revisión. Se decidió por no realizar un análisis de subgrupos sobre la base del tipo de EII (es decir, enfermedad de Crohn o colitis ulcerosa) debido al tamaño de la muestra muy pequeño por grupo de comparación. También se decidió usar un modelo de efectos fijos para el análisis aun cuando la heterogeneidad era significativa. Se sabe que esta decisión puede ser polémica, pero surgió a partir de la necesidad de reducir el sesgo inherente en las revisiones con estudios de tamaño de la muestra pequeño. Aunque se intentó realizar un metanálisis, solo pudieron combinarse los datos sobre náuseas a los 12 meses ya que la heterogeneidad fue baja. Los otros datos en que se presentan dos estudios en el diagrama de bosque no pudieron combinarse debido a los niveles altos de heterogeneidad.
Acuerdos y desacuerdos con otros estudios o revisiones
Los resultados de esta revisión son congruentes con las dos revisiones anteriores que se atuvieron solo a la síntesis de datos (Macer 2017; Mikocka‐Walus 2006). Esta revisión constituye el primer intento de un metanálisis en el área.

Study flow diagram.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Comparison 1 Antidepressants versus placebo, Outcome 1 Anxiety at 12 weeks.

Comparison 1 Antidepressants versus placebo, Outcome 2 Anxiety at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 3 Depression at 12 weeks.

Comparison 1 Antidepressants versus placebo, Outcome 4 Depression at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 5 Adverse events at 12 months.
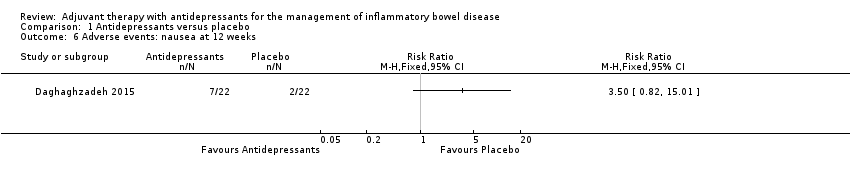
Comparison 1 Antidepressants versus placebo, Outcome 6 Adverse events: nausea at 12 weeks.

Comparison 1 Antidepressants versus placebo, Outcome 7 Adverse events: nausea at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 8 Study withdrawal due to adverse events at 12 weeks.
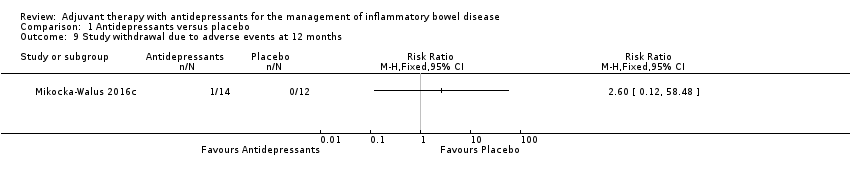
Comparison 1 Antidepressants versus placebo, Outcome 9 Study withdrawal due to adverse events at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 10 Physical QoL at 12 weeks.
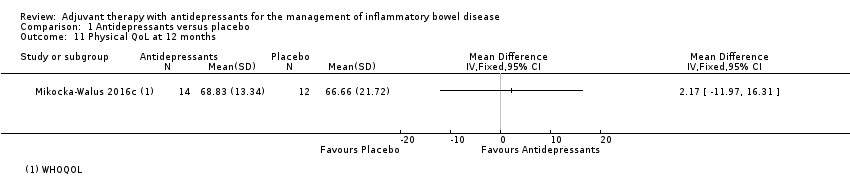
Comparison 1 Antidepressants versus placebo, Outcome 11 Physical QoL at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 12 Psychological QoL at 12 weeks.

Comparison 1 Antidepressants versus placebo, Outcome 13 Psychological QoL at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 14 Social QoL at 12 weeks.
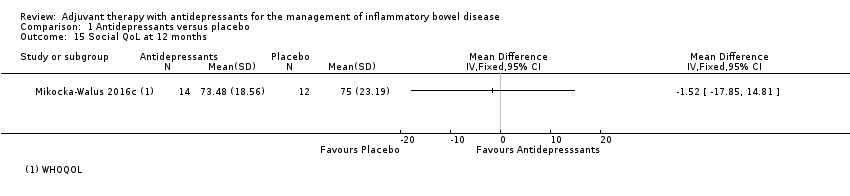
Comparison 1 Antidepressants versus placebo, Outcome 15 Social QoL at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 16 Environmental QoL at 12 weeks.
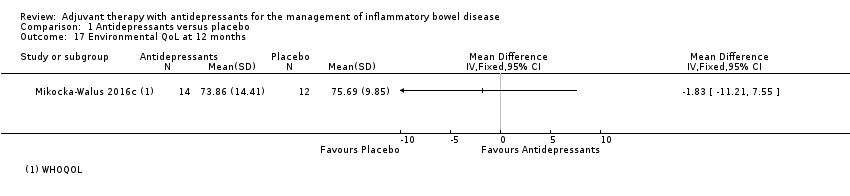
Comparison 1 Antidepressants versus placebo, Outcome 17 Environmental QoL at 12 months.
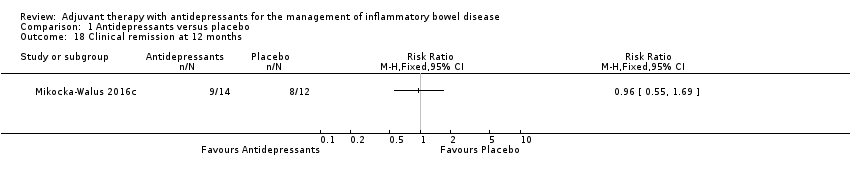
Comparison 1 Antidepressants versus placebo, Outcome 18 Clinical remission at 12 months.
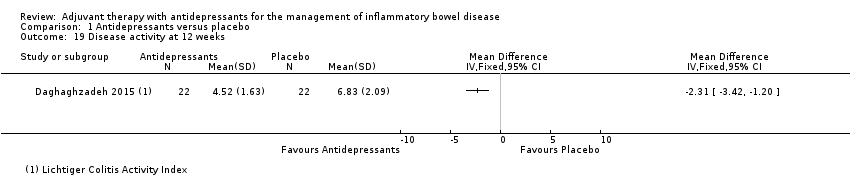
Comparison 1 Antidepressants versus placebo, Outcome 19 Disease activity at 12 weeks.
Comparison 1 Antidepressants versus placebo, Outcome 20 Disease activity at 12 months.
Comparison 1 Antidepressants versus placebo, Outcome 21 Endoscopic relapse at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 22 Relapse using faecal calprotectin at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 23 CRP at 12 months.

Comparison 1 Antidepressants versus placebo, Outcome 24 Cytokines TH Effector Memory RA at 6 months.
Comparison 1 Antidepressants versus placebo, Outcome 25 Cytokines TC Effector Memory RA at 6 months.
Comparison 1 Antidepressants versus placebo, Outcome 26 Interleukin‐10 at 6 months.
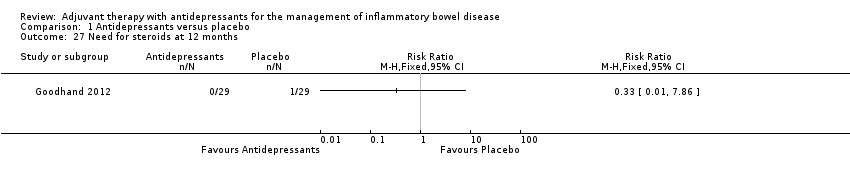
Comparison 1 Antidepressants versus placebo, Outcome 27 Need for steroids at 12 months.
| Antidepressants compared to placebo for inflammatory bowel disease | ||||||
| Patient or population: participants with active and inactive inflammatory bowel disease | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Certainty of the evidence | Comments | |
| Risk with Placebo | Risk with Antidepressants | |||||
| Anxiety at 12 weeks | The mean anxiety was 8.5 (SD = 3.45) | The mean anxiety was 6.11 (SD = 3) MD 2.39 lower | ‐ | 44 | ⊕⊕⊝⊝ | Anxiety was assessed using the HADS |
| Anxiety at 12 months | The mean anxiety was 4.2 (SD = 4.9) | The mean anxiety was 3.8 (SD = 2.5) MD ‐0.40 lower | ‐ | 26 | ⊕⊕⊝⊝ | Anxiety was assessed using the HADS A second non‐randomised study using the HARS reported a mean score of 12.65 + 3.76 in the antidepressant group (n = 30) compared to 17.85 + 3.33 in the placebo group (n = 30) (MD ‐5.20, 95% CI ‐7 to ‐3.40; very low certainty evidence) |
| Depression at 12 weeks | The mean depression was 10.5 (SD = 3.57) | The mean depression was 7.47 (SD = 2.42) MD ‐3.03 lower | ‐ | 44 | ⊕⊕⊝⊝ | Depression was assessed using the HADS |
| Depression at 12 months | The mean depression was 3.1 (SD = 3.4) | The mean depression was 2.9 (SD = 2.8) MD ‐0.20 lower | ‐ | 26 | ⊕⊕⊝⊝ | Depression was assessed using the HADS A second non‐randomised study using the Beck Depression Inventory reported a mean score of 9.6 + 2.76 in the antidepressant group (n = 30) compared to 16.35 + 5.41 in the placebo group (n = 30) (MD ‐6.75, 95% CI ‐8.92 to ‐4.58; very low certainty evidence) |
| Adverse events at 12 months | 250 per 1,000 | 573 per 1,000 | RR 2.29 | 26 | ⊕⊕⊝⊝ | Commonly reported adverse events include nausea, headache, dizziness, drowsiness, sexual problems, insomnia, fatigue, low mood/anxiety, dry mouth muscle spasms and hot flushes None of the included studies reported any serious adverse events |
| Quality of life | ‐ | ‐ | See comment | 70 | ⊕⊕⊝⊝ | Quality of life was assessed using the WHO‐QOL‐BREF We were unable to pool data as the outcome was reported at 12 weeks in 1 trial (44 participants) and 12 months in 1 trial (26 participants). Physical, Psychological, Social and Environmental QoL were improved only at 12 weeks with no group difference at 12 months |
| Pain | Not reported | No studies reported this outcome | ||||
| Maintenance of remission at 12 months | 667 per 1,000 | 640 per 1,000 | RR 0.96 | 26 | ⊕⊕⊝⊝ | Maintenance of remission was measured by the CDAI (< 150) and fecal calprotectin levels |
| Endoscopic relapse at 12 months | 0 per 1,000 | 0 per 1,000 | RR 0.14 | 60 | ⊕⊝⊝⊝ | Non‐randomised study. We were unable to calculate absolute effects. Endoscopic relapse occurred in 0% (0/30) of participants in the antidepressants group compared to 10% (3/30) in the placebo group |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Downgraded one level due to serious imprecision (44 participants) 2 Downgraded one level due to high risk of bias (incomplete outcome data) 3 Downgraded two levels due very serious imprecision (26 participants) 4 Downgraded two levels due very serious imprecision (11 events) 5 Downgraded two levels due very serious imprecision (17 events). 6 Downgraded one level due to very serious imprecision (3 events) and a large CI around the point estimate | ||||||
| Case Control Study | Is the case definition adequate? (/1) | Representativeness of the cases (/1) | Selection of controls (/1) | Definition of controls (/1) | Comparability of cases and controls on the basis of the design or analysis (/2) | Assessment of exposure (/1) | Same method of ascertainment for cases and controls (/1) | Non‐Response Rate (/1) | |
| Goodhand (2012) | 1 | ‐ | 1 | ‐ | 2 | 1 | 1 | 1 | 7 |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Anxiety at 12 weeks Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 2 Anxiety at 12 months Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 3 Depression at 12 weeks Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 4 Depression at 12 months Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 5 Adverse events at 12 months Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 6 Adverse events: nausea at 12 weeks Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 7 Adverse events: nausea at 12 months Show forest plot | 2 | 86 | Risk Ratio (M‐H, Fixed, 95% CI) | 4.02 [0.74, 22.03] |
| 8 Study withdrawal due to adverse events at 12 weeks Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 9 Study withdrawal due to adverse events at 12 months Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 10 Physical QoL at 12 weeks Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 11 Physical QoL at 12 months Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 12 Psychological QoL at 12 weeks Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 13 Psychological QoL at 12 months Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 14 Social QoL at 12 weeks Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 15 Social QoL at 12 months Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 16 Environmental QoL at 12 weeks Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 17 Environmental QoL at 12 months Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 18 Clinical remission at 12 months Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 19 Disease activity at 12 weeks Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 20 Disease activity at 12 months Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 21 Endoscopic relapse at 12 months Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 22 Relapse using faecal calprotectin at 12 months Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 23 CRP at 12 months Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 24 Cytokines TH Effector Memory RA at 6 months Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 25 Cytokines TC Effector Memory RA at 6 months Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 26 Interleukin‐10 at 6 months Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 27 Need for steroids at 12 months Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |

