Información a los médicos sobre la adherencia a la medicación para los pacientes con enfermedades crónicas que toman medicamentos a largo plazo
Resumen
Antecedentes
La adherencia deficiente a la medicación reduce la eficacia del tratamiento y empeora los resultados clínicos, aunque las tasas promedio de la adherencia a los tratamientos farmacológicos a largo plazo para las enfermedades crónicas son sólo de alrededor del 50%. Las intervenciones para mejorar la adherencia a la medicación en gran parte se centran en los pacientes en lugar de en los médicos; sin embargo, las estrategias que mostraron ser efectivas son complejas y difíciles de ejecutar en la práctica clínica. Se necesitan modelos nuevos de atención que consideren el problema de la adherencia a la medicación, e integren este problema al proceso de asistencia al enfermo. Los médicos tienden a sobrestimar cuán correctamente los pacientes toman la medicación según lo prescrito. Este hecho puede dar lugar a que se desaprovechen oportunidades de cambiar la medicación, de resolver los efectos adversos o de proponer el uso de recordatorios para mejorar la adherencia del paciente. Por lo tanto, la información a los médicos sobre la adherencia a la medicación tiene el potencial de impulsar cambios que mejoran la adherencia de los pacientes a los fármacos prescritos.
Objetivos
Evaluar los efectos de proporcionar información a los médicos acerca de la adherencia a la medicación de los pacientes para mejorar la adherencia. También se evaluaron los efectos de la intervención sobre los resultados del paciente, el uso de recursos de salud y los procesos de atención.
Métodos de búsqueda
Se realizó una búsqueda sistemática en el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL), MEDLINE y Embase, en todos desde el inicio de la base de datos hasta diciembre de 2016 y sin restricción de idioma. También se hicieron búsquedas en ISI Web of Science, en dos registros de ensayos y en la literatura gris.
Criterios de selección
Se incluyeron ensayos aleatorios, estudios controlados de antes y después, y estudios de series de tiempo interrumpido que compararon los efectos de proporcionar información a los médicos acerca de la adherencia de los pacientes a la mediación a largo plazo prescrita para las enfermedades crónicas versus atención habitual. Se incluyeron estudios publicados o no publicados en cualquier idioma. Los participantes incluyeron cualquier médico y cualquier paciente al que se le hubiese prescrito medicación a largo plazo para las enfermedades crónicas. Se incluyeron intervenciones que proporcionaban información al médico que realizó la prescripción acerca de la adherencia del paciente a la medicación. Sólo reunieron los requisitos para la inclusión los estudios en los cuales la información al médico era la única intervención o el componente esencial de una intervención multifacética. En los grupos de comparación, los médicos no debían haber tenido acceso a información acerca de la adherencia de los pacientes a la medicación. Se consideraron los siguientes resultados: adherencia a la medicación, resultados de los pacientes, uso de recursos de salud, procesos de atención y eventos adversos.
Obtención y análisis de los datos
Dos autores de la revisión independientes extrajeron y analizaron todos los datos utilizando los procedimientos metodológicos estándar previstos por Cochrane y el Grupo Cochrane para una Práctica y Organización Sanitaria Efectivas (Effective Practice and Organisation of Care group). Debido a la heterogeneidad en la metodología de estudio, los grupos de comparación, los contextos de intervención y las mediciones de los resultados, no se realizó el metanálisis. Se describió el impacto de las intervenciones en los resultados en forma tabular y se realizó una evaluación cualitativa de los efectos de los estudios.
Resultados principales
Se incluyeron nueve estudios (23 255 pacientes): ocho ensayos aleatorios y un análisis de series de tiempo interrumpido. Los estudios tuvieron lugar en ámbitos de atención primaria y otros ámbitos ambulatorios en los EE.UU. y Canadá. Siete intervenciones incluyeron la provisión sistemática de información a los médicos en cuanto a la adherencia de todos los pacientes a la medicación, y dos intervenciones incluyeron la emisión de una alerta sólo para los pacientes no adherentes. Siete estudios usaron datos de la renovación en la farmacia para evaluar la adherencia a la medicación, y dos usaron un dispositivo electrónico o de autoinforme. La definición de adherencia difirió entre los estudios, lo cual dificultó las comparaciones. Ocho estudios estuvieron en alto riesgo de sesgo, y un estudio estuvo en riesgo poco claro de sesgo. La fuente más frecuente de sesgo fue la ausencia de protección contra la contaminación.
La información a los médicos puede dar lugar a poca o ninguna diferencia en la adherencia a la medicación (siete estudios, 22 924 pacientes), los resultados de los pacientes (dos estudios, 1292 pacientes) o el uso de recursos de salud (dos estudios, 4181 pacientes). La información a los médicos sobre la adherencia a la medicación puede mejorar los procesos de atención (p.ej. más cambios en la medicación, diálogo con el paciente, tratamiento de la hipertensión no controlada) en comparación con la atención habitual (cuatro estudios, 2780 pacientes). Ninguno de los estudios informó un evento adverso debido a la intervención. La certidumbre de la evidencia fue baja para todos los resultados, principalmente debido al alto riesgo de sesgo, la heterogeneidad alta entre los estudios y la imposibilidad para generalizar la evidencia.
Conclusiones de los autores
A través de nueve estudios, se observó poca o ninguna evidencia de que la provisión de información a los médicos con respecto a la adherencia de los pacientes a la medicación prescrita mejoró la adherencia a la medicación, los resultados de los pacientes, o el uso de recursos de salud. La información acerca de la adherencia a la medicación puede mejorar los procesos de atención, aunque debido al número pequeño de estudios que evaluaron este resultado y al alto riesgo de sesgo, no es posible establecer conclusiones firmes sobre el efecto de la información en este resultado. La investigación futura debe usar una definición clara y estandarizada de adherencia a la medicación, y la asignación al azar por grupos para evitar el riesgo de contaminación.
PICO
Resumen en términos sencillos
Información a los médicos sobre la adherencia a la medicación para los pacientes con enfermedades crónicas que toman medicamentos a largo plazo
¿Cuál es el objetivo de esta revisión?
El objetivo de esta revisión Cochrane fue determinar si la información a los médicos acerca de la adherencia a la medicación de los pacientes con enfermedades crónicas que toman medicamentos a largo plazo puede mejorar la adherencia, los resultados de los pacientes, el uso de recursos de salud y los procesos de atención.
Mensajes clave
La información a los médicos acerca de la adherencia a la medicación de los pacientes puede dar lugar a poca o ninguna diferencia en la adherencia de los pacientes a los fármacos prescritos, los resultados de los pacientes y el uso de recursos de salud, aunque puede mejorar los procesos de atención. La calidad de la evidencia es baja.
¿Qué se estudió en la revisión?
Los médicos tienden a sobrestimar cuán correctamente los pacientes toman la medicación según lo prescrito y por lo tanto pierden oportunidades para mejorar la adherencia. Estas oportunidades incluyen acciones como cambiar la medicación, resolver los efectos adversos, y proponer el uso de recordatorios de la medicación. Por lo tanto, la información a los médicos acerca de la adherencia a la medicación de los pacientes podría cambiar el comportamiento de los médicos y a su vez mejoraría la adherencia a la medicación.
¿Cuáles son los principales resultados de la revisión?
Se encontraron nueve estudios bien diseñados con 23 255 pacientes. Todos los estudios se realizaron en el ámbito ambulatorio. Se encontró que la información a los médicos acerca de la adherencia a la medicación de los pacientes puede dar lugar a poca o ninguna diferencia en la adherencia, los resultados de los pacientes o el uso de recursos de salud, aunque puede mejorar los procesos de atención. La información a los médicos de forma aislada probablemente es insuficiente para afectar la adherencia. La certidumbre de la evidencia para cada resultado es baja.
¿Cuál es el grado de actualización de esta revisión?
Se hicieron búsquedas de estudios que se habían publicado hasta el 2 diciembre 2016.
Conclusiones de los autores
Summary of findings
| Feedback on medication adherence to physicians versus usual care | |||
| Patient or population: any physician, and any patient treated for chronic diseases with long‐term medication use Settings: hospitals or community, USA and Canada Intervention: feedback on medication adherence to physicians Comparison: usual care | |||
| Outcomes | Effect of providing feedback on medication adherence to physicians | No of patients | Certainty of the evidence |
| Medication adherence Percentage of 'days covered' by medication (medication possession ratio), percentage of 'time covered', percentage of non‐adherent patients, 'time‐to‐refill' (i.e. the number of days between the date where the patient was declared 7 days overdue, and the date of the next refill) | Intervention may lead to little or no difference to medication adherence | 22,924 (7 studies) | ⊕⊕⊝⊝ |
| Patient outcomes Lipid levels, HbA1C level, HIV viral load, number of major atherosclerosis disease events | Intervention may lead to little or no difference to patient outcomes | 1292 | ⊕⊕⊝⊝ |
| Health resource use Rate of hospitalisations, rate of emergency department encounters, rate of outpatient encounters, rate of oral steroid use | Intervention may lead to little or no difference to health resource use | 4181 | ⊕⊕⊝⊝ |
| Processes of care Rate of medication change (medication discontinued, added, replaced), proportion of visits with appropriate management of uncontrolled hypertension, patient rating (quality of care, duration of the visit, communication with physician), patient‐physician dialogue (utterance related to treatment, medication adherence, side effects) | Intervention may improve processes of care. | 2780 | ⊕⊕⊝⊝ |
| Adverse events | None of the 9 studies reported an adverse event due to the intervention. | — | — |
| GRADE Working Group grades of evidence *Substantially different = a large enough difference that it might affect a decision. | |||
| aEvidence downgraded one level due to limitations in the design and implementation: high risk of contamination bias. | |||
Antecedentes
Descripción de la afección
La adherencia a la medicación es el proceso por el cual los pacientes toman la medicación según lo prescrito (Vrijens 2012). En los países desarrollados, las tasas de adherencia a los tratamientos farmacológicos a largo plazo para las enfermedades crónicas son de media un 50% (Sabaté 2003). Las consecuencias de la adherencia deficiente a la medicación incluyen una eficacia comprometida del tratamiento, peores resultados clínicos (DiMatteo 2002; Simpson 2006), y mayores costos de asistencia sanitaria (Sokol 2005).
Descripción de la intervención
La intervención es un método de información al médico que prescribe acerca de la adherencia de los pacientes a la medicación, de forma independiente del método usado para medir la adherencia (p.ej. datos de la renovación, dispositivo electrónico, autoinforme), la manera de aportar información al médico (p.ej. informe impreso, software electrónico) y el momento adecuado o la frecuencia de la información (p.ej. alerta para los pacientes no adherentes, provisión sistemática de información a los médicos).
De qué manera podría funcionar la intervención
La información a los médicos sobre la adherencia a la medicación puede considerar tres barreras al manejo óptimo de la adherencia del paciente a los fármacos prescritos identificadas por la Organización Mundial de la Salud (OMS) (Sabaté 2003): la falta de concientización acerca de la adherencia entre los profesionales de la salud; la ausencia de herramientas clínicas para ayudar a los profesionales de la salud a evaluar la adherencia a la medicación y de intervenciones para mejorarla; y la comunicación subóptima entre los pacientes y los profesionales de la salud. Por lo general los médicos son incapaces de identificar a los pacientes no adherentes. Tienden a sobrestimar cuán correctamente los pacientes toman la medicación y a reconocer a menos de la mitad de los pacientes no adherentes (Meddings 2012; Miller 2002; Mushlin 1977; Zeller 2008). Los médicos, por lo tanto, pierden muchas oportunidades de mejorar la adherencia.
Al mismo tiempo, la relación profesional‐paciente es un determinante principal de la adherencia a la medicación (Arbuthnott 2009; Epstein 2004; Harmon 2006; Haskard Zolnierek 2009). La provisión de información acerca de la administración de medicación a los médicos podría promover el diálogo con los pacientes, y potencialmente dar lugar a estrategias más personalizadas para mejorar la adherencia al tratamiento. A falta de dicha información, los médicos pueden creer equivocadamente que la enfermedad en los pacientes no adherentes es poco receptiva al tratamiento, lo cual puede dar lugar a que aumenten las dosis del fármaco cuando, en realidad, los pacientes no habían tomado la medicación según lo prescrito (Heisler 2008). Por el contrario, los médicos pueden ser renuentes a intensificar el tratamiento para un paciente en particular en los casos en que dicha intensificación es realmente necesaria, debido a que sospechan incorrectamente que el paciente no está siguiendo el tratamiento de forma correcta. Finalmente, la información acerca de la adherencia a la medicación podría ayudar a los médicos a determinar las causas de dicha falta de adherencia. Por ejemplo, los efectos adversos pueden representar una gran parte de los casos de falta de adherencia aunque, lamentablemente, un 37% de los pacientes no tratan dichos problemas con los médicos, incluso cuando la mayoría de estos efectos pueden prevenirse o atenuarse (Gandhi 2003). Varios estudios también han indicado que el costo y la complejidad del régimen pueden aumentar las tasas de no adherencia (Ingersoll 2008; Piette 2004; Shrank 2006). Por lo tanto, la información de los médicos acerca de la adherencia de los pacientes les proporcionaría oportunidades para explicar la enfermedad y su tratamiento al paciente, evaluar y tratar los efectos secundarios, cambiar a una medicación menos costosa o con reembolsos, o reducir la complejidad del régimen de medicación. Estos cambios en los procesos de atención tienen el potencial de en último término mejorar la adherencia.
Por qué es importante realizar esta revisión
Algunos autores han sugerido que la mejoría en la adherencia a la medicación podría tener un mayor impacto sobre la salud que los adelantos en el tratamiento en sí (Sabaté 2003; Woolf 2005). Se han publicado varias revisiones sobre el tema de la falta de adherencia a la medicación (Kripalani 2007; Nieuwlaat 2014; Viswanathan 2012), aunque se centran principalmente en las intervenciones dirigidas a los pacientes en lugar de a los médicos. Hay alguna evidencia de que las intervenciones que se dirigen a los pacientes pueden tener efectos beneficiosos sobre la adherencia de los pacientes a la medicación. Sin embargo, todas las intervenciones efectivas son complejas. Incluyen combinaciones de componentes, como orientación del paciente, información, apoyo conductual y recordatorios, que son difíciles de ejecutar en la práctica clínica y no dan lugar a mejorías grandes en la adherencia (Nieuwlaat 2014). Esta revisión estudia una intervención que es relativamente fácil de ejecutar en la práctica clínica y se centra en los médicos.
Objetivos
Evaluar los efectos de proporcionar información a los médicos acerca de la adherencia a la medicación de los pacientes para mejorar la adherencia. También se evaluaron los efectos de la intervención sobre los resultados de los pacientes, el uso de recursos de salud y los procesos de atención.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron ensayos aleatorios individuales y con asignación al azar grupal; sin embargo, debido a que los mismos a menudo no están disponibles para considerar asuntos relacionados con los efectos de la práctica y la organización de las intervenciones de atención, también se incluyeron estudios controlados de antes y después y estudios de series de tiempo interrumpido, que cumplían con los criterios de diseño de estudios del Grupo Cochrane para una Práctica y Organización Sanitaria Efectivas (Cochrane Effective Practice and Organisation of Care, EPOC) (EPOC 2013a). Se incluyeron estudios publicados o no publicados en cualquier idioma.
Tipos de participantes
Se consideró a los médicos de cualquier área, de forma independiente de la especialidad, que trabajaban en hospitales o en la comunidad. Los pacientes incluyeron a cualquier adulto o niño tratado por enfermedades crónicas con medicación a largo plazo (es decir sin fecha final del período de tratamiento), de forma independiente de la medicación prescrita, la vía de administración, o la adherencia a la medicación inicial.
Tipos de intervenciones
Se incluyeron intervenciones que procuraban mejorar la adherencia a la medicación, los resultados de los pacientes, el uso de recursos de salud o los procesos de atención al proporcionar información al médico que realizó la prescripción acerca de la adherencia de los pacientes a la medicación, de forma independiente del método usado para medir la adherencia (p.ej. datos de la renovación, dispositivo electrónico, autoinforme), la forma de proporcionar información al médico (p.ej. informe impreso, software electrónico), o el momento adecuado y la frecuencia de la información (p.ej. alerta para pacientes no adherentes, provisión sistemática de información a los médicos). En los grupos de comparación, los médicos no debían haber tenido acceso a información acerca de la adherencia a la medicación de los pacientes; se excluyeron los estudios en los cuales tanto el grupo de intervención como el de control recibieron información acerca de la adherencia a la medicación.
Se incluyeron estudios en los cuales la información al médico era la única intervención o el componente esencial de una intervención multifacética. En las intervenciones multifacéticas, se hizo la distinción entre "componente esencial"?? y "componente no esencial"? mediante la misma metodología que Ivers 2012: en los casos en que la información era un agregado a una intervención multifacética que podría ofrecerse fácilmente en su ausencia, el mismo se consideró un componente no esencial y se excluyó el estudio debido a que no hubiese sido posible desentrañar los efectos de los diferentes componentes. Por el contrario, cuando se consideró que era improbable que los otros componentes de la intervención se usaran en ausencia de información, o cuando se basaban en la información como la intervención principal, el mismo se clasificó como un componente esencial se incluyó el estudio. Se excluyeron los estudios que dirigían la información al paciente (la información dirigida al paciente se determinó como una intervención conductual del tipo "recompensas y refuerzo"? (Kripalani 2007).
Tipos de medida de resultado
Se consideraron los siguientes resultados: adherencia a la medicación, resultados de los pacientes, uso de recursos de salud y procesos de atención. Se incluyeron todos los estudios que informaban sobre al menos uno de los resultados primarios o secundarios descritos a continuación.
Resultados primarios
Adherencia a la medicación, de forma independiente de la definición y el método de cálculo (p.ej. porcentaje de "días cubiertos"? por la medicación, porcentaje de pacientes no adherentes, número de días antes de una renovación de la medicación).
Resultados secundarios
-
Resultados de los pacientes (p.ej. puntuación de la actividad de la enfermedad, control de la presión arterial, niveles de lípidos).
-
Uso de recursos de salud (p.ej. tasa de hospitalizaciones).
-
Procesos de atención, relacionados o no con la adherencia a la medicación (p.ej. prácticas de prescripción, tasa y naturaleza del cambio de medicación, naturaleza del diálogo médico‐paciente, tiempo dedicado al paciente).
-
Eventos adversos: se realizaron búsquedas de informes de los efectos adversos en los estudios incluidos (p.ej. cancelación de la consulta médica por parte del paciente, que podía reaccionar negativamente a la intervención).
Results
Description of studies
Results of the search
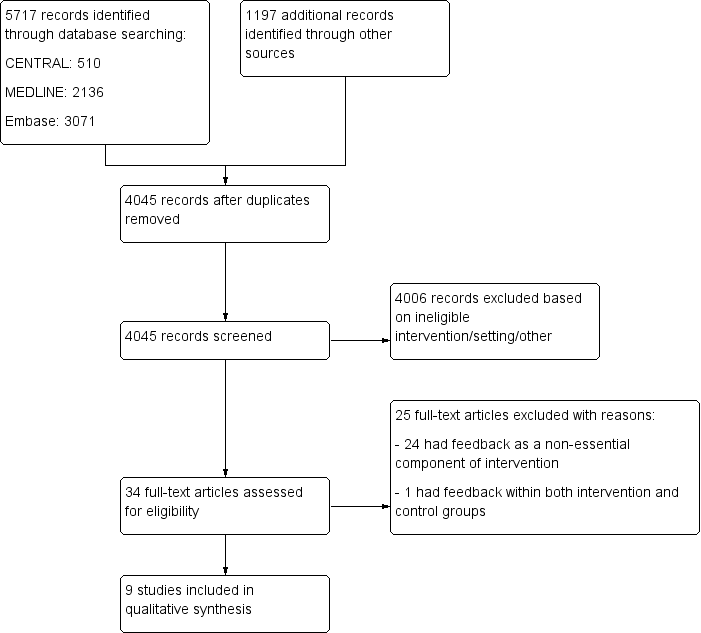
In total, we identified 5717 records from electronic database searches and 1197 records from other sources (see the flow diagram for study selection in Figure 1). We eliminated duplicates and screened 4045 studies by title and abstract, and we excluded 4006 studies that did not meet the eligibility criteria. We identified 34 full‐text articles that appeared to be relevant. We excluded 25 (see Characteristics of excluded studies) and included 9 (Bambauer 2006; Bieszk 2003; Kronish 2016; Nietert 2009; Pladevall 2015; Tamblyn 2010; Williams 2010; Willis 2013; Wilson 2010; see Characteristics of included studies),

Flow diagram for study selection.
Included studies
Study characteristics
We summarise the key features of the nine included studies in the Characteristics of included studies. Five studies were randomised trials (including one cross‐over design) in individuals, three were cluster‐randomised trials, and one was an interrupted time series study. Eight studies were based in the USA and one in Canada (Tamblyn 2010). Publication dates ranged from 2003 to 2016, with six studies published in 2010 or later. All studies took place in an outpatient setting. Three studies involved between 156 and 231 patients, five between 1136 and 2698 patients, and one involved 13,128 patients.
Five of the nine studies specified that the number of physician participants ranged from 24 to 193 (Bieszk 2003; Kronish 2016; Nietert 2009; Williams 2010; Wilson 2010). Physician characteristics were poorly reported; one study specified their age. Most were primary care providers.
In accordance with the inclusion criteria, all studies concerned patient adherence to long‐term treatments: cardiovascular medications, antidiabetic drugs, antidepressants, antipsychotics, antiretroviral drugs, and/or asthma treatments. All studies included mainly adults (mean age 42 to 73 years). Two studies included a significant proportion of children with asthma (Williams 2010, with 44% patients under 18 years old, and Willis 2013, with 45% patients under 21 years old).
Table 1 shows details of the interventions implemented. We identified two main categories: one involved issuing alerts (e.g. fax alerts) for non‐adherent patients (Bambauer 2006; Nietert 2009), and the second involved the systematic provision of information about medication adherence for all patients. In four studies, physicians received a printed report before each patient's encounter (Bieszk 2003; Kronish 2016; Willis 2013; Wilson 2010), and in three studies, they received the information about adherence via electronic prescription software (Pladevall 2015; Tamblyn 2010; Williams 2010). Five of the nine included studies precisely described the support provided to the physician: three supports displayed adherence as a graph (Tamblyn 2010; Williams 2010; Willis 2013), one as a table (Kronish 2016), and one as text (Bambauer 2006). One study provided feedback twice for each patient (during two office visits) (Wilson 2010). The others studies did not clearly report the number of alerts or the number of visits for which the physician received feedback. Seven studies assessed adherence to treatment using refill data, and two other studies via an electronic device or a combination of an electronic device and self‐reporting (Kronish 2016; Wilson 2010).
| Study/country | Study type | Medication | Feedback type/delivery approach | Data source | Intervention description | Intervention received by control group of physicians group | N patients (N physicians)a |
| USA | ITS analysis | Antidepressants | Alert/faxed | Pharmacy refill data | Physicians were alerted via fax in real‐time when their patient had a gap of more than 10 days in refilling antidepressant prescription. | No intervention | 13,128 (NR) |
| USA | Cluster‐RT | Any medication | Systematic/printed report | Pharmacy refill data | A printed medication refill history report was provided to physicians before the patient's encounter. | No intervention | 231 (32) |
| USA | Cluster‐RT | Antihypertensive drugs | Systematic/printed report | Electronic device | A printed adherence report was provided to physicians before the patient's encounter. The report also provided clinical decision support by listing suggested clinical actions according to adherence status. | No intervention | 100 (49) |
| USA | RT | Medication used to treat diabetes, hypertension, hyperlipidaemia, heart failure, depression, or psychosis. | Alert/faxed | Pharmacy refill data | Physicians were alerted via fax once per week about patients with a gap of more than 7 days in refilling medication. Fax included patient adherence data and prompts to assist the patient. | No intervention | 2030 (175) |
| USA | RT | Oral diabetes medication and a lipid‐lowering medication | Systematic/electronic prescription software | Pharmacy refill data | Physicians were provided, via electronic prescription software, with medication adherence of their patients, along with HbA1C (glycated haemoglobin) and LDL‐C (low‐density lipoprotein cholesterol) measurements. Physicians could also view trends in a patient's medication adherence over time by drug class. Physicians were given instruction on how to interpret and discuss this information with patients. | No intervention | 1136 (NR) |
| Canada | RT | Lipid‐lowering or antihypertensive drugs | Systematic/Electronic prescription software | Pharmacy refill data | Physicians were provided, via electronic prescription software, with the list of prescribed and dispensed drugs; medication adherence for each drug; drug costs; out‐of‐pocket expenses; and received an alert for non‐adherent patients. | List of prescribed and dispensed drugs in the electronic prescription software. | 2293 (NR) |
| USA | Cluster‐RT | Anti‐asthma drugs | Systematic/electronic prescription software | Pharmacy refill data | Physicians were provided, via electronic prescription software, with adherence data for inhaled corticosteroid (ICS) use; the frequency of short‐acting beta‐agonist use; and the strength of each patient's current ICS prescription. In addition, the physician received asthma guidelines and methods for discussing non‐adherence with patients. | The physician received asthma guidelines and methods for discussing non‐adherence with patients. | 2698 (193) |
| USA | RT | Medication used to treat asthma, diabetes, hypertension, congestive heart failure, ischemic heart disease or stroke | Systematic/Printed report | Pharmacy refill data | A printed report was provided to physicians before the patient's encounter. The report contained a list of dispensed drugs with a calculation and a graphical depiction of adherence, and recommendations addressing possible deficiencies relative to pharmacotherapy guidelines. | No intervention | 1483 (NR) |
| USA | Cross‐over‐RT | Antiretroviral drugs | Systematic/Printed report | Electronic device + self report | A printed report was provided to physicians before the patient's encounter. The report included electronic adherence data and patient survey data (self‐reported adherence, reminder use, beliefs about antiretroviral drugs, reasons for missed doses, alcohol and drug use, and depression). | No intervention | 156 (41) |
ITS: Interrupted time series; MPR: medication possession ratio; NR: not reported; RT: randomised (controlled) trial.
aNumbers of participants refer to those included in the statistical analyses.
In the control arms, physicians did not receive any feedback about medication adherence and conducted office visits as usual.
Eight studies combined a secondary intervention with adherence feedback to the physician. These secondary interventions were the provision of additional information concerning the patients or their treatment to the physician (e.g. drugs costs, non‐formulary drug and alternatives, reminder use, beliefs about treatment, depression score, biological results) (Bieszk 2003; Tamblyn 2010; Wilson 2010), recommendations addressing issues related to medication adherence (e.g. clinical actions suggested according to adherence status, methods for discussing medication non‐adherence) (Kronish 2016; Nietert 2009; Williams 2010; Willis 2013), or both (Pladevall 2015). A secondary intervention occurred in the control arms of two studies. These interventions consisted of a list of prescribed and dispensed drugs in Tamblyn 2010 or asthma guidelines and recommendations addressing issues relating to adherence in Williams 2010.
Excluded studies
We describe 25 studies that initially seemed to meet the eligibility criteria and our reasons for subsequently excluding them in Characteristics of excluded studies.
Risk of bias in included studies
Figure 2 and Figure 3 show the results of the 'Risk of bias' assessment. Eight studies were at high overall risk because they were at high risk of bias in at least one domain. One study was at unclear risk of bias (Kronish 2016). The most common source of risk of bias was a lack of protection against contamination. The clarity of reporting regarding the risk of bias variables was frequently inadequate. The interrupted time series study was at high risk of bias because the outcome might have been influenced by confounding events during the study period. The three cluster‐randomised trials accounted for design effects in their analysis (Bieszk 2003; Kronish 2016; Williams 2010), as did the cross‐over study (Wilson 2010), so they were not affected by unit‐of‐analysis issues. One study had a reporting bias (Willis 2013), but this bias probably had no impact on the review's findings.
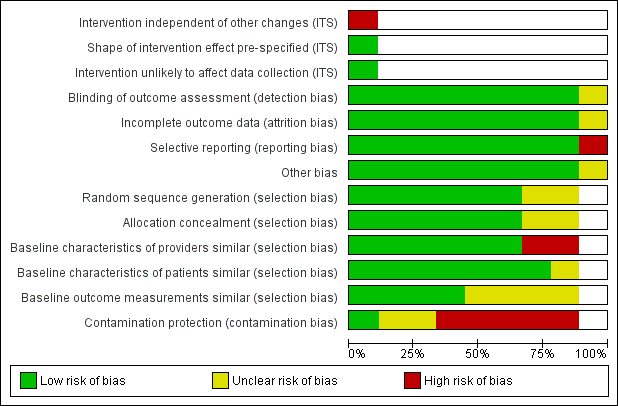
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Of the eight randomised trials, randomisation was adequate for six. (Kronish 2016; Nietert 2009; Pladevall 2015; Tamblyn 2010; Williams 2010; Willis 2013), and it was unclear for two studies (Bieszk 2003; Wilson 2010). The allocation unit was generally patients rather than physicians or practices. Only Williams 2010 included randomised groups of physicians, the best method for preventing the contamination of control participants.
Four of the nine studies correctly measured and reported the baseline outcomes (Pladevall 2015; Tamblyn 2010; Williams 2010; Wilson 2010). Two of the three studies in which providers differed between the intervention and control groups failed to report the baseline characteristics of the providers (Bieszk 2003; Williams 2010).
Blinding
Eight studies assessed the primary outcome variables blindly (Bambauer 2006; Bieszk 2003; Kronish 2016; Nietert 2009; Pladevall 2015; Tamblyn 2010; Williams 2010; Willis 2013). Blinded outcome assessment was unclear in one study (Wilson 2010): the primary outcome was objective, but self‐reported adherence and dialogue between physician and patient were not.
Incomplete outcome data
In eight studies, risk of bias was low in relation to incomplete outcome data. In Bieszk 2003, it was unclear owing to the fact that there is no indication of how the 51 data sets excluded from analyses were distributed between control and intervention groups.
Selective reporting
One study failed to report two outcomes (Willis 2013): 'medication adherence across all drug classes and conditions' and the secondary analyses on 'touched subjects' (subset of patients who actually received intervention). All other studies reported the results of all relevant outcomes described in the Methods.
Other potential sources of bias
One trial stopped early because an efficacy stopping rule was met at midpoint (Kronish 2016).
Effects of interventions
See: summary of findings Table for the main comparison.
The heterogeneity of study outcome definitions and reporting measures precluded meta‐analysis.
Medication adherence
Seven of the nine included studies assessed changes in medication adherence. However, the calculation methods differed between studies: four studies defined adherence as the percentage of 'days covered' by medication, or the 'medication possession ratio' (MPR) (Pladevall 2015; Tamblyn 2010; Williams 2010; Willis 2013), and one study defined adherence as the percentage of 'time covered', measured by medication using micro electro mechanical systems (MEMS) (Wilson 2010). Another study defined adherence as the percentage of non‐adherent patients and as the percentage of 'days uncovered' by medication (Bambauer 2006). Finally, the last study defined this outcome as the 'time‐to‐refill' (i.e. the number of days between the date when the patient was declared 7 days overdue and the date of the next refill) (Nietert 2009).
The intervention may lead to little or no difference to medication adherence (seven studies, 22,924 patients, low‐certainty evidence). Table 2 presents detailed results for medication adherence.
| Study | Definitions of the outcome 'medication adherence' | Result |
| Rate of patients more than 30 days overdue for prescription refilla | Immediate decrease of 2% (P = 0.15) then increase of 0.3% (P = 0.22) each month during the intervention. Over the entire study period, constant average of 75% (95% CI 72.7% to 77.3%) | |
| Proportion of days without treatment ('days uncovered')a | Immediate decrease of 2% (P = 0.15) then increase of 0.4% (P = 0.04) each month during the intervention. Over the entire study period, constant average of 40% (95% CI 38.4% to 41.6%) | |
| Median number of days from alert date to the next date of refill for any medication indicated for the patient's index disease (time‐to‐refill)a | Intervention group: 116 days; control group: 106 days HR 0.87 (98.3% CI 0.76 to 1.00; P > 0.05) | |
| Within 30 days of index date, filled prescription for any medication indicated for the patient's index disease | Intervention group: N = 213 (21.0%); control group: N = 243 (24.0%) OR 0.83 (97.5% CI 0.65 to 1.06; P > 0.05) | |
| Within 60 days of index date, filled prescription for any medication indicated for the patient's index disease | Intervention group: N = 342 (33.7%); control group: N = 373 (36.8%) OR 0.83 (98.3% CI 0.65 to 1.07; P > 0.05) | |
| Within 30 days of index date, filled prescription for any medication | Intervention group: N = 484 (47.6%); control group: N = 490 (48.3%) OR 0.99 (95% CI 0.81 to 1.19; P > 0.05) | |
| Adherence to oral diabetes medications at 6 months (MPR) | Intervention group: 0.74 ± 0.36; control group: 0.75 ± 0.35 Postintervention MD −0.01 (95% CI −0.72 to 0.70; P = 0.67) | |
| Adherence to oral diabetes medications at 12 months (MPR) | Intervention group: 0.74 ± 0.36; control group: 0.75 ± 0.35. Postintervention MD −0.01 (95% CI −0.72 to 0.70; P = 0.57) | |
| Adherence to oral diabetes medications at 18 months (MPR) | Intervention group: 0.73 ± 0.37; control group: 0.75 ± 0.36 Postintervention MD −0.02 (95% CI −0.75 to 0.71; P = 0.47) | |
| Adherence to lipid lowing medications at 6 months (MPR) | Intervention group: 0.69 ± 0.36; control group: 0.70 ± 0.37 Postintervention MD −0.01 (95% CI −0.74 to 0.72; P = 0.88) | |
| Adherence to lipid lowing medications at 12 months (MPR) | Intervention group: 0.69 ± 0.37; control group: 0.70 ± 0.36 Postintervention MD −0.01 (95% CI −0.74 to 0.72; P = 0.78) | |
| Adherence to lipid lowing medications at 18 months (MPR) | Intervention group: 0.70 ± 0.37; control group: 0.70 ± 0.37 Postintervention MD 0.00 (95% CI −0.74 to 0.74; P = 0.95) | |
| Change in medication adherence (MPR) | Difference between postintervention and preintervention periods, intervention group: −6.2% (95% CI 79.7% to 73.5%); control group: −6.4% (95% CI −79.2% to 72.9%). Adjusted postintervention MD 0.11% (95% CI −1.8 to 2.1; P = 0.90) | |
| Inhaled corticosteroid adherence at the end of the study (MPR)a | Intervention group: 23.3% ± 2.2; control group: 21.3 % ± 2.5 (P = 0.55) Difference between study end and preintervention period, intervention group: −4.4% ± 1.2; control group: −4.4% ± 0.7. Postintervention MD 0.0% (95% CI −1.9 to 1.9; P = 0.99) | |
| Overall medication adherence (MPR)a | Data not provided | |
| Medication adherence by drug class (MPR) | 'All medication classes': intervention group: 41.2%; control group: 41.3% Postintervention MD −0.01% (P = 0.82) | |
| Medication adherence by disease condition (MPR) | 'All diseases': intervention group: 40.6%; control group: 39.3% Postintervention MD 1.3% (P = 0.77) | |
| Antiretroviral adherence, electronic data (percentage of 'time covered') between the first physician visit and the crossover physician visita | Postintervention MD 2.0% (95% CI −5.1 to 9.1; P = 0.57) | |
| Medication adherence, self‐report data | No significant difference, i.e. P > 0.05 (data not shown in study) |
CI: confidence interval; HR: hazard ratio; MD: mean difference; MPR: medication possession ratio; OR: odds ratio.
aStudy's primary outcome.
Patient outcomes
Two studies measured patient outcomes. Wilson 2010 measured HIV RNA viral loads, and Pladevall 2015 used glycated haemoglobin and low‐density lipoprotein cholesterol levels along with the number of major atherosclerosis disease events. Providing physicians with feedback on medication adherence may lead to little or no difference on the patient outcomes (two studies, 1292 patients, low‐certainty evidence). Table 3 presents detailed results for patient outcomes.
| Study | Definitions of the patient outcome | Result |
| HbA1C at 18 months (%)a | Intervention group: 7.91 ± 1.53; control group: 7.88 ± 1.53 Postintervention MD 0.03% (95% CI −3.03 to 3.09; P = 0.76) | |
| LDL‐C at 18 months (%)a | Intervention group: 87.27 ± 35.67; control group: 89.02 ± 32.11 Postintervention MD −1.75% (95% CI −69.53 to 66.03; P = 0.38) | |
| HbA1C at 6 months (%) | Intervention group: 7.90 ± 1.44; control group: 7.81 ± 1.42 Postintervention MD 0.09% (95% CI −2.77 to 2.95; P = 0.29) | |
| HbA1C at 12 months (%) | Intervention group: 7.96 ± 1.54; control group: 7.94 ± 1.60 Postintervention MD 0.02% (95% CI −3.12 to 3.16; P = 0.83) | |
| LDL‐C at 6 months (%) | Intervention group: 92.07 ± 36.68; control group: 92.92 ± 32.33 Postintervention MD ‐0.85% (95% CI −69.86 to 68.16; P = 0.67) | |
| LDL‐C at 12 months (%) | Intervention group: 90.70 ± 36.90; control group: 90.63 ± 32.41 Postintervention MD 0.07% (95% CI −69.24 to 69.38; P = 0.97) | |
| Number of major atherosclerosis disease event by 18 months | Intervention group: 43 (7.6%); control group: 29 (5.1%) Postintervention MD 1.49% (P = 0.091) | |
| Number of major atherosclerosis disease event by 24 months | Intervention group: 80 (14.1%); control group: 63 (11.1%) Postintervention MD 1.27% (P = 0.13) | |
| Number of major atherosclerosis disease event by 36 months | Intervention group: 112 (19.7%); control group: 101 (17.8%) Postintervention MD 1.11% (P = 0.42) | |
| Plasma HIV RNA viral loads | No significant difference between the intervention and control groups, i.e. P > 0.05 (data not shown) |
CI: confidence interval; HbA1C: glycated haemoglobin; LDL‐C: low density lipoprotein cholesterol; MD: mean difference; RNA: ribonucleic acid.
aStudy's primary outcome.
Health resource use
Two studies assessed changes in health resource use: Willis 2013 expressed these outcomes as the numbers of outpatient encounters, emergency department visits, and hospitalisations; Williams 2010 used the rates of asthma‐related emergency room visits, asthma‐related hospitalisations, and oral steroid use. In these studies, none of the health resource use outcomes improved with the interventions. Thus, providing physicians with feedback on medication adherence may lead to little or no difference in health resource use (two studies, 4181 patients, low‐certainty evidence). Table 4 presents detailed results for health resource use.
| Study | Definitions of the outcome 'health resource use' | Result |
| Rate of asthma‐related emergency room visits | RR 1.13 (95% CI 0.71 to 1.80; P = 0.61) | |
| Rate of asthma‐related hospitalisations | RR 0.93 (95% CI 0.34 to 2.56; P = 0.89) | |
| Rate of oral steroid use | RR 1.07 (95% CI 0.89 to 1.29; P = 0.45) | |
| Rate of outpatient encounters (per 100 participants during 6 months) | Intervention group: 46.6%; control group: 46.0% RR 1.01 (P = 0.42) | |
| Rate of emergency department encounters (per 100 participants during 6 months) | Intervention group: 0.84%; control group: 0.87% RR 0.97 (P = 0.77) | |
| Rate of hospitalisations (per 100 participants during 6 months) | Intervention group: 0.21%; control group: 0.19% RR 1.11 (P = 0.96) |
CI: confidence interval; RR: relative rate.
Processes of care
Four studies evaluated processes of care. Two assessed this outcome by determining the number and type of medication changes (Bieszk 2003; Tamblyn 2010). Another study evaluated the proportion of visits with appropriate management of the treatment, using patient ratings around quality of care during the visit (Kronish 2016). The last study investigated the characteristics of patient‐physician dialogue, particularly the amount and type of dialogue relating to adherence (Wilson 2010). Three studies suggested that physicians' practices differed between intervention and control groups (Bieszk 2003; Kronish 2016; Wilson 2010). Bieszk 2003 showed that physicians in the intervention group were more likely to modify patient treatment than those in the control group. There were more dose changes, drug additions, drug changes, and drug discontinuation in the intervention group compared to the control group. Wilson 2010 analysed dialogue between the physician and patient during medical encounters, using a system called the Generalized Medical Interaction Analysis System (GMIAS) (Mayfield 2014). This study suggested that the intervention increased the amount of dialogue, particularly concerning the number of utterances related to treatment adherence and solving problems with antiretroviral therapy. Kronish 2016 showed that the management of uncontrolled hypertension during visits was more appropriate in the intervention group than in the control group (more adherent patients had their BP regimen intensified, and more non‐adherent patients received adherence counselling). Moreover, physicians assigned to the intervention group had higher patient ratings on quality of care and communication during the visit. Finally, Tamblyn 2010 observed that physicians accessed the drug profiles more often (the list of prescribed and dispensed drugs) in the intervention group than in the control group. However, trialists found no other difference in physician practice: rates of changes in treatment (treatment intensification or drug discontinuation due to adverse effects) were similar between the intervention and control groups.
Feedback about medication adherence may improve processes of care (four studies, 2780 patients, low‐certainty evidence). Table 5 presents detailed results for processes of care.
| Study | Definitions of the outcome 'processes of care' | Result |
| Rate of patients with medication change | Intervention group: 70.5%; control group: 22.2% RR 3.18 (P = 0.001) | |
| Rate of patients with dosage change | Intervention group: 21.0%; control group: 7.1% RR 2.96 (P = 0.002) | |
| Rate of patients with change in medication usage directions | Intervention group: 1.9%; control group: 0% RR not calculable (P = 0.16) | |
| Rate of patient with medication added | Intervention group: 41.9%; control group: 13.5% RR 3.10 (P = 0.001) | |
| Rate of patients with medication discontinued | Intervention group: 15.2%; control group: 4% RR 3.8 (P = 0.008) | |
| Rate of patients with a non‐formulary medication replaced with a formulary agent | Intervention group: 18.1%; control group: 0% RR not calculable (P = 0.001) | |
| Proportion of visits with appropriate management of uncontrolled hypertensiona | Intervention group: 69%; control group: 34% RR 2.03 (P = 0.001) | |
| Patient rating: quality of care during the visit | Intervention group: 71%; control group: 53% RR 1.34 (P = 0.05) | |
| Patient rating: satisfaction with the amount of time spent during the visit | Intervention group: 92%; control group: 80% RR 1.15 (P = 0.11) | |
| Patient rating: perceptions of patient‐centred communication | Intervention group: 59%; control group: 37% RR 1.59 (P = 0.001) | |
| Patient rating: perceptions of collaborative communication | Intervention group: 49%; control group: 29% RR 1.69 (P = 0.02) | |
| Rate of access to the list of prescribed and dispensed drugs ('drug profile review')a | Intervention group: 44.5%; control group: 35.5% OR 1.46 (95% CI 1.21 to 1.76; P < 0.001) | |
| Change in therapy: rate of increase in therapya | Intervention group: 28.5%; control group: 29.1% OR: 0.98 (95% CI 0.80 to 1.21; P = 0.86) | |
| Change in therapy: rate of discontinuation due to adverse effectsa | Intervention group: 2.3%; control group: 2.0% OR: 1.18 (95% CI 0.63 to 2.19; P = 0.61) | |
| Median number of ART‐related utterances in patient‐physician dialogue | Intervention group: 76 (IQR 52 to 127); control group: 49.5 (IQR 28 to 113) (P = 0.07) | |
| Median number of utterances about adherence to the ART regimen | Intervention group: 51.5 (IQR 37 to 77); control group: 32.5 (IQR 17 to 52) (P < 0.001) | |
| Median number of utterances about ART side effects | Intervention group: 0 (IQR 0 to 11); control group: 0 (IQR 0 to 8) (P = 0.96) | |
| Median number of utterances about ART prescription | Intervention group: 0 (IQR 0 to 15); control group: 0 (IQR 0 to 17) (P = 1.00) | |
| Median number of utterances classified as 'ART problem solving' | Intervention group: 0 (IQR 0 to 12); control group: 0 (IQR 0 to 2) (P = 0.05) |
ART: antiretroviral therapy; CI: confidence interval;IQR: interquartile range; OR: odds ratio; RR: relative rate.
aStudy's primary outcome
Adverse events
None of the studies reported an adverse event due to the intervention.
Discusión
Resumen de los resultados principales
La información a los médicos acerca del uso de la medicación por parte de los pacientes puede dar lugar a poca o ninguna diferencia en la adherencia a la medicación, los resultados de los pacientes o el uso de recursos de salud en los pacientes que reciben tratamiento farmacológico a largo plazo para una enfermedad crónica. Sin embargo, la información puede mejorar los procesos de atención (evidencia de certidumbre baja). Ninguno de los estudios informó ningún evento adverso.
La mejoría en los procesos de atención podría dar lugar a una mejor adherencia a la medicación por parte de los pacientes. Los cuatro estudios que evaluaron el efecto de la información en los procesos de atención proporcionaron resultados conflictivos. Tres de estos cuatro estudios indicaron que la información en cuanto a la adherencia al tratamiento puede mejorar la práctica clínica. La identificación de los pacientes no adherentes podría ayudar a los médicos a modificar el tratamiento según la causa de la falta de adherencia, como los efectos secundarios o la complejidad del régimen de medicación. La información también podría promover el diálogo con los pacientes en cuanto a cuestiones relacionadas con la adherencia y los esfuerzos para resolverlas, un factor asociado con una mejor adherencia (Arbuthnott 2009). Sin embargo, debido al número pequeño de estudios que evaluaron este resultado y sus resultados discordantes, no es posible establecer conclusiones firmes sobre el efecto de la información en los procesos de atención.
Compleción y aplicabilidad general de las pruebas
Siete de los nueve estudios incluidos usaron los datos de la renovación en la farmacia para medir la adherencia, aunque existen muchos otros métodos de adherencia a la medicación, lo cual limita la aplicabilidad de la evidencia. Sólo dos países fueron representados en los estudios incluidos, lo cual también limita la posibilidad de generalizar los resultados.
Los enfoques potencialmente efectivos para mejorar la adherencia son complejos y difíciles de integrar a la atención clínica habitual. Estos enfoques incluyen a contribuyentes múltiples (pacientes, médicos y otros profesionales de la asistencia sanitaria) y un cambio conductual, ya sea a niveles individuales o institucionales. Los enfoques efectivos pueden incluir la mejoría en el apoyo de la familia o de profesionales de salud auxiliares, educación, orientación y uso de recordatorios, aunque las características para su éxito no se han identificado claramente (Nieuwlaat 2014). Se necesitan modelos nuevos de atención que consideren el problema de la adherencia a la medicación, e integren este problema en el proceso de asistencia al enfermo. La mayoría de los estudios incluidos en esta revisión sistemática usaron los datos de la renovación en la farmacia para medir la adherencia. Este método es objetivo y relativamente de bajo costo y apropiado para el uso en un gran número de pacientes, lo cual facilita su integración sin problemas en el flujo de trabajo médico. Es sorprendente que se haya encontrado sólo un estudio que usara un cuestionario de autoinforme para medir la adherencia (Wilson 2010). Este método es un enfoque de bajo costo que es fácil de ejecutar en la práctica clínica. Aunque los cuestionarios de autoinforme son algo subjetivos, esta cualidad podría ser ventajosa para este tipo de intervención. En efecto, la evaluación de la adherencia al tratamiento sobre la base del informe de los pacientes podría permitir que el médico evalúe la experiencia de los pacientes y las razones de la falta de adherencia, lo cual facilitaría la comunicación médico‐paciente, como se muestra en Wilson 2010. La información con respecto a la adherencia podría incluir información sobre las creencias de los pacientes de la necesidad de tratamiento y cuestiones relacionadas con el uso de medicación; en efecto, Horne 2013 mostró una relación entre este factor y la adherencia a la medicación. La posibilidad de tener en cuenta las percepciones de los pacientes acerca de la necesidad de tratamiento, sus creencias y sus inquietudes podría mejorar los procesos de atención y la adherencia a la medicación. Los cuestionarios de autoinforme pueden ayudar a los pacientes a sentir que son escuchados, recalcando la colaboración entre el médico y el paciente (Lutfey 1999). Por el contrario, la posibilidad de compartir los datos de la renovación entre los profesionales de la salud no involucra a los pacientes directamente en cuanto al control de la adherencia a la medicación, lo cual puede limitar su efectividad. El enfoque usado para proporcionar la información también podría desempeñar una función en los efectos de la intervención, en los procesos de atención y por lo tanto en la adherencia del paciente. Tres de las intervenciones consideradas en esta revisión proporcionaron a los médicos los datos de la adherencia directamente a través del software de prescripción electrónica (Pladevall 2015; Tamblyn 2010; Williams 2010). Estas intervenciones no mejoraron la adherencia, aunque este enfoque para proporcionar información es fácil de integrar al flujo de trabajo médico y puede ser mejorado fácilmente mediante la información de otros datos, como los resultados clínicos o biológicos, lo cual probablemente hace que este sistema sea más atractivo para los médicos (Dixon 2013).
Con respecto a la certidumbre de la evidencia, cinco estudios asignaron al azar la intervención por individuo (incluido un diseño cruzado), tres fueron ensayos con asignación al azar por grupos, y un estudio fue una serie de tiempo interrumpido. Basado en la evaluación GRADE, se encontró que la certidumbre de la evidencia de los estudios incluidos fue baja debido a las limitaciones en los diseños de estudio y la ejecución, al alto riesgo de sesgo, a la imposibilidad para generalizar la evidencia, la heterogeneidad alta y los resultados inconsistentes. En consecuencia la certidumbre de la evidencia no permite extraer conclusiones consistentes acerca de las intervenciones que proporcionan información a los médicos acerca de la adherencia a la medicación de los pacientes.
Sesgos potenciales en el proceso de revisión
En la fase de detección, se encontraron muchos artículos que describían intervenciones multifacéticas en las cuales la información al médico no era un componente esencial. Estos estudios se excluyeron debido a que no habría sido posible aislar el efecto de la información del efecto de las otras intervenciones. Cuando hubo una línea estrecha entre el "componente esencial"?? de la información y el "componente no esencial"?? de la información en una intervención multifacética, el equipo de revisión trató los pros y los contras de la inclusión del estudio. Sólo hubo una diferencia de opinión, de manera que es improbable que se excluyeran estudios relevantes o que se incluyeran estudios no relevantes.
Acuerdos y desacuerdos con otros estudios o revisiones
Hay varias revisiones sistemáticas sobre las intervenciones para mejorar la adherencia al tratamiento médico, aunque la mayoría se centraron en las intervenciones dirigidas a los pacientes (Kripalani 2007; Nieuwlaat 2014; Viswanathan 2012). Algunas revisiones se han centrado en intervenciones dirigidas a los médicos (como entrenamiento acerca de temas de adherencia o recomendaciones sobre los cambios de medicación), aunque estos estudios no incluyeron información para los médicos acerca de la adherencia como un componente esencial de la intervención. Laba 2013 encontró que las intervenciones dirigidas simultáneamente a los pacientes y a los médicos fueron más efectivas que las estrategias dirigidas sólo a los pacientes o a los médicos. Cutrona 2010 observó que las intervenciones de adherencia basadas en el médico para la mejoría de la adherencia fueron menos efectivas que las estrategias que incluían a otros profesionales de la asistencia sanitaria. Por lo tanto, los médicos pueden no ser los destinatarios ideales para las intervenciones de información debido a que podrían no hacer una óptima utilización de los datos de la adherencia. Este hecho podría explicar por qué las mejorías en los procesos de atención después de una intervención de información no parecen traducirse en una mejoría en la adherencia.
Los profesionales con experiencia en intervenciones conductuales o en orientación farmacéutica pueden ser más capaces de considerar los retos relacionados con la adherencia. Algunas revisiones sistemáticas centradas en proporcionar información a los profesionales de la asistencia sanitaria lo han logrado mediante una pregunta de revisión que fue más amplia en su alcance. Ivers 2012 mostró que la información del rendimiento clínico a los profesionales de la asistencia sanitaria podría dar lugar a mejorías pequeñas aunque potencialmente importantes en la práctica profesional. El efecto sobre el resultado de los pacientes pareció incierto, con evidencia de certidumbre baja. Boyce 2013 evaluó el impacto de proporcionar información a los profesionales de la asistencia sanitaria sobre las medidas de resultado informadas por el paciente. Esta revisión sistemática indicó que el impacto de esta información sobre los resultados de los pacientes fue débil, aunque los estudios incluidos fueron de calidad deficiente. En muchos estudios que procuraron mejorar la adherencia de los pacientes, los datos de la adherencia a la medicación se usan para proporcionar información a otro destinatario, el paciente. Dichos enfoques se denominan "control de la medicación guiado por la medición"?? (MGMM, por sus siglas en inglés) (Hughes 2007). Varias revisiones sistemáticas han indicado que la provisión de información a los pacientes sobre la adherencia a la medicación fue un método efectivo para mejorar la adherencia al tratamiento (Christensen 2009; Demonceau 2013). Los autores de estas revisiones identificaron las intervenciones basadas en la medición de la adherencia con métodos electrónicos, con información de los resultados a los pacientes. Este tipo de intervención es diferente en varias maneras de las intervenciones evaluadas en esta revisión sistemática. Primero, la información al paciente es un tipo diferente de intervención de la información al médico en cuanto a que puede clasificarse como una intervención conductual del tipo "recompensas y refuerzo"??? (Kripalani 2007; Touchette 2008). Segundo, la vigilancia electrónica en sí misma puede dar lugar a una mejoría leve en la adherencia como un efecto reactivo (Sutton 2014), debido a que los pacientes son conscientes de la vigilancia. Tercero, aunque la información parece ser más efectiva cuando se dirige al paciente en lugar de al médico, este tipo de intervención es más difícil de implementar sistemáticamente en la práctica clínica debido a que se basa casi exclusivamente en métodos electrónicos.
Flow diagram for study selection.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
| Feedback on medication adherence to physicians versus usual care | |||
| Patient or population: any physician, and any patient treated for chronic diseases with long‐term medication use Settings: hospitals or community, USA and Canada Intervention: feedback on medication adherence to physicians Comparison: usual care | |||
| Outcomes | Effect of providing feedback on medication adherence to physicians | No of patients | Certainty of the evidence |
| Medication adherence Percentage of 'days covered' by medication (medication possession ratio), percentage of 'time covered', percentage of non‐adherent patients, 'time‐to‐refill' (i.e. the number of days between the date where the patient was declared 7 days overdue, and the date of the next refill) | Intervention may lead to little or no difference to medication adherence | 22,924 (7 studies) | ⊕⊕⊝⊝ |
| Patient outcomes Lipid levels, HbA1C level, HIV viral load, number of major atherosclerosis disease events | Intervention may lead to little or no difference to patient outcomes | 1292 | ⊕⊕⊝⊝ |
| Health resource use Rate of hospitalisations, rate of emergency department encounters, rate of outpatient encounters, rate of oral steroid use | Intervention may lead to little or no difference to health resource use | 4181 | ⊕⊕⊝⊝ |
| Processes of care Rate of medication change (medication discontinued, added, replaced), proportion of visits with appropriate management of uncontrolled hypertension, patient rating (quality of care, duration of the visit, communication with physician), patient‐physician dialogue (utterance related to treatment, medication adherence, side effects) | Intervention may improve processes of care. | 2780 | ⊕⊕⊝⊝ |
| Adverse events | None of the 9 studies reported an adverse event due to the intervention. | — | — |
| GRADE Working Group grades of evidence *Substantially different = a large enough difference that it might affect a decision. | |||
| aEvidence downgraded one level due to limitations in the design and implementation: high risk of contamination bias. | |||
| Study/country | Study type | Medication | Feedback type/delivery approach | Data source | Intervention description | Intervention received by control group of physicians group | N patients (N physicians)a |
| USA | ITS analysis | Antidepressants | Alert/faxed | Pharmacy refill data | Physicians were alerted via fax in real‐time when their patient had a gap of more than 10 days in refilling antidepressant prescription. | No intervention | 13,128 (NR) |
| USA | Cluster‐RT | Any medication | Systematic/printed report | Pharmacy refill data | A printed medication refill history report was provided to physicians before the patient's encounter. | No intervention | 231 (32) |
| USA | Cluster‐RT | Antihypertensive drugs | Systematic/printed report | Electronic device | A printed adherence report was provided to physicians before the patient's encounter. The report also provided clinical decision support by listing suggested clinical actions according to adherence status. | No intervention | 100 (49) |
| USA | RT | Medication used to treat diabetes, hypertension, hyperlipidaemia, heart failure, depression, or psychosis. | Alert/faxed | Pharmacy refill data | Physicians were alerted via fax once per week about patients with a gap of more than 7 days in refilling medication. Fax included patient adherence data and prompts to assist the patient. | No intervention | 2030 (175) |
| USA | RT | Oral diabetes medication and a lipid‐lowering medication | Systematic/electronic prescription software | Pharmacy refill data | Physicians were provided, via electronic prescription software, with medication adherence of their patients, along with HbA1C (glycated haemoglobin) and LDL‐C (low‐density lipoprotein cholesterol) measurements. Physicians could also view trends in a patient's medication adherence over time by drug class. Physicians were given instruction on how to interpret and discuss this information with patients. | No intervention | 1136 (NR) |
| Canada | RT | Lipid‐lowering or antihypertensive drugs | Systematic/Electronic prescription software | Pharmacy refill data | Physicians were provided, via electronic prescription software, with the list of prescribed and dispensed drugs; medication adherence for each drug; drug costs; out‐of‐pocket expenses; and received an alert for non‐adherent patients. | List of prescribed and dispensed drugs in the electronic prescription software. | 2293 (NR) |
| USA | Cluster‐RT | Anti‐asthma drugs | Systematic/electronic prescription software | Pharmacy refill data | Physicians were provided, via electronic prescription software, with adherence data for inhaled corticosteroid (ICS) use; the frequency of short‐acting beta‐agonist use; and the strength of each patient's current ICS prescription. In addition, the physician received asthma guidelines and methods for discussing non‐adherence with patients. | The physician received asthma guidelines and methods for discussing non‐adherence with patients. | 2698 (193) |
| USA | RT | Medication used to treat asthma, diabetes, hypertension, congestive heart failure, ischemic heart disease or stroke | Systematic/Printed report | Pharmacy refill data | A printed report was provided to physicians before the patient's encounter. The report contained a list of dispensed drugs with a calculation and a graphical depiction of adherence, and recommendations addressing possible deficiencies relative to pharmacotherapy guidelines. | No intervention | 1483 (NR) |
| USA | Cross‐over‐RT | Antiretroviral drugs | Systematic/Printed report | Electronic device + self report | A printed report was provided to physicians before the patient's encounter. The report included electronic adherence data and patient survey data (self‐reported adherence, reminder use, beliefs about antiretroviral drugs, reasons for missed doses, alcohol and drug use, and depression). | No intervention | 156 (41) |
| ITS: Interrupted time series; MPR: medication possession ratio; NR: not reported; RT: randomised (controlled) trial. | |||||||
| Study | Definitions of the outcome 'medication adherence' | Result |
| Rate of patients more than 30 days overdue for prescription refilla | Immediate decrease of 2% (P = 0.15) then increase of 0.3% (P = 0.22) each month during the intervention. Over the entire study period, constant average of 75% (95% CI 72.7% to 77.3%) | |
| Proportion of days without treatment ('days uncovered')a | Immediate decrease of 2% (P = 0.15) then increase of 0.4% (P = 0.04) each month during the intervention. Over the entire study period, constant average of 40% (95% CI 38.4% to 41.6%) | |
| Median number of days from alert date to the next date of refill for any medication indicated for the patient's index disease (time‐to‐refill)a | Intervention group: 116 days; control group: 106 days HR 0.87 (98.3% CI 0.76 to 1.00; P > 0.05) | |
| Within 30 days of index date, filled prescription for any medication indicated for the patient's index disease | Intervention group: N = 213 (21.0%); control group: N = 243 (24.0%) OR 0.83 (97.5% CI 0.65 to 1.06; P > 0.05) | |
| Within 60 days of index date, filled prescription for any medication indicated for the patient's index disease | Intervention group: N = 342 (33.7%); control group: N = 373 (36.8%) OR 0.83 (98.3% CI 0.65 to 1.07; P > 0.05) | |
| Within 30 days of index date, filled prescription for any medication | Intervention group: N = 484 (47.6%); control group: N = 490 (48.3%) OR 0.99 (95% CI 0.81 to 1.19; P > 0.05) | |
| Adherence to oral diabetes medications at 6 months (MPR) | Intervention group: 0.74 ± 0.36; control group: 0.75 ± 0.35 Postintervention MD −0.01 (95% CI −0.72 to 0.70; P = 0.67) | |
| Adherence to oral diabetes medications at 12 months (MPR) | Intervention group: 0.74 ± 0.36; control group: 0.75 ± 0.35. Postintervention MD −0.01 (95% CI −0.72 to 0.70; P = 0.57) | |
| Adherence to oral diabetes medications at 18 months (MPR) | Intervention group: 0.73 ± 0.37; control group: 0.75 ± 0.36 Postintervention MD −0.02 (95% CI −0.75 to 0.71; P = 0.47) | |
| Adherence to lipid lowing medications at 6 months (MPR) | Intervention group: 0.69 ± 0.36; control group: 0.70 ± 0.37 Postintervention MD −0.01 (95% CI −0.74 to 0.72; P = 0.88) | |
| Adherence to lipid lowing medications at 12 months (MPR) | Intervention group: 0.69 ± 0.37; control group: 0.70 ± 0.36 Postintervention MD −0.01 (95% CI −0.74 to 0.72; P = 0.78) | |
| Adherence to lipid lowing medications at 18 months (MPR) | Intervention group: 0.70 ± 0.37; control group: 0.70 ± 0.37 Postintervention MD 0.00 (95% CI −0.74 to 0.74; P = 0.95) | |
| Change in medication adherence (MPR) | Difference between postintervention and preintervention periods, intervention group: −6.2% (95% CI 79.7% to 73.5%); control group: −6.4% (95% CI −79.2% to 72.9%). Adjusted postintervention MD 0.11% (95% CI −1.8 to 2.1; P = 0.90) | |
| Inhaled corticosteroid adherence at the end of the study (MPR)a | Intervention group: 23.3% ± 2.2; control group: 21.3 % ± 2.5 (P = 0.55) Difference between study end and preintervention period, intervention group: −4.4% ± 1.2; control group: −4.4% ± 0.7. Postintervention MD 0.0% (95% CI −1.9 to 1.9; P = 0.99) | |
| Overall medication adherence (MPR)a | Data not provided | |
| Medication adherence by drug class (MPR) | 'All medication classes': intervention group: 41.2%; control group: 41.3% Postintervention MD −0.01% (P = 0.82) | |
| Medication adherence by disease condition (MPR) | 'All diseases': intervention group: 40.6%; control group: 39.3% Postintervention MD 1.3% (P = 0.77) | |
| Antiretroviral adherence, electronic data (percentage of 'time covered') between the first physician visit and the crossover physician visita | Postintervention MD 2.0% (95% CI −5.1 to 9.1; P = 0.57) | |
| Medication adherence, self‐report data | No significant difference, i.e. P > 0.05 (data not shown in study) | |
| CI: confidence interval; HR: hazard ratio; MD: mean difference; MPR: medication possession ratio; OR: odds ratio. | ||
| Study | Definitions of the patient outcome | Result |
| HbA1C at 18 months (%)a | Intervention group: 7.91 ± 1.53; control group: 7.88 ± 1.53 Postintervention MD 0.03% (95% CI −3.03 to 3.09; P = 0.76) | |
| LDL‐C at 18 months (%)a | Intervention group: 87.27 ± 35.67; control group: 89.02 ± 32.11 Postintervention MD −1.75% (95% CI −69.53 to 66.03; P = 0.38) | |
| HbA1C at 6 months (%) | Intervention group: 7.90 ± 1.44; control group: 7.81 ± 1.42 Postintervention MD 0.09% (95% CI −2.77 to 2.95; P = 0.29) | |
| HbA1C at 12 months (%) | Intervention group: 7.96 ± 1.54; control group: 7.94 ± 1.60 Postintervention MD 0.02% (95% CI −3.12 to 3.16; P = 0.83) | |
| LDL‐C at 6 months (%) | Intervention group: 92.07 ± 36.68; control group: 92.92 ± 32.33 Postintervention MD ‐0.85% (95% CI −69.86 to 68.16; P = 0.67) | |
| LDL‐C at 12 months (%) | Intervention group: 90.70 ± 36.90; control group: 90.63 ± 32.41 Postintervention MD 0.07% (95% CI −69.24 to 69.38; P = 0.97) | |
| Number of major atherosclerosis disease event by 18 months | Intervention group: 43 (7.6%); control group: 29 (5.1%) Postintervention MD 1.49% (P = 0.091) | |
| Number of major atherosclerosis disease event by 24 months | Intervention group: 80 (14.1%); control group: 63 (11.1%) Postintervention MD 1.27% (P = 0.13) | |
| Number of major atherosclerosis disease event by 36 months | Intervention group: 112 (19.7%); control group: 101 (17.8%) Postintervention MD 1.11% (P = 0.42) | |
| Plasma HIV RNA viral loads | No significant difference between the intervention and control groups, i.e. P > 0.05 (data not shown) | |
| CI: confidence interval; HbA1C: glycated haemoglobin; LDL‐C: low density lipoprotein cholesterol; MD: mean difference; RNA: ribonucleic acid. | ||
| Study | Definitions of the outcome 'health resource use' | Result |
| Rate of asthma‐related emergency room visits | RR 1.13 (95% CI 0.71 to 1.80; P = 0.61) | |
| Rate of asthma‐related hospitalisations | RR 0.93 (95% CI 0.34 to 2.56; P = 0.89) | |
| Rate of oral steroid use | RR 1.07 (95% CI 0.89 to 1.29; P = 0.45) | |
| Rate of outpatient encounters (per 100 participants during 6 months) | Intervention group: 46.6%; control group: 46.0% RR 1.01 (P = 0.42) | |
| Rate of emergency department encounters (per 100 participants during 6 months) | Intervention group: 0.84%; control group: 0.87% RR 0.97 (P = 0.77) | |
| Rate of hospitalisations (per 100 participants during 6 months) | Intervention group: 0.21%; control group: 0.19% RR 1.11 (P = 0.96) | |
| CI: confidence interval; RR: relative rate. | ||
| Study | Definitions of the outcome 'processes of care' | Result |
| Rate of patients with medication change | Intervention group: 70.5%; control group: 22.2% RR 3.18 (P = 0.001) | |
| Rate of patients with dosage change | Intervention group: 21.0%; control group: 7.1% RR 2.96 (P = 0.002) | |
| Rate of patients with change in medication usage directions | Intervention group: 1.9%; control group: 0% RR not calculable (P = 0.16) | |
| Rate of patient with medication added | Intervention group: 41.9%; control group: 13.5% RR 3.10 (P = 0.001) | |
| Rate of patients with medication discontinued | Intervention group: 15.2%; control group: 4% RR 3.8 (P = 0.008) | |
| Rate of patients with a non‐formulary medication replaced with a formulary agent | Intervention group: 18.1%; control group: 0% RR not calculable (P = 0.001) | |
| Proportion of visits with appropriate management of uncontrolled hypertensiona | Intervention group: 69%; control group: 34% RR 2.03 (P = 0.001) | |
| Patient rating: quality of care during the visit | Intervention group: 71%; control group: 53% RR 1.34 (P = 0.05) | |
| Patient rating: satisfaction with the amount of time spent during the visit | Intervention group: 92%; control group: 80% RR 1.15 (P = 0.11) | |
| Patient rating: perceptions of patient‐centred communication | Intervention group: 59%; control group: 37% RR 1.59 (P = 0.001) | |
| Patient rating: perceptions of collaborative communication | Intervention group: 49%; control group: 29% RR 1.69 (P = 0.02) | |
| Rate of access to the list of prescribed and dispensed drugs ('drug profile review')a | Intervention group: 44.5%; control group: 35.5% OR 1.46 (95% CI 1.21 to 1.76; P < 0.001) | |
| Change in therapy: rate of increase in therapya | Intervention group: 28.5%; control group: 29.1% OR: 0.98 (95% CI 0.80 to 1.21; P = 0.86) | |
| Change in therapy: rate of discontinuation due to adverse effectsa | Intervention group: 2.3%; control group: 2.0% OR: 1.18 (95% CI 0.63 to 2.19; P = 0.61) | |
| Median number of ART‐related utterances in patient‐physician dialogue | Intervention group: 76 (IQR 52 to 127); control group: 49.5 (IQR 28 to 113) (P = 0.07) | |
| Median number of utterances about adherence to the ART regimen | Intervention group: 51.5 (IQR 37 to 77); control group: 32.5 (IQR 17 to 52) (P < 0.001) | |
| Median number of utterances about ART side effects | Intervention group: 0 (IQR 0 to 11); control group: 0 (IQR 0 to 8) (P = 0.96) | |
| Median number of utterances about ART prescription | Intervention group: 0 (IQR 0 to 15); control group: 0 (IQR 0 to 17) (P = 1.00) | |
| Median number of utterances classified as 'ART problem solving' | Intervention group: 0 (IQR 0 to 12); control group: 0 (IQR 0 to 2) (P = 0.05) | |
| ART: antiretroviral therapy; CI: confidence interval;IQR: interquartile range; OR: odds ratio; RR: relative rate. | ||

