Tratamiento con hierro para la anemia preoperatoria
Resumen
Antecedentes
La anemia preoperatoria es frecuente y se presenta en el 5% al 76% de los pacientes antes de una cirugía. Se asocia con un mayor riesgo de transfusión sanguínea alogénica perioperatoria, una estancia hospitalaria más prolongada y un aumento de la morbilidad y la mortalidad. La deficiencia de hierro es una de las causas más frecuentes de anemia. El tratamiento con hierro por vía oral e intravenosa se puede utilizar para tratar la anemia. Se ha demostrado que las preparaciones de hierro parenteral son más efectivas en afecciones como la enfermedad intestinal inflamatoria, la insuficiencia cardíaca crónica y la hemorragia posparto debido a la corrección rápida de las reservas de hierro. Un número limitado de estudios ha investigado el tratamiento con hierro para tratar la anemia preoperatoria. El objetivo de esta revisión Cochrane es resumir la evidencia sobre la administración de suplementos de hierro, por vía enteral y parenteral, para el tratamiento de la anemia preoperatoria.
Objetivos
Evaluar los efectos del tratamiento preoperatorio con hierro (enteral o parenteral) para reducir la necesidad de transfusiones de sangre alogénicas en pacientes con anemia sometidos a cirugía.
Métodos de búsqueda
La búsqueda se realizó el 30 de julio 2018. Se hicieron búsquedas en el Registro Especializado del Grupo Cochrane de Lesiones (Cochrane Injuries Group's Specialised Register), el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials, CENTRAL, la Biblioteca Cochrane), Ovid MEDLINE(R), Ovid MEDLINE(R) In‐Process & Other Non‐Indexed Citations, Ovid MEDLINE(R) Daily y Ovid OLDMEDLINE(R), Embase Classic y Embase (Ovid), CINAHL Plus (EBSCO), PubMed, y en registros de ensayos clínicos, y se examinaron las listas de referencias. Se realizó una búsqueda ampliada el 28 de noviembre 2019; un estudio está a la espera de clasificación.
Criterios de selección
Se incluyeron todos los ensayos controlados aleatorizados (ECA) que comparaban la monoterapia preoperatoria con hierro versus placebo, ningún tratamiento, atención estándar u otra forma de tratamiento con hierro en pacientes adultos con anemia sometidos a cirugía. La anemia se definió como valores de hemoglobina menores que 13 g/dl en los hombres y que 12 g/dl en las mujeres no embarazadas.
Obtención y análisis de los datos
Dos autores de la revisión recopilaron los datos y un tercer autor de la revisión verificó todos los datos recopilados. Se recopilaron datos sobre la proporción de pacientes que recibieron una transfusión de sangre, la cantidad de sangre transfundida por paciente (unidades), la calidad de vida, los niveles de ferritina y los niveles de hemoglobina, medidos como variables continuas en los siguientes puntos temporales predeterminados: pretratamiento (valor inicial), preoperatorio pero posterior a la intervención y posoperatorio. Los análisis estadísticos se realizaron mediante el programa informático Review Manager 5. Los datos de resultados se resumieron en tablas y diagramas de bosque. Se utilizaron los criterios GRADE para describir la calidad del conjunto de evidencia.
Resultados principales
Seis ECA, con un total de 372 participantes, evaluaron el tratamiento preoperatorio con hierro para corregir la anemia antes de una cirugía planificada. Cuatro estudios compararon el tratamiento con hierro (oral [un estudio] o intravenoso [tres estudios]) con ningún tratamiento, placebo o atención habitual, y dos estudios compararon el tratamiento con hierro intravenoso con el tratamiento con hierro oral. El tratamiento con hierro se administró durante una serie de períodos que variaron desde 48 horas hasta tres semanas antes de la cirugía. Los 372 participantes del análisis están muy por debajo de los 819 requeridos (según el cálculo del tamaño de la información) para detectar una reducción del 30% en las transfusiones de sangre. Cinco ensayos, con 310 pacientes, informaron de la proporción de participantes que recibieron transfusiones de sangre alogénica.
El metanálisis del tratamiento con hierro versus placebo o atención estándar no mostró diferencias en la proporción de participantes que recibieron una transfusión de sangre (riesgo relativo [RR] 1,21; intervalo de confianza [IC] del 95%: 0,87 a 1,70; 4 estudios, 200 participantes; evidencia de calidad moderada). Solo un estudio que comparó el tratamiento con hierro oral versus intravenoso midió este resultado y no informó diferencias en el riesgo de transfusión entre los grupos.
No hubo diferencias entre el grupo de tratamiento con hierro y el grupo placebo/atención estándar en el nivel de hemoglobina preoperatorio al final de la intervención (diferencia de medias [DM] 0,63 g/dl; IC del 95%: ‐0,07 a 1,34; 2 estudios, 83 participantes; evidencia de calidad baja). Sin embargo, el tratamiento con hierro intravenoso produjo un aumento de los niveles de hemoglobina preoperatorios posintervención en comparación con el hierro oral (DM 1,23 g/dl; IC del 95%: 0,80 a 1,65; 2 estudios, 172 participantes; evidencia de calidad baja). Los niveles de ferritina aumentaron con la administración de hierro intravenoso en comparación con la atención estándar (DM 149,00; IC del 95%: 25,84 a 272,16; un estudio, 63 participantes; evidencia de calidad baja) y con el hierro oral (DM 395,03 ng/ml; IC del 95%: 227,72 a 562,35; 2 estudios, 151 participantes; evidencia de calidad baja).
No todos los estudios midieron la calidad de vida, la mortalidad a corto plazo o la morbilidad posoperatoria. Algunos midieron los resultados, pero no informaron sobre los datos y los estudios que informaron sobre los datos tuvieron poco poder estadístico. Por lo tanto, aún hay dudas con respecto a estos resultados. Es muy probable que la inclusión de nueva investigación en el futuro cambie estos resultados.
Conclusiones de los autores
La administración de tratamiento con hierro para la anemia preoperatoria no muestra una reducción clínicamente significativa en la proporción de pacientes de los ensayos que recibieron una transfusión de sangre alogénica en comparación con ningún tratamiento con hierro. Los resultados para el hierro intravenoso son consistentes con un mayor aumento de la hemoglobina y la ferritina en comparación con el hierro oral, pero no proporcionan evidencia fiable. Estas conclusiones se extrajeron de seis estudios, tres de los cuales incluyeron a un número muy pequeño de participantes. Se necesitan ECA adicionales, bien diseñados y con un poder estadístico adecuado para determinar la verdadera efectividad del tratamiento con hierro para la anemia preoperatoria. Actualmente se realizan dos estudios que incluyen a 1500 participantes asignados al azar.
PICO
Resumen en términos sencillos
Tratamiento con hierro para el recuento bajo de glóbulos rojos antes de la cirugía
Pregunta de revisión: se revisó la evidencia sobre la administración de tratamiento con hierro a los pacientes con un recuento bajo de glóbulos rojos (anemia) antes de ser sometidos a una cirugía mayor, para observar si reducía la necesidad de transfusiones de sangre cerca del momento de la cirugía. Se encontraron seis estudios que examinaron esta pregunta.
Antecedentes: la anemia es un problema frecuente en los pacientes que van a ser operados. Puede causar mareos, disnea y falta de energía, y también aumentar los riesgos de la cirugía y de una transfusión de sangre. La anemia con frecuencia se debe a la falta de hierro y el se ha observado que el tratamiento con hierro (con comprimidos o inyecciones) es efectivo en otras situaciones para tratar la anemia. Se ha realizado una investigación limitada sobre si el tratamiento con hierro funciona antes de la cirugía.
Fecha de búsqueda: el 30 de julio 2018 se realizó una búsqueda amplia en la literatura médica para identificar estudios médicos relevantes.
Características de los estudios: se examinó a pacientes adultos con anemia que debían ser sometidos a una cirugía, y que recibieron tratamiento con hierro, atención habitual o un tratamiento con hierro "falso" (placebo) antes de la cirugía. También se compararon diferentes formas de tratamiento con hierro entre sí. Se incluyeron seis estudios con 372 participantes.
Resultados clave: el tratamiento con hierro no redujo el riesgo de transfusión de sangre. Actualmente no hay evidencia suficiente para determinar si el tratamiento con hierro administrado antes de la cirugía previene las transfusiones. Hasta la fecha se han realizado muy pocos estudios y los mismos incluyeron a un número muy pequeño de pacientes, por lo que aún no es posible obtener un resultado fiable en cuanto a los efectos de este tratamiento.
Calidad de la evidencia: la limitación principal en el diseño de estudio de todos los ensayos fue el tamaño de la muestra pequeño de los grupos. Se necesita más investigación con ensayos más grandes y bien diseñados antes de que se pueda proporcionar una respuesta definitiva con respecto a la efectividad del tratamiento con hierro antes de la cirugía. Los autores de la revisión Cochrane consideraron que cinco de los seis estudios incluidos en esta revisión tenían un riesgo bajo de sesgo (y por lo tanto, es probable que sus resultados sean fiables). Esta decisión se tomó a pesar de la falta de cegamiento de los participantes en cinco de los ensayos (lo que generalmente disminuiría la confiabilidad de la evidencia), ya que era poco probable que la medición utilizada para evaluar el buen funcionamiento del tratamiento (nivel de hemoglobina en sangre) fuera influenciada por el conocimiento del participante o el investigador sobre qué tratamiento había recibido. Los resultados de un estudio estuvieron en riesgo alto de sesgo debido a que los participantes que no cumplieron con el 80% del tratamiento asignado no se incluyeron en el análisis.
En general, la calidad de la evidencia es baja (según los criterios GRADE). Cuando en el futuro se disponga de investigación adicional, es probable que cambie los resultados obtenidos en esta revisión.
Conclusiones de los autores
Summary of findings
| Iron therapy compared to placebo, no treatment or standard care for preoperative anaemia | ||||||
| Patient or population: people with preoperative anaemia awaiting major surgery | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Placebo, no treatment or standard care | Iron therapy | |||||
| Proportion of participants who received a blood transfusion | 438 per 1000 | 386 per 1000 | RR 1.21 | 200 | ⊕⊕⊝⊝ | |
| Any validated measure of quality of life (measured by SF36) | 6 ± 17 | 8 ± 18 | ‐ | 72 (1 study) | ⊕⊝⊝⊝ Very lowb | |
| Haemoglobin levels at end of preoperative treatment (g/dL) | The mean haemoglobin level in the control groups was | The mean haemoglobin levels in the intervention groups was | MD 0.63 (‐0.07 to 1.34) | 83 | ⊕⊕⊝⊝ | |
| Haemoglobin levels post‐treatment and surgery (g/dL) | The mean haemoglobin level in the control groups was | The mean haemoglobin levels in the intervention groups was | MD 0.17 (‐0.29 to 0.63) | 86 | ⊕⊕⊝⊝ | |
| Ferritin at the end of preoperative treatment (ng/mL) | The mean ferritin level in the control group was 99 ng/mL | The mean ferritin level in the intervention groups was 149 ng/mL higher (26 higher to 272 higher) | MD 149.00 (25.68 to 272.32) | 76 (1 study) | ⊕⊕⊝⊝ | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| aDowngraded 2 levels for imprecision with only four randomised control trials including subsets of anaemic participants, resulting in a small number of participants. | ||||||
| Intravenous iron therapy compared to oral iron therapy for preoperative anaemia | ||||||
| Patient or population: people with preoperative anaemia awaiting major surgery | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Oral iron therapy | Intravenous iron therapy | |||||
| Proportion of participants who received a blood transfusion | No data available | No data available | ‐ | ‐ | ‐ | |
| Any validated measure of quality of life | No data available | No data available | ‐ | ‐ | ‐ | |
| Haemoglobin levels at end of preoperative treatment (g/dL) | The mean haemoglobin level in the oral iron groups was | The mean haemoglobin level in the IV iron groups was | MD 1.23 (0.80 to 1.65) | 172 | ⊕⊕⊝⊝ | |
| Haemoglobin levels post‐treatment and surgery (g/dL) | No data available | No data available | ‐ | ‐ | ‐ | |
| Ferritin preoperatively postintervention (ng/L) | The mean ferritin level in the oral iron groups was 23 ng/mL | The mean ferritin level in the IV iron groups was 395 ng/mL higher (228 higher to 562 higher) | MD 395.03 (227.72 to 562.35) | 151 (2 studies) | ⊕⊕⊝⊝ | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| a Downgraded twice overall: 1 level due to risk of bias (attrition bias), as the Kim 2009 study excluded participants with less than 80% compliance with therapy (compliance was lower in the oral group); and 1 level for imprecision as only two studies with a small number of participants contributed to the results. | ||||||
Antecedentes
Descripción de la afección
La «anemia» se define como una reducción total del número de eritrocitos, una cantidad reducida de hemoglobina circulante, o una reducción en la masa circulante de eritrocitos (Perkins 2006) que da lugar a un estado patológico en el que la capacidad de la sangre de transportar oxígeno no es suficiente para satisfacer la demanda fisiológica (Varat 1972). La Organización Mundial de la Salud (OMS) define la anemia como un nivel de hemoglobina menor que 12 g/l en mujeres adultas no embarazadas, menor que 11 g/l en mujeres adultas embarazadas y menor que 13 g/l en hombres adultos. La anemia es un hallazgo frecuente en los pacientes antes de una cirugía, con una prevalencia que varía del 5% al 76% según la edad del paciente, la naturaleza del trastorno y la cirugía planificada (Shander 2004). La forma más común de anemia es causada por la deficiencia de hierro, que se puede producir luego de pérdidas excesivas de sangre, como hemorragias crónicas, o por una ingesta inadecuada de hierro (Piednoir 2011).
La anemia puede causar síntomas como mareos, falta de aliento, angina y letargo. La anemia en el contexto preoperatorio se asocia con una mayor necesidad de transfusión de sangre perioperatoria (Benoist 2001). En los pacientes sometidos a cirugía colorrectal, la anemia preoperatoria es un factor de riesgo independiente de complicaciones posoperatorias y de una estancia hospitalaria posoperatoria más prolongada (Leichtle 2011). Otros estudios han mostrado que la anemia perioperatoria se asocia con un mayor riesgo de infección y mortalidad perioperatorias (Dunne 2002).
Descripción de la intervención
La administración oral de suplementos de hierro y la transfusión de sangre alogénica son la práctica estándar actual para el tratamiento de la anemia preoperatoria. La administración oral preoperatoria de suplementos de hierro se ha investigado en la cirugía colorrectal (Lidder 2007; Quinn 2010) y en la cirugía ortopédica (Lachance 2011), con resultados contradictorios. El tratamiento es económico, de amplia disponibilidad y se administra fácilmente. Sin embargo, el hierro oral se asocia con una serie de efectos secundarios gastrointestinales en hasta el 52% de los receptores, que es 2,6 veces más que el hierro intravenoso (Tolkien 2015). Los mismos incluyen dolor abdominal, estreñimiento, diarrea y dispepsia (Tolkien 2015). El incumplimiento como resultado de estos efectos secundarios es un problema frecuente (Tolkien 2015). La administración oral de suplementos de hierro también puede no ser suficiente para compensar las pérdidas sanguíneas continuas, o los niveles séricos bajos de hierro causados por la reducción de la absorción intestinal mediada por la hepcidina y el almacenamiento de hierro por los macrófagos, que son el resultado de la inflamación (Ganz 2003).
El hierro parenteral se introdujo por primera vez a principios del siglo XX en forma de inyecciones intramusculares y subcutáneas (Heath 1932). Sin embargo, estas formulaciones antiguas causaron reacciones tóxicas graves que dieron lugar a su abandono. Hacia la segunda mitad del siglo XX se introdujo el hierro dextrán de alto peso molecular para el uso intravenoso e intramuscular; sin embargo, desde entonces se ha ido eliminando progresivamente debido a los informes de reacciones mortales de tipo anafiláctico causadas por la inestabilidad de la molécula (Chertow 2004), así como por la formación de anticuerpos antidextrán. Se ha reemplazado con hierro dextrán de bajo peso molecular y otras formulaciones más nuevas de hierro intravenoso, como sacarosa de hierro, gluconato férrico, ferumoxitol, carboximaltosa férrica e isomaltosida de hierro.
Se han producido avances importantes en el desarrollo de formulaciones más nuevas de hierro intravenoso. Anteriormente, la sacarosa de hierro, una formulación más segura no asociada con reacciones de tipo anafiláctico, se debía administrar en dosis pequeñas máximas de 200 mg por cada infusión, por lo que se requerían varias infusiones de dosis pequeñas para alcanzar el déficit de hierro calculado. Desde entonces se han desarrollado agentes más nuevos como la carboximaltosa férrica y la isomaltosa de hierro que permiten una infusión de dosis total, tienen dosis máximas aprobadas mucho mayores y no se han asociado con reacciones de tipo anafiláctico (Auerbach 2010).
La mayor parte de la investigación sobre el uso del hierro intravenoso se han centrado en el tratamiento de la anemia en la enfermedad intestinal inflamatoria y la nefropatía crónica. Los estudios más antiguos revelaron que el hierro intravenoso es efectivo para el tratamiento de la anemia en la enfermedad intestinal inflamatoria, con un resultado más rápido que el hierro oral y menos efectos secundarios, un factor importante para asegurar el cumplimiento (Kulnigg 2008). Se ha demostrado que la administración de hierro intravenoso en los pacientes con anemia e insuficiencia cardíaca crónica mejora de forma significativa los síntomas y la calidad de vida (Anker 2009; Okonko 2008). En las pacientes con anemia ferropénica posparto, se ha demostrado que el hierro intravenoso es seguro y al menos igual de efectivo que el hierro oral, pero con menos efectos secundarios gastrointestinales (Breymann 2008; Seid 2008). Kim 2009 mostró que el hierro intravenoso fue más efectivo que el hierro oral en el tratamiento de la anemia preoperatoria en pacientes con menorragia. Se ha demostrado que la administración de hierro intravenoso en pacientes con nefropatía crónica es más efectiva que el hierro oral y tiene menos efectos secundarios (Qunibi 2011).
Sin embargo, solo un número limitado de estudios ha analizado el uso de hierro intravenoso para la anemia en un contexto preoperatorio y los mismos se han centrado principalmente en la cirugía ortopédica. Algunos de estos estudios han mostrado una reducción en los riesgos de transfusión e infección con el uso de hierro intravenoso (Cuenca 2004; Garcia‐Erce 2005). Un estudio observacional en pacientes sometidos a cirugía mayor (resecciones por cáncer colorrectal, histerectomías y artroplastias de los miembros inferiores) observó un aumento promedio del nivel de hemoglobina de 2 g/dl en un período de tres a cinco semanas en los pacientes que recibieron hierro intravenoso (Munoz 2014).
De qué manera podría funcionar la intervención
La médula ósea requiere una renovación interna de hierro de 20 a 30 mg/día para la eritropoyesis (formación de glóbulos rojos). El cuerpo absorbe 1 a 2 mg/día de hierro de la dieta, a pesar de que la dieta normal contiene de 15 a 20 mg de hierro. El sulfato ferroso es uno de los suplementos de hierro oral utilizado con más frecuencia y un comprimido de 200 mg contiene 65 mg de hierro. El hierro oral se absorbe principalmente en el duodeno, donde es reducido a un estado ferroso por los enterocitos duodenales y exportado a la circulación a través del exportador de hierro, la ferroportina, ligado a la transferrina (Munoz 2009). El hierro oral se absorbe más fácilmente con el estómago vacío; sin embargo, esto también aumenta el riesgo de efectos secundarios gastrointestinales. Por lo tanto, los suplementos de hierro a menudo se administran con los alimentos para disminuir los efectos secundarios, aunque este procedimiento puede reducir la absorción en un 40% a un 66% (Swain 1996). Determinados fármacos como los antiácidos, los inhibidores de la bomba de protones y las tetraciclinas también reducen la absorción de hierro.
Las preparaciones de hierro intravenoso actuales consisten en complejos de hierro‐carbohidrato. Después de la inyección intravenosa, el complejo hierro‐carbohidrato es absorbido y fagocitado por el sistema retículoendotelial y el núcleo de hierro restante es exportado fuera de la célula y transportado para la eritropoyesis y el almacenamiento (Munoz 2009). Los nuevos eritrocitos generados luego de la corrección de la eritropoyesis restringida por el hierro en la médula ósea tienen una vida media más larga que los eritrocitos transfundidos (Kickler 1985).
El uso de hierro intravenoso elude los problemas de la absorción deficiente que se plantean con los suplementos de hierro oral. El hierro intravenoso también es mejor tolerado, con muchos menos efectos secundarios gastrointestinales que el hierro oral (Qunibi 2011). Las formulaciones más nuevas de hierro intravenoso como la carboximaltosa férrica se pueden administrar en dosis grandes (hasta 1000 mg) y los estudios han mostrado que el hierro intravenoso da lugar a un aumento más rápido en el nivel de hemoglobina en comparación con la administración oral de suplementos de hierro (Qunibi 2011). En la actualidad el hierro intravenoso se considera seguro y eficaz, especialmente en entornos donde el hierro oral es ineficaz o inapropiado, como en presencia de colitis o anemia por enfermedades crónicas debido a la inflamación crónica (Auerbach 2014).
Por qué es importante realizar esta revisión
La anemia preoperatoria es una variable predictiva de la transfusión de sangre alogénica perioperatoria (Shander 2004). A pesar de la selección de los productos sanguíneos, la transfusión de sangre alogénica conlleva riesgos como transmisión viral, inmunomodulación, reacciones alérgicas y aloinmunización y un aumento de la infección (Vamvakas 2009). También se ha asociado de forma independiente con un aumento de la morbilidad y la mortalidad (Ferraris 2012; Glance 2011) y con una reducción de la supervivencia relacionada con el cáncer (Acheson 2012). Los estudios también han asociado la anemia preoperatoria con un aumento de la morbilidad y la mortalidad posoperatorias y una mayor duración de la estancia hospitalaria (Acheson 2012; Beattie 2009; Gupta 2013; Spahn 2010).
El hierro oral se considera un tratamiento de primera línea si el tiempo y la biología de la enfermedad lo permiten. Es económico y efectivo en los que pueden absorberlo y tolerarlo. Cuando no presenta buena tolerabilidad, o si la intervención quirúrgica se planifica de forma inminente, el hierro intravenoso proporciona un método de tratamiento de la anemia que se utiliza cada vez más para tratar la anemia preoperatoria. Se puede administrar como un régimen amplio de dosis única, con menos efectos secundarios gastrointestinales que los comprimidos de hierro oral (Auerbach 2014). Es considerablemente más costoso que el hierro oral, y no hay datos concluyentes que demuestren que reduce la utilización de la asistencia sanitaria, o con respecto a su coste‐efectividad (Fragoulakis 2012). Se recomienda para la anemia preoperatoria, especialmente cuando la cirugía propuesta es urgente (realización prevista antes de las seis semanas) o cuando no se tolera el tratamiento con hierro por vía oral (Munoz 2017).
El objetivo de esta revisión Cochrane es resumir la evidencia sobre la administración de suplementos de hierro, enterales y parenterales, para el tratamiento de la anemia preoperatoria. La evidencia de esta revisión establecerá si se justifica la realización de un ensayo controlado aleatorizado grande para investigar la administración intravenosa de hierro en la anemia preoperatoria.
Objetivos
Evaluar los efectos del tratamiento preoperatorio con hierro (enteral o parenteral) para reducir la necesidad de transfusiones de sangre alogénicas en pacientes con anemia sometidos a cirugía.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Para ser elegibles para la inclusión en la revisión, todos los ECA que se realizaron después de 2010 tenían que haber sido registrados de forma prospectiva (Roberts 2015). Todos los ECA que publicaron sus resultados antes de 2010 fueron elegibles para la inclusión.
Se consideraron todos los ensayos controlados aleatorizados (ECA) que compararon la monoterapia preoperatoria con hierro versus placebo, ningún tratamiento, atención estándar u otra forma de tratamiento con hierro. Los estudios cruzados (crossover) fueron elegibles para inclusión en la revisión, aunque solo se utilizarían los datos de la primera fase. Los ensayos que utilizaron el tratamiento con hierro en combinación con otras intervenciones no fueron elegibles para inclusión en esta revisión.
Tipos de participantes
Adultos mayores de 18 años de edad con anemia sometidos a cirugía. La anemia se definió como valores de hemoglobina menores que 13 g/dl en los hombres y 12 g/dl en las mujeres no embarazadas (según las guías estándar de la OMS). Se aceptaron diferentes criterios de anemia que los utilizados en los estudios, cuando los investigadores proporcionaban una definición clara de lo que consideraban que constituía la anemia.
Se incluyeron los ensayos que no detallaron a los participantes con anemia cuando los resultados se estratificaron para un subgrupo con anemia. En esta revisión no se incluyó a mujeres embarazadas.
Tipos de intervenciones
Se incluyeron los ensayos que comenzaron la administración de hierro entre el día que se decidió la cirugía y el día anterior a la cirugía. Se incluyeron los ensayos con cualquier dosis, duración, formulación o vía (enteral o parenteral) de tratamiento con hierro.
Se comparó una intervención de tratamiento con hierro versus placebo, ningún tratamiento o atención estándar (como se describió en el protocolo de cada ensayo) o entre dos intervenciones de tratamiento con hierro. Se excluyeron los ensayos en los que el efecto del hierro se combinó con otra cointervención (por ejemplo, agentes estimulantes de la eritropoyesis).
Tipos de medida de resultado
Resultados primarios
-
Proporción de participantes que recibieron una transfusión de sangre
Resultados secundarios
-
Cantidad de sangre transfundida por participante (unidades)
-
Mortalidad posoperatoria a corto plazo (en el transcurso de los 30 días) y a largo plazo (de 31 días a un año)
-
Morbilidad posoperatoria (que incluye infección y eventos adversos en el transcurso de los 30 días)
-
Cualquier medida validada de la calidad de vida (en el transcurso de los 30 días)
-
Medición de los siguientes parámetros hematológicos: hemoglobina, hematocrito, nivel de ferritina y recuento de reticulocitos, medidos como variables continuas en puntos temporales predeterminados: pretratamiento; preoperatorio pero posterior al tratamiento y posoperatorio.
Cálculo del tamaño de información para el resultado primario
Si se supone que el 20% de los participantes del grupo de control requerirán una transfusión de sangre y que hay un efecto del tratamiento del 30% (es decir, el 14% requiere transfusión después del tratamiento con hierro), 819 pacientes necesitan ser asignados al azar para recibir tratamiento con hierro o control con el objetivo de obtener una estimación fiable del efecto del tratamiento (alfa = 0,05; beta = 0,1) (Keeler 2015).
Métodos de búsqueda para la identificación de los estudios
In order to reduce publication and retrieval biases we did not restrict our search by language, date or publication status.
Búsquedas electrónicas
An updated search was run on 30 July 2018, and the results of this have been fully incorporated into the review:
-
Cochrane Injuries Group Specialised Register (30 July 2018);
-
Cochrane Central Register of Controlled Trials (CENTRAL; the Cochrane Library Issue 10, 2018);
-
Ovid MEDLINE(R), Ovid MEDLINE(R) In‐Process & Other Non‐Indexed Citations, Ovid MEDLINE(R) Daily and Ovid OLDMEDLINE(R) (1946 to 30 July 2018);
-
Embase Classic and Embase (Ovid SP) (1947 to 30 July 2018);
-
PubMed (30 July 2018);
-
ISI Web of Science: Science Citation Index Expanded (SCI‐EXPANDED) (1970 to 30 July 2018);
-
ISI Web of Science: Conference Proceedings Citation Index‐Science (CPCI‐S) (1990 to 30 July 2018);
-
ClinicalTrials.gov (clinicaltrials.gov) (30 July 2018);
-
WHO International Clinical Trials Registry Platform (ICTRP) Search Portal (apps.who.int/trialsearch) (30 July 2018).
All 30 July 2018 search strategies are listed in Appendix 1. We adapted the MEDLINE search strategy as necessary for each of the other databases: the added study filter is a modified version of the Ovid MEDLINE Cochrane Highly Sensitive Search Strategy for identifying randomised trials; to the Embase search strategy we added the study design terms as used by the UK Cochrane Centre (Lefebvre 2011).
On 28 November 2019, the Cochrane Injuries Group's Information Specialist ran a top‐up search of these databases, the searches are listed in Appendix 2; one study is now awaiting classification.
Búsqueda de otros recursos
We did not search any other resources.
Obtención y análisis de los datos
The Cochrane Injuries Group's Information Specialist ran the July 2018 searches and collated the search results before passing them on to two review authors (ON and BK) for screening. The results of the November 2018 top‐up searches were given an initial screening by the Information Specialist before being passed to the review authors for further examination.
Selección de los estudios
Two review authors (ON and BK) examined the citations independently and applied pre‐agreed selection criteria to identify all potentially eligible studies. Both review authors reviewed the full text of all randomised trials that used iron therapy in surgery. There were no disagreements between authors. We describe the characteristics of excluded studies and reasons for their exclusion in the 'Characteristics of excluded studies' table.
Extracción y manejo de los datos
Independently, two review authors (ON and BK) extracted data relevant to each included study using a standardised data extraction form, and presented information about the studies in the 'Characteristics of included studies' table. Both BK and another review author (HA) independently double‐checked the data. There were no disagreements between the review authors. BK, ON, JS, MB and AA are authors of one of the included trials, Keeler 2017. AM independently extracted data from Keeler 2017 to avoid bias. In addition, the Cochrane Funding Arbiter's panel recommended that a new, unconflicted review author should repeat the data extraction and assessment of risk of bias. This author, HA, independently checked all data extraction, 'Risk of bias' tables and conclusions, including Keeler 2017, to ensure there was no serious bias in the review findings.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (ON and BK) independently assessed each study report for risk of bias by making judgements on the following questions according to the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). A third review author (HA) independently assessed risk of bias to ensure agreement.
-
Was the allocation sequence adequately generated (to check for possible selection bias)?
-
Was the allocation sequence adequately concealed (to check for possible selection bias)?
-
Was the study blinded with reference to participants, personnel and outcome assessors (to check for possible performance bias)?
-
Was there a suggestion of incomplete outcome data (to check for possible attrition bias through withdrawals, dropouts and protocol deviations)?
-
Was there any suggestion of selective outcome reporting?
-
Were there any other sources of bias?
We assessed the magnitude and direction of bias based upon our assessment of each study. If we considered bias likely to impact on findings, we planned to explore the effect of the potential bias by undertaking sensitivity analyses, however, this was not possible, due to lack of data.
A summary of our decisions about different domains of bias is shown in Figure 1 and Figure 2.
Medidas del efecto del tratamiento
For dichotomous data, we present results as summary risk ratios (RRs) with 95% confidence intervals (CIs).
For continuous data we calculated mean differences (MDs) with 95% CIs between the study groups.
The amount of blood transfused per participant was measured in units (where one unit contains approximately 250 mL of blood).
Cuestiones relativas a la unidad de análisis
The unit of analysis was the participant. For cross‐over studies we decided we would include data from the first period before the cross‐over only, due to challenges with defining a wash‐out period of suitably long duration.
Manejo de los datos faltantes
For included studies, we noted the levels of attrition in the 'Risk of bias' tables. We carried out analyses on an intention‐to‐treat basis as far as possible. We emailed trial authors for missing data, but received no responses.
Evaluación de la heterogeneidad
We assessed included trials for heterogeneity by examining forest plots visually for estimated treatment effects. We used the I² statistic to assess statistical heterogeneity. We regarded heterogeneity as moderate when I² was greater than 30%.
Evaluación de los sesgos de notificación
We assessed included trials for reporting bias based upon the absence of main outcomes expected for trials of iron therapy, namely blood transfusion, and levels of haemoglobin and ferritin. Where practicable, we compared the a priori research protocol with the published report.
Síntesis de los datos
We carried out statistical analysis using the Cochrane software, Review Manager 2014. We used a fixed‐effect model in the meta‐analysis and the Mantel‐Haenszel test for statistical significance.
We present outcome data in tables and as forest plots. We interpreted our findings using the GRADE approach and created 'Summary of findings' tables using GRADE Profiler (GRADEpro GDT), according to guidance in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). We compared measurements taken at final follow‐up between treatment groups.
In the 'Summary of findings' tables, we report the main study outcomes with the data available. These include the number of participants who received a blood transfusion, quality of life, haemoglobin levels at the end of preoperative treatment (g/dL), haemoglobin levels postoperatively (g/dL) and ferritin levels (ng/mL).
Análisis de subgrupos e investigación de la heterogeneidad
In future updates of this review, if we identify heterogeneity (I² > 30%), we will investigate it using subgroup analysis and sensitivity analysis. We plan to carry out the following subgroup analyses:
-
variations in interventions (e.g. dosing, time period of intervention, formulation of iron);
-
different types of operations;
-
different patient populations;
-
different control groups (placebo, no treatment, or standard practices).
Análisis de sensibilidad
In future updates of this review, if data permit, we will conduct sensitivity analysis based on allocation concealment (low risk of bias versus unclear or high risk of bias), and may also explore the impact of including studies with high levels of missing data.
Results
Description of studies
Results of the search
Combined searches to 30 July 2018
When the original search for the 2015 review (894 records) was combined with the 2016 (1369 records) and 2018 search (1763 records) for this update, a total of 4026 records was retrieved. After removal of duplicates, the 2015 search yielded 894 records, the 2016 search yielded a further 354 records, and the 2018 search another 89 records, making a total of 1337 records from these three searches. We identified one additional article from an internet search (Metha 2015), which brought the total to 1338 records. We discarded 1319 of the records, as the studies they described did not meet the criteria for inclusion. We assessed the full text of the 19 remaining articles for eligibility; we discarded four articles that concerned two ongoing studies (see Characteristics of ongoing studies), and excluded four articles that reported four studies that did not meet our inclusion criteria (see Excluded studies). We included the remaining 11 articles (relating to six studies) in the review as these investigated iron therapy as an intervention without the concomitant administration of another therapy (Edwards 2009; Froessler 2016; Keeler 2017; Kim 2009; Lidder 2007; Serrano‐Trenas 2011), see Figure 3.
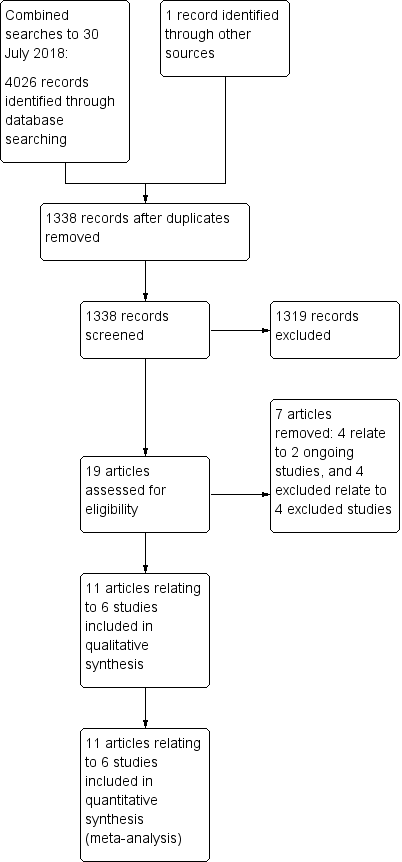
Study flow diagram for combined searches to 30 July 2018 (fully incorporated into review)
28 November 2019 search
The 2019 top‐up search yielded 335 records; after deduplication 242 records remained. These will be examined thoroughly and the results incorporated in the next update of this review. Screening thus far has indicated that 122 records are not relevant, while 116 are worthy of further consideration. Two are additional papers for a study that is already included in the review (Keeler 2017); one has been added to the study references, and reference details for the other ‐ a correction ‐ have been appended to those of the relevant paper, thus bringing the total number of references relating to the six included trials to 12. The remaining two records refer to a study that is awaiting classification (Padmanabhan 2019), see Figure 4.

Study flow diagram for 28 November 2019 top‐up searches (not completely incorporated into review)
Included studies
We found 12 articles relating to six randomised controlled trials (RCTs), with a total of 372 participants, that evaluated the use of preoperative iron therapy to correct anaemia. Four studies were prospectively registered in a clinical trial registry (Edwards 2009; Froessler 2016; Keeler 2017; Serrano‐Trenas 2011), and the two older studies do not appear to have been registered (Kim 2009; Lidder 2007).
Participants
Three studies were in colorectal surgery (Edwards 2009; Keeler 2017; Lidder 2007), one in gynaecological surgery (Kim 2009), one in orthopaedic surgery (Serrano‐Trenas 2011), and one in major abdominal surgery (Froessler 2016).
Interventions
All six studies detailed the use of iron therapy prior to surgery for preoperative anaemia. One study compared oral iron versus no iron therapy (Lidder 2007), three studies compared intravenous iron versus placebo or usual care (Edwards 2009; Froessler 2016; Serrano‐Trenas 2011), and two studies compared intravenous iron versus oral iron (Keeler 2017; Kim 2009).
Interventions and comparisons were either oral or intravenous iron compared to each other or to standard care with or without placebo. Lidder 2007 conducted an open‐label, prospective RCT that compared oral ferrous sulphate with no iron therapy. Edwards 2009 compared 600 mg intravenous iron sucrose against placebo a minimum of two weeks before surgery in a prospective, blinded, placebo‐controlled randomised trial. Kim 2009 administered either intravenous iron sucrose or oral iron (80 mg/day iron succinylate) in the three weeks preceding surgery. Serrano‐Trenas 2011 conducted a prospective RCT that compared standard treatment with 600 mg intravenous iron sucrose. Froessler 2016 gave participants either intravenous ferric carboxymaltose or usual care. Uniquely, in this trial, a preoperative and postoperative dose of intravenous iron were administered; the second postoperatively if blood loss exceeded 100 mL. Keeler 2017 randomised participants to receive either oral ferrous sulphate 200 mg twice a day or intravenous ferric carboxymaltose with dose based upon haemoglobin level and weight.
Outcomes
All studies except Kim 2009 reported the primary outcome of blood transfusion. Studies also reported levels of haemoglobin and ferritin, and morbidity. Froessler 2016 and Keeler 2017 reported quality of life, but the Keeler 2017 study authors did not report these data in time for publication of the present version of this review.
Excluded studies
We excluded four articles relating to four studies: Metha 2015 was excluded because this study was not prospectively registered and was published after 2010. One other study excluded anaemic participants (Garrido‐Martin 2012), while a second had no subgroup analysis of anaemic participants (Andrews 1997). The fourth study randomised only non‐anaemic participants, and gave all anaemic participants iron (Crosby 1994). We also identified four articles relating to two ongoing studies which currently have no available data (NCT01692418; NCT02632760), so could not be included in this iteration of the review.
Risk of bias in included studies
A summary of the review authors' 'Risk of bias' judgements can be found in Figure 1 and Figure 2.
Allocation
All included studies except Lidder 2007 reported allocation using a computer‐generated randomisation sequence, so we considered them to be at a low risk of bias for this domain. The method of random sequence allocation was not clearly described in Lidder 2007, so we judged this study to be at an unclear risk of bias for this domain.
We judged all studies except Lidder 2007 and Serrano‐Trenas 2011 to be at a low risk of bias for allocation concealment with study methodology describing clear methods for preventing investigators knowledge of assignment (opaque sealed envelopes, investigator blinding), but we considered Lidder 2007 and Serrano‐Trenas 2011 to be at an uncertain risk of bias for allocation concealment, as they did not detail how allocation concealment was achieved.
Blinding
Performance bias
One study was placebo‐controlled with participants blinded to intervention by means of an opaque sheath over the intravenous giving set and assessed as being at low risk of bias (Edwards 2009). All other trials were unblinded with either different routes of administration (Keeler 2017; Kim 2009), or compared to usual care and were assessed as being at unclear risk of bias (Froessler 2016; Lidder 2007; Serrano‐Trenas 2011).
Detection bias
The absence of blinding is less likely to create bias in objective outcome measures, such as changes in haemoglobin and ferritin levels, but could influence subjective assessments, such as quality of life questionnaires; only one study reported quality of life in time to be used in the review, and we assessed it as being at unclear of risk of bias (Froessler 2016). Blood transfusion, unless administered under a strict transfusion protocol, could potentially be influenced by lack of blinding in these studies. Four studies reported that the clinicians treating participants were blinded to the intervention the participant received and we assessed these as being at low risk of bias (Edwards 2009; Keeler 2017; Lidder 2007; Serrano‐Trenas 2011). One study did not report whether clinicians were blinded (Kim 2009), and therefore we assessed it as being at unclear risk of bias.
Incomplete outcome data
One study excluded participants with a compliance of less than 80% from the analysis, instead of completing analysis on an intention‐to‐treat basis, and we considered it to have a high risk of bias (Kim 2009). This is important, especially when considering oral iron therapy, where compliance could be a major factor in the efficacy of the treatment.
One study did not report whether data were analysed on an intention‐to‐treat basis (Lidder 2007), and we assessed it as being at unclear risk of bias. All other studies included all patient data from participants in their analyses and we assessed them as being at low risk of bias (Froessler 2016; Keeler 2017; Edwards 2009; Serrano‐Trenas 2011).
Selective reporting
After comparison of the study register record with the published study reports, we found no evidence of selective reporting in four of the studies included in this review and assessed their risk of bias for this domain as low (Froessler 2016; Keeler 2017; Kim 2009; Lidder 2007). Two studies were not prospectively registered and we assessed them as being at unclear risk for reporting bias (Edwards 2009; Serrano‐Trenas 2011).
Other potential sources of bias
One study reported early termination of the study after investigators reported the number of blood transfusions was higher than expected (Froessler 2016). Three independent assessors evaluated interim data and two advised termination due to higher than expected levels of poor outcomes. This interim analysis was conducted independently of the investigators and the data were blinded. However, the risk of bias is unclear. We judged the risk of bias for this domain to be low for all the other studies.
Effects of interventions
See: Summary of findings for the main comparison Iron therapy compared to placebo, no treatment or standard care for preoperative anaemia; Summary of findings 2 Intravenous iron therapy compared to oral iron therapy for preoperative anaemia
Comparison 1: iron therapy compared to placebo, no treatment or standard care
Primary outcome: proportion of participants who received a blood transfusion
Four studies measured and reported the proportion of participants who received allogeneic blood transfusions (Edwards 2009; Froessler 2016; Lidder 2007; Serrano‐Trenas 2011). Iron therapy produced no clear reduction in the proportion of participants who received a blood transfusion (risk ratio (RR) 1.21, 95% confidence interval (CI) 0.87 to 1.70; I² = 54%; 4 studies, 200 participants; moderate‐quality evidence; Analysis 1.1).
Secondary outcomes
Amount of blood transfused per participant (in units)
Four studies measured and reported the number of units of blood transfused in each treatment group (Edwards 2009; Froessler 2016; Lidder 2007; Serrano‐Trenas 2011). However, it was not possible to combine the data because they were skewed and one study did not report subset data for the 90 participants who were anaemic at recruitment (Serrano‐Trenas 2011). The raw data are given in the table below.
| Study | Control | Iron group |
| Median 2 units (interquartile range (IQR) 3 units; n = 9; unspecified number of total units transfused) | Median 0 units (IQR 1 unit; n = 9; unspecified number of total units transfused) | |
| Median 0 units (range 0 to 2 units) | Median 0 units (range 0 to 5 units) | |
| Median 2.5 units (range 0 to 11 units; n = 14; 39 units transfused in total) | Median 1 unit (range 0 to 2 units; n = 6; 6 units transfused in total) | |
| Mean 0.87 units (standard deviation (SD) 1.21 units; n = 100 (50 anaemic)) | Mean 0.76 units (SD 1.16 units; n = 100 (40 anaemic)) |
Postoperative mortality in the short term (within 30 days) and long term (from 31 days up to one year)
Two studies did not measure or report mortality (38 participants) (Edwards 2009; Lidder 2007). Two studies measured and reported no clear difference in short‐term mortality (162 participants) (Froessler 2016; Serrano‐Trenas 2011). In the former study, one death occurred in the intervention group and none in the control; in the latter, 10 participants died in the intervention arm and 11 in the control. As the former study was terminated early, the time periods for these data may not be not directly comparable. No studies measured or reported long‐term mortality.
Postoperative morbidity (including infections and adverse events)
Two studies did not measure or report postoperative morbidity (38 participants) (Edwards 2009; Lidder 2007). Two studies measured and reported no difference in morbidity (162 participants) (Froessler 2016; Serrano‐Trenas 2011). Froessler 2016 reported three minor adverse events: headache, light‐headedness and back pain (72 participants). Serrano‐Trenas 2011 also reported three minor adverse events: one skin rash and two participants with general discomfort (90 participants). No serious adverse events were reported in any study.
Any validated measure of quality of life
Froessler 2016 reported no clear difference in quality of life scores between groups four weeks after intervention (90 participants), measured using the 36‐item Short Form Survey (SF‐36) (Analysis 1.2) (Ware 1992). The other studies within this comparison did not measure quality of life.
Haematologic parameters measured pretreatment, preoperatively but post‐treatment, and postoperatively
Haemoglobin level
Both Lidder 2007 and Serrano‐Trenas 2011 collected data on this outcome at two time points, pretreatment and preoperatively post‐treatment, but the data were not reported separately for the anaemic participants.
Edwards 2009 and Froessler 2016 reported haemoglobin levels for the 83 anaemic participants at the end of preoperative treatment, when there was no difference in haemoglobin levels between the control and intervention groups (mean difference (MD) 0.63 g/dL, 95% CI ‐0.07 to 1.34; I² = 41%; 2 studies, 83 participants; low‐quality evidence; Analysis 1.3).
Postoperatively, there was no clear difference between haemoglobin levels in the two groups (MD 0.17 g/dL, 95% CI ‐0.29 to 0.63; I² = 78%; 2 studies, 86 participants; low‐quality evidence; Analysis 1.4).
Haematocrit level
The Edwards 2009 study collected data on haematocrit levels pretreatment, at the end of treatment preoperatively, and after treatment postoperatively, but no standard deviation values were reported and so it was not possible to analyse the data.
Ferritin level
The Lidder 2007 and Serrano‐Trenas 2011 studies did not report ferritin data separately for anaemic participants.
The Edwards 2009 study collected data on ferritin levels pretreatment, at the end of treatment preoperatively, and after treatment postoperatively, but no standard deviation values were reported and so it was not possible to analyse the data.
Only Froessler 2016 reported an increase in ferritin at four weeks with intravenous iron therapy (MD 149.00, 95% CI 25.84 to 272.16; 1 study, 63 participants; Analysis 1.5). This is clinically important evidence of iron repletion.
Reticulocyte count
The Lidder 2007 study authors performed reticulocyte counts at two time points, pretreatment and preoperatively post‐treatment, but the data were not reported separately for the 20 anaemic participants. The Edwards 2009, Serrano‐Trenas 2011 and Froessler 2016 studies did not report reticulocyte count.
Comparison 2: intravenous iron therapy compared to oral iron therapy
Two studies compared intravenous iron therapy to oral iron therapy, Kim 2009 and Keeler 2017 (172 participants).
Primary outcome: proportion of participants who received a blood transfusion
The Kim 2009 study did not measure this outcome. The Keeler 2017 study (116 participants) reported no difference in blood transfusions between the oral and intravenous iron groups overall (Analysis 2.1).
Secondary outcomes
Amount of blood transfused per participant (in units)
The Kim 2009 study did not measure this outcome. Keeler 2017 (116 participants) reported no difference in the amount of blood transfused (Analysis 2.2).
Postoperative mortality in the short term (within 30 days) and long term (from 31 days up to one year)
The Kim 2009 study did not measure mortality. Keeler 2017 (116 participants) did not report 30‐day mortality, but did report 90‐day mortality, for which there was no clear difference between the intervention groups (six deaths in the oral iron group, eight in the intravenous group).
Postoperative morbidity (including infections and adverse events)
There was no difference in the grade or risk of all complications, or infective complications, between interventions in the Keeler 2017 study (116 participants).
The Kim 2009 study reported no severe adverse events, though minor adverse events were observed in each group. These included two cases of myalgia and one case of injection pain in the intravenous iron group, and one report of nausea and one of dyspepsia in the oral iron group (56 participants).
Keeler 2017 reported one serious adverse event, which was a rash that followed administration of intravenous iron, which was treated with an oral antihistamine. Minor adverse events were observed in both groups, most commonly headaches in the intravenous iron group, and two participants experienced dyspepsia and constipation in the oral iron group (116 participants).
Any validated measure of quality of life
The Kim 2009 study did not measure this outcome. The Keeler 2017 study authors did measure quality of life but the data were not reported in time for publication of the present version of this review.
Haematologic parameters measured pretreatment, preoperatively but post‐treatment, and postoperatively
Haemoglobin level
The Kim 2009 and Keeler 2017 studies reported haemoglobin levels pretreatment, when there was no difference between the control and intervention groups.
Both the Kim 2009 and Keeler 2017 studies measured haemoglobin levels preoperatively post‐treatment. Haemoglobin levels were higher in the intravenous iron therapy group than the oral iron therapy group (MD 1.23 g/dL, 95% CI 0.80 to 1.65; I² = 79%; 2 studies, 172 participants; low‐quality evidence; Analysis 2.3).
These results are despite Kim 2009 only analysing those participants with more than 80% compliance with oral iron therapy, and higher than expected compliance with oral iron therapy seen in the Keeler 2017 study.
Haematocrit level
The Kim 2009 and Keeler 2017 studies did not measure this outcome.
Ferritin level
The Kim 2009 and Keeler 2017 studies reported ferritin levels pretreatment, and there was no difference between the control and intervention groups (MD 6.59 ng/mL, 95% CI ‐11.75 to 24.93; I² = 20%; 2 studies, 151 participants; Analysis 2.4). The results from these studies have wide standard deviations as a result of small sample sizes and very large differences in ferritin levels that ranged from under 30 ng/mL for iron deficiency to over 1000 ng/mL in participants who were iron replete.
The Kim 2009 and Keeler 2017 studies reported ferritin levels preoperatively post‐treatment. Ferritin levels were higher in the intravenous iron therapy group than the oral iron therapy group (MD 395.03 ng/mL, 95% CI 227.72 to 562.35; I² = 69%; 2 studies, 151 participants; low‐quality evidence; Analysis 2.5).
Reticulocyte count
The Kim 2009 and Keeler 2017 studies did not measure this outcome.
Discusión
Resumen de los resultados principales
Se identificaron seis ensayos controlados aleatorizados (ECA) prospectivos, con un total de 372 participantes, que evaluaron el tratamiento preoperatorio con hierro para corregir la anemia. Tres estudios se realizaron en la cirugía colorrectal (Edwards 2009; Keeler 2017; Lidder 2007), uno en la cirugía ginecológica (Kim 2009), uno en la cirugía ortopédica (Serrano‐Trenas 2011) y uno en la cirugía abdominal mayor (Froessler 2016). Cinco ensayos informaron el resultado primario (proporción de participantes que recibieron transfusiones de sangre alogénica) en 316 pacientes (200 hierro versus atención estándar o placebo, 116 hierro oral versus hierro intravenoso). El metanálisis del tratamiento con hierro versus placebo, ningún tratamiento o atención estándar no mostró una reducción en la proporción de participantes que recibieron una transfusión de sangre (riesgo relativo [RR] 1,21; intervalo de confianza [IC] del 95%: 0,87 a 1,70; I² = 54%; 4 estudios, 200 participantes; evidencia de calidad moderada; Análisis 1.1). Solo un estudio informó de las transfusiones después de la administración de hierro oral o intravenoso y no informó de diferencias en las transfusiones (Keeler 2017). El número total de participantes es mucho menor que los 891 participantes que indicó el cálculo del tamaño de información que sería necesario para detectar una diferencia.
Para los resultados secundarios, Edwards 2009; Kim 2009; Keeler 2017 y Froessler 2016 informaron cambios en el nivel de hemoglobina específicamente para los participantes con anemia. No se observaron diferencias claras en la hemoglobina al final del tratamiento preoperatorio con hierro en comparación con placebo o atención estándar (diferencia de medias [DM] 0,63 g/dl; IC del 95%: ‐0,07 a 1,34; I² = 41%; 2 estudios, 83 participantes; evidencia de calidad baja; Análisis 1.3). Hubo un aumento de la hemoglobina con el hierro intravenoso al final del tratamiento preoperatorio (DM 1,23 g/dl; IC del 95%: 0,80 a 1,65; I² = 79%; 2 estudios, 172 participantes; evidencia de calidad baja; Análisis 2.3); sin embargo, los autores del estudio Kim 2009 posiblemente sesgaron sus resultados al excluir a los participantes que cumplieron con menos del 80% del tratamiento.
Los niveles de ferritina aumentaron con el hierro intravenoso en comparación con la atención estándar (Froessler 2016) y con el hierro oral (DM 395,03 ng/ml; IC del 95%: 227,72 a 562,35; I² = 69%; 2 estudios, 151 participantes; evidencia de calidad baja; Análisis 2.5; Keeler 2017; Kim 2009).
En la mayoría de los estudios no se midieron ni informaron otros resultados secundarios como la calidad de vida, la mortalidad a corto plazo y la morbilidad posoperatoria, y en los casos en que sí, no hubo diferencias claras entre las intervenciones.
Compleción y aplicabilidad general de las pruebas
Actualmente, la evidencia con respecto al tratamiento con hierro para la anemia preoperatoria es limitada, con datos disponibles solo de seis ECA, tres de los cuales tenían tamaños de la muestra muy pequeños. Además, los 372 participantes disponibles para el análisis del resultado primario constituyen solo el 45% de los 819 participantes recomendados por el cálculo del tamaño de la información, lo que impide establecer conclusiones fiables con respecto a los efectos del tratamiento con hierro administrado de forma preoperatoria. Estos estudios también son limitados en su generalizabilidad, ya que solo están representadas tres especialidades quirúrgicas, aunque son especialidades en las que la anemia y la pérdida de sangre son frecuentes. Hasta ahora, ningún estudio ha examinado la relación coste‐efectividad.
Dos estudios en curso de la cirugía abdominal abierta mayor, el ensayo PREVENTT (500 participantes), y de la cirugía cardíaca, el ensayo ITACS (1000 participantes), aumentarán significativamente la cantidad de datos disponibles para analizar, e incluirán datos sobre la seguridad, p.ej., el riesgo de infecciones, la calidad de vida y la coste‐efectividad.
Calidad de la evidencia
Esta actualización de la revisión Cochrane anterior, Ng 2015b, ha duplicado el número de estudios incluidos de tres a seis y ha aumentado el número de participantes de 114 a 372. Los tres estudios más recientes han sido más grandes y mejor diseñados, e informaron de la morbilidad y la mortalidad de forma completa, y dos informaron de la calidad de vida (aunque los resultados de Keeler 2017 no se informaron a tiempo para la publicación de la presente versión de esta revisión). Sin embargo, el total de 372 participantes en este análisis está muy por debajo de los 819 requeridos por el cálculo del tamaño de información para detectar una reducción del 30% en las transfusiones de sangre. La evaluación GRADE de la calidad para la medida de resultado primaria, la proporción de participantes que necesitaron una transfusión de sangre, fue de calidad moderada debido al escaso número de participantes. Todos los demás resultados se consideraron de calidad baja debido al escaso número de participantes y a la exclusión de los participantes que no cumplieron con el tratamiento en un ensayo (Kim 2009). Además, el estudio Kim 2009 tuvo importantes omisiones al no registrar las transfusiones de sangre ni los resultados de la calidad de vida. Este estudio también excluyó en el análisis final los datos de los participantes cuyo cumplimiento fue menor del 80% y reconoció que el cumplimiento es un factor importante en la eficacia del tratamiento con hierro oral, aunque, por este motivo, no refleja la realidad de que muchos pacientes no se adhieren al tratamiento con hierro oral debido a los efectos secundarios.
Edwards 2009; Lidder 2007 y Serrano‐Trenas 2011 no excluyeron a los participantes que no presentaban anemia, ni evaluaron la deficiencia de hierro. Aunque incluyeron un análisis de subgrupo de los participantes con anemia, no informaron todos los datos de este grupo con anemia, y estos estudios no tuvieron el poder estadístico para mostrar una diferencia en el grupo de participantes que podrían necesitar hierro para corregir su anemia, es decir, los que presentan anemia por deficiencia de hierro. Como resultado, estos estudios tienen incluso menos participantes con los cuales determinar el verdadero efecto del tratamiento con hierro.
Sesgos potenciales en el proceso de revisión
BK, ON, JS, MB y AA son autores de uno de los ensayos incluidos, Keeler 2017. AM extrajo los datos de Keeler 2017 de forma independiente debido a que no estaba involucrado en el estudio. El panel Cochrane Funding Arbiter recomendó que un autor nuevo, sin conflictos, repitiera la extracción de los datos y la evaluación del riesgo de sesgo. Este autor, HA, verificó de forma independiente toda la extracción de los datos, las tablas de «Riesgo de sesgo» y las conclusiones,con la inclusión de Keeler 2017; para asegurar que los datos se habían extraído e informado de forma precisa.
Acuerdos y desacuerdos con otros estudios o revisiones
Los seis ECA presentados en esta revisión no apoyan las conclusiones de los estudios observacionales y de casos y controles que han demostrado que el tratamiento con hierro reduce la transfusión de sangre alogénica y mejora los niveles de hemoglobina preoperatoria. Los mismos incluyen estudios de la cirugía colorrectal (Okuyama 2005; Quinn 2010), ortopédica (Cuenca 2004; Cuenca 2005; Munoz 2014; Theusinger 2007) y ginecológica (Breymann 2008). Estos hallazgos también contradicen los hallazgos de una revisión sistemática mucho más grande y amplia de 72 estudios que incluyó a 10 605 participantes y examinó la anemia de forma más general, incluidas las afecciones distintas de la anemia preoperatoria (Litton 2013). En la revisión Litton 2013 el metanálisis mostró que el hierro intravenoso se asoció con un aumento de la hemoglobina (DM estándar 6,5 g/l; IC del 95%: 5,1 g/l a 7,9 g/l) y un menor riesgo de transfusión de sangre (RR 0,74; IC del 95%: 0,62 a 0,88). Sin embargo, los resultados de la presente revisión pueden ser un reflejo del tamaño de la muestra pequeño en los seis estudios incluidos y de la capacidad de detectar una diferencia con tan pocos datos.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies. Six studies are included in this review.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Study flow diagram for combined searches to 30 July 2018 (fully incorporated into review)
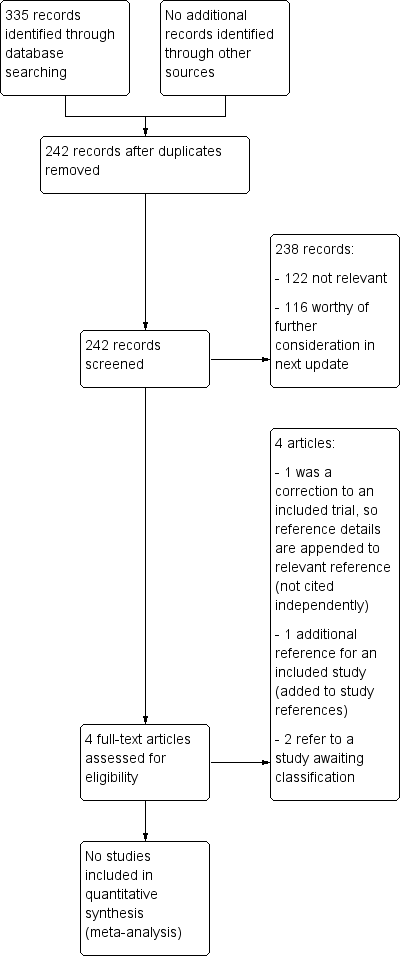
Study flow diagram for 28 November 2019 top‐up searches (not completely incorporated into review)

Comparison 1 Iron therapy versus placebo, no treatment or standard care, Outcome 1 Proportion of participants who received a blood transfusion.

Comparison 1 Iron therapy versus placebo, no treatment or standard care, Outcome 2 Quality of life (SF‐36) 4 weeks postoperatively.
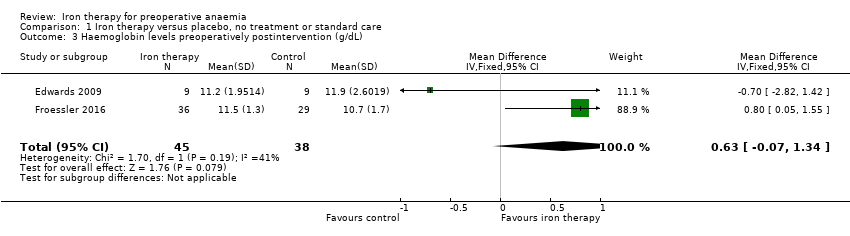
Comparison 1 Iron therapy versus placebo, no treatment or standard care, Outcome 3 Haemoglobin levels preoperatively postintervention (g/dL).

Comparison 1 Iron therapy versus placebo, no treatment or standard care, Outcome 4 Haemoglobin levels postintervention postoperatively (g/dL).

Comparison 1 Iron therapy versus placebo, no treatment or standard care, Outcome 5 Ferritin level post‐treatment (ng/mL).

Comparison 2 Intravenous versus oral iron therapy, Outcome 1 Number of participants who received a blood transfusion.
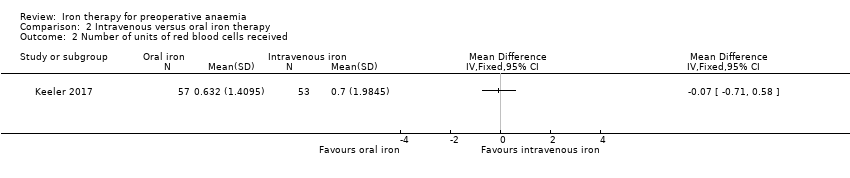
Comparison 2 Intravenous versus oral iron therapy, Outcome 2 Number of units of red blood cells received.
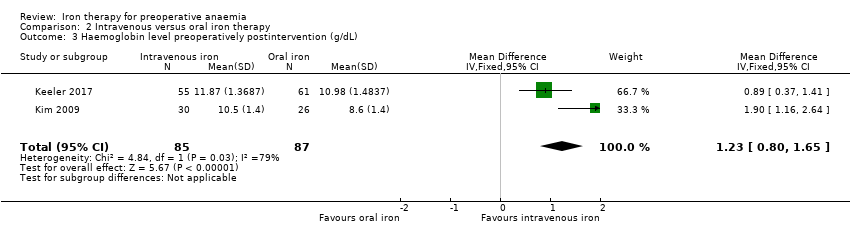
Comparison 2 Intravenous versus oral iron therapy, Outcome 3 Haemoglobin level preoperatively postintervention (g/dL).
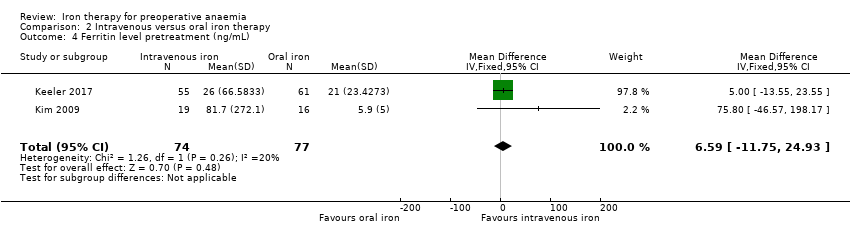
Comparison 2 Intravenous versus oral iron therapy, Outcome 4 Ferritin level pretreatment (ng/mL).

Comparison 2 Intravenous versus oral iron therapy, Outcome 5 Ferritin level preoperatively postintervention (ng/mL).
| Iron therapy compared to placebo, no treatment or standard care for preoperative anaemia | ||||||
| Patient or population: people with preoperative anaemia awaiting major surgery | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Placebo, no treatment or standard care | Iron therapy | |||||
| Proportion of participants who received a blood transfusion | 438 per 1000 | 386 per 1000 | RR 1.21 | 200 | ⊕⊕⊝⊝ | |
| Any validated measure of quality of life (measured by SF36) | 6 ± 17 | 8 ± 18 | ‐ | 72 (1 study) | ⊕⊝⊝⊝ Very lowb | |
| Haemoglobin levels at end of preoperative treatment (g/dL) | The mean haemoglobin level in the control groups was | The mean haemoglobin levels in the intervention groups was | MD 0.63 (‐0.07 to 1.34) | 83 | ⊕⊕⊝⊝ | |
| Haemoglobin levels post‐treatment and surgery (g/dL) | The mean haemoglobin level in the control groups was | The mean haemoglobin levels in the intervention groups was | MD 0.17 (‐0.29 to 0.63) | 86 | ⊕⊕⊝⊝ | |
| Ferritin at the end of preoperative treatment (ng/mL) | The mean ferritin level in the control group was 99 ng/mL | The mean ferritin level in the intervention groups was 149 ng/mL higher (26 higher to 272 higher) | MD 149.00 (25.68 to 272.32) | 76 (1 study) | ⊕⊕⊝⊝ | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| aDowngraded 2 levels for imprecision with only four randomised control trials including subsets of anaemic participants, resulting in a small number of participants. | ||||||
| Intravenous iron therapy compared to oral iron therapy for preoperative anaemia | ||||||
| Patient or population: people with preoperative anaemia awaiting major surgery | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Oral iron therapy | Intravenous iron therapy | |||||
| Proportion of participants who received a blood transfusion | No data available | No data available | ‐ | ‐ | ‐ | |
| Any validated measure of quality of life | No data available | No data available | ‐ | ‐ | ‐ | |
| Haemoglobin levels at end of preoperative treatment (g/dL) | The mean haemoglobin level in the oral iron groups was | The mean haemoglobin level in the IV iron groups was | MD 1.23 (0.80 to 1.65) | 172 | ⊕⊕⊝⊝ | |
| Haemoglobin levels post‐treatment and surgery (g/dL) | No data available | No data available | ‐ | ‐ | ‐ | |
| Ferritin preoperatively postintervention (ng/L) | The mean ferritin level in the oral iron groups was 23 ng/mL | The mean ferritin level in the IV iron groups was 395 ng/mL higher (228 higher to 562 higher) | MD 395.03 (227.72 to 562.35) | 151 (2 studies) | ⊕⊕⊝⊝ | |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| a Downgraded twice overall: 1 level due to risk of bias (attrition bias), as the Kim 2009 study excluded participants with less than 80% compliance with therapy (compliance was lower in the oral group); and 1 level for imprecision as only two studies with a small number of participants contributed to the results. | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Proportion of participants who received a blood transfusion Show forest plot | 4 | 200 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.21 [0.87, 1.70] |
| 2 Quality of life (SF‐36) 4 weeks postoperatively Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 3 Haemoglobin levels preoperatively postintervention (g/dL) Show forest plot | 2 | 83 | Mean Difference (IV, Fixed, 95% CI) | 0.63 [‐0.07, 1.34] |
| 4 Haemoglobin levels postintervention postoperatively (g/dL) Show forest plot | 2 | 86 | Mean Difference (IV, Fixed, 95% CI) | 0.17 [‐0.29, 0.63] |
| 5 Ferritin level post‐treatment (ng/mL) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Number of participants who received a blood transfusion Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 2 Number of units of red blood cells received Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 3 Haemoglobin level preoperatively postintervention (g/dL) Show forest plot | 2 | 172 | Mean Difference (IV, Fixed, 95% CI) | 1.23 [0.80, 1.65] |
| 4 Ferritin level pretreatment (ng/mL) Show forest plot | 2 | 151 | Mean Difference (IV, Fixed, 95% CI) | 6.59 [‐11.75, 24.93] |
| 5 Ferritin level preoperatively postintervention (ng/mL) Show forest plot | 2 | 151 | Mean Difference (IV, Fixed, 95% CI) | 395.03 [227.72, 562.35] |

