Mascar chicle para la mejoría de la recuperación temprana de la función intestinal después de la cesárea
Resumen
Antecedentes
La cesárea es la cirugía mayor más frecuente en el mundo. Después de la cesárea es de esperar una deficiencia transitoria de la motilidad intestinal. Aunque en general se resuelve espontáneamente dentro de unos pocos días, puede causar malestar considerable, requerir medicación sintomática y retrasar el alta hospitalaria, por lo que aumentan los costos. Mascar chicle en el período posoperatorio inmediato es una intervención sencilla que puede ser efectiva para mejorar la recuperación de la función intestinal en otros tipos de cirugías abdominales.
Objetivos
Evaluar los efectos de mascar chicle para reducir la duración del íleo posoperatorio y mejorar la recuperación posoperatoria después de una cesárea.
Métodos de búsqueda
Se hicieron búsquedas en el registro de ensayos del Grupo Cochrane de Embarazo y Parto (Cochrane Pregnancy and Childbirth Group's Trials Register) (20 junio 2016), LILACs (20 junio 2016), ClinicalTrials.gov (20 junio 2016), WHO International Clinical Trials Registry Platform (ICTRP) (20 junio 2016) y en las listas de referencias de los estudios recuperados.
Criterios de selección
Todos los ensayos controlados aleatorios que compararon chicle versus atención habitual para las pacientes en las primeras 24 horas después de una cesárea. Se incluyeron estudios publicados en forma de resumen solamente.
Los ensayos cuasialeatorios, cruzados o asignados al azar de forma grupal no fueron elegibles para inclusión en esta revisión.
Obtención y análisis de los datos
Dos autores de la revisión seleccionaron de forma independiente los estudios para su inclusión, extrajeron los datos y evaluaron el riesgo de sesgo siguiendo los métodos Cochrane estándar. Los resultados dicotómicos se presentaron como cocientes de riesgos (CR) con intervalos de confianza (IC) del 95% y los resultados continuos como diferencias de medias (DM) con IC del 95%. Los resultados de los estudios similares se agruparon mediante un modelo de efectos aleatorios en caso de heterogeneidad importante. Se utilizó el enfoque GRADE para evaluar la calidad general de las pruebas.
Resultados principales
Se incluyeron 17 ensayos aleatorios (3149 participantes) realizados en nueve países diferentes. Siete estudios (1325 pacientes) reclutaron exclusivamente a pacientes sometidas a cesárea electiva y cinco estudios (833 pacientes) sólo incluyeron a pacientes sometidas a una cesárea primaria. Diez estudios (1731 pacientes) utilizaron protocolos de alimentación convencional (nada por vía oral hasta el retorno de la función intestinal). El régimen de mascar chicle varió entre los estudios con respecto al comienzo (inmediatamente después de la cesárea, hasta 12 horas después), la duración de cada sesión (de 15 a 60 minutos) y el número de sesiones por día (tres a más de seis). Todos los estudios se consideraron con alto riesgo de sesgo debido a la naturaleza de la intervención, no fue posible cegar a las pacientes y la mayoría de los resultados fueron autoinformados.
Medidas de resultado principales de esta revisión: En las pacientes que mascaron chicle, el tiempo hasta la expulsión del primer flato fue siete horas más corto que el de las pacientes del grupo control "atención habitual" (DM ‐7,09 horas; IC del 95%: ‐9,27 a ‐4,91 horas; 2399 mujeres; 13 estudios; efectos aleatorios, Tau² = 14,63; I² = 95%, pruebas de muy baja calidad). Este efecto fue consistente en todos los análisis de subgrupos (cesárea primaria y repetida, tiempo mascando chicle por día, protocolos de alimentación temprana y convencional, cesárea electiva y no electiva y tiempo después de la cesárea al que se comenzó a mascar chicle). Como promedio la tasa de íleo fue más del 60% menor en el grupo de chicle en comparación con el control (CR 0,39; IC del 95%: 0,19 a 0,80; 1139 participantes; cuatro estudios; I² = 39%, pruebas de baja calidad). La tolerancia a mascar chicle pareció ser alta. Tres pacientes de un estudio se quejaron acerca del chicle (pero no se proporcionó información adicional) y ninguno de los estudios informó efectos adversos (ocho estudios, 925 mujeres, pruebas de baja calidad).
Medidas de resultado secundarias de esta revisión: el tiempo hasta la evacuación de heces ocurrió como promedio nueve horas antes en el grupo de intervención (DM ‐9,22 horas; IC del 95%: ‐11,49 a ‐6,95 horas; 2016 participantes; 11 estudios; efectos aleatorios, Tau² = 12,53; I² = 93%, pruebas de muy baja calidad). El promedio de la duración de la estancia hospitalaria fue más corto en el grupo de intervención en comparación con el control (DM ‐0,36 días; IC del 95%: ‐0,53 a ‐0,18 días; 1489 participantes; siete estudios; efectos aleatorios, Tau² = 0,04; I² = 92%). El primer ruido intestinal se escuchó antes en el grupo de intervención que en el grupo control (DM ‐4,56 horas; IC del 95%: ‐6,18 a ‐2,93 horas; 1729 participantes; nueve estudios; efectos aleatorios, Tau² = 5,41; I² = 96%). Ninguno de los estudios evaluó la satisfacción de la paciente con respecto a tener que mascar chicle. La necesidad de agentes analgésicos o antieméticos no difirió entre los grupos de intervención y control (CR promedio 0,50; IC del 95%: 0,12 a 2,13; 726 participantes; tres estudios; efectos aleatorios, Tau² = 0,79; I² = 69%).
Conclusiones de los autores
Esta revisión encontró 17 ensayos controlados aleatorios (con 3149 mujeres). La calidad de las pruebas del tiempo hasta la primera expulsión de flatos y evacuación de heces y de los efectos adversos / la intolerancia a mascar chicle se disminuyó debido al alto riesgo de sesgo de los estudios (debido a la falta de cegamiento y el autoinforme). Para el tiempo hasta el primer flato y las primeras heces la calidad de las pruebas se disminuyó de manera adicional debido a la heterogeneidad alta en estos metanálisis y a la posibilidad de sesgo de publicación según la inspección visual de los gráficos en embudo. La calidad de las pruebas para los efectos adversos / la tolerancia a mascar chicle y para el íleo se disminuyó debido al número pequeño de eventos. La calidad de las pruebas para el íleo se disminuyó de manera adicional debido al riesgo incierto de sesgo para los evaluadores que analizaron este resultado.
Las pruebas disponibles indican que mascar chicle en el período posoperatorio inmediato después de una cesárea es una intervención bien tolerada que mejora la recuperación temprana de la función intestinal. Sin embargo, la calidad general de las pruebas es muy baja a baja.
Se necesitan estudios de investigación adicionales para establecer el régimen óptimo de mascar chicle (comienzo, número y duración de las sesiones por día) para mejorar la recuperación de la función intestinal y para evaluar los efectos adversos potenciales y la satisfacción de las pacientes con esta intervención. Los estudios nuevos también necesitan evaluar el cumplimiento de las participantes de las instrucciones recomendadas de mascar chicle. Estudios futuros grandes, bien diseñados y realizados, con mejor calidad metodológica y del informe, ayudarán a informar las actualizaciones futuras de esta revisión y mejorar el grupo de pruebas para esta intervención.
PICO
Resumen en términos sencillos
¿Mascar chicle después de una cesárea da lugar a una recuperación más rápida de la función intestinal?
¿Cuál es el tema?
Actualmente muchas mujeres dan a luz por cesárea. La proporción de mujeres que paren por cesárea varía del 15% a más del 50% en algunos países. Después de una cesárea es frecuente que el intestino deje de funcionar durante varias horas o días. Aunque generalmente se resuelve solo en unos pocos días, puede ser muy incómodo. Los gases y las heces retenidas pueden causar que la barriga de la madre se inflame y presente dolores tipo cólico, pueda sentir náuseas y tener vómitos, por lo que no pueda comer. Puede necesitar fármacos adicionales para aliviar estos síntomas y se puede retrasar el alta hospitalaria. La administración de fármacos que alivien el dolor durante el trabajo de parto y de analgésicos después de la cirugía también puede retrasar la función intestinal.
Aunque la alimentación temprana después de una cesárea puede estimular los intestinos, también podría provocar vómitos. Por eso muchos obstetras todavía impiden la ingestión de alimentos hasta que se detecten sonidos intestinales y haya expulsiones de gases o flatos. Mascar chicle puede ayudar a que los intestinos funcionen nuevamente más temprano, como se muestra con otros tipos de cirugías. Se desea determinar si también funciona después de una cesárea. Mascar chicle en las primeras 24 horas después de la cirugía es una intervención sencilla y barata.
¿Qué pruebas se encontraron?
Se incluyeron estudios controlados aleatorios publicados hasta junio de 2016.
Se encontraron 17 estudios con 3149 pacientes que tuvieron un parto por cesárea. En estos estudios un grupo de pacientes mascó chicle, y un segundo grupo no lo hizo y recibió atención habitual. Los estudios se realizaron en nueve países (principalmente países de ingresos bajos a medios) y fueron diferentes en muchos aspectos. Por ejemplo, algunos estudios sólo incluyeron pacientes que tenían su primer hijo y otros incluyeron pacientes con una cesárea anterior; algunos estudios sólo incluyeron las cesáreas electivas (programada previamente) y otros también incluyeron las cesáreas de urgencia. La manera en la que se proporcionó el chicle también difirió en los estudios; en algunos las pacientes comenzaron a mascar chicle después de la cesárea y en otros se esperó hasta 12 horas. Además, las pacientes no se pudieron cegar a recibir chicle. La combinación de los resultados (en un metanálisis) de estos estudios indicó que las pacientes que mascaron chicle después de una cesárea tuvieron un retorno más temprano de la función intestinal. Como promedio, expulsaron gases siete horas antes (13 estudios, 2399 mujeres). Este efecto fue consistente para la primera cesárea versus la cesárea repetida, el tiempo mascando chicle por día, la alimentación temprana versus nada por vía oral hasta el retorno de la función intestinal, la cesárea electiva versus no electiva o de urgencia, y el tiempo después de la cesárea al que se comenzó a mascar chicle. La calidad de las pruebas para este resultado fue muy baja. Las pacientes que mascaron chicle tuvieron una probabilidad de al menos la mitad de presentar "íleo" (una combinación de síntomas como timpanismo abdominal, dolor tipo cólico, náuseas, vómitos e imposibilidad de defecar) en comparación con las pacientes que no mascaron chicle (cuatro estudios, 1139 mujeres, pruebas de baja calidad). Mascar chicle redujo el tiempo hasta la primera defecación en alrededor de nueve horas antes (11 estudios, 2016 pacientes, pruebas de muy baja calidad) y el tiempo hasta el alta hospitalaria en unas ocho horas (siete estudios; 1489 mujeres). Sólo tres de 925 pacientes se quejaron acerca de tener que mascar chicle y no hubo informes de efectos adversos asociados con mascar chicle (ocho estudios, 925 mujeres, pruebas de baja calidad). Ninguno de los estudios evaluó la satisfacción de las pacientes con respecto al chicle.
La calidad general de las pruebas fue baja a muy baja, principalmente debido a la falta de cegamiento de las participantes (las pacientes sabían que mascaban chicle) y la heterogeneidad entre los estudios.
¿Qué quiere decir esto?
Las pruebas disponibles indican que mascar chicle en las primeras 24 horas después de una cesárea es una intervención sencilla bien tolerada, de bajo costo, segura y fácil que mejora la recuperación temprana de la función intestinal, mejora el bienestar materno y potencialmente reduce los costos hospitalarios. Se necesitan estudios de investigación adicionales para establecer el régimen óptimo de mascar chicle (cuándo comenzar, número y duración de las sesiones por día) para mejorar la recuperación de la función intestinal y para evaluar los efectos adversos potenciales y la satisfacción de las pacientes con esta intervención.
Conclusiones de los autores
Summary of findings
| Chewing gum compared to control for enhancing early recovery of bowel function after caesarean section | ||||||
| Patient or population: women in the immediate postpartum period (within the first 24 hours) after having had a caesarean section | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Chewing gum | |||||
| Time to first passage of flatus | The mean time to first passage of flatus in the control group was 30.36 hours | The mean time to first passage of flatus in the intervention groups was 7.09 h shorter than in the control group (9.27 to 4.91 h shorter) | Not estimable | 2399 | ⊕⊝⊝⊝ | 11 of these studies were conducted in Asia and 2 in Africa. |
| Proportion of participants with ileus | 11 per 100 | 5 per 100 | RR 0.39 | 1139 | ⊕⊕⊝⊝ | 3 of these studies were conducted in Asia and 1 in Africa |
| Number of participants with adverse effects or intolerance to gum | See comments | 3 of 925 participants in the intervention group had intolerance to gum | Not estimable | 1888 | ⊕⊕⊝⊝ | 7 studies were conducted in Asia and 1 in the US. No events in the control group since it was not exposed to the intervention |
| Time to passage of faeces in hours | The mean time to first passage of faeces in the control group was 50.62 h | The mean time to first passage of faeces in the intervention groups was 9.22 h shorter than in the control group (11.49 to 6.95 h shorter) | Not estimable | 2016 (11 studies) | ⊕⊝⊝⊝ | 9 studies were conducted in Asia and 2 in Africa |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 High risk of bias in studies; participants were not blinded to the intervention and self‐reported this outcome 5 Three of four studies with unclear risk of bias for assessors evaluating this outcome | ||||||
Antecedentes
Descripción de la afección
La cesárea es la cirugía mayor más frecuente en el mundo; cada año se realizan unos 18 500 000 procedimientos (WHO 2013). Según los últimos cálculos oficiales, el 15% de todos los partos en el mundo ocurren por cesárea y existen variaciones grandes entre y dentro de los países, con una variación de menos del 5% en algunas regiones de África a más del 50% en varios países latinoamericanos y en China (Betrán 2016; WHO 2013).
Después de cualquier cirugía mayor, incluida la cesárea, es de esperar una deficiencia transitoria en la motilidad intestinal (Bauer 2004; Holte 2000). Esta afección, conocida como íleo paralítico posoperatorio (o "íleo") se define como la inhibición funcional de la actividad propulsiva intestinal (Livingston 1990). La resolución del íleo a menudo se define por la expulsión de flatos (gases) o heces, o ambos. Estos son signos de que la función intestinal se normaliza y tradicionalmente se consideran variables principales de evaluación del íleo posoperatorio (Holte 2000; Kehlet 2001; Livingston 1990; Mattei 2006; Vather 2013). Generalmente el estómago y los intestinos delgados recuperan la motilidad regular dentro de 12 a 24 horas después de la cirugía mayor, mientras que al colon le lleva 48 a 72 horas recuperar su función propulsiva (Condon 1995; Waldhausen 1990). Aunque en la mayoría de los casos el íleo se resuelve espontáneamente dentro de dos a tres días de la cirugía, es una causa importante de malestar y aumenta los costos (Behm 2003; Iyer 2009; Johnson 2009; Kehlet 2001). No hay una definición clínica estandarizada internacionalmente aceptada para el íleo, pero las principales manifestaciones clínicas son la distensión intestinal, la ausencia de sonidos o movimientos intestinales y la falta de expulsión de flatos o de la evacuación de heces. Los pacientes con íleo generalmente se quejan de náuseas, vómitos, dolor abdominal tipo cólico o dolor e incapacidad para tolerar la dieta (Holte 2000; Luckey 2003; Vather 2013). Otros efectos adversos del íleo incluyen aumento del dolor posoperatorio, retardo en la ambulación posoperatoria, aumento en el riesgo de complicaciones pulmonares como neumonía, embolia pulmonar y atelectasia (colapso de los sacos de aire en el pulmón), hospitalización prolongada y disminución en la satisfacción del paciente (Behm 2003; Kehlet 2001).
La patogenia exacta del íleo posoperatorio es compleja, multifactorial y no se comprende bien. Aparentemente incluye la estimulación de fibras de dolor, el tono simpático excesivo causado por el estrés del traumatismo quirúrgico y la liberación de neurotransmisores inhibitorios y mediadores inflamatorios debido a la manipulación intestinal y la irritación peritoneal causada, por ejemplo, por derrame de sangre (Bauer 2004; Behm 2003; Holte 2000; Johnson 2009; Luckey 2003). Aunque no hay un estudio específico sobre los mecanismos del íleo posterior a la cesárea, se puede presumir que son similares a los de otras cirugías abdominales. Los factores de riesgo del íleo incluyen el tiempo quirúrgico total más prolongado, las manipulaciones extensas de la cavidad abdominal y la pérdida sanguínea (Artinyan 2008). Debido a que estas condiciones son más frecuentes en las pacientes con una o más cesáreas anteriores, se podría esperar que estas pacientes tengan más riesgo de desarrollar íleo posoperatorio que las sometidas a una cesárea primaria. La administración de opiáceos durante el trabajo de parto y los fármacos analgésicos en el período posoperatorio también contribuyen al retraso de la función intestinal (Delaney 2004; LaRosa 1993). La incidencia de íleo después de la cesárea varía del 0,9% al 21,5% según la definición utilizada por los autores (Craciunas 2014).
Durante muchas décadas, la atención habitual después de una cesárea consistía en alimentación sólo después de un período de ayuno (protocolo de alimentación convencional) para permitir la reanudación de los movimientos intestinales. A fines de los años noventa se popularizaron los protocolos de "alimentación temprana", que consisten generalmente en la alimentación menos de seis a ocho horas después de la cesárea (Mangesi 2002). Hay pruebas de buena calidad de que la alimentación posoperatoria temprana puede estimular la motilidad intestinal y evitar el íleo prolongado después de una cesárea (Mangesi 2002). Sin embargo, debido a las inquietudes de que la alimentación temprana podría provocar vómitos con neumonía posterior por aspiración y dehiscencia (rotura) de la herida, muchos obstetras todavía impiden la ingesta oral posoperatoria hasta la resolución del íleo, o sea, cuando se detectan sonidos intestinales y hay expulsión de flatos (Kramer 1996; Mangesi 2002; Soriano 1996).
Descripción de la intervención
El chicle es una confitura que se remonta al período neolítico y se hizo originalmente de la savia de látex (chicle) o resinas de árboles (Gustaitis 1998; Matthews 2009). Las versiones modernas consisten en un polímero sintético (polietileno y acetato polivinílico) de goma mezclado con azúcar o edulcorantes artificiales, colorantes, suavizantes como la glicerina o aceite vegetal que ayudan a impedir que el chicle se endurezca o se torne rígido y otras sustancias que proporcionan diferentes sabores en el momento de la masticación (Hendrickson 1990). Históricamente, el chicle se utilizó para limpiar los dientes y refrescar el aliento. El chicle que contiene xilitol ha mostrado reducir las caries de los dientes y la placa dental (Deshpande 2008; Milgrom 2006).
De qué manera podría funcionar la intervención
El chicle se ha evaluado durante más de una década para acelerar la recuperación del íleo posoperatorio (Asao 2002). Esta intervención ha mostrado ser efectiva en el período posoperatorio de la cirugía gastrointestinal (Asao 2002; Griffiths 2007; Ho 2014; Parnaby 2009; Vasquez 2009; Wallström 2014; Wang 2013; Yin 2013) y hay algunos estudios que muestran que también puede ser efectiva después de una cesárea (Craciunas 2014; Zhu 2014). La mayoría de los estudios que evaluaron el chicle para mejorar la recuperación de la función intestinal posterior a la cesárea utilizaron entre tres a 12 piezas de chicle por día y una duración en el tiempo de mascar que varió de 15 a 60 minutos por sesión (Craciunas 2014; Zhu 2014).
Hay varios mecanismos que pueden explicar cómo mascar chicle puede aumentar la motilidad intestinal y mejorar el íleo: en primer lugar, es una forma de alimentación simulada y, por lo tanto, induce la evacuación intestinal (Jepsen 1989; Soffer 1992; Stern 1989); en segundo lugar, produce estimulación colinérgica vagal, que a la vez aumenta la producción de hormonas asociadas con la motilidad intestinal (Griffiths 2007; Kellow 1999; Konturek 1986); y en tercer lugar, aumenta la secreción de jugo pancreático, la salivación y la deglución (Stern 1989). Finalmente, se ha indicado que los edulcorantes artificiales utilizados en los chicles sin azúcar podrían tener una función en la recuperación de la función intestinal debido a los efectos laxantes (Ravry 1980; Tandeter 2009).
Aunque en general mascar chicle se considera seguro, puede dar lugar a fatiga muscular y dolor de la mandíbula (Christensen 1996), y el sorbitol, así como otros edulcorantes en los chicles sin azúcar, causan diarrea de una manera dependiente de la dosis, además de cefaleas y vasculitis en los individuos susceptibles (Fitzgerald 2009; Ravry 1980).
Por qué es importante realizar esta revisión
La cesárea es la cirugía mayor más frecuente en el mundo y las tasas han aumentado en la mayoría de los países de ingresos altos y medios (Betrán 2016; WHO 2013). El íleo es una consecuencia esperada de cualquier cirugía abdominal, incluida la cesárea. Aunque en la mayoría de los casos el íleo se resuelve espontáneamente en unos pocos días, puede causar síntomas incómodos (p.ej. náuseas, vómitos, distensión abdominal y dolor) que pueden afectar a las pacientes posparto, aumentar la duración de la estancia hospitalaria e incluso provocar morbilidad grave (Behm 2003; Kehlet 2001; Mattei 2006). El chicle es una intervención sencilla, de bajo costo, segura y fácil que podría reducir la duración del íleo y, por lo tanto, mejorar el bienestar materno y reducir potencialmente los costos hospitalarios (Keenahan 2014; Lafon 2012; Yeh 2009; Yin 2013).
Varios estudios publicados en los últimos cinco años han examinado el efecto de mascar chicle en el período posoperatorio después de una cesárea. Dos revisiones sistemáticas recientemente publicadas evaluaron los resultados de algunos de estos ensayos y concluyeron que esta intervención mejora la recuperación de la función intestinal (Craciunas 2014; Zhu 2014). Sin embargo, estas dos revisiones incluyeron solamente los estudios publicados hasta principios de 2013 y no evaluaron resultados importantes como la satisfacción de las pacientes o los efectos adversos relacionados con mascar chicle como parte de sus objetivos. También hubo una gran heterogeneidad en todos los metanálisis realizados en estas revisiones, pero no se exploró de forma adicional por los autores. Ambas revisiones tuvieron varias limitaciones metodológicas que incluyeron la falta de búsqueda de estudios registrados en las plataformas de ensayos, lo que aumentó la posibilidad de sesgo de publicación, y no se realizaron análisis de subgrupos. Zhu 2014 excluyó los estudios publicados en idiomas diferentes del inglés, no informó si la selección de los estudios se realizó por duplicado y no evaluó la calidad de las pruebas presentadas. Craciunas 2014 no definió claramente los resultados de interés a priori, no señaló si la evaluación del "Riesgo de sesgo" se realizó por duplicado, no evaluó el sesgo de publicación, no presentó una lista de los estudios excluidos y no proporcionó una explicación para disminuir la calidad de las pruebas. Estas limitaciones pueden comprometer la completitud y la confiabilidad de estas revisiones sistemáticas y, por lo tanto, se requiere cierta precaución al interpretar las conclusiones.
Los resultados de esta revisión podrían ayudar a informar a millones de pacientes y a los médicos acerca de una intervención no farmacológica sencilla que podría ayudar a hacer el período posoperatorio después de una cesárea más cómodo.
Objetivos
Evaluar los efectos de mascar chicle para reducir la duración del íleo posoperatorio y para mejorar la recuperación posoperatoria después de una cesárea.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todos los ensayos controlados aleatorios que compararon mascar chicle versus otras formas de tratamiento (atención habitual) en pacientes en el período posoperatorio de una cesárea. También se incluyeron estudios publicados en forma de resumen.
Los ensayos cuasialeatorios, cruzados o asignados al azar de forma grupal no fueron elegibles para inclusión en esta revisión.
Tipos de participantes
Pacientes en el período posparto inmediato (en las 24 primeras horas) después de una cesárea.
Tipos de intervenciones
Mascar chicle, por lo menos una vez al día, en el período posoperatorio inmediato (en las 24 primeras horas) de una cesárea, a cualquier dosis o intervalos. Los estudios con chicles que contenían un agente terapéutico activo no se incluyeron a menos que el agente también se le proporcionara al grupo control.
La intervención se comparó con atención habitual (protocolo de alimentación convencional, es decir alimentación después de un período de ayuno para la reanudación de los movimientos intestinales, o el protocolo de alimentación temprana, es decir alimentación generalmente menos de seis a ocho horas después de la cesárea) sin mascar chicle.
Tipos de medida de resultado
Resultados primarios
-
Tiempo hasta la primera expulsión de flatos, en horas
-
Proporción de pacientes con íleo como lo definieron los autores del estudio o síntomas y signos de trastorno gastrointestinal como náuseas, vómitos, dolor abdominal tipo cólico o distensión abdominal, en las primeras 72 horas después de la cesárea
-
Tolerancia al chicle y efectos adversos de mascar chicle (como dolor de la mandíbula), en las primeras 72 horas después de la cesárea
Resultados secundarios
-
Tiempo hasta la evacuación de las heces, en horas
-
Duración de la estancia hospitalaria, en días
-
Satisfacción de la paciente como se informó por los autores
-
Necesidad de analgesia o agentes antieméticos en las primeras 72 horas después de la cesárea
-
Tiempo hasta la primera audición de sonidos intestinales normales, en horas
Results
Description of studies
Results of the search
The search retrieved 74 records from the electronic databases and we obtained seven additional records from other sources (Dehcheshmeh 2011; Kamalimanesh 2015; Liang 2007; Lu 2010; Luo 2010; Rashad 2013; Wang 2011). We excluded one duplicate and checked the titles and abstracts of the remaining 80 records. At this stage, we excluded 51 records and selected 29 records for full‐text assessment. After reading these full texts, we excluded two records, referring to two studies (Cevik 2016; Sahin 2015) because they were not randomised controlled trials (RCTs) and we also excluded five records because they were protocols of five ongoing trials (Abd‐El‐Maeboud 2010; Ellaithy 2015; El‐Sharkawy 2015; Kamalimanesh 2015; Yilmaz 2015). We included a total of 22 records reporting 17 trials in the review (Figure 1). Twelve of these 17 studies were full‐text publications with complete data (Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Akhlaghi 2008; Jakkaew 2013; Kafali 2010; Ledari 2012; Liang 2007; Lu 2010; Luo 2010; Rashad 2013; Shang 2010; Wang 2011) and five of the 17 included studies had limited numerical and methodological information because they were either conference abstracts (Garshasbi 2010; Satij 2006; Zamora 2012) or English abstracts of full‐text articles published in Farsi (Abasi 2014; Dehcheshmeh 2011) which we could not translate. One of the 17 included studies (Ledari 2012) had four reports (one protocol of the trial and three publications describing different aspects of the same study); another two studies (Dehcheshmeh 2011; Jakkaew 2013), had two reports each (a protocol of the trial and a publication of the final study). All studies included in this review except Abasi 2014 (one report) and Jakkaew 2013 (two reports) provided data that could be included in one or more of our meta‐analyses.

Study flow diagram of the process of study selection.
Included studies
The 17 included studies involved a total of 3149 women, ranging from 32 (Satij 2006) to 500 (Garshasbi 2010) women per study.
Design
All included studies were parallel‐design RCTs.
Setting
The 17 studies were conducted in nine different countries, mostly low‐ to middle‐income countries: China (Liang 2007; Lu 2010; Luo 2010; Shang 2010; Wang 2011), Egypt (Abd‐El‐Maeboud 2009), Iran (Abasi 2014; Akhlaghi 2008; Dehcheshmeh 2011; Garshasbi 2010; Ledari 2012), Nigeria (Ajuzieogu 2014), The Philippines (Zamora 2012), Saudi Arabia (Rashad 2013), Thailand (Jakkaew 2013), Turkey (Kafali 2010), and USA (Satij 2006). All studies except one were conducted in single hospitals. The Nigerian study (Ajuzieogu 2014) was multicentric and involved a university teaching hospital and three satellite specialised obstetric hospitals located in the same geographic region.
Types of participants
The mean age of the women participating in the studies ranged from 25 to 31.2 years.
Parity varied among the studies: three studies included only nulliparas (Dehcheshmeh 2011; Luo 2010; Wang 2011), six studies did not provide any information at all about the parity of their participants (Akhlaghi 2008; Garshasbi 2010; Liang 2007; Lu 2010; Satij 2006; Zamora 2012) and the other eight studies included both nulliparas and multiparas. Among these eight studies that included multiparas (Abasi 2014; Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Jakkaew 2013; Kafali 2010; Ledari 2012; Rashad 2013; Shang 2010), five were unclear or did not specify how many of their participants had had a previous caesarean section (CS) (Abasi 2014; Kafali 2010; Ledari 2012; Rashad 2013; Shang 2010). One study (Ajuzieogu 2014) included only women without any previous CS, another study had less than half of the participants with a previous CS (Jakkaew 2013) and one study (Abd‐El‐Maeboud 2009) had almost 60% of its participants with at least one previous CS. For our subgroup analyses, we categorised this last study in the "Repeat CS" subgroup since over half of the participants had a previous CS.
The type of CS (moment when the surgery was performed) varied among the 17 studies. Seven studies (Abasi 2014; Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Akhlaghi 2008; Dehcheshmeh 2011; Ledari 2012; Wang 2011) included only women delivered by elective CS. Four studies (Jakkaew 2013; Rashad 2013; Shang 2010; Zamora 2012) reported that their studies included a mixed population comprising women submitted to elective as well as intrapartum or emergency CS. Finally, six studies (Garshasbi 2010; Kafali 2010; Liang 2007; Lu 2010; Luo 2010; Satij 2006) were unclear or provided no information on the number of women submitted to elective or non‐elective CS.
Nine studies (Ajuzieogu 2014; Dehcheshmeh 2011; Jakkaew 2013; Ledari 2012; Liang 2007; Luo 2010; Shang 2010; Wang 2011; Zamora 2012) reported that all or most of their participants received regional anaesthesia, that is, spinal or epidural or both. Two studies (Abd‐El‐Maeboud 2009; Rashad 2013) reported that all or most of their participants received general anaesthesia. One study (Kafali 2010) reported that half of its participants received general anaesthesia and half received regional anaesthesia. Finally, five studies (Abasi 2014; Akhlaghi 2008; Garshasbi 2010; Lu 2010; Satij 2006) did not report the type of anaesthesia used.
Types of interventions
Fourteen studies used different brands of sugar‐free gum, some of which were flavoured (Abasi 2014; Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Akhlaghi 2008; Dehcheshmeh 2011; Jakkaew 2013; Kafali 2010; Ledari 2012; Liang 2007; Luo 2010; Rashad 2013; Shang 2010; Wang 2011; Zamora 2012) while three studies (Garshasbi 2010; Lu 2010; Satij 2006) provided no details on the type of gum used in the intervention group. Most studies reported that the women were asked to chew one stick per session.
In eight studies (Akhlaghi 2008; Dehcheshmeh 2011; Garshasbi 2010; Jakkaew 2013; Liang 2007; Rashad 2013; Satij 2006; Shang 2010) women started chewing gum immediately after the CS; in five studies (Abd‐El‐Maeboud 2009; Kafali 2010; Lu 2010; Luo 2010; Wang 2011) they started two hours after surgery; in two studies (Ajuzieogu 2014; Ledari 2012) they started after six hours; and in one study (Zamora 2012) they started only 12 hours after their CS. One study (Abasi 2014) did not provide information on the exact moment when women started the intervention.
In six studies (Abd‐El‐Maeboud 2009; Dehcheshmeh 2011; Liang 2007; Luo 2010; Wang 2011; Zamora 2012) the duration of each chewing session was 10 to 15 minutes, in another six studies it lasted 30 minutes (Ajuzieogu 2014; Garshasbi 2010; Jakkaew 2013; Lu 2010; Rashad 2013) or at least 30 minutes (Shang 2010); in one study (Akhlaghi 2008) it lasted 45 minutes and in three studies (Abasi 2014; Kafali 2010; Ledari 2012) each session lasted 60 minutes. One study (Satij 2006) did not state the duration of each session.
Most (N = 13) of the studies reported that women chewed gum three or four times per day (Abasi 2014; Ajuzieogu 2014; Akhlaghi 2008; Dehcheshmeh 2011; Garshasbi 2010; Jakkaew 2013; Kafali 2010; Ledari 2012; Liang 2007; Luo 2010; Rashad 2013; Satij 2006; Shang 2010). The authors of three studies (Abd‐El‐Maeboud 2009; Lu 2010; Wang 2011) instructed the participants to chew gum every two hours during the daytime, which resulted in five to six sessions of gum chewing per day. Zamora 2012 did not specify the number of gum‐chewing sessions per day.
The overall duration of gum chewing per day ranged from 45 minutes (Liang 2007) to 180 minutes (Abasi 2014; Kafali 2010; Ledari 2012). Only three studies (Dehcheshmeh 2011; Liang 2007; Luo 2010) had a daily total duration of gum chewing lasting 60 minutes or less. In two studies (Satij 2006; Zamora 2012) the information provided by the authors was insufficient to ascertain the total daily duration of gum chewing.
Most studies (N = 10, 1731 women) used conventional feeding protocols, which consisted of nothing by mouth until the return of intestinal function, defined according to study authors as a series of events such as passage of flatus or return of bowel sounds (Abasi 2014; Abd‐El‐Maeboud 2009; Akhlaghi 2008; Dehcheshmeh 2011; Jakkaew 2013; Ledari 2012; Lu 2010; Shang 2010; Wang 2011; Zamora 2012). Two studies (Kafali 2010; Luo 2010) used early feeding protocols (i.e. oral intake of liquids or food, or both, before there were signs of the return of bowel function) and five studies were unclear or did not describe the feeding protocol used in the control groups (Ajuzieogu 2014; Garshasbi 2010; Liang 2007; Rashad 2013; Satij 2006).
Types of outcome measures
The time to first passage of flatus was reported by 15 studies but only 13 could be used in this meta‐analysis (Garshasbi 2010 and Jakkaew 2013 provided these data as median and range).
Abasi 2014 stated in the study protocol that time to first flatus was one of the outcomes of interest but did not report it in the publication. Satij 2006 was unclear about the definition of their only outcome "return to bowel function"; we contacted the study authors to obtain more details but they did not answer.
Four studies reported the number of participants with postoperative ileus as one of their outcomes (Abd‐El‐Maeboud 2009; Garshasbi 2010; Shang 2010; Zamora 2012) and we included them in our meta‐analyses. Jakkaew 2013 was not included because this study reported the median incidence of participants with ileus in each group. We contacted the study authors to obtain the exact number of participants with ileus in each group but did not obtain an answer.
Tolerance related to gum chewing was reported by eight trials (Abd‐El‐Maeboud 2009; Akhlaghi 2008; Garshasbi 2010; Kafali 2010; Ledari 2012; Liang 2007; Satij 2006; Shang 2010).
Time to first passage of faeces was reported by 12 studies (Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Akhlaghi 2008; Dehcheshmeh 2011; Garshasbi 2010; Ledari 2012; Liang 2007; Lu 2010; Luo 2010; Rashad 2013; Shang 2010; Zamora 2012) but one of them (Garshasbi 2010) reported this as median and range and it could not be included in this meta‐analysis.
The duration of hospital stay was reported by eight studies (Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Akhlaghi 2008; Dehcheshmeh 2011; Jakkaew 2013; Kafali 2010; Shang 2010; Zamora 2012) but one of them (Jakkaew 2013) reported this in median values and could not be pooled in our meta‐analysis. Garshasbi 2010 did not provide numerical data but stated that there was "virtually no difference" for duration of hospital stay between the groups. We contacted the authors of both studies for additional information but obtained no response.
None of the studies assessed women's satisfaction with gum chewing. The Ajuzieogu 2014 study stated (in the Methods) that "patients in the gum group were interviewed on their satisfaction with the technique to rate it using a visual analogue scale", but in the Results they present the scores for both the gum and the control group; therefore, we judged that this study did not actually assess satisfaction with gum chewing.
The need for additional antiemetic or analgesic medication was reported by Abd‐El‐Maeboud 2009; Kafali 2010 and Shang 2010.
The time to first hearing of normal intestinal sounds was reported by 11 studies (Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Akhlaghi 2008; Dehcheshmeh 2011; Garshasbi 2010; Kafali 2010; Ledari 2012; Luo 2010; Rashad 2013; Shang 2010; Wang 2011).
Excluded studies
Two studies were excluded because they were not RCTs.
Cevik 2016 was a study involving 120 women randomised to usual care, chewing gum or oral hydration after a CS. We did not include it because the method described by the study authors to randomise the participants did not ensure that each woman had an equal chance of being randomised to one of the three groups. We therefore classified it as a quasi‐randomised trial, which was part of our exclusion criteria.
Sahin 2015 described the study as a randomised trial involving 240 women divided into eight arms of 30 women each: seven intervention arms and an eighth arm that was the control group. The seven intervention arms tested three interventions (chewing gum, oral hydration or exercise) alone or in combination with each other. The eighth arm of the study (the control group) consisted of women who received usual care after their CS. We did not include this study because the control group was not randomised but consisted of a convenience sample that included women whose doctors did not allow them to be included in the trial.
Ongoing studies
Five studies are ongoing trials (Abd‐El‐Maeboud 2010; Ellaithy 2015; Kamalimanesh 2015; El‐Sharkawy 2015; Yilmaz 2015). See Characteristics of ongoing studies for more details.
Risk of bias in included studies
Details of the risk of bias for each of the 17 individual studies are presented in the Characteristics of included studies table and in Figure 2 In Figure 3 we present the risk of bias as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Allocation
Random sequence generation was judged to be at low risk of bias in six studies (Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Jakkaew 2013; Kafali 2010; Ledari 2012; Shang 2010). A computer‐generated sequence was used by five studies (Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Jakkaew 2013; Ledari 2012; Shang 2010) and one study (Kafali 2010) used sequential, randomised card‐pulling. All other studies were classified as having an unclear risk of bias for this domain because of lack of information.
Allocation concealment was judged to be at low risk in two studies (Jakkaew 2013; Shang 2010) and all other studies were assessed as unclear, because they provided no information to allow judgment.
Blinding
The performance bias was considered high in all 17 studies because, due to the nature of the intervention, it was not possible to blind the participants and personnel.
We separated the outcomes into two categories: subjective and objective. Time to first flatus, tolerance or adverse effects to gum, time to passage of stools and woman's satisfaction were considered subjective outcomes since they were reported directly by the participants. Since the assessors for these outcomes were the women themselves, and since they could not be blinded to the intervention (chewing gum), we considered the assessment of these outcomes as having a high risk of bias in all 17 studies. Diagnosis of ileus, need for additional analgesics or antiemetics, time to first bowel sounds, and duration of hospital stay were considered objective outcomes because they were assessed or determined by the medical personnel who could, in theory, be blinded to the group to which the participant had been allocated. Only two studies (Ajuzieogu 2014; Shang 2010) were classified as having a low risk of bias for objective outcome assessors because they clearly described that the personnel assessing these events were blinded to the participants' group (gum‐chewing or control). The other 15 studies were classified as having an unclear risk of bias for objective outcome assessors due to the lack of information.
Incomplete outcome data
Thirteen studies (Abasi 2014; Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Akhlaghi 2008; Dehcheshmeh 2011; Garshasbi 2010; Liang 2007; Lu 2010; Luo 2010; Rashad 2013; Satij 2006; Shang 2010; Zamora 2012) were classified as having a low risk of attrition bias because they either had no losses or the number of dropouts was small and balanced among the two groups.
Wang 2011 reported that approximately 22% of the participants in the intervention and in the control groups were excluded after randomisation due to complications during or after surgery (e.g. excessive bleeding, abdominal adhesions, extensive resection, surgery duration more than two hours, postoperative fever or use of pethidine). Although exclusions were balanced in the two groups, we classified this study as being at high risk of attrition bias because losses were more than 20%.
We classified Jakkaew 2013 as having an unclear risk for attrition bias because, although the authors state in the publication that "no participant was excluded from the analysis", the sample size in the study protocol was 100 women, while the number of participants described in the published paper was only 50, and the study authors did not reply to our email inquiring about this difference.
Kafali 2010 had a small unbalance in the number of dropouts in the intervention and control groups (5.4% and 3.9%, respectively), did not present the results of these women and did not reply to our email asking for this information; we therefore classified this study as having an unclear risk of attrition bias. Finally, we also classified Ledari 2012 as having an unclear risk of attrition bias because the study authors did not provide any information about the number of dropouts per group and did not reply to our email asking about this information.
Selective reporting
Ten studies were judged as having a low risk of bias for this domain (Abasi 2014; Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Akhlaghi 2008; Kafali 2010, Luo 2010; Rashad 2013; Shang 2010; Wang 2011; Zamora 2012) because all pre‐specified outcomes proposed in the study protocol or the methods section of the publication were reported in the results section. Three studies (Jakkaew 2013; Ledari 2012; Liang 2007) were categorised as having a high risk of bias for this domain because they described outcomes in the study protocols or methods section that were not reported in the results section (see details in the risk of bias tables for the individual studies). We assessed the other four studies (Dehcheshmeh 2011; Garshasbi 2010; Lu 2010; Satij 2006) as having an unclear risk of bias for selective reporting because of lack of information in the publications, and the study authors did not respond to our emails.
Other potential sources of bias
We judged four studies as having a high risk of bias for this domain. Abd‐El‐Maeboud 2009 and Rashad 2013 reported that the duration of surgery was significantly longer in the intervention than in the control groups. Jakkaew 2013 described in the protocol that the planned sample size was of 100 participants but reported the results of only 50 participants in their publication, without providing any explanation for this fact which raises the possibility of partial reporting. We contacted the study authors for more information but they did not reply. Ledari 2012 was categorised as having a high risk of bias for this domain because of several deviations from the study protocol, including the duration of gum‐chewing sessions (planned as 15 minutes bur reported as 60 minutes), initiation of intervention (planned as immediately after CS but reported as six hours after) and type of participants (planned only elective CS but reported that 14% were not elective). All other studies were classified as having an unclear risk of bias for this domain.
Effects of interventions
Chewing gum versus control
Primary outcomes
Time to first passage of flatus, in hours
A meta‐analysis of 13 studies (Abd‐El‐Maeboud 2009; Ajuzieogu 2014; Akhlaghi 2008; Dehcheshmeh 2011; Kafali 2010; Ledari 2012; Liang 2007; Lu 2010; Luo 2010; Rashad 2013; Shang 2010; Wang 2011; Zamora 2012) showed that the time to first passage of flatus was on average seven hours shorter in the group of women who chewed gum compared to the control group (mean difference (MD) ‐7.09 hours, 95% confidence interval (CI) ‐9.27 to ‐4.91 hours; 2399 women; 13 studies; random‐effects Tau2 = 14.63, I2 = 95%) (Analysis 1.1). All of the studies had effects in the same direction but they were extremely variable. Visual inspection of the funnel plot suggests the possibility of publication bias (Figure 4). Using the GRADE approach, the quality of the evidence for this outcome was graded as very low because of potential bias in most studies (participants and personnel were not blinded to the intervention and the outcome was self‐reported), high heterogeneity (although it is more likely to be due to difference in size of effect and not to direction of effect) and possibility of publication bias (see summary of findings Table for the main comparison).
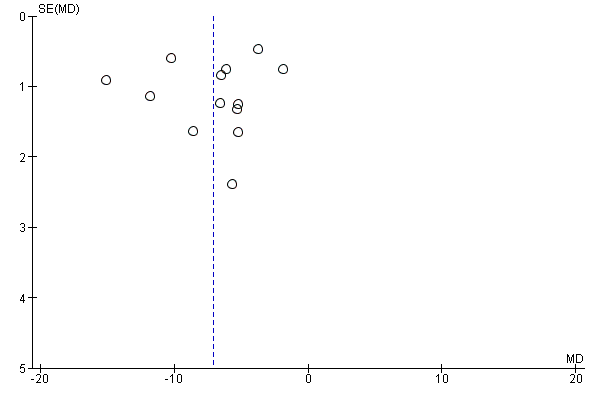
Funnel plot of comparison: 1 Chewing gum versus control, outcome: 1.1 Time to first passage of flatus in hours, all studies.
The reduction in the time to passage of flatus was observed across all of the subgroups that we examined (see Subgroup analyses).
Proportion of participants with ileus
This meta‐analysis (Analysis 1.7), which included four studies (Abd‐El‐Maeboud 2009; Garshasbi 2010; Shang 2010; Zamora 2012), showed that the rate of ileus (as defined by the authors) was over 60% lower in the group that chewed gum compared to the control group, with low heterogeneity (risk ratio (RR) 0.39, 95% CI 0.19 to 0.80; four studies, 1139 participants; I2 = 39%). The quality of the evidence for this outcome was graded as low because of potential bias in most studies (no information on blinding of outcome assessors in three studies) and low number of events (summary of findings Table for the main comparison).
The definition of ileus varied in these four studies. Garshasbi 2010 and Zamora 2012, both short congress abstracts, provided no specific definition for this condition; Garshasbi 2010 stated that the rate of "mild ileus" was 2% in the gum‐chewing group compared to 10% in the control group, while Zamora 2012 stated that there were "no recorded post‐operative ileus symptoms in either group". Abd‐El‐Maeboud 2009 described no cases of ileus in the gum‐chewing group and one case of "severe ileus" in the control group, which was a woman with non‐passage of flatus or bowel movement, abdominal distension and more than three episodes of vomiting, who responded to conservative management including the placement of a nasogastric tube for two days. Shang 2010 had no cases of "severe ileus symptoms" but stated that 12% of the women in the gum‐chewing group, compared to 21% in the control group, developed "mild ileus" defined by the study author as mild anorexia, abdominal cramps and non‐persistent nausea or vomiting".
Due to lack of data, we did not carry out all planned subgroup analyses for this outcome; there was no difference in the results in the subgroups that we examined (see Subgroup analyses).
Tolerance to gum and adverse effects of gum chewing
None of the 17 studies included in this review reported any specific adverse effects associated with the intervention (although this outcome was not listed as a pre‐specified outcome within the trial protocols or the methods sections).
Eight studies, involving 925 women in the intervention group, reported tolerance to gum chewing as one of their outcomes (Abd‐El‐Maeboud 2009; Akhlaghi 2008; Garshasbi 2010; Kafali 2010; Ledari 2012; Liang 2007; Satij 2006; Shang 2010). Seven of these stated that all their participants tolerated the intervention well, while one study (Shang 2010) reported that three of their 195 participants (1.6%) were dissatisfied with having to chew gum but nonetheless completed the intervention until first passage of stool. We wrote to the authors of this study to obtain more details about the specific reasons for this lack of satisfaction but they did not reply (Analysis 1.14). The overall rate of intolerance to gum chewing, based on these eight studies, was 0.3% (3/925).
Due to lack of data, we did not carry out any subgroup analyses for this outcome.
Subgroup analyses
Time to first passage of flatus, in hours
There was no difference in results between subgroups according to:
-
previous caesarean (first versus repeated CS) (Chi2 0.29, df 2 (P = 0.87), I2 0%) Analysis 1.2;
-
time spent chewing (more than 1 hour/day versus up to 1 hour/day) (Chi2 0.34, df 2 (P = 0.84), I2 0%, Analysis 1.3;
-
comparator (early versus conventional feeding) (Chi2 0.99, df 2 (P = 0.61), I2 0%), Analysis 1.4;
-
type of cesarean (elective versus non‐elective) (Chi2 0.91, df 2 (P = 0.63), I2 0%), Analysis 1.5;
-
initiation of gum chewing (immediately after, versus two to five hours after CS, versus six or more hours after CS) (Chi2 2.31, df 2 (P = 0.32), I2 13.4%) Analysis 1.6.
Proportion of participants with ileus
There was no difference in results between subgroups according to:
-
type of cesarean (elective versus non‐elective) (Chi2 3.17, df 2 (P = 0.20), I2 36.9%) Analysis 1.8; and
-
initiation of gum chewing (immediately after, versus two to five hours after CS, versus six or more hours after CS) (Chi2 0.00, df 1 (P = 0.99), I2 0%) Analysis 1.9.
Sensitivity analysis
We planned to perform a sensitivity analysis for the primary outcomes 'Time to first passage of flatus' and 'Proportion of participants with ileus' by excluding studies with high or unclear risk of selection or detection bias, however this was not possible because all studies were judged to have a high risk of detection bias due to the nature of the intervention.
After the exclusion of the studies with unclear (Kafali 2010; Ledari 2012) or high (Wang 2011) risk of attrition bias, the pooled results of the remaining studies showed that chewing gum reduced the time to first passage of flatus by an average of six to seven hours (MD ‐6.65 hours, 95% CI ‐9.15 to ‐4.16 hours, 1916 participants, 10 studies; I2 = 96%) (Analysis 2.1).
We could not perform a sensitivity analysis for rate of ileus excluding studies with high attrition because all four studies with this outcome had a low risk for attrition bias.
Secondary outcomes
Time to passage of faeces
Eleven studies provided data on the time to passage of stools, that could be pooled into a meta‐analysis. The average time to passage of stools was over nine hours shorter in the intervention compared to the control group (MD ‐9.22, 95% CI ‐11.49 to ‐6.95; 2016 participants; 11 studies; random‐effects Tau2 = 12.53, I2 = 93%) (Analysis 1.10), with high statistical heterogeneity. The funnel plot suggests the possibility of publication bias (Figure 5). Garshasbi 2010 stated, in their congress abstract, that the median time to passage of stools was significantly shorter in the gum‐chewing group compared to the control group (19.8 hours versus 27.3 hours, P < 0.001).

Funnel plot of comparison: 1 Chewing gum versus control, outcome: 1.10 Time to passage of faeces, in hours.
Duration of hospital stay
Seven studies assessed this outcome and could be combined in a meta‐analysis (Analysis 1.11). The average duration of hospital stay was about eight hours shorter (0.36 days) in the group that chewed gum compared to the control group (MD ‐0.36 days, 95% CI ‐0.53 to ‐0.18 days; 1489 participants; seven studies; random‐effects Tau2 = 0.04, I2 = 92%). Jakkaew 2013 reported this outcome as median and concluded that duration of hospital stay did not differ significantly between the groups (2.92 days in both groups; P = 0.99). Garshasbi 2010 did not provide any numerical data on this, in a congress abstract, but stated that there was "virtually no difference between the groups".
Woman's satisfaction
None of the studies assessed women's satisfaction with having to chew gum in the postoperative period. Ajuzieogu 2014 stated in Methods that "patients in the gum group were interviewed on their satisfaction with the technique to rate it using a visual analogue scale" but in the Results they present the scores for both the gum and the control group; therefore, we judged that this study did not actually assess satisfaction related to gum chewing. Jakkaew 2013 stated in the study protocol that this was one of the pre‐specified outcomes but it was not reported in the publication.
Need for analgesia or antiemetic agents within the first 72 hours after CS
Abd‐El‐Maeboud 2009 reported no differences in the proportion of women who required additional pethidine in the post‐CS period in the gum and control groups (13/93 versus 15/107). Two other studies (Kafali 2010; Shang 2010) reported on the use of additional anti‐emetic medication in the postoperative period. The meta‐analysis of these three studies showed no clear difference between the intervention and control group (average RR 0.50, 95% CI 0.12 to 2.13; 726 women; three studies; random‐effects Tau2 = 0.79, I2 = 69%) (Analysis 1.12).
Time to first hearing of normal intestinal sounds
Nine studies (involving more than 1700 women) assessed this outcome. The first intestinal sounds were identified, on average, four to five hours earlier in the group of women who chewed gum than in the control group (MD ‐4.56 hours, 95% CI ‐6.18 to ‐2.93; 1729 participants; nine studies; random‐effects, Tau2 = 5.41, I2 = 96%) (Analysis 1.13).
Discusión
Resumen de los resultados principales
Esta revisión identificó 17 ensayos aleatorios (con más de 3000 pacientes) que evaluaron los efectos de mascar chicle para mejorar la recuperación de la función intestinal en el período posoperatorio después de una cesárea. La intervención redujo de manera significativa el tiempo hasta la primera expulsión de flatos, como promedio, en aproximadamente siete horas y este efecto fue consistente en todos los análisis de subgrupos (cesárea primaria versus repetida, tiempo mascando chicle por día, alimentación temprana versus alimentación convencional, cesárea electiva versus no electiva y tiempo después de la cesárea al que se comenzó a mascar chicle). La calidad de las pruebas para este resultado se consideró muy baja debido al alto riesgo de sesgo de la mayoría de los estudios (por la falta de cegamiento y el autoinforme de los resultados), la heterogeneidad alta en el metanálisis y la posibilidad de sesgo de publicación ("Resumen de los hallazgos para la comparación principal").
Mascar chicle también redujo la tasa de íleo en más del 60% en el grupo de intervención en comparación con el grupo control. La calidad de las pruebas para este resultado se consideró baja debido a la baja tasa de eventos y el riesgo incierto de sesgo para los evaluadores que analizaron este resultado en tres de los cuatro estudios. El número de pacientes con intolerancia a la intervención fue muy bajo (menos del 0,5%) y no hubo informes de efectos adversos asociados con mascar chicle en ninguno de los estudios incluidos en esta revisión. La calidad de las pruebas para este resultado se consideró baja debido al escaso número de eventos y al alto riesgo de sesgo de la mayoría de los estudios (por la falta de cegamiento de las participantes y el hecho de que este resultado fue autoinformado) (Resumen de los hallazgos para la comparación principal).
Mascar chicle en el período posterior a la cesárea también acortó el tiempo hasta la evacuación de las heces en aproximadamente nueve horas. La calidad de las pruebas se consideró muy baja porque las participantes no estaban cegadas a la intervención y este resultado fue autoinformado, hubo heterogeneidad alta en el metanálisis y posibilidad de sesgo de publicación (Resumen de los hallazgos para la comparación principal). Mascar chicle acortó el tiempo hasta la audición de los primeros sonidos intestinales en casi cinco horas, y la duración de la estancia hospitalaria en aproximadamente ocho horas. Ningún estudio evaluó la satisfacción de las pacientes a las que se les pidió que mascaran chicle.
Compleción y aplicabilidad general de las pruebas
Esta revisión incluyó 17 estudios publicados entre 2006 y 2014 realizados en diferentes países (en su mayoría países de bajos a medios ingresos) y que implican a 3149 mujeres. Las pacientes tenían diferentes antecedentes reproductivos (nulíparas y multíparas, con y sin cesárea anterior) y se les realizó el parto por cesárea en diferentes circunstancias (electiva, intraparto o urgencia), se utilizaron diferentes tipos de anestesia (regional o general) y recibieron diferentes dosis y tipos de chicle, asociados a diferentes atenciones posoperatorias y protocolos de alimentación. A pesar de estas diferencias, los metanálisis generales y de subgrupos indican que mascar chicle mejora la recuperación de la función intestinal. La efectividad de la intervención bajo estos contextos muy diferentes apoya la validez externa de estos resultados e indica que mascar chicle puede contribuir a la recuperación temprana de la función intestinal después de la cesárea.
Todos los estudios tuvieron efectos en la misma dirección pero fueron muy variables en la mayoría de los resultados evaluados. Por lo tanto, la incertidumbre principal acerca de la efectividad de mascar chicle para la recuperación de la función intestinal después de una cesárea se relaciona con el tamaño del efecto en lugar de con su dirección. Las diferencias en el tamaño de los efectos y la heterogeneidad estadística alta subsiguiente en varios de los metanálisis, se puede explicar por las diferencias intrínsecas de los tamaños de la muestra de los estudios y las características de las participantes y la intervención. Por ejemplo, los criterios de selección de las pacientes en cada estudio individual variaron considerablemente con respecto a las características obstétricas (p.ej. inclusión o exclusión de pacientes sin una o más cesáreas anteriores u otras cirugías abdominales), tipo de anestesia utilizada, si hubo ayuno prequirúrgico o no, cesárea electiva versus cesárea de urgencia, duración de la cirugía, técnica y habilidades de los cirujanos y pérdida sanguínea durante la cirugía. También hubo diferencias entre los estudios en cuanto al tipo de protocolo posoperatorio habitual utilizado (p.ej. tiempo hasta la deambulación, protocolo de alimentación temprana versus convencional, tipo de alimentos, prescripción habitual y tipo de analgésicos y fármacos antieméticos). Los 17 ensayos también tuvieron muchas diferencias en la propia intervención, como el tiempo después de la cirugía al que se comenzó a mascar chicle (p.ej. inmediatamente con la recuperación de la anestesia versus sólo 12 horas después de la cesárea), el número de barras de chicle que se dieron a mascar por sesión, la composición exacta del chicle (tipo y cantidad de edulcorante y aromatizante artificiales), número de sesiones de mascar chicle por día, duración de cada sesión de mascar chicle, y en consecuencia cantidad total de tiempo mascando chicle por día. Se intentó evaluar el posible efecto de algunas de estas características al realizar análisis de subgrupos para los resultados primarios, pero muchos estudios no proporcionaron información detallada sobre estos aspectos.
Los datos existentes indican que mascar chicle puede ser una intervención sencilla, efectiva y aparentemente segura que podría ayudar a mejorar la recuperación de la función intestinal después de una cesárea.
Calidad de la evidencia
Se utilizó el enfoque GRADE para evaluar la calidad de las pruebas. Como se puede observar en "Resumen de los hallazgos para la comparación principal", la calidad de las pruebas para el tiempo hasta la primera expulsión de flatos fue muy baja. Para la proporción de pacientes con íleo e intolerancia al chicle las pruebas fueron de baja calidad.
La calidad de las pruebas para el tiempo hasta la primera expulsión de flatos y la primera evacuación de las heces, así como para los efectos adversos / la intolerancia a mascar chicle, se disminuyó debido al alto riesgo de sesgo de los estudios. Debido a la naturaleza de la intervención no fue posible cegar a las participantes y estos resultados fueron autoinformados. Para el tiempo hasta el primer flato y las primeras heces la calidad de las pruebas se disminuyó de manera adicional debido a la heterogeneidad alta en estos metanálisis y a la posibilidad de sesgo de publicación según la inspección visual de los gráficos en embudo. La calidad de las pruebas para los efectos adversos / la tolerancia a mascar chicle y para el íleo se disminuyó debido al número pequeño de eventos. La calidad de las pruebas para el íleo se disminuyó de manera adicional debido al riesgo incierto de sesgo para los evaluadores que analizaron este resultado.
Sesgos potenciales en el proceso de revisión
Aunque esta revisión incluyó 17 estudios (3149 mujeres), los resultados pueden estar incompletos. Tres de los estudios incluidos (Garshasbi 2010; Satij 2006; Zamora 2012), con un total de 585 pacientes se presentaron sólo como resúmenes de congreso con información muy limitada; uno de estos ensayos (Garshasbi 2010) fue el estudio con el tamaño de muestra más grande (500 participantes). Además, otros dos ensayos (212 participantes) se publicaron en Farsi y sólo fue posible extraer la información proporcionada en los resúmenes en inglés (Abasi 2014; Dehcheshmeh 2011). Esta falta de información limitó la capacidad de evaluar el riesgo de sesgo de varios estudios y de incluir más datos en los metanálisis.
Otra limitación de esta revisión fue que los resultados de dos estudios (Garshasbi 2010; Jakkaew 2013) no se pudieron incluir en los metanálisis porque los autores de los estudios presentaron sus resultados en medianas y rangos y no respondieron a los correos electrónicos. Se decidió no realizar cálculos ni suposiciones al extraer los datos de estos estudios para evitar introducir sesgos adicionales en los metanálisis. Dos estudios incluidos en esta revisión (Abasi 2014; Jakkaew 2013) no proporcionaron información que se pudiera incluir en los metanálisis y los resultados se presentaron solamente en un formato narrativo.
En los 17 estudios incluidos no hubo informes de los efectos adversos relacionados con mascar chicle. Sin embargo, como ninguno señaló específicamente que dichos efectos fueran un resultado preespecificado en sus protocolos o métodos, no fue posible asegurar que mascar chicle en el período posoperatorio de la cesárea esté desprovisto de efectos adversos. Como hay algunas pruebas que indican que el chicle puede dar lugar a dolor de la mandíbula (Tabrizi 2014; Watemberg 2014), es posible que haya ocurrido en algunas de las participantes, especialmente las que mascaron chicle durante períodos más prolongados.
Ninguno de los estudios evaluó o informó el cumplimiento con mascar chicle. Como la intervención depende completamente de la participante, este es un aspecto importante. Es posible que la variación en el cumplimiento de la intervención (p.ej. no seguir exactamente el intervalo recomendado entre cada sesión de mascar chicle, o su duración) pueda haber contribuido a la gran variación en la magnitud de la intervención observada en varios de los resultados.
Los gráficos en embudo de los metanálisis del tiempo hasta el primer flato y el tiempo hasta los primeros ruidos intestinales indican la posibilidad de sesgo de publicación.
Debido a la heterogeneidad alta entre los estudios se utilizó un modelo de efectos aleatorios en todos los metanálisis excepto uno.
Acuerdos y desacuerdos con otros estudios o revisiones
Los presentes hallazgos sobre la efectividad de mascar chicle para mejorar la recuperación temprana de la función intestinal coinciden con otras revisiones sistemáticas existentes sobre mascar chicle para la cesárea (Craciunas 2014; Hochner 2015; Huang 2015; Zhu 2014) y con revisiones sistemáticas de otros tipos de cirugías abdominales que también incluyeron algunos estudios sobre cesárea (Li 2013; Short 2015; Yin 2013). Las estimaciones del efecto del tiempo hasta el primer flato, la evacuación de las heces, los ruidos intestinales y la duración de la estancia hospitalaria en la presente revisión varían algo con respecto a esas otras publicaciones debido al número más pequeño de estudios incluidos en las otras revisiones y a las diferencias metodológicas en la selección de los estudios y al agrupamiento de los datos.
Debido a las diferencias en la estrategia de búsqueda, las restricciones de idiomas y las fechas en las que se realizaron las búsquedas, la presente revisión es la más grande e integral hasta la fecha sobre mascar chicle para la cesárea, en cuanto al número de estudios incluidos y el número total de participantes. Esta revisión también incluyó resultados adicionales (tolerancia / efectos adversos y satisfacción de las pacientes con respecto a mascar chicle) que no son parte de las otras revisiones sobre mascar chicle para la cesárea. Finalmente, a diferencia de cualquiera de las revisiones anteriores, se realizaron análisis de subgrupos para evaluar los efectos de mascar chicle según si existía una cesárea anterior y el tipo de cesárea (electiva o no), así como el tiempo mascando chicle por día y el momento después de la cirugía en el que se comenzó a mascar chicle, y también según el tipo de protocolo de alimentación utilizado (convencional o temprana). Se mostró que mascar chicle es efectivo para mejorar la recuperación de la función intestinal en todos estos subgrupos.

Study flow diagram of the process of study selection.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Funnel plot of comparison: 1 Chewing gum versus control, outcome: 1.1 Time to first passage of flatus in hours, all studies.
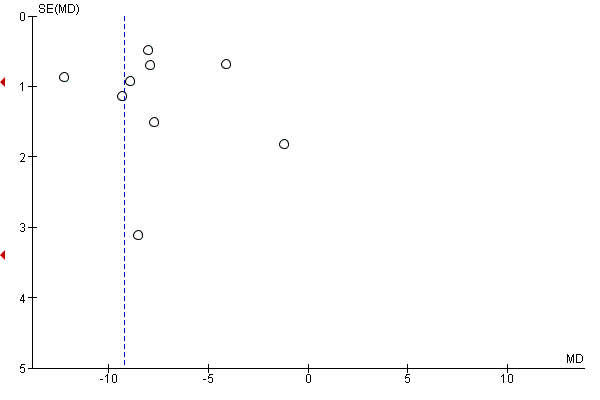
Funnel plot of comparison: 1 Chewing gum versus control, outcome: 1.10 Time to passage of faeces, in hours.

Comparison 1 Chewing gum versus control, Outcome 1 Time to first passage of flatus in hours, all studies.

Comparison 1 Chewing gum versus control, Outcome 2 Time to first passage of flatus in hours, according to previous caesarean.

Comparison 1 Chewing gum versus control, Outcome 3 Time to first passage of flatus in hours according to time spent chewing.

Comparison 1 Chewing gum versus control, Outcome 4 Time to first passage of flatus in hours, according to comparator.

Comparison 1 Chewing gum versus control, Outcome 5 Time to first passage of flatus in hours, according type of caesarean.

Comparison 1 Chewing gum versus control, Outcome 6 Time to first passage of flatus in hours according to initiation of gum‐chewing.

Comparison 1 Chewing gum versus control, Outcome 7 Proportion of participants with ileus all studies.

Comparison 1 Chewing gum versus control, Outcome 8 Proportion of participants with ileus, according type of caesarean.

Comparison 1 Chewing gum versus control, Outcome 9 Proportion of participants with ileus according to initiation of gum chewing.

Comparison 1 Chewing gum versus control, Outcome 10 Time to passage of faeces, in hours.

Comparison 1 Chewing gum versus control, Outcome 11 Duration of hospital stay, in days.

Comparison 1 Chewing gum versus control, Outcome 12 Need for additional analgesics/antiemetics.

Comparison 1 Chewing gum versus control, Outcome 13 Time to first hearing of normal intestinal sounds, in hours.
| Study | Number of participants | N with adverse effects or intolerance to gum | Details |
| Abd‐El‐Maeboud 2009 | 93 | 0 | no details |
| Akhlaghi 2008 | 200 | 0 | no details |
| Garshasbi 2010 | 238 | 0 | no details |
| Kafali 2010 | 74 | 0 | no details |
| Ledari 2012 | 50 | 0 | no details |
| Liang 2007 | 60 | 0 | no details |
| Satij 2006 | 15 | 0 | no details |
| Shang 2010 | 195 | 3 | No information on the exact symptoms.Three women complained about gum chewing but completed their course until first passage of stool. |
Comparison 1 Chewing gum versus control, Outcome 14 Number of participants with adverse effects or intolerance to gum.

Comparison 2 Chewing gum versus control ‐ sensitivity analysis, Outcome 1 Time to first passage of flatus in hours, only studies with low risk of attrition.
| Chewing gum compared to control for enhancing early recovery of bowel function after caesarean section | ||||||
| Patient or population: women in the immediate postpartum period (within the first 24 hours) after having had a caesarean section | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Chewing gum | |||||
| Time to first passage of flatus | The mean time to first passage of flatus in the control group was 30.36 hours | The mean time to first passage of flatus in the intervention groups was 7.09 h shorter than in the control group (9.27 to 4.91 h shorter) | Not estimable | 2399 | ⊕⊝⊝⊝ | 11 of these studies were conducted in Asia and 2 in Africa. |
| Proportion of participants with ileus | 11 per 100 | 5 per 100 | RR 0.39 | 1139 | ⊕⊕⊝⊝ | 3 of these studies were conducted in Asia and 1 in Africa |
| Number of participants with adverse effects or intolerance to gum | See comments | 3 of 925 participants in the intervention group had intolerance to gum | Not estimable | 1888 | ⊕⊕⊝⊝ | 7 studies were conducted in Asia and 1 in the US. No events in the control group since it was not exposed to the intervention |
| Time to passage of faeces in hours | The mean time to first passage of faeces in the control group was 50.62 h | The mean time to first passage of faeces in the intervention groups was 9.22 h shorter than in the control group (11.49 to 6.95 h shorter) | Not estimable | 2016 (11 studies) | ⊕⊝⊝⊝ | 9 studies were conducted in Asia and 2 in Africa |
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 High risk of bias in studies; participants were not blinded to the intervention and self‐reported this outcome 5 Three of four studies with unclear risk of bias for assessors evaluating this outcome | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Time to first passage of flatus in hours, all studies Show forest plot | 13 | 2399 | Mean Difference (IV, Random, 95% CI) | ‐7.09 [‐9.27, ‐4.91] |
| 2 Time to first passage of flatus in hours, according to previous caesarean Show forest plot | 13 | Mean Difference (IV, Random, 95% CI) | Subtotals only | |
| 2.1 First caesarean section | 4 | 833 | Mean Difference (IV, Random, 95% CI) | ‐7.71 [‐11.89, ‐3.52] |
| 2.2 Repeat caesarean section | 1 | 200 | Mean Difference (IV, Random, 95% CI) | ‐6.5 [‐8.14, ‐4.86] |
| 2.3 No information on previous caesarean section | 8 | 1366 | Mean Difference (IV, Random, 95% CI) | ‐6.83 [‐10.23, ‐3.44] |
| 3 Time to first passage of flatus in hours according to time spent chewing Show forest plot | 13 | Mean Difference (IV, Random, 95% CI) | Subtotals only | |
| 3.1 More than 1 hour/day | 9 | 1806 | Mean Difference (IV, Random, 95% CI) | ‐7.30 [‐10.24, ‐4.37] |
| 3.2 Up to 1 hour/day | 3 | 540 | Mean Difference (IV, Random, 95% CI) | ‐6.83 [‐11.48, ‐2.17] |
| 3.3 No information on time chewing per day | 1 | 53 | Mean Difference (IV, Random, 95% CI) | ‐5.67 [‐10.35, ‐0.99] |
| 4 Time to first passage of flatus in hours, according to comparator Show forest plot | 13 | Mean Difference (IV, Random, 95% CI) | Subtotals only | |
| 4.1 Comparator: early feeding | 2 | 450 | Mean Difference (IV, Random, 95% CI) | ‐5.90 [‐10.67, ‐1.12] |
| 4.2 Comparator: conventional feeding | 8 | 1589 | Mean Difference (IV, Random, 95% CI) | ‐7.78 [‐11.09, ‐4.47] |
| 4.3 No information on comparator | 3 | 360 | Mean Difference (IV, Random, 95% CI) | ‐6.02 [‐7.14, ‐4.90] |
| 5 Time to first passage of flatus in hours, according type of caesarean Show forest plot | 13 | Mean Difference (IV, Random, 95% CI) | Subtotals only | |
| 5.1 Elective caesarean section only | 6 | 1233 | Mean Difference (IV, Random, 95% CI) | ‐6.82 [‐10.06, ‐3.58] |
| 5.2 Non‐elective caesarean section | 3 | 499 | Mean Difference (IV, Random, 95% CI) | ‐5.89 [‐7.13, ‐4.65] |
| 5.3 No information | 4 | 667 | Mean Difference (IV, Random, 95% CI) | ‐8.49 [‐14.48, ‐2.50] |
| 6 Time to first passage of flatus in hours according to initiation of gum‐chewing Show forest plot | 13 | Mean Difference (IV, Random, 95% CI) | Subtotals only | |
| 6.1 Imediately after caesarean section | 5 | 1086 | Mean Difference (IV, Random, 95% CI) | ‐6.04 [‐9.31, ‐2.77] |
| 6.2 2 to 5 hours after caesarean section | 5 | 980 | Mean Difference (IV, Random, 95% CI) | ‐9.11 [‐13.75, ‐4.47] |
| 6.3 6 hours or more after caesarean section | 3 | 333 | Mean Difference (IV, Random, 95% CI) | ‐5.27 [‐7.07, ‐3.47] |
| 7 Proportion of participants with ileus all studies Show forest plot | 4 | 1139 | Risk Ratio (M‐H, Random, 95% CI) | 0.39 [0.19, 0.80] |
| 8 Proportion of participants with ileus, according type of caesarean Show forest plot | 4 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 8.1 Elective caesarean | 1 | 200 | Risk Ratio (M‐H, Random, 95% CI) | 0.38 [0.02, 9.29] |
| 8.2 Non‐elective caesarean section | 2 | 439 | Risk Ratio (M‐H, Random, 95% CI) | 0.55 [0.34, 0.88] |
| 8.3 No info on type of caesarean section | 1 | 500 | Risk Ratio (M‐H, Random, 95% CI) | 0.21 [0.08, 0.54] |
| 9 Proportion of participants with ileus according to initiation of gum chewing Show forest plot | 4 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 9.1 Imediately after caesarean section | 2 | 886 | Risk Ratio (M‐H, Random, 95% CI) | 0.37 [0.15, 0.95] |
| 9.2 2 to 5 hours after caesarean section | 1 | 200 | Risk Ratio (M‐H, Random, 95% CI) | 0.38 [0.02, 9.29] |
| 9.3 6 hours or more after caesarean section | 1 | 53 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] |
| 10 Time to passage of faeces, in hours Show forest plot | 11 | 2016 | Mean Difference (IV, Random, 95% CI) | ‐9.22 [‐11.49, ‐6.95] |
| 11 Duration of hospital stay, in days Show forest plot | 7 | 1489 | Mean Difference (IV, Random, 95% CI) | ‐0.36 [‐0.53, ‐0.18] |
| 12 Need for additional analgesics/antiemetics Show forest plot | 3 | 726 | Risk Ratio (M‐H, Random, 95% CI) | 0.50 [0.12, 2.13] |
| 13 Time to first hearing of normal intestinal sounds, in hours Show forest plot | 9 | 1729 | Mean Difference (IV, Random, 95% CI) | ‐4.56 [‐6.18, ‐2.93] |
| 14 Number of participants with adverse effects or intolerance to gum Show forest plot | Other data | No numeric data | ||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Time to first passage of flatus in hours, only studies with low risk of attrition Show forest plot | 10 | 1916 | Mean Difference (IV, Random, 95% CI) | ‐6.65 [‐9.15, ‐4.16] |

