Aflibercept para la degeneración macular neovascular senil
Resumen
Antecedentes
La pérdida de la visión central provocada por la degeneración macular senil (DMS) es la causa principal de ceguera entre las personas de edad avanzada en los países desarrollados. La degeneración macular neovascular senil se caracteriza por la neovascularización coroidea (NVC). El crecimiento de vasos sanguíneos de neoformación en los pacientes con degeneración macular neovascular senil es estimulado por un proceso complejo que incluye una proteína de señalización denominada factor de crecimiento endotelial vascular (en inglés, VEGF‐A). Las fármacos anti‐VEGF que bloquean esta proteína incluyen ranibizumab, bevacizumab y aflibercept.
Objetivos
Evaluar y comparar la efectividad y la seguridad de las inyecciones intravítreas de aflibercept versus ranibizumab, bevacizumab o un simulacro para el tratamiento de los pacientes con degeneración macular neovascular senil.
Métodos de búsqueda
Se realizaron búsquedas en el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials, CENTRAL) (que contiene el Registro de ensayos del Grupo Cochrane de Trastornos de los Ojos y la Visión [Cochrane Eyes and Vision Group]) (número 11, 2015), Ovid MEDLINE, Ovid MEDLINE In‐Process and Other Non‐Indexed Citations, Ovid MEDLINE Daily, Ovid OLDMEDLINE (enero 1946 hasta noviembre 2015), EMBASE (enero 1980 hasta noviembre 2015), PubMed (1948 hasta noviembre 2015), Latin American and Caribbean Health Sciences Literature Database (LILACS) (1982 hasta noviembre 2015), en el metaRegister of Controlled Trials (mRCT) (www.controlled‐trials.com) (última búsqueda 4, diciembre, 2014), ClinicalTrials.gov (www.clinicaltrials.gov), y en la World Health Organization (WHO) International Clinical Trials Registry Platform (ICTRP) (www.who.int/ictrp/search/en). No se aplicó ninguna restricción de fecha o idioma en la búsqueda electrónicas de ensayos. Se buscó por última vez en las bases de datos electrónicas el 30 de noviembre de 2015.
Criterios de selección
Se incluyeron los ensayos controlados aleatorios (ECA) en los que la monoterapia con aflibercept se comparó con ranibizumab, bevacizumab o un simulacro en participantes con degeneración macular neovascular senil que no habían recibido tratamiento de forma previa.
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar de la Colaboración Cochrane para el examen y la extracción de datos y la evaluación de los estudios. Dos autores de la revisión, de forma independiente, examinaron los registros extrajeron los datos y evaluaron el riesgo de sesgo de los estudios incluidos; Las discrepancias se resolvieron mediante discusión o con la ayuda de un tercer autor de la revisión cuando fue necesario.
Resultados principales
Se incluyeron dos ECA (un total de 2457 participantes, 2457 ojos). Los participantes del ensayo presentaban degeneración macular neovascular senil con lesiones neovasculares coroideas subfoveales activas. Ambos ensayos siguieron el mismo protocolo y compararon aflibercept en diversas dosis versus ranibizumab, aunque se realizaron en diferentes países. Un ensayo incluyó a participantes de los Estados Unidos y Canadá, y el segundo ensayo se realizó en 172 sitios en Europa, Asia Pacífico, América Latina y Oriente Medio. La calidad general de las pruebas fue alta y los ensayos incluidos tuvieron bajo riesgo en la mayoría de los dominios de sesgo evaluados; sin embargo, ambos ensayos fueron financiados por los fabricantes de aflibercept. Para realizar el análisis los grupos de aflibercept se combinaron independientemente de la dosis y se analizaron como un único grupo.
Los resultados de la agudeza visual fueron similares entre los grupos de aflibercept y de ranibizumab; al año, los participantes de los grupos de aflibercept mostraron un cambio medio en la agudeza visual mejor corregida (AVMC) a partir del valor inicial similar al de los participantes de los grupos de ranibizumab (diferencia de medias [DM] ‐0,15 letras en el Early Treatment Diabetic Retinopathy Study [ETDRS]; intervalo de confianza del 95% [IC del 95%] ‐1,47 a 1,17; pruebas de alta calidad). A los dos años, el cambio medio en la AVMC a partir del valor inicial fue 7,2 letras en el ETDRS en los grupos de aflibercept versus 7,9 en los grupos de ranibizumab. No hubo datos suficientes disponibles para el cálculo de los intervalos de confianza.
La proporción de participantes que ganaron 15 letras o más de AVMC al año de seguimiento fue de aproximadamente el 32% para el aflibercept y para el ranibizumab (CR 0,97; IC del 95%: 0,85 a 1,11; pruebas de alta calidad) y a los dos años de seguimiento fue de aproximadamente el 31% (CR 0,98; IC del 95%: 0,85 a 1,12; pruebas de alta calidad). Proporciones pequeñas similares de participantes de los grupos de aflibercept y ranibizumab perdieron 15 letras o más de AVMC al año (CR 0,89; IC del 95%: 0,61 a 1,30; pruebas de alta calidad); este resultado no se informó para el seguimiento a los dos años. No se informaron datos sobre la proporción de participantes con una AVMC peor de 20/200 al año o a los dos años de seguimiento.
Los participantes tratados con aflibercept o ranibizumab mostraron una mejoría similar en los resultados morfológicos según lo evaluado a partir de las imágenes (espesor retiniano central y tamaño de la NVC). Al año, la proporción de ojos que logró una retina seca fue similar entre los grupos de aflibercept y de ranibizumab (ausencia de líquido quístico intrarretinal y de líquido subretinal en la tomografía de coherencia óptica [TCO]; CR 1,06; IC del 95%: 0,98 a 1,14; pruebas de alta calidad). Además, los investigadores no informaron diferencia en la reducción del área de NVC entre los ojos tratados con aflibercept y ranibizumab al año (DM ‐0,24 mm2; IC del 95%: ‐0,78 a 0,29; pruebas de alta calidad). No se informaron datos sobre la proporción de ojos con ausencia de pérdidas en la angiografía con fluoresceína al año o los dos años de seguimiento.
En general, la aparición de eventos adversos sistémicos graves fue similar y equivalente en los grupos tratados con aflibercept y ranibizumab al año (CR 0,99; IC del 95%: 0,79 a 1,25). El riesgo de eventos adversos oculares graves fue inferior en el grupo de aflibercept que en el grupo de ranibizumab, aunque la estimación del riesgo es imprecisa (CR 0,62; IC del 95%: 0,36 a 1,07). Debido a la imprecisión, la calidad de las pruebas se consideró moderada para todos los eventos adversos.
Conclusiones de los autores
Los resultados de esta revisión documentan la efectividad comparativa del aflibercept versus ranibizumab para la agudeza visual y los resultados morfológicos en los ojos con degeneración macular neovascular senil. La información disponible actual sobre los efectos adversos de cada fármaco indica que el perfil de seguridad del aflibercept es equivalente al del ranibizumab; sin embargo, el número de participantes que experimentaron eventos adversos fue pequeño, lo que da lugar a estimaciones imprecisas de los tamaños del efecto absoluto y relativo. El régimen de dosis de ocho semanas de aflibercept representa una reducción en la necesidad de tratamiento en comparación con los regímenes de dosis mensuales, por lo que tiene la posibilidad de reducir la carga de tratamiento y los riesgos asociados con las inyecciones frecuentes.
PICOs
Resumen en términos sencillos
Aflibercept para la degeneración macular neovascular senil
Pregunta de la revisión
¿Cuán bien funciona el aflibercept, y cuán seguro es para el tratamiento de los pacientes con degeneración macular neovascular senil en comparación con otros tratamientos utilizados actualmente (ranibizumab y bevacizumab) o ningún tratamiento?
Antecedentes
Una de las causas de pérdida de la vista en el centro del ojo es una enfermedad denominada degeneración macular senil (DMS). La DMS causa ceguera en muchas personas mayores en los países desarrollados. En todo el mundo se calcula que casi el 9% (uno en 11) de las personas de 45 a 85 años de edad presentan DMS. Alrededor del 10% de los pacientes con DMS desarrollan un tipo de DMS llamada DMS neovascular (húmeda), que es resultado del desarrollo de vasos sanguíneos de neoformación en una capa interna del ojo llamada coroide. Si un paciente con este tipo de DMS no recibe tratamiento, el ojo afectado puede perder la vista y desarrollar otros problemas relacionados con la ceguera.
Los vasos sanguíneos de neoformación crecen cuando son señalizados por una proteína llamada factor de crecimiento endotelial vascular A (VEGF‐A). Los fármacos que bloquean esta proteína, los denominados fármacos anti‐VEGF, se inyectan en el ojo y se ha observado que reducen el líquido en la parte posterior del ojo a la vez que causan que los vasos sanguíneos de neoformación desaceleren su crecimiento o se reduzcan. El ranibizumab y el bevacizumab fueron los fármacos anti‐VEGF utilizados con mayor frecuencia desde 2006 a 2011, cuando el aflibercept comenzó a estar disponible. El aflibercept se creó para unirse con mayor firmeza al VEGF; por lo tanto, el aflibercept actúa durante más tiempo después de una inyección, por lo que los pacientes necesitan menos inyecciones de aflibercept que de ranibizumab o bevacizumab.
Detalles de los estudios
Se encontraron dos ensayos que incluyeron 2457 participantes con degeneración macular neovascular senil. Estos ensayos fueron similares en la mayoría de los aspectos, aunque se realizaron en diferentes ubicaciones. Uno se completó sólo en América del Norte, y el otro se realizó en muchos países en muchas partes del mundo. Ambos ensayos compararon inyecciones de aflibercept en el ojo versus inyecciones de ranibizumab y fueron financiados por la empresa que fabrica aflibercept. No se encontraron ensayos que compararan inyecciones de aflibercept versus bevacizumab en el ojo. La última búsqueda de ensayos se realizó el 30 de noviembre de 2015.
Resultados clave
Los participantes tratados con aflibercept o ranibizumab presentaron mejorías similares en la agudeza visual un año después del comienzo del tratamiento. No ocurrió pérdida grave de la visión en muchos ojos que recibieron cualquiera de los tratamientos y no ocurrió más a menudo con aflibercept o con ranibizumab. En los grupos de aflibercept y de ranibizumab se informaron con poca frecuencia efectos adversos graves en el ojo. La incidencia de efectos adversos graves para la salud como hemorragia interna, accidente cerebrovascular e hipertensión fue equivalente entre los grupos de aflibercept y ranibizumab; sin embargo, dichos eventos informados fueron escasos. Por lo tanto, no existe seguridad acerca de las posibles diferencias en los efectos adversos informados entre los pacientes que recibieron aflibercept o ranibizumab.
Calidad de la evidencia
Los dos ensayos identificados estuvieron bien diseñados y la calidad de las pruebas se consideró alta para los resultados relacionados con la visión. Una valoración de calidad alta significa que se considera que es muy poco probable que los estudios de investigación futuros cambien las conclusiones. Debido a la incertidumbre con respecto a los efectos adversos a causa del número pequeño de eventos, la calidad de las pruebas para los efectos adversos se consideró moderada. Una valoración de calidad moderada significa que se considera que los estudios de investigación futuros pueden tener una marcada repercusión sobre las conclusiones.
Conclusiones de los autores
Summary of findings
| Aflibercept vs ranibizumab for neovascular age‐related macular degeneration | ||||||
| Patient or population: people with age‐related macular degeneration Settings: clinical centers Intervention: intravitreal injections of aflibercept Comparison: intravitreal injections of ranibizumab | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Ranibizumab | Aflibercept | |||||
| Mean change in BCVA in ETDRS letters at 1 year (number of letters) | Mean change in visual acuity across ranibizumab groups ranged from gains of 8.57 letters to 8.71 letters | Mean change in visual acuity in aflibercept groups was on average 0.15 fewer letters gained (95% CI 1.47 fewer letters to 1.17 more letters) | MD ‐0.15 | 2412 | ⊕⊕⊕⊕ | |
| Gain of ≥ 15 letters of BVCA at 1 year | 324 per 1000 | 314 per 1000 | RR 0.97 | 2412 (2) | ⊕⊕⊕⊕ | |
| Absence of fluid on optical coherence tomography (OCT) at 1 year | 595 per 1000 | 630 per 1000 | RR 1.06 | 2291 (2) | ⊕⊕⊕⊕ | |
| Quality‐of‐life measures at 1 year (National Eye Institute‐Visual Function Questionnaire [NEI‐VFQ]) | Mean improvement in composite NEI‐VQF score ranged across control groups from 4.9 to 6.3 points | Mean improvement in composite NEI‐VQF score in intervention groups was on average 0.39 points lower (95% CI 1.71 points lower to 0.93 points higher) | MD ‐0.39 | 2412 (2) | ⊕⊕⊕⊕ | |
| Adverse events ‐ serious systemic events at 1 year | 139 per 1000 | 138 per 1000 | RR 0.99 (0.79 to 1.25) | 2419 (2) | ⊕⊕⊕⊝ | |
| Adverse events ‐ serious ocular events at 1 year | 32 per 1000 | 20 per 1000 | RR 0.62 (0.36 to 1.07) | 2419 (2) | ⊕⊕⊕⊝ | |
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). The unit of analysis is the individual (one study eye per person). | ||||||
| GRADE Working Group grades of evidence aAdverse events downgraded to moderate quality as the number of events is small (wide confidence intervals) | ||||||
Antecedentes
Descripción de la afección
La degeneración macular senil (DMS) es una enfermedad degenerativa progresiva de la parte central de la retina (la mácula) que causa pérdida de la visión central. Es muy frecuente entre las personas a partir de los 55 años de edad y es la causa principal de ceguera entre las personas de edad avanzada en los países desarrollados (Friedman 2004). Se calcula que la prevalencia global de cualquier tipo o etapa de la DMS es del 8,69% (intervalo de confianza [IC] del 95%: 4,26% al 17,40%) entre las personas de 45 a 85 años de edad (Wong 2014). A medida que la población global envejece, las proyecciones indican que 196 000 000 de personas tendrán DMS en el año 2020 (Wong 2014). La prevalencia global calculada de la degeneración macular neovascular senil es del 0,46% (IC del 95%: 0,18% al 1,08%)(Wong 2014). Se calcula que 1 750 000 personas en los Estados Unidos (EE.UU.) están afectadas por atrofia geográfica o degeneración macular neovascular (húmeda) senil(Friedman 2004). Los factores de riesgo implicados para la DMS incluyen la mayor edad, el hábito de fumar, la predisposición genética y los antecedentes familiares y las enfermedades cardiovasculares (Chakravarthy 2010; Hyman 2002; Schultz 2003; Thornton 2005).
Los dos tipos principales de DMS son la DMS seca y la DMS neovascular (húmeda) (Bird 1995). La DMS seca se caracteriza por drusas (depósitos amarillos bajo la retina), cambios en el epitelio pigmentario retiniano (EPR), o ambos; causa pérdida gradual de la visión hasta que la fóvea es afectada por la atrofia del EPR (Bird 1995). La atrofia geográfica es una forma de DMS seca. La DMS neovascular, una forma de DMS húmeda, se caracteriza por la neovascularización coroidea (NVC). Las manifestaciones clínicas de la DNS neovascular incluyen líquido subretinal, líquido intrarretinal, y hemorragia retinal, subretinal o sub‐EPR (Bird 1995). Aproximadamente el 10% de los ojos con DMS manifiestan el tipo neovascular de la DMS. Si no se trata, la degeneración macular neovascular senil puede causar pérdida grave de la visión (20/200 o peor) en la mayoría de los ojos (Wong 2008). Esta enfermedad afecta la calidad de vida, con la pérdida consiguiente de la independencia entre los pacientes de edad avanzada (AREDS 2005; Childs 2004; Clemons 2003; Dong 2004; Mangione 1999; Miskala 2004). La visión borrosa, la distorsión de la imagen (metamorfopsia) y el escotoma (un defecto del campo visual o "punto ciego") son los síntomas que se informan con mayor frecuencia entre los pacientes con degeneración macular neovascular senil (Fine 1986). La pérdida de la agudeza visual puede no ser notada por el paciente hasta que ambos ojos son afectados, o a menos que la neovascularización sea subfoveal.
La evaluación diagnóstica de un paciente con síntomas que indican la presencia de degeneración macular neovascular senil incluye la revisión biomicroscópica estereoscópica de la mácula, la angiografía con fluoresceína y la tomografía de coherencia óptica (TCO). La angiografía con fluoresceína ha sido el valor de referencia (gold standard) para detectar y confirmar la presencia de neovascularización coroidea. La angiografía con fluoresceína es una prueba de imaginología invasiva en la que se toman fotografías retinianas seriadas después de inyectar colorante de fluoresceína en una vena. La TCO es un método no invasivo de imaginología de las estructuras posteriores del ojo. Esta técnica de imaginología se utiliza con frecuencia para detectar y vigilar los cambios morfológicos asociados con la neovascularización coroidea. Sin embargo, la angiografía con fluoresceína es el mejor método para la detección de NVC de nuevo inicio (Do 2012).
Descripción de la intervención
El factor de crecimiento endotelial vascular A (VEGF‐A), una proteína de señalización producida por las células en la parte posterior del ojo, actúa como la fuerza impulsora del desarrollo de vasos nuevos en la degeneración macular neovascular senil. Se ha demostrado que los fármacos que pueden bloquear esta proteína de forma exitosa son efectivos no solamente para disminuir el líquido acumulado en la parte posterior del ojo, sino para causar la regresión de los vasos nuevos frágiles (Ferrara 2009). Los fármacos disponibles de esta clase incluyen ranibizumab (Lucentis, Genentech Inc.),bevacizumab (Avastin, Genentech Inc.),y aflibercept (Eylea, Regeneron Pharmaceuticals, Inc.). Estos fármacos se administran a través de una inyección intravítrea en el ojo. El ranibizumab es un fragmento del anticuerpo recombinante humanizado monoclonal específico del VEGF que inhibe todas las isoformas del VEGF‐A. Las inyecciones mensuales de ranibizumab se han utilizado ampliamente para el tratamiento de los pacientes con degeneración macular neovascular senil desde que varios ensayos clínicos mostraron una ganancia visual significativa con su uso (Brown 2006; Brown 2011; Rosenfeld 2006). El bevacizumab es un anticuerpo monoclonal humanizado de tamaño normal específico del VEGF que se desarrolló para su uso en diversos tipos de cáncer y se ha utilizado sin indicación para el tratamiento de los pacientes con degeneración macular neovascular senil (CATT Research Group 2011; IVAN Trial 2013; Jansen 2013). El tratamiento con ranibizumab o bevacizumab generalmente requiere inyecciones mensuales en el ojo o inyecciones administradas según sea necesario sobre la base de las evaluaciones mensuales para vigilar la actividad de la enfermedad (Brown 2011; CATT Research Group 2011; IVAN Trial 2013; Rosenfeld 2006). Las inyecciones y las evaluaciones frecuentes dan lugar a una carga significativa para los pacientes y los cuidadores y conllevan el riesgo de eventos adversos poco frecuentes pero graves asociados con una inyección en el ojo (Haller 2013). La efectividad (Solomon 2014) y seguridad (Moja 2014) del ranibizumab y el bevacizumab para el tratamiento de los pacientes con degeneración macular neovascular senil se han analizado en revisiones Cochrane publicadas y se ha documentado que son similares; por lo tanto, esta revisión se centra en una comparación de los resultados del tratamiento con aflibercept versus los resultados con otros agentes o ningún agente anti‐VEGF.
El aflibercept es un fármaco relativamente nuevo para la degeneración macular neovascular senil que fue autorizado por la Food and Drug Administration de los EE.UU. en noviembre de 2011 (FDA 2011). Se había conocido en la bibliografía científica como VEGF‐Trap (Stewart 2008). El aflibercept es una proteína de fusión fabricada con dominios clave de los receptores de VEGF 1 (VEGF1) y 2 (VEGF2) fundidos con una porción del anticuerpo humano. A diferencia del ranibizumab y el bevacizumab, el aflibercept se une al VEGF‐A, al VEGF‐B y a otra proteína (factor de crecimiento placentario [FCP]) que se considera que desempeña una función en la progresión de la degeneración macular neovascular senil. La afinidad de enlace del aflibercept para al VEGF (Kd = 0,5 pM) es significativamente más fuerte que la del bevacizumab (Kd = 58 pM) o el ranibizumab (Kd = 46 pM) (Holash 2002), lo que da lugar a una duración potencialmente más prolongada de la acción en el ojo que permite intervalos más largos entre los tratamientos. La dosis menos frecuente debería dar lugar a la reducción del riesgo de efectos perjudiciales asociados con las inyecciones intraoculares (Brown 2011; Heier 2011; Heier 2012).
De qué manera podría funcionar la intervención
El aflibercept actúa como un receptor simulado para el VEGF. Se une a ambos extremos del VEGF dimerizado activado con gran firmeza entre sus brazos e impide que interactúe y active los receptores nativos VEGFR1 y VEGFR2 y el enlace cruzado. Esta unión da lugar al bloqueo de la actividad biológica del VEGF e inhibe el crecimiento anormal de los vasos sanguíneos. Se une al FCP de una manera similar e impide que active los receptores VEGFR1 (Rudge 2007).
Por qué es importante realizar esta revisión
Varias revisiones sistemáticas han evaluado y comparado las ventajas y desventajas de diferentes regímenes de dosis de ranibizumab y bevacizumab analizados en diferentes ensayos clínicos para el tratamiento de los pacientes con degeneración macular neovascular senil (Mitchell 2011; Moja 2014; Schmucker 2010; Schmucker 2012; Solomon 2014). Los datos con respecto a los efectos beneficiosos y perjudiciales del aflibercept para el tratamiento de la degeneración macular neovascular senil y la comparación de sus efectos versus los del ranibizumab o el bevacizumab son escasos. La síntesis y el análisis de los datos disponibles ayudarán a los médicos, a los pacientes y a los cuidadores a elegir entre las opciones de tratamiento.
Objetivos
Evaluar y comparar la efectividad y la seguridad de las inyecciones intravítreas de aflibercept versus ranibizumab, bevacizumab o un simulacro para el tratamiento de los pacientes con degeneración macular neovascular senil.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Sólo se incluyeron ensayos controlados aleatorios (ECA).
Tipos de participantes
Se incluyeron los ensayos en participantes con degeneración macular neovascular senil subfoveal diagnosticada, confirmada con angiografía con fluoresceína, que no recibieron tratamiento anterior para la DMS en el ojo estudiado.
Tipos de intervenciones
Se incluyeron los ensayos en los que la monoterapia con aflibercept se comparó con ranibizumab, bevacizumab o un simulacro. Se excluyeron los estudios en los que el aflibercept se evaluó como parte del tratamiento de combinación versus otros tratamientos activos como la fotocoagulación con láser.
Tipos de medida de resultado
Resultados primarios
El resultado primario para la comparación de las intervenciones fue el cambio medio a partir del valor inicial en el número de letras de la agudeza visual mejor corregida (AVMC) al año, según lo medido con el gráfico Early Treatment Diabetic Retinopathy Study (ETDRS) o un equivalente.
Resultados secundarios
Se incluyeron los siguientes resultados secundarios para la comparación de las intervenciones.
-
El cambio medio en el número de letras de AVMC a los dos años.
-
La proporción de participantes que ganaron 15 letras o más de AVMC al año y a los dos años.
-
La proporción de participantes que perdieron 15 letras o más de AVMC al año y a los dos años.
-
La proporción de participantes con AVMC peor que 20/200 al año y a los dos años.
-
La proporción de ojos con ausencia de líquido en la tomografía de coherencia óptica (TCO) al año y a los dos años.
-
La proporción de ojos con ausencia de pérdida de líquido en la angiografía con fluoresceína al año y a los dos años.
-
El número medio de inyecciones recibidas al año y a los dos años.
-
El cambio medio en el espesor retiniano central a partir del valor inicial hasta un año y hasta dos años.
-
El cambio medio en el grado de neovascularización coroidea (NVC) a partir del valor inicial al año y a los dos años.
Resultados de la calidad de vida
Se incluyeron resultados de calidad de vida según lo medido en una escala validada como el National Eye Institute Visual Function Questionnaire (NEI‐VFQ) al año y a los dos años.
Eventos adversos
Se incluyeron los siguientes eventos adversos para la comparación de las intervenciones.
-
Proporción de participantes con eventos trombóticos arteriales al año y a los dos años.
-
Proporción de participantes con eventos adversos sistémicos graves al año y a los dos años.
-
Proporción de ojos con eventos adversos oculares graves al año y a los dos años.
Seguimiento
En el protocolo (Sarwar 2014) se especificó que no se considerarían los resultados antes del año de seguimiento y se planificó utilizar los datos de resultado recopilados entre nueve y 18 meses para calcular los resultados al año cuando no se informaron los datos a los 12 meses de un estudio individual. No fue necesario utilizar esta estrategia de respaldo debido a que los investigadores de cada uno de los estudios incluidos informaron los datos del seguimiento al año. De manera similar, se planificó utilizar los datos de resultado recopilados entre los 18 y los 30 meses para calcular los resultados a los dos años. Por lo tanto, se utilizaron los datos publicados a las 96 semanas en los dos estudios incluidos con el objetivo de calcular los resultados a los dos años.
Results
Description of studies
Results of the search
Electronic searches yielded 9961 total records as of November 30, 2015. After removal of duplicates, we reviewed 7633 unique records. We assessed 13 records as "definitely relevant" or "possibly relevant" after screening titles and abstracts. Eight of these records were reports from two trials (VIEW 1; VIEW 2), both of which we included in the review (Figure 1). We excluded five records and provided reasons for exclusion in the Characteristics of excluded studies table.

Study flow diagram.
The VIEW 1 and VIEW 2 trials were two randomized, double‐masked, active‐controlled, phase 3 trials designed to assess the safety and efficacy of intravitreal aflibercept when used to treat patients with neovascular AMD. These two trials followed the same protocol; VIEW 1 included participants from 154 sites in Canada and the United States, and VIEW 2 included participants from 172 sites located elsewhere. Although data from both trials were reported in a single paper, these data were used to calculate separate estimates of one‐year outcomes. Two‐year outcomes were combined when reported.
We found no trials that compared aflibercept versus bevacizumab or sham intravitreal injections and met the inclusion criteria for this review.
Included studies
Types of participants
This review includes 2458 participants from two RCTs (VIEW 1, registered at clinicaltrials.gov NCT00509795; VIEW 2, registered at clinicaltrials.gov NCT00637377). VIEW 1 enrolled 1217 participants, and VIEW 2 enrolled 1240 participants. Criteria for participant selection common to the two RCTs included age 50 years or older, CNV lesions confirmed by fluorescein angiography, and BCVA score equivalent to 20/40 or worse. Both trials included one study eye per participant. Specific inclusion and exclusion criteria are described in greater detail in the Characteristics of included studies tables.
Types of interventions
Participants in VIEW 1 and VIEW 2 were randomly assigned to four cohorts: 0.5 mg aflibercept every four weeks (0.5q4), 2 mg aflibercept every four weeks (2q4), 2 mg aflibercept every eight weeks (2q8) following three monthly injections, and 0.5 mg ranibizumab every four weeks (Rq4). Both aflibercept and ranibizumab were administered by intravitreal injections, and the primary treatment period lasted one year (52 weeks). During the follow‐up phase ‐ from 52 weeks to 96 weeks ‐ all regimens were switched from a fixed monthly or bimonthly regimen to an as‐needed regimen with a minimum quarterly dosing ("capped PRN").
Types of outcome measures
Visual acuity outcomes
Both trials reported outcomes for best‐corrected visual acuity (BCVA), measured by using the Early Treatment Diabetic Retinopathy Study (ETDRS) chart, at one year and at two years. Investigators assessed BCVA outcomes by using multiple methods of aggregation, including mean change in number of letters, proportion of participants who gained 15 or more letters, and proportion of participants who maintained BCVA, defined by both trials as losing fewer than 15 letters. Neither trial reported the proportion of participants with BCVA worse than 20/200 at any time point.
Anatomic outcomes
Both trials used optical coherence tomography (OCT) to assess the proportion of eyes with absence of fluid at one‐year and two‐year follow‐up and mean change in central retinal thickness from baseline to one year and to two years. The two trials used fluorescein angiography to assess changes in CNV area from baseline to one year and two years. Neither trial reported the proportion of eyes with absence of leakage at any time point.
Mean number of injections
Both trials reported the mean number of injections received by each treatment group by one‐year and two‐year follow‐up. Treatment schedules were fixed for the first year in both trials (every four or eight weeks); therefore, this outcome will be biased on the basis of treatment group. For the second year of the trials, in which treatment schedules were switched to as‐needed dosing, this outcome was reported as the mean number of injections received between one‐year and two‐year follow‐up.
Quality‐of‐life outcomes
Both trials measured vision‐related quality‐of‐life outcomes by using the National Eye Institute Visual Function Questionnaire (NEI‐VFQ), and investigators measured outcomes as mean change from baseline in composite scores at one‐year follow‐up. They reported no data for two‐year follow‐up.
Adverse events
Both VIEW 1 and VIEW 2 reported information related to adverse events, including serious systemic adverse events (eg, death, arteriothrombotic events) and serious ocular adverse events (eg, severe visual acuity loss, retinal hemorrhage). We noted no variation between trials in the types of adverse events reported because the trials were designed similarly and used the same protocol.
Excluded studies
We excluded five studies after full‐text assessment. CLEAR‐AMD 1 examined various doses of aflibercept versus placebo following intravenous administration. This route of treatment is not used in practice, and although this study did compare aflibercept versus placebo ‐ a comparison we sought to review when drafting our protocol (Sarwar 2014) ‐ this comparison was not relevant to this review. We excluded one study because participants were not treatment‐naive (Zehetner 2015) and three studies that were not RCTs (Elshout 2014; Yoshida 2014; Zinkernagel 2015).
Risk of bias in included studies
Because the two included RCTs used the same protocol and methods in different populations, "Risk of bias" assessments are the same for both trials (Figure 2). We assessed studies at low risk of bias for most domains. However, both trials were sponsored by the manufacturer of aflibercept; therefore, we assessed these trials at high risk of bias because of the funding source.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
We assessed these trials at low risk of selection bias. Participants were assigned to treatment groups according to a predetermined centralized randomization scheme with balanced allocation and managed by an interactive voice response system, minimizing the possibility of selection bias.
Masking (performance bias and detection bias)
We assessed these trials at low risk of performance and detection bias. Participants were masked to their particular treatment group. The only unmasked investigator was responsible for receipt, tracking, preparation, destruction, and administration of study drugs, as well as for safety assessments. All other study site personnel were masked to treatment assignment by separating of study records and masking of drug packaging.
Incomplete outcome data
The percentage of participants in each treatment group completing 52 weeks of follow‐up ranged from 91.1% to 96.4% in VIEW 1, and from 88.1 to 96.4% in VIEW 2. Trial investigators reported outcomes based on a full analysis set and a per protocol set by using the last observation carried forward (LOCF) approach to impute missing values. On the basis of these considerations, we assessed these trials at low risk of attrition bias.
Selective reporting
Both trials were registered on clinicaltrials.gov, where primary and secondary outcome measures were prespecified. Final reports of the two trials included all outcomes listed in the clinical trial register. Therefore, we assessed these trials at low risk of reporting bias.
Other potential sources of bias
Many of the corresponding trial authors were employees of or consultants to, or had received research funding from, the manufacturer of aflibercept, Regeneron Pharmaceuticals. Also, the manufacturer of aflibercept participated in trial design, collected and analyzed data, and prepared study reports. We judged this level of involvement to confer high risk of bias because the company may have been motivated to find aflibercept as an equal or superior treatment over ranibizumab, which is manufactured by a different company.
Effects of interventions
See: Summary of findings for the main comparison
Aflibercept vs no treatment, placebo, or sham
We found no trials in which aflibercept had been compared with no treatment or with placebo or sham intravitreal injections.
Aflibercept vs ranibizumab
To compare aflibercept versus ranibizumab for the treatment of patients with neovascular AMD, we performed meta‐analyses of one‐year results from VIEW 1 and VIEW 2. For these meta‐analyses, we combined data from all aflibercept treatment groups and compared them with data from ranibizumab groups. We reported together and summarized below two‐year results for VIEW 1 and VIEW 2.
Visual acuity outcomes
Mean change in BCVA
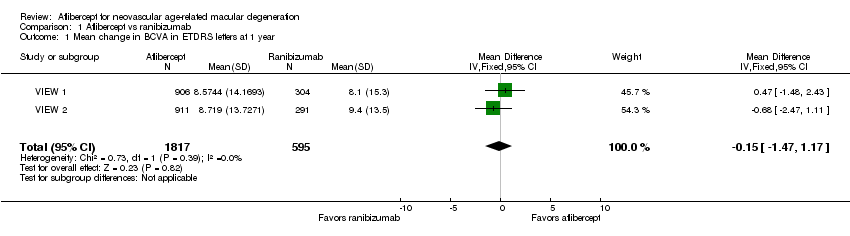
Both trials measured visual acuity using the ETDRS protocol. The mean difference (MD) in mean change in number of letters of BCVA from baseline to one year was less than one letter when aflibercept was compared with ranibizumab (MD ‐0.15, 95% CI ‐1.47 to 1.17; Analysis 1.1;Figure 3). Thus, eyes treated with aflibercept and ranibizumab showed similar gains in visual acuity at one year. We graded the quality of evidence for this outcome as high.
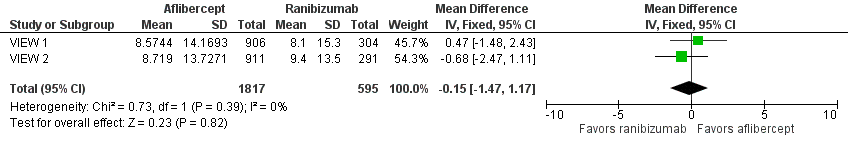
Forest plot of comparison: 1 Aflibercept vs ranibizumab, outcome: 1.1 Mean change in BCVA in ETDRS letters at 1 year.
At two years, the mean change in BCVA from baseline was 7.2 letters for the aflibercept groups versus 7.9 letters for the ranibizumab groups. Additional data regarding two‐year outcomes, such as standard deviation for the mean BCVA change, were not available for further analysis of this outcome.
Gain of 15 or more letters of BCVA
At one‐year follow‐up, the proportion of participants who gained 15 or more letters of BCVA was 31.4% in the aflibercept groups and 32.4% in the ranibizumab groups. For this outcome, a risk ratio (RR) greater than 1 favors treatment with aflibercept. The RR for the combined aflibercept groups versus the ranibizumab groups was 0.97 (95% CI 0.85 to 1.11), which indicates that similar proportions of participants in the aflibercept and ranibizumab groups showed large visual acuity gains (Analysis 1.2;Figure 4). We graded the quality of evidence for this outcome as high.

Forest plot of comparison: 1 Aflibercept vs ranibizumab, outcome: 1.2 Gain of ≥ 15 letters of BVCA at 1 year.
At two‐year follow‐up, 562 (30.9%) of 1817 participants in the aflibercept groups and 188 (31.6%) of 595 participants in the ranibizumab groups gained 15 or more letters from baseline. This outcome was comparable between the two groups (RR 0.98, 95% CI 0.85 to 1.12). We graded the quality of evidence for this outcome as high.
Loss of 15 or more letters of BCVA
At one‐year follow‐up, the proportion of participants who lost 15 or more letters of BCVA was 5.1% in the aflibercept groups and 5.7% in the ranibizumab groups. For this outcome, an RR less than 1 favors treatment with aflibercept, as it indicates that a higher proportion of participants lost letters of visual acuity ‐ a negative outcome ‐ in the ranibizumab groups (RR 0.89, 95% CI 0.61 to 1.30; Analysis 1.3). We graded the quality of evidence for this outcome as moderate due to imprecision.
Two‐year follow‐up reports for the combined VIEW 1 and VIEW 2 trials did not report on the proportion of participants who lost 15 or more letters of BCVA.
BCVA worse than 20/200
This outcome was not reported in the included studies at one year or at two years.
Anatomic outcomes
Absence of fluid on optical coherence tomography (OCT)
At one year, researchers found no significant difference between aflibercept and ranibizumab in the proportion of eyes who achieved dry retinas (absence of cystic intraretinal fluid and subretinal fluid on OCT). In VIEW 1, 61.0% of participants in the aflibercept groups and 63.6% of those in the ranibizumab group had no fluid evident on OCT images at one year; in VIEW 2, 64.4% in aflibercept groups and 55.7% in ranibizumab groups had no fluid. The RR for comparison of aflibercept and ranibizumab groups was 1.06 (95% CI 0.98 to 1.14; Analysis 1.4;Figure 5). We graded the quality of evidence for this outcome as high.

Forest plot of comparison: 1 Aflibercept vs ranibizumab, outcome: 1.4 Absence of fluid on optical coherence tomography (OCT) at 1 year.
At two years, only combined data from VIEW 1 and VIEW 2 were available. The proportion of participants with no retinal fluid evident on OCT images decreased in all treatment groups from one year to two years. A higher proportion of participants in the aflibercept groups (757/1520, 49.8%) showed absence of fluid on OCT compared with participants in the ranibizumab groups (231/508, 45.5%) (RR 1.10, 95% CI 0.98 1.22). We graded the quality of evidence for this outcome as high.
Absence of leakage on fluorescein angiography
The included studies reported no data for this outcome at one year or at two years.
Mean change in extent of choroidal neovascularization (CNV)
In these two trials, change in CNV area from baseline was measured in mm2. At one year, the MD in change in CNV area between aflibercept and ranibizumab groups was ‐0.24 mm2 (95% CI ‐0.78 to 0.29; Analysis 1.5). We graded the quality of evidence for this outcome as high.
Published analyses of combined data from VIEW 1 and VIEW 2 showed mean decreases in CNV area that were maintained from one‐year to two‐year follow‐up in all treatment groups; however, no data were provided for calculating the mean difference in changes in CNV area between groups at two years.
Mean change in central retinal thickness (CRT)
At one‐year follow‐up, the MD between aflibercept and ranibizumab was ‐4.94 µm (95% CI ‐15.48 to 5.61), which is neither a clinically nor statistically important difference (Analysis 1.6). We graded the quality of evidence for this outcome as high.
Investigators provided no data for calculating the mean difference in change in CRT between groups at two years.
Mean number of injections
The dosing schedule for all treatment groups was fixed for the first year of the trial (administered every four weeks or every eight weeks); therefore, we did not analyze data on the mean number of injections for one‐year follow‐up.
The mean number of injections during the "capped PRN" period of these trials (from the end of year one to the end of year two) was within one injection when aflibercept was compared with ranibizumab (MD ‐0.40, 95% CI ‐0.62 to ‐0.19). We graded the quality of evidence for this outcome as high.
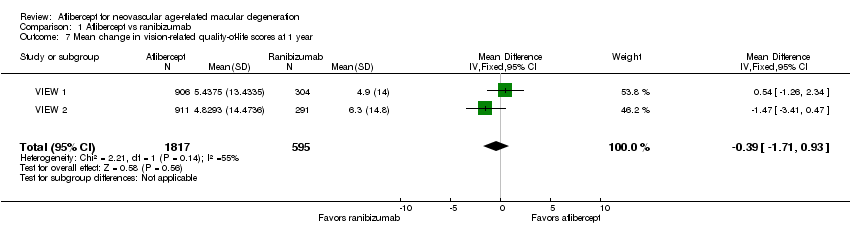
Vision‐related quality‐of‐life (VRQoL)
In both VIEW 1 and VIEW 2, researchers assessed VRQoL by using the National Eye Institute Visual Function Questionnaire‐25 (NEI‐VFQ‐25). Composite scores range from 0 to 100, and higher scores represent higher visual functioning. Similar changes in NEI‐VFQ‐25 composite scores from baseline to one year were reported for both aflibercept and ranibizumab (MD ‐0.39, 95% CI ‐1.71 to 0.93; Analysis 1.7;Figure 6). We graded the quality of evidence for this outcome as high.

Forest plot of comparison: 1 Aflibercept vs ranibizumab, outcome: 1.7 Mean change in vision‐related quality‐of‐life scores at 1 year.
VRQoL data for two‐year follow‐up were not available.
Adverse events
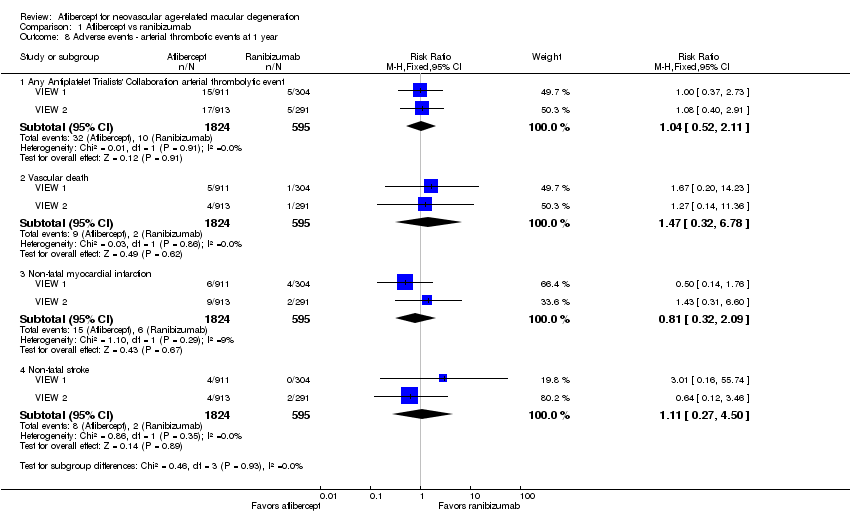
For the VIEW studies (combined data from VIEW 1 and VIEW 2), 1.75% of participants in the aflibercept groups and 1.68% of those in the ranibizumab groups experienced any arterial thrombotic event, as defined by the Antiplatelet Trialists’ Collaboration (APTC), during the first year of follow‐up (RR 1.04, 95% CI 0.52 to 2.11; Analysis 1.8). At one year, the risk for vascular death was small (< 1%), with uncertainty regarding the effect between aflibercept groups and ranibizumab groups (RR 1.47, 95% CI 0.32 to 6.78; Analysis 1.8). Risks of non‐fatal myocardial infarction (RR 0.81, 95% CI 0.32 to 2.09) and non‐fatal stroke (RR 1.11, 95% CI 0.27 to 4.50) were also uncertain when aflibercept groups were compared with ranibizumab groups (Analysis 1.8).
At one‐year follow‐up, the risk of any serious systemic adverse event was similar between aflibercept and ranibizumab groups (RR 0.99, 95% CI 0.79 to 1.25; Analysis 1.9). Congestive heart failure events were more frequent in the aflibercept group than in the ranibizumab group (RR 0.77, 95% CI 0.20 to 2.97; Analysis 1.9). Risk of a non‐ocular hemorrhagic event was lower in the aflibercept group than in the ranibizumab group (RR 2.30, 95% CI 0.42 to 12.70; Analysis 1.9).
At one‐year follow‐up, risk of any serious ocular adverse event was lower in the aflibercept group than in the ranibizumab group (RR 0.62, 95% CI 0.36 to 1.07; Analysis 1.10). Risk of visual acuity loss was similar between aflibercept and ranibizumab groups (RR 1.08, 95% CI 0.30 to 3.93), and risk of retinal hemorrhage was greater in the aflibercept group than in the ranibizumab group (RR 0.65, 95 % CI 0.16 to 2.60; Analysis 1.10).
Adverse event data from individual VIEW 1 and VIEW 2 trials were not available for analysis for two‐year outcomes. By two years, 3.3% (60/1824) of participants in the aflibercept group and 3.2% (19/595) of those in the ranibizumab group had experienced any arterial thrombotic event (RR 1.03, 95% CI 0.62 to 1.71). Risk for vascular death was 1.3% (24/1824) in the aflibercept group versus 0.5% (3/595) in the ranibizumab group (RR 2.61, 95% CI 0.79 to 8.64). Comparative risks of non‐fatal myocardial infarction (RR 0.68, 95% CI 0.34 to 1.34) and non‐fatal stroke (RR 0.85, 95% CI 0.30 to 2.37) were uncertain when aflibercept groups were compared with ranibizumab groups.
At two‐year follow‐up, the risk of any serious systemic adverse event was similar between aflibercept and ranibizumab groups (RR 0.98, 95% CI 0.83 to 1.15). Congestive heart failure events occurred in similar proportions in the aflibercept group and the ranibizumab group (RR 1.04, 95% CI 0.38 to 2.84). Non‐ocular hemorrhagic events occurred in less than one per cent of participants; these data were not reported for two‐year outcomes.
At two‐year follow‐up, the risk of any serious ocular adverse event was lower in the aflibercept group than in the ranibizumab group (RR 0.82, 95% CI 0.52 to 1.27). Risks of visual acuity loss (RR 0.91, 95% CI 0.33 to 2.53) and retinal hemorrhage (RR 1.06, 95 % CI 1.06 0.35 to 3.24) were similar between aflibercept and ranibizumab groups.
The small numbers of events led to risk estimates for these adverse events that are imprecise. As the result of imprecision, we graded the quality of evidence for all adverse events as moderate.
Aflibercept vs bevacizumab
We found no trials in which aflibercept had been compared with bevacizumab.
Discusión
Resumen de los resultados principales
Los dos ensayos incluidos en esta revisión sistemática tuvieron bajo riesgo para la mayoría de los dominios de sesgo y demostraron que los efectos beneficiosos y perjudiciales del tratamiento con aflibercept intravítreo fueron similares a los del ranibizumab entre los participantes con degeneración macular neovascular senil (DMS). Los cambios en la agudeza visual (las ganancias y las pérdidas) fueron similares entre los ojos tratados con aflibercept y con ranibizumab. La mejoría general en la agudeza visual se correlacionó con las mejorías anatómicas (p.ej., espesamiento retiniano, tamaño de la neovascularización coroidea [NVC]) para ambos agentes. Aunque los perfiles de seguridad (ocular y sistémico) para el aflibercept y el ranibizumab fueron similares y no se identificaron señales de seguridad, ni VIEW 1 ni VIEW 2, solos o juntos, proporcionaron un poder estadístico suficiente para la evaluación precisa de los resultados de seguridad. Los resultados de la calidad de vida relacionada con la visión se correlacionaron con los resultados clínicos y anatómicos. Las puntuaciones y los cambios en las puntuaciones al año fueron similares entre los participantes tratados con aflibercept y los tratados con ranibizumab.
Los regímenes de tratamiento con aflibercept actualmente en uso habitualmente permiten inyecciones intravítreas a intervalos de ocho semanas con una vigilancia mensual. Por lo tanto, la reducción en la frecuencia de las inyecciones en comparación con ranibizumab y bevacizumab reduce la carga del tratamiento y la posibilidad de complicaciones relacionadas con la inyección. El ranibizumab y el bevacizumab fueron los tratamientos utilizados con mayor frecuencia para la degeneración macular neovascular senil en el momento en el que se realizaron los estudios VIEW 1 y VIEW 2. Los análisis de los datos disponibles indican que aflibercept presenta la misma efectividad y seguridad y puede considerarse un tratamiento de primera línea en los pacientes con degeneración macular neovascular senil debido a la posibilidad de menos inyecciones necesarias para lograr resultados similares.
Compleción y aplicabilidad general de las pruebas
El objetivo de esta revisión fue comparar la efectividad y la seguridad del aflibercept para el tratamiento de los pacientes con degeneración macular neovascular senil versus ranibizumab, bevacizumab o un simulacro. Solamente se seleccionaron para inclusión en esta revisión los datos de los ensayos controlados aleatorios (ECA) con un seguimiento mínimo de un año. No se encontraron ensayos en los que el aflibercept se hubiera comparado con bevacizumab o un simulacro y que cumplieran los criterios de elegibilidad para esta revisión. Por lo tanto, el análisis estuvo limitado a la comparación de aflibercept y ranibizumab.
El resultado primario de esta revisión fue el cambio medio a partir del valor inicial en la agudeza visual mejor corregida (AVMC) (letras en el Early Treatment Diabetic Retinopathy Study [ETDRS]) hasta el año de seguimiento. Los resultados secundarios incluyeron otros resultados de la agudeza visual, las características morfológicas evaluadas con tomografía de coherencia óptica (TCO) y angiografía con fluoresceína, los eventos adversos oculares y sistémicos, y la calidad de vida relacionada con la visión. Se realizaron búsquedas en publicaciones en revistas, resúmenes de congresos, documentos de la Food and Drug Administration (FDA) de los EE.UU. y registros de ensayos clínicos para identificar datos relevantes.
Para esta revisión se analizaron los datos de resultado de 2457 participantes de dos grandes ensayos. VIEW 1 y VIEW 2 incluyeron hombres y mujeres con 50 años de edad o más con degeneración macular neovascular senil subfoveal en el ojo de estudio, y se realizaron en 174 países en todos los continentes excepto en África y la Antártida.
Calidad de la evidencia
Estos estudios estaban bien diseñados; evaluaron resultados clínicamente relevantes y resultados importantes para los pacientes. La calidad de las pruebas se calificó como alta para la mayoría de los resultados. Los análisis de los resultados encontraron sistemáticamente que no hubo diferencias significativas entre aflibercept y ranibizumab. Sin embargo, los números de participantes incluidos en los análisis de algunos resultados poco frecuentes como los eventos adversos no fueron suficientes para descartar posibles diferencias entre los tratamientos.
Sesgos potenciales en el proceso de revisión
Dos revisores también fueron investigadores para los ensayos VIEW 1 y VIEW 2 y fueron autores de los informes de dichos estudios. Otros revisores no estaban asociados con los estudios incluidos, aunque son miembros del departamento presidido por uno de los investigadores / autores de VIEW 1 y VIEW 2. Por lo tanto, esta revisión presenta un potencial significativo de sesgo a pesar de los esfuerzos por proporcionar una evaluación e interpretación objetivas de los datos disponibles.
Es importante señalar que ambos ensayos incluidos en esta revisión fueron patrocinados por Regeneron Pharmaceuticals, el fabricante de aflibercept. La empresa participó en el diseño del ensayo, recopiló y analizó los datos, y preparó los informes de estudio de ambos ensayos.
Acuerdos y desacuerdos con otros estudios o revisiones
La experiencia clínica con aflibercept en el tratamiento de los pacientes con degeneración macular neovascular senil es consistente con las conclusiones de esta revisión, que aflibercept proporciona una agudeza visual y resultados morfológicos similares sin exceso de eventos adversos en comparación con ranibizumab. Una revisión de la bibliografía que resumió los hallazgos de VIEW 1 y VIEW 2 concluyó que "en comparación con los tratamientos actuales, aflibercept ha mostrado una eficacia y seguridad iguales" a ranibizumab (Thomas 2013). Al igual que en 2015, la American Academy of Ophthalmology ha recomendado los agentes de factor de crecimiento endotelial antivascular (VEGF), incluido el ranibizumab, el bevacizumab y el aflibercept, como tratamiento de primera línea para los pacientes con DMS neovascular (AAO 2015). Un metanálisis de redes realizado por Schmid y cols. que compara diversos agentes y dosis de anti‐VEGF calculó que las dosis estándar de aflibercept (2 mg) y ranibizumab (0,5 mg) pueden funcionar ligeramente mejor que otras dosis de estos agentes (0,5 mg y 0,3 mg, respectivamente), bevacizumab (1,25 mg) y placebo en cuanto a los resultados de la agudeza visual y los eventos adversos graves al año de seguimiento (Schmid 2015).

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Forest plot of comparison: 1 Aflibercept vs ranibizumab, outcome: 1.1 Mean change in BCVA in ETDRS letters at 1 year.

Forest plot of comparison: 1 Aflibercept vs ranibizumab, outcome: 1.2 Gain of ≥ 15 letters of BVCA at 1 year.

Forest plot of comparison: 1 Aflibercept vs ranibizumab, outcome: 1.4 Absence of fluid on optical coherence tomography (OCT) at 1 year.

Forest plot of comparison: 1 Aflibercept vs ranibizumab, outcome: 1.7 Mean change in vision‐related quality‐of‐life scores at 1 year.
Comparison 1 Aflibercept vs ranibizumab, Outcome 1 Mean change in BCVA in ETDRS letters at 1 year.

Comparison 1 Aflibercept vs ranibizumab, Outcome 2 Gain of ≥ 15 letters of BVCA at 1 year.

Comparison 1 Aflibercept vs ranibizumab, Outcome 3 Loss of ≥ 15 letters of BVCA at 1 year.

Comparison 1 Aflibercept vs ranibizumab, Outcome 4 Absence of fluid on optical coherence tomography (OCT) at 1 year.

Comparison 1 Aflibercept vs ranibizumab, Outcome 5 Mean change in size of the choroidal neovascularization at 1 year.

Comparison 1 Aflibercept vs ranibizumab, Outcome 6 Mean change in central retinal thickness at 1 year.
Comparison 1 Aflibercept vs ranibizumab, Outcome 7 Mean change in vision‐related quality‐of‐life scores at 1 year.
Comparison 1 Aflibercept vs ranibizumab, Outcome 8 Adverse events ‐ arterial thrombotic events at 1 year.
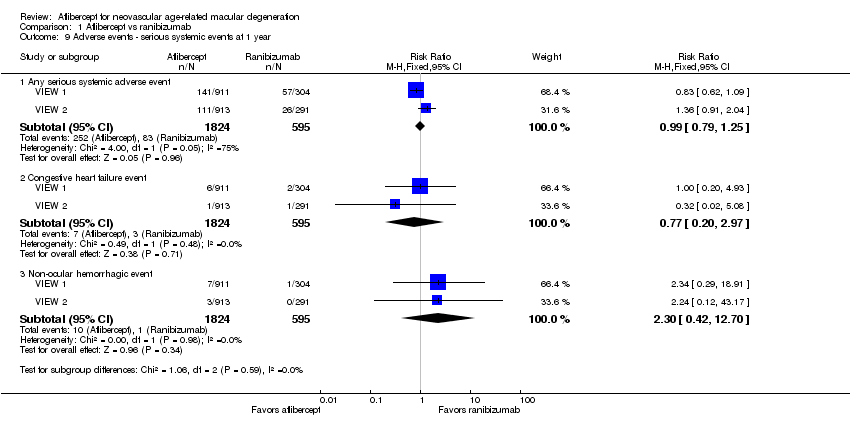
Comparison 1 Aflibercept vs ranibizumab, Outcome 9 Adverse events ‐ serious systemic events at 1 year.
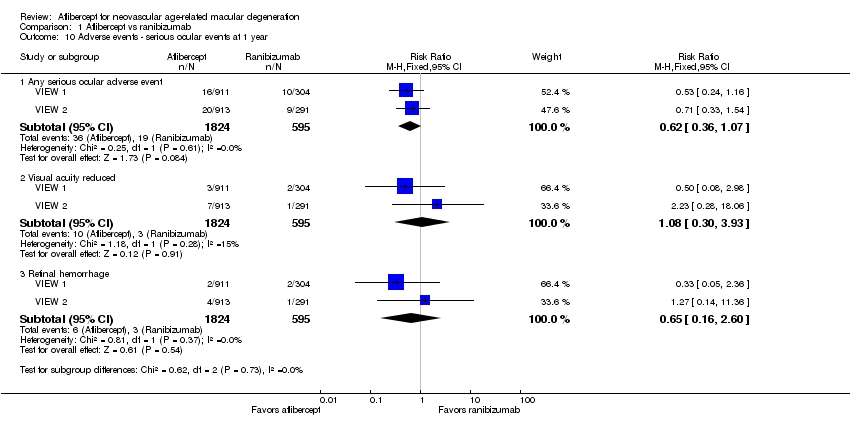
Comparison 1 Aflibercept vs ranibizumab, Outcome 10 Adverse events ‐ serious ocular events at 1 year.
| Aflibercept vs ranibizumab for neovascular age‐related macular degeneration | ||||||
| Patient or population: people with age‐related macular degeneration Settings: clinical centers Intervention: intravitreal injections of aflibercept Comparison: intravitreal injections of ranibizumab | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Ranibizumab | Aflibercept | |||||
| Mean change in BCVA in ETDRS letters at 1 year (number of letters) | Mean change in visual acuity across ranibizumab groups ranged from gains of 8.57 letters to 8.71 letters | Mean change in visual acuity in aflibercept groups was on average 0.15 fewer letters gained (95% CI 1.47 fewer letters to 1.17 more letters) | MD ‐0.15 | 2412 | ⊕⊕⊕⊕ | |
| Gain of ≥ 15 letters of BVCA at 1 year | 324 per 1000 | 314 per 1000 | RR 0.97 | 2412 (2) | ⊕⊕⊕⊕ | |
| Absence of fluid on optical coherence tomography (OCT) at 1 year | 595 per 1000 | 630 per 1000 | RR 1.06 | 2291 (2) | ⊕⊕⊕⊕ | |
| Quality‐of‐life measures at 1 year (National Eye Institute‐Visual Function Questionnaire [NEI‐VFQ]) | Mean improvement in composite NEI‐VQF score ranged across control groups from 4.9 to 6.3 points | Mean improvement in composite NEI‐VQF score in intervention groups was on average 0.39 points lower (95% CI 1.71 points lower to 0.93 points higher) | MD ‐0.39 | 2412 (2) | ⊕⊕⊕⊕ | |
| Adverse events ‐ serious systemic events at 1 year | 139 per 1000 | 138 per 1000 | RR 0.99 (0.79 to 1.25) | 2419 (2) | ⊕⊕⊕⊝ | |
| Adverse events ‐ serious ocular events at 1 year | 32 per 1000 | 20 per 1000 | RR 0.62 (0.36 to 1.07) | 2419 (2) | ⊕⊕⊕⊝ | |
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). The unit of analysis is the individual (one study eye per person). | ||||||
| GRADE Working Group grades of evidence aAdverse events downgraded to moderate quality as the number of events is small (wide confidence intervals) | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Mean change in BCVA in ETDRS letters at 1 year Show forest plot | 2 | 2412 | Mean Difference (IV, Fixed, 95% CI) | ‐0.15 [‐1.47, 1.17] |
| 2 Gain of ≥ 15 letters of BVCA at 1 year Show forest plot | 2 | 2412 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.97 [0.85, 1.11] |
| 3 Loss of ≥ 15 letters of BVCA at 1 year Show forest plot | 2 | 2412 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.89 [0.61, 1.30] |
| 4 Absence of fluid on optical coherence tomography (OCT) at 1 year Show forest plot | 2 | 2291 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.06 [0.98, 1.14] |
| 5 Mean change in size of the choroidal neovascularization at 1 year Show forest plot | 2 | 2412 | Mean Difference (IV, Fixed, 95% CI) | ‐0.24 [‐0.78, 0.29] |
| 6 Mean change in central retinal thickness at 1 year Show forest plot | 2 | 2412 | Mean Difference (IV, Fixed, 95% CI) | ‐4.94 [‐15.48, 5.61] |
| 7 Mean change in vision‐related quality‐of‐life scores at 1 year Show forest plot | 2 | 2412 | Mean Difference (IV, Fixed, 95% CI) | ‐0.39 [‐1.71, 0.93] |
| 8 Adverse events ‐ arterial thrombotic events at 1 year Show forest plot | 2 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 8.1 Any Antiplatelet Trialists' Collaboration arterial thrombolytic event | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.04 [0.52, 2.11] |
| 8.2 Vascular death | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.47 [0.32, 6.78] |
| 8.3 Non‐fatal myocardial infarction | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.81 [0.32, 2.09] |
| 8.4 Non‐fatal stroke | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.11 [0.27, 4.50] |
| 9 Adverse events ‐ serious systemic events at 1 year Show forest plot | 2 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 9.1 Any serious systemic adverse event | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.99 [0.79, 1.25] |
| 9.2 Congestive heart failure event | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.77 [0.20, 2.97] |
| 9.3 Non‐ocular hemorrhagic event | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.30 [0.42, 12.70] |
| 10 Adverse events ‐ serious ocular events at 1 year Show forest plot | 2 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 10.1 Any serious ocular adverse event | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.62 [0.36, 1.07] |
| 10.2 Visual acuity reduced | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.08 [0.30, 3.93] |
| 10.3 Retinal hemorrhage | 2 | 2419 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.65 [0.16, 2.60] |

