Regímenes antibióticos para el tratamiento de la infección intraamniótica
Resumen
Antecedentes
La corioamnionitis es una infección frecuente que afecta a la madre y al feto. Las complicaciones del feto asociadas con la corioamnionitis incluyen sepsis neonatal temprana, neumonía y meningitis. También pueden dar lugar a morbilidad materna como infección pelviana y shock séptico.
Se calcula que la corioamnionitis clínica ocurre en el 1% al 2% de los partos a término y en el 5% al 10% de los partos prematuros; la corioamnionitis histológica se presenta en casi el 20% de los partos a término y en el 50% de los partos prematuros. Las pacientes con corioamnionitis tienen un riesgo de dos a tres veces mayor de parto por cesárea y de tres a cuatro veces mayor de endomiometritis, infección de la herida, absceso pelviano, bacteriemia y hemorragia posparto.
Objetivos
Evaluar los efectos de administrar regímenes antibióticos para la infección intraamniótica sobre la morbilidad y la mortalidad materna y perinatal y las complicaciones relacionadas con la infección.
Métodos de búsqueda
Se hicieron búsquedas en el registro de ensayos del Grupo Cochrane de Embarazo y Parto (Cochrane Pregnancy and Childbirth Group) (1 de octubre de 2014), CENTRAL, MEDLINE, Embase, LILACS, y en WHO ICTRP (septiembre de 2014). También se realizaron búsquedas en las listas de referencias de los estudios recuperados y se estableció contacto con expertos en el tema.
Criterios de selección
Ensayos controlados aleatorios (ECA) que incluyeron pacientes con infección intraamniótica. Los ensayos se incluyeron si compararon tratamiento antibiótico con placebo o ningún tratamiento (de ser aplicable), tratamiento con diferentes regímenes antibióticos o momentos de administración de la antibioticoterapia (intraparto o posparto). Por lo tanto, esta revisión examina los ensayos que evaluaron los antibióticos intraparto, los regímenes antibióticos intraparto y posparto, y los antibióticos posparto. El diagnóstico de la infección intraamniótica se basó en criterios estándar (clínicos / pruebas) y la edad gestacional no fue una limitación.
Obtención y análisis de los datos
Dos revisores de forma independiente evaluaron los ensayos para inclusión y su calidad. Dos revisores de forma independiente extrajeron los datos y verificaron su exactitud. La calidad de las pruebas se evaluó mediante el enfoque Grades of Recommendation, Assessment, Development and Evaluation (GRADE) y se incluyó la tabla "Resumen de los hallazgos".
Resultados principales
Los resultados primarios preespecificados fueron mortalidad materna y neonatal, infección materna y neonatal grave y duración de la estancia hospitalaria materna y neonatal.
Se incluyeron 11 estudios (con 1296 pacientes) que se evaluaron como de riesgo de sesgo bajo a moderado, principalmente porque los métodos de ocultación de la asignación no se informaron adecuadamente; en su mayoría los estudios fueron abiertos y el informe de resultado estaba incompleto. La calidad de las pruebas fue baja a muy baja para la mayoría de los resultados, al igual que para el enfoque GRADE. En los ensayos incluidos se evaluaron los siguientes antibióticos: ampicilina, ampicilina / sulbactam, gentamicina, clindamicina y cefotetán.
Durante el trabajo de parto: el metanálisis de dos estudios no encontró diferencias claras en las tasas de sepsis neonatal (163 recién nacidos; cociente de riesgos [CR] 1,07; intervalo de confianza [IC] del 95%: 0,40 a 2,86; I² = 9%; pruebas de baja calidad), fracaso del tratamiento (endometritis) (163 participantes; CR 0,86; IC del 95%: 0,27 a 2,70; I² = 0%; pruebas de baja calidad) y hemorragia posparto (CR 1,39; IC del 95%: 0,76 a 2,56; I² = 0%; pruebas de baja calidad) cuando se evaluaron dos dosis / regímenes diferentes de gentamicina. No se encontraron diferencias claras entre los grupos para cualquier resultado materno o neonatal informado. La revisión no identificó datos para una comparación de antibióticos versus ningún tratamiento / placebo.
Posparto: el metanálisis de dos estudios que evaluaron la administración de antibióticos versus placebo después del parto vaginal no mostró diferencias significativas entre los grupos en las tasas de fracaso del tratamiento o endometritis posparto. No se encontraron diferencias significativas en las tasas de muerte neonatal y endometritis posparto cuando se comparó la administración de antibióticos con ningún tratamiento. Cuatro ensayos que evaluaron dos dosis / regímenes diferentes de gentamicina o tratamiento con agente dual versus tratamiento con agente triple, o que compararon antibióticos, no encontraron diferencias significativas en la mayoría de los resultados neonatales o maternos informados; la duración de la estancia hospitalaria mostró una diferencia a favor del grupo de pacientes que recibió antibióticos de corta duración (un estudio, 292 pacientes; diferencia de medias [DM] ‐0,90 días; IC del 95%: ‐1,64 a ‐0,16; pruebas de calidad moderada).
Intraparto versus posparto: un estudio pequeño (45 pacientes) que evaluó la administración de ampicilina / gentamicina durante el período intraparto versus el tratamiento posparto inmediato encontró diferencias significativas a favor del grupo intraparto en el número medio de días de estancia hospitalaria materna posparto (un ensayo, 45 pacientes; DM ‐1,00 días; IC del 95%: ‐1,94 a ‐0,06; pruebas de muy baja calidad) y el número medio de días de estancia hospitalaria neonatal (un ensayo, 45 recién nacidos; DM ‐1,90 días; IC del 95%: ‐3,91 a ‐0,49; pruebas de muy baja calidad). Aunque no se encontraron diferencias significativas en la tasa de bacteriemia materna o sepsis neonatal temprana, para el resultado neumonía o sepsis neonatal se observó una diferencia significativa a favor del tratamiento intraparto (un ensayo, 45 recién nacidos; CR 0,06; IC del 95%: 0,00 a 0,95; pruebas de muy baja calidad).
Conclusiones de los autores
Esta revisión incluyó 11 estudios (con un riesgo de sesgo de bajo a moderado). La calidad de las pruebas fue baja a muy baja para la mayoría de los resultados, al igual que para el enfoque GRADE. Se consideró que solamente un resultado (duración de la estancia hospitalaria) proporcionó pruebas de calidad moderada cuando se compararon antibióticos (corta duración) con antibióticos (larga duración) durante el tratamiento posparto de la infección intraamniótica. Los motivos principales de la disminución de la calificación de calidad de las pruebas fueron las limitaciones en el diseño o la realización del estudio (riesgo de sesgo), la falta de precisión y la inconsistencia de los resultados.
Actualmente se dispone de pruebas limitadas que muestren el régimen antimicrobiano más apropiado para el tratamiento de las pacientes con infección intraamniótica, si se debe continuar la administración de antibióticos durante el período posparto y qué régimen antibiótico se debe administrar o cuánto debe durar el tratamiento. Además, no se encontraron pruebas sobre los efectos adversos de la intervención (no se informaron en los estudios incluidos). Un ECA pequeño indicó que la administración de antibióticos durante el período intraparto es superior a su uso durante el período posparto para reducir el número de días de estancia hospitalaria materna y neonatal.
PICO
Resumen en términos sencillos
Administración de antibióticos para tratar la infección intraamniótica en pacientes embarazadas
Pregunta de la revisión: Los revisores Cochrane examinaron las pruebas disponibles de los ensayos controlados aleatorios sobre la administración de antibióticos para el tratamiento de las pacientes embarazadas con infección intraamniótica (corioamnionitis).
Antecedentes: la corioamnionitis ocurre con frecuencia entre las pacientes embarazadas, afecta a la madre y al feto y generalmente da lugar a remisión al hospital. Es una infección de las membranas fetales, el líquido amniótico y la placenta que puede causar complicaciones al recién nacido que incluyen inflamación de todo el cuerpo o sepsis, neumonía y meningitis. La corioamnionitis también puede dar lugar a problemas de salud para la madre como infección pelviana, sepsis, hemorragia posparto y aumento del riesgo de parto por cesárea. Los factores de riesgo para desarrollar corioamnionitis incluyen trabajo de parto activo durante mucho tiempo, aumento en la duración de la rotura de las membranas y monitorización interna, líquido amniótico teñido de meconio y un gran número de exámenes vaginales digitales. El tratamiento de las pacientes con infección intraamniótica consiste generalmente en antibióticos, que se pueden administrar durante el parto o inmediatamente después del mismo. Actualmente no hay información suficiente para indicar el régimen de tratamiento más apropiado, qué régimen antibiótico se debe administrar ni si los antibióticos se deben continuar durante el período inmediatamente después del parto y por cuánto tiempo.
Características de los estudios: se identificaron 11 estudios con 1296 pacientes; la mayoría de los estudios se realizó en EE.UU. Cuatro estudios evaluaron la administración de antibióticos antes del parto (anteparto); seis estudios evaluaron la administración de antibióticos después del parto (posparto); y uno comparó la administración de antibióticos antes y después del parto.
Calidad de la evidencia: la calidad de las pruebas se clasificó de baja a muy baja, principalmente porque muchos estudios tuvieron limitaciones metodológicas con resultados basados en números limitados de ensayos y de participantes incluidas que pudieran agruparse.
Resultados clave: según los hallazgos de un estudio, se encontró que el tratamiento durante el trabajo de parto fue más eficaz que el tratamiento después del trabajo de parto; sin embargo, este hallazgo solamente se relaciona con la duración de la estancia hospitalaria materna y neonatal, y la infección neonatal grave. Ninguna prueba indicó que una dosis mayor de antibióticos antes del parto fue superior a una dosis inferior. Inmediatamente después del parto, ninguna prueba indicó que diferentes tipos de antibióticos o que la duración más larga o más corta del tratamiento mejoraran la salud de la madre y el recién nacido. Todas las pacientes que participaron en los ensayos posparto recibieron antibióticos antes del momento del parto. Por lo tanto, no hubo información suficiente de los ensayos controlados aleatorios que mostrara el régimen más apropiado de antibióticos para el tratamiento de las pacientes con infección intraamniótica, si se debe continuar la administración de antibióticos durante el período posparto y qué régimen antibiótico se debe administrar y por cuánto tiempo. Ninguno de los estudios incluidos presentó información relacionada con los efectos adversos de la intervención.
Conclusiones de los autores
Summary of findings
| Antibiotics versus antibiotics in labor for management of intra‐amniotic infection | ||||||
| Population: women in labor with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Antibiotics versus antibiotics | |||||
| Maternal death | See comment | See comment | Not estimable | 38 | See comment | Comparing daily gentamicin versus 8‐hour gentamicin. Outcome was reported with no events. |
| Neonatal deaths | Study population | RR 1.39 | 133 | ⊕⊝⊝⊝ | Comparing dual‐agent therapy versus triple‐agent therapy. | |
| 31 per 1000 | 43 per 1000 | |||||
| Moderate | ||||||
| 31 per 1000 | 43 per 1000 | |||||
| Neonatal sepsis | Study population | RR 1.07 | 163 | ⊕⊕⊝⊝ | Comparing daily gentamicin versus 8‐hour gentamicin. | |
| 84 per 1000 | 90 per 1000 | |||||
| Moderate | ||||||
| 141 per 1000 | 151 per 1000 | |||||
| Respiratory distress syndrome | Study population | RR 1.69 | 125 | ⊕⊕⊝⊝ | Comparing daily gentamicin versus 8‐hour gentamicin. | |
| 48 per 1000 | 80 per 1000 | |||||
| Moderate | ||||||
| 48 per 1000 | 81 per 1000 | |||||
| Maternal postpartum hospital stay (days) | Mean maternal postpartum hospital stay (days) in the intervention groups was | 125 | ⊕⊕⊝⊝ | Comparing daily gentamicin versus 8‐hour gentamicin. | ||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Treatment failure (endometritis) | Study population | RR 0.86 | 163 (2 studies) | ⊕⊕⊝⊝ | Comparing daily gentamicin versus 8‐hour gentamicin. | |
| 72 per 1000 | 62 per 1000 | |||||
| Moderate | ||||||
| 65 per 1000 | 56 per 1000 | |||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aWide confidence interval crossing the line of no effect, few events, and small sample size. | ||||||
| Antibiotics versus no treatment during postpartum period for management of intra‐amniotic infection | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Antibiotics versus no treatment during postpartum period | |||||
| Neonatal death | Study population | RR 3.32 | 116 | ⊕⊝⊝⊝ | ||
| Not estimable | ||||||
| Moderate | ||||||
| Not estimable | ||||||
| Neonatal sepsis | Study population | RR 1.11 | 55 | ⊕⊝⊝⊝ | ||
| 148 per 1000 | 55 per 1000 | |||||
| Moderate | ||||||
| 148 per 1000 | 54 per 1000 | |||||
| Postpartum endometritis | Study population | RR 1.48 | 116 | ⊕⊝⊝⊝ | ||
| 148 per 1000 | 218 per 1000 | |||||
| Moderate | ||||||
| 148 per 1000 | 219 per 1000 | |||||
| Duration of maternal and neonatal hospital stay | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Need for additional antibiotic therapy | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Failure of treatment | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne study with design limitations. | ||||||
| Antibiotics versus placebo during postpartum period for management of intra‐amniotic infection | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Antibiotics versus placebo during postpartum period | |||||
| Maternal and neonatal mortality | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Maternal and neonatal severe infection | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Duration of maternal and neonatal hospital stay | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Endomyometritis | See comment | See comment | Not estimable | 288 | See comment | This outcome was reported with no events. |
| Need for additional antibiotic therapy | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Treatment failure | Study population | RR 0.97 | 288 | ⊕⊝⊝⊝ | The outcome was reported with no events in one study. | |
| 14 per 1000 | 14 per 1000 | |||||
| Moderate | ||||||
| 8 per 1000 | 8 per 1000 | |||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne study with serious design limitations. | ||||||
| Antibiotic versus antibiotics during postpartum period for management of intra‐amniotic infection | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Antibiotic versus antibiotics during postpartum period | |||||
| Maternal and neonatal mortality | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Maternal and neonatal severe infection | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Length of treatment (days) | Mean length of treatment (days) in the intervention groups was | 131 (1 study) | ⊕⊝⊝⊝ Very lowa,b | Once daily versus thrice daily. | ||
| Endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Treatment failure | Study population | RR 1.02 | 131 | ⊕⊝⊝⊝ | Once daily versus thrice daily. | |
| 61 per 1000 | 62 per 1000 | |||||
| Moderate | ||||||
| 61 per 1000 | 62 per 1000 | |||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne study with design limitations. | ||||||
| Antibiotics (short duration) compared with antibiotics (long duration) postpartum for management of intra‐amniotic infection | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Antibiotics (long duration) postpartum | Antibiotics (short duration) | |||||
| Maternal and neonatal mortality | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Wound infection | Study population | RR 1.87 | 292 | ⊕⊕⊝⊝ | ||
| 7 per 1000 | 13 per 1000 | |||||
| Moderate | ||||||
| 7 per 1000 | 13 per 1000 | |||||
| Duration of hospital stay (days) | Mean duration of hospital stay (days) in the intervention groups was | 292 | ⊕⊕⊕⊝ | |||
| Need for additional antibiotic therapy | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Treatment failure (vaginal and cesarean delivery) | Study population | RR 1.31 | 292 | ⊕⊕⊝⊝ | ||
| 35 per 1000 | 46 per 1000 | |||||
| Moderate | ||||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aWide confidence interval crossing the line of no effect and small sample size. | ||||||
| Intrapartum compared with postpartum treatment | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Intrapartum | ||||||
| Maternal and neonatal mortality | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Maternal bacteremia | Study population | RR 2.19 | 45 | ⊕⊝⊝⊝ | ||
| 53 per 1000 | 115 per 1000 | |||||
| Moderate | ||||||
| 53 per 1000 | 116 per 1000 | |||||
| Early neonatal sepsis | Study population | RR 0.08 | 45 | ⊕⊝⊝⊝ | ||
| 211 per 1000 | 17 per 1000 | |||||
| Moderate | ||||||
| 211 per 1000 | 17 per 1000 | |||||
| Neonatal pneumonia or sepsis | Study population | RR 0.06 | 45 | ⊕⊝⊝⊝ | ||
| 316 per 1000 | 19 per 1000 | |||||
| Moderate | ||||||
| 316 per 1000 | 19 per 1000 | |||||
| Maternal postpartum hospital stay (days) | Mean maternal postpartum hospital stay (days) in the intervention groups was | 45 | ⊕⊝⊝⊝ | |||
| Neonatal hospital stay | Mean neonatal hospital stay in the intervention groups was | 45 | ⊕⊝⊝⊝ | |||
| Endometritis/Failure treatment | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne study with serious design limitations. | ||||||
Antecedentes
Descripción de la afección
La corioamnionitis es "un hallazgo histopatológico de inflamación del amnios o el corion" (Fahey 2008) que generalmente se debe a una infección de las membranas fetales, el líquido amniótico y la placenta o la decidua durante el embarazo; representa un riesgo significativo para la morbilidad y la mortalidad infantil y materna. La definición clínica de corioamnionitis puede variar, pero la afección se caracteriza mejor como fiebre materna (100,4 grados Fahrenheit) que no es atribuible a otra causa junto con al menos uno de los siguientes síntomas: taquicardia materna, taquicardia fetal, sensibilidad uterina, leucocitosis materna (recuento de leucocitos mayor de 15 000 ml) y líquido amniótico con olor desagradable (Fishman 2012). También se le puede llamar infección intraamniótica (IIA), amnionitis e infección del líquido amniótico (Incerpi 2010; Tita 2010). La corioamnionitis se puede definir clínica o histológicamente. Se calcula que la corioamnionitis clínica ocurre en el 1% al 2% de los partos a término y en el 5% al 10% de los partos prematuros; la corioamnionitis histológica se presenta en casi el 20% de los partos a término y en el 50% de los partos prematuros (Incerpi 2010).
Pocas pruebas de diagnóstico son específicas y sensibles, así como seguras para la madre y el feto; por lo tanto, la corioamnionitis se diagnostica principalmente mediante la evaluación de signos y síntomas clínicos. Un cultivo del líquido amniótico obtenido por amniocentesis es el estándar de referencia para el diagnóstico, pero se requieren 48 horas para obtener los resultados de la prueba y no hay datos suficientes de reducción de la morbilidad materna o neonatal. Los hemocultivos y los hisopados vaginales son otras pruebas de diagnóstico para la corioamnionitis, pero las pruebas a su favor son limitadas, y algunas recomendaciones indican que los hisopados vaginales no se deben utilizar en los casos de rotura prematura de membranas antes del término (Czikk 2011).
Al igual que la corioamnionitis clínica, la definición de casos de corioamnionitis histológica varía entre los estudios (Holzman 2007), pero en general se puede definir como cambios inflamatorios agudos en el complejo membrana placenta y en la placa coriónica (Yoon 2001). El diagnóstico se hace según la revisión microscópica de muestras placentarias y corioamnióticas (Tita 2010).
La corioamnionitis es provocada con mayor frecuencia por bacterias que ascienden del aparato genital inferior; se observa predominantemente en los casos de rotura de las membranas pero puede ocurrir con las membranas intactas (Fahey 2008). Esta infección también puede ser causada por infección hematógena o transplacentaria, y por infección transuterina a partir de procedimientos invasivos como la amniocentesis o la toma de muestras de vellosidades coriónicas, pero estas vías se tienden a informar con menor frecuencia (Edwards 2005; Fahey 2008).
Generalmente la corioamnionitis es una infección polimicrobiana; en la mayoría de los casos hay dos agentes patógenos detectables, pero la infección puede ser causada por agentes virales y, en casos poco frecuentes, por agentes micóticos (Czikk 2011). Los microorganismos encontrados frecuentemente en el líquido amniótico son Mycoplasma hominis y Ureaplasma urealyticum (Tita 2010), pero otros agentes patógenos incluyen Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis, bacilos Gramnegativos anaerobios como Bacteroides y Gardnerella vaginalis, Escherichia coli y estreptococos anaerobios y del Grupo B (Czikk 2011; Edwards 2005).
El diagnóstico diferencial de la corioamnionitis incluye fiebre asociada a la epidural y otras afecciones extrauterinas y no infecciosas. La fiebre asociada a la epidural se puede considerar cuando las pacientes tienen una epidural intraparto y presentan una fiebre baja pero sin taquicardia materna o fetal ni otros síntomas clínicos. La fiebre y el dolor abdominal son síntomas de infecciones extrauterinas que incluyen infección urinaria, influenza, apendicitis y neumonía. El dolor abdominal sin fiebre puede indicar una enfermedad no infecciosa como tromboflebitis, dolor del ligamento redondo, colitis, trastorno del tejido conectivo y desprendimiento placentario (Tita 2010).
Los factores de riesgo para el desarrollo de la corioamnionitis incluyen estar en trabajo de parto activo durante mucho tiempo, aumento en la duración de la rotura de las membranas y monitorización interna (Newton 1989), líquido amniótico teñido de meconio, un gran número de exámenes vaginales digitales (Seaward 2005), nuliparidad, grupo étnico de afroestadounidenses, hábito de fumar y consumo de alcohol o drogas, anestesia epidural, vaginosis bacteriana y colonización con estreptococo del Grupo B o bacterias Ureaplasma (Tita 2010).
Es preferible prevenir que tratar la corioamnionitis y algunas intervenciones han mostrado que reducen la incidencia de corioamnionitis (Gibbs 2004). Se observó una reducción del 53% de la morbilidad materna debida a corioamnionitis y endometritis en pacientes con embarazo a término que recibieron un programa de tratamiento activo del trabajo de parto comparado con el tratamiento tradicional (López‐Zeno 1992). En los embarazos a término complicados con rotura prematura de membranas (RPM) antes del término, el tratamiento de inducción inmediata con oxitocina dio lugar a menos casos de corioamnionitis en comparación con el tratamiento conservador (Mozurkewich 1997), y en los embarazos prematuros con RPM la administración de antibióticos de amplio espectro mostró una disminución de la corioamnionitis (Kenyon 2013).
Descripción de la intervención
Algunos aspectos del momento de administración de la antibioticoterapia (intraparto, posparto, o intraparto y posparto combinados), el régimen antibiótico y la duración de la antibioticoterapia se han evaluado en situaciones individuales pero no de manera exhaustiva (Fishman 2012). Una revisión Cochrane anterior (Hopkins 2002) identificó dos ensayos controlados aleatorios que evaluaron la administración de ampicilina y gentamicina para el tratamiento intraparto de las pacientes con infección intraamniótica versus el tratamiento posparto y la administración de ampicilina / gentamicina / clindamicina versus ampicilina / gentamicina; ninguno de los resultados mostró diferencias estadísticamente significativas entre las diferentes intervenciones.
De qué manera podría funcionar la intervención
El tratamiento de la corioamnionitis consiste generalmente en antibióticos que se pueden administrar intraparto o inmediatamente en el posparto. Como la infección puede ser causada por una gran variedad de microorganismos, es necesario el tratamiento con antibióticos de amplio espectro. La atención estándar habitual consiste en clindamicina para las bacterias anaerobias y grampositivas y gentamicina para las bacterias aeróbicas y gramnegativas (Mtira 1997).
Por qué es importante realizar esta revisión
La corioamnionitis es una infección frecuente que afecta a la madre y al feto. Las complicaciones infantiles asociadas con la corioamnionitis incluyen sepsis neonatal temprana, neumonía, meningitis (Incerpi 2010),asma (Getahun 2010), parálisis cerebral (Wu 2000),hemorragia intraventricular (Edwards 2005),y leucomalacia periventricular (Edwards 2005; Rocha 2007). Aunque las complicaciones fetales son más frecuentes, la corioamnionitis también puede dar lugar a morbilidad materna como infección pelviana y shock séptico (Incerpi 2010). El riesgo de un parto por cesárea es dos a tres veces mayor en las pacientes con corioamnionitis y tres a cuatro veces mayor para las que presentan endomiometritis, infección de la herida, absceso pelviano, bacteriemia y hemorragia posparto (Tita 2010).
Hace diez años se realizó una revisión Cochrane para estudiar los efectos de los regímenes antibióticos maternos para la infección intraamniótica sobre la morbilidad y mortalidad materna y perinatal (Hopkins 2002). Esta revisión identificó dos estudios elegibles y las conclusiones fueron limitadas debido al escaso número de estudios identificados. No se observaron diferencias estadísticamente significativas en los resultados; por lo tanto, los revisores no pudieron hacer recomendaciones sobre el momento de administración del tratamiento antibiótico (intraparto versus posparto). Además, hasta el momento ninguna revisión sistemática Cochrane ha evaluado estudios en los que el tratamiento antibiótico para la corioamnionitis se administrara durante el período posparto. Actualmente no hay información suficiente que muestre el régimen antimicrobiano más apropiado para el tratamiento de las pacientes con infección intraamniótica, si se debe continuar la administración de antibióticos durante el período posparto, qué régimen antibiótico se debe administrar y cuál debe ser la duración del tratamiento. Esta revisión actualiza la revisión Hopkins 2002 con referencias nuevas y un mayor alcance, para incluir regímenes antibióticos durante el período posparto.
Objetivos
Evaluar los efectos de administrar regímenes antibióticos para la infección intraamniótica sobre la morbilidad y la mortalidad materna y perinatal y las complicaciones relacionadas con la infección.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron todos los ensayos controlados con asignación aleatoria individual y grupal que comparan tratamiento con antibióticos versus placebo o ningún tratamiento. También se incluyeron los ensayos que compararon diferentes antibióticos o regímenes. Se incluyeron los ensayos de antibióticos intraparto para la infección intraamniótica y los ensayos que compararon regímenes intraparto versus posparto.
Se excluyeron los estudios que utilizaron métodos inapropiados de asignación al azar, así como los ensayos cruzados (crossover) y los ensayos cuasialeatorios.
Tipos de participantes
Pacientes que presentaban infección intraamniótica. El diagnóstico se basó en criterios estándar (clínicos / pruebas). No hubo límite para la edad gestacional.
Tipos de intervenciones
Los ensayos se incluyeron si compararon el tratamiento con antibióticos versus placebo o ningún tratamiento (de ser aplicable), el tratamiento con diferentes regímenes antibióticos, o el momento de administración de la antibioticoterapia (intraparto o posparto). Por lo tanto, la revisión incluyó ensayos que evaluaron los antibióticos intraparto, los regímenes antibióticos intraparto y posparto y los antibióticos posparto.
Tipos de medida de resultado
Resultados primarios
-
Mortalidad maternal y neonatal.
-
Infección materna y neonatal grave.
-
Duración de la estancia hospitalaria materna y neonatal.
Resultados secundarios
-
Necesidad de tratamiento antibiótico adicional.
-
Endometritis.
-
Días con fiebre.
-
Reingreso posparto por endometritis.
-
Fracaso del tratamiento.
-
Hemocultivos y otras pruebas de diagnóstico (hallazgos positivos).
-
Número de dosis de antibiótico(s).
-
Complicaciones relacionadas con la infección.
-
Eventos adversos (p.ej., reacciones alérgicas, diarrea asociada con el antibiótico, desarrollo de resistencia bacteriana).
-
Interrupción o cese de la lactancia.
Results
Description of studies
Results of the search
A search of the Cochrane Pregnancy and Childbirth Group's Register yielded 22 reports. We retrieved 94 from CENTRAL, 84 from MEDLINE, 606 from Embase, 181 from LILACS, and 10 from the WHO International Clinical Trials Registry Platform (ICTRP) (see Figure 1). An initial trawl through this list, undertaken by two review authors (LR and EC), excluded 369 references that did not comply with the inclusion criteria. We screened 24 trials: We excluded five and included 11 randomized controlled trials (RCTs) (17 reports). Two trials are ongoing (Aziz 2009; Shanks 2012).
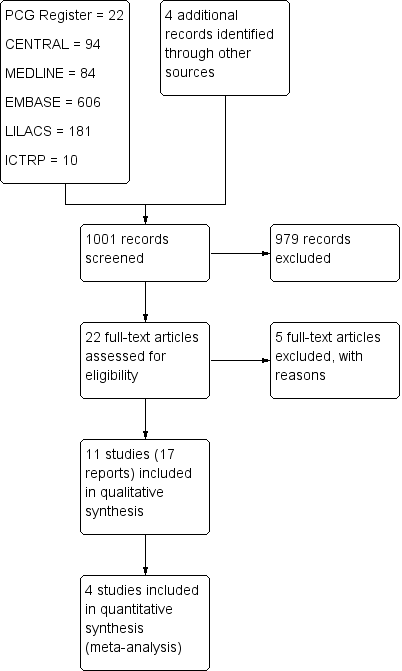
Study flow diagram.
Included studies
Only one out of 11 RCTs that met the inclusion criteria was published as an abstract (Adashek 1998).
Design
All included studies were RCTs.
Settings
Most trials were conducted in the United States of America, usually by the Deparment of Obstetrics and Gynecology of an academic institution; only one study was conducted in Italy (Scalambrino 1989).
Participants
The 11 included studies provided data from a total of 1296 women. Inclusion criteria varied with respect to gestational age, labor status (active, undergoing an induction, cesarean section), maternal age, and definition of chorioamnionitis, among others. Some trials included women who required cesarean delivery (Berry 1994; Chapman 1997; Edwards 2003; Gibbs 1988; Mitra 1997; Turnquest 1998).
The main characteristics of included studies are detailed in the Characteristics of included studies table.
Interventions
During labor
Four studies compared varied regimens or doses of antibiotics versus the same or other antibiotics in labor (Locksmith 2005; Lyell 2010; Maberry 1991; Scalambrino 1989). Locksmith 2005 evaluated the use of two different doses of gentamicin. Lyell 2010 compared the effects of shorter versus longer use of gentamicin: Women in one group received a single dose of gentamicin 5 mg/kg followed by saline placebo, and those in the other group were given gentamicin 1.5 mg/kg every eight hours. In the study of Locksmith 2005, group one received 5.1 mg/kg once daily, and group two was given 80 mg every eight hours. Although the interventions were not exactly the same, data from the two studies were pooled.
Maberry 1991 assessed the effects of using dual‐agent therapy (ampicillin/gentamicin) or triple‐agent therapy (ampicillin/gentamicin/clindamycin). Finally Scalambrino 1989 evaluated the use of sulbactam/ampicillin versus cefotetan.
No trial was found that compared antibiotics versus no treatment or placebo during labor exclusively. In the trial of Lyell 2010, women were assigned to daily gentamicin 5 mg/kg intravenously (IV), followed by a normal saline placebo after eight hours and after 16 hours.
Postpartum
Six studies assessed the use of antibiotics during the postpartum period.
Turnquest 1998 evaluated the use of clindamycin and gentamicin versus no scheduled postoperative antibiotics in women with a clinical diagnosis of chorioamnionitis treated with ampicillin during labor and who required cesarean delivery for obstetric indications.
Two studies compared the use of antibiotics (gentamicin/clindamycin (Adashek 1998) and ampicillin/gentamicin (Berry 1994)) versus placebo after vaginal delivery.
One study evaluated the effectiveness of once‐daily versus thrice‐daily gentamicin/clindamycin (Mitra 1997). Two studies evaluated the effects of short versus long periods of antibiotic treatment (ampicillin/gentamicin (Edwards 2003) and cefotetan (Chapman 1997)) after delivery.
Intrapartum versus postpartum
One trial assessed the use of ampicillin/gentamicin during intrapartum versus immediate postpartum (Gibbs 1988).
Outcomes
Although most studies reported at least one prespecified primary outcome of this review, differences in reporting and definitions of outcomes were noted. For example, treatment failure was clinically defined in different ways, and adverse events were not frequently reported.
Length of follow‐up
Participants were followed up until the time of discharge from the institution. Some trials reported longer periods of follow‐up. Gibbs 1988 reported that four weeks after discharge, the mother was contacted by telephone or by letter and hospital records were assesssed for readmission. Lyell 2010 reported that participants were called after 10 days post discharge. Turnquest 1998 reported that all participants were scheduled to return to the postpartum clinic six weeks after hospital discharge. Mitra 1997 stated that relapse was defined as a cure with subsequent wound infection, abscess, or recurrent endometritis up to six weeks after delivery. Berry 1994 reported that participants were given six‐week postpartum clinic appointments and strict discharge instructions to return. Chapman 1997 stated that a research nurse called each woman within the first week to determine whether she had additional symptoms to report.
Funding source
Only three studies described the source of funds (Berry 1994; Edwards 2003; Lyell 2010).
Excluded studies
A total of five studies were excluded for the following reasons: inadequate randomization (strict alternation); non‐RCT; inadequate reporting (outcome data not provided); very small sample size (five women randomly assigned as part of a trial with broader inclusion criteria). Reasons for exclusion are detailed in the Characteristics of excluded studies table. Ten studies were found in the ICTRP database, and two ongoing RCTs complied with inclusion criteria (Aziz 2009; Shanks 2012); no report of the study results was available in clinicaltrials.gov.
Risk of bias in included studies
Overall studies had moderate risk of bias, mainly because allocation concealment, methods of sequence generation, blinding, and selective reporting were not adequately reported. In addition, it was not clear whether follow‐up was similar for the treatment groups.
Sequence generation and allocation concealment
Sequence generation
Nine RCTs adequately reported methods of generation of randomization, which was attained by using a random number table or a computer‐generated random number table (Berry 1994; Chapman 1997; Edwards 2003; Locksmith 2005; Lyell 2010; Maberry 1991; Mitra 1997; Turnquest 1998) or by flipping a coin (Gibbs 1988). The other two RCTs did not report how randomization was performed.
Allocation concealment
Seven trials adequately reported how allocation concealment was maintained (Berry 1994; Chapman 1997; Edwards 2003; Locksmith 2005; Lyell 2010; Mitra 1997; Turnquest 1998). In these RCTs, allocation concealment was ensured by the use of sealed, opaque, sequentially numbered envelopes or by similar labels for placebo and antibiotic containers provided by the pharmacist (who was the only one to know assignment).
In one RCT (Gibbs 1988), although sealed envelopes were used, no further description was provided. The other three RCTs (Adashek 1998; Maberry 1991; Scalambrino 1989) did not report how allocation concealment was performed and were rated as having unclear risk of bias.
Blinding
Most of the studies were open RCTs, and no blinding of participants, clinicians, or researchers was reported. Berry 1994 conducted a "double‐blind" trial in which the pharmacy labeled placebo and antibiotic containers alike. Only when failure of treatment occurred did the pharmacy reveal treatment or placebo status. In the double‐blind trial conducted by Lyell 2010, the primary outcome was determined on the basis of chart review and follow‐up phone calls by a single provider who was blinded to group allocation. In another trial (Locksmith 2005), reviewers who assessed outcomes were blinded to assignment of women to treatment groups.
Incomplete outcome data
Six studies adequately reported losses to follow‐up (Berry 1994; Chapman 1997; Edwards 2003; Locksmith 2005; Lyell 2010; Maberry 1991). However, it is important to note that different lengths of follow‐up were reported. Adverse outcomes and complications frequently were not defined and were not reported in a standardized way. Five trials were assessed as having 'unclear' risk of attrition bias (Adashek 1998; Gibbs 1988; Mitra 1997; Scalambrino 1989; Turnquest 1998).
Selective reporting
Most RCTs were judged as having unclear risk of reporting bias, mainly because information was insufficient to permit a judgment. One study (Lyell 2010) was assessed as having low risk of bias; this study was registered at clinicaltrials.gov and reported prespecified outcomes.
Other potential sources of bias
Seven studies were assessed as having low risk of bias (Berry 1994; Chapman 1997; Edwards 2003; Locksmith 2005; Lyell 2010; Maberry 1991; Turnquest 1998).
Three studies were assessed as having unclear risk of bias. In one study, baseline characteristics of the groups were not reported (Adashek 1998). In the Gibbs 1988 study, the intrapartum group was significantly older than the postpartum group (P = 0.03). Finally, Mitra 1997 reported that 65.7% of participants in the conventional arm were delivered by cesarean section, whereas 52.6% of women in the experimental arm had a cesarean delivery (P value 0.03).
Effects of interventions
See: Summary of findings for the main comparison Antibiotics versus antibiotics in labor for management of intra‐amniotic infection; Summary of findings 2 Antibiotics versus no treatment during postpartum period for management of intra‐amniotic infection; Summary of findings 3 Antibiotics versus placebo during postpartum period for management of intra‐amniotic infection; Summary of findings 4 Antibiotic versus antibiotics during postpartum period for management of intra‐amniotic infection; Summary of findings 5 Antibiotics (short duration) compared with antibiotics (long duration) postpartum for management of intra‐amniotic infection; Summary of findings 6 Intrapartum compared with postpartum treatment
During labor
Comparison 1. Antibiotic versus no treatment
No studies comparing antibiotics versus no treatment were identified.
Comparison 2. Antibiotic versus placebo
No studies comparing antibiotics versus placebo were identified.
Comparison 3. Antibiotics versus antibiotics
Four studies compared varied regimens or doses of antibiotics versus the same or other antibiotics in labor.
Primary outcomes
Meta‐analysis of two studies (Locksmith 2005;Lyell 2010) found no significant differences in the rate of neonatal sepsis (163 neonates; risk ratio (RR) 1.07, 95% confidence interval (CI) 0.40 to 2.86; I2 = 9%; Analysis 3.8) when two different dosages/regimens of gentamicin were assessed.
No statistically significant difference in maternal postpartum stay was found in individual studies when groups of treatment were compared (one study, 125 women; mean difference (MD) 0.00, 95% CI ‐0.43 to 0.43; Analysis 3.6). No maternal deaths were reported in any treatment groups.
In another study (Maberry 1991), which evaluated the effects of dual‐agent therapy (ampicillin/gentamicin) or triple‐agent therapy (ampicillin/gentamicin/clindamycin), no significant differences were found between groups in rates of neonatal sepsis (one trial, 133 neonates; RR 0.93, 95% CI 0.06 to 14.52; Analysis 3.16 ) or neonatal death (one trial, 133 neonates; RR 1.39, 95% CI 0.24 to 8.06; Analysis 3.17).
Finally Scalambrino 1989 reported no maternal deaths when evaluating the use of sulbactam/ampicillin versus cefotetan (Analysis 3.12).
Secondary outcomes
Meta‐analysis of two studies (Locksmith 2005;Lyell 2010) showed no significant differences in rates of treatment failure (endometritis) (RR 0.86, 95% CI 0.27 to 2.70; two studies; 163 participants (Analysis 3.1) or postpartum hemorrhage (RR 1.39, 95% CI 0.76 to 2.56; 163 participants; Analysis 3.4) when two different dosages/regimens of gentamicin were assessed.
No statistically significant differences were found in other maternal or neonatal outcomes in individual studies: initial successful response to antibiotics (one trial, 125 women; RR 1.05, 95% CI 0.94 to 1.17; Analysis 3.2); maximum maternal temperature (one trial, 125 women; MD 0.40, 95% CI ‐0.45 to 1.25; Analysis 3.3); blood transfusion (one trial, 125 women; RR 0.76, 95% CI 0.18 to 3.27; Analysis 3.5); histologic chorioamnionitis (one trial, 125 women; RR 0.92, 95% CI 0.63 to 1.33; Analysis 3.7); respiratory distress syndrome (one trial, 125 neonates; RR 1.69, 95% CI 0.42 to 6.78; Analysis 3.9); and neonatal antibiotics days (one trial, 125 neonates; MD 0.20, 95% CI ‐0.37 to 0.77; Analysis 3.10) when treatment groups were compared.
In another study (Maberry 1991) evaluating the effects of dual‐agent therapy (ampicillin/gentamicin) versus triple‐agent therapy (ampicillin/gentamicin/clindamycin), no significant differences were found between groups in rates of postpartum endometritis (one trial, 133 women; RR 1.86, 95% CI 0.67 to 5.14; Analysis 3.13) (vaginal: one trial, 73 women; RR 9.63, 95% CI 0.55 to 167.95; Analysis 3.14; or cesarean section: one trial, 60 women; RR 1, 95% CI 0.32 to 3.10; Analysis 3.15); intraventricular hemorrhage (one trial, 133 neonates; RR 4.64, 95% CI 0.23 to 94.90; Analysis 3.18); respiratory distress syndrome (one trial, 133 neonates; RR 1.11, 95% CI 0.36 to 3.47; Analysis 3.19), or neonatal seizures (one trial, 133 neonates; RR 0.93, 95% CI 0.06 to 14.52; Analysis 3.20).
Postpartum
Comparison 4. Antibiotic versus no treatment
Only one study (Turnquest 1998) evaluated use of clindamycin and gentamicin versus no scheduled postoperative antibiotics.
Primary outcomes
No significant differences among groups were found in rates of neonatal sepsis (one trial, 116 neonates; RR 1.11, 95% CI 0.23 to 5.27; Analysis 4.3) and neonatal death (one trial, 116 neonates; RR 3.32, 95% CI 0.14 to 79.88; Analysis 4.4).
Secondary outcomes
No significant differences among groups were found in rates of postpartum endometritis (one trial, 116 women; RR 1.48, 95% CI 0.68 to 3.24; Analysis 4.1); wound infection (one trial, 116 women; RR 0.37, 95% CI 0.04 to 3.45; Analysis 4.2); and transient tachypnea (one trial, 116 neonates; RR 0.83, 95% CI 0.19 to 3.55; Analysis 4.5).
Comparison 5. Antibiotic versus placebo
Primary outcomes
One study evaluating the use of antibiotics versus placebo after vaginal delivery (Berry 1994) reported no cases of sepsis (Analysis 5.4).
Secondary outcomes
Meta‐analysis of two studies (Adashek 1998; Berry 1994) that evaluated use of antibiotics versus placebo after vaginal delivery showed no differences in the rate of treatment failure (two trials, 288 women; RR 0.97, 95% CI 0.14 to 6.77; I2 = not estimable; Analysis 5.1). Both studies reported that no women in either allocated group developed postpartum endometritis. Berry 1994 also reported no cases of wound infection (Analysis 5.3) or required readmission to the hospital (Analysis 5.5).
Comparison 6. Different dosages/regimens of antibiotics
Primary outcomes
Not reported.
Secondary outcomes
One study (Mitra 1997) evaluated the effectiveness of once‐daily versus thrice‐daily gentamicin/clindamycin and found no differences in the rate of treatment failure (one trial, 131 women; RR 1.02, 95% CI 0.27 to 3.89; Analysis 6.1) and nephrotoxicity (no cases in any arm; Analysis 6.2) or in mean days of length of treatment (one trial, 131 women; MD ‐0.30, 95% CI ‐.90 to 0.30; Analysis 6.3).
Comparison 7. Antibiotics versus antibiotics
Primary outcomes
A significant difference favoring the short arm of treatment was found in one study (Edwards 2003) in mean duration of hospital stay (one trial, 292 women; MD ‐0.90, 95% CI ‐1.64 to ‐0.16; Analysis 7.1).
Secondary outcomes
Meta‐analysis of two studies (Chapman 1997; Edwards 2003) revealed no significant differences in the rate of treatment failure when vaginal delivery was assessed (284 women; average RR 1.46, 95% CI 0.39 to 5.51; Tau² = 0.33; I2 = 36%; Analysis 7.4). In addition, no significant differences were found in one study in rates of treatment failure with vaginal and cesarean delivery (one trial, 292 women; RR 1.31, 95% CI 0.42 to 4.02; Analysis 7.2), treatment failure with cesarean delivery (one trial, 117 women; RR 3.31, 95% CI 0.38 to 28.75; Analysis 7.3), wound infection (one trial, 292 women; RR 1.87, 95% CI 0.17 to 20.37; Analysis 7.5), and pelvic abscess (one trial, 292 women; RR 2.80, 95% CI 0.12 to 68.24; Analysis 7.6).
Intrapartum versus postpartum
Comparison 8. Antibiotics versus antibiotics
Primary outcomes
One study (Gibbs 1988) evaluated the use of ampicillin/gentamicin during intrapartum versus immediate postpartum and found significant differences favoring the intrapartum group in mean number of days of maternal postpartum hospital stay (one trial, 45 women; MD ‐1.00, 95% CI ‐1.94 to ‐0.06; Analysis 8.2) and mean number of neonatal hospital stay days (one trial, 45 neonates; MD ‐1.90, 95% CI ‐3.31 to ‐0.49; Analysis 8.7). Although no clear differences were found in rates of maternal bacteremia (one trial, 45 women; RR 2.19, 95% CI 0.25 to 19.48; Analysis 8.4) and early neonatal sepsis (one trial, 45 neonates; RR 0.08, 95% CI 0.00 to 1.44; Analysis 8.5), and a significant difference favoring intrapartum treatment was noted in relation to the outcome of neonatal pneumonia or sepsis (one trial, 45 neonates; RR 0.06, 95% CI 0.00 to 0.95; Analysis 8.6).
Secondary outcomes
One study (Gibbs 1988) evaluated the use of ampicillin/gentamicin during intrapartum versus immediate postpartum and found significant differences favoring the intrapartum group in mean maternal febrile days (Analysis 8.3).
Discusión
Resumen de los resultados principales
Esta revisión actualiza una revisión Cochrane anterior (Hopkins 2002) con referencias nuevas y amplía el alcance de la revisión para incluir regímenes antibióticos durante el período posparto.
Aunque la revisión identificó 11 estudios elegibles, no hay información suficiente que muestre el régimen antimicrobiano más apropiado para el tratamiento de las pacientes con infección intraamniótica, si se debe continuar la administración de antibióticos durante el período posparto, ni qué régimen antibiótico se debe administrar o cuánto debe durar el tratamiento. Con respecto a los resultados primarios maternos, cuatro estudios proporcionaron datos sobre la estancia hospitalaria materna (Edwards 2003; Gibbs 1988; Lyell 2010; Mitra 1997) y dos sobre la infección grave (Berry 1994; Gibbs 1988); cinco proporcionaron datos sobre la infección neonatal grave (Gibbs 1988; Locksmith 2005; Lyell 2010; Maberry 1991; Turnquest 1998) y uno sobre la estancia hospitalaria neonatal (Gibbs 1988).
Durante el trabajo de parto
No se encontraron diferencias significativas entre los grupos en cualquier resultado primario materno o neonatal informado cuando se evaluaron dos dosis / regímenes diferentes de gentamicina. El metanálisis de dos estudios no encontró diferencias significativas en la tasa de sepsis neonatal (pruebas de baja calidad), el fracaso del tratamiento (endometritis) (pruebas de baja calidad) ni la hemorragia posparto (pruebas de baja calidad). La revisión no identificó datos para una comparación de antibióticos versus ningún tratamiento / placebo.
Posparto
No se encontraron diferencias significativas en las tasas de muerte neonatal y endometritis posparto cuando se comparó la administración de antibióticos con ningún tratamiento. El metanálisis de dos estudios que evaluaron la administración de antibióticos versus placebo después del parto vaginal no mostró diferencias significativas entre los grupos en las tasas de fracaso del tratamiento o endometritis posparto. Cuatro ensayos que evaluaron dos dosis / regímenes diferentes de gentamicina o el tratamiento con agente dual versus el tratamiento con agente triple, o que compararon antibióticos, no encontraron diferencias significativas en la mayoría de los resultados neonatales informados; sin embargo, la duración de la estancia hospitalaria mostró una diferencia a favor del grupo de pacientes que recibieron antibióticos de corta duración (pruebas de calidad moderada).
Intraparto versus posparto
Según los resultados de un ensayo controlado aleatorio (ECA) pequeño (con datos de 45 pacientes), se encontró que el tratamiento antibiótico antes del parto fue superior al tratamiento antibiótico posparto en el número medio de días de estancia hospitalaria materna posparto y neonatal y en las tasas de neumonía o sepsis neonatal. No obstante, este estudio tiene riesgo incierto de sesgo para todos los dominios excepto la generación de la secuencia aleatoria y se consideró que el nivel de las pruebas fue muy bajo para todos los resultados. Cuando se evaluaron los estudios realizados en el período anteparto, no se encontraron pruebas de que la administración de una dosis mayor de antibióticos sea superior a la administración de una dosis inferior para mejorar los resultados neonatales y maternos. Con respecto al período posparto, no se encontraron pruebas de que la administración de diferentes tipos de antibióticos o períodos de tratamiento más largos o más cortos mejoraran los resultados neonatales y maternos. Debe señalarse que todas las pacientes que participaron en los ensayos posparto recibieron antibióticos durante el período anteparto.
Compleción y aplicabilidad general de las pruebas
Aunque en esta revisión se incluyeron números razonables de ECA y participantes, los datos están incompletos para varios resultados clínicamente importantes y fue posible agrupar pocos datos de la mayoría de las comparaciones. Por ejemplo, los datos sobre los resultados primarios preespecificados (mortalidad materna o neonatal; infección materna o neonatal grave; y duración de la estancia hospitalaria materna o neonatal) solamente estuvieron disponibles en unos pocos estudios.
Se observaron diferencias en los criterios de inclusión y en las definiciones de los resultados, lo que dificultó interpretar los resultados de la revisión y determinar su aplicabilidad. Las medidas de resultado como "fracaso del tratamiento" se definieron clínicamente de diferentes maneras; los tiempos de seguimiento fueron heterogéneas; y los eventos adversos con frecuencia no se informaron e incluso no se definieron. Por lo tanto, los resultados presentados en esta revisión son todavía limitados.
La aplicabilidad de las pruebas fuera del contexto de estudios de investigación es razonable, ya que todos estos estudios se realizaron en ámbitos clínicos que fueron muy similares. Las comparaciones descritas en la revisión se realizan con frecuencia y son fáciles de aplicar. En su mayoría los ensayos se realizaron en los Estados Unidos de América y no se incluyeron estudios de países de ingresos bajos o medios.
En los ensayos incluidos se evaluaron los siguientes antibióticos: ampicilina, ampicilina / sulbactam, gentamicina, clindamicina y cefotetán. La resistencia es un fenómeno creciente y muchos factores pueden influir en la administración y la resistencia a los antibióticos a nivel de país (Lamont 2014).
Debido a estas limitaciones no fue posible generar pruebas definitivas sobre los efectos de los antibióticos en las pacientes con infección intraamniótica.
Calidad de la evidencia
La calidad de las pruebas fue baja a muy baja para la mayoría de los resultados, al igual que para el enfoque GRADE. Solamente un resultado, duración de la estancia hospitalaria, (comparación de antibióticos de corta duración versus antibióticos de larga duración posparto para el tratamiento de la infección intraamniótica) se consideró que proporcionó pruebas de calidad moderada. Los motivos principales para la disminución de la calificación de calidad de las pruebas fueron las limitaciones en el diseño o la realización del estudio (riesgo de sesgo), la falta de precisión y la inconsistencia de los resultados.
El riesgo de sesgo de los ECA fue principalmente bajo o incierto, y muchos estudios tuvieron tamaños de la muestra pequeños. En general los estudios tuvieron riesgo moderado de sesgo (ver Figura 2; Figura 3), principalmente debido a que los métodos de ocultación de la asignación no se informaron adecuadamente y no se realizó cegamiento. Los métodos utilizados para la generación de la secuencia se informaron de manera adecuada en la mayoría de los ensayos.
La pérdida de participantes en los ensayos incluidos fue en general baja, aunque los tamaños de la muestra fueron pequeños en algunos de ellos; además, la mayoría de los estudios no informó cómo se calculó el tamaño de la muestra. Otra limitación fue el informe incompleto de resultado (p.ej., en varios ECA no se proporcionaron las desviaciones estándar de los resultados continuos); no se informaron las características iniciales, o se observaron diferencias estadísticamente significativas en las características iniciales entre los grupos de tratamiento. Además, ninguno de los ECA informó todos los resultados primarios preespecificados en esta revisión.
Se observó un alto grado de heterogeneidad entre los estudios en cuanto a las intervenciones evaluadas, los tratamientos concomitantes (otros antibióticos), los tipos de partos y los resultados evaluados. El sesgo de publicación no se pudo evaluar debido al pequeño número de ensayos identificados para cada comparación.
Estos factores dificultan determinar la efectividad de los antibióticos en la infección intraamniótica y limitan la evaluación del riesgo de sesgo.
Cuando se comparó gentamicina diaria versus gentamicina cada ocho horas, el fracaso del tratamiento (endometritis), la transfusión de sangre, la estancia hospitalaria posparto materna, la sepsis neonatal y el síndrome de dificultad respiratoria se calificaron como "pruebas de baja calidad" debido al tamaño de la muestra pequeño y a que en el intervalo de confianza se superpone "ningún efecto" (Resumen de los hallazgos para la comparación principal). No fue posible evaluar la muerte materna porque no se informaron eventos para este resultado. Cuando se comparó el tratamiento con agente dual versus tratamiento con agente triple, la calidad de las pruebas para las muertes neonatales se calificó como muy baja porque un estudio tuvo limitaciones en el diseño e intervalos de confianza amplios que cruzan la línea de ningún efecto, con un tamaño de la muestra pequeño.
Cuando se comparó antibióticos versus ningún tratamiento durante el período posparto, la endometritis posparto, la sepsis neonatal y la muerte neonatal se calificaron como pruebas de muy baja calidad debido a las limitaciones en el diseño del estudio y a los intervalos de confianza amplios que cruzan la línea de ningún efecto, con tamaños de la muestra pequeños (Resumen de los hallazgos 2). Ninguno de los estudios incluidos informó los resultados duración de la estancia hospitalaria materna y neonatal, necesidad de antibioticoterapia adicional, reingreso posparto por endometritis ni fracaso del tratamiento.
Cuando se compararon antibióticos versus placebo durante el período posparto, el fracaso del tratamiento se calificó como "pruebas de muy baja calidad" debido a limitaciones en el diseño y a los intervalos de confianza amplios que cruzan la línea de ningún efecto (Resumen de los hallazgos 3). Para el resultado endomiometritis, dos estudios incluidos no informaron eventos. Ninguno de los estudios incluidos informó los resultados mortalidad materna y neonatal, infección materna y neonatal grave, duración de la estancia hospitalaria materna y neonatal, necesidad de antibioticoterapia adicional ni reingreso posparto por endometritis.
Cuando se compararon los antibióticos una vez al día versus tres veces al día durante el período posparto, el fracaso del tratamiento y la duración del tratamiento se calificaron como pruebas de muy baja calidad como resultado de un único estudio con limitaciones en el diseño e intervalos de confianza amplios que cruzan la línea de ningún efecto (Resumen de los hallazgos 4). Ninguno de los estudios incluidos informó los resultados mortalidad materna y neonatal, infección materna y neonatal grave, duración de la estancia hospitalaria materna y neonatal, endometritis ni reingreso posparto por endometritis.
Cuando se compararon los antibióticos de corta duración versus los antibióticos de larga duración administrados durante el período posparto, la duración de la estancia hospitalaria fue significativamente más corta en el grupo de corta duración y la calidad de las pruebas se evaluó como moderada. El fracaso del tratamiento se calificó como "pruebas de baja calidad" debido a los intervalos de confianza amplios que cruzan la línea de ningún efecto (Resumen de los hallazgos 5). Ninguno de los estudios incluidos informó los resultados mortalidad materna y neonatal, necesidad de antibioticoterapia adicional, endometritis ni reingreso posparto por endometritis.
Cuando se comparó el tratamiento intraparto versus posparto, la estancia hospitalaria materna posparto, la bacteriemia materna, la sepsis neonatal temprana, la neumonía o sepsis neonatal y la estancia hospitalaria neonatal se calificaron como riesgo muy bajo porque un único estudio tuvo graves limitaciones en el diseño e intervalos de confianza amplios con un tamaño de la muestra pequeño (Resumen de los hallazgos 6). Ninguno de los estudios incluidos informó los resultados endometritis, fracaso del tratamiento ni mortalidad materna y neonatal.
Sesgos potenciales en el proceso de revisión
Para reducir al mínimo el riesgo de sesgo de publicación se realizó una búsqueda exhaustiva de los estudios. Se encontró que ninguno de los ECA se realizó en países de ingresos bajos o medios y todos los ensayos excepto uno se realizaron en los EE.UU. Debido a la importancia del tema, al parecer no es posible descartar la distorsión de los resultados por este tipo de sesgo.
Aunque se observaron algunas diferencias en las intervenciones y los resultados, se realizaron varios metanálisis. Pequeñas diferencias en las dosis, el régimen o el tipo de antibiótico podrían limitar la interpretación de los hallazgos agrupados. Además, la falta de información con respecto a los resultados principales (p.ej., la desviación estándar alrededor de la media en varios ensayos) no permitió realizar una estimación agrupada en algunos ensayos. Lo anterior puede haber obstaculizado la consideración de toda la información relevante disponible para cada comparación.
Acuerdos y desacuerdos con otros estudios o revisiones
Varias revisiones sistemáticas han evaluado la administración de antibióticos durante el trabajo de parto en otros tipos de infección y en otras afecciones.
Kenyon 2013 encontró que la administración de antibióticos a las pacientes con rotura prematura de membranas redujo significativamente las tasas de corioamnionitis, infección neonatal y otros resultados neonatales, a la vez que aumentó el riesgo de enterocolitis necrosante neonatal (cuando se utilizó co‐amoxiclav); no se encontró una reducción significativa de la mortalidad perinatal.
Ohlsson 2014 evalúo los efectos de los antibióticos intraparto sobre la colonización por estreptococos hemolíticos del Grupo B (EGB) maternos. Los revisores no encontraron información suficiente de ECA bien diseñados y bien realizados para apoyar la administración de antibióticos para reducir la mortalidad por cualquier causa.
Baaqeel 2013 evaluó el momento de administración de antibióticos profilácticos para la cesárea. Aunque la revisión sistemática encontró que "en comparación con la administración intraoperatoria, los antibióticos preoperatorios reducen significativamente la tasa de endometritis", los efectos adversos neonatales se deben evaluar con un tamaño de la muestra más grande.
Además, Siriwachirachai 2010 evaluó la efectividad de la administración de antibióticos profilácticos para el síndrome de aspiración de meconio durante el trabajo de parto; encontró que la administración de antibióticos podría reducir la incidencia de corioamnionitis, pero las pruebas no fueron suficientes con respecto a otros resultados maternos y neonatales (p.ej., reducción de la incidencia de sepsis neonatal). Las pruebas proporcionadas por los ensayos incluidos en esta revisión tuvieron limitaciones similares: Se necesitan ECA bien diseñados con potencia estadística suficiente para identificar diferencias estadísticamente significativas en los principales resultados maternos y neonatales (mortalidad, infecciones graves), así como en los eventos adversos.
Tita 2010 informó que el régimen habitual para tratar la corioamnionitis clínica en el trabajo de parto es la administración intravenosa de ampicilina cada seis horas y gentamicina cada ocho a 24 horas hasta el parto. A menudo se agrega clindamicina cada ocho horas (o metronidazol) cuando se realiza el parto por cesárea.
Otro estudio (Roberts 2012) informó que el 96% de los casos de corioamnionitis histológica ocurrieron sin infección; los autores indicaron que "la infección no es la causa principal de corioamnionitis histológica entre las pacientes de bajo riesgo a término" y, por lo tanto, la inflamación intraamniótica no siempre se debe a infección. Se debe señalar que los autores del estudio informaron que la corioamnionitis histológica estuvo muy asociada con fiebre (69% de las pacientes con fiebre) y se relacionó significativamente con el uso de epidural para el alivio del dolor. Se necesitan estudios de investigación adicionales para determinar la función de otros factores (como el uso de epidural) en la aparición de la fiebre, que es un aspecto clave del diagnóstico intraamniótico. La infección intraamniótica se define con frecuencia como "fiebre materna en asociación con al menos un criterio clínico adicional que incluye taquicardia materna o fetal, leucocitosis materna, sensibilidad uterina u olor desagradable del líquido amniótico" (Fishman 2012).
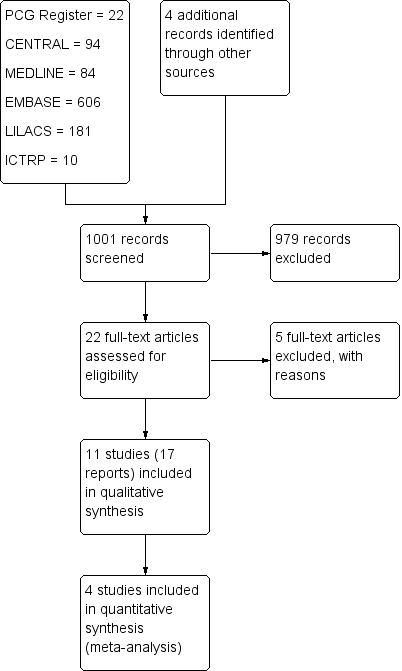
Study flow diagram.
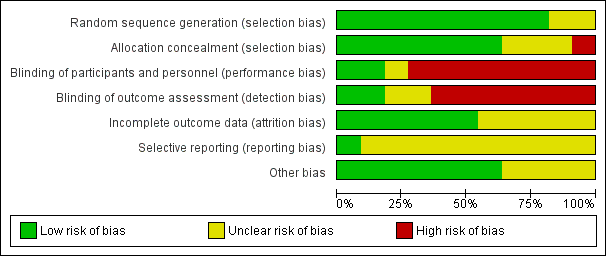
Risk of bias graph: review authors' judgments about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgments about each risk of bias item for each included study.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 1 Treatment failure (endometritis).
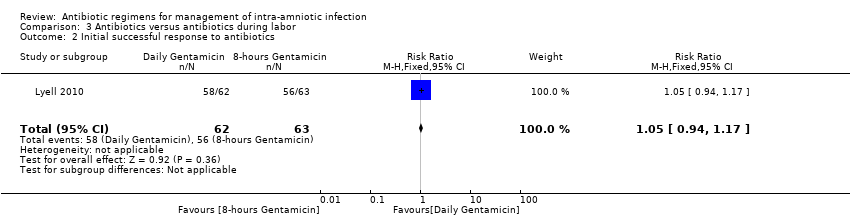
Comparison 3 Antibiotics versus antibiotics during labor, Outcome 2 Initial successful response to antibiotics.
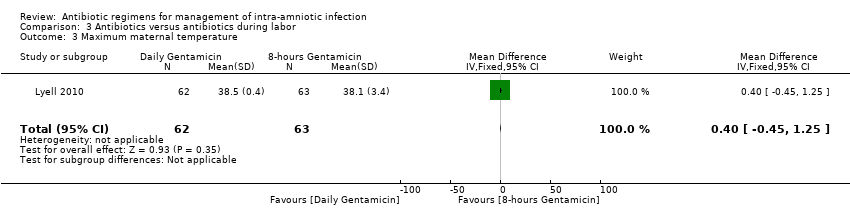
Comparison 3 Antibiotics versus antibiotics during labor, Outcome 3 Maximum maternal temperature.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 4 Postpartum hemorrhage.
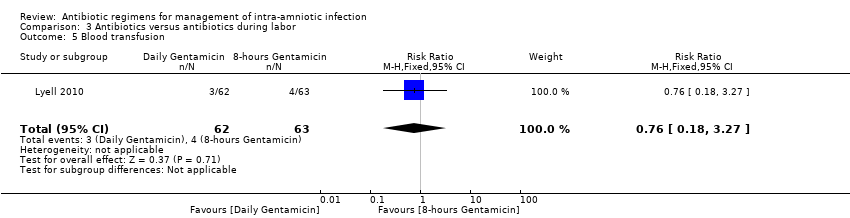
Comparison 3 Antibiotics versus antibiotics during labor, Outcome 5 Blood transfusion.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 6 Maternal postpartum hospital stay (days).

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 7 Histologic chorioamnionitis.
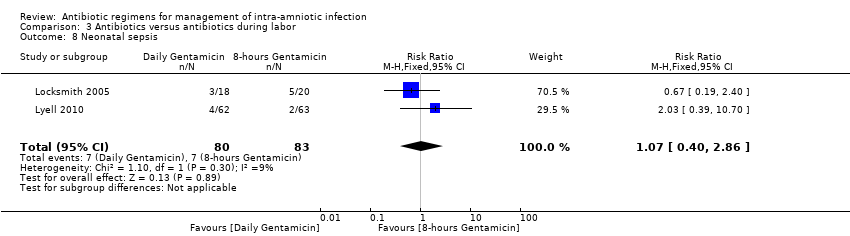
Comparison 3 Antibiotics versus antibiotics during labor, Outcome 8 Neonatal sepsis.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 9 Respiratory distress syndrome.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 10 Neonatal antibiotic (days).

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 11 Treatment failure.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 12 Maternal death.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 13 Postpartum endometritis (double vs triple therapy).
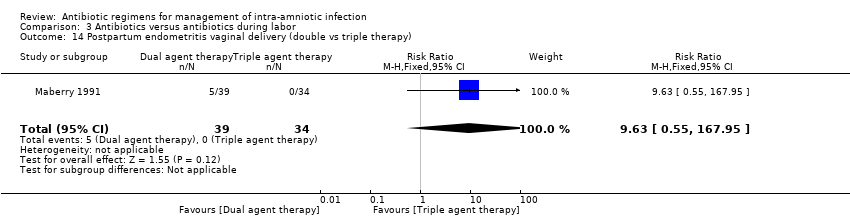
Comparison 3 Antibiotics versus antibiotics during labor, Outcome 14 Postpartum endometritis vaginal delivery (double vs triple therapy).
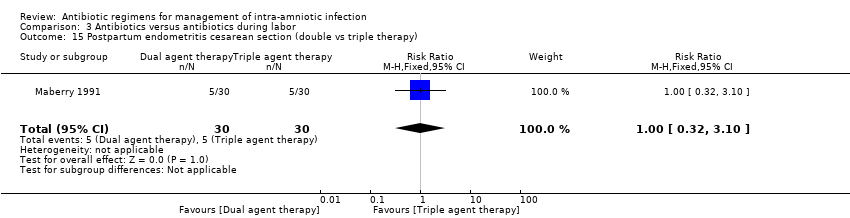
Comparison 3 Antibiotics versus antibiotics during labor, Outcome 15 Postpartum endometritis cesarean section (double vs triple therapy).
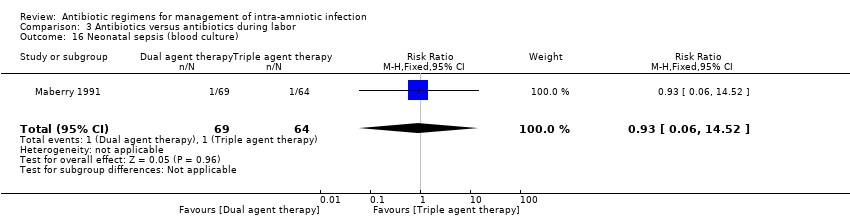
Comparison 3 Antibiotics versus antibiotics during labor, Outcome 16 Neonatal sepsis (blood culture).
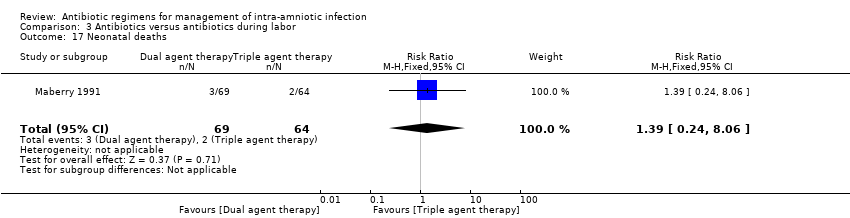
Comparison 3 Antibiotics versus antibiotics during labor, Outcome 17 Neonatal deaths.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 18 Intraventricular hemorrhage.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 19 Respiratory distress syndrome.

Comparison 3 Antibiotics versus antibiotics during labor, Outcome 20 Neonatal seizures.

Comparison 4 Antibiotics versus no treatment during postpartum period, Outcome 1 Postpartum endometritis.

Comparison 4 Antibiotics versus no treatment during postpartum period, Outcome 2 Wound infection.
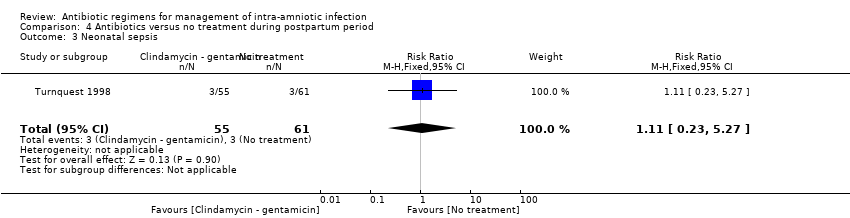
Comparison 4 Antibiotics versus no treatment during postpartum period, Outcome 3 Neonatal sepsis.

Comparison 4 Antibiotics versus no treatment during postpartum period, Outcome 4 Neonatal death.
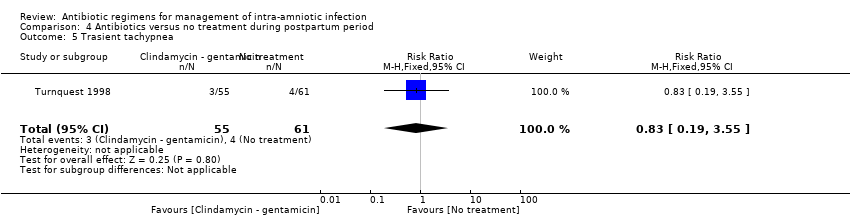
Comparison 4 Antibiotics versus no treatment during postpartum period, Outcome 5 Trasient tachypnea.
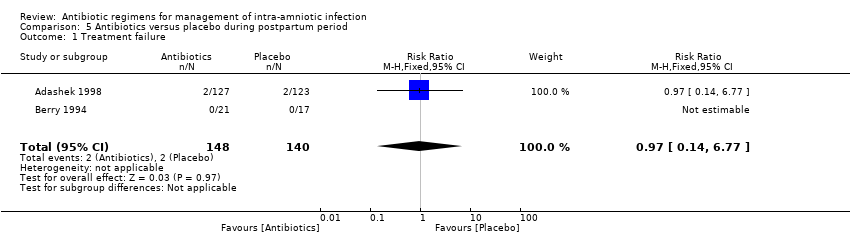
Comparison 5 Antibiotics versus placebo during postpartum period, Outcome 1 Treatment failure.

Comparison 5 Antibiotics versus placebo during postpartum period, Outcome 2 Endomyometritis.
Comparison 5 Antibiotics versus placebo during postpartum period, Outcome 3 Wound infection.
Comparison 5 Antibiotics versus placebo during postpartum period, Outcome 4 Maternal sepsis.
Comparison 5 Antibiotics versus placebo during postpartum period, Outcome 5 Readmission to hospital.
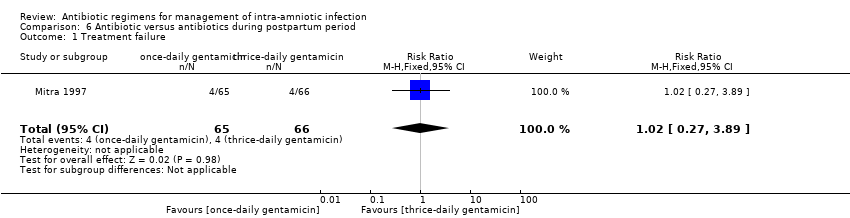
Comparison 6 Antibiotic versus antibiotics during postpartum period, Outcome 1 Treatment failure.

Comparison 6 Antibiotic versus antibiotics during postpartum period, Outcome 2 Nephrotoxicity.
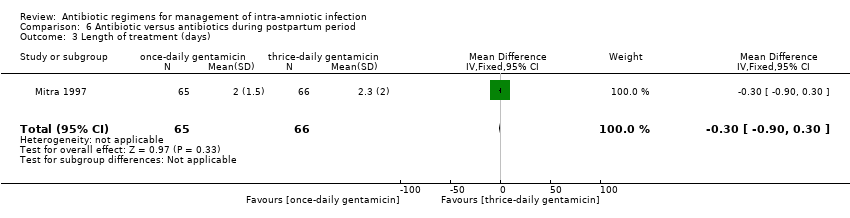
Comparison 6 Antibiotic versus antibiotics during postpartum period, Outcome 3 Length of treatment (days).

Comparison 7 Antibiotics (short duration) versus antibiotics (long duration) in postpartum, Outcome 1 Duration of hospital stay (days).
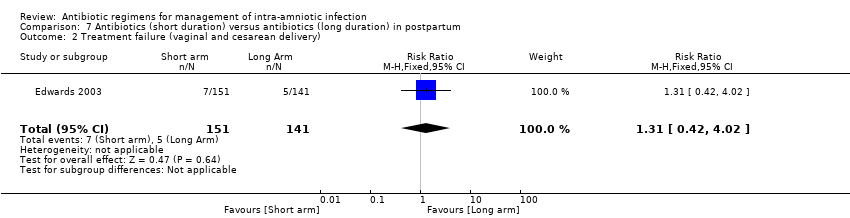
Comparison 7 Antibiotics (short duration) versus antibiotics (long duration) in postpartum, Outcome 2 Treatment failure (vaginal and cesarean delivery).
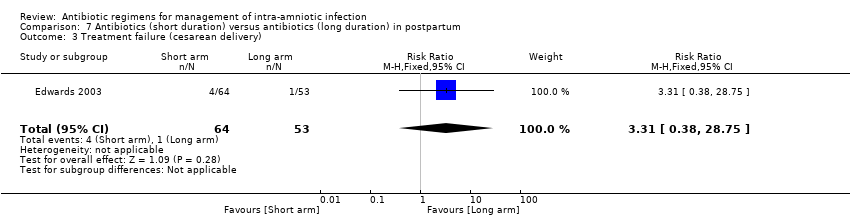
Comparison 7 Antibiotics (short duration) versus antibiotics (long duration) in postpartum, Outcome 3 Treatment failure (cesarean delivery).

Comparison 7 Antibiotics (short duration) versus antibiotics (long duration) in postpartum, Outcome 4 Treatment failure (vaginal delivery).

Comparison 7 Antibiotics (short duration) versus antibiotics (long duration) in postpartum, Outcome 5 Wound infection.

Comparison 7 Antibiotics (short duration) versus antibiotics (long duration) in postpartum, Outcome 6 Pelvic abscess.
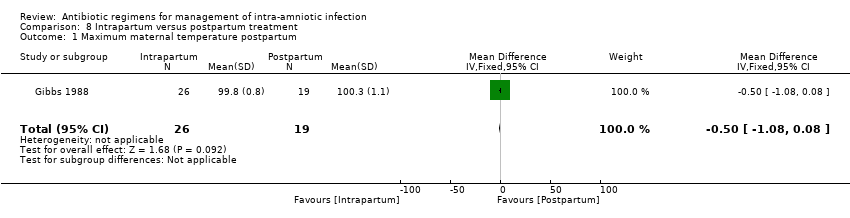
Comparison 8 Intrapartum versus postpartum treatment, Outcome 1 Maximum maternal temperature postpartum.
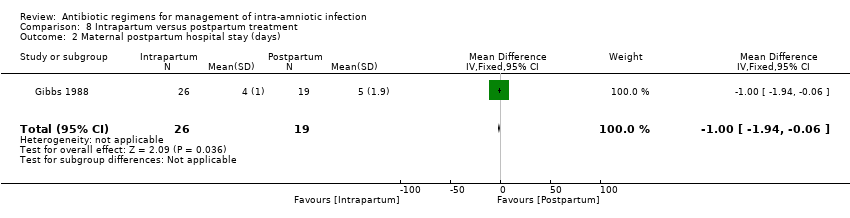
Comparison 8 Intrapartum versus postpartum treatment, Outcome 2 Maternal postpartum hospital stay (days).
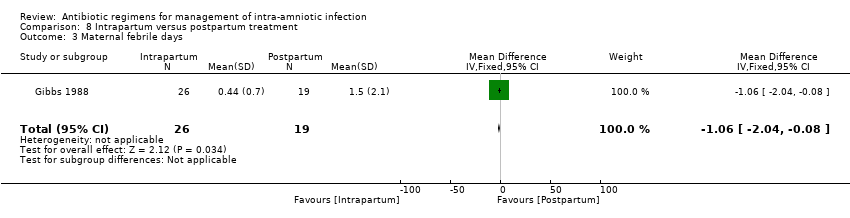
Comparison 8 Intrapartum versus postpartum treatment, Outcome 3 Maternal febrile days.

Comparison 8 Intrapartum versus postpartum treatment, Outcome 4 Maternal bacteremia.
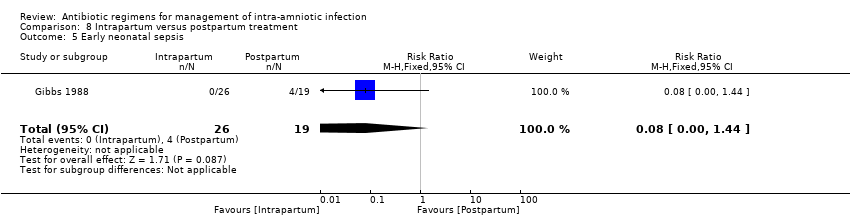
Comparison 8 Intrapartum versus postpartum treatment, Outcome 5 Early neonatal sepsis.

Comparison 8 Intrapartum versus postpartum treatment, Outcome 6 Neonatal pneumonia or sepsis.
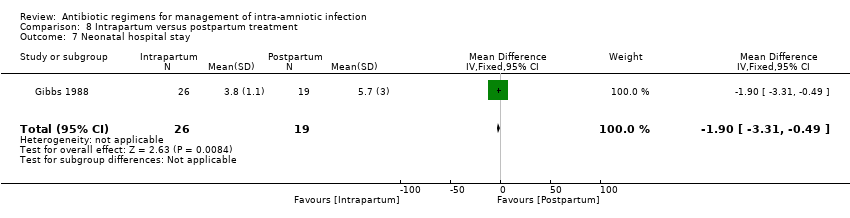
Comparison 8 Intrapartum versus postpartum treatment, Outcome 7 Neonatal hospital stay.
| Antibiotics versus antibiotics in labor for management of intra‐amniotic infection | ||||||
| Population: women in labor with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Antibiotics versus antibiotics | |||||
| Maternal death | See comment | See comment | Not estimable | 38 | See comment | Comparing daily gentamicin versus 8‐hour gentamicin. Outcome was reported with no events. |
| Neonatal deaths | Study population | RR 1.39 | 133 | ⊕⊝⊝⊝ | Comparing dual‐agent therapy versus triple‐agent therapy. | |
| 31 per 1000 | 43 per 1000 | |||||
| Moderate | ||||||
| 31 per 1000 | 43 per 1000 | |||||
| Neonatal sepsis | Study population | RR 1.07 | 163 | ⊕⊕⊝⊝ | Comparing daily gentamicin versus 8‐hour gentamicin. | |
| 84 per 1000 | 90 per 1000 | |||||
| Moderate | ||||||
| 141 per 1000 | 151 per 1000 | |||||
| Respiratory distress syndrome | Study population | RR 1.69 | 125 | ⊕⊕⊝⊝ | Comparing daily gentamicin versus 8‐hour gentamicin. | |
| 48 per 1000 | 80 per 1000 | |||||
| Moderate | ||||||
| 48 per 1000 | 81 per 1000 | |||||
| Maternal postpartum hospital stay (days) | Mean maternal postpartum hospital stay (days) in the intervention groups was | 125 | ⊕⊕⊝⊝ | Comparing daily gentamicin versus 8‐hour gentamicin. | ||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Treatment failure (endometritis) | Study population | RR 0.86 | 163 (2 studies) | ⊕⊕⊝⊝ | Comparing daily gentamicin versus 8‐hour gentamicin. | |
| 72 per 1000 | 62 per 1000 | |||||
| Moderate | ||||||
| 65 per 1000 | 56 per 1000 | |||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aWide confidence interval crossing the line of no effect, few events, and small sample size. | ||||||
| Antibiotics versus no treatment during postpartum period for management of intra‐amniotic infection | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Antibiotics versus no treatment during postpartum period | |||||
| Neonatal death | Study population | RR 3.32 | 116 | ⊕⊝⊝⊝ | ||
| Not estimable | ||||||
| Moderate | ||||||
| Not estimable | ||||||
| Neonatal sepsis | Study population | RR 1.11 | 55 | ⊕⊝⊝⊝ | ||
| 148 per 1000 | 55 per 1000 | |||||
| Moderate | ||||||
| 148 per 1000 | 54 per 1000 | |||||
| Postpartum endometritis | Study population | RR 1.48 | 116 | ⊕⊝⊝⊝ | ||
| 148 per 1000 | 218 per 1000 | |||||
| Moderate | ||||||
| 148 per 1000 | 219 per 1000 | |||||
| Duration of maternal and neonatal hospital stay | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Need for additional antibiotic therapy | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Failure of treatment | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne study with design limitations. | ||||||
| Antibiotics versus placebo during postpartum period for management of intra‐amniotic infection | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Antibiotics versus placebo during postpartum period | |||||
| Maternal and neonatal mortality | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Maternal and neonatal severe infection | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Duration of maternal and neonatal hospital stay | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Endomyometritis | See comment | See comment | Not estimable | 288 | See comment | This outcome was reported with no events. |
| Need for additional antibiotic therapy | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Treatment failure | Study population | RR 0.97 | 288 | ⊕⊝⊝⊝ | The outcome was reported with no events in one study. | |
| 14 per 1000 | 14 per 1000 | |||||
| Moderate | ||||||
| 8 per 1000 | 8 per 1000 | |||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne study with serious design limitations. | ||||||
| Antibiotic versus antibiotics during postpartum period for management of intra‐amniotic infection | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Control | Antibiotic versus antibiotics during postpartum period | |||||
| Maternal and neonatal mortality | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Maternal and neonatal severe infection | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Length of treatment (days) | Mean length of treatment (days) in the intervention groups was | 131 (1 study) | ⊕⊝⊝⊝ Very lowa,b | Once daily versus thrice daily. | ||
| Endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Treatment failure | Study population | RR 1.02 | 131 | ⊕⊝⊝⊝ | Once daily versus thrice daily. | |
| 61 per 1000 | 62 per 1000 | |||||
| Moderate | ||||||
| 61 per 1000 | 62 per 1000 | |||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne study with design limitations. | ||||||
| Antibiotics (short duration) compared with antibiotics (long duration) postpartum for management of intra‐amniotic infection | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Antibiotics (long duration) postpartum | Antibiotics (short duration) | |||||
| Maternal and neonatal mortality | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Wound infection | Study population | RR 1.87 | 292 | ⊕⊕⊝⊝ | ||
| 7 per 1000 | 13 per 1000 | |||||
| Moderate | ||||||
| 7 per 1000 | 13 per 1000 | |||||
| Duration of hospital stay (days) | Mean duration of hospital stay (days) in the intervention groups was | 292 | ⊕⊕⊕⊝ | |||
| Need for additional antibiotic therapy | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Postpartum readmission for endometritis | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Treatment failure (vaginal and cesarean delivery) | Study population | RR 1.31 | 292 | ⊕⊕⊝⊝ | ||
| 35 per 1000 | 46 per 1000 | |||||
| Moderate | ||||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aWide confidence interval crossing the line of no effect and small sample size. | ||||||
| Intrapartum compared with postpartum treatment | ||||||
| Population: women with management of intra‐amniotic infection | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Intrapartum | ||||||
| Maternal and neonatal mortality | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| Maternal bacteremia | Study population | RR 2.19 | 45 | ⊕⊝⊝⊝ | ||
| 53 per 1000 | 115 per 1000 | |||||
| Moderate | ||||||
| 53 per 1000 | 116 per 1000 | |||||
| Early neonatal sepsis | Study population | RR 0.08 | 45 | ⊕⊝⊝⊝ | ||
| 211 per 1000 | 17 per 1000 | |||||
| Moderate | ||||||
| 211 per 1000 | 17 per 1000 | |||||
| Neonatal pneumonia or sepsis | Study population | RR 0.06 | 45 | ⊕⊝⊝⊝ | ||
| 316 per 1000 | 19 per 1000 | |||||
| Moderate | ||||||
| 316 per 1000 | 19 per 1000 | |||||
| Maternal postpartum hospital stay (days) | Mean maternal postpartum hospital stay (days) in the intervention groups was | 45 | ⊕⊝⊝⊝ | |||
| Neonatal hospital stay | Mean neonatal hospital stay in the intervention groups was | 45 | ⊕⊝⊝⊝ | |||
| Endometritis/Failure treatment | Study population | Not estimable | 0 | See comment | This outcome was not reported in any of the included studies. | |
| See comment | See comment | |||||
| Moderate | ||||||
| *The basis for the assumed risk (eg, median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| aOne study with serious design limitations. | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Treatment failure (endometritis) Show forest plot | 2 | 163 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.86 [0.27, 2.70] |
| 2 Initial successful response to antibiotics Show forest plot | 1 | 125 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.05 [0.94, 1.17] |
| 3 Maximum maternal temperature Show forest plot | 1 | 125 | Mean Difference (IV, Fixed, 95% CI) | 0.40 [‐0.45, 1.25] |
| 4 Postpartum hemorrhage Show forest plot | 2 | 163 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.39 [0.76, 2.56] |
| 5 Blood transfusion Show forest plot | 1 | 125 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.76 [0.18, 3.27] |
| 6 Maternal postpartum hospital stay (days) Show forest plot | 1 | 125 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [‐0.43, 0.43] |
| 7 Histologic chorioamnionitis Show forest plot | 1 | 125 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.63, 1.33] |
| 8 Neonatal sepsis Show forest plot | 2 | 163 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.07 [0.40, 2.86] |
| 9 Respiratory distress syndrome Show forest plot | 1 | 125 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.69 [0.42, 6.78] |
| 10 Neonatal antibiotic (days) Show forest plot | 1 | 125 | Mean Difference (IV, Fixed, 95% CI) | 0.20 [‐0.37, 0.77] |
| 11 Treatment failure Show forest plot | 1 | 19 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 12 Maternal death Show forest plot | 1 | 38 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 13 Postpartum endometritis (double vs triple therapy) Show forest plot | 1 | 133 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.86 [0.67, 5.14] |
| 14 Postpartum endometritis vaginal delivery (double vs triple therapy) Show forest plot | 1 | 73 | Risk Ratio (M‐H, Fixed, 95% CI) | 9.63 [0.55, 167.95] |
| 15 Postpartum endometritis cesarean section (double vs triple therapy) Show forest plot | 1 | 60 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.0 [0.32, 3.10] |
| 16 Neonatal sepsis (blood culture) Show forest plot | 1 | 133 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.93 [0.06, 14.52] |
| 17 Neonatal deaths Show forest plot | 1 | 133 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.39 [0.24, 8.06] |
| 18 Intraventricular hemorrhage Show forest plot | 1 | 133 | Risk Ratio (M‐H, Fixed, 95% CI) | 4.64 [0.23, 94.90] |
| 19 Respiratory distress syndrome Show forest plot | 1 | 133 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.11 [0.36, 3.47] |
| 20 Neonatal seizures Show forest plot | 1 | 133 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.93 [0.06, 14.52] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Postpartum endometritis Show forest plot | 1 | 116 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.48 [0.68, 3.24] |
| 2 Wound infection Show forest plot | 1 | 116 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.37 [0.04, 3.45] |
| 3 Neonatal sepsis Show forest plot | 1 | 116 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.11 [0.23, 5.27] |
| 4 Neonatal death Show forest plot | 1 | 116 | Risk Ratio (M‐H, Fixed, 95% CI) | 3.32 [0.14, 79.88] |
| 5 Trasient tachypnea Show forest plot | 1 | 116 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.83 [0.19, 3.55] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Treatment failure Show forest plot | 2 | 288 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.97 [0.14, 6.77] |
| 2 Endomyometritis Show forest plot | 2 | 288 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 3 Wound infection Show forest plot | 1 | 38 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 4 Maternal sepsis Show forest plot | 1 | 38 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 5 Readmission to hospital Show forest plot | 1 | 38 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Treatment failure Show forest plot | 1 | 131 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.02 [0.27, 3.89] |
| 2 Nephrotoxicity Show forest plot | 1 | 131 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 3 Length of treatment (days) Show forest plot | 1 | 131 | Mean Difference (IV, Fixed, 95% CI) | ‐0.30 [‐0.90, 0.30] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Duration of hospital stay (days) Show forest plot | 1 | 292 | Mean Difference (IV, Fixed, 95% CI) | ‐0.90 [‐1.64, ‐0.16] |
| 2 Treatment failure (vaginal and cesarean delivery) Show forest plot | 1 | 292 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.31 [0.42, 4.02] |
| 3 Treatment failure (cesarean delivery) Show forest plot | 1 | 117 | Risk Ratio (M‐H, Fixed, 95% CI) | 3.31 [0.38, 28.75] |
| 4 Treatment failure (vaginal delivery) Show forest plot | 2 | 284 | Risk Ratio (M‐H, Random, 95% CI) | 1.46 [0.39, 5.51] |
| 5 Wound infection Show forest plot | 1 | 292 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.87 [0.17, 20.37] |
| 6 Pelvic abscess Show forest plot | 1 | 292 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.80 [0.12, 68.24] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Maximum maternal temperature postpartum Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐0.5 [‐1.08, 0.08] |
| 2 Maternal postpartum hospital stay (days) Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐1.0 [‐1.94, ‐0.06] |
| 3 Maternal febrile days Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐1.06 [‐2.04, ‐0.08] |
| 4 Maternal bacteremia Show forest plot | 1 | 45 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.19 [0.25, 19.48] |
| 5 Early neonatal sepsis Show forest plot | 1 | 45 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.08 [0.00, 1.44] |
| 6 Neonatal pneumonia or sepsis Show forest plot | 1 | 45 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.06 [0.00, 0.95] |
| 7 Neonatal hospital stay Show forest plot | 1 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐1.90 [‐3.31, ‐0.49] |

