Ginseng para la cognición
Resumen
Antecedentes
El ginseng es una hierba medicinal de uso generalizado en todo el mundo. Se ha investigado su efecto sobre el cerebro y el sistema nervioso. Se ha sugerido, sobre la base de los estudios tanto de laboratorio como clínicos, que puede tener efectos beneficiosos en el rendimiento cognitivo.
Objetivos
Evaluar la eficacia y los efectos adversos del ginseng administrado para mejorar el rendimiento cognitivo en participantes sanos, participantes con deterioro cognitivo o demencia.
Destacar la calidad y la cantidad de pruebas de investigación disponibles.
Métodos de búsqueda
Se hicieron búsquedas en el Registro Especializado del Grupo Cochrane de Demencia y Trastornos Cognitivos (Cochrane Dementia and Cognitive Improvement Group, CDCIG), The Cochrane Library, MEDLINE, EMBASE, PsycINFO, CINAHL, LILACS, en registros de ensayos clínicos y en fuentes de literatura gris el 24 de febrero 2009, utilizando los siguientes términos: ginseng* OR panax OR ginsan OR "Jen Shen"OR shinseng OR Renshen OR schinseng OR ninjin OR gingilone OR panaxoside* OR ginsenoside* OR protopanaxa* OR protopanaxadiol OR protopanaxatriol OR panaxagin OR ginsenol OR ginsenine y términos para la cognición y la demencia. El Registro Especializado de Ensayos Controlados del CDCIG contiene registros actualizados de las principales bases de datos de asistencia sanitaria (The Cochrane Library, MEDLINE, EMBASE, PsycINFO, CINAHL, LILACS), así como de muchos registros de ensayos clínicos y fuentes de literatura gris.
Criterios de selección
Se consideraron para la inclusión todos los ensayos aleatorios controlados con placebo a doble ciego y simple ciego que evaluaran los efectos del ginseng para la función cognitiva. Se consideró que las intervenciones eran con ginseng si se trataba de compuestos que contenían ginseng o agentes activos del género Panax como componente principal.
Obtención y análisis de los datos
Dos revisores extrajeron las características de los ensayos incluidos mediante un formulario de extracción de datos autodesarrollado y los introdujeron en el programa informático RevMan 5.0. Se estableció contacto con autores de ensayos identificados para obtener información adicional y datos no publicados. Los efectos del ginseng en los participantes sanos, los participantes con deterioro cognitivo o demencia se abordaron de forma independiente.
Resultados principales
Se identificaron nueve ensayos controlados aleatorios, a doble ciego y controlados con placebo, que cumplían los criterios de inclusión. Ocho ensayos incorporaron a participantes sanos, y uno fue de personas con déficit de la memoria asociada a la edad.
Sólo cinco de los ensayos identificados tenían información extraíble y se incluyeron en el análisis. Cuatro estudios investigaron los efectos del extracto de ginseng y uno evaluó la eficacia del compuesto de ginseng HT008 1. Estos ensayos investigaron los efectos del ginseng en participantes sanos. El agrupamiento de los datos no fue posible debido a la heterogeneidad en las medidas de resultado, la duración de los ensayos y la dosis de ginseng. Los resultados del análisis indicaron mejoría de algunos aspectos de la función cognitiva, el comportamiento y la calidad de vida. No se encontraron eventos adversos graves asociados al ginseng.
Conclusiones de los autores
Faltan pruebas actuales que demuestren un efecto positivo para la cognición del Panax ginseng en participantes sanos y no hay pruebas de alta calidad acerca de su eficacia en los pacientes con demencia. Se necesitan ensayos aleatorios de grupos paralelos, controlados con placebo, a doble ciego con tamaños muestrales grandes para investigar más en profundidad el efecto del ginseng sobre la cognición en diferentes poblaciones, incluidos los pacientes con demencia.
PICOs
Resumen en términos sencillos
No hay pruebas convincentes de un efecto positivo para la cognición del Panax ginseng.
El ginseng se ha usado para tratar enfermedades y combatir los efectos del envejecimiento durante siglos. Actualmente, el ginseng ocupa una posición prominente en la lista de hierbas más vendidas y es el producto herbario más ampliamente usado en todo el mundo. Esta revisión procuró identificar todos los ensayos aleatorios, controlados con placebo, de simple y doble cegamiento, que evaluaron los efectos del ginseng sobre la función cognitiva. Se incluyeron en la revisión cinco ensayos que investigaron los efectos del ginseng sobre los participantes sanos y tenían información extraíble sobre la eficacia. El ginseng pareció tener algunos efectos beneficiosos sobre la cognición, el comportamiento y la calidad de vida. Se necesitan más estudios de diseño riguroso que traten este tema importante.
Conclusiones de los autores
Antecedentes
Descripción de la afección
La demencia es un síndrome caracterizado por un deterioro cognitivo progresivo, que lleva a una reducción en la capacidad de realizar la actividades cotidianas y se acompaña generalmente de trastornos del comportamiento. Existen varias formas de demencia y la enfermedad de Alzheimer (EA) es la más común, con un 50% a un 75% de los casos (WHO 2004). La demencia vascular (DV), causada por el deterioro del suministro de sangre al cerebro (Román 1993; DSM‐IV), es la segunda forma más común.
La demencia afecta principalmente a las personas mayores. Por encima de los 65 años de edad, la prevalencia se duplica con cada incremento de cinco años en la edad. Se ha calculado que el número de personas afectadas se duplicará cada 20 años a 81 100 000 hacia 2040, la mayoría de los cuales serán residentes en países en desarrollo (del 60% en 2001 al 71% en 2040) (Ferri 2005). La demencia resulta en una carga económica abrumadora para los sistemas de asistencia sanitaria y está convirtiéndose en un problema de salud pública significativo en todo el mundo. A nivel mundial, el costo social total de la demencia, sobre la base de una población de demencia de 29 300 000 personas, se estimó en 315 400 millones de dólares estadounidenses en 2005, incluidos 105 mil millones para la atención informal (Wimo 2007). En los EE.UU., 9 800 000 familias y otras personas que brindan cuidados sin remuneración a pacientes con EA y otras demencias suman 8 400 millones de horas de atención, una contribución a la nación que alcanza los 89 000 millones (Alzheimer's Association 2008). Además, los cuidadores de los miembros de la familia con demencia soportan una carga significativa a nivel emocional, físico y psicológico (Maggio 2010; Miyamoto 2010). Sin embargo, hasta el momento, no hay ningún tratamiento que pueda retrasar o detener el deterioro de las células cerebrales en la demencia.
Afortunadamente, la disminución cognitiva patológica no es una consecuencia inevitable del envejecimiento, y la prevención de la demencia puede ser posible. El deterioro cognitivo leve (DCL) es un trastorno prevalente en el anciano, que representa un estado transitorio entre el envejecimiento cerebral no patológico y la patología cognitiva severa de la demencia. Los estudios epidemiológicos indicaron que algunos casos de DCL quizá sean reversibles. Algunos individuos experimentan pérdida de la memoria que excede cuantificablemente el de sus PARES, aunque no es lo suficientemente severa como para diagnosticarse como DCL o EA, y reciben diagnóstico de déficit de la memoria asociado a la edad (Kidd 2008).
Descripción de la intervención
El ginseng se conoce popularmente con el nombre de "adaptógeno" en gran parte de la bibliografía sobre medicina alternativa. El término "adaptógeno" se refiere a una sustancia que aumenta la resistencia al estrés físico, químico y biológico y estimula la vitalidad general, incluida la capacidad física y mental. El Panax ginseng se ha usado durante siglos como componente importante de muchas prescripciones chinas para tratar enfermedades y combatir el envejecimiento. Su eficacia medicinal se documentó por primera vez en Shengnong Bencao Jing y fue resumida posteriormente por Li Shizhen en Bencao Gangmu y Zhongyao Zhi (Chinese Materia Medica). Más recientemente, el ginseng ha recibido mucha atención como tratamiento que podría mejorar el bienestar y el rendimiento cognitivo.
El ginseng se refiere comúnmente a las especies dentro del género Panax de la familia Araliaceae (Tabla 1). Las dos especies principales usadas en las hierbas medicinales son el ginseng asiático o coreano (Panax ginseng CA. Meyer) y el ginseng estadounidense (Panax quinquefolius). Los principios activos básicos del género de Panax son los denominados "ginsenósidos", que pertenecen a la clase química de las saponinas triterpénicas. Otros agentes activos son sustancias como algunos azúcares y polisacáridos.
De qué manera podría funcionar la intervención
Con las saponinas de ginseng o ginsenósidos como principales componentes activos, se ha investigado la función neuroprotectora del ginseng. La acción antiapoptótica del panaxidol (PND) y panaxinol (PNN) puede disminuir la neurodegeneración (Nie 2006; Nie 2008). El ginsenósido Re, Rg1, Rg3 y Rh2 puede atenuar la toxicidad inducida por el β‐amiloide (Aβ) (Chen 2006; Shieh 2008). El ginsenósido Rg2 puede tener un efecto antioxidativo útil en el tratamiento de la EA (Li 2007), y puede modular la expresión de proteínas que participan en la apoptosis para tratar la DA u otras lesiones isquémicas (Zhang 2008).
Por qué es importante realizar esta revisión
El ginseng ocupa una posición prominente en la lista de hierbas más vendidas y es el producto herbario más ampliamente usado en todo el mundo (Blumenthal 2001). Según los datos de diferentes compañías de investigación de mercado, en el mercado chino, el ginseng significó más de 350 millones de dólares estadounidenses en ventas de 2006 (Heller 2008). Se ha informado que entre las personas de edad avanzada que residen en una comunidad de jubilados, el 14% de las personas que consumen habitual u ocasionalmente un suplementos herbario, consumen el ginseng (Weng 2004). Los productos de ginseng suelen ser adquiridos por los consumidores que creen que experimentarán no solo beneficios físicos, sino también un efecto positivo sobre su bienestar y rendimiento cognitivo (Kennedy 2003).
Es muy difundida la creencia de que el ginseng ejerce un efecto beneficioso sobre el rendimiento cognitivo. Sin embargo, no se ha realizado una revisión sistemática de las pruebas sobre este efecto. Se considera necesaria una revisión sistemática bien organizada y actualizada para evaluar la eficacia y la seguridad del ginseng para la cognición.
Objetivos
El objetivo primario es evaluar la eficacia y los efectos adversos de diferentes tipos de ginseng (y compuestos con ginseng o agentes activos del género Panax como componente principal) consumido por participantes sanos, participantes con deterioro cognitivo o demencia para la cognición.
El objetivo secundario es destacar la calidad y la cantidad de pruebas derivadas de estudios de investigación disponibles.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron todos los ensayos aleatorios controlados con placebo a doble ciego y simple ciego que evaluaran los efectos del ginseng sobre la función cognitiva. No hubo limitación con respecto al idioma y al tipo de publicación de los ensayos. También se consideraron dos estudios cruzados de dos períodos en participantes sanos sin efecto de arrastre.
Tipos de participantes
Se incluyeron ensayos en participantes sanos, participantes con deterioro cognitivo o cualquier tipo de demencia de cualquier gravedad. Los participantes sanos presentaban habilidades cognitivas intactas para excluir la demencia y el DCL. El diagnóstico de deterioro cognitivo se basó en escalas de calificación validadas. La demencia se diagnosticó con criterios de diagnóstico validados y fidedignos, como el American Psychiatric Association Diagnostic and Statistical Manual of Mental Disorders (DSM‐III; DSM‐III‐R; DSM‐IV), National Institute of Neurological Disorders and Stroke ‐ Association Internationale pour la Recherche et l'Enseignement en Neurosciences (NINCDS‐ADRDA: McKhann 1984), National Institute of Neurological Disorders and Stroke (NINDS‐AIREN: Román 1993) y en la International Classification of Diseases (ICD‐10: WHO 1992).
Tipos de intervenciones
Se incluyeron en la revisión los ensayos que evaluaron el ginseng de forma independiente de la dosificación, el modo de administración y la duración.
El objetivo fue mostrar los ensayos como sigue:
1. Ginseng versus placebo solo;
2. Ginseng + tratamiento habitual versus placebo + tratamiento habitual.
El tratamiento estándar consistió en ejercicios funcionales, rehabilitación, atención de enfermería y fármacos contra la demencia.
Además, se consideraron los compuestos que contenían ginseng o agentes activos del género Panax como componente principal. Los compuestos eran fármacos que aparecían en el mercado con efectos aducidos. Esta decisión pretendió asegurar que los compuestos incluidos sean fabricados según normas de calidad aceptables y fiables. No se consideraron los estudios que usaron una combinación de ginseng y ginkgo, ya que este último quizá constituya una proporción relativamente grande de la combinación y ejerza una función en la neuroprotección.
Tipos de medida de resultado
Resultados primarios
La medida de resultado primaria fue la función cognitiva (p.ej., memoria, concentración, memoria inmediata, cálculos, velocidad de procesamiento) medida con pruebas psicométricas como la Mini‐Mental State Examination (MMSE) (Folstein 1975), la Randt Memory Test (RMT) (Randt 1983), la Cognitive Subsection of the Alzheimer's disease Scale (ADAS‐Cog) (Rosen 1984) o alternativas aceptables.
Resultados secundarios
1. Trastornos del comportamiento (p.ej., agitación, ansiedad e inquietud) mediante escalas de calificación validadas como el Neuropsychiatric Instrument (NPI) (Cummings 1994) y el Cohen‐Mansfield Agitation Inventory (CMAI) (Cohen‐Mansfield 1996).
2. Rendimiento en las actividades cotidianas medido con las escalas de calificación validadas (p.ej., evaluación con las Instrumental Activities of Daily Living [IADL]) (Lawton 1969).
3. Impresión global del cambio (cambio clínico o cambios en la gravedad de la enfermedad) mediante escalas de calificación global como The Clinical Global Impression of Change (ADCS‐CGIC) (Schneider 1997). También se programó mencionar la perspectiva subjetiva de los miembros de la familia o los cuidadores.
4. Calidad de vida (medida con escalas o herramientas de calidad de vida reconocidas y validadas).
5. Carga para el cuidador
6. Institucionalización
7. Muerte
8. Aceptabilidad del tratamiento medida según los retiros de los ensayos
9. Incidencia y gravedad de los efectos adversos
Los ensayos que informaron sólo resultados fisiológicos, como los cambios en el índice biológico en plasma, la imaginología funcional o la electroencefalografía (EEG) se consideraron pero no se incluyeron, y estos resultados no implicaron aportes al análisis. También se consideraron los resultados del seguimiento a largo plazo en cualquiera de los ensayos incluidos.
Results
Description of studies
See: Characteristics of included studies; Characteristics of excluded studies
Included studies
Nine randomized, double‐blind, placebo controlled trials (D'Angelo 1986; Neri 1995; Sotaniemi 1995; Sørensen 1996; Kennedy 2001; Reay 2005; Sünram‐Lea 2005; Kennedy 2007; Kim 2008) meeting the inclusion criteria were identified. Eight enrolled healthy participants (D'Angelo 1986; Sotaniemi 1995; Sørensen 1996; Kennedy 2001; Reay 2005; Sünram‐Lea 2005; Kennedy 2007; Kim 2008), and one was of subjects with age‐associated memory impairment (AAMI) (Neri 1995).
Only five (D'Angelo 1986; Sørensen 1996; Sünram‐Lea 2005; Kennedy 2007; Kim 2008) of the identified trials investigating the effects of ginseng on healthy participants had extractable information for efficacy and were included in the review. All of the trials were performed in the medical centers affiliated to universities. Sørensen 1996 was supported by a grant from Dansk Droge. The fourth author of Sünram‐Lea 2005 was employed by Pharmaton SA, the producer of G115 used in the trial. Kim 2008 was supported by grants from Korea Plant Diversity Research Center of 21st Century Frontier Research Program, and by grants from the Seoul R&D Program and the Second Stage of Brain Korea 21 Project.
Three were parallel group studies (D'Angelo 1986; Sørensen 1996; Kim 2008), and two were two‐period cross‐over trials (Sünram‐Lea 2005; Kennedy 2007). Two studies were conducted in UK (Sünram‐Lea 2005; Kennedy 2007), one in Italy (D'Angelo 1986), one in Denmark (Sørensen 1996), and one in Republic of Korea (Kim 2008). The average age of participants in three studies ranged from 20 to 31.3 years (D'Angelo 1986; Sünram‐Lea 2005; Kennedy 2007), and in the other two studies (Sørensen 1996; Kim 2008) ranged from 51.4 to 59.4 years.
One study compared the effects of HT008‐1 (Neu Med, Seoul, Korea), the compound containing ginseng as a major component with placebo (Kim 2008). Four studies compared the effects of ginseng extract with placebo (D'Angelo 1986; Sørensen 1996; Sünram‐Lea 2005; Kennedy 2007). Of these four studies, two assessed the effects of G115 (Pharmaton S.A., Switzerland) (D'Angelo 1986; Sünram‐Lea 2005), one evaluated the effects of Gerimax Ginseng Extract (Dansk Droge, Denmark, currently Orkla ASA Gerimax) (Sørensen 1996), and one assessed the efficacy of Korean ginseng extract (Cheong Kwan Jang, Korea Ginseng Corporation, Seoul, Korea) (Kennedy 2007).
For all of the included trials, ginseng products were administrated orally. G115, Gerimax Ginseng Extract and Cheong Kwan Jang were capsules. HT008‐1 was prepared as a liquid in a 30‐ml pouch of solution. Details of ginseng products were presented in Appendix 3. The daily dose of ginseng extract ranged from 200 mg to 400 mg, whereas the daily dose of ginseng compound HT008‐1 was 5200 mg. Four studies (D'Angelo 1986; Sørensen 1996; Kennedy 2007; Kim 2008) investigated the chronic effects of ginseng, with duration of treatment period varied from eight to twelve weeks. One study (Sünram‐Lea 2005) evaluated the acute effects of ginseng, with treatment duration of merely two days.
Excluded studies
Fifteen reports were excluded because:
1. Data on effects of ginseng could not be extracted (Neri 1995; Sotaniemi 1995; Kennedy 2001; Reay 2005);
2. Not a randomized trial (Thommessen 1996);
3. Not a blinded trial (Heo 2008; Lee 2008);
4. Not a placebo controlled trial (Tian 2003b; Heo 2008; Lee 2008);
5. Compound containing ginseng or active agents of the Panax genus as a major component was not the drug appearing on the market with claimed effects (Tian 2003; Tian 2003a; Tian 2003b);
6. The Latin‐square design cross‐over trials compared other types of intervention besides ginseng were excluded (Kennedy 2004; Reay 2006);
7. Cognitive function was not tested (Wiklund 1994; Ellis 2002);
8. Only the abstract has been published and data were not obtainable from authors (Reay 2008).
Risk of bias in included studies
Allocation
The random number table was utilized to generate allocation sequence in D'Angelo 1986 (correspondence from Emilio Perucca on 28 May 2009). For Sørensen 1996, a randomization code was made by a pharmacist in the company and the detailed method of randomization was unclear. The randomization codes were withheld until all results were analyzed, not until then was the treatment allocation revealed. Meanwhile, members of the company were in no way involved in the conduct of the trial and had absolutely no access to participants or test procedures etc (correspondence from Jesper Sonne on 28 May 2009). A person not involved in the trial of Sünram‐Lea 2005 carried out randomisation manually using a randomisation table. For Kennedy 2007, the computerized random number generator was used to allocate participants (correspondence from David Kennedy on 27 May 2009). All treatments were packaged and coded by a disinterested third party, who retained the emergency code break for use in the event of any serious adverse events. For Kim 2008, participants were randomly assigned through the online service of www.randomizer.org.
Blinding
All of the included trials used double‐blinding method. The methods of blinding in three trials (D'Angelo 1986; Sünram‐Lea 2005Kennedy 2007) were acquired from authors (correspondence from Emilio Perucca on 28 May 2009; correspondence from Keith A. Wesnes on 21 July 2009; correspondence from David Kennedy on 27 May 2009). The blinding efficacy was tested to be adequate in one trial (Kim 2008).
Incomplete outcome data
For D'Angelo 1986, all participants completed the trial. The attrition rate (drop out of the trials) was 12% (15/127) in Sørensen 1996. Compliance in this study was assessed by querying the participants and by counting the tablets returned, and in no case did the returned tablets exceed 5% of the total number distributed to the participants. Detailed reasons for non‐compliance were not provided. For Sünram‐Lea 2005, exact number of participants completed the study was not stated. However, from the degree of freedom in the paired t‐test we concluded that number of participants included in the statistical analysis were the same as the number of participants randomized. For Kennedy 2007, two participants failed to complete the trial, leaving 16 evaluable sets of data. Reasons for loss‐to follow up were unrelated to treatment, for instance, simply dropped out of the trial. 19 participants (9 from HT008‐1 group, 10 from placebo group) were excluded from Kim 2008. Reasons for exclusion were as follows: HT008‐1 (4‐lost to follow up, 1‐adverse events, 4‐protocol violations), Placebo (5‐lost to follow up, 2‐adverse events, 3‐protocol violations). The attrition rate of this trial seemed to be relatively high (19/118). Nevertheless, 7 protocol violations were evidently not associated with the use of HT008‐1 and placebo.
Carryover effects
No assessment was made of the risk of carryover in either of the two included cross‐over trials (Sünram‐Lea 2005; Kennedy 2007). Ginseng is one of the most complex plants, consisting of multiple components. The pharmacokinetics of ginseng, including elimination half‐life, is poorly characterised in humans. Therefore, it is very difficult to judge the adequacy of the washout period. The possibility of carryover effects could not be entirely excluded and the effects would probably lead to an underestimate of the effect size.
A 'Risk of Bias Graph captures the review authors' judgments about each risk of bias item presented as percentages across all included trials see Figure 1 and a 'Risk of Bias Summary captures the review authors' judgments about each risk of bias item for each included trial see Figure 2.
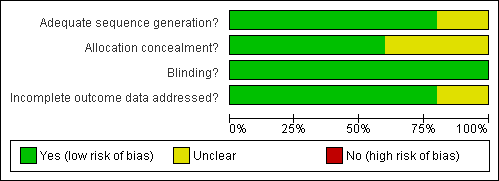
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Effects of interventions
For two parallel group trials (D'Angelo 1986; Kim 2008), we calculated the mean difference and standard deviation of change score from baseline to the final assessment since the mean change had not been suggested in the report. For two cross‐over studies (Sünram‐Lea 2005; Kennedy 2007), only outcomes where results from the paired t‐test were available were included for analysis. We calculated the paired mean difference and standard error of change score from baseline to the final assessment.
Effects of ginseng extract on cognitive function of healthy participants
-
There was statistical significance in favour of 200 mg/day ginseng in working memory as assessed by the Speed of Carrying out 3‐Back Task WMD ‐0.06 (95% CI ‐0.10 to ‐0.02, P = 0.004) at 4 weeks (Kennedy 2007). Nevertheless, no statistical significance was found between 200 mg/day ginseng and placebo in Corsi Block Digit span WMD 0.28 (95% CI ‐0.02 to 0.57, P = 0.07).
-
There was significant statistical difference showing a benefit of 200 mg/day ginseng in working memory as assessed by the Speed of Carrying out 3‐Back Task WMD ‐0.06 (95% CI ‐0.11 to ‐0.01, P = 0.02) at 8 weeks (Kennedy 2007).
-
No statistically significant results in favour of 200 mg/day ginseng were found for 12 weeks on attention and concentration as measured by the Cancellation Test WMD 2.00 (95% CI ‐1.76 to 5.76, P = 0.30) (D'Angelo 1986).
-
There was no statistically significant difference between 200 mg/day ginseng and placebo for 12 weeks in speed of processing as assessed by the Logical Deduction Test WMD 0.02 (95% CI ‐0.02 to 0.06, P = 0.37) and Digit Symbol Substitution Test WMD ‐1.00 (95% CI ‐5.32 to 3.32, P = 0.65) (D'Angelo 1986). However, results from Mental Arithmetic indicated a benefit for 200 mg/day ginseng compared with placebo WMD 0.12 (95% CI 0.03 to 0.21, P = 0.007).
-
For psychomotor performance, there was a statistically significant difference in favour of 200 mg/day ginseng compared with placebo for 12 weeks in Choice Reaction Time WMD ‐0.01 (95% CI ‐0.02 to ‐0.01, P < 0.0001) and the Tapping Test WMD ‐8.00 (95% CI ‐14.66 to ‐1.34, P = 0.02) (D'Angelo 1986). However, no statistically significant differences were found in Simple Visual Reaction Time WMD 0.00 (95% CI ‐0.01 to 0.01, P = 1.00) and Simple Auditory Reaction Time WMD 0.00 (95% CI ‐0.01 to 0.01, P = 1.00).
-
Results from Choice Reaction Time (CDR battery) suggested benefits for 400 mg/day ginseng for 2 days compared with placebo WMD ‐22.09 (95% CI ‐36.92 to ‐7.26, P = 0.004) (Sünram‐Lea 2005). There was also a statistically significant difference in favour of 400 mg/day ginseng in Speed of Attention WMD ‐25.61 (95% CI ‐46.79 to ‐4.43, P = 0.02) in this study.
-
No statistically significant differences were found between 400 mg/day ginseng and placebo for 2 days in the following outcome measures: Continuity of Attention WMD ‐0.32 (95% CI ‐1.65 to 1.01, P = 0.64), Quality of Memory WMD ‐2.28 (95% CI ‐28.57 to 24.01, P = 0.87), Speed of Memory WMD 28.17 (95% CI ‐82.25 to 138.59, P = 0.62), Working Memory WMD 0.05 (95% CI ‐0.02 to 0.12, P = 0.19), and Secondary Memory WMD ‐2.33 (95% CI ‐27.70 to 23.04, P = 0.86) (Sünram‐Lea 2005).
-
There were no benefits in favour of 400 mg/day ginseng for 8 to 9 weeks for improving attention and concentration as assessed by the D2 Test WMD 4.00 (95% CI ‐11.15 to 19.15, P = 0.60) (Sørensen 1996).
-
No statistically significant differences were found when 400 mg/day ginseng for 8 to 9 weeks was compared with placebo on the psychomotor performance as measured by Simple Auditory Reaction Times (10 Percentile) WMD ‐6.60 (95% CI ‐15.72 to 2.52, P = 0.16), Simple Auditory Reaction Times (50 Percentile) WMD ‐9.80 (95% CI ‐22.69 to 3.09, P = 0.14), Simple Visual Reaction Times (10 Percentile) WMD ‐3.70 (95% CI ‐11.26 to 3.86, P = 0.34), Simple Visual Reaction Times (50 Percentile) WMD ‐2.20 (95% CI ‐11.63 to 7.23, P = 0.65), Finger‐tapping Test (Maximum) WMD ‐1.60 (95% CI ‐3.67 to 0.47, P = 0.13), and the Finger‐tapping Test (50 Percentile) WMD ‐2.50 (95% CI ‐5.07 to 0.07, P = 0.06) (Sørensen 1996).
-
Measures of learning and memory: 400 mg/day ginseng for 8 to 9 weeks significantly improved Selective Reminding over placebo; the results showed a WMD of 4.40 (95% CI 0.82 to 7.98, P = 0.02) (Sørensen 1996). However, no statistically significant differences were found between 400 mg/day ginseng and placebo on the following two tests: Logical Memory and Reproduction Test WMD 0.00 (95% CI ‐0.74 to 0.74, P = 1.00), and Rey‐Oestrich Complex Figure Test WMD 0.20 (95% CI ‐1.46 to 1.86, P = 0.81).
Effects of ginseng compound on cognitive function of healthy participants
-
No statistically significant differences were found between 5200 mg/day HT008‐1 and placebo on cognition as measured by any aspects of Wechsler Memory Scale‐III (WMS‐III) (Kim 2008) at 8 weeks. Results were as follows: Logical Memory I WMD 0.20 (95% CI ‐0.62 to 1.02, P = 0.63), Logical Memory II WMD ‐0.09 (95% CI ‐0.95 to 0.77, P = 0.84), Verbal Paired Associates I WMD ‐0.46 (95% CI ‐1.22 to 0.30, P = 0.24), Verbal Paired Associates II WMD ‐0.60 (95% CI ‐1.31 to 0.11, P = 0.10, Letter‐Number Sequencing WMD ‐0.76 (95% CI ‐1.52 to 0.00, P = 0.05), Spatial Span WMD ‐0.23 (95% CI ‐1.16 to 0.70, P = 0.63), and Auditory Recognition Delayed WMD 0.38 (95% CI ‐0.43 to 1.19, P = 0.36).
Effects of ginseng extract on behavior of healthy participants
-
There were benefits associated with 200 mg/day ginseng compared with placebo in Calmness (Bond‐Lader Visual Analogue Scales) WMD ‐9.31 (95% CI ‐14.29 to ‐4.34, P = 0.0002) (Kennedy 2007) at 4 weeks.
-
The change in Calmness (Bond‐Lader Visual Analogue Scales) was significantly better with 200 mg/day ginseng than with placebo WMD ‐5.91 (95% CI ‐7.96 to ‐3.85, P <0.00001) (Kennedy 2007) at 8 weeks.
-
There were no statistically significant differences between 400 mg/day ginseng and placebo in the following aspects as assessed by Bond‐Lader Visual Analogue Scales: Alertness WMD 1.20 (95% CI ‐4.68 to 7.08, P=0.69), Contentedness WMD ‐0.63 (95% CI ‐6.00 to 4.74, P = 0.82), and Calmness WMD ‐1.88 (95% CI ‐9.56 to 5.80, P = 0.63) (Sünram‐Lea 2005) at 2 days.
Effects of ginseng extract on quality of life of healthy participants
-
There were benefits associated with 200 mg/day ginseng compared with placebo in Social Relationships as measured by WHOQOL‐BREF WMD 1.33 (95% CI 0.43 to 2.24, P=0.004) (Kennedy 2007) at 8 weeks.
Effects of ginseng compound on quality of life of healthy participants
-
There was statistical significance in favour of 5200 mg/day HT008‐1 compared with placebo for improving Overall Quality of Life WMD 0.18 (95% CI 0.01 to 0.35, P = 0.04), General Health WMD 0.34 (95% CI 0.16 to 0.52, P = 0.0003), and Physical Health WMD 3.78 (95% CI 0.21 to 7.35, P = 0.04) as assessed by WHOQOL‐BREF (Kim 2008) at 8 weeks. However, no significant differences were found in the following aspects: Psychological Health WMD 2.38 (95% CI ‐1.17 to 5.93, P = 0.19), Social Relationships WMD 4.02 (95% CI ‐0.42 to 8.46, P = 0.08), and Environment WMD 0.60 (95% CI ‐2.83 to 4.03, P = 0.73).
Adverse effects
-
No adverse effects were identified in two trials (D'Angelo 1986; Sørensen 1996) according to the reports. No adverse effects were found in Kennedy 2007 based on information provided by the leading author (correspondence from David Kennedy on 27 May 2009). It should be mentioned that results from one study (Kim 2008) which investigated the efficacy of ginseng compound HT008‐1 revealed some adverse effects in both the HT008‐1 group and the placebo group including headache, dizziness, diarrhea, constipation, vomiting, gastric complaints, and dermatitis or eczema. However, no serious adverse events were reported during the study and no causal relationship was determined between the HT008‐1 treatment and any adverse event.
Discusión
Esta revisión sistemática procuró determinar los efectos del ginseng sobre la cognición en participantes sanos, participantes con deterioro cognitivo y demencia. Se incluyeron en la revisión cinco ensayos orientados a investigar los efectos del ginseng sobre la función cognitiva de los voluntarios sanos. Los participantes en tres de los ensayos incluidos eran voluntarios jóvenes y en dos eran personas de mediana edad. Cuatro estudios investigaron los efectos del extracto de ginseng y uno evaluó la eficacia del compuesto de ginseng HT008 1.
El ginseng pareció tener efectos beneficiosos para la mejoría de algunos aspectos de la función cognitiva, el comportamiento y la calidad de vida en los participantes sanos. No se encontraron eventos adversos graves causados por el ginseng. Para la función cognitiva, los resultados del análisis de los datos indicaron mejoría en: un aspecto de la memoria de trabajo, evaluado con la tarea de velocidad de procesar tres estímulos (3‐Back task), después del tratamiento con 200 mg/día de ginseng durante cuatro y ocho semanas; un aspecto de la velocidad del procesamiento evaluado con las actividades mentales de aritmética, después del tratamiento con 200 mg/día de ginseng durante 12 semanas; dos aspectos del rendimiento psicomotor evaluado con las pruebas Choice Reaction Time y Tapping Test, después del tratamiento con 200 mg/día de ginseng durante 12 semanas; y un aspecto del aprendizaje y la memoria evaluado por el recuerdo selectivo después del tratamiento con 400 mg/día de ginseng durante ocho a nueve semanas. Los efectos beneficiosos inmediatos para la cognición del ginseng se evaluaron mediante el tiempo de reacción para la elección y la velocidad de la atención después del tratamiento con ginseng en dosis de 400 mg/día durante dos días. Para el comportamiento, los resultados del análisis indicaron mejoría en la calma medida con las Bond‐Lader Visual Analogue Scales, después del tratamiento con ginseng en dosis de 200 mg/día durante cuatro y ocho semanas. Para la calidad de vida, los resultados del análisis indicaron mejoría en las relaciones sociales medida con WHOQOL‐BREF, después del tratamiento con ginseng en dosis de 200 mg/día durante ocho semanas, y en la calidad de vida general, la salud general y la salud física medida con WHOQOL‐BREF después del tratamiento con compuesto de ginseng HT008 1 en dosis de 5200 mg/día durante ocho semanas.
Los resultados del análisis deben interpretarse con cautela. Cinco ensayos, con un total de 289 participantes proporcionaron datos para el análisis. El pequeño tamaño muestral quizás contribuya al poder estadístico insuficiente para detectar una diferencia, si existe alguna. Los resultados se basaron en los datos de un único ensayo, que no había sido duplicado por otros ensayos, lo que inevitablemente reduce la solidez de las pruebas. Hubo diversos instrumentos utilizados para medir los distintos aspectos de la cognición en los ensayos individuales, lo que causó problemas en las comparaciones múltiples de los resultados cognitivos. No pudo extraerse ningún datos disponible con respecto a algunas medidas de resultado secundarias de los ensayos incluidos, p.ej., el rendimiento de las actividades cotidianas, la impresión del cambio global y la carga de los cuidadores. Por lo tanto, no pudimos establecer conclusiones acerca de estos resultados. Se necesitan ECA para explorar tales medidas de resultado importantes. Los efectos del ginseng se observaron en el corto plazo, que varió de dos días a 12 semanas. Esta variación no pudo indicar eficacia en el beneficio a largo plazo. Se necesitan ensayos con tratamiento y seguimiento más prolongados para confirmar este efecto.
Tres de los cinco ensayos incluidos estuvieron en riesgo incierto de sesgo en al menos un dominio. El método de generación de secuencias aleatorias no fue claro en un ensayo Sørensen 1996. No se mencionó la ocultación de la asignación y sigue sin poder precisarse si la secuencia se ocultó adecuadamente en dos ensayos (D'Angelo 1986; Sünram‐Lea 2005). Por tanto, se consideró un riesgo de sesgo de selección incierto en estos tres estudios (D'Angelo 1986; Sørensen 1996; Sünram‐Lea 2005). Para Sünram‐Lea 2005, faltó el número exacto de participantes que completó el ensayo y no se supo si algún participante lo abandonó. Como consecuencia, los datos incompletos de resultado quizá entrañen un riesgo incierto de sesgo de deserción. El diseño cruzado es apropiado para estudiar la cognición en los participantes sanos. Sin embargo, los efectos de arrastre no se trataron en los informes de dos ensayos cruzados incluidos (Sünram‐Lea 2005; Kennedy 2007). Por lo tanto, no se sabe si hubo efectos de arrastre en estos dos ensayos.
La revisión procuró evaluar los efectos del ginseng en participantes sanos, participantes con deterioro cognitivo o cualquier tipo de demencia de cualquier gravedad. Sin embargo, sólo se incluyeron participantes sanos jóvenes y de mediana edad con datos extraíbles para el análisis. Como resultado, no pueden establecerse conclusiones acerca del deterioro cognitivo y la demencia que pueda ser de interés para los lectores. Debe señalarse que cinco ECA excluidos también examinaron los efectos del ginseng sobre la cognición. Los participantes de dos ensayos excluidos (Heo 2008; Lee 2008)tenían EA; en un ensayo (Tian 2003b), demencia posaccidente cerebrovascular; en otro (Tian 2003a)eran pacientes de edad avanzada con deterioro cognitivo leve (DCL); y en un ensayo (Neri 1995), tenían más de 50 años y sufrían de déficit de memoria gradual. El ginseng pareció ejercer algunos efectos sobre la función cognitiva según los resultados de estos ensayos. No obstante, se deben tener en cuenta las limitaciones de estos estudios excluidos como se indica anteriormente.
Sesgos potenciales en el proceso de revisión
-
No fue posible realizar un gráfico en embudo para evaluar el sesgo de publicación debido al número limitado de ensayos incluidos.
-
Un estudio (Sørensen 1996) fue financiado mediante una subvención de Dansk Droge A/S (Ishøj, Dinamarca). No se sabe si otros estudios incluidos tienen conflictos de intereses con compañías farmacéuticas. La industria farmacéutica quizá tienda a desalentar la publicación de los estudios negativos que ha financiado (Higgins 2008). La falta de transparencia podría amplificarse en parte por los requisitos contractuales que estipulan los patrocinantes de los investigadores (Williams 2007).
Acuerdos y desacuerdos con otros estudios o revisiones
Lee 2009 intentó evaluar los efectos del ginseng para la EA. Los autores de esta revisión hicieron búsquedas en 20 bases de datos hasta enero 2009, utilizando los términos "ginseng AND Alzheimer". Dos ECA (Lee 2008; Heo 2008) se incluyeron en Lee 2009, pero se excluyeron de esta revisión. Sin embargo, existe coincidencia con las conclusiones de estos autores en cuanto a que las pruebas del ginseng para la EA fueron escasas y no concluyentes.
Las diferencias principales entre Lee 2009 y esta revisión se encuentra en los criterios de selección de los estudios y los métodos de evaluación de la calidad. (1) Los ensayos que incorporaron participantes sanos, participantes con deterioro cognitivo o cualquier tipo de demencia fueron incluidos en la revisión, mientras Lee 2009 incluyó sólo participantes con EA. (2) Lee 2009 también consideró el ginseng como tratamiento adyuvante a la farmacoterapia convencional. No obstante, sólo se incluyeron en la revisión ensayos controlados con placebo a doble ciego y simple ciego. (3) La escala Jadad fue adoptada en Lee 2009 para evaluar la calidad metodológica de los ensayos incluidos, mientras que en esta revisión se usaron los "Métodos generales para las revisiones Cochrane" (Higgins 2008) al evaluar la calidad de los ensayos incluidos.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
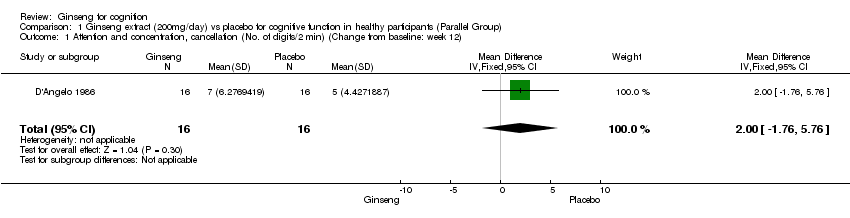
Comparison 1 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 1 Attention and concentration, cancellation (No. of digits/2 min) (Change from baseline: week 12).

Comparison 1 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 2 Speed of processing, Mental arithmetic (correct responses/s) (Change from baseline: week 12).

Comparison 1 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 3 Speed of processing, Logical deduction (correct responses/s) (Change from baseline: week 12).
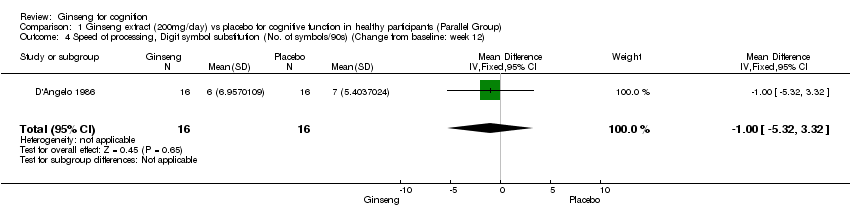
Comparison 1 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 4 Speed of processing, Digit symbol substitution (No. of symbols/90s) (Change from baseline: week 12).

Comparison 1 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 5 Sensorimotor function, choice reaction time (s/10‐no. of errors) (Change from baseline: week 12).

Comparison 1 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 6 Sensorimotor function, simple visual reaction time (s) (Change from baseline: week 12).
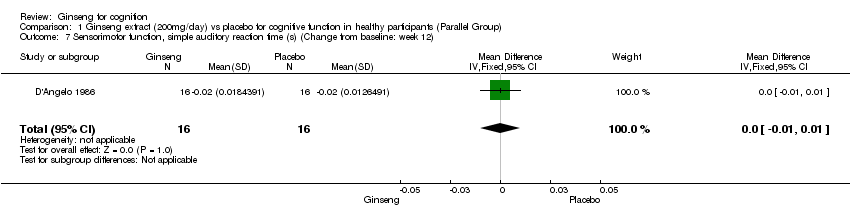
Comparison 1 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 7 Sensorimotor function, simple auditory reaction time (s) (Change from baseline: week 12).

Comparison 1 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 8 Pure motor function, tapping (taps/30s) (Change from baseline: week 12).

Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 1 Attention and concentration, D2 (total score) (Change from baseline: week 8 to 9).

Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 2 Learning and Memory, selective reminding (error index) (Change from baseline: week 8 to 9).
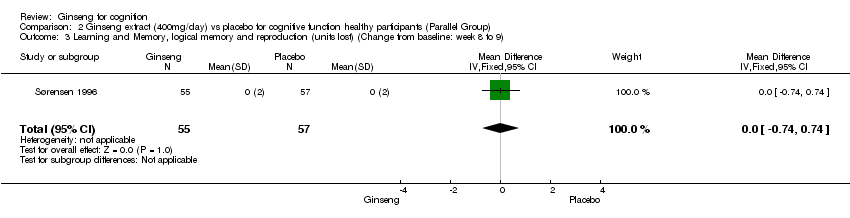
Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 3 Learning and Memory, logical memory and reproduction (units lost) (Change from baseline: week 8 to 9).
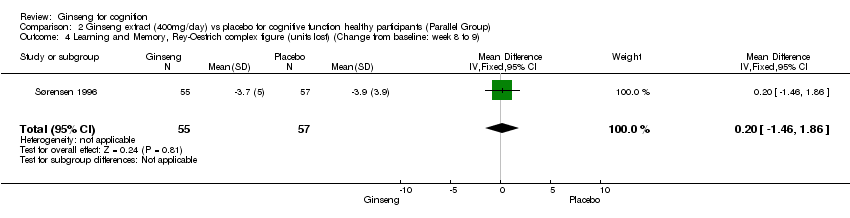
Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 4 Learning and Memory, Rey‐Oestrich complex figure (units lost) (Change from baseline: week 8 to 9).

Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 5 Sensorimotor function, simple auditory reaction times (10 Percentile) (Change from baseline: week 8 to 9).
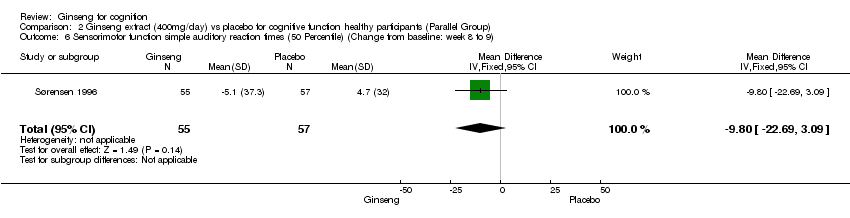
Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 6 Sensorimotor function simple auditory reaction times (50 Percentile) (Change from baseline: week 8 to 9).
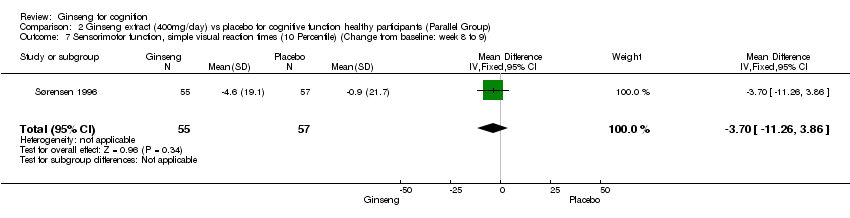
Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 7 Sensorimotor function, simple visual reaction times (10 Percentile) (Change from baseline: week 8 to 9).
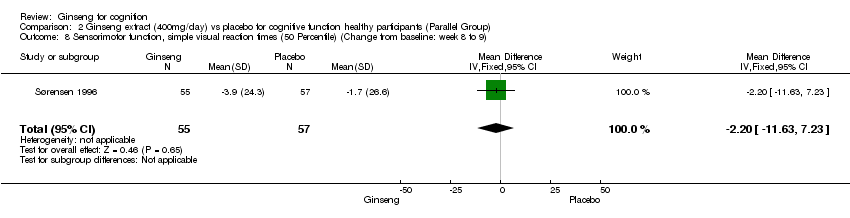
Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 8 Sensorimotor function, simple visual reaction times (50 Percentile) (Change from baseline: week 8 to 9).
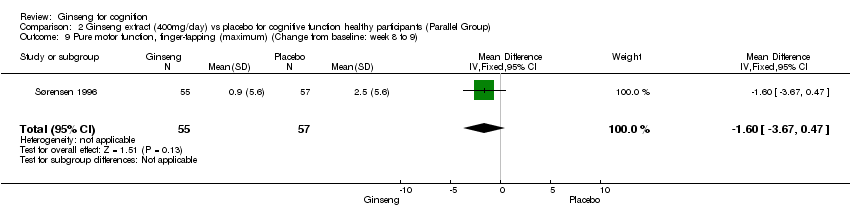
Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 9 Pure motor function, finger‐tapping (maximum) (Change from baseline: week 8 to 9).

Comparison 2 Ginseng extract (400mg/day) vs placebo for cognitive function healthy participants (Parallel Group), Outcome 10 Pure motor function, finger‐tapping (50 Percentile) (Change from baseline: week 8 to 9).

Comparison 3 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 1 Wechsler Memory Scale‐III (WMS‐III), Logical memory I (Change from baseline: week 8).
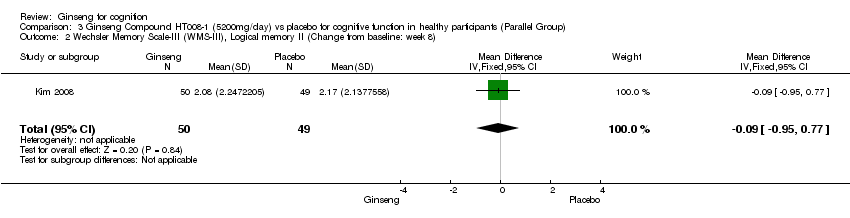
Comparison 3 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 2 Wechsler Memory Scale‐III (WMS‐III), Logical memory II (Change from baseline: week 8).
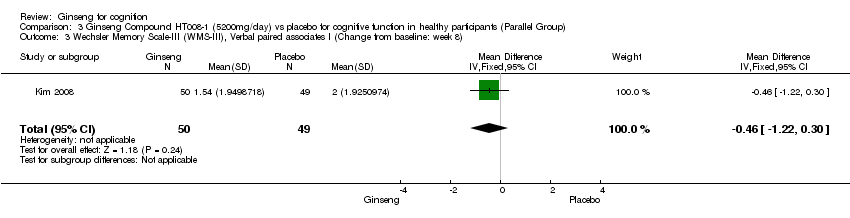
Comparison 3 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 3 Wechsler Memory Scale‐III (WMS‐III), Verbal paired associates I (Change from baseline: week 8).
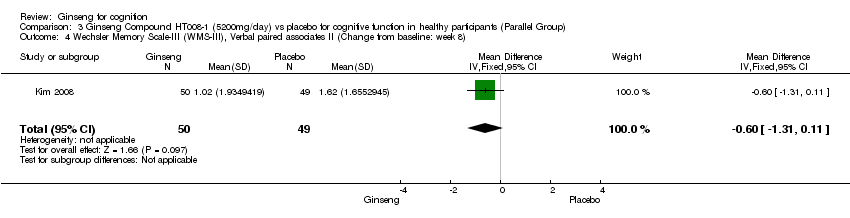
Comparison 3 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 4 Wechsler Memory Scale‐III (WMS‐III), Verbal paired associates II (Change from baseline: week 8).
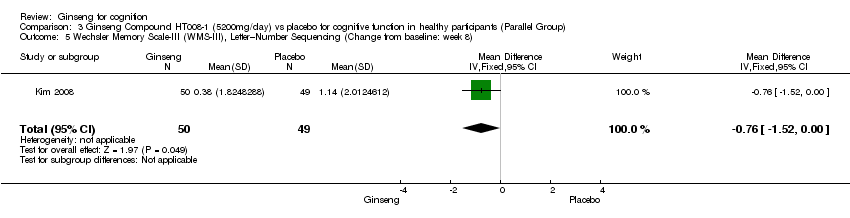
Comparison 3 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 5 Wechsler Memory Scale‐III (WMS‐III), Letter–Number Sequencing (Change from baseline: week 8).

Comparison 3 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 6 Wechsler Memory Scale‐III (WMS‐III), Spatial span (Change from baseline: week 8).

Comparison 3 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for cognitive function in healthy participants (Parallel Group), Outcome 7 Wechsler Memory Scale‐III (WMS‐III), Auditory recognition delayed (Change from baseline: week 8).
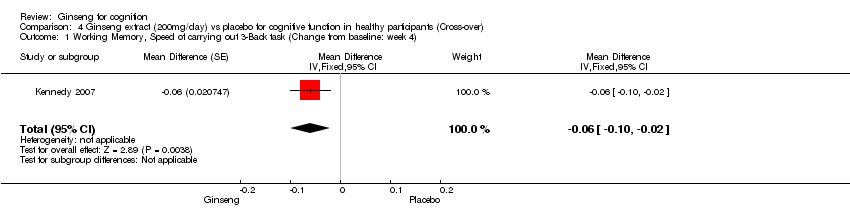
Comparison 4 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 1 Working Memory, Speed of carrying out 3‐Back task (Change from baseline: week 4).
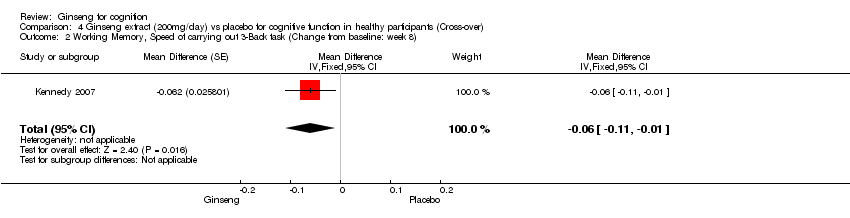
Comparison 4 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 2 Working Memory, Speed of carrying out 3‐Back task (Change from baseline: week 8).

Comparison 4 Ginseng extract (200mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 3 Working Memory, Corsi Block Digit span (Change from baseline: week 4).

Comparison 5 Ginseng extract (400mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 1 Speed of attention (Change from baseline: day 2).

Comparison 5 Ginseng extract (400mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 2 Continuity of attention (Change from baseline: day 2).
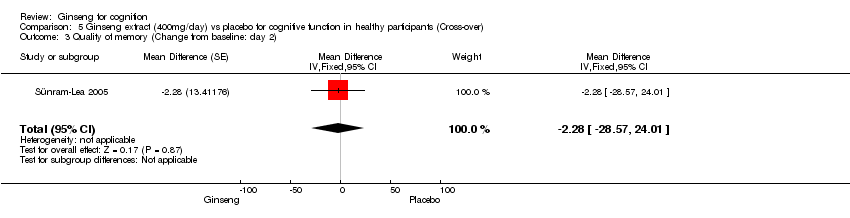
Comparison 5 Ginseng extract (400mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 3 Quality of memory (Change from baseline: day 2).
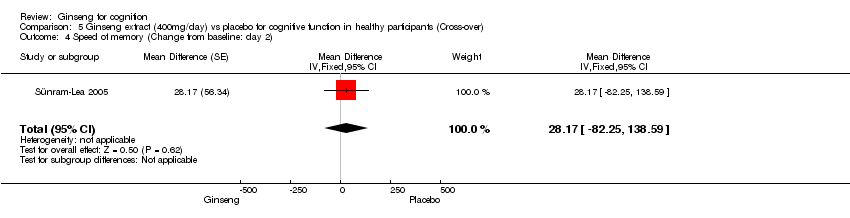
Comparison 5 Ginseng extract (400mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 4 Speed of memory (Change from baseline: day 2).
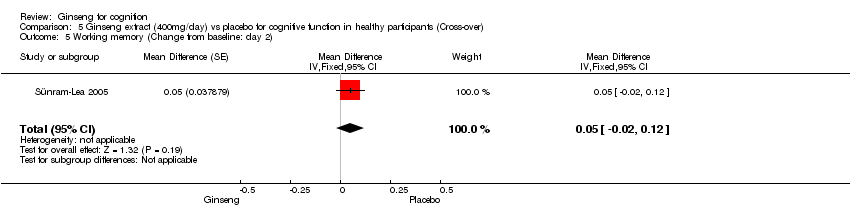
Comparison 5 Ginseng extract (400mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 5 Working memory (Change from baseline: day 2).

Comparison 5 Ginseng extract (400mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 6 Secondary memory (Change from baseline: day 2).
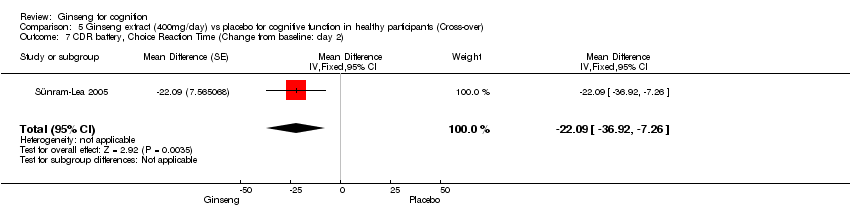
Comparison 5 Ginseng extract (400mg/day) vs placebo for cognitive function in healthy participants (Cross‐over), Outcome 7 CDR battery, Choice Reaction Time (Change from baseline: day 2).
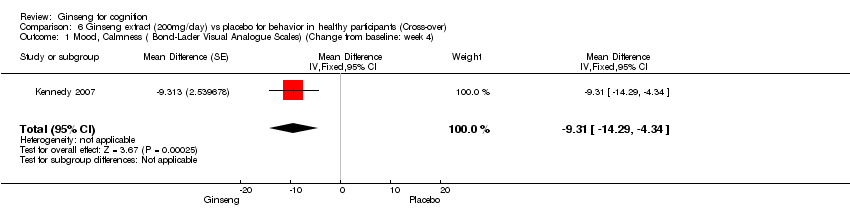
Comparison 6 Ginseng extract (200mg/day) vs placebo for behavior in healthy participants (Cross‐over), Outcome 1 Mood, Calmness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: week 4).

Comparison 6 Ginseng extract (200mg/day) vs placebo for behavior in healthy participants (Cross‐over), Outcome 2 Mood, Calmness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: week 8).

Comparison 7 Ginseng extract (400mg/day) vs placebo for behavior in healthy participants (Cross‐over), Outcome 1 Mood, Alertness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: day 2).

Comparison 7 Ginseng extract (400mg/day) vs placebo for behavior in healthy participants (Cross‐over), Outcome 2 Mood, Contentedness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: day 2).
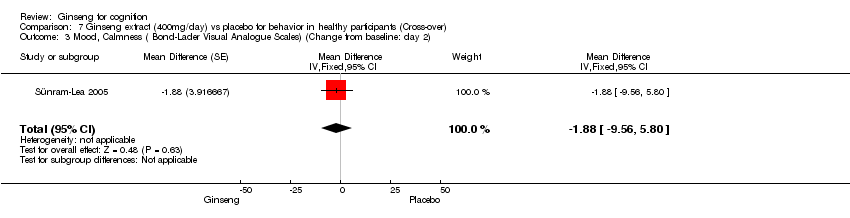
Comparison 7 Ginseng extract (400mg/day) vs placebo for behavior in healthy participants (Cross‐over), Outcome 3 Mood, Calmness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: day 2).
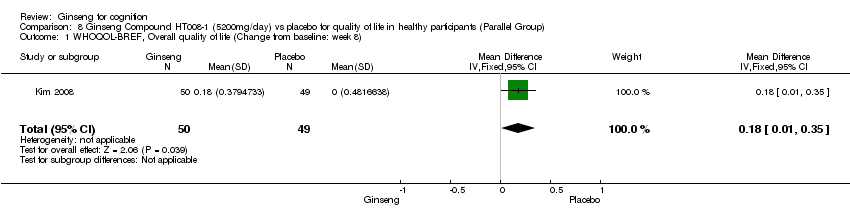
Comparison 8 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for quality of life in healthy participants (Parallel Group), Outcome 1 WHOQOL‐BREF, Overall quality of life (Change from baseline: week 8).
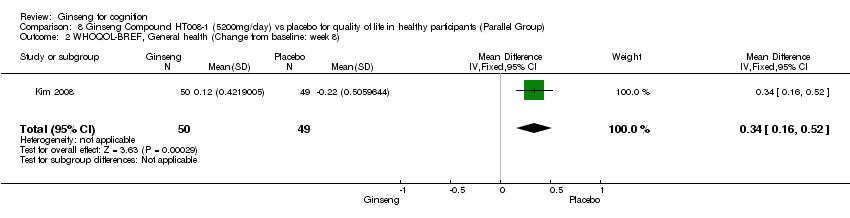
Comparison 8 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for quality of life in healthy participants (Parallel Group), Outcome 2 WHOQOL‐BREF, General health (Change from baseline: week 8).

Comparison 8 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for quality of life in healthy participants (Parallel Group), Outcome 3 WHOQOL‐BREF, Physical health (Change from baseline: week 8).

Comparison 8 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for quality of life in healthy participants (Parallel Group), Outcome 4 WHOQOL‐BREF, Psychological health (Change from baseline: week 8).

Comparison 8 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for quality of life in healthy participants (Parallel Group), Outcome 5 WHOQOL‐BREF, Social relationships (Change from baseline: week 8).
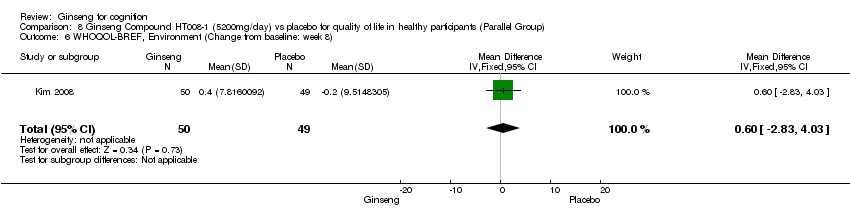
Comparison 8 Ginseng Compound HT008‐1 (5200mg/day) vs placebo for quality of life in healthy participants (Parallel Group), Outcome 6 WHOQOL‐BREF, Environment (Change from baseline: week 8).

Comparison 9 Ginseng extract (200mg/day) vs placebo for quality of life in healthy participants (Cross‐over), Outcome 1 WHOQOL‐BREF, Social relationships (Change from baseline: week 8).
| Pinyin Name | English Name | Latin Name |
| Ren shen | Asian ginseng Asiatic ginseng Chinese ginseng Ginseng Korean ginseng Manchurian ginseng Oriental ginseng Red ginseng (steamed & dried peeled roots) White ginseng (sun‐dried roots) | Panax ginseng |
| Xi yang shen | American ginseng Ginseng (USA) Wild American ginseng Occidental ginseng | Panax quinquefolius |
| Da ye san qi Ri ben ren shen Zhu jie shen | Japanese ginseng | Panax japonicus |
| Xia ye zhu jie shen Xia ye jia ren shen | Narrow‐leaved Japanese ginseng | Panax japonicus |
| San qi | Notoginseng Sanchi ginseng (USA) San‐qi ginseng (USA) South China ginseng Tien‐qi ginseng Yunnan ginseng | Panax notoginseng |
| Jia ren shen | False ginseng Nepal ginseng Himalayan ginseng Pseudoginseng | Panax pseudoginseng |
| Xiu li jia ren shen | Elegant pseudoginseng Pearl ginseng | Panax pseudoginseng |
| Zhu zi shen | Pearl ginseng | Panax pseudoginseng |
| Bai san qi Ping bian san qi Tu san qi Ye san qi Zhu jie qi | Pingpien ginseng | Panax stipuleanatus |
| San ye ren shen | Dwarf ginseng Groundnut (USA) | Panax trifolius |
| Yue nan ren shen Ou mei san qi | Bamboo ginseng Vietnamese ginseng | Panax vietnamensis |
| Xia ye jia ren shen | Narrow‐leaved pseudoginseng | Panax wangianus |
| Jiang zhuang san qi | Ginger ginseng Ginger‐like pseudo‐ginseng | Panax zingiberensis |
| Reference: Multilingual multiscript plant name database http://www.plantnames.unimelb.edu.au/Sorting/Panax.html#bipinnatifidus | ||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Attention and concentration, cancellation (No. of digits/2 min) (Change from baseline: week 12) Show forest plot | 1 | 32 | Mean Difference (IV, Fixed, 95% CI) | 2.0 [‐1.76, 5.76] |
| 2 Speed of processing, Mental arithmetic (correct responses/s) (Change from baseline: week 12) Show forest plot | 1 | 32 | Mean Difference (IV, Fixed, 95% CI) | 0.12 [0.03, 0.21] |
| 3 Speed of processing, Logical deduction (correct responses/s) (Change from baseline: week 12) Show forest plot | 1 | 32 | Mean Difference (IV, Fixed, 95% CI) | 0.02 [‐0.02, 0.06] |
| 4 Speed of processing, Digit symbol substitution (No. of symbols/90s) (Change from baseline: week 12) Show forest plot | 1 | 32 | Mean Difference (IV, Fixed, 95% CI) | ‐1.0 [‐5.32, 3.32] |
| 5 Sensorimotor function, choice reaction time (s/10‐no. of errors) (Change from baseline: week 12) Show forest plot | 1 | 32 | Mean Difference (IV, Fixed, 95% CI) | ‐0.01 [‐0.02, ‐0.01] |
| 6 Sensorimotor function, simple visual reaction time (s) (Change from baseline: week 12) Show forest plot | 1 | 32 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [‐0.01, 0.01] |
| 7 Sensorimotor function, simple auditory reaction time (s) (Change from baseline: week 12) Show forest plot | 1 | 32 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [‐0.01, 0.01] |
| 8 Pure motor function, tapping (taps/30s) (Change from baseline: week 12) Show forest plot | 1 | 32 | Mean Difference (IV, Fixed, 95% CI) | ‐8.0 [‐14.66, ‐1.34] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Attention and concentration, D2 (total score) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | 4.0 [‐11.15, 19.15] |
| 2 Learning and Memory, selective reminding (error index) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | 4.4 [0.82, 7.98] |
| 3 Learning and Memory, logical memory and reproduction (units lost) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [‐0.74, 0.74] |
| 4 Learning and Memory, Rey‐Oestrich complex figure (units lost) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | 0.20 [‐1.46, 1.86] |
| 5 Sensorimotor function, simple auditory reaction times (10 Percentile) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | ‐6.60 [‐15.72, 2.52] |
| 6 Sensorimotor function simple auditory reaction times (50 Percentile) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | ‐9.8 [‐22.69, 3.09] |
| 7 Sensorimotor function, simple visual reaction times (10 Percentile) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | ‐3.70 [‐11.26, 3.86] |
| 8 Sensorimotor function, simple visual reaction times (50 Percentile) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | ‐2.2 [‐11.63, 7.23] |
| 9 Pure motor function, finger‐tapping (maximum) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | ‐1.6 [‐3.67, 0.47] |
| 10 Pure motor function, finger‐tapping (50 Percentile) (Change from baseline: week 8 to 9) Show forest plot | 1 | 112 | Mean Difference (IV, Fixed, 95% CI) | ‐2.5 [‐5.07, 0.07] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Wechsler Memory Scale‐III (WMS‐III), Logical memory I (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | 0.20 [‐0.62, 1.02] |
| 2 Wechsler Memory Scale‐III (WMS‐III), Logical memory II (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | ‐0.09 [‐0.95, 0.77] |
| 3 Wechsler Memory Scale‐III (WMS‐III), Verbal paired associates I (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | ‐0.46 [‐1.22, 0.30] |
| 4 Wechsler Memory Scale‐III (WMS‐III), Verbal paired associates II (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | ‐0.60 [‐1.31, 0.11] |
| 5 Wechsler Memory Scale‐III (WMS‐III), Letter–Number Sequencing (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | ‐0.76 [‐1.52, ‐0.00] |
| 6 Wechsler Memory Scale‐III (WMS‐III), Spatial span (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | ‐0.23 [‐1.16, 0.70] |
| 7 Wechsler Memory Scale‐III (WMS‐III), Auditory recognition delayed (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | 0.38 [‐0.43, 1.19] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Working Memory, Speed of carrying out 3‐Back task (Change from baseline: week 4) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐0.06 [‐0.10, ‐0.02] | |
| 2 Working Memory, Speed of carrying out 3‐Back task (Change from baseline: week 8) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐0.06 [‐0.11, ‐0.01] | |
| 3 Working Memory, Corsi Block Digit span (Change from baseline: week 4) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | 0.28 [‐0.02, 0.57] | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Speed of attention (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐25.61 [‐46.79, ‐4.43] | |
| 2 Continuity of attention (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐0.32 [‐1.65, 1.01] | |
| 3 Quality of memory (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐2.28 [‐28.57, 24.01] | |
| 4 Speed of memory (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | 28.17 [‐82.25, 138.59] | |
| 5 Working memory (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | 0.05 [‐0.02, 0.12] | |
| 6 Secondary memory (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐2.33 [‐27.70, 23.04] | |
| 7 CDR battery, Choice Reaction Time (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐22.09 [‐36.92, ‐7.26] | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Mood, Calmness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: week 4) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐9.31 [‐14.29, ‐4.34] | |
| 2 Mood, Calmness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: week 8) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐5.91 [‐7.96, ‐3.85] | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Mood, Alertness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | 1.2 [‐4.68, 7.08] | |
| 2 Mood, Contentedness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐0.63 [‐4.00, 4.74] | |
| 3 Mood, Calmness ( Bond‐Lader Visual Analogue Scales) (Change from baseline: day 2) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | ‐1.88 [‐9.56, 5.80] | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 WHOQOL‐BREF, Overall quality of life (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | 0.18 [0.01, 0.35] |
| 2 WHOQOL‐BREF, General health (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | 0.34 [0.16, 0.52] |
| 3 WHOQOL‐BREF, Physical health (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | 3.78 [0.21, 7.35] |
| 4 WHOQOL‐BREF, Psychological health (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | 2.38 [‐1.17, 5.93] |
| 5 WHOQOL‐BREF, Social relationships (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | 4.02 [‐0.42, 8.46] |
| 6 WHOQOL‐BREF, Environment (Change from baseline: week 8) Show forest plot | 1 | 99 | Mean Difference (IV, Fixed, 95% CI) | 0.60 [‐2.83, 4.03] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 WHOQOL‐BREF, Social relationships (Change from baseline: week 8) Show forest plot | 1 | Mean Difference (Fixed, 95% CI) | 1.33 [0.43, 2.24] | |

