Antibioticoterapia de corta duración versus ciclo prolongado para la neumonía adquirida en el hospital en adultos graves
Resumen
Antecedentes
La neumonía es la infección más común adquirida en el hospital que afecta a pacientes en la unidad de cuidados intensivos (UCI). Sin embargo, las guías nacionales actuales para el tratamiento de la neumonía adquirida en el hospital (NAH) datan de hace varios años y el diagnóstico de la neumonía en los pacientes sometidos a ventilación mecánica (NAR) ha sido objeto de una considerable atención recientemente. No se conoce la duración óptima de la antibioticoterapia para la NAH en los enfermos graves.
Objetivos
Evaluar la efectividad de un ciclo corto frente a un ciclo prolongado de antibióticos para la NAH en adultos graves, incluidos los pacientes con NAR.
Métodos de búsqueda
Se hicieron búsquedas en CENTRAL (2015, número 5), MEDLINE (1946 hasta junio 2015), MEDLINE in‐process y otras citas no indizadas (5 junio 2015), EMBASE (2010 hasta junio 2015), LILACS (1982 hasta junio 2015) y Web of Science (1955 hasta junio 2015).
Criterios de selección
Se consideraron todos los ensayos controlados aleatorizados (ECA) que compararon una duración «corta» fija del tratamiento con antibióticos con un ciclo «prolongado» para la NAH (incluidos los pacientes con NAR) en adultos graves.
Obtención y análisis de los datos
Dos autores de la revisión realizaron la extracción de datos y la evaluación del riesgo de sesgo. Se estableció contacto con los autores de los ensayos para obtener información adicional.
Resultados principales
Se identificaron seis estudios pertinentes con 1088 participantes. Se incluyeron dos estudios nuevos publicados después de la fecha de la revisión anterior (2011). Hubo una variación considerable en los participantes, en los criterios de diagnóstico utilizados para definir un episodio de neumonía, en las intervenciones y en los resultados comunicados. No se encontró evidencia relacionada con los pacientes con una alta probabilidad de NAH que no estaban siendo sometidos a ventilación mecánica. En general, para los pacientes con NAR, un ciclo corto de siete u ocho días de antibióticos comparado con un ciclo prolongado de 10 a 15 días aumentó los días sin antibióticos en el plazo de 28 días (2 estudios; N = 431; diferencia de medias [DM] 4,02 días; intervalo de confianza [IC] del 95%: 2,26 a 5,78) y redujo la recurrencia de NAR debido a microorganismos multirresistentes (1 estudio; N = 110; odds ratio [OR] 0,44; IC del 95%: 0,21 a 0,95), sin afectar de forma negativa la mortalidad y otros resultados de la recurrencia. Sin embargo, en los casos de NAR causada específicamente por bacilos gramnegativos no fermentadores (BGN‐NF), la recurrencia fue mayor después del tratamiento de corta duración (2 estudios, N = 176; OR 2,18; IC del 95%: 1,14 a 4,16), aunque los resultados de la mortalidad no fueron significativamente diferentes. Un estudio encontró que un ciclo de tres días de tratamiento con antibióticos para pacientes con sospecha de NAH pero una puntuación baja en la Clinical Pulmonary Infection Score (CPIS) se asoció con un riesgo significativamente menor de sobreinfección o aparición de resistencia antimicrobiana, en comparación con el ciclo de tratamiento estándar (prolongado).
Conclusiones de los autores
Sobre la base de un pequeño número de estudios y ante la falta de una definición uniforme de neumonía, se concluye que para los pacientes con NAR no causada por BGN‐NF un ciclo corto y fijo (siete u ocho días) de antibioticoterapia no parece aumentar el riesgo de resultados clínicos adversos, y puede reducir la aparición de microorganismos resistentes, en comparación con un ciclo prolongado (10 a 15 días). Sin embargo, para los pacientes con NAR causada por BGN‐NF, parece haber un mayor riesgo de recurrencia después de un tratamiento de corta duración. Estas conclusiones no difieren de las de la revisión anterior y, en general, son consistentes con las guías actuales. Hay pocos datos de ECA que comparen la duración del tratamiento en pacientes no sometidos a ventilación que presentan NAH, pero sobre la base de un único estudio, el tratamiento de corta duración (tres días) para la NAH parece no estar asociado con un peor resultado clínico, y puede reducir el riesgo de infección posterior o la aparición de microorganismos resistentes cuando hay una baja probabilidad de neumonía según el CPIS.
PICOs
Resumen en términos sencillos
Antibioticoterapia de corta duración versus ciclo prolongado para la neumonía adquirida en el hospital en pacientes adultos de la unidad de cuidados intensivos
Pregunta de la revisión
Se examinó la evidencia de los ensayos controlados aleatorizados (ECA) que compararon los efectos de un ciclo corto frente a un ciclo prolongado de antibióticos para los pacientes de la unidad de cuidados intensivos con neumonía adquirida en el hospital (NAH).
Antecedentes
La neumonía adquirida en el hospital es la causa principal de infección hospitalaria en la unidad de cuidados intensivos (UCI). Existe una serie de factores que dan lugar a que los enfermos graves sean más propensos a desarrollar neumonía, entre los cuales el más importante es la intubación traqueal realizada conjuntamente con la ventilación mecánica; por lo tanto, la mayoría de los pacientes de la UCI con NAH presentan lo que se denomina neumonía asociada al respirador (NAR).
Existe la preocupación de que un ciclo innecesariamente prolongado de tratamiento con antibióticos pueda dar lugar a que los pacientes adquieran microorganismos resistentes a los antibióticos, que pueden ser más difíciles de reconocer y tratar cuando causan una infección y pueden aumentar los costes relacionados con los medicamentos. Por otro lado, un ciclo demasiado corto da lugar al riesgo de fracaso del tratamiento.
Características de los estudios
La evidencia estaba actualizada hasta junio 2015. Se identificaron seis ECA, que habían reclutado a 1088 pacientes. Los estudios adoptaron enfoques bastante diferentes en sus investigaciones, y solo se encontró un estudio que había explorado la duración del tratamiento con antibióticos para los pacientes de la UCI que presentaban NAH, pero no sometidos a ventilación mecánica.
Resultados clave
Para los pacientes con NAR, el hallazgo principal fue que un ciclo de siete u ocho días de antibióticos se asoció con una disminución general en la administración de antibióticos y redujo la recurrencia de neumonía causada por microorganismos resistentes en comparación con un ciclo de 10 a 15 días. Además, lo anterior se logró sin ningún efecto significativo en la mortalidad. No obstante, en los casos en los que la NAR fue causada por un tipo de microorganismo particular («bacilos gramnegativos no fermentadores») que puede ser difícil de erradicar con antibióticos, el riesgo de recurrencia de neumonía pareció mayor después de un ciclo de antibióticos de corta duración.
En un estudio se comprobó que para los pacientes con posible NAH (pero poco probable) un tratamiento de corta duración (tres días) pareció estar asociado con una menor probabilidad de adquirir microorganismos resistentes o de infecciones posteriores causadas por un microorganismo resistente.
Calidad de la evidencia
La calidad de la evidencia de las medidas de resultado principales fue de baja a moderada. Las principales razones por las que la calidad no fue alta incluyeron que solo se identificó un pequeño número de estudios y que hubo diferencias en las poblaciones de pacientes, en la naturaleza de las intervenciones entre los estudios y en los resultados informados.
Conclusiones de los autores
Summary of findings
| Should short‐course antibiotic therapy versus prolonged‐course antibiotic therapy be used in critically ill patients with hospital‐acquired pneumonia? | ||||||
| Patient or population: hospital‐acquired pneumonia | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Prolonged‐course antibiotic therapy | Short‐course antibiotic therapy | |||||
| Mortality | 175 per 1000 | 201 per 1000 | OR 1.18 | 598 | ⊕⊕⊕⊝ | — |
| Mortality NF‐GNB | 265 per 1000 | 255 per 1000 | OR 0.95 | 179 | ⊕⊕⊝⊝ | — |
| Mortality MRSA | 238 per 1000 | 286 per 1000 | OR 1.28 | 42 | ⊕⊕⊕⊝ | — |
| Recurrence of pneumonia | 180 per 1000 | 237 per 1000 | OR 1.41 | 733 | ⊕⊕⊝⊝ | — |
| Recurrence of pneumonia NF‐GNB | 247 per 1000 | 417 per 1000 | OR 2.18 | 176 | ⊕⊕⊕⊝ | — |
| Recurrence of pneumonia MRSA | 370 per 1000 | 479 per 1000 | OR 1.56 | 49 | ⊕⊕⊕⊝ | — |
| 28‐day antibiotic‐free days | The mean 28‐day antibiotic free days in the intervention groups was | 431 | ⊕⊕⊝⊝ | — | ||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Low total number of events. | ||||||
Antecedentes
Descripción de la afección
La neumonía adquirida en el hospital (NAH) suele definirse como la que se produce 48 horas o más después del ingreso al hospital y que no está en proceso de incubación en el momento del ingreso (ATS/IDSA 2005). Sigue siendo una causa importante de morbilidad y mortalidad asociadas a la atención sanitaria en la población general hospitalizada, con una tasa de 5 a 10 por cada 1000 ingresos hospitalarios (ATS/IDSA 2005). Los pacientes de la unidad de cuidados intensivos (UCI, también denominada unidad de terapia intensiva, UTI) parecen presentar un riesgo especial y en este contexto la neumonía es la causa más común de infección adquirida en el hospital en Europa y los Estados Unidos (Burgmann 2010; Richards 2000; Vincent 1995).
Más del 90% de los episodios de neumonía que se desarrollan en las UCI se producen en pacientes que están intubados y que son sometidos a ventilación mecánica (ATS/IDSA 2005); por consiguiente, la neumonía asociada al respirador (NAR) representa un subconjunto muy importante de la NAR en las UCI. La NAR se ha definido como la neumonía que se produce más de 48 a 72 horas después de la intubación traqueal (ATS/IDSA 2005) y se cree que afecta a un 10% a un 20% de los pacientes que reciben ventilación mecánica durante más de 48 horas (Safdar 2005). La intubación endotraqueal probablemente aumenta el riesgo de desarrollar neumonía al facilitar el crecimiento de posibles patógenos bacterianos en las vías respiratorias (Chastre 2002). Los pacientes son más propensos a desarrollar NAR si están más graves, son mayores, han sido sometidos a una cirugía previa o cuando ingresan al hospital con una insuficiencia neurológica o cardiovascular (Blot 2013; Chastre 2002). Recientemente se ha sugerido que la «traqueobronquitis asociada al respirador» (TAR), es decir, la infección del tracto respiratorio asociada al respirador en ausencia de cambios en la radiografía de tórax, puede ser un precursor de la NAR (Dallas 2011), y que el tratamiento con antibióticos puede evitar que un episodio se convierta en neumonía (Agrafiotis 2010).
Un episodio de NAH tiene consecuencias adversas para los enfermos graves. Se ha estimado que la mortalidad atribuible a un episodio de NAR (en contraposición con la enfermedad subyacente grave) es del 4% al 13% (Bekaert 2011; Melsen 2011; Melsen 2013). Además, la duración de la estancia en la UCI y en el hospital se prolonga de forma considerable cuando se desarrolla NAR y se ha estimado que los costes asociados oscilan entre USD 10 000 y 40 000 por paciente (Rello 2002; Safdar 2005; Warren 2003).
En los últimos años se han hecho considerables esfuerzos por perfeccionar las definiciones de la NAR, pero sigue habiendo dudas en cuanto a los medios óptimos para identificar un episodio de NAR con fines clínicos y de vigilancia. Tradicionalmente, se ha requerido evidencia radiológica de neumonía, criterios sistémicos (por ejemplo, pirexia o recuento anormal de glóbulos blancos) o criterios pulmonares (por ejemplo, presencia de respiración bronquial o empeoramiento de la tos) para llevar a cabo un diagnóstico de NAR (ATS/IDSA 2005; HELICS 2004; Horan 2008). Sin embargo, en la práctica puede ser muy difícil distinguir entre la NAR y otras afecciones que se producen en los pacientes graves sometidos a ventilación mecánica, incluidos los procesos no infecciosos como la atelectasia y el edema pulmonar. El cultivo cuantitativo de una muestra respiratoria broncoscópica invasiva (por ejemplo, lavado broncoalveolar, LBA) puede resultar especialmente atractivo para el diagnóstico de la NAR en grupos de pacientes con mayor probabilidad de una causa no pulmonar de inflamación sistémica (p.ej. pacientes con traumatismos o quirúrgicos, Sharpe 2015), y puede reducir la prescripción de antibióticos (Conway Morris 2011; Fagon 2000), pero no suele realizarse en las unidades europeas (Koulenti 2009). De hecho, puede haber una tendencia variable a realizar radiografías de tórax antes de iniciar un ciclo de antibióticos por sospecha de infección del tracto respiratorio adquirida en la UCI (Szakmany 2013), y un desacuerdo sobre la presencia o la ausencia de signos radiográficos (Wunderink 2000), o de características pulmonares clínicas.
Los Centers for Disease Control and Prevention's National Healthcare Safety Network (CDC/NHSN) últimamente han intentado mejorar la fiabilidad de la vigilancia de la morbilidad asociada al respirador en los Estados Unidos, concentrándose en criterios objetivos (por ejemplo cambios en la oxigenación, marcadores inflamatorios, iniciación de los antibióticos y microbiología positiva) e introduciendo una clasificación de «eventos asociados al respirador» (EAV) (Magill 2013), de los cuales la «posible NAR [PNAR]» ahora representa un ejemplo. En esta etapa relativamente temprana se ha planteado la preocupación de que, aunque el desarrollo de una «complicación asociada al respirador» (CAR) sobre la base de una peor oxigenación pueda predecir un resultado clínico más deficiente (Boyer 2015; Hayashi 2013; Klein Klouwenberg 2014; Muscedere 2013), la superposición entre un episodio de VAC (definido según las necesidades de vigilancia) y un episodio de NAR definido históricamente (según los criterios radiográficos, clínicos y microbiológicos) parece ser limitada (Boyer 2015; Hayashi 2013; Klein Klouwenberg 2014; Muscedere 2013; Stoeppel 2014). La utilidad potencial de estas afecciones recientemente definidas con respecto a la prescripción de antibióticos junto a la cama del paciente es incierta (Kipnis 2014).
Descripción de la intervención
Se han descripto varias estrategias para guiar la duración de la antibioticoterapia en el tratamiento de la NAH para los pacientes graves. Los antibióticos administrados de acuerdo a una duración fija son el tema de esta revisión (Chastre 2003a; Ibrahim 2001). Las guías nacionales publicadas en la última década han recomendado un ciclo de antibioticoterapia para la NAH de hasta ocho días cuando hubo una buena respuesta al tratamiento (ATS/IDSA 2005; BSAC 2008), pero un ciclo prolongado de dos a tres semanas si la respuesta ha sido deficiente, o cuando la infección se debe a un bacilo gramnegativo no fermentador (BGN‐NF), como Pseudomonas aeruginosa (P. aeruginosa) (ATS/IDSA 2005), un microorganismo particularmente difícil de erradicar de las vías respiratorias a pesar de su sensibilidad in vitro a la antibioticoterapia (Dennesen 2001; Visscher 2008), y un factor de riesgo independiente de recurrencia de la NAR y mortalidad (Combes 2007; Kollef 1995).
En una versión anterior de esta revisión (Pugh 2011) se exploraron otras estrategias para limitar la duración del tratamiento con antibióticos. Esas estrategias pueden individualizar y suspender el tratamiento según la resolución de las características clínicas (Micek 2004), según los criterios microbiológicos (p.ej. la reducción cuantitativa en el cultivo de las muestras respiratorias; Mueller 2007) o según un biomarcador pertinente, como la procalcitonina (Bouadma 2010; Stolz 2009a). En revisiones sistemáticas recientes específicas de pacientes graves con sepsis (Kopterides 2010) e infección aguda de las vías respiratorias (Schuetz 2012a; Schuetz 2012b) se han explorado estudios de la antibioticoterapia guiada por procalcitonina en pacientes graves (p.ej. Bouadma 2010; Jensen 2011; Nobre 2008; Stolz 2009a). También es de interés adicional el uso recientemente informado de la administración de infusiones prolongadas (p.ej. Chant 2012) y de nuevos métodos de administración, por ejemplo, la nebulización (p.ej. Niederman 2012).
De qué manera podría funcionar la intervención
La resolución de las anomalías clínicas asociadas con la NAR se observa a menudo en la primera semana de antibioticoterapia (Chastre 2003a; Dennesen 2001; Kollef 2012), en particular entre los supervivientes de la UCI (Luna 2003). En el caso de los que han respondido al tratamiento, una mayor prolongación del tratamiento con antibióticos podría dar lugar a la aparición de microorganismos resistentes (Chastre 2003a; Dennesen 2001), podría aumentar el riesgo de desarrollar la enfermedad asociada al Clostridium difficile (C. difficile) (Bignardi 1998; Dubberke 2014) y la toxicidad relacionada con los antibióticos, y aumentaría los costes relacionados con la medicación.
Por qué es importante realizar esta revisión
A nivel mundial, casi tres cuartas partes de los pacientes de la UCI reciben tratamiento con antibióticos (Vincent 2009), y cuando se prescriben para tratar una infección (en contraposición a la profilaxis) el objetivo se dirige mayormente al tracto respiratorio (Vincent 2009). La duración apropiada de la antibioticoterapia es una consideración clave en el manejo óptimo de los antimicrobianos (o el control de los antibióticos) en los pacientes graves con NAH (Kollef 2012b); un ciclo de tratamiento demasiado corto presenta el riesgo de que el tratamiento fracase, mientras que un ciclo de tratamiento demasiado prolongado conlleva costes innecesarios y plantea posibles riesgos para el paciente individual y para otros pacientes debido a la aparición de microorganismos resistentes.
No se conoce la duración óptima de la antibioticoterapia para la NAH (incluida la NAR) en los enfermos graves. Además, cuando la NAH se debe al BGN‐NF, como el P. aeruginosa, el riesgo potencial de fracaso del tratamiento después de un tratamiento de corta duración puede ser mayor.
Objetivos
Evaluar la efectividad de la administración de antibióticos de corta duración versus ciclo prolongado para la NAH en adultos graves, incluidos los pacientes con neumonía asociada al respirador (NAR).
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Ensayos controlados aleatorizados (ECA) que compararan un ciclo «corto» versus «prolongado» de antibioticoterapia en cuanto a los resultados clínicos y microbiológicos en pacientes graves con NAH establecida (incluida la NAR).
Tipos de participantes
Pacientes de la UCI (a partir de los 16 años de edad) con NAH (incluidos los pacientes con NAR) diagnosticados mediante las características clínicas o radiológicas o el cultivo cuantitativo de muestras de las vías respiratorias. Se excluyeron los datos relacionados con los pacientes con neoplasias hematológicas, inmunosupresión inducida químicamente o VIH/SIDA cuando fue posible.
Tipos de intervenciones
ECA que compararan la antibioticoterapia de duración «corta» fija (ocho días o menos) con un ciclo «prolongado» (incluida la atención estándar) de la antibioticoterapia.
Tipos de medida de resultado
Resultados primarios
-
Mortalidad a los 28 días.
-
Recurrencia de la neumonía (diagnosticada sobre la base de los criterios clínicos o microbiológicos).
-
Plazo de 28 días sin antibióticos.
Resultados secundarios
-
Mortalidad en la UCI.
-
Mortalidad en el hospital.
-
Resolución clínica de la neumonía (de acuerdo a los criterios clínicos o microbiológicos).
-
Recaída de la neumonía.
-
Infección posterior causada por «microorganismos resistentes» (por ejemplo, Staphylococcus aureus [S. aureus] resistente a la meticilina [SARM]).
-
Duración de la estancia en la UCI.
-
Duración de la estancia hospitalaria.
-
Duración de la ventilación mecánica (cuando corresponda).
-
Días sin ventilación mecánica (cuando corresponda).
-
Mortalidad atribuible a la NAH.
Métodos de búsqueda para la identificación de los estudios
Búsquedas electrónicas
We searched the Cochrane Central Register of Controlled Trials (CENTRAL 2015, Issue 5), MEDLINE (1946 to 2015), MEDLINE in‐process and other non‐indexed citations (5 June 2015), EMBASE (to June 2015), LILACS (1982 to June 2015) and Web of Science (1955 to June 2015).
We used the search strategy described in Appendix 1 to search MEDLINE and CENTRAL. We combined the MEDLINE search strategy with the Cochrane Highly Sensitive Search Strategy for identifying randomised trials in MEDLINE: sensitivity‐ and precision‐maximising version (2008 revision); Ovid format (Lefebvre 2011). We modified these terms to search EMBASE (Appendix 2), LILACS (Appendix 3) and Web of Science (Appendix 4). We imposed no publication or language restrictions.
Búsqueda de otros recursos
We also searched the World Health Organization (WHO) International Clinical Trials Platform registers of controlled clinical trials, clinicaltrials.gov and the UK Clinical Trials Gateway (5 June 2015). We searched the Database of Abstracts of Reviews of Effects (DARE) for additional reviews. We searched reference lists of identified studies and review papers, and the OpenGrey database of grey literature. We also searched abstracts of recent conferences: International Symposium for Intensive Care and Emergency Medicine, European Society for Intensive Care Medicine, Society of Critical Care Medicine, American Thoracic Society, British Thoracic Society, European Respiratory Society, Chest, Infectious Disease Society of America and Interscience Conference on Antimicrobial Agents, and Chemotherapy.
Obtención y análisis de los datos
Selección de los estudios
Two review authors (RP, CG) independently analysed and reviewed the titles and abstracts of retrieved records for possible inclusion in this review. We used the following inclusion criteria: RCT, participants included ICU patients with HAP, comparison of fixed 'short' (eight days or less) duration of antibiotic therapy with 'prolonged' course antibiotic therapy, and relevant outcome data. We attempted to contact trial authors to clarify methods where indicated. We resolved any disagreements about study inclusion through consensus and, where needed, we involved a third review author (GD).
Extracción y manejo de los datos
We used a standardised data extraction form. Two review authors (RP, CG) extracted data and entered these data into a Review Manager (RevMan) document (RevMan 2014). We contacted trial authors for any missing data.
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors (RP, GD) independently assessed the validity of studies using the Cochrane 'Risk of bias' tool (Sterne 2011). We resolved disagreements through consensus.
Medidas del efecto del tratamiento
We used the following dichotomous data for measuring treatment effect:
-
mortality;
-
clinical resolution;
-
recurrence;
-
relapse;
-
infection with 'resistant organism'.
In addition, we collected the following continuous data:
-
durations of stay;
-
duration of mechanical ventilation;
-
ventilation‐ and antibiotic‐free days.
Cuestiones relativas a la unidad de análisis
We did not identify significant unit of analysis issues (for example, randomisation of a group of individuals rather than an individual in a cluster‐randomised trial, or allocation of an individual to multiple interventions in a cross‐over trial).
Manejo de los datos faltantes
All studies presented data on the basis of the intention‐to‐treat (ITT) principle, i.e. all patients included in the study at the point of randomisation were analysed according to their assigned treatment group, regardless of whether or not treatment was completed.
Evaluación de la heterogeneidad
We anticipated sources of heterogeneity relating to: participation factors (preceding durations of hospitalisation and mechanical ventilation, bacterial pathogen, prior antibiotic administration and illness severity) and intervention factors (class of antibiotic and method of administration). We anticipated that methodological diversity would be a significant source of heterogeneity. We assessed heterogeneity on the basis of the I2 statistic, interpreting a value below 40% as not suggestive of important heterogeneity (Higgins 2002).
Evaluación de los sesgos de notificación
We attempted to minimise reporting bias by searching for unpublished trials and references to trial registries. Due to the small number of studies identified, we did not perform funnel plot tests for funnel plot asymmetry.
Síntesis de los datos
We used the mean difference (MD) as a summary statistic for continuous measures and the odds ratio (OR) for dichotomous measures. We chose a random‐effects model for meta‐analysis given the clinical and methodological diversity of studies, and limited scope to explore heterogeneity through subgroup analysis.
Análisis de subgrupos e investigación de la heterogeneidad
A priori subgroups were:
-
duration of hospitalisation prior to development of pneumonia;
-
ventilator‐ and non‐ventilator‐associated HAP;
-
duration of mechanical ventilation prior to development of pneumonia;
-
administration of antibiotic therapy during hospital admission prior to development of pneumonia;
-
severity of illness;
-
chronic respiratory illness;
-
bacterial pathogen: NF‐GNB and MRSA;
-
class of antibiotic(s).
However, outcome data were insufficiently reported for individual subgroups to enable investigation of sources of heterogeneity with the exception of bacterial pathogen.
We did not perform meta‐regression owing to the low number of included studies (Deeks 2011).
Análisis de sensibilidad
We intended to perform sensitivity analysis if there were apparent differences in participants, interventions or methodology, irrespective of measures of study heterogeneity (I2 statistic).
The studies with which we had particular concerns in this respect were: Medina 2007 (since data has been published in abstract form only), Capellier 2012 (since participants were specifically selected for likelihood of "early‐onset" ventilator‐associated pneumonia) and Kollef 2012 (due to multiple differences between intervention measures), and on this basis, pooled results excluding data from these studies are presented in Appendix 5.
Results
Description of studies
Results of the search
The searches of CENTRAL (2015, Issue 5), MEDLINE (Ovid) from 1946 to June 2015, MEDLINE in‐process and other non‐indexed citations to June 2015, EMBASE to June 2015, LILACS to June 2015 and Web of Science to June 2015 produced 5878 results (after removal of duplicates). Further searching of DARE within The Cochrane Library 2015, Issue 5 identified 131 records. Searches of additional databases produced the following: Clinical.Trials.gov 113 results, WHO International Clinical Trials Registry Platform 83 results, UK Clinical Trials Gateway one result.
Of these, we undertook full‐text review of 12 potentially eligible studies (Capellier 2012; CCCTG 2006; Chastre 2003a; Chastre 2003b; Fagon 2000; Fekih Hassen 2009; Kim 2012; Kollef 2012; Micek 2004; Sanchez‐Nieto 1998; Singh 1998; Singh 2000). We identified five other potential studies from review articles and reference lists (Ibrahim 2001; Kollef 2005; Peery 2001; Rello 2004; Sole 2000). We found a further four studies on investigation of the 'grey literature', including relevant database searches and review of conference abstracts (Labelle 2012; Maldonado‐Ortiz 2004; Medina 2007; Wolff 2003). Review of trials registers identified three potentially relevant ongoing studies (NCT01994980; NCT00410527; NCT01554657).
Included studies
Six studies met the criteria for inclusion in this review, reporting data from a total of 1088 participants (Capellier 2012; Chastre 2003a; Fekih Hassen 2009; Kollef 2012; Medina 2007; Singh 2000). Summary data are presented in the Characteristics of included studies table. Of these, five were RCTs comparing fixed durations of antibiotic therapy in patients with VAP (Capellier 2012; Chastre 2003a; Fekih Hassen 2009; Kollef 2012; Medina 2007). The sixth study was a RCT comparing short (three‐day) course therapy with 'standard' duration therapy for patients with a low probability of HAP, of whom only 58% were mechanically ventilated. There are substantial differences between this study and the others, and data from this study are therefore not included in meta‐analysis (Singh 1998).
Of these six studies, only Kollef 2012 appears to have been blinded, though details about blinding were not available for Fekih Hassen 2009. However, as discussed below, there is a potential significant source of bias in Kollef 2012, since different antibiotic and antibiotic administration regimens were adopted for the seven‐day course (doripenem) and the 10‐day course (imipenem).
Participants
In terms of study size, the multi‐centre French Pneuma study dominates, having enrolled 401 participants (Chastre 2003a). A second multi‐centre French study (Capellier 2012) and an international multi‐centre study (Kollef 2012) recruited 225 and 274 participants, respectively, although in Kollef 2012 primary analysis is focused on the 167 participants fulfilling a "microbiological intention‐to‐treat (MITT)". A Uruguayan study, Medina 2007, recruited 77 participants and has not yet, to our knowledge, been published in a peer‐reviewed journal. A smaller single‐centre Tunisian study, which recruited 30 participants, has been published in a French language journal (Fekih Hassen 2009). The single‐centre US study by Singh 2000 enrolled 81 participants.
With respect to patient characteristics, the Pneuma study was specifically designed to compare durations of antibiotic therapy in a population likely to have a high proportion of more resistant bacteria, including NF‐GNB such as P. aeruginosa, by excluding participants with early VAP (within the first five days of mechanical ventilation) and no antimicrobial therapy within the preceding 15 days (Chastre 2003a); 33% cases of VAP were due to NF‐GNB, and 11% due to MRSA. Kollef 2012 intended to study participants with late‐onset VAP and for the "MITT" group to include only patients with Gram‐negative VAP; of this MITT group, 31% cases of VAP were due to mono‐microbial NF‐GNB; there were no cases of mono‐microbial MRSA VAP, but in 6.6% of cases MRSA was identified with another Gram‐negative organism. Higher proportions of VAP due to NF‐GNB were reported in Fekih Hassen 2009 (72%) and in Medina 2007 (64%). In contrast, Capellier 2012 intended to enrol participants with early‐onset VAP (mechanical ventilation for more than 24 hours, but less than eight days), and there were no cases of VAP due to NF‐GNB or MRSA. Lastly, Singh 2000 sought to recruit patients with a low probability of pneumonia, as determined by a Clinical Pulmonary Infection Score (CPIS, a composite score based upon high or low temperature, leukocyte count, quality of tracheal secretion, oxygenation and presence of radiographic infiltrates) of less than seven at day one and day three; pathogens associated with an episode of HAP were incompletely reported.
Antibiotics had been administered prior to the onset of VAP in 100% participants in Kollef 2012, 84% of participants in Chastre 2003a, and 68% of participants in Medina 2007. Data regarding previous antibiotic use were not provided in Fekih Hassen 2009 nor in Singh 2000, and prior antibiotic administration for pneumonia was an exclusion criterion in Capellier 2012.
Where reported, duration of mechanical ventilation prior to onset of VAP differed between studies: 14 days (Chastre 2003a), 10 days (Fekih Hassen 2009), nine days (Medina 2007), and three days (Capellier 2012). This duration was not reported in Kollef 2012, and in Singh 2000 42% participants were not mechanically ventilated at enrolment.
Presence of underlying respiratory disease was inadequately reported for comparison between studies, and for illness severity scores only limited comparison was possible; mean SAPS II (Simplified Acute Physiology Score II) scores were 45 for Chastre 2003a, 43 for Fekih Hassen 2009, and 39 for Capellier 2012; SOFA (Sequential Organ Failure Assessment) scores were mean 7.3 for Chastre 2003a and 5.8 for Kollef 2012, and median 6 for Medina 2007.
Pneumonia definitions varied between studies. All included the need for radiological and clinical features; in several studies the diagnosis of primary episode of VAP necessitated a threshold quantitative culture of broncho‐alveolar lavage (BAL; Capellier 2012; Chastre 2003a, the "MITT" cohort in Kollef 2012) or protected specimen brush (PSB) samples (Chastre 2003a). In Fekih Hassen 2009, threshold quantitative culture was permissible from endotracheal aspirate (ETA) or PSB, and in Medina 2007, quantitative culture was not required if the CPIS was above six, or blood or pleural cultures were positive. In contrast, for Singh 2000 an episode of HAP was defined according to the development of new infiltrates on chest radiography together with clinical suspicion, and microbiological confirmation was not required.
CPIS was not reported by Chastre 2003a or by Capellier 2012. However, CPIS was six or above in 92% participants in Kollef 2012 and 67% in Fekih Hassen 2009. In Singh 2000, patients with CPIS above six were excluded from study, and mean CPIS was 4.9 on day of enrolment.
Interventions
For the majority of studies, a short course of seven or eight days was compared with a prolonged course of 10 to 15 days. Capellier 2012 and Chastre 2003a allocated patients to receive either eight days or 15 days of antibiotic therapy, Fekih Hassen 2009 and Kollef 2012 to seven days or 10 days of therapy, and Medina 2007 to eight days or 12 days of therapy. Singh 2000 allocated patients whose CPIS remained less than seven on the third day of antibiotic therapy to receive either three days' antibiotic therapy or non‐fixed "standard course" therapy (typically 10 to 21 days at the start of the recruitment), as determined by the treating physician.
The most common classes of antibiotics used in Chastre 2003a were an aminoglycoside or quinolone plus beta‐lactam (91%); in Medina 2007, beta‐lactams were used in 90% of cases and aminoglycosides in 27% overall. In Capellier 2012, all participants received a beta‐lactam for the allocated duration, combined with an aminoglycoside for the first five days of therapy. Carbapenems were used in 100% cases in Kollef 2012, with doripenem in the short‐course group and imipenem in the prolonged‐therapy group. Antibiotic class data are not presented in Fekih Hassen 2009. In Singh 2000, ciprofloxacin monotherapy was used in the short‐course group, but varied widely in the standard‐therapy group (including glycopeptide, beta‐lactam, aminoglycoside and macrolide therapy).
Initial antibiotic therapy was appropriate (according to respiratory specimen culture and sensitivity results) in all cases in Capellier 2012 and Chastre 2003a (from which any patients initially treated with inappropriate antibiotics were subsequently excluded) and in Kollef 2012 (in which the pathogen's imipenem minimum inhibitory concentration, MIC, was confirmed as less than 8 μg/mL). In one case among each of the short‐course and prolonged‐therapy groups the initial antibiotic therapy was inappropriate in both Fekih Hassen 2009 and Medina 2007. Appropriateness of initial therapy is not described in Singh 2000.
Uniquely among the included studies, Kollef 2012 allocated patients in the short‐course doripenem group to receive their antibiotic therapy as a theoretically favourable four‐hour infusion every eight hours (according to pharmacokinetic/pharmacodynamic models), whereas in the prolonged‐course group imipenem was administered as a one‐hour infusion eight‐hourly.
Outcomes
Although some unambiguous outcome measures were reported in the included studies (mortality, length of stay, duration of mechanical ventilation), discussion is required regarding other measures, including 'clinical resolution', 'recurrence' and 'relapse'.
The term 'clinical resolution' used in this review refers to the outcome measures described by Capellier 2012 ('clinical cure', evaluated at day 21 according to clinical and radiographic criteria), Kollef 2012 ('clinical cure', or resolution of clinical features and improvement or lack of progression of radiographic response to therapy, evaluated at day 10 of study) and Medina 2007 ('clinical resolution', described as lessening of symptoms and signs of infection such that additional therapy is not required, evaluation day unspecified).
'Recurrence' data were presented by Capellier 2012, Chastre 2003a, Fekih Hassen 2009, and Medina 2007. In Chastre 2003a, an episode of recurrence, whether relapse (i.e. due to same initial causative organism) or super‐infection (i.e. due to other organism), again required threshold quantitative culture of BAL or PSB; distal respiratory tract sampling could be prompted by changes in oxygenation or haemodynamic status, or development of fever, purulent secretions or new infiltrates on chest radiography. For Capellier 2012, a relapse was defined as culture of original organism in conjunction with clinical or radiological signs of pneumonia or worsening SOFA score. In Fekih Hassen 2009, episodes of recurrence ('réinfection') were described in terms of infection due to initial organism or other organism, presumably using the same clinical, radiographic and microbiological criteria as for a primary episode of VAP. Medina 2007 defined episodes of recurrence according to clinical and microbiological features occurring 72 hours or more after completing an initial course of antibiotic therapy.
Excluded studies
We excluded studies if they had been published as a full paper elsewhere (Chastre 2003b; Singh 1998; Wolff 2003), were not RCTs (Ibrahim 2001; Kollef 2005; Rello 2004), investigated a diagnostic strategy (CCCTG 2006; Fagon 2000; Peery 2001; Sanchez‐Nieto 1998; Sole 2000), or used a de‐escalation or discontinuation clinical protocol (Kim 2012; Micek 2004), or biomarker (Bouadma 2010; Micek 2004; Pontet 2007; Stolz 2009a), to guide duration of therapy rather than comparing fixed durations of therapy. We also excluded two studies published in abstract form: Maldonado‐Ortiz 2004 because of inadequate outcome data and perceived risk of bias, and Labelle 2012 because fixed courses of therapy appear not to have been utilised and duration of therapy was not significantly different between groups.
Please refer to the Characteristics of excluded studies table.
Risk of bias in included studies
Risk of bias is presented in detail in the Characteristics of included studies table, presented graphically in Figure 1 and summarised in Figure 2.

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
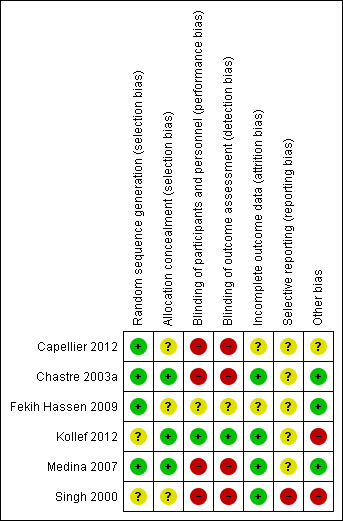
'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Sequence generation was adequate in four studies (Capellier 2012; Chastre 2003a; Fekih Hassen 2009; Medina 2007), and unclear in two studies (Kollef 2012; Singh 1998). Allocation concealment was adequate in three studies (Chastre 2003a; Kollef 2012; Medina 2007), and unclear in three studies (Capellier 2012; Fekih Hassen 2009; Singh 2000).
Blinding
In only one of the studies were there efforts to blind (Kollef 2012). In one study it was unclear whether blinding had been used and contact with the authors has been unsuccessful (Fekih Hassen 2009). Four studies were unblinded (Capellier 2012; Chastre 2003a; Medina 2007; Singh 2000).
Incomplete outcome data
Incomplete outcome data reporting was adequate in four studies (Chastre 2003a; Kollef 2012; Medina 2007; Singh 2000), and unclear in two (Capellier 2012; Fekih Hassen 2009).
Selective reporting
Selective reporting appears to have been a feature of one study (Singh 2000), and was unclear in five (Capellier 2012; Chastre 2003a; Fekih Hassen 2009; Kollef 2012; Medina 2007).
Other potential sources of bias
Interpretation of Kollef 2012 is made more difficult by there having been multiple interventions: the study compares a short course of one antibiotic administered according to theoretically favourable pharmacokinetic modelling versus a prolonged course of another antibiotic administered over a shorter, more conventional time course. Furthermore, the study was stopped early, having enrolled approximately half of the target (480) recruitment, on the basis of inferior efficacy and greater mortality in the short‐course therapy group. Lastly, data from five sites, which had enrolled 41 patients, were excluded from primary analysis because of poor compliance with agreed good clinical practice.
Singh 1998 was stopped early by an institutional review board. Results for patients managed in the 'experimental' group appear to have influenced management of patients subsequently allocated to the 'standard therapy group'.
Effects of interventions
Outcomes are presented in detail (including forest plots) in the Data and analyses section below. Outcomes are summarised in summary of findings Table for the main comparison below.
Primary outcomes
1. 28‐day mortality
Twenty‐eight‐day mortality was reported in three studies and did not differ significantly between short‐course and prolonged‐course therapy groups upon meta‐analysis (odds ratio (OR) 1.18; 95% confidence interval (CI) 0.77 to 1.80; Analysis 1.1); despite differences in study characteristics, heterogeneity appeared to be low (I2 statistic = 0%) (Chastre 2003a; Fekih Hassen 2009; Kollef 2012). Twenty‐eight‐day mortality was reported as significantly greater in the small subgroup of patients in Kollef 2012 with ventilator‐associated pneumonia (VAP) due toP. aeruginosa treated with short‐course therapy (6/17 (35.3%) versus 0/10 (0.0%); 95% CI 12.6% to 58.0%; Kollef 2012). However, including data for patients with other non‐fermenting Gram‐negative bacilli (NF‐GNB) VAP (i.e. Acinetobacter spp.) from this study together with patients with NF‐GNB VAP from Chastre 2003a in meta‐analysis, there was no significant difference in 28‐day mortality between short‐ and prolonged‐course therapy (Analysis 1.1). Similarly, we identified no differences in 28‐day mortality between intervention groups for patients with VAP due to MRSA, and between groups for patients with VAP not due to MRSA/NF‐GNB, or with an unspecified organism.
We performed sensitivity analysis to exclude data from Kollef 2012, given concerns regarding multiple interventions, premature cessation and compliance of several centres with agreed good clinical practice, but this did not lead to significant differences in 28‐day mortality on meta‐analysis (Appendix 5).
2. Recurrence of pneumonia
Recurrence data were presented in four VAP studies (Capellier 2012; Chastre 2003a; Fekih Hassen 2009; Medina 2007). Overall, there was a trend to increased recurrence following a short course of therapy (OR 1.41; 95% CI 0.94 to 2.12; Analysis 1.2; I2 statistic = 5%, suggesting low heterogeneity) in treatment of VAP. However, meta‐analysis of the two studies reporting recurrence data specifically for patients with VAP due to NF‐GNB demonstrated significantly greater recurrence for VAP due to NF‐GNB in the short‐course group (OR 2.18; 95% CI 1.14 to 4.16; P value = 0.02; Analysis 1.2; I2 statistic = 0%), though recurrence rate due to multi‐resistant organism was lower in the short‐course group in one study (OR 0.44; 95% CI 0.21 to 0.95; data from Chastre 2003a only; Analysis 1.11).
We performed a sensitivity analysis to exclude data from Medina 2007 (data currently published in abstract form only) and from Capellier 2012 (early‐onset VAP). On exclusion of data from Medina 2007, increased recurrence following short‐course therapy for VAP due to NF‐GNB was no longer statistically significant (Appendix 5).
3. 28‐day antibiotic‐free days
Chastre 2003a and Fekih Hassen 2009 provided data on 28‐day antibiotic‐free days for patients with VAP (total number of antibiotic‐free days over the 28‐day period, which begins with onset of VAP and commencement of antibiotics). Antibiotic‐free days were significantly greater in the short‐course group (mean difference (MD) 4.02 days; 95% confidence interval (CI) 2.26 to 5.78; Analysis 1.3; I2 statistic = 68%, indicating a high degree of heterogeneity) among patients with VAP due to all organisms (two studies), and in subgroups of patients with VAP due to NF‐GNB or MRSA (one study).
With regards to other measures of antibiotic exposure, for HAP patients randomised to the short‐course therapy group in Singh 2000, 28% of patients received antibiotics for more than three days, compared with 97% in the standard‐therapy group (P value = 0.0001).
Secondary outcomes
1. Intensive care unit (ICU) mortality
We identified no significant differences between short‐ and prolonged‐course antibiotic therapy with respect to ICU mortality, reported in two studies (Fekih Hassen 2009; Medina 2007) (Analysis 1.4).
2. In‐hospital mortality
We identified no significant differences between short‐ and prolonged‐course antibiotic therapy with respect to hospital mortality, reported in one study (Chastre 2003a) (Analysis 1.5).
Other mortality outcomes were reported with respect to: 21 days (Capellier 2012; Analysis 1.6), 60 days (Chastre 2003a; Analysis 1.7), and 90 days (Capellier 2012; Analysis 1.8). Again, we identified no significant differences between short‐ and prolonged‐course antibiotic therapy.
We separately considered data from Singh 1998, given the high proportion of non‐ventilated patients and the prerequisite that all included patients were at low risk of having pneumonia, according to Clinical Pulmonary Infection Score (CPIS). A trend towards lower 30‐day mortality was identified by the study authors in the short‐course group (OR 0.33; 95% CI 0.10 to 1.03). Outcomes for patients who were and were not mechanically ventilated were not reported separately.
3. Clinical resolution of pneumonia
Clinical resolution outcomes were reported in three studies: Capellier 2012 (evaluated at day 21), Kollef 2012 (evaluated at day 10) and Medina 2007 (unclear evaluation date). We observed a non‐significantly lower clinical resolution between treatment groups (OR 0.75; 95% CI 0.49 to 1.15; Analysis 1.9; I2 statistic = 0%) for all patients, and for the small subgroup patients with VAP due to NF‐GNB reported in one study (Kollef 2012). The authors of this last study also noted a significantly lower CPIS on day 11 among the prolonged‐therapy group compared with the short‐course group.
4. Relapse of pneumonia
Relapse of pneumonia was non‐significantly higher following short‐course therapy for VAP among patients as a whole (OR 1.70; 95% CI 0.97 to 2.97; Analysis 1.10) and the subgroup with NF‐GNB (OR 2.08; 95% CI 0.92 to 4.70) in two studies (Capellier 2012; Chastre 2003a).
5. Subsequent infection due to 'resistant organisms'
Recurrence rate due to multi‐resistant organisms was lower in the short‐course group in one study (OR 0.44; 95% CI 0.21 to 0.95; data from Chastre 2003a only; Analysis 1.11).
Singh 2000 reported a composite measure of antibiotic resistance and/or superinfection following treatment of HAP; in the short‐course group, this adverse outcome rate was found to be significantly lower at 13% versus 33% (P value = 0.03; Analysis 2.2).
6. Duration of ICU stay
Duration of ICU stay did not differ significantly between patients with VAP treated according to short‐course and prolonged‐course therapy (Analysis 1.12).
Singh 2000 reported a significantly reduced mean length of ICU stay in the short‐course therapy group (9.4 versus 14.7 days; standard deviation (SD) data not presented; P value = 0.04).
7. Duration of hospital stay
Duration of hospital stay did not differ significantly between patients with VAP treated according to short‐course and prolonged‐course therapy (Analysis 1.13).
8. Duration of mechanical ventilation
Duration of mechanical ventilation did not differ significantly between patients with VAP treated according to short‐course and prolonged‐course therapy (Analysis 1.14).
9. Mechanical ventilation‐free days
28‐day mechanical ventilation‐free days were reported in two studies, and did not differ significantly between study groups: mean 8.7 days (SD 9.1) in the short‐course and 9.1 days (SD 9.4) in the prolonged‐therapy group (Chastre 2003a), and 3.4 (SD 1.9) days in the short‐course versus 2.1 (SD 1.8) days in the prolonged‐therapy group (Fekih Hassen 2009).
10. Mortality attributable to HAP
The included trials did not report this outcome.
Discusión
Resumen de los resultados principales
Se identificaron seis estudios que habían reclutado a un total de 1088 participantes con neumonía (el 92% de los cuales presentaba neumonía asociada al respirador [NAR]) definida según diversos criterios radiológicos, clínicos y microbiológicos. Hubo diferencias notables entre los estudios en cuanto a las características de los pacientes y las intervenciones, aunque en su mayor parte esto no se representó en la heterogeneidad estadística.
Al considerar los cinco estudios que compararon duraciones fijas del tratamiento con antibióticos para la NAR (7 a 8 días versus 10 a 15 días), un ciclo más corto de tratamiento se asoció con una reducción significativa de la exposición a los antibióticos en cuanto a los días sin antibióticos en el plazo de 28 días en dos estudios (diferencia de medias [DM] 4,02 días; intervalo de confianza [IC] del 95%: 2,26 a 5,78), sin ningún aumento significativo de la mortalidad, la duración de la ventilación mecánica o la duración de la estancia hospitalaria, y de forma independiente del patógeno (Chastre 2003a; Fekih Hassen 2009). Un estudio informó que un ciclo más corto de antibioticoterapia se asoció con una reducción significativa de la recurrencia de NAR causada por microorganismos multirresistentes (odds ratio [OR] 0,44; IC del 95%: 0,21 a 0,95) (Chastre 2003a).
La resolución clínica de la NAR no fue significativamente menor (Capellier 2012; Kollef 2012; Medina 2007) (OR 0,75; IC del 95%: 0,49 a 1,15) y la recurrencia no fue significativamente mayor (Capellier 2012; Chastre 2003a; Fekih Hassen 2009; Medina 2007) (OR 1,41; IC del 95%: 0,94 a 2,12) en los pacientes que recibieron un tratamiento de corta duración. Se observó un aumento significativo de la recurrencia en el subgrupo de pacientes con NAR causada por bacilos gramnegativos no fermentadores (BGN‐NF) (Chastre 2003a; Medina 2007) (OR 2,18; IC del 95%: 1,14 a 4,16), aunque no en el caso de los que presentaban NAR causada por Staphylococcus aureus resistente a la meticilina (SARM). A pesar de lo anterior, el tratamiento de corta duración de la NAR causada por BGN‐NF no se asoció con otros resultados significativamente más deficientes, en cuanto a la mortalidad, los días sin ventilación mecánica y la duración de la estancia hospitalaria (Resumen de resultados, tabla 1).
En el caso de los pacientes graves con sospecha de NAH (con o sin ventilación mecánica) pero con baja probabilidad de neumonía (según una puntuación de la Clinical Pulmonary Infection Score [CPIS] inferior a siete en el primer y tercer día; Singh 2000), la interrupción de la antibioticoterapia en el tercer día se asoció con una duración significativamente más corta de la misma (media de tres días frente a 9,8 días; valor de P = 0,0001 informado), una reducción significativa en la tasa compuesta de sobreinfección y resistencia antimicrobiana (OR 0,29; IC del 95%: 0,09 a 0,92) y una reducción significativa de la estancia en la unidad de cuidados intensivos (UCI).
Compleción y aplicabilidad general de las pruebas
En esta revisión, se han incluido solo los estudios que utilizan duraciones fijas del tratamiento con antibióticos para la neumonía adquirida en el hospital (NAH) en los enfermos graves; por lo tanto (a diferencia de la versión anterior de nuestra revisión), se han excluido los estudios que evaluaron la respuesta clínica (por ejemplo, Micek 2004) o un biomarcador (procalcitonina; por ejemplo, Stolz 2009a) como guía para los ciclos variables de tratamiento con antibióticos. En los estudios incluidos participaron 1088 adultos graves con afecciones médicas y quirúrgicas (incluidas las de tipo cardiotorácicas y neuroquirúrgicas) que presentaban NAH en UCI de África, Asia, Europa y América del Norte, Central y del Sur. Sin embargo, el número de estudios fue escaso y los participantes, las intervenciones y los resultados informados variaron de forma considerable. Además, se identificó solo un estudio que presentó datos de resultados para los pacientes con NAH que no recibían ventilación mecánica; no se presentaron datos de resultados por separado para los subgrupos de pacientes que recibían y no recibían ventilación mecánica y, de hecho, se exigió que todos los pacientes inscritos tuvieran una «probabilidad baja» de padecer neumonía según el CPIS (Singh 2000). Todos los otros estudios incluidos se centraron en su totalidad en pacientes con NAR. Esta limitación es importante, ya que puede haber diferencias en las características de los pacientes y en la etiología bacteriana entre los casos de neumonía nosocomial adquirida en la UCI en presencia o ausencia de ventilación mecánica asistida (Esperatti 2010; Kohlenberg 2010); por lo tanto, las guías que intentan extrapolar datos de los estudios de pacientes con NAR a los pacientes no ventilados con NAH pueden ser potencialmente defectuosas.
Para los pacientes graves (que no necesariamente requieren asistencia respiratoria mecánica) con infiltrados radiográficos nuevos y sospecha de neumonía aunque con baja probabilidad (por ejemplo de acuerdo a la CPIS el día del diagnóstico y 72 horas después), un ciclo de corta duración (3 días) de la antibioticoterapia apropiada parece ser más adecuado que un ciclo prolongado (10 a 21 días) (Singh 2000), aunque la generalizabilidad de la monoterapia empírica con ciprofloxacina puede debatirse. Las guías actuales estadounidenses (ATS/IDSA 2005), británicas (BSAC 2008) y canadienses (Rotstein 2008) actuales no hacen ninguna recomendación específica para este escenario particular.
Un ciclo fijo de siete u ocho días (en lugar de 1 de 10 a 15 días) de antibioticoterapia parece reducir la exposición general a los antibióticos y, sobre la base de un estudio, reducir el riesgo de nuevas infecciones asociadas con microorganismos resistentes. Sin embargo, sobre la base de los datos agrupados de dos estudios que incluyeron a un total de 176 pacientes con NAR causada por BGN‐NF, un ciclo fijo de antibioticoterapia de corta duración (7 u 8 días) se asoció con un aumento significativo del riesgo de recurrencia en comparación con un ciclo más prolongado (12 o 15 días) (Chastre 2003a; Medina 2007). Los datos de resultados de un subgrupo de pacientes con NAR causada por BGN‐NF se presentaron solo en otro estudio; se observó una tendencia a una menor resolución clínica después del tratamiento de corta duración entre los pacientes con y sin NAR causada por BGN‐NF, y se observó una mayor CPIS al día 10 después del tratamiento de corta duración (Kollef 2012).
Debido a la menor resolución clínica (no significativa) entre los pacientes que recibieron el tratamiento de corta duración y la recurrencia significativamente mayor entre los pacientes con NAR causada por BGN‐NF, los datos relacionados a la presencia continua de patógenos bacterianos (p.ej. Pseudomonas sp.) en las muestras respiratorias durante y después del tratamiento de duración fija también pueden haber sido de interés, pero no se informaron de manera habitual en los estudios incluidos.
Los criterios de diagnóstico para definir un episodio de neumonía no fueron uniformes, y ninguno presentó datos con la clasificación nueva de los Centers for Disease Control and Prevention (CDC) de los eventos asociados al uso del respirador, incluida la posible NAR (PNAR).
Lamentablemente, no se dispuso de datos de resultado suficientes para poder explorar otros subgrupos de interés, por ejemplo: presencia de enfermedades respiratorias crónicas, gravedad de la enfermedad, administración previa de tratamiento con antibióticos, duración previa de la ventilación mecánica (es decir, NAR de inicio temprano o tardío) y clase de antibiótico (incluido el tratamiento combinado). Las duraciones del tratamiento que incorpora modalidades de administración más novedosas de posible interés presentaron factores de confusión relacionados con las intervenciones múltiples (p.ej. infusión extendida versus infusión estándar, doripenem versus imipenem, tratamiento de corta duración versus tratamiento prolongado) o no cumplieron con los criterios de inclusión para esta revisión (p.ej. uso de antibióticos nebulizados, como Niederman 2012).
La infección posterior causada por microorganismos resistentes solo se informó en dos estudios (uno de los cuales se presentó como una medida compuesta solamente). Es sorprendente que no se informara en absoluto sobre la aparición de infección extrapulmonar, en particular, la enfermedad asociada al C. difficile.
Tanto las guías estadounidenses (ATS/IDSA 2005) como las británicas (BSAC 2008) recomiendan que deben realizarse esfuerzos para acortar la antibioticoterapia para la NAH (incluidos los pacientes con NAR) a una duración de siete a ocho días, cuando hubo una respuesta clínica y, en el caso de las guías American Thoracic Society/Infectious Diseases Society of America (ATS/IDSA), cuando el microorganismo causal no es P. aeruginosa. En general, la revisión fue ampliamente consistente con estas guías; sin embargo, en el contexto de la NAR causada por BGN‐NF, es poco probable que el tratamiento de corta duración sea apropiado para todos los pacientes y la duración óptima sigue siendo incierta.
Calidad de la evidencia
Las diferencias en cuanto a los participantes, las intervenciones y los resultados informados entre los estudios dieron lugar a que el número de estudios que contribuyó a una determinada estadística de resumen fuese muy pequeño. Se consideró que el riesgo de sesgo de selección fue bajo en tres de los seis estudios incluidos. El cegamiento se produjo en solo uno de los seis estudios. Se considera que hubo otros sesgos significativos en dos de los estudios, debido a las diferencias múltiples entre los grupos de intervención (Kollef 2012), y a la contaminación del grupo de control con la interrupción temprana del estudio (Singh 2000). Por consiguiente, se evaluó la calidad de la evidencia según los criterios GRADE como baja a moderada para las principales medidas de resultado (Resumen de resultados, tabla 1).
Sesgos potenciales en el proceso de revisión
Se intentó disminuir el sesgo de varias maneras. La estrategia de búsqueda utilizó la Estrategia de Búsqueda Cochrane de Alta Sensibilidad (Cochrane Highly Sensitive Search Strategy) para identificar ensayos aleatorizados en MEDLINE. Además, se realizaron búsquedas de artículos de revisión y en la «literatura gris» para minimizar el sesgo de informe. Los criterios de inclusión se establecieron antes de la realización de las búsquedas y, de ser necesario, se estableció contacto con los autores para aclarar la elegibilidad del estudio. Los datos se recopilaron mediante un formulario estandarizado de recopilación de datos; cuando no estaban disponibles, se estableció contacto con los autores de los ensayos para que proporcionaran datos relevantes adicionales. Se evaluó sistemáticamente la validez interna utilizando la herramienta Cochrane del «Riesgo de sesgo».
Las posibilidades de heterogeneidad de los estudios se pusieron de manifiesto en la etapa de planificación de la presente revisión, por ejemplo, en lo que respecta a la metodología, los criterios de diagnóstico, la gravedad de la enfermedad y la clase de antibióticos. Se identificaron subgrupos relevantes a priori. Sin embargo, los datos de resultado no se presentaron normalmente con suficiente detalle como para permitir un análisis de subgrupos adecuado (p.ej. según la administración previa de antibioticoterapia, la duración previa de la ventilación mecánica, las clases de antibióticos, incluido el tratamiento combinado) y, debido a las diferencias metodológicas, se utilizó un modelo de efectos aleatorios para el metanálisis.
Debido al número muy pequeño de estudios incluidos, fue posible realizar el metanálisis de los datos de un máximo de cuatro (y con mayor frecuencia solo dos o tres) estudios por resultado. Se incluyeron estudios centrados en la NAR de inicio temprano (Capellier 2012), y los que reclutaron principalmente a pacientes con NAR de inicio tardío (p.ej. Chastre 2003a; Kollef 2012), con la intención de realizar el análisis según el microorganismo causal (p.ej. BGN‐NF). Se considera que este enfoque fue apropiado, en particular teniendo en cuenta que los informes recientes han cuestionado la relación entre la NAR de inicio temprano y la de inicio tardío y la probabilidad de que la neumonía se deba a un microorganismo resistente (Gastmeier 2009; Martin‐Loeches 2015; Restrepo 2013).
Debido a las diferencias marcadas en los participantes, las intervenciones y los resultados informados entre Singh 2000 y otros estudios, se consideraron los resultados de dicho estudio por separado.
Se realizó un análisis de sensibilidad para excluir los resultados de Kollef 2012 de los datos de mortalidad a los 28 días, que no produjo resultados diferentes. También se realizó un análisis de sensibilidad para excluir a Capellier 2012 (debido a su enfoque en la NAR de inicio temprano) y Medina 2007 (ya que se ha publicado solo en forma de resumen) de los resultados de la recurrencia, lo que dio lugar a que la recurrencia entre el subgrupo de pacientes con NAR causada por BGN‐NF ya no fuese estadísticamente significativa.
Acuerdos y desacuerdos con otros estudios o revisiones
Se han publicado tres revisiones sistemáticas centradas específicamente en la duración del tratamiento con antibióticos para la NAR (Dimopoulos 2013; Dugan 2003; Grammatikos 2008). Las dos primeras de estas revisiones incluyeron estudios de observación y estudios centrados en estrategias de diagnóstico (por ejemplo, el diagnóstico invasivo versus no invasivo de la NAR, Fagon 2000). Cabe destacar que la revisión Dugan 2003 también parece haberse escrito antes de la publicación del estudio Pneuma, el ensayo controlado aleatorizado (ECA) más grande realizado hasta la fecha para investigar la duración del tratamiento de la NAR (Chastre 2003a). La revisión sistemática publicada más recientemente, Dimopoulos 2013; se limitó a los ECA, al igual que esta revisión, pero excluyó a Singh 2000 (probablemente sobre la base de que incluía a pacientes no sometidos a ventilación y a que todos los pacientes presentaban una probabilidad baja de neumonía) y Medina 2007 (ya que actualmente se encuentra publicado solo en forma de resumen). En su revisión, se eligió la recaída como una medida de resultado primaria en lugar de la recurrencia.
Las conclusiones de Grammatikos 2008; a saber, que el tratamiento con antibióticos de corta duración para la NAR no causada por BGN‐NF no parece afectar de manera negativa la mortalidad, la recurrencia ni la duración de la estancia hospitalaria (Grammatikos 2008), concuerdan con los resultados de esta revisión y los de Dimopoulos 2013. Dugan 2003 estableció la conclusión de que un ciclo de tratamiento más corto puede asociarse con una reducción de la resistencia antimicrobiana, lo cual es consistente con Chastre 2003a. Sin embargo, los estudios publicados después de su revisión han proporcionado menos apoyo a los beneficios del tratamiento de corta duración en cuanto a la reducción de la estancia en la UCI y el hospital. Tras excluir a Medina 2007, la revisión sistemática publicada por Dimopoulos 2013 informó de una recaída que no fue significativamente mayor en los pacientes con NAR causada por BGN‐NF que recibieron tratamiento de corta duración, en lugar de la recurrencia significativamente mayor que se encontró en el metaanálisis.
El hallazgo de que la antibioticoterapia de corta duración para la NAR en ausencia de BGN‐NF puede ser adecuada, sin que aumente el riesgo de recurrencia o mortalidad, concuerda con los datos de los estudios de observación. Dennesen 2001 demostró que en 27 pacientes con NAR que recibieron un tratamiento antimicrobiano inicial apropiado la resolución clínica ocurrió en el plazo de los primeros seis días de tratamiento y que el S. pneumoniae, el H. influenzae y el S. aureus fueron erradicados en este período. Por el contrario, en el estudio de Dennesen el P. aeruginosa fue aislada a partir de los aspirados endotraqueales en todos los pacientes 15 días después de la iniciación del tratamiento, a pesar de una media de 12,7 días de tratamiento con antibióticos. De manera similar, El Solh 2007 también observó una disparidad entre la respuesta clínica y la colonización respiratoria persistente después de la antibioticoterapia apropiada durante siete días para la NAR, y se siguieron realizando cultivos de P. aeruginosa del lavado broncoalveolar (LBA) a pesar de las mejorías en la CPIS. Esta persistencia podría ser clínicamente significativa. Zhuo 2008 demostró que la carga bacteriana en pacientes con ventilación mecánica y colonización por P. aeruginosa pero que no cumplían los criterios clínicos de la NAR podía predecir el resultado; en su estudio, la alta carga de P. aeruginosa se asoció con una mortalidad significativamente mayor a los 28 días.
Una medida fiable de la respuesta clínica o microbiológica al tratamiento es atractiva como medio para identificar a los pacientes para los que puede ser apropiado un ciclo de tratamiento más corto, en particular entre los que presentan NAR causada por BGN‐NF. Kollef observó que diez días después del inicio de la antibioticoterapia para la NAR causada por la bacteria gramnegativa, la CPIS era menor entre los pacientes tratados durante 10 días en lugar de siete días (Kollef 2012). En un estudio no aleatorizado, el uso de la repetición del LBA para guiar la duración del tratamiento para la NAR en pacientes quirúrgicos/con traumatismos dio lugar a una reducción de la duración del tratamiento entre los pacientes con NAR causada por BGN‐NF en comparación con un grupo de control (media de 10,7 frente a 14,4 días respectivamente) sin que se produjera un aumento general de los días de UCI sin respirador, la mortalidad intrahospitalaria y la recaída de la NAR (Mueller 2007). Bouadma 2010, Pontet 2007 y Stolz 2009a informaron de reducciones en la exposición a los antibióticos en pacientes con NAR tratados según un algoritmo guiado por procalcitonina en comparación con el tratamiento estándar en los ECA, sin observar un aumento de la mortalidad. Las tasas de recurrencia no difirieron entre los grupos de uno de estos estudios (Pontet 2007), aunque los resultados para los pacientes específicamente con NAR causada por BGN‐NF no fueron informados en absoluto.
En resumen, hay muy pocos datos de pacientes no sometidos a ventilación que presenten NAH. En el caso de los pacientes con NAR, aunque el tratamiento de corta duración (7 a 8 días) para la NAR en general parece ser seguro, el aumento de la tasa de recurrencia de la NAR causada por BGN‐NF entre los pacientes a los que se les administra un tratamiento con antibióticos fijo de corta duración demostrado en la revisión puede representar una respuesta microbiológica o clínica inadecuada al tratamiento. Por lo tanto, parece que se justifica seguir trabajando para establecer la duración óptima del tratamiento, en particular para estos pacientes, quizás con estrategias que permitan la individualización del tratamiento.

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 1 28‐day mortality.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 2 Recurrence of pneumonia.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 3 28‐day antibiotic‐free days.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 4 ITU mortality.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 5 In‐hospital mortality.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 6 21‐day mortality.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 7 60‐day mortality.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 8 90‐day mortality.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 9 Clinical resolution.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 10 Relapse of pneumonia.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 11 Subsequent infection due to resistant organism.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 12 Duration of ICU stay.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 13 Duration of hospital stay.

Comparison 1 Short (fixed)‐course antibiotic therapy versus prolonged‐course antibiotic therapy for HAP, Outcome 14 Duration of mechanical ventilation.

Comparison 2 Discontinuation of antibiotics according to Clinical Pulmonary Infection Score, Outcome 1 30‐day mortality.

Comparison 2 Discontinuation of antibiotics according to Clinical Pulmonary Infection Score, Outcome 2 Episodes of superinfection or antimicrobial resistance.
| Should short‐course antibiotic therapy versus prolonged‐course antibiotic therapy be used in critically ill patients with hospital‐acquired pneumonia? | ||||||
| Patient or population: hospital‐acquired pneumonia | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Prolonged‐course antibiotic therapy | Short‐course antibiotic therapy | |||||
| Mortality | 175 per 1000 | 201 per 1000 | OR 1.18 | 598 | ⊕⊕⊕⊝ | — |
| Mortality NF‐GNB | 265 per 1000 | 255 per 1000 | OR 0.95 | 179 | ⊕⊕⊝⊝ | — |
| Mortality MRSA | 238 per 1000 | 286 per 1000 | OR 1.28 | 42 | ⊕⊕⊕⊝ | — |
| Recurrence of pneumonia | 180 per 1000 | 237 per 1000 | OR 1.41 | 733 | ⊕⊕⊝⊝ | — |
| Recurrence of pneumonia NF‐GNB | 247 per 1000 | 417 per 1000 | OR 2.18 | 176 | ⊕⊕⊕⊝ | — |
| Recurrence of pneumonia MRSA | 370 per 1000 | 479 per 1000 | OR 1.56 | 49 | ⊕⊕⊕⊝ | — |
| 28‐day antibiotic‐free days | The mean 28‐day antibiotic free days in the intervention groups was | 431 | ⊕⊕⊝⊝ | — | ||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Low total number of events. | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 28‐day mortality Show forest plot | 3 | 598 | Odds Ratio (M‐H, Random, 95% CI) | 1.18 [0.77, 1.80] |
| 1.1 NF‐GNB | 2 | 179 | Odds Ratio (M‐H, Random, 95% CI) | 0.95 [0.39, 2.27] |
| 1.2 MRSA | 1 | 42 | Odds Ratio (M‐H, Random, 95% CI) | 1.28 [0.32, 5.09] |
| 1.3 Non NF‐GNB/MRSA | 1 | 232 | Odds Ratio (M‐H, Random, 95% CI) | 1.65 [0.73, 3.73] |
| 1.4 Unspecified organism | 2 | 145 | Odds Ratio (M‐H, Random, 95% CI) | 1.22 [0.53, 2.78] |
| 2 Recurrence of pneumonia Show forest plot | 4 | 733 | Odds Ratio (M‐H, Random, 95% CI) | 1.41 [0.94, 2.12] |
| 2.1 NF‐GNB | 2 | 176 | Odds Ratio (M‐H, Random, 95% CI) | 2.18 [1.14, 4.16] |
| 2.2 MRSA | 2 | 49 | Odds Ratio (M‐H, Random, 95% CI) | 1.56 [0.12, 19.61] |
| 2.3 Non NF‐GNB/MRSA | 3 | 478 | Odds Ratio (M‐H, Random, 95% CI) | 1.17 [0.64, 2.14] |
| 2.4 Unspecified organism | 1 | 30 | Odds Ratio (M‐H, Random, 95% CI) | 1.17 [0.14, 9.59] |
| 3 28‐day antibiotic‐free days Show forest plot | 2 | 431 | Mean Difference (IV, Random, 95% CI) | 4.02 [2.26, 5.78] |
| 3.1 NF‐GNB | 1 | 127 | Mean Difference (IV, Random, 95% CI) | 4.5 [2.25, 6.75] |
| 3.2 MRSA | 1 | 42 | Mean Difference (IV, Random, 95% CI) | 8.0 [4.14, 11.86] |
| 3.3 Non NF‐GNB/ MRSA | 1 | 232 | Mean Difference (IV, Random, 95% CI) | 3.70 [2.09, 5.31] |
| 3.4 Unspecified organism | 1 | 30 | Mean Difference (IV, Random, 95% CI) | 2.3 [1.03, 3.57] |
| 4 ITU mortality Show forest plot | 2 | 107 | Odds Ratio (M‐H, Random, 95% CI) | 0.85 [0.37, 1.91] |
| 5 In‐hospital mortality Show forest plot | 1 | 401 | Odds Ratio (M‐H, Random, 95% CI) | 1.09 [0.71, 1.68] |
| 5.1 NF‐GNB | 1 | 127 | Odds Ratio (M‐H, Random, 95% CI) | 0.75 [0.36, 1.53] |
| 5.2 MRSA | 1 | 42 | Odds Ratio (M‐H, Random, 95% CI) | 1.47 [0.43, 4.95] |
| 5.3 Non NF‐GNB/MRSA | 1 | 232 | Odds Ratio (M‐H, Random, 95% CI) | 1.32 [0.72, 2.42] |
| 6 21‐day mortality Show forest plot | 1 | 225 | Odds Ratio (M‐H, Random, 95% CI) | 1.05 [0.41, 2.69] |
| 7 60‐day mortality Show forest plot | 1 | 401 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.86 [0.55, 1.35] |
| 7.1 NF‐GNB | 1 | 127 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.74 [0.35, 1.54] |
| 7.2 MRSA | 1 | 42 | Odds Ratio (M‐H, Fixed, 95% CI) | 1.0 [0.29, 3.47] |
| 7.3 Non NF‐GNB/ MRSA | 1 | 232 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.93 [0.49, 1.76] |
| 8 90‐day mortality Show forest plot | 1 | 198 | Odds Ratio (M‐H, Random, 95% CI) | 0.99 [0.49, 1.99] |
| 9 Clinical resolution Show forest plot | 3 | 472 | Odds Ratio (M‐H, Random, 95% CI) | 0.75 [0.49, 1.15] |
| 9.1 NF‐GNB | 1 | 55 | Odds Ratio (M‐H, Random, 95% CI) | 0.48 [0.16, 1.48] |
| 9.2 Unspecified organism | 3 | 417 | Odds Ratio (M‐H, Random, 95% CI) | 0.81 [0.51, 1.28] |
| 10 Relapse of pneumonia Show forest plot | 2 | 626 | Odds Ratio (M‐H, Random, 95% CI) | 1.70 [0.97, 2.97] |
| 10.1 NF‐GNB | 1 | 127 | Odds Ratio (M‐H, Random, 95% CI) | 2.08 [0.92, 4.70] |
| 10.2 MRSA | 1 | 42 | Odds Ratio (M‐H, Random, 95% CI) | 0.71 [0.14, 3.64] |
| 10.3 Non NF‐GNB/MRSA | 1 | 232 | Odds Ratio (M‐H, Random, 95% CI) | 1.41 [0.51, 3.92] |
| 10.4 Unspecified organism | 1 | 225 | Odds Ratio (M‐H, Random, 95% CI) | 2.92 [0.58, 14.78] |
| 11 Subsequent infection due to resistant organism Show forest plot | 1 | 110 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.44 [0.21, 0.95] |
| 12 Duration of ICU stay Show forest plot | 3 | 656 | Mean Difference (IV, Random, 95% CI) | 0.15 [1.00, 1.29] |
| 12.1 NF‐GNB | 1 | 127 | Mean Difference (IV, Random, 95% CI) | 0.90 [‐5.40, 7.20] |
| 12.2 MRSA | 1 | 42 | Mean Difference (IV, Random, 95% CI) | 2.90 [‐8.39, 14.19] |
| 12.3 Non NF‐GNB/MRSA | 2 | 457 | Mean Difference (IV, Random, 95% CI) | 0.45 [‐1.02, 1.92] |
| 12.4 Unspecified organism | 1 | 30 | Mean Difference (IV, Random, 95% CI) | ‐1.60 [‐4.61, 1.41] |
| 13 Duration of hospital stay Show forest plot | 1 | 30 | Mean Difference (IV, Fixed, 95% CI) | ‐1.0 [‐4.11, 2.11] |
| 14 Duration of mechanical ventilation Show forest plot | 3 | 332 | Mean Difference (IV, Random, 95% CI) | 0.02 [‐0.51, 0.54] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 30‐day mortality Show forest plot | 1 | 81 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.33 [0.10, 1.03] |
| 2 Episodes of superinfection or antimicrobial resistance Show forest plot | 1 | 81 | Odds Ratio (M‐H, Fixed, 95% CI) | 0.29 [0.09, 0.92] |

