Cesárea programada para mujeres con embarazo gemelar
Resumen
Antecedentes
Los embarazos gemelares se asocian con un aumento de la mortalidad perinatal relacionada principalmente con la prematuridad, aunque las complicaciones durante el parto pueden contribuir a la pérdida o a la morbilidad perinatales. Por lo tanto, se debe considerar la opción de la cesárea programada para evitar dichas complicaciones. Por otro lado, los ensayos aleatorizados de otras intervenciones clínicas sobre el proceso del parto para evitar problemas relacionados con el trabajo de parto y el parto (cesárea programada para la presentación podálica y monitorización electrónica continua de la frecuencia cardíaca fetal), mostraron una discordancia inesperada entre la morbilidad perinatal a corto plazo y el resultado neurológico a largo plazo. También se deben tener en cuenta los riesgos de la cesárea para la madre en el embarazo actual y en los posteriores.
Objetivos
Determinar los efectos a corto y a largo plazo sobre las madres y sus recién nacidos de la cesárea programada para el embarazo gemelar.
Métodos de búsqueda
Se realizaron búsquedas en el Registro de ensayos del Grupo Cochrane de Embarazo y Parto (18 de noviembre 2015) y en las listas de referencias de los estudios recuperados.
Criterios de selección
Ensayos aleatorizados que compararan una política de cesárea con el parto vaginal planificado para las mujeres con embarazo gemelar.
Obtención y análisis de los datos
Dos autores de la revisión evaluaron de forma independiente la elegibilidad y la calidad y extrajeron los datos. Se verificó la exactitud de los datos. Para los resultados importantes la calidad de la evidencia se evaluó mediante los criterios GRADE.
Resultados principales
Se incluyeron dos ensayos que compararon la cesárea programada versus el parto vaginal programado para los embarazos gemelares.
La mayoría de los datos incluidos en la revisión provinieron de un ensayo multicéntrico en que 2804 mujeres se asignaron al azar en 106 centros de 25 países. Todos los centros contaban con instalaciones para realizar cesáreas de urgencia y con personal anestésico, obstétrico y de enfermería disponible en el hospital en el momento del parto vaginal programado. En el segundo ensayo realizado en Israel se asignaron al azar 60 mujeres. Se consideró que el riesgo de sesgo fue bajo para todas las categorías excepto para el sesgo de realización (alto) y el sesgo de evaluación de los resultados (incierto).
No hubo evidencia clara de diferencias entre las mujeres asignadas al azar a una cesárea programada o a un parto vaginal programado para la muerte materna o la morbilidad grave (cociente de riesgos [CR] 0,86; intervalo de confianza [IC] del 95%: 0,67 a 1,11; 2844 mujeres; dos estudios; evidencia de calidad moderada). No hubo diferencias significativas entre los grupos para la muerte perinatal o neonatal o la morbilidad neonatal grave (CR 1,15; IC del 95%: 0,80 a 1,67; datos para 5565 recién nacidos, un estudio, evidencia de calidad moderada). Ningún estudio informó de la discapacidad infantil.
Para los resultados secundarios no hubo evidencia clara de diferencias entre los grupos para la mortalidad perinatal o neonatal (CR 1,41; IC del 95%: 0,76 a 2,62; 5685 recién nacidos; dos estudios; evidencia de calidad moderada), la morbilidad neonatal grave (CR 1,03; IC del 95%: 0,65 a 1,64; 5644 recién nacidos; dos estudios; evidencia de calidad moderada), ni para cualquiera de los otros resultados neonatales informados.
En ambos ensayos se informó del número de mujeres sometidas a cesárea. La mayoría de las mujeres en el grupo de cesárea programada recibieron tratamiento según lo planificado (al 90,9% se le realizó una cesárea), mientras que en el grupo de parto vaginal programado al 42,9% se le realizó una cesárea para al menos un gemelo. Con respecto a la mortalidad materna, no se informó sobre eventos en un ensayo, y en el otro se informó de dos muertes (una en cada grupo). No hubo diferencias significativas entre los grupos para la morbilidad materna grave en general (CR 0,86; IC del 95%: 0,67 a 1,11; 2844 mujeres; dos estudios), ni para los diferentes tipos de morbilidad a corto plazo. No hubo diferencias significativas entre los grupos para el fracaso de la lactancia materna (CR 1,14; IC del 95%: 0,95 a 1,38; 2570 mujeres, un estudio; evidencia de calidad moderada), ni para el número de mujeres con puntuaciones superiores a 12 en la escala de depresión posparto de Edinbugh (CR 0,95; IC del 95%: 0,78 a 1,14; 2570 mujeres, un estudio; evidencia de calidad moderada).
Conclusiones de los autores
Los datos provenientes sobre todo de un estudio multicéntrico de gran tamaño no encontraron evidencia clara del efecto beneficioso de la cesárea programada para los embarazos gemelares a término con presentación cefálica del primer gemelo. Se esperan datos sobre los resultados a largo plazo de los recién nacidos. A las mujeres se les debe informar de los posibles riesgos y efectos beneficiosos del trabajo de parto y el parto vaginal en relación con su presentación clínica específica, así como de los efectos actuales y a largo plazo de la cesárea para la madre y para los recién nacidos. No hay evidencia suficiente para apoyar el uso sistemático de la cesárea programada para el embarazo gemelar a término con presentación cefálica del primer gemelo, excepto en el contexto de ensayos aleatorizados adicionales.
PICO
Resumen en términos sencillos
Cesárea programada para el embarazo gemelar
La incidencia de gemelos varía considerablemente entre las comunidades y las familias y ha aumentado recientemente debido al número de madres con más edad y al uso de tratamientos de fertilidad y de concepción asistida. Los fetos de un embarazo gemelar presentan un riesgo mayor de muerte alrededor del momento del parto en comparación con los fetos de un embarazo con feto único. Parte del mismo se debe a un riesgo mayor de parto prematuro. El segundo gemelo en nacer presenta un mayor riesgo de un resultado perinatal deficiente comparado con el primero.
La política de parto vaginal programado para las mujeres con un embarazo gemelar en un ámbito hospitalario se asocia con una tasa del 30% al 40% de cesárea de urgencia. En los casos en que el primer gemelo nace por vía vaginal, aún existe el riesgo de cesárea de urgencia para el parto del segundo gemelo. Es posible que algunos de los resultados adversos se puedan evitar mediante un parto por cesárea programado apropiadamente, aunque deben tenerse en cuenta los riesgos de la cesárea para la madre en el embarazo actual y en los posteriores.
En esta revisión, se incluyeron dos ensayos aleatorizados que compararon la cesárea programada versus el parto vaginal programado para los embarazos gemelares, que en conjunto incluyeron 2864 mujeres. Para los resultados importantes la evidencia se evaluó como de calidad moderada.
Para la mortalidad materna no se informó de eventos en un ensayo y en el otro se informó sobre dos muertes (una en cada grupo). No hubo evidencia clara de diferencias entre las mujeres asignadas al azar a cesárea programada o a parto vaginal programado para la muerte o la enfermedad grave, ni para las madres ni para los recién nacidos. Ningún estudio informó de la discapacidad infantil.
En ambos ensayos se informó del número de mujeres sometidas a cesárea. La mayoría de las mujeres en el grupo de cesárea programada recibieron el tratamiento según lo planificado (90,9%), mientras que en el grupo de parto vaginal programado, en el 42,9% se realizó una cesárea para al menos un gemelo. No hubo diferencias significativas entre los grupos para el fracaso de la lactancia materna ni para la depresión posparto.
Hay muy poca evidencia clara de los estudios de investigación para proporcionar orientación sobre el método de parto para los embarazos gemelares. A las mujeres se les debe informar acerca de los efectos beneficiosos y perjudiciales, incluidas las consecuencias a corto plazo y a largo plazo para la madre y los recién nacidos. Los estudios de investigación futuros deben intentar proporcionar más claridad sobre este tema debido a que las intervenciones médicas en el proceso del parto se deben evitar a menos que haya una certeza clínica razonable de que presentarán un beneficio a largo plazo.
Conclusiones de los autores
Summary of findings
| Planned caesarean section versus planned vaginal birth for women with a twin pregnancy | ||||||
| Patient or population: women with a twin pregnancy | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with planned vaginal birth | Risk with Planned caesarean section | |||||
| Maternal death or serious maternal morbidity | Study population | RR 0.86 | 2844 | ⊕⊕⊕⊝ | ||
| 83 per 1000 | 71 per 1000 | |||||
| Moderate | ||||||
| 42 per 1000 | 36 per 1000 | |||||
| Perinatal or neonatal death or serious neonatal morbidity | Study population | RR 1.15 | 5565 | ⊕⊕⊕⊝ | ||
| 19 per 1000 | 21 per 1000 | |||||
| Disability in childhood | Study population | not pooled | 0 | No data were available for this outcome | ||
| not pooled | not pooled | |||||
| Perinatal or neonatal death | Study population | RR 1.41 | 5685 | ⊕⊕⊕⊝ | ||
| 6 per 1000 | 8 per 1000 | |||||
| Moderate | ||||||
| 3 per 1000 | 4 per 1000 | |||||
| Serious neonatal morbidity | Study population | RR 1.03 | 5644 | ⊕⊕⊕⊝ | ||
| 12 per 1000 | 13 per 1000 | |||||
| Moderate | ||||||
| 6 per 1000 | 6 per 1000 | |||||
| Longer‐term maternal outcomes: failure to breastfeed | Study population | RR 1.14 | 2570 | ⊕⊕⊕⊝ | ||
| 136 per 1000 | 155 per 1000 | |||||
| Longer‐term maternal outcomes: postnatal depression, as defined by trial authors (EPDS > 12) | Study population | RR 0.95 | 2570 | ⊕⊕⊕⊝ | ||
| 148 per 1000 | 140 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Wide 95% CI crossing the line of no effect | ||||||
Antecedentes
Descripción de la afección
El embarazo gemelar es resultado de uno de dos procesos biológicos diferentes. El proceso más frecuente es la fecundación de más de un óvulo luego de una ovulación múltiple. Aquí los neonatos pueden ser del mismo sexo o no, genéticamente no son más similares que los hermanos y tienen circulaciones placentarias y bolsas gestacionales separadas (dicigóticos, diamnióticos, dicoriónicos). El proceso menos frecuente es la división de un único embrión en desarrollo. Los neonatos son del mismo sexo y genéticamente idénticos. El grado de separación depende del estadio del desarrollo en el cual tiene lugar la separación, y puede ser cualquier opción desde circulaciones separadas (monocigóticos, dicoriónicos, diamnióticos) hasta gemelos unidos.
La incidencia de gemelos monocigóticos es bastante constante, pero la de gemelos dicigóticos varía considerablemente entre las comunidades y las familias y ha aumentado recientemente en muchos servicios sanitarios con recursos adecuados debido a la administración de tratamientos de fertilidad y de reproducción asistida, así como al aumento del número de madres de más edad (Anonymous 2000; Laws 2010; Wilcox 1996). La tasa de partos múltiples varía de un país a otro. En Canadá la tasa de partos múltiples aumentó del 1,9% en 1981 al 2,5% en 1997 (Anonymous 2000; Joseph 2001a). En Australia, la tasa en 2008 fue del 3,1% de todos los partos (Laws 2010).
Más del 97% de todos los embarazos múltiples son embarazos gemelares (Joseph 1998). Aproximadamente el 40% de los gemelos tiene una presentación de vértice/vértice, en el 35% la presentación es vértice/no vértice y en el 25% restante de los gemelos el primer recién nacido tiene una presentación diferente de vértice al parto (Blickstein 1987; Grisaru 2000).
Mortalidad y morbilidad de los gemelos versus neonatos de embarazos únicos
Los recién nacidos de un embarazo gemelar tienen un riesgo mayor de mortalidad perinatal/neonatal que los que provienen de un embarazo único (Cheung 2000; Fabre 1988; Ghai 1988; Joseph 2001b; Kiely 1990; Lie 2000). Parte del mismo se debe a un riesgo mayor de parto prematuro (Joseph 2001b). Sin embargo, incluso entre los recién nacidos gemelos con más de 2500 g al nacer, hay un riesgo mayor de muerte en comparación con los neonatos de embarazos únicos del mismo peso al nacer. Nuevamente, las tasas absolutas de mortalidad y morbilidad perinatal variarán según la población. En Australia, la tasa de mortalidad perinatal para los gemelos en 2008 fue 6,8 veces mayor, y fue 18,1 veces mayor para los partos múltiples en comparación con los partos únicos (Laws 2010). Kiely 1990 examinó los datos de 16 831 partos múltiples de los registros demográficos computadorizados del New York City Department of Health para el período de 1978 a 1984. La tasa de mortalidad perinatal para los gemelos versus neonatos de embarazos únicos de 2501 a 3000 g fue 4,3/1000 versus 3,8/1000 (cociente de riesgos [CR] 1,12) y en los de 3001 g o más, 7,4/1000 versus 2,2/1000 (CR 3,32), respectivamente. La tasa de mortalidad fetal intraparto para gemelos versus únicos entre 2501 y 3000 g fue 1,22/1000 versus 0,34/1000 (CR 3,54; IC del 95%: 1,82 a 6,88). Otros estudios confirmaron este riesgo mayor de muerte fetal y neonatal en los gemelos versus los recién nacidos de embarazos únicos cuando el embarazo es a término o casi a término, o cuando están por encima de los 2500 g de peso al nacer (Cheung 2000; Fabre 1988; Ghai 1988; Lie 2000). También se demostró que las convulsiones neonatales, la morbilidad respiratoria y las puntuaciones de Apgar bajas al minuto y a los cinco minutos son mayores para los gemelos versus los neonatos de embarazos únicos con un peso al nacer mayor de 1500 g y mayor de 3000 g (Ghai 1988).
Parte del riesgo mayor de un resultado perinatal adverso en los gemelos en comparación con los neonatos de embarazos únicos se puede deber al crecimiento fetal restringido que, a su vez, puede dar lugar a un riesgo mayor de eventos adversos que ocurren durante el embarazo, durante el trabajo de parto o durante el parto. El riesgo mayor se puede deber al traumatismo y la asfixia asociados con el parto del segundo gemelo. Es posible que algunos de estos resultados adversos se puedan evitar mediante un parto por cesárea programado apropiadamente. El momento adecuado del parto para las mujeres con un embarazo gemelar es el tema de otra revisión Cochrane (Dodd 2014).
En un ensayo controlado aleatorizado multicéntrico que comparó la cesárea programada y el parto vaginal programado para el feto único a término en presentación podálica, la cesárea programada redujo en tres veces el riesgo de muerte perinatal o de morbilidad neonatal grave (del 5,0% al 1,6%; p < 0,001) (Hannah 2000). Aunque algunas de las muertes del grupo de parto vaginal programado en este estudio se debieron a las dificultades asociadas con el parto real, otras se asociaron con problemas que ocurrieron durante el trabajo de parto. Por lo tanto, una política de cesárea programada puede ser beneficiosa para las mujeres con un embarazo en riesgo de complicaciones durante el trabajo de parto debido a que reduce la exposición del embarazo al trabajo de parto.
De qué manera podría funcionar la intervención
Evidencia de efectos beneficiosos y riesgos relacionados con la cesárea programada para los gemelos
Resultado para el segundo gemelo comparado con el primer gemelo
En un estudio de 1305 pares de gemelos con un peso al nacer de 1500 g que nacieron entre 1988 y 1999 en Nova Scotia, el riesgo de resultados perinatales adversos (muerte fetal intraparto, muerte neonatal, síndrome de dificultad respiratoria [SDR] moderado a grave, asfixia, traumatismo y complicaciones de la prematuridad) aumentó significativamente para los segundos gemelos en comparación con los primeros gemelos en nacer (CR 2,1; IC del 95%: 1,4 a 3,1) (Persad 2001b). Sin embargo, se debe señalar que en el Term Breech Trial, la morbilidad neonatal a corto plazo no se asoció con un deterioro a largo plazo (Whyte 2004).
También hay evidencia de que el segundo gemelo presenta un riesgo mayor de un resultado perinatal adverso comparado con el primer gemelo cuando el parto es vaginal, aunque no se ha mostrado lo mismo cuando el parto es por cesárea. Arnold y colegas realizaron un estudio pareado de casos y controles de pares de gemelos prematuros (Arnold 1987). El riesgo de SDR aumentó para el segundo gemelo en comparación con el primero si el parto fue vaginal (odds ratio [OR] 14,2; IC del 95%: 2,5 a 81,1), pero no si el parto fue por cesárea (OR 0,90; IC del 95%: 0 a 17,8). Lo anterior se podría deber a un mayor efecto protector del parto vaginal para el primer gemelo.
Resultados para los gemelos nacidos por vía vaginal versus por cesárea
Se informó sobre tasas mayores de resultados perinatales adversos para el embarazo gemelar a término o casi a término cuando el parto es vaginal versus por cesárea (Barrett 2004). En la revisión Kiely 1990, para los gemelos en presentación de vértice que pesaron más de 3000 g al nacer la tasa de mortalidad perinatal fue 12,3/1000 versus 2,9/1000 (CR 4,22) cuando el parto fue vaginal versus por cesárea. Sin embargo, las comparaciones del método de parto real en contraposición con el planificado están sujetas a un sesgo considerable. En un estudio retrospectivo de mujeres con cesárea previa y un embarazo gemelar actual, la mortalidad perinatal fue más frecuente después de la prueba de trabajo de parto en comparación con la cesárea repetida, pero no hubo diferencias en el resultado después de ajustar las variables de confusión (Aaronson 2010).
Hay cada vez más evidencia de los efectos beneficiosos perinatales relacionados con el parto vaginal. En un estudio transversal de 6929 neonatos sin malformaciones congénitas, con edades gestacionales de 37 a 41 semanas (6/7) con presentación de vértice, el parto por cesárea no urgente bajo anestesia regional comparado con el parto vaginal bajo anestesia local o ninguna anestesia aumentó el riesgo de asistencia respiratoria con bolsa y mascarilla (OR 1,42; IC del 95%: 1,07 a 1,89) cuando se ajustó por el número de embarazos, la hipertensión materna y el peso al nacer (De Almeida 2010). Sin embargo, otro estudio retrospectivo no encontró un aumento significativo en la taquipnea transitoria del recién nacido asociado con el aumento de las tasas de cesárea electiva para los embarazos gemelares con el transcurso del tiempo (Suzuki 2010).
En un estudio retrospectivo de los partos de gemelos a la semana 37 de gestación o más, la cesárea electiva se asoció con un mayor riesgo de transfusión en el recién nacido, no así la de urgencia (Suzuki 2008).
Resultados para los gemelos nacidos por parto vaginal programado (parto vaginal real más cesárea de urgencia) versus cesárea programada
Una revisión sistemática de los estudios no aleatorizados que compararon las políticas de parto vaginal programado y cesárea programada para el parto de gemelos que pesaron al menos 1500 g o alcanzaron al menos las 32 semanas de gestación (Hogle 2002) encontró cuatro estudios pequeños que fueron elegibles para inclusión en la revisión (Blickstein 2000; Grisaru 2000; Rabinovici 1987; Wells 1991). Un metanálisis de los datos de los cuatro estudios no encontró diferencias significativas entre los dos enfoques para el parto en cuanto a la mortalidad o la morbilidad neonatal, aunque la puntuación de Apgar baja a los cinco minutos se redujo con una política de cesárea. Sin embargo, este hallazgo se limitó a los gemelos en los cuales el primero tenía una presentación podálica. Una comparación retrospectiva posterior del parto vaginal programado versus cesárea programada para los embarazos gemelares con el primer gemelo en presentación podálica no encontró una diferencia significativa en la morbilidad perinatal o materna, aparte de un aumento en la enfermedad tromboembólica en el grupo de cesárea programada (Sentilhes 2007). Dos estudios retrospectivos grandes de mujeres con cesárea previa y un embarazo gemelar actual, que compararon el parto vaginal programado con la cesárea electiva (Ford 2006; Varner 2005), no encontraron diferencias en el resultado materno o perinatal, excepto una incidencia de rotura uterina del 0,9% en el grupo de parto vaginal programado en un estudio (Ford 2006).
Una comparación de los resultados en dos distritos daneses con tasas altas (57%) y bajas (28%) de cesáreas para el embarazo gemelar no encontró diferencias en los resultados perinatales (Henriksen 1994).
Las versiones publicadas anteriormente de esta revisión (Crowther 1996; Hofmeyr 2011) solo encontraron un ensayo controlado aleatorizado de cesárea programada versus parto vaginal programado para gemelos, en que se reclutaron 60 pares de gemelos (Rabinovici 1987). No hubo muertes perinatales ni casos de morbilidad neonatal grave en los grupos. El tamaño de muestra fue demasiado pequeño para aportar evidencia del mejor enfoque para el parto.
En los entornos de bajos recursos con instalaciones y personal limitados, altas tasas de complicaciones después de la cesárea y un acceso incierto de la madre a las instalaciones para la cesárea en embarazos futuros, los efectos beneficiosos para la madre al evitar la cesárea son mayores que en los entornos bien dotados de recursos.
Resultados para el segundo gemelo nacido por cesárea después del parto vaginal del primer gemelo, en comparación con la cesárea para ambos gemelos
Un estudio prospectivo multicéntrico de cohortes comparó el resultado para los segundos gemelos nacidos por cesárea después del parto vaginal del primer gemelo, en comparación con la cesárea para ambos gemelos. No hubo diferencias en las puntuaciones de Apgar bajas, en el pH bajo en la sangre del cordón umbilical ni en la encefalopatía neonatal. La infección neonatal aumentó en el grupo con cesárea después del parto vaginal del primer gemelo, aunque esta diferencia no fue estadísticamente significativa después del análisis de regresión logística (Alexander 2008). En un estudio retrospectivo grande de parto vaginal programado para los embarazos gemelares, la cesárea para el segundo gemelo ocurrió en el 9% de los casos y fue más frecuente cuando la presentación del segundo gemelo fue en presentación diferente de vértice, y en los embarazos con otras complicaciones, y menos frecuente cuando el parto vaginal del primer gemelo fue quirúrgico (Wen 2004a).
Importancia de la presentación fetal
Si el primer gemelo tiene una presentación podálica, la tendencia actual en los sistemas de salud con recursos adecuados, al igual que en la presentación podálica en un embarazo con feto único, es recomendar la cesárea como un procedimiento más seguro para los recién nacidos. Este enfoque puede verse influenciado por la extrapolación de la evidencia de los ensayos aleatorizados de cesárea programada para la presentación podálica única (Hofmeyr 2015), aunque la interpretación de esta evidencia es objeto de un debate considerable. El enfoque del parto de gemelos de vértice/no vértice es polémico (ACOG 2002; Barrett 2000; Crowther 1996). Para los gemelos con presentación vértice/vértice, la mayoría de los médicos recomiendan un parto vaginal programado (ACOG 2002; Crowther 1996). Sin embargo, la cesárea programada puede beneficiar a los gemelos cuando el primer gemelo tiene una presentación de vértice debido a varios motivos. Hasta el 20% de los segundos gemelos con una presentación de vértice cambiará la presentación espontáneamente después del parto del primer gemelo (Houlihan 1996). Un número considerable de los que tienen una presentación de vértice/vértice tendrá problemas agudos graves intraparto después del parto del primer gemelo (por ejemplo, conversión a posición transversa, procidencia del cordón, intervalo prolongado hasta el parto del segundo gemelo), que pueden dar lugar a una cesárea de urgencia, muerte perinatal y morbilidad neonatal. Por último, si hay efectos beneficiosos al evitar el trabajo de parto, se deben beneficiar ambos gemelos independientemente de la presentación.
Resultados maternos
La política de parto vaginal programado para las mujeres con un embarazo gemelar en un ámbito hospitalario se asocia con una tasa del 30% al 40% de cesárea de urgencia. Entre los gemelos en que el primero nace por vía vaginal, aún existe un riesgo de cesárea urgente para el parto del segundo gemelo que varía entre el 4% (Suzuki 2009) y el 7% (Persad 2001a). En un estudio retrospectivo de casos y controles, el riesgo de cesárea para el segundo gemelo después del parto vaginal del primero aumentó cuando había antecedentes de tratamiento de infertilidad, la edad gestacional era igual o mayor de 39 semanas, la presentación era diferente de vértice, el parto del primer gemelo fue quirúrgico y el intervalo de tiempo entre el parto de los gemelos fue mayor de 30 minutos (Suzuki 2009). Debido a que el riesgo de muerte materna es mayor si el parto se realiza por cesárea de urgencia, menor después de un parto vaginal e intermedio después de una cesárea electiva (Hall 1999), un número cada vez mayor de cesáreas de urgencia puede reducir los efectos beneficiosos para la mortalidad en los partos vaginales programados.
Un estudio de casos y controles relativamente pequeño no encontró un aumento de la morbilidad materna para la cesárea en gemelos en comparación con el embarazo único (Simoes 2007). Sin embargo, en un estudio poblacional grande de casos y controles pareados que utilizó el United Kingdom Obstetric Surveillance System, el riesgo de histerectomía periparto aumentó para las mujeres con embarazo gemelar (OR 6,30; IC del 95%: 1,73 a 23,0) (Knight 2008), mientras que otro estudio encontró que el embarazo gemelar fue un factor de riesgo de sepsis de la herida luego de la cesárea (Schneid‐Kofman 2005).
Cada vez hay más evidencia de una asociación entre el parto vaginal y la incontinencia urinaria, particularmente si el parto vaginal requiere fórceps o extracción con ventosa (Farrell 2001; Meyer 1998; Wilson 1996). Se ha demostrado que la incontinencia urinaria identificada en el período posparto tiene efectos duraderos, con un riesgo alto de incontinencia urinaria cinco años después (Viktrup 2001). El uso de la posición supina para el parto se ha mencionado como un posible contribuyente a la incontinencia después del parto vaginal. Se ha informado que la incontinencia fecal y la incontinencia de flatos se asocian con el parto vaginal, en particular, cuando se utilizan fórceps y cuando hay desgarros que involucran el esfínter anal (Eason 2002; Zetterström 1999).
En el Term Breech Trial, no hubo diferencias significativas en la mortalidad materna ni en la morbilidad materna grave inmediata entre la cesárea programada y el parto vaginal programado para la presentación podálica en el embarazo con feto único a término (3,9% versus 3,2%; p = 0,35) (Hannah 2002). Tres meses después del parto, las mujeres del grupo de cesárea programada informaron de una incidencia inferior de incontinencia urinaria (4,5% versus 7,3%; p = 0,02). Aunque la incidencia de incontinencia de flatos no fue diferente entre los grupos, cuando se informó fue un problema menor desde el punto de vista significativo en el grupo de cesárea programada (p = 0,006). A los dos años la única diferencia significativa encontrada fue menos constipación en el grupo de parto vaginal programado (Hofmeyr 2015). Sin embargo, los efectos perjudiciales a largo plazo de la cesárea, en particular los riesgos en los embarazos posteriores como placenta previa, placenta acreta, cesárea repetida y rotura uterina, así como la reducción de la fertilidad, no se evaluaron en los ensayos aleatorizados. Por lo tanto, desde una perspectiva materna, los efectos beneficiosos y los riesgos relativos de la cesárea programada versus el parto vaginal programado no se han definido de manera clara. Cualquier evaluación de los efectos perjudiciales versus los efectos beneficiosos debe tener en cuenta la probabilidad de efectos adversos graves a largo plazo de la cesárea. Los datos de una cohorte canadiense grande indicaron que, incluso en mujeres con cesárea previa, la mortalidad materna fue significativamente mayor con la cesárea que con el parto vaginal (Wen 2004b).
Debido a que en los ambientes con recursos adecuados, el suicidio se ha convertido en un contribuyente importante a la mortalidad materna, se debe dar importancia a las consecuencias emocionales del parto, como la depresión, al comparar los efectos beneficiosos y perjudiciales de los diferentes enfoques para la atención. Incluso cuando se realiza una cesárea de urgencia, en algunas mujeres puede aumentar la autoestima si al menos intentan lograr un parto vaginal. El sentido de control de la participación en el proceso de toma de decisiones también puede promover la autoestima.
Por qué es importante realizar esta revisión
En Lavender 2012, se proporciona una descripción más detallada de la evidencia relacionada con los efectos beneficiosos y perjudiciales de la cesárea.
Debido a la evidencia descrita anteriormente, se necesita una revisión sistemática de la información de los ensayos aleatorizados para determinar los efectos beneficiosos y los riesgos relativos de la cesárea programada para el embarazo gemelar para los recién nacidos y la madre.
Objetivos
Evaluar, a partir de la mejor evidencia disponible, los efectos sobre la mortalidad y la morbilidad para la madre y el recién nacido de una política de cesárea programada versus parto vaginal programado para el embarazo gemelar.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todas las comparaciones de la intención de realizar una cesárea y la intención de un parto por vía vaginal, sujetos a un protocolo de tratamiento, para las mujeres con un embarazo gemelar a término o antes del término. Fueron elegibles para inclusión los ensayos controlados aleatorizados, los ensayos cuasialeatorizados y los ensayos aleatorizados grupales. Los ensayos cruzados (cross‐over) no eran elegibles para su inclusión.
Se planificó incluir los estudios informados en forma de resumen, siempre que los métodos se describieran con suficiente detalle para evaluar el riesgo de sesgo.
Tipos de participantes
Mujeres con embarazo gemelar viable consideradas apropiadas para el parto vaginal, con la exclusión de las mujeres con una anomalía fetal grave comprobada.
Tipos de intervenciones
Cesárea programada en comparación con parto vaginal planificado sujetos a los requisitos de un protocolo de tratamiento.
Tipos de medida de resultado
Resultados primarios
-
Muerte perinatal o neonatal (se excluyen las anomalías fatales) o morbilidad neonatal grave (p.ej. asfixia grave al nacer, convulsiones, encefalopatía neonatal, traumatismo grave al nacer, síndrome de dificultad respiratoria grave (SDR), ingreso prolongado en la unidad de cuidados intensivos neonatales; o como la definieron los autores de los ensayos).
-
Mortalidad perinatal o infantil (con la exclusión de las anomalías mortales) o discapacidad en la infancia.
-
Muerte materna o morbilidad materna grave (p.ej., ingreso en la unidad de cuidados intensivos, sepsis, insuficiencia orgánica, rotura uterina, histerectomía, complicación quirúrgica grave, evento potencialmente mortal, discapacidad a largo plazo, o como la definieron los autores de los ensayos).
Resultados secundarios
Morbilidad perinatal/neonatal a corto plazo
-
Muerte perinatal / neonatal (con la exclusión de las anomalías mortales)
-
Morbilidad neonatal grave (p.ej., convulsiones, asfixia al nacer como la definieron los autores del ensayo, encefalopatía neonatal, traumatismo al nacer)
-
Puntuación de Apgar menor a siete a los cinco minutos
-
Puntuación de Apgar inferior a cuatro a los cinco minutos
-
pH bajo en la sangre del cordón umbilical, como lo definieron los autores de los ensayos
-
Déficit alto de bases en la sangre del cordón umbilical, como lo definieron los autores de los ensayos
-
Ingreso en la unidad de cuidados intensivos neonatales
-
Encefalopatía neonatal, como la definieron los autores del ensayo
-
Traumatismo en el parto, como lo definieron los autores de los ensayos
-
Parálisis nerviosa (incluida la lesión del plexo braquial)
-
Hemorragia subdural o intracerebral
-
Hemorragia intraventricular: grado III/IV
-
Leucomalacia periventricular quística
-
Sepsis
-
Meningitis
-
Enterocolitis necrosante
-
Neumopatía crónica
-
Asistencia respiratoria durante 24 horas o más
Resultados del lactante a largo plazo
-
Muerte (con la exclusión de las anomalías mortales)
-
Discapacidad en la infancia, como la definieron los autores de los ensayos
-
Problemas médicos
Resultados maternos a corto plazo
-
Cesárea
-
Analgesia regional
-
Anestesia general
-
Parto vaginal instrumental
-
Muerte
-
Morbilidad materna grave (p.ej. ingreso en la unidad de cuidados intensivos, sepsis, insuficiencia orgánica; o como la definieron los autores de los ensayos)
-
Daño orgánico intraoperatorio
-
Trombosis venosa profunda
-
Embolia pulmonar
-
Sepsis de la herida
-
Infección sistémica
-
Coagulación intravascular diseminada
-
Embolia del líquido amniótico
-
Hemorragia posparto, como la definieron los autores de los ensayos
-
Anemia después del parto, como la definieron los autores de los ensayos
-
Transfusión de sangre
-
Ruptura uterina
-
Repetición de la cirugía
-
Histerectomía
-
Infección de la herida
-
Estancia hospitalaria prolongada
-
Mujer no satisfecha con la atención
Resultados maternos a más largo plazo (desde el mes hasta los seis meses)
-
Fracaso en la lactancia, como la definieron los autores de los ensayos
-
Dolor perineal
-
Dolor abdominal
-
Lumbalgia o dolor lumbar
-
Cualquier dolor
-
Dispareunia, como la definieron los autores de los ensayos
-
Prolapso uterovaginal
-
Incontinencia urinaria
-
Incontinencia de flatos
-
Incontinencia fecal
-
Depresión posnatal, como la definieron los autores de los ensayos
-
Autoestima posnatal, como la definieron los autores de los ensayos
-
Ansiedad posnatal, como la definieron los autores de los ensayos
-
Vínculo con el recién nacido, como lo definieron los autores de los ensayos
-
Relación con la pareja, como la definieron los autores de los ensayos
-
Calidad de vida
Resultados maternos a largo plazo (más de un año)
-
Fracaso en la lactancia, como la definieron los autores de los ensayos
-
Dolor perineal
-
Dolor abdominal
-
Lumbalgia o dolor lumbar
-
Cualquier dolor
-
Dispareunia, como la definieron los autores de los ensayos
-
Prolapso uterovaginal
-
Incontinencia urinaria
-
Incontinencia de flatos
-
Incontinencia fecal
-
Infertilidad
-
Embarazo posterior
-
Aborto espontáneo o terminación de un embarazo posterior
-
Cesárea en un embarazo posterior
-
Rotura uterina en un embarazo posterior
-
Dismenorrea
-
Menorragia
-
Depresión posnatal, como la definieron los autores de los ensayos
-
Autoestima posnatal, como la definieron los autores de los ensayos
-
Ansiedad posnatal, como la definieron los autores de los ensayos
-
Calidad de vida
-
Vínculo con el niño, como lo definieron los autores de los ensayos
-
Relación con la pareja, como la definieron los autores de los ensayos
Servicios de salud
-
Cuidador no satisfecho
-
Coste
Los resultados se incluyeron si fueron clínicamente significativos; medidas razonables tomadas para minimizar el sesgo del observador; datos faltantes que no son suficientes para influir materialmente en las conclusiones; datos disponibles para el análisis según la asignación original, de manera independiente de las violaciones del protocolo; datos disponibles en un formato adecuado para el análisis.
Sólo se informaron los resultados con datos disponibles en las tablas de análisis.
Métodos de búsqueda para la identificación de los estudios
The following methods section of this review is based on a standard template used by the Cochrane Pregnancy and Childbirth Group.
Búsquedas electrónicas
We searched the Cochrane Pregnancy and Childbirth Group’s Trials Register by contacting the Trials Search Co‐ordinator (18 November 2015).
For full search methods used to populate the Cochrane Pregnancy and Childbirth Group’s Trials Register including the detailed search strategies for CENTRAL, MEDLINE, Embase and CINAHL; the list of handsearched journals and conference proceedings, and the list of journals reviewed via the current awareness service, please follow this link to the editorial information about the Cochrane Pregnancy and Childbirth Group in The Cochrane Library and select the ‘Specialized Register ’ section from the options on the left side of the screen.
Briefly, the Cochrane Pregnancy and Childbirth Group’s Trials Register is maintained by the Trials Search Co‐ordinator and contains trials identified from:
-
monthly searches of the Cochrane Central Register of Controlled Trials (CENTRAL);
-
weekly searches of MEDLINE (Ovid);
-
weekly searches of Embase (Ovid);
-
monthly searches of CINAHL (EBSCO);
-
handsearches of 30 journals and the proceedings of major conferences;
-
weekly current awareness alerts for a further 44 journals plus monthly BioMed Central email alerts.
Search results are screened by two people and the full text of all relevant trial reports identified through the searching activities described above is reviewed. Based on the intervention described, each trial report is assigned a number that corresponds to a specific Pregnancy and Childbirth Group review topic (or topics), and is then added to the Register. The Trials Search Co‐ordinator searches the Register for each review using this topic number rather than keywords. This results in a more specific search set which has been fully accounted for in the relevant review sections (Included, Excluded, Awaiting Classification or Ongoing).
Búsqueda de otros recursos
We searched the reference lists of retrieved studies.
We did not apply any language or date restrictions.
Obtención y análisis de los datos
For methods used in the previous version of this review, see Hofmeyr 2011.
For this update, the following methods were used for assessing the five reports that were identified as a result of the updated search.
The following methods section of this review is based on a standard template used by the Cochrane Pregnancy and Childbirth Group.
Selección de los estudios
Two review authors independently assessed for inclusion all the potential studies identified as a result of the search strategy. We resolved any disagreement through discussion or, if required, we consulted the third review author.
Extracción y manejo de los datos
We designed a form to extract data. For eligible studies, two review authors extracted the data using the agreed form. We resolved discrepancies through discussion or, if required, we consulted the third review author. Data were entered into Review Manager software (RevMan 2014) and checked for accuracy.
When information regarding any of the above was unclear, we planned to contact authors of the original reports to provide further details.
(One of the included studies was carried out by a member of the review team (JB); this author was not involved in data extraction or assessment of risk of bias for this trial.)
Evaluación del riesgo de sesgo de los estudios incluidos
Two review authors independently assessed risk of bias for each study using the criteria outlined in the Cochrane Handbook for Systematic Reviews of Interventions (Higgins 2011). Any disagreement was resolved by discussion or by involving a third assessor.
(1) Random sequence generation (checking for possible selection bias)
We described for each included study the method used to generate the allocation sequence in sufficient detail to allow an assessment of whether it should produce comparable groups.
We assessed the method as:
-
low risk of bias (any truly random process, e.g. random number table; computer random number generator);
-
high risk of bias (any non‐random process, e.g. odd or even date of birth; hospital or clinic record number);
-
unclear risk of bias.
(2) Allocation concealment (checking for possible selection bias)
We described for each included study the method used to conceal allocation to interventions prior to assignment and assessed whether intervention allocation could have been foreseen in advance of, or during recruitment, or changed after assignment.
We assessed the methods as:
-
low risk of bias (e.g. telephone or central randomisation; consecutively numbered sealed opaque envelopes);
-
high risk of bias (open random allocation; unsealed or non‐opaque envelopes, alternation; date of birth);
-
unclear risk of bias.
(3.1) Blinding of participants and personnel (checking for possible performance bias)
Blinding participants or staff is not feasible for this type of intervention. We considered that studies were at low risk of bias if we judged that the lack of blinding unlikely to affect results. We assessed blinding separately for different outcomes or classes of outcomes.
We assessed the methods as:
-
low, high or unclear risk of bias.
(3.2) Blinding of outcome assessment (checking for possible detection bias)
We described for each included study the methods used, if any, to blind outcome assessors from knowledge of which intervention a participant received. We assessed blinding separately for different outcomes or classes of outcomes.
We assessed methods used to blind outcome assessment as:
-
low, high or unclear risk of bias.
(4) Incomplete outcome data (checking for possible attrition bias due to the amount, nature and handling of incomplete outcome data)
We described for each included study, and for each outcome or class of outcomes, the completeness of data including attrition and exclusions from the analysis. We stated whether attrition and exclusions were reported and the numbers included in the analysis at each stage (compared with the total randomised participants), reasons for attrition or exclusion where reported, and whether missing data were balanced across groups or were related to outcomes. Where sufficient information was reported, or could be supplied by the trial authors, we planned to re‐include missing data in the analyses which we undertook.
We assessed methods as:
-
low risk of bias (e.g. no missing outcome data; missing outcome data balanced across groups);
-
high risk of bias (e.g. numbers or reasons for missing data imbalanced across groups; ‘as treated’ analysis done with substantial departure of intervention received from that assigned at randomisation);
-
unclear risk of bias.
(5) Selective reporting (checking for reporting bias)
We described for each included study how we investigated the possibility of selective outcome reporting bias and what we found.
We assessed the methods as:
-
low risk of bias (where it is clear that all of the study’s pre‐specified outcomes and all expected outcomes of interest to the review have been reported);
-
high risk of bias (where not all the study’s pre‐specified outcomes have been reported; one or more reported primary outcomes were not pre‐specified; outcomes of interest are reported incompletely and so cannot be used; study fails to include results of a key outcome that would have been expected to have been reported);
-
unclear risk of bias.
(6) Other bias (checking for bias due to problems not covered by (1) to (5) above)
We described for each included study any important concerns we had about other possible sources of bias.
(7) Overall risk of bias
We made explicit judgements about whether studies were at high risk of bias, according to the criteria given in the Handbook (Higgins 2011). With reference to (1) to (6) above, we planned to assess the likely magnitude and direction of the bias and whether we considered it is likely to impact on the findings. In future updates, if more studies are included, we will explore the impact of the level of bias through undertaking Sensitivity analysis.
Assessment of the quality of the evidence using the GRADE approach
For this update the quality of the evidence was assessed using the GRADE approach as outlined in the GRADE Handbook in order to assess the quality of the body of evidence relating to the following outcomes.
-
Perinatal or neonatal death (excluding fatal anomalies) or serious neonatal morbidity (e.g. severe birth asphyxia, seizures, neonatal encephalopathy, serious birth trauma, severe RDS, prolonged neonatal intensive care unit admission; or as defined by trial authors).
-
Perinatal or infant death (excluding fatal anomalies).
-
Maternal death or serious maternal morbidity (e.g. admission to intensive care unit, septicaemia, organ failure, uterine rupture, hysterectomy, major surgical complication, life‐threatening event, long‐term disability, or as defined by trial authors).
-
Serious neonatal morbidity.
-
Disability in childhood, as defined by trial authors.
-
Breastfeeding failure, as defined by trial authors.
-
Postnatal depression, as defined by trial authors.
We graded evidence for our main comparison: planned caesarean section versus planned vaginal birth.
We used the GRADEpro Guideline Development Tool to import data from Review Manager 5.3 (RevMan 2014) in order to create a ’Summary of findings’ table. A summary of the intervention effect and a measure of quality for each of the above outcomes was produced using the GRADE approach. The GRADE approach uses five considerations (study limitations, consistency of effect, imprecision, indirectness and publication bias) to assess the quality of the body of evidence for each outcome. The evidence can be downgraded from 'high quality' by one level for serious (or by two levels for very serious) limitations, depending on assessments for risk of bias, indirectness of evidence, serious inconsistency, imprecision of effect estimates or potential publication bias.
Medidas del efecto del tratamiento
Dichotomous data
For dichotomous data, we presented results as summary risk ratio with 95% confidence intervals.
Continuous data
We planned to use the mean difference if outcomes were measured in the same way between trials or the standardised mean difference to combine trials that measured the same outcome, but used different methods.
Cuestiones relativas a la unidad de análisis
Cluster‐randomised trials
We plan to include cluster‐randomised trials in the analyses along with individually‐randomised trials if such trials are identified in future updates. We will adjust their sample sizes using the methods described in the Handbook using an estimate of the intracluster correlation co‐efficient (ICC) derived from the trial (if possible), from a similar trial or from a study of a similar population. If we use ICCs from other sources, we will report this and conduct sensitivity analyses to investigate the effect of variation in the ICC. If we identify both cluster‐randomised trials and individually‐randomised trials, we plan to synthesise the relevant information. We will consider it reasonable to combine the results from both if there is little heterogeneity between the study designs and the interaction between the effect of intervention and the choice of randomisation unit is considered to be unlikely.
We will also acknowledge heterogeneity in the randomisation unit and perform a sensitivity analysis to investigate the effects of the randomisation unit.
Cross‐over trials
Cross‐over trials are not applicable for this review.
Other unit of analysis issues
For maternal outcomes, we used the number of mothers as the denominator. For neonatal outcomes, we used the number of babies as the denominator. If we include cluster‐randomised trials in future updates and information on ICC is available, we will use cluster‐trial methods, with each woman regarded as a randomised cluster. In the absence of information on ICC, we will analyse the results of babies as if individually‐randomised, conceding that the width of the confidence interval might be underestimated.
Manejo de los datos faltantes
For included studies, we noted levels of attrition. In future updates, if more eligible studies are included, the impact of including studies with high levels of missing data in the overall assessment of treatment effect will be explored by using sensitivity analysis.
For all outcomes, analyses were carried out, as far as possible, on an intention‐to‐treat basis i.e. we attempted to include all participants randomised to each group in the analyses. The denominator for each outcome in each trial was the number randomised minus any participants whose outcomes were known to be missing.
Evaluación de la heterogeneidad
We assessed statistical heterogeneity in each meta‐analysis using the Tau², I² and Chi² statistics. We regarded heterogeneity as substantial if an I² was greater than 30% and either the Tau² was greater than zero, or there was a low P value (less than 0.10) in the Chi² test for heterogeneity. Had we identified substantial heterogeneity (above 30%), we planned to explore it by pre‐specified subgroup analysis.
Evaluación de los sesgos de notificación
In future updates, if there are 10 or more studies in the meta‐analysis, we will investigate reporting biases (such as publication bias) using funnel plots. We will assess funnel plot asymmetry visually. If asymmetry is suggested by a visual assessment, we will perform exploratory analyses to investigate it.
Síntesis de los datos
We carried out statistical analysis using the Review Manager software (RevMan 2014). We used fixed‐effect meta‐analysis for combining data where it was reasonable to assume that studies were estimating the same underlying treatment effect: i.e. where trials were examining the same intervention, and the trials’ populations and methods were judged sufficiently similar.
If there was clinical heterogeneity sufficient to expect that the underlying treatment effects differed between trials, or if substantial statistical heterogeneity was detected, we used random‐effects meta‐analysis to produce an overall summary, if an average treatment effect across trials was considered clinically meaningful. The random‐effects summary was treated as the average range of possible treatment effects and we planned to discuss the clinical implications of treatment effects differing between trials. If the average treatment effect was not clinically meaningful, we did not combine trials. Where we used random‐effects analyses, the results were presented as the average treatment effect with 95% confidence intervals, and the estimates of Tau² and I².
Análisis de subgrupos e investigación de la heterogeneidad
If we had identified substantial heterogeneity, we planned to investigate it using subgroup analyses and sensitivity analyses. We would have considered whether an overall summary was meaningful, and if it was, used random‐effects analysis to produce it.
We planned to carry out the following subgroup analyses.
-
Settings with high (more than 20 per 1000) versus low (less than 20 per 1000) perinatal mortality versus perinatal mortality mixed or unknown.
-
Leading twin cephalic versus non‐cephalic versus mixed presentation or unknown.
-
Leading twin cephalic and second twin cephalic versus non‐cephalic versus mixed presentation or unknown.
-
Gestational age term versus preterm versus mixed or unknown gestational age.
We planned to use all outcomes in subgroup analysis.
We planned to assess subgroup differences by interaction tests available within RevMan (RevMan 2014). In future updates, if enough trials are included to make subgroup analysis possible, we will report the results of subgroup analyses quoting the Chi² statistic and P value, and the interaction test I² value.
Análisis de sensibilidad
We planned to carry out sensitivity analyses to explore the effect of trial quality assessed by concealment of allocation, high attrition rates, or both, with poor quality studies being excluded from the analyses in order to assess whether this makes any difference to the overall result. In this version of the review data from only two trials were included and we did not carry out this additional analysis. In future updates we will carry out sensitivity analysis if sufficient data become available.
Results
Description of studies
Results of the search
The search retrieved 13 reports. We included two trials (11 reports), excluded one trial and one report is awaiting classification. See Characteristics of included studies, Characteristics of excluded studies, and Characteristics of studies awaiting classification.
Included studies
We included two trials comparing planned caesarean versus planned vaginal birth for twin pregnancies.
The earlier trial (Rabinovici 1987), involved 60 women with cephalic/non‐cephalic twin pregnancies in labour at 35 or more weeks' gestation who were allocated to vaginal delivery (33) or caesarean section (27). The trial was conducted in Israel.
In the vaginal birth group, two women were delivered by caesarean section, and in four the second twin changed to cephalic presentation. These six women were excluded from the published data analysis. We have included the categorical neonatal outcomes in this review to conform to an intention‐to‐treat analysis. We were not able to include the continuous neonatal variables, and the maternal outcomes for the six excluded women were not reported, so we have not included these outcomes in this review. The reported maternal febrile morbidity (excluding the six women) was increased in the caesarean section group (11/27 versus 3/27).
Most of the data included in the review are from a more recent multicentre trial (Barrett 2013), where 2804 women were randomised in 106 centres in 25 countries. All centres had facilities to perform emergency caesarean section and had anaesthetic, obstetrical, and nursing staff available in the hospital at the time of planned vaginal delivery. Women with a twin pregnancy between 32 weeks’ and 38 weeks six days gestation were recruited to the trial. Inclusion criteria included that the first twin was cephalic, both twins alive and with weight estimated between 1500 g and 4000 g.
In the intervention group, women were randomised to planned lower segment caesarean delivery. If the first twin was delivered vaginally then caesarean section was attempted with the second twin if this was feasible. In the comparison group women were randomised to planned vaginal delivery with induction of labour between 37 weeks five days and 38 weeks six days and women were attended by clinical staff experienced in managing vaginal delivery of twins. The primary outcomes in this study were fetal or neonatal mortality or serious neonatal morbidity and maternal death or serious maternal morbidity before 28 days postpartum. Secondary outcomes included infant or child death or poor neurodevelopmental outcome up to two years, maternal satisfaction with mode of delivery, breastfeeding, quality of life, fatigue or depression.
Excluded studies
We excluded one study reported in a brief abstract (Juan 2014). The study report contained insufficient information to allow assessment of risk of bias and results were not reported. We will reconsider the eligibility of this study if further reports become available.
Risk of bias in included studies
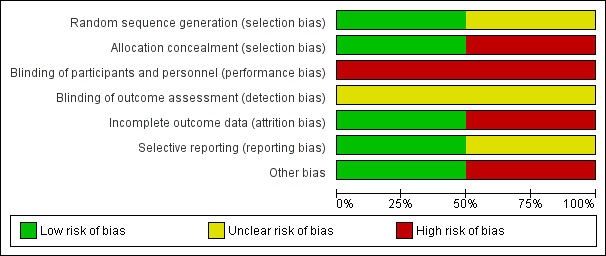
See Figure 1 and Figure 2 for a summary of 'Risk of bias' assessments.
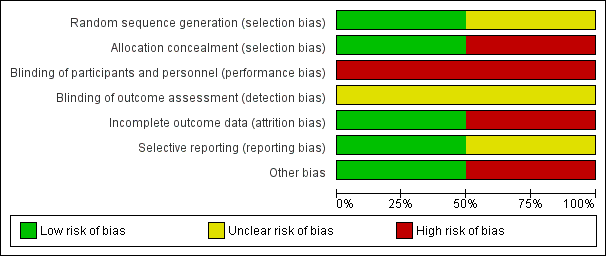
'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.
Allocation
In the Rabinovici 1987 trial, the allocation procedure was described as being changed randomly by a non‐involved person without prior notice on a time basis. A 20% difference in group sizes was not accounted for (27 versus 33). The possibility of inadequate allocation concealment is therefore high.
In the Barrett 2013 trial, randomisation was by computer with stratification for parity and gestational age using random block sizes. Randomisation was carried out centrally and so allocation concealment was assessed as being at low risk of bias.
Blinding
Blinding was not feasible in either trial and therefore both trials were assessed as being at high risk of performance bias. There was no mention about whether neonatal assessments were blinded in the Rabinovici 1987 study, while in the Barrett 2013 trial there was an attempt to blind assessors for the primary outcomes.
Incomplete outcome data
The Rabinovici 1987 trial was assessed as 'high risk' for attrition bias. Six women allocated to planned vaginal birth were excluded from primary analysis for delivery (this was not in accordance with the protocol) (two caesarean section and four vertex vaginal births). Analysis was not conducted on an intention‐to‐treat basis. However, for the categorical neonatal data we were able to include results of the six women in this review. For these neonatal outcomes attrition bias was assessed as being low.
In the Barrett 2013 study there was very little loss to follow‐up for short‐term outcomes and loss was balanced across groups; this trial was assessed as low risk of bias for this domain.
Selective reporting
No pre‐published protocol was available to check predefined outcome reporting for the Rabinovici 1987 study. A protocol was available for the Barrett 2013 trial and all outcomes appeared to be reported.
Other potential sources of bias
We assessed Rabinovici 1987 as being at 'high risk' for other bias because of a baseline imbalance: caesarean section n = 27 versus vaginal n = 33. In the published report of the Barrett 2013 trial there was no evidence of baseline imbalance and the non‐independence of outcomes for twins was taken into account in the trial analysis, though not in this review [pending ICC data].
Effects of interventions
Comparison 1: Planned caesarean section versus planned vaginal birth (two studies, 2864 women randomised)
Primary outcomes
Maternal death or serious maternal morbidity: this outcome was reported by both included trials, but in the Rabinovici 1987 trial there were no events, so all estimable data were from the Barrett 2013 trial. There was no clear evidence of differences between women randomised to planned caesarean or planned vaginal birth for maternal death or serous morbidity (risk ratio (RR) 0.86, 95% confidence interval (CI) 0.67 to 1.11; 2844 women; I² = 0%, moderate quality evidence) (Analysis 1.1).
Perinatal or neonatal death or serious neonatal morbidity: there was no significant difference between groups for this outcome reported in the Barrett 2013 trial (RR 1.15, 95% CI 0.80 to 1.67; data for 5565 babies, moderate quality evidence) (Analysis 1.2).
Perinatal or infant death or childhood disability was not reported. We hope to include data on this outcome in updates if infants from the Barrett 2013 trial are followed up during childhood.
Secondary outcomes
Short‐term Infant outcomes
There was no clear evidence of differences between groups for perinatal or neonatal mortality (RR 1.41, 95% CI 0.76 to 2.62; 5685 babies; two studies, moderate quality evidence) (Analysis 1.4) or serious neonatal morbidity (RR 1.03, 95% CI 0.65 to 1.64; 5644 babies; two studies, moderate quality evidence) (Analysis 1.5).
There were few babies with low Apgar scores at one and five minutes and no significant difference between groups (RR 1.22, 95% CI 0.18 to 8.39; 120 babies; one study, and RR 0.29, 95% CI 0.06 to 1.38; 5644 babies; two studies, respectively) (Analysis 1.6; Analysis 1.7).
There was no clear evidence that outcomes differed for women randomised to planned caesarean versus vaginal birth for serious neonatal morbidity including neonatal encephalopathy (reported in the Rabinovici 1987 trial; no events); birth trauma (RR 0.57, 95% CI 0.17 to 1.95; 5644 babies; two studies) Analysis 1.9; nerve palsy (reported in the Rabinovici 1987 trial; no events) Analysis 1.10; subdural or intracerebral haemorrhage (RR 3.01, 95% CI 0.31 to 28.89; 5644 babies; two studies) Analysis 1.11; intraventricular haemorrhage grades III or IV (no events) Analysis 1.12; cystic periventricular leukomalacia (RR 5.01, 95% CI 0.24 to 104.33; 5524 babies; one study) Analysis 1.13; neonatal sepsis up to 72 hours (RR 0.50, 95% CI 0.05 to 5.52; 5524 babies; one study) Analysis 1.14, or necrotising enterocolitis (RR 0.33, 95% CI 0.03 to 3.21; 5524 babies; one study) Analysis 1.15. Event rates for all of these outcomes were low.
The number of babies requiring assisted ventilation for 24 hours or more was reported in the Barrett 2013 trial and there was no strong evidence of any difference between groups (RR 1.59, 95% CI 0.87 to 2.91; 5524 babies), Analysis 1.16.
Short‐term maternal outcomes
The number of women undergoing caesarean section was reported in both trials. Most women in the planned caesarean group had treatment as planned (90.9% underwent caesarean section), whereas in the planned vaginal birth group, 42.9% had caesarean section for at least one twin (Analysis 1.17).
Both trials reported maternal mortality; no events were reported in the Rabinovici 1987 study and two deaths (one in each group) in the Barrett 2013 trial. There were no significant differences between groups for serious maternal morbidity overall (RR 0.86, 95% CI 0.67 to 1.11; 2844 women; two studies) Analysis 1.1, or for different types of short‐term morbidity including thromboembolism requiring anticoagulant therapy (RR 2.50, 95% CI 0.49 to 12.86; 2782 women; one study) Analysis 1.20; wound infection (RR 1.50, 95% CI 0.83 to 2.71; 2782 women; one study) Analysis 1.21; other infection (RR 1.39, 95% CI 0.76 to 2.53; 2782 women; one study) Analysis 1.22; disseminated intravascular coagulation (RR 5.00, 95% CI 0.24 to 104.05; 2782 women; one study) Analysis 1.23; amniotic fluid embolism (RR 3.00, 95% CI 0.12 to 73.58; 2782 women; one study) Analysis 1.24; postpartum haemorrhage (RR 0.78, 95% CI 0.59 to 1.02; 2782 women; one study) Analysis 1.25, or need for a blood transfusion (RR 0.88, 95% CI 0.64 to 1.21; 2782 women; one study) Analysis 1.26.
Longer‐term maternal outcomes
Women in the Barrett 2013 study were followed up in the postpartum period.
Similar numbers of women in the two groups experienced urinary (RR 0.87, 95% CI 0.64 to 1.18), flatus (RR 0.92, 95% CI 0.77 to 1.09) or faecal incontinence (RR 1.02, 95% CI 0.69 to 1.51), (2570 women, one study, Analysis 1.28; Analysis 1.29; Analysis 1.30).
There were no significant differences between groups for failure to breastfeed (RR 1.14, 95% CI 0.95 to 1.38, moderate quality evidence) Analysis 1.27, or the number of women with scores greater than 12 on the Edinbugh postnatal depression scale (RR 0.95, 95% CI 0.78 to 1.14, moderate quality evidence) Analysis 1.31, (2570 women, one study).
Discusión
Resumen de los resultados principales
No hubo diferencias en cuanto a los resultados perinatales o maternos entre los grupos para ninguno de los resultados primarios o secundarios informados.
Compleción y aplicabilidad general de las pruebas
Los efectos potenciales de la elección de la forma programada del parto en circunstancias clínicas específicas son complejos y se extienden más allá de los resultados clínicos fácilmente cuantificables, hasta consecuencias menos obvias como los efectos emocionales sobre la madre, su sentido de la autoestima y su relación con su niño o sus niños. Los ensayos aleatorizados grandes anteriores de intervenciones asociadas con más intervención médica en el proceso del parto, que han incluido el seguimiento a largo plazo de los niños, demostraron una discordancia inesperada entre la morbilidad perinatal a corto plazo y los resultados del desarrollo nervioso a largo plazo. Dos ejemplos son la cesárea programada para la presentación podálica a término, y la monitorización electrónica fetal continua y el muestreo de sangre del cuero cabelludo durante el trabajo de parto.
En el Term Breech Trial, en países con tasas bajas de mortalidad perinatal, hubo tres muertes perinatales y 26 recién nacidos con morbilidad perinatal grave de 511 en el grupo de parto vaginal programado, en comparación con ninguna muerte y morbilidad perinatal grave en dos de 514 recién nacidos después de la cesárea programada (Hannah 2000). Se esperaba menos retraso del desarrollo nervioso a los dos años en el grupo de cesárea programada, aunque la tendencia (aunque no estadísticamente significativa) fue en la dirección opuesta: 12/457 en comparación con 7/463 en el grupo de parto vaginal programado (Whyte 2004).
En el ensayo de Dublín de cardiotocografía continua durante el trabajo de parto, hubo convulsiones neonatales en 12 de 6530 recién nacidos después de la monitorización electrónica continua durante el trabajo de parto, y en 27 de 6554 después de la auscultación intermitente (Macdonald 1985). Hubo 14 muertes perinatales en cada grupo. A pesar de que hubo muchos menos casos de convulsiones neonatales en el grupo de monitorización electrónica continua, la tasa de parálisis cerebral posterior fue similar entre los grupos: 12/6527 versus 10/6552, respectivamente (Grant 1989). Las comparaciones similares en el ensayo de Seattle de monitorización electrónica continua y muestreo de sangre del cuero cabelludo para el trabajo de parto prematuro fueron: convulsiones 7/122 versus 7/124 (Luthy 1987); parálisis cerebral 16/82 versus 7/91, respectivamente (Shy 1990).
Debido a esta tendencia consistente hacia más secuelas neurológicas a largo plazo luego de las intervenciones médicas durante el parto de las que se esperarían según los resultados perinatales a corto plazo, las decisiones clínicas se deben basar en los resultados a largo plazo en lugar de en los resultados a corto plazo. Debido a que existen más datos disponibles relevantes para esta revisión, es importante que las implicaciones de la morbilidad perinatal a corto plazo se interpreten con cuidado y se esperen los resultados del seguimiento a largo plazo.
Como el estudio de Barrett 2013 fue un ensayo multicéntrico con una amplia distribución geográfica, los resultados deben ser aplicables a una variedad de entornos clínicos. Sin embargo, se debe tener cuidado al aplicar la evidencia en ámbitos sin acceso inmediato a la cesárea, o donde puede no haber acceso en embarazos posteriores.
Calidad de la evidencia
Como del 98% al 100% de los datos para la mayoría de los resultados provienen de un estudio, el riesgo de sesgo para la revisión se aproxima al de Barrett 2013. Se consideró que el riesgo de sesgo fue bajo para todas las categorías, excepto para el sesgo de realización (alto) y el sesgo de evaluación de los resultados (incierto).
Se calificó la calidad de la evidencia para los resultados incluidos en la tabla "Resumen de resultados". Para todos los resultados en que hubo datos disponibles, la evidencia se evaluó como de calidad moderada; la razón para disminuirla fue la imprecisión de las estimaciones del efecto.
Sesgos potenciales en el proceso de revisión
Un autor de revisión (JB), que fue el investigador principal de Barrett 2013, no participó en las decisiones relacionadas con dicho estudio.
Acuerdos y desacuerdos con otros estudios o revisiones
Los resultados de esta revisión son consistentes con los de estudios no aleatorizados y revisiones anteriores, que encontraron poca evidencia de diferencias entre la cesárea y el parto vaginal para el embarazo gemelar (Ford 2006; Henriksen 1994; Hogle 2002, Sentilhes 2007; Varner 2005).
'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 1 Maternal death or serious maternal morbidity.
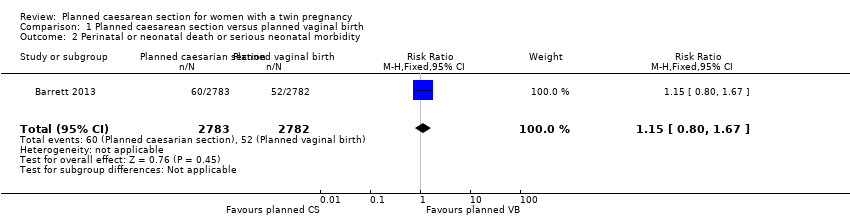
Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 2 Perinatal or neonatal death or serious neonatal morbidity.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 4 Perinatal or neonatal death.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 5 Serious neonatal morbidity.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 6 Apgar score less than eight at five minutes.
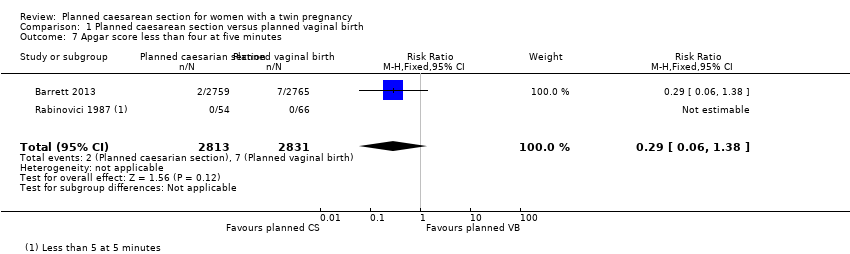
Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 7 Apgar score less than four at five minutes.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 8 Neonatal encephalopathy, as defined by trial authors.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 9 Birth trauma, as defined by trial authors.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 10 Nerve palsy (including brachial plexus injury).
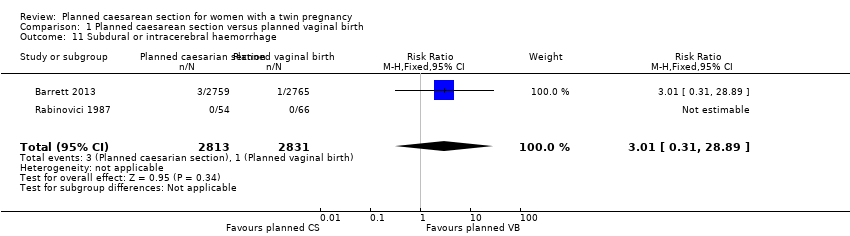
Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 11 Subdural or intracerebral haemorrhage.
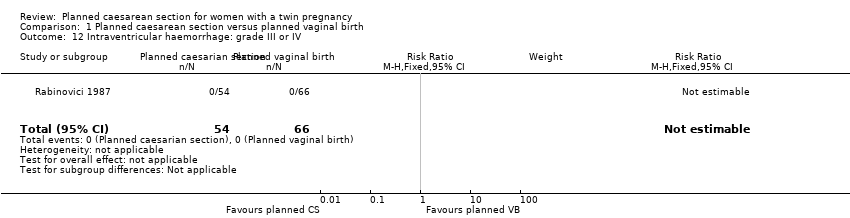
Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 12 Intraventricular haemorrhage: grade III or IV.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 13 Cystic periventricular leukomalacia.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 14 Neonatal sepsis up to 72 hours.
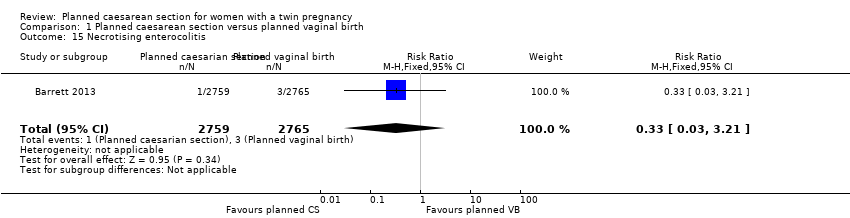
Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 15 Necrotising enterocolitis.
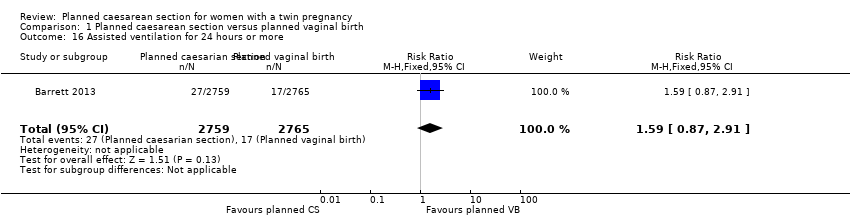
Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 16 Assisted ventilation for 24 hours or more.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 17 Short‐term maternal outcomes: caesarean section.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 18 Short‐term maternal outcomes: mortality.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 19 Short‐term maternal outcomes: serious maternal morbidity.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 20 Short‐term maternal outcomes: thromboembolism requiring anticoagulant therapy.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 21 Short‐term maternal outcomes: wound infection.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 22 Short‐term maternal outcomes: systemic infection.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 23 Short‐term maternal outcomes: disseminated intravascular coagulation.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 24 Short‐term maternal outcomes: amniotic fluid embolism.
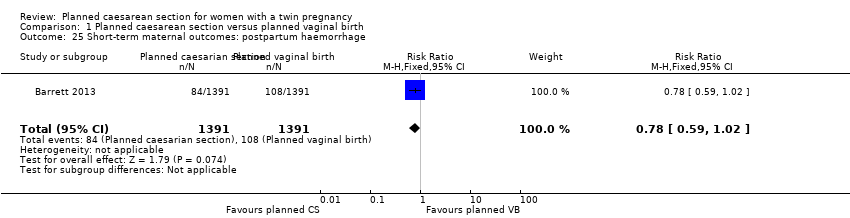
Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 25 Short‐term maternal outcomes: postpartum haemorrhage.
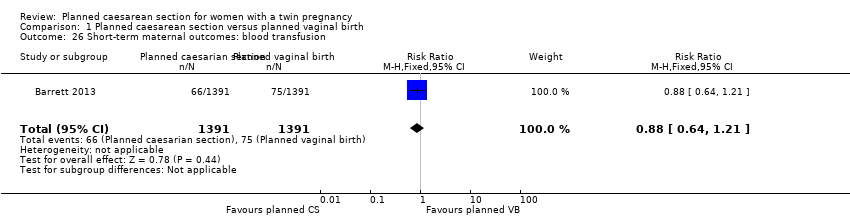
Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 26 Short‐term maternal outcomes: blood transfusion.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 27 Longer‐term maternal outcomes: failure to breastfeed.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 28 Longer‐term maternal outcomes: urinary incontinence.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 29 Longer‐term maternal outcomes: flatus incontinence.
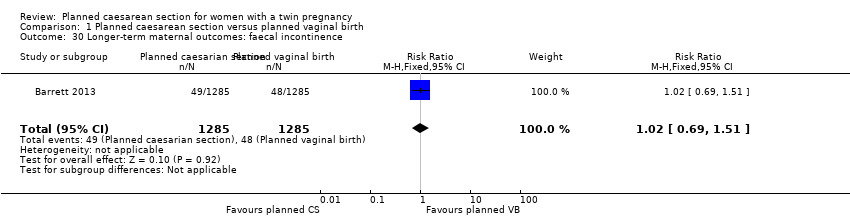
Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 30 Longer‐term maternal outcomes: faecal incontinence.

Comparison 1 Planned caesarean section versus planned vaginal birth, Outcome 31 Longer‐term maternal outcomes: postnatal depression, as defined by trial authors (EPDS > 12).
| Planned caesarean section versus planned vaginal birth for women with a twin pregnancy | ||||||
| Patient or population: women with a twin pregnancy | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with planned vaginal birth | Risk with Planned caesarean section | |||||
| Maternal death or serious maternal morbidity | Study population | RR 0.86 | 2844 | ⊕⊕⊕⊝ | ||
| 83 per 1000 | 71 per 1000 | |||||
| Moderate | ||||||
| 42 per 1000 | 36 per 1000 | |||||
| Perinatal or neonatal death or serious neonatal morbidity | Study population | RR 1.15 | 5565 | ⊕⊕⊕⊝ | ||
| 19 per 1000 | 21 per 1000 | |||||
| Disability in childhood | Study population | not pooled | 0 | No data were available for this outcome | ||
| not pooled | not pooled | |||||
| Perinatal or neonatal death | Study population | RR 1.41 | 5685 | ⊕⊕⊕⊝ | ||
| 6 per 1000 | 8 per 1000 | |||||
| Moderate | ||||||
| 3 per 1000 | 4 per 1000 | |||||
| Serious neonatal morbidity | Study population | RR 1.03 | 5644 | ⊕⊕⊕⊝ | ||
| 12 per 1000 | 13 per 1000 | |||||
| Moderate | ||||||
| 6 per 1000 | 6 per 1000 | |||||
| Longer‐term maternal outcomes: failure to breastfeed | Study population | RR 1.14 | 2570 | ⊕⊕⊕⊝ | ||
| 136 per 1000 | 155 per 1000 | |||||
| Longer‐term maternal outcomes: postnatal depression, as defined by trial authors (EPDS > 12) | Study population | RR 0.95 | 2570 | ⊕⊕⊕⊝ | ||
| 148 per 1000 | 140 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Wide 95% CI crossing the line of no effect | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Maternal death or serious maternal morbidity Show forest plot | 2 | 2844 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.86 [0.67, 1.11] |
| 2 Perinatal or neonatal death or serious neonatal morbidity Show forest plot | 1 | 5565 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.15 [0.80, 1.67] |
| 3 Perinatal or infant death or disability in childhood | 0 | 0 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 4 Perinatal or neonatal death Show forest plot | 2 | 5685 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.41 [0.76, 2.62] |
| 5 Serious neonatal morbidity Show forest plot | 2 | 5644 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.03 [0.65, 1.64] |
| 6 Apgar score less than eight at five minutes Show forest plot | 1 | 120 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.22 [0.18, 8.39] |
| 7 Apgar score less than four at five minutes Show forest plot | 2 | 5644 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.29 [0.06, 1.38] |
| 8 Neonatal encephalopathy, as defined by trial authors Show forest plot | 1 | 120 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 9 Birth trauma, as defined by trial authors Show forest plot | 2 | 5644 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.57 [0.17, 1.95] |
| 10 Nerve palsy (including brachial plexus injury) Show forest plot | 1 | 120 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 11 Subdural or intracerebral haemorrhage Show forest plot | 2 | 5644 | Risk Ratio (M‐H, Fixed, 95% CI) | 3.01 [0.31, 28.89] |
| 12 Intraventricular haemorrhage: grade III or IV Show forest plot | 1 | 120 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 13 Cystic periventricular leukomalacia Show forest plot | 1 | 5524 | Risk Ratio (M‐H, Fixed, 95% CI) | 5.01 [0.24, 104.33] |
| 14 Neonatal sepsis up to 72 hours Show forest plot | 1 | 5524 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.50 [0.05, 5.52] |
| 15 Necrotising enterocolitis Show forest plot | 1 | 5524 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.33 [0.03, 3.21] |
| 16 Assisted ventilation for 24 hours or more Show forest plot | 1 | 5524 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.59 [0.87, 2.91] |
| 17 Short‐term maternal outcomes: caesarean section Show forest plot | 2 | 2845 | Risk Ratio (M‐H, Random, 95% CI) | 4.77 [0.76, 30.00] |
| 18 Short‐term maternal outcomes: mortality Show forest plot | 2 | 2844 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.0 [0.06, 15.97] |
| 19 Short‐term maternal outcomes: serious maternal morbidity Show forest plot | 2 | 2842 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.86 [0.67, 1.11] |
| 20 Short‐term maternal outcomes: thromboembolism requiring anticoagulant therapy Show forest plot | 1 | 2782 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.5 [0.49, 12.86] |
| 21 Short‐term maternal outcomes: wound infection Show forest plot | 1 | 2782 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.5 [0.83, 2.71] |
| 22 Short‐term maternal outcomes: systemic infection Show forest plot | 1 | 2782 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.39 [0.76, 2.53] |
| 23 Short‐term maternal outcomes: disseminated intravascular coagulation Show forest plot | 1 | 2782 | Risk Ratio (M‐H, Fixed, 95% CI) | 5.0 [0.24, 104.05] |
| 24 Short‐term maternal outcomes: amniotic fluid embolism Show forest plot | 1 | 2782 | Risk Ratio (M‐H, Fixed, 95% CI) | 3.0 [0.12, 73.58] |
| 25 Short‐term maternal outcomes: postpartum haemorrhage Show forest plot | 1 | 2782 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.78 [0.59, 1.02] |
| 26 Short‐term maternal outcomes: blood transfusion Show forest plot | 1 | 2782 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.88 [0.64, 1.21] |
| 27 Longer‐term maternal outcomes: failure to breastfeed Show forest plot | 1 | 2570 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.14 [0.95, 1.38] |
| 28 Longer‐term maternal outcomes: urinary incontinence Show forest plot | 1 | 2570 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.87 [0.64, 1.18] |
| 29 Longer‐term maternal outcomes: flatus incontinence Show forest plot | 1 | 2570 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.92 [0.77, 1.09] |
| 30 Longer‐term maternal outcomes: faecal incontinence Show forest plot | 1 | 2570 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.02 [0.69, 1.51] |
| 31 Longer‐term maternal outcomes: postnatal depression, as defined by trial authors (EPDS > 12) Show forest plot | 1 | 2570 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.95 [0.78, 1.14] |

