Tratamiento con líquidos para la meningitis bacteriana aguda
Resumen
Antecedentes
La meningitis bacteriana aguda continúa siendo una enfermedad con altas tasas de mortalidad y morbilidad. Sin embargo, con un tratamiento antimicrobiano y de apoyo rápido y adecuado, han mejorado las perspectivas de supervivencia, especialmente en los lactantes y niños. El tratamiento cuidadoso del equilibrio hidroelectrolítico es un tratamiento de apoyo importante. Tanto una sobrehidratación o baja hidratación se asocia con resultados adversos. Ésta es la última actualización de una revisión publicada por primera vez en 2005 y actualizada en 2008 y 2014.
Objetivos
Evaluar el tratamiento de la meningitis bacteriana aguda con distintos volúmenes en la administración inicial de líquidos (hasta 72 horas después de la primera consulta) y los efectos sobre la muerte y las secuelas neurológicas.
Métodos de búsqueda
Para esta actualización de 2016, se buscó en las siguientes bases de datos hasta marzo 2016: registro especializado del Grupo Cochrane de Infecciones Respiratorias Agudas (Cochrane Acute Respiratory Infections Group's Specialised Register), CENTRAL, MEDLINE, CINAHL, Global Health y en Web of Science.
Criterios de selección
Se consideró la inclusión de ensayos controlados aleatorios (ECA) de diferentes volúmenes de líquido administrado en el tratamiento inicial de la meningitis bacteriana.
Obtención y análisis de los datos
Los cuatro revisores originales extrajeron los datos y evaluaron la calidad de los ensayos en la primera publicación de esta revisión (un autor, la FILA, ha fallecido después que se publicara la revisión original; ver Agradecimientos). Los autores combinaron los datos para el metanálisis usando los cocientes de riesgos (CR) para los datos dicotómicos o la diferencia de medias (DM) para los datos continuos. Se usó un modelo estadístico de efectos fijos. La calidad general de las pruebas se evaluó mediante el enfoque GRADE.
Resultados principales
Se incluyeron tres ensayos con un total de 420 niños; no hubo ensayos en poblaciones adultas. El más grande de los tres ensayos se realizó en ámbitos con tasas de mortalidad elevadas y se consideró de bajo riesgo de sesgo para todos los dominios, excepto el sesgo de rendimiento, que presentó un alto riesgo. Los otros dos ensayos más pequeños no fueron de calidad alta. En el metanálisis no se encontró ninguna diferencia significativa entre el grupo de mantenimiento de líquidos y el de restricción de líquidos en cuanto al número de muertes (CR 0,82; intervalo de confianza [IC] del 95%: 0,53 a 1,27; 407 participantes; pruebas de baja calidad) o las secuelas neurológicas agudas graves (CR 0,67; IC del 95%: 0,41 a 1,08; 407 participantes; pruebas de baja calidad). Sin embargo, cuando se definieron las secuelas neurológicas más en detalle, hubo una diferencia estadísticamente significativa a favor del grupo de mantenimiento de líquidos para la espasticidad (CR 0,50; IC del 95%: 0,27 a 0,93; 357 participantes); y las crisis convulsivas a las 72 horas (CR 0,59; IC del 95%: 0,42 a 0,83; 357 participantes) y a los 14 días (CR 0,19; IC del 95%: 0,04 a 0,88; 357 participantes). Hubo pruebas de muy baja calidad que favorecían el líquido de mantenimiento sobre el líquido restrictivo para las secuelas neurológicas crónicas graves a tres meses de seguimiento (CR 0,42; IC del 95%: 0,20 a 0,89; 351 participantes).
Conclusiones de los autores
La calidad de las pruebas con respecto al tratamiento con líquidos en los niños con meningitis bacteriana aguda es baja a muy baja, y deben realizarse más ECA. Hay pruebas insuficientes para guiar la práctica sobre si los líquidos de mantenimiento deben preferirse por sobre los líquidos restringidos en el tratamiento de la meningitis bacteriana aguda.
PICOs
Resumen en términos sencillos
Tratamiento con líquidos para los pacientes con meningitis bacteriana aguda
Pregunta de la revisión
¿Por qué es importante el efecto de los distintos volúmenes de administración inicial de líquidos en la muerte y las diversas secuelas neurológicas en los pacientes con meningitis bacteriana aguda?
Antecedentes
La meningitis bacteriana es una infección del líquido de la médula espinal y que rodea el cerebro. Se recetan antibióticos como tratamiento. La atención de apoyo incluye otros fármacos y el control de la ingestión de líquidos. No hubo acuerdo acerca de si los líquidos deben estar restringidos o no restringidos porque hay riesgos potenciales tanto con la administración excesiva (edema cerebral) como con la administración insuficiente (shock).
Características de los estudios
Las pruebas están actualizadas hasta marzo 2016. No se encontraron ensayos en poblaciones adultas y se incluyeron tres ensayos con 420 niños. Todos los ensayos se realizaron en países en que las tasas de mortalidad para la meningitis son altas. En un estudio no se mencionó ninguna fuente de financiación. Los dos estudios restantes fueron financiados conjuntamente debido a las inquietudes farmacéuticas por dependencias gubernamentales y un organismo de beneficencia.
Resultados clave
Ningún estudio informó los resultados importantes de asistencia sanitaria, como la duración de la estancia hospitalaria, la presión intracraneal elevada o el estado epiléptico. Un efecto adverso en los niños con ingesta restringida de líquidos fue que presentaron menor probabilidad de tener niveles bajos de sodio en sangre y, por lo tanto, podrían experimentar reducciones mayores en los líquidos corporales. En un estudio, se informó un efecto adverso de la administración de líquidos sin restricción, como la acumulación de líquido en la cara a corto plazo y niveles bajos de sodio en sangre entre el primero y segundo día después de comenzar con la administración de líquidos. Por otro lado, el estudio más amplio no encontró ninguna diferencia en los niveles de sodio en sangre.
La revisión halló pruebas limitadas a partir de estos ensayos para apoyar la no restricción de líquidos en ámbitos con tasas elevadas de mortalidad. No existen pruebas para guiar a los médicos acerca del tratamiento con líquidos en los pacientes adultos con meningitis bacteriana aguda. Se necesita más investigación sobre estos aspectos en el futuro.
Calidad de la evidencia
En el análisis de los ensayos disponibles, se hallaron pruebas de muy baja calidad de que no hay ninguna diferencia significativa entre los regímenes de líquidos de mantenimiento versus restringido para el resultado de muerte y complicaciones neurológicas agudas graves. También hubo algunas pruebas que favorecían el tratamiento con líquidos de mantenimiento sobre los líquidos restringidos para los cuadros neurológicos crónicos severos a tres meses de seguimiento, pero la calidad fue muy baja.
Conclusiones de los autores
Summary of findings
| Maintenance fluids versus restricted fluids for acute bacterial meningitis | |||||
| Patient or population: paediatric patients with acute bacterial meningitis Settings: hospital inpatient department Intervention: maintenance fluids Comparison: restricted fluids | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Restricted fluids | Maintenance fluids | ||||
| Death ‐ all participants | Study population | RR 0.82 (0.53 to 1.27) | 407 | ⊕⊕⊝⊝ | |
| 186 per 1000 | 153 per 1000 (99 to 237) | ||||
| Moderate risk population | |||||
| 213 per 1000 | 175 per 1000 (113 to 271) | ||||
| Severe neurological sequelae ‐ acute (within the first 4 weeks) | Study population | RR 0.67 | 407 | ⊕⊕⊝⊝ | |
| 176 per 1000 | 118 per 1000 (72 to 191) | ||||
| Moderate risk population | |||||
| 252 per 1000 | 169 per 1000 (103 to 272) | ||||
| Severe neurological sequelae ‐ chronic (after the first 4 weeks) | Study population | RR 0.42 | 351 | ⊕⊝⊝⊝ | |
| 121 per 1000 | 51 per 1000 (24 to 108) | ||||
| Moderate risk population | |||||
| 121 per 1000 | 51 per 1000 (24 to 108) | ||||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Total number of events is small and 95% CI around pooled estimate includes both appreciable benefit and harms. | |||||
Antecedentes
Descripción de la afección
La meningitis bacteriana aguda continúa siendo una enfermedad con altas tasas de mortalidad y morbilidad. El resultado en pacientes individuales con meningitis bacteriana se correlaciona con muchos factores, incluidos la edad del paciente, el tiempo y la estabilidad clínica antes de comenzar el tratamiento efectivo con antibióticos, el tipo de microorganismo, el número de bacterias o la cantidad de productos bacterianos activos en el líquido cefalorraquídeo (LCR) en el momento del diagnóstico, la intensidad de la respuesta inflamatoria del huésped y el tiempo transcurrido para esterilizar los cultivos del LCR (Feldman 1977; Mustafa 1990; Saez‐Llorens 1990; Waage 1987).
Descripción de la intervención
Las tasas más altas de mortalidad y morbilidad ocurren en el período neonatal y en las personas de edad avanzada. Uno de cada cuatro adultos que presenta la enfermedad morirá y un gran número de supervivientes continúa con los déficits neurológicos (Bohr 1983; Pfister 1993). La meningitis bacteriana causa más de 100 000 muertes en todo el mundo cada año en los lactantes y los niños pequeños (Duke 1998). Un metanálisis de 1993 analizó las frecuencias generales y específicas de cada microorganismo, de muerte y secuelas neurológicas persistentes, en niños de dos meses a 19 años de edad (Baraff 1993). Se incluyó un total de 4920 niños con meningitis bacteriana aguda en 45 informes que cumplieron con los criterios de inclusión. Los niños descritos en los 19 informes de cohortes incorporadas de manera prospectiva de países de altos ingresos, tuvieron una mortalidad más baja que los niños incluidos en los ensayos de los países de bajos ingresos (4,8% versus 8,1%) y tuvieron más probabilidades de no presentar secuelas (82,5% versus 73,9%). Otro estudio que analizó las consecuencias a largo plazo de la meningitis durante el primer año de vida encontró que un 1,8% de los niños murieron en cinco años (Bedford 2001). No sólo casi un quinto de los niños con meningitis presenta una discapacidad posterior permanente, grave o moderada sino que también fueron más prevalentes los déficits sutiles.
De qué manera podría funcionar la intervención
Las perspectivas de la supervivencia se mejoran con un tratamiento de apoyo y antimicrobiano rápido y adecuado, especialmente en los lactantes y niños, entre quienes se han reducido las tasas de mortalidad a menos de 10% para la meningitis bacteriana y menos de 5% para la meningitis meningocócica (Saez‐Llorens 2003). Dos revisiones Cochrane analizan la efectividad y seguridad de los corticosteroides y los diferentes regímenes antibióticos, respectivamente, utilizados en el tratamiento de la meningitis bacteriana aguda (Brouwer 2015; Prasad 2011).
También es importante el tratamiento cuidadoso del equilibrio hidroelectrolítico para tratar la meningitis. La sobrehidratación y la deshidratación están asociadas con resultados adversos. Se ha recomendado ampliamente la restricción de líquidos en el tratamiento inicial de la meningitis en niños (Conner 1980; Feigin 1992). Sin embargo, también se ha cuestionado esta recomendación. (Conner 1980; Powell 1990; Singhi 1995). La práctica de restricción de líquidos está basada en informes de hiponatremia (concentración de sodio inferior a lo normal en el líquido/sangre extracelular) que se atribuye a mayores concentraciones de hormona antidiurética circulante (ADH; una hormona que inhibe la excreción de agua del organismo). Más del 50% de los niños tienen hiponatremia en el momento del ingreso (Kaplan 1983). Existen asociaciones entre el grado de hiponatremia y la presencia de convulsiones y la gravedad de la enfermedad aguda y los resultados adversos del retraso del desarrollo nervioso (Feigin 1977). Posteriormente, se han relacionado estos resultados con una elevada incidencia de edema cerebral (inflamación del cerebro) en los pacientes que mueren a causa de la meningitis bacteriana aguda (Conner 1980; Dodge 1965; Williams 1964), y se ha sugerido que las concentraciones inadecuadamente superiores de ADH causan retención de líquidos, que, a su vez, exacerban el edema cerebral. Algunos investigadores han concluido que la restricción de líquidos evitará la exacerbación del edema cerebral y puede mejorar el resultado neurológico (Brown 1994).
Sin embargo, también se ha observado deshidratación clínica en los niños con meningitis bacteriana aguda, sin riesgos significativos de mortalidad asociados (Duke 1998). Además, se ha encontrado que en los niños que recibieron líquido de mantenimiento más reemplazo del déficit de volumen, las concentraciones altas de ADH se normalizaron en 24 horas; en aquellos en los que se restringió el líquido de mantenimiento a dos tercios, las concentraciones ADH continuaron siendo altas (Powell 1990). La conclusión fue que las concentraciones de ADH aumentan en los niños con meningitis, debido a la hipovolemia (una disminución en el volumen de sangre circulante) y sólo se normalizan cuando se administra suficiente sodio y líquido.
Por qué es importante realizar esta revisión
A pesar de que está ampliamente aceptado que la hiponatremia es un marcador de enfermedad grave en la meningitis bacteriana de la niñez, hay diferentes opiniones con respecto a la causa de la hiponatremia en el momento de la consulta. Si la deshidratación, en lugar de la antidiuresis inadecuadamente superior, es el factor principal en la patogenia de la hiponatremia de la meningitis, entonces la restricción de líquidos es cuestionable.
Objetivos
Evaluar el tratamiento de la meningitis bacteriana aguda con distintos volúmenes en la administración inicial de líquidos (hasta 72 horas después de la primera consulta) y los efectos sobre la muerte y las secuelas neurológicas.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Fueron aptos para su inclusión los estudios controlados aleatorios (ECA) que analizaron la efectividad de diferentes volúmenes de líquido administrados inicialmente en el tratamiento de la meningitis bacteriana aguda Se programó considerar los ensayos de administración de líquidos para tratar el shock en el momento de la consulta pero se encontró ninguno.
Tipos de participantes
Todos los grupos etarios con diagnóstico de meningitis bacteriana aguda, ya sea por diagnóstico clínico o cultivo de líquido cefalorraquídeo (LCR) obtenido por punción lumbar, eran aptos para la inclusión.
Tipos de intervenciones
-
Líquido administrado en el tratamiento inicial de la meningitis bacteriana aguda; independientemente de la vía de administración, el tipo o el volumen de líquido.
-
Comparaciones de la administración inicial de volúmenes de líquidos en el tratamiento de la meningitis bacteriana aguda, de forma independiente de la vía de administración, el tipo de líquido o la duración de la restricción de líquidos.
Tipos de medida de resultado
Resultados primarios
-
Muerte
-
Secuelas neurológicas a corto plazo (en las cuatro primeras semanas de la enfermedad) y a largo plazo (que persisten después de las cuatro primeras semanas de la enfermedad)
Resultados secundarios
-
Edema (incluso cerebral)
-
Agua corporal total
-
Agua extracelular
-
Sodio sérico y urinario
-
Osmolalidad plasmática y urinaria
-
Duración de la estancia hospitalaria
-
Aumento de la presión intracraneal
-
Estado epiléptico
Results
Description of studies
Results of the search
For this 2016 update we identified 824 records (CENTRAL = 128, CINAHL = 29, Global Health = 298, MEDLINE = 221, Web of Science = 133, ClinicalTrials.gov = 14, reference searching = 1). After removing duplicates (n = 139), we screened 685 records. We recovered full‐texts for three of them (Pelkonen 2011; Roine 2014; van Paridon 2015), but we did not find any to be eligible for inclusion. Reasons for exclusion are documented in the Characteristics of excluded studies table.
For the 2014 update, with duplicates removed (including duplicates of the records sent in 2010) there were 496 search results. We removed animal studies (n = 49) and screened 447 search results (Maconochie 2014). We excluded 445 search results on the basis of title or abstract and two on the basis of full‐text inspection. We did not find any studies in the grey literature. Reasons for exclusion are given in the Characteristics of excluded studies table.
In the 2011 update, six abstracts identified in the search initially appeared to fit the inclusion criteria for the review (Maconochie 2011). After obtaining the full papers, we excluded three of these, leaving three trials eligible for inclusion (420 children). In the 2008 update, we retrieved 105 records from the search of the electronic databases but did not find any new included trials for inclusion (Maconochie 2008).
Included studies
1. Trial design characteristics
Volume and constitution of fluid
The Duke 2002 trial compared milk‐based fluids delivered at 60% of that required for maintenance fluids with 100% of normal maintenance fluids. Maintenance fluids were defined as "100 ml/kg/day for the first 10 kg of body weight, 50 ml/kg for the second 10 kg, and 20 ml/kg for over 20 kg". The milk‐based fluids comprised expressed breast milk or other milk feed given via a nasogastric tube for at least 48 hours, or longer with reduced conscious state, convulsions, impaired upper airway reflexes, or persistent respiratory distress. Normal maintenance fluids (defined as above) of a solution containing 0.45% sodium chloride and 5% dextrose plus 10 mmol/L of potassium chloride per litre were delivered intravenously for at least the first 48 hours.
The Powell 1990 trial compared two‐thirds of required maintenance fluids (similarly defined as "100 ml/kg for the first 10 kg of body weight, plus 50 ml/kg for the next 10 kg (10 kg to 20 kg), plus 20 ml/kg for each kilogram in excess of 20 kg") with full maintenance fluids, plus replacement fluids for any estimated deficit over 24 hours. Rehydration was begun by administering 10 ml/kg or 15 ml/kg by rapid intravenous infusion. Fluids were given intravenously with the composition determined by the attending consultant.
The Singhi 1995 trial compared restricted fluids at 65% of the calculated maintenance fluid requirement with maintenance fluid requirements (110 ml/kg for first 10 kg, 50 ml/kg for next 10 kg and 25 ml/kg for subsequent weight), both given intravenously. The restricted fluids comprised one‐fifth normal saline in 5% dextrose for 24 hours, followed by "a gradual liberalisation at a rate of 10 ml/kg over eight hours, if, after 24 hours of hospital stay, the serum sodium and plasma osmolality had returned to normal and there were no clinical signs of dehydration".
Duration of fluid therapy
The Duke 2002 study administered fluids for 48 hours; the Powell 1990 study administered fluids for 24 hours; and the Singhi 1995 study administered fluids for 24 hours, with a gradual increase thereafter until children in both arms received the full normal maintenance requirement after 48 hours.
2. Baseline characteristics of participants
Age
All studies included only children. Duke 2002 included children between one month and 12 years of age, Powell 1990 included children between three months and 16 years, and Singhi 1995 included children between two months and seven years of age.
Health status
The children in the study carried out in Papua New Guinea were from a population in which 25% were undernourished at the time of their presentation (Duke 2002). In regard to the meningitis symptoms, the mean duration of symptoms was six days, with two‐thirds of children having convulsions, before presentation; 20% of the children were hypoglycaemic.
The Powell 1990 study gave no specific details, but said that they only enrolled "previously healthy children". Malnourished children were excluded from the Singhi 1995 study, and children had a duration of symptoms ranging from one to 10 days on presentation.
Diagnostic techniques used to establish a diagnosis of bacterial meningitis
The Duke 2002 study made a diagnosis according to clinical signs of meningitis and a cloudy or turbid cerebrospinal fluid (CSF) with a moderate or large number of leucocytes and amount of protein, determined by dipstick testing (Multistix 10 SG). The Powell 1990 study diagnosed meningitis on the basis of clinical examination, CSF cytology, and chemical studies. The Singhi 1995 study made a diagnosis on a suggestive history, physical examination, CSF findings of hypoglycorrhachia, increased protein concentration, and polymorphonuclear leucocytosis.
3. Studied outcomes
Death
Two studies reported death as an outcome (Duke 2002; Singhi 1995). Personal communication with the lead author of the Powell 1990 study reported no fatalities.
Short‐term (within the first four weeks of illness) and long‐term (persisting after the first four weeks of illness) neurological sequelae
Two studies reported acute neurological sequelae (Duke 2002; Singhi 1995). One of these studies also reported individual neurological components at 14 days (spasticity, hemiparesis/hemiplegia, visual impairment, and no response to sound) and neurological sequelae at three months (Duke 2002).
Seizures
Duke 2002 reported the incidence of seizures at both 72 hours and 14 days. In the 2014 update of this review, 'seizures' was not treated as a separate secondary outcome since this outcome is already captured within the primary outcome 'acute (short‐term) neurological sequelae'.
Oedema (including cerebral)
One study reported facial oedema, pulmonary oedema, and hydrocephalus (Duke 2002).
Total body water
One study reported total body water as an outcome (Singhi 1995).
Extracellular water
One study reported extracellular water as an outcome (Singhi 1995).
Serum and urinary sodium
Two studies reported comparisons of mean serum‐sodium concentrations (Powell 1990; Singhi 1995). Duke 2002 reported the proportion of children with serum‐sodium concentrations below 130 mmol/litre at 72 hours. One study reported urinary sodium as an outcome (Singhi 1995).
Plasma and urinary osmolality
One study reported plasma and urinary osmolality as an outcome (Singhi 1995).
Duration of hospital stay
No study reported duration of hospital stay as an outcome.
Raised intracranial pressure
No study reported on raised intracranial pressure.
Status epilepticus
No study reported on incidence of status epilepticus.
Excluded studies
We excluded three studies as they were not RCTs (Brown 1994; Duke 1998; Floret 1999), one study because the interventions and comparators were not relevant (Berkley 2004), and another study because insufficient data on culture‐positive bacterial meningitis were available (Maitland 2013).
Risk of bias in included studies
A graphical representation of the risk of bias for the included studies is shown in Figure 1. A summary of methodological quality of the included trials is given in Figure 2.
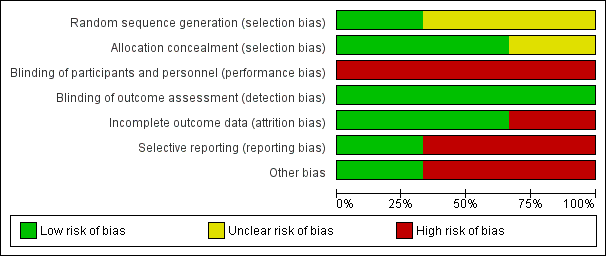
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Two studies used opaque, sealed, sequentially‐numbered envelopes (Duke 2002; Powell 1990). The remaining study used a random numbers table (Singhi 1995) and judged to have low risk. Two trials displayed adequate allocation concealment (Duke 2002; Powell 1990). The quality of allocation concealment in the third study was unclear (Singhi 1995).
Blinding
Performance bias
Blinding of participants and personnel was high risk for all trials
Detection bias
This was judged to be low risk for all the three trials for the outcomes of death and acute severe neurological sequelae as clinically they are quite objective and obvious even though no blinding was done.Since no blinding was done for outcome assessment it would be high risk for the outcome of chronic sever neurological sequale where the clinical manifestation would not be so obvious.
Attrition bias
The attrition bias was found to be low risk for two trials (Duke 2002; Singhi 1995) and high risk for one (Powell 1990).
Reporting bias
Reporting bias was found to be high risk in two studies (Powell 1990; Singhi 1995) and low risk in one study (Duke 2002).
Power calculations
Two studies documented power calculations (Duke 2002; Singhi 1995). Duke 2002 calculated a required participation of 354 to detect a one‐third reduction in adverse outcomes. The study randomised 357 children and analysed results for 346 children immediately at completion of treatment. Singhi 1995 calculated that 31 children in each group were needed to detect a 25% change in intact survival rate from 50%, with a significance of 0.05. This study was terminated early, but enrolled 25 in each group.
Number of centres
Duke 2002 had three participating centres. The remaining two were single‐centre studies (Powell 1990; Singhi 1995).
Intention‐to‐treat (ITT) analysis
No study reported an ITT analysis.
Incomplete outcome data
The largest study had relatively small numbers of dropouts (11 of 357 enrolled children) by the end of treatment, when most of the outcomes were measured (Duke 2002). By three months from diagnosis there were over 10% dropouts.
The Powell 1990 study had five exclusions from 24 children enrolled, and this would have introduced the possibility of significant bias. Singhi 1995 had no dropouts.
Selective reporting
There was no evidence of selective reporting of data in Duke 2002; both short‐term and longer‐term morbidities were reported. Powell 1990 only reported short‐term sodium levels. Singhi 1995 only reported total numbers with short‐term neurological impairment and did not attempt to break these down by type of impairment.
Other potential sources of bias
The main concern was the marked discrepancy in size between the largest study and the two other very small RCTs. The Singhi 1995 trial was stopped prematurely owing to observance of "a trend toward poor outcome in the restricted‐fluid group", and this is also a potential source of bias.
Effects of interventions
Primary outcomes
1. Death
All participants, regardless of serum sodium at enrolment
The meta‐analysis of the three studies (420 children) for deaths (Duke 2002; Powell 1990; Singhi 1995), where one study reported no fatality amongst their participants (Powell 1990), found no significant difference between deaths in the maintenance‐fluid and restricted‐fluid groups; risk ratio (RR) 0.82, 95% confidence interval (CI) 0.53 to 1.27; low quality evidence (summary of findings Table for the main comparison; Analysis 1.1.1).
Participants with or without hyponatraemia
The Singhi 1995 study that subdivided maintenance‐fluid and restricted‐fluid groups into children with or without hyponatraemia at presentation found no significant difference in death rates in either those presenting with hyponatraemia (26 children) or those without hyponatraemia (24 children). With hyponatraemia, the RR for children given the two different fluid intakes was RR 0.15, 95% CI 0.01 to 2.50 (Analysis 1.1.2); without hyponatraemia, the RR was 0.79, 95% CI 0.16 to 3.90 (Analysis 1.1.3).
2. Short‐term (within the first four weeks of illness) and long‐term (persisting after the first four weeks of illness) neurological sequelae
Short‐term neurological sequelae
The meta‐analysis of acute severe neurological sequelae (2 studies, 407 children) found no significant difference between the maintenance‐fluids and restricted‐fluids groups (RR 0.67, 95% CI 0.41 to 1.08; low quality evidence) (summary of findings Table for the main comparison; Analysis 1.2.1).
Data on mild to moderate sequelae at 14 days (1 study, 357 children) also showed no significant difference between maintenance‐fluid and restricted‐fluid groups (RR 1.24, 95% CI 0.58 to 2.65) (Analysis 1.3.1).
However, when neurological sequelae were categorised further, the available data produced the following results.
-
Hemiparesis/hemiplegia (1 study, 357 children): no significant difference between groups (RR 0.97, 95% CI 0.52 to 1.81) (Analysis 1.4.1).
-
Spasticity (1 study, 357 children): there was a statistically significant difference in favour of the maintenance‐fluid group (RR 0.50, 95% CI 0.27 to 0.93) (Analysis 1.5.1).
-
Seizures (1 study, 357 children): there was a statistically significant difference in seizure activity at both 72 hours (RR 0.59, 95% CI 0.42 to 0.83) and 14 days (RR 0.19, 95% CI 0.04 to 0.88) in favour of the maintenance‐fluid group (Analysis 1.6).
-
Visual impairment and response to sound (1 study, 357 children): there was no statistically significant difference in either group. On visual impairment the RR was 0.77, 95% CI 0.44 to 1.35 (Analysis 1.7) and on response to sound, RR 0.60, 95% CI 0.25 to 1.41 (Analysis 1.8).
Participants with or without hyponatraemia
Analyses of data from participants with and without hyponatraemia at presentation showed no significant difference in acute neurological sequelae for either subgroup. Without hyponatraemia, the RR for children given maintenance fluids or restricted fluids was RR 0.59, 95% CI 0.13 to 2.64 (Analysis 1.2.3); with hyponatraemia, RR 0.91, 95% CI 0.34 to 2.47 (Analysis 1.2.4).
Long‐term neurological sequelae
The data relating to chronic severe neurological sequelae (1 study, 351 children) showed a statistically significant difference at three‐month follow‐up in favour of those in the maintenance‐fluid groups: RR 0.42, 95% CI 0.20 to 0.89; very low quality evidence (summary of findings Table for the main comparison; Analysis 1.2.2).
Secondary outcomes
1. Oedema (including cerebral)
The data on facial oedema (1 study, 357 children) showed a statistically significant difference in favour of the restricted‐fluids group: RR 5.47, 95% CI 2.65 to 11.27. There was no statistically significant difference in either pulmonary oedema (RR 8.75, 95% CI 0.47 to 161.38) or hydrocephalus (RR 0.28, 95% CI 0.06 to 1.32) (Analysis 1.9).
2. Total body water
The data on change in total body water at 48 hours after admission (1 study; 24 children without hyponatraemia, 26 children with hyponatraemia) showed a statistically significantly greater reduction in the restricted‐fluids group in both non‐hyponatraemic and hyponatraemic children: mean difference (MD) (meq/litre) 24.50, 95% CI 9.91 to 39.09; and MD (meq/litre) 36.00, 95% CI 19.83 to 52.17, respectively (Analysis 1.10).
3. Extracellular water
The data on reduction in extracellular water at 48 hours after admission (1 study; 24 children without hyponatraemia, 26 children with hyponatraemia) showed a greater reduction in the restricted‐fluid groups: non‐significant for non‐hyponatraemic children: MD (meq/litre) 22.90, 95% CI ‐1.11 to 46.91; and a statistically significant change in hyponatraemic children: MD (meq/litre) 35.00, 95% CI 16.86 to 53.14 (Analysis 1.11).
4. Serum and urinary sodium
Duke 2002 reported the proportion of children with serum sodium concentrations below 130 mmol/litre at 72 hours and found no statistically significant difference between the restricted‐fluid and maintenance‐fluid groups: RR 0.72, 95% CI 0.34 to 1.55 (Analysis not shown).
We did not attempt a meta‐analysis of the two studies comparing mean sodium concentrations, as Powell 1990 measured serum sodium at 24 hours and Singhi 1995, at 48 hours. The Powell 1990 study (13 children with bacterial meningitis) reported all children together and found no statistically significant difference in mean serum sodium at 24 hours: MD (meq/litre) 3.00, 95% CI ‐0.94 to 6.94. The Singhi 1995 study (1 study; 24 children without hyponatraemia, 26 children with hyponatraemia) subgrouped children by hyponatraemia status at study entry. The study found a statistically significant difference in favour of the restricted‐fluid group in children with hyponatraemia (MD (meq/litre) ‐4.20, 95% CI ‐6.20 to ‐2.2). In the original paper, the statistical difference in favour of restricted fluids in children without hyponatraemia (MD (meq/litre) ‐3.50, 95% CI ‐7.58 to 0.58, P = 0.09) was reported as statistically significant, but this is not the case, as evident from examination of the effect estimate and the 95% CI. This study also found a significant difference in the change in serum sodium from baseline, in favour of the restricted‐fluid group, in children both with and without hyponatraemia. Without hyponatraemia, the MD (meq/litre) was ‐5.8, 95% CI ‐11.59 to ‐0.01; with hyponatraemia, MD (meq/litre) ‐4.40, 95% CI ‐6.97 to ‐1.83 (Analysis 1.12).
The one study (24 children without hyponatraemia at admission, 26 children with hyponatraemia) that reported urinary sodium found no significant difference at 48 hours in mean urinary sodium in children without hyponatraemia (MD (meq/litre) ‐14.0, 95% CI ‐31.60 to 3.6) but a statistically significant difference in children with hyponatraemia at admission (MD (meq/litre) ‐21.00, 95% CI ‐34.14 to ‐7.86). There was no significant change from baseline at 48 hours either in children without hyponatraemia (MD (meq/litre) 1.00, 95% CI ‐12.22 to 14.22) or with hyponatraemia (MD (meq/litre) 0.0, 95% CI ‐8.94 to 8.94) (Analysis 1.13).
5. Plasma and urinary osmolality
There was a statistically significant difference in the change in plasma osmolality after 48 hours, with a greater increase in the restricted‐fluid group, in both the children presenting without hyponatraemia (1 study, 24 children): MD (meq/litre) ‐5.00, 95% CI ‐9.82 to ‐0.18; and children presenting with hyponatraemia (1 study, 26 children): MD (meq/litre) ‐6.00, 95% CI ‐11.36 to ‐0.64 (Analysis 1.14).
6. Duration of hospital stay
No study reported on duration of hospital stay.
7. Raised intracranial pressure
No study reported on raised intracranial pressure.
8. Status Epilepticus
No study reported on incidence of status epilepticus.
Discusión
Resumen de los resultados principales
El número pequeño de estudios identificados en esta revisión no demostró diferencias estadísticamente significativas en la mortalidad o las secuelas neurológicas agudas graves por restricción de líquidos. Dos estudios informaron altas tasas de mortalidad generales, muy superiores al 10% (Duke 2002; Singhi 1995; 407 niños). El tercer estudio incluyó un número muy reducido de participantes (19 niños analizados) y no informó muertes (Powell 1990). El metanálisis de los dos estudios que informaron las secuelas neurológicas demostró reducciones estadísticamente significativas en las tasas de espasticidad y convulsiones tempranas y en las secuelas neurológicas generales tardías, en los niños que recibieron líquidos de mantenimiento. No hubo ninguna diferencia estadísticamente significativa en las secuelas neurológicas a corto plazo generales o en el riesgo de hemiparesia, deficiencia visual o auditiva.
Dos de los estudios incorporaron un número muy reducido de niños de centros únicos (Powell 1990; Singhi 1995). Los resultados de mortalidad y morbilidad, por lo tanto, son dominados por el estudio Duke 2002. Los grandes retrasos antes de la presentación y una tasa alta de malnutrición en los niños de este estudio pueden haber estado asociados con una tasa alta de deshidratación en la presentación. El resultado de una tasa mayor de secuelas neurológicas en el grupo de restricción de líquidos de este estudio puede deberse al tratamiento inicial insuficiente de la deshidratación. Esto puede no ser pertinente en los ámbitos en los cuales los pacientes se presentan antes.
Compleción y aplicabilidad general de las pruebas
Los tres estudios incluidos fueron insuficientes para evaluar el objetivo de la revisión de evaluar diferentes volúmenes de administración inicial de líquidos en los resultados del tratamiento de la meningitis bacteriana aguda. No se encontró ningún ensayo que respondiera a la pregunta de revisión para los pacientes adultos. Todos los ensayos se realizaron en ámbitos hospitalarios, y ninguno se realizó en la atención primaria o en sitios extrahospitalarios, en los que a menudo se instituye el tratamiento inicial con líquidos y los pacientes son derivados a un ámbito de atención terciaria para una atención especializada. Los ensayos realizados en ámbitos extrahospitalarios y de atención primaria quizá sean más relevantes para los países de ingresos bajos a medios, donde no hay una buena monitorización de la asistencia sanitaria y, por lo general, es poco estructurada (Maher 2011).
El más grande de los tres estudios incluyó resultados múltiples relevantes a la pregunta de la revisión (Duke 2002). Su deficiencia fue que solo pudo abordar la pregunta en ámbitos de tasas de mortalidad y morbilidad altas y con un tiempo prolongado antes de la consulta.
Los otros dos estudios incluidos fueron demasiado pequeños como para establecer alguna conclusión. Ninguno de los estudios incluyó adultos.
Los resultados de la administración de líquidos a corto plazo y el equilibrio electrolítico no aportan pruebas suficientes sobre las que basar algún cambio en la práctica. El informe de los niveles de sodio fue inconsistente, por lo que no fue posible realizar un metanálisis.
La calidad de las pruebas para los resultados primarios y secundarios fue baja a muy baja y, por lo tanto, insuficiente para guiar la práctica clínica.
Calidad de la evidencia
Se evaluó la calidad general de las pruebas mediante el enfoque GRADE (Schunemann 2011), como se presenta en "Resumen de los resultados para la comparación principal". La calidad general de las pruebas de los regímenes de mantenimiento de líquidos versus los regímenes de restricción de líquidos para los niños con meningitis bacteriana aguda fue baja para los resultados de muerte y secuelas neurológicas agudas graves, y muy baja para las secuelas neurológicas crónicas graves. En esta actualización de 2016, se revisó la tabla GRADE teniendo en cuenta los estándares Cochrane actuales y para mejorar la transparencia y la consistencia del informe de los resultados.
Sesgos potenciales en el proceso de revisión
Se realizaron búsquedas en varias bases de datos electrónicas utilizando una serie de términos de búsqueda. Se espera que la estrategia de búsqueda haya sido exitosa en la identificación de todos los estudios pertinentes. Se han utilizado metodologías Cochrane estándar para minimizar cualquier sesgo en el proceso de revisión.
Acuerdos y desacuerdos con otros estudios o revisiones
No hay ninguna revisión sistemática que haya explorado esta pregunta de investigación.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 1 Death.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 2 Severe neurological sequelae.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 3 Mild to moderate neurological sequelae.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 4 Hemiparesis/hemiplegia.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 5 Spasticity.
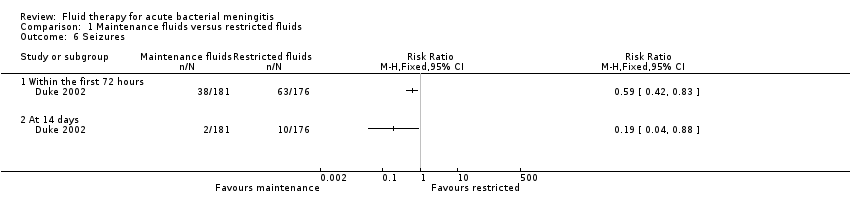
Comparison 1 Maintenance fluids versus restricted fluids, Outcome 6 Seizures.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 7 Visual impairment.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 8 No response to sound.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 9 Oedema.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 10 Total body water ‐ fall after 48 hours.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 11 Extracellular water ‐ fall after 48 hours.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 12 Serum sodium.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 13 Urinary sodium.

Comparison 1 Maintenance fluids versus restricted fluids, Outcome 14 Plasma osmolality ‐ change after 48 hours.
| Maintenance fluids versus restricted fluids for acute bacterial meningitis | |||||
| Patient or population: paediatric patients with acute bacterial meningitis Settings: hospital inpatient department Intervention: maintenance fluids Comparison: restricted fluids | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Restricted fluids | Maintenance fluids | ||||
| Death ‐ all participants | Study population | RR 0.82 (0.53 to 1.27) | 407 | ⊕⊕⊝⊝ | |
| 186 per 1000 | 153 per 1000 (99 to 237) | ||||
| Moderate risk population | |||||
| 213 per 1000 | 175 per 1000 (113 to 271) | ||||
| Severe neurological sequelae ‐ acute (within the first 4 weeks) | Study population | RR 0.67 | 407 | ⊕⊕⊝⊝ | |
| 176 per 1000 | 118 per 1000 (72 to 191) | ||||
| Moderate risk population | |||||
| 252 per 1000 | 169 per 1000 (103 to 272) | ||||
| Severe neurological sequelae ‐ chronic (after the first 4 weeks) | Study population | RR 0.42 | 351 | ⊕⊝⊝⊝ | |
| 121 per 1000 | 51 per 1000 (24 to 108) | ||||
| Moderate risk population | |||||
| 121 per 1000 | 51 per 1000 (24 to 108) | ||||
| *The basis for the assumed risk (e.g. the median control group risk across studies) is provided in footnotes. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Total number of events is small and 95% CI around pooled estimate includes both appreciable benefit and harms. | |||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Death Show forest plot | 2 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 1.1 All participants | 2 | 407 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.82 [0.53, 1.27] |
| 1.2 Participants with hyponatraemia | 1 | 26 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.15 [0.01, 2.50] |
| 1.3 Participants without hyponatraemia | 1 | 24 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.79 [0.16, 3.90] |
| 2 Severe neurological sequelae Show forest plot | 2 | Risk Ratio (M‐H, Fixed, 95% CI) | Subtotals only | |
| 2.1 Acute (within the first 4 weeks) | 2 | 407 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.67 [0.41, 1.08] |
| 2.2 Chronic (after the first 4 weeks) | 1 | 351 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.42 [0.20, 0.89] |
| 2.3 Participants without hyponatraemia | 1 | 24 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.59 [0.13, 2.64] |
| 2.4 Participants with hyponatraemia | 1 | 26 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.91 [0.34, 2.47] |
| 3 Mild to moderate neurological sequelae Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 3.1 At 14 days | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 4 Hemiparesis/hemiplegia Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 4.1 At 14 days | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 5 Spasticity Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 5.1 At 14 days | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 6 Seizures Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 6.1 Within the first 72 hours | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 6.2 At 14 days | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 7 Visual impairment Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 7.1 At 14 days | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 8 No response to sound Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 8.1 At 14 days | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 9 Oedema Show forest plot | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | Totals not selected | |
| 9.1 Acute facial oedema | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 9.2 Acute pulmonary oedema | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 9.3 Acute hydrocephalus | 1 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 10 Total body water ‐ fall after 48 hours Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 10.1 Participants without hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 10.2 Participants with hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 11 Extracellular water ‐ fall after 48 hours Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 11.1 Participants without hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 11.2 Participants with hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 12 Serum sodium Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 12.1 All participants (24 hours) | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 12.2 Participants with hyponatraemia (48 hours) | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 12.3 Participants without hyponatraemia (48 hours) | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 12.4 Change from baseline at 48 hours ‐ without hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 12.5 Change from baseline at 48 hours ‐ with hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 13 Urinary sodium Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 13.1 Participants without hyponatraemia (48 hours) | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 13.2 Participants with hyponatraemia (48 hours) | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 13.3 Change from baseline at 48 hours ‐ without hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 13.4 Change from baseline at 48 hours ‐ with hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 14 Plasma osmolality ‐ change after 48 hours Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 14.1 Participants without hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 14.2 Participants with hyponatraemia | 1 | Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |

