Medias de compresión graduada para la prevención de la trombosis venosa profunda
Resumen
Antecedentes
Los pacientes hospitalizados tienen un mayor riesgo de desarrollar trombosis venosa profunda (TVP) en las venas de las extremidades inferiores y de la pelvis, en un contexto de inmovilización prolongada asociada con la enfermedad médica o quirúrgica. Los pacientes con TVP tienen un mayor riesgo de presentar una embolia pulmonar (EP). Se ha propuesto el uso de medias de compresión graduada (MCG) en pacientes hospitalizados para disminuir el riesgo de TVP. Esta es una actualización de una revisión Cochrane publicada por primera vez en 2000 y actualizada por última vez en 2014.
Objetivos
Evaluar la efectividad y la seguridad de las medias de compresión graduada para la prevención de la trombosis venosa profunda en diversos grupos de pacientes hospitalizados.
Métodos de búsqueda
Para esta revisión, el documentalista del Grupo Cochrane Vascular realizó búsquedas en el Registro Especializado Cochrane de Ensayos Controlados, el Registro Cochrane Central de Ensayos Controlados (CENTRAL) y en los registros de ensayos el 21 marzo 2017; y en el Registro Especializado Cochrane de Ensayos Controlados, CENTRAL, MEDLINE Ovid, Embase Ovid, CINAHL Ebsco, AMED Ovid, y en los registros de ensayos el 12 junio 2018.
Criterios de selección
Ensayos controlados aleatorizados (ECA) que incluyeron las MCG solas o las MCG utilizadas en un contexto de cualquier otro método profiláctico de TVP. Se combinaron los resultados de ambos grupos de ensayos.
Obtención y análisis de los datos
Ambos autores de la revisión (AS, MD) realizaron una evaluación independiente de los ensayos potencialmente elegibles para su inclusión. Un autor de la revisión (AS) extrajo los datos, y un segundo autor (MD) los verificó y autentificó. Dos autores de la revisión (AS, MD) evaluaron la calidad metodológica de los ensayos con la herramienta Cochrane «Riesgo de sesgo». Cualquier desacuerdo fue resuelto mediante la discusión con el autor principal de la revisión (TL). Para los resultados dicotómicos, se utilizó el odds ratio de Peto y el intervalo de confianza (IC) del 95% correspondiente. Los datos se agruparon mediante un modelo de efectos fijos. Para evaluar la calidad general de la evidencia que apoya los resultados evaluados en esta revisión, se utilizaron los criterios GRADE.
Resultados principales
Se incluyeron 20 ECA con un total de 1681 participantes y 1172 piernas individuales (2853 unidades analíticas). De estos 20 ensayos, diez incluyeron a pacientes sometidos a cirugía general; seis incluyeron a pacientes sometidos a cirugía ortopédica; tres ensayos individuales incluyeron a pacientes sometidos a neurocirugía, cirugía cardíaca y cirugía ginecológica, respectivamente; y solo un ensayo incluyó a pacientes con enfermedades médicas. Las medias de compresión graduada se utilizaron el día previo a la cirugía o el día de la cirugía, y se usaron hasta el alta o hasta que los participantes tuvieron una movilidad completa. En la mayoría de los estudios incluidos, la TVP se identificó mediante la prueba de captación de I125 radiactivo. La duración del seguimiento varió de siete a 14 días. En general, los estudios incluidos presentaron un riesgo de sesgo bajo.
Se pudieron agrupar los datos de 20 estudios que informaron sobre la incidencia de la TVP. En el grupo con MCG, 134 de 1445 unidades desarrollaron TVP (9%) en comparación con el grupo control (sin MCG), en el cual 290 de 1408 unidades desarrollaron TVP (21%). El odds ratio de Peto (OR) fue de 0,35 (intervalo de confianza [IC] del 95%: 0,28 a 0,43; 20 estudios; 2853 unidades; evidencia de calidad alta), lo que demuestra un efecto general a favor del tratamiento con MCG (p < 0,001).
En función de los resultados de ocho estudios incluidos, la incidencia de TVP proximal fue de siete de 517 (1%) unidades en el grupo con MCG y de 28 de 518 (5%) unidades en el grupo control. El OR de Peto fue de 0,26 (IC del 95%: 0,13 a 0,53; 8 estudios; 1035 unidades; evidencia de calidad moderada) con un efecto global a favor del tratamiento con MCG (p < 0,001). Al combinar los resultados de cinco estudios, todos basados en pacientes quirúrgicos, la incidencia de EP fue de cinco de 283 (2%) participantes en el grupo con MCG y 14 de 286 (5%) en el grupo control. El OR de Peto fue de 0,38 (IC del 95%: 0,15 a 0,96; cinco estudios; 569 participantes; evidencia de calidad baja) con un efecto global a favor del tratamiento con MCG (p = 0,04). Se disminuyó la calidad de la evidencia para la TVP proximal y la EP debido a la tasa de eventos baja (imprecisión) y a la falta de cribado sistemático para la EP (inconsistencia).
Se realizaron análisis de subgrupos por especialidad (pacientes con enfermedades médicas o quirúrgicas). Al combinar los resultados de 19 ensayos centrados en pacientes quirúrgicos, 134 de 1365 (9,8%) unidades desarrollaron TVP en el grupo con MCG en comparación con 282 de 1328 (21,2%) unidades en el grupo control. El OR de Peto fue de 0,35 (IC del 95%: 0,28 a 0,44; evidencia de calidad alta), con un efecto global a favor del tratamiento con MCG (p < 0,001). En función de los resultados de siete estudios incluidos, la incidencia de TVP proximal fue de siete de 437 unidades (1,6%) en el grupo con MCG y de 28 de 438 (6,4%) en el grupo control. El OR de Peto fue de 0,26 (IC del 95%: 0,13 a 0,53; 875 unidades; evidencia de calidad moderada) con un efecto global a favor del tratamiento con MCG (p < 0,001). Se disminuyó la calidad de la evidencia de la TVP proximal debido a la baja tasa de eventos (imprecisión).
En función de los resultados de un ensayo que se centró en pacientes con enfermedades médicas ingresados después de un infarto agudo de miocardio, cero de 80 (0%) piernas desarrollaron TVP en el grupo con MCG y ocho de 80 (10%) piernas desarrollaron TVP en el grupo control. El OR de Peto fue de 0,12 (IC del 95%: 0,03 a 0,51; evidencia de calidad baja) con un efecto global a favor del tratamiento con MCG (p = 0,004). Ninguno de los pacientes con enfermedades médicas de ninguno de los dos grupos desarrolló una TVP proximal, y no se informó sobre la incidencia de EP.
Hubo datos limitados para evaluar con precisión la incidencia de los efectos adversos y las complicaciones con el uso de MCG, ya que no se informaron de forma sistemática ni cuantitativa en los estudios incluidos.
Conclusiones de los autores
Hubo evidencia de calidad alta de que las MCG son efectivas para reducir el riesgo de TVP en los pacientes hospitalizados sometidos a cirugía general y ortopédica, con o sin otros métodos de tromboprofilaxis de base, cuando resulte clínicamente apropiado. Existe evidencia de calidad moderada de que las MCG probablemente reducen el riesgo de TVP proximal, y evidencia de calidad baja de que las MCG podrían reducir el riesgo de EP. Sin embargo, aún no hay evidencia suficiente para evaluar la efectividad de las MCG en la disminución del riesgo de TVP en pacientes con enfermedades médicas.
PICO
Resumen en términos sencillos
Medias de compresión graduada para la prevención de la trombosis venosa profunda durante la estancia hospitalaria
Antecedentes
En la trombosis venosa profunda (TVP), se forma un coágulo de sangre en una vena profunda del cuerpo, generalmente en las venas de la pierna o de la pelvis. Varios factores como movilidad reducida, edad avanzada, obesidad, cáncer activo, cirugía mayor, lesiones graves, antecedentes de TVP, antecedentes familiares de TVP y haber estado enfermo recientemente pueden aumentar el riesgo de presentar una TVP. Los pacientes hospitalizados, que a menudo presentan uno o más de estos factores de riesgo, presentan un riesgo especial de desarrollar TVP, ya sea inmediatamente después de la cirugía o si permanecen inmovilizados debido a una enfermedad médica.
Los síntomas de la TVP varían de ningún síntoma a dolor y edema en las piernas. Un coágulo de sangre puede desplazarse de la pierna a los pulmones, con el peligro de embolia pulmonar (EP) y muerte. El principal tratamiento para la TVP incluye la administración de anticoagulantes (anticoagulación). Aunque por lo general la trombosis venosa profunda se resuelve, puede tener efectos a largo plazo como hipertensión venosa en la pierna, dolor en las piernas, edema, oscurecimiento de la piel e inflamación.
La trombosis venosa profunda se puede prevenir con el uso de compresión o con fármacos. Los medicamentos pueden causar hemorragia, lo cual es una preocupación particular en los pacientes quirúrgicos. Las medias de compresión graduada (MCG) ayudan a prevenir la formación de coágulos de sangre en las piernas, mediante la aplicación de diferentes grados de presión en distintas partes de la pierna.
Características de los estudios y resultados clave
Se identificaron 20 ensayos controlados aleatorizados (estudios en que los participantes se asignan a un grupo de tratamiento con un método aleatorio) (2853 unidades analíticas con 1681 pacientes individuales y 1172 piernas individuales) en la búsqueda más reciente del 12 junio 2018. Nueve ensayos compararon el uso de medias versus sin medias, y 11 compararon las medias más otro método con dicho método solo. Los otros métodos utilizados fueron: dextrán 70, aspirina, heparina y compresión mecánica secuencial. De los 20 ensayos, diez incluyeron a pacientes sometidos a cirugía general; seis incluyeron a pacientes sometidos a cirugía ortopédica; tres ensayos individuales incluyeron a pacientes sometidos a neurocirugía, cirugía cardíaca y cirugía ginecológica, respectivamente; y solo un ensayo incluyó a pacientes con enfermedades médicas (pacientes que ingresaron al hospital por motivos diferentes de la cirugía). Las medias de compresión se utilizaron el día previo a la cirugía o el día de la cirugía, y se usaron hasta el alta o hasta que los pacientes tuvieron una movilidad completa. En la gran mayoría de los estudios incluidos se utilizaron medias que cubren el muslo. En general, los estudios incluidos fueron de buena calidad. Se encontró que el uso de MCG redujo el riesgo global de desarrollar TVP, y probablemente también la TVP en el muslo. También se encontró que las MCG podrían reducir el riesgo de EP en los pacientes sometidos a cirugía. Como solo un ensayo incluyó a pacientes con enfermedades médicas, los resultados de esta población son limitados. Los estudios incluidos informaron de manera deficiente sobre la aparición de problemas asociados con el uso de las MCG.
Calidad de la evidencia
Esta revisión confirmó que las MCG son efectivas para reducir el riesgo de TVP en pacientes quirúrgicos hospitalizados (evidencia de calidad alta). También demostró que las MCG probablemente reducen el riesgo de desarrollar TVP en el muslo (TVP proximal, evidencia de calidad moderada) y EP (evidencia de calidad baja). Las razones para disminuir la calidad de la evidencia incluyeron una tasa de eventos baja (es decir, un pequeño número de participantes que desarrollaron TVP) y la falta de certeza debido a que solo un pequeño número de pacientes se sometió a cribado sistemático para TVP proximal o EP. Se dispuso de evidencia limitada para los pacientes hospitalizados con enfermedades médicas, y solo un estudio indicó que las MCG pueden prevenir la TVP en dichos pacientes.
Conclusiones de los autores
Summary of findings
| Graduated compression stockings for prevention of deep vein thrombosis | ||||||
| Patient or population: Hospitalised patients1 | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of units/ participants2 | Quality of the evidence | Comments | |
| Risk with no GCS | Risk with GCS | |||||
| Deep vein thrombosis (DVT) Follow‐up: 7 to 14 days, or until discharge | Study population | OR 0.35 | 2853 | ⊕⊕⊕⊕ | Graduated compression stockings reduce the incidence of DVT in hospitalised patients. However, studies did not routinely distinguish between symptomatic and asymptomatic DVTs. | |
| 206 per 1000 | 83 per 1000 | |||||
| Proximal DVT Follow‐up: 7 to 14 days, or until discharge | Study population | OR 0.26 | 1035 | ⊕⊕⊕⊝ | Graduated compression stockings probably reduce the incidence of proximal DVT in hospitalised patients. There was a relatively low event rate overall, and studies did not routinely distinguish between symptomatic and asymptomatic proximal DVTs. | |
| 54 per 1000 | 15 per 1000 | |||||
| Pulmonary embolism Follow‐up: 7 to 30 days | Study population | OR 0.38 | 569 | ⊕⊕⊝⊝ | Graduated compression stockings may slightly reduce the incidence of pulmonary embolism in hospitalised patients. Pulmonary embolism was not routinely assessed in most included studies, and the overall event rate was very low. | |
| 49 per 1000 | 19 per 1000 | |||||
| Adverse effects and complications Follow‐up: until discharge | See comment | ‐ | ‐ | ‐ | Some participants removed stockings due to discomfort or poor fitting, however adverse effects and complications were not routinely reported quantitatively in the included studies. | |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Included patients admitted for surgical procedures (including abdominal, orthopaedic, neurosurgical, gynaecological surgery) and medical illness (acute myocardial infarction). | ||||||
| Graduated compression stockings for prevention of deep vein thrombosis | ||||||
| Patient or population: Patients hospitalised for surgical procedures1 | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of units/ participants2 | Quality of the evidence | Comments | |
| Risk with no GCS | Risk with GCS | |||||
| Deep vein thrombosis (DVT) Follow‐up: 7 to 14 days, or until discharge | Study population | OR 0.35 (0.28 to 0.44) | 2693 (19 RCTs) | ⊕⊕⊕⊕ | Graduated compression stockings reduce the incidence of DVT in hospitalised surgical patients. However, studies did not routinely distinguish between symptomatic and asymptomatic DVTs. | |
| 212 per 1000 | 86 per 1000 | |||||
| Proximal DVT Follow‐up: 7 to 14 days, or until discharge | Study population | OR 0.26 (0.13 to 0.53) | 875 (7 RCTs) | ⊕⊕⊕⊝ | Graduated compression stockings probably reduce the incidence of proximal DVT in hospitalised surgical patients. However, studies did not routinely distinguish between symptomatic and asymptomatic proximal DVTs. There was a relatively low event rate overall. | |
| 64 per 1000 | 17 per 1000 | |||||
| Pulmonary embolism Follow‐up: 7 to 30 days, or until discharge | Study population | OR 0.38 (0.15 to 0.96) | 569 (5 RCTs) | ⊕⊕⊝⊝ | Graduated compression stockings may slightly reduce the incidence of pulmonary embolism in hospitalised surgical patients. However, pulmonary embolism was not routinely assessed in most included studies, and the overall event rate was very low. | |
| 49 per 1000 | 19 per 1000 | |||||
| Adverse effects and complications Follow‐up: until discharge | See comment | ‐ | ‐ | ‐ | Some participants removed stockings due to discomfort or poor fitting, however adverse effects and complications associated with wearing GCS were not routinely reported quantitatively in the included studies. | |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Included patients admitted for surgical procedures (including abdominal, orthopaedic, neurosurgical, gynaecological surgery). | ||||||
| Graduated compression stockings for prevention of deep vein thrombosis | ||||||
| Patient or population: Patients hospitalised following acute myocardial infarction | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of units | Quality of the evidence | Comments | |
| Risk with no GCS | Risk with GCS | |||||
| Deep vein thrombosis (DVT) Follow‐up: 8 days or discharge or until development of DVT | Study population | OR 0.12 (0.03 to 0.51) | 160 | ⊕⊕⊝⊝ | Graduated compression stockings may reduce incidence of DVT in hospitalised medical patients. However, results are based on a single study on medical patients hospitalised following acute myocardial infarction (Kierkegaard 1993). | |
| 100 per 1000 | 13 per 1000 | |||||
| Proximal DVT Follow‐up: 8 days or discharge or until development of DVT | Study population | Not estimable | 160 (1 RCT) | ‐ | None of the participants in either group of this single RCT with a small sample size developed proximal DVT. | |
| 0 per 1000 | 0 per 1000 (0 to 0) | |||||
| Pulmonary embolism | See comment | ‐ | ‐ | ‐ | No studies reported on this outcome. There is paucity of evidence to evaluate the effect of GCS on reducing incidence of pulmonary embolism in hospitalised medical patients. | |
| Adverse effects and complications | See comment | ‐ | 160 (1 RCT) | ‐ | There are rare reports of post‐thrombotic changes in participants who developed DVT in the single included RCT. | |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1We downgraded the quality of the evidence by two steps as there was only one study and a low event rate in the GCS group (imprecision). | ||||||
Antecedentes
Descripción de la afección
La aparición de uno o más factores de la tríada de Virchow (estasis sanguínea, lesión endotelial e hipercoagulabilidad de la sangre) en el sistema venoso a menudo provoca trombosis venosa profunda (TVP) (Virchow 1858). La TVP es difícil de diagnosticar, ya que los antecedentes clínicos del paciente no son específicos, y los síntomas varían desde la ausencia de síntomas hasta dolor y tumefacción de las piernas. Las secuelas de la TVP varían desde la resolución completa del coágulo sin efectos adversos hasta la muerte por embolia pulmonar (EP).
Los factores de riesgo asociados con el desarrollo de TVP incluyen: tener más de 60 años de edad, cáncer activo, obesidad, cirugía mayor, trauma mayor, inmovilización prolongada, embarazo, antecedentes de enfermedad tromboembólica y enfermedades médicas agudas. Los factores de riesgo tromboembólicos son especialmente frecuentes entre los pacientes hospitalizados, con una incidencia inicial de TVP en el 29% de los pacientes quirúrgicos y en el 24% de los pacientes médicos, y una incidencia de EP sintomática de 3% y 1%, respectivamente, sin el uso de tromboprofilaxis (NICE 2010).
La morbilidad debida a la TVP incluye el síndrome postrombótico (SPT), que abarca hipertensión venosa crónica causante de dolor en las extremidades, tumefacción, hiperpigmentación (oscurecimiento de la piel), dermatitis (inflamación de la piel), úlceras y lipodermatoesclerosis (endurecimiento de la piel que puede adquirir una pigmentación rojiza o marrón y que es acompañada de un deterioro de la grasa subcutánea). Los datos de un estudio prospectivo de cohortes multicéntrico revelaron que el 43% de los pacientes con TVP sintomática desarrollaron características de SPT en el seguimiento de dos años (Kahn 2008).
Los valores máximos de mortalidad asociada con la TVP ocurren en los primeros 30 días, entre el 3% y el 6%, aunque el riesgo de muerte sigue aumentando incluso durante el seguimiento a largo plazo (Søgaard 2014). Varios informes sugieren que entre el 28% y el 41% de los pacientes con TVP posteriormente desarrollan una EP, y esto se asocia con un aumento en el riesgo de mortalidad a los 30 días a aproximadamente 12% (White 2003).
Los pacientes que están en riesgo de desarrollar TVP se clasifican en tres grupos de riesgo (bajo, moderado y alto) de acuerdo con las guías del grupo de consenso de la International Consensus Statement and Thromboembolic Risk Factor (THRIFT) (ICS 2013; THRIFT 1992). Sin embargo, las guías sobre profilaxis de la tromboembolia venosa del National Institute for Health and Care Excellence y la Scottish Intercollegiate Guidelines Network ya no clasifican a los pacientes en grupos de riesgo bajo, moderado y alto (NICE 2010; SIGN 2010), sino que examinan los factores de riesgo para desarrollar TVP en los pacientes hospitalizados de forma individual.
Descripción de la intervención
Para la prevención de la TVP se utilizan métodos farmacológicos y mecánicos. Los métodos farmacológicos alteran el perfil de coagulación de la sangre; la mayor desventaja de este método es el riesgo de hemorragia, que puede ser especialmente preocupante en los pacientes quirúrgicos. Por ejemplo, la alteración de la coagulación puede provocar hematomas articulares después de una cirugía de reemplazo articular y hemorragia intracraneal después de un traumatismo craneoencefálico o de una neurocirugía. Los métodos mecánicos incluyen técnicas como la compresión neumática intermitente (CNI) y el uso de medias de compresión graduada (MCG).
De qué manera podría funcionar la intervención
No se conoce cuál es el mecanismo de acción exacto de las MCG. Sin embargo, hay evidencia que sugiere que ejercen una presión circunferencial graduada de distal a proximal que, cuando se combina con la actividad muscular en la extremidad, se cree que desplaza la sangre desde el sistema venoso superficial al profundo, a través de las venas perforantes. Se ha propuesto que esto aumenta con eficacia la velocidad y el volumen del flujo en el sistema profundo, y de este modo podría prevenir la trombosis (Benko 2001).
Por qué es importante realizar esta revisión
A pesar de la efectividad teórica y el uso generalizado de las medias de compresión, su efectividad clínica necesita una mayor evaluación. El uso incorrecto de las medias podría causar complicaciones como molestias, edema en las piernas, TVP e isquemia arterial. Las medias también pueden estar contraindicadas por motivos médicos. No se ha abordado hasta qué punto el perfil de las piernas de los pacientes podría limitar su efectividad. Esta revisión no abordó las recomendaciones relacionadas con la longitud ideal de las medias (hasta la rodilla versus hasta el muslo), que son evaluadas por una revisión Cochrane aparte (Sajid 2012).
Se calcula que el uso de las MCG entre los pacientes quirúrgicos le cuesta al National Health Service (NHS) 63,1 millones de libras esterlinas anuales (GAPS). Por lo tanto, se necesita una base de evidencia sólida para justificar el uso sistemático de MCG entre los pacientes hospitalizados.
Objetivos
Evaluar la efectividad y la seguridad de las medias de compresión graduada para la prevención de la trombosis venosa profunda en diversos grupos de pacientes hospitalizados.
Se analizaron las siguientes hipótesis:
-
las medias de compresión son efectivas para prevenir la TVP en pacientes hospitalizados (excepto el accidente cerebrovascular);
-
en todos los pacientes con riesgo moderado, las medias de compresión solas son adecuadas para la profilaxis de la TVP, excepto en los pacientes que tienen específicamente contraindicadas las medias;
-
las medias no son necesarias en pacientes de riesgo bajo;
-
las complicaciones están asociadas con el uso de medias de compresión.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Solo se incluyeron ensayos controlados aleatorizados (ECA) que abordaron el uso de medias de compresión para la profilaxis de la TVP.
Tipos de participantes
Se incluyeron a pacientes de ambos sexos y de cualquier edad, hospitalizados por enfermedades con excepción del accidente cerebrovascular.
Tipos de intervenciones
Se incluyeron ensayos en que el uso de medias de compresión graduada (MCG) se comparó con la ausencia de profilaxis, y los estudios que compararon el uso de MCG versus sin medias, y que incluyeron otro método de profilaxis de la TVP, tanto en el grupo de tratamiento como en el grupo control (p.ej. aspirina, heparina). Esta actualización analizó juntos ambos grupos de ensayos, ya que los dos evaluaron el mismo efecto del tratamiento (es decir, MCG versus sin MCG).
Tipos de medida de resultado
Resultados primarios
-
Diagnóstico de TVP, ya sea todas las TVP o la TVP proximal, identificadas por ecografía, flebograma o estudios isotópicos
Resultados secundarios
-
Diagnóstico de EP, identificada por una gammagrafía pulmonar de ventilación‐perfusión, angiograma pulmonar o en la autopsia
-
Efectos adversos y complicaciones causados por el uso de MCG
Results
Description of studies
Results of the search
See Figure 1.
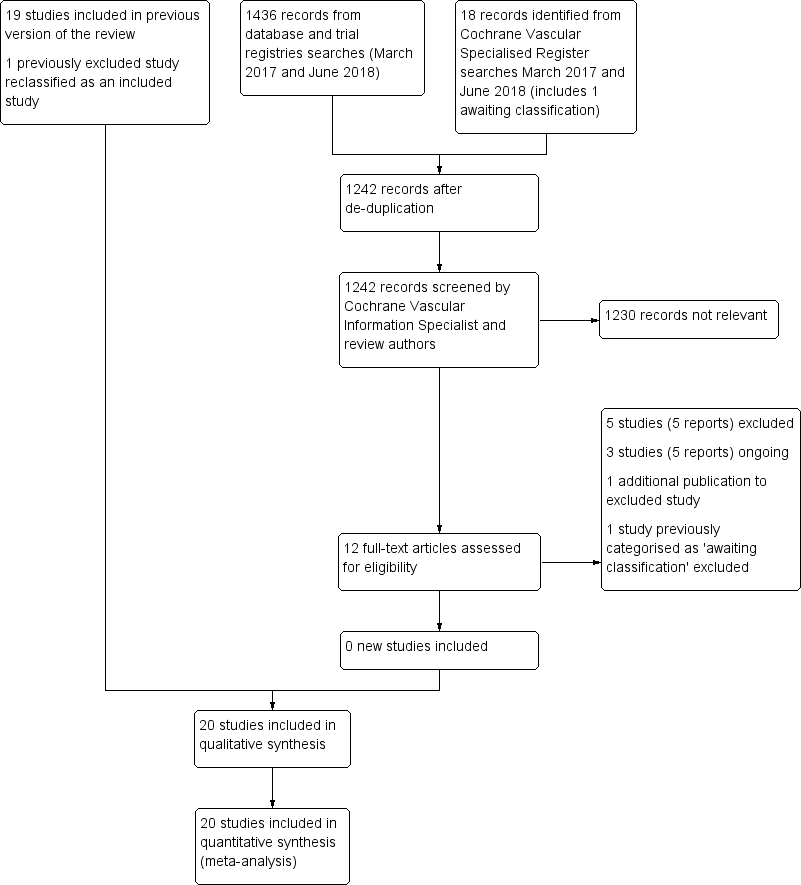
Study flow diagram.
Included studies
We added one additional study in the 2018 update (Mellbring 1986), resulting in a total of 20 RCTs that met the inclusion criteria (Allan 1983; Barnes 1978; Bergqvist 1984; Chin 2009; Fredin 1989; Holford 1976; Hui 1996; Kalodiki 1996; Kierkegaard 1993; Mellbring 1986; Ohlund 1983; Scurr 1977; Scurr 1987; Shirai 1985; Torngren 1980; Tsapogas 1971; Turner 1984; Turpie 1989; Wille‐Jorgensen 1985; Wille‐Jorgensen 1991). See the Characteristics of included studies table. Mellbring 1986 had previously been excluded due to data issues which were overcome for this update.
All trials
The 20 included RCTs provided a total of 2853 analytic units (1681 participants and 1172 legs). Specialties involved:
-
general surgery, 10 trials (Allan 1983; Bergqvist 1984; Holford 1976; Mellbring 1986; Scurr 1977; Scurr 1987; Torngren 1980; Tsapogas 1971; Wille‐Jorgensen 1985; Wille‐Jorgensen 1991);
-
orthopaedics, six trials (Barnes 1978; Chin 2009; Fredin 1989; Hui 1996; Kalodiki 1996; Ohlund 1983);
-
neurosurgery, one trial (Turpie 1989);
-
cardiac surgery, one trial (Shirai 1985);
-
obstetrics and gynaecology, one trial (Turner 1984); and
-
cardiology, one trial (Kierkegaard 1993).
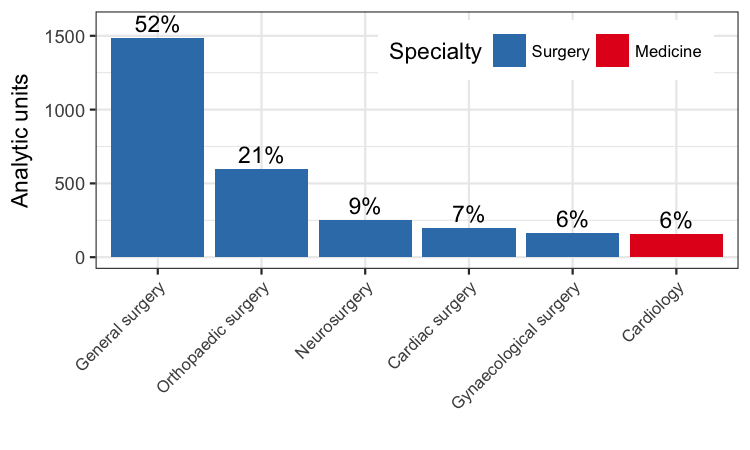
Patients undergoing general surgery formed the largest group (1486 of 2853 analytic units, 52%), followed by patients undergoing orthopaedic surgery (598 of 2853 analytic units, 21%).
All participants in the treatment groups received GCS as the method of DVT prophylaxis, with or without an additional background method of thromboprophylaxis. In nine included trials, participants in the control group received no DVT prophylaxis (Allan 1983; Chin 2009; Holford 1976; Hui 1996; Scurr 1977; Shirai 1985; Tsapogas 1971; Turner 1984; Turpie 1989). In the remaining 11 included trials, where stockings were used over a background method of thromboprophylaxis, participants in the control group received either:
-
dextran 70 (Bergqvist 1984; Fredin 1989; Ohlund 1983);
-
subcutaneous heparin (Torngren 1980; Wille‐Jorgensen 1985; Wille‐Jorgensen 1991);
-
aspirin (Barnes 1978; Kierkegaard 1993);
-
low molecular weight heparin (Kalodiki 1996; Mellbring 1986); or
-
sequential compression (Mellbring 1986; Scurr 1987).
Participants in the treatment group also received GCS.
Methodological differences between trials
In all but one of the RCTs participants were aged 35 years and above. The exception was Turpie 1989, which involved neurosurgical patients aged 16 years and above. One trial involved participants with myocardial infarction who were aged 70 years and over (Kierkegaard 1993), and one trial involved participants undergoing cardiac surgery who were aged 18 to 81 years (Shirai 1985).
All trials used thigh‐length GCS, except Hui 1996, in which one group used thigh‐length stockings and another used knee‐length stockings. We combined these groups for the purposes of this review. One participant in the trial by Turpie 1989 wore knee‐length stockings due to obesity. Five trials did not mention the length of the stockings used (Allan 1983; Chin 2009; Ohlund 1983; Turner 1984; Wille‐Jorgensen 1991).
In all trials GCS were applied either on the day of admission or on the day of operation. This was not critically evaluated on the assumption that all participants were fully mobile prior to surgery. In all but two of the trials the stockings were worn until the day of discharge or until the participants were fully mobile; participants in the remaining two studies wore GCS for 14 days or until discharge (Fredin 1989; Turpie 1989).
Most RCTs (16 of 20 trials) used the radioactive I125 fibrinogen uptake (FUT) assay to screen for DVT postoperatively and phlebography to confirm the diagnosis. One trial used Doppler ultrasonography for screening and phlebography for confirmation of DVT (Barnes 1978); two trials used only phlebography (Hui 1996; Kalodiki 1996); and one trial used only duplex ultrasonography for diagnosis of DVT (Chin 2009).
Excluded studies
We excluded a further six studies in the 2018 update (Barinov 2014; NCT01234064; NCT01935414; Sultan 2014; Wille‐Jorgensen 1986; Zheng 2014), bringing the total number of excluded studies to 56. We excluded studies for the following reasons.
-
Thirty‐five studies did not have appropriate control arms (Ayhan 2013; Barinov 2014; Caprini 1983; Chandhoke 1991; Fasting 1985; Gao 2012; Hansberry 1991; KANT study; Koopmann 1985; Lacut 2005; Lee 1989; Lobastov 2013; Maksimovic 1996; Marston 1995; Maxwell 2000; NCT00333021; NCT01935414; Necioglu 2008; Norgren 1996; Nurmohamed 1996; Orken 2009; Porteous 1989; Rabe 2013; Ryan 2002; Sakon 2012; Serin 2010; Shilpa 2013; Silbersack 2004; Sobieraj‐Teague 2012; Sultan 2014; Vignon 2013; Wille‐Jorgensen 1986; Yang 2009; Zhang 2011; Zheng 2014).
-
Two studies were not designed to assess the effectiveness of stockings in preventing DVT (Ido 1995; Rocca 2012).
-
In six studies DVT was not diagnosed or assessed appropriately (Cohen 2007; Ibegbuna 1997; Manella 1981; Rasmussen 1988; Wilkins 1952; Wilson 1994).
-
Five studies did not use the correct type of GCS (Flanc 1969; Patel 1988; Ramos 1996; Rosengarten 1970; Westrich 1996). Two trials used pneumatic compression (Ramos 1996; Westrich 1996); one trial used Tubigrip (Rosengarten 1970); and one trial used thick elastic compression stockings (Flanc 1969). In one French trial the type of stocking used was not clear (Patel 1988).
-
Three studies did not meet the inclusion criteria of this review based on types of patients included (Belcaro 1993; CLOTS 2009; Muir 2000). One study appeared to evaluate people with recurrent DVT in the community (Belcaro 1993). Two studies evaluated people with acute stroke (CLOTS 2009; Muir 2000); these trials have been included in a separate Cochrane Review focusing on people with acute stroke (Naccarato 2010). The rationale for this is as follows: stockings reduce the cross‐sectional area of the deep veins, making the calf muscle pump more effectively and thereby improving blood flow. The authors of the CLOTS trial have suggested that severe leg weakness in people with acute stroke may therefore account for the ineffectiveness of stockings in this patient group (CLOTS 2009).
-
Five studies were only published as abstracts, making it difficult to accurately assess their methodology and to extract data (Bolton 1978; Brunkwall 1991; NCT01234064; Perkins 1999; Sultan 2011). Further information provided by the authors of the Sultan 2011 trial showed that not all participants in this trial had been hospitalised, therefore it did not meet our inclusion criteria.
See the Characteristics of excluded studies table for further details.
Studies awaiting classification and ongoing studies
We could not adequately assess the study design for Celebi 2001 as the report was not published in English, therefore we have categorised it as awaiting classification. See the Characteristics of studies awaiting classification table for further details.
We identified three ongoing studies (ChiCTR1800014257; GAPS; IRCT2017080935594N1), of which two trials are scheduled to conclude in 2019 (GAPS; IRCT2017080935594N1), and one trial in late 2020 (ChiCTR1800014257). See Characteristics of ongoing studies table for further details.
Risk of bias in included studies
Details regarding risk of bias are provided in the Characteristics of included studies table and are represented in Figure 2 and Figure 3.
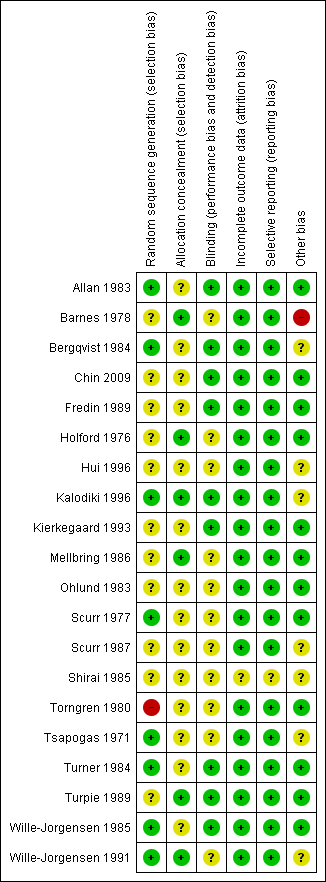
Methodological quality summary: review authors' judgements about each methodological quality item for each included study.

Methodological quality graph: review authors' judgements about each methodological quality item presented as percentages across all included studies.
Allocation
Nine trials described the method of randomisation of participants to treatment and control groups, which was done using:
-
random number tables in six trials (Allan 1983; Bergqvist 1984; Tsapogas 1971; Turner 1984; Wille‐Jorgensen 1985; Wille‐Jorgensen 1991);
-
coin toss in one trial (Scurr 1977);
-
consecutively numbered boxes in one trial (Kalodiki 1996);
-
date of birth in one trial (Torngren 1980), which we deemed to be an inadequate method of randomisation, and so we judged the study to be at high risk of bias.
In Tsapogas 1971, participants were randomised using a random allocation table (low risk of bias). However, there was a discrepancy between the numbers of participants randomised to the treatment and control groups, therefore we deemed this trial to be at unclear risk of bias likely due to unclear allocation concealment.
The method of randomisation was not mentioned in the remaining 11 included trials, so these trials were judged to be at unclear risk of bias (Barnes 1978; Chin 2009; Fredin 1989; Holford 1976; Hui 1996; Kierkegaard 1993; Mellbring 1986; Ohlund 1983; Scurr 1987; Shirai 1985; Turpie 1989). In Hui 1996, participants were randomised in a ratio of 1:1 in the thigh‐length GCS group and 1:4 in the knee‐length GCS group. The control group of the thigh‐length GCS group was also used as the control for the knee‐length GCS group in this trial.
Of note, Chin 2009 was the only included trial published after the publication of the CONSORT statement in 1996 (CONSORT 1996). Despite this, the Chin 2009 trial report did not include a power calculation and did not report the method of randomisation and use of allocation concealment, as advised in the CONSORT statement, suggesting risk of bias.
There was no mention of allocation concealment in 14 of the 20 RCTs judged as at unclear risk of bias. The remaining six studies used sealed envelopes to conceal the allocation of participants to the treatment and control groups and were judged as at low risk of bias (Barnes 1978; Holford 1976; Kalodiki 1996; Mellbring 1986; Turpie 1989; Wille‐Jorgensen 1991).
Blinding
It is inherently difficult to ensure adequate blinding for patients who wear stockings and those who do not. In eight trials, the radiologist reporting the scan results was unaware of whether the participant, or their leg, belonged to the treatment or control group, so these were judged as at low risk of bias (Allan 1983; Bergqvist 1984; Chin 2009; Kalodiki 1996; Turner 1984; Turpie 1989; Wille‐Jorgensen 1985; Wille‐Jorgensen 1991). In two trials the results of the studies were analysed without knowledge of the type of prophylaxis, so these were also judged as at low risk of bias (Fredin 1989; Kierkegaard 1993). We judged the remaining 10 studies as at unclear risk of performance and detection bias (Bergqvist 1984; Holford 1976; Hui 1996; Mellbring 1986; Ohlund 1983; Scurr 1977; Scurr 1987; Shirai 1985; Torngren 1980; Tsapogas 1971).
Incomplete outcome data
In seven trials, results for all included participants were analysed (Barnes 1978; Chin 2009; Kierkegaard 1993; Scurr 1987; Tsapogas 1971; Turner 1984; Turpie 1989). In the remaining trials, participants lost to follow‐up were accounted for, with some participants excluded postrandomisation due to failure to comply with wearing the GCS because they found them uncomfortable. One trial did not report participant attrition during the study period (Shirai 1985), but this report could not be accurately appraised as it was published in Japanese and was therefore found to be at unclear risk of bias. We judged the remainder of the studies as at low risk of bias.
Selective reporting
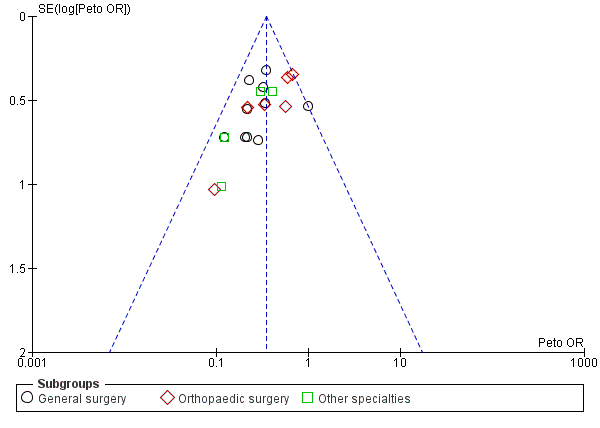
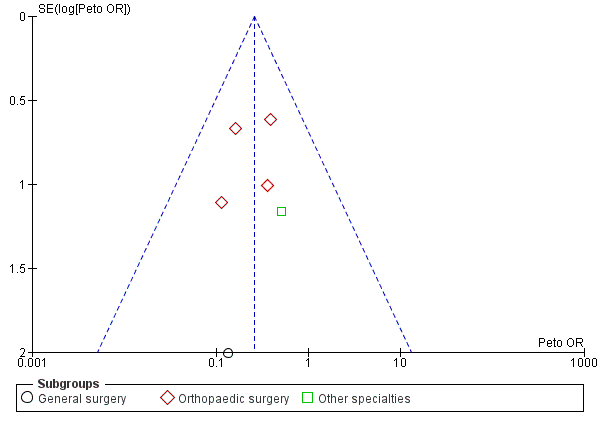
All included studies reported the incidence of DVTs as stated in their aims. Visual inspection of the funnel plot showed that all included trials came within the expected confidence intervals, though there was a suggestion of minimal publication bias (Figure 4). We found one study to be at unclear risk of bias as it was published in Japanese and we were unable to accurately appraise this report (Shirai 1985). The remainder of the studies were judged as at low risk of bias.

Funnel plot of comparison: Incidence of DVT with stockings and without stockings (all specialties).
Other potential sources of bias
None of the trials stratified participants according to DVT risk level. However, our own analysis of the papers indicated that all participants were in either moderate‐ or high‐risk groups.
Six trials obtained funding or support from pharmaceutical companies or manufacturers of GCS, and we were unclear if this could have influenced the studies. These companies included The Kendall Company (Barnes 1978; Scurr 1987; Wille‐Jorgensen 1991), Beiersdorf AB (Bergqvist 1984), Brevet Hospital Products (Hui 1996), and Rhone‐Poulenc Rorer (Kalodiki 1996).
In addition, Barnes 1978 was terminated early as it was deemed unjustifiable to continue after revealing a major incidence of DVT amongst participants who did not wear stockings; we assessed this study as being at high risk of bias.
In one trial (Tsapogas 1971), participants in the treatment group were given an additional recommendation regarding exercise that was not given to the control group. It is possible this influenced the risk of thrombosis, therefore we judged this study as at unclear risk of bias.
One trial was published in Japanese (Shirai 1985), which made it difficult to accurately appraise the study design.
Effects of interventions
See: Summary of findings for the main comparison Graduated compression stockings for prevention of deep vein thrombosis ‐ all patients; Summary of findings 2 Graduated compression stockings for prevention of deep vein thrombosis in surgical patients; Summary of findings 3 Graduated compression stockings for prevention of deep vein thrombosis in medical patients
The results of the review should be interpreted with caution, paying particular attention to the detailed notes in the Description of studies section, as these may have influenced the analysis due to variations within the included trials, for example the use of the opposite limb as the control, differing background prophylactic methods used, and the age difference in some of the trials. However, in the majority of the included trials a statistically significant difference between the treated participants (those that used GCS) and the control group (those that did not use GCS) was demonstrated in the incidence of DVT (primary outcome).
Incidence of DVT
In the 2014 update, we merged trials assessing the effectiveness of GCS as the sole method of prophylaxis together with trials using a background method of thromboprophylaxis for all participants in addition to the use of GCS in the treatment group. This resulted in a total of 2853 analytic units (1681 individual participants and 1172 individual legs) in the meta‐analysis (Analysis 1.1). In the treatment group (GCS), 134 of the 1445 units developed DVT in comparison to 290 of the 1408 units in the control group (no GCS): Peto's odds ratio (OR) of 0.35 (95% confidence interval (Cl) 0.28 to 0.43; 2853 units; 20 studies; P < 0.001; high‐quality evidence). This amounted to a 9% incidence of DVT in the treatment group in comparison to a 21% incidence in the control group.
The I2 statistic for this analysis suggested 10% heterogeneity, with P = 0.33 (Analysis 1.1). This was supported by the corresponding forest plot (Figure 4), using Peto's ORs, which showed that results for all studies were within or on the 95% CI, suggesting minimal publication bias.
Subgroup analysis by specialty
We performed subgroup analysis based upon the specialty under which the participants were managed (Figure 5). There was no significant difference between specialty subgroups regarding the effectiveness of stockings in reducing the incidence of DVT (P = 0.15).

Number of analytic units from each specialty included in the meta‐analysis.
The majority of participants were general surgical patients, accounting for 1486 of 2853 units (52%). Amongst this cohort, the incidence of DVT was 52 of 741 (7%) in the treatment group and 148 of 745 (20%) in the control group (Peto OR 0.30, 95% CI 0.22 to 0.41; 1486 units; 10 studies; high‐quality evidence) (Allan 1983; Bergqvist 1984; Holford 1976; Mellbring 1986; Scurr 1977; Scurr 1987; Torngren 1980; Tsapogas 1971; Wille‐Jorgensen 1985; Wille‐Jorgensen 1991).
Participants undergoing orthopaedic surgery accounted for 598 of 2853 units (21%) (Barnes 1978; Chin 2009; Fredin 1989; Hui 1996; Kalodiki 1996; Ohlund 1983). Amongst participants undergoing orthopaedic surgery, 70 of 314 units (22%) in the treatment group and 97 of 284 units (34%) in the control group developed DVT (Peto OR 0.47, 95% CI 0.32 to 0.68; 598 units; 6 studies; high‐quality evidence) (Analysis 1.1).
The four remaining trials on participants from other specialties provided small sample sizes for each of the specialities (Kierkegaard 1993; Shirai 1985; Turner 1984; Turpie 1989). Combining the results favoured the use of stockings (Peto OR 0.28, 95% CI 0.16 to 0.48; 769 participants; 4 studies; moderate‐quality evidence). Of note, only one trial considered medical patients (Kierkegaard 1993), making it difficult to confidently judge the effect of stockings in these participants (Analysis 1.1).
Subgroup analysis to compare all surgery versus medical did not reveal any differences in DVT incidence (P = 0.15). Combining results from 19 trials focusing on surgical patients, 134 of 1365 units (9.8%) developed DVT in the GCS group compared to 282 of 1328 units (21.2%) in the control group. The Peto OR was 0.35 (95% CI 0.28 to 0.44; P < 0.001; high‐quality evidence), with an overall effect favouring treatment with GCS (Analysis 1.2).
Based on the results from one trial focusing on medical patients admitted following acute myocardial infarction (Kierkegaard 1993), 0 of 80 legs (0%) developed DVT in the GCS group compared to 8 of 80 legs (10%) in the control group. The Peto OR was 0.12 (95% CI 0.03 to 0.51; P = 0.004; low‐quality evidence), with an overall effect favouring treatment with GCS (Analysis 1.2).
Incidence of proximal DVT
Proximal DVTs, which occur in the popliteal, femoral, and iliac veins, are considered to be of greatest clinical significance as they are more likely to embolise to the pulmonary veins and can thereby potentially result in fatal PE. We therefore assessed the incidence of proximal DVT in the two experimental arms of the included trials. Eight trials provided data for the incidence of proximal DVT amongst 1035 included units (Barnes 1978; Bergqvist 1984; Chin 2009; Fredin 1989; Kalodiki 1996; Kierkegaard 1993; Scurr 1987; Turpie 1989). The incidence of proximal DVT was 7 of 517 units (1%) in the treatment group and 28 of 518 units (5%) in the control group (Peto OR 0.26, 95% CI 0.13 to 0.53; 1035 units; 8 studies; P < 0.001; moderate‐quality evidence). There was no significant difference between surgical subgroup specialities regarding the effectiveness of stockings in reducing the incidence of proximal DVT (P = 0.79) (Analysis 2.1).
We carried out subgroup analysis investigating differences between surgical and medical patients. Results from seven included studies evaluating surgical patients showed the incidence of proximal DVT as 7 of 437 units (1.6%) in the GCS group and 28 of 438 units (6.4%) in the control group (Barnes 1978; Bergqvist 1984; Chin 2009; Fredin 1989; Kalodiki 1996; Scurr 1987; Turpie 1989). The Peto OR was 0.26 (95% CI 0.13 to 0.53; 875 units; P < 0.001; moderate‐quality evidence), with an overall effect favouring treatment with GCS. We downgraded the evidence for proximal DVT due to low event rate (imprecision). No events of proximal DVT were recorded in the one study involving medical patients (Analysis 2.2) (Kierkegaard 1993).
Incidence of PE
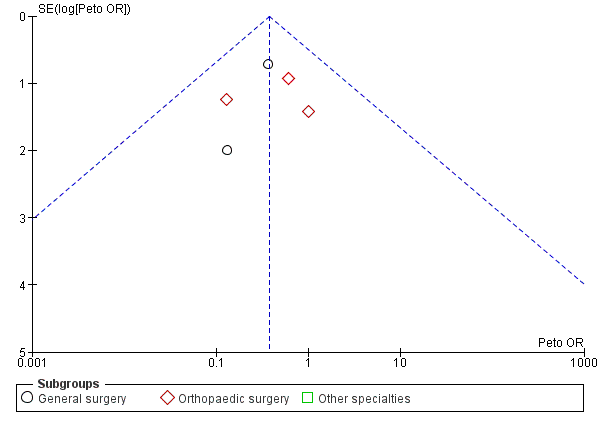
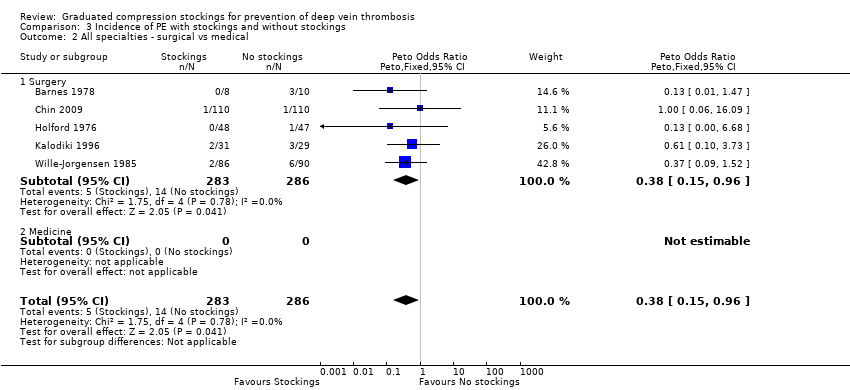
Five trials, all based on surgical patients, provided data for the incidence of PE amongst 569 included participants (Barnes 1978; Chin 2009; Holford 1976; Kalodiki 1996; Wille‐Jorgensen 1985). Routine screening for PE was only conducted in two of these studies using perfusion‐ventilation scintigraphy (Holford 1976; Kalodiki 1996). This method was used to confirm clinically apparent PE in the remaining studies, except in one trial where PE was diagnosed at autopsy (Turpie 1989). The incidence of PE was 5 of 283 participants (2%) in the treatment group and 14 of 286 participants (5%) in the control group (Peto OR 0.38, 95% CI 0.15 to 0.96; 569 participants; 5 studies; P = 0.04; low‐quality evidence). These results should be interpreted with caution in light of the aforementioned limitations in reporting of the incidence of PE in the included trials. (Analysis 3.1).
One further trial reported that one participant was diagnosed with PE at autopsy but did not state to which group this participant belonged (Turpie 1989). However, the cause of death of this participant was found to be cerebral oedema. Two further trials reported a cumulative incidence of three cases of PE but did not specify to which group these participants belonged (Bergqvist 1984; Fredin 1989). Torngren 1980 reported that no participants suffered fatal PE. There was no significant difference between subgroups regarding the effectiveness of stockings in reducing the incidence of PE (P = 0.76). (Analysis 3.1).
Adverse effects and complications from GCS
Seven of 20 trials mentioned the incidence of adverse effects, but none of the trials stated to which groups the participants belonged (Bergqvist 1984; Chin 2009; Fredin 1989; Kalodiki 1996; Kierkegaard 1993; Torngren 1980; Wille‐Jorgensen 1991).
Kierkegaard 1993 reported that some participants experienced postphlebitic changes. Four trials mentioned the incidence of bleeding associated with the background antithrombotic measure used (Bergqvist 1984; Fredin 1989; Kalodiki 1996; Wille‐Jorgensen 1991). Kalodiki 1996 reported no difference in haemorrhagic complications between the treatment and control groups. One trial reported that none of the participants showed any signs of postoperative haemorrhage or side effects (Torngren 1980). Similarly, one further trial reported no adverse events related to the use of GCS (Chin 2009).
Two further trials reported participants' complaints (Hui 1996; Turpie 1989). In one trial, 23% of participants wearing above‐knee stockings and 16% of participants wearing below‐knee stockings found the stockings too uncomfortable and requested their removal (Hui 1996). Ambulant patients in another trial reported disturbance as the stockings fell down easily, which was likely to be due to improper fitting (Turpie 1989).
Discusión
Resumen de los resultados principales
El metanálisis de los 20 ECA incluidos reveló evidencia de calidad alta de que el uso de MCG disminuyó la aparición de TVP en los pacientes hospitalizados (Análisis 1.1).
Ocho ensayos informaron de la incidencia de TVP proximal (Barnes 1978; Bergqvist 1984; Chin 2009; Fredin 1989; Kalodiki 1996; Kierkegaard 1993; Scurr 1987; Turpie 1989) y cinco ensayos informaron de la incidencia de EP (Barnes 1978; Chin 2009; Holford 1976; Kalodiki 1996; Wille‐Jorgensen 1985). Se observó una menor incidencia de TVP proximal (evidencia de calidad moderada) y de EP (evidencia de calidad baja) en los participantes con MCG (Análisis 2.1; Análisis 3.1); sin embargo, la baja tasa de incidencia junto con un tamaño de la muestra relativamente pequeño limita el poder estadístico de estos metanálisis, lo que dificulta estimar con seguridad la efectividad de las MCG para prevenir estos resultados.
Se informaron pocos eventos adversos. En un ensayo, algunos participantes se quitaron las medias antes de lo previsto, supuestamente debido a molestias (Hui 1996). Ningún otro ensayo informó de complicaciones asociadas con el uso de las medias. En un ensayo, algunos participantes presentaron alteraciones posflebíticas (Kierkegaard 1993). Por otro lado, cuatro estudios mencionaron complicaciones hemorrágicas relacionadas con la administración de heparina, dextrán o aspirina; aunque los números fueron demasiado pequeños y no fueron suficientemente uniformes como para emitir una opinión definitiva (Bergqvist 1984; Fredin 1989; Kalodiki 1996; Mellbring 1986; Wille‐Jorgensen 1991).
Compleción y aplicabilidad general de las pruebas
Esta revisión incluyó mayormente a pacientes sometidos a procedimientos quirúrgicos generales y ortopédicos (Figura 5) y, por lo tanto, proporciona evidencia adecuada sobre el uso de MCG en estos grupos de pacientes. Sin embargo, solo un ECA incluyó a pacientes con enfermedades médicas hospitalizados, y ningún ensayo incluyó a participantes considerados de bajo riesgo de desarrollar TVP (Kierkegaard 1993); por lo tanto, no se pueden comentar los beneficios del uso de las MCG en estos grupos de pacientes.
La evidencia disponible se basó principalmente en el uso de medias por encima de la rodilla. Solo Hui 1996 analizó la diferencia entre las MCG hasta el muslo versus sin medias y las MCG hasta la rodilla versus sin medias. En seis ensayos, no se informó de manera explícita sobre el largo de las MCG utilizadas (Allan 1983; Chin 2009; Kierkegaard 1993; Ohlund 1983; Turner 1984; Wille‐Jorgensen 1991). Los números fueron demasiado pequeños para establecer conclusiones en cuanto a la eficacia de la prevención de la TVP, en función de la longitud de las medias utilizadas. No es la competencia de esta revisión, sino que es el tema de otra revisión Cochrane que informó de evidencia insuficiente de calidad alta para determinar si las medias hasta la rodilla y hasta el muslo difieren en efectividad para reducir la incidencia de TVP en los pacientes hospitalizados (Sajid 2012).
La duración del seguimiento sistemático fue de siete a 14 días, o hasta el alta. Un solo estudio realizó el cribado sistemático para la TVP sintomática en el seguimiento de 30 días (Chin 2009). Esto último contrasta con los datos epidemiológicos, que revelan el mayor riesgo de TVP posoperatoria entre cuatro y seis semanas después de la cirugía (Sweetland 2009). El seguimiento sistemático de menor duración en los estudios incluidos no cubre este período de mayor riesgo de TVP y, por lo tanto, no logra estimar con precisión la verdadera magnitud del efecto de las MCG para prevenir la TVP después del alta hospitalaria en la comunidad.
Ninguno de los ECA fue consistente en la descripción ni en la recomendación de la cantidad de tiempo que debían usarse las MCG después de la cirugía; es decir, hasta el alta, hasta la movilización o hasta la siguiente consulta. Este aspecto es importante, porque se sabe a partir de la experiencia clínica que la TVP puede ocurrir incluso en el hogar después del alta, y ha ocurrido una serie de casos de muerte después del alta debidos a TVP y a EP. Además, este dato es respaldado por los resultados del Million Women Study (Sweetland 2009).
Algunas de estas áreas de incertidumbre han sido abordadas en el protocolo publicado de un estudio en curso (GAPS), en que los pacientes quirúrgicos hospitalizados reciben tromboprofilaxis (heparina de bajo peso molecular [HBPM] sola frente a HBPM y MCG), con el resultado primario de incidencia de TVP a los 90 días de seguimiento. En vista del uso creciente de la quimioprofilaxis para la TVP, este ensayo pretende evaluar específicamente el beneficio adicional de las MCG respecto de la HBPM como tromboprofilaxis. Cuando esté disponible, se evaluará el informe final de este estudio para su inclusión en la revisión.
Calidad de la evidencia
Se incluyeron 20 ECA de calidad metodológica adecuada que proporcionaron 2853 unidades analíticas en este metanálisis para determinar la efectividad del uso de MCG en pacientes hospitalizados (Análisis 1.1). Este tamaño de la muestra proporciona evidencia de calidad alta que respalda el uso de MCG para prevenir la TVP en el contexto clínico, especialmente en los pacientes quirúrgicos, ya que la mayoría de los participantes incluidos se sometieron a procedimientos de cirugía general o de cirugía ortopédica (Figura 5). La calidad de la evidencia moderada indica que las MCG pueden prevenir la TVP proximal; se disminuyó la calidad de la evidencia debido a la imprecisión. Se encontró evidencia de calidad baja para las MCG en la prevención de la EP, lo que redujo la calidad, ya que solo dos de los cinco ECA que informaron sobre esta medida de resultado realizaron el cribado sistemático de la EP; además, los resultados fueron inconsistentes. Solo un ensayo incluido tuvo en cuenta a los pacientes hospitalizados con enfermedades médicas, lo que dificulta la formación de un juicio respecto de este subgrupo de pacientes (Kierkegaard 1993).
Además, los pequeños tamaños de la muestra limitaron el análisis de subgrupos según el tipo de procedimiento, la longitud de las medias utilizadas o el tipo de profilaxis de base. No fue posible evaluar con confianza la variación en la efectividad de las MCG en estos parámetros.
Sesgos potenciales en el proceso de revisión
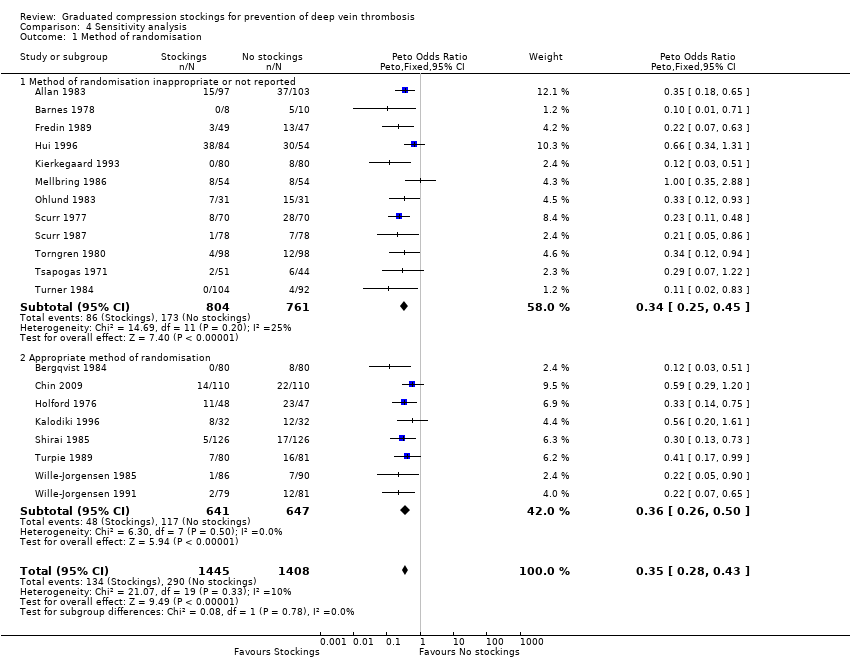
Resulta interesante que todos menos uno de los 20 ensayos incluidos se realizaron antes de que se publicaran las guías CONSORT para el informe de los ECA (CONSORT 1996). Lo que es más importante, 11 de 20 ensayos no informaron lo suficiente o utilizaron un método inadecuado de asignación al azar (consultar el apartado «Riesgo de sesgo de los estudios incluidos»). Por lo tanto, se realizó un análisis de sensibilidad para evaluar el posible riesgo de sesgo asociado, que no encontró diferencias significativas en la efectividad de las medias para reducir la incidencia de TVP entre los ensayos que informaron de un método apropiado de asignación al azar y los que no lo hicieron (p = 0,78; Análisis 4.1).
Siete de los 20 ECA incluidos utilizaron la otra pierna como control (Bergqvist 1984; Kierkegaard 1993; Mellbring 1986; Scurr 1977; Scurr 1987; Shirai 1985; Torngren 1980). Es posible que las MCG utilizadas en una pierna puedan tener un efecto en la otra pierna del mismo paciente (Spiro 1970), aunque no hay evidencia clara de ello. Si esto fuera cierto, podría sesgar los resultados de estos estudios. Ninguno de los estudios incluidos que asignaron al azar las piernas individuales informó del uso de un análisis ajustado o emparejado para abordar el sesgo estadístico debido a la desestimación del emparejamiento. Esto podría hacer que estos estudios tengan muy poca influencia en el metanálisis, debido a que los intervalos de confianza son más amplios y, por lo tanto, es posible que pase desapercibida una heterogeneidad de importancia clínica (Higgins 2011). Sin embargo, el análisis es conservador, ya que los estudios están subponderados en lugar de sobreponderados. A pesar de estas preocupaciones, todos estos ensayos demostraron que las MCG redujeron el riesgo de TVP en comparación con los casos en que no se usaron MCG. Un análisis de sensibilidad realizado para evaluar lo anterior también encontró que las medias fueron efectivas para reducir la incidencia de TVP, independientemente de si la unidad de asignación al azar fueron las piernas individuales o los participantes (Análisis 4.2). En otras palabras, no hubo diferencias en la efectividad de las medias para reducir la incidencia de TVP, independientemente de la unidad de asignación al azar (p = 0,24).
Como parte de una actualización anterior, se fusionaron los ensayos que utilizaron medias como único método de tromboprofilaxis y los que utilizaron medias más otro método de tromboprofilaxis de base, con lo cual se introduce un posible sesgo. Sin embargo, ambos grupos de ensayos demostraron una menor incidencia de TVP, con o sin método de base de tromboprofilaxis (Análisis 4.3), sin una diferencia clara en la magnitud del efecto (p = 0,25). Cabe destacar que los resultados sobre el uso de MCG más un método de tromboprofilaxis de base deben interpretarse con cierta cautela, ya que este grupo de ensayos fue heterogéneo. La profilaxis de base varió entre dextrán 70, heparina, aspirina y compresión secuencial. No se pudo evaluar el grado de influencia de la profilaxis individual de base, ya que una mayor agrupación habría reducido tanto la cantidad de participantes que los datos ya no serían válidos.
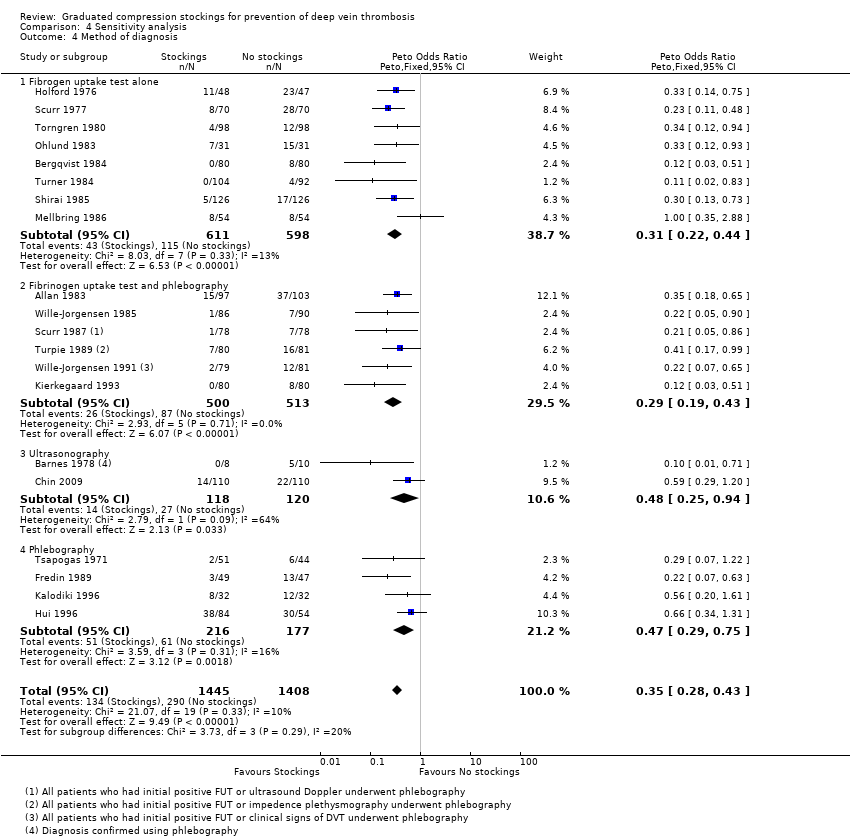
Flordal 1995 y Lensing 1993 anteriormente destacaron la baja eficacia de la prueba de captación de fibrinógeno con I125 radioactivo (FUT) como única modalidad de diagnóstico para la TVP. En esta revisión, ocho de los 20 ensayos incluidos se basaron exclusivamente en la FUT para diagnosticar la TVP. Por lo tanto, se realizó un análisis de sensibilidad para evaluar el posible riesgo de sesgo asociado, mediante la inclusión de estos estudios (Análisis 4.4), y se descubrió que los resultados de los ensayos que utilizaron flebografía para confirmar el diagnóstico de TVP después de una FUT positiva y los que utilizaron otras modalidades para el diagnóstico de TVP (ecografía o flebografía sola) también favorecieron de modo significativo el uso de medias para disminuir el riesgo de TVP. No hubo diferencias significativas en la efectividad de las medias para reducir la incidencia de TVP entre los subgrupos de las modalidades diagnósticas (p = 0,29).
Después de excluir a los pacientes con accidente cerebrovascular, se identificó un solo ECA que incluyó una especialidad médica, con pacientes después de un infarto de miocardio (Kierkegaard 1993). Por lo tanto, fue difícil juzgar con seguridad la efectividad de las MCG para prevenir la TVP en pacientes con enfermedades médicas, y se necesitan otros ensayos en esta cohorte de pacientes.
Cabe señalar que la interpretación visual del gráfico en embudo demostró un riesgo límite de sesgo de publicación en la evaluación de la efectividad de las medias para prevenir la TVP (Figura 4; Análisis 1.1). Sin embargo, no se observó evidencia clara de sesgo de publicación en los metanálisis de la incidencia de TVP proximal y EP (Figura 6; Figura 7).
Acuerdos y desacuerdos con otros estudios o revisiones
Los resultados de esta revisión son similares a los de una evaluación previa de tecnología sanitaria (Roderick 2005), que encontró una reducción del riesgo del 66% con el uso de MCG y una reducción del riesgo del 60% cuando las MCG se utilizaron como base de otro método profiláctico. La variación en el grado de reducción del riesgo informado por dicha revisión, en comparación con los resultados de la presente revisión, puede deberse a que sus análisis se basaron en el número de participantes asignados al azar originalmente en los ensayos incluidos, y que incluyeron a participantes que posteriormente se excluyeron (es decir, un análisis de intención de tratar). Además, varios ensayos incluidos en Roderick 2005 no cumplieron con los criterios de inclusión.
El National Institute for Health and Care Excellence (NICE) publicó una guía para reducir el riesgo de tromboembolia venosa entre los pacientes hospitalizados (NICE 2010). Las recomendaciones son coherentes con el hallazgo de que las MCG son más efectivas que la ausencia de profilaxis. Sin embargo, el NICE recomienda que no se prescriban las MCG a los pacientes ingresados por accidente cerebrovascular; esto se basó principalmente en el ensayo CLOTS 2009, en el que se prescribió aspirina a una gran proporción de pacientes, lo que pudo haber afectado los resultados. También plantea la cuestión de la falta de evidencia sobre el uso de la profilaxis mecánica en pacientes con enfermedades médicas.

Study flow diagram.
Methodological quality summary: review authors' judgements about each methodological quality item for each included study.

Methodological quality graph: review authors' judgements about each methodological quality item presented as percentages across all included studies.
Funnel plot of comparison: Incidence of DVT with stockings and without stockings (all specialties).
Number of analytic units from each specialty included in the meta‐analysis.
Funnel plot of comparison: Incidence of proximal DVT with stockings and without stockings (all specialties).
Funnel plot of comparison: Incidence of PE with stockings and without stockings (all specialties).

Comparison 1 Incidence of DVT with stockings and without stockings, Outcome 1 All specialties.

Comparison 1 Incidence of DVT with stockings and without stockings, Outcome 2 All specialties ‐ surgical vs medical.

Comparison 2 Incidence of proximal DVT with stockings and without stockings, Outcome 1 All specialties.

Comparison 2 Incidence of proximal DVT with stockings and without stockings, Outcome 2 All specialties ‐ surgical vs medical.
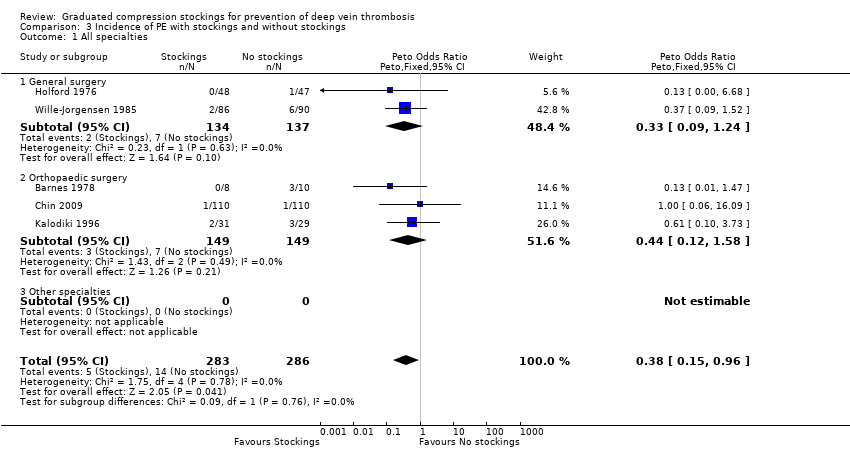
Comparison 3 Incidence of PE with stockings and without stockings, Outcome 1 All specialties.
Comparison 3 Incidence of PE with stockings and without stockings, Outcome 2 All specialties ‐ surgical vs medical.
Comparison 4 Sensitivity analysis, Outcome 1 Method of randomisation.

Comparison 4 Sensitivity analysis, Outcome 2 Unit of analysis for randomisation.

Comparison 4 Sensitivity analysis, Outcome 3 Use of background method of thromboprophylaxis.
Comparison 4 Sensitivity analysis, Outcome 4 Method of diagnosis.
| Graduated compression stockings for prevention of deep vein thrombosis | ||||||
| Patient or population: Hospitalised patients1 | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of units/ participants2 | Quality of the evidence | Comments | |
| Risk with no GCS | Risk with GCS | |||||
| Deep vein thrombosis (DVT) Follow‐up: 7 to 14 days, or until discharge | Study population | OR 0.35 | 2853 | ⊕⊕⊕⊕ | Graduated compression stockings reduce the incidence of DVT in hospitalised patients. However, studies did not routinely distinguish between symptomatic and asymptomatic DVTs. | |
| 206 per 1000 | 83 per 1000 | |||||
| Proximal DVT Follow‐up: 7 to 14 days, or until discharge | Study population | OR 0.26 | 1035 | ⊕⊕⊕⊝ | Graduated compression stockings probably reduce the incidence of proximal DVT in hospitalised patients. There was a relatively low event rate overall, and studies did not routinely distinguish between symptomatic and asymptomatic proximal DVTs. | |
| 54 per 1000 | 15 per 1000 | |||||
| Pulmonary embolism Follow‐up: 7 to 30 days | Study population | OR 0.38 | 569 | ⊕⊕⊝⊝ | Graduated compression stockings may slightly reduce the incidence of pulmonary embolism in hospitalised patients. Pulmonary embolism was not routinely assessed in most included studies, and the overall event rate was very low. | |
| 49 per 1000 | 19 per 1000 | |||||
| Adverse effects and complications Follow‐up: until discharge | See comment | ‐ | ‐ | ‐ | Some participants removed stockings due to discomfort or poor fitting, however adverse effects and complications were not routinely reported quantitatively in the included studies. | |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Included patients admitted for surgical procedures (including abdominal, orthopaedic, neurosurgical, gynaecological surgery) and medical illness (acute myocardial infarction). | ||||||
| Graduated compression stockings for prevention of deep vein thrombosis | ||||||
| Patient or population: Patients hospitalised for surgical procedures1 | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of units/ participants2 | Quality of the evidence | Comments | |
| Risk with no GCS | Risk with GCS | |||||
| Deep vein thrombosis (DVT) Follow‐up: 7 to 14 days, or until discharge | Study population | OR 0.35 (0.28 to 0.44) | 2693 (19 RCTs) | ⊕⊕⊕⊕ | Graduated compression stockings reduce the incidence of DVT in hospitalised surgical patients. However, studies did not routinely distinguish between symptomatic and asymptomatic DVTs. | |
| 212 per 1000 | 86 per 1000 | |||||
| Proximal DVT Follow‐up: 7 to 14 days, or until discharge | Study population | OR 0.26 (0.13 to 0.53) | 875 (7 RCTs) | ⊕⊕⊕⊝ | Graduated compression stockings probably reduce the incidence of proximal DVT in hospitalised surgical patients. However, studies did not routinely distinguish between symptomatic and asymptomatic proximal DVTs. There was a relatively low event rate overall. | |
| 64 per 1000 | 17 per 1000 | |||||
| Pulmonary embolism Follow‐up: 7 to 30 days, or until discharge | Study population | OR 0.38 (0.15 to 0.96) | 569 (5 RCTs) | ⊕⊕⊝⊝ | Graduated compression stockings may slightly reduce the incidence of pulmonary embolism in hospitalised surgical patients. However, pulmonary embolism was not routinely assessed in most included studies, and the overall event rate was very low. | |
| 49 per 1000 | 19 per 1000 | |||||
| Adverse effects and complications Follow‐up: until discharge | See comment | ‐ | ‐ | ‐ | Some participants removed stockings due to discomfort or poor fitting, however adverse effects and complications associated with wearing GCS were not routinely reported quantitatively in the included studies. | |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Included patients admitted for surgical procedures (including abdominal, orthopaedic, neurosurgical, gynaecological surgery). | ||||||
| Graduated compression stockings for prevention of deep vein thrombosis | ||||||
| Patient or population: Patients hospitalised following acute myocardial infarction | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of units | Quality of the evidence | Comments | |
| Risk with no GCS | Risk with GCS | |||||
| Deep vein thrombosis (DVT) Follow‐up: 8 days or discharge or until development of DVT | Study population | OR 0.12 (0.03 to 0.51) | 160 | ⊕⊕⊝⊝ | Graduated compression stockings may reduce incidence of DVT in hospitalised medical patients. However, results are based on a single study on medical patients hospitalised following acute myocardial infarction (Kierkegaard 1993). | |
| 100 per 1000 | 13 per 1000 | |||||
| Proximal DVT Follow‐up: 8 days or discharge or until development of DVT | Study population | Not estimable | 160 (1 RCT) | ‐ | None of the participants in either group of this single RCT with a small sample size developed proximal DVT. | |
| 0 per 1000 | 0 per 1000 (0 to 0) | |||||
| Pulmonary embolism | See comment | ‐ | ‐ | ‐ | No studies reported on this outcome. There is paucity of evidence to evaluate the effect of GCS on reducing incidence of pulmonary embolism in hospitalised medical patients. | |
| Adverse effects and complications | See comment | ‐ | 160 (1 RCT) | ‐ | There are rare reports of post‐thrombotic changes in participants who developed DVT in the single included RCT. | |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1We downgraded the quality of the evidence by two steps as there was only one study and a low event rate in the GCS group (imprecision). | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All specialties Show forest plot | 20 | 2853 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.35 [0.28, 0.43] |
| 1.1 General surgery | 10 | 1486 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.30 [0.22, 0.41] |
| 1.2 Orthopaedic surgery | 6 | 598 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.47 [0.32, 0.68] |
| 1.3 Other specialties | 4 | 769 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.28 [0.16, 0.48] |
| 2 All specialties ‐ surgical vs medical Show forest plot | 20 | 2853 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.35 [0.28, 0.43] |
| 2.1 Surgery | 19 | 2693 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.35 [0.28, 0.44] |
| 2.2 Medicine | 1 | 160 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.12 [0.03, 0.51] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All specialties Show forest plot | 8 | 1035 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.26 [0.13, 0.53] |
| 1.1 General surgery | 2 | 316 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.14 [0.00, 6.82] |
| 1.2 Orthopaedic surgery | 4 | 398 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.25 [0.12, 0.53] |
| 1.3 Other specialties | 2 | 321 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.52 [0.05, 5.03] |
| 2 All specialties ‐ surgical vs medical Show forest plot | 8 | 1035 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.26 [0.13, 0.53] |
| 2.1 Surgery | 7 | 875 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.26 [0.13, 0.53] |
| 2.2 Medicine | 1 | 160 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All specialties Show forest plot | 5 | 569 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.38 [0.15, 0.96] |
| 1.1 General surgery | 2 | 271 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.33 [0.09, 1.24] |
| 1.2 Orthopaedic surgery | 3 | 298 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.44 [0.12, 1.58] |
| 1.3 Other specialties | 0 | 0 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 2 All specialties ‐ surgical vs medical Show forest plot | 5 | 569 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.38 [0.15, 0.96] |
| 2.1 Surgery | 5 | 569 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.38 [0.15, 0.96] |
| 2.2 Medicine | 0 | 0 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Method of randomisation Show forest plot | 20 | 2853 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.35 [0.28, 0.43] |
| 1.1 Method of randomisation inappropriate or not reported | 12 | 1565 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.34 [0.25, 0.45] |
| 1.2 Appropriate method of randomisation | 8 | 1288 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.36 [0.26, 0.50] |
| 2 Unit of analysis for randomisation Show forest plot | 20 | 2853 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.35 [0.28, 0.43] |
| 2.1 Individual participants | 13 | 1681 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.38 [0.29, 0.49] |
| 2.2 Individual legs | 7 | 1172 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.28 [0.19, 0.42] |
| 3 Use of background method of thromboprophylaxis Show forest plot | 20 | 2853 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.35 [0.28, 0.43] |
| 3.1 Trials without background thromboprophylaxis | 9 | 1497 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.38 [0.29, 0.50] |
| 3.2 Trials with background thromboprophylaxis | 11 | 1356 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.29 [0.20, 0.42] |
| 4 Method of diagnosis Show forest plot | 20 | 2853 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.35 [0.28, 0.43] |
| 4.1 Fibrogen uptake test alone | 8 | 1209 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.31 [0.22, 0.44] |
| 4.2 Fibrinogen uptake test and phlebography | 6 | 1013 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.29 [0.19, 0.43] |
| 4.3 Ultrasonography | 2 | 238 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.48 [0.25, 0.94] |
| 4.4 Phlebography | 4 | 393 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 0.47 [0.29, 0.75] |

