Ácido hialurónico y otras opciones terapéuticas conservadoras para la osteoartritis del tobillo
Resumen
Antecedentes
La causa de la osteoartritis del tobillo (OA) es generalmente el traumatismo. Los pacientes son relativamente jóvenes, ya que el traumatismo del tobillo ocurre a una edad relativamente temprana. Varias opciones de tratamiento conservador están disponibles, pero faltan pruebas acerca de los efectos beneficiosos y perjudiciales de estas opciones.
Objetivos
Evaluar los efectos beneficiosos y perjudiciales de cualquier tratamiento conservador para la OA del tobillo en adultos para proporcionar una síntesis de las pruebas como base para futuras guías de tratamiento.
Métodos de búsqueda
Se hicieron búsquedas en el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL 2014, número 9), MEDLINE (Ovid) (1946 hasta el 11 septiembre 2014), EMBASE (1947 hasta septiembre 2014), PsycINFO (1806 hasta septiembre 2014), CINAHL (1985 hasta septiembre 2014), PEDro (todos los años hasta septiembre 2014), AMED hasta septiembre 2014, ClinicalTrials.gov, Current Controlled Trials y en The Dutch Register. Para identificar los estudios potencialmente relevantes, se examinaron las listas de referencias de artículos y ensayos de revisión recuperados.
Criterios de selección
Se consideraron para inclusión los ensayos clínicos aleatorios o controlados que investigaran cualquier intervención no quirúrgica para la OA del tobillo.
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar previstos por la Colaboración Cochrane.
Resultados principales
No se identificaron otros ECA de otros tratamientos conservadores, excepto la administración de ácido hialurónico (AH) para la OA del tobillo. Se incluyeron seis ensayos controlados aleatorios (ECA).
En esta revisión se incluyeron 240 participantes con diagnóstico de OA del tobillo. El análisis primario incluyó tres ECA (109 participantes) que compararon AH con placebo. Un estudio comparó AH con tratamiento con ejercicios, otro comparó AH combinado con tratamiento con ejercicios con una inyección intraarticular de toxina botulínica y otro comparó cuatro dosis diferentes de AH.
Análisis primario: un análisis agrupado de dos ensayos (45 participantes) encontró que la puntuación total en la Ankle Osteoarthritis Scale (AOS) (que mide el dolor y la función física) tuvo una reducción del 12% (IC del 95%: ‐24% al ‐1%) a los seis meses (diferencia de medias [DM] ‐12,53 [IC del 95%: ‐23,84 al ‐1,22] en una escala de 0 a 100; número necesario a tratar para un resultado beneficioso adicional [NNTB] = 4 [IC del 95%: 2 a 205]); estas pruebas se calificaron de calidad baja debido a las limitaciones en el diseño del estudio (riesgo incierto de sesgo de selección en dos estudios y riesgo incierto de sesgo de desgaste en un estudio) y la imprecisión de los resultados: un tamaño pequeño de la población (45 participantes). Se desconoce si una diferencia de medias de 12,53 puntos en una escala de 100 puntos es clínicamente relevante. Se desconoce la diferencia mínima clínicamente importante para esta puntuación. Los resultados dolor y función no se informaron por separado. No se investigaron los cambios radiográficos en la estructura de la articulación. No fue posible realizar un metanálisis para la media de la calidad de vida a los seis meses (dos ensayos; 45 participantes) debido a los datos faltantes. No se observaron eventos adversos graves (EAG) y ningún participante se retiró debido a un evento adverso. Hubo pocos eventos adversos (EA), 5/63 (8%) en el grupo de AH y 2/46 (4%) en el grupo placebo. La probabilidad relativa de Peto (odds ratio [OR] de Peto) de presentar un evento adverso fue 2,34 mayor en comparación con el grupo control (IC del 95%: 0,45 a 12,11). Estas pruebas no son concluyentes debido a un IC amplio y un número pequeño de eventos.
Para la comparación de AH con tratamiento con ejercicios (30 participantes), los resultados de dolor en una escala analógica visual (EAV 0 a 10) a los 12 meses no son concluyentes (DM 0,70; IC del 95%: ‐2,54 a 1,14). La puntuación de la American Orthopedic Foot and Ankle Society (puntuación AOFAS) fue 13,10 puntos (DM) mayor a favor del AH (IC del 95%: 2,97 a 23,23) en una escala de 0 a 100. Las pruebas se calificaron de baja calidad. No se encontraron eventos adversos. No se midieron los cambios radiográficos en la estructura; no se retiraron participantes debido a EA; no se encontraron EAG.
Para la comparación de la inyección de AH combinada con tratamiento con ejercicios con una inyección intraarticular de toxina botulínica A (BoNT‐A) (75 participantes), el resultado de la puntuación de dolor en la AOS de la articulación afectada a los seis meses no es concluyente (DM 0,10; IC del 95%: ‐0,42 a 0,62). La función física (puntuación de discapacidad en la AOS) a los seis meses no es concluyente (DM 0,20; IC del 95% −0,34 a 0,74). Se encontró el mismo número de EA en ambos grupos; AH 2/37 (5,9%), BoNT‐A 2/38 (5,8%) (cociente de riesgos [CR] 1,03; IC del 95%: 0,15 a 6,91). No se examinaron los cambios radiográficos, no se encontraron EAG y ningún participante se retiró debido a EA. Las pruebas se calificaron de baja calidad.
El ECA que comparó cuatro esquemas diferentes de dosis para el AH (26 participantes) mostró la mejor disminución mediana en el dolor al caminar en una EAV (en una escala de 0 a 100) para 3 x 1 ml a las 27 semanas, con una disminución mediana de 30. No se midieron la función física, los cambios radiográficos y la calidad de vida. El 27% de todos los participantes tuvieron EA, la mayoría de ellos en el grupo de 2 ml (57% en este grupo). Ningún participante se retiró debido a EA y no se observaron EAG.
En general la calidad de las pruebas mostró algunas limitaciones graves. Las pruebas se calificaron como bajas para el análisis primario que comparó AH con placebo. Lo anterior se basó en una limitación en el diseño y la implementación: los tamaños de la muestra fueron pequeños (45 a 92 participantes) y hubo imprecisión en los resultados: hubo riesgo incierto de sesgo en varios ítems en cuanto a los tres estudios utilizados en el metanálisis.
Conclusiones de los autores
Actualmente no hay datos suficientes para crear una síntesis de las pruebas como base para las guías futuras para la OA del tobillo. Debido a que la etiología de la OA del tobillo es diferente, las guías que actualmente se utilizan para la OA de la cadera y la rodilla pueden no ser aplicables a la OA del tobillo. Sin embargo, los analgésicos simples, como se recomienda para la OA de la cadera y la rodilla, parecen un primer paso razonable para tratar la OA del tobillo. Debido a la baja calidad de las pruebas, no está claro si hay un efecto beneficioso o perjudicial del AH como tratamiento para la OA del tobillo en comparación con placebo a los seis meses. A partir de la comparación de AH con otros tratamientos se encontraron resultados no concluyentes. El AH se puede recomendar de forma condicional si los pacientes tienen una respuesta insuficiente a los analgésicos simples. Todavía no está claro qué pacientes (edad, grado de OA del tobillo) se benefician más de las inyecciones de AH y qué esquema de dosis se debe utilizar.
PICOs
Resumen en términos sencillos
Ácido hialurónico y otras opciones de tratamiento no quirúrgicas para la osteoartritis del tobillo
Los investigadores Cochrane realizaron una revisión del efecto del tratamiento no quirúrgico en los pacientes mayores de 18 años con osteoartritis del tobillo para proporcionar una síntesis de las pruebas como base para las futuras guías de tratamiento. Después de buscar todos los estudios relevantes hasta septiembre de 2014 no se identificaron estudios que utilizaran otro tratamiento no quirúrgico, excepto la administración de ácido hialurónico para la osteoartritis del tobillo. Se encontraron seis estudios que evaluaron el ácido hialurónico en 240 pacientes. A continuación se resumen los resultados:
Cinco estudios mostraron los resultados de la administración de ácido hialurónico para la osteoartritis del tobillo en comparación con otro tratamiento (ejercicio [30 pacientes]) o inyecciones de toxina botulínica A (75 pacientes) o placebo (inyección falsa) (tres estudios, 109 pacientes). Uno fue un estudio de búsqueda de dosis (26 pacientes). El seguimiento fue de tres a seis meses. La calidad de las pruebas se calificó como baja debido a un riesgo incierto de sesgo y al escaso número de participantes.
En pacientes con osteoartritis del tobillo:
‐ No se identificaron estudios que apoyaran la administración de otro tratamiento no quirúrgico.
‐ No hay certeza de que el ácido hialurónico tenga efectos beneficiosos para el tratamiento de la osteoartritis del tobillo en comparación con placebo.
‐ Los resultados que comparan el ácido hialurónico con otro tratamiento no son concluyentes.
‐ Los resultados acerca del mejor esquema de dosis para el ácido hialurónico no son concluyentes.
‐ Los efectos secundarios posibles del ácido hialurónico podrían incluir tumefacción y dolor de la articulación que cede en un par de días.
‐ Las inyecciones de ácido hialurónico se podrían recomendar de forma condicional cuando han fracasado los analgésicos simples.
¿Qué es la osteoartritis, qué es el ácido hialurónico y qué otras opciones de tratamiento no quirúrgicas existen?
La osteoartritis (OA) es una enfermedad de las articulaciones. Cuando la articulación pierde el cartílago, se produce el crecimiento del hueso para tratar de reparar el daño. Sin embargo, en vez de mejorar la situación, el hueso crece anormalmente y la empeora. Por ejemplo, el hueso puede deformarse y hacer que la articulación se vuelva dolorosa e inestable. Lo anterior puede afectar la función o la capacidad física para utilizar el tobillo.
El ácido hialurónico es un componente natural del líquido sinovial. Las inyecciones de ácido hialurónico (también llamadas "viscosuplementación") son inyecciones de un líquido similar a un gel que ayuda a lubricar la articulación y actúa como un amortiguador para las cargas de la articulación. Estas inyecciones se utilizan en un ambiente hospitalario cuando los analgésicos simples han fracasado.
Otras opciones no quirúrgicas para la OA del tobillo son, por ejemplo, la administración de diferentes tipos de analgésicos y el uso de tratamiento no farmacológico como modificaciones al calzado, férulas, pérdida de peso y ejercicios o una combinación de cualquiera de éstos.
¿Qué les sucede a los pacientes con osteoartritis del tobillo que reciben inyecciones de ácido hialurónico en comparación con placebo?
Después de seis meses (45 pacientes) se midieron el dolor y la función física mediante una puntuación combinada (escala de 0 a 100; 0 es la mejor puntuación y 100 la peor):
‐ los pacientes que recibieron inyecciones de ácido hialurónico calificaron el dolor y la función física como 12,3 puntos menor en comparación con placebo (mejoría absoluta del 12%).
‐ los pacientes que recibieron inyecciones de ácido hialurónico calificaron el dolor y la función como 24,4 puntos menor.
‐ los pacientes que recibieron inyecciones de placebo calificaron el dolor y la función física 12,1 puntos menor.
Cambios radiográficos en la estructura de la articulación:
‐ No se encontraron estudios que consideraran este resultado.
Calidad de vida:
‐ No hubo datos disponibles para establecer una conclusión acerca de la calidad de vida.
Número de pacientes que presentaron algún evento adverso grave (109 pacientes):
‐ En ningún grupo los pacientes presentaron eventos adversos graves.
Número de pacientes que presentaron algún evento adverso (109 pacientes):
‐ 35 pacientes más por 1000 tratados con ácido hialurónico presentarán un evento adverso en comparación con placebo (aumento absoluto del 3,5%).
‐ 78 pacientes por 1000 tratados con ácido hialurónico presentarán un evento adverso.
‐ 43 pacientes por 1000 tratados con placebo presentarán un evento adverso.
Pacientes que se retiran debido a un evento adverso (109 pacientes):
‐ Ningún participante se retiró en ninguno de los grupos.
Conclusiones de los autores
Summary of findings
| Hyaluronic acid for osteoarthritis of the ankle | ||||||
| Patient or population: patients with osteoarthritis of the ankle | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Placebo | Hyaluronic acid | |||||
| AOS total (Pain & Physical function) | The mean pain/physical function change ranged across the control groups from 6.8 to 20.9 points lower with a weighted mean of | The mean pain/physical function in the hyaluronic acid group was 12.53 points lower (23.84 lower to 1.22 lower) compared to placebo at 6 months. | 45 | ⊕⊕⊝⊝ | A lower score indicates less pain and a better physical function. It is not known if a change of 12 points is clinically relevant. NNT = 4 (95% CI 2 to 205) (using a SMD = 0.5 as a minimum important difference). Absolute risk difference is −12.53% (95% CI −23.84 to −1.22). Relative percentage change is 1.85% (95% CI 0.18 to 3.58%). | |
| Radiographic Joint Structure Changes | See comment | See comment | Not estimable | 0 | See comment | Radiographic joint structure changes were not investigated. |
| Quality of Life SF12. Scale from: 0 to 100. Follow‐up: mean 6 months. | See comment | See Comment | Not estimable | 45 (2 studies) | See comment | Cohen 2008 only described that there was no significant difference between placebo and intervention for the SF12 outcome, no exact data was provided. Salk 2006 could not provide us with the standard deviations, so no estimate of the SF12 could be made. He demonstrated a statistically significant difference in his paper favouring hyaluronic acid at 6 months. |
| Number of participants experiencing any serious adverse events | See comment | See comment | Not estimable | 109 | See comment | No serious adverse events (SAEs) were noted |
| Number of participants experiencing any adverse event | 43 per 1000 | 35 per 1000 | RR 1.66 | 109 | ⊕⊕⊝⊝ | Peto Odds Ratio is 2.34 (95% CI 0.45 to 12.11) Absolute risk difference is 5.00% (−5 to 14), relative percentage change is 66% (−53% to 488%). Adverse events for all 3 studies were reported, even though DeGroot had a follow up of 3 months. All adverse events resolved within a week after injection, so a shorter follow up has no effect on the estimate of effect. |
| Participants who withdraw because of an adverse event or any other reason | See comment | See comment | Not estimable | 109 | See comment | No participants withdrew because of an adverse event |
| AOS: Ankle Osteoarthritis ScaleCI: Confidence interval; RR: Risk ratio; OR: Odds ratio; SF12: short form 12 | ||||||
| GRADE Working Group grades of evidence Grade criteria: study limitation, indirectness, inconsistency, imprecision, publication bias. | ||||||
| * The assumed risk was based on the weighted mean of the scores in the control groups across the 2 studies. The range was based on the mean change in pain on a visual analogue scale (100 mm) of the control group in each separate study.The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). 1 Evidence was downgraded based on limitations in study design and imprecision of results. Limitation in study design: there was a unclear risk of selection bias for Salk and Cohen, unclear risk for attrition bias for Salk. Imprecision of results: the population size is small (45 participants). No indirectness of evidence was found, no inconsistency and no publication bias. 2 Evidence was downgraded based on limitations in study design and imprecision of results. Limitation in study design: there was a unclear risk of selection bias for Cohen, an unclear risk for reporting bias for DeGroot. Imprecision of results: the total population size is small (92 participants). No indirectness of evidence was found, no inconsistency and no publication bias. | ||||||
Antecedentes
Descripción de la afección
La osteoartritis (OA) es un trastorno crónico y degenerativo asociado con dolor y pérdida de la función de la articulación. La OA puede afectar cualquier articulación sinovial pero ocurre con mayor frecuencia en la cadera, la rodilla y la mano; la mayoría de estos pacientes se presenta con OA primaria (enfermedad idiopática) (Buckwalter 2004; Kalunian 2012; Witteveen 2008). No hay cifras confiables y fácilmente disponibles sobre la prevalencia de la OA en otras articulaciones, pero los cálculos indican que la incidencia de OA sintomática del tobillo es del 1% al 4% en la población adulta (Cushnaghan 1991; Peyron 1984). A diferencia de la OA de la rodilla y la cadera, del 70% al 78% de los pacientes con OA del tobillo se presentan con enfermedad postraumática secundaria (secuelas después de fractura del tobillo, inestabilidad del tobillo o fractura de la pierna); en el resto se trata de OA primaria, así como de enfermedades inflamatorias como la artritis reumatoide y la gota (Saltzman 2005; Valderrabano 2009). El traumatismo del tobillo ocurre en muchos pacientes a una edad relativamente temprana (Agel 2005; Saltzman 2005). Por lo tanto, la esperanza de vida de la mayoría de los pacientes con OA del tobillo es significativamente más larga que la de los pacientes con OA de la cadera o la rodilla, lo que afecta la calidad de vida por un período de tiempo significativo. Saltzman 2006 demostró que la función física autoinformada en los pacientes con OA sintomática del tobillo cuantificada mediante el cuestionario Short Form‐36 (SF‐36) fue equivalente o peor que la de los pacientes con enfermedad renal terminal o insuficiencia cardíaca congestiva, lo que indica que estos pacientes tienen un deterioro grave.
Descripción de la intervención
En la práctica clínica, a los pacientes con diagnóstico de OA terminal del tobillo (Kellgren Lawrence 3 ó 4 y van Dijk 3) se les ofrece tratamiento quirúrgico si presentan síntomas clínicos significativos (Harada 2011; van Dijk 1997). Estos pacientes son tratadas mediante artrodesia, reemplazo de tobillo u osteotomía. El tratamiento quirúrgico se reserva específicamente para la artritis terminal. Esta decisión se considera polémica debido a las complicaciones a corto y a largo plazo. Las complicaciones consisten en problemas con la cicatrización de la herida, enfermedad infecciosa, consolidación viciosa o retardada y OA de las articulaciones adyacentes debido a sobrecarga (Chang 2013; Deorio 2008; Jung 2007; Krause 2012; Rippstein 2012; Suckel 2012). Las tasas de complicación varían hasta el 44% según el tipo de cirugía; y el tipo de complicación a corto o a largo plazo. La OA de las articulaciones adyacentes después de la artrodesia del tobillo ocurre, por ejemplo, en el 44% al 50% de los casos después de 20 años(Morrey 1980; Pagenstert 2008; Takakura 1995). Por lo tanto, el tratamiento quirúrgico no se considera en una fase temprana de la OA y aún es un desafío el tratamiento de los pacientes con diagnóstico de OA del tobillo de grado bajo (Kellgren Lawrence 1, 2, ó 3 y van Dijk 1 ó 2) (Harada 2011; van Dijk 1997). Los pacientes son jóvenes y presentan discapacidades graves que les impiden participar en el trabajo físico muy pesado, así como en las actividades deportivas. Están disponibles varias opciones de tratamiento conservador; sin embargo faltan pruebas con respecto a los efectos beneficiosos y perjudiciales de estas opciones.
El tratamiento conservador de la OA sintomática del tobillo, como de la OA general, consiste principalmente en tratamiento de los síntomas como el dolor y la rigidez. Debido a que en este momento no hay una cura disponible, otro objetivo del tratamiento es prevenir el deterioro de la articulación (Towheed 2006). El tratamiento no farmacológico se considera el fundamento del tratamiento médico exitoso de la OA general (Hochberg 2012; Zhang 2008; Zhang 2010). Hay revisiones sistemáticas publicadas de la OA de la rodilla y la cadera, e incluyen reducción del peso (IMC > 25), fisioterapia y terapia ocupacional (Brosseau 2011; Brouwer 2005; Rutjes 2009; Rutjes 2010). Para la OA del tobillo, el alivio de la carga de la articulación mediante una férula, bastón, una suela en mecedora y soportes se utilizan habitualmente en la práctica clínica para aliviar el dolor; sin embargo, no existen pruebas para apoyar este tratamiento (Bartels 2007; Brosseau 2003; Fransen 2009; Janisse 1998; Kempson 1991; Messier 2005; McGuire 2003; Wu 2004). Si este tratamiento no farmacológico no es exitoso se puede agregar un analgésico. Están disponibles varias opciones para el alivio del dolor, p.ej. analgésicos como el paracetamol, opiáceos y fármacos antiinflamatorios no esteroideos (AINE) (Cepeda 2006; Garner 2005; Nuesch 2010; Towheed 2006). Se ha mostrado que el ácido hialurónico (AH) también alivia el dolor en la OA del tobillo. Actualmente el AH se utiliza en la práctica clínica cuando los analgésicos simples han fracasado (Chang 2013; Cohen 2008; Pleimann 2002; Salk 2006; Sun 2006; Witteveen 2008; Witteveen 2010). No se ha mostrado el efecto beneficioso de glucosamina / condroitina para la reducción del dolor en la OA general (Towheed 2005).
De qué manera podría funcionar la intervención
El dolor debido a OA del tobillo podría disminuir al aliviar la carga de la articulación mediante el reposo, mediante una férula o mediante un bastón. El bastón puede reducir la cantidad de peso corporal que descansa en la articulación del tobillo en el 25% (Kempson 1991). Se piensa que las suelas en mecedora alivian la carga de la articulación del tobillo al reducir el movimiento del tobillo cuando el talón golpea para el impulso durante la marcha (Wu 2004). Se considera que la pérdida de peso mediante ajustes dietéticos o ejercicios también alivia la carga de la articulación (Bartels 2007; Brosseau 2003; Fransen 2009). En Messier 2005, cada libra de peso perdida dio lugar a una reducción de cuatro veces la carga a la rodilla ejercida por el paso durante las actividades cotidianas. La modificación del calzado como los soportes puede corregir los problemas de alineación y aliviar así la carga a una parte de la articulación, por lo que da lugar a la reducción del dolor (Janisse 1998; McGuire 2003). Es posible que con estas intervenciones la articulación se pueda proteger del deterioro adicional. Hay varios analgésicos disponibles como el paracetamol, los opiáceos y los AINE. Actúan como un analgésico simple, tienen efectos antiinflamatorios, un efecto sedante o una combinación de los anteriores. Las recomendaciones para la OA de la cadera, la rodilla o la mano están bien descritas(Hochberg 2012). Se piensa que el ácido hialurónico (viscosuplementación) restaura las propiedades reológicas de la articulación mediante la creación de un líquido sinovial más viscoelástico, lo que mejora la movilidad y restaura la función protectora natural de la articulación, como la absorción de los golpes durante la marcha (Balazs 1993; Bellamy 2006). Varios estudios han indicado también una reducción del dolor (Chang 2013; Cohen 2008; Pleimann 2002; Salk 2006; Sun 2006; Witteveen 2008; Witteveen 2010). La glucosamina / condroitina puede ser potencialmente condroprotectora y puede modificar la progresión y el curso de la OA en general, aunque la mejoría en el dolor y la función no son concluyentes(Singh 2015; Towheed 2005).
Por qué es importante realizar esta revisión
Se ofrecen muchas formas de tratamiento, pero no existe un algoritmo de tratamiento específico para la OA del tobillo para su uso en la práctica clínica. La elección del tratamiento depende de la gravedad de la enfermedad; edad, antecedentes médicos y sociales del paciente; y nivel de actividad física que se espera se exija de la articulación. Para la OA de la rodilla y la cadera se preconizan varios algoritmos de tratamiento (Kalunian 2012; Pendleton 2000; Tannenbaum 2000 Towheed 2005; Towheed 2006; Zhang 2008; Zhang 2010). Sin embargo, como la OA del tobillo puede ser causada por un mecanismo diferente, es razonable pensar que estos pacientes necesitan un tratamiento diferente.
Hasta el momento no hay un algoritmo de tratamiento basado en pruebas para la OA del tobillo. Se han publicado varios documentos relacionados con la causa de la OA del tobillo y las posibles estrategias de tratamiento conservadoras y quirúrgicas. La sección conservadora resume principalmente las posibilidades, pero no se ha indicado un algoritmo (Demetriades 1998; Katcherian 1998; Martin 2007; Rao 2010; Thomas 2003). Esta revisión se realizó para encontrar pruebas de los efectos beneficiosos y perjudiciales del tratamiento no farmacológico y farmacológico de la OA del tobillo en general o según el estadio de la enfermedad. Se intentó proporcionar una síntesis de las pruebas como una base para las guías de tratamiento futuras.
Objetivos
Evaluar los efectos beneficiosos y perjudiciales de cualquier tratamiento conservador para la OA del tobillo en adultos para proporcionar una síntesis de las pruebas como base para futuras guías de tratamiento.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron en esta revisión todos los ensayos controlados aleatorios (ECA) y ensayos clínicos controlados (ECC).
Tipos de participantes
Se incluyeron en esta revisión los adultos con diagnóstico de osteoartritis (OA) sintomática del tobillo (primaria o secundaria). El diagnóstico se basó en criterios clínicos bien descritos p.ej. los criterios del American College of Rheumatology (ACR) (Hochberg 2012), o basados en una radiografía realizada previamente que se clasificó mediante la escala Kellgren Lawrence o Van Dijk (Harada 2011; van Dijk 1997).
Tipos de intervenciones
Los ensayos que investigaban cualquier intervención no quirúrgica fueron elegibles.
Se incluyeron ensayos que investigan las siguientes intervenciones:
-
tratamiento farmacológico: analgésicos: paracetamol, analgésicos opiáceos como codeína, oxicodona o tramadol; AINE como ibuprofeno o celecoxib, glucorticoides intraarticulares, hialuronato, glucosamina y condroitina intraarticulares;
-
tratamiento no farmacológico como pérdida de peso, reposo, fisioterapia y ortesis; férulas, vendas, soportes, ejercicio (fortalecimiento, movilidad, resistencia y estabilidad de la articulación), tratamiento manual, dieta, autocontrol, intervenciones psicosociales (Kalunian 2012).
Se excluyeron otros métodos que incluyen la medicina tradicional (p.ej. medicina a base de hierbas, acupuntura) y los naturopáticos.
Se intentó identificar dos tipos especiales de ECA o ECC:
-
ECA o ECC que compararon un tratamiento / tratamiento solo con placebo; y
-
ECA o ECC que compararon un tratamiento con el otro.
Tipos de medida de resultado
-
Dolor con una jerarquía de siete niveles (Ghogomu 2014):
-
-
dolor de la articulación afectada;
-
dolor al caminar;
-
dolor en actividades diferentes a la de caminar;
-
dolor durante el descanso o dolor durante la noche;
-
otra escala algofuncional (p.ej. dolor en la AOS o AOS total, Domsic 1998);
-
evaluación global del paciente;
-
evaluación global del médico.
-
Cuando se informó más de uno se adoptó el más alto en la lista.
-
Función física con una jerarquía de ocho niveles (Ghogomu 2014):
-
-
puntuación global de discapacidad;
-
discapacidad de caminar;
-
discapacidad diferente a la de caminar;
-
puntuación de la American Orthopedic Foot and Ankle Society (puntuación AOFAS,Kitaoka 1994);
-
Foot and Ankle Outcome Score (FAOS, Roos 2001);
-
Foot Function Index (FFI, Budiman‐Mak 1991)
-
Función (amplitud de movimiento [ADM]);
-
otra escala algofuncional (p.ej. discapacidad en la AOS o AOS total, Domsic 1998).
-
Cuando se informó más de uno se adoptó el más alto en la lista.
-
Cambios radiográficos en la estructura de la articulación según la jerarquía dada:
-
puntuación Kellgren Lawrence Harada 2011
-
puntuación van Dijk (van Dijk 1997).
-
-
Calidad de vida:
-
-
Short Form‐36 (SF‐36,Ware 1992)
-
EuroQoL‐5 Dimensions (EQ‐5D, Salén 1994).
-
-
Participantes que presentaron cualquier evento adverso grave (EAG); un evento adverso grave se define como cualquier evento adverso, independientemente de una relación posible con el tratamiento administrado, que da lugar a p.ej. la muerte, un evento potencialmente mortal o que requiere hospitalización.
-
Número de participantes sin eventos adversos; un evento adverso es cualquier evento médico adverso en un paciente o un sujeto de la investigación clínica al que se le administró un producto farmacéutico, que no necesariamente tiene una relación causal con el tratamiento.
-
Participantes que se retiran debido a un evento adverso o cualquier otra razón
Si los resultados del dolor o la función se informaron en varios puntos temporales el final del tratamiento se adoptó como el punto temporal primario para el tratamiento farmacológico como el paracetamol, los opiáceos o los AINE, con un intervalo de tres meses como un punto temporal adicional.
En el caso del hialuronato, los glucorticoides, la glucosamina y la condroitina y el tratamiento no farmacológico, se consideraron los seis meses como el punto temporal primario y el intervalo de tres meses como un punto temporal adicional.
Beneficios
Efectos perjudiciales
Results
Description of studies
Results of the search
After performing the first search up to 11 September 2014, 2945 references were retrieved; after de‐duplication this resulted in 2257 citations (1126 MEDLINE, 656 EMBASE, 98 CENTRAL, 50 CINAHL, 138 PsycINFO, 14 PEDro, 175 AMED).
No additional studies or ongoing studies were found searching the trial registers.
After screening the titles and abstracts of these references 14 full‐text articles were selected; after de‐duplication 13 remained. Seven were excluded and six were included.
See the study flowchart for further details (Figure 1).

Study flow diagram.
Included studies
The six included studies are listed in the 'Characteristics of included studies' table. Years of publication ranged from 2006 to 2014.
All studies are blinded randomised controlled trials (RCTs), three are double‐blinded RCTs (Cohen 2008; DeGroot 2012; Salk 2006). These three studies compared the intra‐articular injection of hyaluronic acid (HA) to placebo. Authors of these studies were contacted by email to get the exact results of the scores they used in their trials. Cohen 2008 and Salk 2006 were not able to provide us with these data. DeGroot 2012 did send his original database. Two compared two different treatments: HA injection compared to exercise therapy (Karatosun 2008); or HA combined with exercise therapy versus injection of Intra‐articular botulinum toxin A (Sun 2014). Witteveen 2010 compared the efficacy and safety of four different doses of HA. A total of 240 participants were involved. All were clinically diagnosed with ankle osteoarthritis (OA) which was confirmed radiographically. All participants were in generally good health. The Kellgren Lawrence score as well as the van Dijk score was used as classification for the radiographic presence of OA (Kellgren 1957; van Dijk 1997). All studies except Karatosun 2008 investigated people with unilateral ankle pain. The study population sizes at randomisation varied: 17 (Salk 2006), 75 (Sun 2014), 28 (Cohen 2008), 30 (Karatosun 2008), 64 (DeGroot 2012), 26 (Witteveen 2010). Participants were 18 years or older. Sun 2014 included participants between the age of 20 and 85 years and Cohen 2008 participants were 50 years or older.
Follow‐up in all studies ranged from 3 to 12 months. Either the Ankle Osteoarthritis Scale (AOS, Domsic 1998) or American Orthopedic Foot and Ankle Society score (AOFAS, Kitaoka 1994) or the Visual Analogue Scale (VAS, Ohnhaus 1975) were used as primary outcome measure. Different types of HA, dosage or dosing schedules were used in each trial. Salk 2006 used 5 weekly injections of 1 ml hyaluronic acid (Hyalgan®) compared to saline. Cohen 2008 used five weekly injections of 2 ml of hyaluronic acid (Hyalgan®) compared to 5 injections of 2 ml of saline. Sun 2014 used a single injection of 2 ml hyaluronic acid (Hyalgan®). Karatosun 2008 used three weekly injections of 2.5 ml hyaluronic acid (Adant®). DeGroot 2012 used a single 2 ml injection of hyaluronic acid (Supartz®) compared to saline. Witteveen 2010 investigated four different doses; single injections of 1, 2, 3 ml, and 3 weekly injections of 1 ml (3 x 1 ml) of hyaluronic acid (Orthovisc®).
Excluded studies
A total of seven studies were excluded because they were not randomised controlled trials (Huang 2006; Luciani 2008; Mei‐Dan 2010; Sarkin 1974; Sun 2006; Sun 2011; Witteveen 2008). See the table of Characteristics of excluded studies.
Risk of bias in included studies
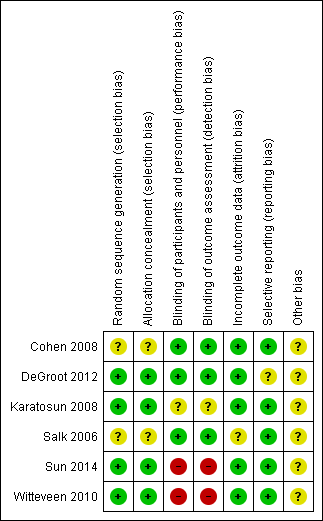
Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
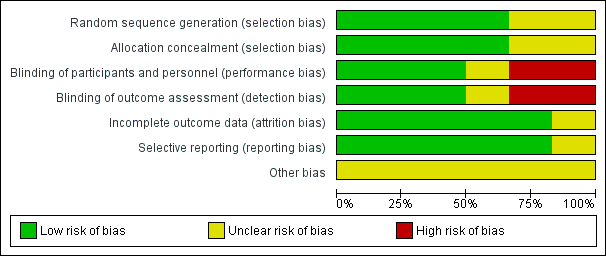
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Allocation
Generally most randomised controlled trials (4/6) described their randomisation process adequately (low risk of bias). Cohen 2008 and Salk 2006 mentioned a randomised component; however the process was not described so it was unclear which process was used to conceal allocation.
Blinding
Three studies were classified as having a low risk for performance bias and detection bias (Cohen 2008; DeGroot 2012; Salk 2006). Karatosun 2008 was classified as unclear for performance bias and detection bias: it is most likely, since the participants were not blinded, that they informed the physical therapist about the treatment they got. Since the outcome was partly participant‐reported, detection bias was considered unclear because these results can be affected by the fact the participant might have a preference for either therapy. For Sun 2014 we assessed a high risk for performance bias, since the participants could not be blinded so most likely this information went to the therapist, which could influence the outcome; the secondary outcomes could be biased by this information so detection bias was considered to be high as well. Witteveen 2010 was classified as high risk for performance and detection bias: participants were not blinded, and it is likely that they judged the fact that they got more injections as better, and therefore performed better, which might have resulted in a better outcome.
Incomplete outcome data
All studies but one were classified as low risk for incomplete data. Salk 2006 described three participants that did not complete the study. However an intention‐to‐treat analysis (ITT) was not described (unclear risk).
Selective reporting
For DeGroot 2012 it was unclear if there was reporting bias: there was a follow‐up of only three months, which can favour placebo and therefore affect the results.
Other potential sources of bias
Cohen 2008 was classified as an unclear risk because there was a difference in participant demographics: a significant difference between the mean age of participants in each group was noted as well as a difference between baseline AOS total scores and Western Ontario and McMasters Universities (WOMAC) pain scores (Bellamy 1988). DeGroot 2012 was also classified as an unclear risk for other bias since the placebo and treatment group were of unequal sizes, 25 compared to 39. Karatosun 2008 was also classified as having an unclear risk because the group that was assigned to exercise therapy had a significantly higher AOFAS score at baseline. Witteveen 2010 was classified unclear since the group that received the 2 ml injections performed unexplainably badly.
Effects of interventions
See: Summary of findings for the main comparison Hyaluronic acid for osteoarthritis of the ankle
Primary analysis: intra‐articular injection of hyaluronic acid compared to placebo (3 studies):
Three studies compared the intra articular injection of hyaluronic acid in the ankle to placebo (saline) (Cohen 2008; DeGroot 2012; Salk 2006). summary of findings Table for the main comparison.
BENEFITS :
Pain Analysis 1.1,
For the outcome 'pain', the AOS pain (at three months) and the total AOS score (at six months) were used to compare the studies. The total AOS was used to make possible a comparison of the two studies used in the meta‐analysis for the primary outcome at six months. Upon contacting the authors no additional information could be provided to perform a sub‐pooled analysis for AOS pain at six months.
In the meta‐analysis (two studies: Cohen 2008 and Salk 2006; 45 participants) compared to control at six months (primary outcome) the AOS total score was 12.53 points lower mean difference (MD) in favour for HA (95% confidence interval (CI) −23.84 to −1.22; Analysis 1.1). We downgraded the quality of evidence from high to low due to the limitation in study design (unclear risk of bias) and imprecision of result (low number of participants). At three months (two studies: Cohen 2008 and DeGroot 2012; 92 participants) compared to control the total AOS score was 2.26 lower points lower (MD) (95% CI −11.23 to 6.72 Analysis 1.2,) We downgraded the quality of evidence from high to very low due to a serious imprecision of results (low number of participants and studies are on opposite sides of null effect) and limitation in study design (unclear bias). At three months (two studies: Cohen 2008, DeGroot 2012; 92 participants) compared to control the AOS sub score pain was 1.83 points lower (MD) (95% CI −11.33 to 7.68; Analysis 1.3,). We downgraded the quality of evidence from high to very low due to serious imprecision of results (low number of participants and studies are on opposite sides of null effect) and limitation in study design (unclear bias).
Physical function Analysis 1.1,
To compare physical function between studies, the AOS disability score (at three months) and the AOS total score (at six months) was used. The total AOS was used to make possible a comparison of the two studies used in the meta‐analysis for the primary outcome at six months. Upon contacting the authors no additional information could be provided to perform a sub analysis for AOS disability at six months.
In the meta‐analysis at six months (primary outcome) (two studies: Cohen 2008 and Salk 2006; 45 participants) compared to control the AOS total score was 12.53 points lower (MD) in favour of HA (95% CI −23.84 to −1.22; Analysis 1.1). We downgraded the quality of evidence from high to low due to the limitation in study design (unclear risk of bias) and imprecision of result (low number of participants). At three months (two studies: Cohen 2008 and DeGroot 2012; 92 participants) compared to control the total AOS score was 2.26 points lower (MD) (95% CI −11.23 to 6.72; Analysis 1.2). We downgraded the quality of evidence from high to very low due to serious imprecision of results (low number of participants and studies are on opposite sides of null effect) and limitation in study design (unclear bias). At three months (two studies: Cohen 2008 and DeGroot 2012; 92 participants) compared to control the AOS sub score disability was 0.13 points lower (MD) (95% CI −9.26 to 9.01; Analysis 1.4). We downgraded the quality of evidence from high to very low due to serious imprecision of results (low number of participants and studies are on opposite sides of null effect) and limitation in study design (unclear bias).
Radiographic joint structure changes was not examined in either study.
Quality of life as outcome was only described in two studies (Cohen 2008 and Salk 2006); both used the Short‐Form 12 (SF12) (Ware 1996).
Cohen 2008: SF12 demonstrated no significant difference in their paper between either group at six months, no exact scores were mentioned in the study results and could not be provided upon contacting the author.
Salk 2006: SF12 demonstrated a significant difference in their paper favouring hyaluronic acid at six months, no standard deviations were present in the result section of the study, upon contacting the author they could not be provided.
Since the exact scores were not available, no meta‐analysis could be performed for this score.
HARMS Analysis 1.5; Analysis 1.6; Analysis 1.7
A meta‐analysis (three studies: Cohen 2008, DeGroot 2012, Salk 2006; 109 participants) showed a similar amount of AEs in either group (Peto odds ratio (Peto OR) 2.34, 95% CI 0.45 to 12.11; Analysis 1.6). No SAEs were found and no participant withdrew due to an AE (Analysis 1.5; Analysis 1.7).
Heterogeneity and sensitivity analysis:
A substantial heterogeneity of 89% was found for Analysis 1.2 . For Analysis 1.3 84%; and 89% for Analysis 1.4. Due to the fact that each analysis, except the harms analyses, only contained two studies no sensitivity analyses was done.
Intra‐articular injection of hyaluronic acid compared to exercise therapy:
Karatosun 2008 described the comparison of injection HA to exercise therapy (Appendix 8).
BENEFITS :
Pain during activity (VAS 0 to 10) showed a decrease in pain (end point was at 12 months) (MD −0.70, 95% CI −2.54 to 1.14; Analysis 2.1). We downgraded the quality of evidence from high to low due to the unclear risk of bias and small sample size (imprecision of results and limitation of design).
Physical function : At 12 months compared to exercise the AOFAS score was 13.10 points higher (MD) in favour of hyaluronic acid (95% CI 2.97 to 23.23 Analysis 2.2) on a scale of 0 to 100. We downgraded the quality of evidence from high to low due to the unclear risk of bias (limitation in study design) and small sample size (imprecision of result). At 12 months compared to exercise the walking distance was 0.30 points (MD) better in favour of exercise therapy at 12 months (95% CI −1.27 to 0.67; Analysis 2.3) We downgraded the quality of evidence from high to low due to the unclear risk of bias and small sample size.
Radiographic joint structure changes was not measured.
No quality of life score was measured.
HARMS:
No AEs were found for either group.
Intra‐articular injection of hyaluronic acid combined with exercise therapy compared to intra‐articular botulinum toxin A (BoNT‐A) injection:
Sun 2014 described the comparison of HA injection combined with exercise therapy to an intra‐articular injection of botulinum toxin A (Appendix 9).
BENEFITS:
Pain: At six months compared to botulinum toxin A the AOS pain score of the affected joint showed a decrease in pain (MD 0.10, 95% CI −0.42 to 0.62: Analysis 3.1). We downgraded the quality of evidence from high to low due to the high risk of bias and small sample size.
Physical function : At six months compared to botulinum toxin A the AOS disability score showed a decrease in physical function (MD 0.20, 95% CI −0.34 to 0.74; Analysis 3.2). We downgraded the quality of evidence from high to low due to the high risk of bias and small sample size.
Radiographic joint structure changes was not measured.
No quality of life score was measured.
HARMS:
In the HA group 2/37 (5.9%) AEs were found, in the BoNT‐A 2/38 (5.8%) (RR 1.03, 95% CI 0.15 to 6.91; Analysis 3.3). The AEs consisted of transient injection site reaction and were mild/moderately painful and resolved without treatment.
Intra‐articular sodium hyaluronate injections in the osteoarthritic ankle joint:
Effects, safety and dose dependency:
Witteveen 2010 randomised trial; four different dosages of intra‐articular injections of HA were randomly allocated; 1 ml, 2 ml, 3 ml and 3 weekly injections of 1 ml were compared for efficacy. Primary endpoint of the study was 15 weeks (Appendix 10).
Benefits:
Pain (during walking (VAS): None of the VAS‐scores for ‘pain during walking activities’ decreased significantly at week 15. The 3 x 1 ml dose group performed best (P = 0.075).
The VAS‐scores of the 1, 2, and 3 ml dose groups separately did not change significantly as compared to baseline scores at both secondary endpoints (week 7 and 27) (0.23 < P < 0.74). At week 7, a statistically significant median decrease of the VAS‐score of 29 mm was observed in the 3 x 1 ml dosage group (P = 0.046).
The median change in decrease of pain at 27 weeks was best for 3 x 1 (−30), however this was not statistically significant (P = 0.25). We downgraded the quality of evidence from high to moderate due to small sample sizes (imprecision of results).
Physical function: No physical function was measured.
Radiographic joint structure changes was not measured.
Quality of life: No quality of life was measured.
Harms:
Adverse events: AEs happened the most in the 2 ml group (57%), other groups had an adverse event rate of 14% to 17%. The total number of AEs was 7 out of 26 participants (27%). These AEs consisted of increased pain and swelling of the ankle joint. They were mild or moderate in severity and resolved within 3 days. One participant experienced severe pain and swelling for a week.
No serious adverse events were reported.
Discusión
Resumen de los resultados principales
No se identificaron ECA relacionados con otro tratamiento conservador, excepto seis estudios que analizaron la administración de ácido hialurónico (AH) para la osteoartritis (OA) del tobillo.
En esta revisión se incluyeron 240 participantes con diagnóstico de OA del tobillo. El análisis primario incluyó tres ECA (109 participantes) que compararon AH con placebo (Resumen de los hallazgos para la comparación principal). Se realizó un metanálisis para investigar los efectos beneficiosos y perjudiciales: el AH mostró una puntuación total en la AOS más baja que placebo a los seis meses (resultado primario). La AOS total se utilizó para poder hacer una comparación entre los estudios, y no fue posible proporcionar una subpuntuación exacta (dolor o discapacidad en la AOS) para el resultado a los seis meses cuando se estableció contacto con los autores. Se encontró que la diferencia en la puntuación fue alentadora; sin embargo, no se conoce si una diferencia de medias de 12,53 puntos en una escala de 100 puntos es clínicamente relevante. No se conoce la diferencia mínima clínicamente importante para esta puntuación. A los tres meses se encontró una disminución (1,83 puntos) para la subpuntuación de dolor de la AOS a favor del AH; sin embargo, los IC son amplios y los tamaños de la muestra son pequeños, por lo que estos resultados no son concluyentes. La subpuntuación de discapacidad de la AOS disminuyó 0,13 puntos a los tres meses a favor del AH. Como los IC fueron amplios y los tamaños de la muestra son pequeños estos resultados son difíciles de interpretar y no son concluyentes.
Fue difícil valorar la calidad de vida debido a que faltaron los números exactos; Salk 2006 demostró una diferencia a favor del AH en su artículo, yCohen 2008encontró resultados similares entre ambos grupos.
Hubo pocos eventos adversos (EA); 5/63 (8%) en el grupo de AH y 2/46 (4%) en el grupo placebo. La probabilidad relativa de Peto (odds ratio [OR] de Peto) de presentar un evento adverso fue 2,34 mayor en comparación con el grupo control (IC del 95%: 0,45 a 12,11). Estas pruebas no son concluyentes debido a un IC amplio y un número pequeño de eventos. Las pruebas para este análisis agrupado se calificaron como bajas debido a limitaciones en el diseño del estudio (riesgo incierto de sesgo de selección en dos estudios y riesgo incierto de sesgo de deserción en un estudio); y la imprecisión de los resultados según el tamaño pequeño de la población (109 participantes; el tamaño de la muestra total es inferior al tamaño de la información óptima calculado de 400 participantes para los resultados continuos).
Karatosun 2008 comparó AH y tratamiento con ejercicios; se encontró una disminución del dolor (EAV 0 a 10) de 0,7 puntos a los 12 meses. Como el IC cruza el 0 y los tamaños de la muestra son pequeños (30 participantes) estos resultados no son concluyentes. Para la función física a los 12 meses la puntuación total de la AOFAS (0 a 100) fue 13,10 mayor a favor del ácido hialurónico: este resultado se considera alentador. Estos resultados también se calificaron como de calidad baja debido a la limitación en el diseño del estudio; sesgo de cegamiento y otros sesgos inciertos, e imprecisión de los resultados debido a un tamaño pequeño de la población (30).
Sun 2014 describió la comparación de la inyección de ácido hialurónico combinada con tratamiento con ejercicios con una inyección intraarticular de toxina botulínica A. Se encontró una disminución del dolor y la función física en ambos grupos. Sin embargo, la disminución es pequeña: para el dolor fue 0,10 y para la función física 0,20 (en una escala de 0 a 100). Como la reducción del dolor y la función física es tan pequeña, probablemente no sea clínicamente relevante. Asimismo, los tamaños de la muestra (75 participantes) son pequeños y el IC cruza el 0: Por lo tanto, los resultados no se consideran concluyentes. El número de eventos adversos era comparable en ambos grupos. Estas pruebas también se calificaron como de calidad baja debido a limitaciones en el diseño del estudio; alto riesgo de sesgo para el cegamiento del resultado y de los participantes, e imprecisión de los resultados debido a un tamaño pequeño de la población (75).
Witteveen 2010 comparó cuatro esquemas diferentes de dosis de inyecciones intraarticulares de AH en cuanto a la eficacia y la seguridad (26 participantes). La mejor disminución mediana del dolor al caminar en una EAV (en una escala de 0 a 100) se mostró para 3 x 1 ml a las 27 semanas, con una disminución mediana de 30. No se midieron la función física, los cambios radiográficos y la calidad de vida. El número total de eventos adversos fue del 27%; la mayoría ocurrió en el grupo de 2 ml (57%). Ningún participante se retiró debido a EA y no se observaron EAG. Estas pruebas se calificaron como de calidad baja por la imprecisión de los resultados debido a un tamaño pequeño de la muestra de participantes (26) y a limitaciones en el diseño del estudio, alto riesgo de sesgo para el cegamiento del resultado y de los participantes.
Compleción y aplicabilidad general de las pruebas
El objetivo de esta revisión fue evaluar los efectos beneficiosos y perjudiciales de cualquier tratamiento conservador de la OA del tobillo. No se identificaron ensayos controlados aleatorios o clínicos además de los seis ECA ya mencionados. Todos se relacionaron con la administración de infiltraciones de AH para la OA del tobillo. No se identificaron ensayos (ECA/ECC o ensayos en curso) relacionados con otro tratamiento conservador.
Se agruparon tres ensayos; el AH se comparó con placebo. Se utilizaron diferentes esquemas de dosis en los estudios. Cohen 2008 utilizó cinco inyecciones semanales de 2 ml de Hyalgan®, Salk 2006 utilizó cinco inyecciones semanales de 1 ml de Hyalgan®, mientras que DeGroot 2012 utilizó una inyección individual de 2,5 ml de Supartz®. Hasta el momento no está claro qué dosis se debe utilizar para cada tipo de inyección de ácido hialurónico. Por ejemplo, Witteveen 2010 encontró que 3 x 1 ml de Orthovisc® funcionó mejor para este tipo de AH. El AH restaura las propiedades reológicas de la articulación y se piensa que protege el cartílago al mejorar la viscoelasticidad (Balazs 1993; Bellamy 2006).
Hay una diferencia notable en los hallazgos entre el resultado primario a los seis meses (AOS total) y las puntuaciones individuales (dolor en la AOS y discapacidad en la AOS) y a AOS total en el punto temporal adicional de tres meses. Puesto que los resultados a los tres meses son difíciles de interpretar debido a una imprecisión grave de los resultados, se necesita más investigación. Una posible explicación puede ser el hecho de que el efecto placebo podría desaparecer a los tres meses, pero hasta el momento es solo especulación. No está claro qué grado de OA responde mejor a las infiltraciones de AH; sin embargo, el grado 3 de van Dijk o el grado 4 de Kellgren Lawrence tienen menos probabilidades de responder. Los tres ensayos incluidos en el metanálisis incluyeron grados 2, 3 y 4 de Kellgren Lawrence, y no se realizaron análisis de subgrupos.
Se piensa que el AH en estos estudios mejoró el dolor y la función, que fue principalmente un efecto a corto plazo. Se piensa que el efecto a largo plazo, al mejorar las propiedades reológicas, desacelera la progresión de la osteoartritis de la articulación; sin embargo, ninguno de estos estudios investigó este resultado. Karatosun 2008 investigó tres inyecciones semanales de 2,5 ml de Adant® comparadas con seis semanas de tratamiento con ejercicios; estos pacientes presentaron en ocasiones OA bilateral del tobillo y también dolor de la rodilla. Sun 2014 comparó una inyección de 2 ml de Hyalgan® combinada con cuatro semanas de tres sesiones semanales de fisioterapia con una inyección de toxina botulínica A. Se supone que ambas inyecciones mejoran el dolor; aún no está claro por qué el ácido hialurónico se agregó al tratamiento con ejercicios, y parece innecesario. Todas estas diferencias entre los estudios (la incertidumbre acerca de factores como el esquema de dosis, el grado ideal de OA del tobillo para esta clase de tratamiento y la falta de pruebas para otros tipos de tratamientos conservadores) dificultan evaluar la aplicabilidad de las pruebas. Hasta el momento no se pueden hacer recomendaciones válidas.
Calidad de la evidencia
En general la calidad de las pruebas mostró algunas limitaciones graves. Hubo limitaciones en el diseño y la implementación e imprecisión de los resultados para el metanálisis. La limitación en el diseño de los estudios se basó en que el riesgo de sesgo se consideró bajo o incierto para todas las categorías en cuanto a los tres estudios utilizados en el metanálisis. Cohen 2008 se consideró incierto porque este estudio no mostró una asignación al azar y un proceso de asignación claros y hubo un desequilibrio en el valor inicial entre ambos grupos en la edad. DeGroot 2012 se consideró incierto para otros sesgos porque el estudio tuvo un tamaño desigual en el número de participantes entre los grupos tratamiento y placebo (39/25). El seguimiento de este estudio se limitó a tres meses; es posible que si el seguimiento hubiera sido más largo el grupo de tratamiento podría haber funcionado mejor debido al efecto decreciente del placebo. Salk 2006 se consideró incierto porque no se describió del proceso de asignación al azar. Los tres estudios relacionados con el metanálisis incluyeron pacientes con grado IV de Kellgren Lawrence y se conoce que la artritis grave no responde bien al tratamiento con ácido hialurónico, por lo que también se consideró como sesgo incierto. Todos estos ensayos tuvieron un número muy bajo de participantes; el número total de participantes utilizados para el análisis agrupado fue 109, y este tamaño de la muestra total es inferior al tamaño de información óptima calculado de 400 pacientes para los resultados continuos. Esta limitación y la imprecisión de los resultados dieron lugar a la disminución de la calidad de las pruebas a baja para los resultados principales. La limitación en el diseño del estudio y la imprecisión de los resultados también provocaron la disminución en dos niveles para el análisis primario, que comparó AH con placebo en la tabla de Resumen de los hallazgos y también dio lugar a una baja calidad.
Karatosun 2008 tuvo limitaciones en el diseño del estudio; riesgo incierto de sesgo de realización y detección porque el cegamiento fue poco claro para el participante y el evaluador podría estar sesgado porque el participante estaba al tanto del tratamiento que recibió; se consideró incierto el dominio otros sesgos porque algunos participantes tenían compromiso bilateral de OA del tobillo, lo que hizo difícil valorar la eficacia, así como imprecisión de los resultados debido a un tamaño pequeño del número de participantes (30), lo que dio lugar a la diminución de la calidad de las pruebas a baja para todos los resultados. Sun 2014 tuvo limitaciones en el diseño del estudio debido a un alto riesgo de sesgo por la falta de cegamiento de los participantes y los evaluadores, así como imprecisión de los resultados debidos a un tamaño de la muestra pequeño (75). Lo anterior dio lugar a la disminución de la calidad de las pruebas a baja para todos los resultados. Witteveen 2010 tuvo limitaciones en el diseño del estudio debido al alto riesgo de sesgo de realización y detección; no fue posible cegar a los participantes, lo que posiblemente dio lugar a sesgo en el resultado informado por el participante, y también hubo imprecisión de los resultados debido al tamaño de la muestra pequeño, lo que dio lugar a la disminución de la calidad de las pruebas a baja para todos los resultados.
Es muy probable que las investigaciones adicionales tengan una repercusión importante sobre la confianza en la estimación del efecto y es probable que cambien la estimación. No se encontraron otros motivos para la disminución de la calidad de las pruebas en ninguno de los estudios incluidos (falta de direccionalidad de las pruebas, heterogeneidad no explicada, alta probabilidad de sesgo de publicación).
Sesgos potenciales en el proceso de revisión
Para minimizar la posibilidad de sesgo durante el proceso de revisión, la revisión se realizó de acuerdo con el protocolo publicado. Debido a que se encontró un bajo número de estudios elegibles, se añadió una búsqueda sensible a fin de incluir la mayor cantidad de estudios posible y minimizar la posibilidad de sesgo de publicación. Se diseñó una estrategia sensible de búsqueda para recuperar los ensayos de las bases de datos bibliográficas electrónicas, sin limitaciones de intervención o idioma. La búsqueda también incluyó una búsqueda de ensayos en curso y recientemente completados. Sin embargo, aún es posible que los ensayos potencialmente relevantes se hayan omitido. Para conseguir los datos adicionales de los ensayos recuperados, se estableció contacto con los investigadores y fueron comunicativos, pero no fue posible obtener datos adicionales. Se realizó un metanálisis y se agruparon los datos; es posible que debido a los datos faltantes, los sesgos inciertos en los ensayos agrupados, el agrupamiento de tamaños de la muestra pequeños y la comparación de ensayos que utilizaron diferentes esquemas de dosis, se compararan datos que no fueran verdaderamente comparables y se haya introducido un sesgo potencial.
Acuerdos y desacuerdos con otros estudios o revisiones
El número de estudios y revisiones relacionados con la administración de ácido hialurónico para la osteoartritis del tobillo es muy limitado. Se identificaron tres revisiones(Abate 2012; Chang 2013; Migliore 2011). En todas las revisiones se incluyó un estudio aleatorio que no fue elegible para la presente revisión, ya que el AH se administró mediante artroscopia después del desbridamiento artroscópico(Carpenter 2008). Abate 2012 examinó cuatro ensayos controlados aleatorios,Carpenter 2008, Cohen 2008,Salk 2006, Karatosun 2008, y cinco series de casos clínicos. No se realizó un análisis agrupado. Los autores concluyeron que no hubo pruebas de la eficacia del AH para el alivio del dolor y mejorar la función en la OA del tobillo. Su recomendación para los estudios de investigación futuros fue examinar un régimen de dosis suficiente, una buena medida de resultado e identificar qué pacientes y grados de OA se benefician más de las inyecciones de ácido hialurónico.
Chang 2013 incluyó cinco ensayos controlados aleatorios (Carpenter 2008; Cohen 2008; DeGroot 2012; Karatosun 2008; Salk 2006), un estudio prospectivo de brazo doble y cuatro de brazo único. Todos los estudios se agruparon según la mejoría en la puntuación a partir del valor inicial. Se encontró una reducción significativa del dolor para las inyecciones de AH según el tamaño del efecto agrupado en las puntuaciones de mejoría a partir del valor inicial a los tres meses, lo que indica que el AH intraarticular es un enfoque terapéutico eficaz para la OA del tobillo. No se encontraron diferencias estadísticamente significativas a favor del AH cuando se comparó con placebo.
Migliore 2011 incluyó cuatro ensayos aleatorios (Carpenter 2008; Cohen 2008; Karatosun 2008; Salk 2006); y cuatro estudios de brazo único. Debido a la heterogeneidad de los estudios no fue posible agrupar los datos. Se describió cada estudio y la conclusión. La conclusión general fue que la viscosuplementación es útil en la OA del tobillo. Los estudios prospectivos futuros deben utilizar resultados estandarizados.
La presente revisión se limitó a un análisis de los datos de ensayos controlados aleatorios; solamente se agruparon los datos comparables. Se encontró que a los seis meses, que fue el punto temporal primario, el AH es superior a placebo para la puntuación total de la AOS (DM ‐12,53; IC del 95%: ‐23,84 a ‐1,22). Sin embargo, este hallazgo se basa en pruebas de baja calidad. No hubo puntuaciones individuales disponibles (dolor o discapacidad en la AOS) para esta comparación a los seis meses. No se conoce si una diferencia de medias de 12,53 puntos en una escala de 100 puntos es clínicamente relevante. A los tres meses, que se especificó como un punto temporal adicional, la puntuación individual del dolor y la discapacidad en la AOS no son concluyentes para el análisis agrupado (como la AOS total), debido a una grave imprecisión de los resultados (los estudios están en lados opuestos del efecto nulo) y las limitaciones en el diseño del estudio; estas pruebas se disminuyeron a muy baja calidad.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
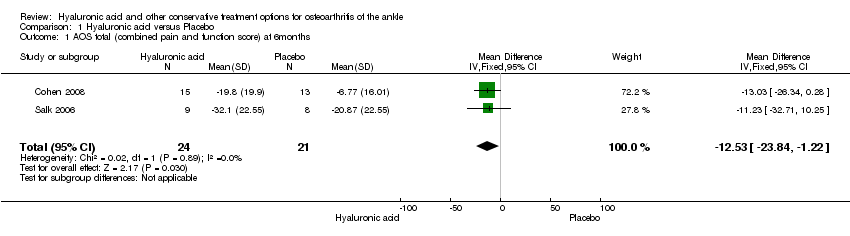
Comparison 1 Hyaluronic acid versus Placebo, Outcome 1 AOS total (combined pain and function score) at 6months.
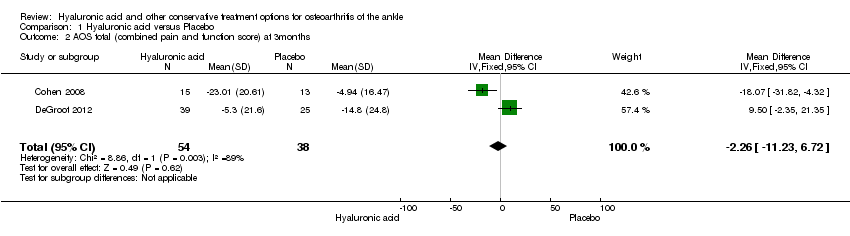
Comparison 1 Hyaluronic acid versus Placebo, Outcome 2 AOS total (combined pain and function score) at 3months.

Comparison 1 Hyaluronic acid versus Placebo, Outcome 3 Pain (AOS pain) at 3months.
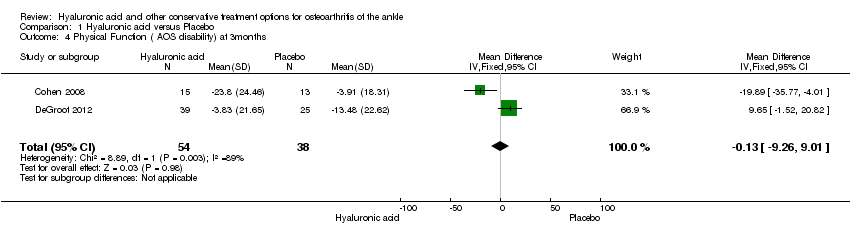
Comparison 1 Hyaluronic acid versus Placebo, Outcome 4 Physical Function ( AOS disability) at 3months.
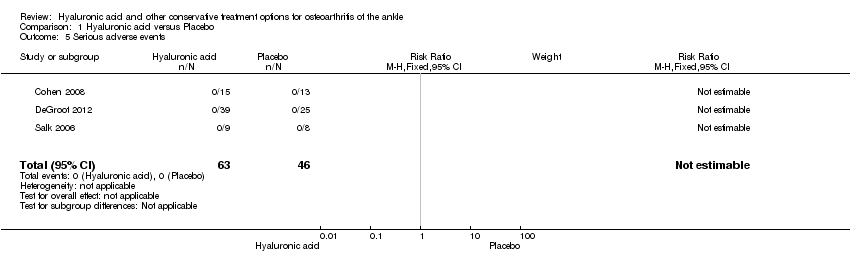
Comparison 1 Hyaluronic acid versus Placebo, Outcome 5 Serious adverse events.
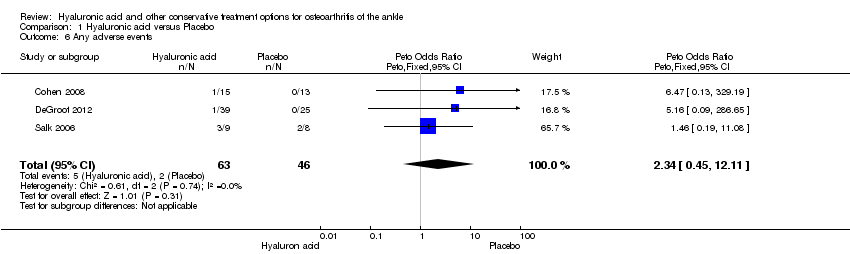
Comparison 1 Hyaluronic acid versus Placebo, Outcome 6 Any adverse events.

Comparison 1 Hyaluronic acid versus Placebo, Outcome 7 Patients who withdraw because of an adverse event.

Comparison 2 Hyaluronic acid versus Exercise therapy, Outcome 1 Pain during activity‐VAS.

Comparison 2 Hyaluronic acid versus Exercise therapy, Outcome 2 Physical Function_total AOFAS.
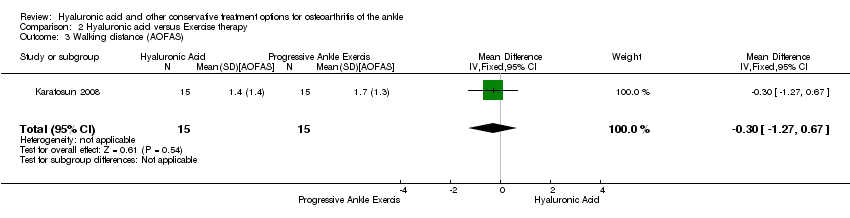
Comparison 2 Hyaluronic acid versus Exercise therapy, Outcome 3 Walking distance (AOFAS).
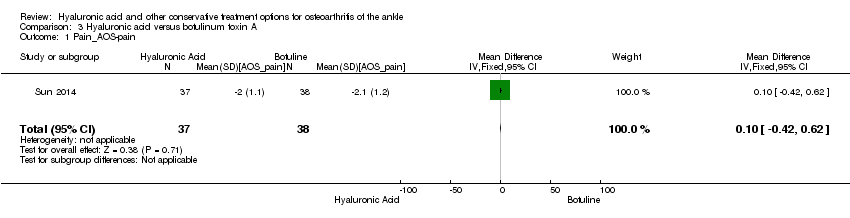
Comparison 3 Hyaluronic acid versus botulinum toxin A, Outcome 1 Pain_AOS‐pain.

Comparison 3 Hyaluronic acid versus botulinum toxin A, Outcome 2 Physical Function_AOS‐disability.

Comparison 3 Hyaluronic acid versus botulinum toxin A, Outcome 3 Adverse events.
| Hyaluronic acid for osteoarthritis of the ankle | ||||||
| Patient or population: patients with osteoarthritis of the ankle | ||||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No of Participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| Placebo | Hyaluronic acid | |||||
| AOS total (Pain & Physical function) | The mean pain/physical function change ranged across the control groups from 6.8 to 20.9 points lower with a weighted mean of | The mean pain/physical function in the hyaluronic acid group was 12.53 points lower (23.84 lower to 1.22 lower) compared to placebo at 6 months. | 45 | ⊕⊕⊝⊝ | A lower score indicates less pain and a better physical function. It is not known if a change of 12 points is clinically relevant. NNT = 4 (95% CI 2 to 205) (using a SMD = 0.5 as a minimum important difference). Absolute risk difference is −12.53% (95% CI −23.84 to −1.22). Relative percentage change is 1.85% (95% CI 0.18 to 3.58%). | |
| Radiographic Joint Structure Changes | See comment | See comment | Not estimable | 0 | See comment | Radiographic joint structure changes were not investigated. |
| Quality of Life SF12. Scale from: 0 to 100. Follow‐up: mean 6 months. | See comment | See Comment | Not estimable | 45 (2 studies) | See comment | Cohen 2008 only described that there was no significant difference between placebo and intervention for the SF12 outcome, no exact data was provided. Salk 2006 could not provide us with the standard deviations, so no estimate of the SF12 could be made. He demonstrated a statistically significant difference in his paper favouring hyaluronic acid at 6 months. |
| Number of participants experiencing any serious adverse events | See comment | See comment | Not estimable | 109 | See comment | No serious adverse events (SAEs) were noted |
| Number of participants experiencing any adverse event | 43 per 1000 | 35 per 1000 | RR 1.66 | 109 | ⊕⊕⊝⊝ | Peto Odds Ratio is 2.34 (95% CI 0.45 to 12.11) Absolute risk difference is 5.00% (−5 to 14), relative percentage change is 66% (−53% to 488%). Adverse events for all 3 studies were reported, even though DeGroot had a follow up of 3 months. All adverse events resolved within a week after injection, so a shorter follow up has no effect on the estimate of effect. |
| Participants who withdraw because of an adverse event or any other reason | See comment | See comment | Not estimable | 109 | See comment | No participants withdrew because of an adverse event |
| AOS: Ankle Osteoarthritis ScaleCI: Confidence interval; RR: Risk ratio; OR: Odds ratio; SF12: short form 12 | ||||||
| GRADE Working Group grades of evidence Grade criteria: study limitation, indirectness, inconsistency, imprecision, publication bias. | ||||||
| * The assumed risk was based on the weighted mean of the scores in the control groups across the 2 studies. The range was based on the mean change in pain on a visual analogue scale (100 mm) of the control group in each separate study.The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). 1 Evidence was downgraded based on limitations in study design and imprecision of results. Limitation in study design: there was a unclear risk of selection bias for Salk and Cohen, unclear risk for attrition bias for Salk. Imprecision of results: the population size is small (45 participants). No indirectness of evidence was found, no inconsistency and no publication bias. 2 Evidence was downgraded based on limitations in study design and imprecision of results. Limitation in study design: there was a unclear risk of selection bias for Cohen, an unclear risk for reporting bias for DeGroot. Imprecision of results: the total population size is small (92 participants). No indirectness of evidence was found, no inconsistency and no publication bias. | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 AOS total (combined pain and function score) at 6months Show forest plot | 2 | 45 | Mean Difference (IV, Fixed, 95% CI) | ‐12.53 [‐23.84, ‐1.22] |
| 2 AOS total (combined pain and function score) at 3months Show forest plot | 2 | 92 | Mean Difference (IV, Fixed, 95% CI) | ‐2.26 [‐11.23, 6.72] |
| 3 Pain (AOS pain) at 3months Show forest plot | 2 | 92 | Mean Difference (IV, Fixed, 95% CI) | ‐1.83 [‐11.33, 7.68] |
| 4 Physical Function ( AOS disability) at 3months Show forest plot | 2 | 92 | Mean Difference (IV, Fixed, 95% CI) | ‐0.13 [‐9.26, 9.01] |
| 5 Serious adverse events Show forest plot | 3 | 109 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| 6 Any adverse events Show forest plot | 3 | 109 | Peto Odds Ratio (Peto, Fixed, 95% CI) | 2.34 [0.45, 12.11] |
| 7 Patients who withdraw because of an adverse event Show forest plot | 3 | 109 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.0 [0.0, 0.0] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Pain during activity‐VAS Show forest plot | 1 | 30 | Mean Difference (IV, Fixed, 95% CI) | ‐0.70 [‐2.54, 1.14] |
| 2 Physical Function_total AOFAS Show forest plot | 1 | 30 | Mean Difference (IV, Fixed, 95% CI) | 13.1 [2.97, 23.23] |
| 3 Walking distance (AOFAS) Show forest plot | 1 | 30 | Mean Difference (IV, Fixed, 95% CI) | ‐0.30 [‐1.27, 0.67] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Pain_AOS‐pain Show forest plot | 1 | 75 | Mean Difference (IV, Fixed, 95% CI) | 0.10 [‐0.42, 0.62] |
| 2 Physical Function_AOS‐disability Show forest plot | 1 | 75 | Mean Difference (IV, Fixed, 95% CI) | 0.20 [‐0.34, 0.74] |
| 3 Adverse events Show forest plot | 1 | 75 | Risk Ratio (M‐H, Fixed, 95% CI) | 1.03 [0.15, 6.91] |

