Agentes estimulantes de la eritropoyesis de acción corta para el tratamiento de la anemia en pacientes de prediálisis
Resumen
Antecedentes
Anteriormente se han demostrado los beneficios de los agentes estimulantes de la eritropoyesis (AEE) para los pacientes con nefropatías crónicas (NC). Sin embargo, sigue sin poder precisarse la eficacia y la seguridad de las epoetinas de acción corta administradas en dosis más altas y con menor frecuencia, así como las de las epoetinas nuevas y los productos biosimilares.
Objetivos
Esta revisión procuró evaluar los efectos beneficiosos y perjudiciales de diferentes vías, frecuencias y dosis de las epoetinas (epoetina alfa, epoetina beta y otras epoetinas de acción corta) para la anemia en adultos y niños con NC no sometidos a diálisis.
Métodos de búsqueda
Se realizaron búsquedas en el registro especializado del Grupo Cochrane de Riñón y Trasplante (Cochrane Kidney and Transplant's Specialised Register) hasta el 12 de septiembre 2016, a través del contacto con el especialista en información, mediante términos de búsqueda relevantes para esta revisión. Los estudios contenidos en el registro especializado se identificaron mediante estrategias de búsquedas específicamente diseñadas para CENTRAL, MEDLINE y EMBASE; búsquedas manuales en actas de congresos; y búsquedas en el International Clinical Trials Register (ICTRP) Search Portal y ClinicalTrials.gov.
Criterios de selección
Se incluyeron ensayos controlados aleatorios (ECA) que compararon diferentes frecuencias, vías, dosis y tipos de AEE de acción corta en los pacientes con NC.
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, evaluaron la elegibilidad de los estudios y cuatro autores evaluaron el riesgo de sesgo y extrajeron los datos. Los resultados se expresaron como cociente de riesgos (CR) o diferencias de riesgos (DR) con intervalos de confianza (IC) del 95% para los resultados dicotómicos. Para los resultados continuos, se usó la diferencia de medias (DM) con intervalos de confianza (IC) del 95%. Para realizar los análisis estadísticos se utilizó un modelo de efectos aleatorios.
Resultados principales
Se identificaron 14 ECA (2616 participantes); nueve estudios fueron multicéntricos, y dos incorporaron a niños. El riesgo de sesgo fue elevado en la mayoría de los estudios; sólo tres estudios presentaron una generación de la secuencia de asignación al azar adecuada, y en sólo dos, el riesgo de sesgo para la ocultación de la asignación fue bajo. El riesgo de sesgo del cegamiento de los participantes y el personal fue bajo en un estudio. El cegamiento de la evaluación de resultados se consideró en bajo riesgo en 13 estudios, ya que las medidas de resultado se informaron como resultados de laboratorio y, por lo tanto, fue poco probable que estuvieran afectadas por el cegamiento. El riesgo de sesgo de deserción fue bajo en ocho estudios, aunque el riesgo de sesgo de informe selectivo fue bajo en seis estudios incluidos.
Se compararon cuatro intervenciones: epoetina alfa o beta a diferentes frecuencias con la misma dosis total (seis estudios); epoetina alfa a la misma frecuencia y diferentes dosis totales (dos estudios); epoetina alfa por vía intravenosa versus subcutánea (un estudio); epoetina alfa o beta versus otras epoetinas o productos biosimilares (cinco estudios). Un estudio comparó dos frecuencias diferentes de epoetina alfa a la misma dosis total, y con la misma frecuencia y a dosis totales diferentes.
En el metanálisis sólo se pudieron incluir los datos de siete de los 14 estudios. No hubo diferencias significativas en los niveles de hemoglobina (Hb) final cuando se aplicó la dosis cada dos semanas en comparación con la dosis semanal (cuatro estudios, 785 participantes: DM ‐0,20 g/dl; IC del 95%: ‐0,33 a ‐0,07) ni con la dosis de cuatro veces por semana comparada con la dosis de dos veces por semana (tres estudios, 671 participantes: DM ‐0,16 g/dl; IC del 95%: ‐0,43 a 0,10) ni cuando se administraron diferentes dosis totales con la misma frecuencia (cuatro veces por semana: un estudio, 144 participantes: DM 0,17 g/dl; IC del 95%: ‐0,19 a 0,53).
Cinco estudios evaluaron diferentes intervenciones. Un estudio comparó la epoetina theta con la epoetina alfa y no se encontraron diferencias significativas en los niveles de Hb (288 participantes: DM ‐0,02 g/dl; IC del 95%: ‐0,25 a 0,21). Un estudio encontró puntuaciones del dolor significativamente mayores con la epoetina alfa subcutánea en comparación con la epoetina beta. Dos estudios (165 participantes) compararon la epoetina delta con la epoetina alfa y no hubo resultados disponibles, ya que la compañía farmacéutica retiró la epoetina delta por razones comerciales. El quinto estudio, que comparó el producto biosimilar HX575 con la epoetina alfa, se interrumpió después de que los pacientes que recibían HX575 por vía subcutánea desarrollaron anticuerpos antiepoetina, y no se dispuso de resultados.
Los eventos adversos se informaron de manera deficiente en todos los estudios, y no hubo diferencias significativas en las comparaciones. La mortalidad sólo se detalló adecuadamente en cuatro estudios, y sólo un estudio incluyó datos de la calidad de vida.
Conclusiones de los autores
La epoetina alfa administrada a dosis mayores por intervalos prolongados (dos o cuatro veces por semana) no es inferior a los intervalos de dosis más frecuentes para mantener los niveles finales de Hb, sin diferencias significativas en los efectos adversos en los pacientes con NC no sometidos a diálisis. Sin embargo los datos son de calidad metodológica baja, por lo que no se pueden excluir diferencias en la eficacia y la seguridad. Se necesitan ECA con resultados centrados en el paciente, más grandes y bien diseñados, para evaluar la seguridad y la eficacia de dosis grandes de AEE de acción corta, que incluyan productos biosimilares a la epoetina alfa administrados con menor frecuencia en comparación con la administración más frecuente de dosis más pequeñas en niños y adultos con NC no sometidos a diálisis.
PICOs
Resumen en términos sencillos
Agentes de eritropoyesis de acción corta en pacientes con nefropatías crónicas que no requieren diálisis
¿Cuál es el problema?
La anemia debido a la reducción de la producción de eritropoyetina por los riñones (una hormona que aumenta la producción de glóbulos rojos) es una causa importante de cansancio y otros problemas que presentan los pacientes con nefropatías crónicas que requieren diálisis o no.
Las eritropoyetinas elaboradas (epoetinas) mejoran la anemia y se suelen prescribir en los pacientes con nefropatías crónicas. Actualmente están disponibles varias epoetinas producidas diferentes.
¿Qué se hizo?
Se realizaron búsquedas en el registro especializado del Grupo Cochrane de Riñón y Trasplante (Cochrane Kidney and Transplant's Specialised Register) hasta el 12 de septiembre 2016, a través del contacto con el especialista en información, mediante términos de búsqueda relevantes para esta revisión. Se incluyeron ensayos controlados aleatorios (ECA) que compararon diferentes frecuencias, vías, dosis y tipos de AEE de acción corta en los pacientes con nefropatías crónicas.
¿Qué se encontró?
Se revisaron las pruebas de 14 estudios, con 2616 participantes con NC que no recibían diálisis, publicados antes del 12 de septiembre de 2016 para determinar si existían diferencias en la mejoría de la anemia y en los efectos secundarios entre diferentes epoetinas de acción corta o entre las mismas epoetinas administradas a diferentes frecuencias. No se encontraron estudios que usaran diferentes frecuencias de epoetinas en niños.
Se encontró que las epoetinas de acción corta tradicionalmente administradas con menos frecuencia (dos veces por semana a cada cuatro semanas) dieron lugar a una corrección similar de la anemia en comparación con la administración semanal o cada dos semanas; no hubo diferencias en los efectos secundarios entre las diferentes comparaciones. Un estudio comparó la administración subcutánea de una epoetina alfa HX575 recientemente producida en comparación con una epoetina alfa que se suspendió después que dos pacientes desarrollaron anticuerpos antieritropoyetina. Sin embargo, se necesitan más estudios ya que la mayoría fueron pequeños y de diseño deficiente, lo que limita la aplicación a la atención de los pacientes.
Conclusiones de los autores
Summary of findings
| Epoetin alpha every 2 weeks versus to weekly for anaemia in CKD patients not receiving dialysis | ||||||
| Patient or population: anaemia in predialysis patients | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Risk with weekly | Risk with Epoetin alpha every 2 weeks | |||||
| Change in Hb level | The mean change in Hb level was 0 g/dL | The mean change in Hb level in the intervention group was 0.19 g/dL lower (0.32 g/dL lower to 0.06 g/dL lower) | ‐ | 798 (4) | ⊕⊕⊝⊝ | downgraded for study limitations and indirectness |
| Number reaching target Hb | Study population | RR 0.96 | 798 (4) | ⊕⊕⊝⊝ | downgraded for study limitations and indirectness | |
| 960 per 1000 | 922 per 1000 | |||||
| Moderate | ||||||
| 947 per 1000 | 910 per 1000 | |||||
| Number of deaths | Study population | RR 0.89 | 838 (4) | ⊕⊕⊝⊝ | downgraded for study limitations and imprecision | |
| 28 per 1000 | 24 per 1000 | |||||
| Moderate | ||||||
| 22 per 1000 | 20 per 1000 | |||||
| Adverse events: RBC transfusions | Study population | RR 1.56 | 580 (3) | ⊕⊕⊝⊝ | downgraded for imprecision and study limitations | |
| 33 per 1000 | 52 per 1000 | |||||
| Moderate | ||||||
| 37 per 1000 | 58 per 1000 | |||||
| Adverse events: hypertension | Study population | RR 0.85 | 838 (4) | ⊕⊕⊕⊝ | downgraded for study limitations | |
| 100 per 1000 | 85 per 1000 | |||||
| Moderate | ||||||
| 95 per 1000 | 81 per 1000 | |||||
| Adverse events: thrombovascular events | Study population | RR 1.41 | 838 (4) | ⊕⊕⊝⊝ | downgraded for study limitations and imprecision | |
| 28 per 1000 | 39 per 1000 | |||||
| Moderate | ||||||
| 27 per 1000 | 38 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 allocation concealment unclear in 3 of 4 studies 2 surrogate outcome 3 few studies with low numbers and wide confidence 4 allocation concealment unclear in 2 of 3 studies | ||||||
| Epoetin alfa every four weeks versus with every two weeks in CKD patients not receiving dialysis | ||||||
| Patient or population: anaemia in predialysis patients | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Risk with every 2 weeks | Risk with Epoetin alpha every 4 weeks | |||||
| Change in Hb level | The mean change in Hb level was 0 | The mean change in Hb level in the intervention group was 0.15g/dL lower (0.41 g/dL lower to 0.1g/dL more) | ‐ | 671 (3) | ⊕⊝⊝⊝ | downgraded for study limitations, heterogeneity and indirectness |
| Number reaching target Hb | Study population | RR 0.95 | 687 (3) | ⊕⊝⊝⊝ | downgraded for study limitations, heterogeneity and indirectness | |
| 916 per 1000 | 870 per 1000 | |||||
| Moderate | ||||||
| 895 per 1000 | 850 per 1000 | |||||
| Number of deaths | Study population | RR 0.95 | 724 (3) | ⊕⊕⊝⊝ | downgraded for study limitations, imprecision | |
| 22 per 1000 | 21 per 1000 | |||||
| Moderate | ||||||
| 26 per 1000 | 25 per 1000 | |||||
| Adverse events: RBC transfusions | Study population | RR 1.26 | 470 (2) | ⊕⊕⊝⊝ | downgraded for study limitations, imprecision | |
| 38 per 1000 | 48 per 1000 | |||||
| Moderate | ||||||
| 35 per 1000 | 44 per 1000 | |||||
| Adverse events: hypertension | Study population | RR 1.02 | 724 (3) | ⊕⊕⊕⊝ | downgraded for study limitations | |
| 70 per 1000 | 72 per 1000 | |||||
| Moderate | ||||||
| 62 per 1000 | 63 per 1000 | |||||
| Adverse events: arteriovenous complications | Study population | RR 1.02 | 724 (3) | ⊕⊕⊝⊝ | downgraded for study limitations, imprecision | |
| 26 per 1000 | 26 per 1000 | |||||
| Moderate | ||||||
| 23 per 1000 | 24 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 two of the three studies had unclear allocation concealment 2 surrogate outcome 3 unexplained heterogeneity 4 small numbers with wide confidence intervals | ||||||
| Epoetin theta versus epoetin beta in CKD patients not receiving dialysis | ||||||
| Patient or population: anaemia in predialysis patients | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Risk with epoetin beta | Risk with Epoetin theta | |||||
| Final Hb | The mean final Hb was 0 g/dL | The mean final Hb in the intervention group was 0.02 g/dL lower (0.25 g/dL lower to 0.21 g/dL higher) | ‐ | 288 (1) | ⊕⊕⊕⊝ | downgraded for indirectness ‐ surrogate outcomes |
| Mean weekly epoetin dose | The mean weekly epoetin dose was 0 units/week | The mean weekly epoetin dose in the intervention group was 0.4 units per week higher (5.68 units per week lower 6.48 units/week higher) | ‐ | 288 (1) | ⊕⊕⊝⊝ | downgraded for indirectness ‐ surrogate outcomes and imprecision |
| Deaths | Study population | RR 2.46 | 288 (1) | ⊕⊕⊝⊝ | downgraded for imprecision | |
| 11 per 1000 | 26 per 1000 | |||||
| Moderate | ||||||
| 11 per 1000 | 26 per 1000 | |||||
| Adverse events: hypertension | Study population | RR 0.35 | 288 (1) | ⊕⊕⊕⊝ | downgraded for imprecision | |
| 74 per 1000 | 26 per 1000 | |||||
| Moderate | ||||||
| 74 per 1000 | 26 per 1000 | |||||
| Adverse events: RBC transfusions | Study population | RR 1.48 | 288 (1) | ⊕⊕⊝⊝ | downgraded for imprecision | |
| 0 per 1000 | 0 per 1000 | |||||
| Adverse events: discontinuation of therapy | Study population | RR 1.77 | 288 (1) | ⊕⊕⊝⊝ | downgraded for imprecision | |
| 53 per 1000 | 93 per 1000 | |||||
| Moderate | ||||||
| 53 per 1000 | 93 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Surrogate outcome, not a patient‐centred outcome 2 Small numbers, wide confidence intervals | ||||||
Antecedentes
Descripción de la afección
La anemia se define como niveles de hemoglobina (Hb) < 12,0 g/dl y 13,0 g/dl en mujeres y hombres adultos respectivamente según la definición de anemia de la Organización Mundial de la Salud (KDIGO 2012; WHO 2011). La anemia se diagnostica en los niños con nefropatías crónicas (NC) si la concentración de Hb es < 11,0 g/dl en los niños con edades desde seis meses a cinco años, < 11,5 g/dl en los niños con edades de cinco a 12 años y < 12,0 g/dl en los niños de 12 a 15 años de edad según las guías Kidney Disease Improving Global Outcomes (KDIGO 2012). La anemia es una complicación conocida de la NC (Dmtrieva 2013) que se desarrolla cuando disminuye la función renal; la prevalencia aumenta según desciende la tasa de filtración glomerular (TFG). La NC estadio 3 a 5 es una variable predictiva de disminución de la Hb (Dmtrieva 2013).
La prevalencia de la anemia varía del 25% al 70% (Hsu 2002; Koch 1991) y la mayoría de los pacientes con NC estadio 5 (TFG < 15 ml/min/1,73 m2) presentan anemia (Astor 2002). La anemia relacionada con la NC provoca morbilidad significativa, mortalidad y aumenta los eventos cardiovasculares, con síntomas que incluyen falta de energía, disnea, mareos, angina, disminución del apetito y de la tolerancia al ejercicio (Canadian EPO 1990; Lundin 1989).
La causa primaria de anemia en la NC es la reducción de la producción de eritropoyetina (EPO) en el riñón, una hormona que se produce de forma natural. La anemia se puede exacerbar por la anemia ferropénica concurrente (KDIGO 2012).
Antes de la disponibilidad de la EPO humana recombinante (rHuEPO), la anemia se trataba con transfusiones de sangre junto con suplementos de hierro y folato. La clonación del gen humano para la EPO se logró en 1983 (Lin 1985) y la producción de rHuEPO comenzó después. La eficacia del tratamiento con agentes estimulantes de la eritropoyesis (AEE) en pacientes de diálisis se demostró en 1986 (Winearls 1986) y varios ensayos controlados aleatorios (ECA) han documentado un efecto beneficioso del tratamiento con AEE para corregir la anemia de los pacientes con NC no sometidos a diálisis (Cody 2005; Stone 1988).
El aumento de los niveles de Hb después del tratamiento con AEE mejora los niveles de energía (Wolcott 1989), mejora el rendimiento cardíaco y aumenta la fracción de expulsión (Pappas 2008) con normalización del gasto cardíaco y reducción de la masa ventricular izquierda (Cannella 1990). Los efectos beneficiosos del tratamiento inicial de la anemia con AEE en los pacientes de prediálisis incluyen aumento en la capacidad de ejercicio, mejoría en la calidad de vida, mejoría de la función cognitiva y disminución más lenta de la función renal (Ritz 2000; Roth 1994).
Descripción de la intervención
La administración de un AEE procura reemplazar la producción de EPO endógena, aumentar los niveles de Hb y aliviar los signos y los síntomas de la anemia. La epoetina alfa tiene una eficacia comprobada en el tratamiento de la anemia en los pacientes con NC (Eschbach 1987). La epoetina alfa tiene una vida media relativamente corta y habitualmente se administra dos o tres veces por semana (Locatelli 2011). Más recientemente se han desarrollado nuevos AEE de acción más prolongada que se pueden administrar con menor frecuencia que los AEE de acción corta, lo que permite la administración de AEE cada una a cuatro semanas según la preparación utilizada y la respuesta individual del paciente. La darbepoyetina fue el primer AEE con una vida media prolongada en entrar a formar parte del mercado, lo que permitió la administración desde una vez a la semana hasta cuatro veces por semana (Macdougall 1999). Más recientemente, la administración del activador continuo del receptor EPO (CERA, por sus siglas en inglés), una epoetina pegilada, ha ampliado los intervalos de dosis a una dosis cada dos a cuatro semanas (Macdougall 2005). Los AEE se deben administrar intravenosa o subcutáneamente, por lo que los beneficios de administrar AEE a los pacientes con NC no sometidos a diálisis, que generalmente recibirán inyecciones subcutáneas en ámbitos de pacientes ambulatorios, se deben equilibrar contra la incomodidad o el malestar de las inyecciones, así como con los posibles efectos perjudiciales de los AEE que incluyen hipertensión, trombosis en el acceso vascular y eventos cardiovasculares. Una preocupación significativa en el tratamiento con AEE es el nivel objetivo de Hb a lograr. El estudio CHOIR informó que un nivel objetivo de Hb de 13,5 g/dl en comparación con 11,3 g/dl se asoció con un aumento en la mortalidad y el riesgo cardiovascular y ninguna mejoría considerable en la calidad de vida. El estudio no pudo proporcionar una explicación para la ocurrencia de resultados más deficientes en los pacientes con un nivel objetivo de Hb mayor (Singh 2006). Las recomendaciones sobre cuándo comenzar el tratamiento con AEE se esbozan en las guías KDIGO (KDIGO 2012). Como las patentes de la epoetina alfa han caducado, se han desarrollado productos biosimilares más baratos de epoetina alfa. Estos productos biológicos son muy similares, aunque no idénticos, a los productos de referencia y se someten a una evaluación más limitada antes de recibir la aprobación para la comercialización. Como no son versiones genéricas de los productos de referencia y podrían tener diferencias, en particular en los efectos adversos, estos productos se deben someter a una evaluación rigurosa antes de la comercialización y a monitorización a largo plazo para asegurar que se identifican los efectos adversos y se atribuyen a la preparación biológica responsable (Mikhail 2013; Schellekens 2009).
De qué manera podría funcionar la intervención
La causa primaria de anemia en la NC es la insuficiencia relativa de EPO que se produce principalmente por los fibroblastos peritubulares en el riñón. La EPO forma parte de un sistema generalizado de la expresión de genes inducibles por hipoxia mediada mediado por factores de transcripción inducibles por hipoxia (HIF, por sus siglas en inglés). Los factores asociados con la producción insuficiente de EPO en la NC progresiva todavía no están claros, aunque datos recientes indican que, además de la pérdida de la producción EPO, está implicado un trastorno en la detección del oxígeno (Bernhardt 2010). Los AEE aceleran la eritropoyesis, aumentan la utilización del hierro y elevan los niveles de Hb, con una mejoría clínica en los signos y síntomas de anemia, a la vez que evitan las transfusiones de sangre. El tratamiento con AEE tiene como objetivo aumentar los niveles de Hb lentamente a una tasa de 1 a 2 g/dl por mes para corregir la anemia. Después de la corrección de la anemia puede ser necesario el ajuste de la dosis para mantener un nivel de Hb estable. Con los AEE la anemia se corrige lentamente para evitar efectos secundarios graves que incluyen hipertensión y eventos trombóticos. Los requerimientos de AEE son difíciles de predecir en los pacientes individuales y pueden aumentar en los pacientes con comorbilidades asociadas que incluyen enfermedades cardiovasculares, diabetes, inflamación crónica e hiperparatiroidismo secundario grave. Los requerimientos de AEE son generalmente inferiores en los pacientes que no reciben diálisis. Un problema principal en cuanto al uso de los AEE se relaciona con un nivel objetivo de Hb a lograr, debido a que se observa un aumento del riesgo cardiovascular con niveles objetivos de Hb más elevados (Drueke 2006; Singh 2006). Revisiones sistemáticas recientes han indicado que centrar la atención en niveles de Hb similares a los observados en adultos sanos se asocia con un riesgo significativamente mayor de mortalidad debido a eventos cardiovasculares como accidente cerebrovascular e hipertensión (Palmer 2010). Los mecanismos para estos efectos perjudiciales relacionados con el tratamiento se comprenden poco, aunque estudios observacionales indican toxicidad relacionada con el tratamiento secundaria a respuestas deficientes de la Hb y a dosis graduales de eritropoyetina (Szczech 2008). Las guías KDIGO (KDIGO 2012) recomiendan que en general los AEE no se deben administrar para elevar los niveles de Hb más allá de 11,5 g/dl.
Por qué es importante realizar esta revisión
En una revisión sistemática Cochrane anterior que incluyó 15 ECA, la rHuEPO (epoetina alfa) aumentó significativamente los niveles de Hb (dos estudios) o hematócrito (HCT) (cinco estudios) en comparación con placebo o ningún tratamiento y redujo significativamente los requerimientos de transfusión de sangre (Cody 2005). Determinar el AEE a utilizar debe incluir la evaluación de la farmacodinamia, la farmacocinética, la vía y la frecuencia de administración, los efectos adversos, la disponibilidad y cualquier aspecto económico (KDIGO 2012). En la mayoría de los países de ingresos altos, la administración de AEE de acción corta (epoetina alfa, epoetina beta) en pacientes con NC se ha reemplazado por los AEE de acción más prolongada (darbepoyetina, CERA) debido a la reducción de la frecuencia de administración. En los países de ingresos bajos donde los AEE de acción más prolongada más nuevos tienen menores probabilidades de estar accesibles, los médicos pueden estar limitados a administrar los AEE de acción corta. El costo de utilizar los AEE más nuevos se tendría que sopesar contra los costos y la incomodidad de la administración más frecuente. Debido a que la eficacia y la seguridad de la rHuEPO comparada con placebo o ningún tratamiento ya se ha demostrado (Cody 2005), esta revisión tiene como objetivo evaluar los AEE de acción corta (epoetina alfa, epoetina beta, otras epoetinas o productos biosimilares de epoetina) en pacientes adultos y niños con NC no sometidos a diálisis (NC estadios 2 a 5) con respecto a la vía de administración (intravenosa versus subcutánea), la frecuencia de administración, diferentes dosis y comparaciones directas de diferentes epoetinas para proporcionar información adicional acerca del valor de estos agentes en las instituciones donde se utilizan AEE de acción corta.
Esta revisión no evaluará los estudios que comparen los AEE de acción corta con los de acción más prolongada para la NC, diferentes AEE de acción más prolongada para la NC, diferentes vías de administración en los pacientes en diálisis o receptores de trasplante renales y diferentes niveles objetivos de Hb, ya que son temas de otras revisiones sistemáticas Cochrane publicadas o planificadas (Hahn 2014; Palmer 2012; Palmer 2014a; Palmer 2014b; Strippoli 2006).
Objetivos
Esta revisión procuró evaluar los efectos beneficiosos y perjudiciales de diferentes vías, frecuencias y dosis de las epoetinas (epoetina alfa, epoetina beta y otras epoetinas de acción corta) para la anemia en adultos y niños con NC no sometidos a diálisis.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todos los ECA y ensayos controlados cuasialeatorios (ECA en los que la asignación al tratamiento se realizó por alternancia, uso de historias clínicas alternas, fecha de nacimiento u otros métodos previsibles) que analizaron las epoetinas (AEE de acción corta) para el tratamiento de la anemia en pacientes con NC no sometidos a diálisis.
Tipos de participantes
Criterios de inclusión
Se incluyeron pacientes de cualquier edad (adultos y niños) con anemia debido a NC (estadios 2 a 5) de cualquier gravedad, no sometidos a diálisis. En esta revisión, se aplicaron las definiciones de NC y anemia utilizadas en los estudios individuales.
Criterios de exclusión
Pacientes de cualquier edad que recibían tratamiento con diálisis. Se excluyeron los pacientes que recibían AEE de acción prolongada o que estaban incluidos en estudios que comparaban AEE de acción más corta con AEE de acción más prolongada. También se excluyeron los receptores de trasplantes renales.
Tipos de intervenciones
-
AEE de acción corta incluidas las epoetinas alfa (Eprex®, Procrit®, Epogen®), beta (Recormin®), delta (Dynepo®), epoetina theta (Biopoin®) y productos biosimilares a la epoetina alfa (HX575, EPO‐ hexal®, Abseamed®), epoetina zeta (Silapo®, Retacrit®, Epoetin Hospira®)
-
AEE de acción corta incluidas las epoetinas con diferentes vías de administración
-
AEE de acción corta incluidas las epoetinas usadas en diferentes frecuencias de administración
-
AEE de acción corta incluidas las epoetinas usadas en diferentes dosis
-
Comparaciones directas de diferentes AEE de acción corta.
Tipos de medida de resultado
Resultados primarios
-
Muerte
-
Mortalidad por todas las causas
-
Mortalidad por enfermedades cardíacas o eventos cerebrovasculares
-
-
Medidas de corrección de la anemia
-
Valores de Hb/HCT o el cambio en la Hb/HCT al final del estudio
-
-
Calidad de vida.
Resultados secundarios
-
Resultados sobre la presión sanguínea y la hipertensión
-
Hipertensión (número de pacientes que presentaron uno o más episodios de hipertensión)
-
Presión arterial sistólica al final del tratamiento (mm Hg)
-
Presión arterial diastólica al final del tratamiento (mm Hg).
-
-
Morbilidad cardiovascular
-
Morbilidad cerebrovascular
-
Efectos adversos
-
Número de pacientes que necesitaron una transfusión de sangre
-
Eventos trombóticos
-
Número de pacientes que interrumpieron la AEE debido a los efectos adversos
-
Número de pacientes que requieren hospitalizaciones por cualquier causa
-
Número de pacientes que desarrollaron aplasia pura de eritrocitos mediada por anticuerpos
-
Número de pacientes que desarrollaron una neoplasia maligna.
-
-
Medidas de función renal (TFG, creatinina sérica [CrS], duplicación de la CrS) como las informaron los autores de los estudios primarios
-
Necesidad de suplementos de hierro.
Results
Description of studies
Results of the search
Seventy‐three reports were identified from the search to 12 September 2016. After title and abstract screening 22 reports were excluded. Full‐text review was carried out the remaining 51 reports. Fourteen studies (30 reports) (Aggarwal 2002; Akiba 1992; Amon 1992; Frenken 1989; Gertz 2012; Haag‐Weber 2012; Knebel 2008; Kronborg 1994; Mignon 2000; Pergola 2009; Pergola 2010; PROMPT Study 2005; Sohmiya 1998; Spinowitz 2008) were included and 17 studies (19 reports) (Brown 1988; Clyne 1992; Duliege 2005; Furukawa 1992; Li 2004; Meloni 2003; NCT00240734; NCT00492427; NCT00563355; Patel 2012; Schwartz 1989; Shaheen 1983; Singh 1999; Teehan 1990; Teplan 1995; Yamazaki 1993; Zheng 1992) were excluded. Two recently completed studies (NCT01576341; NCT01693029) will be assessed in a future update of this review (Figure 1).

Study flow diagram.
Included studies
The 14 studies were divided into four treatment comparisons groups (Figure 1).
Epoetin alpha or beta administered at different frequencies using the same total dose
Six studies (Amon 1992; Pergola 2009; Pergola 2010; PROMPT Study 2005; Sohmiya 1998; Spinowitz 2008) (1613 enrolled/1585 evaluated participants) compared epoetin alpha or beta at different frequencies using the same total dose in each group.
-
Four studies (Pergola 2009; Pergola 2010; PROMPT Study 2005; Spinowitz 2008) with 840 enrolled (838 analysed) participants compared epoetin alpha administered at 10,000IU per week with 20,000IU given every two weeks.
-
Three studies (Pergola 2010; PROMPT Study 2005; Spinowitz 2008) with 724 analysed participants also compared epoetin alpha administered at 20,000 IU every two weeks with 40,000 IU every four weeks.
-
Amon 1992 (22 enrolled, 18 evaluated) compared subcutaneous epoetin alpha 50 IU/kg three times a week with 150 IU/kg given once weekly in children.
-
Sohmiya 1998 (5 enrolled, 5 evaluated) compared continuous infusion of epoetin beta with weekly subcutaneous injections for four weeks using the same total dose in each group in a cross over study.
Epoetin alpha administered at the same frequency using different total doses
Three studies (Akiba 1992; Frenken 1989; Spinowitz 2008) (339 enrolled/333 analysed participants) compared epoetin alpha at different doses but at the same frequencies.
-
Spinowitz 2008 (150 enrolled/144 evaluated) compared 20,000 IU given four weekly with 40 000IU given four weekly
-
Akiba 1992 (165 enrolled and evaluated) compared 3000 IU, 6000 IU and 12 000 IU given weekly to three groups
-
Frenken 1989 (24 enrolled and evaluated) compared 50 IU/Kg, 100 IU/kg and 150 IU/Kg given three times weekly.
Epoetin alpha intravenous versus subcutaneous administration
-
Aggarwal 2002 (20 participants enrolled and evaluated) compared subcutaneous with intravenous administration of epoetin alpha.
Epoetin alpha or beta versus other epoetins or biosimilars of epoetin alpha
Five studies Gertz 2012; Haag‐Weber 2012; Knebel 2008;Kronborg 1994; Mignon 2000) (794 participants) were included in this comparison.
-
Gertz 2012 (288 enrolled and evaluated) compared weekly subcutaneous epoetin theta with epoetin beta
-
Haag‐Weber 2012 (337 enrolled) compared a bio‐similar HX575 epoetin alpha with epoetin alpha (Eprex). This study was terminated due to the development of neutralising antibodies in two patients receiving subcutaneous HX575. Efficacy could not be assessed because the authors did not provide the number of patients, who contributed data to efficacy endpoints. Limited safety data were available.
-
Two studies (Mignon 2000, Knebel 2008) (140 enrolled) compared subcutaneous administration of epoetin delta with epoetin alpha. Both studies were terminated before completion when the pharmaceutical company ceased production of epoetin delta for commercial reasons and no data were available.
-
Kronborg 1994 (29 enrolled and evaluated) compared pain scores in participants treated with epoetin alpha or epoetin beta given subcutaneously using a visual analogue scale (VAS) and a verbal descriptive scale (VDS). As the results included a median with inter‐quartile ranges the data could not be included in a meta‐analysis.
Excluded studies
Seventeen studies were excluded. Eleven studies were ineligible as they compared a short‐acting ESA with placebo or no treatment (Brown 1988; Clyne 1992; Meloni 2003; NCT00240734; NCT00563355; Patel 2012; Schwartz 1989; Shaheen 1983; Singh 1999; Teehan 1990; Teplan 1995). NCT00492427 compared short‐acting ESA with the long acting ESA, darbepoetin and this study is included in another review (Palmer 2014b). Three studies assessed other interventions, or were pharmacokinetic studies (Duliege 2005; Furukawa 1992; Li 2004). Randomisation was unclear in two studies (Yamazaki 1993; Zheng 1992).
Risk of bias in included studies
The results of the risk of bias assessment are shown in Figure 2 and Figure 3.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Sequence generation was deemed at low risk of bias in three studies (Gertz 2012; PROMPT Study 2005; Spinowitz 2008) and unclear in the remaining eleven studies (Aggarwal 2002; Akiba 1992; Amon 1992; Frenken 1989; Haag‐Weber 2012; Knebel 2008; Kronborg 1994; Mignon 2000; Pergola 2009; Pergola 2010; Sohmiya 1998).
Allocation concealment was at low risk of bias in two studies (Gertz 2012; Spinowitz 2008) and unclear in the remaining twelve studies (Aggarwal 2002; Akiba 1992; Amon 1992; Frenken 1989; Haag‐Weber 2012; Knebel 2008; Kronborg 1994; Mignon 2000; Pergola 2009; Pergola 2010; PROMPT Study 2005; Sohmiya 1998).
Blinding
Only one study (Gertz 2012) was blinded and considered to be at low risk of bias for performance bias. Ten studies were not blinded and determined as high risk of performance bias (Aggarwal 2002; Amon 1992; Frenken 1989; Haag‐Weber 2012; Knebel 2008; Pergola 2009; Pergola 2010; PROMPT Study 2005; Sohmiya 1998; Spinowitz 2008). Blinding was unclear in the remaining three studies (Akiba 1992; Kronborg 1994; Mignon 2000).
As the primary outcomes (final Hb level or change in Hb level) in all studies were based on laboratory assessment, and therefore unlikely to be influenced by blinding, 13 studies were deemed to be at low risk of detection bias. The study by Kronborg 1994 was considered at unclear risk of detection bias; it assessed pain scores and was said to be double‐blinded though no information was provided as to how this was performed.
Incomplete outcome data
Eight studies were determined to be at low risk of attrition bias (Aggarwal 2002; Gertz 2012; Kronborg 1994; Pergola 2009; Pergola 2010; PROMPT Study 2005; Sohmiya 1998; Spinowitz 2008). Four studies were at high risk of bias because meta‐analyses could not be performed as total patient numbers were not provided (Akiba 1992; Haag‐Weber 2012; Knebel 2008) or because more than 10% patients were excluded from analysis (Amon 1992). Attrition bias was deemed unclear in the remaining two studies (Frenken 1989; Mignon 2000).
Selective reporting
Studies that did not provide data on final or change in Hb and on patient‐centred outcomes including adverse events such as blood transfusions, vascular access complications or all‐cause mortality were considered to be at high risk for selective reporting. Eight studies were considered at high risk of reporting bias (Aggarwal 2002; Akiba 1992; Amon 1992; Haag‐Weber 2012; Knebel 2008; Kronborg 1994; Mignon 2000; Sohmiya 1998). Six studies (Amon 1992; Gertz 2012; Pergola 2009; Pergola 2010; PROMPT Study 2005; Spinowitz 2008) were assessed at low risk for selective reporting.
Other potential sources of bias
Only two studies were assessed at free of other potential bias sources (Frenken 1989; Sohmiya 1998). Eight studies were industry funded and determined as at high risk of bias (Gertz 2012; Haag‐Weber 2012; Knebel 2008; Mignon 2000; Pergola 2009; Pergola 2010; PROMPT Study 2005; Spinowitz 2008). In the remaining four studies it was unclear whether the study was free of other potential sources of bias (Aggarwal 2002; Akiba 1992; Amon 1992; Kronborg 1994).
Effects of interventions
See: Summary of findings for the main comparison Epoetin alpha every 2 weeks versus to weekly for anaemia in CKD patients not receiving dialysis; Summary of findings 2 Epoetin alfa every four weeks versus with every two weeks in CKD patients not receiving dialysis; Summary of findings 3 Epoetin theta versus epoetin beta in CKD patients not receiving dialysis
Epoetin alpha administered at different frequencies using the same total dose
Six studies investigated this comparison (Amon 1992; Pergola 2009; Pergola 2010; PROMPT Study 2005; Sohmiya 1998; Spinowitz 2008).
Epoetin alpha weekly versus every two weeks using same total dose of epoetin
In meta‐analyses of four non‐inferiority studies (Pergola 2009; Pergola 2010; PROMPT Study 2005; Spinowitz 2008), final Hb levels (Analysis 1.1 (4 studies, 785 participants): MD ‐0.20 g/dL, 95% CI ‐0.33 to ‐0.07) and the number achieving target Hb were statistically significantly higher in patients receiving weekly doses compared with two weekly doses (Analysis 1.2 (4 studies, 798 participants): RR 0.96, 95% CI 0.93 to 0.99). The differences were not considered to be clinically significant. No significant heterogeneity was noted.
There were no significant difference in all‐cause mortality (Analysis 1.3 (4 studies, 838 participants): RR 0.89, 95% CI 0.38 to 2.07), the number requiring transfusion (Analysis 1.4.1 (3 studies, 580 participants): RR 1.56, 95% CI 0.71 to 3.45), the number with hypertension (Analysis 1.4.2 (4 studies, 838 participants): RR 0.85, 95% CI 0.55 to 1.32), the number with thrombovascular complications Analysis 1.4.3 (4 studies, 838 participants): RR 1.41, 95% CI 0.67 to 3.00) or the number discontinuing therapy due to adverse effects (Analysis 1.4.4 (1 study, 258 participants): RR 0.98, 95% CI 0.20 to 4.79).
No neutralising antibodies were detected in study participants in Pergola 2009 and Pergola 2010. Most of the deaths were due to cardiovascular complications reflecting the underlying cardiovascular morbidity of the population studied. Only one study (PROMPT Study 2005) performed quality of life (QOL) assessments and reported no statistical differences in the final QOL scores between groups receiving epoetin once weekly or two weekly.
Epoetin alpha every two weeks versus every four weeks using same total dose of epoetin
In meta‐analyses of three non‐inferiority studies (Pergola 2010; PROMPT Study 2005; Spinowitz 2008), there were no significant differences in final Hb levels (Analysis 2.1 (3 studies, 671 participants): MD ‐0.16 g/dL, 95% CI ‐0.43 to 0.10; I2 = 63%) or in the number reaching target Hb levels (Analysis 2.2 (3 studies, 687 participants): RR 0.95, 95% CI 0.84 to 1.07) with dosing every two weeks compared with every four weeks. There was unexplained marked heterogeneity between these studies.
There were no significant differences in all‐cause mortality (Analysis 2.3 (3 studies, 724 participants): RR 0.95, 95% CI 0.33 to 2.75), the number requiring transfusions (Analysis 2.4.I (2 studies, 470 participants): RR 1.26, 95% CI 0.53 to 2.98); the number with hypertension (Analysis 2.4.2 (3 studies, 724 participants): RR 1.02, 95% CI 0.62 to 1.69); and the number with thrombovascular complications (Analysis 2.4.3 (3 studies, 724 participants): RR 1.02, 95% CI 0.39 to 2.68). PROMPT Study 2005 noted no difference in final QOL scores between participants who received epoetins at two weekly or four weekly intervals.
Other studies
Amon 1992 found that the time to reach a Hb level greater than 11.5 g/dL were significantly longer with weekly administration (15.6 weeks) compared with thrice weekly administration (9.3 weeks). Adverse effects were uncommon and did not differ between groups and there was no deterioration in glomerular filtration rate across the two groups. However there was no significant difference in mean dose/week to sustain Hb levels between different frequencies of administration.
Sohmiya 1998 in a cross‐over study found that continuous subcutaneous infusion of epoetin beta resulted in a significantly greater increase in Hb levels compared with weekly subcutaneous injections (2.56 ± 0.77 g/dL versus 0.28 ± 0.62 g/dL, P < 0.05)
Epoetin alpha administered at same frequency using different total doses
Three studies reported on this comparison (Akiba 1992; Frenken 1989; Spinowitz 2008)
Epoetin alpha different doses given three times weekly
Frenken 1989 reported no statistical significance in the final Hb in groups which received 100 IU/kg/dose (Analysis 3.1.1 (1 study, 16 participants): MD 0.70 g/dL, 95% CI ‐0.78 to 2.18) or 150 IU/kg/dose (Analysis 3.1.2 (1 study, 16 participants): MD 1.00 g/dL, 95% CI ‐0.18 to 2.18) compared with 50 IU/kg/dose. Final mean arterial blood pressures and serum creatinine levels did not differ between subgroups (Analysis 3.2; Analysis 3.3). No anti‐erythropoietin antibodies were detected in the study participants. The study reported overall improvement in well‐being in all participants receiving epoetin.
Epoetin alpha different doses given every four weeks
Spinowitz 2008 reported no significant difference in the final Hb level (Analysis 4.1 (1 study, 144 participants): MD 0.17 g/dL 95% CI ‐0.19 to 0.53) and the number reaching target Hb (Analysis 4.2 (1 study, 144 participants): RR 1.07, 95% CI 0.92 to 1.24) when epoetin alpha was administered at 20,000 U compared with 40,000 U every four weeks. There was no significant difference in all‐cause mortality (Analysis 4.3.1), the number with hypertension (Analysis 4.4.1), thrombovascular complications (Analysis 4.4.2) or number of patients requiring transfusions (Analysis 4.4.3).
Epoetin alpha different doses given every week
Akiba 1992 reported that 6000 IU and 12,000 IU given weekly increased HCT levels more than 3000 IU/week. No standard deviations were provided.
Epoetin alpha intravenous versus subcutaneous administration
Aggarwal 2002 reported no significant difference in final Hb at 12 weeks (Analysis 5.1 (20 participants): MD ‐0.99 g/dL, 95% CI ‐2.08 to 0.10) between intravenous and subcutaneous administration of epoetin alpha.
Epoetin alpha versus other epoetins or biosimilars
Five studies compared epoetin alpha with other epoetins or biosimilars.
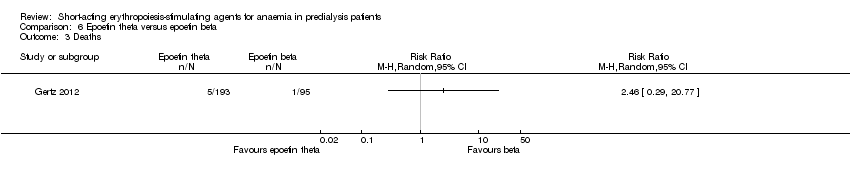
Gertz 2012 found no significant differences in final Hb (Analysis 6.1 (288 participants): MD ‐0.02 g/dL, 95% CI ‐0.25 to 0.21) and weekly epoetin doses (Analysis 6.2 (288 participants) MD 0.40 U/kg, 95% CI ‐5.68 to 6.48) between epoetin theta and epoetin beta. No significant differences were noted in all‐cause mortality (Analysis 6.3 (288 participants): RR 2.46, 95% CI 0.29 to 20.77), hypertension (Analysis 6.4.1 (288 participants): RR 0.35, 95% CI 0.11 to 1.08); transfusions (Analysis 6.4.2 (288 participants): RR 1.48, 95% CI 0.06 to 36.10) and discontinuation of therapy (Analysis 6.4.3 (288 participants): RR 1.77, 95% CI 0.68 to 4.63). No neutralising antibodies were noted in either intervention group. Most of the deaths were due to cardiovascular complications reflecting the population studied.
The quality of this single study was assessed as moderate for the surrogate outcome of final Hb but as low for mean weekly epoetin dose because of imprecision (summary of findings Table 3). The quality of evidence for patient‐centred outcomes was assessed as low for all‐cause mortality, need for blood transfusion and discontinuation of medications and moderate for hypertension because of imprecision due to small numbers of events
Haag‐Weber 2012 (337 participants) compared the biosimilar HX575 epoetin alpha with epoetin alpha; both medications were administered subcutaneously. The study was ceased when two patients receiving HX575 developed antibodies to epoetin and pure red cell aplasia and HX575 epoetin alpha was withdrawn for subcutaneous administration. The change in Hb from baseline at 13 weeks did not differ between groups (HX575 2.2 ± 0.9 g/dL; epoetin alpha 2.2 ± 1.0 g/dL) but the data could not be included in meta‐analyses since no denominators were provided and information could not be obtained from the authors.
Mignon 2000 (65 participants) found no significant differences in response between epoetin delta and epoetin alpha when both were given at the same dose (50 IU/kg/wk). Adverse events were similar between epoetin delta and epoetin alpha. No data were available from Knebel 2008 (60 participants). Since epoetin delta production was ceased for commercial reasons and no information could be obtained from the pharmaceutical company, no meta‐analyses were performed.
Kronborg 1994 (29 participants) found that pain scores were higher in participants treated with subcutaneous epoetin alpha compared with epoetin beta. The results were provided as median with inter‐quartile ranges so could not be included in a meta‐analysis.
Other outcomes
From the available studies, we were not able to analyse the outcomes of causes of death, cardiovascular and cerebrovascular morbidity, kidney function, number of hospitalisations, additional requirement for IV iron, serious infections, or de novo malignancies.
Discusión
Resumen de los resultados principales
En esta revisión se incluyeron 14 estudios (30 informes) con 2616 participantes que evaluaron la eficacia y la seguridad de los AEE de acción corta en pacientes con NC que no requerían diálisis.
Seis estudios (1613 participantes reclutados) compararon la epoetina alfa o la epoetina beta a diferentes frecuencias con el uso de la misma dosis total en cada grupo, y dos estudios no tuvieron suficientes datos para la inclusión en los metanálisis. En cuatro estudios no se identificaron diferencias significativas en la Hb al final del estudio en el número de participantes que lograron niveles objetivos de Hb, en la mortalidad por todas las causas o en los efectos adversos cuando la dosis cada dos semanas se comparó con la dosis semanal o cuando la dosis de cuatro veces por semana se comparó con la dosis de dos veces por semana. Estos datos indican que a los pacientes con NC que no requieren diálisis se les pueden administrar dosis más grandes de epoetinas de acción corta con menor frecuencia sin una pérdida de la eficacia ni un aumento de los efectos adversos. Sin embargo, esta conclusión se basa en pruebas de baja calidad (Resumen de los hallazgos para la comparación principal; Resumen de los hallazgos 2). Tres estudios (incluido Spinowitz 2008, en el que también se evaluaron diferentes frecuencias) compararon diferentes dosis totales de epoetina alfa a la misma frecuencia, aunque sólo se pudieron incluir en los metanálisis los datos de dos estudios. Ambos estudios no encontraron diferencias significativas en la Hb final ni en los efectos adversos con diferentes dosis totales.
Los cinco estudios restantes evaluaron diferentes intervenciones. Un estudio (288 participantes) comparó la epoetina theta con la epoetina alfa y no encontró diferencias significativas en la eficacia ni los efectos adversos. Dos estudios (125 participantes) compararon epoetina delta con epoetina alfa. Sin embargo no hubo resultados disponibles, ya que la compañía farmacéutica retiró la epoetina delta por razones comerciales. El cuarto estudio finalizó antes de completarse después que dos pacientes que recibían una epoetina biosimilar, epoetina alfa HX575, desarrollaron anticuerpos antiepoetina y aplasia pura de eritrocitos. El quinto estudio encontró puntuaciones del dolor significativamente mayores con la epoetina alfa subcutánea en comparación con la epoetina beta.
Compleción y aplicabilidad general de las pruebas
En esta revisión sólo fue posible identificar 14 estudios (2616 participantes) que evaluaron diferentes frecuencias, dosis o vías de administración de las mismas epoetinas o compararon epoetinas diferentes en pacientes de prediálisis. Sólo siete estudios contribuyeron con datos a los metanálisis y dos de estos estudios sólo reclutaron 20 y 24 pacientes, respectivamente. Dos estudios evaluaron a niños y tampoco tuvieron datos suficientes para la inclusión en los metanálisis. Dos estudios finalizaron antes de completarse y no tuvieron datos disponibles, ya que la compañía farmacéutica interrumpió la producción de epoetina delta por razones comerciales. Un estudio finalizó cuando dos pacientes desarrollaron aplasia pura de eritrocitos mediada por anticuerpos con la epoetina alfa HX575, una epoetina biosimilar. No se identificaron estudios en pacientes de prediálisis que evaluaran epoetina alfa HX575 administrada por vía intravenosa, o SB309 (epoetina zeta) administrada por vía intravenosa o subcutánea. La European Medicines Agency ha aprobado para su uso estas epoetinas biosimilares. La información preliminar indica que SB309 (epoetina zeta, Epoetina Hospira®) no se ha aprobado para su uso en los EE.UU. (Big Molecule Watch Blog 2015).
Por lo general, los resultados centrados en el paciente se informaron de manera deficiente. Sólo un estudio informó una evaluación de la calidad de vida y no se identificaron diferencias en las puntuaciones de calidad de vida al final del estudio entre diferentes frecuencias de administración de la epoetina alfa (PROMPT Study 2005). Seis estudios informaron sobre la mortalidad por todas las causas. Sólo se pudieron incluir en los metanálisis los datos de cinco estudios sobre hipertensión y eventos trombovasculares, efectos adversos que se conoce se asocian con la administración de epoetina. Los datos de cuatro estudios sobre el número de participantes que requirieron transfusiones de sangre se pudieron incluir en los metanálisis. Los anticuerpos antieritropoyetina, que pueden provocar aplasia pura de eritrocitos, se evaluaron sólo en cinco estudios.
Calidad de la evidencia
De los catorce estudios incluidos en esta revisión, cuatro estaban disponibles sólo en forma de resumen.
Sólo tres de 14 estudios presentaron una generación de la secuencia de asignación al azar adecuada, y en sólo dos el riesgo de sesgo de ocultación de la asignación se consideró bajo. El riesgo de sesgo del cegamiento de los participantes y el personal fue bajo en un estudio solamente. El cegamiento de la evaluación de resultado se consideró en bajo riesgo en 13 estudios ya que las medidas de resultado se basaron en el laboratorio. Hubo bajo riesgo de sesgo de desgaste y de informe en ocho y siete estudios respectivamente (Figura 3).
Sólo fue posible incluir cinco de 14 estudios en las tablas "Resumen de los hallazgos", ya que otras comparaciones incluyeron solamente estudios únicos pequeños o proporcionaron datos que no se pudieron incluir en los metanálisis. En general la calidad de los estudios (GRADE 2011a; GRADE 2011b) incluidos en los metanálisis se consideró baja, lo que indica que la confiabilidad en los resultados es significativamente baja debido a la calidad deficiente de los estudios y al uso de resultados alternativos como resultados primarios en los estudios incluidos.
La calidad de los estudios incluidos en los metanálisis que comparan la epoetina alfa cada dos semanas con la administración semanal ("Resumen de los hallazgos para la comparación principal") y en los metanálisis que comparan la epoetina alfa cada cuatro semanas con la administración dos veces por semana ("Resumen de los hallazgos 2") para los resultados de eficacia del cambio en el nivel de Hb y el número que alcanza el nivel objetivo de Hb se consideró baja o muy baja. La calidad de estos estudios de disminuyó por la indireccionalidad según el perfil GRADE, ya que fueron resultados alternativos y no resultados centrados en el paciente. En la comparación de la epoetina alfa administrada cada cuatro semanas en comparación con cada dos semanas los resultados se disminuyeron aún más debido a la heterogeneidad marcada no explicada. Además, la calidad de las pruebas para la eficacia se disminuyó debido al diseño y al informe deficiente de los estudios, en particular la generación de la secuencia y la ocultación de la asignación, y por la imprecisión, ya que el escaso número de eventos dio lugar a intervalos de confianza amplios. Los resultados para los efectos adversos se disminuyeron debido al diseño deficiente de los estudios y a la imprecisión.
La calidad del único estudio incluido en los metanálisis que comparó la epoetina theta con la epoetina beta se consideró moderada para el resultado alternativo Hb final, pero se consideró baja para la dosis media de epoetina semanal debido a la imprecisión (Resumen de los hallazgos 3). La calidad de las pruebas para los resultados centrados en el paciente se consideró baja para la mortalidad por todas las causas, la necesidad de transfusión de sangre y la interrupción de los fármacos, y se consideró moderada para la hipertensión debido a la imprecisión por el escaso número de eventos.
Sesgos potenciales en el proceso de revisión
Para esta revisión, se realizó una búsqueda exhaustiva en el registro especializado Cochrane de Riñón y Trasplante, lo que redujo la probabilidad de que los estudios publicados elegibles se omitieran en la revisión. Se podrían haber perdido estudios elegibles publicados después de la última fecha de búsqueda del 12 de septiembre de 2016 o publicados en actas de congresos que no se examinaron de forma sistemática. Cuatro estudios sólo estaban disponibles en forma de resumen, lo que proporcionó información limitada sobre los métodos de estudio y los resultados. La inclusión de estos estudios podría ser una fuente de sesgo.
La revisión fue completada de manera independiente por al menos tres autores, quienes participaron en todas las etapas de la revisión. Lo anterior limitó el riesgo de errores en la determinación de la elegibilidad de los estudios, la extracción de los datos, la evaluación del "riesgo de sesgo" y la síntesis de los datos.
Muchos de los estudios anteriores de epoetina alfa fueron pequeños, con información incompleta sobre los métodos de estudio y los resultados. No se pudo obtener más información acerca de estos estudios de los investigadores ni de la literatura.
Aunque seis de los estudios incluidos fueron patrocinados por compañías farmacéuticas, fueron estudios multicéntricos , por lo que pudieron reclutar números más grandes de pacientes. Los datos por protocolo de dos de estos estudios se incluyeron en los metanálisis para los resultados primarios Hb final o cambio en la Hb, ya que los datos por intención de tratar sólo se presentaron gráficamente. En ambos estudios los autores informaron que los análisis de sensibilidad con el uso de las poblaciones por intención de tratar fueron consistentes con los de las poblaciones por protocolo, lo que aumentó la confiabilidad en los resultados.
Acuerdos y desacuerdos con otros estudios o revisiones
No se identificaron pruebas en el grupo de trabajo KDIGO que indicaran que cualquier tipo de AEE administrado fue superior a otro en cuanto a eficacia y seguridad (KDIGO 2012). El Grupo de Trabajo indicó que la elección del AEE dependió de aspectos específicos de los pacientes y del país que incluyeron la disponibilidad, el costo y el contexto del tratamiento. Las guías NICE 2015 (NICE 2015) indican que la elección del AEE se debe analizar con el paciente con anemia y NC cuando el paciente inicia el tratamiento, y considerar la vía de administración y la disponibilidad local de AEE. No hay pruebas para distinguir entre los AEE en cuanto a la eficacia. Los hallazgos de esta revisión sistemática confirman estas recomendaciones.
Los resultados de esta revisión complementan otras revisiones de AEE del Grupo Cochrane de Riñón y Trasplante que incluyen una revisión actualizada que compara la epoetina en pacientes de prediálisis con placebo o ningún tratamiento específico (Cody 2016), una revisión que evalúa los efectos beneficiosos y perjudiciales de diferentes niveles objetivos de Hb o de HCT en pacientes con NC que reciben tratamiento con AEE para la anemia (Strippoli 2006), una revisión que evalúa la darbepoyetina (Palmer 2014b) y un metanálisis de redes de estudios con cualquier formulación de AEE (Palmer 2014a). Aunque los AEE reducen claramente la necesidad de transfusión de sangre, ninguna revisión sistemática hasta la fecha ha encontrado pruebas claras de la superioridad de cualquier formulación de AEE sobre otra formulación según los datos de eficacia y seguridad disponibles.
Para los pacientes, los médicos y los financiadores las consideraciones como el costo del fármaco y la disponibilidad y las preferencias sobre la frecuencia de la dosis se deben considerar la base para individualizar la atención de la anemia, debido a la falta de datos sobre las diferencias comparativas en los efectos clínicos beneficiosos y perjudiciales de las distintas preparaciones de AEE.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.

Comparison 1 Epoetin alpha every 2 weeks versus weekly, Outcome 1 Change in haemoglobin level.
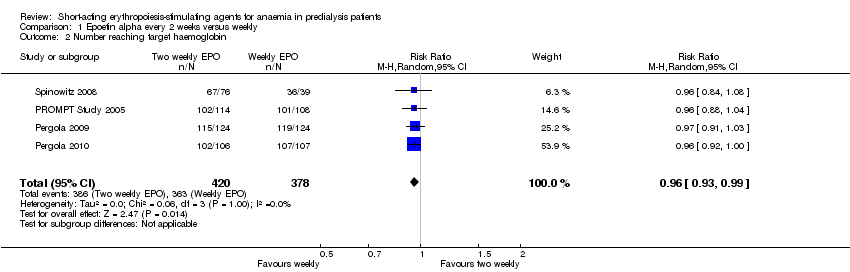
Comparison 1 Epoetin alpha every 2 weeks versus weekly, Outcome 2 Number reaching target haemoglobin.
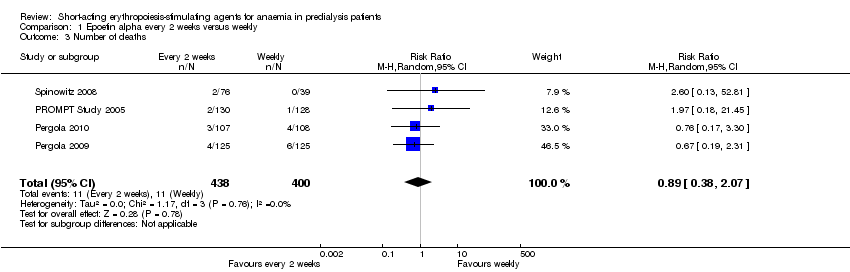
Comparison 1 Epoetin alpha every 2 weeks versus weekly, Outcome 3 Number of deaths.

Comparison 1 Epoetin alpha every 2 weeks versus weekly, Outcome 4 Adverse events.
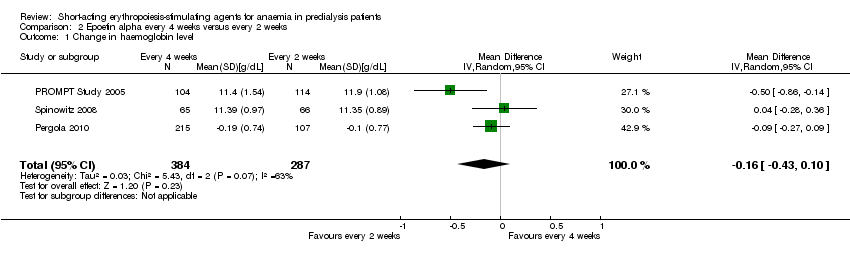
Comparison 2 Epoetin alpha every 4 weeks versus every 2 weeks, Outcome 1 Change in haemoglobin level.
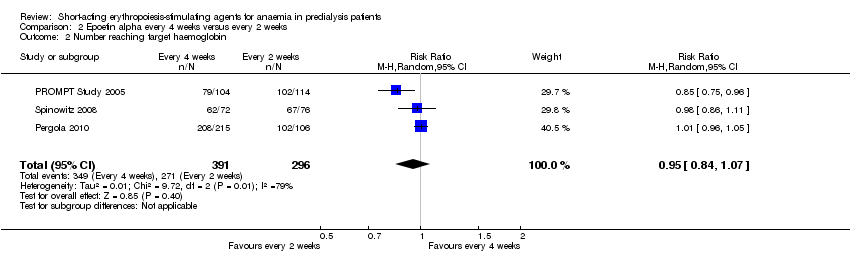
Comparison 2 Epoetin alpha every 4 weeks versus every 2 weeks, Outcome 2 Number reaching target haemoglobin.
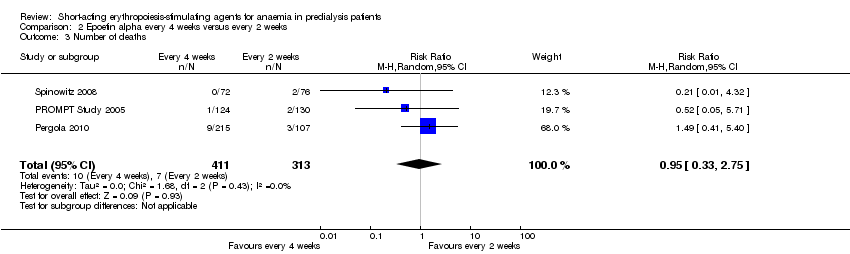
Comparison 2 Epoetin alpha every 4 weeks versus every 2 weeks, Outcome 3 Number of deaths.

Comparison 2 Epoetin alpha every 4 weeks versus every 2 weeks, Outcome 4 Adverse events.

Comparison 3 Epoetin alpha different doses given three times weekly, Outcome 1 Final haemoglobin.
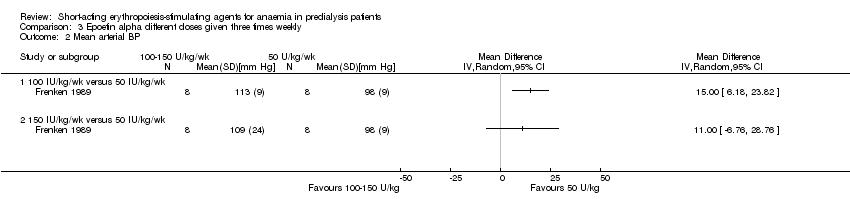
Comparison 3 Epoetin alpha different doses given three times weekly, Outcome 2 Mean arterial BP.

Comparison 3 Epoetin alpha different doses given three times weekly, Outcome 3 Final creatinine levels.

Comparison 4 Epoetin alpha different doses given every four weeks, Outcome 1 Final haemoglobin.

Comparison 4 Epoetin alpha different doses given every four weeks, Outcome 2 Number reaching target haemoglobin.

Comparison 4 Epoetin alpha different doses given every four weeks, Outcome 3 Number of deaths.

Comparison 4 Epoetin alpha different doses given every four weeks, Outcome 4 Adverse events.

Comparison 5 Epoetin alpha IV versus subcutaneous administration, Outcome 1 Final haemoglobin.
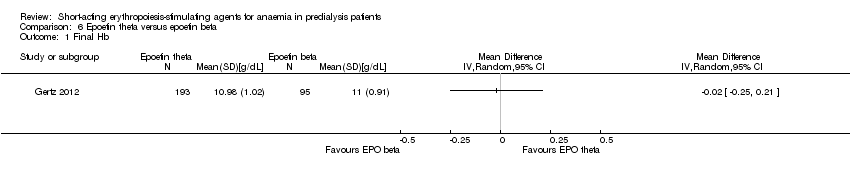
Comparison 6 Epoetin theta versus epoetin beta, Outcome 1 Final Hb.
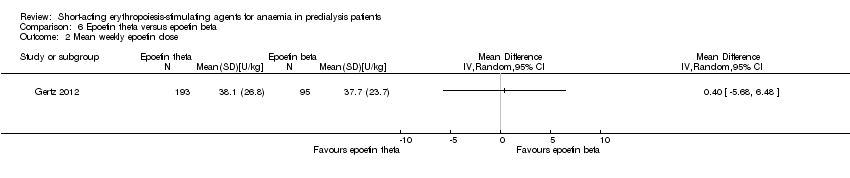
Comparison 6 Epoetin theta versus epoetin beta, Outcome 2 Mean weekly epoetin dose.
Comparison 6 Epoetin theta versus epoetin beta, Outcome 3 Deaths.

Comparison 6 Epoetin theta versus epoetin beta, Outcome 4 Adverse events.
| Epoetin alpha every 2 weeks versus to weekly for anaemia in CKD patients not receiving dialysis | ||||||
| Patient or population: anaemia in predialysis patients | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Risk with weekly | Risk with Epoetin alpha every 2 weeks | |||||
| Change in Hb level | The mean change in Hb level was 0 g/dL | The mean change in Hb level in the intervention group was 0.19 g/dL lower (0.32 g/dL lower to 0.06 g/dL lower) | ‐ | 798 (4) | ⊕⊕⊝⊝ | downgraded for study limitations and indirectness |
| Number reaching target Hb | Study population | RR 0.96 | 798 (4) | ⊕⊕⊝⊝ | downgraded for study limitations and indirectness | |
| 960 per 1000 | 922 per 1000 | |||||
| Moderate | ||||||
| 947 per 1000 | 910 per 1000 | |||||
| Number of deaths | Study population | RR 0.89 | 838 (4) | ⊕⊕⊝⊝ | downgraded for study limitations and imprecision | |
| 28 per 1000 | 24 per 1000 | |||||
| Moderate | ||||||
| 22 per 1000 | 20 per 1000 | |||||
| Adverse events: RBC transfusions | Study population | RR 1.56 | 580 (3) | ⊕⊕⊝⊝ | downgraded for imprecision and study limitations | |
| 33 per 1000 | 52 per 1000 | |||||
| Moderate | ||||||
| 37 per 1000 | 58 per 1000 | |||||
| Adverse events: hypertension | Study population | RR 0.85 | 838 (4) | ⊕⊕⊕⊝ | downgraded for study limitations | |
| 100 per 1000 | 85 per 1000 | |||||
| Moderate | ||||||
| 95 per 1000 | 81 per 1000 | |||||
| Adverse events: thrombovascular events | Study population | RR 1.41 | 838 (4) | ⊕⊕⊝⊝ | downgraded for study limitations and imprecision | |
| 28 per 1000 | 39 per 1000 | |||||
| Moderate | ||||||
| 27 per 1000 | 38 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 allocation concealment unclear in 3 of 4 studies 2 surrogate outcome 3 few studies with low numbers and wide confidence 4 allocation concealment unclear in 2 of 3 studies | ||||||
| Epoetin alfa every four weeks versus with every two weeks in CKD patients not receiving dialysis | ||||||
| Patient or population: anaemia in predialysis patients | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Risk with every 2 weeks | Risk with Epoetin alpha every 4 weeks | |||||
| Change in Hb level | The mean change in Hb level was 0 | The mean change in Hb level in the intervention group was 0.15g/dL lower (0.41 g/dL lower to 0.1g/dL more) | ‐ | 671 (3) | ⊕⊝⊝⊝ | downgraded for study limitations, heterogeneity and indirectness |
| Number reaching target Hb | Study population | RR 0.95 | 687 (3) | ⊕⊝⊝⊝ | downgraded for study limitations, heterogeneity and indirectness | |
| 916 per 1000 | 870 per 1000 | |||||
| Moderate | ||||||
| 895 per 1000 | 850 per 1000 | |||||
| Number of deaths | Study population | RR 0.95 | 724 (3) | ⊕⊕⊝⊝ | downgraded for study limitations, imprecision | |
| 22 per 1000 | 21 per 1000 | |||||
| Moderate | ||||||
| 26 per 1000 | 25 per 1000 | |||||
| Adverse events: RBC transfusions | Study population | RR 1.26 | 470 (2) | ⊕⊕⊝⊝ | downgraded for study limitations, imprecision | |
| 38 per 1000 | 48 per 1000 | |||||
| Moderate | ||||||
| 35 per 1000 | 44 per 1000 | |||||
| Adverse events: hypertension | Study population | RR 1.02 | 724 (3) | ⊕⊕⊕⊝ | downgraded for study limitations | |
| 70 per 1000 | 72 per 1000 | |||||
| Moderate | ||||||
| 62 per 1000 | 63 per 1000 | |||||
| Adverse events: arteriovenous complications | Study population | RR 1.02 | 724 (3) | ⊕⊕⊝⊝ | downgraded for study limitations, imprecision | |
| 26 per 1000 | 26 per 1000 | |||||
| Moderate | ||||||
| 23 per 1000 | 24 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 two of the three studies had unclear allocation concealment 2 surrogate outcome 3 unexplained heterogeneity 4 small numbers with wide confidence intervals | ||||||
| Epoetin theta versus epoetin beta in CKD patients not receiving dialysis | ||||||
| Patient or population: anaemia in predialysis patients | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | No. of participants | Quality of the evidence | Comments | |
| Risk with epoetin beta | Risk with Epoetin theta | |||||
| Final Hb | The mean final Hb was 0 g/dL | The mean final Hb in the intervention group was 0.02 g/dL lower (0.25 g/dL lower to 0.21 g/dL higher) | ‐ | 288 (1) | ⊕⊕⊕⊝ | downgraded for indirectness ‐ surrogate outcomes |
| Mean weekly epoetin dose | The mean weekly epoetin dose was 0 units/week | The mean weekly epoetin dose in the intervention group was 0.4 units per week higher (5.68 units per week lower 6.48 units/week higher) | ‐ | 288 (1) | ⊕⊕⊝⊝ | downgraded for indirectness ‐ surrogate outcomes and imprecision |
| Deaths | Study population | RR 2.46 | 288 (1) | ⊕⊕⊝⊝ | downgraded for imprecision | |
| 11 per 1000 | 26 per 1000 | |||||
| Moderate | ||||||
| 11 per 1000 | 26 per 1000 | |||||
| Adverse events: hypertension | Study population | RR 0.35 | 288 (1) | ⊕⊕⊕⊝ | downgraded for imprecision | |
| 74 per 1000 | 26 per 1000 | |||||
| Moderate | ||||||
| 74 per 1000 | 26 per 1000 | |||||
| Adverse events: RBC transfusions | Study population | RR 1.48 | 288 (1) | ⊕⊕⊝⊝ | downgraded for imprecision | |
| 0 per 1000 | 0 per 1000 | |||||
| Adverse events: discontinuation of therapy | Study population | RR 1.77 | 288 (1) | ⊕⊕⊝⊝ | downgraded for imprecision | |
| 53 per 1000 | 93 per 1000 | |||||
| Moderate | ||||||
| 53 per 1000 | 93 per 1000 | |||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1 Surrogate outcome, not a patient‐centred outcome 2 Small numbers, wide confidence intervals | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Change in haemoglobin level Show forest plot | 4 | 785 | Mean Difference (IV, Random, 95% CI) | ‐0.20 [‐0.33, ‐0.07] |
| 2 Number reaching target haemoglobin Show forest plot | 4 | 798 | Risk Ratio (M‐H, Random, 95% CI) | 0.96 [0.93, 0.99] |
| 3 Number of deaths Show forest plot | 4 | 838 | Risk Ratio (M‐H, Random, 95% CI) | 0.89 [0.38, 2.07] |
| 4 Adverse events Show forest plot | 4 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 4.1 RBC transfusions | 3 | 580 | Risk Ratio (M‐H, Random, 95% CI) | 1.56 [0.71, 3.45] |
| 4.2 Hypertension | 4 | 838 | Risk Ratio (M‐H, Random, 95% CI) | 0.85 [0.55, 1.32] |
| 4.3 Thrombovascular events | 4 | 838 | Risk Ratio (M‐H, Random, 95% CI) | 1.41 [0.67, 3.00] |
| 4.4 Adverse events leading to discontinuation of therapy | 1 | 258 | Risk Ratio (M‐H, Random, 95% CI) | 0.98 [0.20, 4.79] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Change in haemoglobin level Show forest plot | 3 | 671 | Mean Difference (IV, Random, 95% CI) | ‐0.16 [‐0.43, 0.10] |
| 2 Number reaching target haemoglobin Show forest plot | 3 | 687 | Risk Ratio (M‐H, Random, 95% CI) | 0.95 [0.84, 1.07] |
| 3 Number of deaths Show forest plot | 3 | 724 | Risk Ratio (M‐H, Random, 95% CI) | 0.95 [0.33, 2.75] |
| 4 Adverse events Show forest plot | 3 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 4.1 RBC transfusions | 2 | 470 | Risk Ratio (M‐H, Random, 95% CI) | 1.26 [0.53, 2.98] |
| 4.2 Hypertension | 3 | 724 | Risk Ratio (M‐H, Random, 95% CI) | 1.02 [0.62, 1.69] |
| 4.3 Arteriovenous complications | 3 | 724 | Risk Ratio (M‐H, Random, 95% CI) | 1.02 [0.39, 2.68] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Final haemoglobin Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 1.1 100 U/kg versus 50 U/kg | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 1.2 150 U/kg versus 50 U/kg | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 2 Mean arterial BP Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 2.1 100 IU/kg/wk versus 50 IU/kg/wk | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 2.2 150 IU/kg/wk versus 50 IU/kg/wk | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 3 Final creatinine levels Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 3.1 100 IU/kg/wk versus 50 IU/kg/wk | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 3.2 150 IU/kg/wk versus 50 IU/kg/wk | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Final haemoglobin Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 2 Number reaching target haemoglobin Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 3 Number of deaths Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 4 Adverse events Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 4.1 Hypertension | 1 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 4.2 Thrombovascular events | 1 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 4.3 RBC transfusions | 1 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Final haemoglobin Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Final Hb Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 2 Mean weekly epoetin dose Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 3 Deaths Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 4 Adverse events Show forest plot | 1 | Risk Ratio (M‐H, Random, 95% CI) | Totals not selected | |
| 4.1 Hypertension | 1 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 4.2 RBC transfusions | 1 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 4.3 Discontinuation of therapy | 1 | Risk Ratio (M‐H, Random, 95% CI) | 0.0 [0.0, 0.0] | |

