Profilaxis habitual con antibióticos después del parto vaginal normal para la reducción de la morbilidad infecciosa materna
Resumen
Antecedentes
La morbilidad infecciosa es una causa de morbilidad y mortalidad materna y perinatal considerables, e incluye a pacientes sin un aumento del riesgo de infección evidente. Para reducir la incidencia de las infecciones se les suele administrar antibióticos a las pacientes después de un parto sin complicaciones, en particular en ámbitos donde están en mayor riesgo de morbilidad infecciosa puerperal.
Objetivos
Evaluar si la administración habitual de antibióticos profilácticos a las pacientes después de un parto vaginal normal (sin complicaciones), en comparación con placebo o ninguna profilaxis con antibióticos, reduce las morbilidades infecciosas maternas posparto y mejora los resultados.
Métodos de búsqueda
Se hicieron búsquedas en el registro de ensayos del Grupo Cochrane de Embarazo y Parto (Cochrane Pregnancy and Childbirth Group) (31 agosto 2017), LILACS, ClinicalTrials.gov, en la WHO International Clinical Trials Registry Platform (ICTRP) (22 agosto 2017) y en listas de referencias de estudios recuperados.
Criterios de selección
Se planificó incluir los ensayos aleatorios o cuasialeatorios que evaluaran la administración de antibióticos profilácticos versus placebo o ninguna profilaxis con antibióticos. Los ensayos con un diseño aleatorio grupal habrían sido elegibles para inclusión, pero no se encontraron.
En las actualizaciones futuras de esta revisión se incluirán los estudios publicados en forma de resumen solamente, siempre que esté disponible información suficiente para evaluar los riesgos de sesgo. Se considerará excluir los resúmenes una vez que la publicación completa esté disponible, o que los autores proporcionen más información.
Los ensayos que utilizaron un diseño cruzado no fueron elegibles para inclusión.
Obtención y análisis de los datos
Dos autores de la revisión realizaron una evaluación independiente de los ensayos para la inclusión y los riesgos de sesgo. Extrajeron los datos de forma independiente y verificaron su exactitud, resolviendo las diferencias en las evaluaciones mediante discusión. Evaluaron la calidad metodológica utilizando los criterios Cochrane estándar y el enfoque GRADE.
Los resúmenes se presentaron como cocientes de riesgos (CR) y diferencias de medias (DM) mediante modelos de efectos fijos o aleatorios. Para un resultado primario se encontró considerable heterogeneidad e interacción. Se realizaron exploraciones adicionales mediante un análisis de subgrupos para investigar los efectos de la unidad de asignación al azar. Todos los autores de la revisión discutieron e interpretaron los resultados.
Resultados principales
Un ensayo controlado aleatorio (ECA) y dos ensayos cuasialeatorios contribuyeron con datos de 1779 mujeres que tuvieron partos vaginales sin complicaciones, y compararon diferentes regímenes antibióticos con placebo o ningún tratamiento. Los ensayos incluidos tuvieron lugar en la década de 1960 (un ensayo) y los años noventa (dos ensayos). Los ensayos se llevaron a cabo en Francia, Estados Unidos y Brasil. Los antibióticos administrados incluyeron: sulfametoxipiridazina o cloranfenicol orales por tres a cinco días y amoxicilina y ácido clavulánico intravenosos a una dosis única una hora después del parto. La mayoría de los dominios del riesgo de sesgo se calificaron como alto riesgo, con la excepción del sesgo de informe y otro posible sesgo.
La calidad de la evidencia varió de baja a muy baja sobre la base de la evaluación GRADE de la calidad debido a limitaciones muy importantes en el diseño de los estudios incluidos, los pocos eventos y los intervalos de confianza (IC) amplios de las estimaciones del efecto.
Se encontró una disminución en el riesgo de endometritis (CR 0,28; IC del 95%: 0,09 a 0,83; dos ensayos, 1364 mujeres, muy baja calidad). Sin embargo, un ensayo informó cero eventos en este resultado y la evidencia se consideró de muy baja calidad. Hubo poca o ninguna diferencia entre los grupos en el riesgo de infección urinaria (CR 0,25; IC del 95%: 0,05 a 1,19; dos ensayos, 1706 mujeres baja calidad), infección de la herida después de la episiotomía (informada como dehiscencia de la herida en los ensayos incluidos) (CR 0,78; IC del 95%: 0,31 a 1,96; dos ensayos, 1364 mujeres, muy baja calidad) y duración de la estancia hospitalaria materna en días (DM ‐0,15; IC del 95%: ‐0,31 a 0,01; un ensayo, 1291 mujeres, muy baja calidad). Los costos de la atención equivalentes en USD fueron 2½ veces mayores en el grupo control en comparación con el grupo que recibió profilaxis con antibióticos (USD 3600: USD 9000, un ensayo, 1291 mujeres). Hubo poca o ninguna diferencia entre los grupos de tratamiento y control para los efectos adversos de los antibióticos (erupción cutánea) informados en una mujer en cada uno de los dos ensayos (CR 3,03; IC del 95%: 0,32 a 28,95; dos ensayos, 1706 mujeres, muy baja calidad). En los estudios incluidos no se analizaron la incidencia de morbilidad infecciosa materna grave, la resistencia antimicrobiana ni la satisfacción de las mujeres con la atención.
Conclusiones de los autores
La administración habitual de antibióticos puede reducir el riesgo de endometritis después de un parto vaginal sin complicaciones. El número pequeño y la naturaleza de los ensayos limitan la interpretación de la evidencia para su aplicación en la práctica, en particular en ámbitos en los que las pacientes pueden tener un mayor riesgo de desarrollar endometritis. La administración de antibióticos no redujo la incidencia de infecciones urinarias, la infección de la herida ni la duración de la estancia hospitalaria materna. Los antibióticos no sustituyen las medidas de prevención y control de la infección alrededor del momento del parto y en el período posparto. La decisión de administrar antibióticos profilácticos de forma habitual después de los partos vaginales normales se debe equilibrar con las características de las pacientes, el contexto del parto y la experiencia del profesional, que incluye las consideraciones de la contribución del uso indiscriminado de antibióticos para aumentar la resistencia antimicrobiana. Ensayos controlados aleatorios bien diseñados y con alto poder estadístico ayudarían a evaluar el valor agregado de la administración habitual de antibióticos como una medida para prevenir las infecciones maternas después del parto vaginal normal.
PICOs
Resumen en términos sencillos
Tratamiento preventivo habitual con antibióticos después de un parto vaginal normal para reducir las infecciones maternas
¿Cuál es el problema?
Las infecciones que ocurren durante el parto pueden dar lugar a afectaciones importantes a la salud e incluso a la muerte de la madre o el lactante. Se cree que el riesgo de infección es mayor en los partos que ocurren en instalaciones de asistencia sanitaria en ámbitos de bajos ingresos en comparación con los de altos ingresos, como resultado de las condiciones higiénicas deficientes, los sistemas de agua y saneamiento inadecuados, el hacinamiento y la baja proporción de profesionales sanitarios/pacientes. La prescripción de antibióticos después de un parto vaginal sin complicaciones se ha convertido en práctica habitual para superar esta situación en algunos contextos de bajos ingresos.
¿Por qué es esto importante?
Frente al aumento de la resistencia antimicrobiana debido al mal uso y a la sobreprescripción de los antibióticos, se necesita evidencia acerca del efecto de la administración habitual de antibióticos para prevenir las infecciones después de un parto vaginal normal sin complicaciones.
¿Qué evidencia se encontró?
La revisión evaluó si el tratamiento habitual con antibióticos después de un parto vaginal sin complicaciones, en comparación con placebo o ningún antibiótico, evita la infección materna. Se buscó evidencia en agosto de 2017 en tres bases de datos. Se identificaron tres ensayos con 1779 mujeres. La calidad de la evidencia varió de baja a muy baja. En los tres ensayos se administraron antibióticos diferentes y por diferentes períodos de tiempo. Los ensayos se realizaron en la década de 1960 (un ensayo) y en la década de 1990 (dos ensayos) y se llevaron a cabo en Francia, Estados Unidos y Brasil.
La administración habitual de antibióticos redujo el número de pacientes con infección del recubrimiento del útero (endometritis) (dos ensayos, 1364 mujeres) en el 70%. La administración de antibióticos no redujo la incidencia de infecciones urinarias (dos ensayos, 1706 mujeres), infecciones de la herida después de la episiotomía (dos ensayos, 1364 mujeres) ni la duración de la estancia hospitalaria materna (un ensayo, 1291 mujeres).
No hubo diferencias entre los grupos en la erupción cutánea debido a los antibióticos, que se informó en una mujer en cada uno de los dos ensayos (1706 mujeres). El costo de la atención fue mayor en el grupo que no recibió profilaxis con antibióticos. No se analizó la incidencia de infecciones y enfermedades maternas graves, la resistencia antimicrobiana ni la satisfacción de las pacientes con la atención.
¿Qué significa esto?
El escaso número de ensayos limita la interpretación de la evidencia del uso habitual de los antibióticos después de los partos vaginales normales. La baja incidencia de endometritis en los estudios indica que es posible que haya que tratar a un número relativamente grande de pacientes para evitar unos pocos casos de infección.
Debe existir un equilibrio entre las necesidades de las pacientes, el contexto del parto y la experiencia del profesional sanitario (por ejemplo, con exploraciones o intervenciones vaginales frecuentes) y la amenaza de la resistencia a los antibióticos en la salud pública.
Estudios de investigación adicionales a partir de ensayos controlados aleatorios bien diseñados ayudarían a evaluar el valor agregado de administrar antibióticos de forma habitual a las pacientes después de un parto vaginal normal para prevenir las infecciones maternas.
Conclusiones de los autores
Summary of findings
| Routine antibiotic prophylaxis compared to no treatment/placebo for preventing infections in women who had normal vaginal births | ||||||
| Patient or population: Women who had normal vaginal births | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with no treatment/placebo | Risk with routine antibiotic prophylaxis | |||||
| Incidence of severe maternal infectious morbidity (including septicaemia, septic shock, laparotomy/hysterectomy for infection, maternal intensive care unit admission, or organ failure) | not estimable | not estimable | not estimable | 0 | ‐ | No trial reported this outcome |
| Endometritis | Study population | RR 0.28 | 1364 | ⊕⊝⊝⊝ | ‐ | |
| 23 per 1000 | 7 per 1000 | |||||
| Urinary tract infection | Study population | RR 0.25 | 1706 | ⊕⊕⊝⊝ | ‐ | |
| 32 per 1000 | 8 per 1000 | |||||
| Wound infection (episiotomy dehiscence) | Study population | RR 0.78 | 1364 | ⊕⊝⊝⊝ | ‐ | |
| 7 per 1000 | 10 per 1000 | |||||
| Adverse effects of antibiotics (skin rash) | Study population | RR 3.03 | 1706 | ⊕⊝⊝⊝ | ‐ | |
| 0 per 1000 | 0 per 1000 | |||||
| Length of maternal hospital stay | The mean length of maternal hospital stay (including maternal re‐admission to hospital) was 5.12 days | MD 0.15 lower | not estimable | 1291 | ⊕⊝⊝⊝ | ‐ |
| Individual antimicrobial resistance | not estimable | not estimable | not estimable | 0 | ‐ | No trial reported this outcome |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Two studies with very serious design limitations (‐2). | ||||||
Antecedentes
Las infecciones que ocurren durante el embarazo, el parto y el puerperio se asocian con considerable morbilidad y mortalidad materna y perinatal. Sin embargo, los datos mundiales sobre la incidencia de la morbilidad por infección materna son escasos. La Organización Mundial de la Salud (OMS) calcula una incidencia mundial de infecciones puerperales del 4,4% entre los nacidos vivos, lo que representa más de 5 700 000 casos al año (WHO 2005). Existen variaciones importantes entre las regiones, con una incidencia mayor en los países de ingresos bajos y medios (hasta el 7%) en comparación con los países de ingresos altos, en los que la incidencia calculada es inferior (del 1% al 2%) (Dolea 2003).
A pesar de una incidencia general relativamente baja y de la disponibilidad de intervenciones para la prevención y el tratamiento, la sepsis materna es una de las principales causas de mortalidad materna, y representa cerca de la décima parte de las muertes maternas mundiales (Say 2014). La mayoría de las muertes se registran en Asia (12%) y África (10%), en comparación con solo el 2% en los países desarrollados (Khan 2006). Además de la muerte y las morbilidades agudas, las infecciones se asocian con discapacidades maternas a largo plazo y también pueden tener una considerable repercusión sobre la morbilidad y la mortalidad del recién nacido.
Descripción de la afección
En general, se considera que el parto normal (sin complicaciones) se inicia de manera espontánea, presenta bajo riesgo al comienzo del trabajo de parto y se mantiene de esa manera durante todo el trabajo de parto y el parto. El recién nacido nace espontáneamente en posición de vértice entre las 37 y 42 semanas completas de embarazo. Después del parto, la madre y el recién nacido están en buen estado de salud (NICE 2014; WHO 1996).
Varias afecciones maternas preexistentes pueden aumentar el riesgo de desarrollar infecciones bacterianas entre las pacientes que se espera que tengan partos vaginales sin complicaciones. Se incluyen afecciones como la desnutrición, la anemia, la vaginosis bacteriana y las infecciones por estreptococo del Grupo B (Hussein 2010; Tharpe 2008). Además, las complicaciones durante el trabajo de parto y el parto (p.ej. rotura prolongada de las membranas, trabajo de parto prolongado, desgarros genitales y productos de la concepción retenidos) o las intervenciones realizadas por el profesional sanitario (p.ej. las exploraciones vaginales frecuentes, el parto vaginal operatorio [fórceps, ventosa] y la episiotomía) podrían amentar el riesgo de infección en el puerperio (Hussein 2010; Tharpe 2008). Por lo tanto, no es fácil identificar a las pacientes que podrían tener un mayor riesgo de desarrollar una infección después del parto normal, y en las que los antibióticos profilácticos podrían ser útiles para prevenir las infecciones en el puerperio. Además, el diagnóstico de la infección materna se basa principalmente en signos y síntomas clínicos no específicos (dolor pélvico, fiebre, exudado vaginal con olor anormal / hedor o retraso en la involución uterina) que se pueden manifestar varios días después del parto, lo que provoca dificultades para la identificación inmediata de los casos, en particular después del alta hospitalaria (Hussein 2010). No reconocer la aparición de la infección contribuye a retrasos en el tratamiento y a un aumento en el riesgo de morbilidad y mortalidad (Acosta 2014).
Existe la creencia general de que el riesgo de infección es mayor en los partos atendidos en una institución sanitaria (partos institucionales) en ámbitos de bajos ingresos como resultado de las condiciones higiénicas deficientes, los sistemas de agua y saneamiento inadecuados, el hacinamiento y la baja proporción de profesionales sanitarios/pacientes. (Hussein 2010). Además, la identificación inmediata de los microorganismos y la prescripción selectiva del antibiótico a menudo están limitadas en estos contextos.
Descripción de la intervención
Las medidas de higiene y de control de la infección (lavado y desinfección de las manos, uso único de los guantes y limpieza y esterilización de los equipos) son la base para la prevención de la infección alrededor del momento del parto en las pacientes con partos vaginales sin complicaciones (Hussein 2010).
La profilaxis con antibióticos se caracteriza por la administración de antibióticos de espectro amplio (p.ej. ampicilina, cefalosporina, una combinación de antibióticos) que sean efectivos contra el microorganismo con mayor probabilidad de causar las infecciones, administrados antes, durante o inmediatamente después del procedimiento y durante un período corto (dosis única o por menos de 24 horas) y sin la presencia de signos de infección (ACOG 2011). La profilaxis con antibióticos administrada después del parto normal tiene la posibilidad de disminuir de manera adicional el riesgo de infecciones, en particular en ámbitos en los que no están asegurados la higiene apropiada, las medidas de control de la infección ni el saneamiento durante el trabajo de parto, el parto y el período posparto, o en los que la detección temprana de las infecciones puerperales y los estudios de laboratorio son limitados. El objetivo de la profilaxis con antibióticos es prevenir la infección al alcanzar niveles tisulares terapéuticos en el momento en el que es más probable que ocurra la contaminación microbiana (ACOG 2011).
Hay evidencia creciente de que de forma habitual se prescriben diferentes regímenes de antibiótico después de un parto vaginal sin complicaciones en ámbitos de bajos ingresos para superar las deficiencias de los sistemas sanitarios y el alto riesgo de infecciones en el período posparto. Estudios en la India (Sharma 2013) y Vietnam (Ngoc 2005) muestran que más del 90% de las pacientes que tienen un parto vaginal reciben antibióticos antes del alta hospitalaria. Lo anterior incluye la administración de una variedad amplia de antibióticos (amoxicilina, ampicilina, cefalosporinas, fluoroquinolonas o combinaciones de antibióticos), con diferentes vías (oral, intramuscular, intravenosa) y duraciones de administración (como promedio de tres a cuatro días).
De qué manera podría funcionar la intervención
Por lo general, las infecciones bacterianas alrededor del momento del parto son polimicrobianas, incluyen bacterias aeróbicas y anaerobias y reflejan la colonización vaginal (Van Dillen 2010). La profilaxis con antibióticos después del parto vaginal normal podría ayudar a prevenir las infecciones maternas al asegurar concentraciones tisulares y séricas adecuadas del antimicrobiano durante el período posparto. Para que sean efectivos, los antibióticos tienen que ser activos contra los microorganismos predominantes que causan infecciones posparto y ser administrados durante el período más corto para disminuir los efectos secundarios y la repercusión de su uso sistemático sobre la resistencia antimicrobiana emergente. De hecho, la exposición a los antibióticos en el posparto podría causar efectos adversos a la madre o al neonato alimentado con lactancia materna, que incluyen la alteración de la flora normal, un aumento del riesgo de infecciones bacterianas resistentes, reacciones alérgicas y mayores costos de la asistencia sanitaria (ACOG 2011). También existen inquietudes por el aumento de la resistencia a los antibióticos a nivel institucional y comunitario (WHO 2014). Lo anterior podría complicar aún más la elección de los antibióticos profilácticos apropiados, ya que generalmente se necesitan antibióticos de amplio espectro para cubrir los agentes patógenos habituales (Newton 2008).
Por qué es importante realizar esta revisión
El aumento de la tendencia observado en los partos institucionales puede aumentar el riesgo de infecciones intrahospitalarias después del parto vaginal normal si no se acompaña de mejorías en la calidad de la higiene y las medidas de control de la infección (Hussein 2011). Sin embargo, la evidencia acerca del efecto agregado de la profilaxis con antibióticos sobre la prevención de las infecciones posparto después de un parto vaginal sin complicaciones no está clara.
Ha habido un aumento de las preocupaciones en la salud pública con respecto a la resistencia emergente a los antimicrobianos después de la administración inapropiada o exagerada de los antibióticos (WHO 2014). Lo anterior también es aplicable a las poblaciones obstétricas y a la posibilidad de una respuesta inadecuada al tratamiento de las infecciones puerperales debido a la exposición temprana a regímenes de antibióticos profilácticos poco efectivos. Debido a la gran proporción de pacientes que tienen un parto vaginal sin complicaciones, es posible que la aplicación general de antibióticos a dichas mujeres dé lugar a efectos beneficiosos clínicos significativos en cuanto a la reducción del riesgo de infecciones, pero también podría provocar efectos perjudiciales directos a la paciente e indirectos a la población general por el aumento de la resistencia a los antibióticos, como se describe anteriormente.
Objetivos
Evaluar si la administración habitual de antibióticos profilácticos a las pacientes después del parto vaginal normal (sin complicaciones), en comparación con placebo o ninguna profilaxis con antibióticos, reduce la morbilidad infecciosa materna y mejora los resultados después del parto.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Todos los ensayos controlados aleatorios (ECA), incluidos los ensayos cuasialeatorios y los ensayos aleatorios grupales, que compararan la administración de profilaxis habitual con antibióticos después del parto vaginal normal (sin complicaciones) a nivel institucional, con placebo o ninguna profilaxis con antibióticos. En las actualizaciones futuras de esta revisión se incluirán estudios publicados solo en forma de resumen, siempre que haya suficiente información disponible para evaluar los riesgos de sesgo. Se considerará excluir los resúmenes una vez que la publicación completa esté disponible, o que los autores proporcionen más información.
Se excluyeron los ensayos con un diseño cruzado.
Tipos de participantes
Pacientes que tuvieron un parto vaginal sin complicaciones a término. Lo anterior excluye a las pacientes que se presentaron con alguna complicación durante el trabajo de parto, como lo informaron los autores de los ensayos (p.ej. corioamnionitis, rotura prematura de las membranas [RPM] prolongada antes del término, segundo estadio del trabajo de parto prolongado, desgarro vaginal de tercer o cuarto grado, hemorragia posparto), o las que fueron sometidas a procedimientos intraparto (parto vaginal operatorio o extracción manual de la placenta). La episiotomía no se consideró una complicación del trabajo de parto.
Tipos de intervenciones
La comparación principal de la revisión es la administración de cualquier profilaxis habitual con antibióticos después de un parto vaginal sin complicaciones en comparación con placebo o ninguna profilaxis sistemática con antibióticos. No se consideraron para inclusión los ensayos que administraron la profilaxis con antibióticos durante el trabajo de parto.
Tipos de medida de resultado
Resultados primarios
-
Incidencia de morbilidad infecciosa materna grave (que incluye sepsis, shock séptico, laparotomía/histerectomía por infección, ingreso materno a la unidad de cuidados intensivos [UCI] o insuficiencia orgánica) como la informaron los autores de los ensayos.
-
Endometritis (con o sin miometritis y con o sin salpingitis que causa morbilidad febril materna), como la informaron los autores de los ensayos.
-
Infección urinaria (fiebre o disuria y urocultivo positivo).
Resultados secundarios
-
Infección de la herida (desgarro perineal de primer o segundo grado, desgarro vaginal o episiotomía), como la informaron los autores de los ensayos.
-
Efectos adversos de los antibióticos (Maternos: reacción alérgica, náuseas, vómitos, diarrea, erupciones cutáneas, anafilaxia. Neonatales: reacción alérgica, diarrea, erupciones cutáneas, anafilaxia).
-
Duración de la estancia hospitalaria materna (que incluye el reingreso hospitalario materno).
-
Costo de la atención (que incluye el reingreso hospitalario materno, costos del tratamiento con antibióticos).
-
Resistencia antimicrobiana individual (p.ej. ninguna respuesta al tratamiento con antibióticos de primera línea, cultivo de cepas bacterianas resistentes a los antibióticos), como la informaron los autores de los ensayos.
-
Satisfacción de las pacientes con la atención, como la informaron los autores de los ensayos.
Results
Description of studies
Results of the search
The search of the Cochrane Pregnancy and Childbirth Group’s Trials Register retrieved 10 trial reports. We retrieved 259 records from LILACS, 54 from ClinicalTrials.gov and 10 from ICTRP. Among these, we identified five duplicates from the same source. We excluded reports due to lack of comparisons, randomisation and irrelevance to review objective. We retrieved 13 full texts after independent title and abstract screening by two review authors. These studies provided data on women who received antibiotics after normal vaginal births (see Figure 1).
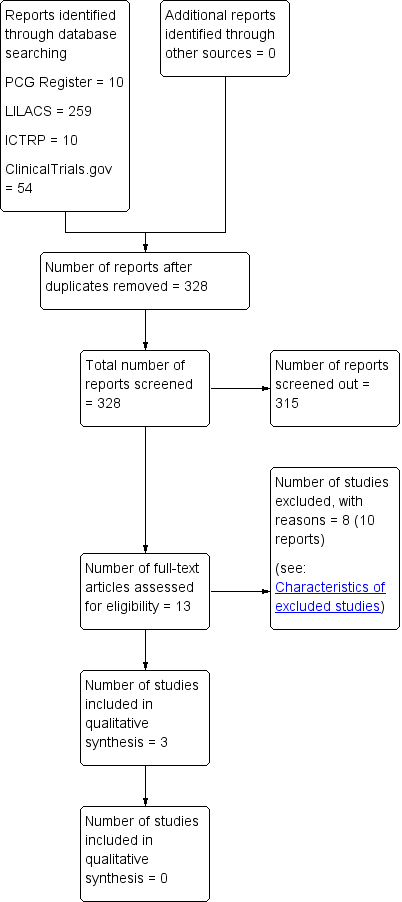
Study flow diagram.
Further full‐text evaluation identified three eligible trials which contribute data to this review. We included one randomised controlled trial (RCT) and two quasi‐RCTs. Studies provided individual data on a different class of drugs, so we could not compare differences between different drug classes.
Included studies
Design
One RCT (Fernandez 1993) and two quasi‐RCTs (Neto 1990; Turck 1962) contributed data on 1779 women who had uncomplicated vaginal births, comparing different antibiotic regimens with placebo or no treatment. Two trials specifically assessed the use of prophylactic antibiotics after in‐out catheterisation of the urethra (Turck 1962) or episiotomy (Neto 1990). In the other study women were recruited in the labour ward as soon as they delivered (Fernandez 1993). Women were followed up at 10 days (Neto 1990), two weeks (Fernandez 1993) and six weeks (Turck 1962) after birth. We provide a detailed description of studies in the table Characteristics of included studies.
In the studies, pregnant women were randomised into two groups, according to hospital registration number (Turck 1962), protocol number (odd/even number) (Neto 1990) or a random‐number table in the labour ward (Fernandez 1993).
The studies took place between 1961 and 1962 (Turck 1962), 1988 and 1989 (Neto 1990), and during 1989 (Fernandez 1993).
Sample sizes
Turck 1962 included 431 women, later excluding 16 participants. The remaining 415 women were assigned to the treated (217) or placebo groups (198). Neto 1990 included 80 women with normal birth and episiotomy, of which 73 were followed‐up and included in the analysis, 34 in the intervention arm and 39 in the control non‐treated arm. Fernandez 1993 included 1373 women, of which 82 were excluded after randomisation and 1291 analysed.
Setting
Two studies were conducted in high‐income countries, in a public hospital in France (Fernandez 1993) and a private clinic in the USA (Turck 1962). The remaining study was conducted in a public hospital in Brazil (Neto 1990).
Participants
In Turck 1962, all the women had catheters inserted just prior to childbirth, from which urine analysis was done. In the second study of 431 pregnant women (Turck 1962), 16 women were excluded prior to assigning the 415 participants to treated (217) and placebo (198) groups. Exclusions were based on allergies to sulphonamides, intake of other antibiotics and the presence of indwelling catheters (Turck 1962) prior to randomisation.
One thousand two hundred and ninety‐one women meeting the following inclusion criteria were eventually analysed in Fernandez 1993: vaginal birth, absence of pyrexia (> 38° C) during labour or the hour following delivery, an interval of less than 24 hours between rupture of membranes and the onset of labour, absence of any evidence of extragenital infection (e.g. urinary tract with absence of urination burning) and absence of known allergies to the drug of choice (Amox‐CA) or to β‐lactams. Women with evidence of amniotic fluid infection at the time of admission were included (Fernandez 1993). In addition, 82 women were excluded after randomisation. These included five in whom the antibiotic given was unknown, 71 women excluded due to antibiotic injections after uterine exploration, and six other women who had more than a 24‐hour interval between rupture of membranes and labour onset. This left 1291 women for analysis. No differences were reported between groups for maternal age, parity, body mass index, history of infection during pregnancy, other maternal morbidity (diabetes, hypertension), gestational age, type of pregnancy (singleton versus twins), time in labour ward, number of vaginal examinations, number of urethral catheterisations, temperature on admission to the labour ward or epidural anaesthesia.
Neto 1990 included data for 34 women in the intervention arm and 39 in the control no‐treatment arm. No difference was reported between groups for race, maternal age, parity, gestational age, length of labour, length of rupture of membranes, and number of vaginal examinations.
Interventions and comparisons
Treatment with antibiotic prophylaxis was compared to placebo (Turck 1962) or no treatment (Fernandez 1993; Neto 1990). Antibiotics administered included: sulphamethoxypyridazine one tablet a day from three to five days after in‐out urethral catheterisation (Turck 1962), oral chloramphenicol 500 mg four times daily for 72 hours after episiotomy repair (Neto 1990), and intravenous amoxicillin and clavulanic acid (®Augmentin, Beecham laboratory) at 1.2 g at one hour after birth (Fernandez 1993). When reported, the choice of the antibiotics by the authors was guided by their broad spectrum (Fernandez 1993), ease of administration and relatively low allergenicity (Turck 1962).
Outcomes
Outcomes addressed by the three eligible studies included two of our primary outcomes (incidence of endometritis, urinary tract infection) and four of our secondary outcomes (wound infection, adverse effects of antibiotics, length of maternal hospital stay and cost of care). The studies did not report on other important outcomes of this review (incidence of severe maternal infectious morbidity, antimicrobial resistance and women's satisfaction with care).
In one study (Fernandez 1993), endometritis was defined as pyrexia of ≥ 38° C confirmed on two separate occasions and accompanied by pain on mobilisation of the uterus or fetid lochia or both, and/or a leukocytosis of more than 10,000/mm3) that occurred within two weeks following childbirth. A slightly different definition was used by Neto 1990, as two of the following; fever, hypogastric pain, uterine involution, abnormal lochia, assessed at 10 days postpartum. In Turck 1962, urinary tract infection was diagnosed as the presence in urine of gram‐negative bacteriuria (more than 105 organisms per millilitre of urine), in addition to symptoms or signs such as fever, dysuria, frequency, or flank pain diagnosed by attending physicians. Neto 1990 defined episiotomy dehiscence as wound rupture without signs of infection, and episiotomy infection as pain, heat, redness or purulent discharge and wound rupture. No definition was provided in Fernandez 1993.
Sources of funding
Sources of trial funding were not mentioned in Fernandez 1993 or Neto 1990. Turck 1962 was supported by a training grant from the US Public Health Service, with the antibiotics and placebo provided through Lederle laboratories.
Trialist declarations of interest
Declarations of interest were not reported in any of the included studies (Fernandez 1993; Neto 1990; Turck 1962)
Excluded studies
We excluded eight studies. Studies were excluded due to lack of randomisation (Charles 1986), inclusion of women with assisted vaginal births, or third‐degree tears (Costa 1998; Yamagishi 2009), prophylactic antibiotic administration during labour (Kampikaho 1993; Oluwalana 2017) or just prior to birth (Cormier 1988; Sharma 2014) and vaginal cleansing with antibiotics (Matthias 1986). One study (Yamagishi 2009) provided non‐segregated data; our efforts to contact the author were unsuccessful, and we eventually excluded the study. See Characteristics of excluded studies .
Risk of bias in included studies
The risks of bias across studies and for the three included studies (which also contributed to the meta‐analysis) are presented in a 'Risk of bias' table in Figure 2. We rated the risk of bias as high for all three included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
The choice of intervention for the control group had elements of randomisation in the three trials. However, two trials used a non‐random sequence generation (Neto 1990; Turck 1962) and were considered at high risk of bias. In the Fernandez 1993 study, random sequence generation was achieved through using a random‐number table (low risk of bias) ‐ however, the sequence could easily have been broken by the head midwife who conducted the randomisation, and the random‐number table was located in the labour ward (Fernandez 1993).
The risk of selection bias due to poor allocation concealment was high for all three included trials. Preservation of allocation concealment could have been broken due to an inadequate sequence of randomisation in the two trials using non‐random sequence generation (participant's hospital registration number (Turck 1962), and even/odd protocol number (Neto 1990)). Selection bias may have been introduced by participants or investigators who may have foreseen assignments. In the Fernandez 1993 study, the choice of treatment was known before inclusion.
Blinding
Performance bias
We rated blinding in terms of performance bias as low risk for one study (Turck 1962), where the control group received an identical‐appearing placebo in prepackaged pill boxes, and distributed in double‐blind fashion. We judged the risk of performance bias to be high for the other two studies (Fernandez 1993; Neto 1990), with no treatment in the control groups.
Detection bias
In terms of detection bias, the risk was high for two studies (Fernandez 1993; Turck 1962). In the Fernandez 1993 study there was was no blinding of the women nor the investigators. In the Turck 1962 study the clinical diagnosis of puerperal urinary tract infection was made by the attending physicians, who were unaware whether the woman was receiving a drug or the placebo. However, blinding could have been broken if the hospital registration number and sequence generation were known by the attending physician. We rated the third study (Neto 1990) as having an unclear risk of bias for this domain as there was insufficient information provided in the trial report.
Incomplete outcome data
The risk of attrition bias was low in one study (Turck 1962), as data were provided for all participants included. We assessed risk of attrition bias to be high risk for the other two studies (Fernandez 1993; Neto 1990). In Neto 1990 information was not available for all 80 women randomised. Six women in the intervention group and one in the control group were missing from follow‐up at 10 days postpartum when outcomes were assessed. However, there were no differences reported in baseline characteristics among those followed up. In Fernandez 1993, 1373 women were conscripted with an intention to treat. Eighty‐two of these women were excluded after randomisation from the treated group. Among the 1291 eventually analysed, 91 unknowns (it was unknown whether they had infection or not) were reported.
Selective reporting
Two studies (Fernandez 1993; Neto 1990) reported on all prespecified outcomes and we therefore considered them to be at a low risk of reporting bias. We assessed the Turck 1962 study as being at a high risk of reporting bias because the trial report did not provide details on the frequency of some outcomes including adverse effects and hospital stay.
Other potential sources of bias
We found no other important risks of bias for the three included trials (Fernandez 1993; Neto 1990; Turck 1962).
Effects of interventions
See summary of findings Table for the main comparison table for results of the main comparison: use of prophylactic antibiotics, compared to placebo or no treatment, after normal vaginal birth.
Routine antibiotic prophylaxis versus no treatment/placebo
Primary outcomes
Incidence of severe maternal infectious morbidity (including septicaemia, septic shock, laparotomy/hysterectomy for infection, maternal intensive care unit (ICU) admission, or organ failure) as reported by trial authors
The incidence of severe maternal infectious morbidity was not addressed by any of the included studies.
Endometritis (with or without myometritis and with or without salpingitis causing maternal febrile morbidity), as reported by the trial authors.
Prophylactic antibiotics after uncomplicated vaginal birth may reduce the risk of endometritis by 72% (risk ratio (RR) 0.28, 95% confidence interval (CI) 0.09 to 0.83, two trials, 1364 women, very low‐quality evidence, see Analysis 1.1). However, one trial was of very small size (73 women) and reported zero events for this outcome (Neto 1990).
Urinary tract infection (fever or dysuria and positive urine culture)
There was substantial heterogeneity (I2 = 67%, P = 0.08) for the risk of urinary tract infection between the two trials contributing data. Pooled estimates from a random‐effects model showed that there was little or no difference in the risk of urinary tract infection (RR 0.25, 95% CI 0.05 to 1.19, T2 = 0.84 , two trials, 1706 women, low‐quality evidence, see Analysis 1.2). We deemed a pooled estimate to be appropriate, as the effect sizes of both trials were in the same direction and the characteristics of the women were considered similar; both studies were conducted in high‐income countries and most of the women had in‐out catheterisation. It is noteworthy that the 16 women who were excluded from Turck 1962 had the highest incidence of urinary tract infection. Four of 16 women not given either antibiotics or placebo had symptoms of urinary infection early in the puerperium. This analysis also presents our subgroup analysis according to the duration of prophylactic antibiotics and the risk of urinary tract infections, as the two trials used short‐duration (single dose) (Fernandez 1993) or long‐duration (3 to 5 days) (Turck 1962) regimens. Applying a fixed‐effect model produced, as expected, a narrower CI and suggests a reduction in the risk of urinary tract infection (RR 0.25, 95% CI 0.11 to 0.57). However, this analysis should be interpreted with caution, as the two included trials tested different antibiotic regimens, used different comparison groups (placebo or no treatment) and Turck 1962 had a quasi‐randomised design.
Secondary outcomes
There were few or no differences between the treated and control groups for the risk of episiotomy wound infection, reported as wound dehiscence, in the included trials (RR 0.78, 95% CI 0.31 to 1.96, T2 = 0.15, I2 = 33%, P = 0.22, two trials, 1364 women, very low‐quality evidence, see Analysis 1.3). There is substantial heterogeneity in the analysis of risk of episiotomy infection. Although the P value is not significant and the CI of the only two studies included in this analysis overlap greatly, we considered the characteristics of women in both trials to be different. Indeed, one trial included only low socioeconomic‐class women from one public hospital in one middle‐income country, while the other trial was conducted in a high‐income country. This baseline difference in risk could explain the greater effect of antibiotics use to prevent infection after episiotomy in Neto 1990. A random‐effects model also equalised the weighting of the contributing studies. A fixed‐effect model showed a very similar estimate (RR 0.78, 95% CI 0.38 to 1.61) without changes in the overall effect.
There were few or no differences between treated and control groups for reported adverse effects (RR 3.03, 95% CI 0.32 to 28.95, two trials, 1706 women, very low‐quality evidence, see Analysis 1.4). One woman in each study recorded skin rash related to antibiotic intake, which resolved with cessation of the drug (Turck 1962) and within a few hours in the other study (Fernandez 1993). In the former, one of the 217 women treated with sulphamethoxypyridazine developed a maculopapular rash and had an untoward reaction of sufficient severity to warrant discontinuation of the drug. Turck 1962 also reported that "the incidence of unexplained pyrexia, headache or dizziness" was similar in both groups. No other maternal or neonatal adverse effects were reported.
There were few or no differences between treated and control groups in the length of maternal hospital stay in days (mean difference ‐0.15, 95% CI ‐0.31 to 0.01, one trial (Fernandez 1993), 1291 women, very low‐quality evidence, see Analysis 1.5). No data were provided for comparisons between groups in the other included studies. However, Turck 1962 reported that the length of hospital stay was slightly prolonged in women with symptomatic illness, but that in general the length of hospital stay was similar between the two groups.
A 2½‐fold increase in costs of care in the control group was reported in Fernandez 1993, compared to antibiotic prophylaxis (USD 3600: USD 9000, one trial, 1291 women, see Analysis 1.6). These costs included prophylactic antibiotics, treatment of endometritis and hospitalisations. These estimates did not include expenditures related to prolonged hospitalisation of the newborn or subsequent management of possible secondary sterility.
The incidence of antimicrobial resistance and women's satisfaction with care were not addressed by any of the included studies.
Discusión
Resumen de los resultados principales
Se encontró una reducción acentuada en el riesgo de endometritis puerperal en las pacientes que recibieron antibióticos profilácticos habituales en comparación con las pacientes que recibieron placebo o ningún tratamiento. Hubo poca o ninguna diferencia entre los grupos en el riesgo de infección urinaria, infección de la herida y duración de la estancia hospitalaria. Los efectos adversos debido a la administración de antibióticos se informaron en una mujer en dos estudios. No se proporcionaron datos sobre la incidencia de morbilidad infecciosa materna grave, la resistencia antimicrobiana ni la satisfacción de las pacientes con la atención.
Los regímenes de profilaxis con antibióticos utilizados en los estudios incluidos son muy variables en cuanto a la clase de antibiótico utilizado y la duración del ciclo. Solo un ensayo utilizó un régimen acorde con la comprensión actual de la profilaxis con antibióticos, como un ciclo a corto plazo de menos de 24 horas. Sin embargo, el análisis de subgrupos según la duración de la profilaxis se limitó solo al resultado infecciones urinarias, ya que no hubo suficientes datos disponibles para los otros dos resultados primarios de esta revisión. También es de señalar que las pacientes reclutadas en los tres ensayos recibieron algún tipo de intervención durante el parto vaginal normal, como episiotomía y cateterismo vesical para evacuación, lo que puede haber aumentado el riesgo inicial de infección.
La administración de antibióticos profilácticos después de un parto vaginal normal puede tener éxito en la prevención de la endometritis puerperal. Sin embargo, la naturaleza de los estudios y los escasos números de participantes, así como la frecuencia baja de eventos (un ensayo no informó eventos) limitan la posibilidad de establecer conclusiones sólidas sobre los efectos beneficiosos de las prescripciones habituales de antibióticos, sobre todo en pacientes que tuvieron un parto sin complicaciones.
El costo del tratamiento y la posibilidad de prevención de la endometritis sugieren un posible efecto beneficioso de la profilaxis habitual con antibióticos. Sin embargo, la baja incidencia de endometritis en los estudios incluidos indica que es posible que haya que tratar a muchas pacientes para evitar unos pocos casos de endometritis. El tratamiento de un gran número de pacientes sin riesgo de desarrollar endometritis plantea el problema de exponer a las madres y a sus recién nacidos a tratamientos innecesarios y a la amenaza de aumentar los modelos de resistencia antimicrobiana. Otra revisión Cochrane analiza diferentes regímenes de antibióticos para el tratamiento de la endometritis posparto (Mackeen 2015).
La incidencia de infecciones urinarias también fue relativamente baja. Se encontró heterogeneidad significativa entre los estudios en la incidencia de infección urinaria, pero se consideró apropiado realizar una estimación agrupada porque los tamaños del efecto en ambos ensayos fueron en la misma dirección y mostraron cierta superposición clínica. Sin embargo, este análisis se debe interpretar con precaución porque solo incluyó dos ensayos que analizaron diferentes regímenes de antibióticos (clase de fármaco y duración del tratamiento), utilizaron diferentes grupos de comparación (placebo o ningún tratamiento) y períodos de seguimiento y un ensayo tuvo un diseño cuasialeatorio. En las diferencias entre los estudios también puede haber influido el cateterismo (aunque fue único), lo que puede haber afectado la relativamente elevada incidencia de infección, como se observó en el grupo control y en las pacientes excluidas en un estudio.
La incidencia de infección de la herida y la duración de la estancia hospitalaria fueron similares en las pacientes tratadas y sin tratar, pero el número escaso de participantes en los estudios limita la posibilidad de establecer conclusiones sobre los efectos beneficiosos de la administración de antibióticos. El informe de los efectos adversos de los antibióticos en dos estudios es de interés, aunque fueron muy pocos, como era de esperar.
Compleción y aplicabilidad general de las pruebas
La frecuencia de la profilaxis habitual con antibióticos es alta en los países de ingresos bajos y medios. Los estudios elegibles proporcionaron datos de dos países de altos ingresos (Francia y EE.UU.) y un país de bajos ingresos (Brasil) en los años sesenta y noventa. El riesgo de sesgo varió de alto a bajo en varios dominios.
Se encontró heterogeneidad significativa en la incidencia de infección urinaria entre los dos estudios que informaron este resultado. Este análisis también permitió la exploración del análisis de subgrupos planificado para la diferencia en la duración del tratamiento, lo que indica diferencias entre los grupos. Esta observación también se podría interpretar en términos de diferencias en el método de comparación o la clase de fármaco entre los estudios. Sin embargo, el efecto fue similar y en la misma dirección para ambos subgrupos, como se demuestra por la superposición de los intervalos de confianza. No obstante, la escasez de estudios y las frecuencias de los participantes limitó una interpretación adicional.
Finalmente, los dos ensayos controlados cuasialeatorios incluidos en esta revisión administraron antibióticos (cloranfenicol, sulfametoxipiridazina) con un uso limitado en la práctica clínica actual, lo que hace surgir interrogantes acerca de la aplicabilidad de los resultados de estos ensayos en la práctica obstétrica actual.
Calidad de la evidencia
El resultado "infección de la herida" se ajustó para incluir la dehiscencia de la episiotomía, como la informaron los autores, como un signo de infección de la episiotomía. Las evaluaciones del riesgo de sesgo variaron de bajo a alto, aunque la mayoría de los dominios tuvieron alto riesgo de sesgo en los estudios incluidos, debido a la ocultación insuficiente de las asignaciones y el cegamiento.
La calidad de la evidencia según la evaluación GRADE varió de baja a muy baja en todos los resultados informados (Resumen de los hallazgos para la comparación principal), debido a limitaciones muy graves en el diseño, a los tamaños pequeños de la muestra, los pocos eventos y los intervalos de confianza amplios.
Sesgos potenciales en el proceso de revisión
La revisión se realizó según las recomendaciones proporcionadas en el Manual Cochrane de Revisiones Sistemáticas de Intervenciones (Higgins 2011). También se realizó una búsqueda exhaustiva de varios registros de ensayos (en inglés o no) y se evaluaron los resultados para la elegibilidad, lo que minimizó los posibles sesgos .
Acuerdos y desacuerdos con otros estudios o revisiones
Hasta donde se conoce, no hay otra revisión sistemática ni estudio relacionados con la administración de profilaxis habitual con antibióticos para la prevención de la morbilidad o la mortalidad maternas en pacientes que tuvieron partos vaginales normales.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
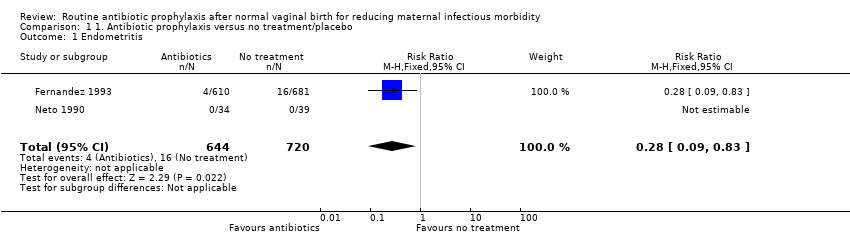
Comparison 1 1. Antibiotic prophylaxis versus no treatment/placebo, Outcome 1 Endometritis.

Comparison 1 1. Antibiotic prophylaxis versus no treatment/placebo, Outcome 2 Urinary tract infection.

Comparison 1 1. Antibiotic prophylaxis versus no treatment/placebo, Outcome 3 Wound infection (episiotomy dehiscence).
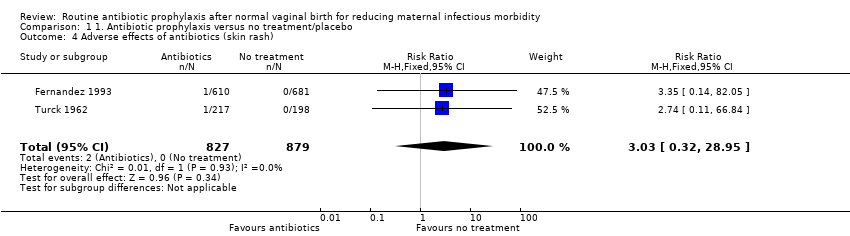
Comparison 1 1. Antibiotic prophylaxis versus no treatment/placebo, Outcome 4 Adverse effects of antibiotics (skin rash).
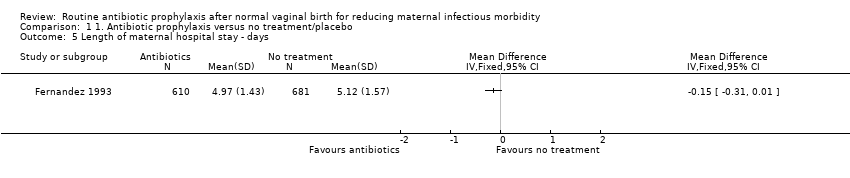
Comparison 1 1. Antibiotic prophylaxis versus no treatment/placebo, Outcome 5 Length of maternal hospital stay ‐ days.
| Study | Experimental | Control |
| Fernandez 1993 | 3600 USD | 9000 USD |
Comparison 1 1. Antibiotic prophylaxis versus no treatment/placebo, Outcome 6 Cost of care (cost of antibiotic prophylaxis, prolonged hospitalisation and treatment of endometritis).
| Routine antibiotic prophylaxis compared to no treatment/placebo for preventing infections in women who had normal vaginal births | ||||||
| Patient or population: Women who had normal vaginal births | ||||||
| Outcomes | Anticipated absolute effects* (95% CI) | Relative effect | № of participants | Quality of the evidence | Comments | |
| Risk with no treatment/placebo | Risk with routine antibiotic prophylaxis | |||||
| Incidence of severe maternal infectious morbidity (including septicaemia, septic shock, laparotomy/hysterectomy for infection, maternal intensive care unit admission, or organ failure) | not estimable | not estimable | not estimable | 0 | ‐ | No trial reported this outcome |
| Endometritis | Study population | RR 0.28 | 1364 | ⊕⊝⊝⊝ | ‐ | |
| 23 per 1000 | 7 per 1000 | |||||
| Urinary tract infection | Study population | RR 0.25 | 1706 | ⊕⊕⊝⊝ | ‐ | |
| 32 per 1000 | 8 per 1000 | |||||
| Wound infection (episiotomy dehiscence) | Study population | RR 0.78 | 1364 | ⊕⊝⊝⊝ | ‐ | |
| 7 per 1000 | 10 per 1000 | |||||
| Adverse effects of antibiotics (skin rash) | Study population | RR 3.03 | 1706 | ⊕⊝⊝⊝ | ‐ | |
| 0 per 1000 | 0 per 1000 | |||||
| Length of maternal hospital stay | The mean length of maternal hospital stay (including maternal re‐admission to hospital) was 5.12 days | MD 0.15 lower | not estimable | 1291 | ⊕⊝⊝⊝ | ‐ |
| Individual antimicrobial resistance | not estimable | not estimable | not estimable | 0 | ‐ | No trial reported this outcome |
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Two studies with very serious design limitations (‐2). | ||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Endometritis Show forest plot | 2 | 1364 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.28 [0.09, 0.83] |
| 2 Urinary tract infection Show forest plot | 2 | 1706 | Risk Ratio (M‐H, Random, 95% CI) | 0.25 [0.05, 1.19] |
| 2.1 Short‐duration prophylaxis | 1 | 1291 | Risk Ratio (M‐H, Random, 95% CI) | 0.51 [0.18, 1.45] |
| 2.2 Long‐duration prophylaxis | 1 | 415 | Risk Ratio (M‐H, Random, 95% CI) | 0.11 [0.03, 0.46] |
| 3 Wound infection (episiotomy dehiscence) Show forest plot | 2 | 1364 | Risk Ratio (M‐H, Random, 95% CI) | 0.78 [0.31, 1.96] |
| 4 Adverse effects of antibiotics (skin rash) Show forest plot | 2 | 1706 | Risk Ratio (M‐H, Fixed, 95% CI) | 3.03 [0.32, 28.95] |
| 5 Length of maternal hospital stay ‐ days Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 6 Cost of care (cost of antibiotic prophylaxis, prolonged hospitalisation and treatment of endometritis) Show forest plot | Other data | No numeric data | ||

