Corticosteroides orales de corta duración solos para la rinosinusitis crónica
Resumen
Antecedentes
Esta revisión es una de un conjunto de seis revisiones Cochrane que examinan las opciones primarias de tratamiento médico para los pacientes con rinosinusitis crónica.
La rinosinusitis crónica es una afección frecuente que incluye la inflamación del recubrimiento de la nariz y los senos paranasales. Se caracteriza por obstrucción nasal y secreción nasal, presión / dolor facial y pérdida del sentido del olfato. La enfermedad puede ocurrir con o sin pólipos nasales. Los corticosteroides orales se utilizan para controlar la respuesta inflamatoria y mejorar los síntomas.
Objetivos
Evaluar los efectos de los corticosteroides orales en comparación con placebo / ninguna intervención u otras intervenciones farmacológicas (corticosteroides intranasales, antibióticos, antimicóticos) para la rinosinusitis crónica.
Métodos de búsqueda
El Especialista en Información del Grupo Cochrane de Enfermedades de Oído, Nariz y Garganta (Cochrane ENT Group) buscó en el Registro de Ensayos del Grupo; Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL 2015, número 7); MEDLINE; EMBASE; ClinicalTrials.gov; ICTRP y fuentes adicionales de ensayos publicados y no publicados. La fecha de la búsqueda fue 11 de agosto de 2015.
Criterios de selección
Ensayos controlados aleatorios (ECA) que compararon un tratamiento de corta duración (hasta 21 días) de corticosteroides orales con placebo o ningún tratamiento o con otras intervenciones farmacológicas.
Obtención y análisis de los datos
Se utilizaron los procedimientos metodológicos estándar previstos por Cochrane. Los resultados primarios fueron la calidad de vida relacionada con la salud (CdVRS) específica de la enfermedad, la gravedad de la enfermedad informada por el paciente y el evento adverso trastornos del estado de ánimo o conductuales. Los resultados secundarios incluyeron la CdVRS general, la puntuación de pólipo nasal por endoscopia, la puntuación del examen de tomografía computarizada (TC) y los eventos adversos insomnio, trastornos gastrointestinales y osteoporosis. Se utilizó GRADE para evaluar la calidad de las pruebas para cada resultado; esto se indica en cursiva .
Resultados principales
Se incluyeron ocho ECA (474 participantes asignados al azar) que compararon corticosteroides orales con placebo o ninguna intervención. Todos los ensayos solamente reclutaron adultos con rinosinusitis crónica con pólipos nasales. Todos los ensayos informaron los resultados a las dos a tres semanas, al final del período de tratamiento con esteroides orales de corta duración. Tres ensayos informaron además los resultados a los tres a seis meses. Dos de estos estudios prescribieron esteroides intranasales a los pacientes en ambos brazos del ensayo al final del período de tratamiento con esteroides orales.
Esteroides orales versus placebo o ninguna intervención
La calidad de vida relacionada con la salud específica de la enfermedad se informó en un estudio. Este estudio informó una mejor calidad de vida después del tratamiento (dos a tres semanas) en el grupo que recibió esteroides orales en comparación con el grupo que recibió placebo (diferencia de medias estandarizada [DME] ‐1,24; intervalo de confianza [IC] del 95%: ‐1,92 a ‐0,56; 40 participantes, RSOM‐31 modificado), lo que corresponde a un tamaño grande del efecto. Las pruebas se evaluaron como de baja calidad (no existe seguridad acerca de la estimación del efecto; el efecto verdadero puede ser considerablemente diferente de la estimación del efecto).
La gravedad de la enfermedad medida según las puntuaciones de los síntomas informados por el paciente, se proporcionó en dos estudios, lo que permitió combinar en una puntuación los cuatro síntomas clave utilizados para definir la rinosinusitis crónica (obstrucción nasal, secreción nasal, presión facial, hiposmia). Los resultados al final del tratamiento (dos a tres semanas) mostraron una mejoría en los pacientes que recibieron esteroides orales en comparación con placebo, ya sea cuando se presentaron como un valor final medio (DME ‐2,84; IC del 95%: ‐4,09 a ‐1,59; 22 participantes) o como un cambio a partir del valor inicial (DME ‐2,28; IC del 95%: ‐2,76 a ‐1,80; 114 participantes). Lo anterior corresponde con tamaños grandes del efecto, pero las pruebas se evaluaron como de baja calidad.
Un estudio (114 participantes) siguió a los pacientes durante diez semanas después del período de tratamiento de dos semanas. Todos los pacientes de ambos brazos recibieron esteroides intranasales al final del período de tratamiento con esteroides orales. Los resultados mostraron que los resultados iniciales después del tratamiento no se mantuvieron (DME ‐0,22; IC del 95%: ‐0,59 a 0,15; 114 participantes, porcentaje de mejoría a partir del valor inicial). Lo anterior corresponde con un tamaño pequeño del efecto y las pruebas se evaluaron como de baja calidad.
Hubo un aumento de los eventos adversos en los pacientes que recibieron esteroides orales en comparación con placebo para los trastornos gastrointestinales (cociente de riesgos [CR] 3,45; IC del 95%: 1,11 a 10,78; 187 participantes; tres estudios) y el insomnio (CR 3,63; IC del 95%: 1,10 a 11,95; 187 participantes; tres estudios). Los esteroides orales no repercutieron significativamente sobre los trastornos del estado de ánimo a la dosis utilizada en el estudio incluido (cociente de riesgos [CR] 2,50; IC del 95%: 0,55 a 11,41; 40 participantes; un estudio). Las pruebas se evaluaron como de baja calidad debido a la falta de definiciones de los eventos adversos y el número pequeño de eventos, del tamaño de la muestra, o ambos).
Otras comparaciones
Ningún estudio que comparó los esteroides orales de corta duración con otro tratamiento para la rinosinusitis crónica cumplió con los criterios de inclusión.
Conclusiones de los autores
Al final del ciclo de tratamiento (dos a tres semanas) hay una mejoría en la calidad de vida relacionada con la salud y la gravedad de los síntomas en los pacientes con rinosinusitis crónica con pólipos nasales que recibieron corticosteroides orales en comparación con placebo o ningún tratamiento. La calidad de las pruebas que apoyan esta conclusión es baja. A los tres a seis meses después del final del período de tratamiento con esteroides orales, hay poca o ninguna mejoría en la calidad de vida relacionada con la salud o la gravedad de los síntomas en los pacientes que recibieron un ciclo inicial de esteroides orales en comparación con placebo o ningún tratamiento.
Los datos sobre los efectos adversos asociados con los ciclos cortos de corticosteroides orales indican que puede haber un aumento del insomnio y los trastornos gastrointestinales, pero no está claro si hay un aumento de los trastornos del estado de ánimo. Todos los resultados de los eventos adversos se basan en pruebas de baja calidad.
Se requieren más estudios de investigación en esta área, en concreto estudios que evalúen pacientes con rinosinusitis crónica sin pólipos nasales, resultados a más largo plazo y los efectos adversos.
No existen pruebas para los esteroides orales comparados con otros tratamientos.
PICOs
Resumen en términos sencillos
Corticosteroides orales de corta duración comparados con ningún tratamiento u otros tratamientos para la rinosinusitis crónica
Pregunta de la revisión
Se examinaron las pruebas de los efectos beneficiosos y perjudiciales de un tratamiento de corta duración (habitualmente hasta 21 días) de corticosteroides administrados por vía oral a los pacientes con rinosinusitis crónica en comparación con un placebo o ningún tratamiento, u otro tipo de tratamiento.
Antecedentes
La rinosinusitis crónica es una afección frecuente que se define como inflamación de la nariz y los senos paranasales (un grupo de espacios llenos de aire detrás de la nariz, los ojos y las mejillas). Los pacientes con rinosinusitis crónica al menos presentan dos o más de los siguientes síntomas durante al menos 12 semanas: obstrucción nasal, secreción por la nariz o rinorrea, dolor o presión en la cara o disminución del sentido del olfato (hiposmia). Algunos pacientes también presentarán pólipos nasales, que son tumefacciones similares a uvas del recubrimiento nasal normal dentro de la vía nasal y los senos.
Los ciclos cortos de corticosteroides orales son un tratamiento utilizado generalmente para la rinosinusitis crónica. Funcionan al controlar la respuesta inflamatoria y cuando existen pólipos, reducen rápidamente su tamaño para mejorar los síntomas. Los efectos adversos de los corticosteroides pueden incluir insomnio, cambios del estado de ánimo y cambios gastrointestinales (como dolor de estómago, acidez, diarrea, estreñimiento, náuseas y vómitos). Cuando se administran a más largo plazo, o durante muchos ciclos cortos repetidos, también es posible desarrollar osteoporosis (huesos frágiles).
Características de los estudios
Esta revisión incluye pruebas hasta el 11 de agosto de 2015. Se incluyeron ocho ensayos controlados aleatorios con un total de 474 participantes. Todos los pacientes fueron adultos que presentaban rinosinusitis crónica con pólipos nasales. Todos los estudios siguieron a los pacientes hasta el final del tratamiento (dos a tres semanas) y tres estudios (210 participantes) siguieron a los pacientes durante tres a seis meses después de haber finalizado el tratamiento. Cinco de los ocho informes mencionan cómo se financió el estudio. Ninguna de las fuentes de financiación era compañía farmacéutica.
Resultados clave
Al final de un ciclo de tratamiento de dos o tres semanas, los pacientes que tomaron esteroides orales pueden haber tenido una mejor calidad de vida, síntomas menos graves y pólipos nasales más pequeños que los pacientes que tomaron placebo o no recibieron tratamiento. Después de tres a seis meses hubo poca o ninguna diferencia en la calidad de vida, la gravedad de los síntomas o los pólipos nasales entre los pacientes que tomaron esteroides orales y los que tomaron placebo o ninguna intervención.
Los pacientes que tomaron esteroides orales pueden haber tenido más trastornos gastrointestinales e insomnio que los pacientes que tomaron placebo o ninguna intervención. No está claro si los pacientes que tomaron esteroides orales tuvieron más trastornos del estado de ánimo que los pacientes que tomaron placebo o ninguna intervención.
Calidad de la evidencia
La calidad de las pruebas de los esteroides orales más los esteroides intranasales en los adultos con pólipos nasales se valoró como baja (es muy probable que estudios de investigación adicionales tengan una repercusión marcada sobre la confianza en la estimación del efecto y es probable que cambien la estimación), ya que algunos de los resultados provienen de solamente uno o dos estudios que no tienen muchos participantes. La mayoría de los ensayos no tuvo alto riesgo de sesgo, pero solamente se incluyeron en la revisión pacientes con pólipos nasales.
Conclusiones de los autores
Summary of findings
| Short‐course oral corticosteroids compared with placebo/no treatment for chronic rhinosinusitis | ||||||
| Patient or population: chronic rhinosinusitis with nasal polyps | ||||||
| Outcomes № of participants | Relative effect | Anticipated absolute effects* (95% CI) | Quality | What happens | ||
| Without oral steroids | With oral steroids | Difference | ||||
| Disease‐specific health‐related quality of life measured by Follow‐up: 2 weeks № of participants: 40 | — | Not estimable | — | The mean disease‐specific health‐related quality of life in the intervention group was 1.24 standard deviations lower (1.92 lower to 0.56 lower) | ⊕⊕⊝⊝ | A lower score indicates reduced impairment. Treatment effect in favour of short‐course oral steroids.
|
| Disease severity, as measured by patient‐reported symptom score,
| — | — | — |
| ⊕⊕⊝⊝ ⊕⊕⊝⊝ ⊕⊕⊝⊝ | A lower score indicates milder symptoms in favour of short‐course oral steroids.
|
| Adverse events: significant mood disturbance № of participants: 40 | RR 2.50 | Study population | ⊕⊕⊝⊝ | It is uncertain whether there were more mood disturbance adverse events in the oral corticosteroids group. | ||
| 100 per 1000 | 250 per 1000 | 150 more per 1000 (45 fewer to 1041 more) | ||||
| Health‐related quality of life, using generic quality of life scores | This outcome was not reported in any of the studies | |||||
| Adverse events: gastrointestinal disturbance Follow‐up: 3 months № of participants:187 | RR 3.45 | Study population | ⊕⊕⊝⊝ | There were more gastrointestinal disturbance adverse events in the oral corticosteroids group. | ||
| 47 per 1000 | 160 per 1000 | 114 more per 1000 (5 more to 455 more) | ||||
| Adverse events: insomnia Follow‐up: 3 months № of participants:187 | RR 3.63 | Study population | ⊕⊕⊝⊝ | There were more insomnia adverse events in the oral corticosteroids group. | ||
| 23 per 1000 | 84 per 1000 | 61 more per 1000 (2 more to 255 more) | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Downgraded to low quality due to limitations in study methodology and imprecision. Only the disease severity scale of the RSOM‐31 was used (unknown validity of this subscale and the range of scores is unclear). One small study (n = 40), which lacked information about the method of randomisation and allocation concealment. There is a also concern that the magnitude of improvement is not sustained; one study that used a non‐validated instrument reported smaller benefit at three to six months than at two to three weeks for health‐related quality of life. 2The individual symptoms measured were: nasal obstruction, nasal discharge, sense of smell and pressure over the sinuses. Scores for the individual symptoms (0 to 10 visual analogue scale (VAS)) were summed to find the total score.The effect size could be underestimated with this method. 3Downgraded to low quality due to imprecision. Results are from one very small study (n = 22) and the results were only measured at the end of treatment (17 days). There is a concern that the magnitude of improvement is not sustained. The outcome was not measured using a validated tool. 4Downgraded to low quality due to limitations in study methodology and imprecision. One small study (n = 40), which lacked information about the method of randomisation and allocation concealment. The definition of 'mood disturbance' is not provided in the paper. The results have large confidence intervals. 5Downgraded to low quality due to inconsistency and imprecision. The terminology between the papers for this outcome differed from "diarrhoea/GI disturbance" to "gastrointestinal disturbance" to "reflux and/or gastric pain". A low number of events were reported resulting in large confidence intervals. 6Downgraded to low quality due to inconsistency and imprecision. The definition of 'insomnia' is not provided in the papers. A low number of events were reported resulting in large confidence intervals. 7The individual symptoms measured were: blocked nose, rhinorrhoea, hyposmia and sinonasal pain. The results were measured as individual symptoms on a seven‐point Likert scale (0 = no symptoms) and presented as percentage change from baseline for each symptom, which was averaged across the four symptoms to create an average change from baseline. The effect size could be underestimated with this method. 8All patients in both groups received intranasal steroids at the end of the treatment period until the end of follow‐up (12 weeks). 9Downgraded to low quality due to limitations in study methodology and imprecision. Results are from one small study (n = 117) with unclear randomisation and allocation concealment. The results were measured at the end of treatment (two weeks). There is a concern that the results are not sustained. The outcome was not measured using a validated tool. 10Downgraded to low quality due to limitations in study methodology and imprecision. Results are from one small study (n = 117) with unclear randomisation and allocation concealment. There is a small effect size with large confidence intervals. The outcome was not measured using a validated tool. | ||||||
Antecedentes
Descripción de la afección
La rinosinusitis crónica se define como la inflamación de la nariz y los senos paranasales caracterizada por dos o más síntomas, uno de los cuales debe ser bloqueo / obstrucción / congestión nasal o secreción nasal (goteo nasal anterior / posterior). Los otros síntomas posibles incluyen dolor / presión facial, disminución o pérdida del sentido del olfato (en los adultos) o tos (en los niños). Los síntomas deben haber continuado durante al menos 12 semanas. Además, los pacientes deben tener cambios de la mucosa dentro del complejo osteomeatal o los senos, demostrados en un examen de tomografía computarizada (TC) o mediante al menos uno de los siguientes signos endoscópicos: pólipos nasales, secreción mucopurulenta principalmente del meato medio o edema / obstrucción de la mucosa principalmente en el meato medio (EPOS 2012).
La rinosinusitis crónica representa una fuente frecuente de enfermedad; el 11% de los adultos del Reino Unido informaron síntomas de rinosinusitis crónica en un estudio en la población general (Hastan 2011). Los síntomas, que incluyen obstrucción nasal, secreción nasal, dolor facial, anosmia y trastornos del sueño, tienen una repercusión importante sobre la calidad de vida, supuestamente mayor en varios dominios del SF‐36 que la angina o la enfermedad respiratoria crónica (Gliklich 1995). Son frecuentes las exacerbaciones agudas, el control insuficiente de los síntomas y la exacerbación de las enfermedades respiratorias. Las complicaciones son poco frecuentes, pero pueden incluir deficiencia visual e infección intracraneal.
Se han identificado dos fenotipos principales de rinosinusitis crónica según la presencia o ausencia de pólipos nasales al examen. Los pólipos nasales son tumefacciones hiperplásicas similares a tumores de la mucosa nasal, y la mayoría se origina habitualmente desde el interior del complejo osteomeatal (Larsen 2004). La rinosinusitis crónica con pólipos nasales (RSCcPN) se diagnostica cuando se observan pólipos (directamente o al examen endoscópico) bilateralmente en el meato medio. Las siglas RSCsPN se utilizan para la afección en la que no hay pólipos presentes.
Aunque la etiología de la rinosinusitis crónica no se comprende completamente, puede incluir anomalías en la respuesta del huésped a los irritantes, microorganismos comensales y patógenos y alergenos, obstrucción de las vías de drenaje de los senos, anomalías de la función mucociliar normal, pérdida de la barrera de la mucosa normal o infección. Se pueden observar dos perfiles característicos en cuanto a los mediadores inflamatorios; en la rinosinusitis crónica eosinofílica, que se asocia habitualmente con pólipos nasales, es posible encontrar niveles altos de eosinófilos, inmunoglobulina E (IgE) e interleucina (IL)‐5, mientras que en la rinosinusitis crónica neutrofílica, asociada con mayor frecuencia con la rinosinusitis crónica sin pólipos, predominan los neutrófilos, con el interferón (IFN) gamma, la IL‐8 y el factor de necrosis tumoral (FNT) elevados (EPOS 2012).
Aunque las decisiones sobre el tratamiento se deben tomar según una comprensión del fenotipo de la rinosinusitis crónica del paciente y su probable etiología, en la práctica el tratamiento se puede iniciar sin el conocimiento del estado de los pólipos, en concreto en la atención primaria. Esta revisión (y la mayoría de las revisiones acompañantes) consideran juntos a los pacientes con y sin pólipos para la evaluación inicial de los efectos del tratamiento. Sin embargo, los análisis de subgrupos exploran las posibles diferencias entre estos pacientes (ver a continuación).
Las intervenciones utilizadas con mayor frecuencia para la rinosinusitis crónica se utilizan tópica (en spray nasal) o sistémicamente (por vía oral) e incluyen esteroides, antibióticos y solución salina.
Descripción de la intervención
Los ciclos cortos de esteroides orales se utilizan ampliamente en la medicina para diversas afecciones inflamatorias. En los pacientes con rinosinusitis crónica a menudo se utilizan con el objetivo de lograr una mejoría rápida en los síntomas y permitirles un mejor acceso a los agentes aplicados tópicamente. Habitualmente se administran durante un período de siete a 21 días y pueden ser a una dosis fija o incorporar una reducción de la dosis durante el ciclo. Esta estrategia se cree que reduce el riesgo de efectos adversos (Mygind 1996). Se ha informado un espectro amplio de eventos adversos con la administración de esteroides sistémicos (ver Tabla 1); sin embargo, hay una falta de datos sobre su incidencia en asociación con la rinosinusitis crónica. Aunque es posible extrapolar los resultados de los ensayos en otras enfermedades, existe el riesgo de que la incidencia sea específica de la enfermedad; por ejemplo, se observa una elevada incidencia de necrosis avascular con la administración de dosis altas de esteroides en el lupus eritematoso sistémico, que se atribuye en parte al proceso y la gravedad de la enfermedad subyacente, así como a las dosis mayores prescritas en la enfermedad grave (Da Silva 2006).
Se dice que los efectos adversos asociados con la administración a corto plazo de esteroides orales incluyen trastornos gastrointestinales, insomnio y alteración del estado mental. Sin embargo, hay pocos o ningún dato publicado sobre la frecuencia de estos efectos cuando se prescriben ciclos a corto plazo. Los efectos adversos asociados con la administración de los esteroides orales a largo plazo también se enumeran en la Tabla 1.
De qué manera podría funcionar la intervención
Los ciclos cortos de esteroides orales se utilizan con mayor frecuencia en los pacientes con rinosinusitis crónica con pólipos nasales. La intención es disminuir la inflamación para producir una reducción rápida del tamaño de los pólipos, mejorar los síntomas y permitir una mejor penetración de los tratamientos tópicos en la cavidad nasal. Se pueden utilizar de una manera similar en los pacientes con rinosinusitis crónica sin pólipos que presentan obstrucción nasal grave o anosmia total (pérdida del sentido del olfato). Se espera que el efecto inicial del tratamiento sea inmediato. Cualquier mejoría observada puede continuar, especialmente si un efecto de la intervención es mejorar la biodisponibilidad de un tratamiento complementario.
Sin embargo, no existen pruebas en relación al régimen de tratamiento óptimo de los corticosteroides orales en lo que se refiere a indicación, dosis y duración. El uso óptimo de los corticosteroides es clínicamente importante porque puede reducir la necesidad de una cirugía al proporcionar un buen control sintomático.
Por qué es importante realizar esta revisión
Los ciclos cortos de esteroides orales se utilizan generalmente solos o como una forma de tratamiento complementario en los pacientes con rinosinusitis crónica. Esta revisión y una revisión nueva estrechamente relacionada de "Esteroides orales de corta duración como tratamiento complementario para la rinosinusitis crónica", Head 2016a, actualizan y amplían una revisión Cochrane anterior que consideró este tratamiento en los pacientes con pólipos (Martinez‐Devesa 2011). Esta revisión intenta establecer la efectividad de los esteroides orales (en comparación con ningún tratamiento o placebo) y su efectividad relativa en comparación con otros agentes utilizados habitualmente para la rinosinusitis crónica (como los corticosteroides intranasales). Por otra parte, la revisión acompañante intenta establecer los efectos beneficiosos (y perjudiciales) adicionales de los esteroides cuando se agregan a los tratamientos existentes para la rinosinusitis crónica.
Esta revisión es una de un conjunto de revisiones Cochrane que examinan las opciones habituales de tratamiento para los pacientes con rinosinusitis crónica (Chong 2016a; Chong 2016b; Chong 2016c; Head 2016b; Head 2016a), y utiliza las mismas medidas de resultado entre las revisiones. No se incluyeron los estudios diseñados para evaluar las intervenciones en el período periquirúrgico inmediato, que se centran en la evaluación de la repercusión de la intervención sobre el procedimiento quirúrgico o en la modificación de los resultados posquirúrgicos (prevenir la recurrencia).
Objetivos
Evaluar los efectos de los corticosteroides orales en comparación con placebo / ninguna intervención u otras intervenciones farmacológicas (corticosteroides intranasales, antibióticos, antimicóticos) para la rinosinusitis crónica.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se incluyeron estudios con las siguientes características de diseño:
-
ensayos controlados aleatorios, incluidos los ensayos aleatorios grupales y los ensayos cuasialeatorios (los ensayos cruzados [crossover] solamente se incluyeron si estaban disponibles los datos de la primera fase); y
-
los pacientes se siguieron durante al menos dos semanas.
Se excluyeron estudios con las siguientes características de diseño:
-
pacientes asignados al azar por lado de la nariz (controlado en el mismo paciente) porque es difícil asegurar que los efectos de cualquiera de las intervenciones consideradas puedan ser localizados; o
-
los estudios perioperatorios, en los que la única finalidad del estudio fue investigar el efecto de la intervención sobre el resultado quirúrgico.
Tipos de participantes
Pacientes con rinosinusitis crónica, con pólipos o sin pólipos.
Se excluyeron los estudios que incluyeron una mayoría de pacientes con:
-
fibrosis quística;
-
sinusitis micótica alérgica / micótica eosinofílica / rinosinusitis mucinosa;
-
enfermedades respiratorias exacerbadas por la aspirina;
-
pólipos antrocoanales (pólipos benignos que se originaron de la mucosa del seno maxilar);
-
pólipos malignos;
-
discinesia ciliar primaria;
-
inmunodeficiencia grave (congénita o adquirida);
-
antecedentes de cirugía por pólipos nasales en el transcurso de seis semanas desde el ingreso al estudio.
Tipos de intervenciones
Se incluyeron todos los ciclos cortos (ver más adelante) de esteroides orales, independientemente de la dosis. Esta estrategia incluyó:
-
prednisona;
-
prednisolona;
-
metilprednisolona;
-
hidrocortisona;
-
acetato de cortisona.
Los ciclos cortos de esteroides orales se definen como los que duran hasta, pero no exceden, 21 días.
Las comparaciones principales fueron: placebo o ninguna intervención
Los principales pares de comparación fueron:
-
corticosteroides orales versus placebo o ningún tratamiento;
-
esteroides orales seguidos de corticosteroides intranasales versus placebo o ningún tratamiento seguido de corticosteroides intranasales.
Otros posibles pares de comparación incluyeron:
-
esteroides orales versus corticosteroides intranasales;
-
corticosteroides orales versus antibióticos;
-
esteroides orales versus antimicóticos.
Esta revisión forma parte de una serie más grande de seis revisiones del tratamiento de la rinosinusitis crónica.
-
Esteroides intranasales versus placebo o ninguna intervención para la rinosinusitis crónica (Chong 2016b).
-
Diferentes tipos de esteroides intranasales para la rinosinusitis crónica (Chong 2016a). Esta revisión compara diferentes clases, dosis y métodos de administración de los corticosteroides intranasales para la rinosinusitis crónica.
-
Esteroides orales de corta duración solos para la rinosinusitis crónica (la presente revisión). Esta revisión compara los esteroides orales de corta duración solos con placebo o ninguna intervención, o versus otras intervenciones farmacológicas como los antibióticos o la irrigación nasal de solución salina.
-
Esteroides orales de corta duración como tratamiento complementario para la rinosinusitis crónica (Head 2016a). Esta revisión compara los esteroides orales cuando se utilizaron como tratamiento complementario a otros tratamientos para la rinosinusitis crónica (como corticosteroides intranasales, antibióticos o solución salina).
-
Irrigación con solución salina para la rinosinusitis crónica (Chong 2016c). Esta revisión compara la irrigación nasal con solución salina para la rinosinusitis crónica con placebo / ninguna intervención y con corticosteroides intranasales o antibióticos.
-
Antibióticos sistémicos y tópicos para la rinosinusitis crónica (Head 2016b). Esta revisión compara los antibióticos tópicos y sistémicos con placebo / ningún tratamiento, dos antibióticos diferentes entre sí y antibióticos con corticosteroides intranasales.
Tipos de medida de resultado
Se analizaron los siguientes resultados en la revisión, aunque no se utilizaron como base para incluir o excluir los estudios.
Los efectos a corto plazo (al final del tratamiento) y a largo plazo son importantes, por lo que se evaluaron como resultados al final del tratamiento o en el transcurso de tres semanas desde el final, y además de tres a seis meses, de seis a 12 meses y más de 12 meses. Para los eventos adversos se analizaron los datos de los períodos más prolongados.
Resultados primarios
-
Calidad de vida relacionada con la salud, mediante puntuaciones de calidad de vida relacionada con la salud específica de la enfermedad como la Sino‐Nasal Outcome Test‐22 (SNOT‐22), las Rhinosinusitis Outcome Measures‐31 (RSOM‐31) y la SNOT‐20.
-
Gravedad de la enfermedad, medida según la puntuación de los síntomas informados por el paciente (como el Chronic Sinusitis Survey [CSS] y escalas analógicas visuales). A falta de datos validados de la puntuación de los síntomas, se informaron las puntuaciones de los síntomas individuales informadas por el paciente para los siguientes síntomas: obstrucción / bloqueo / congestión nasal, secreción nasal (rinorrea), presión / dolor facial, pérdida del sentido del olfato (adultos), tos (niños).
-
Efecto adverso significativo: trastornos del estado de ánimo o conductuales.
Resultados secundarios
-
Calidad de vida relacionada con la salud, mediante puntuaciones genéricas de la calidad de vida como SF‐36, EQ‐5D y otros instrumentos correctamente validados.
-
Otros efectos adversos: trastornos gastrointestinales.
-
Otros efectos adversos: insomnio.
-
Otros efectos adversos: osteoporosis.
-
Puntuación endoscópica (según la población, o la puntuación del tamaño de los pólipos nasales o la puntuación por endoscopia, p.ej. Lund‐Mackay/Lund‐Kennedy).
-
Puntuación del examen por tomografía computarizada (TC) (p.ej. Lund‐Mackay).
Los eventos adversos que se obtuvieron de los estudios que incluyeron uno de los diversos comparadores enumerados anteriormente, fueron iguales que los que se obtuvieron en las revisiones acompañantes que evalúan los efectos de estas intervenciones como tratamientos primarios.
Results
Description of studies
Results of the search
The searches retrieved a total of 2470 references after removal of duplicates. We screened titles and abstracts and subsequently removed 2424 studies. We assessed 46 full texts for eligibility. We excluded 30 studies, with reasons. Thirteen papers are included (eight studies). We identified three ongoing studies. There are no studies awaiting assessment.
A flow chart of study retrieval and selection is provided in Figure 1.

Process for sifting search results and selecting studies for inclusion.
Included studies
We included eight published studies (13 papers) in the review (Alobid 2014; Benitez 2006; Ecevit 2015; Hissaria 2006; Kapucu 2012; Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). See Characteristics of included studies.
There were five papers from one group in Spain (Alobid 2014; Benitez 2006). After contacting the lead author of these papers we clarified that there were two separate trials reported within the different papers. We included the results from only two of these papers: Alobid 2014 for the more recent trial and Benitez 2006 for the earlier trial. The additional papers either present identical groups of patients, or results for subsets of patients.
The aim of the Ecevit 2015 study was to look at the impact of short‐course oral steroids on surgical outcomes. However, disease severity was reported after oral steroid treatment had completed but prior to surgery taking place and so we included the study in this review.
Two of the trials had more than two study arms (Kapucu 2012; Van Zele 2010). Kapucu 2012 was a four‐arm study that compared a short‐course oral steroid, an intra‐polyp steroid injection, intranasal steroid treatment (triamcinolone acetonide spray 55 μg, two times daily with two puffs in both nostril cavities) and a control group who were not given any medication. The oral steroid and the control group are included in this review. Van Zele 2010 was a three‐arm study comparing oral corticosteroids (methylprednisolone), placebo and antibiotics (doxycycline). Only the arm comparing oral steroids with placebo is included in this review although the results for the comparisons that include antibiotics are reported in Head 2016b.
Design
All eight included studies are parallel‐group, randomised controlled trials (Alobid 2014; Benitez 2006; Ecevit 2015; Hissaria 2006; Kapucu 2012; Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). Three studies were unblinded and no steroid treatment was provided in the control arm (Alobid 2014; Benitez 2006; Kapucu 2012). Five studies stated that participants and healthcare professionals were blind to the treatment group (Ecevit 2015; Hissaria 2006; Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). A further discussion of blinding is made in the section Blinding (performance bias and detection bias).
Setting
Four studies were conducted in ENT departments within hospitals (Alobid 2014; Benitez 2006; Ecevit 2015, Van Zele 2010), two in allergy outpatient clinics (Hissaria 2006; Kirtsreesakul 2012), and one in a speciality clinic (Vaidyanathan 2011). The setting of one study was unclear (Kapucu 2012).
Van Zele 2010 was a multicentre trial conducted on five sites in four countries (Belgium, Germany, Holland and Australia). Five studies were single‐centre: two in the same unit in Spain (Alobid 2014; Benitez 2006), one in Turkey (Ecevit 2015), one in Thailand (Kirtsreesakul 2012), and one in Scotland (Vaidyanathan 2011). The number of sites involved in the other studies are not known although one was from Australia (Hissaria 2006), and the other was Turkey (Kapucu 2012).
Participants and sample size
All of the published trials only included adults diagnosed with chronic rhinosinusitis with nasal polyps. There were 474 participants included in the comparison of oral steroids with placebo or no intervention.
The diagnostic criteria for inclusion into the trials varied by study. Three studies did not refer to a minimum grade of nasal polyps for inclusion (Hissaria 2006; Kapucu 2012; Kirtsreesakul 2012), although Hissaria 2006 recruited only "symptomatic polyp patients". Two studies included patients with moderate‐to‐severe bilateral polyps (Alobid 2014; Vaidyanathan 2011). Alobid 2014 based their inclusion on the EPOS 2012 criteria (Appendix 3) and Vaidyanathan 2011 was based on the European Position Paper on Rhinosinusitis and Nasal Polyps 2007.
Three papers included a more severely affected or recalcitrant population (Benitez 2006; Ecevit 2015; Van Zele 2010). Benitez 2006 only included people with "severe" nasal polyps (mean score: 2.7 out of a possible 3 using the Lildholdt score), whereas it was required in the participants in Van Zele 2010 that either the nasal polyps had recurred after surgical resection or were bilateral and grades 3 or 4 in both nares using their five‐point nasal polyp scoring scale (Appendix 4). In Ecevit 2015, the inclusion criteria were patients with moderate or severe nasal polyps who had not responded to a six‐week course of fluticasone nasal drops (200 µg/day). Out of 124 people treated with fluticasone, 23 met the inclusion criteria and were randomised to oral steroids or placebo.
Across all the included studies 67% of participants were male, in keeping with the male preponderance seen in a recent epidemiological study (Hopkins 2016; Philpott 2015). However, the mean age of participants was 46 years, which is a decade lower than the above referenced study; in fact it is notable that the mean age in the control arm of Ecevit 2015 was 26.6 years (although this may have been a reporting error) and the mean age for both arms in Kapucu 2012 was 32.2 years. These participant groups may therefore not be fully representative of the overall chronic rhinosinusitis population.
Interventions and comparisons
All of the eight included studies provided results for a short course of treatment (14 to 21 days) with oral steroids compared with placebo or no treatment (Alobid 2014; Benitez 2006; Ecevit 2015; Hissaria 2006; Kapucu 2012; Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010).
Four trials had washout periods prior to starting the trial (Alobid 2014; Benitez 2006; Kirtsreesakul 2012; Vaidyanathan 2011), in which the patients received no steroids in the two weeks (Vaidyanathan 2011), or four weeks prior to starting oral steroids (Alobid 2014; Benitez 2006; Kirtsreesakul 2012).
Three different oral steroids were given within the trials: prednisone (Alobid 2014; Benitez 2006), prednisolone (Ecevit 2015; Hissaria 2006; Kirtsreesakul 2012; Vaidyanathan 2011), and methylprednisolone (Kapucu 2012; Van Zele 2010). Both studies using prednisone started at 30 mg and reduced the dose over the 14‐day treatment course (reduced by 5 mg every two days) (Alobid 2014; Benitez 2006). For prednisolone, Ecevit 2015 gave a starting dose of 60 mg/day and then reduced this over the 17‐day treatment course. The other three studies gave a 14‐day course but with no reduction: Hissaria 2006 and Kirtsreesakul 2012 gave 50 mg/day whilst Vaidyanathan 2011 gave a lower dose of 25 mg/day. Both studies using methylprednisolone reduced the dose over the trial period. Kapucu 2012 gave oral methylprednisolone at a varying dose depending on the weight of the patient (1 mg/kg/day for three days then reduced by 8 mg/three days). The study did not give details of the average duration of treatment. Van Zele 2010 gave 32 mg/day on days one to five, 16 mg/day on days 6 to 10 and 8 mg/day on days 11 to 20.
The comparator in three studies was no steroid treatment (no placebo) (Alobid 2014; Benitez 2006; Kapucu 2012), placebo tablets in four studies (Ecevit 2015; Hissaria 2006; Kirtsreesakul 2012; Vaidyanathan 2011), and placebo capsules in one study (Van Zele 2010).
No information on any concurrent treatment was given in four studies (Alobid 2014; Benitez 2006; Ecevit 2015; Kapucu 2012). Other medications were not permitted during the oral steroid treatment stage in a further three (Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). Only Hissaria 2006 identified that participants were allowed to continue the use of regular antihistamines (33% (13/40)), topical corticosteroids (55% (22/40)), or both (it is unclear how many patients used both treatments).
Three studies followed up patients beyond the end of the oral steroid treatment phase (Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). Intranasal steroids were routinely prescribed to patients in both treatment arms at the end of the oral steroid treatment in two studies (Kirtsreesakul 2012; Vaidyanathan 2011). In Vaidyanathan 2011, all participants received fluticasone propionate nasal drops for eight weeks and then fluticasone propionate nasal spray for a further 18 weeks, making a total treatment time of 28 weeks (two weeks oral steroids or placebo followed by 26 weeks of intranasal steroids). In Kirtsreesakul 2012, all patients received mometasone furoate nasal spray for a further 10 weeks after initial treatment. Although patients were followed up at 12 weeks in Van Zele 2010, intranasal steroids were not routinely prescribed and were only permitted as rescue medication two months after dosing with the study medication.
Overall, the choice of oral corticosteroids used and the variety of differing regimens reflect the variety seen in mainstream clinical practice. Use of topical corticosteroids after the oral dose was included as a definitive part of the patient pathway in two studies, which reflects current practice.
Outcomes
One study did not report any of the primary or secondary outcomes as defined in the methods section of this review (Kapucu 2012).
Disease‐specific health‐related quality of life (HRQL)
This was measured in two studies using different measurement instruments (Hissaria 2006; Vaidyanathan 2011). Hissaria 2006 used the RSOM‐31 questionnaire to measure HRQL after treatment (14 days), but modified the scoring system, using only the severity parameter but not the importance parameter. Vaidyanathan 2011 used the Jupiter mini‐Rhinoconjunctivitis Quality of Life questionnaire (RQLQ) both immediately after treatment (14 days) and at 26 weeks after treatment. This scale is validated for patients with seasonal or perennial rhinoconjunctivitis but the validity of this instrument is not known in chronic rhinosinusitis patients and the scale is not clear within the paper.
Disease severity, as reported using patient‐reported outcomes
Five studies provided information on patient‐reported disease severity at the end of treatment in terms of a combined score or individual symptom scores, which could be combined into a single score (Ecevit 2015; Hissaria 2006; Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). The symptoms measured, the scales of measurement used and the way in which data were reported varied greatly between studies. See Effects of interventions. Three of the studies provided medium‐term data on patient‐reported symptoms after a follow‐up period of 10 to 12 weeks (Kirtsreesakul 2012; Van Zele 2010), and 26 weeks (Vaidyanathan 2011).
Endoscopic score
Nasal polyp size was reported at the end of treatment in seven studies (Alobid 2014; Benitez 2006; Ecevit 2015; Hissaria 2006; Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010), and after a three‐ to six‐month follow‐up in three studies (Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). Hissaria 2006 reported the estimated percentage reduction in polyp size using pairs of photographs taken pre‐ and post‐treatment. Five studies measured nasal polyps on a 0‐ to 3‐point scale although the definitions vary between categories (Alobid 2014; Benitez 2006; Ecevit 2015; Kirtsreesakul 2012; Vaidyanathan 2011), and Van Zele 2010 used a 0‐ to 4‐point scale. The scales used are summarised in Appendix 4. There was a lack of information in the papers about the methods used (e.g. was the value recorded the worst affected nostril or an average of the two nostrils?), about the validation of the scales used and about any precautions taken or calculation made to ensure consistency between investigators.
Adverse events
Two studies made no mention of whether adverse events were sought or identified in their papers (Alobid 2014; Benitez 2006). Two studies reported that no adverse effects were observed: Ecevit 2015 stated that "Adverse effects were not observed in either group", whilst Kapucu 2012 stated that "No systemic or local side effects of steroid treatment were seen in any patients". Vaidyanathan 2011 presented information about adverse events well, but did not report any of the specific adverse effects of oral steroids outcomes as pre‐defined by this review, although adverse events for intranasal steroid use after oral steroid treatment had finished were reported. The remaining three studies provided clear information about at least one of the adverse effects of interest (Hissaria 2006; Kirtsreesakul 2012; Van Zele 2010).
Excluded studies
We excluded 30 studies after reviewing the full paper. Further details of the reasons for exclusion are summarised in Characteristics of excluded studies. We identified 19 of these from the excluded papers list in previous version of the Cochrane review (Martinez‐Devesa 2011), and we found the reasons for exclusion from the previous review to still be valid under the updated inclusion criteria developed for this review (Alobid 2005; Blomqvist 2001; Blomqvist 2009; Bonfils 1998; Bonfils 2003; Bonfils 2006; Chi Chan 1996; Damm 1999; Hessler 2007; Jankowski 2003a; Jankowski 2003b; Kroflic 2006; Lildholdt 1988; Lildholdt 1989; Nores 2003; Ragab 2006; Rasp 2000; Sieskiewicz 2006; Stevens 2001).
Two papers reported RCTs comparing oral steroid treatment with placebo or no treatment, but all study participants also received concurrent treatment with antibiotics (Ozturk 2011), or intranasal steroids (Bülbül 2013). These studies are included in the Cochrane review of short‐course oral steroids as an adjunct for chronic rhinosinusitis (Head 2016a). In addition, we identified one protocol for an ongoing RCT, which will aim to compare a short course of oral steroids then intranasal steroids with intranasal steroids alone. All patients in both arms will also receive antibiotics (NCT01676415). Further details for this study can be found in the Cochrane review 'Short‐course oral steroids as an adjunct therapy for chronic rhinosinusitis' (Head 2016a).
Of the remaining seven papers, Rupa 2010 included a population of people with allergic fungal rhinosinusitis, which was out of scope for this review. One study compared intranasal steroids with oral steroids but intranasal steroid treatment was only given for 16 days (Reychler 2015). Six were either non‐randomised studies or commentaries on existing, included RCTs (Grammer 2013; Rasp 1997; Remer 2005; Sousa 2009; Tuncer 2003; van Camp 1994).
Ongoing studies
We identified three ongoing studies (Chi 2011; NCT00841802; NCT02367118). All studies are investigating oral steroids compared with either placebo or no treatment.Chi 2011 aims to compare oral prednisone with placebo treatment for 20 days in patients with nasal polyps. The trial was registered in 2011 but no further information was available despite attempts to contact the author. NCT00841802 compares oral prednisone for 21 days with placebo treatment in patients without nasal polyps. We contacted the study authors and confirmed that the study was currently recruiting participants but no results were currently available. The other ongoing study, NCT02367118, aims to compare a five‐day course oral prednisone with no intervention, prior to surgery. The study includes a mixture of patients with chronic rhinosinusitis with and without nasal polyps and the authors confirmed that they should be completing the study shortly, however no results were available in time for this review. See Characteristics of ongoing studies.
Risk of bias in included studies
The included studies were all randomised and controlled. Details of the risk of bias for each study can be found in Figure 2. A 'Risk of bias' graph shows our judgements about each risk of bias item presented as percentages across all included studies (Figure 3). In general the reporting of the trials was not of a high quality.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.
Allocation
Sequence generation
Six of the included studies reported that the participants had been randomised to treatment groups but provided no further information on the methods of sequence generation (Alobid 2014; Benitez 2006; Hissaria 2006; Kapucu 2012; Kirtsreesakul 2012; Van Zele 2010). The ratios for randomising into the separate groups were provided for three of the studies: Alobid 2014 and Benitez 2006 randomised participants at a ratio of 3:1 into the intervention and control arms respectively, whereas Kirtsreesakul 2012 randomised at a ratio of 3:2 into the treatment and control arms respectively.
We assessed both of the remaining two studies to be at low risk of bias with respect to randomisation. Ecevit 2015 randomised participants in blocks of eight, whereas Vaidyanathan 2011 used a computer‐generated random allocation sequence to randomise the trial, using block randomisation with a block size of four.
Allocation concealment
Six studies did not provide any information about allocation concealment (Alobid 2014; Benitez 2006; Hissaria 2006; Kapucu 2012; Kirtsreesakul 2012; Van Zele 2010). For three trials the risk of bias is increased as there was no blinding (Alobid 2014; Benitez 2006; Kapucu 2012).
We assessed two studies to be at low risk of allocation concealment bias (Ecevit 2015; Vaidyanathan 2011).
Baseline characteristics
In three studies the baseline characteristics are poorly reported (Alobid 2014; Benitez 2006; Kapucu 2012). The majority of the information in Alobid 2014 relates to the overall cohort and baseline characteristics for each group are not provided for age or gender. Similarly, in Benitez 2006 some characteristics are only presented for the cohort as a whole (e.g. gender, aspirin sensitivity and comorbidity of asthma). In Kapucu 2012, there is a lack of information about the included population prior to treatment.
In addition, some of the studies do not report key information for key potential effect modifiers that would be expected to be reported. Four studies do not provide information about the severity of the nasal polyps in the different groups at the start of the trial (Alobid 2014; Benitez 2006; Kapucu 2012; Kirtsreesakul 2012). Similarly, information about any previous surgery is not presented in three papers (Benitez 2006; Ecevit 2015; Kirtsreesakul 2012).
In Van Zele 2010 there was an imbalance in the number of aspirin‐intolerant patients in the baseline characteristics (oral steroids: 14.3%; placebo: 26.3%; antibiotics: 7.1%).
Blinding
The participants and healthcare professionals in three studies were not blinded to the treatment group (Alobid 2014; Benitez 2006; Kapucu 2012). Since the main outcomes of interest in the review are patient‐reported, we considered the risk of bias for outcome assessments to be high.
Van Zele 2010 states that the study was "double blinded" but provides no information about the dosing schedule of the three arms within the trial (oral steroids, placebo and antibiotics) and what precautions were taken to prevent the participants and healthcare professionals from identifying the treatment arm to which they had been allocated. There was no information about blinding of outcome assessment in the paper.
The remaining four studies were all reported to be blinded and provide good explanations of the methods used to prevent bias from knowing the treatment arm to which participants had been allocated (Ecevit 2015; Hissaria 2006; Kirtsreesakul 2012; Vaidyanathan 2011). However, none of the studies make any comment on the taste of the placebo tablet. Oral steroids are known to have a distinctive bitter taste, which may be recognisable to patients who have previously received steroids, thus compromising the blinding. It is unclear whether the taste of the interventions was matched in these four studies and so we downgraded the risk of bias to 'unclear'.
Incomplete outcome data
We assessed five studies to be at a low risk of attrition bias (Alobid 2014; Ecevit 2015; Hissaria 2006; Kapucu 2012; Kirtsreesakul 2012). One of these studies reported that all the patients completed the trial and were included in the outcomes (Kapucu 2012). Four other studies reported drop‐out rates of less than 5% (Alobid 2014; Hissaria 2006; Ecevit 2015; Kirtsreesakul 2012).
In Benitez 2006, there was no mention of anyone who dropped out of the trial or had to discontinue for any reason. However, it was not stated within the paper how many patients were analysed for each outcome and so we assessed the risk of bias for incomplete outcome data to be unclear. We also assessed Vaidyanathan 2011 to have an unclear risk of attrition bias; the study had a relatively large drop‐out rate (9/60 (15%)), although the reasons for these drop‐outs are well described. The results table gives different numbers of participants included in each analysis, which are closer to the number of patients available rather than patients randomised and it is unclear why there is a discrepancy.
We assessed the risk of attrition bias in Van Zele 2010 as high. Seven of the initial 47 patients dropped out of the study (14.9%) and an intention‐to‐treat analysis was conducted with the last value carried forward. However, all of the patients who dropped out were from the placebo group: 7/19 (36.8%). The report implies that they all dropped out after the treatment stage during follow‐up. This may have had an effect on the overall results and no sensitivity analysis appears to have been completed to identify the impact.
Selective reporting
We assessed Ecevit 2015 and Kirtsreesakul 2012 to be at a low risk of selective reporting bias.
We assessed five studies to have an unclear risk of selective reporting bias (Alobid 2014; Benitez 2006; Kapucu 2012; Vaidyanathan 2011; Van Zele 2010). Despite meeting the inclusion criteria Kapucu 2012 did not report any of the primary or secondary outcomes specified in this review. Two studies reported primary or secondary outcomes (or both) but did not report any information about whether adverse effects were experienced by any participant within the study (Alobid 2014; Benitez 2006). Vaidyanathan 2011 did not report the methods for collecting data for adverse events (other than biological assays). In Van Zele 2010, all outcomes in the methods section have been reported in the full paper, although many of them have been presented graphically, without providing values at key time periods. The data were not reported in a way that is sufficient to be included in the meta‐analysis of this review. We contacted the study authors but further information was not provided.
We assessed Hissaria 2006 to be at high risk of reporting bias; the nasoendoscopy findings were reported inconsistently within the paper using differing criteria that had not been pre‐specified in the methods section. We were concerned that the cut‐off points for reporting could have been chosen after the results were available to make the results look more favourable.
Protocols could be identified for two of the included studies (Vaidyanathan 2011; Van Zele 2010). For Vaidyanathan 2011, no differences were identified between the outcomes at the protocol stage and those reported in the paper. For Van Zele 2010, it was difficult to judge whether there were differences between the protocol and the full paper as the protocol was not very detailed. We noted that the number of participants that the study aimed to recruit was different from the number actually recruited (120 and 48 respectively).
Other potential sources of bias
Use of validated outcome measures
The validation of outcomes was one area that we identified at the start of the review as an aspect that could lead to potential bias. If an instrument is insensitive to measuring differences, this biases the results to no difference. Six of the eight studies did not provide information about the validation of any of the outcomes relevant to this review (Alobid 2014; Benitez 2006; Ecevit 2015; Kapucu 2012; Kirtsreesakul 2012; Van Zele 2010). Furthermore, Van Zele 2010 also failed to provide information about the scale used for measuring symptoms.
Vaidyanathan 2011 reported validation of the health‐related quality of life measure (mini‐RQLQ), although on further investigation it appears that the validation was not completed in a chronic rhinosinusitis population. The validation of other outcomes was not mentioned. Hissaria 2006 provided references to the validation of the health‐related quality of life outcomes (RSOM‐31), although they use a modified version and no information on how this modification impacts the validation was made. For nasoendoscopy outcomes, the procedure to ensure reliability of measurements was well presented.
Funding and conflicts of interest in trials
Three studies did not report information about funding of the trials, or reported that no funding was provided (Ecevit 2015; Hissaria 2006; Kapucu 2012). The remaining five studies reported funding sources (Alobid 2014; Benitez 2006; Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). None of the studies were explicitly funded by pharmaceutical companies with most of the funding appearing to be from governmental or university grants.
Two studies did not provide information on any of the authors' potential conflicts of interest (Alobid 2014; Benitez 2006), and four studies reported that the authors did not have any conflicts of interest (Ecevit 2015; Kapucu 2012; Kirtsreesakul 2012; Vaidyanathan 2011).
Two studies noted that one or more authors had a potential conflict of interest (Hissaria 2006; Van Zele 2010). Hissaria 2006 reported one of the authors as receiving royalties from a medical device company. Van Zele 2010 reported that one author had received royalties from a medical device company and was a consultant for another company (NeilMed). This author along with two other authors received research grants from external bodies (Garnett Passe and Rodney Williams Foundation, GlaxoSmithKline, Stallergenes, European Union).
Effects of interventions
See also summary of findings Table for the main comparison.
We analysed the pre‐specified primary and secondary outcomes. We included eight trials comprising 474 participants comparing oral steroids with placebo in this review (Alobid 2014; Benitez 2006; Ecevit 2015; Hissaria 2006; Kapucu 2012; Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010), although one of these studies did not include any of the pre‐specified primary or secondary outcomes and so is not included in the results (Kapucu 2012). All of the studies followed up patients until the end of treatment (14 to 21 days).
Three studies (224 participants) also followed up patients in both arms for a further 10 to 26 weeks after treatment (Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). Kirtsreesakul 2012 and Vaidyanathan 2011 (177 participants) gave patients from both arms of the study intranasal corticosteroids after the end of oral steroid treatment and followed up patients for a further 10 to 26 weeks. Van Zele 2010 (47 participants) did not routinely allow intranasal corticosteroids after treatment with oral steroids but followed up patients for 10 weeks after oral steroid treatment had finished. The treatment of both arms with intranasal steroids, as represented in Kirtsreesakul 2012 and Vaidyanathan 2011, more accurately reflects current clinical practice than not providing any treatment. However, the results for all three of the longer‐term trials are also analysed together and are presented below as three‐ to six‐month results.
Where the range of scales and values for minimal important differences were unclear, we used the standardised mean difference (SMD) as a guide to estimate the effect sizes. As suggested in the Cochrane Handbook for Systematic Reviews of Interventions (Handbook 2011), we used standard rules of thumb in the interpretation of effect sizes (SMD, or Cohen's effect size of < 0.41 = small, 0.40 to 0.70 = moderate, > 0.70 = large) (Cohen 1988).
Primary efficacy outcomes
1. Health‐related quality of life, using disease‐specific health‐related quality of life scores
After treatment (two to three weeks)
Two studies (98 participants) measured 'health‐related quality of life' using a disease‐specific instrument (Hissaria 2006; Vaidyanathan 2011). However, these are not fully validated instruments for patients with chronic rhinosinusitis:
-
Hissaria 2006 used the RSOM‐31 questionnaire (a validated instrument) but modified the scoring system, using only the severity parameter but not the importance parameter. The study does not report the possible range of values that could be obtained.
-
Vaidyanathan 2011 used the mini‐Rhinoconjunctivitis Quality of Life Questionnaire (mRQLQ). This questionnaire was developed to measure the quality of life for people with seasonal or perennial rhinoconjunctivitis, and the validity for chronic rhinosinusitis patients is unknown. It has at least three to four items (out of 14) that are related to allergy but not applicable to patients with chronic rhinosinusitis. In addition, it does not include any items on sinonasal or facial pain and sense of smell, which are symptoms included in the EPOS 2012 diagnostic criteria.
Therefore, we have not pooled the results of these studies but they are plotted in Figure 4. The standardised mean difference (SMD) observed in Hissaria 2006 was ‐1.24 (95% confidence interval (CI) ‐1.92 to ‐0.56; 40 participants), whereas the SMD in Vaidyanathan 2011 was ‐0.79 (95% CI ‐1.32 to ‐0.25; 58 participants) (Analysis 1.1). We considered both of these results to be large effect sizes.

Forest plot of comparison: 1 Oral steroids versus no treatment/placebo, outcome: 1.1 Disease‐specific health‐related quality of life ‐ no pooling (2 to 3 weeks).
Medium‐term (three to six months)
Vaidyanathan 2011 also presented results for the mini‐RQLQ data at 26 weeks. The scale is not clear within the paper. The SMD was ‐0.59 (95% CI ‐1.16 to ‐0.02; 50 participants; one study) (Analysis 1.2). We considered this result to be a moderate effect size.
2. Disease severity, as measured by patient‐reported symptom score
None of the papers provided results for a patient‐reported total symptom score validated in a chronic rhinosinusitis population. Where available we combined the results for the individual symptoms into a total score according to the methods section (see Dealing with missing data). In order to be included in the analysis the results needed to provide enough data to meet the EPOS 2012 diagnostic criteria (Appendix 3), which requires at least two symptoms to be present, one of which must be nasal blockage/obstruction/congestion or nasal discharge (anterior/posterior nasal drip), with the other possible symptoms being facial pressure/pain, loss of sense of smell (adults) or cough (children).
Four studies (232 participants) reported this outcome (Ecevit 2015; Hissaria 2006; Kirtsreesakul 2012; Vaidyanathan 2011), but all used different measurements and presented results in different ways.
-
Ecevit 2015 (22 participants) asked patients to report individual symptoms on a visual analogue scale (VAS) (0 to 10; 0 = no symptoms). Scores were given for the four symptoms included in the EPOS 2012 definition (nasal obstruction, nasal discharge, sense of smell and pressure over the sinuses), which were combined to give a total mean final score with a possible range of 0 to 40.
-
Hissaria 2006 (40 participants) measured symptoms using the nasal subscale of the RSOM‐31, which measures six symptoms: congestion, rhinorrhoea, sneezing, hyposmia, postnasal discharge and thick nasal debris, all scored on a one‐ to five‐point VAS (1 = least severe, 5 = most severe). To obtain a total value, the authors averaged the scores across all domains and presented them graphically in the paper. The combined results should, therefore, have been on a scale of one to five but the results clearly show that one of the data points on the graph is less than 1. We contacted the study authors to provide further information but they did not respond. The nasal subscale of the RSOM‐31 represents three of the symptoms of the EPOS 2012 criteria. Facial pain/pressure was not reported.
-
Kirtsreesakul 2012 (114 participants) asked patients to report individual symptoms on a seven‐point Likert scale (0 to 6; 0 = no symptoms, 6 = most severe). The results for each symptom were presented graphically in the paper as percentage change from baseline. The results for the four symptoms representing the EPOS 2012 criteria (blocked nose, rhinorrhoea, hyposmia and sinonasal pain) were averaged to create an average change from baseline score.
-
Vaidyanathan 2011 (57 participants) used the "total nasal symptoms score", which is calculated from the sum of scores for nasal discharge, nasal blockage, nasal itch and sneezing, each measured on a 0‐ to 3‐point scale (total range 0 to 12; 0 = least affected, 12 = most affected). The results include two of the symptoms listed in the EPOS 2012 criteria (nasal blockage and nasal discharge). Data for facial pain/pressure or loss of sense of smell were not recorded. The validation status of the scale is unknown and it is likely to be more specific for rhinitis symptoms.
The results were presented in two different ways within the papers, either as 'mean final value' (Ecevit 2015; Hissaria 2006; Vaidyanathan 2011), or as 'change from baseline' (Kirtsreesakul 2012). Results were only presented after treatment (at two to three weeks) in both studies (Ecevit 2015; Hissaria 2006), and also as medium‐term results (three to six months after treatment) in two studies (Kirtsreesakul 2012; Vaidyanathan 2011).
We considered whether the results using different scales could be pooled, but due to the differences in the individual symptoms included in the scale, we did not consider pooling to be appropriate. We plotted all results separately using SMD on the same forest plot but did not present any totals (see Figure 5; Analysis 1.3).

Forest plot of comparison: 1 Oral steroids versus no treatment/placebo, outcome: 1.3 Disease severity (patient‐reported total symptom score).
After treatment (two to three weeks)
Mean final values
Three studies, with a total of 119 participants, presented results as mean final values immediately after treatment (14 to 17 days) (Ecevit 2015; Hissaria 2006; Vaidyanathan 2011). All of the results showed an improvement in the combined symptoms severity score for oral steroids compared with placebo at the end of treatment, with the largest effect being observed in Ecevit 2015 (SMD ‐2.84, 95% CI ‐4.08 to ‐1.59, 22 participants), followed by Hissaria 2006 (SMD ‐1.59, 95% CI ‐2.31 to ‐0.87, 40 participants) and Vaidyanathan 2011 (SMD ‐0.79, 95% CI ‐1.33 to ‐0.25, 57 participants) (Analysis 1.3). All of these SMD values corresponded to large effect sizes.
We observed a variation in the results for symptom severity between the trials. This may have been due to:
-
differences in the outcome measurement being used in each scale ‐ different individual symptoms were measured in each case and the validity and sensitivity of the scales to measure this outcome are unknown;
-
differences in the included populations within the studies ‐ participants in Ecevit 2015 were more severely affected at baseline according to the diagnostic criteria;
-
differences in the interventions provided ‐ Ecevit 2015 provided oral steroids at a higher dose than Hissaria 2006 or Vaidyanathan 2011.
Change from baseline
Kirtsreesakul 2012 (114 participants) showed a larger average percentage improvement in total symptom score for the oral steroids group compared with placebo at the end of treatment (14 days) (SMD ‐2.28, 95% CI ‐2.76 to ‐1.80) (Analysis 1.3). This corresponds to a large effect size.
Medium‐term (three to six months)
Mean final value
Vaidyanathan 2011 (51 participants) provided results at 26 weeks after the end of oral steroid treatment, where both arms of the trial had been given intranasal steroids after 21 days (when the short course of oral steroids ended). The result for total nasal symptom score was SMD ‐0.43 (95% CI ‐0.99 to 0.12) (Analysis 1.3). This corresponds to a moderate effect size.
Change from baseline
Kirtsreesakul 2012 (114 participants) provided data that allowed the calculation of three‐ to six‐month results for percentage change in total symptoms score from baseline, 10 weeks after completing the oral steroid treatment, where both arms of the trial had been given intranasal steroid therapy from two weeks (i.e. at the end of the oral steroid treatment period). The result for percentage change from baseline was SMD ‐0.22 (95% CI ‐0.59 to 0.15) (Analysis 1.3). This corresponds to a small effect size.
Individual symptom scores
Data for patient‐reported individual symptoms were presented in three papers (Ecevit 2015; Kirtsreesakul 2012; Vaidyanathan 2011). These papers used different measurement scales for the rating of symptoms.
-
Ecevit 2015 (22 participants) asked participants to rank symptoms on a visual analogue scale of 0 to 10 (0 = no complaint, 10 = most annoying). The paper presented the final mean values.
-
Kirtsreesakul 2012 (114 participants) asked participants to rate symptoms using a seven‐point Likert scale (0 to 6, 0 = no symptoms, 6 = severe symptoms). The paper presented results graphically in figures for percentage improvement from baseline for each symptom. We extracted the data from graphs. Data were presented for after treatment (two weeks) and also at 12 weeks after both groups had received intranasal steroids.
-
In Vaidyanathan 2011 the only individual symptom for which data were extractable was hyposmia, which was measured by patients on a 0 to 100 mm hyposmia visual analogue scale. It is not clearly described within the paper but it is inferred from the discussion that a higher score relates to greater severity of smell loss.
Although Alobid 2014 measured loss of sense of smell using the Barcelona Smell Test‐24 score, the results were presented for all patients, control group, patients with asthma and patients without asthma and so it was not possible to include these results.
Nasal obstruction/congestion/blockage
Final value
One study (22 participants) presented data for the mean final value of the nasal obstruction symptom score (measured on a 0 to 10 VAS, 0 = no nasal blockage) for oral steroids compared with placebo at the end of the 17‐day treatment course (mean difference (MD) ‐4.50, 95% CI ‐6.42 to ‐2.58) (Ecevit 2015) (Analysis 1.4).
Change from baseline
One study (114 participants) presented data for percentage change in nasal blockage (measured on a seven‐point Likert scale, 0 = no symptoms) for oral steroid treatment compared with placebo after a 14‐day treatment course (MD ‐38.02, 95% CI ‐48.16 to ‐27.88; 114 participants) and at three months after oral steroid treatment had finished when all patients in both study arms had received intranasal steroids for 10 weeks (MD 0.90, 95% CI ‐8.97 to 10.77) (Kirtsreesakul 2012) (Analysis 1.5).
Nasal discharge
Final value
One study (22 participants) presented data for the mean final value of nasal discharge symptom score (measured on a 0 to 10 VAS, 0 = no nasal discharge) for oral steroids compared with placebo at the end of a 17‐day treatment course (MD ‐4.70, 95% CI ‐6.79 to ‐2.61) (Ecevit 2015) (Analysis 1.6).
Change from baseline
One study (114 participants) presented data for percentage change in rhinorrhoea (measured on a seven‐point Likert scale, 0 = no symptoms) for oral steroid treatment compared with placebo after a 14‐day treatment course (MD ‐55.57, 95% CI ‐69.23 to ‐41.91) and at three months after oral steroid treatment had finished when all patients in both study arms had received intranasal steroids for 10 weeks (MD ‐1.83, 95% CI ‐13.46 to 9.81; 114 participants) (Kirtsreesakul 2012) (Analysis 1.7). Rhinorrhoea was used in preference to the individual symptom of postnasal drip, which was also reported in the paper.
Facial pain/pressure
Final value
One study (22 participants) presented data for the mean final value of facial pressure symptom score (measured on a 0 to 10 VAS, 0 = no facial pressure) for oral steroids compared with placebo at the end of a 17‐day treatment course (MD ‐3.70, 95% CI ‐6.02 to ‐1.38) (Ecevit 2015) (Analysis 1.8). The symptom of facial pressure was used in preference to the individual symptom of headache.
Change from baseline
One study (114 participants) presented data for percentage change in sinonasal pain (measured on a seven‐point Likert scale, 0 = no symptoms) for oral steroid treatment compared with placebo after a 14‐day treatment course (MD ‐30.66, 95% CI ‐46.28 to ‐15.04) and at three months after oral steroid treatment had finished when all patients in both study arms had received intranasal steroids for 10 weeks (MD 0.60, 95% CI ‐12.56 to 13.76) (Kirtsreesakul 2012) (Analysis 1.9). Rhinorrhoea was used in preference to the individual symptom of postnasal drip, which was also reported in the paper.
Loss of sense of smell
Final value
Two studies (80 participants) presented data for the mean final value of loss of sense of smell (Ecevit 2015; Vaidyanathan 2011). Ecevit 2015 measured smell on a 0 to 10 scale (0 = no loss of sense of smell) and Vaidyanathan 2011 measured this on a 0 to 100 mm hyposmia VAS (0 = no loss of sense of smell), which we subsequently scaled to represent a 0 to 10 scale. The result for oral steroids compared with placebo at the end of treatment (14 to 17 days) was MD ‐2.79 (95% CI ‐4.11 to ‐1.47). Vaidyanathan 2011 also presented results 26 weeks after the end of treatment when patients in both arms had received intranasal steroids (MD ‐1.20, 95% CI ‐2.68 to 0.28) (Analysis 1.10).
Change from baseline
One study (114 participants) presented data for percentage change in hyposmia (measured on a seven‐point Likert scale, 0 = no symptoms) for oral steroid treatment compared with placebo after a 14‐day treatment course (MD ‐44.35, 95% CI ‐57.31 to ‐31.39) and at three months after oral steroid treatment had finished when all patients in both study arms had received intranasal steroids for 10 weeks (MD ‐15.05, 95% CI ‐29.69 to ‐0.41) (Kirtsreesakul 2012) (Analysis 1.11).
None of the results for individual symptoms are presented in the GRADE 'Summary of findings' table as we considered it to be re‐presenting information that was already included in the disease severity score and, as such, not considered to be a priority outcome.
3. Significant adverse effect: mood or behavioural disturbances
One study (40 participants) reported mood disturbances as an adverse event (Hissaria 2006). This study found that there were no differences between the oral steroid and the placebo group after the two‐week treatment course (5/20 oral steroids, 0/20 placebo) (risk ratio (RR) 2.50, 95% CI 0.55 to 11.41) (Analysis 1.12).
Secondary efficacy outcomes
1. Health‐related quality of life, using generic quality of life scores, such as the SF‐36, EQ‐5D and other well‐validated instruments
None of the studies reported this as an outcome.
2. Other adverse effects: gastrointestinal disturbances
We analysed together the short‐term 'after treatment' results (two to three weeks) and the medium‐term 'three to six months' results for gastrointestinal disturbances. Three studies (187 participants) reported gastrointestinal disturbances as an adverse event (Hissaria 2006; Kirtsreesakul 2012; Van Zele 2010). Hissaria 2006 reported adverse events after the treatment course had ended (two weeks), whereas Kirtsreesakul 2012 and Van Zele 2010 reported adverse events at 12 weeks. We meta‐analysed the results and there was an increase in gastrointestinal disturbance in the oral steroid group compared with placebo (15/101, 4/86) (RR 3.45, 95% CI 1.11 to 10.78) (Analysis 1.13).
3. Other adverse effects: insomnia
Three studies (187 participants) reported insomnia as an adverse event (Hissaria 2006; Kirtsreesakul 2012; Van Zele 2010). Hissaria 2006 reported adverse events after the treatment course had ended (two weeks), whereas Kirtsreesakul 2012 and Van Zele 2010 reported adverse events at 12 weeks. We meta‐analysed the results and there was an increase in insomnia in the oral steroid group compared with placebo (10/101, 2/86) (RR 3.63, 95% CI 1.10 to 11.95) (Analysis 1.14).
4. Adverse effects: osteoporosis
None of the studies reported this as an outcome.
5. Endoscopic score (polyps size for chronic rhinosinusitis with polyps population, or overall endoscopy score for chronic rhinosinusitis without polyps population)
Five studies measured nasal polyps on a zero‐ to three‐point scale, although the wording used to describe each of the categories is not consistent between the studies (Appendix 4) (Alobid 2014; Benitez 2006; Ecevit 2015; Kirtsreesakul 2012; Vaidyanathan 2011). After reviewing the scales we agreed to analyse the results of the studies together as we thought the definitions between the categories to be roughly equivalent.
After treatment (two to three weeks)
Final value
Four studies (253 patients) reported the total nasal polyp score at the end of treatment (Alobid 2014;Benitez 2006; Ecevit 2015; Vaidyanathan 2011). All of the studies used the four‐point (0 to 3) scale for the measurement of polyps severity. Vaidyanathan 2011 summed the scores for each nostril together to give a total scale of 0 to 6. We have divided these results by two to provide the average polyp score for both nostrils on a scale of 0 to 3, to be consistent with the other studies. It is unclear in the other three papers whether the result refers to the polyp grade in the worst affected nostril or an average of the polyp grade by nostril (Alobid 2014; Benitez 2006; Ecevit 2015). The results showed that there was a reduction in nasal polyp score for oral steroids compared with placebo/no treatment at two weeks (MD ‐0.76, 95% CI ‐0.92 to ‐0.61, 253 participants) (Analysis 1.15). This observed mean difference corresponds to large effect size (SMD of ‐1.21).
There is moderate heterogeneity within the mean final nasal polyp size results as presented above (heterogeneity: Chi² = 7.20, df = 3 (P value = 0.07); I² = 58%). When Vaidyanathan 2011 is removed from the analysis, the heterogeneity is reduced. This may have been due to differences in the methods of assessing the nasal polyps.
Change from baseline
Van Zele 2010 measured the nasal polyps score on a five‐point scale (0 to 4), which was used for each nostril and then summed to get an overall nasal polyp score. The paper presented the results graphically as change from baseline polyps score, however data on the variance of the point estimates were not available for this study and it was not possible to impute them from other studies due to differences in the scale, so it was not included in the meta‐analysis.
Two studies (146 patients) reported the percentage improvement from baseline values at the end of treatment (Hissaria 2006; Kirtsreesakul 2012). Kirtsreesakul 2012 measured the polyps grade using a 0 to 3 scale, whereas Hissaria 2006 reported the estimated percentage reduction in polyp size using pairs of photographs taken pre‐ and post‐treatment. As these ways of measuring polyps were different, we analysed the data using standardised mean difference to report the results. The results showed that there was a larger change from baseline in the size of nasal polyps in the oral steroids group compared with the control group after treatment (two to three weeks) (SMD ‐1.77, 95% CI ‐2.16 to ‐1.38). This corresponds to a large effect size (Analysis 1.16).
Medium‐term (three to six months)
Final value
One study (50 patients) provided results for final mean value of nasal polyps score for oral steroids compared with placebo, 26 weeks after the initial treatment period with both study arms receiving treatment with intranasal steroids (Vaidyanathan 2011). The mean difference in nasal polyps at 26 weeks was ‐0.25 (95% CI ‐0.62 to 0.12, 50 participants) on a 0‐ to 3‐point scale (Analysis 1.15). The observed mean difference corresponds to a small effect size (SMD of 0.36).
Change from baseline
One study measured results at three months from the start of the trial when all patients in both study arms had received intranasal steroids for 10 weeks (Kirtsreesakul 2012). The results for the oral steroid arm compared to the placebo arm were SMD ‐0.52 (95% CI ‐0.90 to ‐0.14) (Analysis 1.16). This corresponds to a moderate effect size.
The results for endoscopic score are not presented in the 'Summary of findings' table as we did not consider it to be a priority outcome.
6. Computerised tomography (CT) scan score
None of the studies reported this as an outcome.
Discusión
Resumen de los resultados principales
La presente revisión incluye ocho ensayos que comparan la efectividad de los esteroides orales de corta duración con placebo o ningún tratamiento en adultos con rinosinusitis crónica con pólipos nasales (Resumen de los hallazgos para la comparación principal).
Hubo pruebas de baja calidad de una mejoría en la calidad de vida relacionada con la salud específica de la enfermedad después del tratamiento (dos a tres semanas) con los corticosteroides orales en comparación con placebo o ningún tratamiento. Existe la preocupación de que la magnitud de la mejoría no se mantiene.
Hubo pruebas de baja calidad de una mejoría en la gravedad de la enfermedad (puntuación inferior de los síntomas) en el grupo de esteroides orales en comparación con el grupo control al final del tratamiento con esteroides (dos a tres semanas). A los tres meses, cuando todos los pacientes habían recibido esteroides intranasales después que había finalizado el período de tratamiento, hubo pruebas de baja calidad de que no hubo diferencias en el cambio a partir del valor inicial en la gravedad de los síntomas entre los grupos de esteroides orales y control.
Hubo pruebas de baja calidad de un aumento del insomnio y los trastornos gastrointestinales en el grupo de esteroides orales en comparación con el grupo control. No está claro si hay diferencias entre los grupos intervención y control en los trastornos del estado de ánimo (pruebas de baja calidad). Ninguno de los estudios proporcionó datos para la osteoporosis.
Inmediatamente después del tratamiento (dos a tres semanas), hubo pruebas (alto riesgo de sesgo) de una mejoría en la puntuación de los pólipos nasales en el grupo de esteroides orales en comparación con el grupo control. Los resultados a los tres a seis meses después del final del tratamiento con esteroides orales indican que es posible que no se mantenga la magnitud de la diferencia entre los grupos (alto riesgo de sesgo).
Ningún estudio informó la calidad de vida genérica relacionada con la salud o la puntuación de la tomografía computarizada como resultados.
Compleción y aplicabilidad general de las pruebas
Todos los estudios incluidos solamente incluyeron adultos con pólipos nasales (Alobid 2014; Benitez 2006; Ecevit 2015; Hissaria 2006; Kapucu 2012; Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). Lo anterior limita la aplicabilidad de las pruebas para los adultos sin pólipos nasales y a la población pediátrica con rinosinusitis crónica. Dos de los tres estudios en curso que se identificaron incluyen pacientes con rinosinusitis crónica que no presentan pólipos nasales (NCT00841802; NCT02367118). NCT00841802 solamente incluye a pacientes con rinosinusitis crónica sin pólipos nasales, mientras que el otro estudio, NCT02367118, incluye a pacientes con y sin pólipos nasales. Por lo tanto, las pruebas para los esteroides orales en los pacientes con rinosinusitis crónica sin pólipos pueden estar disponibles para la próxima actualización de esta revisión.
Las dosis de los esteroides orales administrados en los ensayos difirieron. Mediante un convertidor de equivalencias esteroides (http://www.medcalc.com/steroid.html) para los tres fármacos esteroides orales en los ensayos incluidos (prednisona, prednisolona y metilprednisolona) utilizado para convertir todas las dosis en el fármaco de referencia prednisolona, la dosis del fármaco varió de 25 mg/día (Vaidyanathan 2011) a 60 mg/día (Ecevit 2015). En el análisis se examinaron todas las dosis juntas. Lo anterior excluye al estudio Kapucu 2012, del que no hay resultados disponibles, que calculó la dosis según el peso de los participantes a 1 mg/kg/día de metilprednisolona; para un peso de 84 kg (peso promedio de un hombre en el Reino Unido), sería equivalente a 105 mg/día de prednisolona.
A menudo los resultados primarios no se informaron o se informaron de manera muy deficiente dentro de los artículos. Hubo considerable inconsistencia entre los artículos con respecto a los instrumentos utilizados y a cómo se presentaron los resultados (valor final medio o cambio a partir del valor inicial), lo que dificulta el análisis de los resultados.
Hubo falta de información consistente sobre la gravedad de los síntomas relacionados con la enfermedad. No hubo estudios que utilizaran una herramienta validada para informarla como un resultado. De los cuatro estudios que intentaron informar este resultado (Ecevit 2015; Hissaria 2006; Kirtsreesakul 2012; Vaidyanathan 2011), solamente dos, Ecevit 2015 y Kirtsreesakul 2012, presentaron datos de los cuatro síntomas necesarios para diagnosticar rinosinusitis crónica mediante los criterios EPOS 2012 (Apéndice 3). La falta de información de los síntomas, en concreto de la presión / dolor facial y la hiposmia, se puede haber debido a todas las poblaciones de estudio, formadas en su totalidad por pacientes con pólipos nasales. Habitualmente los estudios analizaron los cambios en los síntomas asociados con los pólipos nasales (como secreción nasal y obstrucción), en lugar de los síntomas más generales de rinosinusitis crónica. A menudo no se estudió el síntoma dolor / presión facial.
Los dos estudios que informaron una "puntuación de gravedad de los síntomas" sin proporcionar información sobre los elementos individuales incluidos, utilizaron escalas que incluyeron ítems que pueden haber sido más relevantes para los resultados de rinitis (Hissaria 2006; Vaidyanathan 2011), lo que limita la aplicabilidad de estos resultados a la población con rinosinusitis crónica. Vaidyanathan 2011 utilizó los "síntomas nasales totales" para informar la gravedad de los síntomas, que abarca cinco dominios: dos son relevantes para los síntomas de la rinosinusitis crónicas (congestión nasal y rinorrea), dos dominios son más específicos para los síntomas de rinitis (prurito nasal y estornudo) y un dominio se relaciona con la repercusión de los síntomas sobre el sueño. De manera similar, Hissaria 2006 utilizó la subescala nasal de la RSOM‐31 para examinar la "gravedad de los síntomas". Esta subescala mide la congestión nasal, la rinorrea, el estornudo, la hiposmia, la secreción posnasal y la secreción nasal espesa, de los cuales algunos elementos son más específicos para los síntomas de rinitis. Estos estudios pueden cambiar la magnitud del efecto.
Los métodos utilizados para la evaluación de los pólipos se informaron deficientemente en los artículos y la evaluación endoscópica del tamaño del pólipo fue el tema de varios sistemas de calificación (Apéndice 4). A menos que los exámenes se graben en video y se evalúen centralmente, estos métodos son algo subjetivos, incluso si se validaron anteriormente, y se deben ver como una guía para la respuesta en lugar de una medida absoluta, ya que estos estudios no informaron la fiabilidad intra e interinformante. Podría haber la posibilidad de sesgo en la manera en la que se informaron las puntuaciones, en concreto en los estudios sin cegamiento.
La información sobre los eventos adversos fue incompleta. Sólo tres de los ocho estudios incluyeron información clara acerca de los eventos adversos (Hissaria 2006; Vaidyanathan 2011; Van Zele 2010). Esta es una tendencia repetida en otras afecciones y en la bibliografía no se han registrado correctamente los datos fiables de los eventos adversos asociados con la administración de esteroides a corto plazo (Burton 2008). Además, hubo una falta de datos a largo plazo en los ensayos, que podrían identificar los efectos a más largo plazo de los esteroides orales como la osteoporosis.
También hubo falta de información sobre otros resultados a más largo plazo. Cinco de los ocho estudios solamente presentaron resultados para ambos brazos de los ensayos al final del tratamiento (Alobid 2014; Benitez 2006; Ecevit 2015; Hissaria 2006; Kapucu 2012). De los tres estudios que proporcionaron resultados a más largo plazo, dos informaron los resultados a los tres meses (Kirtsreesakul 2012; Van Zele 2010), y uno proporcionó resultados a los seis meses (Vaidyanathan 2011).
Calidad de la evidencia
La calidad de las pruebas para todos los resultados evaluados fue baja, incluidos los resultados de los eventos adversos que se informaron.
La calidad de las pruebas estuvo afectada por varios aspectos: limitaciones metodológicas, duración del seguimiento, validación de los instrumentos de resultado y tamaño de los estudios.
Los estudios en general se informaron de manera deficiente y la información acerca de la asignación al azar, la ocultación de la asignación y el cegamiento no estuvo clara en la mayoría. Cinco de los ensayos solamente siguieron a los pacientes hasta el final del tratamiento con esteroides orales (dos a tres semanas), lo que limita la aplicabilidad de las pruebas para los resultados a más largo plazo. Cuando se presentaron los resultados a más largo plazo (tres a seis meses) a menudo se encontró que no se mantuvieron los resultados iniciales.
Otro problema es la falta de uso de instrumentos validados. Muchos estudios no utilizaron medidas de resultado validadas informadas por el paciente y algunos utilizaron instrumentos que se validaron para otras poblaciones (p.ej. pacientes con rinitis). Un "instrumento validado" deja de ser válido cuando se utiliza fuera de la población para la que se concibió, ya que los ítems que se utilizaron pueden dejar de ser relevantes, y es posible que no incluyan áreas importantes para los pacientes con rinosinusitis crónica. También se disminuyó la calidad para el resultado gravedad de la enfermedad cuando no se informó una puntuación general validada de gravedad de la enfermedad y fue necesario hacer imputaciones para calcular las puntuaciones totales de los síntomas (ver Análisis de los datos faltantes).
El tamaño de los estudios incluidos en esta revisión fue generalmente pequeño, con un tamaño de la muestra promedio de 60 participantes (30 en cada brazo). Lo anterior limita cuánta confianza se le puede dar a los resultados.
Sesgos potenciales en el proceso de revisión
Lo que se definió como un "tratamiento de corta duración" de esteroides orales fue un tema que se discutió ampliamente durante la confección del protocolo para esta revisión (Chong 2015). Finalmente se coincidió en que de corta duración se debería considerar un ciclo de hasta 21 días, pero hubo algunas opiniones de que la duración máxima debe ser 14 días. Limitar las pruebas a 14 días habría excluido dos estudios (Ecevit 2015; Van Zele 2010), y posiblemente un estudio adicional en el que la duración no estuvo clara y se basó en el peso en lugar de en el tiempo (Kapucu 2012). Como solamente hubo un número pequeño de artículos para cada resultado no es posible evaluar la repercusión de esta decisión.
La validación de las medidas de resultado fue un sesgo potencial que se identificó en el estadio de protocolo como algo que podría afectar la validez de los resultados. Muchos de los estudios no utilizaron las escalas de calificación de síntomas informados por el paciente que se han validado apropiadamente. La falta de puntuaciones validadas significa que a menudo es necesario emitir valoraciones basadas en la validez aparente de la escala, en lugar de contar con datos fidedignos de la validez. Por ejemplo, en Vaidyanathan 2011, la calidad de vida relacionada con la salud se midió con una medida que se validó en los pacientes con rinitis alérgica estacional o perenne, pero no en los pacientes con rinosinusitis crónica, el mini‐Rhinoconjunctivitis Quality of Life Questionnaire (RQLQ). Este instrumento tiene 14 preguntas que abarcan cinco dominios: limitación de las actividades, problemas prácticos, síntomas nasales, síntomas oculares y síntomas que no son nasales ni oculares, y se centra en los síntomas oculares y nasales relacionados con la alergia. De manera similar, muchos de otros estudios también utilizaron instrumentos para medir la gravedad de los síntomas que no se validaron en pacientes con rinosinusitis crónica.
No utilizar instrumentos validados para medir resultados importantes para el paciente como la repercusión sobre la calidad de vida y la gravedad de la enfermedad, es probablemente el aspecto más importante que obstaculiza la capacidad para metanalizar los resultados o comparar los resultados entre los estudios. Existen cuestionarios específicos de la enfermedad validados y los ensayos futuros se beneficiarían de incluirlos como medidas de resultado primarias. Trabajos preliminares recientes en el Reino Unido han subrayado este aspecto e identificado la necesidad de establecer un conjunto de resultados centrales para la rinosinusitis (Hopkins 2016).
Como hubo una falta de resultados informados mediante medidas validadas, para permitir alguna comparación entre los estudios y las revisiones (Chong 2016a; Chong 2016b; Chong 2016c; Head 2016a; Head 2016b), se tomó la decisión de combinar las puntuaciones de los síntomas individuales para crear una puntuación total de los síntomas. Los métodos y las limitaciones se describen en la sección Métodos (Análisis de los datos faltantes). Los síntomas incluidos se basaron en los criterios diagnósticos EPOS 2012. Sin embargo, esta puntuación no fue una medida validada y, como no existen pruebas sobre el coeficiente de correlación entre los síntomas, el cálculo no las pudo tener en cuenta. Lo anterior puede haber tenido efecto sobre la magnitud del tamaño del efecto cuando se interpreta como una diferencia de medias estandarizada debido a las desviaciones estándar potencialmente mayores o inferiores, pero no a las diferencias de medias (DM) observadas. Para considerar la falta de escalas validadas utilizadas y la falta de métodos validados para sumar las puntuaciones, se disminuyó la calidad de todos los resultados de gravedad de la enfermedad debido a que no se utilizaron escalas validadas cuando se analizaron.
Otro sesgo potencial en el proceso de revisión fue que muchos de los datos de los estudios incluidos se presentaron en los artículos como gráficos o diagramas. Cuando éste fue el caso, se estableció contacto con los autores de los estudios para tratar de obtener más datos precisos; sin embargo, ninguno de los autores proporcionó datos adicionales. Por lo tanto, los datos se extrajeron del artículo mediante un programa en línea (http://arohatgi.info/WebPlotDigitizer/app/). Inevitablemente habrá cierto grado de error al utilizar estos datos debido a la falta de exactitud durante el proceso de impresión y al proceso utilizado para recopilar los datos. Se consideró cuidadosamente la magnitud de cualquier transformación adicional de los datos cuando se interpretaron a partir de los gráficos (como al combinar los síntomas individuales en puntuaciones totales) para intentar disminuir los errores adicionales.
Acuerdos y desacuerdos con otros estudios o revisiones
La presente revisión actualiza una revisión Cochrane anterior (Martinez‐Devesa 2011) y aumenta el alcance de la revisión para incluir pacientes con y sin pólipos nasales.
La revisión Cochrane anterior incluyó tres estudios (Alobid 2006 ‐ informado en esta revisión como Benitez 2006; Hissaria 2006; Van Zele 2010),e hizo referencia a un estudio en curso. Estos cuatro estudios se incluyeron en esta revisión actualizada (incluido el estudio en curso, que ahora se ha publicado completo, Vaidyanathan 2011). Después de la comunicación con el autor del estudio se determinó que Alobid 2006 informó parcialmente sobre participantes de Benitez 2006 y el autor recomendó que Benitez 2006 era el mejor artículo para utilizar. En la revisión anterior se concluyó que "el número limitado de ensayos de calidad metodológica moderada a deficiente mostró una mejoría a corto plazo con un ciclo corto (dos a cuatro semanas) y con dosis variables de corticosteroides orales en el tratamiento de los pólipos nasales." Además, se destacó que la falta de datos a largo plazo impidió establecer conclusiones acerca de un efecto mantenido de este tratamiento para los pólipos nasales. La revisión actual presenta pruebas adicionales de los efectos a corto plazo, aunque la conclusión de que hay una mejoría a corto plazo después de un tratamiento de corta duración con esteroides orales aún es válida. Además, esta revisión agrega tres estudios que informan resultados a los tres a seis meses (Kirtsreesakul 2012; Vaidyanathan 2011; Van Zele 2010). Los resultados a los tres a seis meses indican que la magnitud de la mejoría no se mantiene después del período de tratamiento con esteroides orales.
Se cambiaron los criterios de inclusión de la revisión anterior con respecto a la cirugía previa para incluir estudios en los que los pacientes habían recibido una cirugía en el transcurso de seis semanas antes del comienzo del ensayo, en comparación con los tres meses de la revisión anterior. Esto no aumentó el número de estudios incluidos. Algunos de los estudios investigaron específicamente la administración de esteroides orales preoperatoriamente para mejorar las condiciones del campo quirúrgico durante la cirugía (Ecevit 2015; Sieskiewicz 2006). Estos estudios se incluyeron si la duración del tratamiento fue equivalente a los otros estudios incluidos y cualquiera de los resultados preespecificados se midió antes de la cirugía (Ecevit 2015). En un estudio el ciclo de tratamiento fue solamente de cinco días y los resultados estaban relacionados específicamente con las condiciones del campo quirúrgico, por lo que se excluyó (Sieskiewicz 2006).
El artículo EPOS 2012 divide a la población con rinosinusitis crónica en con y sin pólipos nasales. Para la población sin pólipos nasales solamente se identificó una serie de casos clínicos con información acerca de los eventos adversos extrapolados de la población con rinosinusitis crónica con pólipos nasales. La recomendación, basada en pruebas muy débiles, en el artículo EPOS para la rinosinusitis crónica sin pólipos nasales (RSCsPN) fue que los "corticosteroides sistémicos tienen efectos beneficiosos sobre la RSCsPN". Para la población con rinosinusitis crónica con pólipos nasales (RSCcPN), el artículo EPOS utiliza los tres estudios incluidos en la revisión Cochrane anterior (Alobid 2006 ‐ informado en este estudio como Benitez 2006; Hissaria 2006; Van Zele 2010)y añade tres estudios/cuatro artículos adicionales (Benitez 2006; Vaidyanathan 2011; Martinez‐Anton 2008 ‐ informado en esta revisión como Benitez 2006; Rupa 2010). Vaidyanathan 2011 también se incluyó en esta revisión. Después de la comunicación con el autor del estudio se confirmó que Benitez 2006, Alobid 2006 y Martinez‐Anton 2008 contenían subgrupos de participantes del mismo ensayo y, por lo tanto, algunos pacientes se presentaron en el análisis de los tres ensayos. El autor también indicó que Benitez 2006 era el mejor artículo para utilizar como información más completa del ensayo y esta es la razón por la que se incluyó en esta revisión Cochrane. Rupa 2010 se excluyó de esta revisión porque informó sobre una población que estaba fuera del alcance de la revisión (rinosinusitis micótica alérgica). El artículo EPOS 2012 concluye, basado en pruebas sólidas, que los "corticosteroides sistémicos tienen un efecto beneficioso sobre la RSCcPN pero los efectos posteriores al tratamiento son limitados en el tiempo".
Como parte de este conjunto de revisiones Cochrane sobre las intervenciones para la rinosinusitis crónica, se publicó una revisión sobre la administración de esteroides orales de corta duración como tratamiento complementario (Head 2016a). Dos estudios identificados en esa revisión utilizaron esteroides orales como tratamiento complementario a cualquiera de los esteroides intranasales (Bülbül 2013),o antibióticos (Ozturk 2011). Los ensayos fueron pequeños, de baja calidad y no informaron muchos de los resultados preespecificados. No hubo suficientes pruebas para apoyar o rechazar la administración de esteroides orales como tratamiento complementario a otros tratamientos para la rinosinusitis crónica.
Como los estudios incluidos no informaron la incidencia de eventos adversos y el riesgo de efectos secundarios puede variar según la afección que se trate, es importante considerar los datos de afecciones similares, cuando sea posible. Una revisión reciente de esteroides sistémicos en la rinosinusitis aguda identificó cinco ensayos que incluyeron 1193 participantes que recibieron esteroides orales (prednisolona a dosis que variaron de 24 mg a 80 mg durante tres a siete días) o placebo, en los que se informaron los eventos adversos (Venekamp 2014; Venekamp 2015). No hubo diferencias entre los brazos activos o control en cuanto al riesgo de eventos adversos con respecto a los eventos leves o graves, ni al riesgo de interrupción del tratamiento.

Process for sifting search results and selecting studies for inclusion.

'Risk of bias' summary: review authors' judgements about each risk of bias item for each included study.

'Risk of bias' graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Forest plot of comparison: 1 Oral steroids versus no treatment/placebo, outcome: 1.1 Disease‐specific health‐related quality of life ‐ no pooling (2 to 3 weeks).

Forest plot of comparison: 1 Oral steroids versus no treatment/placebo, outcome: 1.3 Disease severity (patient‐reported total symptom score).

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 1 Disease‐specific health‐related quality of life ‐ no pooling (2 to 3 weeks).

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 2 Disease‐specific health‐related quality of life ‐ RQLQ (3 to 6 months).
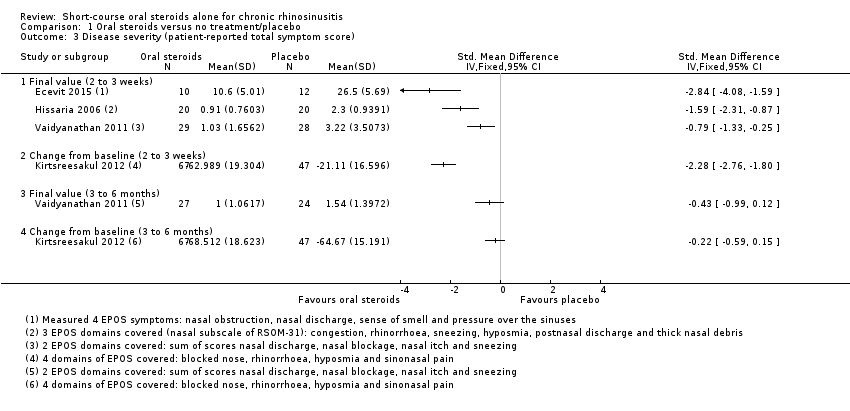
Comparison 1 Oral steroids versus no treatment/placebo, Outcome 3 Disease severity (patient‐reported total symptom score).

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 4 Individual symptoms: nasal obstruction (final value).
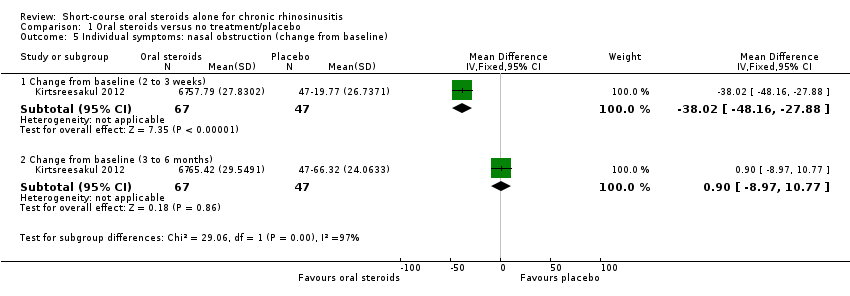
Comparison 1 Oral steroids versus no treatment/placebo, Outcome 5 Individual symptoms: nasal obstruction (change from baseline).
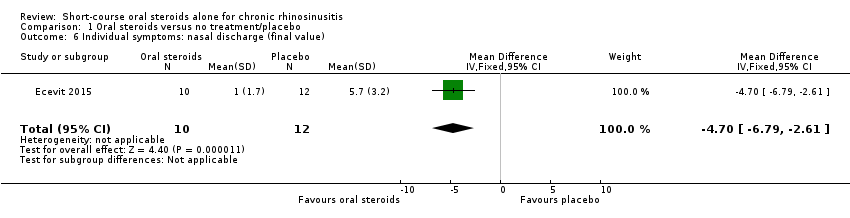
Comparison 1 Oral steroids versus no treatment/placebo, Outcome 6 Individual symptoms: nasal discharge (final value).

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 7 Individual symptoms: nasal discharge (change from baseline).

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 8 Individual symptoms: facial pressure (final value).
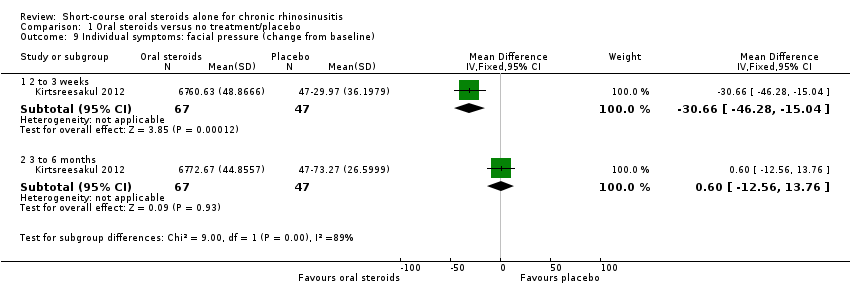
Comparison 1 Oral steroids versus no treatment/placebo, Outcome 9 Individual symptoms: facial pressure (change from baseline).

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 10 Individual symptoms: loss of sense of smell (final value).

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 11 Individual symptoms: loss of sense of smell (change from baseline).

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 12 Adverse events ‐ significant mood disturbance.

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 13 Adverse events ‐ gastrointestinal disturbance.

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 14 Adverse events ‐ insomnia.
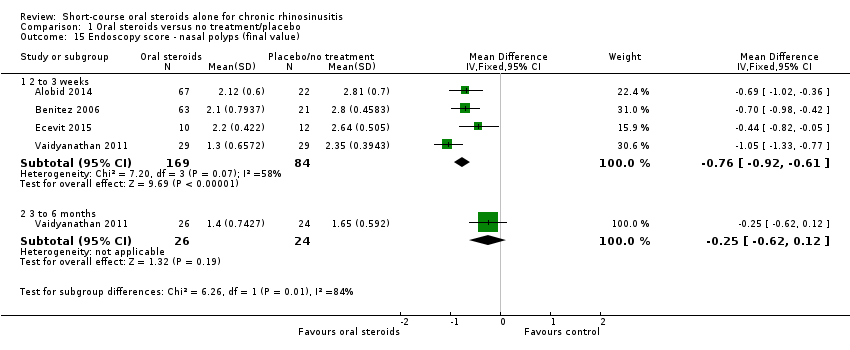
Comparison 1 Oral steroids versus no treatment/placebo, Outcome 15 Endoscopy score ‐ nasal polyps (final value).

Comparison 1 Oral steroids versus no treatment/placebo, Outcome 16 Endoscopy score ‐ nasal polyps score (change from baseline).
| Short‐course oral corticosteroids compared with placebo/no treatment for chronic rhinosinusitis | ||||||
| Patient or population: chronic rhinosinusitis with nasal polyps | ||||||
| Outcomes № of participants | Relative effect | Anticipated absolute effects* (95% CI) | Quality | What happens | ||
| Without oral steroids | With oral steroids | Difference | ||||
| Disease‐specific health‐related quality of life measured by Follow‐up: 2 weeks № of participants: 40 | — | Not estimable | — | The mean disease‐specific health‐related quality of life in the intervention group was 1.24 standard deviations lower (1.92 lower to 0.56 lower) | ⊕⊕⊝⊝ | A lower score indicates reduced impairment. Treatment effect in favour of short‐course oral steroids.
|
| Disease severity, as measured by patient‐reported symptom score,
| — | — | — |
| ⊕⊕⊝⊝ ⊕⊕⊝⊝ ⊕⊕⊝⊝ | A lower score indicates milder symptoms in favour of short‐course oral steroids.
|
| Adverse events: significant mood disturbance № of participants: 40 | RR 2.50 | Study population | ⊕⊕⊝⊝ | It is uncertain whether there were more mood disturbance adverse events in the oral corticosteroids group. | ||
| 100 per 1000 | 250 per 1000 | 150 more per 1000 (45 fewer to 1041 more) | ||||
| Health‐related quality of life, using generic quality of life scores | This outcome was not reported in any of the studies | |||||
| Adverse events: gastrointestinal disturbance Follow‐up: 3 months № of participants:187 | RR 3.45 | Study population | ⊕⊕⊝⊝ | There were more gastrointestinal disturbance adverse events in the oral corticosteroids group. | ||
| 47 per 1000 | 160 per 1000 | 114 more per 1000 (5 more to 455 more) | ||||
| Adverse events: insomnia Follow‐up: 3 months № of participants:187 | RR 3.63 | Study population | ⊕⊕⊝⊝ | There were more insomnia adverse events in the oral corticosteroids group. | ||
| 23 per 1000 | 84 per 1000 | 61 more per 1000 (2 more to 255 more) | ||||
| *The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence | ||||||
| 1Downgraded to low quality due to limitations in study methodology and imprecision. Only the disease severity scale of the RSOM‐31 was used (unknown validity of this subscale and the range of scores is unclear). One small study (n = 40), which lacked information about the method of randomisation and allocation concealment. There is a also concern that the magnitude of improvement is not sustained; one study that used a non‐validated instrument reported smaller benefit at three to six months than at two to three weeks for health‐related quality of life. 2The individual symptoms measured were: nasal obstruction, nasal discharge, sense of smell and pressure over the sinuses. Scores for the individual symptoms (0 to 10 visual analogue scale (VAS)) were summed to find the total score.The effect size could be underestimated with this method. 3Downgraded to low quality due to imprecision. Results are from one very small study (n = 22) and the results were only measured at the end of treatment (17 days). There is a concern that the magnitude of improvement is not sustained. The outcome was not measured using a validated tool. 4Downgraded to low quality due to limitations in study methodology and imprecision. One small study (n = 40), which lacked information about the method of randomisation and allocation concealment. The definition of 'mood disturbance' is not provided in the paper. The results have large confidence intervals. 5Downgraded to low quality due to inconsistency and imprecision. The terminology between the papers for this outcome differed from "diarrhoea/GI disturbance" to "gastrointestinal disturbance" to "reflux and/or gastric pain". A low number of events were reported resulting in large confidence intervals. 6Downgraded to low quality due to inconsistency and imprecision. The definition of 'insomnia' is not provided in the papers. A low number of events were reported resulting in large confidence intervals. 7The individual symptoms measured were: blocked nose, rhinorrhoea, hyposmia and sinonasal pain. The results were measured as individual symptoms on a seven‐point Likert scale (0 = no symptoms) and presented as percentage change from baseline for each symptom, which was averaged across the four symptoms to create an average change from baseline. The effect size could be underestimated with this method. 8All patients in both groups received intranasal steroids at the end of the treatment period until the end of follow‐up (12 weeks). 9Downgraded to low quality due to limitations in study methodology and imprecision. Results are from one small study (n = 117) with unclear randomisation and allocation concealment. The results were measured at the end of treatment (two weeks). There is a concern that the results are not sustained. The outcome was not measured using a validated tool. 10Downgraded to low quality due to limitations in study methodology and imprecision. Results are from one small study (n = 117) with unclear randomisation and allocation concealment. There is a small effect size with large confidence intervals. The outcome was not measured using a validated tool. | ||||||
| System | Adverse events | Notes |
| Musculoskeletal | Osteoporosis | Largely limited to long‐term use Significantly increased risk of fractures with prolonged use |
| Osteonecrosis | Rare, appears to be dose‐dependent | |
| Endocrine | Hyperglycaemia | Common; dose‐dependent, usually reversible |
| Cardiovascular | Hypertension | Common; dose‐dependent, usually reversible |
| Dermatological | Striae, bruising | Dose‐dependent; occurs after > 1 month usage |
| Ophthalmological | Cataracts | Irreversible; largely related to long‐term usage |
| Glaucoma | High risk with pre‐existing disease | |
| Gastrointestinal tract | Peptic ulceration | Increased risk largely due to concomitant NSAIDs |
| Psychological | Psychosis | Common; increased risk with dosages > 40 mg/day |
| References: Da Silva 2006; Naber 1996; Stanbury 1998 NSAIDs: non‐steroidal anti‐inflammatory drugs | ||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Disease‐specific health‐related quality of life ‐ no pooling (2 to 3 weeks) Show forest plot | 2 | Std. Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 1.1 Severity score of RSOM | 1 | 40 | Std. Mean Difference (IV, Fixed, 95% CI) | ‐1.24 [‐1.92, ‐0.56] |
| 1.2 Mini‐RQLQ | 1 | 58 | Std. Mean Difference (IV, Fixed, 95% CI) | ‐0.79 [‐1.32, ‐0.25] |
| 2 Disease‐specific health‐related quality of life ‐ RQLQ (3 to 6 months) Show forest plot | 1 | 50 | Std. Mean Difference (IV, Fixed, 95% CI) | ‐0.59 [‐1.16, ‐0.02] |
| 3 Disease severity (patient‐reported total symptom score) Show forest plot | 4 | Std. Mean Difference (IV, Fixed, 95% CI) | Totals not selected | |
| 3.1 Final value (2 to 3 weeks) | 3 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 3.2 Change from baseline (2 to 3 weeks) | 1 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 3.3 Final value (3 to 6 months) | 1 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 3.4 Change from baseline (3 to 6 months) | 1 | Std. Mean Difference (IV, Fixed, 95% CI) | 0.0 [0.0, 0.0] | |
| 4 Individual symptoms: nasal obstruction (final value) Show forest plot | 1 | 22 | Mean Difference (IV, Fixed, 95% CI) | ‐4.5 [‐6.42, ‐2.58] |
| 5 Individual symptoms: nasal obstruction (change from baseline) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 5.1 Change from baseline (2 to 3 weeks) | 1 | 114 | Mean Difference (IV, Fixed, 95% CI) | ‐38.02 [‐48.16, ‐27.88] |
| 5.2 Change from baseline (3 to 6 months) | 1 | 114 | Mean Difference (IV, Fixed, 95% CI) | 0.90 [‐8.97, 10.77] |
| 6 Individual symptoms: nasal discharge (final value) Show forest plot | 1 | 22 | Mean Difference (IV, Fixed, 95% CI) | ‐4.7 [‐6.79, ‐2.61] |
| 7 Individual symptoms: nasal discharge (change from baseline) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 7.1 2 to 3 weeks | 1 | 114 | Mean Difference (IV, Fixed, 95% CI) | ‐55.57 [‐69.23, ‐41.91] |
| 7.2 3 to 6 months | 1 | 114 | Mean Difference (IV, Fixed, 95% CI) | ‐1.83 [‐13.46, 9.81] |
| 8 Individual symptoms: facial pressure (final value) Show forest plot | 1 | 22 | Mean Difference (IV, Fixed, 95% CI) | ‐3.7 [‐6.02, ‐1.38] |
| 9 Individual symptoms: facial pressure (change from baseline) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 9.1 2 to 3 weeks | 1 | 114 | Mean Difference (IV, Fixed, 95% CI) | ‐30.66 [‐46.28, ‐15.04] |
| 9.2 3 to 6 months | 1 | 114 | Mean Difference (IV, Fixed, 95% CI) | 0.60 [‐12.56, 13.76] |
| 10 Individual symptoms: loss of sense of smell (final value) Show forest plot | 2 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 10.1 2 to 3 weeks | 2 | 80 | Mean Difference (IV, Fixed, 95% CI) | ‐2.79 [‐4.11, ‐1.47] |
| 10.2 3 to 6 months | 1 | 50 | Mean Difference (IV, Fixed, 95% CI) | ‐1.20 [‐2.68, 0.28] |
| 11 Individual symptoms: loss of sense of smell (change from baseline) Show forest plot | 1 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 11.1 2 to 3 weeks (after treatment) | 1 | 114 | Mean Difference (IV, Fixed, 95% CI) | ‐44.35 [‐57.31, ‐31.39] |
| 11.2 3 to 6 months | 1 | 114 | Mean Difference (IV, Fixed, 95% CI) | ‐15.05 [‐29.69, ‐0.41] |
| 12 Adverse events ‐ significant mood disturbance Show forest plot | 1 | 40 | Risk Ratio (M‐H, Fixed, 95% CI) | 2.5 [0.55, 11.41] |
| 13 Adverse events ‐ gastrointestinal disturbance Show forest plot | 3 | 187 | Risk Ratio (M‐H, Fixed, 95% CI) | 3.45 [1.11, 10.78] |
| 14 Adverse events ‐ insomnia Show forest plot | 3 | 187 | Risk Ratio (M‐H, Fixed, 95% CI) | 3.63 [1.10, 11.95] |
| 15 Endoscopy score ‐ nasal polyps (final value) Show forest plot | 4 | Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 15.1 2 to 3 weeks | 4 | 253 | Mean Difference (IV, Fixed, 95% CI) | ‐0.76 [‐0.92, ‐0.61] |
| 15.2 3 to 6 months | 1 | 50 | Mean Difference (IV, Fixed, 95% CI) | ‐0.25 [‐0.62, 0.12] |
| 16 Endoscopy score ‐ nasal polyps score (change from baseline) Show forest plot | 2 | Std. Mean Difference (IV, Fixed, 95% CI) | Subtotals only | |
| 16.1 2 to 3 weeks | 2 | 146 | Std. Mean Difference (IV, Fixed, 95% CI) | ‐1.77 [‐2.16, ‐1.38] |
| 16.2 3 to 6 months | 1 | 114 | Std. Mean Difference (IV, Fixed, 95% CI) | ‐0.52 [‐0.90, ‐0.14] |

