Cirugía asistida por robot en ginecología
Resumen
Antecedentes
Ésta es una actualización de una revisión que fusiona dos revisiones Cochrane originalmente separadas: una sobre cirugía asistida por robot (CAR) para la enfermedad ginecológica benigna, la otra sobre CAR para el cáncer ginecológico. La CAR es una innovación relativamente nueva en la cirugía laparoscópica que le permite al cirujano realizar la operación desde una consola computarizada situada lejos de la mesa quirúrgica. En la actualidad, la CAR se utiliza ampliamente en los Estados Unidos para la histerectomía y ha mostrado ser factible en otros procedimientos ginecológicos. Sin embargo, la efectividad clínica y la seguridad de la CAR en comparación con la cirugía laparoscópica convencional (CLC) no se han establecido claramente y requieren revisión independiente.
Objetivos
Evaluar la efectividad y la seguridad de la CAR en el tratamiento de las pacientes con enfermedad ginecológica benigna y maligna.
Métodos de búsqueda
Para esta actualización, se hicieron búsquedas en el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials) (CENTRAL) (2014, número 5) y en el registro de ensayos del Grupo de Revisión Cochrane de Cáncer Ginecológico (Cochrane Gynaecological Cancer Review Group). También se efectuaron búsquedas en las bases de datos MEDLINE y EMBASE para complementar las búsquedas de las revisiones originales de enfermedades malignas y benignas (realizadas hasta julio de 2010 y noviembre de 2011, respectivamente), desde julio de 2010 hasta junio de 2014.
Criterios de selección
Ensayos controlados aleatorios (ECA) de CAR comparada con CLC o cirugía abierta en pacientes que requerían cirugía por enfermedades ginecológicas.
Obtención y análisis de los datos
Dos revisores de forma independiente evaluaron los estudios para su inclusión y el riesgo de sesgo, y extrajeron los datos de los estudio y los introdujeron en una hoja de cálculo de Excel. Los datos se subagruparon según el tipo de procedimiento y se agruparon mediante los métodos de efectos aleatorios en RevMan 5.3. Se realizaron análisis de sensibilidad con la exclusión de los estudios con alto riesgo de sesgo.
Resultados principales
Se incluyeron seis ECA con 517 pacientes. La mayoría tuvo un riesgo general de sesgo de bajo a moderado; uno tuvo alto riesgo de sesgo. Cuatro estudios evaluaron la CAR para la histerectomía (371 pacientes), y dos estudios evaluaron la CAR para la sacrocolpopexia (146 pacientes). Todos los estudios compararon la CAR con CLC, excepto un estudio que comparó la CAR con CLC o un enfoque quirúrgico vaginal para la histerectomía. Los intervalos de confianza para el riesgo de complicaciones intraoperatorias y postoperatorias incluyeron los efectos beneficiosos con cualquiera de los enfoques cuando se analizaron juntos (cociente de riesgos [CR] 0,95; intervalo de confianza [IC] del 95%: 0,46 a 1,99; participantes = 513; estudios = 6; I2 = 74%) y por separado (pruebas de baja calidad). Se encontraron pruebas de calidad moderada para los efectos de la CAR en la lesión intraoperatoria en comparación con la CLC (CR 1,23; IC del 95%: 0,44 a 3,46; participantes = 415; estudios = 5; I2 = 0%), además de pruebas de baja calidad para las complicaciones hemorrágicas e infecciosas.
La media del tiempo quirúrgico total fue consistente entre los procedimientos y como promedio fue cerca de 42 minutos más prologada en el brazo de CAR en comparación con el brazo de CLC (IC del 95%: 17 a 66 minutos; participantes = 294; estudios = 4; I2 = 82%; pruebas de calidad moderada). La media de la estancia hospitalaria para los procedimientos de histerectomía fue alrededor de siete horas más corta en el brazo de CAR que en el brazo de CLC (diferencia de medias [DM] ‐0,30 días, IC del 95%: ‐0,54 a ‐0,06; participantes = 217; estudios = 2; I2 = 0%; pruebas de baja calidad). La estimación del efecto de la conversión de la CAR en comparación con la CLC fue imprecisa (CR 1,28; IC del 95%: 0,40 a 4,12; participantes = 337; estudios = 4; I2 = 0%; pruebas de calidad moderada). Datos limitados de dos estudios indican que la CAR para la sacrocolpopexia se puede asociar con un aumento del dolor postoperatorio en comparación con la CLC; lo que requiere más investigación. Se identificaron cinco ensayos en curso (cuatro de cirugía por cáncer).
Conclusiones de los autores
No hay certeza sobre si la CAR o la CLC tienen menores tasas de complicación intraoperatorias y postoperatorias debido a la falta de precisión del efecto y la inconsistencia entre los estudios cuando se utilizaron para la histerectomía y la sacrocolpopexia. Pruebas de calidad moderada indican que estos procedimientos tardan más con la CAR pero se pueden asociar con una estancia hospitalaria más corta después de la histerectomía. Se encontraron pruebas limitadas sobre la efectividad y la seguridad de la CAR en comparación con la CLC o la cirugía abierta para los procedimientos quirúrgicos realizados para el cáncer ginecológico; por lo tanto, su uso debe estar limitado a ensayos clínicos. Es probable que los ensayos en curso tengan una repercusión importante sobre las pruebas relacionadas con el uso de la CAR en ginecología.
PICOs
Resumen en términos sencillos
Uso de tecnología computarizada o robótica para ayudar a los cirujanos a realizar la cirugía ginecológica
Esta es una revisión actualizada originalmente cubierta por dos revisiones Cochrane separadas sobre cirugía asistida por robot para la enfermedad ginecológica benigna y maligna.
La pregunta
La cirugía laparoscópica se utiliza ampliamente en ginecología. La cirugía asistida por robot (CAR) es un tipo relativamente nuevo de cirugía laparoscópica que le permite al cirujano realizar la operación desde una consola computarizada situada lejos del paciente mediante brazos mecánicos de mando a distancia adheridos a la mesa quirúrgica. Actualmente, la CAR se utiliza en varios países para la cirugía ginecológica, en particular para la histerectomía (extracción del útero / matriz), y se ha informado que es útil para la miomectomía (extracción de los fibromas uterinos), la reanastomosis tubárica (unir los dos extremos de la trompa de Falopio para restaurar la fertilidad), la sacrocolpopexia (diseñada para reparar el prolapso de la cúpula vaginal, cuando la parte superior de la vagina se desliza hacia abajo) y otros procedimientos para enfermedades benignas (no cancerosas). También se ha utilizado en el tratamiento de las pacientes con cánceres ginecológicos, especialmente del endometrio (recubrimiento de la matriz) y los cánceres cervicouterinos. Sin embargo, no se han establecido claramente los efectos beneficiosos y los riesgos de la CAR versus los enfoques quirúrgicos estándar.
¿Cómo se realizó la revisión?
Los estudios se identificaron mediante búsquedas en bases de datos y se les escribió a los investigadores de ensayos registrados. Dos revisores de forma independiente evaluaron los estudios y recopilaron los datos de cada estudio. Sólo se incluyeron ensayos controlados con asignación al azar. Los datos de los estudios individuales similares se agruparon en los análisis según el tipo de operación realizada (histerectomía o sacrocolpopexia).
Hallazgos
Se incluyeron seis estudios con 517 pacientes con enfermedad ginecológica benigna (no cáncer). Se determinó que un estudio presentaba alto riesgo de sesgo. No hay certeza con respecto a si la CAR o la cirugía laparoscópica convencional (CLC) tienen menores tasas generales de complicación porque las pruebas obtenidas fueron de calidad baja. Se combinaron los datos de cuatro estudios que mostraron que, en promedio, los procedimientos de la CAR fueron alrededor de 42 minutos más prolongados pero los resultados variaron entre los estudios, aunque como promedio las pacientes a las que se les realizó histerectomía tuvieron una estancia hospitalaria más corta de cerca de siete horas; la calidad de las pruebas fue baja. Se identificaron cinco ensayos en curso (cuatro de cirugía por cáncer).
Conclusiones
Las pruebas de baja calidad aplicables a las operaciones de histerectomía y sacrocolpopexia indican que las tasas de complicación para la CAR pueden no ser diferentes de las de la CLC. Pruebas de calidad moderada indican que estos procedimientos tardan más con la CAR pero se pueden asociar con una estancia hospitalaria más corta. Faltan pruebas sobre la CAR para la cirugía por cáncer. Se necesita investigación adicional.
Conclusiones de los autores
Summary of findings
| Robot‐assisted surgery (RAS) compared with conventional laparoscopic surgery (CLS) for gynaecological disease | ||||||
| Patient or population: women with benign gynaecological disease requiring surgery Settings: hospital Intervention: RAS Comparison: CLS | ||||||
| Outcomes | Illustrative comparative risksa (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| CLS | RAS | |||||
| Intraoperative and postoperative complications | All procedures (subgroups were similar) | RR 0.95 (0.46 to 1.99) | 513 (6) | ⊕⊕⊝⊝ | Downgraded because of inconsistency (I2 = 74%) and imprecision. Early studies favoured CLS, whereas later studies favoured RAS but had other limitations | |
| 19 per 100 | 18 per 100 (9 to 38) | |||||
| Intraoperative complications only | All procedures (subgroups were similar) | RR 1.71 (0.83 to 3.52) | 337 (4) | ⊕⊕⊝⊝ | Downgraded because of imprecision and study limitations (2 early studies contributed 16/17 adverse events in the RAS arm). Sensitivity analyses suggest that effect estimate is likely to change | |
| 6 per 100 | 10 per 100 | |||||
| Postoperative complications only | Hysterectomy | RR 0.62 (0.30 to 1.29) RR 3.54 (1.31 to 9.56) | 315 (3) 68 (1) | ⊕⊕⊝⊝ ⊕⊝⊝⊝ | Downgraded because of imprecision and study limitations. Early studies tend to favour CLS, whereas later studies favour RAS but had other limitations Only 1 small, early study reported data, which included urinary tract infections | |
| 16 per 100 | 10 per 100 | |||||
| Sacrocolpopexy | ||||||
| 12 per 100 | 42 per 100 | |||||
| Intraoperative injury | All procedures (subgroups were similar) | RR 1.23 (0.44 to 3.46) | 415 (5) | ⊕⊕⊕⊝ | Downgraded because of imprecision | |
| 3 per 100 | 4 per 100 (1 to 10) | |||||
| Total operating time (minutes) | Mean total operating time ranged across control groups from | Mean total operating time in the intervention groups ranged from | MD 41.71 (17.08 to 66.33) | 294 (4) | ⊕⊕⊕⊝ | Downgraded because of inconsistency (I2 = 82%). 2 studies that could not be included in the meta‐analysis reported no significant differences in median operating times |
| Overall hospital stay (days) | Hysterectomy | MD ‐0.30 (‐0.54 to ‐0.06) | 217 | ⊕⊕⊝⊝ | Downgraded because of risk of bias concerns and imprecision (effect estimate ranged from 1 to 13 hours shorter hospital stay in RAS group) | |
| Mean hospital stay ranged across control groups from 1.4 to 3.6 days | Mean hospital stay in the intervention groups was | |||||
| Sacrocolpopexy | MD 0.37 (‐0.16 to 0.90) | 68 (1) | ⊕⊕⊝⊝ | Downgraded because of study limitations and sparse data | ||
| Mean hospital stay in the control group was 1.42 days | Mean hospital stay in the intervention group was 1.79 days | |||||
| Conversion to another approach | All procedures (subgroups were similar) | RR 1.29 (0.40 to 4.16) | 338 | ⊕⊕⊕⊝ | Downgraded because of imprecision | |
| 3 per 100 | 4 per 100 | |||||
| aThe basis for the assumed risk for dichotomous data is the mean control group risk across studies. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
Antecedentes
Esta es una revisión actualizada de dos revisiones Cochrane originalmente separadas sobre el uso de cirugía asistida por robot para la enfermedad ginecológica benigna (Liu 2012) y para el cáncer ginecológico (Lu 2012).
Descripción de la afección
Las afecciones ginecológicas benignas frecuentes incluyen los fibromas uterinos, la endometriosis (tejido endometrial que se encuentra fuera del útero), los tumores ováricos benignos, el prolapso de órganos pelvianos y la fístula vesicovaginal (una comunicación entre la vejiga y la vagina), entre otros. La cirugía de dichas afecciones pueden incluir la extracción de la parte o la estructura afectada (p.ej. histerectomía [extracción del útero], miomectomía [extracción de los fibromas], cistectomía ovárica [extracción de quistes ováricos]), la cirugía para la endometriosis o la reparación quirúrgica (p.ej. sacrocolpopexia [diseñada para reparar el prolapso vaginal, donde la parte superior de la vagina se desliza hacia abajo], la reparación de fístulas, la reanastomosis tubárica [unión de dos extremos de una trompa de Falopio para restablecer la fertilidad]). La histerectomía es la operación ginecológica mayor realizada con más frecuencia; es probable que a una de cada cinco mujeres en el Reino Unido y una de cada tres mujeres en los EE.UU. se les realice este procedimiento durante su vida (Hyst 2013). Las histerectomías y la mayoría de los otros procedimientos quirúrgicos para las afecciones ginecológicas benignas se pueden realizar de manera eficaz a través de un enfoque laparoscópico.
Las afecciones ginecológicas malignas pueden afectar el útero, los ovarios, las trompas de Falopio, el cuello uterino, la vagina y la vulva y representan del 10% al 15% de los cánceres en las mujeres, con diferente incidencia y pronóstico según la ubicación geográfica (Jemal 2011). En todo el mundo, el cáncer cervicouterino, del endometrio y ovárico son el cuarto, quinto y octavo cáncer más frecuente, respectivamente, y afectan a las mujeres hasta la edad de 65 años (Jemal 2011). Sin embargo, en los países desarrollados el cáncer endometrial es el cáncer ginecológico más frecuente seguido del cáncer de ovario, mientras que el cáncer cervicouterino es el cáncer ginecológico más frecuente en los países en desarrollo (Jemal 2011). Una alta proporción de los cánceres endometriales y cervicouterinos se detectan en un estadio temprano en los países desarrollados, donde el enfoque primario para el tratamiento de estas afecciones es quirúrgico. En el cáncer temprano del endometrio, la cirugía incluye histerectomía y salpingoovariectomía bilateral (SOB) con o sin linfadenectomía; la cirugía para el cáncer cervicouterino temprano incluye histerectomía radical (extracción del útero, el cuello uterino, la parte superior de la vagina, los parametrios y los ganglios linfáticos pelvianos). Con frecuencia el cáncer de ovario solamente se detecta en un estadio avanzado y habitualmente requiere de una cirugía más extensa que incluye histerectomía, SOB, linfadenectomía pelviana y paraaórtica, omentectomía, apendicectomía y exploracion abdominal. Los procedimientos de estadiaje se realizan generalmente a través de una laparotomía; sin embargo, cada vez se utilizan más los enfoques mínimamente invasivos, en particular para los cánceres del endometrio y cervicouterino en estadio temprano. Una revisión Cochrane de 2012 de laparoscopia para el cáncer endometrial encontró que la laparoscopia se asoció con una reducción de la morbilidad operatoria y la estancia hospitalaria y con una supervivencia similar a la de la laparotomía (Galaal 2012). Sin embargo, no se ha establecido la función de la laparoscopía en la cirugía de los cánceres cervicouterinos y ováricos tempranos (Kucukmetin 2013; Lawrie 2013).
Descripción de la intervención
La cirugía asistida por robot (CAR), también conocida como cirugía robótica, cirugía laparoscópica asistida por robot o cirugía asistida por computadora, es una innovación reciente en el campo de la cirugía mínimamente invasiva. Aunque aún no está ampliamente disponible en la mayoría de los países, durante la década pasada aumentó el uso de sistemas quirúrgicos robóticos en todos los tipos de cirugías ginecológicas y no ginecológicas. Una de las primeras aplicaciones de la CAR fue el AESOP (Automated Endoscopic System for Optical Positioning; Computer Motion, Goleta, CA, USA), un endoscopio activado por la voz (Mettler 1998). Otro antecesor del sistema actual fue el ZEUS Robotic Surgical System (ZRSS) (Computer Motion). ZEUS constaba de tres brazos robóticos controlados por control remoto adheridos a la mesa quirúrgica, junto con una consola robótica, que contenía los controles del instrumento. Este dispositivo difería de los modelos anteriores en que permitía al cirujano mantenerse lejos de la mesa de operaciones. Los primeros estudios informaron la aplicación con éxito de ZEUS para la reanastomosis tubárica (Falcone 2000). En 2003, Computer Motion se fusionó con su empresa rival, Intuitive Surgical, y estos sistemas más antiguos se descontinuaron. La empresa fusionada desarrolló el da Vinci ® Surgical System, que estuvo comercialmente disponible para la cirugía ginecológica en 2005.
El da Vinci® Surgical System (Intuitive Surgical, Sunnyvale, CA, USA) consta de tres componentes: una consola operada por el cirujano con visor estereoscópico y controles de manos y pies, imaginología estereoscópica tridimensional (3‐D) a través de un endoscopio y un carro al lado del paciente con tres o cuatro brazos robóticos con instrumentos giratorios que se ha informado que son más diestros que la mano humana (Holloway 2009a). Actualmente este sistema es la única plataforma quirúrgica robótica comercialmente disponible que ha recibido la aprobación de la Food and Drug Administration (FDA) de los EE.UU. para realizar procedimientos ginecológicos. Según el sitio web del fabricante (www.intuitivesurgical.com), se han realizado más de 1 500 000 de operaciones y se han vendido en todo el mundo más de 2000 unidades da Vinci ® (da Vinci 2014). Además, la participación en el mercado de EE.UU. de la empresa para las histerectomías realizadas por afecciones benignas aparentemente fue del 27% en 2011 (da Vinci 2014).
De qué manera podría funcionar la intervención
La cirugía mínimamente invasiva es un enfoque quirúrgico que reduce al mínimo las incisiones quirúrgicas para disminuir el traumatismo al cuerpo. La cirugía laparoscópica es un tipo de cirugía mínimamente invasiva mediante la cual el cirujano hace incisiones pequeñas en la pared abdominal, a través de las cuales se insertan luego instrumentos finos. Dichos instrumentos incluyen un laparoscopio (una cámara con magnificación), que permite visualizar las estructuras dentro del abdomen y la pelvis. En la cirugía laparoscópica convencional (CLC), el cirujano o un ayudante quirúrgico sostienen y dirigen físicamente el laparoscopio y otros instrumentos; lo anterior requiere un alto grado de habilidad, destreza y entrenamiento (Ramsey 2012). La desventaja principal de cualquier sistema laparoscópico comparado con la laparotomía es la falta de percepción táctil (retroalimentación háptica), aunque actualmente se desconoce la importancia de la percepción táctil en la mayoría de los procedimientos ginecológicos (Moy 2010). Cada vez más se prefiere la cirugía laparoscópica a la laparotomía (cirugía abdominal abierta) para varios procedimientos ginecológicos. En los tumores ováricos benignos, la cirugía laparoscópica se asocia con menos complicaciones perioperatorias, menos dolor postoperatorio y una estancia hospitalaria más corta comparada con la laparotomía (Medeiros 2009). Una revisión de la cirugía laparoscópica para el cáncer endometrial temprano informó ventajas similares, sin diferencias en la supervivencia (Galaal 2012).
La cirugía asistida por robot (CAR) es un adelanto tecnológico en la CLC, ya que el laparoscopio y los instrumentos quirúrgicos forman parte de un sistema mecánico que el cirujano opera desde una consola separada. Los partidarios de la CAR señalan que el sistema es más cómodo para el cirujano y ofrece ventajas técnicas adicionales comparada con la CLC que incluyen la visión 3‐D, la reducción al mínimo de los efectos del temblor de las manos, mayor libertad de movimiento, mayor precisión en la disección, más facilidad para suturar y anudar y un proceso de aprendizaje más corto (Cho 2009). Comparada con la CLC, estas ventajas se pueden traducir en una reducción de las complicaciones perioperatorias, las pérdidas sanguíneas, el dolor postoperatorio y la estancia hospitalaria, y un aumento de la supervivencia en la enfermedad maligna. Sin embargo, se conocen varias desventajas que incluyen el elevado costo del equipo y los instrumentos desechables, la completa falta de retroalimentación háptica y la necesidad de entrenar a cirujanos y personal de enfermería. Además, algunos aspectos de la CAR, por ejemplo el número de puertos de incisión requeridos, podrían aumentar los riesgos asociados con el procedimiento en comparación con el enfoque convencional.
Función de la CAR en la enfermedad ginecológica benigna
Desde finales de los noventa, la CAR se ha utilizado en la cirugía ginecológica y en varios informes se han descrito sus aplicaciones. En la enfermedad benigna, la operación ginecológica asistida por robot realizada con más frecuencia es la histerectomía. Se han informado diversos aspectos de la histerectomía laparoscópica asistida por robot que se realizan con mayor facilidad que con la CLC, como el aseguramiento de los vasos uterinos y los ligamentos cardinales, la realización de una colpotomía exacta y la sutura del manguito vaginal (Dimitri 2010; Lenihan 2008; Nezhat 2006; Reynolds 2006). Otros informes de procedimientos asistidos por robot incluyen la miomectomía (Advincula 2004; Advincula 2007; Cela 2013; Gocmen 2013; Nezhat 2009), la reanastomosis tubárica para restablecer la fertilidad (Degueldre 2000; Dharia 2008; Rodgers 2007), la sacrocolpopexia, la reparación de fístulas vesicovaginales (Hemal 2008; Melamud 2005; Schimpf 2007; Sundaram 2006) y la cirugía compleja por endometriosis (Cadiere 2001; Nezhat 2006; Sener 2006). Estudios preliminares de CAR para estos procedimientos han indicado que es factible realizarlos con la CAR.
Función de la CAR en los cánceres ginecológicos
Las operaciones para el estadiaje de las neoplasias ginecológicas son procedimientos extensos que pueden dar lugar a la fatiga del cirujano y molestias musculares que pueden limitar el rendimiento del cirujano (Verheijen 2012). Para el cáncer endometrial, un número cada vez mayor de estudios no aleatorios describe resultados excelentes con la CAR, que incluyen un buen acceso a los ganglios linfáticos, pérdidas sanguíneas escasas, un tiempo quirúrgico comparable, pocas complicaciones y bajas tasas de conversión y estancias hospitalarias cortas (Bell 2008; Cardenas‐Goicoechea 2010; Coronado 2012; DeNardis 2008; Field 2007; Gehrig 2008; Holloway 2009b; Lambaudie 2008; Reynisson 2013; Reynolds 2005; Seamon 2009a; Shafer 2008; Veljovich 2008). Pocos estudios han evaluado la supervivencia posterior al estadiaje con CAR; sin embargo, una revisión retrospectiva de 499 pacientes a las que se les realizó el estadiaje del cáncer endometrial mediante CAR indica que las tasas de supervivencia sin recidiva y general no se afectaron de manera negativa (Kilgore 2013).
En el cáncer cervicouterino, los estudios de histerectomía laparoscópica radical asistida por robot han informado resultados favorables en comparación con la CLC, que incluyen reducción de las pérdidas sanguíneas, estancia hospitalaria más corta y menor necesidad de analgesia (Boggess 2008a; Fanning 2008; Kim 2008; Lowe 2009; Maggioni 2009; Magrina 2008; Nezhat 2008; Persson 2009; Soliman 2013). Además, los informes de casos indican que la traquelectomía asistida por robot puede proporcionar una buena opción para las pacientes que buscan preservar la fertilidad porque permite la visualización excelente de los vasos y los tejidos parametriales (tejido conjuntivo y graso adyacente al útero), que debe ser aislado durante el procedimiento (Diaz 2008; Geisler 2008; Persson 2008; Plante 2008).
Los informes de la CAR para el cáncer de ovario son poco frecuentes debido a la dificultad inherente para la exploración extensa del abdomen con la CAR (y la CLC). Sin embargo, pruebas limitadas indican que los casos tempranos seleccionados pueden ser apropiados (Finger 2014; Madhuri 2012; Verheijen 2012). Vergote 2008 informó una serie de �?ve pacientes a las que se les realizó la evaluación de nódulos retroperitoneales mediante la CAR con resultados excelentes, que incluyó estancias hospitalarias cortas y pérdida sanguínea mínima. Todos los procedimientos fueron completados en menos de una hora de tiempo de consola y los autores del estudio concluyeron que el muestreo paraaórtico retroperitoneal con robot es un procedimiento factible que justifica evaluación adicional.
Por qué es importante realizar esta revisión
La cirugía asistida por robot (CAR) es una tecnología nueva que puede conferir ventajas (o desventajas) en comparación con los enfoques quirúrgicos convencionales utilizados en ginecología. Al igual que con cualquier tecnología nueva en la atención sanitaria, la CAR requiere de una evaluación rigurosa. La CAR es polémica debido a los intereses comerciales significativos involucrados y, como esta tecnología es costosa, los informes tienden a ser generados por los partidarios del enfoque. En los EE.UU., según Schiavone 2012, se ha generalizado la comercialización de la CAR por los hospitales para la ginecología, sus limitaciones potenciales y costos pocas veces se les informan a las pacientes y la mayoría de los sitios web señalan una reducción del dolor, un tiempo de recuperación más corto y menos pérdidas sanguíneas con la CAR. No obstante, los estudios individuales y las revisiones hasta la fecha no han proporcionado pruebas suficientes de la efectividad clínica de la CAR comparada con la CLC. Además, se ha observado un considerable riesgo de sesgo en una revisión de estudios principalmente no aleatorios de CAR versus otros enfoques para la histerectomía (O'Neill 2013).
El costo elevado de los sistemas por robot se puede disminuir si los efectos beneficiosos clínicos significativos sobre la CLC se pueden probar de manera independiente. Se ha indicado que los costos también se pueden disminuir a través de los efectos beneficiosos indirectos para el cirujano (ergonomía, costos de la asistencia sanitaria) (Nieboer 2014).
Las revisiones originales de CAR en la enfermedad ginecológica benigna y maligna (Liu 2012; Lu 2012) encontraron pocos estudios de alta calidad y pocas pruebas para apoyar las declaraciones de equivalencia o superioridad sobre enfoques convencionales menos costosos. Solamente dos ECA pequeños (ambos para la enfermedad benigna) contribuyeron con datos, y no fue posible establecer conclusiones sólidas. Durante los dos últimos años, se han publicado los resultados de varios ECA que potencialmente aportan pruebas de la efectividad clínica de la CAR comparada con la CLC. Esta revisión se actualizó para ayudar a la toma de decisiones por las pacientes, los médicos y otras partes interesadas.
Objetivos
Evaluar la efectividad y la seguridad de la CAR en el tratamiento de las pacientes con enfermedad ginecológica benigna y maligna.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Sólo se incluyeron ensayos controlados aleatorios (ECA).
Tipos de participantes
Pacientes que necesitan cirugía por enfermedad ginecológica benigna o maligna a cualquier edad.
Tipos de intervenciones
-
Cirugía asistida por robot (CAR) versus cirugía laparoscópica convencional (CLC).
-
CAR versus cirugía abierta.
-
Comparación de diferentes tipos de asistentes robóticos.
Tipos de medida de resultado
Resultados primarios
-
Complicaciones intraoperatorias, que incluyen la lesión a la vejiga, los uréteres, el intestino, los vasos sanguíneos y los nervios.
-
Complicaciones postoperatorias, que incluyen complicaciones vasculares (p.ej. hemorragia, trombosis venosa profunda), de la herida (p.ej. infección, dehiscencia [apertura de la herida]), gastrointestinales (p.ej. obstrucción intestinal debido a adherencias fibrosas, íleo paralítico debido a parálisis de los músculos intestinales, hernia incisional [una inflamación causada por protrusión del tejido a través de una herida quirúrgica]), neurológicas, respiratorias (p.ej. neumonía, embolia [coágulo sanguíneo en un vaso sanguíneo pulmonar]) y urinarias (p.ej. retención urinaria aguda).
Resultados secundarios
Para todos los procedimientos.
-
Mortalidad temprana y tardía (la mortalidad temprana se definió como la muerte en el transcurso de 30 días; mortalidad tardía definida como la muerte en el transcurso de tres meses).
-
Tiempo quirúrgico total (desde la incisión hasta el cierre de la piel).
-
Tiempo para la preparación del instrumental.
-
Duración general y postoperatoria de la estancia hospitalaria.
-
Pérdida de sangre calculada.
-
Transfusión sanguínea.
-
Tasa de conversión a cirugía abierta (para CAR versus CLC).
-
Calidad de vida (CdV) evaluada mediante escalas validadas (p.ej. Quality of Life Questionnaire‐Core 30 (QLQ‐C30) (desarrollado para evaluar la calidad de vida de los pacientes con cáncer, Functional Assessment of Cancer Therapy‐Ovarian [FACT‐O]).
-
Dolor postoperatorio evaluado mediante una escala analógica visual u otras escalas validadas.
-
Costo total (que incluye costo de los equipos, costos del quirófano y estancia hospitalaria).
-
Rendimiento y volumen de trabajo del cirujano evaluado por los investigadores (p.ej. mediante el NASA‐TLX Task Load Index [NASA‐TLX]).
Además, para la cirugía por cáncer.
-
Supervivencia libre de enfermedad
-
Supervivencia general.
-
Número de ganglios linfáticos obtenidos: ganglios linfáticos totales, pelvianos y paraaórticos.
Results
Description of studies
Results of the search
Searches conducted for the two original reviews contributed the following studies to this combined review:
-
Liu 2012 (benign gynaecological disease) included Sarlos 2010 (conference abstract only) and Paraiso 2011, and excluded three studies (not RCTs). These previously included studies comprised six citations (five conference abstracts and one full published report).
-
Lu 2012 (malignant gynaecological disease) included no studies and excluded 27 studies (not RCTs).
For further details of these searches, please consult the original reviews (Liu 2012; Lu 2012). For this updated review, the combined updated searches yielded 2221 deduplicated study records. After sifting through the titles and abstracts of these records, we identified 15 records for classification (nine full articles and six conference abstracts) pertaining to 10 studies in total (Anger 2014; Campos 2013; Desille‐Gbaguidi 2013; Gocmen 2013; Green 2013; Martinez‐Maestro 2014; McNanley 2012; Palmer 2013; Paraiso 2013; Sarlos 2010). In addition, we identified one newly published paper (Lonnerfors 2014) by writing to the investigators of a trial identified by searching online trial registers. Of these 11 potentially eligible studies in total, we excluded six studies (Campos 2013; Desille‐Gbaguidi 2013; Gocmen 2013; Martinez‐Maestro 2014; McNanley 2012; Palmer 2013) and included four studies (Anger 2014; Green 2013; Lonnerfors 2014; Paraiso 2013) (Figure 1). The remaining paper was a new publication (full report) of a previously included study, which had been previously included as a conference abstract alone (Sarlos 2010).
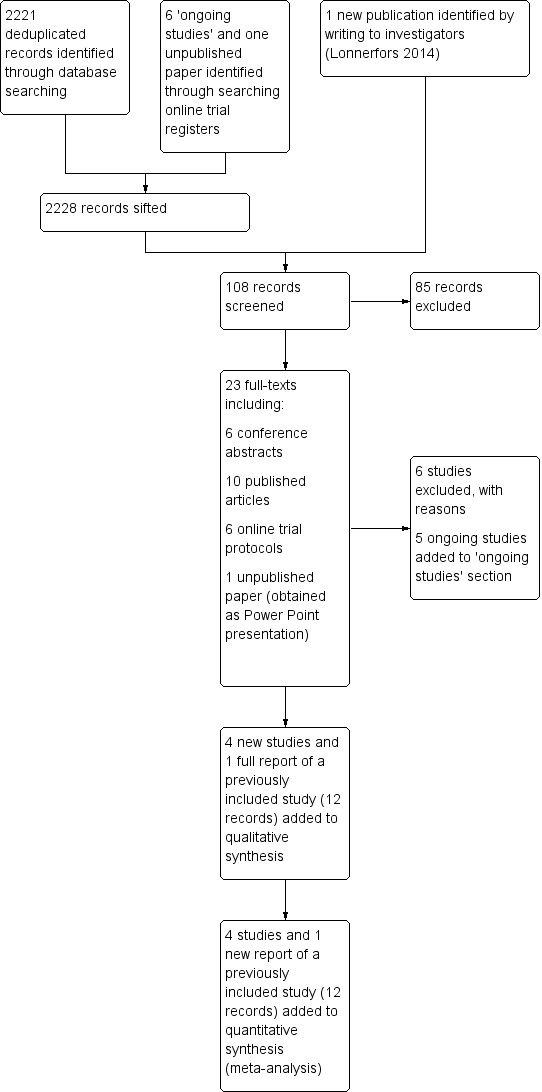
Study flow diagram for updated searches (30 June 2014).
One included study (Green 2013) was a conference abstract of a study initially identified as an 'ongoing study' (see protocol citation linked to Green 2013). We requested unpublished data from these investigators and received limited data in the form of a Microsoft PowerPoint presentation. We were informed by the investigators that they had had difficulty getting the paper published because of 'too many cross‐overs in the stats'; however, we understand that they plan to make further attempts to get the study published. (See Green 2013 in Characteristics of included studies for additional details.)
We identified five ongoing RCTs (Kjolhede 2012; LAROSE 2012; Narducci 2010; Obermair 2008; RASHEC 2013) and contacted these trial investigators for up‐to‐date details about accrual and completion dates. This information is summarised in Table 1.
| Study ID | Malignant (M)/Benign (B) disease | Participants (N) | Number enrolled by June 2014a | Comparison | Procedure | Main outcomes | Primary completion datea |
| Harkins 2013b NCT01581905 | B: menorrhagia, dysfunctional uterine bleeding, fibroids, endometriosis | 400 (closed at 113) | Completed | RAS versus CLS | Hysterectomy | Operating time, EBL, complications, LOS | March 2013 |
| NCT01556204 | B: endometriosis | 74 | ‐ | RAS versus CLS | Surgery for endometriosis | Operating time, pain | December 2013 |
| NCT01247779 | M: cervical, uterine and ovarian cancers | 374 | 320 | RAS versus CLS | Surgical staging procedures | Complications, lymph node yield, surgeons' ergonomy, QoL | June 2015 |
| NCT01526655 | M: endometrial cancer | 50 | 30 | RAS versus open surgery | Hysterectomy, BSO and lavage | QoL, biomarkers, adverse events | December 2015 |
| NCT01847703 | M: endometrial cancer | 100 | 45 | RAS versus open surgery | Hysterectomy, BSO and LA | Lymph node yield, complications | April 2016 |
| NCT00614211 | M: cervical cancer | 740 | 340 | RAS or CLS versus open surgery | Radical hysterectomy | DFS, complications, QoL, OS | July 2018 |
For further details, see Characteristics of ongoing studies.
aUpdated according to contact investigator correspondence when possible.
bSame as Green 2013. This study has been completed but not yet reported in full. Data on 98 women were presented in 2013 and have been included in this review.
Abbreviations: CLS = conventional laparoscopic surgery; DFS = disease‐free survival; EBL = estimated blood loss; LOS = length of stay; OS = overall survival; QoL = quality of life; RAS = robot‐assisted surgery.
Included studies
This update includes six studies (four new and two previously included studies) (Anger 2014; Green 2013; Lonnerfors 2014; Paraiso 2011; Paraiso 2013; Sarlos 2010). All included studies were conducted from 2007 onwards and evaluated RAS in benign gynaecological disease. We identified no RCTs of RAS for malignant gynaecological disease.
Study design
All included studies were RCTs. Most were single‐centre studies; two were conducted at two centres each (Anger 2014; Paraiso 2013). Studies were conducted in the USA (Anger 2014; Green 2013; Paraiso 2011; Paraiso 2013), Switzerland (Sarlos 2010) and Sweden (Lonnerfors 2014).
Participants
Included studies contributed a total of 517 participants as follows: Anger 2014 (66 women); Green 2013 (98 women); Lonnerfors 2014 (122 women); Paraiso 2011 (78 women); Paraiso 2013 (53 women); Sarlos 2010 (100 women). Women participating in studies of RAS for hysterectomy (Green 2013; Lonnerfors 2014; Paraiso 2013; Sarlos 2010) were on average in their mid‐40s, whereas in studies of RAS for sacrocolpopexy (Anger 2014; Paraiso 2011), women were on average about 60 years old. Participant BMIs were not significantly different between study arms for any of these studies, and reported means and medians ranged between 24 and 32 kg/m².
Indications for hysterectomy were stated as benign gynaecological conditions (mainly uterine fibroids or abnormal bleeding) requiring hysterectomy in most studies. Two studies (Green 2013; Sarlos 2010) stated that they excluded women in whom a vaginal hysterectomy was indicated. In the two studies of RAS for sacrocolpopexy, the indication for surgery was symptomatic pelvic organ prolapse. Ninety per cent of women in Paraiso 2011 and 42% of women in Anger 2014 had previously undergone a hysterectomy. No significant baseline differences between study arms were described in any of the studies reporting previous abdominal surgery (Lonnerfors 2014; Paraiso 2013; Sarlos 2010) or caesarean section (Green 2013; Lonnerfors 2014).
Interventions
No included studies compared RAS versus open surgery. All included trials compared RAS versus CLS, except for Lonnerfors 2014, which compared RAS versus other minimally invasive surgery to include CLS or vaginal hysterectomy. Procedures performed were hysterectomy (Green 2013; Lonnerfors 2014; Paraiso 2013; Sarlos 2010) or sacrocolpopexy (Anger 2014; Paraiso 2011). In Anger 2014, 58% of women underwent a concomitant hysterectomy; no statistically significant differences were noted between study arms in the numbers of women undergoing these additional procedures. In Paraiso 2013, concomitant procedures, including culdoplasty, adhesiolysis and excision of endometriosis, were performed with similar frequency between study arms, with four and three women in the RAS and CLS arms, respectively, undergoing more than one concomitant procedure.
In two studies, surgeons had performed a minimum of 10 relevant RAS procedures (Anger 2014; Paraiso 2011), and in three studies, surgeons had performed 20 or more relevant RAS procedures (Lonnerfors 2014; Paraiso 2013; Sarlos 2010). One study (Green 2013) did not describe the experience of the surgeons.
Outcomes
The most common primary outcomes among these studies were cost (Anger 2014; Lonnerfors 2014) and operating time (Green 2013; Paraiso 2011; Paraiso 2013; Sarlos 2010). Most studies included complications and length of hospital stay as secondary outcomes (Green 2013; Lonnerfors 2014; Paraiso 2011; Sarlos 2010). Other stated secondary outcomes included blood loss (Anger 2014; Green 2013; Lonnerfors 2014; Sarlos 2010), QoL (Anger 2014; Paraiso 2011; Paraiso 2013; Sarlos 2010), postoperative pain (Anger 2014; Green 2013; Paraiso 2011; Paraiso 2013), conversion rates (Lonnerfors 2014; Paraiso 2011; Paraiso 2013; Sarlos 2010) and reintervention (Anger 2014; Lonnerfors 2014; Sarlos 2010).
Excluded studies
Thirty non‐randomised studies were excluded from the original reviews. For the updated review, we excluded six additional studies for the following reasons.
-
Quasi‐RCT (Martinez‐Maestro 2014).
-
Not an RCT (Desille‐Gbaguidi 2013; Gocmen 2013).
-
Inappropriate interventions compared (Campos 2013; McNanley 2012; Palmer 2013).
Risk of bias in included studies
Overall, we considered one study to be at high risk of bias (Green 2013) and the other studies to be at low to moderate risk of bias. Risks of bias are summarised in Figure 2 and are detailed below.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
All studies were RCTs, and the method of randomisation was adequately described in all of them. We therefore considered these studies to be at low risk of selection bias, except for two RCTs that did not describe allocation concealment (Green 2013; Sarlos 2010). We considered these two studies to be at unclear risk of bias for this item.
Blinding
Three studies (Anger 2014; Paraiso 2011; Paraiso 2013) described blinding participants and assessors to group allocation; we considered these studies to be at low risk of performance and detection bias. The other three studies (Green 2013; Lonnerfors 2014; Sarlos 2010) were open‐label studies; we considered these to be at high risk of performance bias. Additionally, these studies did not report efforts to blind outcome assessment; we therefore considered them to be at unclear risk of detection bias. However, it was not clear in any of the included studies who had assessed outcomes such as extent of blood loss and length of hospital stay, which normally are determined by the surgeon who performed the procedure and therefore are at potentially high risk of bias.
Incomplete outcome data
Two studies reported no or minimal loss to follow‐up (Anger 2014; Lonnerfors 2014) (low risk of bias). In Paraiso 2011, five women were withdrawn from each study arm after randomisation (unclear risk of bias). In Paraiso 2013, nine women withdrew after randomisation (five in the CLS group and four in the RAS group), one woman allocated for CLS underwent RAS in error (protocol deviation) and one woman in the CLS group was withdrawn as the result of missing data (unclear risk of bias). Quality of life outcomes in Paraiso 2013 and Sarlos 2010 were subject to attrition of greater than 20%, so data for this outcome were considered to be at high risk of bias.
In Green 2013, of 113 women initially randomly assigned, 10 women were withdrawn because procedures were cancelled for medical or personal reasons (eight in the CLS group and two in the RAS group), and five women who had undergone alternative procedures were excluded (three in the CLS group and two in the RAS group). This left 98 participants (48 in the CLS group and 50 in the RAS group), representing attrition of 13% of the sample. In addition, 11 protocol deviations were reported. We considered this study to be at high risk of attrition bias.
Selective reporting
Most included studies reported expected and/or prespecified outcomes. We considered Green 2013 to be at high risk of reporting bias because of high attrition and protocol deviations with subsequent reporting of data per protocol. In Paraiso 2013, most expected outcomes were reported; however, no details of complications were provided despite the fact that three women required blood transfusions (unclear risk). In Lonnerfors 2014, outcomes were reported for RAS versus minimally invasive surgery (CLS and vaginal hysterectomy) together and separately. However, as separate baseline data were not reported, it was not possible to determine whether there were differences in the baseline characteristics of control women undergoing CLS or vaginal hysterectomy (unclear risk).
Other potential sources of bias
Two studies (Paraiso 2011; Sarlos 2010) were early adopters of RAS. Enrolment for these two studies occurred between 2007 and 2011, and, arguably, data from these studies may have been subject to bias caused by the learning curve, although surgeons in the latter study had performed a minimum of 30 RAS procedures before commencing the trial. Nevertheless, to assess this possibility and to avoid potential bias from early studies in the review findings, we performed sensitivity analyses for most outcomes by excluding these early studies.
In the Paraiso 2011 study report, it was unclear whether participants experienced more than one intraoperative and/or postoperative complication, and it was not possible to determine the direction of any bias as a result. This study also included relatively minor complications (e.g. urinary tract infections), unlike the other studies; this might have contributed heterogeneity to the 'complications' analyses, but not bias necessarily. Although we included these data in the analyses, we performed sensitivity analysis by excluding this study.
In Lonnerfors 2014, RAS was compared with CLS or vaginal hysterectomy, and the comparison intervention was based on the surgeon's choice. As participants were not randomly assigned to CLS and vaginal hysterectomy separately, these separate reported data were potentially subject to significant bias (e.g. a higher percentage of women who underwent CLS had a concomitant procedure (75% CLS, 59% RAS and 19% vaginal hysterectomy procedures) that would have influenced procedure time, complication rates, length of hospital stay (LOS) and costs of the separate CLS data. Therefore, we extracted combined data, not separate data, from this study. The direction and magnitude of bias resulting from inclusion of these data in this review are unclear. We performed sensitivity analyses to evaluate the impact of this study on review results.
Authors of all studies reported no potential conflicts of interest. Although most study reports declared the main study sponsor as the institution at which the study was undertaken, it was unclear whether study institutions had received financial support from the system manufacturers, directly or indirectly. Therefore, from a funding perspective, we considered most studies to be at potentially high risk of bias.
As a result of the the small number of included studies, we were unable to meaningfully evaluate publication bias as planned; however, one included study (Green 2013) with significant protocol deviations remains unpublished.
Effects of interventions
See: Summary of findings for the main comparison
Intraoperative and postoperative complications
No statistically significant differences in complication rates were reported between RAS and CLS arms (risk ratio (RR) 0.95, 95% confidence interval (CI) 0.46 to 1.99; participants = 513; studies = 6; I2 = 74%) for hysterectomy or sacrocolpopexy procedures (test for subgroup differences: Chi² = 0.34; df = 1 (P value 0.56); I² = 0%). We downgraded this evidence to 'low' because of inconsistency and imprecision. When we excluded Paraiso 2011 data, overall complication rates were not significantly different for RAS and CLS (RR 0.72, 95% CI 0.37 to 1.43). Early studies tended to favour CLS. whereas later studies favoured RAS (but were at risk of other bias). When we performed various sensitivity analyses, it became clear that the effect estimate was not robust and is likely to change with further research.
Intraoperative complications only
No statistically significant differences in intraoperative complication rates were noted between RAS and CLS arms overall (RR 1.71, 95% CI 0.83 to 3.52; participants = 337; studies = 4; I2 = 0%; Analysis 1.2) or between arms for women undergoing hysterectomy (RR 1.67, 95% CI 0.75 to 3.73; participants = 269; studies = 3; I2 = 0%). Only one study (Paraiso 2011) was conducted in women undergoing sacrocolpopexy (RR 1.89, 95% CI 0.37 to 9.62; participants = 68; studies = 1). Tests for subgroup differences showed no significant differences between hysterectomy and sacrocolpopexy results (Chi² = 0.02; df = 1 (P value 0.90); I² = 0%). Sensitivity analysis using a fixed‐effect (FE) model while excluding studies with limitations yielded similar results. However, most of the events in both arms of these meta‐analyses occurred in two early studies; exclusion of these studies left insufficient data for meta‐analysis. We downgraded this evidence to 'low' as the result of imprecision and study limitations (risk of bias concerns).
Intraoperative injury
For the specific complication 'intraoperative injury,' no significant differences between review arms were noted (RR 1.23, 95% CI 0.44 to 3.46; participants = 415; studies = 5; I2 = 0%; 8/209 events in RAS arm versus 6/206 events in CLS arm; Analysis 1.4). Findings were similar when early studies were excluded; however, reported events were few (moderate‐quality evidence).
Postoperative complications only
With regard to postoperative complications, results of tests for subgroup differences were significant (Chi² = 7.65; df = 1 (P value 0.006); I² = 86.9%); therefore we did not pool subgroup data. For hysterectomy procedures, no statistically significant difference was noted between RAS and CLS arms (RR 0.62, 95% CI 0.30 to 1.29; participants = 315; studies = 3; I2 = 27%; Analysis 1.5). Sensitivity analysis using a fixed‐effect (FE) model yielded a point estimate of 0.62 with a non‐significantly narrower CI. Early studies tended to favour CLS, whereas later studies favoured RAS but had other study limitations. Sensitivity analysis conducted by sequentially excluding studies with risk of bias concerns produced an RR point estimate of 0.63 when only Green 2013 was excluded (95% 0.18 to 2.28; participants = studies = 2; Analysis 1.6), and when both Green 2013 and Lonnerfors 2014 were excluded, only one early study (Sarlos 2010) was left, with an RR of 1.23 (95% CI 0.40 to 3.74). We downgraded this evidence to 'low' as the result of imprecision and study limitations.
For sacrocolpopexy procedures, only one small, early study contributed data (Paraiso 2011). This study found RAS to be associated with a significantly greater number of postoperative complications compared with CLS for this procedure (RR 3.54, 95% CI 1.31 to 9.56; participants = 68); however, it was unclear from the study report whether individual participants might have experienced more than one complication.
Bleeding complications
For the specific outcome 'bleeding complications' (e.g. vaginal haematoma), no statistically significant difference between study arms was noted; however, the point estimated favoured the the RAS arm (RR 0.41, 95% CI 0.10 to 1.66; participants = 367; studies = 4; I2 = 17%; Analysis 1.7). These results were heavily influenced by one study (Lonnerfors 2014), in which 2/61 women in the RAS arm developed vaginal haematoma compared with 11/61 women in the comparison arm. As the latter finding was inconsistent with other data, we performed sensitivity analysis by excluding this study from the analysis. Findings from three studies showed no statistically significant differences, but data were sparse (RR 1.31, 95% CI 0.16 to 10.46; participants = 245; studies = 4; I2 = 0%). The quality of this evidence is low (inconsistency and imprecision).
Infection complications
Overall, no significant differences were noted between RAS and CLS arms with regard to average wound infection rates (RR 1.18, 95% CI 0.42 to 3.36; participants = 435; studies = 5; I2 = 13%; Analysis 1.8). No statistically significant differences remained between the review arms when early studies and those with other limitations were excluded.
Early and late mortality
No deaths were reported in any of the included studies.
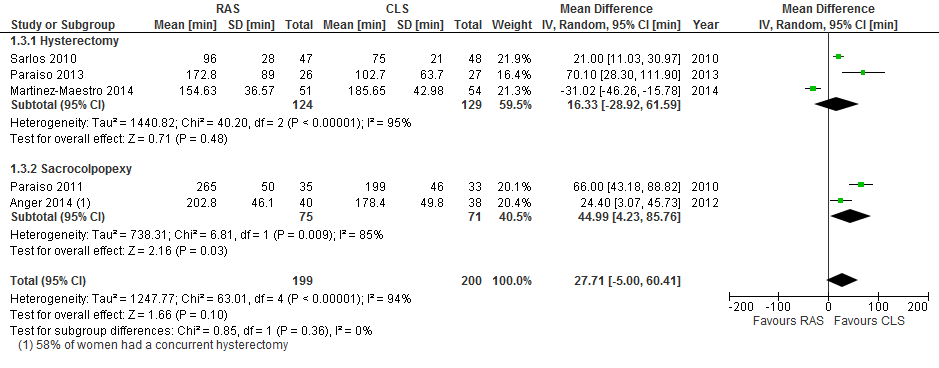
Operating time
Mean total operating time was significantly longer on average in the RAS arm than in the CLS arm overall (mean difference (MD) 41.71 minutes, 95% CI 17.08 to 66.33; P value 0.0009; participants = 294; studies = 4; I2 = 82%; Analysis 1.9). Tests for subgroup differences showed no significant differences in effect between hysterectomy and sacrocolpopexy subgroups (Chi² = 0.01; df = 1 (P value 0.90); I² = 0%), and all studies included in this analysis were at low risk of bias for this outcome. When early studies were excluded from sensitivity analyses, the point estimate was similar, at an average 43 minutes longer operating time in the RAS arm.
Two studies reported this outcome as median (range). Median total operating times reported for the RAS arm versus minimally invasive arms in Lonnerfors 2014 were 76 minutes (43 to 210) versus 86 minutes (29 to 223), respectively (P value 0.54). Likewise, for Green 2013, median total operating times were 90 minutes (74 to 104) and 88 minutes ([75 to 105), respectively (P value 0.69). These individual study data, which shed a favourable light on RAS, were at high risk of bias for the reasons previously mentioned (see Risk of bias in included studies).
Results for mean operating room time were similar to those for mean total operating time (MD 42.51, 95% CI 20.96 to 64.06; participants = 294; studies = 4; I2 = 70%; P value 0.0001; Analysis 1.10).
Length of hospital stay
Mean length of hospital stay in days differed significantly between hysterectomy and sacrocolpopexy procedures (tests for subgroup differences: Chi² = 5.06; df = 1 (P value 0.02); I² = 80.2%; Analysis 1.11); therefore we did not pool these subgroups.
For hysterectomy procedures, RAS resulted in significantly shorter hospital stays on average compared with CLS (MD ‐0.30 days (approximately 7.2 hours), 95% CI ‐0.54 to ‐0.06; participants = 217; studies = 2; I2 = 0%). Data from one study (Lonnerfors 2014) with limitations in the context of this review had a significant impact on this evidence, which we downgraded to low quality.
For sacrocolpopexy procedures, only one small, early study contributed data on mean length of hospital stay (Paraiso 2011; MD 0.37 days, 95% CI ‐0.16 to 0.90; participants = 68; very low‐quality evidence). These data reported as median (range) were 36 hours (19 to 240) in the RAS arm compared with 29 hours (15 to 65) in the CLS arm (non‐significant).
Conversion to another approach
No significant differences between RAS and CLS approaches were observed with regard to rate of conversion (RR 1.28, 95% CI 0.40 to 4.12; participants = 337; studies = 4; I2 = 0%; 6/169 versus 5/168; Analysis 1.12; moderate‐quality evidence). In the RAS arm, three conversions were required as the result of 'robot malfunction,' and one was due to an inability to ventilate the study participant. These incidents occurred in the two earlier studies (Paraiso 2011; Sarlos 2010).
Blood transfusions and blood loss
Three studies reported blood transfusions. No statistically significant difference between RAS and CLS arms was reported (RR 1.23, 95% CI 0.24 to 6.21; participants = 272; I2 = 0%; Analysis 1.13). Similarly, mean estimated blood loss (millilitres) was not statistically significantly different between comparator arms (MD 3.54, 95% CI ‐20.12 to 27.21; participants = 173; studies = 2; I2 = 0%; Analysis 1.14), although only two studies contributed data (tests for subgroup differences: Chi² = 0.59; df = 1 (P value 0.44); I² = 0%).
Pain
Postoperative pain was reported in four studies at different time points within the first two weeks (Anger 2014; Green 2013; Paraiso 2011; Paraiso 2013). However, only two studies provided usable data (means) for meta‐analysis: one in the hysterectomy subgroup (Paraiso 2013) and one in the sacrocolpopexy subgroup (Paraiso 2011).
With regard to the hysterectomy subgroup: Paraiso 2013 reported pain scores during normal activities at two weeks post hysterectomy with no significant differences between study arms (P value 0.79; Analysis 1.15). Green 2013 (a high risk of bias study) reported median postoperative pain scores and found no significant differences between RAS and CLS arms following hysterectomy (P value 0.73).
For the sacrocolpopexy subgroup: Anger 2014 reported mean pain scores at one week postoperatively. Differences in pain scores favoured the CLS arm but were not statistically significant (standardised mean difference (SMD) 0.41, 95% CI ‐0.03 to 0.86; participants = 78; P value 0.07; I2 = 0%; Analysis 1.15). Although it did not contribute data to the meta‐analysis, the other sacrocolpopexy study (Paraiso 2011) reported that the RAS group had significantly greater pain at rest and with activity during weeks 3 to 5 and required longer use of non‐steroidal anti‐inflammatory drugs (NSAIDs) (median 20 days versus 11 days; P value < .005). This low‐quality evidence suggests that, when performed for sacrocolpopexy, RAS may be associated with greater postoperative pain than is noted with CLS.
QoL
Quality of life was reported at four to six weeks in two studies (Anger 2014; Sarlos 2010) and at six months in two studies (Paraiso 2011; Paraiso 2013). Paraiso 2011 also measured QoL at 12 months. However, data were insufficient for meta‐analysis. No significant differences in QoL were found in any of the studies reporting these data, except for Sarlos 2010. The latter study initially found a greater change in QoL at six weeks compared with before the operation in the RAS group, but this self‐reported outcome was subject to significant bias, and results did not remain significant when sensitivity analysis was conducted by the investigators. This evidence was of low quality.
Reintervention/readmission
No significant difference between RAS and CLS was noted with regard to the number of cases requiring reintervention (RR 0.35, 95% CI 0.08 to 1.54; participants = 295; studies = 3; I2 = 0%; Analysis 1.18) or readmission (hysterectomy subgroup only: RR 0.46, 95% CI 0.14 to 1.48; participants = 220; studies = 2; I2 = 0%; Analysis 1.19). These data were sparse, were at risk of bias and were considered to be of low quality.
Cost
Three studies (Anger 2014; Lonnerfors 2014; Paraiso 2011) reported overall costs (including equipment setup and maintenance and theatre and hospital admission costs). We did not pool these data because heterogeneity was substantial (I2 > 90%); however, RAS was consistently associated with increased cost, with MDs ranging from 1936 USD to 8728 USD across the three studies (Analysis 1.20).
Discusión
Resumen de los resultados principales
Los seis estudios incluidos (Anger 2014; Green 2013; Lonnerfors 2014; Paraiso 2011; Paraiso 2013; Sarlos 2010) evaluaron el uso de la CAR comparada con la CLC (u otra cirugía mínimamente invasiva en un estudio) en pacientes que requerían cirugía por enfermedad ginecológica benigna (histerectomía cuatro estudios; sacrocolpopexia dos estudios). Estos estudios incluyeron 517 pacientes. No se observaron diferencias estadísticamente significativas en las tasas de complicaciones con la CAR comparada con la CLC; sin embargo, los hallazgos de los estudios individuales fueron inconsistentes; algunos favorecieron a la CAR y otros a la CLC. Para el resultado combinado "complicaciones intraoperatorias y postoperatorias", el IC del 95% para esta estimación del efecto indica que la CAR se puede asociar con un riesgo tan pequeño como la mitad, o tan grande como el doble, de complicaciones comparada con la CLC. Como resultado de esta inconsistencia y falta de precisión, la calidad de las pruebas se disminuyó a baja calidad (Resumen de los hallazgos para la comparación principal) mediante el enfoque Grading of Recommendations Assessment, Development and Evaluation (GRADE). De manera similar, pruebas de baja calidad no indican diferencias en las tasas de complicaciones específicas, que incluyen lesión intraoperatoria, infección y hemorragia. Los datos sobre la calidad de vida fueron escasos y no fue posible realizar el metanálisis. Sin embargo, pruebas débiles que indican que el dolor postoperatorio posterior a la sacrocolpopexia puede ser peor con la CAR requieren estudios de investigación adicionales.
La media del tiempo quirúrgico total fue como promedio aproximadamente 42 minutos más prolongada en el brazo de CAR que en el brazo de CLC para ambos procedimientos. Estas pruebas fueron sólidas para el análisis de sensibilidad que solamente incluyó cuatro estudios heterogéneos pequeños; por lo tanto, la calidad se disminuyó a moderada. Según datos limitados de dos estudios, la CAR para los procedimientos de histerectomía se asoció con una estancia hospitalaria promedio ocho horas menor que la informada para la CLC (pruebas de calidad baja).
Cuatro estudios no informaron diferencias estadísticamente significativas en la tasa de conversión de la CAR a un enfoque alternativo en comparación con la CLC. Los resultados fueron consistentes entre los estudios incluidos; sin embargo, la calidad de las pruebas se disminuyó a moderada debido a la falta de precisión de la estimación (fue la mitad de probable o hasta cuatro veces más probable que la CAR se convirtiera a otro enfoque). Pruebas de calidad baja no indican diferencias en las tasas de reingreso o reintervención con la CAR en comparación con la CLC.
El análisis económico exhaustivo estuvo más allá del alcance de esta revisión; sin embargo, el costo global calculado para la CAR versus la CLC fue significativamente mayor en cada uno de los tres estudios que informaron este resultado. Este aspecto de la CAR requiere evaluación independiente adicional.
Compleción y aplicabilidad general de las pruebas
Las pruebas relacionadas con la enfermedad ginecológica benigna son incompletas y solamente se aplican a los procedimientos de histerectomía y sacrocolpopexia. Además, no está claro si los hallazgos de la revisión se aplican a las pacientes con obesidad, ya que ninguno de los estudios incluidos evaluó el efecto de esta variable sobre los resultados. Los datos agrupados limitados de seis estudios pequeños no fueron sólidos cuando se realizó el análisis de sensibilidad para una indicación u otra (p.ej. por los datos que se originaron de los primeros que utilizaron la CAR [Paraiso 2011; Sarlos 2010]; experiencia potencialmente limitada de los cirujanos [Anger 2014; Paraiso 2011]; desviaciones del protocolo [Green 2013]; solamente datos por protocolo [Green 2013]; y brazos control con intervenciones mixtas [Lonnerfors 2014]). No se encontraron pruebas sobre la efectividad y la seguridad de la CAR en comparación con la CLC o la cirugía abierta en los cánceres ginecológicos, que incluyen generalmente una cirugía más extensa y más experiencia quirúrgica. Tampoco se encontraron pruebas del efecto de la CAR en comparación con la CLC sobre los resultados rendimiento y volumen de trabajo de los cirujanos. El aumento del dolor postoperatorio con la CAR en los procedimientos de sacrocolpopexia observado en Paraiso 2011 y Anger 2014, que se puede haber debido al puerto extra (la CAR requirió cinco puertos), al mayor tamaño o las diferentes ubicaciones de los trócares, al tiempo quirúrgico más prolongado o a la manipulación robótica en lugar de la manipulación manual de los trócares durante un procedimiento más prolongado, requieren estudios de investigación adicionales.
Calidad de la evidencia
Aún existe mucha incertidumbre con respecto a la estimación de varios efectos importantes de la CAR versus la CLC, y la calidad de los hallazgos de la revisión se califica con mayor frecuencia como baja. Los principales motivos para la disminución de la calidad de las pruebas de estos resultados fueron la inconsistencia y la falta de precisión de los resultados en el escaso número de estudios incluidos que, en general, no se pueden atribuir a diferencias en los tipos de procedimientos realizados. Con solamente seis estudios pequeños incluidos, el efecto promedio de un estudio podría tener un efecto potencial grande sobre el tamaño y la dirección de la estimación general del efecto. Por lo tanto, es de esperar que los estudios de investigación adicionales tengan una marcada repercusión sobre los resultados de la revisión y es probable que cambien la estimación de los efectos para las complicaciones intraoperatorias y postoperatorias, entre otros.
Sesgos potenciales en el proceso de revisión
Se realizó un proceso riguroso para identificar todos los estudios relevantes, por lo que se considera que esta revisión es exhaustiva con respecto a la identificación de todos los estudios elegibles. Después de una exposición minuciosa de los méritos e implicaciones para el riesgo de sesgo, se excluyó un ensayo controlado cuasialeatorio realizado en pacientes que requerían histerectomía (Martinez‐Maestro 2014). Las pacientes de este estudio se asignaron a CAR o CLC "según la posición en la lista de espera del hospital y la disponibilidad del robot el día de la cirugía" y los investigadores informaron que "ni los investigadores ni los cirujanos tenían la posibilidad de interferir con la asignación". Los discretos desequilibrios en la edad (ligeramente más edad en el grupo CLC) y el peso del útero (ligeramente más pequeño en el grupo CAR) podrían deberse al azar. Los análisis de sensibilidad que incluyeron los datos de este estudio indican que los hallazgos no habrían sido significativamente diferentes en cuanto a las complicaciones si se hubieran incluido (Figura 3). Sin embargo, los datos del tiempo quirúrgico total de Martinez‐Maestro 2014 favorecieron significativamente al grupo CAR y habrían reducido la diferencia media general en el metanálisis de esta revisión de este resultado (Figura 4). El tiempo quirúrgico en el brazo de CLC de este estudio fue más prolongado de lo habitual; lo anterior se atribuyó a la falta relativa de experiencia de los cirujanos con respecto a la laparoscopia convencional, que es en sí misma una fuente significativa de sesgo en este estudio.
Las revisiones originales solamente incluyeron dos estudios entre ellas: Sarlos 2010 y Paraiso 2011. Se ha indicado que los estudios realizados por los primeros que utilizaron los robots pueden estar sujetos a sesgo (Lonnerfors 2014); por lo tanto, se realizaron análisis de sensibilidad para explorar si los datos de estos estudios fueron diferentes de los de los estudios posteriores. Los cirujanos de los dos primeros estudios habían realizado como mínimo diez y 30 procedimientos de CAR, respectivamente. Sarlos 2010 informó la necesidad de desacoplar el robot en seis pacientes para cortar el útero en piezas pequeñas para su extracción. Este procedimiento no se describió en los otros estudios incluidos y no está claro cómo otros superaron problemas similares, si es que lo hicieron. En esta revisión los problemas técnicos no se preespecificaron como un resultado; sin embargo, probablemente tendrían una repercusión sobre el tiempo del procedimiento.
Los datos extraídos de las complicaciones intraoperatorias y postoperatorias los definieron los investigadores. Estos datos se utilizaron tal como se informaron, sin censura para las complicaciones menores (p.ej. infecciones urinarias). Lo anterior puede haber influido en parte de la heterogeneidad observada entre los estudios incluidos. Además, se decidió incluir los datos de las complicaciones de Paraiso 2011 cuando se realizaron los análisis de sensibilidad, en lugar de excluirlos. Los primeros estudios tendieron a favorecer a la CLC, mientras que los estudios posteriores tendieron a favorecer a la CAR (pero con frecuencia tuvieron riesgo de segar los hallazgos de la revisión [p.ej. al proporcionar datos por protocolo (Green 2013) o incluir un brazo control de intervención mixta (CLC e histerectomía vaginal) [Lonnerfors 2014]). Este último se incluyó en la comparación CAR versus CLC, incluso aunque el brazo de comparación de este estudio incluyó 25 pacientes (41%) a las que se les realizó histerectomía vaginal. (No fue posible utilizar solamente los datos separados de la intervención de CLC porque estos estudios fueron no aleatorios y, por lo tanto, tuvieron alto riesgo de sesgo de selección). Se realizaron análisis de sensibilidad para determinar la repercusión de incluir este estudio en los hallazgos de la revisión. De manera similar, se realizaron análisis de sensibilidad a la vez que se excluyeron los datos de Green 2013. Se consideró la repercusión de estos sesgos potenciales sobre la interpretación general y la calificación de los hallazgos y se disminuyó la calidad de las pruebas cuando fue apropiado.
Acuerdos y desacuerdos con otros estudios o revisiones
La curva de aprendizaje para la CAR en ginecología se ha abordado en varios estudios y puede variar según el tipo de procedimiento incluido. Los análisis de las curvas de aprendizaje para la enfermedad benigna indican que la competencia (para la cual a menudo el tiempo quirúrgico es un marcador alternativo) se gana al completar aproximadamente 20 procedimientos (Bell 2009), mientras que para la histerectomía radical en pacientes con cáncer cervicouterino el dominio se puede lograr después de realizar 28 procedimientos (Yim 2013).
Varios estudios han indicado que la curva de aprendizaje para la CAR es más corta que para la CLC, por lo que los cirujanos ginecológicos que no tienen experiencia en la CLC deben considerar la CAR (Green 2013). Los hallazgos de un tiempo quirúrgico más corto con la CAR en comparación con la CLC en un ensayo controlado cuasialeatorio con cirujanos relativamente sin experiencia en ambos enfoques (Martinez‐Maestro 2014) podría apoyar esta indicación. Sin embargo, un informe de un contexto de los EE.UU. donde la CAR representó casi el 23% de todas las histerectomías en 2011 señaló que la participación de médicos residentes en la CAR fue menor con el enfoque robótico que con cualquier otra vía (Jeppson 2014). Por lo tanto, la repercusión de esta tecnología sobre el entrenamiento quirúrgico de los médicos jóvenes parece estar muy poco clara.
Una evaluación económica exhaustiva de la CAR en ginecología estuvo más allá del alcance de esta revisión. Sin embargo, una evaluación económica reciente de la CAR para la histerectomía concluyó que sin datos de resultado a más largo plazo o funcionales, el gasto adicional de la CAR puede no estar justificado en un sistema de salud con un presupuesto limitado (Teljeur 2014). Según los hallazgos de la presente revisión, las pruebas actuales relacionadas con la efectividad clínica de la CAR a través de una gama de procedimientos ginecológicos aún son de baja calidad o no se ha probado. Una vez que se pruebe la efectividad, factores indirectos adicionales como el bienestar del cirujano, en particular en cuanto a las físicamente exigentes cirugías laparoscópica y abierta para los cánceres ginecológicos, pueden convertirse en consideraciones de costos importantes. Sin embargo, sin pruebas más sólidas sobre la efectividad y la seguridad clínicas, aún será difícil evaluar la relación entre costo y efectividad de la CAR en ginecología.

Study flow diagram for updated searches (30 June 2014).

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
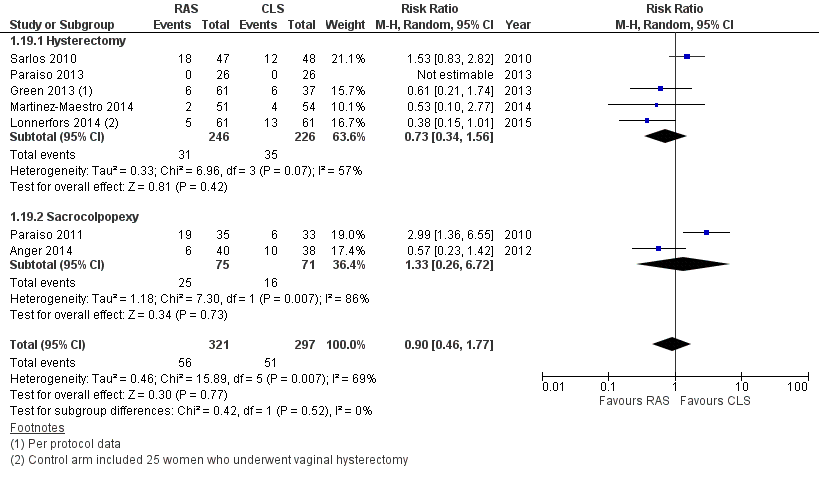
Intraoperative and postoperative complications, with Martinez‐Maestro 2014 included.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 1 Intraoperative and postoperative complications.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 2 Intraoperative complications.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 3 Sensitivity analysis: intraoperative complications.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 4 Complications: intraoperative injury.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 5 Postoperative complications.
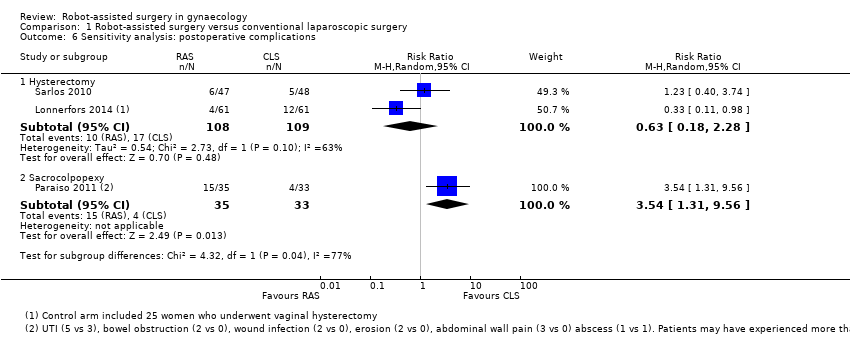
Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 6 Sensitivity analysis: postoperative complications.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 7 Complications: bleeding.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 8 Complications: infection.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 9 Total operating time.
![Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 10 Operating room time [min].](/cdsr/doi/10.1002/14651858.CD011422/media/CDSR/CD011422/rel0001/CD011422/image_n/nCD011422-CMP-001-10.png)
Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 10 Operating room time [min].

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 11 Overall hospital stay.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 12 Conversion to another approach.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 13 Blood transfusions.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 14 Estimated blood loss.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 15 Pain at 1 to 2 weeks.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 16 Quality of life (6 weeks).

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 17 Quality of life (6 months).

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 18 Reintervention.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 19 Readmission.

Comparison 1 Robot‐assisted surgery versus conventional laparoscopic surgery, Outcome 20 Overall cost.
| Robot‐assisted surgery (RAS) compared with conventional laparoscopic surgery (CLS) for gynaecological disease | ||||||
| Patient or population: women with benign gynaecological disease requiring surgery Settings: hospital Intervention: RAS Comparison: CLS | ||||||
| Outcomes | Illustrative comparative risksa (95% CI) | Relative effect | Number of participants | Quality of the evidence | Comments | |
| Assumed risk | Corresponding risk | |||||
| CLS | RAS | |||||
| Intraoperative and postoperative complications | All procedures (subgroups were similar) | RR 0.95 (0.46 to 1.99) | 513 (6) | ⊕⊕⊝⊝ | Downgraded because of inconsistency (I2 = 74%) and imprecision. Early studies favoured CLS, whereas later studies favoured RAS but had other limitations | |
| 19 per 100 | 18 per 100 (9 to 38) | |||||
| Intraoperative complications only | All procedures (subgroups were similar) | RR 1.71 (0.83 to 3.52) | 337 (4) | ⊕⊕⊝⊝ | Downgraded because of imprecision and study limitations (2 early studies contributed 16/17 adverse events in the RAS arm). Sensitivity analyses suggest that effect estimate is likely to change | |
| 6 per 100 | 10 per 100 | |||||
| Postoperative complications only | Hysterectomy | RR 0.62 (0.30 to 1.29) RR 3.54 (1.31 to 9.56) | 315 (3) 68 (1) | ⊕⊕⊝⊝ ⊕⊝⊝⊝ | Downgraded because of imprecision and study limitations. Early studies tend to favour CLS, whereas later studies favour RAS but had other limitations Only 1 small, early study reported data, which included urinary tract infections | |
| 16 per 100 | 10 per 100 | |||||
| Sacrocolpopexy | ||||||
| 12 per 100 | 42 per 100 | |||||
| Intraoperative injury | All procedures (subgroups were similar) | RR 1.23 (0.44 to 3.46) | 415 (5) | ⊕⊕⊕⊝ | Downgraded because of imprecision | |
| 3 per 100 | 4 per 100 (1 to 10) | |||||
| Total operating time (minutes) | Mean total operating time ranged across control groups from | Mean total operating time in the intervention groups ranged from | MD 41.71 (17.08 to 66.33) | 294 (4) | ⊕⊕⊕⊝ | Downgraded because of inconsistency (I2 = 82%). 2 studies that could not be included in the meta‐analysis reported no significant differences in median operating times |
| Overall hospital stay (days) | Hysterectomy | MD ‐0.30 (‐0.54 to ‐0.06) | 217 | ⊕⊕⊝⊝ | Downgraded because of risk of bias concerns and imprecision (effect estimate ranged from 1 to 13 hours shorter hospital stay in RAS group) | |
| Mean hospital stay ranged across control groups from 1.4 to 3.6 days | Mean hospital stay in the intervention groups was | |||||
| Sacrocolpopexy | MD 0.37 (‐0.16 to 0.90) | 68 (1) | ⊕⊕⊝⊝ | Downgraded because of study limitations and sparse data | ||
| Mean hospital stay in the control group was 1.42 days | Mean hospital stay in the intervention group was 1.79 days | |||||
| Conversion to another approach | All procedures (subgroups were similar) | RR 1.29 (0.40 to 4.16) | 338 | ⊕⊕⊕⊝ | Downgraded because of imprecision | |
| 3 per 100 | 4 per 100 | |||||
| aThe basis for the assumed risk for dichotomous data is the mean control group risk across studies. The corresponding risk (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). | ||||||
| GRADE Working Group grades of evidence. | ||||||
| Study ID | Malignant (M)/Benign (B) disease | Participants (N) | Number enrolled by June 2014a | Comparison | Procedure | Main outcomes | Primary completion datea |
| Harkins 2013b NCT01581905 | B: menorrhagia, dysfunctional uterine bleeding, fibroids, endometriosis | 400 (closed at 113) | Completed | RAS versus CLS | Hysterectomy | Operating time, EBL, complications, LOS | March 2013 |
| NCT01556204 | B: endometriosis | 74 | ‐ | RAS versus CLS | Surgery for endometriosis | Operating time, pain | December 2013 |
| NCT01247779 | M: cervical, uterine and ovarian cancers | 374 | 320 | RAS versus CLS | Surgical staging procedures | Complications, lymph node yield, surgeons' ergonomy, QoL | June 2015 |
| NCT01526655 | M: endometrial cancer | 50 | 30 | RAS versus open surgery | Hysterectomy, BSO and lavage | QoL, biomarkers, adverse events | December 2015 |
| NCT01847703 | M: endometrial cancer | 100 | 45 | RAS versus open surgery | Hysterectomy, BSO and LA | Lymph node yield, complications | April 2016 |
| NCT00614211 | M: cervical cancer | 740 | 340 | RAS or CLS versus open surgery | Radical hysterectomy | DFS, complications, QoL, OS | July 2018 |
| For further details, see Characteristics of ongoing studies. aUpdated according to contact investigator correspondence when possible. bSame as Green 2013. This study has been completed but not yet reported in full. Data on 98 women were presented in 2013 and have been included in this review. Abbreviations: CLS = conventional laparoscopic surgery; DFS = disease‐free survival; EBL = estimated blood loss; LOS = length of stay; OS = overall survival; QoL = quality of life; RAS = robot‐assisted surgery. | |||||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Intraoperative and postoperative complications Show forest plot | 6 | 513 | Risk Ratio (M‐H, Random, 95% CI) | 0.95 [0.46, 1.99] |
| 1.1 Hysterectomy | 4 | 367 | Risk Ratio (M‐H, Random, 95% CI) | 0.76 [0.31, 1.88] |
| 1.2 Sacrocolpopexy | 2 | 146 | Risk Ratio (M‐H, Random, 95% CI) | 1.33 [0.26, 6.72] |
| 2 Intraoperative complications Show forest plot | 4 | 337 | Risk Ratio (M‐H, Random, 95% CI) | 1.71 [0.83, 3.52] |
| 2.1 Hysterectomy | 3 | 269 | Risk Ratio (M‐H, Random, 95% CI) | 1.67 [0.75, 3.73] |
| 2.2 Sacrocolpopexy | 1 | 68 | Risk Ratio (M‐H, Random, 95% CI) | 1.89 [0.37, 9.62] |
| 3 Sensitivity analysis: intraoperative complications Show forest plot | 3 | 215 | Risk Ratio (M‐H, Random, 95% CI) | 1.78 [0.84, 3.75] |
| 3.1 Hysterectomy | 2 | 147 | Risk Ratio (M‐H, Random, 95% CI) | 1.75 [0.76, 4.06] |
| 3.2 Sacrocolpopexy | 1 | 68 | Risk Ratio (M‐H, Random, 95% CI) | 1.89 [0.37, 9.62] |
| 4 Complications: intraoperative injury Show forest plot | 5 | 415 | Risk Ratio (M‐H, Random, 95% CI) | 1.23 [0.44, 3.46] |
| 4.1 Hysterectomy | 3 | 269 | Risk Ratio (M‐H, Random, 95% CI) | 1.62 [0.20, 12.91] |
| 4.2 Sacrocolpopexy | 2 | 146 | Risk Ratio (M‐H, Random, 95% CI) | 1.13 [0.34, 3.70] |
| 5 Postoperative complications Show forest plot | 4 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 5.1 Hysterectomy | 3 | 315 | Risk Ratio (M‐H, Random, 95% CI) | 0.62 [0.30, 1.29] |
| 5.2 Sacrocolpopexy | 1 | 68 | Risk Ratio (M‐H, Random, 95% CI) | 3.54 [1.31, 9.56] |
| 6 Sensitivity analysis: postoperative complications Show forest plot | 3 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 6.1 Hysterectomy | 2 | 217 | Risk Ratio (M‐H, Random, 95% CI) | 0.63 [0.18, 2.28] |
| 6.2 Sacrocolpopexy | 1 | 68 | Risk Ratio (M‐H, Random, 95% CI) | 3.54 [1.31, 9.56] |
| 7 Complications: bleeding Show forest plot | 4 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 7.1 Hysterectomy | 4 | 367 | Risk Ratio (M‐H, Random, 95% CI) | 0.41 [0.10, 1.66] |
| 8 Complications: infection Show forest plot | 5 | 435 | Risk Ratio (M‐H, Random, 95% CI) | 1.18 [0.42, 3.36] |
| 8.1 Hysterectomy | 4 | 367 | Risk Ratio (M‐H, Random, 95% CI) | 0.62 [0.13, 2.88] |
| 8.2 Sacrocolpopexy | 1 | 68 | Risk Ratio (M‐H, Random, 95% CI) | 1.89 [0.63, 5.68] |
| 9 Total operating time Show forest plot | 4 | 294 | Mean Difference (IV, Random, 95% CI) | 41.71 [17.08, 66.33] |
| 9.1 Hysterectomy | 2 | 148 | Mean Difference (IV, Random, 95% CI) | 41.18 [‐6.17, 88.53] |
| 9.2 Sacrocolpopexy | 2 | 146 | Mean Difference (IV, Random, 95% CI) | 44.99 [4.23, 85.76] |
| 10 Operating room time [min] Show forest plot | 4 | 294 | Mean Difference (IV, Random, 95% CI) | 42.51 [20.96, 64.06] |
| 10.1 Hysterectomy | 2 | 148 | Mean Difference (IV, Random, 95% CI) | 44.35 [5.22, 83.47] |
| 10.2 Sacrocolpopexy | 2 | 146 | Mean Difference (IV, Random, 95% CI) | 43.24 [0.12, 86.35] |
| 11 Overall hospital stay Show forest plot | 3 | Mean Difference (IV, Random, 95% CI) | Subtotals only | |
| 11.1 Hysterectomy | 2 | 217 | Mean Difference (IV, Random, 95% CI) | ‐0.30 [‐0.54, ‐0.06] |
| 11.2 Sacrocolpopexy | 1 | 68 | Mean Difference (IV, Random, 95% CI) | 0.37 [‐0.16, 0.90] |
| 12 Conversion to another approach Show forest plot | 4 | 337 | Risk Ratio (M‐H, Random, 95% CI) | 1.28 [0.40, 4.12] |
| 12.1 Hysterectomy | 3 | 269 | Risk Ratio (M‐H, Random, 95% CI) | 1.17 [0.24, 5.77] |
| 12.2 Sacrocolpopexy | 1 | 68 | Risk Ratio (M‐H, Random, 95% CI) | 1.41 [0.25, 7.94] |
| 13 Blood transfusions Show forest plot | 3 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 13.1 Hysterectomy | 3 | 272 | Risk Ratio (M‐H, Random, 95% CI) | 1.23 [0.24, 6.21] |
| 14 Estimated blood loss Show forest plot | 2 | 173 | Mean Difference (IV, Random, 95% CI) | 3.54 [‐20.12, 27.21] |
| 14.1 Hysterectomy | 1 | 95 | Mean Difference (IV, Random, 95% CI) | 7.0 [‐18.26, 32.26] |
| 14.2 Sacrocolpopexy | 1 | 78 | Mean Difference (IV, Random, 95% CI) | ‐21.30 [‐89.02, 46.42] |
| 15 Pain at 1 to 2 weeks Show forest plot | 2 | 114 | Std. Mean Difference (IV, Random, 95% CI) | 0.22 [‐0.26, 0.70] |
| 15.1 Hysterectomy | 1 | 36 | Std. Mean Difference (IV, Random, 95% CI) | ‐0.09 [‐0.74, 0.56] |
| 15.2 Sacrocolpopexy | 1 | 78 | Std. Mean Difference (IV, Random, 95% CI) | 0.41 [‐0.03, 0.86] |
| 16 Quality of life (6 weeks) Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 16.1 Sacrocolpopexy | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 17 Quality of life (6 months) Show forest plot | 1 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 17.1 Hysterectomy | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 18 Reintervention Show forest plot | 3 | 295 | Risk Ratio (M‐H, Random, 95% CI) | 0.35 [0.08, 1.54] |
| 18.1 Hysterectomy | 1 | 122 | Risk Ratio (M‐H, Random, 95% CI) | 0.25 [0.03, 2.17] |
| 18.2 Sacrocolpopexy | 2 | 173 | Risk Ratio (M‐H, Random, 95% CI) | 0.47 [0.06, 3.59] |
| 19 Readmission Show forest plot | 2 | Risk Ratio (M‐H, Random, 95% CI) | Subtotals only | |
| 19.1 Hysterectomy | 2 | 220 | Risk Ratio (M‐H, Random, 95% CI) | 0.46 [0.14, 1.48] |
| 20 Overall cost Show forest plot | 3 | Mean Difference (IV, Random, 95% CI) | Totals not selected | |
| 20.1 Hysterectomy | 1 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |
| 20.2 Sacrocolpopexy | 2 | Mean Difference (IV, Random, 95% CI) | 0.0 [0.0, 0.0] | |