Anticoagulantes orales directos versus warfarina para la prevención del accidente cerebrovascular y los eventos embólicos sistémicos en los pacientes con fibrilación auricular y nefropatía crónica
Resumen
Antecedentes
La nefropatía crónica (NC) es un factor de riesgo independiente de fibrilación auricular (FA), que es más prevalente entre los pacientes con NC que en la población general. La FA provoca accidente cerebrovascular o embolia sistémica, lo que da lugar a un aumento de la mortalidad. El agente antitrombótico profiláctivo convencional warfarina se prescribe con frecuencia para la prevención del accidente cerebrovascular, pero el riesgo de hemorragia requiere una monitorización terapéutica regular. Se espera que los anticoagulantes orales directos (ACOD) recientemente desarrollados sean útiles como opciones a la warfarina.
Objetivos
Evaluar la eficacia y la seguridad de los ACOD que incluyen el apixaban, el dabigatran, el edoxaban y el rivaroxaban versus la warfarina en los pacientes con FA y NC.
Métodos de búsqueda
Se realizaron búsquedas en el registro especializado del Grupo Cochrane de Riñón y Trasplante (Cochrane Kidney and Transplant Specialised Register) (hasta el 1 agosto 2017), mediante contacto con el especialista en información, utilizando términos de búsqueda relevantes para esta revisión. Los estudios en el registro especializado se identifican mediante búsquedas en CENTRAL, MEDLINE y EMBASE, en actas de congresos, en el International Clinical Trials Register (ICTRP) Search Portal, y en ClinicalTrials.gov.
Criterios de selección
Se incluyeron todos los ensayos controlados aleatorios (ECA) que compararon directamente la eficacia y la seguridad de los anticoagulantes orales directos (inhibidores directos de la trombina o inhibidores del factor Xa) con la warfarina a dosis ajustada para prevenir el accidente cerebrovascular y los eventos embólicos sistémicos en pacientes con FA no valvular y NC, definida como clearance de creatinina (ClCr) o TFGc entre 15 y 60 ml/min (NC estadio G3 y G4).
Obtención y análisis de los datos
Dos autores de la revisión, de forma independiente, seleccionaron los estudios, evaluaron la calidad y extrajeron los datos. Se calcularon el cociente de riesgos (CR) y los intervalos de confianza del 95% (IC del 95%) para la asociación entre el tratamiento anticoagulante y todos los accidentes cerebrovasculares y eventos embólicos sistémicos como el resultado primario de eficacia, y los eventos hemorrágicos graves como el resultado primario de seguridad. La confiabilidad de la evidencia se evaluó mediante GRADE.
Resultados principales
Esta revisión incluyó 12 545 participantes con FA y NC de cinco estudios. Todos los participantes se asignaron al azar a ACOD (apixaban, dabigatran, edoxaban y rivaroxaban) o a warfarina a dosis ajustada. Cuatro estudios utilizaron un sistema de respuesta central, interactivo y automatizado para la ocultación de la asignación, mientras que el otro no especificó los métodos de ocultación. Cuatro estudios fueron cegados, mientras el otro fue parcialmente abierto. Sin embargo, debido a que todos los estudios incluyeron la evaluación cegada de los eventos de resultado, se consideró que el riesgo de sesgo fue bajo. No fue posible crear gráficos en embudo debido al escaso número de estudios, lo que impidió la evaluación del sesgo de publicación. La duración de los estudios varió entre 1,8 y 2,8 años. La gran mayoría de los participantes incluidos en este estudio presentaba NC estadio G3 (12 155), y un número pequeño presentaba estadio G4 (390). De 12 545 participantes de cinco estudios, ocurrieron por año un total de 321 casos (2,56%) del resultado primario de eficacia. Además, de 12 521 participantes de cinco estudios, ocurrieron por año un total de 617 casos (4,93%) del resultado primario de seguridad. Al parecer es probable que los ACOD reduzcan la incidencia de accidente cerebrovascular y eventos de embolia sistémica (5 estudios, 12 545 participantes: CR 0,81; IC del 95%: 0,65 a 1,00; evidencia de confiabilidad moderada) y reduzcan ligeramente la incidencia de eventos hemorrágicos graves (5 estudios, 12 521 participantes: CR 0,79; IC del 95%: 0,59 a 1,04; evidencia de baja confiabilidad) en comparación con la warfarina.
Conclusiones de los autores
Los resultados de esta revisión indican que es probable que los ACOD y la warfarina prevengan todos los accidentes cerebrovasculares y los eventos embólicos sistémicos sin aumentar el riesgo de eventos hemorrágicos graves entre los pacientes con FA e insuficiencia renal. Estos resultados deben estimular a los médicos a prescribir los ACOD en los pacientes con FA y NC sin temor a hemorragia. La limitación principal es que los resultados de este estudio reflejan sobre todo la NC estadio G3. La aplicación de los resultados a los pacientes con NC estadio G4 requiere estudios de investigación adicionales. Además, no fue posible evaluar a pacientes con NC estadio G5. Las revisiones futuras deben evaluar a pacientes con NC en estadios más avanzados. Además, no fue posible realizar análisis de subgrupos ni análisis de sensibilidad detallados debido a la falta de datos.
PICOs
Resumen en términos sencillos
Anticoagulantes orales directos para la prevención del accidente cerebrovascular en pacientes con fibrilación auricular y nefropatía crónica
¿Cuál es el problema?
Los pacientes con enfermedad renal crónica (NC) tienen un mayor riesgo de fibrilación auricular (FA), que a menudo puede provocar accidente cerebrovascular o embolia sistémica. El tratamiento convencional para prevenir la FA es la warfarina a dosis ajustada, pero puede aumentar el riesgo de hemorragia, por lo que se requiere monitorización terapéutica regular. Recientemente se han desarrollado los anticoagulantes orales directos (ACOD) como opciones a la warfarina. Se revisó la evidencia sobre los ACOD comparados con la warfarina para prevenir el accidente cerebrovascular y los eventos embólicos sistémicos en pacientes con FA y NC.
¿Qué se hizo?
Se encontraron cinco estudios que compararon los efectos de los ACOD (apixaban, dabigatran, edoxaban y rivaroxaban) y la warfarina a dosis ajustada. Los 12 545 participantes de estos cinco estudios tenían FA no valvular e insuficiencia renal moderada. Estos estudios presentaron datos sobre todos los resultados compuestos de accidente cerebrovascular y eventos embólicos sistemáticos como el resultado primario de eficacia, y de los eventos hemorrágicos graves como el resultado primario de seguridad. La mediana del período de seguimiento varió de 1,8 a 2,8 años. La evidencia se corresponde con lo encontrado hasta agosto de 2017.
¿Qué se encontró?
Es probable que los ACOD reduzcan la incidencia de accidente cerebrovascular y eventos embólicos sistémicos como el resultado primario de eficacia, en comparación con la warfarina. Además, los ACOD podrían reducir ligeramente la incidencia de eventos hemorrágicos graves como el resultado primario de seguridad, en comparación con la warfarina.
Conclusiones
Esta revisión demostró que es probable que los ACOD y la warfarina prevengan todos los accidentes cerebrovasculares y los eventos embólicos sistémicos sin aumentar los eventos hemorrágicos graves entre los pacientes con FA y NC. Según GRADE, la calidad de la evidencia fue moderada para el resultado primario de eficacia debido a inquietudes con respecto a la imprecisión y baja para el resultado primario de seguridad debido a inquietudes con respecto a la inconsistencia y la imprecisión. Los resultados de este estudio se aplican principalmente a los pacientes con NC estadio G3, ya que no fue posible evaluar pacientes con NC estadio G4 ni G5.
Conclusiones de los autores
Summary of findings
| DOAC versus warfarin for preventing stroke and systemic embolic events among atrial fibrillation patients with CKD | |||||
| Patient or population: atrial fibrillation patients with CKD Setting: Hospital‐based setting Intervention: DOAC Comparison: Dose‐adjusted warfarin | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No. of participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Warfarin | DOAC | ||||
| All strokes and systemic embolic events Follow up: 1.8 years to 2.8 years | 29 per 1,000 | 23 per 1,000 | RR 0.81 (0.65 to 1.00) | 12,545 (5) | ⊕⊕⊕⊝¹ |
| Major bleeding Follow up: 1.8 years to 2.8 years | 55 per 1,000 | 43 per 1,000 | RR 0.79 (0.59 to 1.04) | 12,521 (5) | ⊕⊕⊝⊝¹ ² |
| Myocardial infarction Follow up: 2.8 years | 11 per 1,000 | 10 per 1,000 (5 to 21) | RR 0.92 (0.45 to 1.90) | 2,740 (1) | ‐ |
| Minor bleeding Follow up: 2.5 years to 2.8 years | 74 per 1,000 | 72 per 1,000 (43 to 119) | RR 0.97 (0.58 to 1.61) | 3,012 (2) | ⊕⊕⊝⊝¹ ² |
| Gastrointestinal bleeding Follow up: 1.9 years to 2.8 years | 17 per 1,000 | 24 per 1,000 (17 to 35) | RR 1.40 (0.97 to 2.01) | 5,678 (2) | ⊕⊕⊕⊝¹ |
| Intracranial haemorrhage Follow up: 1.8 years to 2.8 years | 14 per 1,000 | 6 per 1,000 | RR 0.43 (0.27 to 0.69) | 12,521 (5) | ⊕⊕⊕⊝¹ |
| All‐cause mortality Follow up: 1.8 years to 2.8 years | 78 per 1,000 | 71 per 1,000 | RR 0.91 (0.78 to 1.05) | 9,595 (4) | ⊕⊕⊕⊝¹ |
| *The risk in the intervention group (and its 95% CI) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). AF: atrial fibrillation; CI: confidence interval; DOAC: direct oral anticoagulants; RR: risk ratio | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Some concerns with imprecision because of the uncertain effect estimate 2 Some concerns with inconsistency because of medium heterogeneity | |||||
Antecedentes
Descripción de la afección
La fibrilación auricular (FA) es la forma más frecuente de arritmia mantenida y provoca una frecuencia cardíaca irregular y rápida. Los síntomas habituales son palpitación y dolor torácico; algunos pacientes también se desmayan.
La nefropatía crónica (NC) es un factor de riesgo independiente de FA (Go 2009). Se ha informado que la prevalencia de FA entre los pacientes con NC es mucho mayor del 1% al 2% de prevalencia en la población general (Alonso 2011; Go 2001; Nelson 2012; Stewart 2001). Un estudio reciente demostró una prevalencia de FA del 16% en los pacientes con una tasa de filtración glomerular calculada (TFGc) de 45 ml/min o más y una prevalencia del 20,4% en los que presentan una TFGc < 45 ml/min (Soliman 2010). La NC se define como la presencia de una anomalía en la función o la estructura renal por más de tres meses, con implicaciones en la salud. La NC se clasifica en estadio 1 (TFGc ≥ 90 ml/min); estadio 2 (60 a 89 ml/min); estadio 3a (45 a 59 ml/min); estadio 3b (30 a 44 ml/min); estadio 4 (15 a 29 ml/min); y estadio 5 (< 15 ml/min) (KDIGO 2012).
La NC y la FA tienen varios factores de riesgo en común como el envejecimiento, la hipertensión, la diabetes mellitus y otras cardiopatías preexistentes. Una vez que las personas presentan NC, múltiples factores adicionales se asocian con la FA, como la activación del sistema renina‐angiotensina‐aldosterona, la inflamación crónica, la calcificación vascular y la hipertrofia ventricular izquierda (Ng 2013). La FA se asocia con accidente cerebrovascular o embolia sistémica, los que dan lugar a un aumento en la morbilidad o la mortalidad. El accidente cerebrovascular debido a FA se atribuye a un estado contráctil deficiente de la aurícula izquierda y a estasis sanguínea en la aurícula, lo que provoca la formación de trombos (Watson 2009). Se ha indicado que la reducción en la TFGc y la proteinuria se asocian de forma independiente con la incidencia de tromboembolia en los pacientes con FA después del ajuste para otros factores de riesgo del accidente cerebrovascular (Go 2009).
Descripción de la intervención
Se ha informado que el tratamiento anticoagulante reduce el riesgo de eventos tromboembólicos en los pacientes con FA y función renal normal. El agente antitrombótico profiláctico convencional es un antagonista de la vitamina K como la warfarina. Se ha informado que la eficacia de la warfarina a dosis ajustada para la prevención del accidente cerebrovascular relacionado con la FA es mejor (reducción del riesgo del 60%) que la de la aspirina (reducción del riesgo del 20%)(Hart 2007). Sin embargo, la warfarina tiene algunas limitaciones: tiene interacciones alimentarias múltiples, especialmente con la vitamina K y con fármacos concomitantes; y demora dos a tres días para hacer efecto. Debido a que la warfarina tiene una ventana terapéutica estrecha, y el control inadecuado provoca hemorragia, las guías indican que los niveles de warfarina se deben controlar dentro del rango de la razón internacional normalizada (RIN) de 2,0 a 3,0(EHRA‐EACTS 2010). En los pacientes con NC pueden surgir complicaciones adicionales relacionadas con la warfarina porque aumenta el riesgo de hemorragia(Olsen 2012). La administración de warfarina a los pacientes con nefropatía terminal es particularmente desafiante debido al riesgo de hemorragia grave; sin embargo, los pacientes con NC en estadios más tempranos y FA se pueden beneficiar de la warfarina.
Recientemente se han desarrollado los anticoagulantes orales directos (ACOD) como opciones a los agonistas de la vitamina K. Se ha informado que los ACOD como los inhibidores directos de la trombina y los inhibidores del factor Xa, se asocian con riesgos menores de accidente cerebrovascular y hemorragia que los agonistas de la vitamina K en los pacientes con función renal normal (Bruins Slot 2013; Miller 2012; Mitchell 2013). Los ACOD tienen una acción rápida y no necesitan monitorización regular porque no interactúan con alimentos u otros fármacos (Eriksson 2011). Actualmente, los organismos reguladores principales(EMA 2014; FDA 2014; Health Canada 2017) han aprobado a los ACOD para los pacientes con FA y NC estadio G3 o G4 (clearance de creatinina [ClCr] o TFGc entre 15 y 60 ml/min) (Tabla 1), pero la evidencia que apoya su administración es limitada (Reinecke 2013).
De qué manera podría funcionar la intervención
La warfarina interrumpe de forma indirecta la cascada extrínseca de coagulación al inhibir la síntesis de los factores de la coagulación II, VII, IX y X dependientes de la vitamina K. Por el contrario, los inhibidores del factor Xa que incluyen el apixaban, el edoxaban y el rivaroxaban interrumpen directamente la actividad del factor de la coagulación Xa, que convierte la protrombina a trombina. Además, los inhibidores directos de la trombina como el dabigatran también actúan mediante la inhibición directa de la trombina.
Bruins Slot 2013 mostró que los ACOD disminuyen de forma significativa el número de accidentes cerebrovasculares y otros eventos embólicos sistémicos en comparación con la warfarina a dosis ajustada en los pacientes con FA independientemente de la función renal (odds ratio [OR] 0,81; intervalo de confianza [IC] del 95%: 0,72 a 0,91) y reducen la hemorragia grave (OR 0,89; IC del 95%: 0,81 a 0,98).
Por qué es importante realizar esta revisión
El número de pacientes con NC y FA aumenta anualmente. El riesgo de accidente cerebrovascular o tromboembolia sistémica debido a FA en los pacientes con NC es significativamente mayor que en los pacientes con función renal normal (cociente de riesgos instantáneos [CRI] 1,49; IC del 95%: 1,38 a 1,59). La mortalidad por todas las causas también es significativamente mayor entre los pacientes con NC (CRI 2,37; IC del 95%: 2,30 a 2,44) (Olsen 2012) que en la población general.
Aunque con frecuencia a los pacientes con NC y FA se les prescriben anticoagulantes para reducir el riesgo de accidente cerebrovascular o eventos tromboembólicos sistémicos, estos agentes tienden a utilizarse con menos frecuencia en esta población que en los pacientes que no presentan NC(Olsen 2012). Este resultado se atribuye al hecho de que faltan resultados de estudios clínicos grandes del tratamiento anticoagulante para la FA entre los pacientes con NC moderada a grave, y los médicos son cautelosos por el riesgo de hemorragia.
Los ACOD pueden ser más efectivos y más seguros para los pacientes con NC que la warfarina; son prometedores para reducir la prevalencia de accidente cerebrovascular y eventos embólicos sistémicos y pueden reducir el riesgo de hemorragia.
Objetivos
Evaluar la eficacia y la seguridad de los ACOD que incluyen el apixaban, el dabigatran, el edoxaban y el rivaroxaban versus la warfarina en los pacientes con FA y NC.
Métodos
Criterios de inclusión de estudios para esta revisión
Tipos de estudios
Se obtuvieron todos los ensayos controlados aleatorios (ECA) y cuasialeatorios (ECA en que los que la asignación al tratamiento se obtuvo por alternancia, uso de historias clínicas alternas, fecha de nacimiento u otros métodos predecibles) de ACOD con warfarina. Los ECA grupales también se incluyeron si se informó el coeficiente de correlación intragrupos. Los estudios cruzados no se incluyeron para evitar los efectos de arrastre.
Tipos de participantes
Los participantes elegibles se diagnosticaron con FA no valvular e insuficiencia renal moderada, definida como ClCr o TFGc entre 15 y 60 ml/min (NC estadio G3 y G4). La FA no valvular se diagnosticó mediante electrocardiografía. Los pacientes se excluyeron si presentaban FA valvular, accidente cerebrovascular reciente y afecciones asociadas con un aumento en el riesgo de hemorragia.
Tipos de intervenciones
Se incluyeron los estudios que investigaron los ACOD. Estos incluyen apixaban, dabigatran, edoxaban y rivaroxaban, así como cualquier otra intervención clasificada como ACOD. Se incluyó cualquier dosis o régimen comparado con warfarina. La warfarina se utilizó a dosis ajustada mediante la RIN.
Tipos de medida de resultado
Resultados primarios
-
Resultado compuesto de todos los accidentes cerebrovasculares y eventos embólicos sistémicos
-
Todos los accidentes cerebrovasculares: déficit neurológico focal súbito causado por trombosis cerebrovascular, y categorizado como isquémico, hemorrágico o inespecífico
-
eventos embólicos sistémicos: oclusión vascular aguda de una extremidad u órgano
-
-
Hemorragia grave: reducción en la hemoglobina de al menos 20 g/l y transfusión de al menos dos unidades de sangre, o hemorragia sintomática en un área u órgano críticos.
En el protocolo de la revisión se planificó diferenciar el efecto de los ACOD sobre dos resultados primarios de eficacia: todos los accidentes cerebrovasculares y eventos embólicos sistémicos. Sin embargo, todos los estudios incluidos informaron resultados compuestos para todos los accidentes cerebrovasculares, que incluyeron el accidente cerebrovascular isquémico y hemorrágico y los eventos embólicos sistémicos; por lo tanto, se evaluaron como un resultado compuesto.
Resultados secundarios
-
Infarto de miocardio (IM): diagnóstico basado en cambios electrocardiográficos, elevación de las enzimas o confirmado durante el examen post mortem
-
Hemorragia leve: hemorragia no grave clínicamente relevante
-
Hemorragia gastrointestinal (GI)
-
Hemorragia intracraneal: todas las hemorragias intracerebrales, subdurales, epidurales y subaracnoideas
-
Mortalidad por todas las causas: muerte por cualquier causa (vascular y no vascular)
-
Muerte por causa vascular: muerte debido a accidente cerebrovascular (isquémico y hemorrágico), cardiopatía, hemorragia y muertes súbitas de causas desconocidas.
Results
Description of studies
For detailed descriptions of the studies covered in this review, please see the following tables: Characteristics of included studies; Characteristics of excluded studies; Characteristics of ongoing studies.
Results of the search
After searching the Specialised Register, contacting pharmaceutical companies, and an additional web search, we identified 177 records. After full‐text review, five studies (172 records) were included (ARISTOTLE Study 2010; ENGAGE AF‐TIMI 48 Study 2013; J‐ROCKET AF Study 2012; RE‐LY Study 2009; ROCKET AF Study 2010) and four studies (four records) were excluded (Caluwé 2016; Eriksson 2003a; Koretsune 2015; Murray 2004). One ongoing study was identified (X‐NOAC Study 2015) and will be included in a future update of this review (Figure 1).

Study flow diagram.
Included studies
We identified a total of 172 records representing five large studies (ARISTOTLE Study 2010; ENGAGE AF‐TIMI 48 Study 2013; J‐ROCKET AF Study 2012; RE‐LY Study 2009; ROCKET AF Study 2010). We sent enquiry requests to the relevant pharmaceutical companies about how they dealt with missing data (the ITT analysis or modified ITT analysis). All companies responded but only one provided additional unpublished information (ARISTOTLE Study 2010).
These five studies enrolled 12,545 G3 and G4 participants. The participants had non‐valvular AF and moderate kidney impairment. All five studies used the Cockcroft‐Gault equation to define CrCl as a marker of kidney function. ARISTOTLE Study 2010 defined moderate kidney impairment as CrCl of 25 to 50 mL/min, while the other studies defined it as CrCl of 30 to 50 mL/min. Although participants with severe kidney impairment were exclusionary in ENGAGE AF‐TIMI 48 Study 2013, a few participants with CrCl < 30 mL/min were randomised and analysed as having moderate kidney impairment.
-
ARISTOTLE Study 2010 included 2747 participants (91.1%) with CKD stage G3 and 270 participants (8.9%) with CKD stage G4
-
ENGAGE AF‐TIMI 48 Study 2013 included 2620 participants (95.6%) with CKD stage G3 and 120 participants (4.4%) with CKD stage G4
-
J‐ROCKET AF Study 2012 included 284 participants with CKD stage G3
-
RE‐LY Study 2009 included 3554 participants with CKD stage G3
-
ROCKET AF Study 2010 included 2950 participants with CKD stage G3.
Therefore, the large majority of participants included in this review were CKD stage G3 rather than stage G4 (CKD stage G3: 12,155 participants; stage G4: 390 participants).
Of 172 records, ARISTOTLE Study 2010 had 43 records, ENGAGE AF‐TIMI 48 Study 2013 had 27 records, J‐ROCKET AF Study 2012 had 15 records, RE‐LY Study 2009 had 25 records, and ROCKET AF Study 2010 had 62 records. They included original studies and various sub studies such as different research questions, different population focused on specific conditions (e.g. elderly patients, patients with high CHADS2 score), and conference proceedings.
We used a subset of data from these five studies, which enrolled primarily AF patients with normal kidney function. The number of patients with CKD in each study was:
-
ARISTOTLE Study 2010: 3,017/18,122 (17%)
-
ENGAGE AF‐TIMI 48 Study 2013: 2,740/14,071 (19.5%)
-
J‐ROCKET AF Study 2012: 284/1,278 (22.2%)
-
RE‐LY Study 2009: 3,554/17,951 (19.8%)
-
ROCKET AF Study 2010: 2,950/14,264 (20.7%).
The extracted participants from each study were of an acceptable sample size. We determined that the patients with CKD represented a predefined subgroup in each of the original studies, because the balance of the allocated groups had been maintained.
All five studies were RCTs. We summarized the baseline characteristics of four studies that estimated kidney function by the Cockcroft‐Gault equation (ARISTOTLE Study 2010; ENGAGE AF‐TIMI 48 Study 2013; J‐ROCKET AF Study 2012; ROCKET AF Study 2010). RE‐LY Study 2009 estimated kidney function by CKD‐EPI and while the characteristics of these patients were not likely to differ from the other four studies, the results of this study were excluded from the summary of the baseline characteristics.
Mean and median age of participants ranged between 78 and 79 years, and 53.5 % were female. Previous stroke history was 35.6%, mean CHADS2 score ranged between 2.6 and 3.7, prior vitamin K use was 56.1%, and prevalence of aspirin use was 33.6%.
Patients excluded from the included studies had: reversible AF or AF due to heart valve disorder; experienced a stroke in the past seven days; a condition associated with an increased risk of bleeding; were contraindicated for warfarin treatment; severe anaemia; received an investigational drug or medical device within 30 days before the planned clinical trial; active liver disease; severe comorbidity and whose life expectancy fell within the planned study period; were pregnant; and were unfit or unwilling to comply with the study‐related procedures, such as subjects with alcohol dependence or those who refused to supply written informed consent. All studies allowed participants to use concomitant anti‐platelet agents containing less than 100 mg of acetylsalicylic acid and thienopyridine, but this was restricted to a single use.
The included studies compared warfarin against the following DOAC: apixaban 2.5 or 5.0 mg (ARISTOTLE Study 2010), dabigatran 110 or 150 mg (RE‐LY Study 2009), edoxaban 30 mg (ENGAGE AF‐TIMI 48 Study 2013), rivaroxaban 10 mg (J‐ROCKET AF Study 2012) or 15 mg (ROCKET AF Study 2010). Apixaban and dabigatran are usually administered twice a day while edoxaban and rivaroxaban were administered once daily. All studies compared DOAC with dose‐adjusted warfarin using INR. The target INR for four studies, excluding J‐ROCKET AF Study 2012, was between 2.0 and 3.0 among all participants. In J‐ROCKET AF Study 2012, the target INR in participants younger than 70 years was between 2.0 and 3.0, while that in those aged 70 years and older was between 1.6 and 2.5.
All five studies presented data on all composite outcomes of stroke and systematic thromboembolism as the primary efficacy outcome, with major bleeding events as the primary safety outcome. The median follow‐up period ranged from 1.8 to 2.8 years.
Excluded studies
Four studies were excluded. Three studies where pharmacokinetic/pharmacodynamic studies of ximelagatran and metagatran (Eriksson 2003a), edoxaban (Koretsune 2015), and argatroban (Murray 2004), and one study compared rivaroxaban plus vitamin K2 versus vitamin K antagonist (Caluwé 2016).
Risk of bias in included studies
Figure 2 and Figure 3 summarize our assessment of risk of bias for the five included studies. Two authors independently assessed the included studies for each checklist item as having high, low, or unclear risk of bias.
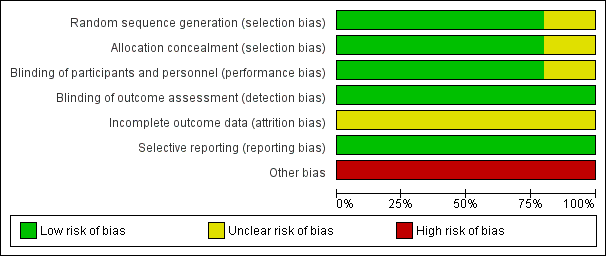
Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
Allocation
Four studies used a central, interactive, automated response system for allocation concealment (ARISTOTLE Study 2010; ENGAGE AF‐TIMI 48 Study 2013; RE‐LY Study 2009; ROCKET AF Study 2010), while J‐ROCKET AF Study 2012 did not specify randomisation or concealment methods. Therefore, we assessed the four studies to have a low risk of bias and J‐ROCKET AF Study 2012 to have unclear risk of bias. We used subgroup analysis results from each large study but determined that the balance of the allocated groups had been maintained because the extracted participants from each study were of an acceptable sample size.
Blinding
Four studies had adequate double‐blinding procedures (ARISTOTLE Study 2010; ENGAGE AF‐TIMI 48 Study 2013; J‐ROCKET AF Study 2012; ROCKET AF Study 2010). Further, independent, centralized clinical end‐point committees who were blind to treatment assessed outcomes based on agreed‐upon definitions. RE‐LY Study 2009 had incomplete blinding, as while dabigatran was administered in a blinded fashion, warfarin was administered in an open‐label fashion, and INR was adjusted at least monthly. This incomplete blinding may have led to performance bias. However, we considered that any risk of performance bias would be reduced by a predetermined equal interval of follow‐up. Further, we assessed the risk of detection bias to be low because the outcomes were objective measures and outcome assessors were blinded.
Incomplete outcome data
For the primary efficacy outcome of all strokes and systematic thromboembolic events, two studies (ARISTOTLE Study 2010; RE‐LY Study 2009) reported results from ITT analyses; ENGAGE AF‐TIMI 48 Study 2013 reported results based on both ITT and modified ITT analyses; ROCKET AF Study 2010 reported results based on ITT, modified ITT, and PP analyses; and J‐ROCKET AF Study 2012 reported results from modified ITT and PP analyses. For the primary safety outcome of major bleeding events, only RE‐LY Study 2009 reported results from ITT analyses, while the other four provided results from modified ITT analyses, which included all randomised participants who had received at least one dose of the study drug during the follow‐up period.
Selective reporting
We found no evidence of selective reporting bias in any of the five studies, and all predefined primary efficacy and safety outcomes in the protocols were reported in the published manuscripts.
Other potential sources of bias
All of the studies examined were sponsored by pharmaceutical companies.
Effects of interventions
See: summary of findings Table for the main comparison for the main comparisons.
In the original protocol, we aimed to distinguish two primary efficacy outcomes: all strokes and systemic embolic events. However, all included studies reported composite outcomes of all strokes, including both ischaemic and haemorrhagic stroke and systemic embolic events; therefore we examined them as one composite outcome.
For both primary and secondary efficacy outcomes, including all strokes and systemic embolic events, MI, and all‐cause mortality, we included the results that used the conventional ITT analyses for the four studies (ARISTOTLE Study 2010; ENGAGE AF‐TIMI 48 Study 2013; RE‐LY Study 2009; ROCKET AF Study 2010) and the results that used the modified ITT analyses for one study (J‐ROCKET AF Study 2012). Vascular death was not reported in any of the included studies.
For primary and secondary safety outcomes, including major bleeding, minor bleeding, GI bleeding, and intracranial haemorrhage, we included the results that used modified ITT analyses for four studies (ARISTOTLE Study 2010; ENGAGE AF‐TIMI 48 Study 2013; J‐ROCKET AF Study 2012; ROCKET AF Study 2010) and the result that used the conventional ITT analyses for one study (RE‐LY Study 2009).
Primary outcomes
All strokes and systemic embolic events
A total of 12,545 participants from all five studies were included in this analysis. We used the random‐effects model to assess the association between anticoagulants and the primary efficacy outcome. DOAC probably reduced the incidence of composite outcomes in comparison with warfarin (Analysis 1.1 (5 studies, 12,545 participants): RR 0.81, 95% CI 0.65 to 1.00; moderate certainty evidence). There was no heterogeneity (I2 = 0%). We assessed the quality of evidence for the primary efficacy outcome to be moderate by GRADE because of concerns with imprecision. In addition, four studies (ARISTOTLE Study 2010; ENGAGE AF‐TIMI 48 Study 2013; J‐ROCKET AF Study 2012; ROCKET AF Study 2010) reported the RR of ischaemic stroke or haemorrhagic stroke. DOAC probably made little difference to the incidence of ischaemic stroke in comparison with warfarin (Analysis 1.2 (4 studies, 8,991 participants): RR 1.01, 95% CI 0.75 to 1.36; moderate certainty evidence). There was no heterogeneity (I2 = 0%). In contrast, DOAC probably reduced the incidence of haemorrhagic stroke in comparison with warfarin (Analysis 1.3 (4 studies, 8,991 participants): RR 0.52, 95% CI 0.28 to 0.97; moderate certainty evidence). There was no heterogeneity (I2 = 0%). We assessed the quality of evidence concerning both ischaemic and haemorrhagic strokes to be moderate because of concerns with imprecision.
Major bleeding
A total of 12,521 participants from all five studies reported major bleeding events, defined as a reduction in at least 20 g/ L of haemoglobin, transfusion of at least two units of blood, symptomatic bleeding in a critical area or organ, or death due to major bleeding, according to the ISTH criteria. DOAC might slightly reduce the incidence of major bleeding events in comparison with warfarin (Analysis 1.4 (5 studies, 12,521 participants): RR 0.79, 95% CI 0.59 to 1.04; low certainty evidence). There was medium heterogeneity (I2 = 63%). We assessed the quality of evidence for the primary safety outcome to be low by GRADE because of concerns with inconsistency and imprecision.
Secondary outcomes
Myocardial infarction
ENGAGE AF‐TIMI 48 Study 2013 reported no difference in the incidence of MI between DOAC compared to warfarin (Analysis 1.5 (1 study, 2,740 participants): RR 0.92, 95% CI 0.45 to 1.90). Although the other four studies (ARISTOTLE Study 2010; J‐ROCKET AF Study 2012; RE‐LY Study 2009; ROCKET AF Study 2010) indicated that they would assess the incidence of MI in their protocol, ARISTOTLE Study 2010 and J‐ROCKET AF Study 2012 did not report on the results, while RE‐LY Study 2009 and ROCKET AF Study 2010 reported the composite outcomes for stroke, systemic embolic events, MI and others, but not separately for these items.
Minor bleeding
Two studies (ENGAGE AF‐TIMI 48 Study 2013; J‐ROCKET AF Study 2012) reported that DOAC might make little difference to minor bleeding events in comparison with warfarin (Analysis 1.6 (2 studies, 3,012 participants): RR 0.97, 95% CI 0.58 to 1.61; low certainty evidence). There was substantial heterogeneity (I2 = 70%). We assessed the quality of evidence to be low because of concerns with inconsistency and imprecision. No data was available for the other three studies (ARISTOTLE Study 2010; RE‐LY Study 2009; ROCKET AF Study 2010).
Gastrointestinal bleeding
Two studies (ENGAGE AF‐TIMI 48 Study 2013; ROCKET AF Study 2010) reported that DOAC probably leaded to slightly more GI bleeding events in comparison with warfarin (Analysis 1.7 (2 studies, 5,678 participants): RR 1.40, 95% CI 0.97 to 2.01; moderate certainty evidence). There was no heterogeneity (I2 = 0%). We assessed the quality of evidence to be moderate because of concerns with imprecision. No data was available for the other three studies (ARISTOTLE Study 2010; J‐ROCKET AF Study 2012; RE‐LY Study 2009).
Intracranial haemorrhage
All five studies reported that DOAC probably reduced intracranial haemorrhage events in comparison with warfarin (Analysis 1.8 (5 studies, 12,521 participants): RR 0.43, 95% CI 0.27 to 0.69; moderate certainty evidence). There was low heterogeneity (I2 = 25%). We assessed the quality of evidence to be moderate because of concerns with imprecision.
All‐cause mortality
Four studies (ARISTOTLE Study 2010; ENGAGE AF‐TIMI 48 Study 2013; J‐ROCKET AF Study 2012; RE‐LY Study 2009) reported that DOAC probably make little difference to all‐cause mortality in comparison with warfarin (Analysis 1.9 (4 studies, 9,595 participants): RR 0.91, 95% CI 0.78 to 1.05; moderate certainty evidence). There was no heterogeneity (I2 = 0%). We assessed the quality of evidence to be moderate because of concerns with imprecision. Although ROCKET AF Study 2010 also indicated the assessment of all‐cause mortality in their protocol, the results were not reported.
Vascular death
We could not obtain the results for vascular death from any of the included studies.
Subgroup analyses
We conducted several pre‐defined subgroup analyses for both the primary efficacy outcome and primary safety outcome to explore the heterogeneity of treatment effects.
CKD stages
ARISTOTLE Study 2010 and ENGAGE AF‐TIMI 48 Study 2013 included several participants with CrCl < 30 mL/min. In the original articles, these participants were analysed as having moderate kidney impairment. However, an FDA report for ENGAGE AF‐TIMI 48 Study 2013 and a report from the pharmaceutical company for ARISTOTLE Study 2010 categorised the data differently, as CKD stage 3 (CrCl 30 to 50 mL/min) and CKD stage 4 (CrCl 15 to 30 mL/min), respectively. Therefore, we re‐analysed the primary outcomes according to CKD stage, categorising 12,155 participants as CKD stage G3 and 390 participants as stage G4.
DOAC probably slightly reduced the composite efficacy outcomes of all strokes and systemic embolic events in comparison with warfarin for participants with CKD stage 3 (Analysis 2.1 (5 studies, 12,155 participants): RR 0.82, 95% CI 0.66 to 1.02; moderate certainty evidence). There was no heterogeneity (I2 = 0%). Likewise, DOAC might slightly reduce the composite efficacy outcomes in comparison with warfarin for participants with CKD stage G4 (Analysis 3.1 (2 studies, 390 participants): RR 0.68, 95% CI 0.23 to 2.00; low certainty evidence). There was no heterogeneity (I2 = 0%). These results were consistent with the overall results.
DOAC probably slightly reduced major bleeding events in comparison with warfarin for participants with CKD stage G3 (Analysis 2.2 (5 studies, 12,132 participants): RR 0.80, 95% CI 0.62 to 1.03; moderate certainty evidence). There was moderate heterogeneity (I2 = 53%). Only one study (ARISTOTLE Study 2010) of 268 participants with CKD stage G4 reported that DOAC might improve major bleeding events in comparison with warfarin (Analysis 3.2 (1 studies, 268 participants): RR 0.30, 95% CI 0.11 to 0.80).
Other baseline characteristics
No data were available for subgroup analyses of other participant characteristics such as age, history of stroke and risk factors of baseline stroke (CHADS2 score). Additional assessments are required once more information is published.
How to prescribe anticoagulants
Dose and duration of therapy per day
Participants in RE‐LY Study 2009 were randomly assigned to receive either 110 mg or 150 mg of dabigatran twice a day. Participants in ARISTOTLE Study 2010 were prescribed either 2.5 mg or 5 mg of apixaban twice a day, with dosage determined according to whether participants satisfied two or more of the following criteria: (i) age ≥ 80 years; (ii) body weight ≤ 60 kg; or (iii) SCr ≥ 1.5 mg/dL (133 μmol/L). Participants in the other three studies were administered single doses (ENGAGE AF‐TIMI 48 Study 2013: 30 mg edoxaban once a day; ROCKET AF Study 2010: 15 mg rivaroxaban once a day; J‐ROCKET AF Study 2012: 10 mg rivaroxaban once a day).
We conducted subgroup analyses to assess the different dosages of DOAC. In RE‐LY Study 2009, the patients were randomised in a 1:1:1 fashion, 110 mg of dabigatran, 150 mg of dabigatran or dose‐adjusted warfarin, and the results of analyses were separately shown for dabigatran 110 mg versus warfarin and for dabigatran 150 mg versus warfarin. However, we could not obtain the results for different dosages of apixaban (ARISTOTLE Study 2010). We entered two comparisons of dabigatran (dabigatran 110 mg versus warfarin, and dabigatran 150 mg versus warfarin) into the meta‐analysis. Participants on DOAC probably reduced the composite primary efficacy outcomes of all strokes and systemic embolic events in comparison with warfarin (Analysis 4.1 (5 studies, 12,545 participants): RR 0.81, 95% CI 0.65 to 1.00; moderate certainty evidence). There was no heterogeneity (I2 = 0%). Likewise, DOAC probably made little difference to all‐cause mortality as the secondary efficacy outcome in comparison with warfarin (Analysis 4.3 (4 studies, 9,595 participants): RR 0.91, 95% CI 0.78 to 1.05; moderate certainty evidence). There was no heterogeneity (I2 = 0%). Further, DOAC might slightly reduce the incidence of major bleeding in comparison with warfarin (Analysis 4.2 (5 studies, 12,521 participants): RR 0.81, 95% CI 0.63 to 1.03; low certainty evidence). There was moderate heterogeneity (I2 = 54%). These results were mostly consistent with the original results.
No data were available for the comparison of the duration of each therapy.
Subtype of DOAC
Rivaroxaban was studied in two studies (ROCKET AF Study 2010; J‐ROCKET AF Study 2012). However, the sample size of J‐ROCKET AF Study 2012 was smaller than ROCKET AF Study 2010, and the prescribed doses were different between the studies. Therefore, it was difficult to perform subtype analysis. All other drugs were examined by a single study respectively, so we could not assess differences in DOAC subtypes.
Concomitant use of antiplatelet therapy
All studies allowed the use of less than 100 mg or 165 mg of aspirin, and all but one study (ENGAGE AF‐TIMI 48 Study 2013) permitted the use of antiplatelet agents such as thienopyridine. However, no data were available for subgroup analysis.
Adverse events
Several adverse events were assessed for rivaroxaban (ROCKET AF Study 2010; J‐ROCKET AF Study 2012). Rivaroxaban might make little difference to any adverse effects in comparison with warfarin (see results; Analysis 5).
Sensitivity analysis
We planned several pre‐defined sensitivity analyses for both the primary efficacy outcome and primary safety outcome to explore the influence on effect size.
We did not carry out the sensitivity analysis for repeating the analysis excluding unpublished studies, because our study did not include unpublished studies. We did not carry out the sensitivity analysis for repeating the analysis taking into account risk of bias, because we considered the risk of bias to be low. We did not carry out the sensitivity analysis for repeating the analysis excluding any very long or large studies to establish how much they dominate the results, because the sample size of J‐ROCKET AF Study 2012 was small, and other studies had similar weight. We also did not the sensitivity analysis for repeating the analysis excluding studies using the following filters: diagnostic criteria, language of publication, source of funding (industry versus other), and country. The criteria for kidney impairment and warfarin dosage were previously described and similar, and other criteria were similar. All included publications were written in English. All studies were supported by pharmaceutical research companies. Various western or Asian countries were involved in all studies except for J‐ROCKET AF Study 2012, which targeted Japanese participants only.
Analysis using fixed effects model
We performed sensitivity analyses using the fixed‐effect model. DOAC probably slightly reduced the incidence of composite outcomes in comparison with warfarin (Analysis 6.1 (5 studies, 12,545 participants): RR 0.81, 95% CI 0.65 to 1.01; moderate certainty evidence). There was no heterogeneity (I2 = 0%). Further, DOAC probably reduced the incidence of major bleeding in comparison with warfarin (Analysis 6.2 (5 studies, 12,521 participants): RR 0.79, 95% CI 0.67 to 0.92; low certainty evidence). There was medium heterogeneity (I2 = 63%). The results obtained using the fixed‐effects model were mostly consistent with those obtained using the random‐effects model even though the point estimates and 95% CIs were slightly different.
Discusión
Resumen de los resultados principales
Se analizaron 12 545 pacientes con FA e insuficiencia renal moderada a grave en cinco ECA que examinaron la eficacia y la seguridad de cuatro ACOD: apixaban, dabigatran, edoxaban y rivaroxaban.
Los estudios incluidos compararon directamente la asociación entre ACOD y warfarina a dosis ajustada en los resultados compuestos de todos los accidentes cerebrovasculares y eventos embólicos sistémicos como el resultado primario de eficacia, y la hemorragia grave como el resultado primario de seguridad. En los pacientes con FA y NC que reciben ACOD probablemente se reduzca la incidencia de todos los accidentes cerebrovasculares y eventos embólicos sistémicos en comparación con los que reciben warfarina. Además, en los participantes que reciben ACOD se podría reducir ligeramente la incidencia de eventos hemorrágicos graves.
Estos resultados se obtuvieron a partir de un subconjunto de datos de cinco estudios grandes, que reclutaron sobre todo a pacientes con FA independientemente de la función renal. La incidencia de todos los accidentes cerebrovasculares y eventos embólicos sistémicos entre los pacientes con NC probablemente fue ligeramente consistente entre todos los participantes de los estudios originales (Bruins Slot 2013). Además, las estimaciones puntuales de la incidencia de hemorragia grave entre los participantes con NC fueron inferiores que entre los pacientes sin insuficiencia renal, aunque el IC del 95% fue más amplio debido al tamaño de la muestra más pequeño.
Por lo general los resultados de los análisis de subgrupos según la NC estadio G3 y G4 fueron consistentes con los resultados generales. La única cuestión diferente fue que en la NC estadio G4 (ARISTOTLE Study 2010) los ACOD pudieran reducir los eventos hemorrágicos graves en comparación con la warfarina, pero el número de participantes categorizados con NC estadio G4 fue pequeño, por lo que no fue posible evaluar la asociación con un poder estadístico suficiente.
Estos resultados indican que en los pacientes con FA y NC los ACOD tienen igual o más efectividad y una seguridad similar que la warfarina a dosis ajustada, al menos en la NC estadio 3. Por lo tanto, los médicos se pueden sentir más seguros al prescribir los ACOD a los pacientes con FA y NC sin la carga de la monitorización regular que es necesaria con la warfarina.
Compleción y aplicabilidad general de las pruebas
Actualmente, los organismos reguladores principales (EMA 2014; FDA 2014; Health Canada 2017) han aprobado los ACOD para el uso en pacientes con FA con estadio NC G3 o G4, pero la evidencia que apoya su uso es limitada (Reinecke 2013).
Se revisaron de forma sistemática los estudios que volvieron a analizar los subgrupos; o sea, los participantes con insuficiencia renal, de los cinco ECA grandes dirigidos a pacientes con FA. El tamaño de la muestra de cada estudio de subgrupos fue grande y el equilibrio y la comparabilidad de las características aleatorias iniciales se mantuvo en estos subgrupos.
Todos los participantes en los grupos de intervención y control presentaban FA no valvular y NC, y otras características iniciales fueron similares entre los estudios. La warfarina se controló dentro del rango de la RIN de 2,0 a 3,0 en cuatro estudios, con la exclusión del J‐ROCKET AF Study 2012, y las condiciones para las comparaciones fueron consistentes entre los estudios. En J‐ROCKET AF Study 2012, el rango objetivo de la RIN fue 2,0 a 3,0 para los pacientes menores de 70 años y 1,6 a 2,5 para los pacientes de 70 años y más.
Cada estudio también incluyó a participantes de países occidentales y asiáticos, lo que indica que los datos fueron más generalizables.
Esta revisión sistemática presentaba varias limitaciones. Primero, ARISTOTLE Study 2010 y ENGAGE AF‐TIMI 48 Study 2013 incluyeron participantes con insuficiencia renal grave (ClCr < 30 ml/min). Sin embargo, como se mostró en los análisis de subgrupos, los resultados se aplican sobre todo a los pacientes con NC estadio G3, por lo que se requieren estudios adicionales para determinar la eficacia y la seguridad de los ACOD en los pacientes con NC estadio G4. Además, no fue posible examinar los efectos de los pacientes con NC estadio G5. Aunque los metanálisis recientes indicaron que la warfarina puede no ser beneficiosa en los pacientes con nefropatía terminal, el efecto de los ACOD sobre estos pacientes no está claro (Dahal 2016; Liu 2015). Las revisiones futuras deben evaluar a participantes con NC en estadios más avanzados. Segundo, la función renal se puede medir con el uso de varios parámetros y ecuaciones como la ClCr, calculada mediante la ecuación de Cockcroft‐Gault; y la TFGc, calculada mediante la ecuación Modification of Diet in Renal Disease (MDRD) o la CKD‐EPI. La TFG calculada mediante la MDRD o la CKD‐EPI puede ser más precisa que la ClCr (Levey 2006; Levey 2009). Sin embargo, no fue posible calcular la TFG mediante la MDRD o la CKD‐EPI porque no se indicó el número de participantes dentro de cada grupo. Se utilizó la ClCr calculada por la ecuación de Cockcroft‐Gault porque es muy utilizada y todos los ECA incluidos en esta revisión determinaron la función renal mediante este método. Tercero, no fue posible realizar análisis de subgrupos ni de sensibilidad debido a la falta de datos disponibles. En particular, es importante evaluar los subtipos o diferentes dosis de ACOD para explorar las posibles fuentes de heterogeneidad. Dichos análisis se deben realizar una vez que se hayan obtenido más resultados de ECA y repetirse los análisis en este estudio después de la publicación de más datos.
Calidad de la evidencia
Solo RE‐LY Study 2009 se realizó de una forma simple ciego; sin embargo, como se cegó a los evaluadores de resultado, se concluyó que este método de análisis no tuvo efectos adversos sobre los resultados. Se consideró que el riesgo de sesgo de los resultados primarios de eficacia y de seguridad fue bajo. Sin embargo, este estudio no informó resultados secundarios importantes como IM y mortalidad por todas las causas, aunque se definieron previamente en el protocolo; por lo tanto, se presumió que hubo sesgo de informe de resultados.
No fue posible evaluar de forma suficiente las diferencias en los tipos ni las dosis de ACOD. No se pudieron obtener resultados de diferentes dosis de apixaban. Es posible que las dosis mayores provocaran hemorragia más grave que las dosis inferiores, pero esta información se encubrió al combinar las dosis.
Para evaluar la publicación de datos incompletos de resultados, que está relacionada con el sesgo de desgaste, básicamente se adoptó el principio de intención de tratar para el resultado primario de eficacia y el principio modificado de intención de tratar para el resultado primario de seguridad. El principio de intención de tratar para los resultados de eficacia mantiene el equilibrio de la asignación aleatoria y por lo general es conservador al aceptar los resultados de falta de cumplimiento y los abandonos. Por el contrario, los resultados de seguridad no se deben debilitar por la falta de cumplimiento ni los abandonos, lo que hace que el principio modificado de intención de tratar sea más apropiado. J‐ROCKET AF Study 2012 utilizó el principio modificado de intención de tratar para los resultados de eficacia y RE‐LY Study 2009 utilizó el principio convencional de intención de tratar para los resultados de seguridad. Se previó que la medida relativa (CR) fuera probablemente similar en los análisis de intención de tratar convencionales y modificados porque en esta revisión se adaptó un comparador activo. Por lo tanto, se consideró que es probable que el cumplimiento fuera similar en ambos grupos y no se relacionara con la eficacia ni la seguridad.
Los sesgos de financiamiento también pueden afectar los resultados de los estudios. Debido a que todos los estudios incluidos siguieron el protocolo predeterminado, se consideró que la repercusión, de haber alguna, fue pequeña.
Con el uso del sistema GRADE, el resultado primario de eficacia se consideró de calidad moderada debido a las inquietudes con respecto a la imprecisión y el resultado primario de seguridad de baja confiabilidad debido a inquietudes con respecto a la inconsistencia y la imprecisión. Para los resultados secundarios, los resultados de la hemorragia leve se consideraron de baja confiabilidad debido a inquietudes con respecto a la inconsistencia y la imprecisión; la hemorragia GI, la hemorragia intracraneal y la mortalidad por todas las causas se consideraron de confiabilidad moderada debido a inquietudes con respecto a la imprecisión, respectivamente.
Sesgos potenciales en el proceso de revisión
Se realizó una búsqueda exhaustiva de varias bases de datos diferentes pero no es posible descartar la posibilidad de que se perdieran algunos estudios más pequeños. Además, se estableció contacto con los patrocinadores y se realizaron búsquedas en la web para obtener datos que no era posible obtener a partir del registro especializado del Grupo Cochrane de Riñón y Trasplante, pero todavía es posible que se perdieran algunos datos.
Acuerdos y desacuerdos con otros estudios o revisiones
Una revisión sistemática anterior informó que los ACOD fueron más efectivos que la warfarina para prevenir el accidente cerebrovascular y la embolia sistémica entre los pacientes con FA independientemente de la función renal, pero no se estableció la evidencia entre los pacientes con insuficiencia renal. Debido a que los pacientes con NC tienen un mayor riesgo de accidente cerebrovascular en comparación con la población general, en estos pacientes son necesarias estrategias preventivas para el accidente cerebrovascular (Lau 2016; Marinigh 2011; Masson 2015). Sin embargo, los médicos dudan en prescribir los anticoagulantes a los pacientes con NC debido a inquietudes relacionadas con los riesgos de hemorragia (Lau 2016). Por ejemplo, el dabigatran se excreta principalmente por los riñones (Stangier 2008), por lo que existe el riesgo de que se eleven las concentraciones sanguíneas del fármaco.
Todos los ECA originales incluidos se diseñaron como estudios de no inferioridad y los datos de un grupo más pequeño de participantes en esta revisión mostraron resultados consistentes. Además, las estimaciones puntuales entre los pacientes con NC fueron menores que entre los pacientes sin insuficiencia renal; la variabilidad (por los IC del 95%) fue más grande debido al tamaño de la muestra más pequeño.

Risk of bias graph: review authors' judgements about each risk of bias item presented as percentages across all included studies.

Risk of bias summary: review authors' judgements about each risk of bias item for each included study.
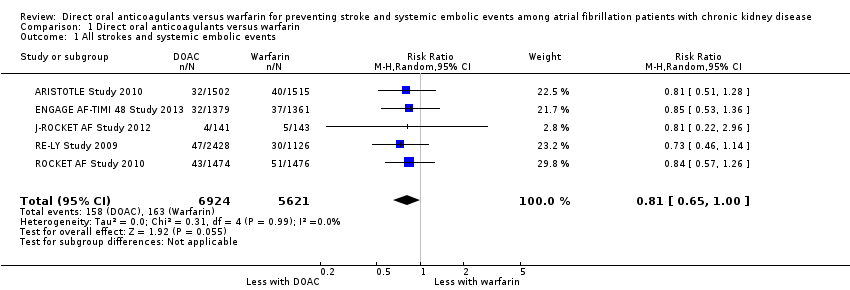
Comparison 1 Direct oral anticoagulants versus warfarin, Outcome 1 All strokes and systemic embolic events.

Comparison 1 Direct oral anticoagulants versus warfarin, Outcome 2 Ischaemic stroke.

Comparison 1 Direct oral anticoagulants versus warfarin, Outcome 3 Haemorrhagic stroke.
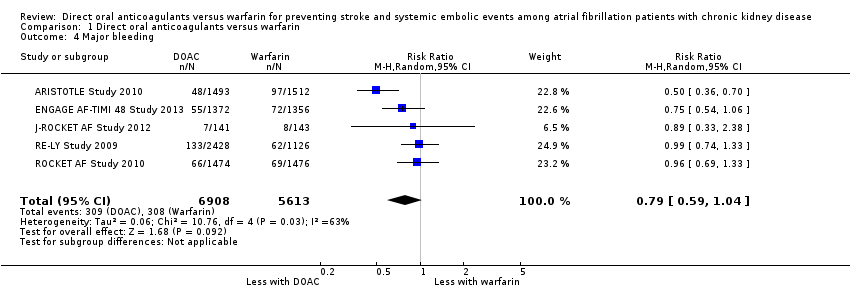
Comparison 1 Direct oral anticoagulants versus warfarin, Outcome 4 Major bleeding.

Comparison 1 Direct oral anticoagulants versus warfarin, Outcome 5 Myocardial infarction.
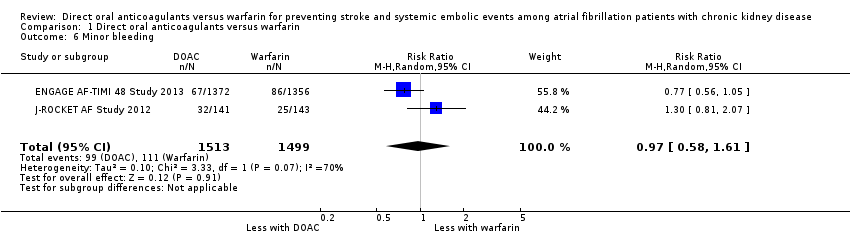
Comparison 1 Direct oral anticoagulants versus warfarin, Outcome 6 Minor bleeding.
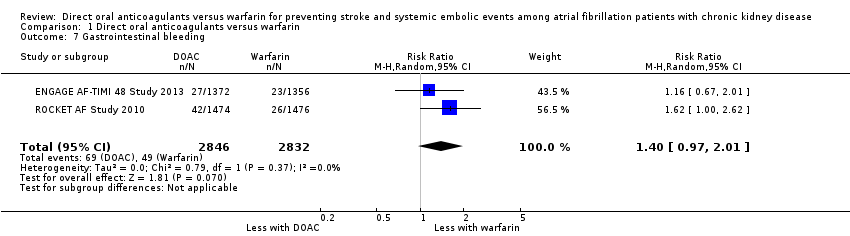
Comparison 1 Direct oral anticoagulants versus warfarin, Outcome 7 Gastrointestinal bleeding.

Comparison 1 Direct oral anticoagulants versus warfarin, Outcome 8 Intracranial haemorrhage.
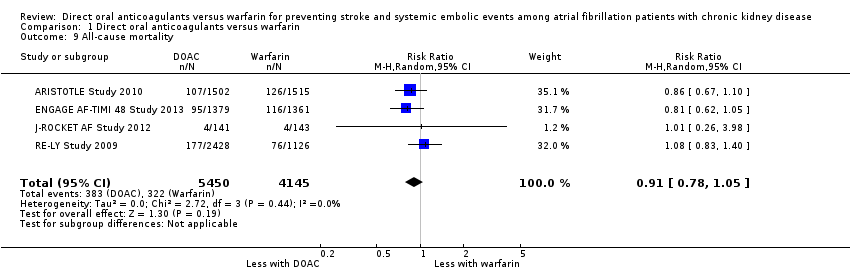
Comparison 1 Direct oral anticoagulants versus warfarin, Outcome 9 All‐cause mortality.
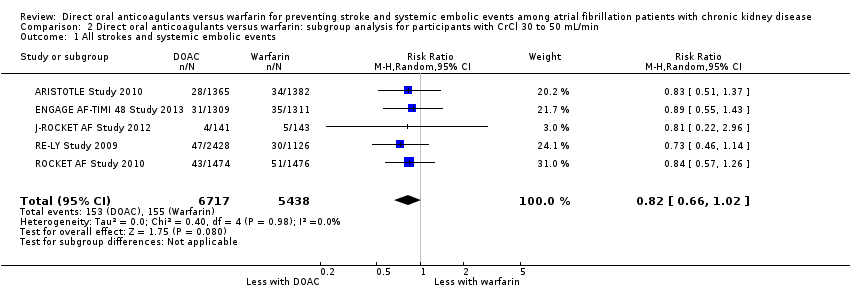
Comparison 2 Direct oral anticoagulants versus warfarin: subgroup analysis for participants with CrCl 30 to 50 mL/min, Outcome 1 All strokes and systemic embolic events.

Comparison 2 Direct oral anticoagulants versus warfarin: subgroup analysis for participants with CrCl 30 to 50 mL/min, Outcome 2 Major bleeding.

Comparison 3 Direct oral anticoagulants versus warfarin: subgroup analysis for participants with CrCl 15 to 30 mL/min, Outcome 1 All strokes and systemic embolic events.
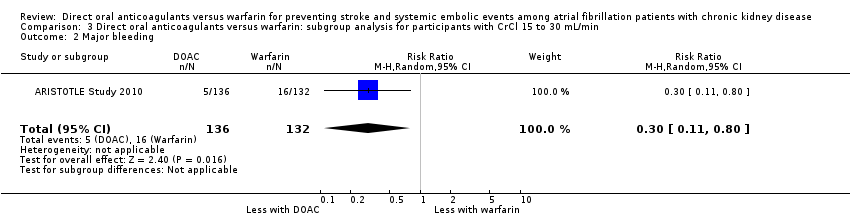
Comparison 3 Direct oral anticoagulants versus warfarin: subgroup analysis for participants with CrCl 15 to 30 mL/min, Outcome 2 Major bleeding.
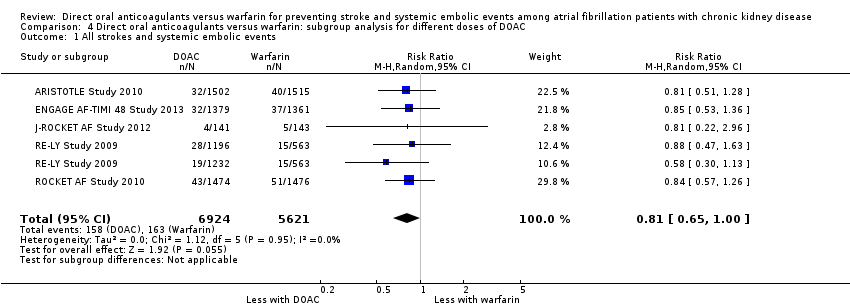
Comparison 4 Direct oral anticoagulants versus warfarin: subgroup analysis for different doses of DOAC, Outcome 1 All strokes and systemic embolic events.

Comparison 4 Direct oral anticoagulants versus warfarin: subgroup analysis for different doses of DOAC, Outcome 2 Major bleeding.
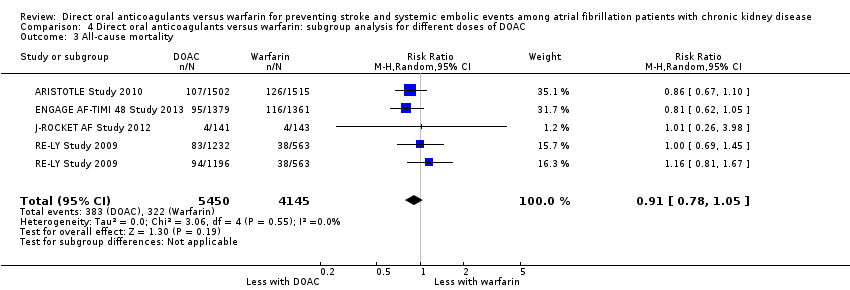
Comparison 4 Direct oral anticoagulants versus warfarin: subgroup analysis for different doses of DOAC, Outcome 3 All‐cause mortality.

Comparison 5 Direct oral anticoagulants versus warfarin: adverse events, Outcome 1 Epistaxis.
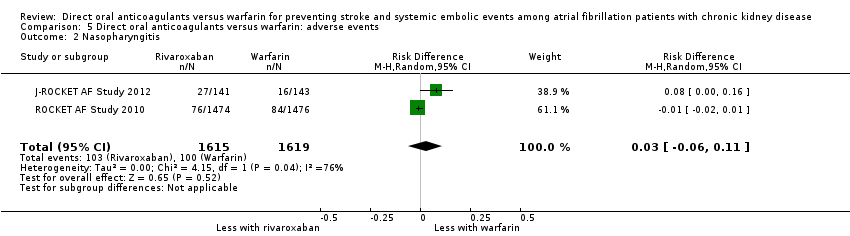
Comparison 5 Direct oral anticoagulants versus warfarin: adverse events, Outcome 2 Nasopharyngitis.

Comparison 5 Direct oral anticoagulants versus warfarin: adverse events, Outcome 3 Diarrhoea.

Comparison 5 Direct oral anticoagulants versus warfarin: adverse events, Outcome 4 Upper respiratory tract inflammation.

Comparison 5 Direct oral anticoagulants versus warfarin: adverse events, Outcome 5 Back pain.

Comparison 5 Direct oral anticoagulants versus warfarin: adverse events, Outcome 6 Cardiac failure.

Comparison 6 Direct oral anticoagulants versus warfarin: fixed‐effect model, Outcome 1 All strokes and systemic embolic events.

Comparison 6 Direct oral anticoagulants versus warfarin: fixed‐effect model, Outcome 2 Major bleeding.
| DOAC versus warfarin for preventing stroke and systemic embolic events among atrial fibrillation patients with CKD | |||||
| Patient or population: atrial fibrillation patients with CKD Setting: Hospital‐based setting Intervention: DOAC Comparison: Dose‐adjusted warfarin | |||||
| Outcomes | Illustrative comparative risks* (95% CI) | Relative effect | No. of participants | Quality of the evidence | |
| Assumed risk | Corresponding risk | ||||
| Warfarin | DOAC | ||||
| All strokes and systemic embolic events Follow up: 1.8 years to 2.8 years | 29 per 1,000 | 23 per 1,000 | RR 0.81 (0.65 to 1.00) | 12,545 (5) | ⊕⊕⊕⊝¹ |
| Major bleeding Follow up: 1.8 years to 2.8 years | 55 per 1,000 | 43 per 1,000 | RR 0.79 (0.59 to 1.04) | 12,521 (5) | ⊕⊕⊝⊝¹ ² |
| Myocardial infarction Follow up: 2.8 years | 11 per 1,000 | 10 per 1,000 (5 to 21) | RR 0.92 (0.45 to 1.90) | 2,740 (1) | ‐ |
| Minor bleeding Follow up: 2.5 years to 2.8 years | 74 per 1,000 | 72 per 1,000 (43 to 119) | RR 0.97 (0.58 to 1.61) | 3,012 (2) | ⊕⊕⊝⊝¹ ² |
| Gastrointestinal bleeding Follow up: 1.9 years to 2.8 years | 17 per 1,000 | 24 per 1,000 (17 to 35) | RR 1.40 (0.97 to 2.01) | 5,678 (2) | ⊕⊕⊕⊝¹ |
| Intracranial haemorrhage Follow up: 1.8 years to 2.8 years | 14 per 1,000 | 6 per 1,000 | RR 0.43 (0.27 to 0.69) | 12,521 (5) | ⊕⊕⊕⊝¹ |
| All‐cause mortality Follow up: 1.8 years to 2.8 years | 78 per 1,000 | 71 per 1,000 | RR 0.91 (0.78 to 1.05) | 9,595 (4) | ⊕⊕⊕⊝¹ |
| *The risk in the intervention group (and its 95% CI) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). AF: atrial fibrillation; CI: confidence interval; DOAC: direct oral anticoagulants; RR: risk ratio | |||||
| GRADE Working Group grades of evidence | |||||
| 1 Some concerns with imprecision because of the uncertain effect estimate 2 Some concerns with inconsistency because of medium heterogeneity | |||||
| Dabigatran | Apixaban | Rivaroxaban | Edoxaban | |
| 150 mg twice daily for CKD stage G3 (CrCl 30 to 50 mL/min) No recommendation for CKD stage G4 | 2.5 mg twice daily in patients with at least two of the following characteristics: ‐ age ≥ 80 years ‐ body weight ≤ 60 kg ‐ SCr > 1.5 mg/dL | 15 mg daily for CKD stage G3 and G4 (CrCl 15 to 50 mL/min) | 30 mg once daily for CKD stage G3 and G4 (CrCl 15 to 50 mL/min) | |
| 150 mg twice daily for CKD stage G3 (CrCl > 30 mL/min) 75 mg twice daily for CKD stage G4 (CrCl 15 to 30 mL/min) | 2.5 mg twice daily in patients with at least two of the following characteristics: ‐ age ≥ 80 years ‐ body weight ≤ 60 kg ‐ SCr > 1.5 mg/dL | 15 mg daily for CKD stage G3 and G4 (CrCl 15 to 50 mL/min) | 30 mg once daily for CKD stage G3 and G4 (CrCl 15 to 50 mL/min) | |
| 110 or 150 mg twice daily for CKD stage G3 (CrCl 30 to 50 mL/min) No recommendation for CKD stage G4 | 2.5 mg twice daily in patients with at least two of the following characteristics: ‐ age ≥ 80 years ‐ body weight ≤ 60 kg ‐ SCr > 1.5 mg/dL | 15 mg daily for CKD stage G3 (CrCl 30 to 50 mL/min) No recommendation for CKD stage G4 | 30 mg once daily for CKD stage G3 (CrCl 30 to 50 mL/min) | |
| CKD ‐ chronic kidney disease; CrCl ‐ creatinine clearance; SCr ‐ serum creatinine | ||||
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All strokes and systemic embolic events Show forest plot | 5 | 12545 | Risk Ratio (M‐H, Random, 95% CI) | 0.81 [0.65, 1.00] |
| 2 Ischaemic stroke Show forest plot | 4 | 8991 | Risk Ratio (M‐H, Random, 95% CI) | 1.01 [0.75, 1.36] |
| 3 Haemorrhagic stroke Show forest plot | 4 | 8991 | Risk Ratio (M‐H, Random, 95% CI) | 0.52 [0.28, 0.97] |
| 4 Major bleeding Show forest plot | 5 | 12521 | Risk Ratio (M‐H, Random, 95% CI) | 0.79 [0.59, 1.04] |
| 5 Myocardial infarction Show forest plot | 1 | 2740 | Risk Ratio (M‐H, Random, 95% CI) | 0.92 [0.45, 1.90] |
| 6 Minor bleeding Show forest plot | 2 | 3012 | Risk Ratio (M‐H, Random, 95% CI) | 0.97 [0.58, 1.61] |
| 7 Gastrointestinal bleeding Show forest plot | 2 | 5678 | Risk Ratio (M‐H, Random, 95% CI) | 1.40 [0.97, 2.01] |
| 8 Intracranial haemorrhage Show forest plot | 5 | 12521 | Risk Ratio (M‐H, Random, 95% CI) | 0.43 [0.27, 0.69] |
| 9 All‐cause mortality Show forest plot | 4 | 9595 | Risk Ratio (M‐H, Random, 95% CI) | 0.91 [0.78, 1.05] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All strokes and systemic embolic events Show forest plot | 5 | 12155 | Risk Ratio (M‐H, Random, 95% CI) | 0.82 [0.66, 1.02] |
| 2 Major bleeding Show forest plot | 5 | 12132 | Risk Ratio (M‐H, Random, 95% CI) | 0.80 [0.62, 1.03] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All strokes and systemic embolic events Show forest plot | 2 | 390 | Risk Ratio (M‐H, Random, 95% CI) | 0.68 [0.23, 2.00] |
| 2 Major bleeding Show forest plot | 1 | 268 | Risk Ratio (M‐H, Random, 95% CI) | 0.30 [0.11, 0.80] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All strokes and systemic embolic events Show forest plot | 5 | 12545 | Risk Ratio (M‐H, Random, 95% CI) | 0.81 [0.65, 1.00] |
| 2 Major bleeding Show forest plot | 5 | 12521 | Risk Ratio (M‐H, Random, 95% CI) | 0.81 [0.63, 1.03] |
| 3 All‐cause mortality Show forest plot | 4 | 9595 | Risk Ratio (M‐H, Random, 95% CI) | 0.91 [0.78, 1.05] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 Epistaxis Show forest plot | 2 | 3234 | Risk Difference (M‐H, Random, 95% CI) | ‐0.05 [‐0.22, 0.11] |
| 2 Nasopharyngitis Show forest plot | 2 | 3234 | Risk Difference (M‐H, Random, 95% CI) | 0.03 [‐0.06, 0.11] |
| 3 Diarrhoea Show forest plot | 2 | 3234 | Risk Difference (M‐H, Random, 95% CI) | 0.01 [‐0.04, 0.06] |
| 4 Upper respiratory tract inflammation Show forest plot | 2 | 3234 | Risk Difference (M‐H, Random, 95% CI) | ‐0.01 [‐0.02, 0.01] |
| 5 Back pain Show forest plot | 2 | 3234 | Risk Difference (M‐H, Random, 95% CI) | ‐0.02 [‐0.05, 0.01] |
| 6 Cardiac failure Show forest plot | 2 | 3234 | Risk Difference (M‐H, Random, 95% CI) | ‐0.01 [‐0.03, 0.01] |
| Outcome or subgroup title | No. of studies | No. of participants | Statistical method | Effect size |
| 1 All strokes and systemic embolic events Show forest plot | 5 | 12545 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.81 [0.65, 1.01] |
| 2 Major bleeding Show forest plot | 5 | 12521 | Risk Ratio (M‐H, Fixed, 95% CI) | 0.79 [0.67, 0.92] |

